Содержание семинара «Основы надлежащей производственной практики (GMP)»
advertisement
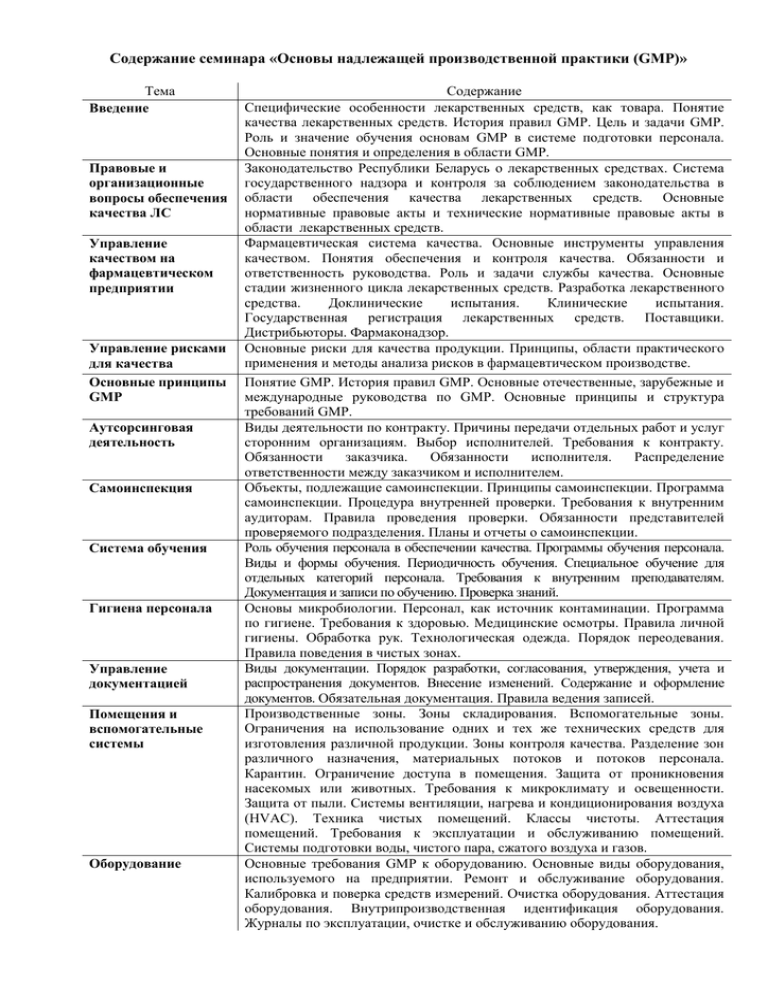
Содержание семинара «Основы надлежащей производственной практики (GMP)» Тема Введение Правовые и организационные вопросы обеспечения качества ЛС Управление качеством на фармацевтическом предприятии Управление рисками для качества Основные принципы GMP Аутсорсинговая деятельность Самоинспекция Система обучения Гигиена персонала Управление документацией Помещения и вспомогательные системы Оборудование Содержание Специфические особенности лекарственных средств, как товара. Понятие качества лекарственных средств. История правил GMP. Цель и задачи GMP. Роль и значение обучения основам GMP в системе подготовки персонала. Основные понятия и определения в области GMP. Законодательство Республики Беларусь о лекарственных средствах. Система государственного надзора и контроля за соблюдением законодательства в области обеспечения качества лекарственных средств. Основные нормативные правовые акты и технические нормативные правовые акты в области лекарственных средств. Фармацевтическая система качества. Основные инструменты управления качеством. Понятия обеспечения и контроля качества. Обязанности и ответственность руководства. Роль и задачи службы качества. Основные стадии жизненного цикла лекарственных средств. Разработка лекарственного средства. Доклинические испытания. Клинические испытания. Государственная регистрация лекарственных средств. Поставщики. Дистрибьюторы. Фармаконадзор. Основные риски для качества продукции. Принципы, области практического применения и методы анализа рисков в фармацевтическом производстве. Понятие GMP. История правил GMP. Основные отечественные, зарубежные и международные руководства по GMP. Основные принципы и структура требований GMP. Виды деятельности по контракту. Причины передачи отдельных работ и услуг сторонним организациям. Выбор исполнителей. Требования к контракту. Обязанности заказчика. Обязанности исполнителя. Распределение ответственности между заказчиком и исполнителем. Объекты, подлежащие самоинспекции. Принципы самоинспекции. Программа самоинспекции. Процедура внутренней проверки. Требования к внутренним аудиторам. Правила проведения проверки. Обязанности представителей проверяемого подразделения. Планы и отчеты о самоинспекции. Роль обучения персонала в обеспечении качества. Программы обучения персонала. Виды и формы обучения. Периодичность обучения. Специальное обучение для отдельных категорий персонала. Требования к внутренним преподавателям. Документация и записи по обучению. Проверка знаний. Основы микробиологии. Персонал, как источник контаминации. Программа по гигиене. Требования к здоровью. Медицинские осмотры. Правила личной гигиены. Обработка рук. Технологическая одежда. Порядок переодевания. Правила поведения в чистых зонах. Виды документации. Порядок разработки, согласования, утверждения, учета и распространения документов. Внесение изменений. Содержание и оформление документов. Обязательная документация. Правила ведения записей. Производственные зоны. Зоны складирования. Вспомогательные зоны. Ограничения на использование одних и тех же технических средств для изготовления различной продукции. Зоны контроля качества. Разделение зон различного назначения, материальных потоков и потоков персонала. Карантин. Ограничение доступа в помещения. Защита от проникновения насекомых или животных. Требования к микроклимату и освещенности. Защита от пыли. Системы вентиляции, нагрева и кондиционирования воздуха (HVAC). Техника чистых помещений. Классы чистоты. Аттестация помещений. Требования к эксплуатации и обслуживанию помещений. Системы подготовки воды, чистого пара, сжатого воздуха и газов. Основные требования GMP к оборудованию. Основные виды оборудования, используемого на предприятии. Ремонт и обслуживание оборудования. Калибровка и поверка средств измерений. Очистка оборудования. Аттестация оборудования. Внутрипроизводственная идентификация оборудования. Журналы по эксплуатации, очистке и обслуживанию оборудования. Тема Валидация Исходные и упаковочные материалы Технологическая документация Производство и упаковывание Хранение и транспортирование Система контроля качества Документация по контролю качества Отбор проб и проведение испытаний Рекламации и отзыв продукции Обзор качества продукции Содержание Понятие валидации. Понятие критических процессов. Виды валидации. Программа валидации. Валидация процессов. Планы и отчеты о валидации. Контроль изменений. Ревалидация. Валидация в производстве стерильных лекарственных средств. Работа с поставщиками. Программа и процедуры аудита поставщиков. Закупка сырья. Приемка сырья и упаковочных материалов. Контроль в процессе приемки. Идентификация. Документация по приемке и выдаче исходных и упаковочных материалов. Карантинное хранение. Отбор проб. Выдача разрешений на использование. Условия хранения. Обращение с первичными и маркированными упаковочными материалами. Выдача в производство. Независимый контроль взвешивания. Формирование серии. Технологические инструкции. Инструкции по упаковыванию. Стандартные операционные процедуры. Протоколы производства и упаковывания серии. Правила внесения записей в протоколы. Регистрация отклонений. Порядок формирования досье на серию. Очистка и проверка чистоты рабочей зоны. Идентификация серии в процессе производства. Источники риска контаминация и перекрестной контаминации. Программа по санитарии. Меры против образования и распространения пыли. Процедуры очистки и дезинфекции помещений и оборудования. Валидация процедур очистки. Моющие и дезинфицирующие средства, материалы и инвентарь для очистки и помещения для их хранения. Удаление отходов. Мониторинг производственной среды. Обращение с промежуточной и нерасфасованной продукцией. Контроль в процессе производства. Сопоставления фактического выхода продукции с расчетным. Работа с отклонениями. Повторное использование и переработка. Источники риска перепутывания и неправильного маркирования. Очистка и проверка чистоты упаковочной линии. Ограничения на упаковывание различной продукции в одной зоне. Идентификация серии в процессе упаковывания. Контроль правильности упаковывания и маркирования. Подведение баланса. Возврат и уничтожение упаковочных материалов. Передача готовой продукции в карантин. Надлежащая практика хранения и транспортирования. Надлежащая практика оптовой реализации. Прослеживаемость в цепочке реализации. Основные функции системы контроля качества. Отдел контроля качества. Принцип независимости контроля качества от производства. Оценка сырья и готовой продукции. Мониторинг стабильности продукции. Основные требования к лабораториям. Спецификации. СОП и протоколы отбора проб. Лабораторные журналы. Методики и протоколы испытаний. Валидация методик испытаний. СОП и протоколы калибровки средств измерений и технического обслуживания оборудования. Данные по контролю окружающей среды. Понятие репрезентативности отобранных проб (образцов). Зоны отбора проб. Предотвращение контаминации и перепутывания при отборе проб. Идентификация проб. Архивные образцы. Реактивы, стандартные образцы, питательные среды. Основные методы испытаний. Обращение с результатами, выходящими за пределы спецификаций. Причины возникновения жалоб и рекламаций. Система работы с рекламациями. Ответственность за работу с рекламациями. Процедура обработки рекламаций. Расследование и устранение причин несоответствий. Проверка аналогичных серий. Анализ тенденций. Протоколы реализации продукции. Система отзыва продукции из реализации. Обращение с отозванной и возвращенной продукцией. Система сбора и анализа данных о качестве. Основные разделы обзора и их содержание. Статистическая обработка и графическое представление данных. Выявление тенденций. Действия по результатам обзора качества продукции.



















