Календарно – тематический план Тема урока Содержание учебного материала
advertisement
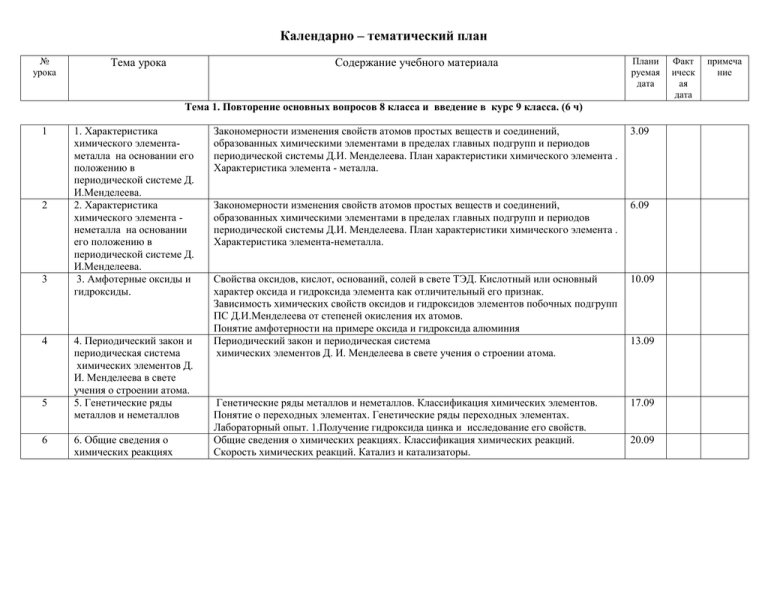
Календарно – тематический план № урока Тема урока Содержание учебного материала Плани руемая дата Тема 1. Повторение основных вопросов 8 класса и введение в курс 9 класса. (6 ч) 1 2 3 4 5 6 1. Характеристика химического элементаметалла на основании его положению в периодической системе Д. И.Менделеева. 2. Характеристика химического элемента неметалла на основании его положению в периодической системе Д. И.Менделеева. 3. Амфотерные оксиды и гидроксиды. 4. Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома. 5. Генетические ряды металлов и неметаллов 6. Общие сведения о химических реакциях Закономерности изменения свойств атомов простых веществ и соединений, образованных химическими элементами в пределах главных подгрупп и периодов периодической системы Д.И. Менделеева. План характеристики химического элемента . Характеристика элемента - металла. 3.09 Закономерности изменения свойств атомов простых веществ и соединений, образованных химическими элементами в пределах главных подгрупп и периодов периодической системы Д.И. Менделеева. План характеристики химического элемента . Характеристика элемента-неметалла. 6.09 Свойства оксидов, кислот, оснований, солей в свете ТЭД. Кислотный или основный характер оксида и гидроксида элемента как отличительный его признак. Зависимость химических свойств оксидов и гидроксидов элементов побочных подгрупп ПС Д.И.Менделеева от степеней окисления их атомов. Понятие амфотерности на примере оксида и гидроксида алюминия Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома. 10.09 Генетические ряды металлов и неметаллов. Классификация химических элементов. Понятие о переходных элементах. Генетические ряды переходных элементах. Лабораторный опыт. 1.Получение гидроксида цинка и исследование его свойств. Общие сведения о химических реакциях. Классификация химических реакций. Скорость химических реакций. Катализ и катализаторы. 17.09 13.09 20.09 Факт ическ ая дата примеча ние Тема 2. Металлы (19ч.) 7 1. Положение металлов в периодической системе Д.И.Менделеева. Общие физические свойства металлов 2. Сплавы 8 9 3.Химические свойства металлов 10 4. Химические свойства металлов (продолжение). Ряд активности металлов 11 5. Металлы в природе, общие способы получения металлов 12 6.Практическая работа №1 "Получение соединений металлов и изучение их свойств" 7. Общие понятия о коррозии металлов 13 Краткий исторический обзор: Век медный – век бронзовый – век железный. Характеристика положения элементов-металлов в периодической системе. Строение атомов металлов. Металлические кристаллические решетки. Металлическая химическая связь. Общие физические свойства металлов. Легкие и тяжелые металлы. Черные и цветные металлы. Драгоценные металлы. Лабораторный опыт. 2 Ознакомление с образцами металлов Сплавы и их классификация. Черные металлы: чугуны и стали. Цветные металлы: бронза, латунь, мельхиор, дюралюминий. Характеристика сплавов, их свойства. Значение важнейших сплавов .Химические свойства металлов как восстановителей. Восстановительные свойства металлов. Взаимодействие металлов с кислородом и другими неметаллами 24.09 Характеристика общих химических свойств металлов на основании их положения в ряду напряжения в свете представления об ОВР. Электрохимический ряд напряжения металлов и его использование для характеристики химических свойств конкретных металлов .Правила применения электрохимического ряда напряжений при определении возможности взаимодействия с растворами кислот и солей. Поправки к правилам применения электрохимического ряда напряжения. Металлотермия. Лабораторный опыт. 3 Взаимодействие металлов с растворами кислот и солей. Самородные металлы. Минералы. Руды. Металлургия и ее виды: Пиро-, гидро-, электрометаллургия. Металлотермия. Микробиологические методы получения металлов. Лабораторный опыт. 4 Ознакомление с образцами природных соединений а) натрия, б) кальция в) алюминия г) железа. Правила техники безопасности при выполнении данной работы. Химические свойства металлов и их соединений. Получение соединений металлов и изучение их свойств. Объяснять результаты и записывать уравнения соответствующих реакций в молекулярной и ионной формах Коррозия металлов, способы защиты металлов от коррозии. 4.10 27.09 1.10 8.10 11.10 15.10 14 15 16 17 18 19 20 21 22 23 8. Щелочные металлы Общая характеристика щелочных металлов. Строение атомов элементов главной подгруппы первой группы. Щелочные металлы - простые вещества. Общие физические свойства щелочных металлов. Химические свойства щелочных металлов: взаимодействие с простыми веществами, с водой. Природные соединения, содержащие щелочные металлы, способы получения металлов 9.Соединения щелочных Обзор важнейших соединений щелочных металлов: оксиды, щелочи, соли (хлориды, металлов карбонаты, сульфаты, нитраты). Их свойства и применение в народном хозяйстве. Калийные удобрения. Природные соединения щелочных металлов 10. Общая характеристика Общая характеристика элементов главной подгруппы II группы. Строение атомов элементов главной щелочноземельных металлов. Физические свойства. Химические свойства: подгруппы II группы взаимодействие с простыми веществами, с водой, с оксидами (магний, кальций и др.) 11. Важнейшие соединения Важнейшие соединения: оксид кальция – негашеная известь, оксид магния – жженая щелочноземельных магнезия, гидроксид кальция, соли (мел, мрамор, известняк, гипс, фосфаты и металлов др.).Применение важнейших соединений народном хозяйстве. Роль химических элементов кальция и магния в жизнедеятельности живых организмов 12 Алюминий Строение атома алюминия. Физические, химические свойства алюминия: взаимодействие с простыми веществами, кислотами; Алюминотермия. Соединения алюминия – оксид, гидроксид. Их амфотерный характер. Природные соединения алюминия и способы его получения. Области применения алюминия 13. Соединения алюминия Соединения алюминия: амфотерность оксида и гидроксида. Важнейшие соли алюминия. Применение алюминия и его соединений Лабораторный опыт. 5 Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей. 14. Железо. Строение Строение атома железа. Степени окисления железа. Физические, химические свойства атома, физические и железа: взаимодействие с простыми веществами, водой, кислотами, солями. Железо в химические свойства природе, минералы железа 15. Генетические ряды Соединения катионов железа: Fe2+ Fe3+. Качественные реакции на ионы железа. железа (II) и железа (III). Железо – основа современной техники. Значение железа, его соединений и сплавов в Важнейшие соли железа природе и народном хозяйстве .Важнейшие соли железа. Понятие коррозии. Роль химического элемента железа в жизнедеятельности живых организмов Лабораторный опыт. 6 Качественные реакции на ионы железа. 16.Практическая работа №2 Правила техники безопасности при выполнении данной работы. Химические свойства «Осуществление цепочки веществ. Осуществление цепочки химических превращений веществ. химических превращений». Объяснять результаты и записывать уравнения соответствующих реакций в молекулярной и ионной формах 17. Обобщение и Повторение ключевых моментов темы «Металлы»: систематизация знаний по физические и химические свойства металлов и их важнейших соединений 18.10 22.10 25.10 29.10 1.11 12.11 15.11 19.11 22.11 26.11 24 25 теме « Металлы» 18.Практическая работа №3«Экспериментальные задачи по распознаванию и получению веществ» 19. Контрольная работа №1 по теме «Металлы» Правила техники безопасности при выполнении данной работы. Химические свойства веществ. Получение и распознавание веществ. Объяснять результаты и записывать уравнения соответствующих реакций в молекулярной и ионной формах Тематический контроль знаний 29.11 3.12 Тема 3 Неметаллы (25ч.) 26 1. Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон 27 2. Водород 28 3. Галогены 29 4. Соединения галогенов 30 31 5. Получение галогенов. Биологическое значение и применение галогенов . 6. Кислород 32 7. Сера и ее соединения Положение элементов- неметаллов в ПСХЭ Д.И. Менделеева, особенности строения их атомов. Свойства простых веществ неметаллов. Электроотрицательность как мера неметалличности, ряд электроотрицательности. Кристаллическое строение неметаллов – простых веществ. Аллотропия, состав воздуха. Физические свойства неметаллов. Относительность понятий «металл» - «неметалл». Двойственное положение водорода в периодической системе Д. И. Менделеева. Физические свойства водорода. Химические свойства водорода – окислительные и восстановительные. Применение водорода. Получение, собирание, распознавание водорода Строение атомов галогенов и их степени окисления. Физические свойства галогенов. Химические свойства галогенов: взаимодействие с металлами, водородом, растворами солей и галогенов. Изменение окислительно-восстановительных свойств у галогенов от фтора к йоду. Галогеноводороды. Галогеноводородные кислоты: фтороводородная (плавиковая), хлороводородная (соляная). Бромоводородная, йодоводородная. Галогениды: фториды, хлориды, бромиды, йодиды. Качественные реакции на галогенид-ион. Лабораторный опыт. 7. Качественные реакции на хлорид – ион. Природные соединения галогенов. Получение галогенов электролизом расплавов или растворов солей. Биологическое значение галогенов. Применение галогенов и их соединений в народном хозяйстве. 6.12 Кислород в природе. Химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами) Сложными веществами. Горение и медленное окисление. Дыхание и фотосинтез. Получение кислорода. Применение кислорода Строение атомов серы и степени окисления серы. Аллотропия серы. Химические свойства серы: взаимодействие с металлами, кислородом, водородом. Демеркуризация. Сера в природе: самородная, сульфидная и сульфатная. Биологическое значение серы. Применение серы. 24.12 10.12 13.12 17.12 20.12 27.12 33 8. Серная кислота. Окислительные свойства серной кислоты 34 35 9.Практическая работа 4 Экспериментальные задачи по теме «Подгруппа кислорода». 10. Азот 36 11. Аммиак 37 12. Соли аммония 38 13.Кислородные соединения азота. Азотная кислота и ее соли. 39 14.Окислительные свойства азотной кислоты 15. Фосфор и его соединения 40 41 42 43 16. Обобщение и систематизация знаний по теме «Подгруппа азота». 17. Углерод 18. Кислородные соединения углерода Сероводород и сульфиды. Сернистый газ, сернистая кислота, сульфиты Серная кислота разбавленная и концентрированная. Применение серной кислоты в народном хозяйстве. Соли серной кислоты: глауберова соль, гипс, сульфат бария, медный купорос. Производство серной кислоты. Лабораторный опыт. 8 Качественная реакция на сульфат-ион. Правила техники безопасности при выполнении данной работы. Подтверждение качественного состава веществ. Химические свойства веществ. Определение веществ по их свойствам. Объяснять результаты и записывать уравнения соответствующих реакций в молекулярной и ионной формах. Строение атомов и молекул азота. Свойства азота. Взаимодействие с металлами, водородом и кислородом. Получение азота из жидкого воздуха. Азот в природе и его биологическое значение Строение молекулы аммиака. Свойства аммиака: взаимодействие с водой, кислотами, кислородом. Донорно-акцепторный механизм образования связи в ионе аммония. Получение, собирание и распознавание аммиака. Свойства солей аммония, обусловленные ионом аммония и различными анионами. Разложение солей аммония. Соли аммония и их применение Лабораторный опыт. 9 Распознавание солей аммония. Несолеобразующие кислотные оксиды азота. Оксид азота (IV). Свойства азотной кислоты как электролита и как окислителя. Применение азотной кислоты. Нитраты, селитры .Нитраты и нитриты, проблема их содержания в сельскохозяйственной продукции. Азотные удобрения. Взаимодействие концентрированной и разбавленной кислоты с металлами и неметаллами. Строение атома фосфора. Аллотропия фосфора: белый фосфор. Красный фосфор. Свойства фосфора: образование фосфидов, оксида фосфора (V). Фосфорная кислота и три ряда ее солей: фосфаты, гидрофосфаты и дигидрофосфаты. Биологическое значение фосфора (фосфат кальция, АТФ, ДНК и РНК). Применение фосфора и его соединение. Фосфорные удобрения. Решение упражнений по теме "Подгруппа азота". Повторение ключевых понятий темы. Решение задач на определение массы и объема веществ, массовой доли примеси по данной массе или обьему. Строение атома и степень окисления углерода. Аллотропия углерода: алмаз и графит. Древесный активированный уголь. Свойства аллотропных модификаций, применение. Адсорбция и ее применение. Химические свойства углерода. Взаимодействие с кислородом, металлами, водородом, с оксидами металлов. Карбиды кальция и алюминия. Ацетилен и метан. Круговорот углерода в природе Оксид углерода (II) или угарный газ: получение, свойства, применение. Оксид углерода (IV) или углекислый газ. Качественная реакция на углекислый газ. Получение, свойства, 14.01 17.01 21.01 24.01 28.01 31 01 4.02 7.02 11.02 14.02 18.02 44 19. Практическая работа №6 «Получение, собирание и распознавание газов» 45 20. Кремний и его соединения. 46 21. Применение кремния и его соединений. 47 22. Практическая работа №5 «Экспериментальные задачи по теме « Подгруппа азота и углерода» 23. Решение задач. Вычисления массы и объемов продуктов реакции с определенной долей выхода. 24. Обобщение и систематизация знаний по теме «Неметаллы» 48 49 50 25. Контрольная работа №2 «Неметаллы» 51 1. Предмет органической применение. Лабораторный опыт. 10 Получение углекислого газа и его распознавание. Угольная кислота и ее соли. Карбонаты и гидрокарбонаты их значение в природе и жизни человека. Превращение карбонатов в гидрокарбонаты и обратно. Понятие жесткости воды и способы ее устранения. Качественная реакция на соли угольной кислоты. Лабораторный опыт. 11 Качественная реакция на карбонат – ион. Правила техники безопасности при выполнении данной работы. Технологическая схема работы. Получение и способы собирания и распознавания кислорода ,аммиака, водорода, оксида углерода. Строение атома, кристаллический кремний, его свойства и применение. Природные соединения кремния: кремнезем, кварц , силикаты, алюмосиликаты, асбест. Биологическое значение кремния. Свойства кремния: полупроводниковые, взаимодействие с кислородом, металлами, щелочами. Оксид кремния (IV): его строение и свойства. Кремниевая кислота и ее соли. Растворимое стекло. Лабораторный опыт. 12 Ознакомление с природными силикатами. Применение кремния и его соединений. Силикатная промышленность. Стекло. Цемент. Керамика. Лабораторный опыт. 13 Ознакомление с продукцией силикатной промышленности. Правила техники безопасности при выполнении данной работы. Ионные уравнения реакций. Качественные реакции на ионы. Химические свойства солей аммония, нитратов, карбонатов. Решение задач. Вычисления массы и объемов продуктов реакции с определенной долей выхода от теоретически 2102. 25.02 28.02 4.03 7 03 Обобщение, систематизация и коррекция знаний, умений и навыков учащихся по теме 11.03 «Неметаллы» Химические свойства неметаллов и их соединений. Характеристика реакций по различным признакам. Задания на смещение химического равновесия. Задачи на избыток и недостаток исходных веществ. Контроль знаний, умений и навыков. Химические свойства неметаллов и их 14.03 соединений. Характеристика реакций по различным признакам. Задания на смещение химического равновесия. Задачи на избыток и недостаток исходных веществ Тема 4 Органические соединения – (12 ч.) Вещества органические и неорганические, относительность понятия « органические 18.03 химии. 52 2. Предельные углеводороды 53 3. Непредельные углеводороды. Этилен и его гомологи 54 4 Решение задач и упражнений по теме « Углеводы» 5. Спирты. Альдегиды. 55 56 6. Предельные одноосновные карбоновые кислоты. Сложные эфиры 57 7. Жиры 58 8. Аминокислоты. Белки 59 9. Углеводы. 60 10. Полимеры. 61 11. Обобщение и вещества».Первоначальные сведения о строении органических веществ. Причины многообразия органических соединений. Особенности органических веществ Теория витализма. Ученые, работы которых опровергли теорию витализма. Понятие об изомерии и гомологических рядах. Молекулярные и структурные формулы органических веществ. Строение алканов. Номенклатура алканов. Метан и этан: строение молекул. Углеводороды: метан, этан, особенности физических и химических свойств. Горение метана и этана. Применение метана. Непредельные углеводороды: этилен. Химическое строение молекулы этилена. Двойная связь. Взаимодействие этилена с водой. Полимеризация. Полиэтилен и его значение Шаростержневые и другие виды моделей молекул веществ. Лабораторный опыт. 14 Изготовление моделей молекул углеводородов. Решение упражнений и задач по теме «Углеводороды» . Решение задач «Определение формулы вещества на основании данных о его плотности и массовой доли элемента» 21.03 1.04 4.04 Спирты и их атомность. Метанол, этанол, этиленгликоль, глицерин – важнейшие представители класса спиртов, их строение и свойства. Понятие о карбонильной группе и альдегидах. Лабораторный опыт. 15 Свойства глицерина. Карбоксильная группа и общая формула предельных одноосновных карбоновых кислот. Муравьиная и уксусная кислоты - важнейшие представители класса предельных одноосновных карбоновых кислот, их строение и свойства 8.04 Предельные и непредельные жирные кислоты. Жиры как сложные эфиры. Растительные и животные жиры, их применение. Понятие о мылах, синтетических моющих средствах Аминокислоты. Получение и свойства аминокислот. Биологическая роль аминокислот. Пептидная связь и полипептиды. Белки, их строение . Уровни организации структуры белка. Свойства белков и их биологические функции. Качественные реакции. Понятие об углеводах. Углеводы: моносахариды, дисахариды, полисахариды. Глюкоза и фруктоза. Сахароза. Крахмал. Целлюлоза. Глюкоза ,ее свойства и значение. Крахмал и целлюлоза их биологическая роль. Лабораторный опыт. 15 Взаимодействие глюкозы с гидроксидом меди ( 11) без нагревания и при нагревании. Лабораторный опыт. 16 Взаимодействие крахмала с иодом. Основные понятия химии ВМС: «полимер», «мономер», «структурное звено», «степень полимеризации», «средняя молекулярная масса полимера». Краткий обзор важнейших полимеров Решение упражнений по теме «Первоначальные представления об органических 15.04 11.04 18.04 22.04 25.04 29.04 62 систематизация знаний по теме «Органические соединения» 12. Контрольная работа по теме « Органические вещества» веществах». Повторение ключевых понятий темы. Отработка теоретического материала в рамках данной темы Классификация органических веществ. Строение и химические свойства органических веществ. Качественные реакции на органические соединения. Решение залач. 2.05 Тема 6 Обобщение знаний по химии за курс основной школы (5 +1 ч.) 63 64 65 1.Закономерности изменения свойств элементов и их соединений в периодах и группах. 2.Типы химических связей и типы кристаллических решеток. Классификация химических реакций 3.Классификация и свойства неорганических веществ 66 4.Классификация и свойства органических веществ 67 5. Итоговая контрольная работа Резерв 68 Закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атома. Металлические и неметаллические свойства Окислительные и восстановительные свойства. 6.05 Типы химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств. Классификация химических реакций по различным признакам. Число состав реагирующих веществ и образовавшихся веществ; тепловой эффект, использование катализатора; направление; изменение степеней окисления атомов. Классификация веществ. Простые и сложные вещества, металлы, неметаллы, оксиды, основания, кислоты, соли. Свойства неорганических веществ. Соли: состав, классификация и общие химические свойства в свете теории электролитической диссоциации и представлений о процессах окисления-восстановления. Классификация и свойства органических веществ. Строение, номенклатура органических веществ. Углеводороды: метан, этан, особенности физических и химических свойств. .Метанол, этанол, этиленгликоль, глицерин – важнейшие представители класса спиртов, их строение и свойства. Понятие о карбонильной группе и альдегидах. Непредельные углеводороды: этилен. Химическое строение молекулы этилена. Классификация и свойства органических веществ. Строение, номенклатура органических веществ. Карбоновые кислоты. Реакции этерификации. Жиры. Аминокислоты. Реакции поликонденсации. Белки, их строение и биологическая роль. Классификация и свойства неорганических веществ. Строение, номенклатура и свойства органических веществ. 13.05 16.05 20.05 23.05 График контрольных работ 9 класс. № 1 2 3 Контрольная работа Контрольная работа №1 по теме «Металлы» Контрольная работа №2 «Неметаллы» Контрольная работа №3 по теме « Органические вещества» Дата проведения. 3.12 14.03 2. 05 4 Итоговая контрольная работа 23.05