Что нужно знать о ХРОНИЧЕСКОМ МИЕЛОЛЕЙКОЗЕ
advertisement

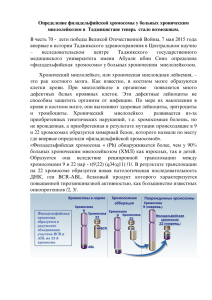
Что нужно знать о ХРОНИЧЕСКОМ МИЕЛОЛЕЙКОЗЕ Встреча с любым хроническим заболеванием всегда вызывает некоторую тревогу и, даже, пугает нас. Беспокойство, внутренний дискомфорт могут быть вызваны не только плохим самочувствием на фоне заболевания, но и появлением необходимости регулярно посещать врачей, сдавать анализы и практически постоянно принимать те или иные лекарственные препараты. Наши волнения зачастую обусловлены нехваткой полноценной информации по поводу заболевания, способов его преодоления, а также отсутствием ясности в своем будущем. У Вас установлен диагноз одного из серьезных заболеваний крови под названием хронический миелолейкоз. Всего несколько десятилетий назад данное заболевание считалось неизлечимым и приводило к смерти через несколько месяцев, а иногда и через считанные недели, после установления диагноза. В настоящее время, благодаря современным достижениям медицины, длительность жизни больных исчисляется годами, более того, почти четверть всех заболевших может быть даже излечена. Мы предлагаем небольшую справку по хроническому миелолейкозу. Наша задача, помочь Вам преодолевать трудности в схватке с этим тяжелым заболеванием, поддержать Вас в Вашей борьбе за Вашу жизнь. Общеизвестно, что с заболеванием борются больной, врач и лекарство. Без Вашего активного, осмысленного участия, эта схватка обречена на неудачу. Понимание сути заболевания, механизмов его развития и представление о том, какие существуют способы борьбы с ним в современной медицине, безусловно, помогут Вам более успешно сотрудничать с нами, принимать активное участие в предстоящей программе лечения и осознанно бороться с этим потенциально смертельным недугом. Наша информация является общей, очень сжатой и не может быть ответом на все ваши вопросы. Каждый организм индивидуален и заболевание у каждого из вас течет по-разному. Лечащий доктор при выборе того или иного способа лечения для Вас, всегда учитывает как особенности Вашего организма, так и особенности течения заболевания конкретно у Вас. Поэтому, каждый из вас вправе задавать любые интересующие вопросы по поводу заболевания, характера предлагаемого вам обследования и терапии вашему лечащему доктору. Причина появления ХМЛ: Не известна! У людей, ранее получивших высокие дозы радиации (техногенные катастрофы, перенесенная лучевая терапия по поводу других заболеваний…), увеличивается риск развития ХМЛ, также как и многих других злокачественных заболеваний. Однако, хр.миелолейкозом, как и другими онкогематологиченскими болезнями, страдают люди ранее не имеющие очевидный контакт с радиацией или с какимилибо другими вредными факторами. Механизмы развития ХМЛ: Хронический миелолейкоз является одним из немногих заболеваний, механизм развития которого удалось хорошо расшифровать. В каждой клетке организма человека содержится 46 хромосом (23 пары). Каждая хромосома имеет строгую последовательность небольших участков, называемых генами. Каждый ген отвечает за синтез одного вида белка. Те или иные белки необходимы для разных процессов жизнедеятельности нашего организма. Под воздействием какой-то причины (радиация, др.неизвестные факторы…) 22-ая и 9-ая хромосомы обмениваются участками(см.рис 1 и 2) таким образом, что на 22-ой хромосоме, к остаткам гена под названием BCR присоединяется часть гена ABL от 9-ой хромосомы. Образуется новый патологический ген BCR-ABL на 22-ой хромосоме. Измененная (укороченная) 22-ая хромосома была выявлена в 1960г. учеными из Филадельфии и, впоследствии, была названа Филадельфийской (аббревиатура Ph-хромосома). Далее было выявлено, что ген BCR-ABL регулирует образование белка тирозин киназы. Данный белок влияет на многие процессы в клетке, таким образом, что придает ей свойства злокачественной клетки(быстрое и бесконтрольное размножение, устойчивость к иммунной системе организма, замедление процессов старения и гибели). Рис.1 Рис.2 Обычно в организме ежедневно появляются клетки с измененными генами, однако иммунные клетки быстро их уничтожают и предотвращают образование тех или иных видов опухоли. Однако ген BCR-ABL придает клетке устойчивость к иммунным, защитным силам организма и через некоторое время из одной измененной клетки появляется огромное количество ее потомков(рис.3). Так зарождается заболевание под названием хронический миелолейкоз. Рис.3 ЗP Развитие заболевания и его клинические проявления: Все клетки крови образуются из единой (полипотентной) стволовой клетки, которая вначале делится на лимфоидную и миелоидную стволовую клетку. Стволовые клетки находятся в основном в костном мозге (губчатое вещество костей). Филадельфийская хромосома исходно стволовой клетке. В норме появляется в миелоидной под воздействием разных веществ (называются ростовыми факторами), из этой миелоидной стволовой клетки в костном мозге в определенном количестве образуются те или иные виды клеток (предшественники лейкоцитов, эритроцитов, тромбоцитов…)(рис.4). Эти клетки, после созревания до определенного этапа, выходят из костного мозга в периферическую кровь, где начинают выполнять свои функции: -лейкоциты («белые» клетки крови)-защищают организм от инфекции; -эритроциты («красные» клетки крови)-доставляют кислород и др.вещества, ко всем клеткам организма); -тромбоциты- участвуют в образовании сгустка при кровотечениях. Рис.4 После своего возникновения лейкозная стволовая клетка, под воздействием патологического белка - тирозин киназы, начинает бесконтрольно размножаться и производить огромное количество себе подобных, постепенно созревающих до клеток крови. Костный мозг постепенно переполняется формами клеток, бластными всеми созревающими в первую очередь лейкоцитарного ряда -очень молодыми клетками, промиелоцитами, миелоцитами, метамиелоцитами… Обычно они отсутствуют в крови, но при чрезмерном накоплении в костном мозге, начинают выходить и на периферию. Постепенно увеличивается количество и зрелых клеток крови: в первую очередь лейкоцитов-«белых клеток» (отсюда устаревшее название болезни- «белокровие»), в начале заболевания нередко увеличивается количество и других клеток крови (тромбоцитов и эритроцитов). По мере прогрессии заболевания, у бластных клеток снижается способность к созреванию, они постепенно накапливаются в костном мозге и выходят на периферию в большом количестве. При этом они преимущественно созревают только до лейкоцитов и поэтому, при неуклонном росте лейкоцитоза, на поздних стадиях заболевания, уменьшается количество тромбоцитов (тромбоцитопения) и эритроцитов (соответственно снижается уровень гемоглобина, т.е. появляется анемия). У больных увеличивается риск кровотечений и кровоизлияний, а на фоне низкого гемоглобина появляются слабость, усталость, головные боли, боли в области сердца, ощущение нехватки воздуха… Значительное увеличение количества клеток в костном мозге у больных может вызывать очень сильные, распирающего характера боли в костях, иногда требующие введение обезболивающих, вплоть до наркотических средств. Огромное количество токсических веществ, выделяемых лейкозными клетками, вызывают снижение недомогание, веса у слабость, больного. Это повышение так температуры, называемые признаки потливость, опухолевой интоксикации, которые могут появиться как вначале заболевания, вынуждая больного обратиться к врачам, так и на поздних этапах болезни, указывая на прогрессирование болезни и необходимость применения более активной терапии. Лейкозные клетки при ХМЛ могут накапливаться в разных органах, но чаще всего они переполняют селезенку и печень. Эти органы постепенно разрастаются и иногда, достигают огромных размеров, вызывая дискомфорт и боли у больных(схему см.ниже). Схема №1 Появление и постепенное накопление лейкозных клеток Переполнение костного мозга и периферической крови предшественниками гранулоцитарных лейкоцитов (бласты, промиелоциты…) и зрелыми лейкоцитами нейтрофильного ряда(палочко-и сегменто-ядерные) Уменьшение количества других клеток крови Эритроцитов Тромбоцитов Накопление лейкозных клеток в органах Боли в костях Опухолевая интоксикация -Увеличение селезенки -слабость -Увеличение печени -усталость -Слабость, - кровоподтеки, -повышение -усталость, -кровотечения, температуры -головокружение, -кровоизлияния… -потливость -сердцебиение, -похудание -нехватка воздуха… Постановка дагноза ХМЛ: ХМЛ можно заподозрить при выявлении высокого лейко-, эритро- или тромбоцотозах в анализе крови, увеличении количества клеток в костном мозге, увеличении размеров селезенки и печени, но однозначно диагноз ХМЛ устанавливается только при выявлении Филадельфийской хромосомы(Phхромосомы) и/или гена BCR-ABL. Как правило, заболевание выявляется при накоплении опухолевых клеток в организме в количестве, превышающем 1012 лейкозных клеток. На этом этапе уже появляются изменения в анализе крови и можно заподозрить наличие болезни крови. Вторым шагом для уточнения диагноза является исследование костного мозга для подсчета количества клеток и выполнения цитогенетического анализа, который является наиболее распространенным способом хромосомного. Данным способом Ph-хромосома выявляется у 95% больных ХМЛ. Анализ хромосом возможен только в процессе их деления. Полученный от больных костный мозг проходит специальную обработку для получения делящихся клеток. Ограничением метода является невозможность у 100% больных добиться деления клеток(митозы отсутствуют), а также относительно низкая чувствительность метода, т.к. лейкозную клетку с Ph—хромосомой удается обнаружить при количестве опухолевых клеток, превышающем 108-10. Ген BCR-ABL выявляют методом полимеразно-цепной реакции (ПЦР) практически у всех 100% больных ХМЛ. Чувствительность метода очень высокая и позволяет выявить 1 опухолевую клетку, содержащую данный ген, среди 100 000 нормальных клеток крови или костного мозга. В ходе лечения продолжение выявления гена BCR-ABL и/или Ph-хромосомы является признаком сохранения заболевания. При исчезновении Ph-хромосомы в ходе лечения говорят о наступлении цитогенетической ремиссии, а при отсутствии еще и гена BCR-ABL говорят о молекулярной ремиссии болезни, хотя как мы видим, небольшое количество клеток могут быть недоступны для выявления имеющимися, на сегодняшний день, способами обследования. Поэтому, вероятность возврата болезни остается даже у больных, достигших полной молекулярной ремиссии. Фазы ХМЛ: Как правило, в своем развитии заболевание проходит 3 последовательные фазы: 1.Хроническая фаза. Течение болезни в этой фазе относительно спокойное. Количество клеток может быть значительно увеличено, но бластные клетки или отсутствуют или обнаруживаются в небольшом количестве, как в костном мозге как и в ан.крови(менее 15%). Любые препараты, применяемые для лечения ХМЛ, могут нормализовать количество клеток крови и размеры органов, а также существенно улучшить самочувствие пациентов. Продолжительность данной фазы колеблется от нескольких недель до нескольких лет, но, в среднем, до 5-6 лет. 2.Фаза акселерации. В этой фазе болезни количество молодых клеток прогрессивно увеличивается(бл.клетки 15-30%), могут появиться анемия и тромбоцитопения. Уменьшается эффективность лекарственных препаратов, необходимо проведение более интенсивной химиотерапии. Продолжительность данной фазы- от нескольких недель до нескольких месяцев, в среднем, 6-9мес. 3.Фаза бластного криза. Выявляется большое количество бластных клеток как в крови, так и в костном мозге (более 30%). На этой стадии болезни эффективность всех видов лечения, известных современной медицине, ограничена. Несмотря на терапию, заболевание продолжает прогрессировать. Продолжительность данной терминальной фазы также от нескольких недель до нескольких месяцев, в среднем, до 3-6 мес. Лечение: Существует несколько видов терапии(рис. 5): 1.Цитостатики. В хронической фазе болезни применяются гидроксиуреа(гидреа), миелосан(бусульфан), цитозар(обычно в сочетании с реафероном). Показано, что эти препараты существенно уменьшают количество лейкозных клеток, уменьшают размеры органов, улучшают самочувствие больных, но они не уменьшают количество гена BCR-ABL и Ph-хромосомы, таким образом они не излечивают от болезни и более того, они не увеличивают продолжительность жизни больных ХМЛ. У больных, терминальная фаза получающих болезни-фаза данную терапию бластного криза. неминуемо Другие наступает цитостатики (рубомицин, меркаптопурин, винкристин…) или гормональные препараты в основном, применяются в фазе бластного криза. Эти препараты оказывают только временный эффект, несколько лучший, при лимфоидном варианте криза. 2.Лучевая терапия. Облучение селезенки оказывает только временный эффект в виде уменьшения размеров данного органа, а также уменьшения количества клеток крови. Применяют в случае неэффективности лекарственных средств при прогрессирующем увеличении селезенки. 3.Препараты интерферона-альфа: реальдирон, реаферон… Очень эффективное биологическое средство для терапии ХМЛ, активизирующее иммунные силы самого больного против лейкозных клеток. Применение этих препаратов было мощным прорывом в лечении больных ХМЛ. Препараты интерферона, особенно в сочетании с цитозаром, у определенной части больных (около 10-25%) позволяют добиться стойкой полной цитогенетической ремиссии, т.е.полного исчезновения терапию препаратами интерферона, имеются «долгожители»( 8 и более лет). Однако, почти у всех Ph-хромосомы. Среди больных ХМЛ, получающих больных, даже при стабильном отсутствии Ph-хромосомы, выявляют ген BCRABL, т.е. у них сохраняются признаки заболевания и, соответственно, остается риск дальнейшего прогрессирования болезни. Это подтверждено многолетним наблюдением, интерфероном, когда у через больных несколько на фоне лет продолжающегося благополучия, лечения вновь начинает обнаруживаться Филадельфииская хромосома и заболевание прогрессирует до фазы бластного криза. 4.Интенсивная химио(-лучевая)терапия с последующей инфузией стволовых клеток («трансплантация костного мозга»). Данная терапия является одним из наиболее эффективным видом лечения ХМЛ, который дает шанс больным на полное избавление от этой смертельной болезни. Немного подробнее остановимся на этом способе лечения. Больному вводят огромные дозы химиопрепаратов, способных уничтожить всю популяцию лейкозных клеток. Однако терапия не является адресной и, наряду с опухолевыми клетками, погибают и здоровые клетки костного мозга. Для восстановления нормальных клеток костного мозга больному трансплантируют (т.е. пересаживают, а чисто технически просто вливают в вену) заранее заготовленные стволовые клетки. В качестве стволовых клеток используются или клетки самого больного (аутотрансплантация), взятые у больного до проведения интенсивной химиолучевой терапии или клетки совместимого донора (аллотарнсплантация). Таким донором могут быть родные братья или сестры больного (родственная трансплантация) или добровольцы из международного регистра доноров стволовых клеток (неродственная трансплантация)(см.схему №2 ниже). Хотя аутотрансплантация стволовых клеток сопровождается меньшими осложнениями в ходе терапии, оно является и менее эффективным, чем аллотрансплантация СК, так как обратно в организм больного снова попадает некоторое количество Ph-положительных стволовых клеток(даже при наличии молекулярной ремиссии). Однако, при аутотранслантации, в случае уничтожения всех опухолевых клеток при интенсивной химиотерапии, после введения обратно стволовых клеток, в организм попадает значительно меньшее количество опухолевых клеток и далее терапия обычными препаратами становится более эффективной, усиливается роль и иммунной системы в болрьбе против болезни. Т.О. смысл этого лечения в значительном уменьшении количества опухолевых клеток в ходе интенсивной терапии, что в дальнейшем может повысить эффективность интерферона и цитостатиков. Аллотрансплантация стволовых клеток(аллоТСК) является самым эффективным средством для лечения больных ХМЛ. Большинство больных, получивших данное лечение, достигают длительной полной, в том числе и молекулярной ремиссии. Многолетние наблюдения показывают, что многие из них полностью излечиваются от болезни. Схема №2 1 этап. Забор и криоконсервация(замораживание)стволовых клеток У самого больного (при аутотрансплантации) У совместимого по системе HLA брата или сестры (при родственной аллотрансплантации) У совместимого по системе HLA неродственного донора * (при неродственной трансплантации) 2 этап. Интенсивная химиотерапия для уничтожения лейкозных клеток 3.Этап. Внутривенное введение заранее забранных стволовых клеток для восстановления нормальных клеток кроветворения. *В России банка доноров стволовых клеток нет. Поиск неродственных доноров стволовых клеток проводится в Европейском и Международном банке. К сожалению, для большинства больных ХМЛ данная терапия невозможна из-за отсутствия донора, пожилого возраста пациента, наличия у него других тяжелых заболеваний. HLA овместимый донор выявляется только у 30-40% больных, подлежащих аллотрансплнтации (возраст до 50лет, отсутствие других тяжелых заболевания). Данное лечение является очень токсичным. Во всем мире, даже в наилучших центрах по пересадке стволовых клеток, часть больных погибает от осложнений связанных с лечением. У другой части больных из-за развития, так называемой, «реакции трансплантат против хозяина» с поражением разных органов и тканей, значительно ухудшается качество жизни и, нередко, эти изменения приводят к смерти через несколько месяцев, а то и лет после аллоТСК. К сожалению, у небольшого количества цитогенетической и больных перенесших аллоТСК после молекулярной ремиссии, вновь длительной происходит рецидив заболевания. В конечном счете, только 40-50% больных перенесших аллоТСК излечиваются от болезни полностью и имеют при этом удовлетворительное качество жизни. 5.Гливек (иматиниб мезилат). Гливек первый препарат, целенаправленно воздействующий на опухолевую клетку. Он блокирует белок тирозин киназу, который у больных образуется в большом количестве патологическим геном BCRABL. Он придает клетке злокачественные способности-способность бесконтрольно делиться, замедлять физиологические процессы старения и гибели, ускользать от влияния иммунной системы… Подавляя этот белок в лейкозной клетке, Гливек лишает ее всех этих злокачественных свойств. Всего несколько лет назад были начаты первые клинические испытания по Гливеку, однако, его эффективность оказалась настолько ошеломляющей, что многие страны мира вскоре дали добро на его применение в общей клинической практике. Для начала препарат был применен для лечения больных, у которых терапия реаферона оказалась неэффективной. У большинства этих больных был получен цитогенетический ответ, у части из них была достигнута полная цитогенетическая ремиссия. Как и предполагалось, Гливек оказался более эффективным у больных, с впервые выявленным ХМЛ. У, более чем половины, этих больных была достигнута полная цитогенетическая ремиссия, более того у некоторых из них при повторном исследовании не выявлялся и ген BCR-ABL. Терапия Гливеком также оказалась эффективной и у больных в фазе акселерации. У части этих больных наряду с полной гематологической ремиссией, была достигнута и цитогенетическая ремиссия. Как и все другие ныне существующие способы лечения, Гливек не оказывает стойкий эффект у больных в фазе бластного криза, хотя у определенной части этих больных временно была достигнута гематологическая ремиссия болезни. Наряду с неэффективностью препарата у части больных, особенно на поздних стадиях болезни, к сожалению, уже известны случаи рецидива заболевания у больных с полной цитогенетической и даже молекулярной ремиссией при продолжающемся лечении Гливеком. Основными причинами неудачи в терапии в настоящее время считаются выявляемые изменения в Филадельфийской хромосоме(мутации). Считается, что эти мутантные клетки, наряду с обычными Ph(+)-клетками, появляются при развитии болезни в некотором количестве. В ходе терапии Гливек уничтожает Ph(+)-клетки, но не эти мутантные формы. Эти лейкозные клетки в дальнейшем размножаясь вызывают прогрессирование болезни, несмотря на терапию Гливеком. Существует методики для определения этих мутантных форм в периферической крови или костном мозге. Данный анализ необходимо проводить в динамике, особенно при отсутствии хорошего эффекта от терапии Гливеком. При обнаружении данных клеток наряду с появлением неэффективности терапии Гливеком, показано изменение тактики терапии(подготовка больного к трансплантации, добавление цитостатиков или интерферона…). Неэффективность Гливека также может быть обусловлена появлением других хромосомных изменений, увеличением активности гена множественной лекарственной устойчивости (белок образуемый этим геном из клетки обратно выкачивает многие лекарства, в том числе Гливек, таким образом уменьшая их концентрацию внутри клетки и снижая их эффективность). Несмотря на неудачи лечения Гливеком у определенной части больных, первые результаты терапии данным препаратом сильно обнадеживают. Впервые у всех больных ХМЛ, независимо от их возраста, появился реальный шанс на избавление от этого смертельного заболевания путем применении относительно нетоксичного способа лечения. В настоящее время накоплен слишком небольшой опыт, чтобы с уверенностью говорить о всех достоинствах и недостатках препарата. Пока уверенно можно сказать только одно- Гливек превосходит все ранее известные лекарственные средства для лечения ХМЛ. Он очень эффективен у больных в хронической фазе болезни и вероятно, дает шанс на полное излечение, хотя бы, части из них от этого грозного заболевания. Гливек в России: программа GIPAP муждународной гуманитарной организация Max Foundation. Максимилиано Риварола со своим отцом-организатором Max Foundation, Педро Риварола В России Гливек для лечения больных ХМЛ появился вскоре после его внедрения в медицинскую практику в 2001 году благодаря гуманитарным организациям. В Санкт-Петербурге с января 2003г. действует программа помощи больным хроническим миелолейкозом GIPAP (Glivec International Patients Assistance Program) под патронажем международной гуманитарной организации Max Foundation. Max Foundation организована Педро Риварола, аргентинцем по происхождению, в память о своем сыне Максимилиано М.Риварола, погибшем от хронического миелолейкоза. Макс заболел хроническим миелолейкозом в возрасте 14 лет. Он лечился в США, в одном из лучших онкологических центров мира. К сожалению, донор костного мозга для Макса не был найден. В 1991г. была выполнена интенсивная химиотерапия с аутотрансплантациий костного мозга. Однако болезнь продолжала прогрессировать и Макс скончался в марте 1991г. в 17 летнем возрасте. После смерти сына, Педро стал оказывать помощь детям с хроническим миелолейкозом, помогал их родителям в поисках доноров коcтного мозга, организовывал сбор пожертвований для этих детей. Официально Max Foundation был создан в 1996г. для оказания помощи больным лейкемией, в основном, детям испанского происхождения. Постепенно организация стала помогать больным онкогематологическими заболеваниями всех возрастов. Max Foundation в настоящее время насчитывает огромное количество постоянных членов и добровольцев, оказывающих многостороннюю помощь онкогематологическим больным -от психологической поддержки до обеспечения жизненно-важными лекарственными препаратими. Многие из больных ХМЛ или их родственники впоследствии становятся добровольцами Max Foundation, оказывая посильную помощь другим. GIPAP–одна из гуманитарных программ организации Max Foundation, специально созданный для обеспечения больных ХМЛ препаратом Гливек. Содействие Max Foundation в реализации этой программы оказывает фирма-производитель препарата Гливек Novartis Pharma AG. Благодаря усилиям организаторов и огромного количества добровольцев Max Foundation, больные ХМЛ из 59 стран мира, в том числе и в России, получают бесплатно препарат Гливек по программе GIPAP. Max Foundation продолжает набирать добровольцев, желающих оказать помощь больным онкогематологическими заболеваниями. Каждый из Вас, при желании, может стать волонтером этой организации. Pedro Rivarola, добровольцев Susana Sarabia, Pat Garcia-Gonzalez и огромная армия Max Foundation, руководители программы GIPAP в России, представители фирмы Novartis Pharma AG в России, врачи-гематологи СПбГМУ им.акад.И.П.Павлова под Руководством проф. Андрея Юрьевича Зарицкого -это люди, прикладывающие большие усилия для обеспечения Вас наиболее современным и эффективным средством лечения хронического милелолейкозапрепаратом Гливек, это люди готовые помочь Вам в Вашей борьбе за Вашу жизнь. И конечно же, все мы рассчитываем на ваше сотрудничество с нами. Мы желаем успехов каждому из Вас в этой нелегкой схватке. Координатор программы GIPAP в Санкт-Петербурге проф. А.Ю. Зарицкий. Тел. E-mail: 499-70-68 haemat@spmu.rssi.ru # THE MAX FOUNDATION 110 W Dayton, Suite 205 Edmonds, WA 98020 USA Phone: 425-778-8660 / Toll Free: 1-888-462-9368 Fax: 425-778-8760