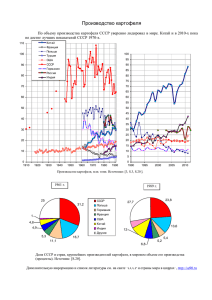
диагностика вирусов в растениях картофеля in vitro
advertisement

Министерство образования и науки РФ Федеральное государственное автономное образовательное учреждение высшего образования «КАЗАНСКИЙ (ПРИВОЛЖСКИЙ) ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» ИНСТИТУТ ФУНДАМЕНТАЛЬНОЙ МЕДИЦИНЫ И БИОЛОГИИ КАФЕДРА МИКРОБИОЛОГИИ Направление: 06.03.01 (ОКСО 020400.62) – биология ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА Бакалаврская работа ДИАГНОСТИКА ВИРУСОВ В РАСТЕНИЯХ КАРТОФЕЛЯ IN VITRO Работа завершена: « » 2015 г. (О. Ю.Тихонова) Работа допущена к защите: научные руководители к. б. н. зав. лаб. селекции картофеля ФГБНУ «ТатНИИСХ» « » 2015 г. (С. Г. Вологин) к. б. н., доцент « » 2015 г. (Н. С. Карамова) Заведующий кафедрой д. б. н., профессор « » 2015 г. (О. Н. Ильинская) Казань – 2015 СОДЕРЖАНИЕ СПИСОК СОКРАЩЕНИЙ ................................................................................. 4 ВВЕДЕНИЕ............................................................................................................. 5 1 ОБЗОР ЛИТЕРАТУРЫ..................................................................................... 8 1.1 Общая характеристика вирусов картофеля .................................................... 8 1.1.1 Y – вирус картофеля ..................................................................................... 8 1.1.2 Х-вирус картофеля ........................................................................................ 9 1.1.3 M – вирус картофеля ................................................................................... 10 1.1.4 S – вирус картофеля .................................................................................... 11 1.1.5 Вирус скручивания листьев картофеля..................................................... 12 1.2 Метод культуры апикальных меристем....................................................... 13 1.3 Диагностика вирусных патогенов ................................................................. 15 1.3.1 Иммунобиологические методы диагностики ........................................... 15 1.3.2 Молекулярно-генетические методы исследования ................................. 18 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ ................................................................ 21 2 МАТЕРИАЛЫ И МЕТОДЫ .......................................................................... 21 2.1 Объект исследования ...................................................................................... 21 2.2 Выделение апикальных эксплантов картофеля ........................................... 21 2.3 Преаналитическая подготовка растительного материала ........................... 23 2.4 Исследование воздействия антисептических соединений .......................... 24 2.5 Методика проведения ИФА ........................................................................... 25 2.6 Перечень реактивов использовавшихся при проведении ИФА ................. 26 2.7 Методика проведения ОТ-ПЦР ..................................................................... 27 2.8 Математическая обработка результатов ....................................................... 29 3 РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ ........................................................ 30 3.1 Преаналитическая подготовка растительного материала для диагностики вирусных патогенов. ............................................................................................. 30 3.1.1. Анализ структуры проб .............................................................................. 30 2 3.1.2 Влияние состава биоматериала и условий его температурного хранения ................................................................................................................. 32 3.1.3 Влияние буферных соединений .................................................................. 36 3.1.4 Действие антисептических соединений..................................................... 38 3.1.5 Алгоритм преаналитической подготовки биоматериала ......................... 43 3.2 Диагностика вирусов в меристемных линиях картофеля ........................... 44 ВЫВОДЫ .............................................................................................................. 48 СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ ..................................... 49 3 СПИСОК СОКРАЩЕНИЙ ВСЛК – вирус скручивания листьев картофеля YВК – Y-вирус картофеля AВК – A-вирус картофеля MВК – M-вирус картофеля SВК – S-вирус картофеля XВК – X-вирус картофеля ИФА – имммуноферментный анализ ОТ – обратная транскрипция ПЦР – полимеразная цепная реакция РРК – разрушенные растительные компоненты dNTP - диоксинуклеотиды 4 ВВЕДЕНИЕ Одной из наиболее значимых сельскохозяйственных культур является картофель (Solanum размножаемой tuberosum культурой. L.). Картофель Большинство является поражающих вегетативно его болезней инфицирует клубни, что приводит к ухудшению питательной ценности и снижению качества посадочного материала. Одной из наиболее вредоносных групп инфекционных агентов являются вирусы. Описано около 37 видов вирусов, поражающих картофель [Salazar, 1996]. Шесть из них являются экономически значимыми из-за широкого распространения и вредоносности. К таким патогенам относят: Y-, А-, М-, Хи S-вирусы картофеля, а также вирус скручивания листьев картофеля [Иванюк с соавт., 2005]. Вирусные болезни растений не поддаются лечению в ходе вегетативного цикла. Вирусы растений передаются насекомыми, в первую очередь персиковой тлей Myzus persicae Sulz., а также при механическом контакте. Борьба с вирусными инфекциями сводится к использованию здорового посадочного материала, а также ограничению жизнедеятельности насекомых переносчиков [Иванюк с соавт., 2005]. Большое значение занимает возделывание вирусоустойчивых сортов, однако среди современных образцов они занимают незначительную часть. В настоящее время создана система семеноводства картофеля на оздоровленной основе, включающая получение свободных от вирусов растений картофеля, их размножение и выращивание в условиях защиты от вирусной инфекции [Семеноводство картофеля…, 2002]. Для получения свободного от вирусов картофеля используют метод культуры апикальных меристем. В настоящее время метод получил широкое распространение и используется для оздоровления посадочного материала картофеля. Использование метода апикальных меристем само по себе не гарантирует обязательного оздоровления. применение диагностического контроля 5 Из-за этого вирусного необходимо поражения в размножаемом материале на различных этапах производственного процесса [Halterman et al., 2012; Замалиева, 2013]. В настоящее диагностические время разработаны тест-системы для и активно обнаружения применяются вирусов картофеля, основанные на иммунобиологических [Бызова с соавт., 2009; Усков, 2011] и молекулярно-генетических методах исследования [Drygin et al., 2007; Рязанцев, Завриев, 2011]. При этом остаются не достаточно изученными аспекты, связанные преаналитической подготовкой растительного материала. При проведении лабораторных исследований необходимо учитывать возможное влияние методов разрушения растительных тканей, а также цитологические и биохимические особенности изучаемых биоматериалов. Показано, что некоторые компоненты проб, полученные при разрушении ряда растительных тканей картофеля, могут оказывать воздействие на результаты лабораторной диагностики вирусных патогенов [Приходько с соавт., 2010], что приводит к ошибочному результату. Таким образом, является актуальным аспект разработки новых способов пробоподготовки, учитывающих сохраняющих биологические особенности растительных тканей, молекулярную структуру патогенов и таким образом приводящих к повышению уровня чувствительности применяемых методов диагностики. Целью работы являлось повышение достоверности процесса диагностики вирусов в растениях картофеля, растущих в асептической культуре in vitro. Были поставлены следующие задачи: 1) Проанализировать структуру биоматериала, получаемого для диагностики вирусных патогенов из побегов растений картофеля, растущих в асептической культуре in vitro. 2) Выявить зависимость результатов диагностического выявления Y-вируса картофеля от состава биоматериала и температурных условий его хранения. 6 3) Исследовать антисептических комбинированное соединений на действие результаты буферных диагностики и Y-вируса картофеля. 4) Разработать эффективный алгоритм подготовки биоматериала растений картофеля растущих в культуре in vitro для диагностики вирусных патогенов. 5) Провести диагностику вирусов в растениях, прошедших процесс регенерации из апикальных эксплантов сортов и перспективных гибридов картофеля. 7 1 ОБЗОР ЛИТЕРАТУРЫ 1.1 Общая характеристика вирусов картофеля Впервые при изучении мозаичной болезни табака в 1982 году русским ботаником Д. И. Ивановским был обнаружен фильтрующийся вирус. Вирусы растений в качестве инфекционного материала содержат одноцепочечные молекулы нуклеиновой кислоты, окруженные протеиновой оболочкой. Вирусы картофеля различимы по форме и размеру частиц и могут быть либо изометрическими, что характерно для вируса скручивания листьев (ВСЛК), либо палочковидными и нитевидными (вирусы картофеля X-, Y-, S-, M-). Длина этих частиц колеблется в пределах от 500 до 900 нм [Анисимов, 2004]. В основном, у большинства фитовирусов относительное содержание белков, преобладает над количеством нуклеиновых кислот и находится в пределах 93-95%; содержание нуклеиновых кислот составляет 5-7% [Гнутова, 1993]. 1.1.1 Y – вирус картофеля Y – вирус картофеля (YВК) наиболее вредоносный и старейший из всех известных вирусов картофеля. Вирус YВК распространен повсеместно и наносит значительный экономический ущерб: его вредоносность составляет 30-90% [Struik, Wiersema, 1999; Анисимов, 2004]. YВК является типичным представителем рода Potyvirus, относящийся к семейству Potyviridae. Вирионы нитевидные, гибкие. Длина вирусных частиц 500-900 нм, диаметр 12-15 нм [Гнутова, 1993]. YВК обладает широким кругом растений-хозяев и способен инфицировать 41 вид, относящихся к четырем семействами [Брант, 2005]. Вирус переносится неперсистентно многими видами крылатых тлей, том числе Myzus persicae, Macrosiphum euphorbiae, Aphis nasturtii, A. frangulae, A. fabae и др. В настоящее время в качестве потенциальных векторов YВК рассматривается 65 видов тлей [Pelletier et al., 2012]. Высокая концентрация вируса в растении значительно увеличивает вероятность его переноса с помощью насекомых. Генетический материал вируса представлен одной молекулой одноцепочечной (+)-смысловой РНК, обладающей размером 9,7 тыс. п.н. 8 [Robaglia et al., 1989]. Продукт трансляции матричной РНК представляет один белок (протополипептид), который подвергается посттрансляционной модификации, сопровождающейся удалением под действием протеазы следующих белков: белка цитоплазматического включения, малого белка VPg, РНК-зависимой РНК-полимеразы, капсидного белка [Van der Vlugt, 1993]. YВК имеет три основных штамма: обычный (YВКO), некротический (YВКN) и штриховатой полосчатости (YВКC). Все три штамма имеют общие антигенные детерминанты, специфичные для этого вируса [Гнутова, Сибирякова, 1992]. При поражении картофеля штаммами YВКO и YВКC первичные симптомы проявляются в виде крапчатости и некрозов листьев, вторичные в виде курчавости листьев и карликовости растения. Поражение некротическим штаммом YВКN вызывает появление кольцевых некротических пятен на клубнях, которые впоследствии углубляются и становятся особенно заметными во время хранения [Le Romancer, Nedellec, 1994]. 1.1.2 Х-вирус картофеля Х-вирус картофеля (ХВК) относится к роду Potexvirus семейства Flexiviridae. Вирионы нитевидной формы. Длина частиц 445-775 нм, диаметр частиц 11-15 нм [Гнутова, 1993]. Геном вируса представлен линейной, одноцепочечной молекулой (+)смысловой РНК. Длина генома составляет 6435 нуклеотидов [Skryabin et al., 1988]. Концевые участки геномной РНК подвергаются постранскрипционной модификации: 5'-конец РНК кэпирован, 3'-конец содержит поли(А) последовательность [Brunt et al., 1996]. Геномная РНК содержит 5 открытых рамок считывания, с которых нарабатывается структурный негликозилированный белок оболочки (25 кДа), а также пять неструктурных полипептидов с молекулярными массами 8, 12, 15, 40 и 44 кДа [Гнутова, 1993]. При развитии инфекционного процесса ХВК в растительных тканях образует включения в виде слоистых агрегаций или бусовидных пластин. 9 Образование данных включений не связано с накоплением вирусного белка оболочки [Brunt et al., 1996]. Показано, что при поражении XВК происходит значительная дегенерация хлоропластов листа, граны и ламеллы теряют четкость. Цитоплазматическая мембрана разрушается, идет процесс плазмолиза с формированием зон содержащих везикулы [Гнутова, 1993]. На растениях картофеля пораженных ХВК симптомы болезни варьируют. Их проявление зависит от сортовых особенностей, штамма вируса, условий окружающей среды и проявления синергизма при смешанных типах инфекции [Лебенштейн, 2005]. Обычно поражение патогеном приводит к развитию крапчатой мозаики листовой ткани. В ряде случаев – к некротизации верхушки растения. В настоящее время известно несколько штаммов, различающихся по способности преодолевать устойчивость генов NX и NB у различных сортов картофеля. Патологические признаки штаммов коррелируют с их серологическими свойствами. Штаммы, авирулентные на сортах картофеля несущих ген NX выявляются моноклональными антителами к Х-типу белка оболочки, в то время как вирулентные диагностируются специфическими антителами к В-типу капсидного белка [Querci et al., 1995]. Инфицирование ХВК приводит к снижению урожая на 10-25% [Struik, Wiersema, 1999]. В случае микст-инфицирования, сопряженного с YВК, потери урожайности достигают 50 % [Лебенштейн, 2005]. Вирус передается при механическом контакте и инокуляцией соком больного растения. Не передается через ботанические семена. Трансмиссия с помощью насекомых-переносчиков отсутствует. Имеются сообщения о передаче патогена зооспорами грибов Synchytrichiun endobioticum [Nienhaus, Stille, 1965] и Phytophtora infestans [Aли, 2011]. 1.1.3 M – вирус картофеля M – вирус картофеля (MВК) относится к роду Carlavirus семейства Flexiviridae. Вирусные частицы обладают нитевидной формой размером 650 нм. Диаметр вириона 12 нм. Вирус передается механическим путем, тлями, 10 клопами и картофельной ковкой. МВК может существовать в растении в «дефектной» форме, т.е. лишенной белковой оболочки, поэтому его присутствие не всегда подтверждается серологическими методами [Иванюк с соавт., 2005]. Геном представлен одной однонитевой (+)-смысловой молекулой РНК, включающей 8534 нуклеотида [Zavriev et al., 1991]. Геномная РНК состоит из 6 открытых рамок считывания, кодирующих полипептиды с молекулярным размером 11, 34, 7, 12, 25 и 223 кДа [Гнутова, 1993]. Трансмиссия МВК осуществляется многими видами тлей по неперсистентныму пути переноса. Вирус не передается через ботанические семена. Экспериментально передается с помощью механической инокуляции [Brunt et al., 1996]. М вирус картофеля на растениях вызывает мозаичное закручивание их листьев. Является одним из наиболее вредоносных вирусных заболеваний, вызывающее снижение урожая клубней от 15 до 70%, а при смешанной инфекции – и более. При сильном распространении PVM, потери урожая могут достигать 50%. Такая большая вредоносность этого вируса, вызывающего тяжелые и средние формы вирусного заражения на картофеле, объясняется, прежде всего, тем, что он быстро распространяется переносчиками, например, зеленой персиковой тлей (Myzus persicae), и почти всегда передается вегетативно размножаемому потомству через клубни. 1.1.4 S – вирус картофеля S – вирус картофеля (SВК) относится к семейству Flexiviridae, роду Carlavirus. Вирионы PVS - нитевидные частицы, длиной 650 нм и 12 нм в диаметре [Гнутова, 1993]. Геном представлен линейной одноцепочечной молекулой РНК. Длина генома составляет 1169 нуклеотидов, последовательность которых на гидроксильном конце расшифрована. Белковые субъединицы имеют молекулярный вес 33-34 кДа [Foster, Mills, 1992]. Поражения на растениях картофеля, вызванные данным патогеном, разнообразны - от полного отсутствия симптомов до бронзовости листьев 11 растения, а также слабая морщинистость, посветление, глубокое жилкование, краевой некроз и ложечковидная деформация листьев. Вирус картофеля S передается в полевых условиях при механическом контакте и с помощью тлей [Frank, Banttary, 1996]. Известны два основных штамма вируса - PVSO и PVSА, а также несколько второстепенных. Штамм PVSO имеет широкое распространение в мире, а штамм PVSА распространен в странах Южной Америки [Брант, 2005]. Большинство изолятов снижает урожай на 10-20% [Анисимов, 2004]. Вирус скручивания листьев картофеля (ВСЛК) относится к роду Poleovirus семейства Luteoviridae. Нуклеокапсид изометрической формы, длина вириона 690 нм. Диаметр частиц 24 нм. [Brunt et al., 1996]. Геном представлен линейной одноцепочечной молекулой РНК, размером 5987 нуклеотидов [Mayo, 1989]. При поражении вирусом у растений картофеля наблюдается хлороз и сильное скручивание долей листьев вдоль средней жилки, нарушается нормальный обмен фитогормонов, вследствие чего происходит превращение вегетативных органов в генеративные, чрезмерная кустистость и карликовость [Дьяков с соавт., 2001]. 1.1.5 Вирус скручивания листьев картофеля Вирус скручивания листьев картофеля (ВСЛК) относится к роду Poleovirus семейства Luteoviridae. Нуклеокапсид изометрической формы, длина вириона 690 нм. Диаметр частиц 24 нм. [Brunt et al., 1996]. Геном представлен линейной одноцепочечной молекулой РНК, размером 5987 нуклеотидов [Mayo, 1989], которая ковалентно связана с Nконцом VPg белка. Известно два структурных полипептида с молекулярным весом 7 и 26.3 кДа [Rowhani, Stace-Smith, 1979]. Геномная последовательность содержит 8 открытых рамок считывания, разделенных на два кластера. Изоляты вируса серологически не различимы [Гнутова, 1993]. Развитие вируса протекает только в клетках флоэмной ткани. В связи с этим концентрация ВСЛК в инфицированном растении бывает низкой и 12 диагностическое определение в листовом и клубневом материале бывает затруднительным [Loebenstein et al., 1997]. При поражении вирусом у растений картофеля наблюдается хлороз и сильное скручивание долей листьев вдоль средней жилки, что объясняется избыточным накоплением углевода каллозы. Переполнение клеток листьев углеводами приводит к подавлению нормальных физиологических процессов и, прежде всего, фотосинтеза. Кроме того, вирус нарушает нормальный обмен фитогормонов, тератоморфы: вследствие превращение чего возникают вегетативных органов различного в рода генеративные, чрезмерная кустистость и карликовость [Дьяков с соавт., 2001]. Вирус передается только персистентно с помощью тлей- переносчиков. При механических инокуляциях, ботаническими семенами и пыльцой вирус не передается [Brunt et al., 1996]. Во многих странах возделывающих картофель патоген занимает одно из первых мест по вредоносности. Снижение урожайности при инфицировании вирусом достигает 70 %, при этом значительно снижается содержание крахмала в клубнях [Дынник, Попкова, 1997]. 1.2 Метод культуры апикальных меристем Безвирусный растительный материал можно получить, используя меристемные ткани апексов и пазушных почек органов стеблевого происхождения [Першина, 2000]. Меристемная ткань бывает представленной конусом нарастания, а также одним или двумя листовыми зачатками – примордиями и может являться свободной от вирусной инфекции. Предположение о возможности отсутствия вирусов в меристематических тканях растений впервые было высказано Чуигом в 1938 г. и Уайтом в 1943 г. Начиная с 50-х гг. предприняты первые успешные опыты по получению свободных от вирусов растений георгина из точки роста. Авторы этого метода Морель и Мартин полагали, что в больном растении вирус распространяется с отставанием от быстрорастущих молодых органов, особенно в молодых недифференцированных 13 тканях, где концентрация вируса может снижаться, вплоть до полного отсутствия. Теоретические концепции, положенные в основу этого метода, стали проясняться в последнее время. Строение точки роста растений имеет свою специфику: средний диаметр апикальной меристемой, у разных растений составляет до 200 мкм, высота – от 20 до 150 мкм. Вместе с тем зона, свободная от вирусных частиц, значительно варьирует для различных вирусов. Практически, можно вырастить растения из апикальной меристемы, состоящей из конуса нарастания и одного или двух листовых зачатков. Можно создать условия и для получения растений из ткани только конуса нарастания без листовых зачатков, хотя при этом эффективность процесса резко снижается. Это связано с тем, что чем больше размер меристематического экспланта, т.е. чем больше листовых зачатков и ткани стебля он имеет, тем легче идет процесс морфогенеза, заканчивающийся получением целого растения [Шевелуха, 2008]. Выбирая размер меристемного экспланта, необходимо находить компромисс между её размером и выходом безвирусных растений. Можно использовать предельно малый размер экспланта (0.075−0.100 мм) и разрабатывать оптимальные условия для регенерации растений. Действительно, верхушки побегов картофеля содержат безвирусную зону, величина которой, по разным источникам, варьирует в зависимости от сорта и степени пораженности растений разными вирусами от 100 до 500 мкм. Известно, что из апексов размером 200 мкм от вируса скручивания листьев картофеля были свободны 50% полученных регенерантов, от XВК – 10% [Оптимизация приемов оздоровления…, 1996]. Глубже всего проникал в меристему SВК. По другим данным при регенерации из меристем размером 150-200 мкм от YВК были свободны 85-100% полученных растений, от XВК – до 24%, но при этом не получено ни одного растения свободного от MВК и SВК [Харченко, 1971]. 14 Эффективность оздоровления зависит от размера вычленяемых меристем. Стремясь получить растения из меристем минимального размера, исследователи столкнулись с трудностью регенерации эксплантов [Трофимец, 1976]. Для того чтобы получить здоровые растения картофеля и клубни, необходимо было вычленять огромное количество тканевых эксплантов. Последующие исследования, направленные на повышение эффективности оздоровления, велись в направлении совершенствования методов, способствующих морфогенезу меристем: подбор оптимальных питательных сред и их отдельных ингредиентов. Были предприняты удачные попытки увеличить безвирусную зону верхушечной меристемы путем добавления в среду ингибиторов вирусов [Трофимец, 1976]. 1.3 Диагностика вирусных патогенов Диагностика вирусов растений – это различные приемы идентификации возбудителя инфекционного процесса [Иванюк, 2005]. К числу этих приемов относят: изучение симптомов заболевания, получение доказательств инфекционной природы возбудителя, оценку характера и условий распространения заболевания, заражение растений-индикаторов, изучение морфологии возбудителя и его внутриклеточных включений методами электронной микроскопии, изучение антигенных свойств инфекционного агента с использованием серологических методов, а также использование молекулярно-генетических методов исследования [Самсонова с соавт., 2001]. 1.3.1 Иммунобиологические методы диагностики Основной прорыв в области лабораторной диагностики вирусов растений произошел в связи с разработкой и внедрением методов иммуноанализа. В основе иммунодиагностики лежит реакция взаимодействия «антиген-антитело». Один из этих реагентов является определяемым веществом, а другой – узнающим, обладающим специфической избирательностью по отношению к определяемому веществу. 15 Большинство вирусов растений обладают высоким и средним уровнем иммуногенности [Гнутова, 1993]. При введении посредством инъекций высокоочищенных вирусных препаратов экспериментальным животным, они стимулируют выработку специфических антител (γ-иммуноглобулинов), которые могут быть использованы в различных модификациях иммуноанализа: серологической капельной диагностике, реакциях двойной и радиальной диффузии в геле, а также в многочисленных вариантах иммуноферментного анализа [Самсонова с соавт., 2001]. Полученные подобным образом антитела являются поликлональными: они синтезируются различными клонами В-лимфоцитов и обнаруживают гетерогенность по уровню специфичности, аффинности и своему титру [Гнутова, 1993]. В результате работ по соматической гибридизации была показана возможность получения перевиваемых линий клонированных клеток (гибридом) синтезирующих моноклональные антитела, обладающих моноспецифичной активностью [Kohlеr, Мilstem, 1975]. Выбор между использованием моно- и поликлональных антител определяется конкретными задачами исследования. Не смотря на ряд значительных преимуществ моноклональных антител, следует учитывать, что их применение может быть ограничено физикохимическими свойствами: более высокой чувствительностью к изменениям кислотно-основного равновесия, температуры и концентрации солей [Гнутова, 1993]. Также разработан метод получения рекомбинантных антител, с использованием фаговой библиотеки, содержащей гены функциональных фрагментов тяжелой и легкой цепей иммуноглобулинов. Данный подход был использован для создания различных иммунобиологических диагностикумов, в том числе и для выявления YВК [Boonham, Barker, 1998]. Получение рекомбинантных антител не требует использования животных, как правило является более быстрым и относительно экономичным способом получения иммунобиологических диагностикумов [Ziegler, Torrance, 2002]. 16 Наиболее распространенным вариантом иммунодиагностики вирусов растений является твердофазный иммуноферментный анализ (ИФА) в котором для выявления комплексов «антиген-антитело» используется ферментативная метка [Clark, Adams, 1977]. Диагностический процесс состоит из физической сорбции антител на твердом носителе, образования сложного иммунного комплекса, протекания ферментативной реакции и стадии детектирования. В качестве носителя могут использоваться нитроцеллюлозные мембраны, бумага, стекло, агароза, планшеты, а также пробирки из полистирола, поливинилхлорида или полипропилена. Наиболее широкое распространение получили оптически-прозрачные планшеты из полистирола, использование которых позволило значительно автоматизировать диагностические процедуры. Связь белков с матрицей осуществляется за счет гидрофобных и электростатических взаимодействий. Эффективность сорбции зависит от концентрации белка, уровня рН и ионной силы раствора. Процесс сорбции иммуноглобулинов на поверхности полистирола был исследован с помощью метода атомно-силовой микроскопии [Зайцев с соавт., 2006]. Показано, что в основном процесс сорбции антител протекает в областях резкого изменения пространственного ландшафта молекул полистирола. При этом большая часть подложки остается свободной от сорбируемых частиц. Наличие подобных свободных центров может индуцировать протекание неспецифической сорбции растительных белков на поверхности планшета. Для предотвращения неспецифических реакций, процесс сорбции проводят в присутствии нейтральных бычьего сывороточного альбумина, белков: казеина, яичного альбумина и желатина [Обручков, 1993; Дашкевич с соавт., 2005]. В настоящее время создано вариантов проведения распространенными большое количество различных твердофазного благодаря своей ИФА простоте, ставших скорости широко проведения исследований, относительно высокой чувствительности и специфичности 17 анализа. Наиболее часто используемым форматом является «сэндвич»вариант ИФА (DAS-ELISA) в котором антитела, находящиеся на поверхности подложки связываются с антигеном тестируемого образца, а затем получившийся иммунный комплекс выявляется с помощью антивидовых иммуноглобулинов конъюгированных с ферментом. В качестве ферментативной метки обычно используются пероксидаза и щелочная фосфатаза, в ряде случае применяются также пенициллиназа, β- галактозидаза и люцифераза [Самуилов, 1999]. В отечественной литературе описано создание тест-системы для определения вирусов картофеля использующей в качестве ферментативной метки бактериальную пирофосфатазу [Бобкова с соавт., 2003]. Развитие современных методов иммунобиологического анализа связано с разработкой новых приемов повышающих уровень пропускной способности лаборатории, а также способов диагностики не требующих использования специального оборудования. К новым методам можно отнести вариант гибридного ИФА [Вadarau et al., 2009] при проведении которого происходит сокращение продолжительности выполнения анализа, а также технологию Luminex xMAP при которой происходит одновременное исследование образца на несколько антигенов [Bergervoet et al., 2008]. Широкое применение находит диагностика вирусов растений осуществляемая с помощью метода иммунохроматографического анализа (ИХА), которая проводится за короткий промежуток времени при комнатной температуре [Бызова с соавт., 2009]. 1.3.2 Молекулярно-генетические методы исследования Выявление возбудителей вирусных болезней, основанное идентификации их генома, является прямым и точным на методом лабораторной диагностики. Хронологически ранней технологией молекулярной диагностики являлся метод клиническая гибридизации диагностика, нуклеиновых 1999]. Данная 18 кислот технология [Молекулярная основана на специфической связи молекулярного зонда и детектируемой нуклеиновой кислоты. Продуктами осуществляемой реакции могут быть молекулярные дуплексы РНК:РНК, РНК:ДНК или ДНК:ДНК. Наиболее часто в качестве молекулярных зондов использовались низкомолекулярные молекулы кДНК [Гера, Марко, 2005]. В тоже время было показано, что зонды, основанные на молекулах кРНК, обладают способностью образовывать более прочную связь с молекулярной мишенью, в связи с чем, их применение обеспечивает более высокий уровень чувствительности [Robinson, Romero, 1991]. На ранних этапах развития метода, детекция гибридизации осуществлялась с помощью радиоавтографии. В последствие были внедрены нерадиоактивные системы детекции связанные с применением ферментативной метки, дигоксигенина и диен-платиновой метки [Мусин с соавт., 1997]. Метод молекулярной гибридизации применялся при диагностике вирусов картофеля, в том числе и YВК [Leclerc, 1992]. Перспективной разновидностью гибридизационной диагностики фитопатогенов является метод биочипов [Bystricka et al., 2005] не получивший в нашей стране широкого распространения. Наиболее используемым в настоящее время методом молекулярногенетической диагностики фитопатогенов является полимеразная цепная реакция (ПЦР). Принцип данного метода заключается в специфической амплификации фрагментов ДНК в условиях избытка ДНК-затравок (олигонуклеотидных праймеров). В настоящее время разработано несколько вариантов осуществления ПЦР-анализа для диагностики вирусов картофеля. При проведении проведению диагностики полимеразной РНК-содержащих реакции, патогенов предшествует стадия растений, обратной транскрипции (ОТ) – перевод геномной РНК вируса в форму кДНК. Эта реакция катализируется ферментом РНК-зависимой ДНК-полимеразой (ревертазой). Наибольшее распространение при проведении ОТ получили ферменты М-МuLV- и AMV-ревертазы, выделенные из Moloney murine leukemia virus и Аvian myeloblastosis virus [PCR Application Manual, 2000]. 19 Для повышения чувствительности реакции ОТ-ПЦР часто применяют метод гнездной ПЦР (nested-PCR) [Молекулярная клиническая диагностика, 1999], заключающийся в последовательном использовании двух пар амплификационных рамок – внешней и внутренней. Данный метод был успешно использован при диагностическом поиске YВК в растениях картофеля, регенерированных из апикальной меристемной ткани [Зайнуллин с соавт., 2002]. Для одновременного обнаружения нескольких вирусов картофеля в одной исследуемой пробе создана система мультиплексной ОТ-ПЦР, основанная на участии в реакции нескольких пар праймеров [Nie, Singh, 2001]. Применяются высокочувствительные подходы проведения амплификационного тестирования: ПЦР «в реальном времени» (Real-time PCR) [Agindotan et al., 2007] и метод флуоресцентного определения продуктов реакции по конечной точке (Flach-PCR) [Рязанцев, Завриев, 2009]. Эти методы проведения детектирования результатов ПЦР не требуют открывания пробирок с реакционной смесью, в связи с чем, ликвидирована возможность контаминации ДНК-амплификонами. В настоящее время разработаны подходы, которые объединяют принципы иммуноанализа и генодиагностики. К числу таких методов можно отнести иммуносорбентную ПЦР (IC-PCR), применение которой было использовано при диагностике YВК на ротовом аппарате насекомыхпереносчиков [Varveri, 2000]. Диагностическая система ОТ-ПЦР-МГА-ИФА, объединила способы молекулярной гибридизации, амплификационного синтеза и иммуноанализа [Drygin et al., 2007]. Современные способы диагностики и идентификации вирусных патогенов, в основном, базируются на технологиях ИФА и ПЦР. Эти технологии постоянно совершенствуются в плане чувствительности, надежности и простоты исполнения [Защита картофеля…, 2009]. Таким образом, область современной диагностики фитопатогенов приобретает черты динамично-развивающейся системы. 20 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2 МАТЕРИАЛЫ И МЕТОДЫ 2.1 Объект исследования Объектом исследования служили растения различных сортов и гибридов картофеля (Solanum tuberosum L) растущие в асептической культуре in vitro. В экспериментах по преаналитической обработке растительного материала использовали побеги растений картофеля сорта Невский инфицированные Y – вирусом картофеля (YВК). Культивирование осуществляли в стеклянных пробирках на среде Мурасига-Скуга (таблица 1) при комнатной температуре и 16 часовом световом периоде. 2.2 Выделение апикальных эксплантов картофеля Работы по вычленению эксплантов из клубней картофеля проводили в предварительно простерилизованном (УВ-стерилизация) ламинар-боксе. Апикальные экспланты размером 100-400 мк с 1-4 листовыми зачатками (примордиями), вычленяли скальпелем маленького размера под бинокулярным микроскопом с 24-кратным увеличением. После вычленения биоматериал на острие иглы переносили на поверхность питательной среды MSM1 (таблица 1). Изолированные экспланты инкубировали в климатической камере с постоянным режимом температуры равной 24-25°С, освещенности 2 тыс. лк, фотопериод 16 ч и влажности воздуха 70 %. После регенерации проростки пересаживали на питательную среду MSM2 (таблица 1). Регенерированные растения с сформировавшимися 6-8 листовыми пластинками подвергали микроклональному размножению и высаживали на питательную среду MS (таблица 1). Дальнейшее поддерживание растений картофеля в асептической культуре in vitro осуществляли в стеклянных пробирках на среде Мурасиге и Скуга [Murashige, Skoog,1962; Оздоровление и ускоренное размножение…, 1985] при комнатной температуре и 16 часовом световом периоде. 21 Таблица 1 – Состав питательных сред Мурасиге и Скуга (мкг/л) Компоненты MS MSM1 MSM2 1 2 3 4 МС I раствор макроэлементов NH4NO3 1650.000 KNO3 CaCl2 * 2H2O MgSO4 * 7H2O KH2PO4 1900.000 440.000 370.000 170.000 МС II раствор микроэлементов KJ 0.830 H3BO3 MnSO4 * H2O ZnSO4 * 7H2O Na2MoO4 * 2H2O CuSO4 * 5H2О CoCl2 * 6H2O 6.200 0.223 8.600 0.250 0.025 0.025 МС III раствор хелатного железа FeSO4 * 7H2O 0.557 Na2ЭДТА * 2H2O Мезо-инозит - 37.200 100.000 - Никотиновая кислота - 2.000 - Пиридоксин 1.000 1.000 1.000 Тиамин 0.200 1.000 0.200 Аскорбиновая кислота 0.200 - 0.200 Пантотенат Са - 10.000 - Гидрозилат казеина 40.000 - 40.000 Фолиевая кислота - 0.500 - В12 - 0.015 - 22 1 2 3 4 Рибофлавин - 0.500 - Биотин - 1.000 - Гибереллиновая кислота - 2.000 - Кинетин - 0.500 0.040 Гетероауксин - - 1.000 Аденин - 40.000 - Ферулловая кислота - - 0.020 8-гидроски-хиналин - - 0.300 Сахароза 20.000 Агар 7.000 рН 5.700 2.3 Преаналитическая подготовка растительного материала Для диагностических исследований использовали побеги растений достигших размера 10-15 см. Для проведения диагностических исследований побеги растений разрушали с помощью тефлонового пестика (Хеликон, Россия) в полипропиленовых пробирках типа «эппендорф». Для анализа структуры проб растений in vitro, разрушение осуществляли также с помощью механического ручного пресса. Осаждение включений разрушенных растительных компонентов (РРК) проводили на центрифуге Biofuge pico (Heraeus, Германия) при угловой скорости 13 тыс. об/мин в течение 2 минут. Массу биоматериала, гомогенизированного раствора, а также надосадочной и осадочной фракций определяли с помощью аналитических весов HR-200 (AMD, Япония). Формирование экспериментальных серий проб с массовой долей осадочной фракции 5, 10, 15 и 20%, осуществляли в полипропиленовых пробирках типа «Eppendorf». В первой серии – YВК-содержащий супернатант вносили в компоненты осадочной фракции инфицированные вирусом. Во второй серии – неинфицированный вирусом супернатант вводили в 23 компоненты отмытой осадочной фракции, полученной от инфицированных листьев картофеля. Отмывку осадочной фракций осуществляли трехкратным внесением в пробу 1 мл 0.1 М Тris-HCl буфера (pH 7.0) и центрифугированием в таком же режиме, как и при удалении растительных включений. Хранили биоматериал в бытовом двухкамерном холодильнике Стинол 103Q (Россия) на протяжении 16 ч, соблюдая температурный режим в холодильной камере в диапазоне от +2 до +8 ○С, в морозильной камере – от 18 до -25○С. Для определения количества водосодержащей фазы в РРК, осадочную фракцию подвергали замораживанию в морозильной камере на протяжении 16 часов. После размораживания образцы интенсивно перемешивали на вортексе CV-1500 (Хеликон, Россия) и подвергали центрифугированию при угловой скорости 13 тыс. об/мин в течение 2 минут. Учитывали массу получившейся надосадочной фракции. Морфологическое изучение состава разрушенного биоматериала осуществляли с помощью конфокального микроскопа LSM META 510 (Carl Zeiss, Германия) при λex 633/ λem 650 нм. 2.4 Исследование воздействия антисептических соединений Сразу после разрушения биоматериал вносили в полипропиленовые пробирки типа «Eppendorf», содержащие десятикратные растворы изучаемых химические соединений. Соотношение объема исследуемого материала и концентрированных растворов составляло 9:1. После аккуратного ресуспендирования достигали требуемой конечной концентрации. Tris-HCl буфер (pH 7.0) готовили на основе трис(гидроксиметил)аминометан гидрохлорида (Amresco, США) в диапазоне конечных концентраций от 0.05 до 0.20 М. Также были использованы растворы 0.1 М Tris-HCl буфер, включающего финальные 0.01 М концентрации следующих веществ: азида натрия (Sigma-Aldrich, США), аскорбиновой кислоты (AppliChem, США), мертиолята натрия (BioChemica, США), 2-меркаптоэтанола (AppliChem, США), поливинилпироллидона м.в 24 100000 (AppliChem, США), тиогликолевой кислоты (Pancreac, Испания), тиосалициловой кислоты (Sigma-Aldrich, США), сульфита натрия (Россия) и этилендиаминтетроуксусной кислоты (Amresco, США). Хранение проб до постановки анализа осуществляли в бытовом холодильнике Стинол 103Q (Россия) на протяжении 16 ч, соблюдая температурный режим в холодильной камере в диапазоне от +2 до +8 ○С. При длительном хранении биоматериал, содержавший и не содержавший химические соединения, аликвотировали и инкубировали в таком же температурном режиме на протяжении 28 сут. Постановку анализа проводили через каждые 7 сут., используя не исследованные аликвоты. 2.5 Методика проведения ИФА Моноклональные антитела (Neogen Europe, Великобритания) к вирусам картофеля, растворенные в покровном буфере, вносили в лунки иммунологических полистироловых планшетов (Медполимер, Россия) и инкубировали на протяжении 4 часов в условиях влажной камеры при температуре +37 С. Не связавшиеся компоненты реакции отмывали промывочным буфером (ФСБт) с помощью автоматического устройства HydroFlex (Tecan, Австрия). В лунки планшета вносили по 90 мкл блокирующего буфера, после чего во все лунки вносили по 10 мкл исследуемого материала. Изучаемые варианты биоматериала, полученные из общего образца, исследовали в четырехкратной аналитической повторности на одном планшете, применяя одну серию реактивов. Инкубацию планшета проводили в холодильнике при температуре +4 С в течение 16 часов. После инкубации планшет трехкратно промывали ФСБт. Далее вносили 100 мкл антител конъюгированных с щелочной фосфатазой, растворенные в блокирующем буфере, после чего проводили инкубацию при температуре +37 С в течение 4 часов. Не связавшиеся компоненты реакции четырехкратно отмывали ФСБт. Во все лунки вносили по 100 мкл 25 субстратного буфера и инкубировали планшет в темноте при комнатной температуре в течение 12 часов. Результаты ИФА детектировали на многоканальном фотометре «Opsys MR» (Dinex Tech., США) при длине волны 405 нм против референсного светофильтра (620 нм). Расчет критического порога (Р), при котором результат ИФА интерпретируется как положительный, проводили по формуле: Р=1.5*Х-ср, где Х-ср - среднее значение оптической плотности негативного контроля вычисленное по данным трех аналитических повторностей. В качестве негативного контроля использовали исходный оздоровленный материал картофеля сорта Невский, выращенный в условиях защищенного грунта и не содержащий вирусных патогенов согласно данным ИФА и ОТ-ПЦР. 2.6 Перечень реактивов использовавшихся при проведении ИФА 1. Покровный буфер: Карбонат натрия 1.59г Гидрокарбонат натрия 2.93г Дистиллированная вода до 1000мл pH = 9.6 2. Фосфатно-солевой буфер (ФСБ): Хлорид натрия 8.00г Дигидроортофосфат калия 0.20г Гидроортофосфат натрия 12-водный 2.90г Хлорид калия 0.20г Дистиллированная вода до 1000мл pH = 7.2 3. Промывочный буфер (ФСБт): 0.50мл Tween 20 Фосфатно-солевой буфер до 1000мл 26 4. Блокирущий буфер: Сухое обезжиренное молоко 20,00г Фосфатно-солевой буфер с Tween 20 до 1000.00мл 5. Субстратный буфер: Трис(гидроксиметил)аминометан 24.20г Пара-нитрофенилфосфат 1.00г Дистиллированная вода до 1000мл pH = 9.8 2.7 Методика проведения ОТ-ПЦР В работе использовали дезоксирибонуклеотидтрифосфаты (dNTP), Taq ДНК-полимеразу, M-MuLV обратную транскриптазу, буферные растворы для ферментов, производства НПО «СибЭнзим» (Россия). Экстракцию вирусной РНК из исследуемых растений картофеля, осуществляли с помощью коммерческих наборов «Рибо-сорб» (Интерлабсервис, Россия). В качестве положительных контрольных образцов использовали биоматериал растений картофеля сорта Невский, инфицированный различными вирусными патогенами. Реакционную смесь готовили согласно протоколу, представленному в таблице 2. Структура олигонуклеотидных праймеров [Nie, Singh, 2001], использованных в работе, представлена в таблице 3. Реакцию ОТ-ПЦР проводили на приборах «Mastercycler Gradient» (Eppendorf, Германия) согласно следующему режиму: 1 цикл: 37 оС – 1 час; 1 цикл: 94 оС – 5 мин; 42 цикла: 94 оС – 1 мин, 60 оС – 1 мин, 72 оС – 1 мин; 1 цикл: 72 оС – 5 мин; 4 оС – хранение. Детекцию результатов ОТ-ПЦР осуществляли методом горизонтального электрофореза в 2.0 % агарозном геле в трис-ацетатном буфере (рН 8.0), содержащем бромистый этидий в концентрации 0.5 мкг/мл. Визуализацию амплифицированных продуктов проводили в ультрафиолетовом трансиллюминаторе при длине волны 310 нм. Размеры 27 фрагментов ДНК оценивали по подвижности в сравнении со стандартными ДНК-маркерами молекулярного размера «СибЭнзим» (Россия). Таблица 2 – Состав реакционной смеси для проведения ОТ-ПЦР № Реактивы Концентрация / объем 1. Смесь dNTP 0.2 мМ 2. Буфер для M-MuLV обратной транскриптазы 0.5 3. Буфер для Taq ДНК полимеразы 0.5 4. Смысловой праймер 1мкМ 5. Антисмысловой праймер 1мкМ 6. M-MuLV – транскриптаза 1 ед. акт. 7. Taq –ДНК полимераза 1 ед. акт. 8. Объем препарата РНК 2 мкл 9. dH2O до 25мкл Таблица 3 – Олигонуклеотиды, использованные в реакции ОТ-ПЦР Размер № п/п Праймер Нуклеотидная последовательность фрагмента, п.н. 1. pvy-s ACGTCCAAAATGAGAATGCC 2. pvy-a TGGTGTTCGTGATGTGAC 3. pvx-s TAGCACAACACAGGCCACAG 4. pvх-а GGCAGCATTCATTTCAGCTTC 5. plrv-s CGC GCTAACAGAGTTCAGCC 6. plrv-a GCAATGGGGGTCCAACTCAT 7. pvs-s TGGCGAACACCGAGCAAATG 8. pvs-1a AATCTCAGCGCCAAGCATCC 9. МС-1 ACTGCGATGTCTTTGTGCGT 10. МС-2 CGAGTGGCCAAGAGGTG 28 480 562 336 181 299 2.8 Математическая обработка результатов Обработку полученных результатов проводили с использованием программного обеспечения Excel 2003 и Statistica 6.0. Анализировали основные статистические параметры описательной статистики: среднее арифметическое значение, ошибку среднего значения, медиану, стандартное отклонение, межквартильный интервал. Анализ соответствия изучаемого признака закону нормального распределения проводили с помощью критерия Шапиро-Уилка [Реброва, 2002]. В случае подчинения полученных данных нормальному распределению, расчет достоверности различий проводили с помощью параметрического t-критерия Стьюдента. [Лакин, 1990]. В несоответствия экспериментальных данных закону случае нормального распределения использовали непараметрический T-критерий Уилкоксона 29 3 РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ 3.1 Преаналитическая подготовка растительного материала для диагностики вирусных патогенов. 3.1.1. Анализ структуры проб Проведению лабораторной диагностики фитопатогенных вирусов предшествует этап, связанный с преаналитической подготовкой исследуемых образцов. Первым элементом такой подготовки служит стадия разрушения растительного материала, способствующая переходу фитопатогенов из биологических тканей в диагностически-используемую водосодержащую фракцию пробы. Для полного понимания процессов протекающих в ходе пробоподготовки было исследовано применение различных способов разрушения биоматериала и проанализирована структура получаемых проб. В работе было изучено два способа разрушения побегов растении картофеля in vitro: с помощью тефлонового пестика в пробирках типа «эппендорф» и механического ручного пресса. Проведенное исследование показало, что во всех случаях разрушенный биоматериал оказался не однородным и содержал в своем составе включения разрушенных растительных компонентов (РРК). С помощью конфокальной микроскопии было показано, что основными элементами данных включений являлись хлоропласты (рисунок 1а). Интактные клетки встречались крайне редко 0.11±0.03 шт. в поле зрения (увеличение х 400). С помощью центрифугирования было проведено разделение проб на надосадочную и осадочную фракции (таблица 4). Определение массовой доли супернатанта показало, что при различных способах разрушения побегов растений, растущих в асептической культуре, содержание данных фракций варьировало в пределах 2% (р<0.05), а наиболее высокий выход надосадочной фракции был отмечен при использовании тефлонового пестика. 30 Рисунок 1 – Разрушенный материал в пробах картофеля: а – биоматериал, хранившийся в холодильной камере, б – биоматериал после проведения замораживания-оттаивания. Обозначения: Хл – хлоропласт, иКл – интактная клетка, рКл – разрушенная клетка. Масштабный отрезок равен 50 мкм. Таблица 4 – Фракционный состав проб картофеля при различных способах разрушения биоматериала Фракционный состав проб картофеля при различных способах разрушения биоматериала Массовая доля, % Вариант Надосадочная фракция Осадочная фракция Механический пресс 81.4±8.0 15.4±7.3 Тефлоновый пестик 82.8±7.8 16.6±7.4 Примечание: %±m – относительное количество с ошибкой доли. Осадочная фракция проб была подвергнута однократному циклу замораживания-оттаивания. С помощью метода конфокальной микроскопии было выявлено, что в ходе данного процесса произошло изменение структуры проб. Включения РРК располагались неравномерно в виде тяжистых скоплений (рисунок 1б). 31 в пространстве Была проведена оценка относительного количества водосодержащей фазы, вышедшей из РРК в ходе замораживания-оттаивания. При разрушении растительного материала тефлоновым пестиком массовая доля данной фазы составила 21.7 ±8.4%, при разрушении механическим ручным прессом – 19.5±8.1%. Таким образом, содержание водосодержащей фазы, связанной с РРК, также не зависела от применяемого способа гомогенизации (р0.05). 3.1.2 Влияние состава биоматериала и условий его температурного хранения В дальнейших экспериментах было проанализировано влияние на результаты диагностического выявления YВК методом ИФА комплекса факторов: состава биопроб и условий их температурного хранения. При изучении биоматериала, хранившегося, до проведения диагностических исследований, в условиях холодильной камеры, было обнаружено негативное действие РРК на результаты ИФА (рисунок 2). Об этом свидетельствовал более низкий уровень колориметрического сигнала, по сравнению с аналогичным показателем, выявленным в пробах не содержащих включений РРК. В тоже время, при изучении биоматериала, хранившегося в условиях морозильной камеры и таким образом подвергнутого перед проведением диагностики однократному циклу замораживания-оттаивания, более высокий уровень колориметрического сигнала был обнаружен в пробах, содержащих РРК. Анализ проб, подвергнутых центрифугированию и таким образом не содержавших в своем составе РРК, не выявил влияния процедуры замораживания-оттаивания на результаты лабораторной диагностики вируса. Ранговый дисперсионный анализ по Фридмену подтвердил достоверность комплексного влияния факторов температурного хранения и состава всех видов растительных проб на результаты ИФА (p<0,001). 32 Коэфф. позитивности, отн. ед 40 ** ** 30 20 10 0 1 2 3 Температура +2... +8°С 1 2 Температура -18... -25°С Рисунок 2 – Влияние состава биоматериала и условий его температурного хранения на результаты ИФА. 1 – пробы содержащие разрушенные растительные компоненты, 2 – пробы не содержащие разрушенные растительные компоненты. В дальнейшем была исследована зависимость результатов ИФА от количественного содержания РРК в биоматериале. Для этого, в супернатант, полученный при разрушении объединенной партии YВК-содержащих побегов растений, растущих в асептической культуре, вносили определенное количество инфицированных полученный материал хранили компонентов при двух осадочной фракции, температурных и режимах. Результаты эксперимента представлены на рисунке 3а. Выявлено, что с увеличением концентрации РРК, величина детектируемого сигнала ИФА последовательно снижалась. При содержании РРК в диапазоне 10…20% концентрации, уровень падения сигнала был достоверно выше у образцов, хранившихся до проведения анализа в условиях холодильной камеры (p<0.05). Это свидетельствовало о большем ингибирующем воздействии данного материала, по сравнению с РРК, которые подверглись процессу замораживания-оттаивания. 33 а * 20 15 * 2 * 1 10 5 0 0 б 20 Коэфф. позитивности, отн. ед. Коэфф. позитивности, отн. ед. 25 5 10 15 20 Массовая доля осадочной фракции, % 15 10 * * ** 2 5 1 0 0 5 10 15 20 Массовая доля осадочной фракции, % Рисунок 3 – Результаты ИФА-диагностики в пробах растений картофеля растущих in vitro при комбинировании: а – YВК-содержащих надосадочной и осадочной фракций, б – неинфицированной надосадочной и YВК-содержащей осадочной фракции. 1 – осадочная фракция, не подвергавшаяся замораживанию, 2 – осадочная фракция, после процесса замораживания; *–p<0.05, **– p<0.01 (t-критерий Стьюдента). Также было изучено содержание YВК в составе РРК пробах. Для этого, в неинфицированный супернатант вводили определенное количество отмытой с помощью 0.1 М Tris-HCl буфера осадочной фракции. Подготовленный биоматериал до постановки анализа хранили при двух температурных режимах. Результаты проведенного изучения отражены на рисунке 3б. В случае биопроб, хранившихся в условиях холодильной камеры, увеличение содержания осадочной фракции приводило к незначительному повышению уровня колориметрического сигнала. В тоже время, у проб, подвергнутых однократному циклу замораживания- оттаивания, произошло повышение данного показателя в 2.5 раза. Полученные результаты свидетельствовали, что однократное проведение процесса замораживания-оттаивания не оказало существенного воздействия на структуру антигенных детерминант белка оболочки YВК. Это соответствует литературным данным о длительной сохранности антигенной активности YВК в замороженных экстрактах инфицированных растений [Purcifull et al., 1975]. 34 Изучение растительного материала, не подвергавшегося процессу центрифугирования, показало, что наличие включений РРК оказывает негативный эффект на результаты ИФА-диагностики. Ингибирующее действие РРК может быть связано с тем, что эти компоненты, попадая в реакционную смесь, экранируют поверхность полистиролового планшета с адсорбированными антителами и таким образом блокируют протекание реакции «антиген-антитело». Был обнаружен эффект повышения уровня сигнала в ИФА при использовании проб, содержащих замораживания-оттаивания. РРК Наиболее и подвергнутых вероятно, что процессу увеличение коэффициента позитивности связано с выходом дополнительного количества инфекционного агента из состава РРК. В первую очередь подобное высвобождение вируса может происходить из компонентов растительных клеток окруженных мембранными структурами. Известно, что вирионы YВК, репликация которых протекает в эндоплазматическом ретикулуме, образуют связь с мембраной посредством многокомпонентного комплекса, включающего вирусные белки 6K2, CI, VPg-NIa и NIb [Schaad et al., 1997a; Schaad et al., 1997b]. В процессе замораживания-оттаивания данный комплекс мог разрушаться. Кроме того, YВК может содержаться в COPIIсекреторных везикулах [Wei et al., 2010] и хлоропластах [Gunasinghe, Berger, 1991; Wei et al., 2010]. Выход вирусного агента из разрушенных хлоропластов мог служить причиной повышения уровня колориметрического сигнала в ИФА, который был выявлен при исследовании замороженных проб. Также нельзя исключать, что при замораживании биоматериала происходит высвобождение структурных компонентов вируса из различных белковых комплексов. Например, известно образование прочного комплекса между белком оболочки YВК и большой субъединицей фермента рибулозо1.5-бифосфаткарбоксилазы/оксигеназы, содержащейся в хлоропластах [Feki et al., 2005]. 35 Полученные в исследовании данные позволили сделать заключение о том, что РРК, остающиеся в пробах после процесса разрушения растительных тканей, являются ценным диагностическим материалом, а процесс их замораживания с последующим удалением – обязательный элемент подготовки биоматериала картофеля для проведения диагностических исследований. 3.1.3 Влияние буферных соединений Одной из характерных особенностей клеток растительного происхождения является наличие внутриклеточной вакуоли. При разрушении растительного материала происходит подкисление гомогената, связанное с высвобождением органических кислот из вакуолярной системы [Саламатова, 1983]. Известно, что сдвиг кислотно-щелочного равновесия оказывает негативное влияние на молекулярную структуру многих вирусов растений [Гнутова, 1993]. В связи с этим возникает необходимость стабилизации исследуемого материала с помощью соединений, обладающих высокой буферной емкостью. Было исследовано внесение в состав растительного материала TrisHCl и натрий-фосфатного буферов (рН 7.0) в диапазоне концентраций 0.05 – 0.20 М. В ходе пробоподготовки, связанной с проведением цикла замораживания-оттаивания разрушенного биоматериала и удалением РРК с помощью центрифугирования, внесение буферных соединений оказало относительно небольшое воздействие на результаты диагностики вируса. Наибольший эффект был выявлен в пробах, хранившихся до постановки анализа в условиях холодильной камеры. Введение Tris-HCl и натрийфосфатного буферов в 0.05 и 0.10 М концентрациях привело к небольшому возрастанию показателя оптической плотности. При дальнейшем увеличении концентрации буферных соединений этот показатель оставался на прежнем уровне (рисунок 4а). В случае хранения биоматериала в условиях морозильной камеры (рисунок 4б), действие Tris-HCl буфера во всем исследованном диапазоне 36 концентраций оказалось стабильным и не отразилось на результатах диагностики. В тоже время, увеличение концентрации фосфатного буфера при замораживании растительных образцов привело к достоверному снижению величины детектируемого сигнала по сравнению с контрольным вариантом (р<0.05). 40 Коэфф. позитивности, отн .ед. Коэфф. позитивности, отн .ед. 40 30 20 10 0 К 2 ТБ ФБ 5 0,05 ТБ ФБ 8 0,10 20 10 0 ТБ ФБ 11 ТБ ФБ 0,15 30 0,20 Моль К 2 ТБ ФБ 5 ТБ ФБ 8 0,05 0,10 ТБ ФБ 11 ТБ ФБ 0,15 0,20 Моль Рисунок 4 – Эффективность внесения буферных соединений при хранении: а – холодильной камере, б – морозильной камере. ТБ – Tris-HCl буфер, ФБ – фосфатный буфер (n=110). На основании полученных данных было сделано заключение о том, что при различных режимах пробоподготовки растительного материала наиболее оптимальным является применение 0.1 М Tris-HCl буфера (рН 7.0). По нашему мнению относительно невысокий преаналитический эффект буферных соединений свидетельствует о незначительном повреждении белковых компонентов YВК, при хранении биоматериала в холодильной камере на протяжении проведенного эксперимента. Снижение интенсивности детектируемого сигнала при исследовании проб, содержащих фосфатный буфер и подвергшихся процессу замораживания, может быть связано с повреждающим действием однозамещенного фосфата натрия [Досон с соавт., 1991]. В связи с этим, использование фосфатного буфера в процессе пробоподготовки растительного материала, подвергающегося циклу замораживания-оттаивания, является не целесообразным. 37 3.1.4 Действие антисептических соединений Длительное хранение биологического материала может быть осуществлено путем введения в его состав химических соединений, обладающих антисептическими свойствами. В данной работе было исследовано преаналитическое действие двух антисептических соединений: азида натрия и мертиолята натрия (тимерозала). На первом этапе исследований 0.01 М растворы этих соединений вносили в биоматериал и осуществляли хранение в условиях холодильной камеры на протяжении 16 часов. Перед проведением анализа проводили центрифугирование и полученный супернатант исследовали в ИФА. Внесение 0.01 М азида натрия совместно с 0.1 М Tris-HCl буфером в состав проб вызвало достоверное (p<0.01) снижение величины детектируемого сигнала в среднем на 59.6% (рисунок 5). На основании этого было сделано заключение о нежелательности использования азида натрия в процессах преаналитической подготовки растительного материала. Введение 0.01 М мертиолята натрия совместно с 0.1 М Tris-HCl буфером в состав образцов приводило к статистически значимому повышению уровня детектируемого сигнала (p<0.01) на 38.3%. Было сделано предположение, что трансформацией приводившей к выявленный мертиолята эффект натрия образованию двух в связан с биохимической растительном соединений – материале, метилртути и тиосалициловой кислоты, аналогично процессу протекающему в тканях животного происхождения [Tan, Parkin, 2000]. Последнее соединение имело в своем составе тиогруппу, присутствие которой могло блокировать негативное воздействие веществ полифенольного ряда на аминокислотную структуру белка оболочки YВК. Для проверки данного предположения было исследовано преаналитическое действие тиосалициловой кислоты. Действие которой, оказалось сопоставимым с влиянием других тиосодержащих соединений: 2меркаптоэтанола и тиогликолевой кислоты. Кроме того, позитивный эффект 38 тиосалициловой кислоты оказался сопоставимым с действием соединений, обладающих антиоксидантными, фенолсвязывающими хелатирующими, а также свойствами, которые широко применяются для нейтрализации действия полифенолов [Томас, Каниевски, 2005]. Различия, выявленные между контролем и этими экспериментальными вариантами, оказались статистически достоверными (p<0.05). В тоже время между самими экспериментальными вариантами статистически значимых различий обнаружено не было (p>0.05). (рисунок 6). Рисунок 5 – Преаналитическое действие антисептических соединений на ИФА: 1 – Tris-HCl буфер (0.1М), 2 – азид натрия (0.01 М)+ Tris-HCl буфер (0.1М), 3 – мертиолят натрия (0.01 М)+ Tris-HCl буфер (0.1М); ** – p<0.01 (T-критерий Уилкоксона) На следующем этапе исследований был изучен процесс длительного хранения растительных тиосалициловую кислоту проб, содержащих (рисунок 7). мертиолят Хранение натрия биоматериалов осуществлялось в условиях холодильной камеры на протяжении 28 суток. 39 и Коэф. позитивности, отн. ед. 35 30 * * * * * * * 25 20 15 10 5 0 К МЭ ТСК ТГК ЭДТА СН ПВП АСК А Рисунок 6 – Влияние стабилизирующих соединений на результаты ИФА. К – контроль, ТСК – тиосалициловая кислота, МЭ – 2-меркаптоэтанол, ЭДТА – этилендиаминтетроуксусная кислота, ПВП – поливинилпироллидон, СН – сульфит натрия, АСК – аскорбиновая кислота. Концентрация всех Коэф.позитивности, отн. ед. соединений – 0.01 М. *– p<0.05 (T-критерий Уилкоксона). 25 20 15 10 ТСК 5 МН К 0 1 7 14 Время, сут. 21 28 Рисунок 7 – Результаты диагностического выявления вирусов в зависимости от продолжительности хранения биоматериалов. К – контроль, ТСК – тиосалициловая кислота, МН – мертиолят натрия. По истечении первых 7 суток хранения, действие мертиолята натрия и тиосалициловой кислоты на результаты ИФА, достоверно отличалось от контрольного варианта (p<0.01). Диагностическое выявление вирусов, в контрольном варианте переходило в область отрицательных результатов на 14 сутки исследования. Внесение в биоматериалы тиосалициловой кислоты и мертиолята натрия увеличивало продолжительность диагностического выявления вирусов. Предел диагностического обнаружения в случае тиосалициловой кислоты наступал на 21 сутки, а при использовании 40 мертиолята натрия – на 28 сутки хранения. Таким образом, применение мертиолята натрия и тиосалициловой кислоты в условиях холодильной камеры, оказалось эффективным лишь при небольшой продолжительности хранения растительного материала (до 7 суток). В проведенном исследовании было выявлено снижение детектируемого сигнала при внесении азида натрия в состав образцов. Известно, что азид натрия является ингибитором работы пероксидаз и каталаз [Захарова с соавт., 2011], а также служит эффективным блокатором работы гемопротеиновых компонентов электрон- транспортной цепи хлоропластов и митохондрий [Alayash et al., 2001]. Возможно, что была блокирована работа элементов электрон-транспортной цепи хлоропластов, что могло привести к образованию свободных радикалов. Под действием активных форм кислорода могла произойти значительная оксидативная модификация белков оболочки вирусов и, как следствие более низкий уровень выявления патогенов методами иммуноанализа. Имеются данные, что при введении азида натрия при экстракции вируса желтой мозаики ячменя из листового материала злаковых культур снижался уровень оптической плотности ИФА в среднем на 30% [Кастальева, Можаева, 2002]. Обнаруженный положительный эффект введения мертиолята натрия на стадии преаналитической подготовки мог быть связан с процессом трансформации тимерозала и образованием тиосалициловой (2- меркаптобензойной) кислоты, защищавшей аминокислотную структуру белков оболочки вирусов от негативного воздействие веществ полифенольного ряда. Отрицательное воздействие веществ полифенольного ряда на молекулярную структуру вирусов растений является широко известным [Метьюз, 1973; Гнутова, 1993]. В растительных клетках полифенольные соединения локализованы преимущественно в вакуолях. При нарушении целостности тканей происходит высвобождение 41 орто-дифенольных соединений, которые при взаимодействии с кислородом воздуха вступают в дифенолоксидазную реакцию с образованием орто-хинонов [Кретович, 1971]. Данные соединения взаимодействуют с белками, образуя ковалентные связи с остатками серосодержащих аминокислот. Это приводит к денатурации белковых молекул. Некоторые серосодержащие органические соединения, например тиогликолевая кислота и 2-меркаптоэтанол, являются сильными восстановителями. Протекторное действие этих веществ заключается в быстром окислении входящей в их состав тиогруппы и блокировании окисления органических молекул [Томас, Каниевски, 2005]. В проведенных нами экспериментах, действие тиосалициловой кислоты оказалось сопоставимым с действием тиогликолевой кислоты и 2-меркаптоэтанола, а также с действием ряда антиоксидантных, фенолсвязывающих и хелатирующих соединений, блокирующих негативное воздействие веществ полифенольного ряда. Согласно нашему мнению, мертиолят натрия и тиосалициловая кислота обладают аналогичными протекторными свойствами, и могут использоваться в ходе преаналитической подготовки растительного материала для проведения диагностики вирусов растений. Учитывая высокую токсичность ртутьсодержащих соединений, предпочтительным является применение нетоксичной тиосалициловой кислоты. В отечественной литературе описан успешный опыт включения в состав экстракционного буфера для связывания полифенольных компонентов гидроксипроизводного бензойной кислоты [Упадышев, 2011] – соединения, близкого по химическому строению к тиосалициловой кислоте. Внесение изучаемых соединений не предотвращало полного снижения антигенной активности вируса, что может быть связано с функционированием растительных и вирусных протеиназ. К числу последних относятся NIa, HC-Pro и P1 белки YВК [Garcia et al., 1990]. Эффективное применение мертиолята натрия и тиосалициловой кислоты в процессах преаналитической подготовки, оказалось возможным лишь при небольшой продолжительности хранения растительного материала. Можно 42 предположить, что увеличение периода хранения будет достигнуто при внесении ингибиторов протеиназ, однако для этого требуется проведение дополнительных исследований. 3.1.5 Алгоритм преаналитической подготовки биоматериала На основании проведенных исследований был предложен следующий алгоритм преаналитической подготовки растительного материала для проведения диагностики вирусов картофеля. После процедуры разрушения растительный материал вносится в полипропиленовые емкости, содержащие 0.1 М Tris-HCl буфер (рН 7.0) и 0.01 М тиосалициловой кислоты. После этого, биоматериал подвергается замораживанию и до постановки анализа хранится в условиях морозильной камеры (температура -18…-25 ○С). После завершения хранения и процесса оттаивания биоматериала, РРК удаляются с помощью центрифугирования. Полученный супернатант используется в диагностическом исследовании. Эффективность разработанного алгоритма пробоподготовки была апробирована при диагностическом изучении растений картофеля, регенерированных из апикальной меристемной ткани и растущих на искусственных питательных средах. В ходе диагностического исследования 127 меристемных линий, с помощью метода ИФА было выявлено 29 YВКпозитивных образцов. При этом, применение разработанного алгоритма позволило повысить уровень детектируемого сигнала и диагностировать YВК в 4 образцах (14% от количества инфицированных линий), не выявленных при использовании обычного способа пробоподготовки (рисунок 8, образцы 1-4). Кроме того, применение данного алгоритма позволило сделать заключение о наличии YВК в образце, результаты которого при обычном способе пробоподготовки находились в области сомнительных результатов (рисунок 8, образец 5). Содержание YВК во всех серопозитивных образцах было подтверждено с помощью метода ОТ-ПЦР. Расчет t-критерия Стьюдента для бинарных данных показал, что различия, выявленные между 43 контрольным и экспериментальным вариантами являются статистически Коэфф. позитивности, отн. ед достоверными (р<0.05). 1,6 1,4 1,2 Пороговое значение (Р) 1,0 0,8 0,6 0,4 0,2 0,0 Негативный контроль 1 2 3 4 5 Исследуемые образцы Стандартный алгоритм Разработанный алгоритм Рисунок 8 – Эффективность преаналитической подготовки биоматериала при диагностике YВК в меристемных линиях картофеля Принимая во внимание, что YВК обладает некоторыми общими физико-химическими, биологическими и иммунологическими свойствами с рядом широко распространенных вирусов, индуцирующих развитие мозаичных болезней картофеля [Гнутова, 1993], можно ожидать, что выявленный эффект будет наблюдаться при диагностическом выявлении широкого круга Разработанный инфекционных алгоритм агентов преаналитической вирусного подготовки происхождения. растительного материала был использован при проведении скрининговых диагностических исследований вирусных патогенов в семенном материале картофеля. 3.2 Диагностика вирусов в меристемных линиях картофеля Современный биотехнологический процесс получения семенного картофеля основан на способе вычленения неинфицированной вирусами апикальной меристемной ткани и регенерации из нее растений на искусственных питательных средах. Применение биотехнологических методов получения безвирусных растений, возможно не только в процессе семеноводства сортов картофеля, но и при проведении селекционной работы. 44 Сочетание селекционного и биотехнологического процессов позволяет осуществлять оздоровление перспективных гибридов до проведения государственного сортоиспытания и может обеспечить более быстрое внедрение новых сортов в производственную практику. С помощью методов ИФА и ОТ-ПЦР было исследовано 234 образца растений картофеля, регенерированных из апикальной меристемной ткани и растущих in vitro. Сравнительный анализ двух методов диагностики показал, что использование ОТ-ПЦР характеризовалось более высокой эффективностью, чем применение ИФА (таблица 5). Таблица 5 – Сравнительный анализ применения методов ИФА и ОТ-ПЦР при выявлении вирусов в растениях регенерированных из апикальной меристемы (n=234) Количество инфицированных линий, шт. (% ± m) Метод ИФА ОТ-ПЦР YВК МВК SВК ХВК ВСЛК 82 73 146 14 2 (35.0±3.0) (31.0±3.0) (62.0±3.2) (5.9±1.5) (1.1 ±0.8) 93 82 166 15 3 (39.7±3.0) (35.0±3.1) (70.0±2.9) (6.4±1.8) (1.7±1.0) Примечание: % m – относительное количество с ошибкой доли. С помощью генодиагностики было выявлено: 20 SВК -, 11 YВК -, 9 МВК- и 1 ВСЛК - инфицированных меристемных линий, которые не были детектированы в ИФА. Статистический анализ, проведенный с помощью tкритерия Стьюдента для бинарных данных, не выявил достоверных различий между результатами ИФА и ОТ-ПЦР. Не смотря на отсутствие достоверных статистических различий (p>0.05) следует признать, что обнаружение даже единичной инфицированной меристемной линии в условиях биотехнологического производства безвирусного картофеля имеет большое значение, поскольку материал, размноженный 45 из данной линии, впоследствии неизбежно будет подвергнут выбраковке. Таким образом, применение метода ОТ-ПЦР при проведении диагностического контроля патогенов в растениях, регенерированных из меристемной ткани, является оправданным. Дальнейший анализ данных был основан на результатах ПЦРисследования. Проведенное исследование позволило обнаружить различия в видовом составе вирусных патогенов, выявленных в образцах сортового и гибридного материала (таблица 6). Таблица 6 – Видовой состав вирусов, выявленный в меристемных линиях с помощью метода ОТ-ПЦР Патоген Сорта Гибриды (n = 125) (n = 109) шт. %±m шт. %±m YВК* 49 39.2 ± 4.3 22 20.2 ± 3.7 МВК 33 26.4 ± 3.8 40 36.7 ± 4.5 SВК 49 39.2 ±4.3 32 29.3 ± 4.3 ХВК** 13 10.4 ± 2.6 0 0 ВСЛК 3 2.4 ± 1.0 0 0 *– p<0.05, ** - р<0.01 В растениях, регенерированных из тканей сортов картофеля, были обнаружены все пять диагностируемых патогена. Наибольшей частотой встречаемости характеризовался распространения следовали SВК МВК и и YВК, ХВК. затем по уровню Наименьшая частота диагностирования в растениях-регенерантах была отмечена в случае ВСЛК. В меристемных линиях гибридов были диагностированы три патогена – YВК, МВК, SВК. Частота встречаемости МВК превосходила частоту с которой были детектированы YВК и SВК. В связи с тем, что клубни сортов картофеля, служившие источником меристемных эксплантов, были отобраны 46 с обширной территории (различные регионы России, страны ближнего и дальнего зарубежья) характеризующейся различными эколого-географическими условиями, то в растениях-регенерантах был обнаружен широкий спектр вирусных патогенов: YВК, МВК, SВК, ХВК и ВСЛК. Клубни гибридов картофеля, использованные в данной работе, были получены от растений, выращенных из ботанических семян и возделывавшихся в открытом грунте на протяжении 4-5 вегетационных сезонов. Так как вирусы картофеля не передаются через ботанические семена [Мэтьюз, 1973], то результаты диагностического изучения отразили уровень инфекционной нагрузки существующей в Среднем Поволжье – регионе, где были выращены перспективные гибриды. Таким образом, при работе методом культуры апикальных меристем в Среднем Поволжье наибольшей вредоносностью обладают YВК, МВК и SВК. В результате проведенных диагностических исследований в производственную безвирусную коллекцию было включено 25 сортов (28 меристемных линий) и 20 перспективных гибридов (27 меристемных линий) картофеля. 47 1) ВЫВОДЫ Не зависимо от применяемого способа разрушения, биоматериал растений картофеля содержал разрушенные включения, представленные преимущественно хлоропластами. 2) Компоненты проб картофеля оказывали как позитивное, так и негативное влияние на результаты выявления Y-вируса картофеля в зависимости от условий температурного хранения биоматериала. В ходе однократного цикла замораживания-оттаивания в пробах содержащих разрушенные компоненты в ходе иммуноферментного анализа (ИФА) отмечено повышение величины детектируемого колориметрического сигнала на 18.8%. 3) Внесение 0.01 М азида натрия совместно с 0.1 М Tris-HCl буфером (рН 7.0) в состав проб содержащих разрушенные включения вызвало снижение величины детектируемого колориметрического сигнала в ИФА на 59.6% (p<0.01). Комбинированное применение 0.01 М мертиолята натрия совместно с 0.1 М Tris-HCl буфером приводило к повышению уровня детектируемого сигнала на 38.3% (p<0.01). 4) Разработан алгоритм преаналитической подготовки, включающий: а) внесение в состав разрушенного растительного материала 0.01 М тиосалициловой кислоты и 0.1 М Tris-HCl буфера, б) однократного цикла замораживания-оттаивания, в) удаления разрушенных растительных компонентов с помощью центрифугирования. Применение алгоритма повысило уровень выявления Y-вируса картофеля в биоматериале меристемных растений in vitro на 14%. 5) Меристемные линии сортов и перспективных гибридов картофеля отличались по видовому составу диагностированных вирусных патогенов. В производственную безвирусную коллекцию было включено 25 сортов (28 меристемных линий) и 20 перспективных гибридов (27 меристемных линий) картофеля. 48 СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ 1) Али, Х. Х. Взаимодействие X вируса картофеля с Phytophtora infestans и особенности их распространения: автореф. дисс. … канд. биол. наук: 06.01.07 [Текст] / Х. Х. Али; РГАУ-МСХА им. К.А. Тимирязева. – М., 2011. – 23 с. 2) Анисимов, Б. В. Защита картофеля от болезней вредителей и сорняков [Текст] / Б. В. Анисимов, Г. Л. Белов, Ю. А. Варицев. – М.: Картофелевод, 2009. – 272 с. 3) Анисимов, Б. В. Фитопатогенные вирусы и их контроль в семеноводстве картофеля [Текст] / Б. В. Анисимов. – М.: ФГНУ «Росинформагротех», 2004. – 80с 4) Бобкова, А. Ф. Пиротест – метод иммуноферментного анализа вирусов картофеля [Текст] / А. Ф. Бобкова, А. Н Блинцов, С. Н.Чирков // Аграрная Россия. – 2003. – № 3. – С. 23 – 27. 5) Брант, А. А. [Текст] / Основные вирусы заражающие культуру картофеля А. А. Брант // Вирусные и вирусоподобные болезни и семеноводство картофеля. – СПб.: Инновационный центр защиты растений, 2005. – С. 13-19. 6) Бызова, Н. А. Разработка иммунохроматографических тест-систем для экспрессной детекции вирусов растений [Текст] / Н. А. Бызова, И. В. Сафенкова, С. Н. Чирков, А. В. Жердев, А. Н. Блинцов, Б. Б. Дзантиев, И. Г. Атабеков // Прикладная биохимия и микробиология. – 2009. – Т.45. – № 2. – С. 225-231. 7) Гера, А. Определение и идентификация вирусов картофеля [Текст] / А. Гера, Ш. Марко // Вирусные и вирусоподобные болезни и семеноводство картофеля. – СПб.: Инновационный центр защиты растений. – 2005. – С. 146155. 8) Гнутова, Р. В. Серология и иммунохимия вирусов растений [Текст] / Р. В. Гнутова. – М.: Наука, 1993. – 301 с. 49 9) Гнутова, Р. В. Антигенная характеристика Y-вируса картофеля (штаммовый состав) [Текст] / Р. В. Гнутова, И. И. Сибирякова // Биологические науки. − 1992. – № 5. – С. 42-49. 10) Дашкевич, В. К. Оптимизация методики проведения иммуноферментного анализа на основе реагентов собственного производства по определению вирусов картофеля [Текст] / В. К. Дашкевич, Е. В. Радкович, Г. Н. Гуща // Актуальные проблемы защиты картофеля, плодовых и овощных культур от болезней, вредителей и сорняков: Материалы международной конференции, Минск, 2005.г. – С. 54-60. 11) Досон, Р. Справочник биохимика [Текст] : [пер с англ] / Р. Досон, Д. Эллиот, У. Эллиот, К. Джонс. – М.: Мир, 1991. – 544с. 12) Дынник, В. В. Картофель: вирусные, бактериальные и грибные болезни. Альбом характерных признаков и симптомов [Текст] / В. В. Дынник, К. В. Попкова. – Пущино: ПВАК, 1997. – 50 с. 13) Дьяков, Ю. Т. Общая и молекулярная фитопатология [Текст] / Ю. Т. Дьяков, О. Л. Озерецковская, В. Г. Джавахия, С. Ф. Багирова. – М.: Общество фитопатологов, 2001. – 302 с. 14) Зайнуллин, А. А. Использование современных методов тестирования Y-вируса картофеля в пробирочных растениях [Текст] / А. А. Зайнуллин, А. С. Зайнуллина, Ф. Ф. Замалиева // Вестник защиты растений. – 2002. – №3. – С 37-41. 15) Зайцев, Б. Н. Применение атомно-силовой микроскопии для изучения сорбции антител и захвата поверхностного антигена гепатита В на поверхности иммунологических планшет [Текст] / Б. Н. Зайцев, И. В. Юдина, А. Н. Канев // Биотехнология. – 2006. – №1. – С. 89-96. 16) Замалиева, Ф. Ф. Борьба с вирусными болезнями картофеля [Текст] / Ф. Ф. Замалиева // Защита и карантин растений. – 2013. – №3. – С. 17-21. 17) Захарова, Г. С. Пероксидаза из корней хрена: модулирование свойств химической модификацией белковой глобулы и гемма [Текст] / Г. С. 50 Захарова, И. В. Упоров, В. И. Тишков // Успехи биологической химии. – 2011. – Т.51. – С. 37-64. 18) Иванюк, В. Г. Защита картофеля от болезней, вредителей и сорняков [Текст] / В. Г. Иванюк, С. А. Банадысев, Г. К. Журомский. – Минск: Белпринт, 2005. – 696 с. 19) Кастальева, Т. Б. Оптимизация методики определения вируса желтой карликовости ячменя с помощью иммуноферментного анализа [Текст] / Т. Б. Кастальева, К. А. Можаева // Вестник защиты растений. – 2002. – № 2. – С. 49-54. 20) Кретович, В. Л. Основы биохимии растений [Текст] / В. Л. Кретович. – М.: Высшая школа, 1971. – 464 с. 21) Лакин, Г. Ф. Биометрия [Текст] / Г. Ф. Лакин. – М.: Высшая школа, 1990. – 352 с. 22) Лебенштейн, Г. Х вирус картофеля [Текст] / Г. Лебенштейн // Вирусные и вирусоподобные болезни и семеноводство картофеля. – СПб: Инновационный центр защиты растений, 2005. – С. 25-29. 23) Метьюз, Р. Вирусы растений [Текст] : [пер. с англ] / Р. Метьюз. – М.: Мир, 1973. – 686с. 24) Молекулярная клиническая диагностика. Методы [Текст] / под ред. С. Херрингтона, Дж. Макги – M.: Мир, 1999. – 558 с. 25) Мусин, С. М. Разработка метода для определения ВВКК и создания диагностикума с нерадиоактивной меткой [Текст] / С. М. Мусин, В. В. Бойко, Б. В. Анисимов // Актуальные проблемы современного картофелеводства. – М.: ВНИИКХ, 1997. – С. 56-78. 26) Обручков, В. С. Биологические особенности YВК и способы его идентификации на основных пасленовых культурах: автореф. дисс. … канд. биол. наук: 06.01.11 [Текст] / В.С. Обручков; ВИЗР. – СПб, 1993. – 23 с. 27) Оптимизация приемов оздоровления, размножения и защиты семенного картофеля от вирусной инфекции. (Методические указания) 51 [Текст] / под ред. Ж. В. Блоцкой, Н. Н. Тимофеева, О. Н. Зубкевича [с соавт.] – Минск, 1996. – 16 с. 28) Першина, Л. А. Методы культивирования in vitro в биотехнологии растений [Текст] / Л. А.Першина. – Новосибирск: Новосибирский государственный университет, 2000. – Ч. 2. – С. 69 29) Приходько, Ю. Н. Совершенствование фитопатологического контроля объектов карантинного значения [Текст] / Ю. Н. Приходько, Ю. А.Шнейдер, Т. С. Живаева, Е. С.Мазурин, Н. А.Шероколава, Магомедов У.Ш., А. И.Усков, Ю. А. Варицев, Б. В. Анисимов // Защита и карантин растений. – 2010. – №11. – С. 31-38. 30) Реброва, О. Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA [Текст] / О. Ю. Реброва. – М.: МедиаСфера, 2002. – 312 с. 31) Рязанцев, Д. Ю. Эффективный метод диагностики и идентификации вирусных патогенов картофеля [Текст] / Д. Ю. Рязанцев, С. К. Завриев // Молекулярная биология. – 2009. – Т.43. – С. 558–567. 32) Саламатова, Т. С. Физиология растительной клетки [Текст] / Т. С. Саламатова. – Л.: Изд-во Ленинград. ун-та, 1983. – 283 с. 33) Самсонова, Л. Н. Диагностика вирусных фитоплазменных болезней овощных культур и картофеля / Л. Н. Самсонова, А. Е. Цыпленков, Т. А. Якуткина. – СПб.: Инновационный центр защиты растений, 2001. – 48 с. 34) Самуилов, В. Д. Иммуноферментный анализ [Текст] / В. Д. Самуилов // Соросовский образовательный журнал. – 1999. – №12. – С. 9-15. 35) Семеноводство картофеля. Контроль качества. Сертификация. (Методическое пособие) [Текст] / под ред. А. В. Коршунова, Б. В. Анисимова. – М, 2002. – 335 с. 36) Томас, Р. Е. Выделение и очистка вирусов картофеля [Текст] / Р. Е. Томас, В. К. Каниевски // Вирусные и вирусоподобные болезни и семеноводство картофеля. – СПб.: Инновационный центр защиты растений, 2005. – С. 156-172. 52 37) Трофимец, Л. Н. Методы лечения картофеля зараженного вирусными болезнями [Текст] / Л. Н. Трофимец, П. А. Хижняк, А. П. Кучумов [с соавт.] – М.: ВНИИТЭИСХ, 1976. – 62 с. 38) Трофимец, Л. Н. Оздоровление и ускоренное размножение семенного картофеля [Текст] / JI. H. Трофимец, Д. П. Остапенко, В. В. Бойко [с соавт.] – М.: ВАСХНИЛ, – 1985. – 36 с. 39) Упадышев, М. Т. Вирусные болезни и современные методы оздоровления плодовых и ягодных культур: автореф. дисс. … докт. с.-х. наук: 06.01.07 [Текст] / М. Т. Упадышев; ВСТИСП Россельхозакадемии. – М., 2011. – 48 с. 40) Усков А. И. Воспроизводство оздоровленного исходного материала для семеноводства картофеля: 6. Методы лабораторного контроля [Текст] / А. И. Усков // Достижения науки и техники АПК. – 2011. – №10. – С. 23-25. 41) Харченко, Л. Т. Сравнительное изучение способов выращивания растений картофеля, свободных от вирусов X, S, M, Y из тканей вирозных растений [Текст] : автореф. дисс. … кандидат сельскохозяйственных наук / Л. Т. Харченко; ВНИИКХ.- Коренево, 1971. – 21 с. 42) Шевелуха, B. C. Сельскохозяйственная биотехнология [Текст] / B. C. Шевелуха, Е. А. Калашникова, Е. З. Кочиева. – М.: Высшая. школа, 2008.— 710с. 43) Agindotan, O. Simultaneous detection of potato viruses, PLRV, PVA, PVX and PVY from dormant potato tubers by TaqMan real-time RT-PCR [Text] / O. Agindotan, J. P. Shiel, P. H. Berger // Journal of Virological Methods. – 2007. – V. 142. – Р. 18-21. 44) Alayash, A. I. Redox reactions of hemoglobin and myoglobin: biological and toxicological implications [Text] / A. I. Alayash, P. P. Rakesh, E. C. Robert // Antioxidants & Redox Signaling. – 2001. – V. 3. – N 2. – P. 1–9. 45) Badarau, C. L. The influence of samples incubacion on detection of PLRV and the effect of some extraction buffer’s additives on the detection of Potato viruses S, Y, A, X and S by ELISA technique [Text] / C. L. Вadarau, N. Cojocaru, 53 S. N. Rusu, M. Ionosu, K. Petrusca // Analele Univ. din Oradea. – 2009. – V. 16. – N 2. – P. 15-19. 46) Bergervoet, J. H. Multiplex microsphere immuno-detection of potato virus Y, X and PLRV [Text] / J. H. Bergervoet, J. Peters, van Bechover [et al.] // J. Virol. Methods. – 2008. – V. 149. – N1. – P. 63-68. 47) Boonham, N. Strain specific recombinant antibodies to potato virus Y potyvirus [Text] / N. Boonham, I. Barker // J. Virol. Meth. – 1998. – V. 74. – P. 193-199. 48) Brunt, А. Viruses of Plants [Text] / А. Brunt, K. Crabtree, M. Dallwitz, A. Gibbs, L. Watson. – Wellingford: CAB Inernational, 1996. – P. 44-53. 49) Bystricka, D. Oligonucleotide-based microarray: A new improvement in microarray detection of plant viruses [Text] / D. Bystricka, O. Lenz, I. Mraz // J. Virol. Methods. – 2005. – V. 128. – P. 176-182. 50) Clark, M. F. Characteristics of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses [Text] / M. F. Clark, A. N.Adams // Journal of General Virology. – 1977. – V. 34. – P. 475-483. 51) Drygin, Yu.F. High-sensitive technologies for molecular diagnostics of potato virus and viroid infections [Text] / Yu.F. Drygin, S.N. Chirkov, O.A. Kondakova // Potato Production and Innovative Technologies. – Wageningen: Acad. Publishers, 2007. - P. 274-285. 52) Feki, S. Interaction between tobacco Ribulose-l,5-biphosphate Carboxylase/Oxygenase large subunit (RubisCO-LSU) and the PVY Coat Protein (PVY-CP) [Text] / S. Feki, M. J. Loukili, R. Triki-Marrakchi // European Journal of Plant Pathology. – 2005. – V. 112 – N 3. – P. 221-234. 53) Foster, G. D The 3’ –nucleotide sequence of an ordinary strain of potato virus S [Text] / G. D. Foster, P. R. Mills, G. Foster // Virus Genes. − 1992. − N 6. – P. 213-220. 54) Frank G. D. Translocation and mechanical spread of potato virus S in potatoes [Text] / G. D. Frank, E. E. Banttari // Potato Res.-1996. – N 73. – P.123133. 54 55) Garcia, J. A. Mutational analysis of the plum pox potyvirus polyprotein processing by the NIa protease in Escherichia coli [Text] / J. A. Garcia, S. Lain, M. T. Cervera, J. L. Riechmann, M. T. Martin // J. Gen. Virology. – 1990. – V. 71. – P. 2773-2779. 56) Gunasinghe, U. B. Association of potato virus Y gene products with chloroplasts in tobacco [Text] / U. B. Gunasinghe, P.H. Berger // Mol. Plant Microbe Interact. – 1991. – V. 4. – P. 452-457. 57) Halterman, D. Potato, viruses, and seed certification in the USA to provide healthy propagated tubers [Text] / D. Halterman, A. Charkowski, J. Verchot // Pest Technology. 6. Special Issue 1. – 2012. – P. 1-14 58) Kohler, G. Continuous cultures of fused cells secreting antibody of predefined specificity [Text] / G. Kohler, С. Milstein // Nature. – 1975. – V. 56. – P. 495. 59) Le Romancer, M. Biological characterization of various geographical isolates of Potato virus Y inducing superficial necrosis on potato tubers [Text] / M. Le Romancer, C. Kerlan, M. Nedellec // Plant. Pathol. – 1994. – V. 43. – P. 138144. 60) Leclerc, D. Biotinylated DNA probes for detecting virus Y and aucuba mosaic virus in leaves and dormant tubers of potato [Text] / D. Leclerc, R. P. Eweida, M. G. Singh, // Potato Research. – 1992. – V. 35. – P. 173-182. 61) Loebenstein, G. Improved detection of potato leafroll luteovirus in leaves and tubers with a dioxigenin-labeled cRNA probe / G. Loebenstein, F. Akad, V. Filatov // Plant Dis. – 1997. – V. 81. – P. 489-491. 62) Mayo, M. Nucleotide sequence of potato leafroll luteovirus RNA [Text] / M. Mayo, D. Robinson, C. Jolly, L. Hyman // J.Gen. Virol. – 1989. – V. 70. – P.1037-1051. 63) Murashige, T. A revised medium for rapid growth and bioassays with tobacco tissue cultures [Text] / Murashige T. and Skoog F. // Physiol. Plant. – 1962. – V. 15. – P. 473-497. 55 64) Nie, X. A novel usage of random primers for multiplex RT-PCR detection of virus and viroid in aphids, leaves, and tubers [Text] / X. Nie, R. P. Singh // J. Virol. Methods. – 2001. – V. 91. – P.37- 49. 65) Nienhaus, F. Ubertragung des Kartoffel-Virus durch Zoosporen von Synchytrichiun endobioticum [Text] / F. Nienhaus, B. Stille // Phytopatol. – 1965.V.54.- P. 335-337 66) PCR Application Manual: Roche Molecular Biochemicals [Text]. – 2000. – P.88-127. 67) Pelletier, Y. A new approach for the identification of aphid vectors (Hemiptera: Aphididae) of potato virus Y [Text] / Y. Pelletier, X. Nie, M. A. Giguère , U. Nanayakkara, E. Maw, R. Foottit // J. Econ. Entomol. – 2012. – V. 10. – N 6. – P. 1909-1914. 68) Purcifull, D. E. Preservation of plant virus antigens by freeze-driynd [Text] / D. E. Purcifull, S. R. Christie, D. L. Bathelor // Phytopathology. – 1975. – V. 65. – P. 1202-1205. 69) Querci, M. Analisis of the resistance-breaking determinants of potato virus X (PVX) strain HB on different potato genotypes expressing extreme resistance to PVX [Text] / M. Querci, D. C. Baulcombe, R. W. Goldbach, L. F. Salazar // Phytopatol. – 1995. – V. 85. – P. 1003-1010. 70) Robaglia, C. M. Nucleotide sequence of potato virus Y (N strain) genomic RNA [Text] / C. M. Robaglia, M. Durand-Tardif, G. Tronchet // J. Gen. Virology. – 1989. – V. 70. – P. 935-947. 71) Robinson, D. Sensitivity and specificity of nucleic acid probes for potato ieafroll luteovirus detection [Text] / D. Robinson, J. Romero // J.Virol. Meth.1991. – N 34. – P. 209-214. 72) Rowhani, A. Purification and characterization of potato leafroll virus [Text] / A. Rowhani, R. Stace-Smith // Virology. – 1979. – V. 98. – P. 45-54. 73) Salazar, L. F. Potato viruses and their control [Text] / L. F. Salazar. – Lima: Intern. Potato Center, 1996. – 214 p. 56 74) Schaad, M. C. VPg of tobacco etch potyvirus is a host genotype-specific determinant for long-distance movement [Text] / M. C. Schaad, A. D. Lellis, J. C. Carrington // J. Virology. – 1997а. – V. 71. – P. 8624-8631. 75) Schaad, M. C. Formation of plant RNA virus replication complexes on membranes: role of an endoplasmic reticulum-targeted viral protein [Text] / M. C. Schaad, P. E. Jensen, J. C. Carrington // EMBO J. – 1997b. – V. 16. – P. 40494059. 76) Skryabin, K. G., The nucleotide sequence of potato virus X RNA [Text] / K. G. Skryabin, A. S. Kraev, S. Y. Morozov, M. N. Rozanov, B. K. Chernov, L. I. Lukasheva, J. G. Atabekov //Nucleic Acids Res.-1988.− V.16.− P.10929-10930. 77) Struik, H. C. Seed potato technology [Text] / H. C. Struik, S. G. Wiersema. – Wageningen: Wageningen Pres,, 1999.− 383 p. 78) Tan, M. Route of decomposition of thiomersal (thimerosal) [Text] / M. Tan, J. E. Parkin // Int. J. Pharm. – 2000. – V. 208. – N 1-2. – P. 23-24. 79) Van der Vlugt, A. A. Determination of aphid transmission efficiencies for N, NTN and Wilga strains of potato virus Y [Text] / M. Verbeek, P. G. M. Piron, A. M. Dullemans, C. Cuperus, and R. A. A. van der Vlugt // Annals of Applied Biology. – 2010. – V.156. – P.39-49. 80) Varveri, C. Potato Y Potyvirus Detection by Immunological and Molecular Techniques in Plants and Aphids [Text] / C. Varveri // Phytoparasitica. – 2000. – Vl. 2. – N 28. – P.243-251. 81) Wei, T. Sequential recruitment of the endoplasmic reticulum and chloroplasts for plant potyvirus replication [Text] / T. Wei, T.S. Huang, J. McNeil // J. Virol. – 2010. – V. 84. – P. 799–809. 82) Zavriev, S. K. The genome organization of potato virus M RNA [Text] / S.K. Zavriev, K.V. Kanyuka, K.E. Levay // J. Gen. Virol. – 1991. – V. 72. – P. 914. 83) Ziegler, A. Applications of recombinant antibodies in plant pathology [Text] / A. Ziegler, L. Torrance // Molecular Plant Pathology. – 2002. – V. 3. – P. 401407. 57