Clinical pharmacology of the interactions between zinc and iron
advertisement

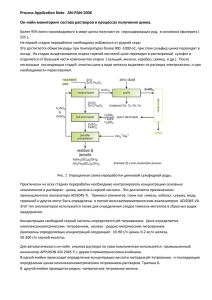
Взаимодействия цинка и железа Клиническая фармакология взаимодействий цинка и железа 1, 2 1, 3 1, 2 1, 2 ✑ О.А. Громова , И.Ю. Торшин , И.К. Томилова , Л.Э. Федотова 1 2 РСЦ Института микроэлементов ЮНЕСКО Ивановская государственная медицинская академия 3 ВЦ РАН им. А.А. Дородницына В статье рассматриваются клиникофармакологические характеристики двух эссенциаль ных микроэлементов – цинка и железа, механизмы их взаимодействия в организме и дан ные клинических исследований. Совокупность данных позволяет предположить, что опти мальным способом восполнения физиологической потребности в железе и цинке является их раздельный прием в течение суток во время еды при молярном отношении компонентов 1 : 1. Ключевые слова: цинк, железо, взаимодействия микроэлементов. Клиническая фармакология цинка и же леза включает в себя не только фармакоки нетику и фармакодинамику каждого эле мента в отдельности, но и их взаимодейст вия между собой. Часто пациенты нужда ются в назначении и цинка, и железа. Многочисленные эпидемиологические и клинические исследования указывают, что сочетанный дефицит цинка и железа встре чается очень часто [1, 2]. В среднем по Рос сии дефицит цинка отмечается у 20% лю дей (у детей – до 40%), дефицит железа – у 22%. По разным оценкам, дефицит цинка и железа одновременно встречается у 6–20% людей [2]. Результаты клиникофармакологических испытаний лекарственных форм, содержа щих одновременно железо и цинк, указыва ют на взаимный антагонизм между ними: железо уменьшает положительные эффек ты цинка и наоборот [2–6]. Поэтому при разработке витаминноминеральных ком плексов следует учитывать не только фар Контактная информация: Громова Ольга Алексе евна, unesco.gromova@gmail.com макологические свойства отдельных ком понентов, но также их возможные взаимо действия – антагонизм и синергизм. К со жалению, различными взаимодействиями между микроэлементами и витаминами ча сто пренебрегают. Анализ более 1000 публикаций по моле кулярной фармакологии и биохимии за по следние 40 лет показал, что между цинком и железом существуют значительные фи зиологические и лекарственные взаимо действия, как синергидные, так и конку рентные. В данной статье после рассмотре ния функций и фармакокинетики обоих микроэлементов обсуждаются все виды их взаимодействия, а также молекулярная фармакология цинка и железа [7, 8]. Фармакокинетика железа Биологические функции железа заклю чаются в транспорте электронов, кислоро да, обеспечении окислительновосстано вительных реакций и активации перекис ного окисления, предварительно подготов ленного ионами меди. Железо необходимо для нормального функционирования им Лечебное дело 1.2010 31 Клиническая фармакология мунной системы (Тлимфоциты, фагоци тоз), для формирования костей и нервной системы, для работы желудочнокишечно го тракта и эндокринных желез. В организме человека содержится от 3 до 5 г железа. Из этого количества 70–80% приходится на гемоглобин; 5–10% – на миоглобин; 1% – на дыхательные фермен ты и трансферрин. Около 25% всего железа депонировано, преимущественно в печени и мышцах. Таким образом, основная масса железа содержится в гемоглобине эритро цитов, миоглобине мышц и резервных бел ках – ферритине и гемосидерине. В кишечнике взрослого человека всасы вается приблизительно 20% железа, содер жащегося в пище. Железо абсорбируется главным образом в двенадцатиперстной кишке (90–95%) и только 5–10% – в на чальных отделах тощей кишки. Чтобы быть абсорбированным, железо должно нахо диться в двухвалентной форме (фермент ферроредуктаза восстанавливает ионы Fe3+ до Fe2+). Интенсивность всасывания железа зави сит от многих факторов, включая запасы железа в организме, скорость образования эритроцитов в костном мозге и концентра цию гемоглобина в крови. Всасыванию же леза способствуют простые углеводы (лак тоза, фруктоза, сорбит), аскорбиновая кис лота и аминокислоты гистидин, лизин и цистеин. Усвоение железа снижается при воспалительном процессе, трансфузионной полицитемии, дефиците меди, никеля и из бытке кальция. Кофе и чай могут уменьшать всасывание железа за счет связывания его с полифенольными соединениями. Уменьша ется абсорбция железа и в результате связы вания с фитатами, клетчаткой и фосфатами, а также с пищевым консервантом ЭДТА. Неорганические соединения железа (ги дроксид или хлорид) усваиваются плохо (биодоступность составляет 3–5%), у суль фата железа биодоступность не превышает 15%, не достигая намного более высокой 32 Лечебное дело 1.2010 биодоступности органических солей (сук цинат, фумарат, глюконат). Усвоение железа организмом не может рассматриваться в отрыве от других вита минов и микроэлементов. Дефицит вита мина А уменьшает способность к усвоению железа. Лучше принимать железо вместе с антиоксидантами – витаминами С и Е. Аскорбиновая кислота повышает биодо ступность железа и восстанавливает Fe3+ до необходимого Fe2+. Также для нормаль ного усвоения и использования железа не обходимо адекватное количество рибофла вина и пиридоксина в рационе. Суточные нормы потребления железа составляют для детей в возрасте до 1 года 4–10 мг, от 1 года до 3 лет – 5 мг, а с 4 лет – 8 мг. Суточная норма потребления железа для мужчин равна 10 мг, для женщин – 18 мг (для беременных – 20 мг, кормящих грудью – 25 мг). Белки гомеостаза железа Железо в организме человека находится в двух физиологических состояниях: в виде запасов в ретикулоэндотелиальной системе (печени, селезенке, костном мозге) или в активном функциональном состоянии – в эритроцитах и их предшественниках. Мо лекулярные механизмы транспорта и го меостаза железа достаточно сложны. В ге номе человека существует не менее 230 ге нов, белки которых вовлечены в гомеостаз железа или необходимы для проявления его биологических функций. Тяжелые на рушения гомеостаза железа могут возни кать при нарушении функций десятков различных белков, из которых наиболее известны трансферрин и ферритин – ос новные транспортные белки железа. Трансферрин отличается высоким срод ством к ионам железа. С трансферрином связано лишь около 0,1% всего железа в ор ганизме, но трансферрин играет важней шую роль – доставляет железо клеткам, имеющим специфические мембранные ре Взаимодействия цинка и железа цепторы (например, предшественникам эритроцитов в костном мозге, клеткам нервной системы). Молекула трансферри на, нагруженная двумя ионами железа, вза имодействует с трансферриновым рецепто ром на поверхности клетки и транспорти руется внутрь клетки. В ходе транспорта рН везикулы понижается особой разновиднос тью АТФаз, что приводит к высвобожде нию ионов железа. Перенос железа через трансферрин невозможен без АТФ и, та ким образом, является энергозависимым, активным транспортом. Затем рецептор и молекула трансферрина высвобождаются и возвращаются на поверхность клетки для переноса новой порции ионов железа [9]. Ферритин доставляет высвободившееся из трансферрина железо в митохондрии, где оно включается в состав гема с участием феррохелатазы. Ферритин осуществляет внутриклеточное хранение железа и пред ставляет собой “контейнер”, в полости ко торого может поместиться около 4500 ионов Fe3+. Концентрации ферритина макси мальны в печени, селезенке, костном моз ге, преимущественно в эндотелиоцитах. Запасание железа в окисленной форме препятствует его вовлечению в окисли тельные процессы [1]. Трансферрин и ферритин – только два компонента сложной системы гомеостаза железа. Белок HFE регулирует взаимодей ствие трансферрина с рецепторами (вариа ции гена HFE считаются одной из причин гемохроматоза). Пептид гепцидин – один из недавно найденных центральных факто ров регуляции железа. Гепцидин связывает гемопортин на мембранах энтероцитов, ма крофагов и гепатоцитов. Комплекс гепци дин–гемопортин всасывается внутрь клет ки, что приводит к сокращению экспорта железа и, следовательно, к более низкому уровню железа в плазме. Уровни гепцидина увеличиваются при перегрузке железом и уменьшаются при его недостатке [10]. Фармакокинетика цинка В организме человека содержится 1,5–2,5 г цинка, из них 90% – в депо: в ске летной мускулатуре (60%) и в костях (30%). Цинк – внутриклеточный металл, его кон центрации особенно высоки в печени, мыш цах, предстательной и поджелудочной желе зе, глазном яблоке, гипофизе, гипоталамусе и обонятельных луковицах. Лишь 2% этого элемента определяется в сыворотке крови. Суточная потребность в цинке состав ляет 8–15 мг у взрослых (11 мг – у мужчин, 8 мг – у женщин, 15 мг – у лиц, испытыва ющих повышенные физические нагрузки, 20–25 мг – у беременных и кормящих гру дью женщин). Потребность в цинке у де тей в возрасте до 12 мес составляет 3–4 мг, 1–6 лет – 5–10 мг, 7–17 лет – 10–15 мг. Ключевым этапом усвоения цинка явля ется тонкокишечная рециркуляция, заклю чающаяся в поддержании баланса между абсорбцией цинка и его эндогенной секре цией панкреатическими и интестинальны ми клетками. Всасывание цинка происхо дит в верхнем отделе кишечника, причем в двенадцатиперстной кишке всасывается 40–45%, а в тощей и подвздошной – 15–20%. В желудке и прямой кишке всасы вается не более 2% цинка. Всего в зависи мости от соединений (пиколинат, оксид и др.) всасывается от 50 до 85% цинка, по ступающего с пищей и водой. Абсорбция увеличивается по мере снижения содержа ния этого элемента в рационе. Неорганиче ские формы цинка имеют низкую биодо ступность (менее 10%). Улучшают всасывание цинка содержа щиеся в пище миозин, глицин, глутамино вая кислота, цистеин, гистидин, лактоза, а также гонадотропин, глюкокортикостерои ды, витамины А и В6. Дефицит витамина А сопровождается недостаточным синтезом транспортных белков, необходимых для всасывания и циркуляции цинка в орга низме. Ухудшают всасывание цинка воспа лительные процессы в слизистых оболоч Лечебное дело 1.2010 33 Клиническая фармакология Ион цинка Рис. 1. Структура типа “цинковый палец”. ках кишечника, фитиновая кислота, каль ций, фосфаты, железо, медь, магний, мар ганец. Кадмий и свинец способны вытес нять цинк из организма. Выделение цинка осуществляется в основном с калом (в том числе со слущивающимися клетками эпи телия), значительно меньше – с потом и мочой. Период полуэлиминации цинка со ставляет от 20 сут до 1 года [1]. Сложный гомеостаз цинка к настояще му времени изучен недостаточно подробно. В плазме 80% цинка связано с альбумина ми, 18% – с α2макроглобулином и 2% – с транспортными белками (трансферрин, церулоплазмин и металлотионеины). Аль бумины и α2макроглобулин осуществляют неспецифический транспорт ионов цинка, а трансферрин, церулоплазмин и металло тионеины – специфический транспорт. Металлотионеины являются плейотроп ными низкомолекулярными белками, бо гатыми цистеином. У человека известны 4 класса этих белков с 16 изоформами [13]. Металлотионеины имеют молекулярную массу до 6–7 кДа и способны связывать широкий спектр металлов, в том числе ток сичных (свинец и кадмий), тем самым ока зывая антиоксидантный эффект. Ионы ме таллов индуцируют экспрессию металло тионеинов в различных тканях (мозг, пе чень, миокард и т.д.). Белки гомеостаза цинка Клиникофармакологические взаимодействия цинка и железа Анализ генома человека показывает, что существует не менее 1700 белков, так или иначе взаимодействующих с цинком. Зна чительная часть этих белков – транскрип ционные факторы типа “цинковый палец” (рис. 1), необходимые для активации транскрипции многих тысяч генов [7]. На пример, все рецепторы стероидов содержат взаимодействующий с ДНК домен, кото рый не может активироваться в отсутствие цинка в их структуре. Цинк необходим для функции нескольких сотен ферментов, ко торые участвуют в метаболизме углеводов, жиров, белков, нуклеиновых кислот и др. Наиболее важные функции цинка: метабо лизм белков и углеводов, влияние на рост и деление клеток, поддержание кислотного баланса крови, участие в иммунной защи те, антиоксидантное действие, метаболизм ретинола (необходимого для образования зрительного пигмента). Белки, содержащие как цинк, так и же лезо, работают во всех физиологических системах организма и взаимодействуют на разных уровнях управления гомеостазом. На наш взгляд, наиболее фундаменталь ным представляется их физиологическое взаимодействие на уровне дыхания (обмен O2/CO2) и регуляции pH крови. Железо входит в состав гемоглобина – основного транспортного белка для кисло рода. Гемоглобин обратимо связывается с кислородом в капиллярах легких. С кровью эритроциты доставляются ко всем органам и тканям, где необходимый для протекания окислительных процессов кислород высво бождается из связи с гемоглобином. Эри троциты также переносят углекислый газ и выделяют его в капиллярах легких. В гемоглобине простетической группой выступает гем – комплекс протопорфири на IX с двухвалентным ионом железа. Свя 34 Лечебное дело 1.2010 Взаимодействия цинка и железа зываемая гемоглобином молекула кислоро да оказывается заключенной между ионом железа и аминокислотными остатками ге моглобина. Для транспорта эритроцитами кислоро да и углекислого газа абсолютно необходим цинк: большая часть цинка крови содер жится именно в эритроцитах в составе цин ковых металлоферментов – карбоангидраз. Карбоангидразы катализируют взаимные превращения угольной кислоты и углекис лого газа (H2CO3 CO2 + H2O). Угольная кислота служит депо углекислоты, выделя ющейся при клеточном дыхании, а также основным компонентом карбонатного бу фера, поддерживающего pH крови в фи зиологическом диапазоне (7,25–7,35) [7]. Таким образом, железо и цинк участвуют в двух комплементарных процессах дыха ния: транспорте кислорода и элиминации углекислоты. При недостатке любого из этих микроэлементов нарушается баланс O2/CO2. Поскольку цинк также способст вует поддержанию нормальной кислотнос ти крови, то его недостаток будет способст вовать сдвигу pH крови в сторону ацидоза. Гомеостаз цинка и гомеостаз железа крайне сложны, и их взаимодействия могут происходить на многих уровнях. Поэтому представляется целесообразным последо вательно рассмотреть все известные разно видности возможных лекарственных взаи модействий: фармацевтическое, фармако кинетическое и фармакодинамическое. Фармацевтические взаимодействия Фармацевтическое взаимодействие ве ществ подразумевает протекание химичес кой реакции (например, реакция между щелочами и кислотами, окислительновос становительные реакции и др.) между ком понентами лекарства до его поступления в организм. В обычных условиях химическое взаимодействие между железом и цинком в принципе невозможно, так как оба эти эле мента представлены катионами, не образу ют окислительновосстановительную пару и в общем случае не могут образовывать нерастворимый осадок [15]. Возможны, однако, взаимодействия между некоторыми конкретными соедине ниями цинка и железа. Например, совме щение в одном препарате карбоната цинка и любой водорастворимой соли железа (сульфата, нитрата, фумарата) приведет к выпадению осадка из карбоната и гидро ксида железа при попадании воды в лекар ственную форму. Поэтому следует избегать совместного применения любых карбона тов (карбоната цинка, карбоната кальция и др.) с любыми формами железа. Это пра вило хорошо известно в фармацевтике и обязательно учитывается в технологии из готовления лекарств. Фармакокинетические взаимодействия Экспериментальные и клинические ис следования фармакокинетики железа и цинка при совместном применении показы вают, что ингибирование одними ионами всасывания других зависит от их соотноше ния. При молярном отношении Fe : Zn <2 : 1 у крыс не наблюдалось существенного влия ния железа на всасывание цинка. При более высоких отношениях Fe : Zn усвоение цинка достоверно уменьшалось, а при отношении 5 : 1 дозозависимое торможение всасывания цинка перестает нарастать [16]. В исследовании у 22 добровольцев, по лучавших 0,5 мг железа с различными доза ми цинка, существенного влияния цинка на всасывание железа не было найдено при молярных отношениях Zn : Fe <2 : 1 [17, 18]. При отношениях 5 : 1, 10 : 1 и 20 : 1 вса сывание железа уменьшалось на 28–40%. В других исследованиях при отношении Zn : Fe 1 : 1 наблюдалось очень слабое тор можение всасывания цинка – менее 10% [3, 19]. Эти и другие клинические исследо вания показали, что высокие концентра ции железа могут ингибировать абсорбцию цинка и наоборот (краткое описание этих Лечебное дело 1.2010 35 Клиническая фармакология Клинические исследования у здоровых добровольцев, в которых изучались взаимодействия содер жащихся в пище цинка и железа Источник Fe, мг Zn, мг Fe : Zn, мг Носитель Уменьшение абсорбции цинка Solomons, Jacob, 1981 [19] 25 50 75 100 25 25 25 54 1:1 2:1 3:1 2:1 Лимонад Лимонад Лимонад Устрицы Да (слабое) Да Да Нет Solomons et al., 1983 [20] 50 25 2:1 Лимонад Да 47 25 2:1 Вода Да 100 50 2:1 Вода Да Aggett et al., 1983 [21] Meadows et al., 1983 [22] Valberg et al., 1984 [6] .. Sandstrom et al., 1985 [23] Crofton et al., 1989 [3] RossanderHulten et al., 1991 [4] Davidsson et al., 1995 [24] 51 26 17 34 6 6,2 4 4 10 : 1 5:1 5:1 10 : 1 Вода Вода Индейка Индейка Да Да Нет Нет 2,2 5,6 56 2,2 5,6 56 2,6 2,6 2,6 2,6 2,6 2,6 1:1 3:1 25 : 1 1:1 3:1 25 : 1 Вода Вода Вода Рис и мясо Рис и мясо Рис и мясо Нет Нет Да Нет Нет Да 47 24 24 22 27 68 2:1 1:1 1:3 Вода Вода Вода Нет Да (слабое) Да 3 3 3 15 45 15 1:5 1 : 15 1:5 Вода Вода Бутерброд Да Да Нет Детское питание Детское питание Бутерброд Детское питание Нет Нет Нет Нет 10,3 25,3 4,5 5,5 0,4 0,4 0,5 0,5 исследований приведено в таблице). Таким образом, при разработке комплексов, включающих цинк и железо, следует стре миться к молярному отношению цинка к железу 1 : 1 и по возможности разделять их прием в течение суток. Как показывает анализ результатов при веденных исследований, угнетающее воз действие железа на всасывание цинка на блюдалось в основном при приеме обоих минералов в жидкой фазе. Если их прини мали с едой, то угнетения всасывания цин ка практически не происходило. Этот вы 36 Лечебное дело 1.2010 23 : 1 57 : 1 9:1 10 : 1 вод характеризуется высокой статистичес кой достоверностью (отношение шансов 52, p < 0,0001): при приеме обоих минера лов с жидкостью риск угнетения всасы вания цинка выше в 52 раза. Между тем в инструкциях по применению большинства витаминноминеральных комплексов, включающих одновременно цинк и желе зо, рекомендуется запивать таблетку (дра же) водой или другой жидкостью. Как по казывают данные исследований (см. таб лицу), выполнение этой рекомендации со Взаимодействия цинка и железа здает условия для антагонизма между цин ком и железом на уровне всасывания. В 2006 г. были опубликованы итоги мно гоцентрового исследования по совместно му и раздельному применению препаратов цинка и железа, в котором приняли участие около 2,5 тыс. детей [30]. В нем было пока зано, что прием монопрепаратов железа не влияет отрицательно на концентрацию цинка в крови у детей, однако прием моно препаратов цинка может негативно влиять на обмен железа. Совместный прием пре паратов железа и цинка менее эффективен для предотвращения развития анемии, чем их раздельный прием. Другое исследование, проведенное в 2004 г. с участием 650 детей, показало, что при приеме цинка улучшается рост, при приеме железа – рост и психомоторное развитие, но в комбинации эти элементы не оказывают значительного эффекта ни на рост, ни на развитие ребенка [31]. Фармакодинамические взаимодействия Фармакодинамические взаимодействия цинка и железа имеют два аспекта: синер гидный и антагонистический. Вряд ли мож но отрицать существование синергизма между цинком и железом. Помимо упомя нутого ранее физиологического взаимодей ствия анализ функциональной взаимосвязи цинка и железа, проведенный нами по ав торской методике в геноме человека, пока зал, что существуют по крайней мере 230 ге нов, белки которых вовлечены в гомеостаз железа [7, 8]. Анализ указал на существова ние белков, которые могут выполнять свою биологическую функцию только при адек ватных уровнях и цинка, и железа. Ряд этих белков необходим для регулирования кис лородного баланса, они активируются при гипоксии. Известно, что совместное приме нение препаратов железа и цинка сущест венно улучшает показатели крови [25, 26]. Особый интерес представляет синергизм между железом и цинком, обеспечивающий реакцию клеток на гипоксию. Пролилгид роксилаза2 – фермент, специфичный в от ношении индуцируемого гипоксией факто ра (HIF1), является сенсором кислорода в клетке. Этот фермент, содержащий “цинко вый палец”, гидроксилирует пролиновые остатки HIF1 и модулирует тем самым ре акцию клеток на гипоксию [27]. Ферменты NOсинтазы необходимы для синтеза одной из важных сигнальных мо лекул – оксида азота (NO). Этот нейро медиатор и вазодилататор синтезируется NOсинтазами из аргинина. Ион железа является частью каталитического центра в составе гема, а ион цинка необходим для стабилизации пространственной структу ры фермента [28]. Существует и конкурентное взаимодей ствие цинка и железа. Ионы этих микроэле ментов могут менять носители (например, связываться с определенными белками) и вызывать изменения абсорбции. Наиболее вероятным молекулярным механизмом та кого взаимодействия железа и цинка явля ется транспортный белок ZIP14, участвую щий в не связанном с трансферрином транспорте железа, а также в транспорте цинка (рис. 2). В энтероцитах и других клетках, экспрессирующих этот белок, транспорт с помощью ZIP14 происходит, по всей видимости, с участием АТФ, т.е. яв ляется активным [9]. Следует также прини мать во внимание, что 60% цинка в плазме неспецифически связывается с альбуми ном, в то время как около 10% цинка пере носится самим трансферрином. Поэтому избыток железа может тормозить абсорб цию цинка и наоборот [29]. Гипотеза о возникновении антагонизма между цинком и железом вследствие кон куренции за транспортные рецепторы под тверждается приведенными выше резуль татами экспериментальных и клинических исследований, показавшими, что эффекты взаимодействия наблюдаются только при высоких молярных отношениях. Если бы взаимодействие было опосредовано через Лечебное дело 1.2010 37 Клиническая фармакология Избыток Fe2+ Вытеснение Zn2+ Транспортер двухвалентных ионов (Ме2+) Отношение Zn : Fe ~1 : 1 Избыток Zn2+ Вытеснение Fe2+ Рис. 2. Конкуренция между цинком и железом за транспортеры типа ZIP14, DMT1, ZnT и др. при разных условиях. изменения уровней транскрипции, оно бы ло бы заметным уже при молярных отно шениях около 1 : 1. Заключение Взаимодействие цинка и железа – это сложный, многосторонний и быстро меня ющийся во времени процесс, зависящий от множества факторов: характера пищи, фа зы пищеварения, состояния пищевари тельной системы, пропорции поступления этих элементов с пищей или в составе ле карственных препаратов, а также от хими ческой природы их соединений (рис. 3). Между цинком и железом имеется как не сомненный физиологический и фармако динамический синергизм, так и определен ный антагонизм. 38 Лечебное дело 1.2010 Зачастую в клинической практике встре чается сочетанный дефицит железа и цин ка, что приводит к необходимости назна чать совместно препараты железа и цинка или использовать комплексные препараты. При одновременном поступлении в орга низм в жидкой среде цинк и железо конку рируют за транспортные белки. Для пред отвращения этой конкуренции следует со блюдать следующие важные правила: • одновременный прием железа и цинка приведет к минимальному антагонизму, если отношение Fe : Zn не превышает 1 : 1; • при раздельном приеме конкуренция между цинком и железом за транспорт ные белки исключается, биодоступность элементов повышается; Взаимодействия цинка и железа АНТАГОНИЗМ СИНЕРГИЗМ Тf (трансферрин) Fe обмен О2 /СО2, регуляция рН TfR1, TfR2 (рецепторы трансферрина) Zn Fe Конкуренция за трансферрин и другие транспортные белки Исследования на добровольцах, изучение взаимодействия диетарных Zn и Fe Zn Fe, Zn Fe Консистенция (жидкость) Оптимум употребления Отношение Zn : Fe ~1 : 1 Прием с твердой пищей Раздельный по времени прием Zn и Fe Белки, для функционирования которых одновременно необходимы ионы цинка и железа Рис. 3. Схема антагонизма и синергизма цинка и железа. • при совместном приеме этих минералов не следует их запивать, а надо принимать препарат во время еды. Таким образом, оптимальным решением является раздельный прием железа и цинка в разное время суток, поэтому следует отда вать предпочтение препаратам, учитываю щим данное взаимодействие. Список литературы 1. Ребров В.Г., Громова О.А. Витамины, макро и микроэлементы. М.: ГэотарМед, 2008. 2. Kordas K., Stoltzfus R.J. New evidence of iron and zinc interplay at the enterocyte and neural tis sues // J. Nutr. 2004. V. 134. № 6. P. 1295–1298. 3. Crofton R.W., Gvozdanovic D., Gvozdanovic S. et al. Inorganic zinc and the intestinal absorp tion of ferrous iron // Am. J. Clin. Nutr. 1989. V. 50. P. 141–144. .. 4. Rossander'Hulten L., Brune M., Sandstrom B. et al. Competitive inhibition of iron absorption by manganese and zinc in humans // Am. J. Clin. Nutr. 1991. V. 54. P. 152–156. 5. Solomons N.W., Cousins R.J. Zinc // Absorption and Malabsorption of Mineral Nutrients / Ed. by N.W. Solomons, I.H. Rosenberg. N.Y.: Alan R. Liss, 2004. P. 125–197. 6. Valberg L.S., Flanagan P.R., Chamberlain M.J. Effects of iron, tin, and copper on zinc absorp tion in humans // Am. J. Clin. Nutr. 1984. V. 40. № 3. P. 536–541. Лечебное дело 1.2010 39 Клиническая фармакология 7. Torshin I.Yu. Bioinformatics in the post genomic era: sensing the change from molecu lar genetics to personalized medicine // Bioinformatics in the PostGenomic Era (series) / Ed. by I.Yu. Torshin. N.Y.: Nova Biomedical Books, 2009. 8. Torshin I.Yu. Bioinformatics in the Post Genomic Era: The Role of Biophysics / Ed. by I.Yu. Torshin. N.Y.: Nova Biomedical Books, 2006. 9. Pietrangelo A. Physiology of iron transport and the hemochromatosis gene // Am. J. Physiol. Gastrointest. Liver Physiol. 2002. V. 282. № 3. P. G403–414. 10. Borch'Iohnsen B., Hagve T.A., Hauge A., Thorstensen K. Regulation of the iron metabo lism // Tidsskr. Nor. Laegeforen. 2009. V. 129. № 9. P. 858–862. 11. Brooks W.A., Santosham M., Naheed A. et al. Effect of weekly zinc supplements on incidence of pneumonia and diarrhoea in children younger than 2 years in an urban, lowincome population in Bangladesh: randomised controlled trial // Lancet. 2005. V. 366. № 9490. P. 999–1004. 12. Maret W. Molecular aspects of human cellular zinc homeostasis: redox control of zinc poten tials and zinc signals // Biometals. 2009. V. 22. № 1. P. 149–157. 13. Thirumoorthy N., Manisenthil Kumar K.T., Shyam Sundar A. et al. Metallothionein: an overview // World J. Gastroenterol. 2007. V. 13. № 7. P. 993–996. 14. Cousins R.J., Blanchard R.K., Moore J.B. et al. Regulation of zinc metabolism and genomic outcomes // J. Nutr. 2003. V. 133. № 5. Suppl. 1. P. 1521S–1526S. 15. Некрасов Б.В. Основы общей химии. М., 1969. 16. Peres J.M., Bureau F., Neuville D. et al. Inhibi tion of zinc absorption by iron depends on their ratio // J. Trace Elem. Med. Biol. 2001. V. 15. № 4. P. 237–241. 17. Olivares M., Pizarro F., Ruz M. New insights about iron bioavailability inhibition by zinc // Nutrition. 2007. V. 23. № 4. P. 292–295. 18. Olivares M., Pizarro F., Ruz M. Zinc inhibits nonheme iron bioavailability in humans // Biol. Trace Elem. Res. 2007. V. 117. № 1–3. P. 7–14. 19. Solomons N.W., Jacob R.A. Studies on the bioavailability of zinc in humans: effects of heme and nonheme iron on the absorption of zinc // Am. J. Clin. Nutr. 1981. V. 34. P. 475–482. 40 Лечебное дело 1.2010 20. Solomons N.W., Pinedea O., Viteri F., Sand' stead H. Studies on the bioavailability of zinc in humans: mechanism of the intestinal interac tion of nonheme iron and zinc // J. Nutr. 1983. V. 113. P. 337–349. 21. Aggett P.J., Crofton R.W., Khin C. et al. The mutu al inhibitory effect on the bioavailability of inor ganic zinc and iron // Zinc Deficiency in Human Subjects / Ed. by A.S. Prasad, A.O. Cavdar, G.J. Brewer, P.J. Aggett. N.Y.: Alan R. Liss, 1983. P. 117–124. 22. Meadows N.J., Grainger S.L., Ruse W. et al. Oral iron and the bioavailability of zinc // Br. Med. J. 1983. V. 287. P. 1013–1014. .. 23. Sandstrom B., Davidsson L., Cederblad A., Lon' nerdal B. Oral iron, dietary ligands and zinc absorption // J. Nutr. 1985. V. 115. P. 411–414. .. 24. Davidsson L., Almgren A., Sandstr om B., Hurrell R.F. Zinc absorption in adult humans: the effect of iron fortification // Br. J. Nutr. 1995. V. 74. P. 417–425. 25. Berger J., Ninh N.X., Khan N.C. et al. Efficacy of combined iron and zinc supplementation on micronutrient status and growth in Vietnamese infants // Eur. J. Clin. Nutr. 2006. V. 60. № 4. P. 443–454. 26. Wasantwisut E., Winichagoon P., Chitchumroon' chokchai C. et al. Iron and zinc supplementation improved iron and zinc status, but not physical growth, of apparently healthy, breastfed infants in rural communities of northeast Thailand // J. Nutr. 2006. V. 136. № 9. P. 2405–2411. 27. Choi K.O., Lee T., Lee N. et al. Inhibition of the catalytic activity of hypoxiainducible factor1 alphaprolylhydroxylase 2 by a MYNDtype zinc finger // Mol. Pharmacol. 2005. V. 68. № 6. P. 1803–1809. 28. Hemmens B., Goessler W., Schmidt K., Mayer B. Role of bound zinc in dimer stabilization but not enzyme activity of neuronal nitricoxide syn thase // J. Biol. Chem. 2000. V. 275. № 46. P. 35786–35791. 29. Rink L., Gabriel P. Zinc and the immune sys tem // Proc. Nutr. Soc. 2000. V. 59. № 4. P. 541–552. 30. Wieringa F.T., Berger J., Dijkhuizen M.A. et al. Combined iron and zinc supplementation in infants improved iron and zinc status, but inter actions reduced efficacy in a multicountry trial in Southeast Asia // J. Nutr. 2007. V. 137. № 2. Р. 466–471. Клиническая фармакология .. 31. Lind T., Lonnerdal B., Stenlund H. et al. A communitybased randomized controlled trial of iron and zinc supplementation in Indonesian infants: effects on growth and development // Am. J. Clin. Nutr. 2004. V. 80. № 3. P. 729–736. Clinical Pharmacology of the Interactions between Zinc and Iron O.A. Gromova, I.Yu. Torshin, I.K. Tomilova, and L.E. Fedotova In this article we carried out a systematic analysis of interactions of the two essential trace elements, iron and zinc. We consider the biological functions of these micronutrients, their pharmacokinetics and pharmacodynamics, the mechanisms of interaction of these minerals in the body and the findings from clinical studies. The available data suggest that the best way of replenish the daily need for these minerals would be separate intake of the substances with meal in the 1 : 1 ratio. Key words: zinc, iron, micronutrients interactions. Книги Издательского холдинга “Атмосфера” Хроническая обструктивная болезнь легких Монография / Под ред. Чучалина А.Г. (Серия монографий Российского респираторного общества; Гл. ред. серии Чучалин А.Г.). В первой монографии фундаментальной серии Российского респираторно го общества обобщен накопленный мировой и отечественный опыт по всему кругу проблем, связанных с хронической обструктивной болезнью легких (ХОБЛ). Исчерпывающе представлены такие разделы, как эпидемиология, факторы риска, молекулярные основы развития заболевания, его системные эффекты, биологические маркеры, клинические проявления болезни, диа гностика и дифференциальная диагностика, исследование респираторной функции и визуализа ция, эмфизема легких, легочная гипертензия, обострения, качество жизни, лечение, вакцинация, реабилитация и др. Впервые освещаются ранее не исследованные вопросы, касающиеся феноти пов заболевания, а также сопутствующих заболеваний, которые наиболее часто встречаются у больных ХОБЛ, в частности сочетание ХОБЛ с артериальной гипертонией, ишемической болез нью сердца, сахарным диабетом второго типа. Особого внимания заслуживают те разделы моно графии, которые посвящены современным лечебным программам, изложенным с позиции меди цины доказательств, а также предоперационной подготовке больных ХОБЛ, страдающих много численными сопутствующими заболеваниями. 568 c., ил. Для пульмонологов, терапевтов, врачей общей практики, патофизиологов, клиницистов. Информацию по вопросам приобретения книг можно получить на сайте www.atmosphere%ph.ru или по телефону (499) 973%14%16. 42 Лечебное дело 1.2010