применение антипрогестинов для профилактики рецидивов
advertisement
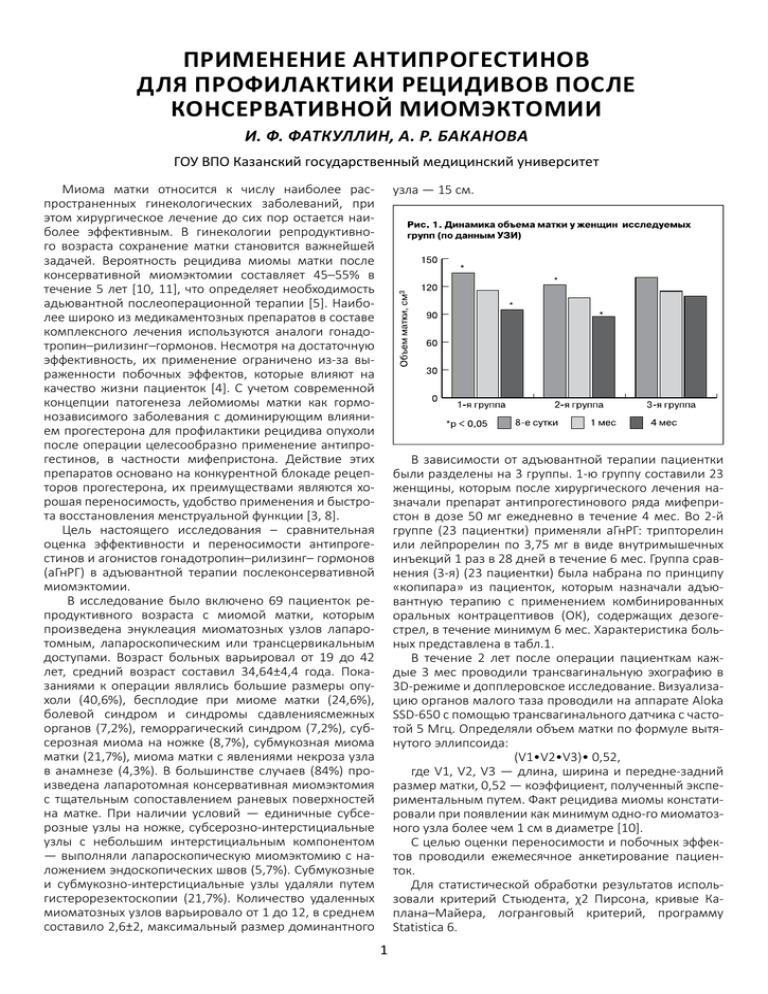
ПРИМЕНЕНИЕ АНТИПРОГЕСТИНОВ ДЛЯ ПРОФИЛАКТИКИ РЕЦИДИВОВ ПОСЛЕ КОНСЕРВАТИВНОЙ МИОМЭКТОМИИ И. Ф. ФАТКУЛЛИН, А. Р. БАКАНОВА ГОУ ВПО Казанский государственный медицинский университет Миома матки относится к числу наиболее распространенных гинекологических заболеваний, при этом хирургическое лечение до сих пор остается наиболее эффективным. В гинекологии репродуктивного возраста сохранение матки становится важнейшей задачей. Вероятность рецидива миомы матки после консервативной миомэктомии составляет 45–55% в течение 5 лет [10, 11], что определяет необходимость адьювантной послеоперационной терапии [5]. Наиболее широко из медикаментозных препаратов в составе комплексного лечения используются аналоги гонадотропин–рилизинг–гормонов. Несмотря на достаточную эффективность, их применение ограничено из-за выраженности побочных эффектов, которые влияют на качество жизни пациенток [4]. С учетом современной концепции патогенеза лейомиомы матки как гормонозависимого заболевания с доминирующим влиянием прогестерона для профилактики рецидива опухоли после операции целесообразно применение антипрогестинов, в частности мифепристона. Действие этих препаратов основано на конкурентной блокаде рецепторов прогестерона, их преимуществами являются хорошая переносимость, удобство применения и быстрота восстановления менструальной функции [3, 8]. Цель настоящего исследования ‒ сравнительная оценка эффективности и переносимости антипрогестинов и агонистов гонадотропин–рилизинг– гормонов (аГнРГ) в адъювантной терапии послеконсервативной миомэктомии. В исследование было включено 69 пациенток репродуктивного возраста с миомой матки, которым произведена энуклеация миоматозных узлов лапаротомным, лапароскопическим или трансцервикальным доступами. Возраст больных варьировал от 19 до 42 лет, средний возраст составил 34,64±4,4 года. Показаниями к операции являлись большие размеры опухоли (40,6%), бесплодие при миоме матки (24,6%), болевой синдром и синдромы сдавлениясмежных органов (7,2%), геморрагический синдром (7,2%), субсерозная миома на ножке (8,7%), субмукозная миома матки (21,7%), миома матки с явлениями некроза узла в анамнезе (4,3%). В большинстве случаев (84%) произведена лапаротомная консервативная миомэктомия с тщательным сопоставлением раневых поверхностей на матке. При наличии условий — единичные субсерозные узлы на ножке, субсерозно-интерстициальные узлы с небольшим интерстициальным компонентом — выполняли лапароскопическую миомэктомию с наложением эндоскопических швов (5,7%). Субмукозные и субмукозно-интерстициальные узлы удаляли путем гистерорезектоскопии (21,7%). Количество удаленных миоматозных узлов варьировало от 1 до 12, в среднем составило 2,6±2, максимальный размер доминантного узла — 15 см. В зависимости от адъювантной терапии пациентки были разделены на 3 группы. 1-ю группу составили 23 женщины, которым после хирургического лечения назначали препарат антипрогестинового ряда мифепристон в дозе 50 мг ежедневно в течение 4 мес. Во 2-й группе (23 пациентки) применяли аГнРГ: трипторелин или лейпрорелин по 3,75 мг в виде внутримышечных инъекций 1 раз в 28 дней в течение 6 мес. Группа сравнения (3-я) (23 пациентки) была набрана по принципу «копипара» из пациенток, которым назначали адъювантную терапию с применением комбинированных оральных контрацептивов (ОК), содержащих дезогестрел, в течение минимум 6 мес. Характеристика больных представлена в табл.1. В течение 2 лет после операции пациенткам каждые 3 мес проводили трансвагинальную эхографию в 3D-режиме и допплеровское исследование. Визуализацию органов малого таза проводили на аппарате Aloka SSD-650 с помощью трансвагинального датчика с частотой 5 Мгц. Определяли объем матки по формуле вытянутого эллипсоида: (V1•V2•V3)• 0,52, где V1, V2, V3 — длина, ширина и передне-задний размер матки, 0,52 — коэффициент, полученный экспериментальным путем. Факт рецидива миомы констатировали при появлении как минимум одно-го миоматозного узла более чем 1 см в диаметре [10]. С целью оценки переносимости и побочных эффектов проводили ежемесячное анкетирование пациенток. Для статистической обработки результатов использовали критерий Стьюдента, χ2 Пирсона, кривые Каплана–Майера, логранговый критерий, программу Statistica 6. 1 Табл. 1. Характеристика больных. Показатель Адъювантная терапия после операции Средний возраст, годы Средний объем матки, см3 Количество миоматозных узлов Средний диаметр доминантного узла, см 1-я Группа больных 2-я мифепристон 50 мг аГнРГ 34,3±4,1 321,2±85,2 35,2±3,4 298±75,4 3-я ОК, содержащие дезогестрел 35,78±3,1 345±75 2,7±2,9 2,5±2,5 2,1±1,2 7,33±1,28 8,1±1,43 7,9±2,16 Группы больных, включенных в исследование, были сопоставимы по полу, возрасту, объему матки и количеству миоматозных узлов (см. табл. 1). Достоверных различий по приведенным показателям в группах не обнаружено (p>0,05). Через 1 мес после операции объем матки, по данным ультразвукового исследования, уменьшился в одинаковой степени во всех трех группах в среднем на 14±2%. Через 4 мес дальнейшее уменьшение объемов матки наблюдалось только в 1-й и 2-й группах, в среднем на 28±1,6 и 29±2,2% соответственно (p<0,05) (рис. 1). В группе сравнения после завершения лечения объем матки оставался на уровне первого месяца после операции. В 1-й группе у 4 (17,4%) пациенток после курса терапии мифепристоном по данным УЗИ было обнаружено утолщение эндометрия более 16 мм. Основываясь на данных литературы, согласно которым препарат вызывает эстрогензависимые измене-ния в эндометрии [9], не ассоциированные с гиперплазией [6, 7], пациенток оставили под наблюдением до очередной менструации. В течение последующих циклов никаких ультразвуковых признаков изменений в эндометрии не обнаружено. Контроль эффективности адъювантной терапии проводили в течение 12–24 мес. Кумулятивная частота рецидива миомы в зависимости от вида терапии представлена на рис. 2. Как видно на рис. 2, кумулятивный процент рецидива в 1-й и 2-й группах был достоверно ниже, чем в 3-й группе (р Log-Rank = 0,02) в течение всего периода наблюдения. Появление новых миоматозных узлов, по данным ультразвукового исследования, обнаружено у 2 (8,6%) из 23 женщин как в 1-й, так и во 2-й группе. Вновь выявленные образования определялись через 12, 22 и 14, 24 мес после операции соответственно. В 3-й группе новые миоматозные узлы обнаружены у 7 (30,4%), в среднем через 6,5 мес после операции (р Log-Rank = 0,03). Маточная беременность самостоятельно наступила у 2 пациенток из 1-й группы и 3 — из 2-й группы. Из них в 4 случаях беременность завершилась родами путем кесарева сечения. В 1 случае произошел самопроизвольный выкидыш на сроке 14 нед. В контрольной группе случаев наступления беременности не было. Среди пациенток, принимавших после операции ОК, вновь возникшие миоматозные узлы обнаружены у 7 (30,4%), из них у 3 (13 %) в течение года после лечения возобновился геморрагический синдром. Одна пациентка была направлена на повторное оперативное лечение в связи с большими размерами опухоли (соответственно 13 нед беременности). Всего за двухлетний период наблюдения вновь возникшие миоматозные узлы выявлены у 12 (17,3%) из 69 оперированных женщин. У всех них до операции определялась множественная миома матки с преимущественно интерстициальным расположением миоматозных узлов. В 10 из 12 случаев при гистологическом исследовании макропрепарата определялась пролиферирующая миома. При этом, у пациенток, получавших адъювантную терапию аГнРГ или антипрогестинами, миоматозные узлы были достоверно меньшего диаметра и возникали через достоверно более длительный интервал времени (p<0,05). Таким образом, адъювантная терапия, хотя и не предотвращает полностью развитие рецидивов, но существенно снижает их частоту и увеличивает длительность ремиссии, представляя пациенткам возможность реализации репродуктивной функции. Клинический эффект мифепристона связан с инактивацией рецептора прогестерона. Синтетический стероид с антипрогестагенными свойствами обладает способностью к сильной связи с прогестероновыми рецепторами, а также слабой антиглюкокортикоидной и антиандрогенной активностью [8]. Блокада рецептора прогестерона тормозит гормональную стимуляцию роста опухоли, снижает митотическую активность миометрия, обусловленную действием прогестерона [2]. Другим возможным механизмом регрессии миомы матки под влиянием мифепристона является прямое 2 Табл. 2. Побочные эффекты адъювантной терапии мифепристоном, аГнРГ, ОК. Показатель 1-я абс. Приливы более 5 раз в сутки Сухость во влагалище, снижение либидо Утомляемость,снижение трудоспособности Нарушение сна (бессонница) Группа больных 2-я абс. % 17 73,4 % 0 3-я абс. % 0 1 4,34 10 43,4 2 8,7 8 34,8 9 39,1 5 21,7 1 4,34 10 43,4 Прибавка массы тела более 3 кг 5 21,7 0 8 34,8 Периодическое ощущение тошноты, рвоты Утолщение эндометрия более 16 мм (по данным УЗИ) после окончания терапии 2 8,7 0 5 21,7 4 17,3 0 антиангиогенное действие. Антипрогестин приводит к существенному уменьшению как содержания сосудистоэндотелиального фактора роста (СЭФР), так и экспрессии мРНК СЭФР в тканях миоматозных узлов [1]. Препарат оказывает минимальное влияние на гипофизарно-яичниковую систему, что объясняет его хорошую переносимость. Основной целью консервативно-пластических операций при миоме матки является восстановление фертильности. Высокая частота рецидива миомы после хирургического лечения снижает вероятность наступления беременности. Органосберегающее лечение миомы матки должно быть комплексным, сочетающим своевременное и бережное оперативное вмешательство и послеоперационную адъювантную терапию. Применение гинестрила (мифепристона 50 мг) в течение 4 мес после операции или аГнРГ в течение б мес достоверно снижает частоту рецидивов миомы матки. Объективной оценкой эффективности является отсутствие рецидивов, обратное развитие неудаленных узлов, уменьшение объемов матки и тенденция к нормализации кровотока в маточных артериях. C учетом лучшей переносимости и быстроты восстановления менструальной функции мифепристон является препаратом выбора для профилактики рецидивов после консервативной миомэктомии у женщин, планирующих беременность. 0 0 ванном лечении больных с лейомиомой матки// Aкуш. и гин. - 2006. -N° 1, npилoж. - C. 34-40. 5. Тихомиров А.Л., Лубнин Д.M. Оптимизация лечения больных миомой матки // Bonp. гинекол., акуш. и перинатол. - 2005. - N° 2. - C. 2-8. б. Buffet N.C., Meduri G. et al. Selective progesterone receptor modulators and progesterone antagonists: mechanisms of action and clinical applications // Human Reproduction Update. - 2005. N° 3. -P. 293-307. 7. Eisinger S.H., Fiscella J. et al. Open-label study of ultra low-dose mifepristone for the treatment of uterine leiomyomata//Eur.J.Obstet. Gynecol.Reprod.Biol. -2009. -N7. -P.215-218. 8. Heikinheimo O, Kekkonen R., Lahteenmaki P. The pharmacokinetics of mifepristone in humans reveal insights into differential mechanisms of antiprogestin action. //Contraception. - 2003. - N° 6. - P. 421-426. 9. Hanafi M. Predictors of Leiomyoma Recurrence After Myomectomy // Obstetrics & Gynecology. -2005. - Vol. 105 - N° 4. - P. 877-881. 10. Sachie N., Mayuko S., Kodo S. High Recurrence Rate of Uterine Fibroids on Transvaginal Ultrasound after Abdominal Myomectomy in Japanese Women // Gynecol. Obstet l nvest . -2006. - N° 6. -R 155-159. 11. Yoo E.H., Lee P.I. et al. Predictors of leiomyoma recurrence after laparoscopic myomectomy// J. of Minimally Invasive Gynecology. 2007. - Vol. 14, N° 6. - P. 690-697. Литература 1. Вихляева E.M., Савельева И.C., Городничева Ж.A. Возможности клинического применения антипрогестинов в акушерстве и гинекологии // Вопр. гинекол., акуш. и перинатол. - 2007. - N° 2. -С. 58-63. 2. Ланчинский B.И. Современные. представления об этиологии и патологии миомы матки // Вестн. гинекол. и перинатол. 2003. - N° 5-6. -С. 64-69. 3. Самойлова Т.Е., Аль-Сейкал Т.С. Перспективы применения мифепристона в лечении гормонально-зависимых заболеваний у женщин // Пробл. репродукции. -2004. -N4 6. - C. 35- 42. 4. Самойлова T.E. Перспективы применения аналогов рилизинг гормона, гонадотропинов и антигестагенов в комбиниро- 3 Інформація про лікарський засіб. Інформація для профессійної діяльності медичних і фармацевтичних працівників. ГІНЕСТРИЛ. Р.п. МОЗ України №UA/12929/01/01 від 18.05.2013р. Склад: міфепристону 50 мг; допоміжні речовини: целюлоза мікрокристалічна, натрію крохмальгліколят (тип А), тальк, кальцію стеарат. Фармакотерапевтична група: статеві гормони та засоби, які впливають на статеву сферу. Антигестагенні засоби. Показання для застосування: лікування лейоміоми матки (розміром до 12 тижнів вагітності). Протипоказання: вагітність, період годування груддю. Наявність в анамнезі підвищеної чутливості до міфепристону, надниркова недостатність та тривала глюкокортикостероїдна терапія, гостра та хронічна ниркова та/або печінкова недостатність, порфірія, анемія, порушення гемостазу (у тому числі попереднє лікування антикоагулянтами), запальні захворювання жіночих статевих органів, наявність тяжкої екстрагенітальної патології. Субмукозне розташування міоматозних вузлів. Розмір лейоміоми матки, що перевищує у розмірі 12 тижнів вагітності. Пухлини яєчників та/або гіперплазія ендометрія. З обережністю застосовують при хронічних обструктивних захворюваннях легенів (у тому числі бронхіальній астмі), тяжкій артеріальній гіпертензії, порушеннях ритму серця і серцевій недостатності, гострих запальних та інфекційних захворюваннях. Виробник: ЗАТ «Обнінська хіміко-фармацевтична компанія». Російська Федерація, 249036, Калузька обл., м. Обнінськ, вул. Корольова, буд. 4, тел./факс (48439) 6-47-41. Представництво "ТОВ "МИР-ФАРМ" в Україні: м. Київ, 01004, Печерський р-н, вул. Басейна, 21-А, оф. 4, тел.: (044) 287-70-21; 287-70-29. Повна інформація про лікарський засіб міститься в інструкціі до медичного 4 застосування препарату.