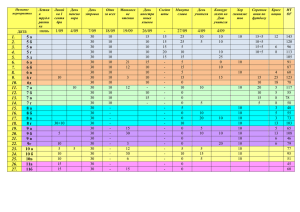
020583 B1 020583 B1 (11) 020583
advertisement

Евразийское патентное ведомство (19) (11) 020583 (13) B1 (12) ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ (45) Дата публикации и выдачи патента (51) Int. Cl. G01N 33/50 (2006.01) 2014.12.30 (21) Номер заявки 201171232 (22) Дата подачи заявки 2010.04.09 (54) СПОСОБ ПЕРЕНОСА ПОЛИПЕПТИДОВ В КЛЕТКИ B1 020583 (72) Изобретатель: (74) Представитель: (57) Изобретение относится к способу переноса полипептидов в клетки. Кроме того, заявленное изобретение относится к детекции специфических к полипептидам иммунных клеток и примированию, выращиванию и реактивации специфических к полипептиду Т-клеток. Помимо этого, заявленное изобретение относится к полипептидам, получаемым при помощи способов согласно заявленному изобретению, в комбинации с мочевиной и их применению в исследованиях, диагностике или лечении и профилактике заболеваний человека и животных. Барабас Саша, Эдмайер Катрин, Демль Людвиг (DE) Гончаров В.В. (BY) B1 (56) WO-A1-2008101680 WO-A2-03080792 BARABAS SASCHA ET AL.: "UreaMediated Cross-Presentation of Soluble Epstein-Barr Virus BZLF1 Protein". PLOS PATHOGENS, vol. 4, no. 11, November 2008 (2008-11), pages 1-10, XP002543139, the whole document, figure 1 ANONYMOUS: "Carbamylation of Proteins". IONSOURCE.COM, [Online], 17 February 2007 (2007-02-17), XP002543138, Retrieved from the Internet: URL:http://www.ionsource.com/Card/ carbam/carbam.htm> [retrieved on 2009-08-26], the whole document KRAUS L.M. ET AL.: "Carbamoylation of amino acids and proteins in uremia". KIDNEY INTERNATIONAL, SUPPLEMENT 2001 US, vol. 59, no. 78, 2001, pages S102-S107, XP002590326, ISSN: 0098-6577, pages S-102 US-A-5639854 DIRNHUBER P. ET AL.: "The isomeric transformation of urea into ammonium cyanate in aqueous solutions", BIOCHEMICAL JOURNAL, THE BIOCHEMICAL SOCIETY, LONDON, GB, vol. 42, no. 4, 1 January 1948 (1948-01-01), pages 628-632, XP009135697, ISSN: 0264-6021 * abstract 020583 (31) 09157777.5 (32) 2009.04.09 (33) EP (43) 2012.05.30 (86) PCT/EP2010/054711 (87) WO 2010/115984 2010.10.14 (71)(73) Заявитель и патентовладелец: ЛОФИУС БИОСАЙЕНСЕЗ ГМБХ (DE) 020583 Изобретение относится к способу переноса полипептидов в клетки. Помимо этого, заявленное изобретение относится к детекции специфических к полипептидам иммуноцитов и примированию, выращиванию и реактивации специфических к полипептиду Т-лимфоцитов (ЦТЛ). Кроме того, заявленное изобретение относится к полипептидам, получаемым при помощи способов согласно заявленному изобретению, в комбинации с мочевиной и их применению в исследованиях, диагностике или лечении и профилактике заболеваний человека и животных. Описываемая область иммунной системы включает гуморальную (иммуноглобулины) и клеточную иммунную защиту. Клеточные и микробные полипептиды получают при помощи процессинга антигенпрезентирующих клеток (АПК) путем специфического расщепления, фрагменты (эпитопы) которого получают вместе с МНС (ГКГ) молекулами класса I и/или класса II на поверхности клетки. При помощи своего рецептора, улавливающего Т-лимфоциты (Т-клетки), Т-лимфоциты целенаправленно узнают эпитопы, презентированные в комплексе с ГКГ белками и вступают с ними в иммунную реакцию. Т-лимфоциты можно подразделить на различные эффекторные популяции с использованием специфических поверхностных белков. CD4+ Т-клетки (Т-хелпер-клетки) узнают пептиды, которые презентированы на поверхности АПК вместе с белками ГКГ класса II, и играют существенную роль в управлении и поляризации иммунной защиты. Т-хелпер-клетки можно разделить на подклассы клеток Тхелперов типа 1 (Th-1), Т-хелперов типа 2 (Th-2) и Т-хелперов типа 17 (Th-17). Th-1 клетки характеризуются воспроизводством цитокинов IFN-γ и TNF-α и экспрессией фактора транскрипции T-bet. Th-1 клетки активируют клеточные иммунные ответы путем увеличения эффективности уничтожения у макрофагов и стимуляции пролиферации цитотоксических CD8+ Т-клеток (цитотоксические Т-клетки (ЦТЛ, CTL) или CD4-CD8+ Т-клетки). Th-2 клетки характеризуются секрецией IL-4, IL-5, IL-6, IL-10 и IL-13 и продуцированием фактора транскрипции GATA-3 и суппортом воспроизводства антител, а также переключением класса антител (гуморальная составляющая иммунного ответа). Th-17 клетки характеризуются продуцированием IL-17 и, по всей видимости, играют ключевую роль в аутоиммунных заболеваниях. Кроме того, Th-1, Th-2 и Th-17 клетки, а популяция CD4+ T-клеток включает примерно 10% регуляторных Т-лимфоцитов, играют существенную роль в ослаблении иммунного ответа, в предотвращении аутоиммунных заболеваний и в оральной толерантности. Регуляторные Т-лимфоциты можно подразделить на CD4-, CD25- и ЦТЛА4-позитивные натуральные регуляторные Т-лимфоциты (Treg), а также на Th3 и Tr1 лимфоциты, которые характеризуются продуцированием (воспроизводством) TGF-β (Th3 лимфоцитов) или IL-10 (Tr1 лимфоцитов). Важное значение CD8+ Т-лимфоцитов заключается в распознавании и уничтожении дегенеративных, опухолевых и раковых клеток, а также ткани и клеток, которые инфицированы микроорганизмами или паразитами. Т-лимфоциты, таким образом, выполняют важную функцию защитного механизма приобретенной иммунной системы для предотвращения и контроля над заболеваниями, вызванными микробами и, в особенности, вирусами, и для распознавания и уничтожения дегенеративных и опухолевых клеток. В дополнение к вышеупомянутым популяциям Т-лимфоцитов описаны другие субпопуляции циркулирующих Т-клеток, имеющих двойной позитивный CD4+CD8+ фенотип (например, CD4+CD8dim, CD4dimCD8bright и CD4hiCD8hi T-клетки). CD4+CD8dim Т-клетки экспрессируют CD8αα гомодимеры и могут быть подвергнуты детекции с меньшей частотой (менее чем 2% от общего объема популяции CD3+ Т-клеток) в крови. Наблюдали транзиентную или персистирующую экспансию CD4+CD8dim Т-клеток как у здоровых пациентов, так и у пациентов с различными заболеваниями, включая инфекции, вызванные различными вирусами, например вирусом иммунодефицита человека 1 типа (HTV-1) и вирусом человеческого цитомегаловируса (ЦМВ), а также у пациентов с различными аутоиммунными заболеваниями. CD4dimCD8bright Т-клетки представляют собой активированный фенотип CD8+ Т-клеток, как определено повышенным уровнем содержания активационных и функциональных маркеров (CD95, CD25, CD38, CD69, CD28 и CD45RA+ CD45RA0+) по сравнению с их CD4-CD8+ аналогами. CD4hiCD8hi Т-клетки экспрессируют высокие уровни содержания CD4 молекул и CD8αβ цепей и повышаются при аутоиммунном ответе. АПК с каноническими функциями (иммунные АПК), такие, как дендритные клетки, моноциты, макрофаги, а также неиммунные АПК, как, например, В-клетки, нейтрофилы и фибробласты (десмоциты), играют центральную роль как в запуске (триггеринге) реакции Т-клетки на экзогенные и эндогенные иммуногены и в индукции толерантности Т-клетки по отношению к эндогенной ткани. Активация и пролиферация Т-клеток протекает при симультанном запуске двух сигналов. Первый сигнал проводится в Тклетку рецептором Т-клетки, который распознает эпитоп совместно с ГКГ на поверхности АПК. Второй костимулирующий сигнал опосредуется специфическим взаимодействием костимулирующих молекул, как, например, В7.1 (CD80) или В7.2 (CD86) на АПК с релевантным рецептором (как, например, CD28) на поверхности Т-клетки. В отсутствие костимулирующего сигнала эпитопспецифическая Т-клетка становится анергической (с подавленным иммунитетом). Анергия характеризует состояние, при котором Т-клетки теряют способность к размножению и реакции на антиген. Состояние полипептида однозначно определяет эффективность и путь процессинга эпитопа и появ-1- 020583 ление посредством АПК. Дополнительно, степень активации АПК и, соответственно, течение индуцированного иммунного ответа испытывают адверсивное влияние в зависимости от лекарственной формы полипептида. Таким образом, концентрация и биохимические свойства полипептида, а также присутствие или отсутствие иммуномодулирующих веществ (в особенности, бактериальных компонентов, таких, как нуклеиновые кислоты (например, CpG-позитивные ДНК), липополисахаридов (ЛПС) и полипептидов (например, e.g. flagellin), а также цитокинов (например, IL-4, IL-5, IL-10, IL-12, IFN-γ, IL-18, IL-23) оказывают определяющее значение, будет ли активирована клеточная (опосредованный Т-хелпером-1 (Th1)-тип иммунного ответа) или гуморальная (опосредованный Т-хелпером-2 (Th-2)-тип иммунного ответа) составляющая иммунной системы или же иммунный ответ пойдет по толерогенному пути. До настоящего времени описано всего лишь небольшое количество способов транслокации экзогенных полипептидов в клетки млекопитающих. Более того, описано только совсем незначительное число способов транслокации экзогенных полипептидов в ГКГ классе I пути процессинга АПК. К настоящему времени для переноса белков в клетки с тем или иным успехом применяли, например, механические способы микроинъекций, электропорации и липофекции. Прочие способы переноса полипептидов в клетки основаны на использовании белковых трансдукционных доменов (PTD). Аминокислотные последовательности, богатые аргинином, содержащие от 10 до 35 аминокислот, происходят, например, из белков HIV Tat, вируса простого герпеса (HSV) VP22 или гомеобелка сложного локуса, в котором локализованы гомеозисные мутации дрозофил (Antp). В дополнение определили синтетические PTD последовательности методом фаговых библиотек. Значительного увеличения мембранной распространенности и транслокации полипептидов можно достичь путем сопряжения оных с PTD. Описаны другие способы переноса белков в клетки, основанные на использовании различных катионно-липидных композиций или включении полипептидов в частицы ISCOM (CSL Limited, Victoria, Australia). Все упомянутые способы чрезвычайно затратны в трудо- и финансовом аспектах при рутинном применении. Помимо этого, многие частные случаи практического воплощения системы переноса обладают цитотоксическими (например, липосомы) или иммуномодулирующими свойствами (частицы ISCOM), которые могут, в конечном итоге, оказывать адверсивное влияние на естественные свойства обрабатываемых клеток. Принимая во внимание исключительное значение клеточного иммунного ответа, в особенности, цитотоксических Т-клеток (ЦТЛ), при контроле над микробными инфекциями и опухолями, в настоящее время проходят апробацию множество новых технологий примирования ЦТЛ in vivo, в дополнение к Тхелпер-клеткам. Данные технологии включают использование пептидов, полипептидов, белков, вирусоподобных частиц, живых ослабленных бактерий и вирусов, рекомбинантных живых вакцин (на основе различных рекомбинантных бактерий и вирусов) и ДНК вакцин. Кроме того, обработанные ex vivo аутогенные АПК, которые представляют специфические пептиды в контексте с ГКГ белками классов I и II, являются подходящим реагентом для индукции специфических к полипептидам иммунных ответов, в особенности, в терапевтическом лечении. На ранних стадиях была доказана эффективность применения АПК, обработанных в пульсирующем поле с опухолевыми извлечениями, клеточные лизаты, экспрессионные плазмиды и иРНК, для симультанной индукции CD4+ и CD8+ Т-клеточных ответов (Herr et al. (2000), Blood, 96:1857). Более того, в ЕР 0421949 В1 описано, что химически модифицированные аллергены, предварительно обработанные цианатами щелочных металлов, можно применять для индукции специфических антител класса IgG. В настоящее время существуют различные способы стимуляции различных популяций иммунных клеток, которые эффективны в различной степени для детекции специфических популяций антигенспецифических иммунных клеток. Прямая загрузка мембраносвязанных ГКГ белков с пептидами определенной длины (оптимально, 812 аминокислот для загрузки ГКГ белков класса I и оптимально от 16 до 22 аминокислот для загрузки ГКГ белков класса II) представляет собой способ, часто используемый для стимуляции определенных популяций иммунных клеток, в особенности CD8+ Т-клетки и CD4+ Т-клетки. В дополнение, 14-16мерные пептиды можно использовать для симультанной активации CD4+ и CD8+ Т-клеток. Тем не менее, существуют значительные ограничения на применение данного способа стимуляции для измерения белок-специфических Т-клеток, заключающиеся в том, что специфическое распознавание эпитопов Тклеток подвержено влиянию (зависит) рестрикции ГКГ; т.е. пациенты, организм которых экспрессирует различные ГКГ белки, обладают свойством распознавания различных эпитопов в пределах полипептида, что значительно усложняет проведение анализа полипептид-специфических Т-клеток в крови доноров с вариабельными ГКГ структурами. Кроме того, пептиды различного размера (от 8- до 12- и от 18- до 22-мерных) преимущественно представлены на ГКГ белках класса I или II. Таким образом, только Т-клетки, которые направлены против известных эпитопов в контексте с определенными ГКГ белками, можно специфически регистрировать, применяя данный способ. Альтернативно, пептидные пулы (например, 14-16-мерные пептиды, перекрывающиеся в 13 амино-2- 020583 кислотах), разматывающие весь белок, можно использовать для симультанной детекции специфических к белкам Т-клеток. Тем не менее, воспроизводство пулов перекрывающихся пептидов, охватывающие все белки, является дорогостоящим и затратным процессом. Кроме того, применение многих пептидов, включая известные эпитопы Т-клеток, ограничено низким потенциалом активации Т-клеток. Здесь, эффективность активации Т-клеток ГКГ/пептидными комплексами зависит от (i) аффинности пептида к молекуле ГКГ, (ii) стабильности пептидно-ГКГ комплексов и (iii) аффинности Т-клеточного рецептора к ГКГ/пептидным комплексам. Однако описан только один способ повышения эффективности эпитопов для стимуляции Т-клеток. Петерсоном (Peterson) и соавторами опубликовано подтверждение того факта, что фосфорилированные, HLA А2-рестриктированные ЦТЛ эпитопы показывают измененную емкость по отношению к стимулированным ЦТЛ, по сравнению с их нефосфорилированными аналогами (Petersen et al. (2009), PNAS 106: 2776-2781). В отличие от этого растворимые полипептиды и белки подходят для детекции полипептидспецифических CD4 Т-клеток, вне зависимости от ГКГ рестрикции донора и наличия данных о детальной локализации Т-клетки в полипептиде. Растворимые полипептиды практически полностью поглощаются (оттягиваются) и восстанавливаются посредством процессинга ГКГ класса II и пути представления в АПК таким образом, что данный способ практически монопольно применим для детекции CD4+ Тклеток. Более того, также описаны различные способы денатурации полипептидов, которые позволяют поставлять (переводить) данные полипептиды в процессинг и путь представления ГКГ класса I и ГКГ класса II. Данные способы включают, например, обработку полипептидов термическим способом или с использованием додецилсульфата натрия (SDS). Данные способы апробированы для достижения представления эпитопа на молекулах ГКГ классов I и II в АПК мышей (Schirmbeck et al. (1994), Eur. J. Immunol, 24:2068); (Schirmbeck et al. (1995), Vaccine, 13:857). В упомянутых исследованиях было доказано, что белки, денатурированные различными способами, оттягиваются в АПК посредством различных механизмов и различаются по своей эффективности индуцирования полипептидной загрузки молекул ГКГ класса I. Таким образом, в сравнении с ДСН-обработанными белками, полипептиды, обработанные при помощи способа термоинактивации (1 ч при 60°С или 15 мин при 100°С), всего лишь индуцировали незначительную стимуляцию представления эпитопов на белках ГКГ класса I в обработанных АПК мышей. С другой стороны, способ денатурации с использованием ДСН доказал свою низкую эффективность для применения в культурах клеток человека вследствие высокой токсичности. Другой способ предварительной обработки полипептидов описан в ЕР 1487497 В1, при котором полипептиды предварительно обрабатывают с использованием мочевины. Другой способ стимуляции представления эпитопов ГКГ классов I и II основан на инкорпорации полипептидов в определенные структуры, например липосомы, субстанции определенных носителей, вирусоподобные или липопротеиновые частицы. Первые исследования подтвердили применимость HTV1 Pr55gag вирусоподобных частиц в диагностике CD4+ и CD8+ Т-клеток (Sester et al. (2000), AIDS, 14:2653-60). Тем не менее, воспроизводство частицесвязанных полипептидов является высокозатратным. Другим способом стимуляции представления эпитопов ГКГ классов I и II на АПК основан на инкорпорации полинуклеотидов, кодирующих требуемые плипептиды с использованием плазмид, невирусных и вирусных векторов. Недостатком использования плазмид в диагностических целях является низкая эффективность и цитотоксический эффект переноса нуклеиновой кислоты в АПК с использованием существующих на данный момент способов трансфекции, например электропорации или липофекции. Вирусные или бактериальные векторы зачастую обладают значительно повышенной интенсивностью трансфекции АПК в сравнении с плазмидами. Тем не менее, данные системы переноса генов зачастую не обладают иммунологической инертностью и модулируют способность АПК к процессингу (обработке) эпитопов и представлению полипептидов. Дополнительно, применение данных способов, основанных на использовании нуклеиновых кислот, ограничено высокими затратами на получение (воспроизводство) генных носителей. На настоящий момент CD4+ Т-клетки можно детектировать путем детерминации пролиферации клеток или мессенджерных субстанций (цитокинов), воспроизводимых Т-клетками после специфической стимуляции. Пролиферация клеток обычно детектируется с использованием традиционного, меченного тритием тимидина (3H-TdR), теста на инкорпорацию или теста на пролиферацию без использования радиомечения, как, например, энзимсвязанный иммуносорбентный метод исследования (ELISA) с 5-бром2-дезоксиуридином, анализ на планшете с тетразолием и анализ с кислой фосфатазой. Производство цитокинов из CD4+ Т-клеток после специфической стимуляции с полипептидами можно детерминировать посредством анализа ELISA с цитокинами, анализа ELISPOT или посредством технологии FACS путем определения (детерминации) межклеточных цитокинов (например, окрашивание при помощи межклеточных цитокинов) или секретированных цитокинов (например, секреционный анализ FACS). CD8+ Т-клетки традиционно детектируют посредством детерминации их специфической цитотоксической активности или мессенджерных субстанций (цитокинов), полученных CD8+ Т-клетками после -3- 020583 специфической стимуляции, в особенности, интерферона-γ (IFN-γ). Цитотоксичность обычно детектируют посредством классического теста высвобождения классического хрома или адекватного нерадиоактивного способа, при котором измеряют высвобождение энзимов или АТР из таргетных клеток как результат специфического лизиса эффекторной клетки с цитотоксическими свойствами. Альтернативно, цитотоксическую активность CD8+ Т-клеток можно измерить детерминацией транзиентной поверхностной экспрессии CD107a,b (LAMP 1,2 белки). Производство цитокинов из CD8+ Т-клеток после эпитоп-специфической стимуляции можно определить посредством энзимсвязанного иммуносорбентного анализа (ELISA) с цитокинами, иммуноферментного спот-анализа (ELISPOT) или с использованием анализа флуоресцентной сортировки клеток (FACS) посредством детерминации межмолекулярных цитокинов или секретированных цитокинов (секреционный анализ FACS). IFN-γ, TNF и IL-2 обычно применяют в качестве маркерных цитокинов для представления полипептид-специфических CD8+ Т-клеток. К настоящему времени аутологичные АПК, которые представляют эпитопы CD8+ Т-клеток в связке с ГКГ белками класса I на их поверхности, применяли, например, для стимуляции эпитоп- или полипептид-специфических CD8+ Т-клеток. К настоящему времени индукцию ГКГ класса I, опосредованную представлением эпитопа на АПК, в свою очередь, опосредовали инкубацией данного процесса эпитоп-несущими пептидами требуемой длины (от 8 до 16 аминокислот), инкубацией липополипептидами, в частности полипептидами или полипептидами, упакованными в специальные структуры, лизаты или полипептид-производящие клетки, а также рекомбинантные и живые аттенуированные микроогранизмы, в особенности вирусы или бактерии. Технологии Тетрамер (Coulter), Пентамер (Proimmune) и Стрептамер (IBA, Gottingen) являются способами детекции эпитоп-специфических CD8+ Т-клеток и CD4+ Т-клеток. Тем не менее, ограничения, препятствующие широкому внедрению данных способов для диагностики Т-клеток, связаны с крайне высокими затратами на производство данных реагентов. К тому же, тетрамеры, пентамеры и стрептамеры на настоящий момент применяют только в ограниченном ассортименте ГКГ типов, в особенности, для часто встречающихся белков ГКГ класса I, например HLA A2. Дополнительно, данная технология всего лишь позволяет проводить детекцию определенных эпитоп-специфических Т-клеток. Реакции Тклетки по отношению к множественным эпитопам можно определить только используя данный способ при значительных временных и финансовых затратах. Таким образом, целью заявленного изобретения является новый способ переноса полипептидов в клетки. Данную цель достигают практическим воплощением предмета изобретения, раскрытого в формуле заявленного изобретения. Объяснению сути заявленного изобретения служат следующие фигуры. Фиг. 1 представляет механизм реакции на карбамилирование первичных аминов. (А) Мочевина находится в равновесии с аммонием и цианатом. Воздействие тепла и/или времени склоняют течение реакции к расщеплению мочевины, вызывая накопление циановой кислоты. (Б) При показателе рН от нейтрального до основного циановая кислота подвергается нуклеофильной атаке первичных аминов, образующих карбамилированный амин, как следует из процесса карбамилирования белков, при котором в особенности N-конец, но также и лизины в общем и другие аминокислоты белка подвергаются карбамилированию (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). Фиг. 2 представляет аккумуляцию цианата в растворах мочевины, хранящихся при низкой температуре. Кривые А, В и С - 6,66, 3,33, и 1,11 М мочевины соответственно, выдерживают при 25°С, кривая D - 6,66 М мочевины выдерживают при 5°С (Marier et al. (1964), Analytical Biochemistry 7:304). Фиг. 3 представляет аккумуляцию цианата и соответствующие изменения в 6,66 М мочевины при 85°С (Marier et al. (1964), Analytical Biochemistry 7:304). Фиг. 4 представляет изменения в концентрации цианата в 6,66 М мочевины при 25°С. Кривая А повторное равновесие подогретого раствора (например, 85°С, 50 мин). Кривая В - прямое равновесие (Marier et al. (1964), Analytical Biochemistry 7:304). Фиг. 5 представляет изменения в концентрации цианата в 8 М мочевины, выдерживаемой при -40°С, при 4 и 25°С (Christison et al., Direct Determination of Cyanate in a Urea Solution and a Urea Containing Protein Buffer Using a Reagent-Free Ion Chromatography System", Dionex (www.dionex.com)). Фиг. 6 иллюстрирует подтверждение факта, что нагревание полипептидов в растворе 2 М мочевины (конечная концентрация) приводит к измененному миграционному поведению белков в полиакриламидных гелях. (А) 0,84 мг/мл HTV капсидного белка р24 (растворенного в 150 мМ NaCl, 50 мМ NaP, pH 7,6), (В) 1 мг/мл бычьего сывороточного альбумина (БСА) или (С) 0,64 мг/мл частиц парвовируса В19 VP2 (растворенного в 38% (по весу) CsCl) смешали 1:1:1 (объем/объем/объем) с (B,D,E) H2O и 30 мМ Tris pH 3,9 или (A,C,F) 6 М раствора мочевины и 30 мМ Tris pH 3,9, затем инкубировали в течение 60 мин при 96°С в термомиксере. Затем, белки подвергли сепарации при помощи электрофореза в (А) 12,5% или (В,С) 10% ДСН-полиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: маркеры молекулярного веса (А, В): Colour Plus предварительно окрашенный маркерный белок, широкий спектр NEB P7703; (С): предварительно окрашенный маркерный белок, ши-4- 020583 рокий спектр NEB P7703. Размеры указаны в килодальтонах (кДа). Фиг. 7 иллюстрирует подтверждение факта, что обработка с мочевиной в соответствии с различными протоколами карбамилирования приводит к образованию модифицированных белков бычьего сывороточного альбумина, с увеличенным молекулярным весом, что подтверждено измененной миграцией в полиакриламидных гелях. 1 мг/мл БСА смешали 1:1:1 (объем/объем/объем) с (А) Н2О/HCl (рН 3,6) и 30 мМ трис рН 3,6 или (B, C) 6 М раствора мочевины и 30 мМ трис рН 3,6, инкубировали (А) в течение 0 мин при 96°С или (В) 30 мин при 96°С, или (С) 60 мин при 96°С. (D) БСА обработали в соответствии с протоколом карбамилирования белка, описанным Angel и соавторами (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). 10 нМ БСА растворили в 100 мкл 8 М раствора мочевины/200 мМ трис-HCl, рН 7,4. Данный раствор восстановили с 20 мМ дитиотреитола (ДТТ) в течение 2 ч при 50°С, с последующим карбамидометилированием с 45 мМ иодоацетамида (ИДА) при комнатной температуре в течение 1 ч. Раствор денатурированных, восстановленных алкилированных белков разбавили 1:8 с 50 мМ бикарбоната аммония для коррекции концентрации мочевины до 1 М и инкубировали в течение ночного времени суток при 37°С. (Е) ВСА обработали в соответствии с описанием (D). Затем, раствор просушили под вакуумом при 37°С и растворили в 300 мкл 8 М мочевины/200 мМ трис-HCl, рН 8,5. Затем, образец перемешали на вортексе до полного растворения и затем инкубировали в течение 4 ч при 80°С, с периодическим перемешиванием на вортексе (согласно Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). Затем, белки подвергли сепарации с использованием электрофореза в 10% ДСН-полиакриламидном геле (PAGE) и визуализировали окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7702. Размеры указаны в кДа. Фиг. 8 иллюстрирует подтверждение факта, что обработка БСА с мочевиной в соответствии с различными протоколами карбамилирования приводит к образованию модифицированных БСА белков, что подтверждено измененным значением pKi, как показано на примере двумерного электрофореза. 1 мг/мл БСА смешали 1:1:1 (объем/объем/объем) с (А) Н2О/HCl (рН 3,6) и 30 мМ трис рН 3,6 или (В, С) с 6 М раствора мочевины и 30 мМ трис рН 3,6 и инкубировали в течение для (А) 0 мин (В) 30 мин или (С) 60 мин при 96°С. (D) БСА обработали в соответствии с протоколом карбамилирования белка, описанным Angel и соавторами (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). 10 нМ БСА растворили в 100 мкл 8 M мочевины/200 мМ трис-HCl, рН 7,4. Данный раствор восстановили с 20 мМ дитиотреитола (ДТТ) в течение 2 ч при 50°С, с последующим карбамилометилированием с 45 мМ иодоацетамида (ИДА) при комнатной температуре в течение 1 ч. Раствор денатурированных, восстановленных алкилированных белков разбавили 1:8 с 50 мМ бикарбоната аммония для коррекции концентрации мочевины до 1 М и инкубировали в течение ночного времени суток при 37°С. Затем белки подвергли сепарации при помощи изоэлектрического фокусирования на ИЭФ полосках (Immobiline DryStrip рН 3-10, 11 см, GE Healthcare) при 26350 Vh, с последующим электрофорезом в 10% ДСН-полиакриламидном геле (PAGE). Белки визуализировали при помощи окрашивания серебром. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7702. Размеры указаны в кДа. Фиг. 9 иллюстрирует подтверждение факта, что на модификацию БСА путем обработки с 2 М мочевины, 10 мМ трис (инкубация в течение 2 ч при 96°С) не оказывает существенного влияния значение рН в диапазоне от 3,9 до 8,7. 1 мг/мл БСА смешали 1:1:1 (объем/объем/объем) с (А-С) 6 М мочевины и (А) 30 мМ трис рН 3,9, или (В) 30 мМ трис рН 6,8, или (С) 30 мМ трис рН 8,7, или (D-F) Н2О и (D) 30 мМ трис рН 3,9, или (Е) 30 мМ трис рН 6,8, или (F) 30 мМ трис рН 8,7 и затем инкубировали в течение 2 ч при 96°С в термомиксере (300 об/мин). Затем, белки сепарировали (разделили) при помощи электрофореза в 10% ДСН-полиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7702. Размеры указаны в кДа. Фиг. 10 иллюстрирует подтверждение факта, что эффективность модификации БСА с мочевиной зависит от времени инкубации. (А) 1 мг/мл бычьего сывороточного альбумина (БСА) смешали 1:1:1 (объем/объем/объем) с 6 М мочевины и 30 мМ трис рН 3,9 и инкубировали при 96°С в течение предписанного времени инкубации (от 0 до 60 мин). (В) 1 мг/мл бычьего сывороточного альбумина (БСА) смешали 1:1:1 (объем/объем/объем) с 6 М мочевины и 30 мМ трис рН 3,9 и инкубировали при 96°С в течение предписанного времени инкубации (от 0 до 8 ч). Затем, белки сепарировали (разделили) при помощи электрофореза в 10% ДСН-полиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7702. Размеры указаны в кДа. Фиг. 11 иллюстрирует подтверждение факта, что эффективность модификации БСА с мочевиной зависит от температуры. 1 мг/мл бычьего сывороточного альбумина (БСА) в Н2О смешали 1:1:1 (объем/объем/объем) с 6 М мочевины и 30 мМ трис рН 3,9 (дорожка A-L) и инкубировали в течение 2 ч при заданных температурах (от 0 до 96°С). Затем, белки сепарировали (разделили) при помощи электрофореза в 10% ДСН-полиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7702. Размеры указаны в кДа. -5- 020583 Фиг. 12 иллюстрирует подтверждение факта, что обработка белка IE1 цитомегаловируса (ЦМВ) человека с осажденной мочевиной (от 7 до 14 дней при комнатной температуре, с последующим нагревом в течение более чем 1 ч при 96°С) приводит к образованию модифицированных IE1 белков, что подтверждено измененным значением pKi, как показано на примере двумерного электрофореза. (А) Либо 100 мкл белка IE1 (0,89 мкг/мл в ФСБ) или (В) IE1 в ФСБ, смешанном 1:1 (об./об.) с 8 М осажденной мочевины (нагретой в течение более 1 ч при 96°С, затем выдержанной в течение от 7 до 14 дней при комнатной температуре) инкубировали в течение ночного времени суток при 40°С. Затем белки подвергли сепарации при помощи изоэлектрического фокусирования на ИЭФ полосках (рН 3-10, линейные) при 38300 Vh, с последующим электрофорезом в 10% ДСН-полиакриламидном геле (PAGE). Белки визуализировали при помощи окрашивания серебром. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7703. Размеры указаны в кДа. Фиг. 13 представляет результаты масс-спектрометрического анализа с использованием времяпролетной ионизации лазерной десорбцией, необработанных БСА и БСА, обработанных с осажденной мочевиной. Получены спектры (А) немодифицированных БСА; сдвоенно-изотопическая протонированная масса 33230.3 и (В) БСА после смешивания (1:1; об./об.) с осажденной мочевиной 8 М (от 7 до 14 дней при комнатной температуре, с последующим нагревом в течение более 1 ч при 96°С); сдвоенноизотопическая протонированная масса 33497. Таким образом, при упомянутых условиях проведения опыта, обработка мочевиной ВСА индуцировала сдвиг массы на 226,7 Да. Фиг. 14 иллюстрирует подтверждение факта, что температура инкубации и время предварительного нагрева мочевины являются критическими факторами для эффективности индуцированной мочевиной модификации БСА. 1 мг/мл БСА в Н2О смешали 1:1 (об./об.) с либо (A, C, E, G) свежеприготовленного 4 М раствора мочевины или (B, D, F, H) 4 М мочевины, который был предварительно нагрет в течение 1 ч при 96°С и затем быстро охлажден. Затем образцы инкубировали в течение для (А, В) 0 ч, (C, D) 2 ч, (E, F) 4 ч или (G, H) 17 ч при 40°С в термомиксере (при 300 об/мин). Затем белки сепарировали при помощи электрофореза в 10% ДСН-полиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7703. Размеры указаны в кДа. Фиг. 15 иллюстрирует подтверждение факта, что инкубация с осажденной мочевиной в течение 24 ч при 40°С индуцирует сдвиг массы у БСА. 1 мг/мл БСА в Н2О смешали 1:1 (об./об.) с осажденной мочевиной 4 М (которую предварительно нагрели в течение 1 ч при 96°С и затем инкубировали в течение 8 дней при комнатной температуре) и инкубировали в течение рекомендованных временных промежутков (от 0 до 24 ч) при 40°С. Затем белки сепарировали при помощи электрофореза в 10% ДСНполиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7703. Размеры указаны в кДа. Фиг. 16 иллюстрирует подтверждение факта, что обработка БСА с мочевиной в соответствии с различными протоколами карбамилирования приводит к образованию модифицированных БСА белков, что подтверждено измененным значением pKi, как показано на примере двумерного электрофореза. 1 мг/мл БСА смешали 1:1:1 (объем/объем/объем) с (А) Н2О/HCl (рН 3,6) и 30 мМ трис рН 3,6 или (В, С) с 6 М раствора мочевины и 30 мМ трис рН 3,6 и инкубировали в течение для (А) 0 мин (В) 30 мин или (С) 60 мин при 96°С. (D) Альтернативно, 10 мМ БСА смешали 1:1 (об./об.) с 4 М осажденной мочевины (нагрев в течение 1 ч при 96°С, затем выдерживание в течение 3 месяцев при комнатной температуре) и инкубировали в течение 20 ч при температуре 40°С. Затем белки подвергли сепарации при помощи изоэлектрического фокусирования на ИЭФ полосках при примерно (A-D) 26350 Vh, с последующим электрофорезом в 10% ДСН-полиакриламидном геле (PAGE). Белки визуализировали при помощи окрашивания серебром. Размеры стандартов белков указаны в килодальтонах (кДа). Фиг. 17 иллюстрирует результаты опыта по химическому карбамилированию БСА с цианатом калия (цианово-кислым калием). БСА (1 мг/мл в воде) смешали 1:1 (об./об.) в течение 1 ч при 40°С в термомиксере с цианово-кислым калием при конечной концентрации (А) 0 мМ, (В) 25 мМ, (С) 100 мМ, (D) 500 мМ и (Е) 1000 мМ. Продукты реакции сепарировали при помощи электрофореза в 10% ДСНполиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: предварительно окрашенный маркерный белок, широкий спектр NEB P7702. Размеры указаны в кДа. Фиг. 18 иллюстрирует результаты опыта по химическому карбамилированию БСА с цианатом калия (цианово-кислым калием). БСА (1 мг/мл в воде) смешали 1:1 (об./об.) с возрастающей концентрацией водных растворов цианово-кислого калия (конечная концентрация KOCN: (А) 0 мМ, (В) 1 мМ, (С) 5 мМ, (D) 10 мМ, (Е) 20 мМ, (F) 50 мМ, (G) 100 мМ, (Н) 200 мМ, (J) 500 мМ. Затем, белки инкубировали в течение 19,5 ч при 40°С в термомиксере с последующей сепарацией при помощи электрофореза в 10% ДСН-полиакриламидном геле (PAGE) и визуализировали белки окрашиванием кумасси бриллиантовым голубым. М: маркер молекулярного веса (предварительно окрашенный маркерный белок, широкий спектр (NEB P7708)). Размеры указаны в кДа. -6- 020583 Фиг. 19 представляет аффинную очистку белков IE1 цитомегаловируса человека от лизатов pGEXKG-IE1 трансфицированных бактерий (M15[pREP4]). Образцы, полученные в результате выполнения указанных этапов очистки, сепарировали при помощи электрофореза в 12,5% ДСН-полиакриламидном геле (PAGE) и визуализировали окрашиванием кумасси бриллиантовым голубым. Маркер: предварительно окрашенный маркерный белок, широкий спектр (Biolabs; NEB7703), Размеры указаны в кДа. Фиг. 20 иллюстрирует повышенную способность модифицированных с мочевиной полипептидов для специфической реактивации CD4+ и/или CD8+ T-клеток путем проточных цитометрических анализов гепаринизированной цельной крови ЦМВ-позитивного HLA А2-позитивного пациента после рестимуляции синтетическими пептидами или рекомбинантным ЦМВ IE1 белком, как в карбамилированной, так и некарбамилированной формах. При проведении данных опытов, очищенный IE1 белок (0,89 мкг/мл в ФСБ) смешали 1:1 (об./об.) с 8 М осажденной мочевины (предварительно инкубированной в течение ночного времени суток при 96°С) и инкубировали в течение ночного времени суток при 40°С. Пептиды (10 мкг/мкл в 100% ДМСО) смешали 1:1 (об./об.) с 8 М осажденной мочевины (предварительно инкубированной в течение ночного времени суток при 96°С) и инкубировали в течение ночного времени суток при 40°С. Показаны CD4+ Th-клетки и CD8+ цитотоксические Т-клетки, проанализированы на IFN-γ секрецию, как определено в соответствии с окрашиванием межклеточных цитокинов. Гепаринизированную цельную кровь HLA А2-позитивного, ЦМВ-серопозитивного пациента стимулировали в течение 6 ч с либо необработанным или обработанным с мочевиной белком IE1 или YIL пептидом (представляя HLA А2- рестрикционный ЦТЛ эпитоп внутри белка IE1) и активацию IE1 или YIL-специфических CD4+ и CD8+ Т-клеток определили путем межклеточного IFN-γ окрашивания. Клетки стимулировали контрольным пептидами, представляя мышиный ЦТЛ эпитоп внутри HIV р24 белка в качестве отрицательного контроля. Секрецию цитокинов из активированных клеток ингибировали путем добавления брефелдином А в течение последних 4 ч стимуляции. Диаграммы представляют данные по интенсивности флуоресценции. Фиг. 21 иллюстрирует повышенную способность карбамилированных с цианатом и мочевиной пептидов для специфической реактивации CD8+ Т-клеток в гепаринизированной цельной крови ЦМВпозитивного HLA А2-позитивного пациента, в соответствии с результатами проточных цитометрических анализов. В данных опытах синтетический пептид YIL (10 мкг/мкл в 100% ДМСО) смешали 1:1 (об./об.) либо с 8 М осажденной мочевины (предварительно инкубированной в течение ночного времени суток при 96°С), либо с 200 мМ цианово-кислого калия в H2Odest и инкубировали в течение ночного времени суток при 40°С. Затем, гепаринизированную цельную кровь HLA А2-позитивного, ЦМВсеропозитивного пациента стимулировали в течение 9 ч либо с 10 мкг/мл E10F пептида, с покрытием мышиного ЦТЛ эпитопа внутри р24 капсидной области HIV-1(BH10) Gag (aa291-300) (Wild et al. (2004), Vaccine. 2004; 22:1732-1743) или YIL пептида (представляя HLA А2-рестрикционный ЦТЛ эпитоп внутри белка IE1), или, альтернативно, YIL пептида, который был карбамилирован либо с 100 мМ KOCN или 4 М осажденной мочевины. В качестве контроля, стимулировали клетки либо с 4 мМ мочевины, либо с 200 мМ KOCN. Активацию активацию YIL или PSA-специфических CD8+ Т-клеток определили путем межклеточного IFN-γ окрашивания с применением клеточного сортера с активацией флуоресценции. Секрецию цитокинов из активированных клеток ингибировали путем добавления брефелдином А в течение последних 7 ч стимуляции. Диаграммы представляют данные по интенсивности флуоресценции. Фиг. 22 представляет результаты проточно-цитометрических анализов мышиных (клеток), иммунизированных либо с немодифицированными, либо с карбамилированными р24 в отсутствие или в присутствии иммуностимулирующих CpG ODN 1668 после рестимуляции с синтетическими пептидами, представляющими р24-специфические ЦТЛ эпитопы или не нерелевантные ЦТЛ эпитопы. В качестве контроля использованы специфически или неспецифически рестимулированные селезеночные клетки мышей, иммунизированные либо с ФСБ, либо с HIV Gag VLP. Показаны номера CD8+ T-клеток, подвергнутые анализу на IFN-γ секрецию, в соответствии с окрашиванием межклеточных цитокинов. В данных опытах 6 BALB/c белых мышей иммунизировали с немодифицированным или модифицированным с мочевиной HIV p24 белком в отсутствие или в присутствии иммуностимулирующих CpG ODN 1668 (Bauer et al. (1999), Immunology 97:699). В качестве отрицательного и положительного контроля мышей иммунизировали с ФСБ или HIV Gag вирусоподобными частицами (VLP) (Demi et al. 2005, Mol. Immunol. 42:259). На неделе 2 и 4 после первичной иммунизации мышам сделали бустер-инъекцию, содержащую тот же самый иммуноген. По истечении 7 дней после первой и второй бустер-инъекций получили селезеночные клетки от каждой третьей мыши в группе и каждые 2×106 клеток рестимулировали в течение 6 ч с 10 мкг либо HTV С-тип р24 пептида (AMQILKDTI (SEQ ID NO: 1); аа197-205 в случае р24 иммунизированных мышей), либо с HIVLAI A9I пептида (AMQMLKETI (SEQ ID NO: 2); аа197-205 (Wild et al. (2004), Vaccine 22:1732)) в случае мышей, иммунизированных с вирусоподобными частицами (VLP) в присутствии брефельдина А. В качестве контроля, селезеночные клетки стимулировали с контрольным пептидом, представляющим человеческий ЦТЛ эпитоп внутри простат-специфического антигена (PSA 141-150 FLTPKKLQCV (SEQ ID NO: 3); Chakraborty et al. (2003), Cancer Immunol. Immunother. 52:497) в присутствии брефельдина А. Показаны средние значения плюс стандартное отклонение (СО) от номеров IFN-γ, -7- 020583 экспрессирующих CD8+ клетки. Фиг. 23 иллюстрирует повышенную способность карбамилированных с цианатом и мочевиной (A) YIL пептида и (В) CMV рр65 белка для специфической реактивации CD8+ Т-клеток в гепаринизированной цельной крови ЦМВ-позитивного HLA А2-позитивного пациента, в соответствии с результатами проточных цитометрических анализов. В данных опытах синтетический пептид YIL, представляющий HLA А2-рестрицированный ЦТЛ эпитоп внутри CMV IE1 белка (YILEETSVML (SEQ ID NO: 4); аминокислоты 315-324; Prod'homme et al. (2003), J. Immunol. 170:2030) растворили в 100% ДМСО с конечной концентрацией 2 мкг/мкл. Область антигенной детерминанты ЦМВ (линия AD169) белка рр65 (аа 8621048; RecMol UL83-pp65, Cat. No 1B023A) растворили в Н2О, включая 140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ KH2PO4 и возрастающую концентрацию KOCN (0 мМ, 100 мМ, 200 мМ и 500 мМ) и инкубировали в течение ночного времени суток при 40°С. Затем, гепаринизированную цельную кровь HLA А2-позитивного, ЦМВ-серопозитивного пациента стимулировали в течение 6 ч с 10 мкг/мл указанных карбамилированных с цианово-кислым калием YIL пептидов или белков рр65 в присутствии 0,04 М свежеприготовленной мочевины. Анти-CD49d и анти-CD28 моноклональные антитела (BD) добавили для ко-стимуляции в соответствии с протоколом производителя. Активацию YIL- или рр65специфических CD8+ Т-клеток детерминировали (определили) путем межклеточного IFN-γ окрашивания с применением клеточного сортера с активацией флуоресценции. Секрецию цитокинов из активированных клеток ингибировали путем добавления 10 мкг/мл брефелдина А (сигма) в течение последних 4 ч стимуляции. Следующие реагенты использовали для проточного цитометрического анализа, если не указано иначе: флуоресцинизотиоцианат (FITC-конъюгированное анти-CD8 (клон B9.11), фикоэритринтехасский-красный (ECD)-конъюгированное анти-CD3 (клон UCHT1) и фикоэритрин (РЕ)конъюгированное анти-IFN-γ антитело (клон 45.15) (все - Beckman Coulter). Межклеточные маркеры окрасили после окрашивания поверхностных маркеров, фиксации и пермеабилизации клеток. Окрашенные клетки пропустили через проточный цитометр FACS Epics XL MCL (Beckman Coulter). Пропускание живых лимфоцитов и CD3+ событий осуществили во время забора. Для каждого анализа взяли до 2×106 событий. Результаты оформили в процентном выражении от пропущенных CD8+ Т-клеток, производящих IFN-γ в ответ на специфическую стимуляцию. В описании заявленного изобретения использованы следующие общепринятые сокращения терминов, обозначающих нуклеотиды и аминокислоты. Термин "полинуклеотид", в том смысле, в котором он используется в описании заявленного изобретения, обозначает полимерную форму нуклеотидов произвольной длины, предпочтительно дезоксирибонуклеотиды (ДНК) или рибонуклеотиды (РНК). Термин эксклюзивно обозначает первичную структуру молекулы. Термин включает двух- и одноцепочечные ДНК или РНК, например полинуклеотиды - ловушки или антисмысловые полинуклеотиды, а также синтетические олигодезоксинуклеотиды (ОДН) и ОДН с устойчивым к нуклеотидам остовом. Термин "полипептид" или "белок", в том смысле, в котором он используется в описании заявленного изобретения, обозначает полимер из аминокислот произвольной длины. Предпочтительно термин "полипептид", в том смысле, в котором он используется в описании заявленного изобретения, относится к полимеру аминокислот, состоящему из более чем 6 аминокислотных остатков. Термин "полипептид" также включает термины "эпитоп", "пептид", "олигопептид", "белок", "полибелок" и совокупности (агрегаций) полипептидов. Также включены те полипептиды с пост-трансляционными модификациями, например гликолизаты, ацетилаты, фосфорилаты и подобные модификации, а также химические модификации, как, например, карбамоилаты, тиокарбамоилаты, гуанидин-замещенные группы и подобные модификации. Данный термин, помимо этого, включает, например, полипептиды, которые обладают одним или множеством аналогов аминокислот (например, ненатуральные аминокислоты), полипептиды с замещенными звеньями, а также другие модификации, которые известны из уровня техники, вне зависимости от натуральности происхождения. Термин "карбамилирование", в том смысле, в котором он используется в описании заявленного изобретения, обозначает перенос карбамоила из карбамоилсодержащей молекулы (например, карбамоил фосфата) в акцепторную группу, как, например, аминогруппу, карбоксигруппу, сульфгидрильную группу, фосфатную группу, гидроксильную группу или имидазольную группу. Помимо этого, термин "карбамилирование", в том смысле, в котором он используется в описании заявленного изобретения, также обозначает тиокарбамоилирование полипептидов. Термин "карбамоил", в том смысле, в котором он используется в описании заявленного изобретения, обозначает ацил радикал, NH2-CO-. Перенос карбамоил-группы играет существенную роль в определенных биохимических реакциях; например, в орнитиновом цикле (цикле образования мочи), через карбамоил фосфат. Термин "карбамоил" также обозначает тиокарбамоил-группу (NH2-CS-). Термин "цианат", в том смысле, в котором он используется в описании заявленного изобретения, обозначает анион NCO-, полученный из циановой кислоты (HNCO) и любой соли циановой кислоты. Помимо этого, термин "цианат" относится к любому органическому соединению, содержащему моновалентную группу -OCN, и, следовательно, к любому органическому соединению со структурой R-OCN, -8- 020583 где R - любая органическая группа (фрагмент, молекула). В частности, термин "цианат" также относится к изоцианату и изотиоцианату. Термины "очищенный" и "изолированный", в том смысле, в котором они используется в описании заявленного изобретения, обозначают тот факт, что молекула, например полипептид или последовательность нуклеиновой кислоты, присутствует в возможно полном отсутствие биологических макромолекул сравнимого типа. Термины обозначают фракционный вес требуемого продукта на уровне как минимум 65%, более предпочтительно как минимум 75%, более предпочтительно как минимум 85%, наиболее предпочтительно как минимум 95% и в наибольшей степени предпочтительно как минимум 98% от общей массы (веса) присутствующих биологических макромолекул. Помимо этого, вода, буфер и прочие небольшого размера молекулы, в особенности, молекулы с молекулярной массой менее 1000 Да, не охвачены термином "биологические макромолекулы", в том смысле, в котором этот термин используется в описании заявленного изобретения. Термин "эпитоп", в том смысле, в котором он используется в описании заявленного изобретения, обозначает область полипептида, которая обладает свойствами антигена, и, например, выполняет функцию сайта распознавания Т-клеток или иммуноглобулинов. В контексте заявленного изобретения, эпитопы, например, представляют собой такие участки полипептидов, которые распознаются иммунными клетками, такими, как, например, иммунные клетки, к примеру, CD4+ Т-клетки, CD8+ Т-клетки, CD4+CD8+ Т-клетки, CD4+CD8dim T-клетки, CD56+CD8+ и CD56-CD57+CD8+ NKT клетки или CD4+ регуляторные Т-клетки. Эпитоп может состоять из 3 или более аминокислот. Как правило, эпитоп состоит из как минимум от 6 до 7 аминокислот, или, более привычно, от 8 до 12 аминокислот, или от 13 до 18 аминокислот. Тем не менее, эпитоп может также состоять из более чем 18 аминокислот и совсем редко из более чем 30 аминокислот. Термин "эпитоп" также включает уникальную пространственную конформацию конкретного эпитопа. Данную пространственную конформация получают из последовательности аминокислот в области эпитопа. Термин "микроорганизм", в том смысле, в котором он используется в описании заявленного изобретения, обозначает вирусы, прокариотные и эукариотные микробы, как, например, архебактерии, бактерии, одноклеточные и грибки, при этом последняя группа включает, например, дрожжевые клетки и гифомицеты (нитчатые грибки). Термин "иммунные клетки", в том смысле, в котором он используется в описании заявленного изобретения, обозначает лимфоциты с хелперными, цитолитическими или регуляторными свойствами, как, например, CD4+ T-клетки, CD8+ Т-клетки, CD4+CD8+ Т-клетки, CD4+CD8dim Т-клетки, CD4+ регуляторные Т-клетки (Т-лимфоциты), CD56+CD8+ и CD56-CD57+CD8+ NKT-клетки, а также CD16+CD56+ NK клетки. Тем не менее, термин "иммунные клетки", в том смысле, в котором он используется в описании заявленного изобретения, обозначает не только иммунные клетки, выращенные и воспроизводимые in vitro в культуральной среде, но также и популяции иммунных клеток, взятые из здоровой донорской крови, пациента или животного, а также соответствующим образом очищенные иммунные клетки. Термин "полипептид-специфические Т-клетки", в том смысле, в котором он используется в описании заявленного изобретения, относится ко всем типам Т-клеток, обладающим рецепторами для специфических сайтов связывания специфических полипептидов, как, например, CD4+ Т-клетки, CD8+ Тклетки и CD4+ регуляторные Т-клетки. Термин "полипептид-специфические Т-клетки" также относится к эпитоп-специфическим, антиген-специфическим и иммуноген-стимулированным клеткам. Термин "CD4+ Т-клетки", в том смысле, в котором он используется в описании заявленного изобретения, относится к Т-хелпер-клеткам, которые либо управляют активацией макрофагов и CD8+ Т-клеток (Th-1 клетки), производством антител В клетками (Th-2 клетки) или которые играют существенную роль в аутоиммунных заболеваниях (Th-17 клетки). Дополнительно, термин "CD4+ Т-клетки" также относится к регуляторным Т-клеткам, которые представляют примерно 10% от общей популяции CD4+ T-клеток. Регуляторные Т-клетки выполняют важную функцию в демпфировании (ослаблении) иммунных ответов, в предотвращении аутоиммунных заболеваний и в оральной толерантности. Термин "натуральные регуляторные Т-лимфоциты" или "регуляторные Т-клетки", в том смысле, в котором он используется в описании заявленного изобретения, относится к Treg, Th3 и Tr1 клеткам. Treg характеризуются экспрессией поверхностных маркеров CD4, CD25, ЦТЛА4 и фактору транскрипции Foxp3. Th3 и Tr1 клетки представляют собой CD4+ T-клетки, которые характеризуются экспрессией TGFβ (Th3 клетки) или IL-10 (Tr1 клетки) соответственно. Термины "CD8+ T-клетки" или "ЦТЛ", в том смысле, в котором они используется в описании заявленного изобретения, относятся к цитотоксичным Т-клеткам, распознающим и разрушающим дегенерированные, опухолевые и злокачественные клетки, а также тканям и клеткам, которые инфицированы микроорганизмами или паразитами. CD8+ Т-клетки также именуют CD4-CD8+ T-клетками или Th-1 клетками. Термин "антиген-презентирующие клетки (АПК)", в том смысле, в котором он используется в описании заявленного изобретения, относится к клеткам, которые обладают способностью захвата, переработки полипептидов и презентирования фрагментов данных полипептидов (эпитопов) в иммунную систему в ассоциации с белками ГКГ класса I и ГКГ класса II. В частности, термин "антиген-9- 020583 презентирующие клетки (АПК)", в том смысле, в котором он используется в описании заявленного изобретения, относится к профессиональным АПК, как, например, дендритные клетки, моноциты, макрофаги и В клетки, но также к непрофессиональным АПК, как, например, нейтрофилы, фибробласты, а также васкулярные эпителиальные клетки и различные эпителиальные, мезенхимные (мезенхимальные) клетки, а также микроглиальные клетки головного мозга. Термин "осажденная мочевина", в том смысле, в котором он используется в описании заявленного изобретения, относится к мочевине, прошедшей предварительную обработку при некоторых режимах инкубации. В частности, предварительная обработка мочевины может включать инкубацию мочевины при температуре примерно от -20 до примерно 40°С, предпочтительно при примерно комнатной температуре в течение нескольких часов, дней, недель или месяцев и/или подогрев мочевины при температурах от примерно 40 до примерно 100°С в течение нескольких минут, часов или дней. Термин "осажденная мочевина", в том смысле, в котором он используется в описании заявленного изобретения, предпочтительно относится к раствору мочевины с повышенной концентрацией цианата в сравнении с неосажденной мочевиной. Более предпочтительно термин "осажденная мочевина", в том смысле, в котором он используется в описании заявленного изобретения, относится к раствору мочевины с концентрацией цианата от примерно 0,2 до примерно 50 ммоль/л, более предпочтительно от примерно 0,3, 0,4, 0,5, 0,6, 0,7, 0,8 до примерно 0,9 до примерно 50 ммоль/л, более предпочтительно от примерно 1 до примерно 50 ммоль/л, более предпочтительно от примерно 2 до примерно 45 ммоль/л, более предпочтительно от примерно 5 до примерно 40 ммоль/л, более предпочтительно от примерно 10 до примерно 40 ммоль/л, более предпочтительно от примерно 20 до примерно 40 ммоль/л, более предпочтительно от примерно 30 до примерно 40 ммоль/л. Термин "белковые трансдукционные домены (PTD)", в том смысле, в котором он используется в описании заявленного изобретения, относится к доменам и цепочкам белков, которые обладают способностью перемещать указанные белки в цитоплазму клеток. Таким образом, белковые трансдукционные домены облегчают перенос внеклеточных белков в цитоплазму клеток и, в частности, в эндогенный путь АПК процессинга именно пути ГКГ класса I. В частности, термин "белковые трансдукционные домены (PTD)", в том смысле, в котором он используется в описании заявленного изобретения, относится к: (i) натурально-белковым трансдукционным доменам, как, например, аргинин-обогащенные PTD, включая HIV Tat (трансактиватор транскрипции), Drosophila Antp (Antennapedia) и PTD-5; (ii) гидрофобной сигнальной последовательности (лидерному пептиду), как например, сигнальной последовательности фактора роста фибробластов, также относящемуся к мембранной трансдукционной последовательности (MTS); (iii) синтетически-белковым трансдукционным доменам, как, например, лизиновым, орнитиновым и аргининовым гомополимерам, и (iv) мембранным транслокационным доменам бактериальных токсинов, таких, как, например, дифтерийный и столбнячный токсины. Авторами заявленного изобретения неожиданно было обнаружено, что полипептиды, инкубированные с цианатом, можно с высокой эффективностью перемещать в клетки в присутствии мочевины. Помимо этого, авторы заявленного изобретения обнаружили, что полипептиды, инкубированные с цианатом, индуцируют значительное презентирование эпитопа на белках ГКГ классов I и II в иммунных клетках в присутствии мочевины и, таким образом, обладают способностью эффективного примирования, реактивации и выращивания полипептид-специфических Т-клеток (например, CD4+ Т-клетки и CD8+ Тклетки). Таким образом, заявленное изобретение относится к способу переноса полипептидов в клетки, включающему следующие этапы: а) инкубирование полипептидов в растворе, содержащем ионы цианата, в котором ионы цианата присутствуют в концентрации от примерно 0,2 до примерно 9000 ммоль/л; б) инкубирование клеток с полипептидами согласно этапу а) в присутствии мочевины. Способ в соответствии с заявленным изобретением можно применять для инфильтрации полипептидов в произвольные клетки, которые являются прокариотными, например, бактерии, и эукариотными, например, грибки (дрожжи и филаментные (нитчатые) грибки), клетки насекомых, птиц, рептилий, рыб, земноводных и млекопитающих, например, клетки мышей или человека, в частности, антигенпрезентирующие клетки (АПК), как, например, дендритные клетки (например, клетки Лангерганса), моноциты, макрофаги, В-клетки, а также клетки васкулярного эндотелия и различные клетки эпителия, мезенхимные, а также клетки микроглии головного мозга. Другим способом в соответствии с заявленным изобретением является способ детекции полипептид-специфических иммунных клеток, включающий следующие этапы: а) инкубирование полипептидов в растворе, содержащем ионы цианата, в котором ионы цианата присутствуют в концентрации от примерно 0,2 до примерно 9000 ммоль/л; б) инкубирование АПК-содержащих клеточных культур с полипептидами согласно этапу а) в присутствии мочевины; в) инкубирование АПК-содержащих клеточных культур или биологических жидкостей, получен- 10 - 020583 ных согласно этапу б) с иммунными клетками или с биологическими жидкостями, содержащими иммунные клетки; г) симультанную и/или специфическую детекцию и/или количественный анализ различных подтипов полипептид-специфических иммунных клеток, которые специфичны по отношению к полипептидам согласно этапу а). АПК-содержащая биологическая жидкость предпочтительно представляет собой цельную кровь и/или жидкость. В одном из вариантов практического воплощения способа детекции согласно заявленному изобретению, АПК-содержащая клеточная культура содержит популяцию клеток костного мозга (лейкеферезат), изолированные моноцитные клетки и/или сепарированные популяции АПК, предпочтительно содержащие дендритные клетки (клетки Лангерганса), моноциты, макрофаги и/или В-клетки. Термин "АПК-содержащие клеточные культуры", в том смысле, в котором он используется в описании заявленного изобретения, относится не только к клеткам, содержащим АПК, удерживаемым и воспроизводимым in vitro в культуральной среде, но также и к клеточным популяциям, взятым у пробанда, пациента или животного и содержащим очищенные АПК. К примеру, кровь или другую АПК-содержащую биологическую жидкость можно взять у здорового донора крови или пациента. Биологическую жидкость можно использовать напрямую, согласно этапу б) способа в соответствии с заявленным изобретением или можно очистить АПК-содержащие клеточные популяции, а затем использовать их. Очищение АПКсодержащих клеточных популяций, взятых (полученных) из крови или прочих АПК-содержащих биологических жидкостей соответствует уровню развития техники и известно специалистам в соответствующей области техники. После инкубирования АПК-содержащих клеточных культур или биологических жидкостей с карбамилированными полипептидами в присутствии раствора мочевины, клетки инкубируют с иммунными клетками или с биологическими жидкостями, содержащими иммунные клетки. Иммунные клетки или биологические жидкости, содержащие иммунные клетки, предпочтительно получают у того же самого здорового донора крови, пациента или животного, у которых получили АПК-содержащие клеточные культуры или биологические жидкости. Альтернативно, иммунные клетки или биологические жидкости, содержащие иммунные клетки, получают у здоровых доноров крови, пациентов или животных, у которых присутствует ГКГ-набор, совместимый с АПК-содержащими клеточными культурами или биологическим жидкостями. Биологические жидкости, содержащие полипептид-специфические иммунные клетки, могут представлять собой цельную кровь и/или жидкость. Полипептид-специфические иммунные клетки могут представлять собой Т-клетки (Т-лимфоциты), предпочтительно CD4+ Т-клетки, CD8+ Тклетки, CD4+CD8dim Т-клетки и/или CD4+ регуляторные Т-клетки, и/или они могут представлять собой прочие иммунологические клеточные популяции, предпочтительно CD56+CD8+, CD56-CD57+CD8+ NKT клетки и/или CD56+ NK клетки. Способы получения и очищения требуемых АПК и популяций иммунных клеток соответствуют передовому уровню развития техники. АПК-содержащая клеточная культура или биологическая жидкость, например цельная кровь, жидкость или очищенные клетки костного мозга, используемые в этапе б), уже могут содержать популяции иммунных клеток, которые необходимо подвергнуть детекции. В данном случае отпадает необходимость добавления иммунных клеток или биологических жидкостей, содержащих иммунные клетки в ходе этапа в). Инкубирование согласно этапу в) занимает примерно от 1 мин до примерно 240 ч или дольше, предпочтительно от примерно 2 до примерно 6 ч, или примерно от 6 до примерно 12 ч, или от примерно 12 до примерно 36 ч, или примерно от 36 до примерно 72 ч, или от 72 до примерно 240 ч при приемлемых условиях культивации, например при 37°С в атмосфере с повышенным уровнем влажности, в присутствии от 5 до 8% СО2 в Т-клеточной среде (RPMI 1640 с 2 до 10% инактивированной нагреванием (30 мин, 56°С) человеческой плазмы или сыворотки эмбриона теленка (FCS), 2 мМ глутамина и 100 мг/мл канамицина или гентамицина (все компоненты производства фирмы PanSystems, Aidenbach). Тем не менее, могут применяться также и другие подходящие условия, известные из уровня техники, с вариациями в составе среды, температуре, влажности воздуха, времени инкубирования. Детекция определенных популяций полипептид-специфических иммунных клеток основана на принципе, что после специфического распознавания полипептидов, которые презентированы совместно с ГКГ белками классов II и/или I на поверхности АПК, иммунных клеток, подтверждает повышенную экспрессию характеристических цитокинов, в особенности IFN-γ и/или TNF и/или EL-2, или IL-4 и/или IL-5, или IL-17 или EL-10 и/или TGF-β. Как результат совмещенного анализа поверхностных белков, которые характерны для определенных популяций иммунных клеток, и цитокинов, присутствие и/или концентрация определенных популяций полипептид-специфических имуунных клеток можно подвергнуть детекции из смеси различных популяций иммунных клеток. Детекция и/или количественный анализ согласно этапу г), таким образом, происходит путем симультанной детекции поверхностных белков и цитокинов. Таким образом, в одном из вариантов практического воплощения заявленного способа детекции и/или количественного анализа проводится путем детекции специфических поверхностных маркеров - 11 - 020583 полипептид-специфических иммунных клеток и производства маркерных цитокинов, как, например, IL2, TNF, IFN γ, IL4 или IL5, IL10, TGF-β. Детекцию и/или количественный анализ можно проводить методами ELISA, ELISpot или FACS. Альтернативно, детекцию и/или количественный анализ можно проводить путем измерения транзиентной поверхностной экспрессии CD107a,b или путем пролиферации Тклеток, или, в случае, если, например CD8+ Т-клетки подвергаются детекции или количественному анализу, путем проведения классического теста с радиоактивным хромом или эквивалентного нерадиоактивного теста. Помимо этого, детекцию определенных клеточных популяций через специфические поверхностные белки можно проводить, например, через CD4 для Т-хелпер-клеток, CD8 для цитотоксических Т-клеток, CD4 и CD8 для CD4+CD8dim и CD4+CD8+ Т-клеток, CD56 для NK клеток, CD4 и CD25 для Treg клеток и CD56 и CD8 или CD57 и CD8 для различных популяций NKT клеток. Специфическое состояние клеточных популяций (необученные, активированные и клетки памяти) и степень активируемости могут быть определены путем детекции дополнительных поверхностных белков (например, CD69, CD45R0, CD45RA, CCR7) и межклеточных белков (например, гранзимов, перфоринов, FoxP3), межклеточных цитокинов (например, IL-2, TNF, IFN-γ, IL-4, IL-5, IL-10, TGF-β) или поверхностно-"обученные" белки, как, например, CD107a,b. Таким образом, специфическая детекция специфических клеточных популяций становится осуществимой в соответствии с заявленным способом. Перечисленные характеристические поверхностные маркеры для определенных клеточных популяций известны из уровня техники, как же, как и детекция и описание характеристических свойств различных популяций иммунных клеток, например, с использованием технологии FACS (клеточный сортер с активацией флуоресценции). Специфическую активацию иммунных клеток определяют после инкубации с АПК-содержащими клеточными культурами или биологическими жидкостями, полученными в соответствии с этапом б) путем измерения любого повышенного уровня производства цитокинов активированных иммунных клеток. Например, CD4+ Т-клетки, CD8+ Т-клетки, CD4+CD8dim и CD4+CD8+ Т-клетки, CD56+ NK клетки, и CD56+CD8+ или CD57+CD8+ NKT клетки вызывают повышение IFN-γ после специфической стимуляции, в то время, как CD4+ T-хелпер-клетки Т-хелпер 2 типа (Th-2) показывают повышенное производство цитокинов EL-4 и IL-5. Регуляторные Т-клетки (Treg, Th3, Tr1 клетки) показывают повышенную экспрессию IL-10 и/или TGF-β. Полученные цитокины можно детерминировать с использованием уже известных из техники способов, либо внутриклеточно, либо после секреции в супернатанте, с использованием, в некоторых случаях, доступных на рынке способов, например, FACS (например, внутриклеточным окрашиванием цитокинов, или анализом на секрецию цитокинов), энзимсвязанного иммуносорбентного анализа (ELISA) или методом иммуноферментных пятен (иммуноферментный спот-анализ ELIspot). Детекция также возможна через другие цитокины, проивзодимые после специфической активации иммунных клеток или прочих производимых маркеров. Активированные иммунные клетки можно определить и характеризировать, к примеру, путем проточной цитометрии (FACS: Fluorescence activated cell scan - клеточный сортер с активацией флуоресценции). Данный способ позволяет измерить при помощи проточного цитометра флуоресцентную интенсивность отдельных (индивидуальных) клеток в смешанной клеточной популяции. Проточноцитометрический анализ клеток затем проводят с использованием системы FACS, например проточного цитометра FACS Epics XL MCL и программного обеспечения Expo 32 (Becton Coulter) или проточного цитометра FACS Canto II и программного обеспечения Diva 6.1.1. (Beckton Dickinson). Флуоресцеин-сопряженные, например, с R-фикоэритрином (R-PE), пиридин хлорофиллом с (PerCP), флуоресцеином (FITC), техасским красным (ТХ), аллофикоцианином (АРС), Amcyane, тихоокеанским голубым, Tandem PE-ТХ, Tandem PE-Cy5, РЕ-Су7 или Tandem APC-Cy7, различные флуорохромы Alexa, первые или вторичные антитела приемлемы для детекции уже упомянутых характеристических поверхностных белков и цитокинов, с использованием FACS и других имеющихся на рынке способов (например, производства Becton Dickinson, Dako, Coulter, eBioscience, Biolegend). В дополнение к FACS, приемлемы другие способы детерминации факта производства через иммунные клетки, к примеру методы ELISA, Elispot, биосенсоры и определение профиля экспрессии также подходят для детекции полипептид-специфических иммунных клеток. Данные методы известны из уровня техники. Другой способ, заявленный в данном изобретении, является способом примирования, выращивания и/или реактивации полипептид-специфических Т-клеток, включающий следующие этапы: а) инкубирование полипептидов в растворе, содержащем ионы цианата, в котором ионы цианата присутствуют в концентрации от примерно 0,2 до примерно 9000 ммоль/л; б) инкубирование клеток с полипептидами согласно этапу а) в присутствии мочевины и в отсутствие или в присутствии иммуномодулирующих веществ. При данном способе полипептид-специфические Т-клетки предпочтительно представляют собой CD4+ Т-клетки и/или CD8+ Т-клетки. Способ примирования, выращивания и/или реактивации полипептид-специфических Т-клеток можно осуществить in vivo, in vitro и/или ex vivo. Клетки, инкубированные согласно этапу б), могут представлять собой АПК и/или Т-клетки, про- 12 - 020583 шедшие очистку от крови, мононуклеарных клеток периферической крови (МКПК) или другую биологическую жидкость, содержащую упомянутые АПК и/или Т-клетки. Альтернативно, кровь, МКПК или другую биологическую жидкость, содержащую АПК и/или Т-клетки, напрямую используют в этапе б). Кровь, МКПК или другая биологическая жидкость, содержащая АПК и/или Т-клетки, может представлять собой образец, предварительно полученный от пациента - человека или животного. В одном из вариантов практического воплощения заявленного способа примирования, выращивания и/или реактивации полипептид-специфических Т-клеток, инкубацию по этапу б) предпочтительно осуществляют несколько раз, предпочтительно 2, 3, 4, 5, 6, 7, 8, 9, 10 или даже более раз. Повторение этапа б), в частности, предпочтительно для способа выращивания полипептид-специфических Т-клеток. Все способы согласно заявленному изобретению основаны на инновационных технологиях, подразумевающих, что перенос полипептидов в клетки значительно улучшается в случае, если полипептиды предварительно обрабатывают вместе с цианатом, инкубируют с упомянутыми клетками в присутствии мочевины. Таким образом, данная основополагающая идея относится ко всем вышеописанным заявленным в данном изобретении способам. Полипептиды могут быть получены (произведены) синтетически или экспрессированы в различных клетках с использованием традиционных про- или эукариотных систем экспрессии. Примерами приемлемых систем экспрессии могут служить бактерии, как, например, Bacillus subtilis, E. coli, Streptococcus cremoris или Streptococcus lividans, дрожжевые клетки, как, например, Candida albicans, Candida maltosa, Hansenula polymorpha, Kluyveromyces fragilis, Saccharomyces cerevisiae, Schizosaccharomyces pombe, или Yarrowia lipolytica, клетки насекомых, как, например, Aedes aegypti, Autographa californica, Bombvx mori, Drosophila melanogaster, Spodoptera frugiperda или Trichoplusia ni, клетки млекопитающих, как, например, овариальные клетки китайского хомячка (СНО), клетки HeLa, клетки почки новорожденного хомяка (ВНК), клетки почки обезьяны (COS), или клетки растений. Используемые полипептиды можно очищать традиционными молекулярно-биологическими способами, например путем расщепления клеток, ферментацией нуклеиновыми кислотами, применением способов концентрирования белков, аффинной хроматографией, ионообменной хроматографией и гельхроматографией, или в сочетании с методами денатурирования полипептидов, например осаждения кислотой, обработкой мочевиной, обработкой щелочью, термической обработкой, обработкой ДСН или сонификацией. Данные способы очистки полипептидов могут дополнительно сочетаться с друг с другом в определяемой пользователем форме. Полипептиды могут быть синтетическими, т.е. ненатурально полученными, или полученными из живых организмов, например млекопитающих, как, например, людей, приматов, мышей, крыс, кроликов, коз, овец, коров, свиней или других животных, паразитов, микроорганизмов или вирусов. Тем не менее, они также могут происходить из растений или водорослей. Помимо этого, они могут происходить из белков приона. Полипептиды, используемые в этапе а) заявленных в данном изобретении способов, можно разделить на две группы в зависимости от присущего им свойства проникать в цитозоль (гиалоплазму) клеток, в частности АПК. Первая группа полипептидов обладает внутренней способностью проникать в цитозоль клеток, в частности, АПК. Соответственно, такие белки перерабатываются и презентируются через путь ГКГ класса I, без каких-либо добавлений. Упомянутое присущее свойство может быть вызвано трансдукционным доменом (PTD) упомянутого белка. Упомянутый трансдукционный домен может представлять собой встречающийся в природе трансдукционный домен (PTD) или рекомбинантно добавленный трансдукционный домен. Примерами белков со встречающимся в природе трансдукционным доменом являются белки HIV трансактивации или транскрипции (Tat) и Rev, вирус простого герпеса VP22 и гомеобелок Drosophila antennapedia (сложного локуса дрозофилы, в котором локализованы гомеозисные мутации) (antp) (Sugita et al. (2008), Br J. Pharmacol. 153: 1143-1152). Тем не менее, упомянутое присущее свойство также может быть вызвано естественной функцией специфической цепи полипептидов, как то тяжелой цепи токсина столбняка. Прочие примеры полипептидов с присущими свойствами проникновения в цитозоль - токсин дифтерии. В данном случае транслокация опосредуется транслокацией или "Т доменом". Помимо этого, доказали, что гидрофобная сигнальная последовательность фибробластного фактора роста, также именуемая мембранной трансдукционной последовательностью (MTS), принадлежит к другому типу проникающего в клетку пептида (СРР). Помимо этого, сопряжение полипептидов в микро узлы, антитела, липиды, белки теплового шока и аргинин-обогащенные белковые трансдукционные домены (PTD) приводит к доставке в HLA класс I требуемых свойств АПК. Вторая группа полипептидов не обладает присущей способностью проникновения в цитозоль клеток, в частности АПК. Такие белки не могут проникнуть в цитозоль АПК без какой-либо помощи, но остаются в эндосомальном/эндолизосомальном компартменте упомянутой АПК. Соответственно, упомянутые белки, как правило, не перерабатываются и не презентируются через путь ГКГ класса I, а перерабатываются и презентируются только через путь ГКГ класса II. Вторая группа включает подавляющее большинство встречающихся в природе и рекомбинантных искусственных человеческих, микробных, вирусных, животных или растительных белков и, в частности, соответствующие растворимые полипеп- 13 - 020583 тиды и полипептиды лизатов клеток, тканей, бактерий, вирусов и паразитов. В одном варианте практического воплощения заявленного изобретения заявленные способы осуществляют с полипептидами первой группы, т.е. с полипептидами, обладающими вышеупомянутой способностью проникать в цитозоль клеток, в частности АПК. Таким образом, заявленные способы упрощают перенос полипептидов в цитозоль клеток, в частности АПК. Таким образом, эффективность переноса полипептидов можно повышать для вышеупомянутых пептидов при помощи заявленных способов. В другом варианте практического воплощения заявленного изобретения заявленные способы осуществляют с полипептидами второй группы, т.е. с полипептидами, не обладающими вышеупомянутой способностью проникать в цитозоль клеток, в частности АПК. Для такого полипептида заявленное изобретение описывает способ, позволяющий осуществлять очень эффективный перенос полипептида в цитозоль клетки, в частности АПК. Предпочтительными полипептидами второй группы являются все типы полипептидов, имеющих эпитопы Т-клеток, но не обладающие (i) натуральным белковым трансдукционным доменом и/или (ii) любым вектором или доменом, связанным с упомянутым полипептидом рекомбинантной связью, которая вызывает транслокацию полипептида в клетки, в частности АПК. Примерами полипептидов второй группы служат микробные белки, в частности белки: (i) вируса иммунодефицита человека (ВИЧ, HIV), как, например, gp120, gp160, p24, gag, полимераза, обратная транскиптаза и nef; (ii) вируса Эпштейна-Барра (ВЭБ), как, например, EBNA1, EBNA2, EBNA3A, EBNA3B, EBNA3C, EBNA4, EBNA6, BZLF1, BMLF1, BMRF1, BHRF1, BARF0, BRLF1, BI'LF4, gp85, gp110, gp220/350, VCA p150, EBNA-LB, LMP-1 и LMP-2 (например, описанные Khanna et al. (2000), Annu. Rev, Microbiol. 54:1948); (iii) цитомегаловируса (ЦМВ), как, например, UL123 (IE1), UL122 (IE-2), UL83 (рр65), UL82, HL99, UL28, UL33, UL37, US3, UL94, UL16, UL55(gB), UL85, UL25, US18, UL45 и UL32 (рр150) (например, описанные Crough et al. (2009), Clin Microbiol Rev. 22:76-98); (iv) вируса ветряной оспы (ВВО), как, например, ORF1, ORF4, ORF10, ORF14, ORF29, ORF62 и ORF68 (gE); (v) M. Tuberculosis, как, например, CFP10, ESAT6, ТВ7.7, ТВ37.6, МРТ63; (vi) борреллий бургдорфери, как, например, OSPA и OSPC; (vii) вируса гепатита В, как, например, HBsAg и HBcAg; (viii) аденовируса, как, например, AdV5 Hexon. Помимо этого, человеческие белки предпочтительно являются полипептидами упомянутой второй группы, например, антигены опухолевых клеток, как, например, простат-специфический антиген (PSA), HER-2/neu, муцин 1 MUC-1, точечно мутированный или сверхэкспрессированный дикого типа р53, MAGE антиген и СЕА (карциноэмбриональный антиген). Также предпочтительными полипептидами упомянутой второй группы являются белки, представляющие релевантные мишени для аутоагрессивных Т-клеток при аутоиммунных заболеваниях. Примерами таких белков в аспекте множественного склероза (аутоиммунного генеза) являются основной миелиновый белок (МВР), миелин-олигодендроцитарный гликопротеин (MOG), протеолипид протеин (PLP), миелин, гибридный белок MBP/PLP (MP4), миелинассоциированный гликопротеин (MAG). Примерами таких протеинов в аспекте диабета по I типу (аутоиммунного генеза) являются инсулин В, препроинсулин (PPI), IA-2, GAD65, IGRP, cd4, хромогранин A (ChgA) (например, как описано Velthuis et al. (2010), Diabetes). Также предпочтительны в применении фрагменты вышеупомянутых белков в аспекте заявленных способов. Для определения, принадлежит ли полипептид первой или второй группе, можно тестировать способность проникновения в цитозоль эукариотных клеток, в частности, АПК, методами флуоресцентной микроскопии, при которой клеточные компартменты и полипептиды можно определить как флуоресцент-конъюгированные. Соответствующие способы известны специалистам в области техники и описаны, к примеру, в Kaplan et al. (Journal of Controlled Release 102 (2005) 247-253) и в WO 99/55899. Полипептиды согласно этапу а) в соответствии с заявленными способами можно использовать в произвольных концентрациях. Предпочтительно концентрация составляет от примерно 0,01 до примерно 200 мкг/мл или выше, от примерно 0,01 до примерно 0,1 мкг/мл, от примерно 0,1 до примерно 0,5 мкг/мл, от примерно 0,5 до примерно 2 мкг/мл, от примерно 2 до примерно 10 мкг/мл, от примерно 10 до примерно 50 мкг/мл или от примерно 50 до примерно 200 мкг/мл. Наиболее предпочтительны полипептидные концентрации от примерно 0,1 до примерно 50 мкг/мл, более предпочтительны от примерно 1 до примерно 40 мкг/мл, от примерно 3 до примерно 30 мкг/мл или от примерно 5 до примерно 20 мкг/мл. В наибольшей степени предпочтительна полипептидная концентрация примерно 10 мкг/мл. Предварительная обработка полипептидов с цианатом согласно этапу а) в заявленных способах приводит к карбамилированию аминогрупп полипептидов. Карбамилирование представляет собой перенос карбамоила из карбамоилсодержащей молекулы (например, карбамоил фосфата) в акцепторную группу, как, например, аминогруппу, карбоксигруппу, сульфгидрильную группу, фосфатную группу, гидроксильную группу или имидазольную группу. Карбамоил представляет собой ацил радикал со структурой NH2-CO-. Тем не менее, карбамилирование может также осуществляться с участием тиокар- 14 - 020583 бамоильной группы со структурой NH2-CS-. Карбамилирование полипептида в соответствии с заявленным изобретением может представлять собой карбамилирование аминогруппы, карбоксигруппы, сульфгидрильной группы, фосфатной группы, гидроксильной группы или имидазольной группы. Более предпочтительно карбамилирование полипептидов в соответствии с заявленным изобретением представляет собой карбамилирование простейших аминогрупп полипептида, в частности конечной аминогруппы и эпсилон-аминогруппы остатков лизина. Альтернативно, или дополнительно, можно карбамилировать гидроксильную группу тирозина, сульфгидрильную группу цистеина, карбоксильную группу аспарагиновой и глутаминовой кислот и имидазольной группы гистидина. Реакция карбамилирования может протекать путем инкубирования полипептидов в растворе, содержащем цианат. В одном из вариантов практического воплощения заявленного изобретения концентрация цианата составляет от примерно 0,3 до примерно 5000 ммоль/л, более предпочтительно от примерно 0,4, 0,5, 0,6, 0,7, 0,8 или от примерно 0,9 до примерно 5000 ммоль/л, от примерно 1,2 или от примерно 5 до примерно 5000 ммоль/л, от примерно 2 до примерно 5000 ммоль/л, от примерно 10 до примерно 4000 ммоль/л, от примерно 25 до примерно 3000 ммоль/л, от примерно 100 до примерно 2000 ммоль/л или от примерно 500 до примерно 1000 ммоль/л. Наиболее предпочтительны концентрации цианата от примерно 1 до примерно 1000 ммоль/л, более предпочтительно от примерно 5 до примерно 900 ммоль/л, от примерно 10 до примерно 800 ммоль/л, от примерно 20 до примерно 700 ммоль/л или от примерно 50 до примерно 600 ммоль/л. В частности, предпочтительны концентрации цианата от примерно 100 до примерно 500 ммоль/л, как, например, концентрации цианата от примерно 100, примерно 150, примерно 200, примерно 250, примерно 300, примерно 350, примерно 400, примерно 450 или примерно 500 ммоль/л. Время инкубации согласно этапу а) в соответствии с заявленными способами, может составлять от примерно нескольких минут до нескольких часов, дней, недель или месяцев. Инкубирование может проходить при температуре от примерно -20 до примерно 100°С, предпочтительно от примерно комнатной температуры до примерно 96°С или от примерно 40 до примерно 96°С. Инкубация при низких температурах требует более продолжительного времени инкубирования, а при высоких температурах - более короткого времени инкубирования, в частности, вследствие того факта, что полипептиды распадаются в случае, если их инкубируют при высокой температуре в течение длительного времени. Предпочтительна температура инкубации от примерно комнатной температуры до примерно 60°С, от примерно 30 до 50°С или от примерно 37 до 45°С. Наиболее предпочтительна температура инкубации примерно 40°С. Таким образом, предпочтительным является время инкубации от примерно 5 мин до примерно 24 ч или от примерно 30 мин до примерно 2 ч. В особенности, предпочтительно время инкубации 1 ч. В одном из вариантов практического воплощения заявленного изобретения полипептид инкубируют для карбамилирования в растворе мочевины, содержащем цианат. Предпочтительно концентрация мочевины в упомянутом растворе мочевины составляет от примерно 0,01 до примерно 8 моль/л, от примерно 0,1 до примерно 0,5 моль/л, от примерно 0,5 до примерно 5 моль/л или от примерно 5 до примерно 8 моль/л. Концентрация цианата свежеприготовленного раствора мочевины составляет менее 0,2 ммоль/л. Тем не менее, согласно этапу а) заявленных способов полипептиды необходимо инкубировать в растворе с концентрацией цианата на уроне примерно 0,2 ммоль/л. Предпочтительным является раствор, содержащий мочевину с концентрацией цианата от примерно 0,2 до примерно 50 ммоль/л, более предпочтительно от примерно 0,3, 0,4, 0,5, 0,6, 0,7, 0,8 или примерно 0,9 до примерно 50 ммоль/л, от примерно 1 до примерно 50 ммоль/л, от примерно 2 до примерно 45 ммоль/л, от примерно 5 до примерно 40 ммоль/л, от примерно 10 до примерно 40 ммоль/л, от примерно 20 до примерно 40 ммоль/л или от примерно 30 до примерно 40 ммоль/л. С целью повышения концентрации цианата в растворе мочевины возможны следующие способы. В одном из вариантов практического воплощения заявленного изобретения концентрация цианата в растворе мочевины повышается путем инкубирования упомянутого раствора мочевины при специфических условиях инкубации. Мочевина в растворе находится в равновесном состоянии с цианатом аммония. Форма, которая вступает в реакцию с аминогруппами полипептидов, представляет собой изоциановую кислоту. Изоциановая кислота реагирует с N-концом полипептидов и боковыми цепями остатков лизина и аргинина. Таким образом, карбамилирование полипептидов в растворе мочевины можно сделать более эффективным путем повышения концентрации цианата в упомянутом растворе мочевины и, таким образом, путем манипуляций равновесной реакции мочевины и цианата аммония. На течение упомянутой равновесной реакции могут оказывать влияние нагрев и/или время инкубации. Накопление цианата в водных растворах мочевины было подробно проанализировано Marier и соавторами (Marier et al. (1964), Analytical Biochemistry 7:304). Они описали, что максимальный уровень цианата был достигнут при 25°С приблизительно по истечении 60 дней. При заданной концентрации мочевины максимальный уровень цианата при 25°С составлял приблизительно 60% от полученного при 38°С (7 дней) и приблизительно 23% от полученного при 85°С (50 мин). - 15 - 020583 Для увеличения концентрации мочевины в растворе мочевины можно инкубировать раствор мочевины в течение от примерно нескольких минут до примерно нескольких часов, дней, недель или месяцев. Инкубация может происходить при температурах от примерно -20°С до примерно 100°С, от примерно комнатной температуры до примерно 98°С, от примерно 37 до примерно 96°С, от примерно 40 до примерно 96°С или от примерно 70, 80 или примерно 90 до примерно 96°С. Для повышения концентрации цианата, очевидно, что инкубация при низких температурах требует длительного времени инкубации, в то время как инкубация при высоких температурах требует более короткого времени инкубации. Например, инкубация при -20°С может занять от примерно нескольких недель до нескольких месяцев, в то время как инкубация при 96°С может занять от примерно нескольких минут до примерно 1 ч или нескольких часов. Если описанный выше предварительно обработанный раствор мочевины используют в инкубации согласно этапу а) в заявленных способах, инкубация согласно этапу а) происходит предпочтительно при температурах от примерно комнатной температуры до примерно 100°С, от примерно 30 до примерно 70°С или от примерно 37 до примерно 40°С. Таким образом, предпочтительно время инкубации от примерно 5 мин до примерно 48 ч. Тем не менее, более предпочтительно время инкубации от примерно 30 мин до примерно 24 ч. В другом варианте практического воплощения заявленного изобретения концентрацию цианата в растворе мочевины повышают в течение этапа инкубации а) заявленных способов. Таким образом, полипептиды можно инкубировать в растворе мочевины в течение от примерно нескольких минут до примерно нескольких часов, дней, недель или месяцев. Инкубация может проходить при температурах от примерно -20 до примерно 100°С, от примерно комнатной температуры до примерно 96°С или от примерно 40 до примерно 96°С. Для повышения концентрации цианата очевидно, что инкубация при низких температурах требует длительного времени инкубации, в то время, как инкубация при высоких температурах требует более короткого времени инкубации. Тем не менее, необходимо учитывать возможность деградации (распада) полипептида при более высоких температурах. Предпочтительно, например, время инкубации от примерно 20 мин до примерно 4 ч или от примерно 30 мин до примерно 2 ч. В особенности, предпочтительно время инкубации от примерно 1 ч при температуре примерно 96°С. Также предпочтительно время инкубации от примерно 1 до примерно 3 ч, предпочтительно 2 ч при температуре от примерно 60 до примерно 90°С, в особенности предпочтительно от примерно 70 до примерно 80°С. Приемлемые для инкубации условия повышения концентрации цианата в чистом растворе мочевины или в растворе мочевины, содержащем полипептиды. Можно определить путем измерения концентрации цианата. Способы измерения концентрации цианата известны из уровня техники специалисту в данной области техники (см. e.g. Marier et al. (1964), Analytical Biochemistry 7:304). Значение рН согласно этапу а) в заявленных способах предпочтительно находится от примерно 3,0 до примерно 9,0, более предпочтительно примерно 3,9, 6,8 или 8,7. В частности, карбамилирование фосфатных групп можно улучшить путем повышения значения рН. Тем не менее, карбамилирование лизиновых групп происходит предпочтительно при кислых значениях рН. Еще в одном из вариантов практического воплощения карбамилирование полипептида достигается применением методов количественного карбамилирования полипептидов, описанных Angel и соавторами (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). Соответственно, полипептиды растворяют в 100 мкл 8 М мочевины, 200 мМ Tris-HCl, рН 7,4. Данный раствор восстанавливают с 20 мМ дитиотреитола (ДТТ) в течение 2 ч при 50°С, с последующим карбамидометилированием с 45 мМ иодоацетамида (ИДА) при комнатной температуре в течение 1 ч. Раствор денатурируют, восстанавливают и алкилированные полипептиды растворяют 1:8 с 50 мМ бикарбоната аммония с целью коррекции концентрации мочевины до 1 М и инкубируют в течение ночного времени суток при 37°С. После расщепления (настаивания) раствор просушили и растворили в 300 мкл 8 М мочевины, 200 мМ Tris-HCl, рН 8,5. После этого образцы перемешали на вортексе до полного растворения и затем инкубировали в течение 4 ч при 80°С с периодическим перемешиванием образцов. В одном из вариантов практического воплощения заявленного изобретения цианат добавляют к раствору мочевины согласно этапу а) заявленных способов. Таким образом, конечная концентрация цианата находится в предпочтительных пределах от примерно 1 до примерно 1000 ммоль/л. Более предпочтительна концентрация цианата от примерно 5 до примерно 900 ммоль/л, от примерно 10 до примерно 800 ммоль/л, от примерно 20 до примерно 700 ммоль/л или от примерно 50 до примерно 600 ммоль/л. В частности, предпочтительна концентрация цианата от примерно 100 до примерно 500 ммоль/л, как, например, концентрация цианата примерно 100, примерно 150, примерно 200, примерно 250, примерно 300, примерно 350, примерно 400, примерно 450 или примерно 500 ммоль/л. В одном из вариантов практического воплощения заявленного изобретения карбамилирование полипептида согласно этапу а) можно получить путем инкубации полипептида в цианате щелочных металлов, органическом цианате или органическом изотиоцианате в щелочной среде. Время инкубации может занимать от нескольких минут до примерно 36 ч, предпочтительно от примерно 30 мин до примерно 24 ч, предпочтительно от примерно 1 до примерно 12 ч. Температура инкубации предпочтительно составля- 16 - 020583 ет как минимум примерно 20°С, примерно 30°С, примерно 40°С или примерно 50°С. Значение рН предпочтительно составляет от примерно 7 до 11, более предпочтительно от примерно 8 до примерно 10. Предпочтительно использование цианово-кислого калия, цианово-кислого натрия, цианово-кислого серебра или β-Estradiol 6 oxime (конъюгат изоцианата БСА флуоресцеина). Карбамилированные полипептиды затем применяют для инкубирования клеток согласно этапу б) заявленных способов. Количество полипептида, используемого в расчете на приблизительно 106 клеток, должно составлять от примерно 0,1 до примерно 200 мкг или выше, от примерно 0,1 до примерно 200 мкг, от примерно 0,1 до примерно 2 мкг, от примерно 0,1 до примерно 10 мкг, от примерно 10 до примерно 50 мкг или от примерно 50 до примерно 200 мкг полипептида. В одном из вариантов практического воплощения заявленного изобретения концентрация мочевины согласно этапу б) составляет от примерно 0,001 до примерно 0,8 моль/л, предпочтительно от примерно 0,001 до примерно 0,2 моль/л, от примерно 0,001 до примерно 0,1 моль/л, от примерно 0,001 до примерно 0,01 моль/л, от примерно 0,01 до примерно 0,2 моль/л, от примерно 0,01 до примерно 0,1 моль/л или от примерно 0,1 до примерно 0,8 моль/л. Тем не менее, концентрация мочевины также может составлять менее 0,001 моль/л. В случае присутствия общего большого количества жизнеспособных (живых) клеток, и если соотношение живых клеток к фиксированным получается в пользу доминирования живых клеток, концентрация мочевины согласно этапу б) должна составлять менее чем приблизительно 0,8 моль/л, предпочтительно менее чем приблизительно 0,3 моль/л. Наиболее предпочтительна концентрация мочевины согласно этапу б) от примерно 0,01 до примерно 0,1 моль/л, от примерно 0,015 до примерно 0,09 моль/л, от примерно 0,02 до примерно 0,08 моль/л, от примерно 0,025 до примерно 0,07 моль/л, от примерно 0,03 до примерно 0,06 моль/л или от примерно 0,035 до примерно 0,05 моль/л. Наиболее предпочтительна концентрация мочевины согласно этапу б) на уровне примерно 0,04 моль/л. Помимо этого, раствор мочевины согласно этапу б) заявленных способов может дополнительно содержать NaCl, предпочтительно в концентрации в пределах примерно от 0,25 до примерно 200 ммоль/л или от примерно 0,25 до примерно 75 ммоль/л. Альтернативно или дополнительно, раствор мочевины согласно этапу б) заявленных способов может содержать ДТЭ или ДТТ, предпочтительно с концентрацией от примерно 0,25 до примерно 200 нмоль/л или от примерно 0,25 до примерно 75 нмоль/л. Кроме того, концентрация ДТЭ или ДТТ может составлять менее 0,25 или выше 200 нмоль/л. Карбамилированные полипептиды инкубируют с клетками согласно этапу б) по заявленному изобретению, предпочтительно в течение примерно от 1 мин до примерно 240 ч или дольше, предпочтительно в течение примерно от 2 до примерно 6 ч, или от примерно 6 до примерно 12 ч, или от примерно 12 до примерно 36 ч, или от примерно 36 до примерно 240 ч. В другом варианте практического воплощения заявленных способов инкубацию согласно этапу б) проводят в среде, содержащей липополисахариды (ЛПС). Активность ЛПС согласно этапу б) предпочтительно составляет от примерно 0,001 до примерно 10000 ед./мл, примерно от 0,01 до примерно 8000 ед./мл, от примерно 0,2 до примерно 6000 ед./мл, примерно от 1 до 1000 ед./мл или от примерно 10 до 100 ед./мл. Инкубация полипептидов согласно этапу а) приводит к повышению молекулярного веса полипептидов и/или сдвигу значения pKi полипептида в сторону более кислотного значения pKi. Для подтверждения факта карбамилирования обработанных полипептидов согласно этапу а) и наличия повышенного молекулярного веса в сравнении с некарбамилированными полипептидами, могут применять традиционные способы, известные специалистам в области техники. Например, сравнение молекулярного веса могут анализировать путем сепарации и анализа SDS-PAGE (анализ методом электрофореза в полиакриламидном геле с додецилсульфатом натрия), анализа MALDI-TOF MS (времяпролетная ионизация лазерной десорбцией с использованием матрицы в масс-спектрометрии) или ЯМРспектроскопия (ядерная магнитно-резонансная спектроскопия). Анализ MALDI-TOF MS представляет собой метод, при котором копреципитат УФ-абсорбирующей матрицы и биомолекулу облучают наносекундным импульсным лазером. Большую часть энергии лазера абсорбируется матрицей, что предотвращает нежелательную фрагментацию биомолекулы. Ионизированные биомолекулы ускоряются в электрическом поле и поступают в пролетную трубку. Во время пролета в данной трубке различные молекулы сепрарируют в соответствии с их весом (в зависимости от удельного заряда) и достигают детектора в различное время. Таким образом, каждая молекула производит характерный сигнал. Метод применяют для детекции и описания характеристических свойств биомолекул, как, например, белков, пептидов, олигосахаридов и олигонуклеотидов, с молекулярным весом от 400 до 350,000 Да. Например, значения pKi можно сравнить и проанализировать путем двумерного электрофореза. Метод детекции полипептид-специфических Т-клеток в соответствии с заявленным изобретением применим в различных научно-исследовательских и медицинских областях, например, для анализа, в диагностике и лечении. Применяя заявленный способ, можно определить одновременно различные популяции полипептид-специфических иммунных клеток, например, для мониторинга (контроля) эффективности терапевтических и профилактических вакцинаций или индуцирования иммунных клеток, для - 17 - 020583 определения эффективности терапевтического лечения заболеваний с применением иммунных клеток, с целью скринингового отбора безопасных и эффективных медикаментозных средств, которые вызывают делецию анергических иммунных клеток или приводят к общему подавлению иммунитета, с целью мониторинга и диагностики заболеваний, вызванных микроорганизмами и паразитами, включающими иммунные клетки, с целью мониторинга и диагностики хронических воспалительных заболеваний с применением иммунных клеток, с целью мониторинга и диагностики иммунных клеток, специфических к опухолевым антигенам, с целью мониторинга и диагностики иммунных клеток, которые играют роль при отторжении трансплантатов, с целью диагностики аутоиммунных заболеваний или специфического отбора доноров крови для испытаний вакцин и клинических испытаний терапевтических средств. Предпочтительно способ детекции в соответствии с заявленным изобретением осуществляется in vitro или ex vivo. Способ в соответствии с заявленным изобретением можно применять у всех позвоночных, которые вырабатывают иммунные клетки, в особенности Т-клетки, в особенности у человека, приматов и грызунов. Полипептид-специфические иммунные клетки можно детектировать и количественно определить, к примеру, при взятии у пациентов, страдающих от микробных инфекций, опухолевых заболеваний, хронических воспалительных заболеваний, отторжения трансплантатов или аутоиммунных заболеваний или же у здоровых доноров крови или участников группы клинических испытаний. Дополнительно, эпитопспецифические Т-клетки можно детектировать с использованием клеток, полученных заявленным способом, предпочтительно, АПК, полученные у приматов или других животных, которые вырабатывают эпитоп-специфические иммунные клетки. Способ детекции полипептид-специфических иммунных клеток в соответствии с заявленным изобретением можно применять в диагностике микробных инфекций, аутоиммунных заболеваний, отторжений трансплантатов и опухолевых заболеваний. В сравнении с уже известными способами детекции полипептид-специфических иммунных клеток заявленный способ характеризуется следующими преимуществами. (1) Одновременно можно подвергать детекции различные популяции полипептид-специфических иммунных клеток. (2) Детекцию различных популяций полипептид-специфических иммунных клеток можно проводить на образцах небольшого объема. (3) Одновременно можно определить количественные и качественные характеристики различных популяций полипептид-специфических иммунных клеток. (4) Отсутствуют ограничения по выбору специального оборудования, т.е. способ можно осуществить при помощи имеющегося в свободной продаже и постоянно используемого во многих диагностических лабораториях оборудования (FACS, ELISA-, ELISpot). (5) Способ можно повсеместно применять для детекции реактивных полипептид-специфических иммунных клеток, вне зависимости от HLA-констелляции донора крови/пациента. (6) Диагностический способ в соответствии с заявленным изобретением примемлем для детерминации пациент-специфической реактивности лимфоцитов по сравнению с комплексным полипептидом. В данном случае при осуществлении способа отпадает необходимость определения структур-мишеней данных иммунных клеток. (7) В сравнении с традиционными методами диагностики, основанными на стимуляции Т-клеток с пептидами, растворимыми белками, клеточными лизатами, экспрессионными плазмидами или РНК, данный способ детекции полипептид-специфических иммунных клеток можно применять повсеместно, является намного более простым в применении, значительно менее затратен в финансовом и временном аспектах и более точен. Способ улучшенного примирования, выращивания и реактивации специфических к полипептиду Тклеток в соответствии с заявленным изобретением можно применять в диагностических, терапевтических и профилактических целях. В частности, реактивация специфических к полипептиду Т-клеток является наиболее важным этапом детекции и/или количественного анализа специфических к полипептиду Тклеток в диагностических целях. В сравнении, выращивание специфических к полипептиду Т-клеток можно применять для подготовки клеток для терапевтических или исследовательских целей. В частности, полипептиды, полученные согласно этапу а) в соответствии с заявленными способами, можно использовать для примирования и реактивации специфических к полипептиду Т-клеток in vivo для, к примеру, лечения или предотвращения заболеваний. Предпочтительно полипептиды, полученные согласно этапу а) в соответствии с заявленными способами, можно использовать в качестве профилактических или лечебных вакцин. В связи с этим, полипептиды, полученные согласно этапу а) в соответствии с заявленными способами, предпочтительно диализируют в буферсодержащей мочевине, предпочтительно от примерно 0,001 до примерно 0,2 моль/л, более предпочтительно от примерно 0,01 до примерно 0,1 моль/л. Кроме того, буфер содержит предпочтительно ФСБ. Более предпочтительно упомянутый буфер не содержит двухвалентные ионы. Таким образом, заявленное изобретение относится к фармацевтической композиции, содержащей полипептиды согласно этапу а) и предпочтительно подвергнутые вышеописанному диализу в буферсо- 18 - 020583 держащей мочевине, предпочтительно от примерно 0,001 до примерно 0,2 моль/л, более предпочтительно от примерно 0,01 до примерно 0,1 моль/л. Более того, буфер содержит предпочтительно ФСБ. Более предпочтительно упомянутый буфер не содержит двухвалентные ионы. Кроме того, фармацевтическая композиция предпочтительно содержит адъюванты или иммуностимулирующие вещества. Предпочтительно фармацевтическая композиция применима для введения пациенту, предпочтительно путем инъекции. Фармацевтическая композиция предпочтительно применима для использования в качестве вакцины или для лечения и профилактики инфекционных заболеваний и/или опухолей. Кроме того, заявленное изобретение относится к применению клеток, полученных в соответствии с заявленными способами, в различных областях. Клетки, обработанные в соответствии с заявленными способами, можно применять в исследовательских, диагностических и лечебных целях и профилактике заболеваний у животных и человека. Например, АПК, полученные с применением заявленных способов, применимы в терапевтических и профилактических целях для борьбы с инфекционными заболеваниями и опухолями. В еще одном аспекте заявленное изобретение относится к применению заявленных способов в совокупности различных научно-исследовательских, медицинских и диагностических областях, например, для: (а) исследования важности роли данных полипептидов в клеточных процессах, (б) индукции гуморального и клеточного иммунных ответов в экспериментах с участием животных и у человека, (в) получения сыворотки и антител в диагностических, терапевтических и профилактических целях, (г) индукции достаточно эффективных иммунных ответов для защиты от или в лечении микробных инфекций и опухолевых заболеваний, (д) терапевтических и профилактических вакцин или (е) стимуляции ex vivo Т-клеток в диагностических, терапевтических и профилактических целях, (ж) идентификации неоструктур-мишеней (эпитопов) цитотоксических Т-клеток. Таким образом, заявленное изобретение относится к применению карбамилированных полипептидов для индуцирования специфических Т-клеток у животных, в особенности у млекопитающих, например мышей, крыс, кроликов, овец, коз, лошадей, рогатого скота, свиней, собак, кошек и приматов. Карбамилированные полипептиды можно также применять для индукции клеточных иммунных ответов у человека. В данном случае карбамилированные полипептиды можно вводить по отдельности или в сочетании в иммуностимулирующими агентами ("адъювантами") или иммуномодулирующими веществами (например, липополисахаридами (ЛПС)) и/или в сочетании с мочевиной. Наиболее приемлемыми адъювантами и иммуномодулирующими стимулирующими агентами для повышения эффективности описанных выше сочетаний вакцин и вакцин, являются, например: (1) гелеподобные адъюванты, как, например, алюминиевые соли, как, например, гидроокись алюминия, фосфат алюминия, сульфат алюминия и фосфат кальция; (2) микробные адъюванты, как, например, бактериальные нуклеиновые кислоты и синтетические олигодезоксинуклеотиды (ОДН), включая CpG-мотивы (например, CpG 1668 или CpG 2216; (Waibler et al. (2008), Europ. J. Immunol. 38:3127), эндотоксины, как, например, монофосфорил липид А, экзотоксины, как, например, токсины дифтерии, холеры, столбнячный токсин, термолабильный энтеротоксин Е.coli и мурамоил дипептиды, как, например, MDP; (3) масляные эмульсии и вакцины на основе эмульсий, как, например, неполный адъювант Фрейнда (IFA), MF59, SAF и Ribi™ адъювантные системы (RAS), (Ribi Immunochem, Hamilton, Mont.); (4) некоторые адъюванты, как, например, иммуностимулирующие комплексы (ISCOMs), липосомы, PLG полимеры, биоразлагаемые микросферы и сапонины (QS-21), и синтетические адъюванты, как, например, неионные блок-полимеры, аналоги мурамилпептидов, полифасфазен и синтетические полинуклеотиды и (5) цитокины, например интерлейкины (IL-1, IL-2, IL-12, помимо прочих), гранулоцитарно-моноцитарный колониестимулирующий фактор/макрофагальный колониестимулирующий фактор (GM-CSF) или колониестимулирующий фактор макрофагов (M-CSF), а также фактор некроза опухолей (TNF). В дополнение к адъювантам могут применяться все прочие вещества, которые оказывают иммуностимулирующий эффект повышения эффективности составов упомянутых вакцин. Перечень применимых доступных на рынке адъювантов доступен во всемирной сети Интернет по адресу (http://www.bvl.bund.de/nn_510850/EN/04_PlantProtectionProducts/03_PlantResistanceImproversAndAdjuvan ts/04_ListAdjuvants/ListAdjuvants_node.html_nnn=true). Упомянутые сочетания (комбинации) вакцин (например, карбамилированные полипептиды в соединении с фармацевтически приемлемым компонентом-носителем и/или адъювантом) добавляют к растворам, как, например, водные, солевые растворы, глицерол, этанол. Дополнительно, в данных композициях могут присутствовать добавочные компоненты, как, например, увлажняющие и эмульгирующие агенты, рН-буферные вещества и прочие подобные компоненты. Сочетания вакцин можно комбинировать в бустерных режимах с прочими вакцинами, например пептидами, рекомбинантными белками, ДНК-экспрессионными плазмидами, рекомбинантными вирусами и бактериями и жизнеспособными аттенюированными (ослабленными) патогенами. Данные комбинации вакцин обычно присутствуют в приемлемой для инъекций форме, либо в качестве жидких раство- 19 - 020583 ров, либо суспензий. Иммуногенные композиции можно эмульгировать или включать в липосомы с целью повышения адъювантных свойств, в соединении с фармацевтически приемлемым компонентом-носителем. Вакцинные композиции можно вводить различными приемлемыми путями, например перорально, наружно, внутривенно, внутрибрюшинно, внутримышечно, внутриартериально, подкожно, интраназально, внутрикожно или кожно. Вакцинную композицию вводят согласно инструкциям. Определение подходящей дозировки для различных организмов соответствует современному уровню техники. Упомянутую вакцинную комбинацию могут применять в профилактических или терапевтических целях. Кроме того, АПК, модифицированные с применением карбамилированных полипептидов, приемлемы для использования в терапевтических и профилактических целях. Способы получения и выращивания АПК ex vivo, а также для реинфузии модифицированных ex vivo АПК в организм, описаны в многочисленных публикациях и соответствует современному уровню техники. Нижеследующие примеры объясняют суть заявленного изобретения без ограничения касательно сути заявленного изобретения. Пример 1. Карбамилирование полипептидов путем обработки с мочевиной при высокой температуре. Очищенный HIV капсидный белок р24 (0,84 мг/мл; растворенный в 150 мМ NaCl, 50 мМ NaP, pH 7,6), имеющийся в свободной продаже альбумин бычьей сыворотки (БСА; альбуминовая фракция V, Applichem); (1 мг/мл в Н2О) или частицы парвовируса В19 VP2 (Lindner et al. (2008), Journal of Infectious Diseases, 198:1677); (0,64 мг/мл растворили в 38% (по весу) CsCl) смешали 1:1:1 (по объему) либо с Н2О и 30 мМ трис рН 3,9 или 6 М свежеприготовленного раствора мочевины и 30 мМ трис рН 3,9 и затем инкубировали в течение 60 мин при 96°С в термошейкере (300 об/мин). Затем, белки сепарировали при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия 12,5% (HTV р24) или 10% (PAGE) (БСА, Парвовирус В19 VP2) и белки визуализировали окрашиванием кумасси бриллиантовым голубым. Сепарацию белков при помощи SDS PAGE и окрашивание белков осуществили в соответствии с практикумом Molecular cloning: A laboratory manual, third edition (Sambrook et al. (2001), Cold Spring Harbor Laboratory, New York). Данные опыты показали, что инкубация с мочевиной при высоких температурах приводит к химической модификации полипептидов, как показано при помощи измененной миграции в SDS полиакриламидном геле. Таким образом, различные полипептиды, например HTV р24, БСА и парвовирус В19 VP2 показали значительное различие в наблюдаемом сдвиге массы, в зависимости от числа участков карбамилирования и его эффективности. Пример 2. Карбамилирование полипептидов в соответствии с различными протоколами карбамилирования. Доступный в свободной продаже БСА (1 мг/мл в Н2О) смешали 1:1:1 (по объему) с Н2О/HCl (рН 3,6) и 30 мМ Tris pH 3,6 или с 6 М раствора мочевины и 30 мМ трис рН 3,6 и инкубировали образцы в течение 0 мин, 30 мин или 60 мин при 96°С в термошейкере (300 об/мин). Альтернативно, БСА обработали в соответствии с протоколом карбамилирования белков, описанным Angel и соавторами (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). 10 нмоль БСА растворили в 100 мкл 8 М мочевины/200 мМ трис-HCl, рН 7,4. Данный раствор восстановили с 20 мМ дитиотреитола (ДТТ) в течение 2 ч при 50°С, с последующим карбамидометилированием с 45 мМ иодоацетамида (ИДА) при комнатной температуре в течение 1 ч. Раствор денатурированных, восстановленных и алкилированных белков разбавили 1:8 с 50 мМ бикарбоната аммония с целью коррекции концентрации мочевины до 1 М и инкубировали в течение ночного времени суток при 37°С. Затем, раствор просушили и растворили в 300 мкл 8 М мочевины/200 мМ трис-HCl, рН 8,5. Затем, образцы подвергли перемешиванию на вортексе до полного растворения, после чего инкубировали в течение 4 ч при 80°С, с периодическим перемешиванием образцов на вортексе (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623). Затем, карбамилированные белки сепарировали при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия 10% (PAGE) и визуализировали окрашиванием кумасси бриллиантовым голубым. Данный опыт показывает, что инкубация БСА с мочевиной в соответствии с различными протоколами карбамилирования приводит к различной эффективности карбамилирования белков. При этом инкубация БСА с мочевиной при 96°С в течение 60 мин индуцирует более эффективное карбамилирование БСА, чем обработка с мочевиной в течение 30 мин, что подтверждается пониженной миграцией в SDS полиакриламидных гелях. В сравнении с обработкой с осажденной мочевиной при высоких температурах, карбамилирование по протоколу, описанному Angel и соавторами, индуцировало более эффективное карбамилирование БСА. Тем не менее, упомянутое карбамилирование согласно протоколу Angel и соавторов привело к повышенной деградации БСА. Результаты данных опытов показывают, что эффективность карбамилирования полипептидов можно контролировать с использованием различных протоколов карбамилирования, варьируя, таким образом, исходные продукты и/или время инкубации. Пример 3. Карбамилирование БСА с мочевиной согласно различным протоколам карбамилирования приводит к появлению модифицированных БСА белков с измененным значением pKi. - 20 - 020583 Доступный в свободной продаже БСА (1 мг/мл в Н2О) смешали 1:1:1 (по объему) с Н2О/HCl (рН 3,6) и 30 мМ трис рН 3,6 или с 6 М раствора мочевины и 30 мМ трис рН 3,6 и инкубировали образцы в течение 0 мин, 30 мин или 60 мин при 96°С. Альтернативно, обработали БСА согласно протоколу карбамилирования белков, описанному Angel и соавторами (Angel et al. (2007), Rapid Commun. Mass Spectrom. 21:1623), как описано в примере 2. Затем, модифицированные БСА белки сепарировали при помощи изоэлектрического фокусирования на полосках ИЭФ 26350 Vh, с последующим электрофорезом в 10% SDSPAGE и визуализировали белки окрашиванием серебром. 2-D (двумерный) электрофорез осуществили в соответствии с руководством по эксплуатации "ImmobilineR DryStrip Kit for 2-D electrophoresis with ImmobilineR DryStrip and ExcelGel SDS" 18-1038-63 Edition AB (Pharmacia Biotech) при помощи Multiphor II Electrophoresis System (Pharmacia) и Electrophoresis Power Supply EPS 3500 XL. Данные опыты показали, что химическая модификация БСА в соответствии с различными протоколами карбамилирования приводит к снижению изоэлектрической точки БСА. Таким образом, снижение изоэлектрической точки находится в соотношении со степенью (интенсивностью) карбамилирования. Таким образом, обработка белков согласно протоколу, описанному Angel и соавторами, приводит к индукции значительного сдвига изоэлектрической точки БСА, после нагрева БСА при 96°С в мочевине в течение 60 мин или нагреванию БСА при 96°С в мочевине в течение 30 мин. Дополнительно, нагрев БСА в мочевине при 96°С в течение 60 мин приводит к появлению 2 форм частично карбамилированных белков. Пример 4. Влияние значения рН на карбамилирование БСА путем обработки с 2 М раствора мочевины. В данном опыте альбумин бычьей сыворотки (БСА; 1 мг/мл в Н2О) смешали 1:1:1 (по объему) с 6 М раствора мочевины и 30 мМ трис рН 3,9 или 30 мМ трис рН 6,8 или 30 мМ трис рН 8,7 или альтернативно БСА (1 мг/мл в Н2О) смешали 1:1:1 (по объему) с Н2О и 30 мМ трис рН 3,9 или 30 мМ трис рН 6,8 или 30 мМ трис рН 8,7. Затем, образцы инкубировали в течение 2 ч при 96°С в термошейкере (300 об/мин) и сепарировали при помощи 10% SDS-PAGE. Белки визуализировали окрашиванием кумасси бриллиантовым голубым. Данные опыты показали, что на химическую модификацию (частичное карбамилирование) БСА, наблюдаемое после обработки с 2 М мочевины, 10 мМ трис в течение 2 ч при 96°С, не оказывает значительного влияния значение рН, составляющее от 3,9 до 8,7. Пример 5. Роль времени инкубации в карбамилировании БСА с мочевиной. БСА (1 мг/мл в Н2О) смешали 1:1:1 (по объему) с 6 М мочевины и 30 мМ трис рН 3,9 и инкубировали в течение от 0 до 60 мин (0, 2, 3, 4, 5, 20, 30, 45, 60 мин) при 96°С. В отдельном опыте, БСА смешали 1:1:1 (по объему) с 6 М мочевины и 30 мМ трис рН 3,9 и инкубировали в течение от 0 до 8 ч (0, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 4, 5, 6, 7, 8 ч) при 96°С. Затем, сепарировали образцы при помощи 10% SDS-PAGE и визуализировали белки окрашиванием кумасси бриллиантовым голубым. Данные опыты показали, что обработка БСА с 6 М мочевины и 30 мМ трис рН 3,9 при 96°С приводит к зависимому от времени повышению степени карбамилирования БСА, как показано при помощи замедленной седиментации модифицированных БСА белков в SDS полиакриламидных гелях. При этом определяемое (детектируемое) повышение в молекулярной массе БСА наблюдали уже по истечении от 2 до 3 мин инкубации. Повышение в молекулярной массе БСА наблюдали в течение до 2 ч инкубации. При более поздних временных точках, обработка БСА с мочевиной при 96°С приводит к уменьшению количества детектируемого БСА белка, что предполагает несомненную деградацию модифицированного БСА. Пример 6. Влияние температуры инкубации на карбамилирование БСА с мочевиной. БСА (1 мг/мл в Н2О) смешали 1:1:1 (по объему) с 6 М мочевины и 30 мМ трис рН 3,9 и инкубировали в течение 2 ч при температурах от 0 до 96°С (0, 4, 18, 30, 40, 50, 60, 70, 80, 90, 96°С). После этого сепарировали образцы при помощи 10% SDS-PAGE и визуализировали белки окрашиванием кумасси бриллиантовым голубым. При описываемых условиях опытов наблюдали детектируемое карбамилирование БСА при температурах инкубации выше 60°С. Пример 7. Модуляция изоэлектрической точки IE1 белка человеческого цитомегаловируса (ЦМВ) путем обработки с осажденной мочевиной (подвергнутой нагреву в течение более 1 ч при 96°С, затем инкубировали в течение от 7 до 14 дней при комнатной температуре). Либо 100 мкл IE1 белка (0,89 мкг/мл в фосфатно-солевом буфере (ФСБ) (Lonza)), либо IE1 (в ФСБ) смешали 1:1 (по объему) с 8 М осажденной мочевины (нагретой в течение более 1 ч при 96°С, затем инкубировали в течение от 7 до 14 дней при комнатной температуре) инкубировали в течение ночного времени суток при 40°С. Затем, белки сепарировали при помощи изоэлектрического фокусирования на полосках ИЭФ (Immobiline DryStrip pH 3-10, 13 см, GE Healthcare) при 37500 Vh с последующим 10% SDS-PAGE. Белки визуализировали окрашиванием серебром. Результаты данных опытов показывают, что инкубация с осажденной мочой индуцирует химические модификации, снижая изоэлектрическую точку ЦМВ IE1. - 21 - 020583 Пример 8. Анализ MALDI-TOF MS (время-пролетная ионизация лазерной десорбцией с использованием матрицы) необработанных и карбамилированных БСА. Для MALDI-TOF-мишени применили способ высушенной капли. Таким образом, растворили полипептиды в буфере (50% ацетонитрила (АЦН), сорт LC/NS (J.T. Baker), 0,01% трифлуоруксусной кислоты (TFA), степень чистоты для секвенирования полипептидов (Applied biosystems) и затем растворили напрямую с матричным раствором, содержащим а-циано-4-гидроксикоричную кислоту в соотношении матрица-образец от 1:1 до 10:1. После этого 1 мкл смеси матрица-образец нанесли на чашку с образцами, высушили при комнатной температуре и подвергли анализу с использованием анализатора MALDI-TOF 4800 plus Analyzer производства Applied Biosystems. Массовые спектры зарегистрировали рефлектором Bruker reflex V замедленной экстракцией массспектрометром MALDI-TOF, оборудованным цифрователем 2GHz LeCroy и 337 нм N2 лазером, используя следующие параметры: положительная полярность, ускоряющее напряжение 20 кВ; IS/2 17 кВ; напряжение фокусирующих линз 8,90 кВ; задержка экстракции 400 нс. Детектор пропускного типа. Примерно 100 столкновений зафиксировали в трех до пяти различных положениях в пределах одного образца. Идентификацию белков осуществили с использованием MASCOT (MatrixScience) и путем поиска отпечатков соответствующих белковых масс в базе данных по белкам. Применяемые критерии поиска - фиксированная модификация карбоксиамидометилирования цистеина, вариабельная модификация окисления метионина и точность проведения опыта касательно теоретической изоэлектрической точки и молекулярного веса. Белковые скоры имеют повышенное значение при значении р менее 0,05 (значение р - возможность того, что наблюдаемое совпадение представляет собой случайное событие). Спектры измерили у немодифицированных БСА; сдвоено-изотопическая протонированная масса 33230,3 и БСА после смешивания (1:1; по объему) с осажденной 8 М мочевиной (нагретой в течение более 1 ч при 96°С, затем инкубированная в течение от 7 до 14 дней при комнатной температуре); сдвоеноизотопическая протонированная масса 33497. Таким образом, при данных условиях реакции, обработка мочевиной БСА индуцировала сдвиг массы 226,7 Да, относительно 12,4±2 карбамилирования. Пример 9. Анализ карбамилирования полипептидов при помощи ядерной магнито-резонансной (ЯМР)-спектроскопии. С немеченым белком традиционно регистрируют совокупность 2D гомоядерных опытов: корреляционная спектроскопия (COSY), TOCSY и NOESY. Таким образом, 190 мкл раствора полипептида, 190 мкл ФСБ (Lonza) и 20 мкл стандартного раствора S5 (D2O плюс триметилсилил-2,2,3,3тетрадейтеропропионную кислоту (TSP)) поместили в 5 мм ампулу для ЯМР-спектроскопии (Norell 502). Образцы гомогенно смешали путем осторожного переворачивания закрытой ампулы и проанализировали с использованием ЯМР-спектрометра Bruker AVANCE II+ 600 МГц при следующих параметрах: Температура: 283 K (10°С) Образец: TXI Метод: 500-XXX-Lif600-TXI-V1 NS (переходы): 128 (1D-Spectra), а именно 16 (2D-Spectra) SWH (спектральное окно): 9591 Гц (эквивалентно 16 мг/м3) D1 (время между перескоками): 2 с Пример 10. Роль температуры и времени инкубации в карбамилировании БСА с мочевиной. В данном опыте БСА (1 мг/мл в Н2О) смешали 1:1 (по объему) либо со свежеприготовленным раствором 4 М мочевины, либо с 4 М мочевины, предварительно обработанной в течение 1 ч при 96°С, затем быстро охладили до 40°С и выдержали в течение 10 мин при 40°С. Затем образцы инкубировали в течение 0, 2, 4 или 17 ч при 40°С в термошейкере (300 об/мин). Затем сепарировали белки при помощи 10% SDS-PAGE и визуализировали белки окрашиванием кумасси бриллиантовым голубым. Данные опыты показали, что свежеприготовленный раствор 4 М мочевины был менее эффективен в карбамилировании БСА, чем подогретая мочевина. Дополнительно, детектировали значительное увеличение молекулярной массы БСА по истечении 17 ч, но не ранее 2 и 4 ч после инкубации, как в случае использования свежеприготовленной, так и подогретой мочевины. При вышеописанных условиях обработанные с мочевиной БСА показали всего лишь незначительное увеличение в молекулярной массе, подтверждая частичное карбамилирование БСА. Пример 11. Карбамилирование БСА с осажденной мочевиной. БСА (1 мг/мл в Н2О) смешали 1:1 (по объему) с осажденной 4 М мочевиной (которую предварительно обработали в течение 1 ч при 96°С и затем инкубировали в течение 8 дней при комнатной температуре) и затем инкубировали в течение 0 до 24 ч (0, 2, 4, 6, 8, 10, 24 ч) при 40°С. Затем сепарировали образцы при помощи 10% SDS-PAGE и визуализировали белки окрашиванием кумасси бриллиантовым голубым. В данных опытах детектируемое увеличение молекулярной массы БСА наблюдали после 24 ч, но не после 2 до 10 после инкубации с осажденной мочевиной. Пример 12. Химическая модификация (карбамилирование) БСА с осажденной мочевиной приводит к появлению модифицированных БСА белков, с измененным значением pKi. - 22 - 020583 БСА (1 мг/мл в Н2О) смешали 1:1:1 (по объему) с H2O/HCl (рН 3,6) и 30 мМ трис рН 3,6 или с 6 М раствора мочевины и 30 мМ трис рН 3,6 и инкубировали образцы в течение 0, 30 или 60 мин при 96°С. Альтернативно, 10 мМ БСА смешали 1:1 (по объему) с 4 М осажденной мочевины (подогретой в течение 1 ч при 96°С, затем выдержанной в течение 3 месяцев при комнатной температуре) и инкубировали в течение 20 ч при 40°С. После этого сепарировали белки при помощи изоэлектрического фокусирования на полосках ИЭФ (Immobiline DryStrip pH 3-10, 11 см, GE Healthcare) при 26350 Vh, с последующим электрофорезом в 10% SDS-PAGE и визуализировали белки окрашиванием серебром. Данные опыты продемонстрировали, что и нагрев смесей мочевина/БСА, и инкубация БСА с осажденной мочевиной приводит к появлению модифицированных БСА белков, с измененной изоэлектрической точкой. При описанных условиях подогрев смесей БСА/мочевина при 96°С приводит к значительно более выраженному восстановлению изоэлектрической точки, по сравнению с инкубацией БСА с осажденной мочевиной при 40°С. Дополнительно, более длительный нагрев смесей БСА/мочевина приводит к непрерывному понижению изоэлектрической точки БСА, подтверждая повышенное карбамилирование БСА. Пример 13. Химическое карбамилирование БСА при помощи обработки с цианово-кислым калием. В данных опытах БСА (1 мг/мл в Н2О) инкубировали в течение 1 ч при 40°С, либо с 25, 100, 500 или 1000 мМ цианово-кислого калия в термошейкере (300 об/мин). Затем, образцы сепарировали при помощи 12,5% SDS PAGE и визуализировали окрашиванием кумасси бриллиантовым голубым. В данных опытах инкубация с цианово-кислым калием индуцировала значительное увеличение молекулярной массы БСА путем карбамилирования. Пример 14. Химическое карбамилирование БСА при помощи обработки с цианово-кислым калием. В данных опытах BSA (1 мг/мл в Н2О) инкубировали в течение 19,5 ч при 40°С, либо с 0, 1, 5, 10, 20, 50, 100, 200 или 500 мМ цианово-кислого калия в термошейкере (300 об/мин). Затем, образцы сепарировали при помощи 10% SDS PAGE и визуализировали окрашиванием кумасси бриллиантовым голубым. В данных опытах инкубация с цианово-кислым калием индуцировала значительное увеличение молекулярной массы БСА путем карбамилирования. Пример 15. Получение и очищение IE1 белка человеческого цитомегаловируса (ЦМВ) в E.coli. С целью получения IE1 белка человеческого цитомегаловируса (ЦМВ) плазмиду pGEX-KG-IE1 трансформировали в штамм Е.coli M15[pRep4]. Для построения pGEX-KG-IE1 ген, кодирующий белок IE1, удалили из плазмиды pcDNA-IE1 с использованием рестрикционных энзимов HindIII/EcoRI и обработали с энзимом Klenow. Полученный фрагмент затем клонировали в SmaI/EcoRI дигестированную плазмиду pGEX-KG, которую обработали с щелочной фосфатазой, до сшивания, с целью предотвращения самоотжига вектора. Для генерации pcDNA-IE1, удалили кодирующую область белка IE1 с KpnI/BamHI из плазмиды pCGN-IE1 (Nevels et al. (2004), J. Virol. 78:7803) и вставили в KpnI/BamHI дигестированную плазмиду pcDNA3 (Invitrogen). Все этапы клонирования осуществили в соответствии с практикумом Molecular cloning: A laboratory manual, third edition (Sambrook et al. (2001), Cold Spring Harbor Laboratory, New York). Плазмида pRep4 кодирует репрессор промотора lac (lacIq), что, таким образом, делает возможной практически полную репрессию получения (производства) белка pGEX-экспрессирующими векторами в отсутствие индуктора экспрессии белка. Для получения ЦМВ IE1, выдержанные в течение ночного времени суток культуры pGEX-KG-IE1 трансформированного штамма Е.coli M15[pRep4] растворили в LBamp/kana среде и индуцировали экспрессию IE1 в течение 16 ч с 1 мМ изопропилтиогалактозида (IPTG). Индуцированные клетки вызвали производство повышенного уровня IE1 белков с молекулярной массой примерно 80 и 32 кДа, соответствующие массам глутатион-S-трансферазы (GST)-IE1 и белков GST и добавочных белков с более низкой молекулярной массой, презентирующие продукты деградации GSTIE1 и GST белка. Идентичность данных белков подтвердили при помощи иммуноблоттинга с использованием IE1-специфического мышиного анти-ЦМВ IE1 моноклонального антитела ((клон lB12) (Zhu et al. 1995, J. Virol. 69: 7960). Таким образом, M15[pRep4] клетки трансфицировали с плазмидой pGEX-KG-IE1 и лизировали аликвоты клеток до и после 16 ч индукции IPTG. После этого клеточные лизаты подвергли электрофорезу 10% SDS-PAGE и перенесли сепарированные белки в нитроцеллюлозу. Затем, IE1 белки визуализировали с использованием анти-IE1 моноклонального антитела (клон 1В12). Сепарацию белков при помощи SDS PAGE и последующий анализ белков методом иммуноблоттинга осуществили в соответствии с описанием в практикуме Molecular cloning: A laboratory manual, third edition (Sambrook et al. (2001), Cold Spring Harbor Laboratory, New York). Для очищения IE1 белков pGEX-KG-IE1 трансформированные M15[pRep4] клетки седиментировали после 16 ч индукции EPTG при помощи центрифугирования в течение 10 мин при 11000 об/мин в центрифуге Eppendorf Centrifuge 5417R и пеллету ресуспендировали в ФСБ (Lonza) без бивалентных ионов (140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4; 1,8 мМ KH2PO4). Дополнительно, добавили смесь ингибиторов протеаз (комплект, Roche, 1 таблетка в 50 мл ФСБ (Lonza)) с целью предотвращения деградации белков. Затем, клетки подвергли полному лизированию с использованием французского жима (1,5 кбар, 4°С) и седиментировали клеточные детриты при помощи центрифугирования (15000 об/мин, 30 мин, 4°С - 23 - 020583 в роторе Sorvall SS34). Растворимую фракцию клеточного лизата, включающего гибридный белок GSTIE1, затем подвергли очистке в GST колонке. При этом обогащения гибридного белка GST-IE1 достигли путем связывания с Glutathione Sepharose и последующим элюированием с восстановленным глутатионом (50 мМ трис/HCl, 10 мМ восстановленного глутатиона, рН 8,5). Элюат собрали в 2 мл фракции и определили содержание белка в каждой фракции путем измерения оптической плотности при 280 нм. Белоксодержащие фракции анализировали при помощи 12,5% SDS PAGE и визуализировали окрашиванием кумасси бриллиантовым голубым. Фракции, содержащие гибридный белок GST-IE1, соединили вместе и инкубировали в течение 3 ч с тромбином (7 ед./мг гибридного белка GST-IE1) для сепарации GST tag. Затем, IE1 сепарировали от GST-IE1 гибридных белков при помощи анионообменной хроматографии с использованием колонок HQ-PorosR (Applied Biosystems). Таким образом, GST и IE1 показали существенные различия в изоэлектрических точках (GST: 6.52; IE1: 4.58). Поскольку GST не связан с колонкой и может быть детектирован в проходящем потоке, IE1 связывает и может подвергнуться элюированию из колонки с 540 мМ NaCl с использованием линейного NaCl градиента (50 мМ до 1 М). Элюат собрали в фракции 2 мл, а содержание белка в каждой фракции определили измерением оптической плотности при 280 нм. Белоксодержащие фракции проанализировали при помощи электрофореза 12,5% SDS PAGE и окрашиванием кумасси бриллиантовым голубым. Соединили фракции, содержащие IE1 белок. Для сепарации остаточных GST-IE1 гибридных белков, комбинированные антигены подвергли второй сепарации в колонке GST. Таким образом, GST-IE1 связывается с матрицей Glutathione Sepharose, при этом IE1 не связующий и не может быть детектирован в проходящем потоке. С целью анализа чистоты и идентичности, полученный IE1 подвергли электрофорезу 12,5% SDS-PAGE, а гель проанализировали путем окрашивания кумасси бриллиантовым голубым. Дополнительно, белки перенесли из отдельных гелей в нитроцеллюлозу, а белки IE1 специфически визуализировали иммуноблоттингом с использованием IE1-специфического моноклонального антитела (клон 1В12). Полученный IE1 белок вывел значение чистоты > 90%. Белок подвергли концентрированию с использованием концентрационного оборудования Amicon и фильтров с отсекаемым размером частиц 25 кДа. Концентрацию очищенного IE1 определили при помощи определения молярного коэффициента экстинкции. Таким образом, значение OD280 на уровне 21500 относится к 1 моль IE1 белка. От 4 до 8 мг очищенного IE1 белка получили из 1 л культуральной жидкости. Пример 16. Емкость карбамилированного IE1 белка и YIL пептида касательно специфической реактивации CD4+ и/или CD8+ Т-клеток. В данном опыте презентировали стабильность карбамилированных IE-1 белка и YIL пептида на молекулах ГКГ I и II классов, с последующим анализом способности реактивации полипептидспецифических CD4+ и CD8+ Т-клеток при помощи проточной цитометрии. К данному выводу логически приводит наблюдение, что практически все HLA А2-позитивные, ЦМВ-позитивные доноры крови вырабатывают CD8+ цитотоксические Т-клетки, которые узнают специфический эпитоп (YILEETSVML (SEQ ID NO: 4); аминокислота 315-324), (Prod'homme et al. (2003), J. Immunol 170:2030) внутри ЦМВ белка IE1. В качестве контроля стимулировали образцы с пептидом E10F, с покрытием мышиного ЦТЛ эпитопа в течение р24 капсидной области HIV-1(BH10) Gag (aa291-300) (Wild et al. (2004), Vaccine. 2004;22:17321743). Таким образом, гепаринизированную цельную кровь серопозитивного донора инкубировали в аликвотах 1 мл в стерильных пробирках фирмы Falcon (BD) с немодифицированными и карбамилированными IE-1 белком и YIL пептидом. Для карбамилирования очищенный IE1 белок (0,89 мкг/мл в ФСБ(Lonza)) или очищенный YIL пептид смешали 1:1 (по объему) с 8 М осажденной мочевины (предварительно инкубированной в течение ночного времени суток при 96°С) и инкубировали в течение ночного времени суток при 40°С. После этого осуществили следующие стимуляции: 1: контрольный пептид: немодифицированный HTV Pr55gag извлеченный пептид (10 мкг/мл); 2: немодифицированный IE1 белок (10 мкг/мл); 3: карбамилированный IE1 белок (10 мкг/мл); 4: немодифицированный IE1 извлеченный пептид YIL (10 мкг/мл); 5: карбамилированный IE1 извлеченный пептид YIL (10 мкг/мл). В дополнение к белкам или пептидам моноклональные антитела, эффективные в отношении костимулирующих молекул CD28 и CD49d (Becton Dickinson) добавили к конечной концентраци 1 мкг/мл. Клетки затем инкубировапри 37°С в течение 2 ч. Затем, 10 мкг/мл брефелдина А добавили к образцам с целью предотвращения секреции цитокинов. После этого образцы тщательно перемешали на вортексе и инкубировали при 37°С в течение еще 7 ч. После 9 ч инкубации добавили 100 мкл охлажденного до 0°С раствора ЭДТК (ЭДТК в ФСБ (Lonza), 20 мМ). Образцы быстро перемешали на вортексе и затем инкубировали в течение 10 мин при комнатной температуре. После этого образцы тщательно перемешали на вортексе и инкубировали с 9 мл лизирующего раствора FACS (BD) в течение 10 мин при комнатной температуре. Образцы затем центрифугировали при 4°С в течение 8 мин при 340g. Супернатант тщательно слили и дважды промыли клетки с 9 мл буфера FACS (ФСБ (Lonza) + 0,1% вес./об. NaN3 + 1% вес./об. FCS). Клетки затем ресуспендировали в - 24 - 020583 небольшом объеме FACS буфера для окрашивания поверхностных молекул. Таким образом, конъюгированные с флуорохромом (меченные флуоресцином) моноклональные антитела против поверхностных молекул (CD3 FITC, CD4 ECD и CD8 АПК) добавили в соответствии с протоколом производителя и инкубировали при комнатной температуре в течение 20 мин в темном помещении. Затем, клетки промыли с FACS буфером, как описано выше, зафиксировали через добавление 0,5 мл 2% параформальдегида (2% в ФСБ (Lonza)) и инкубировали в течение 10 мин в темном помещении. После этого клетки переместили в пробирки FACS (BD) и промыли с 3 мл буфера FACS. Затем, провели пермеабилизацию и внутриклеточное окрашивание. Для этого 10 мкл пермеабилизированного раствора (2% сапонинов в ФСБ) и конъюгированных с флуорохромом моноклональных IFN-γ-PE антител (в соответствии с протоколом производителя) пипеткой поместили на клетки. Образцы тщательно перемешали на вортексе и инкубировали в течение 30 мин при комнатной температуре в темном помещении. Затем, клетки дважды промыли с 3 мл 0,1% раствора сапонина (0,1% сапонина в ФСБ (Lonza)) и зафиксировали в 0,5 мл параформальдегида (1% в ФСБ (Lonza)). Окрашенные клетки пропустили через проточный питометр FACS Epics XL MCL (Beckman Coulter) и интерпретировали результаты с использованием программного обеспечения CellQuest Software (Becton Dickinson). Результаты показали, что значительно больше CD3 и CD8 экспрессирующих клеток можно извлечь путем стимуляции с карбамилированными полипептидами. Пример 17. Емкость пептидов, карбамилированных с мочевиной и цианатом, касательно специфической реактивации CD8+ Т-клеток. Емкость карбамилированных пептидов касательно реактивирования пептид-специфических CD8+ Т-клеток проанализировали с применением проточного цитометра внутриклеточного производства IFN-γ после пептид-специфической инкубации. Для этого цельную кровь инкубировали с различными композициями пептида YIL в течение 9 ч и окрасили МКПК в соответствии с протоколом, описанным в примере 16. В данных опытах пептид YIL (10 мкг/мкл в 100% ДМСО) смешали 1:1 (по объему) либо с 8 М осажденной мочевины (предварительно инкубированной в течение ночного времени суток при 96°С), либо с 200 мМ KOCN и инкубировали в течение ночного времени суток при 40°С. После этого осуществили следующие стимуляции: 1: 10 мкг/мл контрольного пептида HTV р24 извлеченный пептид E10F; 2: 10 мкг/мл ЦМВ IE1 извлеченного пептида YIL; 3: 10 мкг/мл ЦМВ IE1 извлеченного пептида YIL карбамилированного с 100 мМ KOCN (включая конечную концентрацию 200 мкМ KOCN в образце стимулированной крови); 4: 10 мкг/мл ЦМВ IE1 извлеченного пептида YIL карбамилированного с 4 М мочевины (включая конечную концентрацию 8 мМ мочевины в образце стимулированной крови); 5: 200 мкМ KOCN (конечная концентрация в образце стимулированной крови); 6: 8 мМ мочевины (конечная концентрация в образце стимулированной крови). Результаты показали, что с 200 мМ KOCN карбамилированного YIL пептида значительно реактивирует больше CD8+ Т-клеток, чем некарбамилированный YIL пептид. Пример 18. Емкость пептидов и белков, карбамилированных с цианатом, касательно специфической реактивации CD8+ Т-клеток. В данном опыте проанализировали емкость карбамилированного с цианатом ЦМВ YIL пептида и рр65 белка, касательно специфической реактивации CD8+ Т-клеток. Для этого цельную кровь инкубировали с различными композициями YIL пептида в течение 6 ч и окрасили МКПК в соответствии с протоколом, описанным в примере 16. В данных опытах пептид YIL (2 мкг/мкл в 100% ДМСО) смешали 1:1 (по объему), либо с 200 мМ, 400 мМ или 1000 мМ KOCN в Н2О и инкубировали в течение ночного времени суток при 40°С. Область антигенной детерминанты ЦМВ (штамм AD169) рр65 (аа 862-1048; RecMol UL83-Pp65, Cat. No 1B023A) растворили в Н2О, включая 140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ KH2PO4, а также различные концентрации KOCN от 0 до 500 мМ инкубировали в течение ночного времени суток при 40°С. После этого осуществили следующие стимуляции: 1: нестимулированные клетки (отрицательный контроль); 2: 10 мкг/мл ЦМВ IE1 пептида YIL; 3:10 мкг/мл ЦМВ IE1 пептида YIL карбамилированного с 100 мМ KOCN (включая конечную концентрацию 1 мМ KOCN в образце стимулированной крови); 4: 10 мкг/мл ЦМВ IE1 пептида YIL карбамилированного с 200 мМ KOCN (включая конечную концентрацию 2 мМ KOCN в образце стимулированной крови); 5: 10 мкг/мл ЦМВ IE1 пептида YIL карбамилированного с 500 мМ KOCN (включая конечную концентрацию 5 мМ KOCN в образце стимулированной крови); 6: 10 мкг/мл ЦМВ рр65 белка (область антигенной детерминанты); 7: 10 мкг/мл ЦМВ рр65 белка карбамилированного с 100 мМ KOCN (включая конечную концентрацию 1 мМ KOCN в образце стимулированной крови); 8: 10 мкг/мл ЦМВ рр65 белка карбамилированного с 200 мМ KOCN (включая конечную концентрацию 2 мМ KOCN в образце стимулированной крови); - 25 - 020583 9: 10 мкг/мл ЦМВ рр65 белка карбамилированного с 500 мМ KOCN (включая конечную концентрацию 5 мМ KOCN в образце стимулированной крови). Результаты показали, что карбамилированный с цианово-кислым калием YIL пептид и рр65 белок в присутствии 0,04 М мочевины проявляют значительно большую емкость специфической реактивации CD8+ Т-клеток, чем некарбамилированный YIL пептид и рр65 белок соответственно. При этом обработка рр65 с возрастающей концентрацией цианово-кислого калия от 100 до 500 мМ напрямую связана возрастающей емкостью рр65 касательно специфической реактивации CD8+ Т-клеток в IFN-γ производстве. В сравнении для YIL пептида предварительная обработка с 100 мМ и 200 мМ цианово-кислого калия более эффективна для повышения потенциала YIL специфически стимулировать CD8 Т-клетки, чем предварительная обработка YIL с 500 мМ цианово-кислого калия. Пример 19. Емкость модифицированного с мочевиной HTV р24 капсидного антигена в комбинации с CpG ODN 1668 касательно специфической активации CD8+ Т-клеток у мышей. Емкость карбамилированного HIV p24 капсидного белка для стимуляции р24-специфических CD8+ Т-клеток проанализировали в мышиной модели (белая мышь, популяция BALB/c). Таким образом, аликвот очищенного рекомбинантного р24 обработали в течение ночного времени суток при 40°С с осажденной мочевиной (предварительно нагретой в течение 1 ч при 96°С) и затем подвергли интенсивному диализу в присутствии 0,04 М мочевины в ФСБ (Lonza). Шесть белых мышей женского пола популяции BALB/c в возрасте от 40 до 60 дней иммунизировали внутримышечно, либо с 10 мкг немодифицированного р24 в отсутствие (группа 4) или в присутствии 50 мкг/дозу CpG ODN1668 (группа 5) или обработанного с мочевиной, модифицированного р24 (up24) в отсутствие (группа 2) или в присутствии 50 мкг/дозу CpG ODN1668 (группа 3). Иммуногены ввели в общем объеме 100 мкг в ФСБ (Lonza). В качестве контроля, иммунизировали группы из шести мышей, либо с 0,04 М раствора мочевины (группа 1) или 10 мкг HIV извлеченных из клеток насекомых HIV Gag вирусоподобных частиц (VLP) (Demi et al. 2005, Mol. Immunol. 42:259) в общем объеме 100 мкл в ФСБ (Lonza). Всех животных иммунизировали на неделе 0 и ввели бустерную инъекцию с теми же самыми иммуногенами на неделях 2 и 4. На неделях 3 и 6 три мыши из каждой группы умертвили путем смещения шейных позвонков, с асептическим изъятием селезенки. После этого селезенки поместили в 50 мл трубки Falcon (BD Heidelberg, Germany), содержащие 10 мл среды со спленоцитами (селезеночными макрофагами) (RPMI-раствор, 5% инактивированной нагреванием фетальной телячьей сыворотки (FCS), 20 мМ N-2-гидроксиэтилпиперазин-N2-этансульфоновой кислоты HEPES, 50 мкМ 2-меркаптоэтанола, 1% Pen/Step раствора) и выдержали при комнатной температуре (не более 15 мин). Среду заменили эквивалентным объемом свежей среды со спленоцитами и перенесли селезенки в клеточное сито 70 мкМ (BD cat. No. 352350), которую поместили в 50 мл трубки Falcon. Генерировали одноклеточные суспензии путем затирания селезенки против клеточного сита с поршнем 5 мл, пока в невыдавленном остатке не получили практически только волокнистую фиброзную ткань. Выделенные из совокупности клетки аспирировали из клеточного сита путем повторяющегося добавления 2 мл среды со спленоцитами. Полученные клеточные суспензии седиментировали путем центрифугирования при 300g в течение 5 мин при комнатной температуре и пеллетированные клетки ресуспендировали в 5 мл/спленоцитного ACK гемолизного буфера (150 мМ NH4Cl, 1 мМ KHCO3, 0,1 мМ Na2EDTA (Titriplex III); корректировали рН 7,2 до 7,4 с 1 N HCl) путем осторожного добавления пластмассовой пипеткой 10 мл или 25 мл. После этого клеточную суспензию центрифугировали при 300g в течение 5 мин при комнатной температуре и трижды промыли с 10 мл/среды с селезеночными спленоцитами. На каждом этапе промывания, клеточные суспензии сепарировали от собранной волокнистой фиброзной ткани. В конце, клетки ресуспендировали в 5 мл/среды с селезеночными спленоцитами, подсчитали и скорректировали до уровня конечной концентрации 2×106 клеток/мл среды с селезеночными спленоцитами и презервировали при 37С° (не более 30 мин) до использования. 2×106 мышиных спленоцитов культивировали в 100 мкл среды со спленоцитами на лунку тестплашки с плоским дном на 96 лунок при 37°С. Клетки стимулировали с 10 мкг либо с HIV С-типа р24 пептида (AMQILKDTI (SEQ ID NO: 1); aa197-205 в случае р24 иммунизированных мышей), либо с HTVLAI A9I пептида (AMQMLKETI (SEQ ID NO: 2); аа197-205 (Wild et al. (2004), Vaccine 22:1732) в случае VLPстимулированных мышей) или для отрицательного контроля с иррелевантным пептидом, репрезентирующим HLA А2-рестрикционный ЦТЛ эпитоп внутри простатоспецифического антигена (PSA 141-150 FLTPKKLQCV (SEQ ID NO: 3); Chakraborty et al. (2003), Cancer Immunol. Immunother. 52:497). Комбинацию ФМА (форбол 12-миристат 13-ацетата) и иономицина использовали в качестве положительного контроля. Каждую стимуляцию полипептидов проводили дважды. Стимуляционные иммуногены смешали следующим образом: негативный контроль: 1,5 мл среды со спленоцитами + 3 мкл брефелдина А (5 мкг/мкл) + 3 мкл PSA-пептида (10 мкг/мкл); положительный контроль: 1 мл среды со спленоцитами + 2 мкл брефелдина А (5 мкг/мкл) + 1 мкл ФМА (1 мкг/мкл) + 1 иономицина (1 мкг/мкл); HIV С-типа р24 пептидного раствора: 1,5 мл среды со спленоцитами + 3 мкл брефелдина А (5 - 26 - 020583 мкг/мкл) + 3 мкл пептида (10 мкг/мкл); HIVLAI A9I peptide solution: 0,5 мл среды со спленоцитами + 1 мкл брефелдина А (5 мкг/мкл) + пептид (10 мкг/мкл). Чашки Петри затем инкубировали в стандартном инкубаторе при 37°С. После 6 ч образцы перенесли в колонки FACS, содержащие 1 мл буфера FACS (ФСБ (Lonza), 1% (по объему) FCS, 0,1% по весу/по объему NaN3). Образцы затем центрифугировали при 4°С в течение 5 мин при 300g. Супернатант затем осторожно декантировали, а клетки затем промыли с 1 мл FACS-буфера и снова центрифугировали при 300g в течение 8 мин. Затем, клетки ресуспендировали в малом объеме (примерно 100 мкл) FACS буфера и первый раз инкубировали в течение 10 мин при 4°С с анти-FcRII/III mAb (PharMingen, Hamburg, Germany) с целью блокирования неспецифического связывания флуоресцент-меченых антител. Затем, поверхностные маркеры окрасили в течение 30 мин на льду в объеме окрашивающей среды 100 мкл с использованием следующих антител в соответствии с протоколом производителя: CD3 FITC, CD4 PerCP и CD8 АПК. Клетки затем промыли с 5 мл FACS буфера и центрифугировали в течение 5 мин при 300g. После этого клетки зафиксировали с 250 мкл Cytofix/Cytoperm (4% (по весу/по объему) PFA + 1% (по весу/по объему) сапонина) в течение 20 мин на льду. Клетки затем дважды промыли с 5 мл перм/промывке (0,1% (по весу/по объему) сапонина в ФСБ (Lonza)) и центрифугировали в течение 5 мин при 500g при 4°С после каждого этапа промывания. Клетки ресуспендировали в 100 мкл перм/промывке и окрасили внутриклеточные IFN-γ с использованием IFN-γ-PE антител в соответствии с протоколом производителя в течение 20 мин на льду в темном помещении. После этого клетки промыли дважды с 5 мл FACS буфера и центрифугировали в течение 5 мин при 300g после каждого этапа промывания. Наконец, клетки ресуспендировали в 200 мкл 1% раствора параформальдегида (полиоксиметилена). Провели анализ FACS на проточном цитометре FACSCalibur (Becton Dickinson, Germany), с забором 30,000 CD8+ Т-клеток на образец. Данные FACS были затем проанализированы с использованием программного обеспечения CellQuest software. Результаты четко показали, что иммунизация мышей карбамилированным р24 в комбинации с CpG ODN 1668 индуцирует значительно больше CD8+ T-клеток по сравнению с мышами, иммунизированными с немодифицированными р24 в отсутствие и в присутствии CpG ODN 1668 или карбамилированными р24 в отсутствие CpG ODN 1668. Пример 20. Поглощение HIV р24 капсидного белка в зрелых дендритных клетках. Для определения факта, обладает ли HIV р24 капсидный белок присущей способностью внедряться в цитозоль зрелых дендритных клеток и, таким образом, классифицировать ли оный в первую или вторую группу полипептидов, как описано выше, провели следующий опыт: 6-9×105/мл зрелых дендритных клеток в R10 (RPMI 1640, 10% человеческой сыворотки АВ) инкубировали с 10 мкг/мл рекомбинантного HIV р24 капсидного белка в течение 15 мин при 37°С. Соответственно, 333 мкл клеточной суспензии поместили в цитоцентрифугу (Hettich, Tuttlingen) и центрифугировали в течение 3 мин при 300g. После высушивания стекол в течение 60 мин, клетки покрыли параформальдегидом (4% в ФСБ) для фиксации и инкубировали в течение 15 мин при 37°С. Клетки затем промыли три раза с 10 мл ФСБ. Область фиксации клеток окружили слоем вазелина. После этого окрасили цитоплазматическую мембрану клеток с 150 мкл (5 мкг/мл) красителя Alexa Fluor (Invitrogen, USA) в течение 10 мин. После этого стекла промыли дважды с 10 мл ФСБ, покрыли клетки 4°С холодным ацетоном с целью пермеабилизации клеток. Затем, клетки насытили (пропитали) 150 мкл R10 в течение 30 мин. После удаления R10, на клетки нанесли р24 детекционного флуоресцирующего антитела KC57FITC (Coulter Clone, USA) на клетки в течение 2 ч в соответствии с протоколом производителя. После этого стекла промыли три раза с 10 мл ФСБ. Затем, ядра клеток маркировали 150 мкл (10 нг/мл) 4',6диамино-2-фенилиндол (DAPI) (Roche, Mannheim). Стекло промыли с 10 мл ФСБ и высушили в течение 60 мин. Затем, добавили к стеклу 15 мкл MobiGlow среды для заключения ткани (MoBiTec, Göttingen) и накрыли покровным стеклом. После этого осуществили флуоресцентную микроскопию с использованием микроскопа LEICADMRX (Leica, Wetzlar). Результаты интерпретировали с использованием программного обеспечения Image-Pro Plus 6.2 (MediaCybernetics, USA). Снимки, полученные при помощи микроскопа, показали, что HIV р24 капсидный белок не проникает в цитозоль дендритных клеток. Таким образом, HIV р24 капсидный белок является полипептидом в соответствии со второй группой полипептидов согласно приведенному выше описанию. - 27 - 020583 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ переноса полипептидов в клетки, включающий следующие этапы: 1) инкубирование полипептидов в растворе, содержащем ионы цианата, в котором ионы цианата присутствуют в концентрации от примерно 1 до примерно 1000 ммоль/л; 2) инкубирование клеток с полипептидами согласно этапу а) в присутствии мочевины. 2. Способ по п.1, при котором клетки представляют собой прокариотные клетки, предпочтительно бактерии, или эукариотные клетки, предпочтительно грибки, более предпочтительно дрожжи и филаментные (нитчатые) грибки, клетки насекомых, птиц, рептилий, рыб, земноводных и млекопитающих, предпочтительно клетки мышей или человека, в частности антиген-презентирующие клетки (АПК), предпочтительно дендритные клетки (более предпочтительно клетки Лангерганса), моноциты, макрофаги, В-клетки или клетки васкулярного эпителия и различные клетки эпителия, мезенхимные и клетки микроглии головного мозга. 3. Способ детекции полипептид-специфических иммунных клеток, включающий следующие этапы: 1) инкубирование полипептидов в растворе, содержащем ионы цианата, в котором ионы цианата присутствуют в концентрации от примерно 1 до примерно 1000 ммоль/л; 2) инкубирование АПК-содержащих клеточных культур или биологических жидкостей с полипептидами согласно этапу а) в присутствии мочевины; 3) инкубирование АПК-содержащих клеточных культур или биологических жидкостей, полученных согласно этапу б) с иммунными клетками или с биологическими жидкостями, содержащими иммунные клетки; 4) симультанную и/или специфическую детекцию и/или количественный анализ различных подтипов полипептид-специфических иммунных клеток, которые специфичны по отношению к полипептидам согласно этапу а). 4. Способ по п.3, при котором АПК-содержащая клеточная культура представляет собой популяцию клеток костного мозга - лейкеферезат, изолированные моноцитные клетки и/или сепарированные популяции АПК, предпочтительно содержащие дендритные клетки (более предпочтительно клетки Лангерганса), моноциты, макрофаги и/или В-клетки, а АПК-содержащая биологическая жидкость представляет собой цельную кровь или жидкость, и/или при котором полипептид-специфические иммунные клетки представляют собой Т-клетки, предпочтительно CD4+ Т-клетки, CD8+ Т-клетки, CD4+CD8dim Tклетки или CD4+ регуляторные Т-клетки, или другие популяции иммунологических клеток, предпочтительно CD56+CD8+, CD56-CD57+CD8+ NKT клетки или CD56+ NK клетки, или смесь оных, и/или при котором биологические жидкости, содержащие иммунные клетки, представляют собой цельную кровь и/или жидкость. 5. Способ по любому из пп.3, 4, при котором детекцию и/или количественный анализ осуществляют путем детекции специфических поверхностных маркеров для полипептид-специфических иммунных клеток и производством маркерных цитокинов TNF, IFN-γ, IL-2, IL-4, IL-5, IL-10, IL-17 или TGF-β. 6. Способ примирования, выращивания и/или реактивации полипептид-специфических Т-клеток, включающий следующие этапы: а) инкубирование полипептидов в растворе, содержащем ионы цианата, в котором ионы цианата присутствуют в концентрации от примерно 1 до примерно 1000 ммоль/л; б) инкубирование клеток с полипептидами согласно этапу а) в присутствии мочевины и в отсутствие или в присутствии иммуномодулирующих веществ, при котором полипептид-специфические Тклетки предпочтительно представляют собой CD4+ Т-клетки и/или CD8+ Т-клетки. 7. Способ по любому из предшествующих пунктов, при котором ионы цианата присутствуют в концентрации от примерно 5 до примерно 900 ммоль/л, от примерно 10 до примерно 800 ммоль/л, от примерно 20 до примерно 700 ммоль/л, от примерно 50 до примерно 600 ммоль/л или от примерно 100 до примерно 500 ммоль/л. 8. Способ по любому из предшествующих пунктов, при котором раствор согласно этапу а) содержит дополнительно мочевину, предпочтительно от примерно 0,01 до примерно 8 моль/л, от примерно 0,1 до примерно 0,5 моль/л, от примерно 0,5 до примерно 5 моль/л или от примерно 5 до примерно 8 моль/л. 9. Способ по п.8, при котором мочевину предварительно обработали путем инкубации, при котором параметры инкубации предпочтительно определяются нагревом и/или временем. 10. Способ по любому из предшествующих пунктов, при котором концентрация мочевины согласно этапу б) составляет от примерно 0,001 до примерно 0,8 моль/л, от примерно 0,01 до примерно 0,1 моль/л, от примерно 0,015 до примерно 0,09 моль/л, от примерно 0,02 до примерно 0,08 моль/л, от примерно 0,025 до примерно 0,07 моль/л, от примерно 0,03 до примерно 0,06 моль/л или от примерно 0,035 до примерно 0,05 моль/л и, в частности, при котором концентрация мочевины по этапу б) составляет примерно 0,04 моль/л. 11. Способ по любому из пп.8-10, при котором раствор мочевины дополнительно содержит NaCl с концентрацией от примерно 0,25 до примерно 200 ммоль/л или от примерно 0,25 до примерно 75 - 28 - 020583 ммоль/л и/или дитиоэритрит (ДТЭ) или дитиотреитол (ДТТ) с концентрацией от примерно 0,25 до примерно 200 нмоль/л или от примерно 0,25 до примерно 75 нмоль/л. 12. Способ по любому из предшествующих пунктов, при котором полипептиды в: (i) этапе а) присутствуют в концентрации от примерно 0,1 до примерно 50 мкг/мл, от примерно 1 до примерно 40 мкг/мл, от примерно 3 до примерно 30 мкг/мл или от примерно 5 до примерно 20 мкг/мл и, в частности, в концентрации примерно 10 мкг/мл; и/или (ii) этапе б) присутствуют в количестве от примерно 0,1 до примерно 200 мкг или выше, или от примерно 0,1 до примерно 200 мкг, или от примерно 0,1 до примерно 2 мкг, или от примерно 0,1 до примерно 10 мкг, или от примерно 10 до примерно 50 мкг или от примерно 50 до примерно 200 мкг в расчете на примерно 106 клеток. 13. Способ по любому из предшествующих пунктов, при котором инкубация полипептидов согласно этапу а) приводит к повышению молекулярной массы полипептидов и/или сдвигу в pKi-значении полипептидов в сторону более кислотного pKi-значения. 14. Применение полипептидов в сочетании с мочевиной в исследовательских, диагностических или лечебных целях и предотвращении заболеваний у животных и человека, характеризующееся тем, что полипептиды предварительно инкубированы в растворе, содержащем ионы цианата в концентрации от 1 до 1000 ммоль/л. 15. Применение полипептидов в сочетании с мочевиной в качестве медикаментозного средства предпочтительно для предотвращения и лечения инфекционных заболеваний и опухолей, характеризующееся тем, что полипептиды предварительно инкубированы в растворе, содержащем ионы цианата в концентрации от 1 до 1000 ммоль/л. Фиг. 1 - 29 - 020583 Фиг. 2 Фиг. 3 - 30 - 020583 Фиг. 4 Фиг. 5 - 31 - 020583 Фиг. 6 Фиг. 7 Фиг. 8 Фиг. 9 - 32 - 020583 Фиг. 10 Фиг. 11 Фиг. 12 - 33 - 020583 Фиг. 13 Фиг. 14 Фиг. 15 - 34 - 020583 Фиг. 16 Фиг. 17 Фиг. 18 - 35 - 020583 Фиг. 19 - 36 - 020583 Фиг. 20 - 37 - 020583 Фиг. 21 - 38 - 020583 Фиг. 22 - 39 - 020583 Фиг. 23 - 40 - 020583 Перечень последовательностей Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2 - 41 -