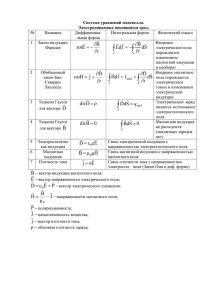
010434 Область техники мых в области медицины.
advertisement

010434 Область техники Настоящее изобретение относится к способу получения цитотоксических лимфоцитов, используемых в области медицины. Предшествующий уровень техники Живой организм защищается от чужеродных веществ главным образом посредством иммунной реакции, и иммунная система образована различными клетками и продуцируемыми ими растворимыми факторами. Среди них ключевую роль играют лейкоциты, особенно лимфоциты. Лимфоциты классифицируют на два больших класса, В-лимфоциты (которые здесь могут называться В-клетками) и Тлимфоциты (которые здесь могут называться Т-клетками), и те, и другие специфически распознают антиген и воздействуют на этот антиген, защищая живой организм. Т-клетки подразделяют на Т-хелперы, имеющие маркер CD4 (кластер дифференцировки) (здесь называемые Тх), главным образом принимающие участие в образовании антител и индукции различных иммунных ответов, и цитотоксические Т-клетки, имеющие маркер CD8 (Тс: цитотоксические Тлимфоциты, также называемые Т-киллерами, которые здесь могут называться CTL), главным образом проявляют цитотоксическую активность. CTL, которые играют наиболее важную роль в распознавании, разрушении и выведении опухолевых клеток, клеток, инфицированных вирусом, или т.п., не продуцируют антитела, специфически взаимодействующие с антигеном, как в случае В-клеток, а напрямую распознают и воздействуют на антигены (антигенный пептид) клеток-мишеней, которые связаны с молекулами главного комплекса гистосовместимости [МНС, который также может называться лейкоцитарным антигеном человека (HLA) у людей] класса I, находящимися на поверхности мембраны клетки-мишени. В то же время рецептор Т-клеток (здесь называемый TCR), находящийся на поверхности мембраны CTL, специфически распознает вышеупомянутые антигенные пептиды и молекулы МНС класса I и определяет, является ли данный антигенный пептид собственным или чужеродным. Клетка-мишень, определяемая как чужеродная, затем специфически разрушается и элиминируется под действием CTL. В последние годы было пересмотрено отношение к терапии, такой как фармакотерапия и радиотерапия, которая может оказывать серьезное негативное влияние на пациента, и возрос интерес к иммунотерапии как к терапии, не оказывающей агрессивное воздействие на пациента. В частности, была отмечена эффективность адоптивной иммунотерапии, при которой CTL, способные специфически взаимодействовать с представляющим интерес антигеном, индуцируются in vitro из лимфоцитов, полученных у человека с нормальной иммунной функцией, или лимфоцитов, количество которых повышено без индукции, и затем перенесенных пациенту. Например, предполагают, что на модели животных адоптивная иммунотерапия является эффективным способом лечения вирусной инфекции и рака [описано Greenberg, P. D., Advances in Immunology, опубликовано в 1992; Reusser P., et al., Blood, 78(5), 1373-1380 (1991)]. При таком лечении важно поддерживать или увеличить количество клеток в состоянии, при котором поддерживается или усиливается антигенспецифическая цитотоксическая активность CTL. При адоптивной иммунотерапии, как описано выше, для получения терапевтического эффекта необходимо вводить цитотоксические лимфоциты в установленном количестве или выше. Иными словами, можно сказать, что основной проблемой является получение вышеуказанного количества клеток in vitro за короткий период времени. Для поддержания и усиления антигенспецифической цитотоксической активности CTL, для индукции специфической реакции CTL на антиген в основном использовали способ повторяющейся стимуляции представляющим интерес антигеном. Однако обычно в этом способе число полученных в конечном счете CTL может быть снижено, и поэтому не может быть получено достаточное количество клеток. В качестве способа получения Т-клеток, эффективного для лечения заболевания, известна, например, адоптивная иммунотерапия, в которой используются опухоль-инфильтрирующие лимфоциты (TIL), индуцированные высокими концентрациями IL-2 [N. Engl. J. Med., 316, 1310-1321 (1986); Rosenberg S. A. et al, N. Engl. J. Med., 319(25), 1676-1680 (1988); Ho M. et al., Blood, 81(8), 2093-2101 (1993)]. Затем был описан способ получения антигенспецифических CTL, в котором выделяли и нращивали CMV-специфический клон CTL, используя собственные CMV-инфицированные фибробласты и IL-2 [Riddell S. A. et al., J. Immunol., 146(8), 2795-2804 (1991)] или используя анти-CD3-моноклональное антитело (анти-CD3-mAb) и IL-2 [Riddell S. A. et al., J. Immunol. Methods, 128(2), 189-201 (1990)]. Кроме того, в WO 96/06929 описан способ REM (способ быстрой экспансии). Этот способ REM представляет собой способ разложения популяции первичных Т-клеток, содержащих антигенспецифические CTL и Тх за короткий период времени. Иными словами, этот способ характеризуется тем, что большое количество Т-клеток может быть получено путем пролиферации индивидуальных Т-клеточных клонов и что количество антигенспецифических CTL повышается при использовании анти-CD3-антител, IL2 и РВМС (мононуклеары периферической крови), различных по своей способности к пролиферации под действием излучения, и клеток, инфицированных вирусом Эпштейна-Барр (здесь упоминаемом как EBV). Более того, в WO 97/32970 описан модифицированный способ REM, который представляет собой способ, в котором в качестве питающих клеток используют штамм недифференцированных клеток млекопитающего, экспрессирующих стимулирующий Т-клетки компонент, который отличается от РВМС -1- 010434 тем, что снижает количество используемых РВМС. Лимфокин-активированные клетки-киллеры (LAK-клетка) представляют собой функциональную клеточную популяцию, обладающую цитотоксической активностью, которую получают, добавляя IL-2 к периферической крови (лейкоцитам периферической крови), крови из пуповины, тканевой жидкости или т.п., содержащей лимфоциты, и культивируя in vitro клетки в течение нескольких дней. Во время культивирования пролиферацию LAK-клетки дополнительно усиливают добавлением анти-CD3-антител и культивированием клеток. Таким образом, полученные LAK-клетки обладают неспецифической цитотоксической активностью в отношении различных раковых клеток и других мишеней. LAK-клетки также используют в адоптивной иммунотерапии, также, как и вышеуказанные CTL. Как описано выше, использование IL-2 необходим на стадии получения цитотоксических лимфоцитов, например, CTL, LAK-клеток, TIL или т.п. Эти клетки в дальнейшем активируют путем присоединения IL-2 к рецепторам интерлейкина 2 (IL-2R) на клеточной поверхности. Кроме того, известно, что IL2R является маркером активации лимфоцитов. С этих точек зрения, важно усилить экспрессию IL-2R на клеточной поверхности. Кроме того, при индукции CTL важно улучшить эффективность индукции клеток-предшественниц CTL, подвергнутых стимуляции антигеном в виде CTL, то есть увеличить долю (соотношение) CD8-положительных клеток в группе клеток после индукции. Фибронектин представляет собой гигантский гликопротеин с молекулярной массой 250 тысяч, который находится в крови животных, на поверхности культивируемых клеток или во внеклеточном матриксе ткани, и известно, что он обладает различными функциями. Его доменная структура делится на семь частей (далее ссылка на фигуру), где в его аминокислотной последовательности находится три типа сходных последовательностей, и повторы каждой из этих последовательностей составляют полную последовательность. Три вида сходных последовательностей называют тип I, тип II и тип III. Среди них, тип III состоит из 71-96 аминокислотных остатков, где степень совпадения этих аминокислотных остатков составляет от 17 до 40%. В фибронектике имеется четырнадцать последовательностей типа III, среди которых 8-я, 9-я или 10-я последовательность (каждая здесь называется III-8, III-9 или III-10) содержится в клеточном связывающем домене, а 12-я, 13-я или 14-я последовательности (каждая здесь называется III-12, III-13 или III-14) содержатся в гепарин-связывающем домене. Кроме того, VLA (антиген с поздней активацией)-5-связывающая область содержится в III-10, и его коровой последовательностью является RGDS. Кроме того, на С-концевой стороне гепаринсвязывающего домена находится область, называемая IIICS. Область, называемая CS-1, состоящая из 25 аминокислот и обладающая связывающей активностью с VLA-4, находится в IIICS (Deane F. Momer, Фибронектин, ACADEMIC PRESS INC., 1-8 (1988); Kimizuka F. et al., J. Biochem. 110, 284-291 (1991); Hanenberg H. et al., Human Gene Therapy 8, 2193-2206 (1997)). Подробное описание изобретения Целью настоящего изобретения является способ получения цитотоксических лимфоцитов, обладающих высокоэффективной цитотоксической активностью, который соответствующим образом используется в области медицины. Конкретно, настоящее изобретение относится: [1] к способу получения цитотоксического лимфоцита, характеризующемуся тем, что данный способ включает в себя стадию осуществления по меньшей мере одного из процессов - индукции, поддержания и экспансии цитотоксических лимфоцитов - в присутствии фибронектина, его фрагмента или их смеси; [2] к способу в соответствии с вышеизложенным [1], где цитотоксические лимфоциты высокоэффективно экспрессируют рецепторы интерлейкина-2, по сравнению с цитотоксическими лимфоцитами, полученными путем осуществления по меньшей мере одного из процессов - индукции, поддержания и экспансии - в отсутствие фибронектина, его фрагмента или их смеси; [3] к способу в соответствии с вышеуказанным [1], где в указанных цитотоксических лимфоцитах в большей степени присутствуют CD8-позитивные клетки, чем в цитотоксических лимфоцитах, полученных путем осуществления по меньшей мере одного из процессов - индукции, поддержания и экспансии в отсутствие фибронектина, его фрагмента или его смеси; [4] к способу в соответствии с любым из вышеуказанных [1]-[3], где указанные цитотоксические лимфоциты высокоэффективно поддерживают цитотоксическую активность по сравнению с цитотоксическими лимфоцитами, полученными путем осуществления по меньшей мере одного из процессов - индукции, поддержания и экспансии - в отсутствие фибронектина, его фрагмента или его смеси; [5] к способу в соответствии с любым из вышеуказанных [1]-[4], где фибронектин, его фрагмент или их смесь иммобилизованы на твердой фазе; [6] к способу в соответствии с вышеизложенным [5], где твердая фаза представляет собой приспособление для клеточной культуры или носитель для клеточной культуры; [7] к способу в соответствии с вышеизложенным [6], где приспособлением для клеточной культуры является чашка Петри, кювета или мешок, а носитель для клеточной культуры представляет собой бусы, мембрану или предметное стекло; [8] к способу в соответствии с любым из вышеуказанных [1]-[4], где по меньшей мере один из про-2- 010434 цессов - индукции, поддержания и экспансии цитотоксических лимфоцитов осуществляют в среде, содержащей фибронектин, его фрагмент или их смесь; [9] к способу в соответствии с любым из вышеуказанных [1]-[8], где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7 из списка последовательностей, или полипептид с заменой, делецией, вставкой или добавлением одной или нескольких аминокислот в аминокислотной последовательности вышеуказанного полипептида, где такой полипептид обладает функциями, эквивалентными функциям полипептида, указанного выше; [10] к способу в соответствии с вышеуказанным [9], где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепарин-связывающей активностью; [11] к способу в соответствии с вышеуказанным [9], где фрагмент фибронектина представляет собой полипептид, выбранный из полипептидов, содержащих любую из аминокислотных последовательностей, показанных в SEQ ID NO: 8-19 из списка последовательностей; [12] к способу в соответствии с вышеуказанным [1], включающему в себя осуществление по меньшей мере одного из процессов - индукции, поддержания и экспансии цитотоксических лимфоцитов - в присутствии фибронектина, его фрагмента или их смеси в приспособлении для клеточной культуры, содержащем среду, где данный способ удовлетворяет любому из следующих условий: (a) отношение числа клеток вначале культивирования к площади культуры в приспособлении для клеточной культуры составляет от 1 до 5×105 клеток/см2; и (b) концентрация клеток в среде в начале культивирования составляет от 1 до 5×105 клеток/мл; [13] к способу в соответствии с вышеуказанным [12], где в указанном способе исключена стадия разбавления или стадия замены приспособления для клеточной культуры; [14] к цитотоксическим лимфоцитам, полученным способом в соответствии с любым из вышеуказанных [1]-[13]; [15] к лекарственному средству, содержащему в качестве действующего компонента цитотоксические лимфоциты, полученные способом в соответствии с любым из вышеуказанных [1]-[13]; [16] к агенту, усиливающему экспрессию рецепторов интерлейкина-2 в клетке, характеризующемуся тем, что указанный агент содержит в качестве действующего компонента фибрснектин, его фрагмент или их смесь; [17] к агенту в соответствии с вышеуказанным [16], где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7 из списка последовательностей, или полипептид с заменой, делецией, вставкой или добавлением одной или нескольких аминокислот в аминокислотой последовательности указанного выше полипептида, где данный полипептид обладает функциями, эквивалентными функциям полипептида, указанного выше; [18] к агенту в соответствии с вышеуказанным [17], где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепарин-связывающей активностью; [19] к агенту в соответствии с вышеизложенным [17], где фрагмент фибронектина представляет собой полипептид, выбранный из полипептидов, содержащих любую из аминокислотных последовательностей, показанных в SEQ ID NO: 8-19 из списка последовательностей; [20] к агенту для повышения уровня (доли) CD8-положительных клеток в лимфоцитах, характеризующемуся тем, что данный агент содержит в качестве действующего компонента фибронектин, его фрагмент или их смесь; [21] к агенту в соответствии с вышеизложенным [20], где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7 из списка последовательностей или полипептид с заменой, делецией, вставкой или добавлением одной или нескольких аминокислот в аминокислотной последовательности указанного выше полипептида, где данный полипептид обладает функциями, эквивалентными функциям полипептида, указанного выше; [22] к агенту в соответствии с вышеизложенным [21], где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепарин-связывающей активностью; [23] к агенту в соответствии с вышеизложенным [21], где фрагмент фибронектина представляет собой полипептид, выбранный из полипептидов, содержащих любую из аминокислотных последовательностей, показанных в SEQ ID NO: 8-19 из списка последовательностей; [24] к агенту для повышения или поддержания цитотоксической активности цитотоксических лимфоцитов, характеризующемуся тем, что данный агент содержит в качестве действующего компонента фибронектин, его фрагмент или их смесь; [25] агенту в соответствии с вышеизложенным [24], где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7 из списка последовательностей, или полипептид с заменой, делецией, вставкой или добавлением одной или нескольких аминокислот в аминокислотной -3- 010434 последовательности указанного выше полипептида, где данный полипептид обладает функциями, эквивалентными функциям полипептида, указанного выше; [26] к агенту в соответствии с вышеизложенным [25], где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепарин-связывающей активностью; [27] к агенту в соответствии с вышеизложенным [25], где фрагмент фибронектина представляет собой полипептид, выбранный из полипептидов, содержащих любую из аминокислотных последовательностей, показанных в SEQ ID NO: 8-19 из списка последовательностей; [28] к способу повышения экспрессии рецепторов интерлейкина-2 в цитотоксических лимфоцитах, характеризующемуся тем, что данный способ включает в себя стадию осуществления по меньшей мере одного из [процессов] - индукции, поддержания и экспансии цитотоксических лимфоцитов - в присутствии фибронектина, его фрагмента или их смеси; [29] к способу повышения уровня (доли) CD8-положительных клеток в цитотоксических лимфоцитах, характеризующемуся тем, что данный способ включает в себя стадию осуществления по меньшей мере одного из [процессов] - индукции, поддержания и экспансии цитотоксических лимфоцитов - в присутствии фибронектина, его фрагмента или их смеси; [30] к способу повышения или поддержания цитотоксической активности цитотоксических лимфоцитов, характеризующемуся тем, что данный способ включает в себя стадию осуществления по меньшей мере одного из [процессов] - индукции, поддержания и экспансии цитотоксических лимфоцитов - в присутствии фибронектина, его фрагмента или их смеси; [31] к способу в соответствии с любым из вышеуказанных [1]-[13], дополнительно включающему в себя стадию трансдукции чужеродного гена в цитотоксический лимфоцит; и [32] к способу в соответствии с вышеуказанным [31], где указанный чужеродный ген трансдуцируют, используя ретровирус, аденовирус, адено-ассоциированный вирус или вирус обезьян. На чертеже схематически представлена доменная структура фибронектина. Наилучший способ осуществления данного изобретения Настоящее изобретение было осуществлено на основании полученных данных о том, что в цитотоксических лимфоцитах, полученных в присутствии фибронектина и/или его фрагмента, поддерживается высокая цитотоксическая активность, значительно повышается уровень экспрессии IL-2R и доля CD8положительных клеток. В этой связи, здесь получение цитотоксических лимфоцитов относится к стадии, выключающей в себя стадию, включающую в себя каждую стадию индукции (активации), поддержания и экспансии клеток, или их объединенные стадии. Получение цитотоксических лимфоцитов согласно изобретению также относится к культивированию цитотоксических лимфоцитов. Настоящее изобретение будет конкретно описано ниже. (1) Фибронектин и его фрагмент, используемые в настоящем изобретении. Фибронектин и его фрагмент, указанные здесь, могут быть получены из природного источника или могут быть искусственно синтезированы. Фибронектин и его фрагмент могут быть получены, по существу, в чистом виде из материала природного происхождения, на основании описания Ruoslahti E. et al. [J. Biol. Chem., 256(14), 7277-7281 (1981)]. Выражение «по существу, чистый фибронектин или фрагмент фибронектина», как указано здесь, означает, что этот фибронектин и фрагмент фибронектина, по существу, не содержат других белков и т.п., присутствующих вместе с фибронектином в природе. И вышеуказанный фибронектин, и его фрагмент могут быть использованы в настоящем изобретении сами по себе или в разных типах смесей. Полезная информация, относящаяся к фрагментам фибронектина, которые могут быть использованы в настоящем изобретении, и способами получения этих фрагментов может быть получена из публикаций Kimiduka F., et al. [J. Biochem., 110, 284-291 (1991)], Kornbrihtt A. R. et al. [EMBO J., 4(7), 17551759 (1985)], Sekiguchi K., et al. [Biochemistry, 25(17), 4936-4941 (1986)], и др. В настоящем изобретении примером фрагмента фибронектина служит, например, полипептид, содержащий аминокислотную последовательность, по меньшей мер, с любой областью из областей III-8 (аминокислотная последовательность, показанная в SEQ ID NO: 1 в списке последовательностей), III-9 (аминокислотная последовательность, показанная в SEQ ID NO: 2 в списке последовательностей), III-10 (аминокислотная последовательность, показанная в SEQ ID NO: 3 в списке последовательностей), III-12 (аминокислотная последовательность, показанная в SEQ ID NO: 4 в списке последовательностей), III-13 (аминокислотная последовательность, показанная в SEQ ID NO: 5 в списке последовательностей), III-14 (аминокислотная последовательность, показанная в SEQ ID NO: 6 в списке последовательностей) и CS-1 (аминокислотная последовательность, показанная в SEQ ID NO: 7 в списке последовательностей) (см фигуру). Кроме того, предпочтительно, чтобы в качестве фрагмента был использован фрагмент, обладающий активностью клеточной адгезии и/или гепаринсвязывающей активностью. Активность клеточной адгезии может быть оценена путем анализа связывания фрагмента (его связывающего клетку домена), используемого согласно изобретению, с клеткой, с использованием известного способа. Например, способ, указанный выше, включает в себя способ Williams D. A., et al. [Nature, 352, 438-441 (1991)]. Данный способ -4- 010434 представляет собой способ определения связывания клетки с фрагментом, иммобилизованном на культуральной чашке. Кроме того, гепаринсвязывающая активность может быть оценена путем анализа связывания фрагмента (его гепаринсвязывающего домена), используемого согласно изобретению, с гепарином, с использованием известного способа. Например, связывание данного фрагмента с гепарином можно оценить тем же способом, используя гепарин, например, меченый гепарин, вместо клетки в вышеупомянутом способе Williams D. A. et al. Кроме того, примером фрагмента фибронектина служит полипептид, выбранный из С-274 (аминокислотная последовательность, показанная в SEQ ID NO: 8 в списке последовательностей), Н-271 (аминокислотная последовательность, показанная в SEQ ID NO: 9 в списке последовательностей), Н-296 (аминокислотная последовательность, показанная в SEQ ID NO: 10 в списке последовательностей), СН-271 (аминокислотная последовательность, показанная в SEQ ID NO: 11 в списке последовательностей), СН-296 (аминокислотная последовательность, показанная в SEQ ID NO: 12 в списке последовательностей) или C-CS1 (аминокислотная последовательность, показанная в SEQ ID NO: 13 в списке последовательностей). Каждый из вышеупомянутых фрагментов СН-271, СН-296, С-274 и C-CS1 представляет собой полипептид с доменом клеточного связывания со связывающей активностью в отношении VLA-5. Также CCS1, Н-296 или СН-296 представляет собой полипептид с доменом клеточного связывания со связывающей активностью в отношении VLA-4. Кроме того, Н-271, Н-296, СН-271 или СН-296 представляет собой полипептид с гепаринсвязывающим доменом. В настоящем изобретении также может быть использован фрагмент, в котором каждый из приведенных выше доменов модифицирован. Гепаринсвязывающий домен фибронектина состоит из трех последовательностей типа III (III-12, III-13 и III-14). Согласно изобретению также может быть использован фрагмент, содержащий гепарин-связывающий домен с делецией одной или двух последовательностей типа III. Например, примерами данных фрагментов могут служить CHV-8 9 (аминокислотная последовательность, показанная в SEQ ID NO: 14 из списка последовательностей), CHV-90 (аминокислотная последовательность, показанная в SEQ ID NO: 15 из списка последовательностей) или CHV-92 (аминокислотная последовательность, показанная в SEQ ID NO: 16 из списка последовательностей), представляющие собой фрагмент, в котором сайт клеточного связывания фибронектина (VLA-5 связывающий домен: с Pro1239 по Ser1515) и одна из последовательностей типа III являются связанными, или CHV-179 (аминокислотная последовательность, показанная в SEQ IE) NO: 17 из списка последовательностей) или CHV-181 (аминокислотная последовательность, показанная в SEQ ID NO: 18 из списка последовательностей), представляющие собой фрагмент, в котором сайт клеточного связывания фибронектина и две последовательности типа III являются связанными. CHV-89, CHV-90 и CHV-92 содержат III-13, III-14 и III12, соответственно, a CHV-179 содержит III-13 и III-14, a CHV-181 содержит III-12 и III-13, соответственно. Кроме того, в настоящем изобретении может быть использован фрагмент с добавлением дополнительной аминокислоты к каждому из вышеупомянутых фрагментов. Например, данный фрагмент может быть получен добавлением желаемой аминокислоты к каждому вышеуказанному фрагменту в соответствии со способом получения Н-275-Cys, описанном в примерах получения, изложенных ниже. Например, H-275-Cys (аминокислотная последовательность, показанная в SEQ ID NO: 19 из списка последовательностей) представляет собой фрагмент с гепаринсвязывающим доменом фибронектина и остатком цистеина на С-конце. Фрагментом, используемым в настоящем изобретении, может быть фрагмент, содержащий полипептид, состоящий из аминокислотной последовательности с заменой, делецией, вставкой или добавлением одной или нескольких аминокислот в аминокислотной последовательности полипептида, составляющего фрагмент, по меньшей мере, частично содержащий аминокислотную последовательность природного фибронектина, приведенную в качестве примера выше, где полипептид обладает действием, эквивалентным действию данного фрагмента, при условии получения желаемых эффектов согласно изобретению. Предпочтительно, чтобы замещение или т.п. аминокислот, осуществляемое в объемах, при которых могут изменяться физико-химические характеристики, и т.п., свойственные полипептиду, были в пределах сохранения функции полипептида. Например, замена или т.п. аминокислот выгодна в объемах, при которых характеристики, свойственные данному полипептиду (например, гидрофобность, гидрофильность, электрический заряд, pK и пр.) существенно не изменяются. Например, заменой аминокислот является замена в пределах каждой группы: 1) глицина, аланина; 2) валина, изолейцина, лейцина; 3) аспарагиновой кислоты, глутаминовой кислоты, аспарагина, глутамина; 4) серина, треонина; 5) лизина, аргинина; 6) фенилаланина, тирозина. Делецией, добавлением или вставкой аминокислот является делеция, -5- 010434 добавление или вставка аминонокислот с характеристиками, сходными с характеристиками окружения подлежащего сайта в полипептиде в пределах, в которых характеристики окружения подлежащего сайта по существу не изменяются. Кроме того, под фразой «имеющий эквивалентную функцию» понимают, что имеется, по меньшей мере, любая из функций: (i) функция поддержания цитотоксической активности цитотоксического лимфоцита, (ii) функция усиления уровня экспрессии IL-2R или (iii) функция увеличения доли CD8положительных клеток. Обладает ли фрагмент, содержащий полипептид с аминокислотной заменой или пр., этими функциями или нет может быть соответствующим образом подтверждено способом, описанным в примерах, изложенных ниже. Кроме того, в качестве фрагмента, содержащего полипептид с аминокислотной заменой или пр., предпочтительным является фрагмент, обладающий активностью клеточной адгезии и/или гепаринсвязывающей активностью. Активность клеточная адгезии и гепаринсвязывающая активность могут быть оценены в соответствии с вышеуказанными способами определения этих активностей. В настоящем изобретении в качестве фрагмента, содержащего полипептид с аминокислотной заменой или пр., также может быть использован, например, фрагмент с одной или несколькими аминокислотами, введенными в качестве связующего звена между двумя различными доменами. В этой связи, в качестве фибронектина per ser в настоящем изобретении так же может быть использован полипептид с аминокислотной последовательностью, имеющей замену, делецию, вставку или добавление одной или нескольких аминокислот в аминокислотной последовательности, составляющей полипептид фибронектина, где данный полипептид обладает по меньшей мере одной из функций (i)-(iii), указанных выше. Фрагмент фибронектина, о котором здесь идет речь, также может быть получен из генетического рекомбинанта в соответствии с описанием, например, патента США № 5198423. Например, каждый из фрагментов Н-271 (SEQ ID NO: 9), Н-296 (SEQ ID NO: 10), СН-271 (SEQ ID NO: 11) и СН-296 (SEQ ID NO: 12) и способ получения этих фрагментов подробно описаны в описании к данному патенту. Кроме того, вышеупомянутый фрагмент С-274 (SEQ ID NO: 8) может быть получен в соответствии со способом, описанным в патенте США № 5102988. Более того, фрагмент C-CS1 (SEQ ID NO: 13) может быть получен в соответствии со способом, описанным в Бюллетене патентов Японии № 3104178. Каждый из фрагментов CHV-89 (SEQ ID NO: 14), CHV-90 (SEQ ID NO: 15) или CHV-179 (SEQ ID NO: 17) может быть получен в соответствии со способом, описанным в Бюллетене патентов Японии № 2729712. Кроме того, фрагмент CHV-181 (SEQ ID NO: 18) может быть получен по способу, описанному в WO 97/18318. Фрагмент CHV-92 (SEQ ID NO: 16) может быть получен методами генной инженерии с использованием плазмиды, сконструированной обычным способом на основе плазмиды, описанной в литературе со ссылкой на Бюллетень патентов Японии № 2729712 и WO 97/18318. Эти фрагменты или фрагменты, которые могут быть получены из этих фрагментов обычным образом, могут быть получены с использованием микроорганизмов, депонированных в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology, Tsukuba Central 6, 11, Higashi 1-chome, Tsukuba-shi, Ibaraki-ken, Japan (Zip code 305-8566) под нижеприведенными инвентарными номерами, или модифицированием плазмиды, которую несет каждый микроорганизм, известным способом. FERM BP-2264 (Escherichia coli с плазмидой, кодирующей Н-271, дата депонирования: 30 января 1989); FERM BP-2800 (Escherichia coli с плазмидой, кодирующей СН-296, дата депонирования: 12 мая 1989); FERM BP-2799 (Escherichia coli с плазмидой, кодирующую Н-271, дата депонирования: 12 мая 1989); FERM BP-7420 (Escherichia coli с плазмидой, кодирующую Н-296, дата депонирования: 12 мая 1989); FERM BP-1915 (Escherichia coli с плазмидой, кодирующую С-274, дата депонирования: 17 июня 1988); FERM BP-5723 (Escherichia coli с плазмидой, кодирующую С-CS1, дата депонирования: 5 марта 1990); FERM P-12182 (Escherichia coli с плазмидой, кодирующую CHV-89, дата депонирования: 8 апреля 1991); и FERM P-12183 (Escherichia coli с плазмидой, кодирующую CHV-179, дата депонирования: 8 апреля 1991). Поскольку фибронектин представляет собой гигантский гликопротеин, для промышленной цели и с целью получения лекарственного средства не так уж легко получать и использовать природный белок. Более того, в большом количестве фибронектин находится в плазме живого организма. Следовательно, при получении фибронектина из плазмы, используемой как препарат крови, существует риск контаминации сопутствующими компонентами, помимо фибронектина, поэтому необходимо учитывать риск с точки зрения безопасности. Кроме того, поскольку фибронектин представляет собой многофункциональный -6- 010434 белок, необходимо учитывать некоторые недостатки, причиной которых являются области, отличные от областей, проявляющих эффект согласно способу в соответствии с настоящим изобретением, в зависимости от обстоятельств его применения. В связи с этим, с точки зрения доступности, удобства обработки и безопасности в настоящем изобретении предпочтительно использовать фрагмент фибронектина, более предпочтительно использовать фрагмент рекомбинантного фибронектина, полученный, как описано выше. Кроме того, особенно предпочтительно использовать фрагмент фибронектина, который обладает эффектом, таким как улучшение экспансии доли лимфоцитов, увеличивая уровень экспрессии IL-2R в размножающихся лимфоцитах или увеличивая долю CD8-положительных клеток в популяции экспансивных лимфоцитов, как описано ниже. Кроме того, молекулярная масса данного фрагмента фибронектина, используемого в настоящем изобретении, предпочтительно составляет, но конкретно не ограничиваясь этими, от 1 до 200 кДа, более предпочтительно от 5 до 190 кДа и еще более предпочтительно от 10 до 180 кДа. (2) Способ получения цитотоксических лимфоцитов согласно настоящему изобретению. Далее будет конкретно описан способ получения цитотоксических лимфоцитов согласно настоящему изобретению. Способом согласно настоящему изобретению является способ получения цитотоксических лимфоцитов, включающий в себя осуществление, по меньшей мере, любого из процессов - индукции, поддержания и экспансии цитотоксических лимфоцитов - в присутствии указанного выше фибронектина, его фрагмента или их смеси. Используемый здесь термин «цитотоксические лимфоциты» означает группу клеток, содержащих цитотоксические лимфоциты. В узком смысле, в некоторых случаях цитотоксические лимфоциты могут относиться только к цитотоксическом лимфоцитам, содержащимся в вышеуказанной группе клеток. Кроме того, получение цитотоксических лимфоцитов согласно изобретению включает в себя любой из процессов - индукции, начиная от клеток-предшественниц, которые могут превращаться в лимфоциты согласно изобретению, и заканчивая лимфоцитами, обладающими цитотоксической активностью, поддержание цитотоксических лимфоцитов и экспансию цитотоксических лимфоцитов, с использованием цитотоксических лимфоцитов и/или клеток-предшественниц. Цитотоксические лимфоциты согласно изобретению включают в себя, конкретно ими не ограничиваясь, например, цитотоксические Т-клетки (CTL), лимфокин-активированные клетки-киллеры (LAKклетка), опухоль-инфильтрирующие лимфоциты (TIL), NK-клетки и пр., где каждая клетка обладает антигенспецифической цитотоксической активностью. В настоящем изобретении клетка-предшественница, которая может превращаться в цитотоксический лимфоцит, то есть клетка-предшественница, которая способна дифференцироваться в лимфоцит, представляет собой, например, РВМС, NK-клетки, "наивные" клетки, клетки памяти, гемопоэтические стволовые клетки, мононуклеарные клетки пуповинной крови и пр. Кроме того, поскольку клетка представляет собой гемоцит, эту клетку можно использовать в качестве клетки-предшественницы согласно изобретению. Могут быть непосредственно использованы любые клетки, выделенные из живого организма, или могут быть использованы клетки, которые подвергались замораживанию для хранения. В связи с этим в способе получения цитотоксических лимфоцитов согласно изобретению также может быть использован материал, содержащий вышеуказанные клетки, например, кровь, такая как периферическая кровь или пуповинная кровь; материал, полученный путем удаления компонентов, такой как эритроциты и плазма крови; костномозговая жидкость; и пр. Одна из главных особенностей этого способа получения цитотоксических лимфоцитов согласно изобретению состоит в том, что эти цитотоксические лимфоциты получают в присутствии эффективного компонента, выбранного из фибронектина, его фрагментов или их смеси. В способе согласно изобретению индукцию, поддержание и/или экспансию цитотоксических лимфоцитов обычно осуществляют в среде, содержащей данные компоненты в присутствии вышеупомянутого эффективного ингредиента согласно изобретению. Например, в способе согласно изобретению, когда предполагается индукция или экспансия цитотоксических лимфоцитов, число клеток (цитотоксических лимфоцитов и/или клеток-предшественниц) в начале культивирования, используемых в настоящем изобретении конкретно не ограничено. Например, это число предпочтительно составляет от 1 до 1 × 108 клеток/мл. Кроме того, условия культивирования конкретно не ограничены, и могут быть использованы обычные условия культивирования клеток. Например, клетки можно культивировать в при 37°С в присутствии 5% CO2 и т.п. Кроме того, среда может, заменяться свежей средой с подходящими интервалами. Среда, используемая в способе получения цитотоксических лимфоцитов согласно изобретению, конкретно не ограничена, и может быть использована известная среда, полученная путем смешения компонентов, необходимых для поддержания и роста цитотоксических лимфоцитов или клетокпредшественниц. Например, может быть использована коммерчески доступная среда. Такие среды, кроме основных компонентов, могут содержать подходящие белки, цитокины и другие компоненты. Предпочтительно в настоящем изобретении используется среда, содержащая IL-2. Концентрация IL-2 в среде составляет, конкретно этим не ограничиваясь, например, предпочтительно от 0,01 до 1 × 105 Ед/мл, более -7- 010434 предпочтительно - от 0,1 до 1 × 104 Ед/мл. Кроме того, клетка-предшественница, которая может превращаться в цитотоксический лимфоцит, может быть культивирована в среде, дополнительно содержащей антитело против CD3. Концентрация антитела против CD3 в среде составляет, конкретно этим не ограничиваясь, например, предпочтительно от 0,01 до 100 мкг/мл. Антитело против CD3 может быть добавлено для активации рецепторов лимфоцитов. Также, помимо приведенного выше, может быть добавлен лимфоцит-стимулирующий фактор, такой как лецитин. Концентрация данного компонента в среде конкретно не ограничена, при условии, что достигаются желательные эффекты. Помимо одновременного присутствия этих компонентов, которое достигается при растворении этих компонентов в среде, они могут быть иммобилизированы на соответствующей твердой фазе, например на приспособлении для клеточной культуры (включая любую из открытых и закрытых систем), например на чашке Петри, колбе или мешке, или на носителе для клеточной культуры, таком как бусы, мембрана или предметное стекло. Материалы таких твердых фаз конкретно не ограничены, при условии, что эти материалы могут быть использованы для клеточной культуры. В том случае, когда компоненты иммобилизованы, например, на вышеуказанном приспособлении, предпочтительно иммобилизовать данное количество каждого компонента в количестве среды, помещаемой в данное приспособление, таким образом, чтобы среда имела сходную пропорцию с желаемой концентрацией, при которой данные компоненты используются как компоненты, растворенные в среде, при помещении данной среды в приспособление. Количество иммобилизованных компонентов конкретно не ограничено, при условии, что достигаются желательные результаты. Вышеуказанный носитель используется путем погружения носителя в культуральную среду в приспособлении для клеточной культуры во время культивирования клеток. В том случае, когда вышеуказанные компоненты иммобилизованы на вышеупомянутом носителе, предпочтительно иммобилизовать данное количество каждого компонента в количестве среды, помещенной в данное оборудование, так, чтобы среда имела сходную пропорцию с желаемой концентрацией, при которой данные компоненты используются как компоненты, растворенные в среде, при помещении носителя в среду. Количество иммобилизованных компонентов конкретно не ограничено, при условии, что достигаются желательные результаты. В обоих случаях иммобилизация вышеупомянутых компонентов может осуществляться известным способом, например, способом иммобилизации фрагмента фибронектина, изложенным ниже. Более того, вместе с вышеуказанными компонентами можно использовать соединение, выбранное из группы, состоящей из кислых полисахаридов, кислых олигосахаридов, кислых моносахаридов и их солей, которые эффективны для индукции цитотоксических Т-клеток, обладающих антигенспецифической цитотоксической активностью, как описано в WO 02/14481, или вещество, выбранное из нижеследующих пунктов (A)-(D): (A) вещество со связующей активностью в отношении CD44; (B) вещество, способное регулировать сигнал, возникающий при связывании лиганда CD44 с CD44; (C) вещество, способное ингибировать связывание фактора роста с рецептором фактора роста; и (D) вещество, способное регулировать сигнал, возникающий при связывании фактора роста с рецептором фактора роста. Примером вышеуказанного вещества со связующей активностью в отношении CD44 может служить, например, лиганд CD44 и/или антитело против CD44. Вещество, способное регулировать сигнал, возникающий при связывании лиганда CD44 и CD44, включает в себя, например, различные ингибиторы фосфоферментов. Вещество, способное ингибировать связывание фактора роста с рецептором фактора роста, включает в себя, например, вещество с активностью связывания с фактором роста и образующее комплекс с фактором роста, тем самым ингибируя связывание фактора роста с рецептором фактора роста, или вещество с активностью связываниия с рецептором фактора роста, тем самым ингибируя связывание фактора роста и рецептором фактора роста. Кроме того, вещество, способное регулировать сигнал, возникающий при связывании фактора роста с рецептором фактора роста, включает в себя, например, различные ингибиторы фосфоферментов. Концентрация этих компонентов в среде конкретно не ограничена, при условии, что могут достигаться желательные результаты. Также эти компоненты могут быть использованы для иммобилизации на соответствующей твердой фазе, как указано выше, в дополнение к совместному присутствию этих компонентов в среде при растворении данных компонентов в указанной среде. В данном случае каждое из различных веществ, указанных выше, может быть использовано отдельно или в смеси двух или более разновидностей таких веществ. В настоящем изобретении фраза «в присутствии вышеуказанного эффективного ингредиента» относится к тому факту, что эффективный ингредиент находится в состоянии, когда вышеуказанный эффективный ингредиент может проявлять свою функцию при проведении индукции, поддержания и экспансии цитотоксических лимфоцитов, и реализация существующего способа конкретно не ограничена. Например, в том случае, когда используется эффективный ингредиент, растворенный в среде, содержание данного эффективного ингредиента согласно изобретению в среде, в которой проводят культивирование, конкретно не ограничено, при условии, что достигаются желательные результаты. Содержание эффективного ингредиента составляет, например, предпочтительно от 0,01 до 1000 мкг/мл, более пред-8- 010434 почтительно от 0,1 до 1000 мкг/мл, еще более предпочтительно от 1 до 100 мкг/мл. Кроме одновременного присутствия эффективного ингредиента при растворении этого эффективного ингредиента в среде, как указано выше, в данном случае может быть использована иммобилизация на соответствующей твердой фазе, например, на приспособлении для клеточной культуры (в том числе в любой из открытых и закрытых систем), например на чашке Петри, колбе или мешке, или на носителе для клеточной культуры, например бусах, мембране или предметном стекле. С точки зрения введения культивированных цитотоксических лимфоцитов в живой организм, желательно, чтобы вышеупомянутый эффективный ингредиент был иммобилизован, но этот факт конкретно не ограничен. В том случае, когда различные компоненты, указанные выше, или эффективный ингредиент согласно изобретению иммобилизованы на твердой фазе, цитотоксические лимфоциты могут быть легко отделены от эффективного ингредиента или пр., после получения лимфоцитов способом согласно изобретению лишь путем отделения от твердой фазы, с тем, чтобы предотвратить загрязнение лимфоцитов эффективным ингредиентом. В том случае, когда эффективный ингредиент согласно изобретению иммобилизован, например, на вышеуказанном приспособлении, предпочтительно иммобилизовать данное количество каждого эффективного ингредиента в количество среды, помещаемой в приспособление, так, чтобы среда имела пропорцию, сходную с желаемой концентрацией, при которой эффективный ингредиент используется как растворенный в среде эффективный ингредиент, при помещении среды в оборудование. Количество эффективного ингредиента конкретно не ограничено, при условии, что достигаются желательные результаты. В том случае, когда эффективный ингредиент иммобилизован на вышеуказанном носителе, предпочтительно иммобилизовать данное количество каждого эффективного ингредиента в количестве среды, помещаемой в приспособление, так, чтобы среда имела пропорцию, сходную с желаемой концентрацией, при которой эффективный ингредиент используется как растворенный в среде эффективный ингредиент, при помещении носителя в среду. Количество действующего ингредиента особым образом не ограничено, при условии, что достигаются желательные результаты. Например, иммобилизацию фрагмента фибронектина можно проводить в соответствии со способами, описанными в WO 97/18318 и WO 00/09168. При определении уровня экспрессии IL-2R цитотоксическими лимфоцитами, полученными способом согласно изобретению, было показано значительное увеличение уровня экспрессии IL-2R по сравнению с таковым в цитотоксических лимфоцитах, полученных при осуществлении по меньшей мере одного из процессов - индукции, поддержания и экспансии - в отсутствие фибронектина, его фрагмента или их смеси. В данном случае, уровень экспрессии IL-2R можно определить известным способом, например, с помощью, антитела против IL-2R. Как описано выше, цитотоксические лимфоциты, полученные способом согласно изобретению, имеют повышенный уровень экспрессии IL-2R. IL-2R представляет собой маркер активации, который экспрессируется на поверхности активированных Т-клеток, и при экспрессии этой молекулы активируется продукция цитокинов, цитотоксическая активность, активность пролиферации или т.п. Следовательно, цитотоксические лимфоциты, полученные способом согласно изобретению, представляют собой группу клеток с высокой функциональной активностью. Кроме того, поскольку цитотоксические лимфоциты, полученные способом согласно изобретению, имеют повышенный уровень экспрессии IL-2R, эти цитотоксические лимфоциты обладают повышенной чувствительностью к стимуляции IL-2, при добавлении в среду, или IL-2, продуцируемого клеткамипредшественницами цитотоксических лимфоцитов, самими лимфоцитами или совместно с другими присутствующими клетками. Поэтому цитотоксические лимфоциты могут быть активированы самим по себе даже в окружении меньшего количества IL-2 (например, в живом организме или пр.). Кроме того, в цитотоксических лимфоцитах, полученных способом согласно изобретению, присутствующее относительное содержание (CD8-позитивных) клеток с маркером CD8 выше по сравнению с относительным содержанием в цитотоксических лимфоцитах, полученных при осуществлении по меньшей мере любого одного из процессов - индукции, поддержания и экспансии - в отсутствие фибронектина, его фрагмента или их смеси. Этот факт имеет некоторые преимущества, например, 1) CD8позитивные клетки продуцируют цитокин, такой как интерферон-γ, тем самым вызывая иммунологическую активацию, изменяя баланс хелперных Т-клеток в сторону Th1 доминантной системы, 2) CD8позитивные клетки относятся к клеточным иммуноцитам, которые могут эффективно устранять чужеродное вещество, такое как вирус или опухолевую клетку, 3) при получении CD8-позитивных клеток количество этих CD8-позитивных клеток может быть увеличено при культивировании клеток способом согласно изобретению, при этом CD8-позитивные клетки очищают обычным способом с помощью магнитных бус или проточного цитометра, 4) цитотоксические лимфоциты подходящим образом используют в качестве клеток-предшественниц во время индукции CTL из-за большего соотношения CD8позитивных клеток, 5) даже если клеточная популяция имеет более низкое отношение CD8-позитивных клеток, ее можно культивировать, увеличивая отношение CD8-позитивных клеток, и пр. Следовательно, способ согласно изобретению является очень эффективным для получения цитотоксических лимфоцитов. -9- 010434 В данном случае, отношение CD8-позитивных клеток в цитотоксических лимфоцитах, полученных способом согласно изобретению, может быть определено, например, с использованием антитела против CD8, но конкретно этим не ограничиваясь. Кроме того, цитотоксические лимфоциты, главным образом CTL, полученные в соответствии со способом согласно изобретению, имеют прекрасные характеристики, такие как отсутствие резкого снижения цитотоксической активности, что наблюдалось ранее, даже когда клетки после культивирования поддерживали в течение длительного периода времени, или при пролиферации клеток. Другими словами, цитотоксические лимфоциты сохраняет высокую цитотоксическую активность по сравнению с цитотокскческими лимфоцитами, полученными при осуществлении, по меньшей мер, любого из процессов индукции, поддержания и экспансии - в отсутствие фибронектина, его фрагмента или их смеси. Следовательно, стабильную цитотоксическую активность лимфоцитов можно поддерживать, клонируя цитотоксические лимфоциты. Кроме того, индуцированные CTL могут пролиферировать и размножаться путем стимуляции CTL антигеном, различными видами цитокинов или антителом против CD3. Для поддержания и экспансии лимфоцитов может быть использован любой известный способ, без конкретного ограничения. Поддержание вышеупомянутых цитотоксических лимфоцитов относится к поддержанию цитотоксических лимфоцитов при сохранении их цитотоксической активности. Условия культивирования во время поддержания конкретным образом не ограничены, и могут быть использованы условия, используемые при поддержании обычной клеточной культуры. Например, клетки можно культивировать в условиях при 37°С в присутствии 5% CO2 и пр. Кроме того, среду можно заменять свежей средой с подходящими интервалами времени. Используемая среда и другие используемые вместе с ней компоненты и пр., являются такими же, как указано выше. Одной из главных особенностей поддержания и экспансии цитотоксических лимфоцитов в способе согласно изобретению является тот факт, что данный способ включает в себя, соответственно, непрерывное культивирование и экспансию цитотоксических лимфоцитов в среде в присутствии эффективного ингредиента согласно изобретению, т.е. фибронектина, его фрагмента или их смеси. В соответствии с экспансией, число клеток цитотоксических лимфоцитов может увеличиваться в стадии поддержания цитотоксической активности цитотоксических лимфоцитов. Другими словами, как один вариант осуществления способа согласно изобретению, здесь предлагается способ экспансии цитотоксических лимфоцитов. В способе экспансии цитотоксическых лимфоцитов согласно изобретению условия культивирования конкретно не ограничены, и могут быть использованы условия, используемые для культивирования обычной клеточной культуры. Например, клетки можно культивировать в условиях при 37°С в присутствии 5% CO2 и пр. Кроме того, среду можно заменять свежей средой в подходящие интервалы времени. Используемая среда и другие используемые вместе с ней компоненты и пр. являются такими же, как указано выше. В соответствии со способом экспансии согласно изобретению, например, в случае экспансии CTL, экспансия в течение 14 дней дает увеличение числа клеток CTL в 100-1000 раз. Кроме того, в качестве одного из примеров экспансии, культивирование в течение 7 дней клеток LAK дает увеличение числа клеток LAK в 200 раз, и примерно в 1000 раз - при культивировании этих клеток в течение 9 дней. Более того, полученные таким образом цитотоксические лимфоциты, в особенности CTL, обладают более высокой цитотоксической активностью по сравнению с CTL, полученными обычным способом экспансии цитотоксических лимфоцитов, например, REM-способом или модифицированным REM-способом. Результаты настоящего изобретения, описанные выше, могут быть подтверждены путем определения цитотоксической активности CTL или пр., при экспансии способом согласно изобретению, в соответствии со способом, описанным в примерах, представленных ниже. Кроме того, способ получения цитотоксических лимфоцитов согласно изобретению имеет особенность, заключающуюся в том, что культивирование может быть происходить при низком числе клеток. Для проведения адоптивной иммунотерапии требуется большое количество лимфоцитов, но у пациента трудно получить большое количество лимфоцитов. Кроме того, при обычной экспансии цитотоксических лимфоцитов необходимо выбирать приспособление для клеточной культуры с соответствующей площадью для культивирования, в зависимости от числа используемых клеток, и культивировать в соответствующем количестве среды. Другими словами, обычно культивирование начинают в условиях высокой плотности, когда количество (число) клеток на площадь культивирования в приспособлении для клеточной культуры [т.е. площадь (см2) поверхности приспособления, контактирующая со средой] составляет от 1 × 106 клеток/см2 или более, и концентрация клеток составляет от 1 × 106 клеток/мл или более. В тех случаях, когда культивирование проводят в условиях ниже этого уровня клеток, коэффициент экспансии [отношение числа клеток после экспансии к числу клеток до экспансии (число клеток после экспансии/число клеток до экспансии)] становится очень низким, в результате чего требуется длительный период культивирования для получения цитотоксических лимфоцитов в большом количестве. Следовательно, в настоящий момент большое число лимфоцитов получают обычно, например, начиная культивирование с небольшим приспособлением для клеточной культуры, а затем используя поэтапное, широ- 10 - 010434 комасштабное приспособление для клеточной культуры, или увеличивая число приспособлений для клеточных культур и методик повторных разведений. Как описано выше, для обычной экспансии цитотоксических лимфоцитов требуется большое количество культур. В соответствии со способом согласно изобретению, даже в том случае, когда культивирование начинают с небольшого количества клеток, клетки могут быть культивированы с высоким коэффициентом экспансии, не зависимо от размера приспособления для клеточной культуры. Следовательно, сложная методика, такая как замена приспособления для клеточной культуры, и методика разьедения, описанные выше, становятся ненужными. Другими словами, в соответствии со способом согласно изобретению, экспансия цитотоксических лимфоцитов может быть удовлетворительно проведена с помощью способов культивирования с использованием одного приспособления для клеточной культуры, т.е. с помощью одной культуральной системы. Следовательно, способ согласно изобретению представляет собой способ получения цитотоксических лимфоцитов, который исключает стадию разведения или стадию замены приспособления для клеточной культуры. Главным образом, в том случае, когда в соответствии со способом согласно изобретению проводят экспансию LAK-клеток, LAK-клетки могут быть экспансированы при добавлении в приспособление для клеточной культуры большого объема клеток, которые могут давать LAK-клетки, и среды, и при добавлении к ней только IL-2 на последующих стадиях. Настоящее изобретение очень эффективно в том аспекте, что с помощью простой методики может быть получено большое количество LAK-клеток. В данном случае предпочтительно для получения более высокого коэффициента экспансии в качестве эффективного ингредиента согласно изобретению использовать фрагмент фибронектина. Как описано выше, в соответствии со способом согласно изобретению, необходимое количество цитотоксического лимфоцита может быть получено за более короткий период времени. Например, когда по меньшей мере любой один из процессов - индукции, поддержания и экспансии цитотоксического лимфоцита начинают при небольшом числе клеток в приспособлении для клеточной культуры, содержащем среду, в присутствии эффективного ингредиента согласно изобретению, данная индукция, поддержание или экспансия может проводиться с использованием количества клеток, удовлетворяющего условиям, выбранным из следующих (а) и (b) в начале культивирования: (a) соотношение количества клеток к площади культуры в используемом приспособлении для клеточной культуры составляет предпочтительно от 1 до 5 × 105 клеток/см2, более предпочтительно от 10 до 1 × 105 клеток/см2, особенно предпочтительно от 1 × 102 до 5 × 104 клеток/см2; и (b) концентрация клеток в среде составляет предпочтительно от 1 до 5 × 105 клеток/мл, более предпочтительно от 10 до 1 × 105 клеток/мл, особенно предпочтительно от 1 × 102 до 5 × 104 клеток/мл. Количество клеток, в используемом здесь смысле, относится к числу цитотоксических лимфоцитов и/или клеток-предшественниц. Кроме того, в способе согласно изобретению может быть приведен в качестве примера способ, включающий в себя проведение по меньшей мере любого одного из [процессов] - индукции, поддержания и экспансии цитотоксических лимфоцитов - в одной культуральной системе, в котором исключена стадия замены приспособления для клеточной культуры или стадия процедуры разведения. Способ согласно изобретению будет раскрыт на примере получения CTL. Индукцию CTL проводят путем инкубации (культивирования) клеток-предшественниц, способных к дифференцировке в CTL, вместе с соответствующими антигенпредставляющими клетками в присутствии вышеуказанного эффективного ингредиента, например, в любой среде, для получения CTL, способных распознавать желаемый антиген. Клетки-предшественницы конкретно не ограничены, при условии, что клетки-предшественницы представляют собой клетки, находящиеся на стадии, предшествующей стадии образования данной CTL-клетки, для которой предопределена дифференцировка в CTL, и включают в себя, например, мононуклеарные клетки периферической крови (РВМС), "наивные" клетки, клетки памяти, мононуклеарные клетки пуповинной крови, гемопоэтические стволовые клетки и пр. Антигенпредставляющие клетки конкретно не ограничены, при условии, что данные клетки способны представлять антиген для его распознавания Т-клетками. В настоящем изобретении могут использоваться, например, мононуклеарные клетки, В-клетки, Т-клетки, макрофаги, дендритные клетки, фибробласты или пр., которые могут представлять желаемый антиген. В настоящем изобретении условия культивирования для клетки-предшественницы, или тому подобное, во время получения CTL могут быть, например, приведены в соответствие с общеизвестными условиями [см., например, Carter J. et al., Immunology 57(1), 123-129 (1986)]. Кроме того, клетка может быть культивирована совместно с подходящей питающей клеткой. В том случае, когда CTL культивируют совместно с питающей клеткой, желательно, чтобы среда представляла собой среду, подходящую для обеспечения жизнедеятельности и роста как CTL, так и питающей клетки. В качестве среды может быть использована коммерчески доступная среда. Питающая клетка, используемая для способа согласно изобретению, особым образом не ограничена, при условии, что данная питающая клетка стимулирует CTL совместно с анти-CD3 антителом для активации Т-клеточного рецептора. В настоящем изобретении, например, используют РВМС или Вклетку, трансформированную вирусом Эпштейна-Барр (EBV-B-клетка). Обычно питающую клетку ис- 11 - 010434 пользуют после лишения ее пролиферативной активности посредством излучения или пр. В этой связи, содержание питающей клетки в среде может быть определено в соответствии с известными условиями. Например, данное содержание составляет предпочтительно от 1 × 105-7 клеток/мл. В особенно предпочтительном варианте осуществления настоящего изобретения в качестве питающей клетки используют невирусинфицированную клетку, например, клетку, иную, чем EBV-B-клетка. Используя невирусинфицированную клетку, можно устранить возможность того, что EBV-B-клетка смешается с развивающимся CTL, тем самым, повышая безопасность при медицинском лечении с использованием CTL, таком как адоптивная иммунотерапия. Антигенпредставляющая клетка может быть получена путем добавления антигенного пептида к клетке, обладающей способностью представлять антиген, тем самым давая возможность клетке представлять данный антигенный пептид на ее поверхности [см., например, Bendnarek M. A. et al., J. Immunol. 147(12), 4047-4053 (1991)]. Кроме того, в том случае, когда клетка, обладающая антигенпредставляющей способностью, обладает способностью процессировать антиген, к данной клетке добавляют антиген, посредством чего антиген внедряется в клетку и процессируется в ней, и фрагментированные антигенные пептиды представляются на клеточной поверхности. В этой связи, в том случае, когда добавляют антигенный пептид к клетке, обладающей способностью представлять антиген, антигенный пептид соответствует МНС-рестрикции использующейся антигенпредставляющей клетки и индуцируется соответсвующая CTL. В этой связи, антиген, используемый в настоящем изобретении, особым образом не ограничивается и включает в себя, например, экзогенные антигены, такие как бактерии и вирусы, эндогенные антигены, такие как антигены, ассоциированные с опухолью (раковые антигены), и пр. Согласно изобретению предпочтительно, чтобы антигенпредставляющую клетку делали непролиферирующей. Для того чтобы сделать клетку непролиферирующей, клетку можно, например, подвергнуть облучению Х-лучами или пр., или обработать агентом, таким как митомицин. Согласно изобретению общие условия для инкубации (совместного культивирования) клеткипредшественника, способной дифференцироваться в CTL, вместе с антигенпредставляющей клеткой в присутствии действующего ингредиента, выбранного из фибронектина, его фрагмента или их смеси, для индукции CTL, могут быть известными условиями [см., например, Bendnarek M. А. et al., J. Immunol., 147(12), 4047-4053 (1991)]. Условия совместного культивирования особым образом не ограничены, и могут быть использованы условия, обычно используемые для клеточной культуры. Например, клетки можно культивировать в условиях при 37°С в присутствии 5% CO2, и пр. Совместное культивирование обычно проводят примерно в течение от 2 до 15 дней, в течение этого времени антигенпредставляющую клетку можно заменить свежеприготовленной клеткой для повторной стимуляции. Кроме того, среда может быть заменена свежей средой в соответствующие интервалы времени. CTL, полученные способом согласно изобретению, обладают способностью специфически распознавать желаемый антиген, например, специфически разрушать клетку, имеющую данный антиген, своей цитотоксической активностью. Эта цитотоксическая активность CTL может быть оценена известным способом. Например, цитотоксическая активность CTL против клетки-мишени, меченной радиоактивным веществом, флуоресцентным веществом или пр., может быть оценена путем определения радиоактивности или интенсивности флуоресценции, приписываемой клетке-мишени, разрушенной под действием CTL. Кроме того, ее можно определить путем определения количества цитокина, такого как GMCSF или IFN-γ, высвобождаемого антигенспецифически из CTL или клетки-мишени. Помимо этого, цитотоксическая активность может быть непосредственно подтверждена использованием антигенного комплекса пептид-МНС, в котором данный пептид помечен флуоресцентным красителем или пр. В этом случае, например, CTL приводят в контакт с первым флуоресцентным маркером, соединенным с CTLспецифическим антителом, а затем с антигенным комплексом пептид-МНС, в котором данный пептид соединяют со вторым флуоресцентным маркером, и наличие клетки с двойной меткой выявляют с помощью FACS-анализа (активированная флуоресценцией сортировка клеток), посредством чего может быть оценена цитотоксическая активность CTL. В этой связи, способ развития CTL согласно изобретению особым образом не ограничен, при условии, что вышеупомянутый действующий ингредиент находится в культуре, используемой в данном способе. Настоящее изобретение также охватывает вариант осуществления, в котором данный способ проводят в присутствии вышеупомянутого действующего ингредиента в культуре в общепринятом способе развития CTL, помимо описанного выше, т.е. культивирование клетки-предшественника или подобной, проводят в присутствии действующего ингредиента согласно изобретению (например, путем добавления вышеупомянутого действующего ингредиента к среде, используемой в данной культуре). Далее способ культивирования LAK-клетки будет раскрыт подробно. Культивирование LAK-клетки проводят путем инкубации клетки, которая может быть превращена в LAK-клетку, вместе с IL-2 в присутствии вышеупомянутого действующего ингредиента. Данная клетка, которая может быть превращена в LAK-клетку, включает в себя, особо ими не ограничиваясь, например, мононуклеарную клетку периферической крови (РВМС), NK-клетку, мононуклеарную клетку пупо- 12 - 010434 винной крови, гемопоэтическую стволовую клетку, компонеты крови, содержащие эти клетки, и пр. Кроме того, основные условия для культивирования LAK-клетки могут быть установлены в соответствии с известными условиями [например, см. Saibo Кодаки (Cell Technology), 14(2), 223-227 (1995); Saibo Baiyo(Cell Culture) 17(6), 192-195 (1991); THE LANCET, 356, 802-807 (2000); Current Protocols in Immunology, supplement 17, UNIT 7.7]. Условия совместного культивирования особым образом не ограничены, и могут быть использованы условия, которые используют для обычной клеточной культуры. Например, культивирование можно проводить в условиях при 37°С в присутствии 5% CO2 и пр. Такое совместное культивирование обычно проводят примерно в течение от 2 до 15 дней. Кроме того, среда может быть заменена свежей средой в соответствующие интервалы времени. Таким же образом, как и для вышеупомянутой индукции, поддержания или развития CTL- или LAK-клетки, в отношении TIL, группа клеток, обладающая высокой цитотоксической активностью, может быть получена культивированием данных клеток в присутствии фибронектина, его фрагмента или их смеси. В настоящем изобретении отсутствуют особые ограничения в процедурах активации этих клеток, при условии, что фибронектин, его фрагмент или их смесь присутствует совместно с ними, и данные процедуры могут быть проведены с использованием среды, подходящей для культивирования или активации вышеупомянутых клеток. В отношении используемого количества фибронектина, его фрагмента или их смеси, способа добавления компонента и пр., подходящие количества и способы могут быть выбраны в соответствии с вышеупомянутым способом. В соответствии с вышеупомянутым способом получения цитотоксического лимфоцита согласно изобретению, здесь получают цитотоксический лимфоцит, у которого цитотоксическая активность сохранена на высоком уровне, уровень экспрессии IL-2R значительно повышен и повышена доля CD8позитивных клеток, среди цитотоксических лимфоцитов, который подходит для использования в медицине. Соответственно, в качестве одного варианта осуществления способа согласно изобретению, здесь дополнительно предложен способ повышения экспрессии рецептора интерлейкина-2 в цитотоксическом лимфоците, включающий в себя проведение, по меньшей мере, любой из стадий: индукции, обеспечения жизнедеятельности и развития цитотоксического лимфоцита в присутствии действующего ингредиента согласно изобретению; способ повышения соотношения CD8-позитивной клетки в цитотоксическом лимфоците, включающий в себя проведение любой из стадий: индукции, обеспечения жизнедеятельности и развития цитотоксического лимфоцита в присутствии действующего ингредиента согласно изобретению; и способ повышения или сохранения цитотоксической активности в цитотоксическом лимфоците, включающий в себя проведение по меньшей мере любой из стадий: индукции, обеспечения жизнедеятельности и развития цитотоксического лимфоцита в присутствии действующего ингредиента согласно изобретению. В другом варианте осуществления настоящего изобретения предлагается агент для усиления экспресии IL-2R на клеточной поверхности, который включает в себя в качестве действующего ингредиента фибронектин, его фрагмент или их смесь. Данный усиливающий агент включает в себя сам действующий ингредиент и дополнительно другой необязательный ингредиент, например, среду, белок и цитокин (предпочтительно IL-2), подходящие для активируемой клетки, и другие желательные компоненты. Также среда, содержащая вышеупомянутый усиливающий агент, может быть использована в качестве среды для усиления экспресии IL-2R в цитотоксическом лимфоците. Вышеупомянутая среда необязательно содержит основные компоненты для клеточной культуры. Здесь усиливающий агент и среда для усиления экспресии IL-2R, упомянутые выше, могут быть приготовлены с использованием действующего ингредиента согласно изобретению в соответствии с изестным способом. Содержание действующего ингредиента согласно изобретению, и подобного, в усиливающем агенте или в среде для усиления экспрессии IL-2R, упомянутые выше, особым образом не ограничиваются, при условии, что достигаются жела.тельные результаты согласно изобретению. Например, данное содержание может быть подходящим образом определено в соответствии с содержанием действующего ингредиента и пр., в вышеупомянутой среде, по желанию используемой в способе согласно изобретению. Кроме того, вышеупомянутый усиливающий агент может быть введен непосредственно в живой организм, посредством чего может быть усилена экспрессия IL-2R на клетке в живом организме. Еще в одном варианте осуществления настоящего изобретения предлагается агент для повышения соотношения CD8-позитивной клетки в популяции культивируемых лимфоцитов, характеризующийся тем, что данный агент содержит в качестве действующего ингредиента фибронектин, его фрагмент или их смесь. Агент, повышающий соотношение, включает в себя сам действующий ингредиент и дополнительно другой необязательный ингредиент, например, среду, белок и цитокин (предпочтительно IL-2), подходящие для активируемой клетки, и другие желательные компоненты. Также среда, содержащая вышеупомянутый агент, повышающий соотношение, может быть использована в качестве среды для повышения соотношения (доли) CD8-позитивных клеток в цитотоксическом лимфоците. Вышеупомянутая среда необязательно содержит основные компоненты для клеточной культуры. Здесь агент, повышающий соотношение клеток, и среда для повышения соотношения, упомянутая выше, могут быть получены с использованием действующего ингредиента настоящего изобретения в соответствии с известным способом. Содержание действующего ингредиента настоящего изобретения и пр. в повышающем соотноше- 13 - 010434 ние агенте или среде для повышения соотношения (доли) CD8-позитивных клеток, упомянутого выше, может быть подходящим образом определено при желании таким же образом, как в случае вышеупомянутого агента для экспрессии IL-2R и пр. Кроме того, вышеупомянутый повышающий соотношение агент может быть непосредственно введен в живой организм, посредством чего может быть повышена доля цитотоксических лимфоцитов в живом организме. В другом варианте осуществления настоящего изобретения предлагается агент для повышения или сохранения цитотоксической активности в цитотоксическом лимфоците, характеризующийся тем, что данный агент содержит в качестве действующего ингредиента фибронектин, его фрагмент или их смесь. Данный повышающий или сохраняющий агент содержит сам действующий ингредиент и дополнительно другой необязательный ингредиент, например, среду, белок и цитокин (предпочтительно IL-2), подходящие для активируемой клетки, и другие желательные компоненты. Также данная среда, содержащая вышеупомянутый повышающий или сохраняющий агент, может быть использована в качестве среды для повышения или сохранения цитотоксической активности в цитотоксическом лимфоците. Вышеупомянутая среда необязательно содержит основные компоненты для клеточной культуры. Здесь, повышающий или сохраняющий агент и среда для повышения или сохранения, упомянутые выше, могут быть приготовлены с использованием действующего ингредиента согласно изобретению в соответствии с известным способом. Содержание действующего ингредиента согласно изобретению в повышающем или сохраняющем агенте и среде для повышения или сохранения, упомянутых выше, особым образом не ограничивается, при условии, что достигаются желательные результаты согласно изобретению. Например, содержание может быть подходящим образом определено в соответствии с содержанием действующего ингредиента в среде, упомянутой выше, по желанию используемой в способе согласно изобретению. Кроме того, вышеупомянутый повышающий или сохраняющий агент может быть введен непосредственно в живой организм, посредством чего может быть повышена или сохранена активность цитотоксического лимфоцита в живом организме. Более того, агент, усиливающий экспрессию, агент, повышающий соотношение, и агент для повышения или сохранения цитотоксической активности, упомянутые выше, могут быть в форме, когда данные компоненты иммобилизованы на соответствующей твердой фазе, например приспособлении для клеточной культуры, например чашке Петри, колбе или мешке (в том числе и открытой системы, и закрытой системы), носителе клеточной культуры, таком как бусы, мембрана или покровное стекло. Обычно в лимфоцитсодержащей культуре, полученной с использованием способа получения цитотоксического лимфоцита, описанного выше, примешаны клетки, иные, чем цитотоксический лимфоцит, например, хелперная Т-клетка. Однако поскольку лимфоциты, обладающие цитотоксической активностью, содержатся в большом количестве в лимфоцитсодержащей культуре, полученной согласно изобретению, данные клетки в культуре могут быть собраны из культуры с помощью центрифугирования или пр., и непосредственно использованы в качестве цитотоксического лимфоцита, полученного способом согласно изобретению. Более того, если вышеупомянутый действующий ингредиент или пр., иммобилизован на приспособлении для клеточной культуры или пр., отсутствует риск примешивания данного компонента, или пр., в полученный в результате цитотоксический лимфоцит. Кроме того, клеточная популяция (или культура), богатая цитотоксическими лимфоцитами, может быть дополнительно выделена из культуры известным способом и использована как цитотоксический лимфоцит согласно изобретению. Другими словами, способ получения цитотоксического лимфоцита, полученного способом согласно изобретению, может включать в себя стадию отбора клеточной популяции, богатой цитотоксическими лимфоцитами, из культуры, полученной данным способом. Способ отбора клеточной популяции, богатой цитотоксическими лимфоцитами, особым образом не ограничен. Данный способ иллюстрируется, например, способом, включающим в себя селективный сбор только желаемой клетки из культуры с использованием приспособления для клеточной культуры или носителя, с которым связано антитело против антигена кх:еточной поверхности, экспрессируемого на поверхности желаемой клетки, например, анти-CD8-антитело, или способом с использованием проточного цитометра. Вышеупомянутый носитель иллюстрируется магнитными бусами или колонкой. Кроме того, клеточная популяция, богатая желаемыми клетками, может быть получена путем удаления с помощью адсорбирования клеток, помимо желаемой клетки, из культуры. Например, Т-клетка-хелпер может быть удалена из культуры лимфоцитов с использованием антитела против антигена клеточной поверхности, экспрессируемого на поверхности Т-клетки-хелпера, например анти-CD4-антитела. На этой стадии также может быть использован проточный цитометр. Клеточная популяция, богатая цитотоксическими лимфоцитами, полученными таким образом, обладает цитотоксической активностью большей силы по сравнению с цитотоксической активностью клеточной популяции, собранной неселективно из культуры, так что данная клеточная популяция может быть особенно предпочтительно использована в медицине. Далее в настоящем изобретении предложены цитотоксические лимфоциты, полученные способом получения цитотоксических лимфоцитов согласно изобретению, упомянутым выше. Данные лимфоциты, особенно CTL, обладают высокой цитотоксической активностью, которая характеризуется тем, что существует небольшое снижение цитотоксической активности, даже когда лимфоциты подвергают продолжительному культивированию или развитию на протяжении длительного периода времени. Кроме того, в настоящем изобретении предложено лекарственное средство (терапевтический агент), содержа- 14 - 010434 щее данные лимфоциты в качестве действующего ингредиента. Главным образом вышеупомянутый терапевтический агент, содержащий данные лимфоциты, соответствующим образом используют в адоптивной иммунотерапии. В адоптивной иммунотерапии лимфоциты, обладающие цитотоксической активностью, подходящей для лечения пациента, вводят пациенту, например, внутривенно. Терапевтический агент может быть получен, например, посредством смешивания лимфоцита, полученного способом согласно изобретению, в качестве действующего ингредиента, например, с известным органическим или неорганическим носителем, подходящим для неперорального введения, эксципиентом, стабилизирующим агентом и пр., в соответствии со способом, известным в области фармакологии. В этой связи, различные условия для данного терапевтического агента, такие как содержание лимфоцита согласно изобретению в терапевтическом агенте и доза терапевтического агента, могут быть определены соответствующим образом согласно известной адоптивной иммунотерапии. Способ получения цитотоксических лимфоцитов согласно изобретению дополнительно может включать в себя стадию трансдукции чужеродного гена в лимфоцит. Другими словами, в одном из вариантов осуществления настоящего изобретения предложен способ получения цитотоксических лимфоцитов, включающих в себя стадию трансдукции чужеродного гена в цитотоксический лимфоцит. Здесь термин «чужеродный» относится к тому, что является чужеродным лимфоциту, в который трансдуцируют ген. Способа получения цитотоксических лимфоцитов согласно изобретению, в особенности способ развития цитотоксических лимфоцитов, усиливает способность репликации ДНК культивируемых лимфоцитов. Следовательно, включение стадии трансдукции гена в способ получения цитотоксических лимфоцитов согласно изобретению может способствовать усилению генной трансдукции. Способы трансдукции чужеродного гена особым образом не ограничены, и подходящий способ может быть выбран из известного способа трансдукции гена. Стадию трансдукции гена можно проводить на любой заданной стадии во время получения цитотоксических лимфоцитов. Например, предпочтительно проводить данную стадию одновременно с любой стадией вышеупомянутой индукции, обеспечения жизнедеятельности и/или развития лимфоцита, или после данной стадии, с точки зрения производительности труда. Как вышеупомянутый способ трансдукции гена, любые способы с использованием живого вектора и способы без использования вектора могут быть использованы в настоящем изобретении. Подробности этих способов уже были описаны в многочисленных изданиях. Вышеупомянутый вирусный вектор особым образом не ограничен, и используют известный вирусный вектор, обычно используемый в способе трансдукции гена, например, ретровирусный вектор, лентивирусный вектор, аденовирусный вектор, аденоассоциированный вирусный вектор, вектор обезьяньего вируса, вектор вируса коровьей оспы, вектор вируса Сендай или пр. Особенно предпочтительно использовать в качестве вирусного вектора ретровирус, аденовирус, аденоассоциированный вирус или обезьяний вирус. В качестве вышеупомянутого вирусного вектора предпочтительными являются векторы, у которых отсутствует способность к репликации, для того, чтобы вирусный вектор не мог самореплицироваться в инфицированной клетке. Ретровирусный вектор используют для целей генной терапии или пр., поскольку в вектор в хромосомной ДНК клетки может быть стабильно введен чужеродный ген и вектор может быть трансдуцирован. Поскольку данный вектор обладает высоким инфицирующим действием на клетку во время митоза и пролиферации, трансдукцию гена предпочтительно проводят в способе получения цитотоксических лимфоцитов, например, на стадии развития. В качестве способа трансдукции гена без использования вирусного вектора здесь может быть использован, но особым образом не ограничен, например, способ с использованием носителя, такого как липосома или лиганд-полилизин, способ фосфата кальция, способ электропорации, метод пушки частицами и пр. В этом случае трансдуцированный чужеродный ген включен в плазмидную ДНК или линейную ДНК. Чужеродный ген, трансдуцированный в цитотоксический лимфоцит, в настоящем изобретении особым образом не ограничен, и может быть выбран произвольный ген, который желательно трансдуцировать в вышеупомянутую клетку. В качестве гена, описанного выше, помимо гена, кодирующего белок (например, фермент, цитокин, рецептор и пр.), может быть использован, например, ген, кодирующий антисмысловую нуклеиновую кислоту или рибозим. Кроме того, одновременно можно трансдуцировать соответствующий маркерный ген, который обладает способностью к селекции клетки, в которую трансдуцирован ген. Вышеупомянутый чужеродный ген может быть, например, вставлен в вектор, плазмиду и пр., так, чтобы данный чужеродный ген экспрессировался под контролем соответствующего промотора и использовался. Кроме того, для достижения эффективной транскрипции гена в векторе может находиться другой регуляторный элемент, который кооперируется с промотором или сайтом инициации транскрипции, например, энхансерная последовательность или терминальная последовательность. Кроме того, с целью вставки чужеродного гена в хромосому лимфоцита, в который трансдуцируют данный ген путем гомологичной рекомбинации, например, чужеродный ген может быть расположен между фланкирующими по- 15 - 010434 следовательностями, включающими нуклеотидные последовательности, гомологичные нуклеотидным последовательностям, расположенным с обеих сторон желаемого целевого сайта вставки данного гена в хромосому. Трансдуцируемый ген может представлять собой ген, встречающийся в природе или полученный искусственным путем, или может представлять собой ген, в котором молекулы ДНК, имеющие происхождение, связаны известным способом, таким как лигирование. Более того, чужеродным геном может быть ген, имеющий последовательность, в которой в природную последовательность введена мутация, в зависимости от его назначения. В соответствии со способом согласно изобретению, например, ген, кодирующий фермент, ассоциированный с лекарственной устойчивостью, используемый для лечения пациентов, больных раком и пр., трансдуцируют в цитотоксический лимфоцит, тем самым придавая лимфоциту устойчивость к лекарственному средству. В том случае, если используют цитотоксический лимфоцит, описанный выше, адоптивная иммунотерапия и лекарственная терапия могут быть объединены, и, следовательно, может быть достигнут более высокий терапевтический эффект. Ген устойчивости к лекарственным средствам иллюстрируется, например, геном устойчивости ко многим лекарственным средствам. С другой стороны, в отличие от вышеупомянутого варианта осуществления, ген трансдуцируют в лимфоцит с тем, чтобы придать чувствительность к определенному лекарственному средству, тем самым придавая чувствительность к данному лекарственному средству. В этом случае лимфоцит после трансплантации в живой организм может быть удален посредством введения данного лекарственного средства. Ген, придающий чувствительность к лекарственному средству, иллюстрируется, например, геном тимидинкиназны. Примеры Настоящее изобретение будет более конкретно описано примерами, не ограничивающими объем настоящего изобретения. Препаративный пример 1. Получение фрагмента фибронектина. (1) Получение фрагмента фибронектина. Фрагмент Н-271, полученный из фибронектина человека, получали из Escherichia coli HB101/pHD101 (FERM BP-2264) в соответствии со способом, описанным в патенте США № 5198423. Кроме того, фрагменты Н-296, СН-271 и СН-296, полученные из фибронектина человека, каждый получали из культуры, получаемой культивированием Escherichia coli HB101/pHD102 (FERM BP-7420), Escherichia coli HB101/pCH101 (FERM BP-2799) или Escherichia coli HB101/pCH102 (FERM BP-2800), в соответствии со способом, описанным в вышеупомянутом бюллетене. Фрагмент С-274, полученный из фибронектина человека, получали из культуры, полученной культивированием Escherichia coli JM109/pTF7221 (FERM BP-1915), в соответствии со способом, описанным в патенте США № 5102988. Фрагмент C-CS1, полученный из фибронектина человека, получали из культуры, получаемой культивированием Escherichia coli HB101/pCS25 (FERM BP-5723) в соответствии со способом, описанным в Бюллетене патентов Японии № 3104178. Каждый фрагмент CHV-89 и CHV-179, полученный из фибронектина человека, получали из культуры, полученной культивированием Escherichia coli HB101/pCHV89 (FERM P-12182) или Escherichia coli HBl01/pCHV179 (FERM P-12183), в соответствии со способом, описанным в Бюллетене патентов Японии № 2729712. Кроме того, CHV-90, фрагмент, извлеченный из фибронектина человека, готовили в соответствии со способом, описанным в Бюллетене патентов Японии № 2729712. Конкретно, плазмиду pCHV90 конструировали в соответствии с методикой, описанной в бюллетене, и после этого культивировали трансформант несущий плазмиду, и из культуры получали CHV-90. Фрагмент CHV-181, полученный из фибронектина человека, получали путем конструирования плазмиды (pCHV181), содержащей ДНК, кодирующую CHV-181, в соответствии со способом, описанным в WO 97/18318, с последующим культивированием Escherichia coli HB101/pCHV181, в которую вводили данную плазмиду, и фрагмент получали из культуры так же, как для вышеуказанного CHV-179. (2) Получение CHV-92 Как и в случае плазмиды pCHV181 для экспрессии вышеуказанного полипептида CHV-181, была сконструирована плазмида CHV92 с делецией в области кодирования III-13 области в области кодирования CHV-181. Процедуру получения делеции осуществляли в соответствии со способами получения делеции кодирующей области III-14 из плазмиды pCHV179, как описано в патенте Японии Gazette № 2729712. Escherichia coli HB101 (Escherichia coli HB101/pCHV92), трансформированную вышеупомянутой плазмидой pCHV92, культивировали, и осуществляли процедуры очиски в соответствии со способом очистки полипептида CHV-89, описанным в патенте Японии Gazette № 2729712, с получением из полученной культуры чистого препарата CHV-92. (3) Получение H-275-Cys. Плазмиду для экспрессии полипептида H-275-Cys конструировали в соответствии с нижеуказанными способами. Конкретно, плазмиду рСН102 получали из Escherichia coli НВ101/рСН102 (FERM BP- 16 - 010434 2800). PCR проводили, используя праймер 12S с нуклеотидной последовательностью, показанной в SEQ ID NO: 20 в списке последовательностей, и праймер 14А с нуклеотидной последовательностью, показанной в SEQ ID NO: 21 в списке последовательностей, с вышеуказанной плазмидой в качестве образца, с получением фрагмента ДНК размером приблизительно 0,8 т.п.н., кодирущего гепаринсвязывающий полипептид фибронектина. Полученный фрагмент ДНК расщепляли NcoI и BamHI (оба производятся Takara Bio Inc.); и затем лигировали с pTV118N (производство Takara Bio Inc.), расщепленной NcoI и BamHI, для получения плазмиды pRH1. Плазмидный вектор pINIII-ompA1 [Ghrayeb J. et al., EMBO J., 3(10), 2437-2442 (1984)] расщепляли BamHI и HincII (производство Takara Bio Inc.), собирали фрагмент ДНК размером около 0,9 т.п.н., содержащий концевую область липопротеина. Этот фрагмент смешивали и лигировали с вышеупомянутой плазмидой pRH1, которую расщепляли BamHI и HincII, с получением плазмиды pRH1-T, содержащей lac-промотор, фрагмент ДНК, кодирующий гепарин связывающий полипептид и концевую область липопротеина, в указанном порядке. Взаимодействие для PCR осуществляли, используя праймер Cys-А с нуклеотидной последовательностью, показанной в SEQ ID NO: 22 в списке последовательностей, и праймер Cys-S с нуклеотидной последовательностью, показанной в SEQ ID NO: 23 в списке последовательностей с этой плазмидой pRH1-T в качестве образца. После этого, собранный амплифицированный фрагмент ДНК расщепляли NotI (производство Takara Bio Inc.), и фрагмент ДНК затем лигировался сам на себя. Циклическую ДНК, полученную таким образом, расщепляли SpeI и ScaI (производство Takara Bio Inc.) с получением фрагмента ДНК размеров 2,3 т.п.н., и полученный фрагмент смешивали и лигировали с фрагментов ДНК размером 2,5 т.п.н., полуенным при расщеплении плазмиды pRH1-T SpeI и ScaI (производство Takara Bio Inc.), с получением плазмиды pRH-Cys. Плазмида кодирует полипептид H-275-Cys, в котором в Nконцевую часть вышеупомянутого Н-271 были добавлены четыре аминокислоты Met-Ala-Ala-Ser, а в Сконец Н-271 был добавлен дополнительный Cys. Полипептид H-275-Cys получали следующим способом. Escherichia coli HB101 трансформировали вышеупомянутой плазмидой pRH-Cys (Escherichia coli HB101/pRH-Cys), культивировали в течение ночи при 37°С в 120 мл среды LB. Клетки, собранные из клеточной культуры, суспендировали в 40 мл буфере для лизиса (50 мМ Tris-HCl, 1 мМ EDTA, 150 мМ NaCl, 1 мМ DTT, 1 мМ PMSF, рН 7,5) и суспензию подвергали обработке ультрафиолетом для разрушения клеток. Супернатант, полученный центрифугированием, помещали на колонку HiTrap-гепарин (производство Pharmacia), уравновешенную буфером для очистки (50 мМ Tris-HCl, рН 7,5). Неадсорбированную на колоке фракцию промывали тем же буфером и затем проводили элюирование буфером для очистки, содержащим концентрационный градиент 0-1 М NaCl. Элюат анализировали с помощью электрофореза на SDS-полиакриламидном геле, и фракции, соответствующие молекулярной массе H-275-Cys, собирали, получая очищенный препарат H-275-Cys. Пример 1. Коэффициент CD8-положительных клеток в CTL-клетках. (1) Выделение и хранение клеток РВМС. У здоровых индивидуальных доноров собирали компонент крови, содержащий HLA-A2,1, полученный на основании имеющейся информации. Собранный компонент крови 2-кратно разбавляли PBS(-), помещали на Ficoll-paque (производство Pharmacia) и центрифугировали при 500 × g в течение 20 мин. В среднем слое пипеткой собирали мононуклеарные клетки периферической крови (РВМС) и промывали. Собранные РВМС суспенидровали в растворе для хранения, содержащем 90% FBS (производство Bio Whittaker)/10% DMSO (производство SIGMA), и хранили в жидком азоте. В течение индукции CTL, хранящиеся РВМС быстро размораживали на водяной бане при 37°С и промывали средой RPMI 1640 (производство Bio Whittaker), содержащей 10 мкг/мл Dnase (производство Calbiochem). После этого с помощью метода окрашивания трипановым синим подсчитывали количество живых клеток, и клетки использовали в каждом эксперименте. (2) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа осуществляли, частично изменяя способ Bednarek et al. [J. Immunology, 147(12), 4047-4053 (1991)]. Конкретно, РВМС, полученные в пункте (1) примера 2, суспенировали в среде RPMI 1640 (производство Bio Whittaker), содержащей 5% сыворотки человека АВ-типа, 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия, 2 мМ L-глутамина (вышеуказанные вещества были произведены Bio Whittaker), 10 мМ HEPES (производство Nakalai tesque), 1% стрептомицина-пенициллина (производство Gibco BRL) (называемые здесь просто «5HRPMI») так, чтобы концентрация составляла от 1 до 4 × 106 клеток/мл. После этого суспензию помещали в 24-луночный планшет для культуры клеток (производство Falcon) в объеме 1 мл/лунку, и клетки инкубировали во влажном инкубаторе с 5% CO2 при 37°С в течение 1,5 ч для отделения моноцитов, адгезированных на пластике. После этого неадгезированные клетки собирали, используя среду RPMI 1640, и хранили на льду как прореагировавшие клетки. Для выделения моноцитов добавляли 0,5 мл каждого 5HRPMI, содержащего в качестве антигена пептида 5 мкг/мл эпитопа пептида, полученного из белка вируса гриппа (А2,1связывающий пептид получали из белка матрикса, последовательность которого показана в SEQ ID NO: - 17 - 010434 24 в списке последовательностей), и 1 мгк/мл микроглобулина β2 (производство Scrips). Смесь инкубировали при комнатной температуре в течение 2 ч и затем клетки облучали рентгеновскими лучами (5500R), с получением антигенпредставляющих клеток. Раствор пептида удаляли отсасыванием из каждой лунки, и лунки промывали средой RPMI 1640. После этого прореагировавшие клетки, которые до этого хранили на льду, аспирировали в 5HRPMI, так, чтобы концентрация составляла от 0,5 до 2 × 106 клеток/мл, и суспензию добавляли к антигенпредставляющим клеткам в количестве 1 мл на лунку. В это время каждый фрагмент фибронектина (здесь называемый «FNfr»), описанный в получении в примере 1, добавляли так, чтобы конечная концентрация составила 10 мкг/мл. Группу без добавления FNfr определяли как контроль. Планшет культивировали при 37°С в присутствии 5% CD2. На второй день после инициации культуры в каждую лунку добавляли по 1 мл 5HRPMI, содержащего 60 Ед/мл IL-2 (производство Shionogi & Co., Ltd.) и 10 μg/мл FNfr (контроль содержал только IL-2). Также на пятый день удаляли половину супернатанта культуры и добавляли по 1 мл каждой среды, содержащей IL-2 и FNfr (контроль содержал только IL-2), таким же образом, как указано выше. На седьмой день антигенпредставляющие клетки получали тем же способом, что и описанный выше, и затем прореагировавшие клетки, которые культивировали в течение одной недели, суспендировали в 5HRPMI, так, чтобы концентрация составила от 0,5 до 2 × 106 клеток/мл. К антигенпредставляющим клеткам, полученным в количестве 1 мл/лунку, добавляли суспензию для повторной стимуляции. Вместе с суспензией к ним добавляли FNfr, так, чтобы окончательная концентрация составила 10 мкг/мл (добавление в контроль не осуществляли). На седьмой день после повторной стимуляции к каждой лунке добавляли 1 мл 5HRPMI, содержащего 60 Ед/мл IL-2 и 10 мкг/мл FNfr (контроль содержал только IL-2). Также на пятый день половину супернатанта культуры удаляли и добавляли по 1 мл каждой среды, содержащей те же компоненты, как и перед удалением. Культуру культивировали еще два дня, таким образом, индуцируя CTL. (3) Определение цитотоксической активности CTL Цитотоксическую активность CTL, полученных в пункте (2) примера 1, на четырнадцатый день после первичной индукции оценивали способом определения цитотоксической активности, используя кальцеин-АМ [R. Lichtenfels et al., J. Immunological Methods, 172(2), 227-239 (1994)]. В-клетки, трансформированные EBV и содержащие HLA-A2,1 (название клеток: 221А2.1), которые культивировали в течение ночи вместе с этитопом пептида или в отсутствии эпитопа пептида, суспендировали в среде RPKI 1640, содержащей 5% FBS (производство Bio Whittaker) так, чтобы концентрация составила 1 × 106 клеток/мл. После этого к суспензии добавляли кальцеин-АМ (производство Dotite), так, чтобы окончательная концентрация составила 25 мкМ, и клетки культивировали при 37°С в течение 1 ч. Клетки промывали средой, не содержащей кальцеин-АМ, и затем смешивали с K562-клетками (АТСС CCL-243) в количестве 20 больше, чем клеток, с получением клетокмишеней, меченных кальцеином. K562-клетки использовали для исключения неспецифической цитотоксической активности NK-клеток, находящихся в смеси с прореагировавшими клетками. CTL памяти, полученные в пункте (2) примера 1, поэтапно разбавляли 5HRPMI так, чтобы концентрация составляла от 1 × 105 до 9 × 106 клеток/мл, как эффекторные клетки. После этого каждое разведение переносили в каждую лунку 96-луночного планшета для культуры клеток в количестве 100 мкл/лунку. В лунки добавляли клетки-мишени, меченные кальцеином, с получением коцентрации 1 х 105 клеток/мл в количестве 100 мкл/лунку в каждой. Планшет, содержащий вышеуказанную клеточную суспензию, центрифугировали при 400 × g в течение 1 мин, и затем инкубировали во влажном инкубаторе с CO2 при 37°С в течение 4 ч. Через 4 ч из каждой лунки отбирали 100 мкл супернатанта культуры, и количество высвобожденного кальцеина (интенсивность флуоресценции) в супернатант культуры определяли, используя флуоресцентный счетчик для планшетов (485 нм/538 нм). Цитотоксическую активность CTL подсчитывали с помощью следующего равенства 1: Равенство 1. Цитотоксическая активность (%) = [(найденное значение в каждой лунке - минимальное высвобожденное количество)/(максимальное высвобожденное количество - минимальное высвобожденное количество)] × 100. В вышеуказанном равенстве минимальное высвобожденное количество представляет собой количество высвобожденного кальцеина в лунке, содержащей только клетки-мишени и K562 клетки, что показывает количество естественно освобожденного кальцеина из клеток-мишеней. Кроме того, максимальное высвобожденное количество представляет собой количество высвобожденного кальцеина при полном лизисе клеток при добавлении к клеткам-мишеням 0,1% поверхностно-активного вещества Triton X100 (производство Nakalai tesque). В результате цитотоксическая активность индуцировалась сразу после индукции, но была значительная разница между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (4) Определение относительного содержания CD8-положительных клеток в клеточной популяции CTL. CTL, которые были получены в пункте (2) примера 1, в количестве 2 × 105 клеток, фиксировали PBS (производство Nissui), содержащим 1% параформальдегида (производство Nakalai tesque), и затем промывали PBS. Зафиксированные клетки суспендировали в 100 мкл PBS, содержащего 1% BSA (производство SIGMA), и добавляли IgG1 мыши, меченный FITC или мышиное антитело против человеческого - 18 - 010434 CD8, меченное FITC (оба произведены DAKO), а затем смесь инкубировали на льду в течение 30 мин. После инкубации клетки промывали PBS и снова суспендировали в PBS, содержащем 1% параформальдегида. Клетки подвергали проточной цитометрии, используя FACS Vantage (производство Becton Dickinson), и определяли относительное содержание CD8-положительных клеток. Результаты показаны на табл. 1. Таблица 1 Как показано в табл. 1, в группе с добавлением различных фрагментов фибронектина в процессе индукции CTL процент CD8-положительных клеток на четырнадцатый день после первичной индукции CTL был высоким по сравнению со значением в контроле без добавления этих фрагментов фибронектина. Другими словами, было определено, что CTL могут быть индуцированы с большей пролиферативной активностью CD8-положительных клеток в присутствии фрагмента фибронектина. Пример 2. Индукция экспрессии рецепторов интерлейкина-2. (1) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа проводили тем же способом, описанным в пункте (2) примера 1, используя РВМС, которые выделяли и хранили так же, как описано в пункте (1) примера 1. Цитотоксическая активность CTL на четырнадцатый день после первичной индукции оценивали тем же способом, описанным в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (2) Определение процента экспрессии рецепторов интерлейкина -2 в CTL. Процент экспрессии рецепторов интерлейкина-2 (IL-2R) в CTL, полученных в пункте (1) примера 2 на четырнадцатый день после первичной индукции, определяли в соответствии со способом, описанным в пункте (4) примера 1. Здесь, в этом способе, мышиное антитело против человеческого CD8, меченное FITC, меняли на мышиное антитело против человеческого IL-2R(CD25), меченное FITC (производство DAKO). Результаты представлены в табл. 2. Таблица 2 Как показано в табл. 2, во всех случаях индукции CTL путем добавления различных фрагментов фибронектина в клетках популяции наблюдалось увеличение процента экспрессии IL-2R. Другими сло- 19 - 010434 вами, было определено, что CTL могут быть индуцированы с большим уровнем экспрессии IL-2R при проведении индукции в присутствии фрагмента фибронектина. Пример 3. Экспансия CTL. (1) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа проводили тем же способом, описанным в пункте (2) примера 1, используя РВМС, которые выделяли и хранили так же, как описано в пункте (1) примера 1. Цитотоксическая активность CTL на четырнадцатый день после первичной индукции оценивали тем же способом, описанным в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (2) Экспансия CTL. CTL, полученные в пункте (1) примера 3, промывали 5HRPMI и затем суспендировали с получением суспензии с концентрацией 3 × 104 клеток/мл. В это время аллогенные РВМС, не содержание HLAА2,1, которые собирали тем же способом, описанным в пункте (1) примера 1, облучали рентгеновскими лучами (3300R), и клетки промывали средой и суспендировали с получением суспензии с концентрацией от 2 до 5 × 106 клеток/мл. Эти CTL (3 × 104 клетки) и аллогенные РВМС (от 4 до 10 × 106 клеток) суспендировали в 10 мл 5HRPMI или среды RPMI 1640 (производство Bio Whittaker), содержащей 10% Hyclone FBS, 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия, 2 мМ L-глутамина (все произведены Bio Whittaker), 10 мМ HEPES (производство nakalai tesque) и 1% стрептомицин-пенициллина (производство Gibco BRL) (здесь называемой просто 10HycloneRPMI) и затем добавляли анти-CD3-антитело (производство Janssen-Kyowa) так, чтобы конечная концентрация составляла 50 нг/мл. Смесь помещали в колбу объемом 12,5 см2 (производство Falcon), и клетки культивировали во влажном инкубаторе с CO2 при 37°С в течение 14 дней. В процессе культивирования добавляли FNfr, так, чтобы конечная концентрация составляла 10 мкг/мл, что было аналогично добавлению в процессе индукции CTL. Также к контрольной группе, где индукцию проводили без добавления FNfr, FNfr не добавляли. При этом культивировании для стимуляции совсем не добавляли пептид. На первый день после начала экспансии добавляли IL-2, так, чтобы конечная концентрация составляла 120 Ед/мл. Кроме того, на четвертый день после инициализации культуры и в последующие дни через каждые 2-3 дня проводили процедуру удаления половины супернатанта культуры и затем добавления 5 мл 5HRPMI, содержащей 60 Ед/мл IL-2 или 10HycloneRPMI, в каждую колбу. В процессе культивирования FNfr в той же концентрации добавляли к среде в группе, где был добавлен FNfr. На четырнадцатый день после начала экспансии цитотоксическую активность CTL определяли тем же способом, описанным в пункте (3) примера 1. Степень, при которой сохранялась цитотоксическая активность перед экспансией, рассчитывали как «поддержание цитотоксической активности (%)». «Поддержание цитотоксической активности (%)» рассчитывали в соответствии со следующим равенством 2. Равенство 2. Поддержание цитотоксической активности (%) = [цитотоксическая активность (%) после экспансии/цитотоксическая активность (%) перед экспансией] × 100. Полученные результаты представлены в табл. 3. В табл. отношение Е/Т означает отношение числа эффекторных клеток (Е) к числу клеток-мишеней (Т). - 20 - 010434 Таблица 3 Как показано в табл. 3, специфическая высокоэффективная цитотоксическая активность CTL в группе с добавлением различных фрагментов фибронектина во время индукции и экспансии, поддерживалась даже после экспансии в течение 14 дней по сравнению с активностью в контроле без добавления фрагмента фибронектина. Другими словами, было определено, что CTL могут экспансироваться в состоянии, при котором в течение долгого периода времени сохраняется высокая цитотоксическая активность при проведении индукция и экспансии в присутствии фрагмента фибронектина. Пример 4. Экспрессия IL-2R в клеточной популяции после экспансии CTL. (1) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа проводили тем же способом, описанным в пункте (2) примера 1, используя РВМС, которые выделяли и хранили так же, как описано в пункте (1) примера 1. Цитотоксическая активность CTL на четырнадцатый день после первичной индукции оценивали тем же способом, описанным в пункт (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (2) Определение показателя экспрессии рецепторов интерлейкина -2 в экспансированных CTL. CTL, полученные в пункте (1) примера 4, экспансировали тем же способом, описанным в пункте (2) примера 3. Процент клеток с экспрессией IL-2R определяли для CTL после экспансии, полученных тем же способом, что и в пункте (2) примера 2. Результаты представлены в табл. 4. - 21 - 010434 Таблица 4 Как показано в табл. 4, во всех группах с добавлением различных фрагментов фибронектина во время индукции и экспансии CTL наблюдалось увеличение в клеточной популяции процента клеток, экспрессирующих IL-2R. Другими словами, было определено, что CTL могут быть экспансированы с повышенным уровнем экспрессии IL-2R при проведении индукции и экспансии CTL в присутствии фрагмента фибронектина. Пример 5. Индукция и экспансия CTL в присутствии фибронектина. (1) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа проводили тем же способом, описанным в пункте (2) примера 1, используя РВМС, которые выделяли и хранили так же, как описано в пункте (1) примера 1. При индукции фибронектина (производство Calbiochem), в планшет добавляли FNfr, так, чтобы конечная концентрация составляла 10 мкг/мл (в контроле добавление не проводили). Цитотоксическую активность CTL определяли на четырнадцатый день после начала индукции тем же способом, описанным в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении фибронектина в процессе индукции или в его отсутствие. (2) Определение процента экспрессии рецепторов интерлейкина -2 в CTL. Процент клеток, экспрессирующих IL-2R, определяли на CTL, полученных в пункте (1) примера 5 тем же способом, описанным в пункте (2) примера 2. Результаты показаны в табл. 5. Таблица 5 Как показано в табл. 5, в CTL, индуцированных в присутствии фибронектина, наблюдалось увеличение уровня экспрессии IL-2R в клетках популяции. Другими словами, было определено, что CTL могут быть индуцированы с повышенным уровнем экспрессии IL-2R при проведении индукции CTL в присутствии фрагмента фибронектина. (3) Экспансия CTL. CTL, полученные в пункте (1) примера 5, экспансировали тем же способом, описанным в пункте (2) примера 3. Во время экспансии к группе, в которую во время индукции был добавлен фибронектин, добавляли фибронектин (производство Calbiochem), так, чтобы окончательная концентрация составляла 10 мкг/мл (добавление в контроль не осуществлялось). Цитотоксическую активность полученных CTL определяли тем же способом, описанным в пункте (3) примера 1, и степень поддержания цитотоксической активности до экспансии подсчитывали как «поддержание цитотоксической активности (%)». Полученные результаты представлены в табл. 6. - 22 - 010434 Таблица 6 Как показано в табл. 6, группа, в которой индукция и экспансия CTL проводилась в присутствии фибронектина, сохранялась высокая цитотоксическая активность. С другой стороны, цитотоксическая активность в контроле, без добавления фибронектина во время индукции и экспансии CTL, была несомненно ниже. Другими словами, было определено, что CTL могут экспансироваться в состоянии, при котором в течение долгого времени периода сохраняется специфическая цитотоксическая активность, при добавлении фибронектина во время индукции и экспансии CTL. Пример 6. Экспансия CTL в присутствии иммобилизованного фрагмента фибронектина (FN). (1) Иммобилизация фрагмента FN. Фрагмент фибронектина иммобилизовали на приспособлении (сосуде) для культивирования, используя нижеследующий эксперимент. Конкретно, в каждую лунку 24-луночного планшета для культуры клеток и в 12,5 см2 колбу добавляли PBS, содержащий различные фрагменты фибронектина (окончательная концентрация: 10 мкг/мл) в количестве от 1 до 2 мл. Планшет и колбу инкубировали при комнатной температуре в течение 5 ч, и затем хранили при 4°С перед использованием. Кроме того, перед использованием планшет и колбу дважды промывали PBS. (2) Индукция CTL памяти против вируса гриппа. Индукция CTL памяти против вируса гриппа осуществляли в соответствии со способом, описанным в пункте (2) примера 1, используя выделенные РВМС, и хранили в соответствии со способом, описанным в пункте (1) примера 1. Во время индукции в качестве приспособления использовали планшет с иммобилизованным FNfr (для контроля использовали планшет без иммобилизованного FNfr). Цитотоксическую активность CTL после индукции оценивали тем же способом, описанным в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью в присутствии или в отсутствие иммобилизованного на планшете FNfr в процессе индукции. (3) Экспансия CTL. CTL, полученные в пункте (2) примера 6, экспансировали тем же способом, описанным в пункте (2) примера 3. Во время экспансии в качестве приспособления для культуры использовали колбы с различными иммобилизованными на них FNfr (для контроля использовали планшет без иммобилизованного FNfr). Кроме того, в качестве среды использовали среду 10HycloneRPMI. Степень, в которой сохранялась цитотоксическая активность CTL, экспансированных таким образом, по сравнению с активностью до экспансии оценивали как «поддержание цитотоксической активности (%)». Полученные результаты представлены в табл. 7. Таблица 7 - 23 - 010434 Как показано в табл. 7, в группе, в которой во время индукции и экспансии CTL использовалось приспособление для клеточной культуры (планшет, колба) с иммобилизованным фрагментом фибронектина, CTL сохраняли специфическую высокую цитотоксическую активность даже после экспансии. С другой стороны, в контроле, в котором во время индукции и экспансии CTL использовалось приспособление для клеточной культуры (планшет, колба) без иммобилизованного фрагмента фибронектина, цитотоксическая активность была заметно ниже. Другими словами, было определено, что CTL могут экспансироваться в состоянии, при котором в течение долгого периода сохраняется высокая цитотоксическая активность по сравнению со случаем, когда фрагмент растворяли в среде, используя иммобилизованный фрагмент фибронектина. Пример 7. Процент содержания CD8-положительных клеток в клеточной популяции после экспансии CTL. (1) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа проводили тем же способом, описанным в пункте (2) примера 1, используя РВМС, которые выделяли и хранили так же, как описано в пункте (1) примера 1. Цитотоксическую активность CTL на четырнадцатый день после первичной индукции оценивали тем же способом, описанным в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (2) Определение процента содержания CD8-положительных в экспансированных CTL. CTL, полученные в пункте (1) примера 7, экспансировали тем же способом, описанным в пункте (2) примера 3. Процент содержания CD8-положительных клеток определяли в CTL после экспансии, полученных тем же способом, описанным в пункте (4) примера 1. Результаты представлены в табл. 8. Таблица 8 Как показано в табл. 8, во всех группах с добавлением различных фрагментов фибронектина во время индукции и экспансии CTL наблюдали увеличение процента содержания CD8-положительных клеток в клеточной популяции после экспансии. Другими словами, было определено, что CTL могут быть экспансированы со значительной пролиферацией CD8-положительных клеток при проведении индукции и экспансии CTL в присутствии фрагмента фибронектина. Пример 8. Индукция экспрессии рецепторов интерлейкина-2 в CTL, индуцированных в присутствии иммобилизоавнных фрагментов фибронектина. (1) Иммобилизация фрагмента FN. Фрагмент фибронектина иммобилизировали на приспособлении для культуры клеток (сосуд) тем же способом, как описано в пункте (1) примера 6. (2) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа осуществляли в соответствии со способом, описанным в пункте (2) примера 1, используя РВМС, которые выделяли и хранили в соответствии со способом, - 24 - 010434 описанным в пункте (1) примера 1. Во время индукции использовали планшет с иммобилизированными FNfr, как в пункте (1) примера 8, в качестве приспособления для культуры клеток (для контроля использовали планшет без иммоблизированного FNfr). Цитотоксическую активность CTL после индукции оценивали тем же способом, как описано в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью в присутствии или в отсутствие иммоблизированного FNfr на планшете в процессе индукции. (3) Экспансия CTL. CTL, полученные в пункте (2) примера 8, экспансировали тем же способом, как описано в пункте (2) примера 3. Во время экспансии, в качестве приспособления для культуры клеток использовали колбу с иммобилизированными на ней FNfr, полученную в пункте (1) примера 8, (для контроля использовали планшет без иммоблизированного FNfr). Кроме того, в качестве среды использовали 10HycloneRPMI. Процент клеток, экспрессирующих IL-2R, определяли тем же способом, как описано в пункте (2) примера 2, в CTL, полученных до и после экспансии. Полученные результаты представлены в табл. 9. Таблица 9 Как показано в табл. 9, в группе CTL, в которой во время индукции и экспансии CTL использовали приспособление для культуры клеток (планшет, колба) с иммобилизированным фрагментом фибронектина, наблюдали увеличение процента клеток, экспрессирующих IL-2R, по сравнению с контрольной группой как до, так и после экспансии. Другими словами, было определено, что CTL могут быть экспансированы с поддержанием высокого уровня экспрессии IL-2R по сравнению с уровнем экспрессии в среде с растворенным фрагментом, при использовании иммобилизированного фрагмента фибронектина. Пример 9. Индукция клеток, экспрессирующих на поверхности CD8-клеток рецептор интерлейкина-2. (1) Индукция CTL памяти против вируса гриппа. Индукцию CTL памяти против вируса гриппа осуществляли тем же способом, как описано в пункте (2) примера 1, используя РВМС, которые выделяли и хранили тем же способом, как описано в пункте (1) примера 1. Цитотоксическую активность CTL на четырнадцатый день после инициации индукции оценивали тем же способом, как описано в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью в присутсвии или в отсутствие добавления FNfr в процессе индукции. (2) Определение процента CTL, экспрессирующих рецепторы интерлейкин-2. Процент экспрессии рецептора интерлейкина-2 (IL-2R) в CTL (главным образом, на поверхности CD8-клеток), полученных в пункте (1) примера 9, на четырнадцатый день после инициации индукции определяли в соответствии со способом, описанным в пункте (4) примера 1. Здесь, в этом способе, в качестве первичного антитела использовали мышиное антитело против человеческого CD8, меченное FITC, а в качестве вторичного антитела использовали мышиное антитело против человеческого IL2R(CD25), меченное РЕ (производство DAKO). Результаты показаны в табл. 10. - 25 - 010434 Таблица 10 Как показано в табл. 10, в CTL, индуцированных путем добавления различных фрагментов фибронектина, наблюдалось увеличение экспрессии IL-2R в CD8-положительной клеточной популяции. Другими словами, было определено, что проводя индукцию в присутствии фрагмента фибронектина, можно индуцировать CTL с повышенным уровнем экспрессии IL-2R на поверхности CD8-клеток. Пример 10. Относительное содержание CD8-положительных клеток в клеточной популяции до и после экспансии CTL (сравнение фибронектина с фрагментами фибронектина). (1) Индукция CTL клеток против вируса гриппа. Индукцию CTL-клеток против вируса гриппа осуществляли тем же способом, как описано в пункте (2) примера 1, используя РВМС, которые выделяли и хранили тем же способом, как описано в пункте (1) примера 1. Цитотоксическую активность CTL на четырнадцатый день после начала индукции оценивали тем же способом, как описано в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (2) Определение относительного содержания CD8-положительных клеток в экспансированных CTL. CTL, полученные в пункте (1) примера 10, экспансировали тем же способом, как описано в пункте (2) примера 3. Относительное содержание CD8-положительных клеток определяли перед и после экспансии CTL, полученных тем же способом, как описано в пункте (4) примера 1. Результаты представлены в табл. 11. Таблица 11 Как показано в табл. 11, во всех группах с добавлением различных фрагментов фибронектина во время индукции и экспансии CTL наблюдали увеличение относительного содержания CD8положительных клеток в клеточной популяции до экспансии и после экспансии по сравнению с содержанием в контрольной группе. Другими словами, было определено, что CTL могут быть полезно экспансированы со значительной пролиферацией CD8-положительных клеток, как перед экспансией, так и после экспансии, при проведении процессов - индукции и экспансии - CTL в присутствии фрагментов фибронектина по сравнению с присутствием фибронектина per se. Пример 11. Индукция экспрессии IL-2R в клеточной популяции перед и после экспансии CTL (сравнение фибронектина и фрагментов фибронектина). (1) Индукция CTL клеток против вируса гриппа. Индукция CTL клеток против вируса гриппа осуществляли тем же способом, как описано в пункте (2) примера 1, используя РВМС, которые выделяли и хранили тем же способом, как описано в пункте (1) примера 1. Цитотоксическую активность CTL на четырнадцатый день после начала индукции оценивали тем же способом, как описано в пункте (3) примера 1. Цитотоксическую активность CTL на четырнадцатый день после начала индукции оценивали тем же способом, описанным в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении FNfr в процессе индукции или в его отсутствие. (2) Определение относительного содержания клеток, экспрессирующих IL-2R в экспансированных CTL. CTL, полученные в пункте (1) примера 11, экспансировали тем же способом, как описано в пункте (2) примера 3. Относительное содержание клеток, экспрессирующих IL-2R, в CTL определяли до и после - 26 - 010434 экспансии тем же способом, описанным в пункте (2) примера 2. Результаты представлены в табл. 12. Таблица 12 Как показано в табл. 12, во всех группах с добавлением фрагментов фибронектина во время индукции и экспансии CTL, наблюдали увеличение относительного содержания клеток, экспрессирующих IL2R, в клеточной популяции перед экспансией и после экспансии по сравнению с содержанием в контрольной группе. Увеличение соотношения было очень высоким по сравнению с группой, в которую добавляли фибронектин. Другими словами, было определено, что CTL могут быть полезно экспансированы со значительной пролиферацией клеток, экспрессирующих IL-2R, как перед экспансией, так и после экспансии, при проведении индукции и экспансии CTL в присутствии фрагмента фибронектина, по сравнению с фибронектином per se. Пример 12. Экспансия CTL (сравнение фибронектина с фрагментами фибронектина). (1) Индукция CTL клеток против вируса гриппа. Индукция CTL клеток против вируса гриппа осуществляли тем же способом, как описано в пункте (2) примера 1, используя РВМС, которые выделяли и хранили тем же способом, как описано в пункте (1) примера 1. Цитотоксическую активность CTL на четырнадцатый день после начала индукции оценивали тем же способом, как описано в пункте (3) примера 1. В результате не было получено значительных различий между цитотоксической активностью при добавлении фобронектина и FNfr в процессе индукции или в его отсутствие. (2) Экспансия CTL. CTL, полученные в пункте (2) примера 12, экспансировали тем же способом, как описано в пункте (2) примера 3. Кроме того, в качестве среды использовали 10HycloneRPMI. Уровень, на котором поддерживалась цитотоксическая активность, экспансированных таким образом CTL по сравнению с уровнем до экспансии, оценивали как «поддержание цитотоксической активности (%)». Полученные результаты представлены в табл. 13. Таблица 13 Как показано в табл. 13, в группе CTL с добавлением фрагмента фибронектина во время индукции и экспансии, поддерживалась специфическая, высокая цитотоксическая активность даже после экспансии через 14 дней по сравнению с контрольной группой без добавления фрагментов фибронектина. Эта активность была также очень высокой по сравнению с группой с добавлением фибронектина. Другими словами, было определено, что CTL могут быть полезно экспансированы в состоянии, когда в течение длительного времени поддерживается высокая цитотоксическая активность, если проводить индукцию и экспансию в присутствии фрагмента фибронектина по сравнению с присутствием фибронектина per se. Пример 13. Определение кратности экспансии в культуре клеток LAK (лимфокин-активированные клетки-киллеры). (1) Иммобилизация антител против CD3 человека и FN или фрагментов FN. Антитела против CD3 человека и фибронектин или фрагменты FN иммобилизировали на приспособлении для культуры клеток (сосуд), используя нижеследующий эксперимент. Конкретно, 1 мл (в случае 24-луночного планшета) или 2 мл (в случае колбы с объемом 12,5 см2) каждого PBS, содержащего - 27 - 010434 антитела против CD3 человека (производство Janssen-Kyowa) (конечная концентрация 5 мкг/мл), добавляли в 24-луночный планшет для культуры или колбу с объемом 12,5 см2 (производство Falcon). Во время добавления к группе с добавлением фибронектина или фрагментов FN добавляли фибронектин или каждый фрагмент фибронектина (FNfr), перечисленные в получании примера 1, так, чтобы конечная концентрация составила 10 мкг/мл (в случае 24-луночного планшета) или 25 мкг/мл (в случае колбы с объемом 12,5 см2). В качестве контроля также использовалась группа без добавления фибронектина и FNfr. После этого, приспособления для культуры клеток инкубировали при комнатной температуре в течение 5 ч, перед использованием приспособления для культуры клеток хранили при 4°С. Сразу перед использованием, из этих приспособлений для культуры клеток удаляли отсасыванием PBS, содержащий антитело и FNfr, и затем каждую лунку дважды промывали PBS, и затем один раз средой XVIVO20 (производство Bio Whittaker), содержащей 5% человеческой сыворотки типа АВ (производство Bio Whittaker) и 1% стрептомицин-пенициллина (производство GIBCO BRL) (здесь называемой просто 5HXVIVO20), и приспособления для культуры клеток использовали в каждом эксперименте. (2) Индукция и культивирование LAK-клеток. РВМС, которые были получены в пункте (1) примера 1, суспендировали в 5HXVIVO20 так, чтобы концентрация составляла 0,5 до 1 × 106 клеток/мл, и затем суспензию помещали в планшет с иммобилизированными антителами против CD3 человека, или в планшете с иммобилизированными антетелами против CD3 и фибронектином или FNfr, полученную в пункте (1) примера 13, в объеме 1 мл/лунка, и к ней добавляли IL-2 (производство Shionogi & Co., Ltd.) так, чтобы конечная концентрация составляла 1000 Ед/мл. Эти планшеты культивировали при 37°С в 5% CO2 (нулевой день культуры). На второй и третий день после начала культурирования, добавляли 5HXVIVO20, содержащий 1000 Ед/мл IL-2 в объеме 1 мл/лунка. На четвертый день после начала культивирования, культуральную среду, надлежащим образом разведенную 5HXVIVO20, переносили в свежую колбу без иммобилизированных антител, и добавляли IL-2 так, чтобы конечная концентрация составляла 500 Ед/мл. Продолжали культивирование, культурную среду должным образом разводили 5HXVIVO20 каждые 2 или 3 дня тем же способом как на пятый день после начала культурирования, и добавляли IL-2 так, чтобы конечная концентрация составляла 300-500 Ед/мл. Начиная с седьмого и заканчивая пятнадцатым днем от начала культивирования культуры, методом окрашивания трипановым синим подсчитывали число живых клеток, и подсчитывали кратность экспансии путем сравнения числа клеток в начале культивирования. Результаты представлены в табл. 14. Таблица 14 - 28 - 010434 Как показано в табл. 14, в группе, где использовались приспособления для культуры клеток с иммобилизироваными фрагментами фибронектина каждого типа, на ранней стадии индукции LAK-клеток, кратность экспансии LAK-клеток была выше, по сравнению с экспансией в контрольной группе. Кроме того, кратность экспансии группы с иммобилизированными фрагментами фибронектина каждого типа была выше, чем экспансия группы, где использовались приспособления для культуры клеток с иммобилизированным фибронектином на пятнадцатый день после начала культивирования. Следовательно, было определено, что в случае, когда экспансию проводят в течение долгого периода времени, индукция и культивирование LAK-клеток предпочтительней проводить с большей кратностью экспресисии в присутствии фрагментов фибронектина на ранней стадии индукции клеток LAK, чем в присутствии фибронектина per se. Пример 14. Определение уровня пролиферации в культуре клеток LAK. (1) Индукция и культивирование LAK-клеток. Индукцию и культивирование LAK-клеток осуществляли тем же способом, как описано в пункте (2) примера 13. Рассчитывали уровень пролиферации клеток, начиная с четвертого и заканчивая седьмым днем начала культивирования на этой стадии. Результаты представлены в табл. 15. Таблица 15 Как показано в табл. 15, в группе, в которой использовали приспособления для культуры клеток с иммобилизированными фрагментами фибронектина каждого типа, на ранней стадии индукции LAKклеток, уровень пролиферации LAK-клеток, начиная с четертого и заканчивая седьмым днем начала культивирования, была выше, по сравнению с экспансией в контрольной группе. Другими словами было определено, что LAK-клетки могут быть индуцированы и культивировали с более быстрым уровнем пролифираци в присутствии фрагментов фибронектина на ранней стадии индукции LAK-клеток. Пример 15. Определение кратности экспансии в культуре LAK-клеток (индукция и культивирование LAK-клеток из небольшого числа клеток). (1) Индукция и культивирование LAK-клеток. Индукция и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (2) примера 13. В этот период, клеточную концентрацию в начальной культуре доводили до концентрации от 2 × 105 до 1 × 106 клеток/мл (от 1 × 105 до 5 × 105 клеток/см2). На пятнадцатый день от начала культивирования, подсчитывали число живых клеток методом окрашивания трипановым синим, и подсчитывали кратность экспансии по сравнению с числом клеток в начале культивирования. Результаты представлены в табл. 16. Таблица 16 - 29 - 010434 Как показано в табл. 16, в группе, в которой использовали приспособления для культуры клеток с иммобилизированным фрагментов фибронектина каждого типа во время индукция LAK-клеток, экспансию с высокой кратностью наблюдали на пятнадцатый день от начала культивирования, независимо от количества клеток в начале культивирования. Напротив, в контрольной группе, кратность экспансии на пятнадцатый день от начала культивирования была ниже, если в начале культивирования было мало клеток. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высокой кратностью экспансии в присутствии фрагмента фибронектина во время индукции LAK-клеток с низким числом клеток, независимо от числа клеток в начале культивирование. Пример 16. Определение кратности экспансии в культуре LAK-клеток. (Индукция и культивирование LAK-клеток с низким количеством клеток/культивирование без процедуры разведения). (1) Индукция и культивирование LAK-клеток. РВМС, которые были получены в пункте (1) примера 1, суспендировали в 5HXVIVO20 так, чтобы концентрация составляла 1 × 104 клеток/мл, и затем суспензию помещали в планшет с иммобилизированными антителами против CD3 человека, или в 6-луночный планшет с иммобилизированными антетелами против CD3 и фибронектином или FNfr, полученную в пункте (1) примера 13, в объеме 1 мл/лунка. В лунки добавляли четыре миллилитра 5HXVIVO20 (1 × 103 клеток/см2) и IL-2 (производство Shionogi & Co., Ltd.) так, чтобы конечная концентрация составляла 500 Ед/мл. Эти планшеты культивировали при 37°С в 5% CO2 (нулевой день культуры). На второй, третий и четвертый день после начала культурирования, добавляли IL-2 так, чтобы конечная концентрация составила 500 Ед/мл. Продолжали культивирование, и начиная с седьмого и заканчивая пятнадцатым днем от начала культивирования культуры каждые 2 или 3 дня добавляли IL-2 так, чтобы конечная концентрация составляла 500 Ед/мл. Во время добавления процедуры разведения культуральной среды не осуществляли. На пятнадцатый день от начала культивирования число живых клеток подсчитывали методом окрашивания трипановым синим, и подсчитывали кратность экспансии путем сравнения с числом клеток в начале культивирования. Результаты представлены в табл. 17. Таблица 17 Как показано в табл. 17, в группе, в которой использовали приспособления для культуры клеток с иммобилизированным фрагментов фибронектина каждого типа во время индукция LAK-клеток с низким числом клеток, экспансию с высокой кратностью наблюдали на пятнадцатый день после начала культивирования без необходимости разведения клеток во время индукции. Также, кратность экспансии была высока по сравнению с группой, в которой использовали приспособления для культуры клеток с иммобилизированным фибронектином. В противоположность этому, в контрольной группе клетки практически не пролифериловали даже на пятнадцатый день после начала культивирования. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высокой кратностью экспансии в присутствии фибронектина или фрагмента фибронектина, предпочтительно, фрагмента фибронектина, во время индукция LAK-клеток с низким числом клеток, без необходимости проведения разведения. Пример 17. Индукция экспрессии IL-2R в LAK-клетках. (1) Индукция и культивирование LAK-клеток. Индукцию и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (2) примера 13. (2) Определение уровня экспрессии IL-2R в LAK-клетках. Уровень экспрессии IL-2R в LAK-клетках, которые подвергали индукции и культивированию в пункте (1) примера 17, определяли в соответствии со способом, описанным в пункте (2) примера 2. Результаты представлены в табл. 18. В табл. относительное содержание клеток, экспрессирующих IL-2R (%), показано как уровень экспрессии IL-2R (%). - 30 - 010434 Таблица 18 Как показано в табл. 18, в группе, в которой использовали приспособления для культуры клеток с иммобилизированным фрагментов фибронектина каждого типа на ранией стадии индукции LAK-клеток, во время культивирования на поврехности LAK-клеток наблюдали высокий уровень экспрессии IL-2R. Также этот уровень экспрессии IL-2R был высок даже по сравнению с группой, в которй использовали приспособления для культуры клеток с иммобилизированным фибронектином. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с полезным уровнем экспрессии IL-2R, выше, чем в присутствии фибронектина per se, в присутствии фрагментов фибронектина во время индукция LAK-клеток. Пример 18. Индукция экспрессии IL-2R в LAK-клетках. (1) Индукция и культивирование LAK-клеток. Индукцию и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (2) примера 13. (2) Определение уровня экспрессии IL-2R в LAK-клетках. Уровень экспрессии IL-2R на поверхности CD4-клеток и CD8 LAK-клеток, которые подвергали индукции и культивированию в пункте (1) примера 17, определяли на семнадцатый день в соответствии со способом, описанным в пункте (2) примера 9. Здесь в этой методике в качестве первичных антител использовали мышиные антитела против CD4 человека, меченные FITC, и в качестве вторичных антител использовали мышиные антитела против IL-2R(CD25) человека, меченные РЕ. Результаты представлены в табл. 19. Таблица 19 Как показано в табл. 19, в группе, в которой использовали приспособления для культуры клеток с иммобилизированным фрагментов фибронектина каждого типа на ранней стадии индукции LAK-клеток, во время культивирования может быть индуцирован высокий уровень экспрессии IL-2R на поверхности LAK-клеток (как на CD4-положительных, так и CD8-положительных клетках). Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высоким уровнем экспрессии IL-2R на поверхности как на CD4-положительных, так и CD8-положительных клеток в присутствии фрагмента фибронектина во время индукция LAK-клеток. Пример 19. Относительное содержание CD8-положительных клеток в клеточной популяции LAK. (1) Индукция и культивирование LAK-клеток. Индукцию и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (2) примера 13. (2) Определение относительного содержания CD8-положительной клеточной популяции в LAK- 31 - 010434 клетках. Относительное содержание CD8-положительных клеток в LAK-клетках, которые подвергали индукции и культивированию в пункте (1) примера 19, определяли на пятнадцатый день в соответствии со способом, описанным в пункте (4) примера 1. Результаты представлены в табл. 20. Таблица 20 Как показано в табл. 20, в группе, в которой использовали приспособления для культуры клеток с иммобилизированным фрагментов фибронектина каждого типа на ранней стадии индукции LAK-клеток, во время культивирования может идуцироваться высокое относительное содержание CD8положительных клеток в LAK-клетках. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высоким относительным содержанием CD8-положительных клеток в LAK-клетках в присутствии фибронектина во время индукция LAK-клеток. Пример 21. Определение кратности экспансии в культуре LAK-клеток. (2) Индукция и культивирование LAK-клеток. РВМС, которые были получены в пункте (1) примера 1, суспендировали в 5HXVIVO20 так, чтобы концентрация составляла 0,5 до 1 × 106 клеток/мл, и затем суспензию помещали в планшет с иммобилизированными антителами против CD3 человека, или в планшет с иммобилизированными антетелами против CD3 и FNfr, полученную в пункте (1) примера 13, в объеме 1 мл/лунка, и к ней добавляли IL-2 (производство Shionogi & Co., Ltd.) так, чтобы конечная концентрация составляла 1000 Ед/мл. Эти планшеты культивировали при 37°С в 5% CO2 (нулевой день культуры). На второй и третий день после начала культурирования добавляли 5HXVIVO20, содержащий 1000 Ед/мл IL-2 в объеме 1 мл/лунка. На четвертый день после начала культивирования, культуральную среду, надлежащим образом разведенную 5HXVIVO20, переносили в свежую колбу без иммобилизированных антител, и добавляли IL-2 так, чтобы конечная концентрация составляла 500 Ед/мл. На восьмой или девятый день после начала культивирования, культивированную среду, надлежащим образом разведенную 5HXVIVO20, переносили в колбу с иммобилизованными антителами против CD3 человека или в колбу с иммобилизованными антителами против CD3 человека и FNfr (при условии, что при иммобилизации использовалась концентрация антител против CD3 человека равная 0,5 мкг/мл), полученную тем же, как описано в пункте (1) примера 13, и добавляли IL-2 так, чтобы конечная концентрация составляла 500 Ед/мл. На одиннадцатый или двенадцатый день после начала культивирования культуральную среду, надлежащим образом разбавленную 5HXVIVO20, переносили в свежую колбу без иммобилизованных антител, и добавляли IL-2 так, чтобы окончательная концентрация составляла 500 Ед/мл. На пятнадцатый день от начала культивирования, подсчитывали число живых клеток методом окрашивания трипановым синим и подсчитывали кратность экспансии путем сравнения числа клеток в начале культивирования. Результаты представлены в табл. 21 и 22. В табл. «донор» обозначает доноров РВМС. Таблица 21 - 32 - 010434 Таблица 22 Как показано в табл. 21 и 22, в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали фрагменты фибронектина каждого типа и антитела против CD3, кратность экспансии LAK-клеток была высокой, по сравнению с контрольной группой. Эти уровни экспансии были гораздо выше уровня экспансии в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали антитела против CD3. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высокой кратностью экспансии при стимуляции с использованием фрагментов фибронектина и антител против CD3 человека на ранней стадии и промежуточной стадии индукции LAKклеток. Пример 21. Определение уровня пролиферации в культурах LAK-клеток. (1) Индукция и культивирование LAK-клеток. Индукцию и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (1) примера 20. Расчитывали уровень пролиферации клеток, начиная с четвертого дня по восьмой день от начала культивирования, и уровень пролиферации клеток, начиная с одиннадцатого по пятнадцатый день от начала культивирования в данных методиках. Результаты представлены в табл. 23 и 24. Таблица 23 - 33 - 010434 Таблица 24 Как показано в табл. 23 и 24, в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали фрагменты фибронектина каждого типа и антитела против CD3, уровень пролиферации LAK-клеток был выше в более поздней стадии индукции по сравнению с контролем. Эти уровни пролиферации были гораздо выше уровня пролиферации LAK-клеток в более поздней стадии индукции в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали только антитела против CD3. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высоким уровнем пролиферации при стимуляции с использованием фрагментов фибронектина и антител против CD3 человека на ранней стадии и промежуточной стадии индукции LAK-клеток. Пример 22. Индукция экспрессии IL-2R в LAK-клеткх. (1) Индукция и культивирование LAK-клеток. (1) Индукция и культивирование LAK-клеток. Индукцию и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (1) примера 20. (2) Определение уровня экспрессии IL-2R в LAK-клетках Уровень экспрессии IL-2R в LAK-клетки, которые подвергали индукции и культивированию в пункте (1) примера 22, определяли на пятнадцатый день в соответствии со способом, описанным в пункте (2) примера 2. Результаты представлены в табл. 25 и 26. В табл. относительное содержание клеток, экспрессирующих IL-2R (%) показано как уровень экспрессии IL-2R (%). Таблица 25 - 34 - 010434 Как показано в табл. 25 и 26, в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали фрагменты фибронектина каждого типа и антитела против CD3, уровень экспрессии IL-2 на поверхности LAK-клеток на пятнадцатый день после начала культивирования был высокий по сравнению с контролем. Эти уровни экспрессии IL-2 были гораздо выше уровня экспрессии IL-2 в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали только антитела против CD3. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высокой экспрессией IL-2 при стимуляции с использованием фрагментов фибронектина на ранней стадии и промежуточной стадии индукции LAK-клеток. Пример 23. Определение уровня CD8-положительных LAK-клеток. (1) Индукция и культивирование LAK-клеток. Индукция и культивирование LAK-клеток осуществляли тем же способом, описанным в пункте (1) примера 20. (2) Определение относительного содержания CD8-положительных клетко в популяции LAK-клетки. Относительное содержание CD8-положительных клеток в клеточной популяции LAK-клетки, которые индуцировали и культивировали в пункте (1) примера 23, определяли на пятнадцатый день в соответсвии со способом, описанным в пункте (4) примера 1. Результаты представлены в табл. 27. Таблица 27 Как показано в табл. 27, в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали фрагменты фибронектина каждого типа и антитела против CD3, относительное содержание CD8положительных клеток в клеточной популяции LAK-клетки была высокой на пятнадцатый день от начала культивирования, по сравнению с контролем. Это относительное соединение CD8-положительных клеток было гораздо выше содержания CD8-положительных клеток в группе, в которой использовали приспособления для культуры клеток, на которые на ранней стадии и промежуточной стадии индукции LAK-клеток неоднократно иммобилизировали антитела против CD3. Другими словами, было определено, что LAK-клетки могут быть индуцированы и культивированы с высоким относительным содержанием CD8-положительных клеток при стимуляции с использованием фрагментов фибронектина на ранней стадии и промежуточной стадии индукции LAK-клеток. Независимый текст перечня последовательностей SEQ ID NO: 1; частичный участок фибронектина, называемый III-8. SEQ ID NO: 2; частичный участок фибронектина, называемый III-9. SEQ ID NO: 3; частичный участок фибронектина, называемый III-10. SEQ ID NO: 4; частичный участок фибронектина, называемый III-12. SEQ ID NO: 5; частичный участок фибронектина, называемый III-13. SEQ ID NO: 6; частичный участок фибронектина, называемый III-14. SEQ ID NO: 7; частичный участок фибронектина, называемый CS-1. SEQ ID NO: 8; фрагмент фибронектина, называемый С-274. SEQ ID NO: 9; фрагмент фибронектина, называемый Н-271. SEQ ID NO: 10; фрагмент фибронектина, называемый Н-296. SEQ ID NO: 11; фрагмент фибронектина, называемый СН-271. SEQ ID NO: 12; фрагмент фибронектина, называемый СН-296. SEQ ID NO: 13; фрагмент фибронектина, называемый C-CS1. SEQ ID NO: 14; фрагмент фибронектина, называемый CHV-89. SEQ ID NO: 15; фрагмент фибронектина, называемый CHV-90. SEQ ID NO: 16; фрагмент фибронектина, называемый CHV-92. SEQ ID NO: 17; фрагмент фибронектина, называемый CHV-179. - 35 - 010434 SEQ ID NO: 18; фрагмент фибронектина, называемый CHV-181. SEQ ID NO: 19; фрагмент фибронектина, называемый H-275-Cys. SEQ ID NO: 20; праймер 12S. SEQ ID NO: 21; праймер 14А. SEQ ID NO: 22; праймер Cys-A. SEQ ID NO: 23; праймер Cys-S. SEQ ID NO: 24; сконструированный пептид на основании матриксного белка вируса гриппа. Промышленное применение В соответствии со способом получения цитотоксических лимфоцитов согласно изобретению, были получены цитотоксические лимфоциты в которых сохранялась высокая цитотоксическая активность, значительно увеличивался уровень экспрессии IL-2R и увеличивался процент CD8-положительных клеток. Лимфоциты могут быть подходящим образом использоваться, например, в адоптивной иммунотерапии. Следовательно, вероятно способ согласно изобретению внесет большой вклад в область медицины. - 36 - 010434 Список последовательностей - 37 - 010434 - 38 - 010434 - 39 - 010434 - 40 - 010434 - 41 - 010434 - 42 - 010434 - 43 - 010434 - 44 - 010434 - 45 - 010434 - 46 - 010434 - 47 - 010434 - 48 - 010434 - 49 - 010434 - 50 - 010434 - 51 - 010434 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения цитотоксических лимфоцитов, предусматривающий проведение по меньшей мере одной из стадий - индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем полученные цитотоксические лимфоциты отличаются повышенной экспрессией рецептора интерлейкина-2 по сравнению с цитотоксическими лимфоцитами, полученными в отсутствие фибронектина, его фрагмента или их смеси. 2. Способ получения цитотоксических лимфоцитов, предусматривающий проведение по меньшей мере одной из стадий - индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем полученные цитотоксические лимфоциты содержат больший процент CD8положительных клеток по сравнению с цитотоксическими лимфоцитами, полученными в отсутствие фибронектина, его фрагмента или их смеси. 3. Способ получения цитотоксических лимфоцитов, предусматривающий проведение по меньшей мере одной из стадий - индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем полученные лимфоциты обладают более высокой цитотоксической активностью по сравнению с таковой лимфоцитов, полученных в отсутствие фибронектина, его фрагмента или их смеси. 4. Способ получения цитотоксических лимфоцитов, предусматривающий проведение по меньшей мере одной из стадий - индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем полученные цитотоксические лимфоциты обладают более высокой кратностью экспансии по сравнению с таковой цитотоксических лимфоцитов, полученных в отсутствие фибронектина, его фрагментов или их смеси. 5. Способ по любому из пп.1-4, согласно которому фибронектин, его фрагмент или их смесь иммобилизированы на твердой фазе. 6. Способ по п.5, согласно которому твердой фазой является приспособление для клеточной культуры или носитель в клеточной культуре. 7. Способ по п.6, согласно которому приспособлением для клеточной культуры является чашка Петри, колба или мешок, а носителем в клеточной культуре являются бусы, мембрана или покровное стекло. 8. Способ по любому из пп.1-4, согласно которому по меньшей мере одну из стадий - индукцию, поддержание и экспансию цитотоксических лимфоцитов проводят в культуральной среде, содержащей фибронектин, его фрагмент или их смесь. 9. Способ по любому из пп.1-8, согласно которому фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7, или полипептид с заменой, делецией, вставкой или добавлением одной или более аминокислот в аминокислотной последовательности указанного полипептида, обладающий теми же самыми свойствами, что и исходный полипептид. 10. Способ по п.9, согласно которому фрагмент фибронектина обладает активностью клеточной адгезии и/или гепаринсвязывающей активностью. 11. Способ по п.9, согласно которому фрагментом фибронектина является полипептид, содержащий любую из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 819. 12. Цитотоксические лимфоциты, полученные способом по любому из пп.1-11. 13. Лекарственное средство для адаптивной иммунотерапии, содержащее в качестве действующего компонента цитотоксические лимфоциты, полученные способом по любому из пп.1-11. 14. Применение фибронектина, его фрагмента или их смеси в качестве действующего начала для усиления экспрессии рецептора интерлейкина-2 цитотоксическими лимфоцитами. 15. Применение по п.14, где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7, или полипептид с заменой, делецией, вставкой или добавлением одной или более аминокислот в аминокислотную последовательность указанного полипептида, обладающий теми же самыми свойствами, что и исходный полипептид. 16. Применение по п.15, где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепаринсвязывающей активностью. 17. Применение по п.15, где фрагмент фибронектина представляет собой полипептид, содержащий любую из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 819. 18. Применение фибронектина, его фрагмента или их смеси в качестве действующего начала для повышения процента CD8-положительных клеток в популяции культивируемых цитотоксических лимфоцитов. 19. Применение по п.18, где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями - 52 - 010434 SEQ ID NO: 1-7, или полипептид с заменой, делецией, вставкой или добавлением одной или более аминокислот в аминокислотной последовательности указанного полипептида, обладающий теми же самыми свойствами, что и исходный полипептид. 20. Применение по п.19, где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепаринсвязывающей активностью. 21. Применение по п.19, где фрагмент фибронектина представляет собой полипептид, содержащий любую из аминокислотных последовательностей, представленных в SEQ ID NO: 8-19. 22. Применение фибронектина, его фрагмента или их смеси в качестве действующего начала для повышения цитотоксической активности культивируемых лимфоцитов. 23. Применение по п.22, где фрагмент фибронектина представляет собой полипептид, содержащий по меньшей мере одну из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 1-7, или полипептид с заменой, делецией, вставкой или добавлением одной или более аминокислот в аминокислотную последовательность указанного полипептида, обладающий теми же самыми свойствами, что и исходный полипептид. 24. Применение по п.23, где фрагмент фибронектина обладает активностью клеточной адгезии и/или гепаринсвязывающей активностью. 25. Применение по п. 23, где фрагмент фибронектина представляет собой полипептид, содержащий любую из аминокислотных последовательностей, представленных последовательностями SEQ ID NO: 819. 26. Способ повышения экспрессии рецептора интерлейкина-2 цитотоксическими лимфоцитами, характеризующийся тем, что осуществляют по меньшей мере одну из стадий - индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем экспрессия рецептора интерлейкина-2 цитотоксическими лимфоцитами повышена по сравнению с экспрессией цитотоксическими лимфоцитами, полученными в отсутствие фибронектина, его фрагмента или их смеси. 27. Способ повышения процента CD8-положительных клеток в популяции культивируемых цитотоксических лимфоцитов, характеризующийся тем, что осуществляют по меньшей мере одну из стадий индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем доля CDS-положительных клеток в популяции культивируемых лимфоцитов повышена по сравнению с таковой лимфоцитов, полученных в отсутствие фибронектина, его фрагмента или их смеси. 28. Способ повышения цитотоксической активности лимфоцитов, характеризующийся тем, что осуществляют по меньшей мере одну из стадий - индукции, поддержания и экспансии в присутствии фибронектина, его фрагмента или их смеси, причем цитотоксическая активность лимфоцитов повышена по сравнению с таковой лимфоцитов, полученных в отсутствие фибронектина, его фрагмента или их смеси. 29. Способ по любому из пп.1-11, дополнительно предусматривающий стадию трансдукции чужеродного гена в цитотоксические лимфоциты. 30. Способ по п.29, согласно которому указанный чужеродный ген трансдуцируют, используя ретровирус, аденовирус, аденоассоциированный вирус. 31. Способ по п.30, согласно которому указанный вирус является вирусом обезьян. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6 - 53 -