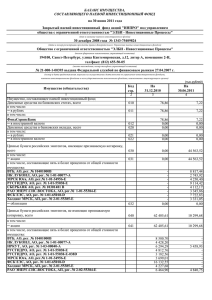
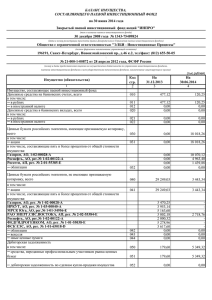
На правах рукописи ЕЛИСЕЕВА ДАРЬЯ ДМИТРИЕВНА
advertisement

На правах рукописи ЕЛИСЕЕВА ДАРЬЯ ДМИТРИЕВНА КРИТЕРИИ АКТИВНОСТИ ПАТОЛОГИЧЕСКОГО ПРОЦЕССА ПРИ РАССЕЯННОМ СКЛЕРОЗЕ ПО РЕЗУЛЬТАТАМ ИССЛЕДОВАНИЯ РЕГУЛЯТОРНЫХ Т-КЛЕТОК Автореферат диссертации на соискание ученой степени кандидата медицинских наук Специальность: 14.01.11 – Нервные болезни 14.03.09 – Клиническая иммунология, аллергология Москва 2011 Работа выполнена в Учреждении Российской академии медицинских наук Научном центре неврологии РАМН НАУЧНЫЕ РУКОВОДИТЕЛИ: доктор медицинских наук, профессор Завалишин Игорь Алексеевич; доктор медицинских наук, профессор Быковская Светлана Нюневна ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ: доктор медицинских наук, профессор Бойко Алексей Николаевич; доктор медицинских наук, профессор Пинегин Борис Владимирович ВЕДУЩАЯ ОРГАНИЗАЦИЯ: ГОУ ВПО «Московский государственный медикостоматологический университет» Министерства здравоохранения и социального развития РФ Защита диссертации состоится « » 2011 года в часов на заседании Совета по защите докторских и кандидатских диссертаций Д 001.006.01 при Учреждении Российской академии медицинских наук Научном центре неврологии РАМН по адресу: 125367, Москва, Волоколамское шоссе, 80. С диссертацией можно ознакомиться в научной библиотеке НЦН РАМН по адресу: 125367, Москва, Волоколамское шоссе, 80. Автореферат разослан « » 2011 года Ученый секретарь Совета по защите докторских и кандидатских диссертаций Д 001.006.01, кандидат медицинских наук Е.В. Гнедовская 2 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность проблемы Рассеянный склероз (РС) – распространенное аутоиммунное демиелинизирующее заболевание центральной нервной системы (ЦНС), которое поражает в основном лиц молодого возраста и почти неизбежно приводит на определенной стадии своего развития к инвалидизации [Compston A., Coles A., 2002]. В основе патогенеза РС лежит аутоиммунный процесс, который выражается в активации, дифференцировке специфические рецепторы аутореактивных Т-клеток, к и пролиферации компонентам индуцирующих Т-клеток, в имеющих миелина, т.е. образовании развитие демиелинизирующего процесса. Причем, ведущая роль в развитии иммунопатологического процесса при РС принадлежит популяции CD4+ Т-клеток. Считается, что CD4+ Т-лимфоциты первыми встречаются с антигеном и приобретают свойства эффекторных миелинспецифических клеток [Delgado S., Sheremata W.A., 2006; Hemmеr В. et al., 2002]. Активация Т-клеток происходит при взаимодействии соответствующего рецептора Т-лимфоцита и аутоантигена, связанного с молекулами главного комплекса гистосовместимости II класса, который экспрессируется на антигенпрезентирующих (АПК) клетках, после чего происходит пролиферация и дифференцировка аутореактивных В Т-клеток. результате Т-лимфоциты приобретают аутоагрессивные свойства. На следующем этапе происходит проникновение активированных Т-лимфоцитов через гематоэнцефалический барьер (ГЭБ) в ЦНС и их взаимодействие с антигенами собственного миелина, в результате развивается воспалительный процесс, который приводит к повреждению миелина головного и спинного мозга. По современным представлениям, развитие аутоиммунных заболеваний связано не только с дифференцировкой, пролиферацией и активацией эффекторных Т-клеток, но и с нарушением супрессорных механизмов, которые контролируют толерантность Т- и В-лимфоцитов к аутоантигенам [Mills K.H. et al., 2004]. Ключевую роль в механизмах иммуносупрессии играют регуляторные Тклетки с фенотипом CD4+CD25+Foxp3+ (Т рег). Т рег в норме составляют 3-5 % от 3 общего числа CD4+ T-клеток в периферической крови и лимфоидных тканях. Т рег созревают в тимусе и на 3-4 день неонатального развития расселяются в кровь и периферические лимфоидные органы [Sakaguchi S. et al., 1995]. У больных аутоиммунными заболеваниями выявлено значительное снижение количества и нарушение функции Т рег. Так, дефект Т рег показан у больных системной красной волчанкой [Lyssik E.Y. et al., 2007], сахарным диабетом 1 типа [Dejaco C. et al., 2006], псориазом [Sugiyama H. et al., 2005], ревматоидным артритом [Pohlers D. et al., 2007]. Проведенные в настоящее время исследования показали, что имеется возможность увеличить количество Т рег, выделенных из крови пациента, культивированием их в условиях ex vivo [Selvaraj R.K., Geiger T.L., 2008; Allan S.E. et al., 2008]. При этом, полученные культивированием Т рег высоко стабильны, долго живущие, обладают супреcсорными свойствами, неспецифичны и неиммуногенны и введение этих клеток пациенту с целью восстановления Т рег в крови больного до уровня нормы может стать инструментом коррекции иммунных нарушений при аутоиммунных заболеваниях [Peters J.H. et al., 2008; Thornton A.M. el., 2010]. Проведены пилотные испытания по введению аутологичных культивированных Т рег больным системной красной волчанкой [Lyssik E. Y. et al., 2007], диабетом 1-го типа [Godebu E., Summers-Torres D. et al., 2008], пациентам с реакции трансплантант-против хозяина после трансплантации гемопоэтических стволовых клеток [Корсунский И.А. и соавт., 2008; Riley J.L. et al., 2009]. При этом, получено достоверное увеличение количества Т рег в периферической крови этих больных, которое коррелировало с улучшением клинических показателей и не вызывало побочных реакций у больных. В последнее время появились работы, посвящённые изучению роли Т рег в патогенезе рассеянного склероза [Haas J. et al., 2005, 2007; Venken K. et al., 2007, 2008, 2010; Feger U. С. et al., 2007]. Установлено, что Т рег играют определенную роль в нарушении регуляторных механизмов в аутоиммунитете, приводящих к развитию и прогрессированию РС. В то же время, результаты исследований количества и функциональной активности при РС отличаются значительной разноречивостью, 4 что обусловлено недостаточностью сопоставлений количества и функциональной активности Т рег с клинической картиной заболевания. Помимо этого, в настоящее время имеются лишь единичные описания результатов культивирования Т рег больных РС, а попыток использования Т рег в терапевтических целях при этом заболевании не проводилось. В связи с вышеизложенным были сформулированы цели и задачи исследования. Цели и задачи исследования Целью настоящего исследования является изучение роли регуляторных Т-клеток CD4+CD25+Foxp3+ в патогенезе рассеянного склероза. Задачи исследования: 1. Исследовать состояние клеточного иммунитета больных ремитирующим РС путем изучения содержания основных субпопуляций лимфоцитов (фенотипы CD3+, CD4+, CD8+, CD16+56+, CD19+) на различных этапах заболевания. 2. Изучить количество регуляторных Т-клеток CD4+CD25+Foxp3+ в крови больных РС в зависимости от стадии заболевания (обострение, ремиссия), длительности и тяжести его течения. 3. Изучить функциональную активность Т рег у больных РС в стадии обострения и ремиссии. 4. Провести культивирование аутологичных Т рег, выделенных из крови больных РС, с целью получения линий этих клеток (индукция Т рег ex vivo) и сравнить их фенотипические и функциональные характеристики с нативными Т рег. 5. Выполнить введение выращенных ex vivo регуляторных Т-клеток CD4+CD25+Foxp3+ для коррекции иммунных нарушений у больных РС, от которых эти клетки были получены. Научная новизна. Впервые исследовано количество и функциональная активность регуляторных Т-клеток CD4+CD25+Foxp3+ в крови больных РС в зависимости от стадии заболевания. При этом, установлены значимые корреляции стадии демиелинизирующего процесса с количеством Т рег. Проведено культивирование аутологичных Т рег путем их индукции ex vivo и доказана идентичность культивированных и нативных клеток. Впервые выполнено введение выращенных ex vivo аутологичных регуляторных Т-клеток с целью коррекции иммунных 5 нарушений у больных РС. Выявлено, что введение таких аутологичных клеток больным приводит к увеличению содержания Т рег в крови и хорошо переносится пациентами, и может в дальнейшем рассматриваться как новый подход к терапии этого заболевания. Практическая и теоретическая значимость работы. На основании проведенного исследования расширены представления о взаимосвязи количественного и функционального дефекта регуляторных Т-клеток в механизмах формирования иммунопатологического процесса при РС, что имеет значение для понимания роли регуляторных механизмов в патогенезе этого заболевания. Результаты проведенного исследования имеют важное практическое значение в плане диагностического показателя наступающего обострения РС при снижении количества Т рег и формирования ремиссии заболевания при повышении числа этих клеток в крови больных. Выявлено, что регуляторные Т-клетки CD4+CD25+Foxp3+ можно выделить из периферической крови больного и вырастить в лабораторных условиях достаточное количество клеток, которое может компенсировать их дефицит в организме и соответственно применяться для коррекции иммунных нарушений при РС. Основные положения, выносимые на защиту: 1. Иммунофенотипическое исследование крови больных РС выявило дисбаланс CD4+ и CD8+ Т-клеток за счет повышения количества СD8+ Т-клеток. 2. Выявлено снижение количества Т рег в крови больных РС в целом по группе. Установлено, что в стадии обострения РС количество Т рег значительно снижено, а переход в стадию ремиссии заболевания характеризуется ростом их числа. 3. Отмечено снижение функциональной активности Т рег, выделенных из периферической крови больных РС, как в стадии обострения, так и в стадии ремиссии заболевания. 4. Установлена обратная зависимость между количеством Т рег и степенью инвалидизации и длительностью РС, что является отражением степени активности иммунопатологического процесса. 5. В результате культивирования аутологичных Т рег больных количество этих клеток увеличивается в десятки раз. При этом, культивированные Т рег по 6 фенотипическим и функциональным характеристикам идентичны нативным. Введение выращенных ex vivo аутологичных Т рег больным РС позволяет повысить уровень Т рег в крови больных и не вызывает побочных эффектов. Апробация работы. Работа апробирована и рекомендована к защите на совместном заседании сотрудников I, II, III, V, VI неврологических, нейрореанимационного и научно-консультативного отделений, отделения лучевой диагностики, лабораторий нейрохимии, гемореологии и гемостаза, эпидемиологии и профилактики заболеваний нервной системы, клинической нейрофизиологии и патоморфологии Научного центра неврологии РАМН 06 апреля 2011 г. Материалы диссертации были представлены и обсуждены на: заседании XVII Всероссийской конференции «Нейроиммунология. Рассеянный склероз» (Санкт-Петербург, 2009 г.), IX Международном конгрессе «Новые направления иммуносупрессии и иммунотерапии” (Женева, 2010 г.), Совете молодых ученых НЦН РАМН (Москва, 2011 г.), V Сибирской межрегиональной научнопрактической конференции «Рассеянный склероз: 30 лет спустя» (Новосибирск 2011 г.), V Международной конференции по иммунологической регуляции (Давос, 2011 г.). Публикации. По теме диссертации опубликовано 9 печатных работ, в том числе 5 в журналах, рекомендованных ВАК. Объем и структура Работа диссертации. изложена на 120 страницах машинописного текста и состоит из введения, обзора литературы, характеристики пациентов и методов исследования, главы, посвященной результатам, обсуждения полученных результатов, выводов и практических рекомендаций. Работа иллюстрирована 20 рисунками и 10 таблицами. Библиографический указатель включает в себя 199 источников, из них 11 отечественных и 188 зарубежных. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Общая характеристика больных В настоящей работе представлены результаты клинико-иммунологического исследования, в том числе, определение количества регуляторных Т-клеток CD4+CD25+Foxp3+ (Т рег), у 50 больных с достоверным диагнозом РС. 19 пациентов из этой группы изучены в динамике, как в стадии обострения, так и в стадии ремиссии. 10 больным РС проведено исследование функциональной 7 активности Т рег в смешанной культуре лимфоцитов. Выращено 5 клеточных линий CD4+ Т-клеток 5 больных РС и 3 здоровых доноров для индукции ex vivo (культивирования) регуляторных Т-клеток CD4+CD25+Foxp3+. Проведено подкожное введение выращенных ex vivo (культивированных) Т рег 5 больным РС. Клиническое обследование больных проводилось в 6-ом неврологическом отделении НЦН РАМН, руководитель отделения – профессор И.А. Завалишин. У больных была детально изучена клиническая картина заболевания с использованием данных анамнеза, неврологического и соматического статуса, проведена магнитно-резонансная томография (МРТ) головного и/или спинного мозга. Все 50 пациентов, включенных в исследование, имели достоверный диагноз ремитирующего РС, согласно диагностическим критериям Poser С.М. (1998г) и McDonald W.I. (2005г.). Группа пациентов состояла из больных РС: в стадии ремиссии – 31 человек, в стадии обострения – 19 человек. Среди обследованных лиц преобладали женщины в соотношении 1:2,3. Возраст больных варьировал от 19 до 56 лет. Тяжесть неврологического дефицита оценивалась с использованием расширенной шкалы инвалидизации EDSS (The Expanded Disability Status Scale), которая у больных в стадии обострения РС находилась в пределах от 1,0 до 5,0, в стадии ремиссии РС от 1,0 до 2,5 баллов. У 19 больных в стадии обострения болезни, были взяты образцы крови в динамике, т.е. как в стадии обострения, так и в стадии ремиссии заболевания. Этим больным, до забора крови для определения иммунофенотипического состава крови, проведены неврологический осмотр, при котором выявлено нарастание или появление новой неврологической симптоматики и МРТ головного и/или спинного мозга, позволяющая выявить активные очаги демиелинизации. После выявления обострения процесса больным проводилась пульс-терапия метилпреднизолоном (суммарная доза 3000 - 5000 мг). Повторное взятие крови осуществлялось спустя не менее 4-х недель после окончания гормональной терапии. У пациентов, изученных в динамике в стадии обострения и в стадии ремиссии, средний возраст составил 34,9±9,76 лет (25-56), балл по шкале EDSS находился в пределах от 1,5 - 5,0, в стадии ремиссии степень выраженности неврологического дефицита у этих больных составила 1,55±0,57 [1,0;3,0] баллов. 8 У всех 50 больных была проведена оценка периода от момента постановки диагноза РС до начала исследования. В целом по группе длительность РС варьировала от 3 до 207 месяцев. Выделено 2 группы больных по длительности течения РС. Первую группу составили 28 больных, страдающих РС менее 36 месяцев, вторую – 22 больных, страдающих РС более 36 месяцев. При этом, средняя длительность заболевания в первой и второй группах была равна 15,29 ±11,12 (3-35) и 110,5±51,17 (44-208) месяцев, соответственно. В качестве контрольной группы исследован иммунофенотип крови 21 здорового донора, соответствующих больным по возрастному и половому составу. Среди здоровых лиц, преобладали женщины 1:1,63. Возраст доноров находился в пределах от 19 до 57 лет. Определение функциональной активности Т рег проведено 10 больным РС, из них 7 пациентам в стадии обострения и 3 – в стадии ремиссии. Среди них 7 женщин и 3 мужчин. Возраст этих больных РС варьировал от 24 до 39 лет. Группа больных РС, у которых были взяты образцы крови для культивирования аутологичных Т рег и последующего их подкожного введения состояла из 5 человек. Данная группа больных состояла из 4 женщин и 1 мужчины, возраст пациентов составил от 26 до 37 лет, средний балл по шкале EDSS был равен 2,9 [2,5±3,0]. Протоколы диссертационного исследования «Критерии активности патологического процесса при рассеянном склерозе по результатам исследования регуляторных Т-клеток» и клинического исследования «Иммунокоррегирующая терапия ремитирующего рассеянного склероза путем введения выращенных ex vivo аутологичных регуляторных Т-клеток CD4+CD25+Foxр3+» были одобрены Локальным Этическим Комитетом НЦН РАМН. Протокол №9/08 от 25 июня 2008 года. Все пациенты дали согласие на участие в исследовании, подписав информированное согласие. Методы исследований Исследование иммунофенотипического состава крови, в том числе определение количества регуляторных Т-клеток CD4+CD25+Foxp3+ больных РС и здоровых доноров, проводилось с использованием метода проточной цитометрии 9 на базе лаборатории клинической и экспериментальной нейрохимии НЦН РАМН, руководитель – профессор А.А. Болдырев. Все измерения проводились на проточном цитометре FACS Calibur(tm) (BD Biosciences). Для оценки количества клеток CD3+, CD8+, CD4+, CD4+CD25+, CD19+, CD16+CD56+ в мононуклеарной фракции, клеточную суспензию окрашивали соотвествующими антителами. Оценка экспрессии поверхностных маркеров проводилась в соответствии с протоколом, разработанным производителем набора антител BD Multitest IMK Kit(tm) (BD Biosciences, США). Процентное содержание позитивных по специфическим маркерам клеток подсчитывалось при помощи программного обеспечения MACSQuantify(tm) (Miltenyi Biotec GmbH, Германия). Выделение регуляторных Т-клеток CD4+CD25+Foxр3+ из периферической крови больных рассеянным склерозом осуществлялось инкубацией CD4+CD25+ Т-клеток с PE-мечеными анти-человеческими антителами к FoxP3, клон PCH101 (eBioscience, США). Определение функциональной активности и культивирование регуляторных Тклеток CD4+CD25+Foxp3+ проводилось на базе Отдела клеточных технологий и регенеративной медицины ГОУ ВПО РГМУ, руководитель отдела – профессор С.Н. Быковская. Данный метод включал забор 40 мл периферической крови у испытуемого, выделение субпопуляций регуляторных и эффекторных Т-лимфоцитов и АПК донора, окраску эффекторных Т-лимфоцитов витальным красителем карбоксифлуоресцеин сукцинимидиловым эфиром (Carboxyfluorescein succinimidyl ester – CFSE) и пролиферацию в смешанной культуре лимфоцитов (mixed lymphocyte reaction – MLR), которая оценивается по редукции внутриклеточного красителя CFSE методом проточной цитометрии. Для культивирования Т рег применяли среду RPMI-1640, содержащую феноловый красный, L-глутамин и 25мМ HEPES (Gibco, Великобритания) c добавлением 5-10% аутологичной сыворотки и 1% раствора пенициллинстрептомицина (Gibco, Великобритания). В культуральную среду добавляли интерлейкин (ИЛ) - 2 (ИЛ-2, R&D Systems, Великобритания), мышиные моноклональные антитела к человеческому рецептору CD3 (МедБиоСпектр, РФ) и мышиные моноклональные антитела к человеческому рецептору CD28 (BD 10 Pharmingen, США). Клетки культивировали во флаконах 25 см2 или 75 см2 в CO2инкубаторе при 370С в атмосфере 5% СО2. Свежую среду и ростовые факторы добавляли каждые 3-4 дня. Время культивирования составляло от 5-8 дней. Далее оценивались фенотипические характеристики (экспрессии маркеров) и экспансия (увеличение количества) Т рег после культивирования с помощью проточной цитометрии, и изучалась супрессорная активность нативных и индуцированных ex vivo Т рег. На 7-12й день культивирования клетки концентрировали, подсчитывали количество живых клеток в гемоцитометре и отмывали центрифугированием в 50 мл конических стерильных пробирках в фосфатном солевом буферном растворе без Са2+ и Mg2+ в течение 10 мин при 300 g. Осадок разводили в 2-3 мл стерильного физиологического раствора или 6% раствора полиглюкина и сразу набирали в стерильный одноразовый шприц, который помещали в стерильную упаковку и в специальный контейнер для переноса клеток, который незамедлительно транспортировался в НЦН РАМН. После доставки в 6-ое неврологическое отделение НЦН РАМН, клетки немедленно вводили пациенту подкожно, в область передней брюшной стенки. После введения клеток пациент находился на стационарном лечении в 6-ом неврологическом отделении НЦН РАМН в течение 2-х недель. В течение последующего года наблюдение за пациентами осуществлялось в амбулаторном порядке, с явкой на осмотр 1 раз в 3 месяца. Статистическая обработка полученных результатов осуществлялась с использованием пакета прикладных программ STATISTICA 6.0 (StatSoft Inc., США) для персонального компьютера. Для нормально распределенных признаков вычислялось среднее значение и стандартное отклонение, результаты представлены в виде m±δ. При выполнении описательной статистики для количественных признаков, распределение которых не подчинялось законам нормального распределения, вычислялись медиана и интерквартильный размах – нижний 25% и верхний 75%-ный интервалы. Результаты представлены в виде медианы (нижний квартиль (LQ)=; верхний квартиль (UQ)=). Сравнение двух независимых групп по одному признаку для количественных, качественных, порядковых и номинальных признаков проводилось с помощью критерия Манна-Уитни. Взаимосвязь двух 11 признаков анализировалась при помощи корреляционного анализа по Спирмену, с вычислением коэффициента корреляции R. Порог статистической значимости (р) был установлен на уровне 0,05. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Установлено, что в целом по группе больных РС имело место статистически значимое снижение уровня иммунологического регуляторного индекса (ИРИ) – CD4+/CD8+ (р=0,04) (табл. 1). Таблица 1 Иммунофенотип периферической крови больных РС в целом по группе больных Больные РС I n=50 70,95 ± 8,19 [52,20;88,70] + CD8 25,75 ± 7,83 [11,09;51,25] + CD4 42,18 ± 9,42 [19,70;64,06] + + CD4 /CD8 1,83 ± 0,88 [0,40;5,78] + CD19 9,83 ± 3,94 [2,60;19,78] + + CD16 CD56 17,01 ± 7,53 [3,20;34,90] «*»- статистически значимые отклонения Количество (n) CD3+ Доноры II n=21 72,52 ± 7,79 [(61,30;84,30] 22,70 ± 4,77 [14,50;28,88] 46,67 ± 7,15 [34,94;55,01] 2,18 ± 0,72 [1,29;3,66] 11,89 ± 6,72 [5,41;29,13] 13,72 ± 5,84 [6,24;25,00] р I-II 0,58 0,19 0,07 0,04* 0,48 0,15 При динамическом исследовании иммунофенотипа крови 19 больных РС в стадии обострения и ремиссии выявлено достоверное повышение количества CD8+ Т-клеток (р=0,007) по сравнению с количеством этих клеток в стадии ремиссии, что обусловило снижение ИРИ (р=0,04) у этой группы пациентов. Ремиссия же PC ассоциировалась со снижением числа эффекторных Т-лимфоцитов (CD4+, CD8+), причем, в большей степени CD8+ Т-клеток. Кроме того, иммунограмма больных PC в стадии ремиссии характеризовалась достоверным снижением содержания Влимфоцитов (р=0,009) (табл. 2). Таблица 2 Иммунофенотип периферической крови больных РС, обследованных в динамике Количество (n) Обострение РС I n=19 Ремиссия РСII n=19 Доноры n=21 р I-II 12 CD3+ 70,84 ± 8,33 69,36 ± 8,92 [55,80;82,90] [48,10;81,80] + CD8 26,59 ± 4,62 21,83 ± 5,31 [20,60;36,20] [13,67;33,70] + CD4 42,58 ± 8,61 39,98 ± 8,90 [30,23;59,12] [21,30;54,70] + + CD4 /CD8 1,61 ± 0,43 1,86 ± 0,36 [1,20;2,80] [1,30;2,80] + CD19 11,76 ± 3,79 8,37 ± 4,29 [4,80;19,30] [3,45;16,50] + + CD16 CD56 19,07 ± 7,32 16,92 ± 11,87 [8,50;34,90] [3,20;37,67] «*»- статистически значимые отклонения 72,52 ± 7,79 [(61,30;84,30] 22,70 ± 4,77 [14,50;28,88] 46,67 ± 7,15 [34,94;55,01] 2,18 ± 0,72 [1,29;3,66] 11,89 ± 6,72 [5,41;29,13] 13,72 ± 5,84 [6,24;25,00] 0,67 0,007* 0,43 0,02* 0,009* 0,22 Таким образом, в исследовании выявлено, что процентное содержание Тлимфоцитов, экспрессирующих CD4+ и СD8+ маркеры и обладающих эффекторными свойствами, и, соответственно, способностью атаковать миелин в целом по группе больных РС не отклонялось от нормальных показателей. Однако, имело место снижение показателя ИРИ, который отражает соотношение популяций этих Т-клеток. Снижение ИРИ у больных РС может быть обусловлено дисбалансом этих клеток вследствие несущественного уменьшения процентного содержания CD4+ Т-клеток и увеличения числа CD8+ Т-клеток. При обострении РС отмечалось преобладание CD8+ Т-клеток и еще в большей степени снижался показатель ИРИ. В стадии ремиссии РС наблюдалось уменьшение количества Т-лимфоцитов, экспрессирующих CD4+ и CD8+, причем, в большей степени последних, что приводило к нормализации ИРИ. Следующим этапом нашей работы явилась идентификация субпопуляции регуляторных Т-клеток CD4+CD25+Foxp3+, характерными маркёрами которых, являются постоянная экспрессия на мембране клетки альфа-цепи рецептора ИЛ-2 (IL2R) CD25+ высокой афинности и экспрессия продукта гена Foxp3, который кодирует дифференцировку и функциональную активность этих клеток [Nakamura K., Kitani A., Strober W., 2001]. В результате исследования установлено, что содержание Т рег в периферической крови больных РС в целом по группе составило 1,38±0,86% [0,19;4,40], у доноров – 3,56±1,53% [1,86;6,07], что указывает на достоверно значимое снижение количества Т рег у больных (р=0,0001). При сравнении содержания Т рег в периферической крови больных РС в стадии ремиссии (1,37±0,90% [0,2;4,4]) и в стадии обострения (0,88±0,45% 13 [0,19;1,90]) заболевания наблюдалось достоверное отличие числа этих клеток (р=0,03) (рис. 1). Рис. 1. Увеличение содержания регуляторных Т-клеток CD4+CD25+Foxp3+ в крови больных РС в стадии ремиссии Таким образом, по нашим данным, в крови больных РС выявлено достоверное снижение количества Т рег независимо от стадии заболевания. Однако, обращает на себя внимание, что в большей степени содержание Т рег снижено при обострении аутоиммунного процесса. Аналогичные данные получены в работах других авторов [Haas J. et al., 2007; Venken K. et al., 2007, 2008, 2010; Jean M. Fletcher et al., 2009]. Причиной данного обстоятельства может быть увеличенная продукция провоспалительных цитокинов активированными CD4+ Тклетками, которые угнетают как образование Т рег на периферии, так и повреждают уже существующие клетки. Помимо этого, может наблюдаться цитотоксическое действие CD8+ Т-клеток. Venken K. с соавт. (2008) связывают наличие малого числа Т рег в крови больных РС со снижением уровня экспрессии гена Foxp3 на периферических Т рег, в результате чего нарушается образование этих клеток, а Т рег, циркулирующие в крови, подвергаются повреждающему действию эффекторных клеток. При динамическом анализе периферической крови 19 больных в стадии обострения и в стадии ремиссии РС получено достоверное повышение количества 14 Т рег с 0,88±0,45% [0,19;1,90] до 2,57±1,52% [0,63;5,50] (р=0,00003), которое не достигало уровня здоровых лиц (3,56 ± 1,53% [1,86;6,07]) (р=0,04). Таким образом, установлено, что при переходе заболевания в фазу ремиссии отмечается увеличение числа Т рег в крови больных РС. Такие результаты получены впервые, т.к. ранее не проводилось подобных исследований у одних и тех же больных РС в динамике. Следует отметить, что некоторыми исследователями продемонстрирован дефицит Т рег в крови больных в стадии обострения [Viglietta V. et al., 2004; Venken K. et al., 2007, 2008], причем, основной причиной низкого количества Т рег в обострении РС, по их мнению, является миграция этих клеток с периферии в участки демиелинизации, что объясняется выявлением количественного преобладания Т рег в ЦСЖ больных, особенно в период обострения процесса [Venken K. et al., 2008; Feger U. et al., 2007; Haas J et al., 2005]. Увеличение количества Т рег в крови больных РС в стадии ремиссии заболевания может быть связано с тем, что в дополнение к натуральным Т рег, образующимся в тимусе, прибавляются индуцированные на периферии Т рег. Эти клетки образуются из CD4+ Т-клеток, примированных антигеном. Необходимым условием для появления индуцированных Т рег является присутствие трансформирующего фактора ростаβ (Transforming growth factor beta – TGFβ). При этом индуцированные Т рег обладают таким же фенотипом и функциями как и натуральные. В процессе сопоставления выраженности неврологического дефицита, который в группе больных РС в целом составил 2,84±1,26 [1,0-5,5] баллов со средним содержанием Т рег (1,38±0,86% [0,19;4,40]) в периферической крови этих пациентов, выявляется обратная корреляция (r=-0,7175), т.е., чем больше выражена интенсивность неврологических симптомов, которая является отражением активности иммунопатологического процесса, тем меньшее количество Т рег определяется в крови больных (рис. 2). 15 Correlation: r = -,7175 5,0 4,5 3,5 3,0 + + CD4 CD25 Foxp3 + 4,0 2,5 2,0 1,5 1,0 0,5 0,0 0 1 2 3 4 5 EDSS 6 95% confidence Рис. 2. Обратная корреляция между степенью инвалидизации (баллы) по шкале EDSS и количеством Т рег в периферической крови больных РС В группе больных РС, обследованных в динамике, получено подтверждение этих результатов. Так, при обострении РС балл инвалидизации по шкале EDSS составил 3,08±1,12 [1,5;5,0], при этом количество Т рег было равно 0,88±0,45 [0,19;1,90], в стадии же ремиссии содержание Т рег возросло до 2,57±1,52 [0,63;5,50]% и, соответственно, уменьшилась степень выраженности неврологического дефицита (1,55±0,57 [1,0;3,0] балла). Выявленная в работе корреляционная зависимость между степенью неврологического дефицита и количеством Т рег в крови больных РС, вероятно, вторичная, нарушений. т.к. является Иными проявлением словами, активности иммунопатологических распространенность демиелинизирующего повреждения в ЦНС зависит от пролиферативной и функциональной активности миелин-специфических Т-клеток. Соответственно, более агрессивное течение аутоиммунного процесса опосредует вовлечение большего объема белого вещества головного и/или спинного мозга, что в большинстве случаев отражается в клинической картине заболевания. У больных РС, обследованных в динамике и получавших гормональную терапию, мы получили ту же взаимосвязь. Стадия обострения характеризуется появлением новой или усугублением имеющейся неврологической симптоматики, что, как мы показали, ассоциируется с дисбалансом аутоагрессивных CD4+ и CD8+ Т-клеток, вследствие дефицита 16 CD4+ активированных Т-клеток, экспрессирующих CD25+, и активной пролиферацией цитотоксических лимфоцитов (ЦТЛ), в результате чего, вероятно, происходит угнетение циркулирующих в крови Т рег. В стадии ремиссии происходит снижение степени тяжести клинических проявлений, что ассоциируется с увеличением Т-клеток, секретирующих провоспалительные цитокины, и стимуляцией образования Т рег. Средняя длительность заболевания в группе больных РС составила 57,58±58,68 [3;207] месяцев. При анализе количества Т рег в крови пациентов РС в зависимости от длительности заболевания получена обратная корреляционная зависимость (r=-0,6891), т.е. у длительно болеющих пациентов в периферической крови содержится меньшее число Т рег (рис. 3). Correlation: r = -,6891 5,0 4,5 3,5 3,0 + + CD4 CD25 Foxp3 + 4,0 2,5 2,0 1,5 1,0 0,5 0,0 -20 0 20 40 60 80 100 120 длительность РС 140 160 180 200 220 95% confidence Рис. 3. Обратная корреляция между количеством регуляторных Т-клеток CD4+CD25+Foxp3+ в периферической крови больных и длительностью РС Для уточнения этого результата, мы разделили больных РС на 2 группы: у лиц, болеющих меньше 36 (15,11±11,20 [3;35]) месяцев количество Т рег составило 1,94±0,75% [0,6;4,4], в то время как в группе пациентов, болеющих более 36 (106,83±51,73 [44;207]) месяцев – 0,72±0,37% [0,19;1,8]. Получена статистически достоверная разница в содержании Т рег между этими группами больных (р=0,0001). 17 Таким образом, установлено, что содержание Т рег в крови больных РС обратно пропорционально длительности заболевания, что, вероятно, связано с истощением регуляторных механизмов при длительно существующем аутоиммунном процессе. Эти данные подчеркивают влияние повторяющихся эпизодов активации аутореактивных клеток на иммунорегуляторное звено иммунитета. Помимо уменьшения количества Т рег в крови, также важную роль в развитии иммунопатологического процесса при РС играют нарушения функциональной (супрессорной) активность этих клеток, т.е. способность Т рег подавлять пролиферацию эффекторных CD4+ Т-клеток. Нами исследована супрессорная активность Т рег, выделенныех из периферической крови 7 больных РС в стадии обострения, 3 больных – в стадии ремиссии и 5 здоровых доноров. Установлено, достоверное снижение функциональной активности Т рег у больных РС как в стадии обострения (55,94±7,76% [48,90;69,60]) (р=0,004), так и в стадии ремиссии (65,20±4,92% [59,70;69,20]) (р=0,02) по сравнению с группой здоровых доноров (86,92±4,41% [79,7;91,2]). Статистически значимого отличия супрессорной активности Т рег на разных стадиях аутоиммунного процесса при РС не получено (р=0,14). Для определения супрессорного влияния Т рег на эффекторные клетки рассчитывают индекс пролиферации (ИП), который представляет собой способность CD4+ Т-клеток пролиферировать в отсутствии и в присутствии Т рег. Так, при определении ИП CD4+ Т-клеток в отсутствии Т рег, статистически достоверные отличия наблюдались между группой доноров и больными РС как в стадии обострения (р=0,004), так и больными в стадии ремиссии (р=0,025). При сравнении значения ИП CD4+ Т-клеток на разных стадиях заболевания отмечалось статистически значимое его повышение у больных РС в стадии обострения (р=0,03). При инкубации СD4+ Т-клеток с Т рег получены достоверные различия между группой доноров и группой больных как в стадии обострения (р=0,004), так и в стадии ремиссии (р=0,025) (табл. 3). 18 Таблица 3 Индекс пролиферации CD4+ Т-лимфоцитов и CD4+ Т-лимфоцитов, инкубированных с Т рег. Пролиферативный Обострение РС Ремиссия индекс (1) (2) 1,74±0,10 1,56±0,05 0,82±0,14 *р1-2=0,03 [1,59;1,91] [1,52;1,61] [0,61;0,96] *р1-3=0,004 CD4 + РС Доноры (3) р *р2-3=0,025 CD4+/Т рег 0,75±0,10 0,77±0,08 0,16±0,04 р1-2=0,23 [0,61;0,89] [0,69;0,85] [0,1;0,21] *р1-3=0,004 *р2-3=0,025 «*» - статистически значимые отклонения Таким образом, установлено, что способность к пролиферации CD4+ Тлимфоцитов значительно выше у больных РС, причем, в большей степени в стадии обострения заболевания. При инкубации CD4+ Т-клеток с Т рег наблюдалось подавление активности эффекторных Т-лимфоцитов, за счет проявления Т рег супрессорных свойств. Однако, у больных РС эта способность значительно снижена по сравнению с донорами и не зависит от стадии заболевания. В настоящее время установлена возможность выделения и индукции ex vivo больших количеств Т рег [Hoffmann P. et al., 2004; Battaglia M. et al., 2006; Lyssik E. Y. et al., 2007; Godebu E., Summers-Torres D. et al., 2008; Thornton A.M. et al., 2010]. Считается, что полученные ex vivo (культивированные) Т рег высоко стабильны, долго живущие, обладают супрессорными свойствами, неспецифичны и неиммуногенны. Эти клетки можно размножить без потери функции и ввести в периферические участки тела с уверенностью, что они будут мигрировать в анатомический очаг воспаления [Allan S.E. et al., 2008]. В нашем исследовании индукция ex vivo Т рег осуществлялась культивированием выделенных из суспензии мононуклеарных клеток (МНК) CD4+ Т-лимфоцитов в течение 6 - 7 дней с помощью их стимуляции анти-CD3 и анти-CD28 в присутствии АПК и ИЛ-2. Мы располагали клеточными линиями CD4+ T-клеток 5 больных РС и 3 здоровых доноров. 19 В результате культивирования CD4+ Т-клеток больных и доноров получено увеличение количества регуляторных Т-клеток с фенотипом CD4+CD25+Foxp3+ в десятки раз (табл. 4). Таблица 4 Количество CD4+CD25+Foxp3+ Т-клеток до и после культивирования у больных РС (А) и здоровых доноров (Б) А.) Количество клеток % CD4+CD25+Foxp3+ До культивирования 1,10±0,48 [0,60;1,80] Больные РС После культивирования 89,12±0,93 [87,9; 90,3] 1 Увеличение в n раз 95,08±41,80 [49,22;149,5] Б.) Количество клеток % CD4+CD25+Foxp3+ 1 Доноры До культивирования 3,05±0,65 [2,50;3,77] 1 После культивирования 89,23±0,85 [88,40;90,10] Увеличение в n раз 30,03±5,92 [23,66;35,36] кратность увеличения количества клеток после культивирования в течение 7 дней С целью изучения супрессорной активности Т рег после экспансии, мы сравнили способность культивированных и нативных Т рег ингибировать пролиферацию клеток-мишений (CD4+) в смешанной культуре лимфоцитов. Установлено, что у больных РС супрессорная активность нативных (53,04±4,03% [48,2;56,8]) и культивированных Т рег (55,04±4,66% [50,20;60,10]) достоверно не отличалась (р=0,94). Таким образом, установлено, что выращенные ex vivo регуляторные Тклетки CD4+CD25+Foxр3+ по фенотипическим и функциональным характеристикам полностью идентичны нативным Т рег, выделенным из периферической крови больного, и их количество после экспансии возрастает в десятки раз На основании, полученных нами результатов, мы предположили, что введение аутологичных (собственных) регуляторных Т-клеток CD4+CD25+Foxp3+ больным РС с целью восстановления количества этих клеток до уровня нормы может использоваться в качестве коррекции иммунных нарушений при этом заболевании. 20 Нами однократно проведено введение культивированных аутологичных регуляторных Т-клеток CD4+CD25+Foxp3+ пяти больным РС. После введения выращенных ex vivo аутологичных регуляторных Т-клеток CD4+CD25+Foxр3+ у всех больных РС через 2 недели выявлено увеличение содержание этих клеток в периферической крови в среднем с 0,6±0,14% [0,4;0,8] до 1,4±0,44% [1,1;1,9], (p=0,009) (табл. 5). Таблица 5 Увеличение количества Т рег в периферической крови больных РС через 2 недели после введения выращенных ex vivo Т рег Больные РС Кол-во Т рег до введения , % Кол-во Т рег введенных больным, х106 Кол-во Т рег после трансплантации, % М. Т. З. Ч. П. 0,7 0,7 0,4 0,4 0,8 355 400 273 250 312 1,1 1,5 1,1 1,4 1,9 Таким образом, в результате пилотного исследования получено достоверное увеличение содержания Т рег в крови больных РС после подкожного введения культивированных аутологичных Т рег, что свидетельствует о возможности миграции этих клеток в кровь. Причем, у пациентов не наблюдалось никаких побочных реакций в ответ на инъекцию выращенных ex vivo Т рег, как в первые дни, так и в течение последующих 12 месяцев наблюдения, что указывает на безопасность и потенциальную возможность применения культивированных аутологичных Т рег в клинике для коррекции иммунных нарушений у больных РС. Выводы: 1. Исследование иммунофенотипического состава крови больных РС выявило разнонаправленные изменения содержания CD4+ и CD8+ Т-лимфоцитов, что является отражением активности аутоиммунного процесса при этом заболевании. 2. Установлено снижение количества регуляторных Т-клеток с фенотипическими характеристиками CD4+CD25+Foxp3+ в крови больных РС в целом по группе. 21 3. Выявлено, что больший количественный дефект Т рег имеет место у больных в стадии обострения РС, а при переходе в стадию ремиссии число Т рег возрастает. 4. Получено снижение супрессорной активности Т рег больных РС как в стадии обострения, так и в стадии ремиссии заболевания. 5. Установлена обратная зависимость между количеством Т рег в периферической крови больных и длительностью РС, а также между количеством Т рег и тяжестью течения РС, что отражает степень активности аутоиммунного процесса. 6. Показано увеличение количества Т рег в 30-90 раз с помощью их индукции ex vivo. Причем, культивированные Т рег имеют фенотипические и функциональные характеристики нативных Т рег. 7. В результате введения выращенных ex vivo аутологичных Т рег больным РС наблюдается повышение уровня Т рег в крови пациентов, при этом в течение 12месячного периода наблюдения за больными после инъекции Т рег не зарегистрировано побочных эффектов. Практические рекомендации: 1. Снижение количества Т рег можно использовать как диагностический критерий активности наступающего обострения, а повышение их количества рассматривать как прогностический тест формирования ремиссии 2. Т рег клетки CD4+CD25+Foxp3+ можно выделить из периферической крови больного и вырастить в лабораторных условиях такое количество клеток, которое потенциально может компенсировать их дефицит в организме и, соответственно, использоваться с терапевтической целью Список работ, опубликованных по теме диссертации: 1. Елисеева Д.Д., Быковская С.Н., Завалишин И.А. Регуляторные Т-клетки CD4+CD25+FoxP3+ при рассеянном склерозе // Нейроиммунология. – 2009. – Т. 7. – № 1. – С. 35 – 36. 2. Завалишин И.А., Елисеева Д.Д. Патогенетическая терапия рассеянного склероза // Лечащий врач. – 2009. – №9. – С. 43 – 46. 22 3. Елисеева Д.Д., Быковская С.Н., Завалишин И.А. Роль регуляторных Тклеток в патогенезе рассеянного склероза // Журн Медицина критических состояний. – 2010. – № 5. – С. 18 – 23. 4. Елисеева Д.Д., Завалишин И.А., Быковская Карандашов Е.Н., Трунова О.А. С.Н., Федорова Т.Н., Регуляторные Т-клетки CD4+CD25+Foxр3+ у больных ремитирующим рассеянным склерозом // Анналы клин. и эксперим. неврологии. – 2011. – Т. 5. – № 2. С. 9 – 13. 5. Завалишин И.А., Переседова А.В., Стойда Н.И., Алексеева Н.С., Гулевская Т.С., Гурьянова О.Е., Арзуманян Н.Ш., Елисеева Д.Д., Трифонова О.В., Брюхов В.В. Вопросы диагностики и лечения рассеянного склероза // Журн неврол. и психиатрии им. С.С.Корсакова. – 2011. – Т. 111. – № 6. – С. 88 – 95. 6. Завалишин И.А., Елисеева Д.Д. Лечение рассеянного склероза // Доктор.Ру. – 2009. – № 4. – С. 25 – 29. 7. D. Eliseeva, I. Zavalishin, E. Lyssuk, E. Karandashev, S. Bykovskaia. Pathological impairments of regulatory T cells CD4+CD25+Foxp3 in multiple sclerosis and injections of expanded ex vivo autologous T regs // Materials of 9th International Conference on New Trends in Immunosuppression and Immunotherapy, Geneva, Switzerland. – 2010. – P. 37. 8. Елисеева Д.Д., Быковская С.Н., Завалишин И.А. Регуляторные Т-клетки CD4+CD25+Foxp3+ при ремитирующем рассеянном склерозе // Материалы V Сибирской межрегиональной научно-практической конференции «Рассеянный склероз: 30 лет спустя». Новосибирск. – 2011. – С. 53-58. 9. Eliseeva D., Lyssuk Е., Karandashov E., Zavalishin I., Bykovskaia S., Karaulov A. Expanded ex vivo regulatory T cells CD4+CD25+FOXP3+ (Tregs) can restore immune regulation in patients with remitting-relapsing multiple sclerosis (RR-MS) // Final Programme and Abstracts. V World Immune Regulation Meeting. Davos, Switzerland. – 2011. P.67. 23 Условные сокращения: АПК - антиген-презентирующие клетки ИЛ - интерлейкин ИП - индекс пролиферации ИРИ - иммунологический регуляторный индекс МНК - мононуклеарные клетки МРТ - магнитно-резонансная томография РС - рассеянный склероз Т рег - регуляторные Т- клетки CD4+CD25+Foxp3+ ЦНС - центральная нервная система ЦТЛ - цитотоксические лимфоциты CFSE - сarboxyfluorescein succinimidyl ester (карбоксифлуоресцеин сукцинимидиловый эфир) EDSS - the Expanded Disability Status Scale (расширенная шкала инвалидизации) MLR - mixed lymphocyte reaction (смешанная культура лимфоцитов) TGFβ - transforming growth factor beta (трансформирующий фактора ростаβ) 24