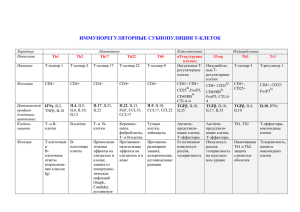
1.9 Реконституция Т-клеточного звена при трансплантации от
advertisement

ФГБУ «Гематологический научный центр» Министерства здравоохранения Российской Федерации На правах рукописи Дроков Михаил Юрьевич « Исследование экспрессии гранзима В в CD4+ лимфоцитах и Т-регуляторных клетках у пациентов после трансплантации аллогенного костного мозга» 14.01.21 - Гематология и переливание крови диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель Академик РАН, проф., Савченко В.Г. Москва, 2014 2 Оглавление Список используемых сокращений ............................................................................... 6 Введение ........................................................................................................................... 8 Актуальность темы.......................................................................................................... 8 Цель исследования .......................................................................................................... 9 Задачи исследования ....................................................................................................... 9 Научная новизна ............................................................................................................ 10 Практическая значимость работы ............................................................................... 10 Основные положения, выносимые на защиту ............................................................ 10 Глава 1: Обзор литературы ........................................................................................... 12 1. Реконституция Т-клеточного звена как ключевой фактор у пациентов с гемобластозами после трансплантации аллогенного костного мозга. .................... 12 1.2 История вопроса ...................................................................................................... 12 1.3 Иммунофенотипические характеристики Т клеточного звена иммунной системы........................................................................................................................... 14 1.4 Реконституция Т клеточного звена иммунной системы. .................................... 16 1.5 Реконституция CD8+ субпопуляций Т-лимфоцитов. .......................................... 21 1.6 Реконституция CD4+ субпопуляции Т-лимфоцитов. .......................................... 22 1.7 Реконституция Т-регуляторных клеток ................................................................ 23 1.8 Реконституция НК-клеток. ..................................................................................... 24 1.9 Реконституция Т-клеточного звена при трансплантации от родственного донора. ............................................................................................................................ 25 1.10 Реконституция Т-клеточного звена при трансплантации от неродственного донора. ............................................................................................................................ 26 1.11 Реконституция Т-клеточного звена при трансплантации костного мозга после Т-клеточной деплеции. ................................................................................................. 27 3 1.12 Реконституция Т-клеточного звена при трансплантации пуповинной крови 28 1.13 Толерантность при трансплантации аллогенного костного мозга и стволовых клеток крови................................................................................................................... 29 1.14 Реакция трансплантат против хозяина. ............................................................... 32 1.15 Реакция трансплантат против лейкоза. ............................................................... 33 1.16 Реконституция Т-клеточного звена и влияния трансфузии лимфоцитов донора на нее. ................................................................................................................ 33 1.17 Влияние кондиционирования и иммуносупрессивных агентов на реконституцию Т-клеточного звена. ........................................................................... 34 1.18 Подходы к ускорению Т-клеточной реконституции. ........................................ 36 1.19 Гранзим В ............................................................................................................... 38 Глава 2. Материалы и методы ...................................................................................... 41 2.1. Клиническая характеристика больных ................................................................ 41 2.2. Схемы предтрансплантационного кондиционирования, используемые у больных, включенных в исследование ....................................................................... 42 2.3 Схемы профилактики острой реакции трансплантат против хозяина (препараты, дозы, дни введения) ................................................................................. 44 2.4. Объем исследования и временной регламент ..................................................... 44 2.5 Проточная цитометрия ........................................................................................... 46 2.5.1 Пробоподготовка при определении уровня экспрессии внутриклеточного гранзима В и FoxP3 в различных субпопуляциях лимфоцитов ............................... 47 2.5.2 Определение доли и экспрессии внутриклеточного гранзима В в различных субпопуляциях лимфоцитов ......................................................................................... 50 2.5.3 Пробоподготовка при определении различных субпопуляций Т лимфоцитов с использованием метода «лизис без отмывки». ....................................................... 52 2.6 Статистический анализ данных ............................................................................. 54 Глава 3. Результаты исследования и обсуждение ...................................................... 55 4 3.1 Клинические результаты ........................................................................................ 55 3.2 Особенности оценки экспрессии гранзима В и его доли в популяции CD4+ лимфоцитов, а также субпопуляции Т-регуляторных CD4+CD25high клеток .......... 61 3.3 Характеристика интенсивности экспрессии гранзима В и его доли в CD4 + и CD4+CD25high клетках периферической крови у больных до проведения трансплантации костного мозга и в контрольной группе здоровых доноров. ....... 63 3.4 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high субпопуляциях лимфоцитов периферической крови у больных в зависимости от диагноза до проведения трансплантации костного мозга ............. 66 3.5 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках в популяциях периферической крови при реконституции донорской иммунной системы у больных с различными нозологиями после трансплантации аллогенного костного мозга. ......................... 69 3.6 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга от родственного и неродственного донора. ............................................................................................................................ 73 3.7 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга с кондиционированием в миелоаблативном режиме и режиме пониженной интенсивности. ......................... 77 3.8 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга с использованием циклофосфамида в качестве индуктора толерантности. ............................................................................ 81 3.9 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных, у которых диагностирована острой реакции трансплантат против хозяина. ............................ 82 3.10 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга с цитомегаловирусной инфекцией и без нее. ........... 89 5 3.11 Результаты исследования субпопуляций Т лимфоцитов у пациентов после трансплантации аллогенного костного мозга и введении мезенхимальных стромальных клеток в качестве профилактики острой реакции трансплантат против хозяина............................................................................................................... 90 3.12 Коэффициент соотношения CD4\CD8 клеток у пациентов после трансплантации аллогенного костного мозга до введения мезенхимальных стромальных клеток и в контрольной группе здоровых доноров. ........................... 95 Глава 4. Заключение ...................................................................................................... 96 Выводы: ........................................................................................................................ 100 Список литературы ..................................................................................................... 101 Приложение ................................................................................................................. 115 6 Список используемых сокращений FSC - прямое рассеяние света KIR – иммуноглобулиноподобный рецептор киллер-клетки RIC – режим кондиционирования пониженной интенсивности SSC - боковое рассеяние света Tcm - Центральные клетки памяти Tem - Эффекторные клетки памяти Th1 – Т хелперы первого типа Th2 - Т хелперы второго типа Алло-ТКМ – трансплантация аллогенного костного мозга АТГ – антитимоцитарный глобулин ДК - дендритные клетки ДНК - дезоксирибонуклеиновая кислота ИЛ – интерлейкин ИСТ – иммуносупрессивная терапия КМ - костный мозг ЛПЗ – лимфопролиферативное заболевание МАК – миелоаблативное кондиционирование МкАТ - моноклональные антитела МСК – мультипотентные мезенхимные стромальные клетки НК – натуральные киллеры ОЛ - острый лейкоз ОЛЛ - острый лимфобластный лейкоз ОМЛ - острый миелобластный лейкоз оРТПХ – острая реакция трансплантат против хозяина ПК - периферическая кровь РНК - рибонуклеиновая кислота РТПХ – реакция трансплантат против хозяина 7 СD - кластер дифференцировки ТКР – Т-клеточный рецептор Трег – Т-регуляторные клетки ХТ – химиотерапия ЦФ - циклофосфамид ЭДТА - этилендиаминтетрауксусная кислота 8 Введение Актуальность темы Трансплантация аллогенного костного мозга в настоящее время является единственным методом, позволяющим добиться биологического излечения у больных гемобластозами. Это достигается как с помощью миело- и немиелоаблативного воздействия на кроветворную ткань, так и с помощью иммунологических механизмов, прежде всего реакции трансплантат против лейкоза. Реконституция именно Т-клеточного звена иммунной системы определяет развитие иммунологической толерантности, реакции трансплантат против хозяина и реакции трансплантат против лейкоза. После идентификации маркеров Т-лимфоцитов были выполнены многочисленные исследования по оценке химеризма в отдельных популяциях Т- и В- клеток у реципиентов аллогенного костного мозга. Так по данным Veneri и соавт. [104] среди В- клеток раньше всего происходит реконституция популяции В1a- клеток. В нашей клинике было установлено, что восстановление лимфопоэза происходит постепенно и характеризуется длительной персистенцией клеток, принадлежащих реципиенту [119]. Так, в популяции Т-клеток на ранних сроках после трансплантации костного мозга (ТКМ) в большинстве случаев выявлен смешанный химеризм на +30 день после ТКМ. Лишь у 53% - CD3+ клетки были только донорского генотипа. Также Желновой и соавт. было показано, что быстрая реконституция лимфоцитов, принадлежащих донорскому генотипу, увеличивает вероятность развития острой РТПХ [119]. В случае же проведения трансплантации костного мозга от гаплоидентичного донора, по данным Luznik и соавт. именно динамика восстановления CD3+ клеток, а также их принадлежность к генотипу донора или реципиента, определяет частоту развития хронической РТПХ [51]. Реконституция же НК-клеток напрямую коррелирует с частотой развития острой РТПХ. В популяции Т-регуляторных клеток, являющихся ключевыми в индукции 9 поддержания толерантности и в сдерживании РТПХ по данным Noriega (устный доклад на 36th Annual Meeting of the European Group for Blood and Marrow Transplantation), лишь у 85% больных определяется полный донорский химеризм, и в среднем - к +38 дню после ТКМ. Учитывая важность не только проявлений РТПХ, но и процесса ее регуляции. В качестве объекта исследования был выбран гранзим В - фермент, с помощью которого Т-регуляторные клетки осуществляют контроль за клетками-эффекторами иммунного ответа. Публикуемые в литературе сведения позволяют говорить о Т-клеточном звене, как о ведущем в иммунной системе у пациентов с гемобластозами после трансплантации костного мозга Цель исследования Изучить интенсивность экспрессии гранзима В и долю гранзим Вположительных CD4+ лимфоцитов и Т-регуляторных (CD4+CD25high) клеток у больных после трансплантации аллогенного костного мозга. Задачи исследования Для достижения цели были поставлены следующие задачи: 1. Определить частоту развития оРТПХ у больных различными вариантами гемобластозов в зависимости от диагноза, фазы заболевания, режима кондиционирования, вида трансплантата (источник, донор) 2. Определить относительное количество CD4+ лимфоцитов и Т-регуляторных клеток (CD4+CD25high), экспрессирующих гранзим В, в периферической крови доноров и пациентов с гемобластозами до алло-ТКМ, в контрольные сроки после алло-ТКМ и в день развития оРТПХ 3. Определить интенсивность экспрессии внутриклеточного гранзима В в популяции CD4+ и Т-регуляторных клеток (CD4+CD25high) в 10 периферической крови доноров и пациентов с гемобластозами до аллоТКМ, в контрольные сроки после алло-ТКМ и в день развития оРТПХ 4. Проанализировать влияние вида трансплантата (источник, донор), схемы иммуносупрессивной терапии, а также других факторов до и после аллоТКМ на уровень экспрессии гранзима В в субпопуляции Т-регуляторных клеток (CD4+CD25high). 5. Изучить влияние экспрессии гранзима В в популяции CD4+ и Трегуляторных клеток (CD4+CD25high) на частоту развития острой реакции трансплантат против хозяина Научная новизна Впервые проведено исследование уровня гранзима В в популяциях CD4+ и CD4+CD25high лимфоцитов ПК у больных гемобластозами и у здоровых доноров. Выполнено исследование по определению динамики субпопуляций Т лимфоцитов после введения МСК с целью профилактики оРТПХ. Практическая значимость работы В результате данного исследования у больных после трансплантации аллогенного костного мозга была выявлена потенциальная значимость гранзима В как фактора прогноза развития оРТПХ. Эти данные будут учтены в разработке протоколов превентивной терапии оРТПХ. Основные положения, выносимые на защиту 1. У здоровых доноров и пациентов в полной ремиссии острого лейкоза процент гранзим В-положительных CD4+CD25high клеток выше, чем у пациентов находящихся вне ремиссии до алло-ТКМ. 2. Интенсивность иммуносупрессивной терапии после алло-ТКМ влияет на количество гранзим В-положительных CD4+CD25high клеток на +30 день 11 и гранзим В-положительных CD4+ клеток на +30 и +90 день после аллоТКМ: чем интенсивнее ИСТ, тем ниже содержание гранзима В. 3. На всех контрольных сроках при отсутствии оРТПХ количество экспрессирующих гранзим В клеток в популяции CD4+CD25high существенно выше их количества у больных в день развития оРТПХ и у тех, у кого впоследствии разовьется оРТПХ, что дает основания рассматривать исследуемый показатель и как маркер, и как предиктор оРТПХ . 4. Количество гранзима В в популяции CD4+CD25high в день констатации оРТПХ ниже, чем на любых контрольных сроках у пациентов без оРТПХ. 12 Глава 1: Обзор литературы 1. Реконституция Т-клеточного звена как ключевой фактор у пациентов с гемобластозами после трансплантации аллогенного костного мозга. 1.2 История вопроса До 1960 года сам тимус был органом с неизвестной функцией, а его связь с иммунитетом и лимфоцитами была не установлена. В 1960 году Жак Миллер, работая в больнице в Лондоне, как и многие в то время был заинтересован тем фактом, что некоторые вирусы, в том числе MoMuLV, могут вызывать лейкозы и лимфомы, при введении в новорожденных мышей. Как субстрат, исследователи рассматривали клетки, происходящие из тимуса, поэтому в исследование входили группы мышей, которым тимус был удален хирургически. Во время опытов практически все мыши с удаленным тимусом умерли от генерализованной инфекции. Опыты, повторенные на курицах Cooper с соавт., подтвердили роль тимуса как центрального звена иммунитета [17]. В 1980 году произошли дальнейшие шаги в понимании Т-клеточного иммунитета – Edwin et. al. [22] были определены специфические маркеры Тлимфоцитов CD4, CD8 и CD3. По мере дальнейших исследований было выяснено, что развитие иммунного ответа требует высокоорганизованной клеточной миграции по всему организму. В процесс ответа оказались вовлечены Т- и В-клетки, а также такие органы как тимус, костный мозг, представляющие первичные лимфоидные органы, селезенка, лимфатические узлы и бляшки Пейера, представляющие вторичные лимфоидные органы. Во время афферентной фазы иммунного ответа лимфатические узлы выполняют функции «главного места встреч», где происходят высоко динамичные процессы клеточного движения, позволяющие формировать ответ Т- 13 и В-клеткам, столкнувшимся с антигенпрезентирующими клетками, которые мигрировали с периферии. В эфферентной фазе иммунного ответа, активированные Т-клетки оставляют лимфатические узлы и мигрируют в периферические ткани. лимфатические узлы Миграция при Т-клеток афферентной через фазе эндотелий иммунного сосудов в ответа и в периферических тканях при эфферентной фазе регулируется селектинами, интегринами, и хемокинами. Кроме того, ретиноевая кислота, метаболит витамина А, способствует заселению Т-клеток в кишечник, в то время витамин D способствует хоумингу Т клеток в кожу. Описанные выше механизмы уже с участием Т- клеток донорского и хозяйского генотипа и обуславливают основные механизмы развития как реакции трансплантат против хозяина (РТПХ), так и реакции трансплантат против лейкоза (РТПЛ). Так что многие попытки поиска центрального регулирующего звена РТПХ и РТПЛ именно среди Т лимфоцитов вполне обоснованы. Один из важных компонентов Т-клеточной системы открытый в 1998 году Гранзим В – представляет собой сериновую протеазу, содержащуюся в гранулах Т-лимфоцитов и НК-клеток. Основная ее задача заключается в запуске процесса апоптоза в клетках-мишенях. В некоторых работах было показано что высокий уровень гранзима В в Тклетках связан с большей вовлеченностью органов и тканей в РТПХ. Так по данным Hodge et. al. [31] высокий уровень гранзима В наблюдается в них при РТПХ с поражением легких. В это же время благодаря исследованиям Sheng et. al. [88] на мышиных моделях стало понятно, что гранзим В участвует не только в эффекторном звене с участием Т-лимфоцитов, но также и в регуляторном, через которое и обусловлено модулирование как РТПХ, так и реакции трансплантат против лейкоза. 14 1.3 Иммунофенотипические характеристики Т клеточного звена иммунной системы. Т-клеточное звено иммунной системы в настоящее время представляет объект динамично развивающейся области исследования. Среди методов, используемых используют для характеристики многоцветную гетерогенной проточную популяции цитометрию, которая лимфоцитов, по данным литературы и таких баз данных как PubMed в настоящее время преобладает как метод оценки данной популяции клеток. Кроме того, сложность структуры CD3+ популяции Т-лимфоцитов , как в функциональном, так и в фенотипическом плане - делает многоцветную проточную цитометрию, начиная с 1980 года, необходимым и эффективным инструментом для исследователей. В настоящее время Т-клетки могут быть разделены на три основные группы в зависимости от их функциональных и фенотипических характеристик. Цитотоксические Тклетки, Т-хелперы (Th), Т-регуляторные клетки (Трег). Именно различия в экспрессии маркеров кластеров дифференцировки на поверхности клеточной мембраны, а также различия в секреции цитокинов позволяют разделить эти популяции. Например, CD8+ цитотоксические Т-клетки уничтожают инфицированные клетки-мишени с помощью перфорин-гранзимного механизма. Тогда как CD4+ - Т-хелперы (т. е. Th1, Th2, Th9, Th17, и TFH клетки) обладают маленькой цитотоксической активностью и в основном секретируют цитокины, которые действуют на другие клетки, такие как В-клетки, макрофаги, эозинофилы, нейтрофилы с целью элиминации патогена. Что касается Трегуляторных клеток, их функция заключается в подавлении Т-клеточного ответа с помощью нескольких механизмов. T-регуляторные клетки играют важную роль в поддержании иммунного гомеостаза [105], также их роль выявлена при многих аутоиммунных заболеваниях [105]. Например при IPEX синдроме, когда утрачивается функция T- регуляторных клеток, возникают аутоиммунные поражения как кожных покровов, так и эндокринных желез [105]. Для определения Т-регуляторных клеток проточная цитометрия не заменима. 15 Выделяют два основных класса CD4+ Т-регуляторных клеток (Трег): «натуральные» Трег (nТрег), которые иммунофенотипически характеризуются экспрессией CD25 на поверхности и внутриклеточной экспрессией FoxP3. Вторая субпопуляция - это индуцированные Т-регуляторные клетки (iТрег), в которых CD25 и FoxP3 появляются вследствие цитокиновой активации, а не в процессе созревания [105]. Эта субпопуляция Т-регуляторных клеток берет свое начало из тимуса, родоначальником ее выступают дифференцируются в CD25+/FoxP3+ CD4+ клетки [105]. Они под действием адекватной антигенной стимуляции и цитокинов, таких как TGF-β, ИЛ -10, и ИЛ-2 [105]. Также для данной популяции характерна так называемая пластичность – т.е. способность клеток к трансдифференцировке в Th1 и Th17 клетки. Что касается иммунофенотипического маркера окончательно идентифицирующего и определяющего Т-регуляторные клетки, то им является FoxP3. Однако в литературе, в частности Hansen et. al. [28] приводятся данные о небольших популяциях FoxP3 негативных Т-регуляторных клеток. Выявление FoxP3 в качестве маркера для Трег позволило выявить дополнительные маркеры, в том числе CD127, экспрессия которого на поверхности обратно пропорциональна внутриклеточной экспрессии FoxP3 [44] Помимо основных популяций использование антител к таким антигенам как CCR7, CD62L и/или CD69 могут дать важную информацию о потенциале клеток к заселению ниш и об их локализации в организме [76]. В настоящее время появляется также много работ о Т клетках памяти. Центральные клетки памяти (Tcm) и эффекторные клетки памяти (Tem) первоначально были выявлены на основании наличия или отсутствия непосредственно эффекторных функций, а также экспрессии рецепторов, которые позволяют клеткам мигрировать во вторичные лимфоидные органы, такие как лимфатические узлы и другие [81]. Так Tcm постоянно экспрессируют на своей поверхности CCR7 и CD62L - рецепторы, которые необходимы для прохождения клеток через вены с высоким эндотелием, 16 которые располагаются в лимфатических узлах. Эффекторные Т клетки памяти не экспрессируют CCR7, являются гетерогенными по экспрессии CD62L, а также имеют в своей цитоплазме большое количество перфорина, что и обеспечивает им более высокую цитотоксическую активность и функцию близкую к той, которую выполняют CD8+ клетки. 1.4 Реконституция Т клеточного звена иммунной системы. У всех пациентов с гемобластозами после трансплантации костного мозга или гемопоэтических клеток крови развивается глубокий иммунодефицит в том числе и клеточный, это происходит как вследствие кондиционирования, наличия донорских T лимфоцитов, инфузированных вместе с костномозговой или лейковзвесью, и неспособных выполнять свою функцию полноценно, а также использования иммуносупрессивных препаратов, направленных на предотвращение развития РТПХ. Восстановление компетентной иммунной системы после трансфузии клеточной взвеси является неотъемлемой частью успешной трансплантации аллогенного костного мозга. Без восстановления Т клеточного звена иммунной системы, реципиент подвержен высокому риску развития оппортунистических инфекций (вирусов, бактерий, грибов и простейших), рецидиву опухоли. В основном компетенция иммунной системы опосредуется через Т-лимфоциты, Влимфоциты и натуральные киллеры (НК). Несмотря на это разнообразие, именно антиген-специфичные Т-лимфоциты играют центральную роль в человеческом клеточном иммунитете, а именно в контроле ДНК- и РНК-вирусных инфекций, содействуют выработке специфических антител к бактериальным патогенам (в сочетании с В-клетками), контроле грибковых инфекций [29] Таким образом, именно развитие нормально лимфоцитов является функционирующих необходимостью для антиген-специфичных Т- реконституции компетентной иммунной системы у пациентов после трансплантации аллогенного костного мозга. Успешное приживление гемопоэтических общих лимфоидных 17 предшественников, ведет к развитию Т-и В-лимфоцитов и НК-клеток. Общие лимфоидные предшественники мигрируют в тимус где проходят нормальный для Т-лимфоцитов онтогенез, но только в случае нормально функционирующего тимуса. Экспериментальные данные показали, что начальное восстановление Тклеток после трансплантации происходит главным образом за счет экспансии зрелых Т-клеток донора, тимусзависимое восстановление происходит позднее. Включение тотального облучения тела в режим кондиционирования и развитие РТПХ, по данным Taub [98] нарушает процесс восстановления функции тимуса после трансплантации, а, учитывая тот факт, что функция тимуса с возрастом снижается, вышеперечисленные факты оказывают свое влияние преимущественно на реконституцию у взрослых пациентов, нежели детей. В тимусе общие лимфоидные предшественники проходят последовательную череду делений и дифференцировку под контролем как цитокинов, так и молекул, располагающихся на поверхности клеток стромы. Центральную роль в этом процессе играют молекулы Notch-1, а также цитокины, такие как ИЛ-7 и ИЛ-2 [8]. На этих ранних предшественниках выявляется высокая экспрессия рецепторов к ИЛ-7, однако такие маркеры как CD3, CD4 и CD8 не определяются. Первоначально, CD3 выявляется только в цитоплазме, а появление на поверхности клетки совпадает по времени с выявлением перестроенного Тклеточного рецептора (ТКР), как ТКР-αβ, так и ТКР-γδ. ТКР-αβ тимоциты первоначально начинают экспрессировать CD3 и ТКР, но не CD4 и CD8. Далее происходит экспансия Т-лимфоцитов со специфичностью к определенным пептидам, которые презентируются на главном комплексе гистосовместимости стромальных клеток тимуса. Происходит как положительная селекция, так и негативная селекция – т.е. центральная делеция аутореактивного клона. Во время негативной селекции клетки уже несут на своей поверхности CD4 и CD8 маркеры. Что касается отдельных популяций, то тимусзависимый путь Т-клеточного 18 восстановления является более важным для восстановления CD4+ клеток, чем для CD8+. [2] Таким образом, в случае наличия прижившегося общего лимфоидного предшественника и адекватно функционирующего тимуса, клетки с фенотипом CD3+/CD4- и CD3+/CD8- могут быть найдены в периферической крови примерно спустя 3 месяца после трансплантации гемопоэтических стволовых клеток крови, на этих сроках данные клетки уже могут подвергаться экспансии после адекватной стимуляции их TCR. Эти данные также совпадают со многими клиническими данными, в том числе и Thomas и соавт. [2], которые говорят о периоде до +100 дня, как о периоде, в котором пациент максимально подвержен инфекционным осложнениям как бактериальной, так и вирусной природы. Стоит отметить, что восстановление врожденного иммунитета - НК-клеток и интерферон (ИНФ)-продуцирующих клеток происходит в течение первого месяца после трансплантации. По данным Storek и соавт. [97] к факторам, которые могут препятствовать восстановлению Т клеточного звена относятся использование пуповинной крови, использование трансплантата от неродственного донора, трансплантаты, содержащие низкое число CD34+ и/или Т-клеток, пожилой возраст реципиента или донора, возникновение острой и/или хронической РТПХ, высокие дозы глюкокортикоидных гормонов. Все эти факторы могут привести к снижению массы тимуса, а также функциональному дефекту клеток стромы тимуса, а именно способности этих клеток продуцировать цитокины особенно ИЛ-7 и Kit-лиганд, то есть цитокины, которые необходимы для пролиферации и дифференцировки тимоцитов. Что касается пациентов после интенсивной химиотерапии, то по данным Mackall и соавт. [53] функция тимуса зависит от возраста, а, учитывая важность тимус-зависимого пути прежде всего для CD4+ лимфоцитов, число CD4+ Т-лимфоцитов у молодых пациентов после полихимиотерапии, больше чем у пожилых пациентов. Таким образом, исходя из множества фактов, было показано, что самой иммунокомпрометированной 19 группой являются пожилые пациенты после трансплантации аллогенного костного мозга, в программу кондиционирования у которых была включена как высокодозная химиотерапия, так и тотальное облучение тела, у которых имело место РТПХ. Такие пациенты имеют недостаточную функцию тимуса, чтобы обеспечить адекватную реконституцию Т клеточного звена и разнообразие репертуара Т клеточного рецептора. За исключением тех случаев, когда в качестве трансплантата используется трансплантат после Т клеточной деплеции, т.к. в норме как в лейко- так и костномозговой взвеси содержатся антигенспецифичные Т-лимфоциты, наивные Т-лимфоциты, и общие лимфоидные предшественники. Основываясь на исследованиях Mackall и соавт. [54] на животных, можно утверждать, что как антиген-специфичные, так и наивные Т-лимфоциты могут подвергаться выраженной экспансии под действием ИЛ-7. Таким образом, имеется шунтирующий путь реконституции, когда при недостаточной функции тимуса удается достичь нормальных параметров Т клеточного звена за счет экспансии донорских лимфоцитов. Несмотря на это, учитывая отсутствие тимусзависимого пути, репертуар ТКР чрезвычайно сужен. Таким образом восстановление Т клеточного звена происходит как через тимус-независимые механизмы - экспансию зрелой Т-клеточной популяции трансплантата, так и тимус-зависимые механизмы - со всеми этапами созревания. Время до восстановления варьируется для различных компонентов и функций Т клеточного звена и зависит от многих факторов. Так у пациентов после трансплантации аллогенного костного мозга от HLA-идентичного сиблинга, пролиферативный ответ на фитогемагглютинин достигал нормальных значений только через 4-6 месяцев, количество CD4+ клеток в периферической крови начинает достигать нормального диапазона спустя 7-9 месяцев [66] Реконституция Т клеточного звена происходит позже у пациентов, в качестве трансплантата у которых использовался костный мозг или стволовые клетки 20 крови после Т клеточной деплеции [2]. Также в некоторых работах показано, что восстановление CD4+ клеток происходит быстрее, в тех случаях, когда для трансплантации использовались мобилизованные гемопоэтические клетки, а не костный мозг[2] Несмотря на все вышеперечисленные данные как инфузированные Т клетки, так и общие лимфоидные предшественники не обладают способностью к самоподдержанию, что приводит к формированию пробелов в репертуаре ТКР. Это все делает невозможным ответ на некоторые патогены, особенно ярко это было показано в работе Patel и соавт. [71], в которой у больных с тяжелым комбинированным иммунодефицитом после трансплантации аллогенного костного мозга количество эписом c ТКР в Т клетках спустя 14 лет после трансплантации соответствовало уровню 80-летних здоровых доноров. В течение первых 3х месяцев после трансплантации костного мозга происходит селективная пролиферация Т-клеток по тимус-независимому пути причем происходит изменение репертуара Т клеточного рецептора, а именно, спектр перестройки ограничен и неустойчив. Причиной этого, вероятнее всего, служит массивное поступление антигенов из кишечника в кровоток в процессе кондиционирования, именно поэтому ограничение особенно выраженно у пациентов с РТПХ. Что касается НК-клеток, то они являются наиболее ранними из CD3лимфоидных клеток, наблюдаемых после трансплантации костного мозга. Их уровень достигает нормы в течение первых 3-х месяцев [74]. НК-клетки экспрессируют ингибирующие и активирующие KIR-рецепторы и CD94: NKG2 лектиноподобные рецепторы [27] Эта экспрессия предопределена генетически, и у здоровых доноров преобладает экспрессия KIR, в то время как после трансплантации аллогенного костного мозга у больных начинают экспрессироваться CD94. Затем происходит нормализация в экспрессии и KIRрецепторы начинают преобладать. Это происходит в течение 1-3 лет после трансплантации, в данном случае эти клетки повторяют естественный онтогенез. 21 1.5 Реконституция CD8+ субпопуляций Т-лимфоцитов. Первыми Т-клетками, из CD3+ положительных, которые появляются после трансплантации костного мозга как при использовании трансплантата с Тклеточной деплецией, так и без нее являются преимущественно CD8+ клетки, и они остаются доминирующей популяцией более чем в течение года. Также по данным Schroff и соавт. [85] CD8+ популяция появляется крайне рано и является особенно выраженной у пациентов с вирусными инфекциями, особенно цитомегаловирусной инфекцией (ЦМВ). Кроме того, популяция CD8+ клеток у пациентов после трансплантации костного мозга, может иметь аберрантный фенотип, который редко можно встретить у здоровых доноров, это также ведет к ослаблению функции Т-клеточного звена иммунной системы. Субпопуляция CD8+ клеток, а именно тех, которые экспрессируют CD57 по данным Wursch и соавт. [111] составляет до 75% всех CD8+ клеток особенно у ЦМВ-позитивных реципиентов в период реактивации вируса. У здоровых доноров уровень CD8+CD57+ Т-клеток составляет порядка 7%. Что касается функциональных особенностей, то CD8+CD57+ клетки подавляют Т-клеточную функцию нормальных Т-лимфоцитов и в тестах не отвечают на стимуляцию митогеном, однако по данным Autran [5] и Sadat-Sowti [80] способны опосредовать цитотоксичность. Анализ ТКР CD8+CD57+ субпопуляции показал ограниченный репертуар. Тем не менее, по данным Morley и соавт. [62] CD8+CD57+ Т-клетки и у нормальных доноров могут иметь олигоклональный репертуар, что может представлять собой нормальный ответ на какой-либо антиген. У ЦМВположительных реципиентов СD8+CD57+ Т-клетки преимущественно представлены ЦМВ-специфическими клетками, что было доказано путем клонирования и измерения продукции ИФН-а и ФНО в ответ на ЦМВ. По данным некоторых исследователей, в том числе Rowbottom [78] у пациентов после трансплантации аллогенного костного мозга с высоким процентом CD8+CD57+, 22 данная популяция отвечала экспансией в ответ на аутологичные ЦМВинфицированные фибробласты, однако процент ЦМВ-специфичных клеток был крайне мал, по сравнению с кровью пациентов с небольшой популяцией CD8+CD57 + Т-клеток. По всей вероятности, экспансия происходит в ответ на ЦМВ, но не понятно относится ли это к противовирусному ответу, либо к ЦМВопосредованной иммуносупрессии. Интересно, что Dolstra и соавт. [20] обнаружили более низкую частоту рецидивов у реципиентов костного мозга после Т-клеточной деплеции, с высоким уровнем CD8+CD57+ Т-клеток после трансплантации, что указывает на дополнительную роль этой субпопуляции в реакции трансплантат против лейкоза. Исследования Soiffer [76] у реципиентов костного мозга после Т-клеточной деплеции также подтвердили роль ЦМВ в экспансии CD3+CD57+ Т-клеток. Так количество CD3+CD57+ Т-клеток было нормальным на +100 день у пациентов, которые были ЦМВ- положительны во время трансплантации, причем уровень этой субпопуляции быстро вырос и остался на уровне выше нормального во всем посттрансплантационном периоде. У ЦМВ-негативных пациентов уровень CD3+CD57+ клеток рос постепенно и нормализовался к 6 месяцу после трансплантации. К другим проявлениям аберрантного фенотипа при реконституции Тклеточного звена после трансплантации костного мозга относится снижение уровня коэкспрессии CD28 и CD11b на CD8+ Т-клетках. Примерно 25-50% от нормальной популяции CD8+ клеток экспрессируют CD28) костимуляторную молекулу, а CD11b экспрессируют всего 50% СD8+ клеток. Однако у пациентов после аллогенной трансплантации CD8+ Т-клетки экспрессируют CD28 менее чем в 5% событий, при том, что уровень CD11b крайне высок, и нормализуется лишь к концу первого года. CD8 +CD11b+ отображает, прежде всего, супрессорную активность, в то время как CD28+ субпопуляция опосредует цитотоксичность. 1.6 Реконституция CD4+ субпопуляции Т-лимфоцитов. 23 Основные фенотипические аномалии, наблюдаемые в CD4+ популяции лимфоцитов после алло-ТКМ - это преобладание Т-клеток с фенотипом CD4+CD45RO+. Обычно CD45RO экспрессируют Т-клетки памяти после антигенной стимуляции и клональной экспансии [53]. Тем не менее, этот кластер дифференцировки не является специфическим для этих клеток. CD4+ Т-клетки, совместно коэкспрессирующие HLA-DR и CD38 также численно преобладают в раннем посттрансплантационном периоде. Что касается популяции CD45RА+ клеток, т.е. наивных CD4+ Т-клеток, то она остается сниженной в течение года после аллогенной трансплантации. Стоит отметить, что, прежде всего, такое низкое количество CD4+ Т-клеток, способствует возникновению оппортунистических инфекций [85]. CD134 (ОХ-40) является рецептором активации, который функционирует как костимуляторный рецептор CD4+ Т-клеток. CD134 экспрессируется в 1-8% CD4+ Т-клеток у здоровых доноров, однако экспрессия увеличивается в результате их активации. Lamb и соавт. [41] представил данные о том, что у пациентов после трансплантации аллогенного костного мозга без признаков РТПХ уровень CD4+CD134+ клеток возрастает до 40-50% от всех CD4+ клеток в течение первого месяца. Стоит отметить тот факт, что ни относительный процент, ни абсолютное число CD4+CD134+ клеток не смогло доказать свою роль в качестве предиктора РТПХ, однако снижение этой популяции выступило показателем ответа на терапию РТПХ. 1.7 Реконституция Т-регуляторных клеток Несмотря на тот факт, что Трег играют важную роль в поддержании толерантности после аллогенной трансплантации, данные литературы очень противоречивы. По данным Matsuoka и соавт. [58] Трег быстро пролиферируют и достигают нормального уровня к 9 месяцу после трансплантации, но уровень Трег впоследствии снижается у пациентов с длительной CD4+ лимфопенией, что 24 приводит к относительному дефициту Трег, и связано с высокой частотой РТПХ. Эти исследования показали, что CD4+ лимфопения является решающим фактором в гомеостазе Т-регуляторных клеток. По данным Xhaard и соавт [112] которые анализировали не только Трег но и их субпопуляции, показано, что их количество постепенно возрастает в течение 2х лет и лишь после этого периода достигает нормальных значений. Также было показано, что такие факторы как режим кондиционирования пониженной интенсивности, стволовые клетки крови в качестве трансплантата, а также возраст реципиента менее 25 лет были связаны с более быстрой способностью к восстановлению Трег. При оценке числа Трег по данным китайских авторов [113], была выявлена обратная корреляция между их количеством в трансплантате и тяжестью оРТПХ после алло-ТКМ. Еще одной особенностью Трег, отмеченной после трансплантации аллогенного костного мозга [55] явилась восприимчивость и повышенная чувствительность Т-регуляторных клеток к Fas-опосредованному апоптозу. Однако причина этого феномена выяснить в настоящее время не удалось. 1.8 Реконституция НК-клеток. Результаты нескольких детальных исследований НК-клеточного фенотипа после трансплантации показали некоторые особенности. Большинство НК-клеток у здоровых доноров являются CD3- , имеют низкий уровень экспрессии CD56 и высокий уровень CD16 (CD56dimCD16bright). Около 20% из этих клеток имеют низкую экспрессию CD8. По данным Robertson et.al [77] CD56dimCD16bright НК=клетки имеют самую высокую степень цитолитической активности. Приблизительно 2% от числа нормальных лимфоцитов экспрессируют высокие уровни CD56 (CD56bright) и низкую либо отсутствующую экспрессию CD16. Эти клетки имеют цитолитическую активность меньше чем CD56dimCD16bright, но являются наиболее чувствительными к экспансии в ответ на ИЛ-2. Около 35% реципиентов нативного аллогенного костного мозга в первые четыре месяца осуществляют свою реконституцию именно за счёт этой популяции - 25 CD56brightCD16-. Эти клетки не обладают адекватной цитолитической активностью, однако после инкубации с ИЛ-2 полностью ее восстанавливают. Shenoy и соавт. [89] представил данные, что уровень нормальных НК клеток, восстанавливался к первому месяцу, а затем падал к концу первого года после трансплантации, в это же время было отмечено снижение их цитолитической активности. Также стоит отметить, что при использовании периферических стволовых клеток крови и пуповинной крови, число НК-клеток также было резко снижено по сравнению с пациентами у которых в качестве трансплантата использовался нативный костный мозг. 1.9 Реконституция Т-клеточного звена при трансплантации от родственного донора. В течение первых 20 лет от момента введения в клиническую практику трансплантации, именно костный мозг от родственного донора использовался в качестве основного источника гемопоэтических стволовых клеток. Однако в последние 17 лет по данным Европейской ассоциации по трансплантации крови и костного мозга (EBMT) в качестве трансплантата все больше находят свое применение гемопоэтические стволовые клетки крови, полученные в результате мобилизации. Стоит отметить, что есть существенные отличия в реконституции Т клеточного звена иммунной системы у пациентов в качестве трансплантата у которых использовался костный мозг и стволовые клетки крови. По данным Linch и соавт. [43], а также в исследованиях Atkinson [4] была отмечена небольшая задержка в восстановлении CD4+ и CD8+ Т-лимфоцитов у реципиентов аллогенного костного мозга. По их данным количество CD8+ Т-лимфоцитов, восстанавливалось быстрее, чем число CD4+ лимфоцитов, в результате чего возникает инверсия CD4/CD8 соотношения, которое нормализуется лишь к 6-9 месяцу после трансплантации. В этих работах было показано, что количество CD8+ лимфоцитов увеличивается в основном за счет экспансии (пролиферации зрелых клеток), т.е. по тимус независимому пути, в то время как CD4+ клетки 26 восстанавливаются за счет созревания клеток-предшественников, т.е. тимусзависимо. Что до натуральных киллеров, то НК-клетки появляются в ранние сроки после трансплантации – в течение первого месяца, и являются доминирующей популяцией в это время. У реципиентов нативного костного мозга, по данным Welte и соавт. [108], ответ на митогены, такие как фитогемагглютинин начинает появляться через 2-3 месяца после трансплантации, однако пролиферативный ответ ограничен в связи с дефектом продукции ИЛ-2, который в такие ранние сроки адекватно не секретируется. При этом трансфузированные с костномозговой взвесью антиген-специфичные лимфоциты не детектируются до момента развития инфекции. Антиген-специфичные Тлимфоциты, направленные на инфекционные агенты, включая вирус простого герпеса, могут быть обнаружены, начиная со 2 месяца после трансплантации. После этого начинают детектироваться лимфоциты, специфичные к варицеллазостер вирус (ВЗВ), а затем и к цитомегаловирусу (ЦМВ) , это было показано еще в работах 1986 года Ljungman [46]. Реципиенты гемопоэтических стволовых клеток крови показывают более быстрое восстановление CD4 T-лимфоцитов, и, в отличие от реципиентов костного мозга, по данным Ottinger и соавт [68] донорские антиген-специфичные Т-лимфоциты могут быть выявлены после трансплантации без иммунизации или инфекции. Это объясняется тем фактом, что количество зрелых Т клеток в лейковзвеси превышает их число в костном мозге в 10-100 раз. Несмотря на это, а также несмотря на шунтирующие механизмы Т клеточной реконституции по данным Storek [96] достоверных различий в частоте инфекционных осложнений между реципиентами костного мозга и гемопоэтических клеток получено не было. Отрицательным моментом также является, выявленная Schmitz [84] и IBMTR, достоверное увеличение частоты хронической РТПХ при использовании стволовых клеток крови. 1.10 Реконституция Т-клеточного звена при трансплантации от неродственного донора. 27 Иммунофенотипическая реконституция Т-лимфоцитов у реципиентов неродственного костного мозга или стволовых гемопоэтических стволовых клеток крови более вариабельна. В качестве причины этого явления рассматривается более агрессивная иммуносупрессивная стратегия, чем у реципиентов родственного костного мозга. Наиболее тяжелый дефект у реципиентов неродственного костного мозга по данным Small [93] и Kapoor [37] наблюдается в гуморальном иммунитете и связан с дефектом формирования антикарбогидратных антител, т.е. антител к одному из бактериальных компонентов. Все остальные особенности в общем схожи с теми, которые наблюдаются при трансплантации от родственного донора. 1.11 Реконституция Т-клеточного звена при трансплантации костного мозга после Т-клеточной деплеции. Так как Т-лимфоциты играют центральную роль в развитии РТПХ, их удаление из трансплантата имеет свои клинические преимущества: прежде всего сокращение частоты и тяжести острой и хронической РТПХ. Однако имеются и минусы - в виде высокой частоты рецидивов. Также в отсутствие адекватного предтрансплантационного кондиционирования, T-клеточная деплеция ведет к увеличению риска отторжения трансплантата. Первоначально Т-клеточная деплеция использовалась при трансплантации от гаплоидентичного донора у детей с тяжелым комбинированным иммунодефицитом, что было описано Reisner [74] в своих работах. Успех Reisner [74] был развит Aversa [6] и Jakubowski [33], которые использовали опыт Т-клеточной деплеции при гаплоидентичной трансплантации при гемобластозах, а затем применили этот опыт при трансплантации от родственного и неродственного донора. Особенностью реконституции Т-клеточного звена при использовании трансплантата после Т-клеточной деплеции является полное отсутствие иммунофенотипически детектируемых лимфоцитов в первые месяцы после 28 трансплантации. В эти сроки пролиферативный ответ на митогены также не выявляется. Как уже было сказано ранее реконституция Т-лимфоцитов у детей происходит лучше за счет тимус-зависимого пути, в то время как Т-лимфоциты у взрослых восстанавливаются медленнее, что указывает на сниженную тимическую функцию взрослых реципиентов. При использовании трансплантата после Т-клеточной деплеции, реконституция может идти лишь за счет прижившихся гемопоэтических стволовых клеток. Таким образом, учитывая почти полное отсутствие в первые 3 месяца Т-клеточного иммунитета у таких пациентов, риск развития инфекционных осложнений заметно выше. Также, учитывая опять же все вышеперечисленное, по данным Wu [110] репертуар ТКР также достаточно скуден и неустойчив. 1.12 Реконституция Т-клеточного звена при трансплантации пуповинной крови Пуповинная кровь является самым необычным из источников стволовых клеток крови. Особенность трансплантата является то, что он не содержит антиген-специфических Т-лимфоцитов, так как плод существует в среде где нет антигенов, которые могут вызвать иммунный ответ. И, следовательно, при трансплантации пуповинной крови не происходит передачи антиген специфичных лимфоцитов, таким образом возникает ситуация сходная с трансплантации стволовых клеток крови после Т-клеточной деплеции, что связано с отсутствием зрелых Т-лимфоцитов в трансплантате. Иммунофенотипирование крови, проведенное Niehus [66] и Parkman [70] у пациентов после трансплантации пуповинной крови, показало, нормализацию количества НК-клеток в течение 3-6 месяцев, показатели CD3+ и CD4+ T-лимфоцитов восстанавливаются к 12 месяцам, после трансплантации пуповинной крови. Репертуар ТКР, учитывая сохранную тимическую функцию, антиген-специфических Т-лимфоцитов развивается в течение одного месяца после трансплантации пуповинной крови от неродственного донора, что по данным Cohen [16] вероятнее всего и служит 29 причиной отсутствия различий в частоте инфекционных осложнений в сравнении с другими источниками трансплантата. 1.13 Толерантность при трансплантации аллогенного костного мозга и стволовых клеток крови В настоящее время на фоне развития фармакологии и клинической медицины не составляет большого труда провести высокодозную химиотерапию с последующей трансплантацией аллогенного костного мозга. Однако те неконтролируемые механизмы, которые запускаются после инфузии аллогенного костного мозга, раз за разом приводят к неудачам, в виде реакции отторжения трансплантата или обратной ситуации в виде реакции трансплантат против хозяина. Под толерантностью во всех этих случаях принято понимать, то состояние при котором иммунная система не оказывает своего деструктивного действия на те органы и ткани которые экспрессируют «нужные антигены» (например, антигены принадлежащие хозяину или плоду при беременности), и полностью реагирует при проникновении чужеродных. Когда разговор заходит о толерантности при трансплантации аллогенного костного мозга у пациентов с гемобластозами, всегда есть два направления: это толерантность трансплантата в отношении хозяина и соответственно хозяина в отношении трансплантата. При нарушении толерантности в первом случае развивается РТПХ, а во втором констатируется не приживление трансплантата. Так как именно Т-клеточное звено участвует в индукции толерантности, стоит остановиться на трех пунктах, обеспечивающих этот механизм: деструкция аллореактивного клона, блок активного взаимодействия Т-клеточного звена, активная супрессия ответа. Во многих работах было показано, что при манипуляциях с трансплантатом, а именно при Т-клеточной деплеции, процент развития РТПХ значительно ниже чем при использовании нативного трансплантата, в это же время, частота 30 рецидивов заметно выше [86]. Ключевую роль при любом этапе Т-клеточного ответа играет Т клеточный рецептор. При помощи антител к участку бета-цепи Т клеточного рецептора, было показано, что именно интратимическое уничтожение лимфоцитов является центральным звеном толерантности, и именно оно также является ключевым при индукции толерантности при трансплантации аллогенного костного мозга. Несмотря на видимую полноту охвата, не все аутореактивные клоны могут быть уничтожены там. Вторым механизмом толерантности является так называемая функциональная инактивация, когда, встречаясь с антигеном, лимфоцит не может начать активно пролиферировать из-за невозможности получить адекватную костимуляцию [2]. В случае, когда речь идет о Т-клетках, анергия связана с недостаточной продукцией ИЛ-2, что, в свою очередь, породило множество протоколов, использующих экзогенный интерлейкин как средство активации Тклеточного звена в борьбе с опухолью – потенцирование РТПЛ. Именно такой протокол используется в клинике ФГБУ Гематологического научного центра Минздрава России. Третьим механизмом индукции толерантности выступает иммуносупрессия, которая практически всегда направлена именно на Т-клетки. Одним из самых важных аспектов иммуносупрессии является специфическая популяция клеток, которая может модулировать иммунный ответ – Т-регуляторные клетки. Для этой популяции клеток характерна постоянная экспрессия CD25 (IL-2 рецептор альфа цепи), FoxP3 (как регулирующего белка) и CTLA4 (ингибитор иммунного ответа) [95]. На мышиных моделях было показано, что при дефиците данной популяции мыши страдают от тяжелой аутоиммунной патологии [12]. Для своего развития данным клеткам необходимы стромальные тимические клетки, которые обеспечивают их позитивную селекцию, а также ИЛ-2, от которого они зависят, но который не способны продуцировать [100]. Т-регуляторные клетки (Трег) могут вырабатывать цитокины, которые могут непосредственно ингибировать 31 функцию эффекторных Т-клеток [105]. Трег клетки экспрессируют CD25, ИЛ-2 рецептор, и соответственно имеют способность конкурировать с эффекторными Т-клетками за ИЛ-2 в результате чего происходит цитокин-опосредованное лишение эффекторных клеток стимула к делению и Bim-опосредованный апоптоз [3]. Трег, экспрессирующие Foxp3 – клетки, которые могут функционировать как цитотоксические клетки и непосредственно осуществлять цитотоксическую функцию похожую на ту, которую выполняют CD8+ цитотоксические клетки [105]. В этом процессе участвует гранзим В, а основными целями являются клетки собственной иммунной системы [105]. Активированные Трег клетки также могут экспрессировать на своей поверхности молекулы (например, галектин-1), которые могут взаимодействовать с рецепторами на эффекторных T клетках, в результате чего останавливается их клеточный цикл [25]. Все эти механизмы могут быть также использованы Трег клетками для ингибирования функции антиген-презентирующих клеток или других клеток иммунной системы. Так СTLA-4 на поверхности клеток снижает экспрессию и предотвращает активацию CD80 и CD86, основных костимуляторных молекул на антигенпрезентирующих клетках. Точно так же LAG-3, который тоже экспрессируется на Трег и может взаимодействовать с MHC класса II на антиген-презентирующих клетках, вызывая ингибирование созревания [32]. Также в последнее время появились работы, описывающие вовлечение отдельных Т-клеток в так называемую инфекционную толерантность, а именно речь идет о межклеточной передаче – трогоцитозе – определенных молекул. В частности, HLA-G от антиген-презентирующих клеток может передаваться Тклеткам с целью переключения Т-клеток с цитотокстической активности на супрессорную [42] Подобная толерантность имеет место в системе мать-плод. Попытки фармакологического импульсного воздействия на Т-клеточное звено предпринимались давно. Описано использование метотрексата (цитостатический препарат из группы антиметаболитов, антагонистов фолиевой 32 кислоты) с целью индукции иммунологической толерантности к растворимому антигену. В начале 90х годов ХХ века японскими исследователями во главе с Maeda [56] была показана фармакологическая деструкция аллореактивного Тклона при введении циклофосфамида в опытах на мышах. В дальнейшем стратегия применения циклофосфамида как одного из средств индукции толерантности была продемонстрирована Luznik и соавт. [50], который использовал дозы 50 мг/кг при проведении трансплантации костного мозга от гаплоидентичного донора, наряду со стандартными иммуносупрессивными агентами. В дальнейшем это было использовано также в некоторых совместных работах китайских и американских ученых Fuch [49] и Huang [113]. 1.14 Реакция трансплантат против хозяина. Помимо того, что на скорость и глубину восстановления Т-клеточного звена влияет источник гемопоэтических стволовых клеток крови, также оказывает влияние и наличие или отсутствие острой и/или хронической РТПХ. Острая РТПХ по данным Noel и соавт. [67] имеет незначительное влияние на реконституцию Т-клеточного звена иммунной системы. Наличие острой РТПХ является одним из основных факторов развития хронической РТПХ, и как было показано Weinberg [107] оказывает негативное воздействие на функцию тимуса реципиента, даже в случае контроля над хронической РТПХ. По данным Deeg [19] хроническая РТПХ возникает чаще у пожилых реципиентов костного мозга. Вероятнее всего, это связано с компрометированной функцией тимуса и неадекватным уровнем Tрег, однако подтверждению этого в литературе найдено не было. У реципиентов с хронической РТПХ не выявляются Т-клетки тимического происхождения, что указывает на тот факт, что зрелые Т-лимфоциты являются результатом экспансии зрелых лимфоцитов. Отсутствие адекватной функции тимуса также может объяснить, почему реципиенты с хронической РТПХ демонстрируют низкое число CD4+ лимфоцитов. Также стоит отметить, что эскалация иммуносупрессивной терапии, применяемая для лечения острой и 33 хронической РТПХ, также препятствует адекватной реконституции как Т-, так и В –клеточного звена и увеличивает частоту вирусных, бактериальных и грибковых инфекций, которые связывают с РТПХ. 1.15 Реакция трансплантат против лейкоза. Наличие острой РТПХ у реципиентов костного мозга по данным многих авторов снижает риск рецидива основного заболевания, особенно, когда трансплантация выполняется пациентам с гемобластозами [18]. Этот эффект был назван реакцией трансплантат против лейкоза (РТПЛ). Возможность отделить реакцию трансплантат против лейкоза от реакции трансплантат против хозяина по заявлению Morris [63] является «святым Граалем» всей трансплантационной методики. Множество клеточных механизмов, участвуют в РТПЛ, и прежде всего они связаны с Т-клетками. На поверхности клетки многие антигены могут являться целями для донорских лимфоцитов так же, как и их отсутствие может приводить к рецидиву гемобластоза. Ruggeri [79] было отмечено что у реципиентов гаплоидентичных стволовых клеток крови при остром миелоидном лейкозе в случае несоответствия KIR рецепторов НК-клеток, частота рецидива была достоверно ниже. Реконституция компетентной иммунной системы, ее Тклеточного звена, после трансплантации пуповинной крови, измеренная Parkman [70] количеством герпес-специфичных Т-лимфоцитов, была связана со снижением частоты рецидива лейкоза. 1.16 Реконституция Т-клеточного звена и влияния трансфузии лимфоцитов донора на нее. На основании клинических наблюдений, того факта что РТПЛ эффект существует, в клиническую практику вошла трансфузия лимфоцитов донора. По данным Pérez-Martínez [72] который для трансплантации использовал выделенные с помощью магнитных частиц CD34+ клетки с последующей трансфузией лимфоцитов донора (ТЛД), у пациентов отмечено более быстрое восстановление 34 Т-клеточного звена. По данным Small и соавт. [93], который использовал трансфузию лимфоцитов донора для профилактики посттрансплантационных лимфопролиферативных заболеваний, отмечено увеличение скорости реконституции Т-клеточного звена. Однако даже небольшие дозы лимфоцитов вызывали достаточно тяжелую форму РТПХ у данных пациентов. 1.17 Влияние кондиционирования и иммуносупрессивных агентов на реконституцию Т-клеточного звена. Основная задача предтрансплантационного кондиционирования заключается в подготовке ниш, куда смогут «заселиться» донорские стволовые клетки, а также иммуносупрессия, которая будет препятствовать отторжению трансплантата. Данные цели достигаются с помощью комбинации агентов, которые соответственно имеют как иммуно- так и миелоаблативное воздействие. В последнее время по данным EBMT происходит увеличение трансплантаций, в которых используется режим пониженной интенсивности, т.е. тот режим, в котором ставка делается на иммуносупрессию, а не иммуноабляцию. Реконституция Т-клеточного звена после трансплантации аллогенного костного мозга с использованием режима пониженной интенсивности не отличается от той, что возникает при миелоаблативном режиме, однако может происходить по срокам раньше [2]. Вероятнее всего это связано с трансфузией донорских как антиген-специфичных, так и наивных Т-лимфоцитов, также использование менее токсичного режима кондиционирования позволяет достичь более адекватной функции тимуса для реконституции компетентной иммунной системы. Так же, как указывает Bahceci [7,35], вероятнее всего, это может быть связано с отсутствием метотрексата в схеме профилактики РТПХ (в большинстве протоколов он заменен на мофетил микофенолат). Как было кондиционирование сказано ранее, нарушает не только «естественный» предтрансплантационное характер восстановления популяции, попытки коррекции Т-клеточного звена иммунной системы как in 35 vitro, так и in vivo ведутся давно. Прежде всего стоит отметить попытку длительной коррекции иммунного Т клеточного ответа, например, применяемые в ФГБУ Гематологический научный центр Минздрава России и многих других клиниках кальценевриновые блокаторы. Одним из таких блокаторов является циклоспорин. Циклоспорин связывается с цитозольным белком циклофилином. Этот комплекс ингибирует кальциневрин, который при нормальных условиях отвечает за активацию транскрипции интерлейкина-2. Несмотря на преимущества блока продукции ИЛ-2 в краткосрочной перспективе, как в реакции как отторжения трансплантата, так и РТПХ, использование циклоспорина (как и любого другого агента, блокирующего производство ИЛ-2) снижает экспрессию Fas и FasL на поверхности антиапоптотической молекулы Т-клеток, FLIP, что а также в снижает долгосрочной экспрессию перспективе препятствует элиминации клона, агрессивного в отношении реципиента. Zeiser [117], приводит данные, которые указывают на снижение иммуносупрессивного действия CD4+CD25high лимфоцитов, при совместном их применении с циклоспорином для лечения острой РТПХ. Кроме того, Jenkins [34] выявил снижение уровня экспрессии основного комплекса гистосовместимости II класса в тимусе, что может снизить как позитивную, так и негативную селекцию, в результате чего нарушается как репертуар ТКР, так и центральная делеция аутореактивных клонов, по-видимому, участвующих в хронической РТПХ. Что касается других иммуносупрессивных препаратов, влияющих на реконституцию, то здесь стоит отметить метотрексат, используемый в течение уже 50 лет для профилактики острой РТПХ. Метотрексат опосредует своё действие путем разрушения Т-лимфоцитов. К сожалению, полученные при трансфузии костномозговой или лейковзвеси антиген-специфичные Т-лимфоциты также уничтожаются. Пожалуй, наиболее сильнодействующим на Т-клеточное звено препаратом является антитимоцитарный глобулин (АТГ). Внутривенное введение АТГ 36 приводит к разрушению клеток-мишеней как через систему комплемента, так и за счет иммуноглобулин-зависимой клеточной цитотоксичности [61]. Введение АТГ по данным Witherspoon и соавт. [109] уменьшает первичный иммунный ответ на антигены, даже если у реципиента не развивается хроническая РТПХ. По данным Small [94] взрослые реципиенты трансплантата после Т-клеточной деплеции, которые получали антитимоцитарный глобулин (АТГ) и метилпреднизолон несмотря на быстрое восстановление нейтрофилов, имели задержку в реконституции Т-клеточного звена, по сравнению с реципиентами, которые не получали данные препараты. Похожие результаты были получены Kook [40] у детей также после трансплантации костного мозга, где реконституция Т-и Вклеточного звена задерживалась у больных, получавших АТГ. Глюкокортикоиды в течение уже многих лет остаются терапией первой линии в лечении острой и хронической РТПХ [36]. Глюкокортикостероиды вызывают массивную гибель лимфоцитов. Кроме того, они по данным Ozdemir [69] обладают избирательным действием в отношении ФНО-продуцирующих CD8+ антиген-специфических Т-лимфоцитов Таким образом, стероиды могут оказывать выраженное влияние на реконституцию Т-клеточного звена иммунной системы, что чаще всего проявляется в увеличении частоты грибковых и вирусных инфекций, что объясняет более высокую летальность у таких пациентов [2]. 1.18 Подходы к ускорению Т-клеточной реконституции. Как Г-КСФ, так и ГМ-КСФ широко используются у пациентов после трансплантации аллогенного костного мозга в период нейтропении, цель этого заключается в снижение койко-дня, уменьшения частоты инфекций. Приживление гранулоцитарного ростка при введении этих цитокинов происходит в среднем на 2-4 дня раньше, что приводит к уменьшению ранних инфекционных проявлений. Тем не менее, существенно изменить ситуацию не удалось: эти эффекты не оказали влияние на долгосрочные результаты и лишь увеличили 37 стоимость и без того дорогой процедуры – трансплантации. Более того, Г-КСФ, по крайней мере, трансплантатов от в условиях использования гаплоидентичного донора CD34+ может селектированных снижать скорость восстановления CD4+ клеток. Volpi и соавт. [106] описывает снижение числа Th2индуцирующих дендритных клеток, которые не способны производить ИЛ-12, а также увеличение числа Th2 клеток, продуцирующих высокий уровень IL-4 и IL10, у больных, получавших Г-КСФ с целью ускорения приживления гранулоцитарного ростка. В этом исследовании у пациентов, которые не получали Г-КСФ, не было достоверных различий в скорости приживления нейтрофилов, однако отмечалось более быстрое восстановление CD4+ Т-клеток, принадлежащих к классу Th1. Что касается влияния на НК-клетки, то по данным Klingemann [39] использование ГМ-КСФ позволяет ускорить восстановление числа НК-клеток. Использования экзогенного ИЛ-2, то его применение может быть оправдано в связи с тем, что он является фактором роста Т-клеток, а его синтез в ранние сроки резко угнетен у всех реципиентов костного мозга. Основной проблемой в его клиническом применении заключается в том, что после этого увеличивается риск развития острой РТПХ. Несмотря на все положительные моменты, эффекты ИЛ-2 очень кратковременны и достаточно быстро исчезают при прекращении введения. Другой цитокин ИЛ-7 представляет собой белок, производимый клетками стромы, и оказывает чрезвычайно большое влияние на лимфопоэз. В нескольких работах с использованием ИЛ-7 на мышах в начале 90х, была показана его эффективность. Результаты были обнадеживающие, однако по данным Sinha и соавт. [92] проведенное на тех же мышах, отмечалось достоверное увеличение частоты РТПХ, что не позволяет применять ИЛ-7, за исключением тех случаев, когда речь идет о трансплантации с использованием трансплантата после Тклеточной деплеции. 38 Доклиническая работа проводится также в области использования нейрогормонов. Среди этих гормонов – соматотропин и инсулин-подобный фактор роста-1. привлекательным нейроэндокринные Применение отчасти гормоны из-за нейроэндокринных отсутствия обладают гормонов токсичности. плейотропным является Экзогенные воздействием на микроокружение тимуса, в том числе увеличивают экспрессию цитокинов и гормонов. Их применение усиливает пролиферацию эпителиальных клеток тимуса и экспансию тимоцитов [83]. Так инъекции соматотропина в стареющих мышей увеличивают общее число тимоцитов и процент циркулирующих CD3+ Тклеток, ответ тимоцитов на митоген и увеличивает продукцию ИЛ-6. Также Savino [83] было показано, что соматотропин стимулирует внутритимусную Тклеточную миграцию, а в мышиных моделях, используемых Tian и соавт.. [100], при введении соматотропина было отмечено увеличение скорости тимусзависимой реконституции. 1.19 Гранзим В В 1987 году группа по руководством Tschopp [57] опубликовала данные о семействе сериновых протеаз, найденных в цитолитических гранул цитотоксических Т-лимфоцитов. Ученые смогли верифицировать восемь протеаз из этого семейства белков, исследовать их субстраты, а также определить аминокислотную последовательность. Два белка позже были получены в лаборатории Bleackley [47] и были названы гранзимами. На тот моментя было принятым считать, что белок перфорин (цитолизин) является единственным медиатором уничтожения клеток-мишеней. Поэтэому открытие гранзимов привело к более глубокому пониманию феномена клеточной цитотоксичности. Гранзим В (Гранзим 2, сериновая протеаза- В, Цитотоксическая клеточная протеаза-1)[ 102] является одной из сериновых протеаз, которая располагается в гранулах цитотоксических Т-клеток и НК-клеток. Намного более низкие уровни найдены в моноцитах, покоящихся Т-клетках, В-клетках, активированных 39 гранулоцитах, и активированных моноцитах. [75] Гранзим имеет решающее значение для быстрой индукции смерти клеток-мишеней путем апоптоза, индуцированного взаимодействием с цитотоксическими Т-клетками. Ген, кодирующий гранзим В как у мышей, так и людей, находится на 14 хромосоме. Он входит в состав «кластера», наряду с этим кодирующего гранзим Н, катепсин G, и химазу-1 тучных клеток. У мышей данный «кластер» содержит гены, кодирующие гранзимы B, C, F, N, G, D, E, катепсин G, химазу-1 тучных клеток. Первоначальные исследования гранзима В показали, что он обладает способностью к лизису клеток in vitro, способен фрагментировать ДНК и изменять конденсацию хроматина [30, 65, 90 ] Последующие эксперименты показали, что очищенный гранзим В вместе с перфорином индуцирует в клетках многие классические черты апоптоза, такие как высвобождение цитохрома С, генерацию свободных радикалов, повышает проницаемость мембраны для витальных красителей (например, трепановый синий). Ключевой особенностью гранзима В, которая и привела к его открытию, явилась его способность расщеплять аспарагиновую кислоту. Эта специфичность к аспарагиновой кислоте является уникальной среди эукариотических сериновых протеаз. Рецептор к гранзиму В был идентифицирован Motyka и соавт. [64], как манноза-6-фосфат-рецептор, который идентичен рецептору инсулин-подобному фактору роста -2. Ингибирование взаимодействия гранзима В и этого рецептора предотвращает эндоцитоз, а соответственно и индукцию апоптоза. Гранзим В протеолитически активирует несколько каспаз, участвующих в апоптозе, включая каспазу-3 и каспазу-7 [14] Активация предшественника каспазы-7 идет посредством промежуточной активации каспазы-3, которая удаляет пропептид каспазы-7, что ведет к ее активации [116] Также гранзим может влиять на другие каспазы напрямую. Barry и соавт [9] показали, что 40 гранзим непосредственно расщепляет проапоптотический белок BID, минуя необходимость активации каспазы-8. Adrain и соавт. [1] показали, что гранзим В повреждает цитоскелет путем отщепления С-конца хвост альфа-тубулина, что в свою очередь повышает полимеризацию микротрубочек. Loeb и соавт [48] также показали, что гранзим В воздействует на белки Notch-1 и FGFR1, которые отвечают за рост и дифференцировку клеток и чье нарушение функции ведет к апоптозу. Что касается клинического значения, то есть много исследований, показывающих участие гранзима В в развитии диабета первого типа. Так, было доказано, что деструкция бета-островков поджелудочной железы, синтезирующих инсулин, осуществляется за счет гранзим В-зависимых механизмов, что приводит к дефициту этого гормона. (Thomas HE, Trapani JA, Kay TW. The role of perforin and granzymes in diabetes. Cell Death Differ. 2010 Apr;17(4):577-85). Также имеются сообщения о корреляции между количеством CD8+ лимфоцитов, экспрессирующих гранзим В, и активностью системной красной волчанки (Blanco P, Pitard V, Viallard JF, Taupin JL, Pellegrin JL, Moreau JF.Increase in activated CD8+ T lymphocytes expressing perforin and granzyme B correlates with disease activity in patients with systemic lupus erythematosus.Arthritis Rheum. 2005 Jan;52(1):201-11.) Однако в литературе нам не встретилось ни одного описания исследования уровня внутриклеточного гранзима В на разных этапах после трансплантации аллогенного костного мозга у больных гемобластозами. Также, несмотря на значительное количество работ по исследованию реконституции Т-клеточного звена, у пациентов после инфузии МСК с целью профилактики оРТПХ такие исследования не проводились. Комплекс перечисленных вопросов и определил выбор тематики данной работы. 41 Глава 2. Материалы и методы 2.1. Клиническая характеристика больных В исследование (состоящее из 2х частей) включено 30 больных с диагнозами острый лейкоз, миелодиспластический синдром, хронический миеломоноцитарный лейкоз, лимфома, находившиеся в отделении химиотерапии гемобластозов и трансплантации костного мозга ФГБУ ГНЦ МЗ РФ (рук.отдела д.м.н. Паровичникова Е.Н.) за период с сентября 2012 года по апрель 2014 года. Трансплантация аллогенного костного мозга была выполнена от родственного или неродственного HLA-совместимого или частично совместимого донора. Всем больным осуществлялось подробное предтрансплантационное обследование. Для подтверждения ремиссии или её отсутствия в момент поступления пациента в отделение всем включенным в исследование больным выполнялось морфологическое (клиническая лаборатория, зав. лаб. к.м.н. Двирнык В.Н.), при наличии хромосомных аберраций - цитогенетическое (лаборатория кариологии, зав. лаб. к.м.н. Обухова Т.Н.) исследование костного мозга. Также материал направлялся в лабораторию молекулярной гематологии для последующего выявления молекулярной метки с целью мониторинга химеризма после трансплантации аллогенного костного мозга (лаборатория молекулярной гематологии, зав. лаб. д.б.н. Судариков А.Б.). У 13 больных был диагностирован ОМЛ (мужчин – 6, женщин – 7, возраст от 22 до 60 лет (медиана – 42 года)). У 12 больных – ОЛЛ (мужчин – 6, женщин – 6, возраст от 18 до 58 лет (медиана – 27 лет)). Также был включен 1 пациент с ХММЛ, 2 пациента с 42 МДС и 2 пациента с лимфомами (ALK+ Т лимфома и Т/НК-лейкоз лимфома). Медиана возраста во всей исследуемой группе составила 39 лет (от 18 до 60 лет). Из 30 больных 5 пациентов находились в прогрессии заболевания. Пациенткам с МДС (n=1) и ХММЛ (n=1) трансплантация была выполнена в качестве первой линии терапии. Остальные 23 пациента на момент начала предтрансплантационного кондиционирования находились в ремиссии основного заболевания. Основные показатели первичного обследования всех включенных в исследование больных представлены в таблице 1. Таблица 1. Клинико-диагностическая характеристика пациентов Время до Диагноз n м/ж Возраст, Me Ремиссия Прогрессия ТКМ (Ме), мес ОМЛ 13 6/7 42 (от 22 до 60) 9 4 12,9 ОЛЛ 12 6/6 27 (от 18 до 58) 11 1 10,9 ХММЛ 1 0/1 27 - - 0 МДС 2 0/2 40 (от 48 до 55) 1 - 8,4 Лимфомы 2 2/0 21.5 (от 20 до 22) 2 - 34,5 В контрольную группу включено 8 здоровых доноров.3 мужчин 5 женщин. Средний возраст 28,13±2,35(20-38). 2.2. Схемы предтрансплантационного кондиционирования, используемые у больных, включенных в исследование Всем исследуемым больным проводили предтрансплантационное кондиционирование по стандартным программам. У 10 больных был использован миелоаблативный режим (9 пациентам проведено кондиционирование по схеме 43 «бусульфан+циклофосфан» и 1 пациенту по схеме «тиотепа+флюдарабин+кармустин»). Из 9 больных кондиционирование по программе «бусульфан+циклофосфан» было проведено 1 пациенту с ОМЛ, 7 пациентам с ОЛЛ и 1 пациенту с лимфомой. Остальным 20 пациентам по той или иной причине были выбраны режимы пониженной интенсивности. Предтрансплантационное кондиционирование «флюдарабин+бусульфан» выполнили 9 пациентам с ОМЛ. 3 пациентам с ОМЛ выполнили кондиционирование по схеме «FLAMSA модифицированная». 3 больным с ОЛЛ предтрансплантационное кондиционирование проводилось по схеме «флюдарабин+бусульфан», 1 пациенту по схеме «флюдарабин+мелфалан» и 1 пациенту по схеме «треосульфан+циклофосфан». Пациенткам с МДС кондиционирование проводилось по схеме «флюдарабин+бусульфан». Схемы предтрансплантационного приложение 1. Всем больным кондиционирования до начала представлены в предтрансплантационного кондиционирования также выполняли диагностическую люмбальную пункцию с введением метотрексата (15мг) и дексаметазона (4мг). После завершения кондиционирования всем пациентам была выполнена трансфузия стволовых гемопоэтических клеток. В 26 случаях трансплантация выполнялась от неродственного и в 4 случаях от родственного донора. Трансфузия костного мозга была выполнена 6 пациентам (4 от родственного HLA идентичного донора, 2 от неродственного HLA идентичного донора). Медиана клеточности трансплантата составила 5,1*108/кг миелокариоцитов. 24 пациентам выполнена трансфузия гемопоэтических стволовых клеток крови (22 от неродственного донора, 2 от неродственного HLA идентичного донора). Медиана клеточности трансплантата в этом случае составила 5,6*106/кг CD34+ клеток. Схемы предтрансплантационного кондиционирования подробно описаны в приложении 1. 44 2.3 Схемы профилактики острой реакции трансплантат против хозяина (препараты, дозы, дни введения) 26 исследуемым больным (23 после трансплантации от неродственного донора, 3 после трансплантации от родственного донора) профилактика острой реакции трансплантат против хозяина проводилась по стандартным схемам. 12 пациентов получали трехкомпонентную схему (АТГ+ЦСА+ММФ). 5 из 12 получили также профилактику МСК в дозе 1*106/кг на момент восстановления показателей лейкоцитов. 11 пациентов получали четырехкомпонентную схему (АТГ+ЦСА+ММФ+МТХ). 5 из них так же получили профилактику МСК в дозе 1*106/кг на момент восстановления. 3 пациентам, учитывая трансплантацию от родственного донора, проводилась иммуносупрессивная терапия только ЦСА и МТХ. Четверым (3 после трансплантации от неродственного донора, 1 после трансплантации от родственного донора) пациентам проводилась иммуносупрессивная терапия с использованием циклофосфамида на +3, +4 день и МСК на момент восстановления. Также 3 из 4 человек получали АТГ в суммарной дозе 40 мг/кг во время кондиционирования. 4-му пациенту в режим профилактики АТГ не было включено, учитывая трансплантацию от родственного донора, Основные режимы профилактики острой реакции трансплантат против хозяина представлены в приложение 2. 2.4. Объем исследования и временной регламент В первой части исследования определяли экспрессию гранзима В (Granzyme B) в субпопуляциях Т лимфоцитов (CD4+ клетках, CD4+CD25high Т-регуляторных клетках) ПК у больных после трансплантации аллогенного костного мозга. Экспрессия маркеров в ПК также была определена у здоровых доноров контрольной группы. 45 Во второй части работы определяли динамику субпопуляций Т-регуляторных клеток, а также других субпопуляций Т лимфоцитов (Т хелперы, Т цитотоксические клетки) на разных сроках после введения мезенхимальных стромальных клеток с целью профилактики острой реакции трансплантат против хозяина в ПК у больных после трансплантации аллогенного костного мозга. Динамика в данном случае оценивалась как в относительных (по отношению к CD4+ популяции), так и в абсолютных значениях. Таблица 2. Алгоритм исследования экспрессии маркеров у больного после трансплантации аллогенного костного мозга Популяция Белок Клеток День исследования До 0 30 60 90 День развития РТПХ CD4+CD25high Granzyme + + + + + + + + + + + B CD4+ Granzyme + B Маркеры и сроки их определения после трансплантации у пациентов после трансплантации аллогенного костного мозга представлены в таблице 2 и 3. Таблица 3. Алгоритм исследования экспрессии маркеров у больного после трансплантации аллогенного костного мозга и введения мезенхимальных стромальных клеток. Популяция клеток Дни после мезенхимальных клеток День исследования инфузии 0 +1 +3 +7 +14 46 СD4+CD25high + + + + + CD45+CD3+CD4+ + + + + + CD45+CD3+CD8+ + + + + + Образцы ПК больных после трансплантации аллогенного костного мозга исследовали до начала кондиционирования и в контрольные сроки после трансплантации. У двух больных экспрессию маркеров исследовали только до +60 дня так они умерли от токсических осложнений и острой РТПХ, соответственно. 2.5 Проточная цитометрия Для определения экспрессии внутриклеточного гранзима В в различных субпопуляциях лимфоцитов у исследуемых больных применяли метод проточной цитометрии. Исследование выполняли в лаборатории иммунофенотипирования костного мозга ФГБУ ГНЦ МЗ России (зав. лаборатории к.м.н. Гальцева И.В.) на проточном цитометре FACS Canto II, Beckton Dikinson. Материалом для иммунофенотипического исследования служили образцы ПК больных, взятые до алло-ТКМ и в различные контрольные сроки после нее, а также в момент развития оРТПХ и начала иммуносупрессивной терапии. Для определения экспрессии исследуемых белков применяли панель моноклональных антител (мкАТ), конъюгированных одним из 6 флюорохромов: FITC, с max эмиссией при λ=525 нм, фикоэритрин (РЕ), с max эмиссией при λ=575 нм, PerCP, с max эмиссией при λ=660 нм PE-Cy7, с max эмиссией при λ=750 нм, APC-Cy7, с max эмиссией при λ=785 нм, PerCP-Cy5.5, с max эмиссией при λ=695 нм. Характеристика мкАТ подробно представлена в таблице 4. Таблица 4. Характеристики используемых моноклональных антител Препараты Клон CD Класс Флюорохром Производи 47 мкАТ принадлежнос Ig тель ть Anti-CD4 RPA-T4 Anti-CD25 G1 APC-Cy7 BD M-A251 CD25 G1 APC BD GB11 Granzyme B G1 PE BD Anti-CD3 SK7 CD3 G1 FITC BD Anti-CD45 2D1 CD45 G1 PerCP-Cy5.5 BD Anti-CD4 SK3 CD4 G1 PE-Cy7 BD Anti-CD8 SK1 CD8 G1 APC-Cy7 BD Anti-CD4 SK3 CD4 G1 PE BD Anti-Granzyme B CD4 2.5.1 Пробоподготовка при определении уровня экспрессии внутриклеточного гранзима В и FoxP3 в различных субпопуляциях лимфоцитов Пробоподготовка для исследования крови с использованием внутриклеточного окрашивания (исследование гранзима В в первой части работы) и исследования только поверхностных антигенов (исследование динамики субпопуляций Т-регуляторных клеток, а также других субпопуляций Т лимфоцитов , которое проводилось во второй части работы) различалась. В первой части работы, учитывался тот факт, что пациенты в ранние сроки после трансплантации находятся в цитопении, в том числе и лимфопении, а также тот факт, что для статистической достоверности качественной оценки субпопуляции Т лимфоцитов (определения содержания гранзима В) требуется просчет достаточно большого числа событий. Перед проведением окраски мкАТ, 48 после забора венозной крови в транспортную пробирку с ЭДТА (для предотвращения свертывания) в объеме 5 мл, из данного объема крови методом разделения клеток в градиенте плотности, согласно протоколу Miltenyi Biotec выделяли фракцию мононуклеарных клеток. Для этого объем крови доводили до 10 мл при помощи изотонического солевого фосфатного буфера (PBS, Sigma Aldrich). Далее в пробирку объемом 15 мл и содержащую 4 мл раствора фиколла (плотностью 1,077 г/см3), постепенно наслаивали разведенную суспензию клеток. После чего центрифугировали в течение 35 минут при 400g при комнатной температуре. Полученное мононуклеарное кольцо, содержащее фракцию мононуклеарных клеток, осторожно переносили в чистую 15 мл пробирку и доводили объем с помощью PBS до 10 мл. Клетки перемешивали и затем центрифугировали в течение 30 минут при 300g. Надосадочную жидкость удаляли. Клетки ресуспендировали в 600 мкл PBS. Далее проводили окраску клеточной суспензии с помощью мкАТ по стандартному протоколу фирмы BD, поставляемому с раствором для внутриклеточного окрашивания (Cytofix/Cytoperm, BD, USA). Учитывая выделение клеток на градиенте плотности дополнительный лизис эритроцитов не проводили. Для определения экспрессии поверхностных антигенов (CD4, CD25) по 150 мкл клеточной взвеси распределяли в пробирки (соответственно количеству комбинаций антител), далее добавляли в требуемом объеме мкАТ. Также с целью определения аутофлюоресценции в каждое исследование включали неокрашенный контроль, который проходил все этапы пробоподготовки. Учитывая крайне малое число Fc рецепторов на поверхности лимфоцитов, а также использование градиента сывороточный альбумин плотности и растворов изотипический контроль содержащих для бычий определения неспецифичного связывания антител не ставился. Далее при +4ºС в темноте происходила инкубация в течение 25 минут. Спустя 25 минут после инкубации клеточная взвесь дважды отмывалась: к клеточной взвеси добавлялся PBS в объеме 1 мл. Взвесь ресуспендировалась и 49 осаждалась центрифугированием в течение 3,5 минут при 450g. Супернатант удалялся. После этого для окрашивания внутриклеточных антигенов (Granzyme B) к окрашенным поверхностными мкАТ клеткам добавляли 250 мкл раствора Cytofix/Cytoperm (Beckton Dikinson) и инкубировали в течение 20 минут при температуре +4ºС. После этого пробы дважды отмывали раствором Perm/wash (BECKTON DIKINSON): к клеточной взвеси был добавлен Perm/wash (Beckton Dikinson) в объеме 1 мл. Взвесь ресуспендировали, осаждали центрифугированием в течение 3,5 минут при 450g. Супернатант удаляли. Далее в пробирки добавляли мкАТ к внутриклеточным белкам Granzyme B. После инкубации при +4 ºС в течение 35 минут, пробы дважды отмывали раствором Perm/wash (Beckton Dikinson): к клеточной взвеси добавлляли Perm/wash (Beckton Dikinson) в объеме 1 мл. Взвесь ресуспендировали и осаждали центрифугированием в течение 3,5 минут при 450g. Супернатант удалляли. Далее клетки анализировали на проточном цитометре. Методика определения популяций CD4+ лимфоцитов отображена на рисунке 1. Для определения фракции CD4+ в пуле мононуклеарных клеток ПК использовались мкАТ для поверхностного антигена CD4. Для определения фракции CD4+/CD25high в пуле мононуклеарных клеток ПК использовались мкАТ для поверхностных антигенов CD4 и CD25. Также в качестве внутреннего негативного контроля выступала CD4- популяция (рисунок 2А). Она была использована с целью отделить CD25high популяцию CD4+ клеток. Стратегия гейтирования была описана ранее Clark и соавт [15] и была следующей: сначала фракцию CD4+ клеток выделяли на точечной диаграмме SSC/CD4-APC, затем выставляли гейт на точечной диаграмме FSC/SSC для исключения клеточного дебриса и более четкой характеристики CD4+ - лимфоцитов. 50 2.5.2 Определение доли и экспрессии внутриклеточного гранзима В в различных субпопуляциях лимфоцитов В нашем исследовании оценку экспрессии гранзима В после алло-ТКМ проводили на CD4+ и CD4+CD25high клетках. При анализе точечных диаграмм группу событий, экспрессирующих специфический поверхностный (CD4+ либо CD4+CD25high) антиген, изолировали с помощью инструмента выделения области (gate), как описано выше. Долю гранзима В позитивных событий определяли с использованием внутреннего позитивного контроля – популяции CD4-негативных клеток, то есть тех клеток которые, учитывая вхождение в них CD8+ клеток заведомо несут гранзим В (рисунок 2В). А B Рис. 1. Примеры точечных графиков при исследовании ПК методом проточной цитометрии. 1А. Расположение CD4+ лимфоцитов (выделено многоугольной рамкой) в зависимости от сигналов бокового (SSC) и прямого (FSC) светорассеивания. 1В. Распределение клеток, окрашенных мкАТ CD4-APC-Cy7, соответствующее субпопуляции CD4+ лимфоцитов (выделено многоугольной рамкой). 51 Установка курсора, отделяющего позитивные и негативные значения, выполнялась по внутреннему контролю (CD4-негативной популяции клеток образца, заведомо имевшего в своем составе гранзим В положительные события). В А Рис. 2. Определение доли гранзим В положительных клеток в CD4+CD25high популяции лимфоцитов в ПК у больного после трансплантации аллогенного костного мозга 2А. Определение популяции CD4+CD25high (выделен фиолетовым) c использованием внутреннего отрицательного контроля (выделен синим) 2В. Определение доли гранзим В – позитивных клеток (верхний левый квадрант) среди CD4+CD25high клеток (выделено темнокрасным) с использованием внутреннего положительного контроля – CD4- популяции (выделено синим на рисунке 2А, на рисунке 2В выделено фиолетовым). 52 Учитывая задачу по оценке уровня экспрессии гранзима В посредством определения MFI (геометрической средней интенсивности флюорисценции, которая автоматически рассчитывается системой на основании полученных данных) и сравнение результатов между собой, все данные были получены с использованием «стандартных настроек», после первоначального выполнения компенсации. В каждом образце исследовали 50000 CD4+ клеток. 2.5.3 Пробоподготовка при определении различных субпопуляций Т лимфоцитов с использованием метода «лизис без отмывки». Учитывая тот факт, что во второй части работы, где исследовалось влияние МСК на различные субпопуляции Т лимфоцитов, не использовалось внутриклеточное окрашивание и не требовалась качественная оценка популяций, лишь количественные характеристики. С целью снижения потерь редких событий, которые могут возникнуть при отмывке от избытка антител, был использован метод «лизиса без отмывки», согласно инструкции производителя (Beckton Dikinson). Для определения экспрессии поверхностных антигенов (CD3 FITC/ CD45 PerCP-Cy5.5 / CD4 PE-Cy7 / CD8 APC-Cy7/ CD4-PE/ CD25-FITC) 100 мкл цельной крови распределяли в пробирки (соответственно количеству комбинаций антител) и добавляли в требуемом объеме мкАТ. Далее при +4 ºС в темноте происходила инкубация в течение 25 минут. Спустя 25 минут после инкубации к клеточной взвеси был добавлен 1х лизирующий раствор Lysis Buffer (Beckton Dikinson) в объеме 1 мл. Взвесь перемешивали и помещали на 15 минут в темное место при комнатной температуре. Проводили подсчет в проточном цитометре всего объема клеточной взвеси. С целью последующей количественной оценки субпопуляций клеток данные образцы крови, с целью получения абсолютного числа лейкоцитов крови также были проанализированы на гематологическом анализаторе Sysmex XE-2100. 53 При анализе точечных графиков группу событий, экспрессирующих специфический поверхностный (CD45) антиген, изолировали с помощью инструмента выделения области (gate). Далее используя характеристики приведенные ниже были определены различные субпопуляции Т лимфоцитов. Популяция клеток Используемые параметры Лейкоциты CD45+ Лимфоциты FSClow, SSClow, CD45+ Т лимфоциты CD3+, CD45+ Т хелперы CD3+CD4+CD45+ Т супрессоры CD3+CD8+CD45+ Т-регуляторные клетки CD4+CD25high Методика выделения различных субпопуляций лимфоцитов подробно отражена на рисунке 3. И заключалась в последовательном выделении дискретных популяции несущих то или иное сочетание антигенов, которое было указано выше. Измерение проводилось в процентах от CD45+ популяции для Т хелперов, Т супрессоров и Т лимфоцитов. Для Т-регуляторных клеток подсчет велся относительно CD4+. Также стоит отметить, тот факт, что для данной части работы использовались антитела для in vitro диагностики и согласно рекомендациям производителя при проведении анализа они не требуют какоголибо контроля. 54 B А C D А А Рис. 3. Определение лейкоцитарного гейта (CD45+) (А), с последующим определением Т-лимфоцитов (CD45+CD3+) (В) и их субпопуляций - Т— хелперов (CD45+CD3+CD4+) – (С), цитотоксических Т-клеток (CD45+CD3+CD8+) – (D) 2.6 Статистический анализ данных Статистический анализ данных проводился совместно с лабораторией биостатистики ФГБУ ГНЦ МЗ РФ (к.т.н. Куликов С.М.) с использованием статистического пакета Statview. Для оценки достоверности различий в двух независимых выборках использовался t-критерий Стьюдента и метод Хиквадрат.С целью определения значимости факторов использовался подсчет отношения шансов. Для оценки выживаемости были использованы кривые Каплан-Мейер и log-ранк тест. 55 Глава 3. Результаты исследования и обсуждение 3.1 Клинические результаты В исследование, посвященное анализу развития острой РТПХ, было включено 27 пациентов: 24 пациента с острыми лейкозами (ОМЛ=12, ОЛЛ=12), двое - злокачественные лимфомами и один - МДС. Из 12 больных ОЛЛ 11 находились перед трансплантацией в полной ремиссии заболевания. 9 больным ОЛЛ алло-ТКМ была выполнена от неродственного донора, троим - от родственного донора. В целом по группе у 56 16,6% (n=2) (оба получили СКК от неродственного донора) была диагностирована оРТПХ на сроке +8 и +21 день. Степень поражения была оценена как 4 в обоих случаях (органы мишени - печень, кожа, кишечник). В одном случае оРТПХ характеризовалась рефрактерным течением, что послужило причиной смерти больной. Из 12 пациентов с ОМЛ перед алло-ТКМ полная ремиссия сохранялась лишь у 8. 11 больным ОМЛ была выполнена алло-ТКМ от неродственного донора, одному - от родственного донора. У 8 (75%) пациентов отмечалось развитие оРТПХ (все пациенты получили СКК от неродственного донора). Медиана возникновения составила 33 дня (10-88). I степень тяжести о РТПХ была диагностирована у одного больного, II степени - у 1, III степени - у 3, IV степени у 3. Поражения преимущественно были комбинированными. Органами- мишенями были кишечник (n=5), кожа (n=5), печень (n=1). У 2 пациентов была констатирована резистентная к терапии форма оРТПХ. Один из них скончался на сроке 1,8 мес., вторая пациентка на контрольном сроке в 90 дней была жива. Одному больному МДС аллогенная ТКМ была выполнена вне полной ремиссии, оРТПХ у него не была диагностирована в течение всех контрольных сроков. Все больные лимфомами были в полной ремиссии перед алло-ТКМ, и у одного из них на +14 день была констатирована оРТПХ 4 степени с поражением кишечника. У пациента был получен клинический ответ на терапию ГКС, и он был жив в контрольные сроки. Поскольку наличие полной ремиссии перед аллогенной ТКМ является ключевым прогностическим фактором, мы проанализировали общую выживаемость больных, включенных в наше исследование, в зависимости от этого показателя. Результаты анализа отражены на рис.4. 57 Рисунок 4. Сравнение общей выживаемости больных в ПР (красная кривая) и вне ее (синяя кривая) после алло-ТКМ. (p=0,006*) ПР – полная ремиссия. Как видно из рисунка 4, несмотря на малые группы больных, общая выживаемость тех, кому алло-ТКМ была выполнена в ПР, достоверно (p=0,006) отличалась от общей выживаемости у больных, которым алло-ТКМ была осуществлена вне ПР: 75% в сравнении с 15% в течение 1,5 лет. С учетом столь критических различий в долгосрочном прогнозе у больных в полной ремиссии и вне полной ремиссии, весь дальнейший анализ мы осуществляли для этих двух групп пациентов отдельно. За период проведения нашего исследования с апреля 2011 по апрель 2014, в отделении применяли различные подходы к профилактике оРТПХ. 4 больным вне полной ремиссии стандартную профилактику оРТПХ не проводили, а использовали введение циклофосфана в дозе 50 мг/м2 на +3, +4 дни после трансплантации. Из них у двух констатирована оРТПХ. Двум больным вне полной ремиссии использовали стандартную профилактику с введением метотрексата и ЦСА, и из них у одного была оРТПХ. Группы крайне малы, чтобы сделать заключение о влиянии режимов профилактики на вероятность развития оРТПХ, но ясно одно, что у половины больных (3/6), трансплантированных вне 58 ПР, развилась оРТПХ, что, по всей видимости, подтверждает влияние этого фактора на развитие оРТПХ . Больным в ПР применяли два режима - с включением (n=13) и без включения (n=8) метотрексата (15 мг/м2 в +1 и 10 мг/м2 в +3, +6, + 11 дни) в программу стандартной профилактики. Мы проанализировали частоту возникновения оРТПХ у этих больных в зависимости от использования метотрексата в программе профилактики и в зависимости от типа донора. Результаты представлены в таблице 5. Таблица 5. Частота развития оРТПХ у пациентов в ПР после трансплантации аллогенного костного мозга от родственного и неродственного донора в зависимости от использования метотрексата. (p=0.013*). Больные в Частота оРТПХ ПР Частота оРТПХ (с МТХ в (без МТХ в ИСТ) (n=8) ИСТ) (n=13) родственный неродственный родственный неродственный ОМЛ/МДС (n=8) донор (n=0) донор (n=8) донор (n=3) донор (n=10) 0 4/5 (80%) 0 1/3 (33%) 0/3 1/6 (16,6%) 0 0/1 ОЛЛ (n=11) 0 ЛПЗ (n=2) 0 Итого 6/8 (75%) 1/2 (50%) 1/1 (100%) 2/13 (15%) Как наглядно видно из таблицы 5, при использовании в схеме ИСТ метотрексата у больных в ПР, частота развития оРТПХ статистически достоверно была выше (p=0.013). После получения результатов этого анализа, метотрексат был возвращен в программы профилактики оРТПХ. При анализе связи между применением метотрексата и развитием оРТПХ для больных в ПР методом Хиквадрат были получены статистически достоверные значения р=0.006. При оценке 59 значимости этого фактора и оценке отношения шансов (Odds ratio) – он составил OR=0.0606 (CI95=0.0067-0.5459) (P = 0.0124). С учетом значимых отличий в частоте возникновения оРТПХ у больных в ПР в зависимости от использования метотрексата, мы сравнили долгосрочные результаты у этих больных. На рис.5 представлены кривые выживаемости больных в зависимости от варианта профилактик оРТПХ. Рисунок 5. Сравнение общей выживаемости больных в ПР с (красная кривая) и без МТХ (синяя кривая) в ИСТ. (р=0,15) Представленные результаты событийного анализа демонстрируют четкую тенденцию к снижению показателей общей выживаемости у больных, у которых не использовали метотрексат (62%), в сравнении с теми, у кого его применяли (84%). Таким образом, ключевым фактором, оказывающим значимое влияние на долгосрочные результаты в нашем исследовании, стал факт наличия или отсутствия ПР до ТКМ. У больных в ПР исключение МТХ из режима профилактики оРТПХ привело к значительному увеличению частоты развития оРТПХ и близко к достоверному снижению показателей ОВ (р=0,15). Стоит отметить, что наличие летальности и технические особенности привели к снижению количества больных, анализируемых на разных сроках после 60 алло-ТКМ. Так к +60 дню скончалось двое пациентов, одному пациенту после алло-ТКМ исследования не выполнялись в связи с техническими причинами. Стоит отметить что всем - 11 пациентам с оРТПХ в день развития оРТПХ исследования были выполнены в полном объеме. А учитывая тот факт, что различия оценивались на определенные сроки после алло-ТКМ и нами использовался t-критерий Стьюдента, то данные изменения в числе больных не оказывали существенного влияния на достоверность и статистическую значимость результатов. Таблица 6. Количество включенных и исключенных пациентов, причины исключения из исследования. До алло- День +30 +60 +90 27 24 24 24 - - - - - (Неродственный - 3 3 3 - - - 1 1 - - 3 2 2 - ТКМ Количество включенных оРТПХ 11 пациентов Исключено (Родственный донор) Исключено донор) Исключено (МАК) Исключено (RIC) 61 Умерло Технические причины - - 2 2 - - 3 1 1 - 3.2 Особенности оценки экспрессии гранзима В и его доли в популяции CD4+ лимфоцитов, а также субпопуляции Трегуляторных CD4+CD25high клеток Динамическое исследование экспрессии внутриклеточного гранзима В в субпопуляции Т-регуляторных клеток выполнено 27 больным после трансплантации аллогенного костного на разных сроках после нее. Исследования методом проточной цитометрии проводили до алло-ТКМ, на +30, +60 и +90 день. В случае развития у пациента оРТПХ исследование также выполняли в день начала терапии оРТПХ. Учитывая, что исследование проводилось в ранние сроки после алло-ТКМ – до 90 дня, оценку экспресии гранзима В в субпопуляциях Т лимфоцитов в случае развития поздней острой формы РТПХ не осуществляли. Все клинические данные также оценивались до +90 дня. Окрашивание внутриклеточных белков требует выделения клеток на градиенте плотности и множественных отмывок. Однако при этом ввиду больших потерь не представляется возможным адекватно оценить абсолютное количество CD4+ и CD4+CD25high клеток. При использовании этих методов потери клеток достаточно высоки, что подтверждается нашими исследованиями количества Трегуляторных клеток (CD4+CD25high) у доноров, процентное содержание у которых по отношению к популяции CD4+ клеток составило 1,96±0,37(1-3,5), что достаточно существенно отличается от принятых лабораторных норм в 5-10%. В то же время при оценке данной популяции у тех же доноров методом «лизис без отмывки», процентное содержание Т-регуляторных клеток (CD4+CD25high) составило 8,26±0,68(4,6-9,4) по отношению к популяции CD4+ клеток, что 62 полностью сопоставимо с лабораторными нормами. Более подробные данные приведены в таблице 7. Таблица 7. Относительное количество Т-регуляторных клеток у пациентов с использованием различных методов пробоподготовки. (P= 0.0008) % содержание CD4+CD25high (по отношению к популяции CD4+ клеток) Окраска (включающая Окраска внутриклеточное окрашивание метод и градиента использованием (с метода «лизис без отмывки») плотности) Донор №1 3,5 9,3 Донор №2 1,3 6,3 Донор №3 1,7 9,4 Донор №4 1,8 7,4 Донор №5 2 8,9 Донор №6 3,4 7,6 Донор №7 1 5,5 Донор №8 1 4,6 Итого 1,96±0,37(1-3,5) 8,26±0,68(4,6-9,4) P= 0.0008* OR 63 Таким образом, учитывая все вышеизложенное, подсчет абсолютного количества клеток в первой части работы не осуществлялся, и мы использовали относительные показатели. 3.3 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных до проведения трансплантации костного мозга и в контрольной группе здоровых доноров. Мы определяли долю гранзим В положительных клеток среди CD4+ популяции и CD4+CD25high популяции клеток, подробно данные представлены в приложениях 3 и 4. Также мы исследовали геометрическое среднее интенсивности флюоресценции каждого события (MFI) – т.е. уровень экспрессии гранзима В в каждой клетке. Для сравнения результатов больные были разделены на 2 группы: в ПР и вне ремиссии. Как видно из рисунка 6, у здоровых доноров и пациентов в ремиссии по сравнению с пациентами вне ремиссии отмечается большая доля гранзим В положительных CD4+CD25high клеток. У доноров процент гранзим В положительных событий среди CD4+CD25high клеток составил 1,9±0,57(0,2-4,6), в то время как у больных вне ремиссии он составил всего 0,58±0,26(0-1,6). У больных же, находящихся в ремиссии, он практически не отличался от значений у здоровых доноров и составлял 2,45±0,65 (0-10,4). 64 P= 0.17 % от CD4+\CD25high популяции 3,5 P= 0.48 3 2,5 2 1,5 1 0,5 0 Ремиссия (n=21) Вне ремиссии (n=6) Доноры (n=8) Рис 6. Доля гранзим В - положительных CD4+CD25high клеток у больных до алло-ТКМ вне и в ремиссии, и в контрольной группе доноров. Работ, посвящённых оценке гранзима В в CD4+ и CD4+CD25high популяции крайне мало, и они в основном реализованы на мышиных моделях. По всей видимости, такая тенденция по доли гранзим В положительных CD4+CD25high клеток между пациентами вне ремиссии, донорами и пациентами, находящимися в ремиссии, говорит о восстановлении баланса в Т клеточной популяции у больных в ПР. При этом вне ПР число Т-регуляторных клеток с гранзимом В существенно снижено, что может косвенно свидетельствовать о том, что, повидимому, опосредовано увеличивается доля клеток эффекторного (цитотоксического) звена иммунной системы [114]. Было показано также отсутствие различий между интенсивностью экспрессией гранзима В в каждой клетке, относящейся к популяции CD4\CD25high, что отображено на рисунке 7, где MFI (индекс, который использовался для оценки уровня внутриклеточной экспрессии гранзима В в каждой клетке) для доноров составил 1934±815(6196869), у пациентов же вне ремиссии 1309,17±565,01(0-3691), а в ремиссии 1867,11±572,44(0-14842) 65 3000 Еденицы MFI 2500 2000 1500 1000 500 0 Ремиссия (n=21) Вне ремиссии (n=6) Доноры (n=8) Рис 7. Сравнение величин интенсивности экспрессии гранзима В (средней интенсивности флюоресценции (MFI)) каждой клетки, относящейся к популяции CD4+CD25high у больных до алло-ТКМ (в и вне ремиссии) и в контрольной группе доноров Тенденция к снижению доли гранзим В положительных клеток у больных вне ремиссии – отмечена и в отношении общей популяции CD4+ клеток (Рис 8) (p=0.14). Что касается интенсивности экспрессии гранзима В среди CD4+ клеток то она составила - 5803,38±1481,75(1467-12143) для доноров , 4453,71±809,35(534-17007) для пациентов в ремиссии и 2859,67±981,12(355-6662) для пациентов в прогрессии. 66 12 % от CD4 популяции 10 8 6 4 2 0 Ремиссия (n=21) Вне ремиссии (n=6) Доноры (n=8) Рис 8. Доля гранзим В - положительных CD4+ клеток у больных до аллоТКМ и в контрольной группе доноров. Таким образом, мы выявили дисбаланс в доле гранзим В положительных клеток у больных вне ПР как в популяции Т-регуляторных клеток, так и в общей CD4+ популяции. В период ПР эти показатели не отличались от таковых у доноров. 3.4 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high субпопуляциях лимфоцитов периферической крови у больных в зависимости от диагноза до проведения трансплантации костного мозга У больных в ПР вне зависимости от диагноза – ОМЛ или ОЛЛ – доля гранзим В положительных клеток среди Т-регуляторных клеток была сопоставима с донорскими показателями и составляла 1,9±0,57(0,2-4,6) для доноров, 2,61±1,02(0,2-10,4) и 2,54±1,12(0-8,3) для пациентов с ОЛЛ и ОМЛ в ПР. У больных же вне ремиссии, и при ОМЛ и при ОЛЛ, число анализируемых клеток снижено. К сожалению, анализируемые группы невелики, поэтому значимых отличий не получено. 67 У двух больных с лимфомами в ПР доля гранзим В+ Т-регуляторных клеток одинакова в сравнении с донорами и ОЛ в ПР и составила 1,2±0,57(0,8-1,6). Это говорит об универсальных закономерностях функционирования иммунной системы вне зависимости от диагноза, но в четкой связи с этапами опухолевого развития. Подробно все данные приведены на рисунке 9. Рис 9. Доля гранзим В - положительных CD4+CD25high клеток у больных до алло-ТКМ в зависимости от ремиссии и статуса заболевания до алло-ТКМ. При анализе доли гранзим В положительных клеток в общей CD4+ популяции (рисунок 10) можно отметить, что, как и в Т-регуляторных клетках у больных в ПР, доля гранзим В клеток среди CD4+ выше и сопоставима с донорами. На малой группе хотелось бы отметить что у больных ОЛЛ в ПР процент гранзим В положительных CD4+ клеток существенно выше 12,3±2,68(0,6-27), в сравнении и с ОМЛ в ПР и с донорами (p=0.06 и 0,077 соответственно), - 6,21±1,81(0,4-11,7) и 6,96±1,93(1,5-16,5) соответственно. 68 P=0.06 P=0.077 Рис 10. Сравнение доли гранзим В положительных CD4+ клеток у пациентов с различными нозологиями и фазами заболевания. Объяснением этому может служить факт различия в распределении гранзима В в популяции Т хелперов. По большому числу сообщений его количество преобладает в популяции Т хелперов первого типа, нежели в остальных субпопуляциях [21], что говорит о поляризации в сторону Т хелперов 1-го типа у данных пациентов. При ОМЛ в дебюте заболевания преобладают Th1 над Th2, а в период ПР процент Th1 снижен, но превышает таковой у доноров [118]. При ОЛЛ у детей описывают иную ситуацию: в дебюте Th1 меньше Th2, а в ПР Th1 значительно больше. Возможно, столь высокое содержание у больных ОЛЛ в ПР гранзим В положительных CD4+ клеток косвенно свидетельствуют о восстановлении и активации Th1 звена иммунной системы. Что до интенсивности экспрессии гранзима В в популяциях CD4+ и CD4+CD25high Т лимфоцитов у больных ОМЛ с различными нозологиями, то их уровень не отличался (подробно данные приводятся в приложении 4). Таким образом до ТКМ, у пациентов вне зависимости от диагноза при отсутствии ремиссии отмечается наименьшее число гранзим В положительных 69 клеток среди популяции CD4+CD25high. В это же время, именно при ОЛЛ в ремиссии количество гранзим В положительных CD4+ клеток максимально и по сравнению с донорами, и больными с другими нозологиями. 3.5 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках в популяциях периферической крови при реконституции донорской иммунной системы у больных с различными нозологиями после трансплантации аллогенного костного мозга. В контрольные сроки на +30, +60 и +90 день после алло-ТКМ определяли количество гранзим В положительных событий в популяциях CD4+ и CD4+CD25high лимфоцитов, принадлежащих уже донорскому кроветворению. Мы оценивали восстановление CD4+ и CD4+CD25high популяции Т лимфоцитов у больных в зависимости как от диагноза, так и фазы заболевания (ПР или вне ПР). Так на рисунке 11, отражена динамика доли гранзим В положительных Трегуляторных клеток у больных ОМЛ вне и в ПР на разных этапах после аллоТКМ. % от CD4+\CD25high популяции 60 50 40 30 20 10 0 30 60 ОМЛ (ремиссия) (n=8) 90 Доноры (n=8) ОМЛ/МДС прогрессия (n=5) Рис 11. Сравнение доли гранзим В положительных CD4+CD25high клеток у пациентов с ОМЛ с различными фазами заболевания после алло-ТКМ. 70 Как видно из рисунка 11, при анализе динамики доли гранзим В положительных клеток среди CD4+CD25high популяции на +30, +60 и +90 дни отличий не отмечено. Доли составили для пациентов в ремиссии 8,22±4,83(1,1-30) на +30, 8,07±4,06(0,6-23,9) на +60 и 3,24±1,38(0,2-6,2) на +90 день соответственно. Также не были они выявлены и при оценке доли гранзим В положительных событий среди CD4+ популяции . Так для ОМЛ в ремисии они составили 11,67±5,38(0,5-32,5) на +30 день, 13,35±5,29(0,3-43,6) на +60 день и 9,96±5,84(0,947) на +90 день. Для сравнения у пациентов вне ремиссии этот уровень составил 14,52±7,37(0,6-39,2), 30,05±22,24(5,5-87,1), 16,28±7,32(4,7-31,6) на +30,+60 и +90 день соответственно. Что касается оценки интенсивности флюоресценции, а соответственно, и экспрессии гранзима В внутри CD4+ клеток, то у пациентов с ОМЛ после трансплантации вне ремиссии интенсивность экспрессии гранзима В в CD4+ нарастала:1715,2±350,29(813-2506), 2603,5±277,7(2288-3318), 4717,5±531,96(3916-6034) на +30,+60 и +90 день соответственно. Более подробно это отображено на рисунке 12. При этом видно, что у больных ОМЛ вне ПР индекс MFI в CD4+ клетках становится сопоставимым с донорскими показателями. А у больных в ПР этот индекс был ниже на всех этапах исследования в сравнении с донорами, несущественно изменяясь по величине с течением времени (+30, +60, +90 день), и достоверно различался с уровнем пациентов вне ремиссии лишь на +90 день после алло-ТКМ . 71 P=0.03* P=0.13 Рис 12. Сравнение интенсивности экспрессии гранзима В (величин средней интенсивности флюоресценции (MFI) каждой клетки), среди популяции CD4+ клеток, у больных ОМЛ после алло-ТКМ (в и вне ремиссии). Это, по всей видимости, связано с более «интенсивной» антигенной стимуляцией у больных трансплантировавшихся вне ремиссии (в том числе за счет распада опухоли на этапе кондиционирования, а также более тяжелых инфекционных процессов, развившихся в раннем посттрансплантационном периоде). Что касается интенсивности экспресии гранзима В среди CD4+CD25high клеток, то уровень экспрессии 2858,17±617,69(359-4349), при ОМЛ 447,33±74,3(129-600), в ремиссии составлял : 1343,4±855,8(462-4400) на +30,+60 и +90 день соответственно. Вне ремиссии 3815,2±2158,82(0-9638), 982,5±442,6(462-2109), 3037,75±1263,54(438-5180) также на +30,+60 и +90 день. Мы сравнили долю гранзим В положительных клеток в Т-регуляторных клетках у больных ОМЛ и ОЛЛ в ПР. Результаты отражены на рисунке 13 . 72 Рис 13. Динамика доли гранзим В положительных клеток в CD4+CD25high клетках больных ОМЛ и ОЛЛ в ПР до алло-ТКМ и на разные сроки после. Этот анализ демонстрирует сходную динамику исследуемых клеток популяции у больных различными ОЛ; и при ОМЛ, и при ОЛЛ отмечается некоторая тенденция к увеличению этой популяции с +30 к +60 дню и снижение к 90 дню до уровня до ТКМ. Возможно, это объясняется тем, что именно в эти ранние сроки после ТКМ развиваются и оРТПХ (медиана +26 день после аллоТКМ), и инфекционные осложнения. У двух больных с лимфомами в ПР (в нашем случае ALK+ лимфома, Т/НКклеточная лейкоз/лимфома) на +30 день доля гранзим В положительных CD4+CD25high клеток составила 0,9±0,42(0,6-1,2), уровень интенсивности экспрессии гранзима В по MFI 841±927,72(185-1497). В популяции CD4+ клеток 0,75±0,35(0,5-1) и 2524±538,82(2143-2905), соответственно. На +60 отмечалось некоторое повышение доли гранзим В положительных день Т- регуляторных клеток до 1,3±0,28(1,1-1,5), уровень MFI при этом снизился до 563±57,98(522-604). На +60 день в популяции CD4+ клеток отмечалась схожая тенденция, так доля гранзима В и интенсивность экспрессии составили 2±1,7(0,83,2) и 1574,5±1351,28(619-2530), соответственно. На +90 день данная тенденция полностью нивелировалась - доля CD4+CD25high GZMB+ клеток составила 0,5±0,71(0-1), по MFI - 793,5±1122,18(0-1587). Среди популяции CD4+ клеток 73 доля и интенсивность экспрессии составила - 3,15±1,2(2,3-4) и 1982±67,88(19342030) соответственно. Эта динамика аналогична таковой у больных ОЛ. Таким образом, при восстановлении кроветворения и иммунной системы за счет донорского гемопоэза статистически достоверное отличие в доле гранзим В положительных клеток (CD4+ и CD4+CD25high) в зависимости от диагноза и фазы заболевания не найдено. Однако, интенсивность экспрессии гранзима В среди CD4+ клеток на +90 день была достоверно выше у пациентов вне ремиссии до алло-ТКМ. 3.6 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга от родственного и неродственного донора. При анализе тенденций в динамике количества гранзим В положительных клеток среди CD4+CD25high популяции клеток у больных после ТКМ при использовании различных источников трансплантата статистически достоверные различия были выявлены на ранних сроках – а именно на +30 после алло-ТКМ (p=0.04). Как видно на рисунке 14 доля гранзим В положительных CD4+CD25high событий при алло-ТКМ от неродственного донора составило на +30 день 6,23±2,46(0-30). В то время как при алло-ТКМ от родственного донора процент событий составил 12,83±4,28(6,8-18,9). В другие контрольные дни эти значения составили 12,7±7,2(2,1-22,4) для алло-ТКМ от родственного донора на +60 и 5,71±1,81(0-25,7) при алло-ТКМ от неродственного донора соответственно. На +90 день доля составила 3,95±1,52(1,1-6,9) и 3,14±0,95(0-14,3) соответственно. Что до доли гранзим В положительных CD4+ клеток, при трансплантации от неродственного донора, то она составила 9,23±3,24(0,5-39), 34,69±26,01(0,3-436) и 10,17±3,87(0,9-53,7) на +30,+60 и +90 день. При этом в группе трансплантации от родственного донора доля среди CD4+ клеток 28,2±25,87(5,3-70,4), 27,27±25,5(6,468,9) и 29,57±26,43(6,7-72,7) соответственно. 74 P=0.04* Рис 14. Сравнение доли гранзим В положительных CD4+CD25high клеток у пациентов после алло-ТКМ от родственного и неродственного донора в ПР. Стоит отметить тот факт, что в случае трансплантации от неродственного донора в ПР в 100% (n=18) использовались СКК, при трансплантации от родственного донора в 100% (n=4) использовался костный мозг. Учитывая, что многие иммуносупрессанты могут модулировать количество гранзим В положительных событий, что было показано в работе [101], использование более массивной иммуносупрессивной терапии при трансплантации от неродственного донора, а именно большие дозы АТГ и микофенолата мофетил, которые напрямую действуют на Т клеточное звено иммунной системы, вполне может объяснить факт заметно более низкого доли гранзим В положительных клеток в CD4+CD25high популяции на +30 после аллоТКМ при трансплантации от неродственного донора. Что касается интенсивности экспрессии гранзима В в CD4+CD25high клетках то существенные отличия в группе больных после трансплантации (1717,63±370,77(0-4349), от неродственного 1340,41±519,01(0-7709), донора в ПР 1059±414,44(0-5127) на 75 +30,+60,+90 день) и родственного в ПР (2824,67±108,47(2695-2994), 1747,33±1129,18(243-3423), 2293±699,94(1216-3163)) получены не были. P=0.0003* P=0.001* Рис 15. Сравнение интенсивности экспрессии гранзима В в CD4+ клетках у больных после трансплантации от родственного и неродственного донора (по MFI) Как видно на рисунке 15, при использовании трансплантата от неродственного донора в ПР отмечено различие в экспрессии гранзима В в CD4+ клетках на +30 и +90 день после алло-ТКМ по сравнению с пациентами после алло-ТКМ от родственного донора. Так, у пациентов после алло-ТКМ от неродственного донора в ПР интенсивности экспрессии гранзима В, была ниже по сравнению с такими же параметрами, полученными при исследовании у пациентов после трансплантации от родственного донора, и составляла 2725,88±387,12(454-5783), 3189,88±1054,78(392-13796), 2046,12±584,77(295-9057) на +30,+60,+90 день соответственно 4624±1735,21(2903-7434), родственного донора в ПР. против 6832±546,89(5942-7341) 6930,67±1638,55(4486-9095), при трансплантации от 76 Анализ различий в интенсивности экспрессии гранзима В в CD4+ популяции в зависимости от фазы заболевания у больных после алло-ТКМ от неродственного донора представлено на рисунке 16. Как видно из рисунка 16, были выявлены значимые отличия у больных вне ПР на +90 день в сравнении с больными в ПР. Интенсивность экспрессии гранзима В в CD4+ популяции на +90 день было достоверно выше у пациентов вне ПР, чем в ПР (p=0.03). P=0.06 P=0.03* Рис 16. Сравнение интенсивности экспрессии гранзима В в CD4+ клетках у больных после трансплантации от неродственного донора вне и в ПР. Что касается доли гранзима В в CD4+ и в CD4+CD25high популяции то в группе трансплантации от неродственного донора вне ПР для CD4+CD25high - доля составила 0,95±0,59(0-2,1), 2,6±2,02(0,8-5,9) и 5,13±3,09(1,3-9,9) для CD4+ 8,35±3,46(0,6-15,2), 11,03±5,27(5,5-19,5), 19,33±9,62(4,7-31,6) на +30,+60,+90 день соответственно. 77 Таким образом, у пациентов после трансплантации костного мозга от неродственного донора в ПР доля гранзим В положительных CD4+CD25high клеток на +30 день была почти статистически значимо ниже по сравнению с пациентами после алло-ТКМ от родственного донора. Такая же тенденция выявлена и для доли гранзим В положительных клеток и высокого уровня интенсивности экспрессии гранзима В которые отмечались на +30 и +90 день при исследовании гранзима В в CD4+ клетках. У пациентов вне ПР после алло-ТКМ от неродственного донора, достоверно повышена интенсивности экспрессии гранзима В в CD4+ клетках на +90 день (p=0.03) это по всей видимости, связано с попыткой не восстановившейся иммунной системы предотвратить развитие рецидива основного заболевания. Так по нашим неопубликованным данным при трансплантации вне ремиссии медиана развития рецидива составляет 94 дня. 3.7 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга с кондиционированием в миелоаблативном режиме и режиме пониженной интенсивности. С момента внедрения алло-ТГСК в клиническую практику считается, что ее выполнение невозможно без проведения предварительного предтрансплантационного кондиционирования, целью которого является как миело-, так и иммуносупрессия. В настоящее время режимы кондиционирования подразделяют на 3 основные группы: миелоаблативные, немиелоаблативные и режимы пониженной интенсивности. По мнению экспертов International Bone Marrow Transplant Registry (IBMTR) [59], любой режим кондиционирования, который включает дозу тотального облучения менее 500 сГр (единовременно) или менее 800 сГр фракционировано, 78 бусульфан в дозе менее 9 мг/кг, мелфалан менее 140 мг/м2, тиотепа менее 10 мг/кг, можно отнести к режимам пониженной интенсивности. Учитывая, что исторически на первых этапах своего становления трансплантацию применяли лишь в качестве терапии спасения при рефрактерных опухолях, именно миелоаблативные режимы до недавнего времени использовали при ТГСК. Трансплантация без кондиционирования выполнялась лишь детям с врожденными иммунодефицитами, и в настоящее время используется лишь в детской трансплантологии [13,26]. В данном исследовании МАК (миелоаблативное кондиционирование) выполнили 10 больным, режим пониженной интенсивности (RIC) выполнили 17 пациентам. Показанием для использования миелоаблативного режима кондиционирования был молодой возраст до 45 лет, а также отсутствие серьезной сопутствующей патологии в анамнезе (грибковая инфекция, алло- или ауто-ТКМ в анамнезе). В остальных случаях использовался режим пониженной интенсивности. У пациентов вне ремиссии при наличии бластоза использовался также режим пониженной интенсивности. При анализе данных, полученных у пациентов с различными режимами кондиционирования разницы в доле гранзим В положительных CD4+ и CD4+CD25high выявлено не было. Так для МАК доля гранзим В положительных CD4+CD25high клеток составила 5,37±2,31(0-18,9),4,98±2,74(0-22,4),3,49±1,21(0- 9,9) против 6,87±2,61(0-30),13,69±6,62(0-97,9), 3,15±1,14(0,2-14,3) в случае RIC на +30,+60 и +90 день соответственно. Что до интенсивности экспрессии гранзима В среди популяции CD4+CD25high (рисунок 17), то на +30 день была выше (p=0,08) у больных после RIC, чем МАК. 79 P=0.08 Еденицы MFI 4000 3000 2000 1000 0 30 МАК (n=10) 60 90 RIC (n=17) Рис 17. Интенсивность экспрессии гранзима В в CD4+CD25high клетках больных после трансплантации при различных режимах кондиционирования. – на +30 день (P= 0.08) По всей видимости, причиной этого является тот факт, что в качестве миелоаблативного «классическую» режима схему при проведении кондиционирования, алло-ТКМ включающую использовали бусульфан и циклофосфан (ЦФ) [103] Именно ЦФ в высоких дозах по данным El-Serafi [23], обладает способностью снижать экспрессию гранзима В в мононуклеарной фракции клеток. Несмотря на тот факт, что изменение экспрессии определяли лишь сутки спустя, по всей видимости, данный эффект может сохраняться и более продолжительное время. Это также подтверждается тем фактом, что произошло снижение именно интенсивности экспрессии гранзима В в CD4+CD25high клетках (что было оценено по MFI, который и отображает именно уровень экспрессии внутри клетки). Доля же гранзим В положительных CD4+ клеток у больных после RIC составила - 13,09±3,8(0,5-39,2), 45,71±29,47(0,3-436), 14,38±4,49(0,9-53,7) против 12,06±7,92(0,5-70,4), 11,79±7,65(0,8-68,9), 12,33±8,04(2,2-72,7) после МАК на +30,+60 и +90 день после алло-ТКМ. Здесь также не было выявлено достоверных отличий. Так же не было выявлено их и для интенсивности экспресии гранзима В среди CD4+ лимфоцитов, так для МАК интенсивность составила 3592±1005,58(731-9095), 4087,22±1467,67(619-13796) и 3490,22±974,78(444-7341) 80 против 2710,27±410,94(454-5783),2752,79±852,53(392-12593), 2849,2±711,74(2959057) после RIC на +30,+60 и +90 день после алло-ТКМ При анализе интенсивности экспрессии гранзима В в зависимости от статуса заболевания до алло-ТКМ, (p=0.04) было выявлено, что интенсивность экспрессии гранзима В в CD4+ клетках на +30 день (рис 18) была достоверно выше у пациентов в ремиссии после RIC (3114,09±496,74(454-5783), 2858,45±1105,64(392-12593), и 2349,08±822,93(295-9057) на +30,+60,+90 день после алло-ТКМ), по сравнению с пациентами вне ремиссии также после RIC (1599,75±434,18(813-2506), 2365,33±57,85(2288-2451), 4849,67±764,4(3916-6034) в те же контрольные сроки). По всей видимости это связано с тем что 80% пациентов вне ремиссии получили более интенсивное кондиционирование по программе FLAMSA-RIC, именно этим и объясняется отсутствие достоверных различий в экспрессии гранзима В между пациентами вне ремиссии после RIC и в ремиссии после МАК в ремиссии (p=0.49). P=0.07 7000 P=0.49 6000 P=0.04* ЕДЕНИЦЫ MFI 5000 4000 3000 2000 1000 0 30 Ремиссия РИК (n=12) 60 Вне ремиссии РИК (n=5) 90 МАК (n=9) 81 Рис 18. Интенсивность экспрессии гранзима В в CD4+ клетках у больных после трансплантации при различных режимах кондиционирования. У пациентов после трансплантации аллогенного костного мозга после кондиционирования в миелоаблативном режиме интенсивность экспрессии гранзима В среди CD4+ клеток на +30 день была ниже по сравнению с пациентами после алло-ТКМ в режиме пониженной интенсивности. А при кондиционировании вне ремиссии более интенсивное кондиционирование приводило к снижению интенсивности экспрессии гранзима В в CD4+ клетках. 3.8 Изменение характеристики интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга с использованием циклофосфамида в качестве индуктора толерантности. В конце 1990-х годах появились сообщения об использовании высоких доз ЦФ в сочетании со стандартной иммуносупрессией для индукции толерантности у больных после алло-ТГСК от гаплоидентичного донора. В 2002 г. была опубликована работа L. Luznik и соавт.[49], в которой подтверждена эффективность применения ЦФ в качества индуктора толерантности при аллоТГСК. В дальнейшем опубликованы данные нескольких групп исследователей из Сиэтла и Балтимора [50], которые, наряду со стандартной иммуносупрессией, использовали введение ЦФ в дозе 50 мг/кг в сутки на +3-й, либо на +3-й и +4-й день после алло-ТГСК от гаплоидентичного донора с целью индукции толерантности [51]. Частота острой РТПХ 2-4 степени и 3-4 степени составила 34% и 6%, соответственно. Причем снижение частоты острой РТПХ при эскалации дозы ЦФ не происходило. Согласно данным M.Kastan и соавт. [38], в гемопоэтических предшественниках определяется высокий уровень альдегиддегидрогеназы (АЛДГ), что делает их не восприимчивыми к высоким дозам ЦФ, так как именно с участием АЛДГ элиминируются цитотоксические метаболиты ЦФ. 82 Мы использовали описанный Luznik [50] способ у четырех больных. Интенсивность экспрессии гранзима В при использовании ЦФ в качестве индуктора толерантности среди CD4+CD25high клеток значимо отличалась лишь на +30 день (P=0.002). При использовании только ЦФ в качестве индуктора толерантности интенсивность экспрессии составила 5977,33±3116,59(1085-9638) против 1766,67±307,75(0-4349) при использовании стандартной иммуносупрессии. Существует несколько возможных объяснений этому. Во-первых, использование режимов кондиционирования без ЦФ, таких как FLAMSA-RIC, что могло определять более высокий уровень экспрессии гранзима В среди CD4+CD25high клеток. Но все же, по всей видимости, самым существенным является полный отказ от использования иммуносупрессии у этих больных, что могло привести к увеличению уровня гранзима В по сравнению с клетками, полученными от пациентов, которым проводилась стандартная иммуносупрессия. В-третьих, пациенты, у которых в качестве индукции толерантности использовался ЦФ были вне ремиссии, а по результатам нашего исследования именно нахождение пациента в или вне ПР является ключевым фактором, определяющим динамику экспрессии гранзима В в исследуемых популяциях. Что касается доли гранзима В и интенсивности его экспрессии в CD4+CD25high и CD4+ клетках, то эти данные подробно указаны в приложение 6. В нашем исследовании у пациентов у которых в качестве профилактики оРТПХ использовался ЦФ отмечен более высокая интенсивность экспрессии гранзима В в клетках, относящихся к популяции CD4+CD25high клеток. 3.9 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных, у которых диагностирована острой реакции трансплантат против хозяина. Чтобы оценить роль экспрессии гранзима В в различных клетках в момент развития оРТПХ, мы использовали метод «landmark-анализа». В первую группу 83 пациентов (n=16) «без оРТПХ» мы включили всех пациентов независимо от диагноза и режима кондиционирования, у которых с 0 до 90 дня не было констатировано развития оРТПХ. Во вторую группу (n=4) были включены пациенты, у которых оРТПХ развилась на более чем +30 день (из них 2 после 60 дня) и более чем на +60 день (n=2). Больные у которых оРТПХ развилась до +30 дня, были объединены в третью группу(n=7), т.к. у них время оценки популяции было в день диагностики оРТПХ, а в контрольные сроки (на +30,+60 и +90 день) – у них у всех была эскалированная иммуносупрессивная терапия. Сравнение проводилось между показателями доли гранзим В положительных событий и интенсивности экспрессии гранзима В в популяции CD4+ и CD4+CD25high клеток. P= 0.03* 25 % от CD4+\CD25high популяции 20 P= 0.003* 15 10 5 0 30 Пациенты без оРТПХ (n=16) 60 90 Пациенты с оРТПХ (после +30 дня)(n=4) 84 Рис 19. Сравнение доли гранзим В положительных CD4+CD25high клеток на 30 и 60 день после алло-ТКМ у пациентов без оРТПХ и тех у которых она разовьется позже. Как показано на рис.19, доля гранзим В положительных клеток в популяции CD4+CD25high – была более высокой на +30 и +60 день при отсутствии РТПХ за время наблюдения и по сравнению с группой пациентов, развивших оРТПХ в течение +30…+90 дня. По нашим данным доля гранзим В положительных CD4+CD25high событий у пациентов без оРТПХ составила 9,49±2,79(0-30) и 16,56±6,98(0-97,9) на +30 и +60 день, в группе без оРТПХ что было значимо выше, чем в группе с оРТПХ резвившейся после +30 дня (На +30 день p= 0.003, на +60 день p= 0.03). С нашей точки зрения, этот факт крайне интересен, поскольку свидетельствует о возможности предположить, у кого из больных при обследовании в контрольные сроки может развиться оРТПХ или нет, что открывает перспективу превентивной терапии оРТПХ. Т-регуляторные клетки – одни из главных игроков, обеспечивающих периферическую толерантность за счет делеции аллореактивных клонов. Поэтому небольшое число клеток с гранзимом В среди популяции CD4+CD25high среди больных, у которых в последствии развилась оРТПХ представляется вполне логичным. Следует отметить, что в литературе вопрос об использовании гранзима В как фактора - предиктора развития оРТПХ не изучался. Учитывая это нами была выполнена попытка выполнить расчет отношения шансов (Odd ratio, OR) оно составило 2.7 (CI95=0.5-14), при пороге в 5%, значение p при расчете методом Хи-квадрат составило 0,24 - что недостоверно, и по всей видимости связано с малой выборкой. В таблице 8 приведены данные о р при различных порогах. Стоит отметить что расчет p велся при помощи z-статистики. Таблица 8. Значения р для различных порогов гранзима В в CD4+CD25high клетках. 85 Порог (% от CD4+CD25high клеток) Значение p 5% 0.24 4% 0.24 3% 0.24 2% 0.24 Более высокое содержание гранзима В позволяет Т-регуляторным клеткам ограничивать популяцию цитотоксических лимфоцитов, которые участвуют в противоопухолевом и противовирусном звене иммунной системы [105], но и являются эффекторным звеном оРТПХ. [2] P= 0.003* P= 0.003* 86 Рис 20. Сравнение доли гранзим В положительных CD4+\CD25high клеток алло-ТКМ у пациентов без оРТПХ и тех у которых она разовьется после 30 дня и в день оРТПХ. Как отмечалось ранее, мы исследовали долю гранзим В положительных Трегуляторных клеток и у больных, у которых развилась оРТПХ до 30 дня (первой контрольной точки после ТКМ), и измеряли этот показатель в день развития оРТПХ. Он составил - 3,8±1,78(0-16,8). Этот показатель был значимо ниже показателей на контрольных сроках (+30 день) у больных, у которых оРТПХ вообще не развилась (рис. 20). В целом доля гранзим В положительных клеток в CD4+CD25high клетках в день развития РТПХ у всех больных (n=11), (медиана - 26 день) была существенно ниже в сравнении с показателями на +30 и +60 контрольных сроках у тех, у кого не развилась оРТПХ в наблюдаемом периоде 90 дней (рис. 21) 25 P= 0.051 % от CD4+\CD25high популяции 20 P= 0.04* 15 P= 0.2 10 5 0 30 Пациенты без оРТПХ (n=16) 60 90 Пациенты с оРТПХ (в день установления диагноза)(n=11) 87 Рис 21. Динамическое исследование доли гранзим В положительных CD4+CD25high клеток у пациентов без оРТПХ и в день развития оРТПХ. Как видно из рисунка 21, различия в доле клеток являлись достоверными. Доля гранзим В положительных Т рег составила 3,8±1,78(0-16,8) в день развития оРТПХ и 9,49±2,79 (0-30) на +30 день и 16,56±6,98(0-97,9) на +60 день у больных без оРТПХ. Стоит отметить, что к +90 дню данные различия становились не значимыми. Это вполне укладывается в тот факт, что развитие оРТПХ после 100 дня, т.н. «поздней» оРТПХ, является достаточно редким событием. По всей видимости, именно приобретение «достаточного» контроля со стороны Трегуляторных клеток над эффекторной популяцией приводит к резкому снижению частоты оРТПХ после 100 дня. Все эти данные также подтверждаются и ранее полученными результатами в которых доля гранзим В положительных CD4+CD25high клеток служила предиктором развития оРТПХ. И его более низкий уровень задолго до развития оРТПХ свидетельствовал о развитии оРТПХ в будущем. 88 90 80 P= 0.13 % от CD4+ популяции клеток 70 60 50 40 P= 0.1 P= 0.15 30 20 10 0 30 Пациенты без оРТПХ (n=16) 60 90 Пациенты с оРТПХ (в день установления диагноза)(n=11) Рис 22 Сравнение доли гранзим В положительных CD4+ клеткок у больных после трансплантации с оРТПХ и без. Доля гранзим В положительных CD4+ клеток у больных без оРТПХ была достоверно выше, чем у больных развивших оРТПХ, измеренной в день развития оРТПХ (рис 22). Что, по всей видимости, связано с массивной активацией CD4+ клеток на фоне «цитокинового шторма» при развитии оРТПХ [60] Таким образом, у пациентов после трансплантации аллогенного костного мозга малое количество гранзим В положительных CD4+CD25high клеток определяло высокую вероятность развития оРТПХ: или наоборот, чем больше было количество гранзим В положительных CD4+CD25high клеток, тем меньше была вероятность развития оРТПХ в будущем. А своего минимального значения этот показатель достигал в день установления диагноза оРТПХ. 89 Доля гранзим В положительных CD4+ клеток «отображала» активность хелперного звена на фоне «цитокинового шторма», т.к. именно в случае когда их количество было максимальным отсутствовала оРТПХ. 3.10 Характеристика интенсивности экспрессии гранзима В и его доли в CD4+ и CD4+CD25high клетках периферической крови у больных после трансплантации аллогенного костного мозга с цитомегаловирусной инфекцией и без нее. Учитывая тот факт, что доля гранзима В в субпопуляциях CD4+ клеток изменяется лишь в случае необходимости регуляции Т эффекторного звена (т.е. в случае вирусного или опухолевого поражения), а также принимая во внимание клиническую значимость выявления для больных после алло-ТКМ ЦМВ инфекции, мы проанализировали все исследуемые параметры в зависимости от наличия активной ЦМВ-инфекции. Основной период реактивации ЦМВ это +30 и более дней после алло-ТКМ. Согласно литературным данным и данным ФГБУ ГНЦ Минздрава России в 30% случаев регистрируется реактивация ЦМВ [46] , однако эти данные разнятся от центра к центру и зависят от многих факторов, таких как профилактика и инфицированность доноров. В нашем исследовании ЦМВ-реактивация была зафиксирована у 10% больных (n=3). Реактивацию оценивали обнаружением ДНК-копий методом ПЦР и/или серологически (выявлением IgM) в контрольные сроки. Доля гранзима В в CD4+ и CD4+CD25high клетках ПК у больных после трансплантации аллогенного костного мозга , у которых была или не была диагностирована ЦМВ инфекция, представлена на рисунке 23 и более подробно в приложении 5. 90 25 20 15 10 5 0 60 90 ЦМВ- (n=24) ЦМВ+(n=3) Рисунок 23. Доля гранзима В в популяции CD4+CD25high клеток у больных после трансплантации аллогенного костного мозга с и без ЦМВ инфекции. При острой бактериальной инфекциях роль Т-регуляторных клеток также важна, однако она, по современным данным ограничивается лишь выработкой цитокинов, таких как интерлейкин- 10 (ИЛ-10) или трансформирующий фактор роста- β (TGF) с целью предотвратить повреждение тканей в очаге инфекции [10]. Гранзим В сам по себе не участвует в регуляции Т клеточного звена иммунной системы в период развития бактериальной инфекции. Поэтому различные инфекционные осложнения бактериальной природы вряд ли могли повлиять на баланс гранзим В положительных Т-регуляторных клеток. Таким образом, нами не было получено данных о каких-либо различиях в доле гранзим В+ клеток или уровне экспресии гранзима В в популяциях CD4+ и CD4+CD25high клеток при развитии или отсутствии ЦМВ инфекции. 3.11 Результаты исследования субпопуляций Т лимфоцитов у пациентов после трансплантации аллогенного костного мозга и введении мезенхимальных стромальных клеток в качестве профилактики острой реакции трансплантат против хозяина 91 МСК оказывают важное влияние на иммунную систему, а именно, они способны блокировать дифференцировку моноцитов и кроветворных клетокпредшественников, снижают секрецию Th1- индуцирующего цитокина и интерлейкина (ИЛ) 12, в результате чего возможно контакт - зависимое ингибирование Т-клеток. Также МСК экспрессируют «толерогенный» цитокин ИЛ10. Таким образом, МСК индуцируют созревание ДК в сторону супрессивного или ингибиторного фенотипа, что оказывает высокопротективное действие на развитие РТПХ [82]. МСК ингибируют ответ наивных и антиген-специфических клеток памяти, способны ингибировать продукцию ИЛ2 Т-клетками в результате чего уменьшается образование цитотоксических CD8+ Т лимфоцитов, непосредственно ингибируется пролиферация Т-клеток, но не их активация. МСК индуцируют апоптоз активированных Т-клеток, но не влияют на покоящиеся Тклетки СD3, CD4 и CD8-антигены позволяют характеризовать популяцию Тклеток в зависимости от различных сочетаний данных антигенов. Попытки делить Т лимфоциты на Т хелперы и Т супрессоры позволяют в общем характеризовать популяцию Т клеток по их функциональной активности. Чтобы оценить влияние введения МСК в качестве профилактики оРТПХ на Т клеточную популяцию, мы измеряли в абсолютных и относительных значениях различные субпопуляции Т клеток до и после введения МСК на 1,3,7 и 14 день. Мы выполнили определение процентного содержания CD3+CD4+ и CD3+CD8+ клеток в ПК у больных после трансплантации аллогенного костного мозга до и после введения МСК в качестве профилактики оРТПХ и в контрольной группе здоровых доноров. Cравнение показателей субпопуляций лимфоцитов у больных, получивших МСК в качестве профилактики оРТПХ с донорами приведено в таблице 9. Таблица 9. Абсолютное и относительное количество CD4+ и Трегуляторных (CD4+CD25high) клеток ПК у больных после трансплантации 92 аллогенного костного мозга до введения МСК и в контрольной группе здоровых доноров. Процент Группы Количество Т-регуляторных клеток в ПК CD4+ клеток от лимфоцитов Пациенты (n = 9±2(2-22) % от CD4+ популяции 5,84±1(1,6-11) Абс. Количество кл/мкл 9,13±4,03(0,28-38,68) 10) P=0.014* P=0.27 Доноры (n = 8) 18±4(8-39) 7,38±0,68(4,6-9,4) 72,27±12,27(41,67121,61) Как видно из таблицы 9, у здоровых доноров по сравнению с пациентами, включенными в исследование, отмечается статистически достоверно большее количество Т-регуляторных клеток в абсолютном и относительном значении. Так, у доноров процент Т-регуляторных клеток в ПК составил 7,38±0,68(4,6-9,4), в то время как у больных - 5,84±1(1,6-11). В абсолютных значениях различия оказались более существенными: 72,27±12,27(41,67-121,61) и 9,13±4,03(0,2838,68)у доноров и пациентов, соответственно. Эти различия обусловлены отсутствием полноценной реконституции Т клеточного звена иммунной системы на день введения МСК медиана которого составила – 16 дней (12-39), что 93 является достаточно хорошо описанным фактом в литературе. [24]. Динамика субпопуляции представлена на рисунке 24 и в приложениях 7 и 8. Несмотря на то, что на +1 день после введения МСК среди Т лимфоцитов отмечалось некоторое повышение Т-регуляторных клеток данные изменения оказались статистически не значимыми (рисунок 24). Рисунок 24. Динамика Т-регуляторных клеток в относительных значениях после введения МСК до, на +1, +3, +7, +14 день после введения. При анализе количества клеток в абсолютных значениях (Рисунок 25) также не было выявлено достоверных отличий. 94 Рисунок 25. Динамика Т-регуляторных клеток в абсолютных значениях после введения МСК до, на +1, +3, +7, +14 день после введения. Как видно из рисунка 26, до введения МСК процент CD45+CD3+, CD45+CD3+CD4+ и CD45+CD3+CD8+ составил 13±3(4-30), 9±2(2-22) и 4±1(1-13), соответственно. Более подробно это отражено в приложение 7 и 8 P= 0.03* P= 0.04* P= 0,06* Рисунок 26. Сравнения процентного соотношения субпопуляций Т лимфоцитов у пациентов до введения МСК и здоровых доноров. Процент всех популяций был ниже, чем в контрольной группе доноров, в которой он составил для Т клеток 29±6(18-62) (P=0.03*), для Т хелперов (CD45+CD3+CD4+) -18±4(8-39) (P=0.04*) и 9±2(6-18) для цитотоксических Т клеток (CD45+CD3+CD8+). (P=0.006*) соответственно. 95 Рисунок 27. Динамика субпопуляции Т лимфоцитов в абсолютных значениях после введения МСК до, на +1, +3, +7, +14 день после введения. Как видно из рисунка 27 введение МСК значимо не изменяло (все значения р> 0.05) количество клеток субпопуляций у больных. Таким образом, при исследовании CD45+CD3+CD4+, CD45+CD3+CD8+, CD4+CD25high клеток как до введения МСК, так и в остальные дни после введения мы определили статистически значимо большее количество этих субпопуляций у доноров по сравнению с исследуемой группой. Однако выявить влияние МСК на эти популяции нам не удалось. 3.12 Коэффициент соотношения CD4\CD8 клеток у пациентов после трансплантации аллогенного костного мозга до введения мезенхимальных стромальных клеток и в контрольной группе здоровых доноров. Несмотря на то, что в настоящее время соотношение CD4/CD8 принято считать отражением «здоровья» иммунной системы (нормальное соотношение колеблется между 1 и 4), у пациентов после трансплантации аллогенного костного мозга данный коэффициент не нашел своего применения в отличие от пациентов 96 с ВИЧ инфекцией. При анализе соотношений субпопуляций CD45 +CD3+CD4+ и CD45+CD3+CD8+ до введения МСК коэффициент составил 3,33±0,76(0,39-5,92). У доноров данный показатель составил 2,01±0,36(0,97-3,53). После введения МСК коэффициент существенно не менялся и составил 2,46±0,64(0,35-6,12), 2,49±0,54(0,45-5,15),1,68±0,27(0,69-3,11), 1,38±0,24(0,67-2,68) для 1, 3, 7 и 14 дня соответственно. Причиной этого относительно нормального соотношения CD4\CD8 является тот факт, что CD8 + Т-клетки и НК-клетки восстанавливаются до нормальных значений в течение нескольких месяцев после алло-ТКМ. [5], в отличие от CD4+ Т-клеток которые не восстанавливаются полностью в течение двух лет после трансплантации. Низкое же количество и тех и других на ранних сроках после алло-ТКМ обеспечивает «нормальное» соотношения CD4\CD8 Таким образом можно констатировать что коэффициент соотношения CD4\CD8 абсолютно неприменим (P=0.29) к больным после трансплантации аллогенного костного мозга и не позволяет характеризовать состояние иммунной системы у данных пациентов. Глава 4. Заключение Регуляция Т клеточного звена иммунной системы представляет собой сложнейший каскад, состоящий как из клеточных, так и гуморальных 97 механизмов. Совершенно очевидно, что гранзим В в субпопуляции Т лимфоцитов играет важную роль в процессе регуляции иммунного ответа и модулировании оРТПХ после трансплантации аллогенного костного мозга. Таким образом, именно возможность оценить эти механизмы регуляции и позволяет определить степень значимости этого фактора и использовать его в качестве предиктора в развитии оРТПХ. Гранзим В, который содержится в различных субпопуляциях Т лимфоцитов, играет ключевую роль в регуляции эффекторного Т клеточного звена иммунной системы. Прежде всего чрезвычайно важна его функция в популяции Т- регуляторных клеток. В исследование по изучению экспрессии гранзима В в Т клеточном звене иммунной системы были включены 27 больных после трансплантации аллогенного костного мозга. Оценка экспрессии исследуемых маркеров выполнена на лимфоидной CD4 положительной клеточной популяции ПК у больных после алло-ТКМ до и в контрольные сроки после алло-ТКМ – 30, 60 и 90 день после трансплантации. Также исследования выполнялись в день констатации развития оРТПХ и в группе здоровых доноров. В первую очередь нами были статистически доказаны различия (р=0,0008) и обоснованность используемого нами методологического подхода. В исследовании выявлены отличия в доли и экспрессии гранзима В в популяции клеток с фенотипом CD4+CD25high у больных до алло-ТКМ вне и в ремиссии, и в контрольной группе доноров. Так у доноров и пациентов в ремиссии процент этих клеток был выше чем у пациентов находящихся вне ремиссии до алло-ТКМ. Даже на малой группе хотелось бы отметить что у больных ОЛЛ в ПР процент гранзим В положительных CD4+ клеток был существенно выше, в сравнении и с ОМЛ в ПР и с донорами (p=0.06). Объяснением этому может служить факт различия в распределении гранзима В в популяции Т хелперов. По большому числу сообщений его количество преобладает в популяции Т хелперов первого типа, 98 нежели в остальных субпопуляциях. Таким образом, вероятнее всего, при ОЛЛ имеет место преобладание популяции Т хелперов первого типа. Экспрессия гранзима В внутри CD4+ клеток, у пациентов с ОМЛ после трансплантации вне ремиссии достоверно нарастала и к +90 дню достоверно отличалась (p=0,03) в сравнении с пациентами в ремиссии ОМЛ. Это по, всей видимости, связано с более «интенсивной» антигенной стимуляцией у больных трансплантировавшихся вне ремиссии. Нами была значимость интенсивности иммуносупрессивной терапии у пациентов после алло-ТКМ. Так у больных после алло-ТКМ от неродственного донора, что предполагает более интенсивную ИСТ, доля гранзим В положительных CD4+CD25high клеток на +30 день было значимо ниже (p=0.04), нежели чем у пациентов после алло-ТКМ от родственного донора. Данная тенденция сохранилась и для интенсивности экспрессии гранзима В в CD4+ клетках на +30 и +90 день после алло-ТКМ. Так, у пациентов после алло-ТКМ от неродственного донора интенсивность экспрессии гранзима В по MFI был значимо ниже (P=0.0003 и P=0,001) на +30 и +90 день по сравнению с пациентами после алло-ТКМ от родственного донора. Что, по всей видимости, связано с интенсивностью иммуносупрессии и/или источником трансплантата. В нашем исследовании также было показано, что доля экспрессирующих гранзим В клеток в популяции CD4+CD25high – была более высокой на всех контрольных сроках на (+30 и +60 день) при отсутствии РТПХ за время наблюдения и статистически более низким (P= 0.003 и P= 0.03) в сравнении с долей таких клеток в день развития оРТПХ. А также при сравнении доли гранзим В-позитивных CD4+\CD25high клеток на +30 день у пациентов без оРТПХ и пациентов с оРТПХ после +30 дня (p=0.003). Этот факт крайне интересен, поскольку свидетельствует о возможности предположить, у кого из больных при обследовании в контрольные сроки может развиться оРТПХ или нет, что открывает перспективу превентивной терапии оРТПХ. 99 Учитывая это, была выполнена попытка выполнить расчет отношения шансов (Odds ratio, OR) -он составил 2.7 (CI95=0.5-14), при пороге в 5%, значение p при расчете методом Хи-квадрат составило 0,24 - что недостоверно, и по всей видимости связано с малой выборкой. Также была предпринята попытка проанализировать изменение субпопуляций Т лимфоцитов после введения МСК. Однако при анализе нам лишь в очередной раз удалось подтвердить достоверно большее абсолютное число Т клеток (P=0.03), Т-регуляторных клеток (P=0.014), Т хелперов (P=0.04*) и цитотоксических Т лимфоцитов (P=0.006*) у доноров нежели реципиентов костного мозга. Также нами было показано неправомочность использования соотношения CD4\CD8 клеток как какого-то интегрального показателя у больных после трансплантации аллогенного костного мозга. Таким образом, выявленные изменения свидетельствуют о необходимости проведения дальнейших исследований в этой области и попытке использовать количество гранзим В положительных CD4+CD25high клеток как маркерапредиктора развития оРТПХ. 100 Выводы: 1. Частота развития острой РТПХ (II-IV ст) у больных, включенных в исследование, составила 41% и не зависела от фазы заболевания, диагноза, режима кондиционирования, типа донора. 2. У доноров и пациентов в полной ремиссии доля гранзим В положительных Трег (CD4+CD25high) клеток выше, чем у пациентов находящихся вне ремиссии до трансплантации аллогенного костного мозга. 3. При трансплантации положительных Трег от неродственного (CD4+CD25high) донора клеток на доля +30 гранзим день В после трансплантации значительно ниже, чем при использовании трансплантата от родственного донора (p<0.05). 4. Доля гранзим В положительных клеток в популяции Трег (CD4+CD25high) было более высоким на всех контрольных сроках при отсутствии оРТПХ (p<0.05). 5. Доля гранзим В положительных клеток в популяции (CD4+CD25high) в день констатации оРТПХ было значимо ниже, чем на любых контрольных сроках у пациентов без оРТПХ (p<0.05). 101 Список литературы 1. Adrain C, Duriez PJ, Brumatti G, Delivani P, Martin SJ.] The cytotoxic lymphocyte protease, granzyme B, targets the cytoskeleton and perturbs microtubule polymerization dynamics.J Biol Chem. 2006 Mar 24;281(12):811825. 2. Appelbaum Frederick R., Stephen J. Forman, Robert S. Negrin, Karl G. Blume “Thomas' Hematopoietic Cell Transplantation: Stem Cell Transplantation”,2004 3. Asselin-Labat ML, David M, Biola-Vidamment A, Lecoeuche D, Zennaro MC, Bertoglio J, Pallardy M.GILZ, a new target for the transcription factor FoxO3, protects T lymphocytes from interleukin-2 withdrawal-induced apoptosis. Blood. 2004 Jul 1;104(1):215-23 4. Atkinson K. Reconstitution of the haemopoietic and immune systems after marrow transplantation. Bone Marrow Transplant 1990; 5: 209–26.) 5. Autran B, Leblond V, Sadat-Sowti B, et al. A soluble factor released by CD8+CD57+ lymphocytes from bone marrow transplanted patients inhibits cellmediated cytolysis. Blood 1991;77:2237–2241 6. Aversa F, Tabilio A, Velardi A et al. Treatment of high-risk acute leukemia with T-cell-depleted stem cells from related donors with one fully mismatched HLA haplotype. N Engl J Med 1998; 339: 1186–93 7. Bahceci E, Epperson D, Douek DC et al. Early reconstitution of the T-cell repertoire after nonmyeloablative peripheral blood stem cell transplantation is from post-thymic T-cell expansion and is unaffected by graft-versus-host disease or mixed chimaerism. Br J Haematol 2003; 122: 934–43. 8. Balciunaite G, Ceredig R, Fehling HJ, Zúñiga-Pflücker JC, Rolink AG The role of Notch and IL-7 signaling in early thymocyte proliferation and differentiation.Eur J Immunol. 2005 Apr;35(4):1292-300. 102 9. Barry M, Heibein JA, Pinkoski MJ, Lee SF, Moyer RW, Green DR, Bleackley RC.Granzyme B short-circuits the need for caspase 8 activity during granulemediated cytotoxic T-lymphocyte killing by directly cleaving Bid.Mol Cell Biol. 2000 Jun;20(11):3781-94. 10.Belkaid Y. Regulatory T cells and infection: a dangerous necessity. Nat Rev Immunol. 2007 Nov;7(11):875-88. 11.Blanco P, Pitard V, Viallard JF, Taupin JL, Pellegrin JL, Moreau JF.Increase in activated CD8+ T lymphocytes expressing perforin and granzyme B correlates with disease activity in patients with systemic lupus erythematosus.Arthritis Rheum. 2005 Jan;52(1):201-11 12.Brunkow, M.E., et al. 2001. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat. Genet. 27:68-73 13.Cancrini C., Ferrua F. Role of reduced intensity conditioning in T-cell and B-cell immune reconstitution after HLA-identical bone marrow transplantation in ADASCID, Haematologica. 2010 Oct;95(10):1778-82 14.Chinnaiyan AM, Hanna WL, Orth K, Duan H, Poirier GG, Froelich CJ, Dixit VM.Cytotoxic T-cell-derived granzyme B activates the apoptotic protease ICELAP3. Curr Biol. 1996 Jul 1;6(7):897-9. 15.Clarke SL, Betts GJ, Plant A, Wright KL, El-Shanawany TM, Harrop R, Torkington J, Rees BI, Williams GT, Gallimore AM, Godkin AJ. CD4+CD25+FOXP3+ regulatory T cells suppress anti-tumor immune responses in patients with colorectal cancer. PLoS One. 2006 Dec 27;1:e129 16.Cohen G, Carter SL, Weinberg KI et al. Antigenspecific T-lymphocyte function after cord blood transplantation. Biol Blood Marrow Transplant 2006; 12: 1335– 42. 17.Cooper MD, Raymond DA, Peterson RD, South MA, Good RA The functions of the thymus system and the bursa system in the chicken. 103 18.Cutler C, Giri S, Jeyapalan S, Paniagua D, Viswanathan A, Antin JH.Acute and chronic graft-versus-host disease after allogeneic peripheral-blood stem-cell and bone marrow transplantation: a meta-analysis.J Clin Oncol. 2001 Aug 15;19(16):3685-91 19.Deeg HJ, Storb R. Graft-versus-host disease: pathophysiological and clinical aspects. Annu Rev Med 1984; 35: 11–24. 20.Dolstra H, Preijers F, Van de Wiel-van Kemenade E, et al. Expansion of CD8+CD57+ T cells after allogeneic BMT is related with a low incidence of relapse and with cytomegalovirus infection. Br J Haematol 1995;90:300–307 21.Domingues HS, Mues M, Lassmann H, Wekerle H, Krishnamoorthy G.Functional and pathogenic differences of Th1 and Th17 cells in experimental autoimmune encephalomyelitis. PLoS One. 2010 Nov 29;5(11):e15531. 22.Edwin W. Ades,Robert K. Zwerner, Ronald T. Acton, And Charles M. Balch Isolation and partial characterization of the human homologue of Thy-1 J Exp Med. 1980 February 1; 151(2): 400–406 23.El-Serafi I, Abedi-Valugerdi M, Potácová Z, Afsharian P, Mattsson J, Moshfegh A, Hassan M. Cyclophosphamide alters the gene expression profile in patients treated with high doses prior to stem cell transplantation. PLoS One. 2014 Jan 22;9(1): e86619 24.Foot AB, Potter MN, Donaldson C, Cornish JM, Wallington TB, Oakhill A, Pamphilon DH Immune reconstitution after BMT in children. Bone Marrow Transplant. 1993 Jan;11(1):7-13 25.Garín MI, Chu CC, Golshayan D, Cernuda-Morollón E, Wait R, Lechler RI.Galectin-1: a key effector of regulation mediated by CD4+CD25+ T cells. Blood. 2007 Mar 1;109(5):2058-65. 26.Gaspar H.B., Aiuti A., Porta F., Candotti F., Hershfield M.S., Notarangelo L.D. . How I treat ADA deficiency. Blood. 2009; 114(17):3524–32. 27.Gunturi A, Berg RE, Forman J. The role of CD94/NKG2 in innate and adaptive immunity. Immunol Res. 2004; 30(1):29-34. 104 28.Hansen,W., K. Loser, A.M.Westendorf, D. Bruder, S. Pfoertner, C. Siewert, J. Huehn, S. Beissert, and J. Buer. 2006. G protein-coupled receptor 83 overexpression in naive CD4+CD25- T cells leads to the induction of Foxp3+ regulatory T cells in vivo. J Immunol 177:209–215 29.Hebart H, Bollinger C, Fisch P, Sarfati J, Meisner C, Baur M, Loeffler J, Monod M, Latgé JP, Einsele H.]. Analysis of T-cell responses to Aspergillus fumigatus antigens in healthy individuals and patients with hematologic malignancies. Blood. 2002 Dec 15;100(13):4521-8 30.Heibein JA, Barry M, Motyka B, Bleackley RC. Granzyme B-induced loss of mitochondrial inner membrane potential (Delta Psi m) and cytochrome c release are caspase independent. J Immunol 1999; 163: 4683–4693 31.Hodge S, G Hodge, J Ahern, C-L Liew,P Hopkins, D C Chambers, P N Reynolds, and M Holmes Increased levels of T cell granzyme b in bronchiolitis obliterans syndrome are not suppressed adequately by current immunosuppressive regimens Clin Exp Immunol. Nov 2009; 158(2): 230–236 32.Huang CT, Workman CJ, Flies D, Pan X, Marson AL, Zhou G, Hipkiss EL, Ravi S, Kowalski J, Levitsky HI, Powell JD, Pardoll DM, Drake CG, Vignali DA Role of LAG-3 in regulatory T cells.Immunity. 2004 Oct;21(4):503-13 33.Jakubowski AA, Small TN, Young JW et al. T cell depleted stem-cell transplantation for adults with hematologic malignancies: sustained engraftment of HLA-matched related donor grafts without the use of antithymocyte globulin. Blood 2007; 110:4552–9 34.Jenkins MK, Schwartz RH, Pardoll DM. Effects of cyclosporine A on T cell development and clonal deletion. Science 1988; 241: 1655–8 35.Jiménez M, Martínez C, Ercilla G et al. Reducedintensity conditioning regimen preserves thymic function in the early period after hematopoietic stem cell transplantation. Exp Hematol 2005; 33:1240–8 36.Joachim H. How I treat refractory acute GVHD Blood. May 15, 2007; 109(10): 4119–4126. 105 37.Kapoor N, Chan R, Weinberg KI, Burotto F, Parkman R. Defective anticarbohydrate antibody responses to naturally occurring bacteria following bone marrow transplantation. Biol Blood Marrow Transplant 1999; 4: 46–50 38.Kastan M.B., Schlaffer E., Russo J.E., Colvin O.M., Civin C.I, Hilton J. Direct demonstration of elevated aldehyde dehydrogenase in human hematopoietic progenitor cells Blood. 1990 May 15;75(10):1947-50 39.Klingemann H. Relevance and potential of natural killer cells in stem cell transplantation. Biol Blood Marrow Transplant 2000;6:90–99 40.Kook H, Goldman F, Padley D, et al. Reconstruction of the immune system after unrelated or partially matched T-cell-depleted bone marrow transplantation in children: immunophenotypic analysis and factors affecting the speed of recovery. Blood 1996;88:1089–1097. 41.Lamb LS, Abhyankar SA, Hazlett L, et al. Expression of CD134 (0X-40) on T cells during the first 100 days following allogeneic bone marrow transplantation as a marker for lymphocyte activation and therapy-resistant graft-versus-host disease. Cytometry 1999;38:238–243 42.LeMaoult J, Caumartin J, Daouya M, Favier B, Le Rond S, Gonzalez A, Carosella ED.Immune regulation by pretenders: cell-to-cell transfers of HLA-G make effector T cells act as regulatory cells. Blood. 2007 Mar 1;109(5):2040-8.] 43.Linch DC, Knott LJ, Thomas RM et al. T cell regeneration after allogeneic and autologous bone marrow transplantation. Br J Haematol 1983; 53:451–8 44.Liu W, Putnam AL, Xu-Yu Z, Szot GL, Lee MR, Zhu S, Gottlieb PA, Kapranov P, Gingeras TR, Fazekas de St Groth B, Clayberger C, Soper DM, Ziegler SF, Bluestone JA.CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. J Exp Med. 2006 Jul 10;203(7):1701-11. 45.Ljungman P CMV infections after hematopoietic stem cell transplantation Bone Marrow Transplantation (2008) 42, S70–S72; doi:10.1038/bmt.2008.120 106 46.Ljungman P, Wilczek H, Gahrton G et al. Longterm acyclovir prophylaxis in bone marrow transplant recipients and lymphocyte proliferation responses to herpes virus antigens in vitro. Bone Marrow Transplant 1986; 1: 185–92. 47.Lobe CG, Finlay BB, Paranchych W, Paetkau VH, Bleackley RC. Novel serine proteases encoded by two cytotoxic T lymphocyte-specific genes. Science 1986; 232: 858–861 48.Loeb CR, Harris JL, Craik CS.] Granzyme B proteolyzes receptors important to proliferation and survival, tipping the balance toward apoptosis. J Biol Chem. 2006 Sep 22;281(38):28326-35. 49.Luznik L, Javier Bolaños-Meade, Marianna Zahurak, Allen R. Chen, B. Douglas Smith, Robert Brodsky, Carol Ann Huff, Ivan Borrello, William Matsui, Jonathan D. Powell, Yvette Kasamon, Steven N. Goodman, Allan Hess, Hyam I. Levitsky, Richard F. Ambinder, Richard J. Jones and Ephraim J. Fuchs High-dose cyclophosphamide as single-agent, short-course prophylaxis of graft-versus-host disease 50.Luznik L., Engstrom L.W, Iannone R, Fuchs E.J. Posttransplantation Cyclophosphamide Facilitates Engraftment of Major Histocompatibility Complex– Identical Allogeneic Marrow in Mice Conditioned With Low-Dose Total Body Irradiation , Biol Blood Marrow Transplant. 2002;8(3):131-8. 51.Luznik L., O'Donnell P.V., Symons H.J., Chen A.R., Leffell M.S., Zahurak M. et. Al. HLA-Haploidentical Bone Marrow Transplantation for Hematologic Malignancies Using Nonmyeloablative Conditioning and High-Dose, Posttransplantation Cyclophosphamide. Biol Blood Marrow Transplant. 2008 Jun;14(6):641-50. 52.Luznik L., O'Donnell P.V., Symons H.J., Chen A.R., Leffell M.S., Zahurak M. et. Al. HLA-Haploidentical Bone Marrow Transplantation for Hematologic Malignancies Using Nonmyeloablative Conditioning and High-Dose, Posttransplantation Cyclophosphamide. Biol Blood Marrow Transplant. 2008 Jun;14(6):641-50 107 53.Mackall CL, Fleisher TA, Brown MR et al. Age,thymopoiesis, and CD4+ Tlymphocyte regeneration after intensive chemotherapy. N Eng J Med 1995; 332: 143–9 54.Mackall CL, Fry TJ, Bare C et al. IL-7 increases both thymic-dependent and thymic-independent Tcell regeneration after bone marrow transplantation. Blood 2001; 97: 1491–7 55.Mackay CR. Dual personality of memory T cells. Nature. 1999 Oct 14;401(6754):659-60. 56.Maeda T., Eto M., Nishimura Y., Nomoto K., Kong Y.-Y. & Nomoto K. Direct evidence for clonal destruction of allo-reactive T cells in the mice treated with cyclophosphamide after allo-priming Immunology. 1993 Jan;78(1):113-21. 57.Masson D, Tschopp J. A family of serine esterases in lytic granules of cytolytic T lymphocytes. Cell 1987; 49: 679–685 58.Matsuoka K, Kim HT, McDonough S, et al. Altered regulatory T cell homeostasis in patients with CD4+ lymphopenia following allogeneic hematopoietic stem cell transplantation. J Clin Invest 2010;120(5):1479-1493 59.Maziarz R.T., Slater S., Blood and Marrow Transplant Handbook, Oregon, 2011, page 39, 60.Megan KL MacLeod, John W Kappler, and Philippa Marrack Memory CD4 T cells: generation, reactivation and re-assignment Immunology. May 2010; 130(1): 10–15. 61.Mohty M.Mechanisms of action of antithymocyte globulin: T-cell depletion and beyond.Leukemia. 2007 Jul;21(7):1387-94. 62.Morley JK, Batliwalla FM, Hingorani R, et al. Oligoclonal CD8+ T cells are preferentially expanded in the CD57+ subset. J Immunol 1995;154:6182–6190 63.Morris ES., Kelli P. A. MacDonald, and Geoffrey R. Hill «Stem cell mobilization with G-CSF analogs: a rational approach to separate GVHD and GVL?» 64.Motyka B, Korbutt G, Pinkoski MJ, Heibein JA, Caputo A, Hobman M, Barry M, Shostak I, Sawchuk T, Holmes CF, Gauldie J, Bleackley RC.Mannose 6- 108 phosphate/insulin-like growth factor II receptor is a death receptor for granzyme B during cytotoxic T cell-induced apoptosis. Cell. 2000 Oct 27;103(3):491-500 65.Nakajima H, Park HL, Henkart PA. Synergistic roles of granzymes A and B in mediating target cell death by rat basophilic leukemia mast cell tumors also expressing cytolysin/perforin. J Exp Med 1995; 181: 1037–1046 66.Niehues T, Rocha V, Filipovich AH, Chan KW, Porcher R, Michel G, Ortega JJ, Wernet P, Göbel U, Gluckman E, Locatelli F.Factors affecting lymphocyte subset reconstitution after either related or unrelated cord blood transplantation in children -- a Eurocord analysis. Br J Haematol. 2001 Jul;114(1):42-8. 67.Noel DR, Witherspoon RP, Storb R et al. Does graft-versus-host disease influence the tempo of immunologic recovery after allogeneic human marrow transplantation? An observation on 56 long-term survivors. Blood 1978; 51: 1087– 105 68.Ottinger HD, Beelen DW, Scheulen B, Schaefer UW, Gross-Wilde H. Improved immune reconstitution after allotransplantation of peripheral blood stem cells instead of bone marrow. Blood 1996; 88:2775–9 69.Ozdemir E, St John LS, Gillespie G et al. Cytomegalovirus reactivation following allogeneic stem cell transplantation is associated with the presence of dysfunctional antigen-specifi c CD8+ T cells. Blood 2002; 100: 3690–7 70.Parkman R, Cohen G, Carter SL et al. Successful immune reconstitution decreases leukemic relapse and improves survival in recipients of unrelated cord blood transplantation. Biol Blood Marrow Transplant 2006; 12: 919–27 71.Patel DD, Gooding ME, Parrott RE et al. Thymic function after hematopoietic stem-cell transplantation for the treatment of severe combined immunodeficiency. N Engl J Med 2000; 342: 1325–32. 72.Pérez-Martínez A, González-Vicent M, Valentín J, Aleo E, Lassaletta A, Sevilla J, Vicario JL, Ramírez M, Díaz MA. Early evaluation of immune reconstitution following allogeneic CD3/CD19-depleted grafts from alternative donors in childhood acute leukemia. Bone Marrow Transplant. 2012 Nov;47(11):1419-27 109 73.Petersen S L, L P Ryder, P Björk, H O Madsen, C Heilmann, N Jacobsen, H Sengeløv and L L Vindeløv A comparison of T-, B- and NK-cell reconstitution following conventional or nonmyeloablative conditioning and transplantation with bone marrow or peripheral blood stem cells from human leucocyte antigen identical sibling donors Bone Marrow Transplantation (2003) 32, 65–72. 74.Reisner Y, Kapoor N, Kirkpatrick D et al. Transplantation for severe combined immunodeficiency with HLA-A, B, D, DR incompatible parental marrow cells fractionated by soybean agglutinin and sheep red blood cells. Blood 1983; 61: 341–8 75.Rissoan MC, Duhen T, Bridon JM, Bendriss-Vermare N, Péronne C, de Saint Vis B, Brière F, Bates EE. Subtractive hybridization reveals the expression of immunoglobulin-like transcript 7, Eph-B1, granzyme B, and 3 novel transcripts in human plasmacytoid dendritic cells. Blood. 2002 Nov 1;100(9):3295-303. 76.Robert J. Soiffer MD Stem Cell Transplantation for Hematologic Malignancies, 2008 77.Robertson MJ, Ritz J. Biology and clinical relevance of human natural killer cells. Blood 1990;76:2421–2438. 78.Rowbottom A, Garland R, Lepper M, et al. Functional analysis of the CD8+CD57+ cell population in normal healthy individuals and matched unrelated T-cell-depleted bone marrow transplant recipients. Br J Haematol 2000;110:315– 321 79.Ruggeri L, Capanni M, Urbani E et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science 2002; 295: 2097– 100. 80.Sadat-Sowti B, Debre P, Mollet L, et al. An inhibitor of cytotoxic functions produced by CD8+CD57+ T-lymphocytes from patients suffering from AIDS and immunosuppressed bone marrow recipients. Eur J Immunol 1994;24:2882–2888. 110 81.Sallusto F, Lenig D, Förster R, Lipp M, Lanzavecchia A. Two subsets of memory T lymphocytes with distinct homing potentials and effector functions.Nature. 1999 Oct 14;401(6754):708-12. 82.Sato,K., Yamashita,N., Yamashita,N., Baba,M., and Matsuyama,T. (2003). Regulatory dendritic cells protect mice from murine acute graft-versus-host disease and leukemia relapse. Immunity. 18, 367-379. 83.Savino W, Postel-Vinay MC, Smaniotto S, et al. The thymus gland: a target organ for growth hormone. Scand J Immunol 2002;55:442–452. 84.Schmitz N, Eapen M, Horowitz MM et al. Longterm outcome of patients given transplants of mobilized blood or bone marrow: a report from the International Bone Marrow Transplant Registry and the European Group for Blood and Marrow Transplantation. Blood 2006; 108: 4288–90 85.Schroff RW, Gale RP, Fahey JL. Regeneration of T cell subpopulations after bone marrow transplantation: cytomegalovirus infection and lymphoid subset imbalance. J Immunol 1982;129:1926–1930 86.Sehn LH, Alyea EP, Weller E, Canning C, Lee S, Ritz J, Antin JH, Soiffer RJ.Comparative outcomes of T-cell-depleted and non-T-cell-depleted allogeneic bone marrow transplantation for chronic myelogenous leukemia: impact of donor lymphocyte infusion. J Clin Oncol. 1999 Feb;17(2):561-8 87.Sharma V, Delgado M, Ganea D.;Activation-Induced T Helper Cell Death Contributes to Th1/Th2 Polarization following Murine Schistosoma japonicum Infection Gratama JW, Verdonck LF, Van Der Linden JA et al. Cellular immunity to vaccinations and herpesvirus infections after bone marrow transplantation.Transplantation 1986; 41: 719–24. 88.Sheng F. Cai, Xuefang Cao, Anjum Hassan, Todd A. Fehniger, Timothy J. Ley Granzyme B is not required for regulatory T cell–mediated suppression of graftversus-host disease? Blood. 2010 March 4; 115(9): 1669–1677 111 89.Shenoy S, Mohanakumar T, Todd G, et al. Immune reconstitution following allogeneic peripheral blood stem cell transplants. Bone Marrow Transplant 1999;23:335–346 90.Shi L, Kraut RP, Aebersold R, Greenberg AH. A natural killer cell granule protein that induces DNA fragmentation and apoptosis. J Exp Med 1992; 175: 553–566. 91.Shimoda M, Saraya T, Tsujimoto N, Kurai D, Takizawa H, Goto H.Fatal Disseminated Cryptococcosis Resembling Miliary Tuberculosis in a Patient with HIV Infection. Intern Med. 2014;53(15):1641-4 92.Sinha ML, Fry TJ, Fowler DH, Miller G, Mackall CL. Interleukin 7 worsens graftversus-host disease. Blood. 2002 Oct 1;100(7):2642-9 93.Small TN, Avigan D, Dupont B, et al. Immune reconstitution following T-cell depleted bone marrow transplantation: effect of age and post-transplant graft rejection prophylaxis. Biol Blood Marrow Transplant 1997;3:65–75 94.Small TN, Papadopoulos EB, Boulad F, et al. Comparison of immune reconstitution after unrelated and related T-cell-depleted bone marrow transplantation: effect of patient age and donor leukocyte infusions.Blood 1999;93:467–480 95.Sojka DK, Hughson A, Fowell DJ.CTLA-4 is required by CD4+CD25+ Treg to control CD4+ T-cell lymphopenia-induced proliferation.Eur J Immunol. 2009 Jun;39(6):1544-51. 96.Storek J, Dawson MA, Storer B et al. Immune reconstitution after allogeneic marrow transplantation compared with blood stem cell transplantation. Blood 2001; 97: 3380–9 97.Storek J, Joseph A, Dawson MA et al. Factors influencing T-lymphopoiesis after allogeneic hematopoietic cell transplantation. Transplantation 2002; 73: 1154–8. 98.Taub DD, Longo DL Insights into thymic aging and regeneration. Immunol Rev. 2005 Jun;205:72-93. 99.Thomas HE, Trapani JA, Kay TW. The role of perforin and granzymes in diabetes. Cell Death Differ. 2010 Apr;17(4):577-85 112 100. Tian ZG, Woody MA, Sun R, et al. Recombinant human growth hormone promotes hematopoietic reconstitution after syngeneic bone marrow transplantation in mice. Stem Cells 1998;16:193–199 101. Todd W. Kelley and Olga Efimova Induction of Granzyme B expression in human regulatory T cells requires TCR and CD28 triggering but not IL-2 and is suppressed by inhibitors of the PI3K-mTOR pathway. 102. Trapani JA, Browne KA, Dawson M, Smyth MJ.] Immunopurification of functional Asp-ase (natural killer cell granzyme B) using a monoclonal antibody. Biochem Biophys Res Commun. 1993 Sep 15;195(2):910-20 103. Tutschka PJ, Copelan EA, Klein JP. Bone marrow transplantation for leukemia following a new busulfan and cyclophosphamide regimen. Blood. 1987 Nov;70(5):1382-8. 104. Veneri Dino, Massimo Franchini, Donata de Sabata, Silvia Ledro, Antonio Vella, Riccardo Ortolani, Giovanni Pizzolo, and Fabio Benedetti Blood Transfus. Oct 2008; 6(4): 220–224 105. Vignali DA, Collison LW, Workman CJ.How regulatory T cells work. Nat Rev Immunol. 2008 Jul;8(7):523-32. doi: 10.1038/nri2343 106. Volpi I, Perruccio K, Tosti A et al. Postgrafting administration of granulocyte colony-stimulating factor impairs functional immune recovery in recipients of human leukocyte antigen haplotypemismatched hematopoietic transplants. Blood 2001; 97: 2514–21 107. Weinberg K, Blazar BR, Wagner JE et al. Factors affecting thymic function after allogeneic hematopoietic stem cell transplantation. Blood 2001; 97:1458–66.), 108. Welte K, Kiobanu N, Moore MAS et al. Defective interleukin-2 production in patients after bone marrow transplantation and in vitro restoration of defective Tlymphocyte proliferation by highly purified interleukin 2. Blood 1984; 64: 380–5.), 109. Witherspoon RP, Storb R, Ochs HD et al. Recovery of antibody production in human allogeneic marrow graft recipients: infl uence of time posttransplantation, 113 the presence or absence of chronic graft-versus-host disease, and antithymocyte globulin treatment. Blood 1981; 58: 360–8 110. Wu CJ, Chillemi A, Alyea EP, Orsini E, Neuberg D, Soiffer RJ, Ritz J. Reconstitution of T-cell receptor repertoire diversity following T-cell depleted allogeneic bone marrow transplantation is related to hematopoietic chimerism. Blood. 2000 Jan ;95(1):352-9 111. Wursch AM, Gratama JW, Middeldorp JM, et al. The effect of cytomegalovirus infection on T lymphocytes after allogeneic bone marrow transplantation. Clin Exp Immunol 1985;62:278–287. 112. Xhaard A, Moins-Teisserenc H, Busson M, Robin M, Ribaud P, Dhedin N, Abbes S, Carmagnat M, Kheav VD, Maki G, Peffault de Latour R, Toubert A, Socié G. Reconstitution of regulatory T-cell subsets after allogeneic hematopoietic SCT.Bone Marrow Transplant. 2014 Aug;49(8):1089-92 113. Xiao-jun Huang Current status of haploidentical stem cell transplantation for leukemia J Hematol Oncol. 2008; 1: 27. Published online 2008 December 31. doi: 10.1186/1756-8722-1-27 114. Xinyu Xu, Xiaoyun Wen, Ying Chi, Lei He, Sha Zhou, Xuefeng Wang, Jiaqing Zhao, Feng Liu, and Chuan Su Granzyme B, a new player in activation-induced cell death, is down-regulated by vasoactive intestinal peptide in Th2 but not Th1 effectors. J Immunol. 2006 Jan 1;176(1):97-110. 115. Yang K, Fan ZP, Liu QF, Zhang Y Effect of donor CD4+CD25+ regulatory T cells on hematopoietic and immune reconstitution, GVHD and disease-free survival after allogeneic hematopoietic stem cell transplantation Nan Fang Yi Ke Da Xue Xue Bao. 2008 Apr;28(4):537-41 116. Yang X, Stennicke HR, Wang B, Green DR, Jänicke RU, Srinivasan A, Seth P, Salvesen GS, Froelich CJ Granzyme B mimics apical caspases. Description of a unified pathway for trans-activation of executioner caspase-3 and -7.J Biol Chem. 1998 Dec 18;273(51):34278-83 114 117. Zeiser R, Nguyen VH, Beilhack A et al. Inhibition of CD4+CD25+ regulatory Tcell function by calcineurin-dependent interleukin-2 production. Blood 2006; 108: 390–9 118. Е.Н. Паровичникова, И.В. Гальцева, И.А. Воробьев Характеристика Тклеточного звена иммунной системы у больных острыми лейкозами // Терапевтический архив : Научно-практический журнал. - 2006. - Том78, N7. С. 18-25 : 119. Желнова Е. И., Демидова И.А., Гальцева И. В., Любимова Л. С., Мисюрин А. В., Савченко В.Г. Количественный анализ гемопоэтического химеризма у больных после аллогенной трансплантации стволовых клеток крови методом иммуномагнитной селекции и ПЦР-амплификации гипервариабельных участков ДНК научное издание Молекулярная медицина. - 2009. - N3. - С. 3237 115 Приложение Приложение 1. Схемы предтрансплантационного кондиционирования (препараты, дозы, дни введения) Кондиционирование Доза Дни введения «Бусульфан+циклофо Бусульфан 4мг/кг/сут с-7 по -4 дни сфан» циклофосфан 60 мг/кг с-3 по -2 дни Флюдарабин 25 мг/м2/сут с-6 по -4 дни Тиотепа 10 мг/кг/сут с-5 по -4 дни Кармустин 400 мг/м2 -6 день «Тиотепа+флюдараби н+кармустин» Препараты с -10 по -7 FLAMSA флюдарабин 30 мг/м2/сут день и с -4 по -3 день (модифицированная) идарубицин 10 мг/м2/сут с -10 по -8 день 116 с -10 по -7 цитозар 2 г/м2/сут бусульфан 4 мг/кг/сут с -4 по -3 день «Флюдарабин+бусуль Флюдарабин 30 мг/м2/сут с-10 по -5 дни фан» 4 мг/кг/сут с-6 по -5 дни «Циклофосфан+треос Циклофосфан 60 мг/кг/сут -3 и -2 день ульфан» треосульфан 12 г/м2 С -6 по -4 Флюдарабин 25 мг/м2/сут с-6 по -2 дни мелфалан 70 мг/м2 с-3 по -2 дни бусульфан «Флюдарабин+мелфа лан» день Приложение 2.Схемы профилактики острой реакции трансплантат против хозяина (препараты, дозы, дни введения) Схемы Препараты Доза Циклоспорин А 3 мг/кг/сут «ЦСА+МТХ» Метотрексат «АТГ+ЦСА+ММФ» Антитимоцитарный глобулин Дни введения С -1 дня до 180 дня 15 мг/м2 в +1 день 10 мг/м2 в +3,6,11 день 10 мг/кг/сут с-4 по -1 день 117 Циклоспорин А Микофенолата мофетил Антитимоцитарный глобулин Циклоспорин А «АТГ+ЦСА+ММФ+ МСК» Микофенолата мофетил Мезенхимальные стромальные клетки Антитимоцитарный глобулин Циклоспорин А 3 мг/кг/сут Микофенолата мофетил Метотрексат «АТГ+ЦСА+ММФ+ Антитимоцитарный МТХ+МСК» глобулин дня 3 г/сут С +1 дня до 60 дня 10 мг/кг/сут с-4 по -1 день 3 мг/кг/сут 3 г/сут С -1 дня до 180 дня С +1 дня до 60 дня День 1*106/кг восстановления показателей крови 10 мг/кг/сут 3 мг/кг/сут «АТГ+ЦСА+ММФ+ МТХ» С -1 дня до 180 с-4 по -1 день С -1 дня до 180 дня 3 г/сут С +1 дня до 60 дня 15 мг/м2 в +1 день 10 мг/м2 в +3,6,11 день 10 мг/кг/сут с-4 по -1 день 118 Циклоспорин А Микофенолата мофетил Метотрексат Мезенхимальные стромальные клетки Антитимоцитарный глобулин «АТГ+ МТХ» ЦСА+ Циклоспорин А Метотрексат Антитимоцитарный глобулин Циклоспорин А 3 мг/кг/сут Метотрексат Мезенхимальные стромальные клетки дня 3 г/сут С +1 дня до 60 дня 15 мг/м2 в +1 день 10 мг/м2 в +3,6,11 день День 1*106/кг восстановления показателей крови 10 мг/кг/сут 3 мг/кг/сут с-4 по -1 день С -1 дня до 180 дня 15 мг/м2 в +1 день 10 мг/м2 в +3,6,11 день 10 мг/кг/сут с-4 по -1 день 3 мг/кг/сут «АТГ+ЦСА+МТХ+ МСК» С -1 дня до 180 С -1 дня до 180 дня 15 мг/м2 в +1 день 10 мг/м2 в +3,6,11 день 1*106/кг День восстановления 119 показателей крови Антитимоцитарный глобулин Циклофосфамид «АТГ+ЦФ+МСК» Мезенхимальные стромальные клетки Циклофосфамид «ЦФ+МСК» Мезенхимальные стромальные клетки 10 мг/кг/сут с-4 по -1 день 50 мг/кг/сут +3, +4 день День 1*106/кг восстановления показателей крови 50 мг/кг/сут +3, +4 день День 1*106/кг восстановления показателей крови Приложение 3. Характеристика доли и интенсивности экспрессии гранзима В в CD4+ и CD4+CD25high клетках у больных до алло-ТКМ и в контрольной группе доноров. Экспрессия гранзима В в Экспрессия Группы гранзима CD4+ клетках CD4+CD25high клетках М±m (разброс значений) М±m (разброс значений) В в 120 Процент Процент Granzyme B - положительных MFI CD4+ клеток Granzyme B положительных - MFI CD4+CD25high клеток Пациент ы (n = 27) 7,8±1,4 4099,5 2,0±0,5 1867,1±572,4 (0,4-27) ±663,9 (0-10,4) (0-14842) 1934,6 2±815, Доноры (n = 8) 1,9±0,57 5 (0,2-4,6) (6196869) 6,96±1,92 (1,5-16,5) 5803,37±1481 (1467-12143) Приложение 4. Характеристика доли и интенсивности экспрессии гранзима В в CD4+ и CD4+CD25high клетках у больных до алло-ТКМ в зависимости от нозологии. Группы Экспрессия гранзима В в CD4+ клетках Экспрессия гранзима В в CD4+CD25high клетках М±m (разброс значений) М±m (разброс значений) 121 CD4+Granzyme B+ В Вне 5,68±1,28(0,4-11,7) ОМЛ/МДС (n = 13) ОЛЛ (n = 12) MFI В Вне 12,3±2,68 (0,6-27) 2 MFI В В Вне 4202,17±1305 ,68(3551,95±0,76(0-8,3) 17007) 4842, 3055, 4,24±1,46( 63±1 8±119 1,8-8,7) 883,8 6,63(3 1(218 5566662) 1700 4461,83±785, 7) 11,44±2,59(0,6-27) 78(10468678) 6,21±1,8 1(0,411,7) CD4+CD25high Granzyme B+ Вн е 2328,17±1233, 79(0-14842) 2636,5±189 1 5 0,7±0,28(0,1-1,6) 7,25(07 14842) 1571 1 ± 6 1643,67±506,90 2,39±0,95(0-10,4) 8, 8(0-5440) 4 9 4696,6 2,61±1,0 1793,09±53 ( 4±821, 187 2(0,20 0,59(41206 19(104 9 10,4) 5440) 0 6-8678) 7 3 1562±1453,81 870,5±594,68(4 6 1,2±0,57(0,8-1,6) (534-2590) 50-1291) 9 1 ) 2,54± 1,12(0 -8,3) ЛПЗ (n = 2) 0,85±0,07(0,8-0,9) Доноры (n = 8) 6,96±1,92 5803,37±1481 1,9±0,57 1934,62±815,5 (1,5-16,5) (1467-12143) (619-6869) (0,2-4,6) 122 Приложение 5. Характеристика доли и интенсивности экспрессии гранзима В в CD4+ и CD4+CD25high клетках ПК у больных после трансплантации аллогенного костного мозга в зависимости от наличия активной ЦМВ инфекции. Группы Экспрессия гранзима В в CD4+ клетках Экспрессия гранзима В в CD4+CD25high клетках М±m (разброс значений) М±m (разброс значений) CD4+Granzyme B+ CD4+CD25high Granzyme B+ MFI 10,59±4,61(097,9) 1319,09±411,72(07709) 3,11±0,79(014,3) 1619,9±416,32(05180) 8,6±10,61(1,116,1) 1469,5±1424,82(462 -2477) MFI 60 3230±820, 33,57±20,17(0,3 96(392-436) 13796) 90 12,2±3,8(0,972,7) 60 3747±606, 26,65±29,91(5,5 7(3318-47,8) 4176) 90 29,2±34,65(4,753,7) ЦМВ – (n=24) ЦМВ + (n=3) 3117,73±5 97,53(2959057) 2780±2179 1258,5±1132,08(458 ,3(12395,1±6,79(0,3-9,9) -2059) 4321) Приложение 6. Характеристика доли и интенсивности экспрессии гранзима В в CD4+ и CD4+CD25high клетках ПК у больных после трансплантации аллогенного костного мозга при использовании циклофосфамида в качестве индуктора толерантности. 123 Экспрессия гранзима В в CD4+ клетках Экспрессия гранзима В в CD4+CD25high клетках М±m (разброс значений) М±m (разброс значений) CD4+Granzyme B+ MFI CD4+CD25high Granzyme B+ 12,2±3,87(0,5-70,4) 3227,14±487, 06(454-9095) 6,68±2,01(0-30) 1766,67±307,75(0-4349) 60 31,15±20,05(0,3436) 3361,19±819, 5(392-13796) 6,89±1,84(0-25,7) 1332,32±414,03(0-7709) 90 13,54±4,26(0,9-72,7) 2887,14±584, 3(295-9057) 3,36±0,87(0-14,3) 1263,05±335,96(0-5127) 30 16,27±14,35(0,639,2) 1737,33±606, 11(813-2506) 3,7±3,52(0,2-9,4) 5977,33±3116,59(10859638) 60 53,3±47,8(19,5-87,1) 2369,5±115,2 6(2288-2451) 49,35±68,66(0,8-97,9) 1324±1110,16(539-2109) 90 14,4±10,32(7,1-21,7) 5316,5±1014, 7(4599-6034) 2,65±2,19(1,1-4,2) 4827±499,22(4474-5180) Группы Без ЦФ (n=23) С ЦФ (n=4) MFI 124 Приложение 7. Абсолютное число Т клеток из различных субпопуляций Т лимфоцитов ПК у больных после трансплантации аллогенного костного мозга на разных сроках после введения МСК. Абсолютное число клеток в мкл Субпопуляции Т лимфоцитов Т лимфоциты (CD45+CD3+) 0 день +1 день +3 день +7 день +14 день Доноры 157,34± 42,67(2 2,53486,08) 237,46± 73,16(4 8,75738,4) 194,05± 49,09(6 0,51528,77) 308,08± 397,9±95 1598,79±149 90,04(6 ,86(100,6 ,69(1229,999,348-889,1) 2206,97) 865,12) 125 Т хелперы (CD45+CD3+CD4+) Цитотоксические Т клетки (CD45+CD3+CD8+) Т-регуляторные клетки (CD4+\CD25high) 111,34± 33,08(9, 18351,63) 136,94± 37,34(3 6,47343,06) 121,25± 29,23(3 1,55285,18) 165,85± 41,27(3 6,01366,51) 209,25±5 987,85±141, 1,97(62,6 15(553,3171600,07) 515,99) 43,48±1 2,82(12, 66119,19) 93,92±3 6,77(11, 07374,59) 68,83±2 2,12(17, 12232,55) 130,85± 182,87±5 527,04±54,7 48,79(3 3,4(35,2- 4(394,410,09526,62) 820,82) 486,28) 9,13±4, 03(0,28 -38,68) 8,6±3,2 1(1,4134,01) 6,7±2,6 2(0,9626,41) 6,69±2, 96(0,41 -27,05) 6,13±2,5 4(0,8724,77) 72,27±12,27( 41,67121,61) Приложение 8. Относительное число различных субпопуляций Т лимфоцитов ПК у больных после трансплантации аллогенного костного мозга на разных сроках после введения МСК. Субпопуляции Т лимфоцитов в Процентное содержание субпопуляции Т лимфоцитов в ПК проценте от CD45 событий 126 0 +1 день +3 день +7 день +14 день Доноры 13±3(4-30) 14±3(526) 10±2(2- 12±4(2- 13±3(420) 35) 28) 29±6(1862) 9±2(2-22) 8±1(315) 6±1(113) 7±2(119) 6±1(314) 18±4(839) 4±1(1-13) 6±2(115) 4±1(19) 5±2(116) 6±2(115) 9±2(6-18) 5,37±1, 45(0,913,9) 4,36±0, 98(0,48,3) 2,93±0,4 6(0,74,8) 7,38±0,68( 4,6-9,4) день Т лимфоциты (CD45+CD3+) Т хелперы + + (CD45 CD3 CD 4+) Цитотоксическ ие Т клетки + + (CD45 CD3 CD 8+) Т-регуляторные 6,48±1,2 5,84±1(1,6клетки 4(1,811) 11,5) (CD4+CD25high)