доклад - Иммунология гемопоэза
advertisement

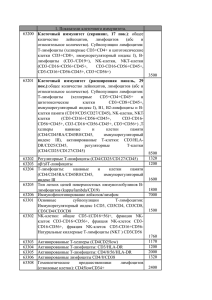
А.М. Попов Результаты работы группы по иммунодиагностике МРБ в онкогематологии. Предложения по терминологии и набору маркеров Иммунология гемопоэза. Костный мозг у онкологических больных, Москва, 9-10 июня 2014 г. Вопрос №1 Какие маркеры должны входить в панель для диагностического иммунофенотипирования ОЛ Требования к панели антител Наличие в каждой пробирке антитела, позволяющего идентифицировать бластные клетки: CD45 Линиеспецифичные антигены Маркеры клеток-предшественников Маркеры разных стадий созревания Маркеры, позволяющие отличать опухолевые клетки от нормальных Маркеры, применяемые для мониторинга МОБ Панель должна удовлетворять всем современным классификациям Антитела, применяемые для иммунофенотипирования ОЛ Общелейкоцитарный антиген: CD45 В-линейные маркеры: CD19, CD10, CD22, cytCD79a, CD20, CD24, κ-цепь, λ-цепь, μ-цепь Т-линейные маркеры: CD7, cytCD3, CD5, CD2, CD1a, CD4, CD8, CD3, TCRαβ, TCRγδ NK-клеточные маркеры: CD16, CD56 Миелоидные маркеры: CD33, CD13, CD15, CD14, CD65, CD64, CD11c, CD117, MPO, Lysozyme, CD61, CD41a, CD71, CD235a, CD66b, CD11b, CD11a Маркеры клеток-предшественников: CD34, CD133, CD99, TdT Активационные антигены: HLA-DR, CD38 Опухоле-ассоциированные маркеры: CD58, NG2 Антитела, применяемые для иммунофенотипирования ОЛ Общелейкоцитарный антиген: CD45 В-линейные маркеры: CD19, CD10, CD22, cytCD79a, CD20, CD24, κ-цепь, λ-цепь, μ-цепь Т-линейные маркеры: CD7, cytCD3, CD5, CD2, CD1a, CD4, CD8, CD3, TCRαβ, TCRγδ NK-клеточные маркеры: CD16, CD56 Миелоидные маркеры: CD33, CD13, CD15, CD14, CD65, CD64, CD11c, CD117, MPO, Lysozyme, CD61, CD41a, CD71, CD235a, CD66b, CD11b, CD11a Маркеры клеток-предшественников: CD34, CD133, CD99, TdT Активационные антигены: HLA-DR, CD38 Опухоле-ассоциированные маркеры: CD58, NG2 Пациент №3 ♀ 10 лет Направительный диагноз: острый лимфобластный лейкоз, рецидив Цитологическое исследование костного мозга: 26% бластных клеток CD19 99,9% SSC CD22 CD33 CD14 78,3% 22,4% CD3 99,9% 21,7% CD7 99,9% CD13 CD64 CD45 iCD79a CD14 NG2 CD34 iMPO 6,9% 99,9% 2,7% 99,9% 97,3% CD11c CD10 55,5% iCD3 CD15 CD10 44,5% 93,1% CD10 93,2% 99,9% CD117 CD10 99,9% 94,8% 6,8% CD20 Kappa Lambda CD45 iKappa 99,9% 99,9% 5,2% CD34 IgM CD19 iLysozyme CD58 iIgM 99,5% 99,9% iLambda iCD19 Антитела, применяемые для иммунофенотипирования ОЛ Общелейкоцитарный антиген: CD45 В-линейные маркеры: CD19, CD10, CD22, cytCD79a, CD20, CD24, κ-цепь, λ-цепь, μ-цепь Т-линейные маркеры: CD7, cytCD3, CD5, CD2, CD1a, CD4, CD8, CD3, TCRαβ, TCRγδ NK-клеточные маркеры: CD16, CD56 Миелоидные маркеры: CD33, CD13, CD15, CD14, CD65, CD64, CD11c, CD117, MPO, Lysozyme, CD61, CD41a, CD71, CD235a, CD66b, CD11b, CD11a Маркеры клеток-предшественников: CD34, CD133, CD99, TdT Активационные антигены: HLA-DR, CD38 Опухоле-ассоциированные маркеры: CD58, NG2 Вопрос №2 Какую классификацию необходимо использовать при диагностике ОЛЛ? Иммунофенотипические классификации ОЛЛ EGIL (M.C. Bene et al, Leukemia, 1995) В-линейные ОЛЛ BI-ОЛЛ BII-ОЛЛ BIII-ОЛЛ BIV-ОЛЛ Т-линейные ОЛЛ TI-ОЛЛ TII-ОЛЛ TIII-ОЛЛ TIV-ОЛЛ Острые гибридные лейкозы Острый бифенотипический лейкоз Острый билинейный лейкоз NK-ОЛЛ Острый недифференированный лейкоз ВОЗ (J.W. Vardiman et al, Blood, 2009) В-лимфобластный лейкоз/лимфома Т-лимфобластный лейкоз/лимфома Острые лейкозы неясной линейности Острый недифференцированный лейкоз Острые лейкозы смешанной линейности В-линейные острые лимфобластные лейкозы Маркер Pro-B (BI) Common B (BII) Pre-B (BIII) B-ALL (BIV) CD19 CD22 cyt + + + + + + + + CD79a cyt CD10 CD20 CD34 HLA-DR TdT IgM cyt IgM surf + -/+ +/+ + - + + +/+/+ + - + +/+/-/+ + +/+ - + +/+/+ + + T-линейные острые лимфобластные лейкозы Маркер Pro-T (TI) Pre-T (TII) Cortical T (TIII) T-ALL (TIV) TdT + + + +/- CD3 cyt + + +/- - CD7 + + + + CD2 - + + + CD1a - - + - CD5 - + + + CD34 +/- +/- - - HLA-DR +/- - - - CD3 surf - -/+ -/+ + CD4+8 - - + - CD4 или CD8 - - +/- + TCRαβ/γδ - - - + Пациент №5 ♂ 8 лет Направительный диагноз: острый лейкоз Цитологическое исследование костного мозга: тотальная инфильтрация бластными клетками CD19 CD22 CD33 SSC 2,6% 45,5% 54,5% 92,1% 29,6% 97,4% 70,2% CD7 CD3 CD13 CD45 CD14 iCD79a CD14 NG2 14,5% 85,3% 99,9% 99,9% 99,8% CD64 CD34 54,6% CD11c iMPO iCD3 CD10 CD15 CD99 44,9% 85,9% 98,7% 1,3% 99,8% 16,1% CD117 CD1a iLysozyme CD7 TCRγδ CD8 iTdT 36,7% 28,9% CD5 1,7% 99,8% CD2 70,9% 60,3% iCD3 1,3% CD4 99,8% TCRαβ Пациент №5 MPAL; 1 TIV-ОЛЛ ; 2 Т-ОЛЛ; 5 TI-ОЛЛ ; 1 TII-ОЛЛ ; 11 Пациент №5 MPAL; 1 TIV-ОЛЛ ; 2 Т-ОЛЛ; 5 TI-ОЛЛ ; 1 TII-ОЛЛ ; 11 Классификация EGIL Bene MC et al, Leukemia, 1995 Пациент №5 MPAL; 1 TIV-ОЛЛ ; 2 Т-ОЛЛ; 5 TI-ОЛЛ ; 1 TII-ОЛЛ ; 11 Классификация EGIL Bene MC et al, Leukemia, 1995 Пациент №5 Однако: Не определена экспрессия Т-клеточных рецепторов CD3 экспрессируется лишь на части опухолевой популяции Экспрессируется CD34 (???) Кроме того: CD3-позитивная субпопуляция определяется при TОЛЛ достаточно часто. Все эти случаи – TIV? Классификация AIEOP-BFM (модифицированная EGIL) CD1aneg and surfaceCD3pos (CD3strong, or CD3weak and TCR pos) Вопрос №3 Как определять лейкозы «неясной линейности»? Острый бифенотипический лейкоз Баллы В-линейные Т-линейные Миелоидные 2 CD79a (s/cyt) CD22 (s/cyt) cytIgM CD3 (s/cyt) TCRαβ TCRγδ MPO 1 CD19 CD20 CD10 CD2 CD5 CD8 CD10 CD13 CD33 CDw65 CD117 0,5 TdT CD24 CD14 CD15 CD64 Определение линейной принадлежности опухолевых клеток (ВОЗ, 2008) Миелоидная линия Миелопероксидаза, определенная любым методом или Не менее двух моноцитарных антигенов (НСЭ, CD11c, CD64, CD14, лизоцим) Т-линия Цитоплазматическая экспрессия CD3, определенная методом проточной цитометрии с использованием антител к ε цепи рецептора или Мембранная экспрессия CD3 В-линия Яркая экспрессия CD19 и как минимум одного из следующих антигенов: CD10, cytCD22, cytCD79a или Слабая экспрессия CD19 и яркая экспрессия как минимум двух из следующих антигенов: CD10, cytCD22, cytCD79a Вопрос №4 Какие маркеры нужно использовать для мониторинга МОБ? 1st Workshop on the MRD monitoring standardization in ALL-MB and MLL-Baby protocols (Ekaterinburg, Nov 2007) Группа исследования МОБ в рамках протоколов ALL-MB и MLL-Baby 1st Workshop on the MRD monitoring standardization in ALL-MB and MLL-Baby protocols (Екатеринбург, Ноябрь 2007 г) Дизайн исследования День 0 День 15 День 36 День 85 Панель MoAB (FITC/PE/PE-Cy7(PerCP)/APC) Для BII/BIII-ALL: CD45/CD20/CD10/CD19 CD45/CD58/CD10/CD19 CD45/CD11a/CD10/CD19 CD45/CD34/CD10/CD19 CD45/CD38/CD10/CD19 Для BI-ALL: CD10+20/CD38/CD45/CD19 CD10+20/CD34/CD45/CD19 Для T-ALL: CD99/CD7/CD5/CD3 TdT/CD7/CD3cyt/CD3 CD45/CD7/CD5/CD3 Комбинаци антител для мониторинга МОБ ВП-ОЛЛ Основные: CD19 (SJ25C1 или J4.119), CD10 (SS2/36 или HI10a), CD34 (8G12), CD58 (AICD58) CD20, CD45, CD38 Дополнительные: CD11a, CD11b, CD123, My, NG2 etc... Т-ОЛЛ Основные: CD7, CD3cyt, CD3, CD5, CD99 (3B2), CD45, CD4, CD8 Дополнительные: TdT, CD1a, CD2, CD34, My etc… Требования к панели антител Наличие в каждой пробирке антитела, позволяющего идентифицировать бластные клетки: CD45 Линиеспецифичные антигены Маркеры клеток-предшественников Маркеры разных стадий созревания Маркеры, позволяющие отличать опухолевые клетки от нормальных Маркеры, применяемые для мониторинга МОБ Панель должна удовлетворять всем современным классификациям Требования к панели антител Наличие в каждой пробирке антитела, позволяющего идентифицировать бластные клетки: CD45 Линиеспецифичные антигены Маркеры клеток-предшественников Маркеры разных стадий созревания Маркеры, позволяющие отличать опухолевые клетки от нормальных Маркеры, применяемые для мониторинга МОБ Панель должна удовлетворять всем современным классификациям Требования к панели антител Наличие в каждой пробирке антитела, позволяющего идентифицировать бластные клетки: CD45 Линиеспецифичные антигены Маркеры клеток-предшественников Маркеры разных стадий созревания Маркеры, позволяющие отличать опухолевые клетки от нормальных Комбинации маркеров, применяемые для мониторинга МОБ Панель должна удовлетворять всем современным классификациям Требования к панели антител Наличие в каждой пробирке антитела, позволяющего идентифицировать бластные клетки: CD45 Линиеспецифичные антигены Маркеры клеток-предшественников Маркеры разных стадий созревания Маркеры, позволяющие отличать опухолевые клетки от нормальных Комбинации маркеров, применяемые для мониторинга МОБ Панель должна удовлетворять всем современным классификациям Первичная панель FITC PE PerCP PE-Cy7 APC APC-Cy7 CD7 CD10 CD45 CD22 CD19 CD3 CD64 CD13 CD45 CD33 CD11c CD14 CD15 NG2 CD45 CD34 CD117 LZ MPO CD45 CD79a CD3 cyt В-линия FITC PE PerCP ECD PE-Cy7 APC APC-Cy7 CD58 CD10 CD45 CD38 CD34 CD19 CD20 Kappa Lambda CD19 IgM CD45 Kappa cyt Lambda cyt CD19 IgM cyt CD45 Т-линия FITC PE PerCP ECD PE-Cy7 APC APC-Cy7 CD99 CD7 CD45 CD5 CD3 cyt TdT CD3 CD99 CD7 CD8 CD5 CD3 cyt CD4 CD3 TCRαβ TCRγδ CD3 CD2 CD1a CD45 Миелоидная линия Дети 1го года жизни FITC PE PerCP PE-Cy7 APC APC-Cy7 CD61 GlyA CD45 CD33 CD41a CD4 FITC PE PerCP APC CD65 CD133 CD45 CD19 CD7 CD133 CD45 CD99 CD133 CD45 CD33 Первичная панель FITC PE PerCP PE-Cy7 APC APC-Cy7 CD7 CD10 CD45 CD22 CD19 CD3 CD64 CD13 CD45 CD33 CD11c CD14 CD15 NG2 CD45 CD34 CD117 LZ MPO CD45 CD79a CD3 cyt В-линия FITC PE PerCP ECD PE-Cy7 APC APC-Cy7 CD58 CD10 CD45 CD38 CD34 CD19 CD20 Kappa Lambda CD19 IgM CD45 Kappa cyt Lambda cyt CD19 IgM cyt CD45 Т-линия FITC PE PerCP ECD PE-Cy7 APC APC-Cy7 CD99 CD7 CD45 CD5 CD3 cyt TdT CD3 CD99 CD7 CD8 CD5 CD3 cyt CD4 CD3 TCRαβ TCRγδ CD3 CD2 CD1a CD45 Миелоидная линия Дети 1го года жизни FITC PE PerCP PE-Cy7 APC APC-Cy7 CD61 GlyA CD45 CD33 CD41a CD4 FITC PE PerCP APC CD65 CD133 CD45 CD19 CD7 CD133 CD45 CD99 CD133 CD45 CD33 Вопросы для обсуждения: формат заключения Описание иммунофенотипа опухолевых клеток должно включать все маркеры, или лучше ограничиться только «позитивными»? Какие экспрессируемые маркеры должны выноситься в заключение помимо основного варианта ОЛЛ? Должны ли в заключении быть сформулированы признаки опухолевой природы бластных клеток? Насколько детальной должна быть «словесная» часть заключения? Насколько необходима классификация Т-линейных ОЛЛ? Можно ли ограничиться заключением «Т-ОЛЛ», или, скажем, специфицировать только CD1a+ и CD1a-? Каковы должны быть критерии «зрелого» Т-линейного ОЛЛ? Как должен формулироваться диагноз при гетерогенной экспрессии диагностических маркеров Спасибо за внимание!