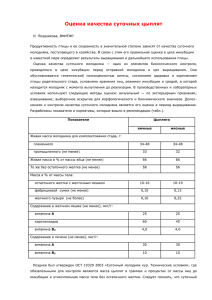
1 Федеральное государственное образовательное учреждение высшего профессионального образования
advertisement

1 Федеральное государственное образовательное учреждение высшего профессионального образования Московская государственная академия ветеринарной медицины и биотехнологии имени К. И. Скрябина На правах рукописи Ермолова Юлия Сергеевна ОБРАБОТКА ЯИЦ КУР БИОЛОГИЧЕСКИ АКТИВНЫМИ ПРЕПАРАТАМИ ДЛЯ СТИМУЛЯЦИИ РЕЗИСТЕНТНОСТИ ЦЫПЛЯТ НА РАЗЛИЧНЫХ СТАДИЯХ ОНТОГЕНЕЗА 06.02.05 – ветеринарная санитария, экология, зоогигиена и ветеринарно-санитарная экспертиза Диссертация на соискание ученой степени кандидата биологических наук Научный руководитель: заслуженный деятель науки Российской Федерации, доктор сельскохозяйственных наук, профессор М.С. Найденский Москва – 2010 2 СОДЕРЖАНИЕ ВВЕДЕНИЕ………….......................................................................................... 5 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ................................................................... 9 1.1. Применение естественных метаболитов и комплексных препаратов на их основе для стимуляции роста и развития животных ..................................................................................................... 9 1.2. Применение тканевых препаратов для повышения естественной резистентности животных............................................... 15 1.3. Биологическая роль микроэлементов и их влияние на обмен веществ, здоровье и продуктивность животных.................................. 23 ГЛАВА 2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ ........................................ 42 2.1. Материал и методы исследований .................................................. 42 2.2. Результаты исследований................................................................. 47 2.2.1. Первая серия экспериментов – эффективность предынкубационной обработки яиц растворами АСД Ф-2 ..................... 47 2.2.1.1. Опыт 1............................................................................... 47 2.2.1.1.1. Показатели биоконтроля инкубации ....................... 47 2.2.1.2. Опыт 2............................................................................... 50 2.2.1.2.1. Показатели биоконтроля инкубации ....................... 51 2.2.1.2.2. Анатомические показатели цыплят........................ 54 2.2.1.2.3. Некоторые показатели неспецифической резистентности................................................................................. 56 2.2.1.2.4. Биохимические исследования сыворотки крови ...... 57 2.2.1.2.5. Зооветеринарные показатели .................................. 57 2.2.1.3. Опыт 3............................................................................... 59 2.2.1.3.1. Показатели биоконтроля инкубации ....................... 59 3 2.2.2. Оптимизация эффекта применения препарата АСД путем двукратной обработки яиц ......................................................................... 62 2.2.2.1. Опыт 4............................................................................... 62 2.2.2.1.1. Показатели биоконтроля инкубации ...................... 63 2.2.2.2. Опыт 5............................................................................... 66 2.2.2.2.1. Показатели биоконтроля инкубации ....................... 66 2.2.2.2.2. Анатомические показатели цыплят........................ 70 2.2.2.2.3. Некоторые показатели неспецифической резистентности................................................................................. 72 2.2.2.2.4. Гематологические исследования.............................. 72 2.2.2.2.5. Биохимические исследования сыворотки крови ...... 73 2.2.2.2.6. Зооветеринарные показатели .................................. 73 2.2.3. Третья серия экспериментов – эффективность предынкубационной обработки яиц растворами комплекса микроэлементов.......................................................................................... 75 2.2.3.1. Опыт 6............................................................................... 75 2.2.3.1.1. Показатели биоконтроля инкубации ....................... 76 2.2.3.2. Опыт 7............................................................................... 78 2.2.3.2.1. Показатели биоконтроля инкубации ....................... 78 2.2.3.2.2. Анатомические показатели цыплят........................ 82 2.2.3.2.3. Некоторые показатели неспецифической резистентности................................................................................. 82 2.2.3.2.4. Биохимические исследования сыворотки крови ...... 84 2.2.3.2.5. Зооветеринарные показатели .................................. 85 2.2.4. Четвертая серия экспериментов – эффективность двукратной обработки яиц растворами комплекса микроэлементов .......................... 86 2.2.4.1. Опыт 8............................................................................... 86 2.2.4.1.1. Показатели биоконтроля инкубации ...................... 87 4 2.2.4.2. Опыт 9............................................................................... 90 2.2.4.2.1. Показатели биоконтроля инкубации ....................... 90 2.2.4.3. Опыт 10............................................................................. 93 2.2.4.3.1. Показатели биоконтроля инкубации ...................... 93 2.2.4.4. Опыт 11............................................................................. 96 2.2.4.4.1. Показатели биоконтроля инкубации ....................... 96 2.2.4.4.2. Анатомические показатели цыплят........................ 99 2.2.4.4.3. Некоторые показатели неспецифической резистентности............................................................................... 101 2.2.4.4.4. Гематологические иследовния................................ 101 2.2.4.4.5. Биохимические исследования сыворотки крови .... 102 2.2.4.4.6. Зооветеринарные показатели ................................ 103 2.2.4.5. Производственная проверка.......................................... 105 ГЛАВА 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ .......... 110 ВЫВОДЫ……................................................................................................. 130 СВЕДЕНИЯ О ПРАКТИЧЕСКОМ ИСПОЛЬЗОВАНИИ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ........................................................... 133 РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ НАУЧНЫХ ВЫВОДОВИ…................................................................................................ 133 СПИСОК ЛИТЕРАТУРЫ............................................................................ 134 ПРИЛОЖЕНИЯ ............................................................................................. 154 5 ВВЕДЕНИЕ Актуальность темы Промышленное птицеводство как самая наукоемкая и динамичная отрасль АПК вносит весомый вклад в обеспечение населения развитых стран продовольствием. За последние 20 лет среднегодовой прирост яиц и мяса в мире превышает 4% (Фисинин В.И., 2006). Эффективность птицеводства во многом зависит от результатов инкубации яиц и жизнеспособности молодняка птицы. Доля влияния генотипа на выводимость яиц составляет 15%, а на сохранность молодняка 5%, тогда как доля влияния внешних факторов 85% и 95% соответственно (Кочиш И.И. и др., 2007). За 2008 г. гибель птицы от болезней составила 47,2 млн. гол. или 3,8% от всего поголовья. Сохранность молодняка птицы не превышала 93,2%, а яичных кур 96,2% (Фисинин В.И., 2009). С применением новых технологических схем, направленных на повышение яйценоскости, нагрузка на организм птицы значительно возрастает. Нарушения в кормлении и содержании родительского стада кур могут спровоцировать заболевания и повышенный падеж поголовья, а также снижение инкубационного качества яиц (Забудский Ю.И., 2004; Бессарабов Б.Ф., 2007; Фисинин В.И., 2009). В связи с этим большое значение приобрела проблема использования физических и химических стимуляторов для профилактики заболеваний и повышения продуктивности птицы на различных стадиях онтогенеза, включая и эмбриональный период (Szymkiewics M.M. et. al., 1985; Mazurkievicy M. Et al., 1992; Забудский Ю.И., 2002; Кочиш О.И., 2006; Кочиш И.И. и др., 2008; Егоров И.А., Имангулова Ш.А., 2005). Однако многие аспекты вышеуказанной проблемы требуют дальнейшей разработки и обоснования. Особенно эффективно применение 6 различных стимуляторов на ранней стадии онтогенеза, когда организм наиболее реактивен и пластичен. В связи с этим актуален поиск возможностей прогнозирования результатов инкубации и управления эмбриональным развитием птицы для получения молодняка высокого качества, что имеет важное зоотехническое и экономическое значение (Naidensky M.S., 1996; Дядичкина Л.Ф, 2008). Поэтому необходима разработка мероприятий, направленных на цыплят комплекса зоогигиенических повышение резистентности организма на различных стадиях онтогенеза путем целенаправленного применения эффективных адаптогенов. К таким препаратам относятся некоторые естественные метаболиты (органические кислоты: сукцинат, фумаровая кислота, глицин и другие), а также тканевые препараты, которые применяются в животноводстве, как эффективные стимуляторы при выращивании и откорме с.-х. животных и птиц, а также для профилактики заболеваний. В связи с изложенным, для обработки инкубационных использовали отечественные препараты комплексного действия: яиц АСД фракция 2 (АСД Ф-2), а также органический комплекс микроэлементов. АСД Ф-2 (антисептик стимулятор Дорогова) содержит низкомолекулярные компоненты, которые по своей структуре аналогичны метаболитам клеточного обмена и, следовательно, свойственны живому организму. АСД обладает нейротропным, холиномиметическим действием, активизирует обменные процессы в организме, повышает его успешно применяют в ветеринарной практике для неспецифическую резистентность. Препарат повышения жизнеспособности телят, поросят и цыплят (Дерябина З.И., 1980 г.; Графов Д., Бесарабов Б., Гонцова Л., 2007 г. и др.). Однако несмотря на выполненные исследования до сих пор не изучена эффективность применения АСД для обработки инкубационных яиц с целью повышения резистентности цыплят на различных стадиях онтогенеза. 7 В последнее время для восполнения дефицита микроэлементов и аминокислот фирмой «А-Био» разработан комплексный препарат под коммерческим названием Ферропептид, который содержит микроэлементы (Fe, Cu, Co, Zn, Mn, Se и J2) в комплексе с декстраном и их хелаты, а также пептиды (ферментативный гидролизат соевого белка). Содержание микроэлементов в препарате 1 мл содержит Железо (III) в комлексе с декстраном Медь в комплексе с железом-декстраном Кобальт в комплексе с железом-декстраном Селен в комплексе с железом-декстраном Йод Марганец (хелат) Цинк (хелат) Абиопептид мг 5,0 0,5 0,2 0,04 0,14 20 14 60 Данный препарат предназначен для алиментарного применения. Впервые действие его на эмбриональное развитие мясных цыплят было изучено член-корр. РАСХН, профессором Кочишем И.И. и аспирантом Боруком В.В. Однако влияние этого препарата на эмбриональное развитие цыплят яичных кроссов еще не изучено. Цель и задачи исследований Цель работы – определить оптимальные инкубационных яиц растворами микроэлементов схемы обработки АСД Ф-2, а также комплекса для стимуляции эмбрионального и постэмбрионального развития цыплят кросса «Птичное». Для достижения указанной цели были поставлены следующие задачи: 1. Изучить влияние предынкубационной обработки яиц растворами АСД Ф-2, концентраций а также на комплекса некоторые микроэлементов показатели постэмбрионального развития цыплят. различных эмбрионального и 8 2. Определить возможность эмбриогенеза оптимизации эффекта путем повторного применения стимуляции вышеуказанных препаратов. 3. Установить влияние вышеуказанных препаратов на некоторые анатомические, гематологические и биохимические показатели цыплят. 4. Изучить длительность последействия препаратов на рост и резистентность цыплят. 5. Определить экономическую эффективность оптимальных схем применения АСД Ф-2 и комплекса микроэлементов. Научная новизна Впервые изучено влияние обработки инкубационных яиц кур кросса «Птичное» растворами препаратов АСД Ф-2, а также комплекса микроэлементов на эмбриональное и постэмбриональное развитие цыплят. Дано биологическое и зоотехническое обоснование оптимальных концентраций и схем применения препаратов. Доказано, что оптимальная концентрация препаратов при двукратной обработке яиц (перед и на 19-е сутки инкубации) повышает вывод кондиционного молодняка, естественную резистентность и некоторые биохимические показатели цыплят, улучшает рост и развитие молодняка. На защиту выносятся следующие положения диссертации: 1. Обработка стимуляции инкубационных эмбрионального яиц и растворами АСД Ф-2 постэмбрионального для развития цыплят и повышения их резистентности. 2. Использование растворов препарата комплекса микроэлементов для обработки инкубационных яиц с целью повышения резистентности цыплят на различных стадиях онтогенеза. 9 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Применение естественных метаболитов и комплексных препаратов на их основе для стимуляции роста и развития животных За последние выполнением годы вследствие ветеринарно-санитарных недостаточного и контроля гигиенических за требований произошло снижение как вывода цыплят, так и резистентности полученного молодняка. Так, вывод цыплят яичных кроссов колеблется от 62 до 85%, при нормативном уровне не менее 80%, а сохранность молодняка – всего 87,7% (Фисинин В.И., 2004). Поэтому повышение вывода кондиционных цыплят при минимальных дополнительных затратах и без существенного изменения технологии инкубации имеет важное экономическое значение (Забудский Ю.И., 2000; Кочиш И.И. и др., 2007). В настоящее время широкое распространение получило применение естественных метаболитов, стимуляторов роста и развития сельскохозяйственных животных, и в частности органических кислот - янтарная и аминоуксусная кислоты (глицин), а также комплекс препаратов, полученных на их основе - митомин, лимонтар, эмицидин и другие. Янтарная кислота, ЯК, сукцинат (бутандиовая кислота, этан- 1,2дикарбоновая кислота), общей формулы: HOOC–CH2–CH2–COOH, образуется в цикле трикарбоновых кислот Кребса, обеспечивающей энергетические потребности организма. Установлено, что янтарная кислота и ее соли обладают адаптогенной способностью, оказывая антиоксидантное, антистрессовое и нейротропное действия, нормализуют энергетический, углеводный обмены, общее физиологическое состояние организма, усиливают биохимические и физиологические восстановительные процессы в различных органах в условиях патологии и интенсивной физической нагрузки и устраняет метаболический ацидоз. В организме действие сукцината реализуется через регуляторные центры – гипоталамус и 10 надпочечники. (Bindoli A. Et al., 1982; Найденский М.С., Нестеров В. В., и др., 1999; Нестеров В.В., Тотоева М.Э., Волчкова Л.А., 2003). Янтарная кислота является универсальным антистрессовым препаратом и с этой целью широко применяется в медицине, ветеринарии и животноводстве (Aberle E.D., Morkol R.A., 1974; Velon S.M., Tomas S., 1981; Toutain P.L., 1985; Tretter L. Et al, 1987; Kondrashova M.N. et al., 1991; Rafal P., 1994). Глицин (гликокол) - является простейшей аминоуксусной кислотой, используется в организме для синтеза парных желчных кислот, глутатиона, креатинина, серина, коламина, пуринов и порфиринов. При недостатке глицина в рационе замедляется рост молодняка, снижается конверсия корма и повышается гибель птицы. Обмен глицина связан с метаболизмом триптофана, метионина, серина, бетаина, холина и креатина (Нестеров В.В., Тотоева М.Э., Волчкова Л.А., 2003). Митомин – комплексный препарат, включающий янтарную кислоту, витамин С и фруктозу, с широким спектром действия: способствует активации энергетического обмена во всех тканях организма, повышает его устойчивость к воздействию окружающей среды, стимулируя иммунную систему. Эмицидин – производное 3-оксипиридина и янтарной кислоты, водорастворимый выраженным антиоксидант антигипоксическим нового поколения, эффектом. Механизм обладающий его действия заключается в способности нейтрализовать в организме свободные радикалы, разрушающие клетки. В последние годы под руководством профессора Найденского М.С. сотрудниками и аспирантами кафедры зоогигиены им. А.К. Даниловой разработан ряд методов по стимуляции обработке инкубационных яиц кур с целью жизнеспособности цыплят, начиная с ранних стадий эмбриогенеза водными растворами сукцината, сукцинатсодержащими и другими биологически активными препаратами (Найденский М.С., Лазарева 11 Н.Ю., Констанди О.Х., 2000; Кочиш И.И., Найденский М.С., Азарнова Т.О., Краснобаев Ю.В., 2008) По данным ряда авторов (Лазарева Н.Ю., 1998; Агеева К.М., 2006; Кочиш И.И., Найденский М.С., Елизаров Е.С., 2007) установлено, что при обработке инкубационных яиц кур яичных и мясных кроссов растворами янтарной кислоты увеличивается выводимость яиц на 2-5,3%, а вывод кондиционного молодняка на 2-5%. При этом повышаются энергетический, белковый, липидный обмены, а также естественная резистентность цыплят. В.А. Грицюк (2000) был получен положительный эффект от однократной аэрозольной обработки яиц кур кросса «Ломан коричневый» 0,3% раствором янтарной кислоты, при этом выводимость яиц увеличилась на 2,28-11,8%, живая масса в 20-дневном возрасте – на 5,4-7,5%. Однако, ростостимулирующий эффект продолжался не более первых 2-х декад постэмбрионального развития. Исследования С.С. Бурлакова (2001) показали, что предынкубационная обработка яиц мясных кур кросса «Исса-Ведетте» 0,3% растворами комплекса препаратов (глицин+янтарная кислота+крезацин или глицинат меди+янтарная кислота+крезацин) оказала положительное влияние на развитие эмбрионов и цыплят, что выразилось в повышении выводимости яиц и вывода кондиционных цыплят на 6,2-6,0% (р‹0,001) и (р‹0,001) соответственно. При этом 5,9-6,5% установлен эффект длительного физиологического последействия, который выразился в увеличении живой массы бройлеров на 4,4-7,8% и сохранности на 6,6-7,6% по сравнению с контролем. Т.О. Азарнова (2006) обрабатывая инкубационные яйца кур яичного кросса «Хайсекс-белый» по следующей схеме: 0,1% комплекса янтарной кислоты и глицина до инкубации, а при переводе на вывод 0,5% раствором янтарной кислоты, получила увеличение выводимости яиц и вывода цыплят на 9,66% (р‹0,001) и 9,67% (р‹0,001) соответственно. 12 Тотоева М.Э., 2004 отметила, что предынкубационная обработка яиц 0,5% раствором митомина (янтарная кислота+витамин С) стимулирует эмбриогенез уже на ранних стадиях развития: через 48 часов инкубации количество пар сомитов возросло на 20,0%, диаметр сосудистого поля на 21,7%, длина эмбриона на 22,2%, по сравнению с контролем. В дальнейшем увеличилась масса эмбрионов и выводимость яиц на 5,3%-15,4%. Последующее алиментарное применение препарата улучшило ряд гематологических и биохимических показателей. В крови повысилось содержание гемоглобина и эритроцитов на 11,6 и 8,8%, а также активность ферментов (каталазы и пероксидазы) и содержание аскорбиновой кислоты на 12,4, 19,4 и 21% соответственно. Общий белок в сыворотке крови повысился на 22,6%, содержание альбуминов и гамма – глобулинов возросло на 8,1 и 33% соответственно. Увеличилась лизоцимная и бактерицидная активность сыворотки крови на 60% и 28,5% по сравнению с контролем. Аналогичные данные получила при обработке яиц перепелов Кузьмина С.В. (2006). По данным О.И. Кочиш (2005) при комбинированном использовании 0,3%-ного раствора митомина и 0,0015%-ного раствора эмицидина для предынкубационной обработки яиц мясных кур достоверно повысились выводимость яиц на 5,5%, вывод цыплят на 5,3%; сохранность молодняка на 3,1%. В сыворотке крови суточных цыплят, полученных из яиц, обработанных митомином и эмицидином достоверно возросло содержание общего белка на 3,0-4,6%, трансферинов на 28,1-66,7%, Fe на 6,2-7,0%, Mn на 44,4-55,6%, Ca на 12,6-20,3%. Кроме вышеуказанных препаратов в последние годы широкое распространение получили фитопрепараты, в т.ч. рибав. Рибав – спиртовой (65%) экстракт из биомассы микоризных грибов, выделенных из корня женьшеня, и включает в себя комплекс биологически активных веществ – продуктов синтеза грибов: витаминов, аминокислот, 13 фитогормонов, липидов, фосфорсодержащих соединений, стимулирующих жизнеспособность организма. Данный препарат обладает широким спектром фармакологического действия: иммуностимулирующей и гепатозащитной активностью, антитоксическим и ростостимулирующим действием. Кроме того, рибав способствует повышению питательной ценности продукции птицеводства и улучшению его экологического состояния за счет снижения содержания нитритов, нитратов и солей тяжелых металлов (Азарнова Т.А., 2006). Соломатин М.В. (2005) доказал стимулирующее влияние рибав на птиц, даже при однократном пероральном применении в дозе 0,25 мл/кг на клеточные факторы иммунитета. Онокиенко Н.И., Головирина Л.И., Газзави Л.В., Черный Н.В. (2006) применяли рибав в дозе 0,5 мл. на 1кг веса цыплятам кросса «Кобб-500» с 5суточного до 42-суточного возраста и установили увеличение живой массы на 4,6% по сравнению с контролем. Рибав также оказал стимулирующее влияние на морфологические показатели крови. Так, по сравнению с контролем, в опыте количество эритроцитов было выше на 9,3%, лейкоцитов на 8,9%, гемоглобина на 4,1%. И.И. Кочиш, М.С. Найденский, Т.О. Азарнова, Ю.В. Краснобаев (2008) установили, что сочетанное аэрозольное применение рибав + янтарная кислота перед инкубацией и на 19-е сутки оказывает положительное влияние на эмбриональное и постэмбриональное развитие цыплят яичных кроссов в течение 60 суток выращивания. В опытных группах увеличилась выводимость яиц на 4,2-7,1% и вывод цыплят на 6,3-10,7%. Использование растворов рибав и янтарной кислоты привело к длительному эффекту последействия, что позволило снизить падеж в опытных группах за 60 суток выращивания в 1,5 – 2 раза по сравнению с контролем. Положительный эффект от применения вышеуказанных препаратов получен и на других видах животных. 14 В работе Басанкина А.В., Антипова В.А. (2008) установлено, что добавление в рацион свиноматок янтарной кислоты в количестве 0,1 г/кг массы тела оказывает положительное действие на потомство: повышается рождаемость, крупноплодность, жизнеспособность новорожденных, при этом уменьшается количество мертворожденных и слабых. Доказано, что скармливание сукцината сухостойным коровам в период интенсивного развития плода позволяет повысить живую массу телят при рождении, резистентность, а также среднесуточный удой коров на 10-15% (Tyutyunnic N.N., Kozhevnikova L.K., 1996). В.М. Пурецкий, В.А. Прахт (2005) доказали, что скармливание новорожденным телятам препарата рибав в дозах 0,25, 0,17 и 0,12 мл/кг живой массы один раз в сутки со 2-го дня после рождения до 10-ти суточного возраста, способствовало снижению заболевших диспепсией в 1,6 - 4,5 раза и сроков продолжительности болезни в 2 - 4 раза. Среднесуточный прирост живой массы телят опытных групп увеличился на 25,4%, 28,2 и 16,7% соответственно вышеуказанным дозам. Л.Ю. Топурия (2005) изучала влияние иммуностимулятора рибав на иммунный статус коров и их новорожденных телят. Стельным коровам за 60 и 30 суток до отела перорально вводили рибав в дозе 0,25 мл/кг массы в течение 5 суток. В результате проведенных исследований было доказано повышение лизоцимной и бактерицидной активности в сыворотки крови у коров и молодняка крупного рогатого скота. У коров опытной группы за 7 суток до отела наблюдалось повышение IgG на 28,21% и IgM на 25,30%; сразу после родов – 39,07 и 6,36% соответственно. Применение растительного иммуномодулятора значительно увеличивало в крови количество Т и В лимфоцитов. Таким образом, применение рибава стельным коровам повышает естественную резистентность и воспроизводительную способность 15 животных, способствует устранению иммунодефицитных состояний у полученного от них потомства. Резюмируя вышеизложенное, следует отметить, что применение биологически активных веществ, и в частности органических кислот оказывает стимулирующее влияние на продуктивные качества и защитные механизмы организма использование животных и открывает птицы, большие а значит, перспективы активное для их повышения продуктивности животных. 1.2. Применение тканевых препаратов для повышения естественной резистентности животных В настоящее препараты время животного большой интерес происхождения, представляют которые тканевые применяются для профилактики заболеваний различных видов животных и птиц, повышения естественной резистентности организма и нормализации обмена веществ (Булашева А.И., 2005; Пальчиков А.Ю., Безбородов Н.В., Шитов Г.Г., 2005; Бессарабов Б.Ф., Мельникова И.И., Лазуткина Е.А., 2006; Графов Д., Бессарабов Б., Гонцова Л., 2007). Теоретические основы тканевой терапии заложены еще академиком М.П. Тушновым в 1905 г. Он придавал особое значение физиологической роли продуктов клеточного распада в обмене веществ, считая, что согласованность физиологических функций в организме зависит не только от нервной и гормональной систем, но и от промежуточных продуктов метаболизма. Особое внимание М.П. Тушнов обратил на действие продуктов распада белка. По его мнению, первичные высокомолекулярные продукты распада белка являются наиболее мощными физиологическими раздражителями. Они повышают общий жизненный тонус организма в целом, а с другой стороны, сохраняя химическую специфичность строения белка различных тканей, действуют наиболее активно на клетки той ткани, из которой они образовались. 16 При парентеральном введении продуктов распада белка различных органов можно стимулировать деятельность гомологичных тканей, исправлять нарушение обмена веществ и устранять патологию (Дерябина З.И., Николаев А.В., 1968). С 1933 г. тканевая терапия получила дальнейшее развитие в работах академика В.П. Филатова, который установил способность переживающих на холоду тканей стимулировать регенеративные процессы в живом организме. Теоретическая основа применения тканевых препаратов В.П. Филатова сводится к тому, что при неблагоприятных условиях в переживающих тканях накапливаются специфические активные вещества, вырабатываемые живыми клетками. Эти вещества были названы В.П. Филатовым биогенными стимуляторами. Биогенные стимуляторы образуются не только в тканях животных, но и в клетках растений. Биогенные стимуляторы Филатова применяются для лечения разнообразных болезней человека и животных, при этом специфичность ткани не имеет существенного значения. Получение лечебного эффекта при различных по этиологии заболеваниях В.П. Филатов объясняет тем, что биостимуляторы не оказывают влияния на причину болезни. целом, мобилизуя физиологические Они действуют на организм в его естественные защитные силы и стимулируя и иммунобиологические реакции. Стимулирующее влияние осуществляется через нервную систему. Биогенные стимуляторы, изменяя активность ферментных систем, повышают уровень обменных процессов и устойчивость к различным патогенным воздействиям. Благоприятное влияние биогенных стимуляторов на функции организма послужило основой для применения их в животноводстве для стимуляции роста при откорме животных (Дорогов А., 1951). Среди существующих средств тканевой терапии препарат АСД занимает особое место. Тканевый лекарственный препарат АСД Ф-2 (антисептик-стимулятор Дорогова) является оригинальным отечественным препаратом, 17 изготовленным по специальной методике, разработанной кандидатом ветеринарных наук А.В. Дороговым в 1948 г. По своему химическому составу АСД Ф-2 резко отличается от других тканевых препаратов. Он содержит химические соединения, не имеющие какого-либо родства с белком и не расщепляющиеся протеолитическими ферментами, его можно применять внутрь и парентерально. Препарат не имеет ни видовой, ни органной специфичности, так как при глубоком распаде тканей животных, который происходит при получении АСД Ф-2, постепенно расщепляются органические вещества (белки, жиры, углеводы) до низкомолекулярных компонентов, сходных по своей химической структуре с метаболитами клеточного обмена, стираются все различия, присущие органам и тканям, а также и отдельным классам живых организмов. Препарат представляет собой прозрачную летучую жидкость от желтого до темно-красного цвета с резким специфическим запахом, имеет щелочную реакцию и хорошо растворим в воде. (Дерябина З.И., 1980; Тимофеев Б.А., Щедрин Е.Л, Сироткина В.П. и др., 1987; Абрамов В.Е., Абдрахманов В.И., Дорогова О.А. и др., 2004). Одним из основных биологически активных компонентов препарата являются холиновые эфиры карбоновых кислот типа ацетилхолина, бутирилхолина, пропионилхолина, которые обладают выраженным ацетилхолинподобным действием. Ацетилхолин является одним из основных регуляторов жизненных процессов в организме. Он осуществляет метаболическую функцию, участвуя во внутриклеточной регуляции обмена путем воздействия на проницаемость клеточных мембран и на активность различных ферментов. Ацетилхолин усиливает синтез адреналина, РНК, белка, увеличивает поглощение кислорода тканями, способствует активации транспорта РНК, аминокислот, сахаров, электролитов через мембраны эритроцитов, скелетных мышц, кровеносных сосудов. 18 В случаях холиновой недостаточности препарат может восполнять дефицит холина, восстанавливать нормальную трофику тканей и устранять дистрофические состояния. Жирные кислоты, содержание которых в препарате АСД Ф-2 составляет около 4%, при введении в организм могут использоваться в процессах обмена как пластический и энергетический материал (Дерябина З., 2000). В препарате установлено содержание свободных неорганических азотистых веществ (до 15%) в виде солей аммония и органических веществ, среди которых были идентифицированы первичные и вторичные амины, карбоновые кислоты жирного ряда, их амиды и аммонийные соли, холиновые эфиры карбоновых кислот (Абрамов В.Е., Абдрахманов В.И., Дорогова О.А. и др., 2004). По данным многочисленных авторов ионы аммония, а также ионы щелочных металлов (Na, K, Ca) относятся к числу основных электролитов, обеспечивающих функциональную активность нервной и мышечной тканей. В малых концентрациях они являются физиологическими раздражителями и стимулируют функцию нервной системы, процессы дыхания. Кроме того высокая биологическая активность препарата АСД Ф-2 обусловлена содержанием функционально активных сульфгидрильных групп (SH –групп), которые участвуют в синтезе глутатиона. Препарат оказывает стимулирующее влияние на те биохимические процессы в организме, которые сопряжены с биологической функцией сульфгидрильных групп, т.е. препарат может активизировать процессы обмена углеводов, липидов и белков в животном организме (Дерябина З., 2000). Ацетат метиламин ускоряет синтез биологических аминов (холина, серотонина, гистамина, адреналина). Метилмеркаптан – донор в образовании тиолового кофактора глутатиона – принимает участие в синтезе аминокислот, метионина, холина, креатинина. Уксусная кислота – активный 19 компонент коэнзима А, необходимого для синтеза дикарбоновых, трикарбоновых и жирных кислот, кетоновых тел, стеринов, убихинона, ацетилхолина. Метилмочевина обеспечивает синтез производных жирных кислот, участвующих в обменных процессах. Циклопентан – промежуточный продукт в синтезе пуриновых и пиримидиновых оснований. Декан – важный элемент в создании эфиров, спиртов, кетонов, липидов, каротиноидов. Диметилпиррол входит в состав гемоглобина крови. Под воздействием препарата возрастает легочный газообмен, повышается потребление кислорода тканями и активность ряда ферментных систем, увеличивается антиоксидантная защита (Кирюткин Г., Абдрахманов В., Шабанов В., 2004). При изучении газового и энергетического обмена у собак (А.В. Дорогов, З.И. Дерябина, 1957), которым препарат АСД Ф-2 вводили в дозе 100 мг/кг вместе с кормом в течение 3 и 9 месяцев, было установлено повышение величины легочного газообмена, увеличение артерио-венозной разности кислорода и кислородной емкости крови, повышение потребления кислорода тканями. Возрастала интенсивность энергетического обмена. Перестройка процессов обмена веществ была длительной, так как после 6месячного перерыва в применении препарата АСД показатели газового и энергетического обмена у животных были выше исходных. Усиление процессов газо-энергетического обмена свидетельствует о стимулирующем влиянии вышеуказанного препарата на общий обмен веществ в организме, на повышение окислительного фосфолирирования в митохондриальной дыхательной цепи. Т.А. Мороз (1986) было установлено положительное действие АСД Ф-2 на обмен витамина А в организме животных, а также его эффективность в профилактике гибели эмбрионов у коров в критические периоды внутриутробного развития. Изучение влияния препарата АСД Ф-2 на яичники и гаметы коров проводили методом трансплантации эмбрионов. Животным опытной группы 20 до осеменения вводили препарат путем трехкратной мышечной инъекции с интервалом в 5 суток. Доза препарата составила 0,001-0,003 мл на 1кг живой массы. Обработка коров препаратом АСД Ф-2 увеличивает в два раза количество полноценных эмбрионов, что свидетельствует о стимулирующем действии препарата, который повышает их выживаемость. Мороз Т.А. (1998) было также доказано, что у животных, обработанных биостимулятором в критические периоды внутриутробного развития эмбрионов, стельность повышалась на 15-20%, а сервис-период сокращался на 10-13 суток. Аналогичные данные получены Полянцевым Н.И., Подберезным В.В. (2004). О.М. Швец (2008), вводя коровам опытной группы препарат «Янтарный биостимулятор» (янтарная кислота+АСД Ф-2) внутримышечно в дозе 5 мл, двукратно с интервалом 15 сут, за месяц до отела и телятам опытной группы этот же препарат в дозе 2 мл внутримышечно на 2-3 сутки после рождения, отметил достоверное повышение содержания общего белка в сыворотке крови, а также альбуминов и фракций глобулинов, бактерицидную активность сыворотки крови и содержание Т-лимфоцитов. Горбанец Т.М., Лобач П.И., Божко И.Г., Мануйленко В.Г. (1984) установили влияние АСД-Ф2 на рост и мясные качества бройлеров. Молодняку опытных групп дополнительно препарата, вследствие чего скармливали по 0,005 мл живая масса бройлеров увеличивалась на 7,5- 9,9%, а содержание протеина в тушке возросло на 4,3-5,2%. Курам опытной группы вводили внутрь препарат АСД Ф-2 в дозе 125мг/кг веса в 10%-ном водном растворе. Живая масса кур в первые два месяца применения препарата была выше, чем у контрольных на 8%. Яйценоскость у контрольных кур в 6-ти месячном возрасте составляла 22%, а у опытных – 30,2% (то есть на 8,2% выше). 21 Таким образом, препарат АСД Ф-2 способствует повышению интенсивности роста у кур и увеличению их продуктивности. Исследования показали, что повышение синтеза белка в организме кур находилось в тесной корреляции с синтезом нуклеиновых кислот (НК). Через 30 суток после введения препарата АСД Ф-2 в крови кур содержание НК достоверно увеличивалось на 10,2% по сравнению с контролем. Через 60 суток после введения АСД Ф-2 содержание НК у опытных кур было выше на 9,8%. Под влиянием препарата у опытных кур повышалась активность фермента рибонуклеазы. При почти равном содержании сахара в крови кур уровень гликогена в печени опытной группы был на контроле, обеих групп 23% выше, чем в что указывает на преобладание в организме кур процессов ассимиляции над процессами диссимиляции, т.е. подтверждается анаболическое действие данного препарата на организм. Б.Ф. Бессарабов, И.И. Мельникова и Е.А. Лазуткина (2006) применяли АСД Ф-2 для профилактики заболеваний перепелов, повышения естественной резистентности птицы, а также стимуляции яйценоскости у самок перепелов. К концу опыта интенсивность яйценоскости возросла на 36,9% по сравнению с контролем. Таким образом, проведенные исследования показали, что препарат АСД Ф-2 оказывает стимулирующее влияние на продуктивность птиц и их естественную резистентность. Кроме вышеуказанного АСД Ф-2 в последние годы широкое распространение получили препараты на основе плаценты: ПДЭ (плацента денатурированная эмульгированная) из плаценты человека, ПДС (плацента денатурированная суспендированная), изготавливаемая из плаценты человека и тканевый препарат «Биостим» (Багданова О.С., Дементьев Е.П., 2005; Пальчиков А.Ю., Безбородов Н.В., Шитов Г.Г., 2005). 22 Препарат ПДЭ содержит 16 аминокислот, в том числе незаменимые, высокоактивные короткие белки-пептиды, нуклеиновые кислоты, микроэлементы и другие вещества, всего около 100, содержащихся в этой уникальной, созданной природой ткани для развития и защиты будущей жизни. Данный препарат обладает противовоспалительным, противоотечным, иммуномоделирующим действием, способен резорбировать соединительную ткань (Вагина М.С., 2005). М.С. Вагина (2004) изучала действие ПДЭ на цыплятах – бройлерах кросса «Смена» в возрасте 1-42 суток, которых обрабатывали аэрозолем препарата. Было установлено, что содержание общего белка в сыворотки крови в опытной группе было на 5,4 г/л больше. Увеличение общего белка в крови цыплят опытной группы происходило за счет возрастания β- и γглобулинов соответственно на 0,54% и 6,55%. На фоне повышения сохранности молодняка на 3,5% установлено повышение приростов живой массы до 5%. По данным Кириловой Ю.В. (2004) установлено, что под влиянием 0,25% раствора тканевого препарата «Биостим» происходят положительные изменения в лейкоцитарной формуле крови у цыплят. Особенно за счет увеличения лимфоцитов на 6,8%. Активизация обменных процессов, проходящих в организме цыплят, отразилась и на биохимических показателях сыворотки крови цыплят. Содержание общего кальция повысилось на 0,53 мг/%, фосфора – 0,19 мг/%, витамина Е – 0,20 мг/% и каротина - 0,04 мг/% в пределах физиологической нормы. Общий белок повысился на 0,53 г/%. Гуревичев П.А., Уразаев Д.Н., Равилов М.Н. (2005) отметили, что применение ПДЭ способствует профилактике задержания последа у коров. Этот препарат сокращает сроки отделения последа у животных в среднем за эндометритов. 4 часа, а также снижает вероятность возникновения 23 На основании вышеизложенного можно сделать вывод о том, что тканевые препараты оказывают многостороннее влияние на организм. Повышают обмен веществ и окислительные процессы, стимулируют рост и развитие молодняка. Тканевые препараты вызывают улучшение функционального состояния механизмов естественной резистентности, усиливают процессы регенерации тканей, стимулируют иммуногенез, вследствие чего повышается сопротивляемость к неблагоприятным воздействиям. 1.3. Биологическая роль микроэлементов и их влияние на обмен веществ, здоровье и продуктивность животных В составе животных организмов имеется 55 микроэлементов или 0,40,6% живой массы тела животного. Они необходимы как для оптимального функционирования различных органов и тканей, так и для роста и развития организма в целом. Микроэлементы входят в состав гормонов, ферментов, витаминов, определяют их активность и этим оказывают непосредственное влияние на интенсивность процессов обмена веществ и энергии, состояние естественной резистентности и иммунобиологической воспроизводительную способность, реактивности, продуктивность, жизнеспособность поголовья (Цымбал Р.А., 2000; Кабиров Г.Ф., Юсупов Р.Х., 2006). Вопросам биологической роли и практического применения микроэлементов в питании сельскохозяйственных животных посвящено большое число исследований, результаты которых обобщены в ряде обзоров (Beisel W., 1982; Ковальский В.В., 1983; Танатаров А.Б., 1984; Двинская Л.М., Дудин В.И., 1986; Кальницкий Б.Д. и др., 1986; Гогин А.Е, 2001; Пермяков Н.С., 2001; Сазонов Н.Н., 2001; Двоярская Ю.И., Сурай П.Ф., 2006; Павленко О., 2007; Шацких Е., Цыганова О., 2007). Изучение роли влияния микроэлементов в составе биологически активных веществ органической природы на организм птицы в онтогенезе является актуальной проблемой (Ручий О.С., 2007). 24 При дефиците микроэлементов в инкубационных яйцах нарушается эмбриогенез и ухудшается их выводимость (Фисинин В.И., Журавлев И.В., Айданян Т.Г., 1990). Особенно чувствительны к дефициту микроэлементов эмбрионы в первую половину инкубации. Чем больше дефицит по минеральным веществам, тем выше смертность эмбрионов птицы, которая наступает в более ранние сроки. Недостаток меди, селена является одной из причин повышенной гибели эмбрионов в первую неделю инкубации, при этом количество отходов инкубации в виде кровяных колец превышает гибель зародышей в виде задохликов (Дядичкина Л., 2007). Дефицит кобальта, цинка, марганца и йода отрицательно сказывается на резистентности и продуктивности птицы (выводимости яиц, интенсивности роста, сохранности молодняка и яйценоскости). За последние годы установлено, что биологическая доступность микроэлементов из неорганических солей невелика и, даже при достаточном их содержании в рационе, организм может испытывать нехватку того или иного микроэлемента. Это происходит в результате взаимодействия минеральных веществ конкурентного в желудочно-кишечном тракте. Усвоение железа ухудшается при избытке в рационе марганца, что проявляется в снижении уровня гемоглобина и приростов массы свиней. Повышенный уровень кальция в рационе затрудняет всасывание цинка и нередко служит причиной заболевания свиней паракератозом. Одним из кормовых факторов, препятствующих всасыванию и отложению меди в организме жвачных, является одновременное присутствие в корме избыточного количества сульфатов и молибдена (Горобец А.И., 1984; Кальницкий Б.Д., 1985). По данным Ю.В. Краснобаева (2009) микроэлеметы в кишечнике животных усваиваются всего лишь на 10-40%, а остальные 90-60% не только не усваиваются, но, при постоянном использовании приводят к отложению 25 нерастворимых солей на стенках кишечника, что является причиной возникновения запоров и блокированию каналов, через которые происходит всасывание, что уменьшает поступление минеральных веществ. Поэтому применение неорганических форм минеральных веществ может оказывать негативное влияние на организм. Основной процесс всасывания микроэлементов происходит в тонком отделе кишечника, который не способен усваивать отдельные ионы минералов. В результате в кишечнике происходит процесс хелатирования, то есть связывания доступных органических веществ с ионом минерала (Пикалина О.А., 2007). Однако для того чтобы процесс хелатирования проходил более успешно, необходимо определенное соотношение количества минералов и органических соединений (аминокислоты, белки, органические кислоты), которые поступают в организм сельскохозяйственных животных с кормом. Хелаты способствуют стабильности комплекса при его прохождении через кислую среду желудка, в результате чего обеспечивается оптимальная доступность микроэлементов в кишечнике. Усвоение микроэлементов увеличивается в 10-20 раз по сравнению с обычно используемыми в кормлении сульфатами и оксидами (Малышев М.А., Брылин А.П., 2006). Хелаты (или циклические комплексные соединения) – это координационные соединения, в которых центральный атом или ион связан с двумя или более донорными атомами лиганда, в результате чего замыкается один или несколько гетероциклов (рис.1). 26 Рисунок 1. Образование хелатной связи Так, при действии водного раствора аминокислоты глицин H2N-CH2COOH на гидроксид меди (II) Cu(OH)2 образуется вещество, содержащее на один атом меди два остатка аминокислоты: Cu(OH)2 + 2 NH2CH2COOH= Cu(NH2CH2COO)2 + 2H2O Глицин с центральным атомом металла может связываться как посредством азота аминогруппы, так и посредством кислорода карбоксильной группы, поэтому он является бидентатным лигандом (рис. 2). Рисунок 2. Структура хелатного соединения 27 Хелатные формы биогенных металлов 1. Хелатное соединение металла с аминокислотой. Это процесс хелатирования между аминокислотой и ионом металла из растворимой соли металла. Использование хелатных добавок цинка, железа, марганца и меди с аминокислотами (глицином, метионином, лизином и гистидином) в рационе птицы положительно влияет на интенсивность роста, активность металлоэнзимов и накопление элементов в органах и тканях по сравнению с добавками микроэлементов в виде сульфатов. Стимулирующий эффект комплексных соединений микроэлементов с аминокислотами на обмен веществ обусловлен более высокой биологической доступностью хелатов микроэлементов в процессе их всасывания и использования в обмене веществ (Панина Н.В., 2006). Особый интерес в кормлении птицы представляют смешаннолигандные соединения биометаллов (Fe) с аминокислотами (лизин, глицин, гистидин, фенилаланин) и витамином В2 (рибофлавином). Характерной биометаллов способностью комплексных соединений с витамином В2 и аминокислотами является то, что входящий в их состав рибофлавин восстанавливается в дегидрорибофлавин значительно легче, чем рибофлавин в свободном состоянии. Применение комплексных соединений железа аминокислотами с рибофлавином и в кормлении цыплят кросса «Бройлер 6» оказало положительное влияние на продуктивность, интенсивность метаболизма, использование питательных и минеральных веществ корма и качество мяса птицы (Кебец А.П., Кебец Н.М., Егоров С.В., Богатырев А.А., 2006). Положительное влияние таких соединений на обменные процессы в организме и продуктивность животных связаны с тем, что при образовании такого комплекса происходит изменение химической структуры биометалла и аминокислоты и появляются новые виды биологической активности, 28 которыми не обладают входящие в их состав индивидуальные компоненты (Кебец А.П. и др., 2006). Парентеральная инъекция анемичных поросят хелаткомплексным соединением аспарагината марганца и глицината меди с йодидом калия на фоне инъекции ферроглюкина быстрее стимулирует эритро- и гемопоэз в их организме, увеличивая к 24 суткам жизни количество эритроцитов в 1,70 раза, гемоглобина в 1,58 раза; величину гематокрита в 1,36 раза по сравнению с 2-х разовой инъекцией только железодекстрана (Бушов А.В., Тен Э.В., 2005). 2. Комплексы пептидов и белков с металлами. Металлокомплекс карнозин оказывает модулирующее действие на способность цинка и меди влиять на возбудимость нейронов и на нейротоксичность этих металлов (П.К. Тромбли и др., 2000 – цитировано по: Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). Металлирование белков приводит к возникновению характерных для образующихся металлопротеидных комплексов качественно новых свойств. Нерастворимые в дистиллированной воде глобулины легко растворяются в обычных водносолевых образованию растворителях, комплексных соединений что происходит глобулинов с благодаря металлами – металлоглобулинатов. (Э.В. Тен, Х.Ш. Казаков и др., 1972 – цитировано по: Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). 3. Взаимодействие металлов с азотистыми основаниями нуклеотидов и нуклеиновыми кислотами. Двухвалентные катионы металлов играют ключевую роль во всех ферментативных реакциях с участием нуклеиновых кислот, которые могут координироваться с ионами металлов и своими основаниями, и углеводными компонентами, и фосфатными группами, т.е. обладают амбивалентными, или амбидентантными свойствами. Связывания металлов с фосфатной группой приводит к расщеплению фосфодиэфирных связей РНК, что очевидно является одной из причин 29 эволюционного предпочтения ДНК в качестве носителя генетической информации (Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). 4. Взаимодействие металла с углеводами. Синтезированы комплексы биогенных металлов с моносахаридами, комплекс полисахарида железа. В качестве природных хелатирующих макролигандов используют также крахмал, декстраны, глептоксил, цитровит и другие соединения (M.E. Mochie-Eldin et al., 1994; U. Hofmann et al., 1989 – цитировано по: Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). 5. Синтетические хелаты с искусственными хелатообразователями. По данным Калимуллина Ю.Н. (1984), Кривовой Т.С. и др. (1986), Сехина А.А. (2003), Бушова А.В. (2005), Логиновой Г.П. (2005), Лоховой С. (2005) большую перспективу для повышения продуктивности, иммунодинамических и воспроизводительных функций, а также для профилактики и лечения заболеваний сельскохозяйственных животных представляет применение синтетических комплексов биогенных металлов с органическими соединениями. Наиболее важны для животных следующие элементы: Железо Потребность в нем у птиц составляет около 20-60 мг/кг корма. Особенно нуждаются в этом элементе растущие организмы. Часть железа находится в тканях печени, селезенки, костном мозге. Много микроэлемента в красном оперении птиц (38-40 мг/кг). Большая часть его находится в эритроцитах (Микулец Ю.И. и др., 2004; Комаров Ф.И., 2006; Бессарабов Б.Ф., 2007). Железо выполняет различные уникальные физиологические функции в организме, оказывая влияние как на активность лимфоидно-макрофагальной системы, так и на многие стороны метаболизма, главным образом процессы обмена белков. Оно оказывает значительное влияние на гемопоэз и участвует в образовании гемоглобина, миоглобина, пероксидазы, цитохромов и каталазы. (Конопатов Ю.В., Макеева Е.Е., 2006). 30 При недостатке железа в первую очередь нарушаются обменные процессы в костном мозге, где образуются первичные форменные элементы крови. Нарушается и полностью подавляется синтез гемоглобина. Эритропоэз отстает от потребностей быстрорастущего организма, вследствие чего развивается гипохромная анемия и нарушаются окислительно- восстановительные процессы. Развивается кислородное голодание. Для компенсации общей гипоксии пульс усиливается, увеличивается минутный объем сердца, что приводит к гипертрофии сердечной мышцы (Скрынникова Т.И., Есепенок В.А., 2006). У взрослых особей недостаток железа встречается редко в связи с высоким содержанием его в растительных кормах, удовлетворительной усвояемостью и реутилизацией элемента в организме, хотя иногда железодефицитное состояние регистрируют и у высокопродуктивного скота. Анемия чаще проявляется у молодняка. Так, у новорожденных поросят имеет место железодефицитная анемия, которая характеризуется расстройством функционирования органов кроветворения, нарушения обменных процессов, снижением резистентности и иммунодефицитом. В связи с этим применение железосодержащих препаратов, представляющих собой комплекс железа с низкомолекулярным декстраном, способствует эффективной профилактике анемии и положительно влияет на иммуногенез. Однако такие препараты содержат только одно железо, а все остальные микроэлементы, участвующие в гемопоэзе отсутствуют. (Кузнецов С., Кузнецов А., 2003; Алимов А. с соавтор., 2005). Гемовит-плюс - препарат, содержащий в своем составе микроэлементы (Fe, Mn, Cu, Zn, Co, Se, J) в хелатной форме. По данным Д.В. Пчельникова и В.А. Бабич (2005) установлено, что выпойка 5 мл. препарата с кормом один раз в сутки телятам черно-пестрой породы повышает неспецифическую резистентность животных; введение в рацион 10 мл. гемовита-плюс свиноматкам крупной белой породы стабилизирует гемопоэз, эритропоэз и лейкопоэз, о чем свидетельствует повышение количества гемоглобина на 31 22,6%, эритроцитов на 27%, лейкоцитов на 71% и сывороточного железа на 45,6%. Недостаток железа у кур вызывает уменьшение количества красных кровяных телец, затем нарушение пигментации оперения. В экспериментах при содержании на рационах без железа на 14-21 сутки после начала опыта перья теряют окраску и через 60 суток становятся совершенно белыми (Бессарабов Б.Ф., 2007). Цинк По количественному содержанию в организме животных цинк занимает среди микроэлементов второе место после железа. Он влияет на рост, развитие и воспроиводительную функцию животных, процессы остеогенеза. Цинк входит в состав более 200 ферментов, относящихся ко всем шести классам, включая гидролазы, трансферазы, оксидоредуктазы, лиазы, лигазы, изомеразы, контролирующие процессы роста, синтеза ДНК, функционирования тканей и нормального развития репродуктивных органов. Он крайне необходим для формирования скелетной системы, так как при его дефиците невозможна кальцификация. Обеспечивая синтез Т-лимфоцитов и бласттрансформацию В-лимфоцитов, цинк усиливает иммунные реакции и тем самым повышает естественную резистентность организма. Этот микроэлемент поджелудочной увеличивает железы, активность щелочной пищеварительных фосфатазы, ферментов аминопептидазы, нейтральных протеаз, повышая переваримость корма, а также усиливает биодоступность витаминов (А и В6). В результате увеличиваются приросты и улучшается конверсия корма. Цинк также обладает сильным антимикробным действием, особенно в отношении различных видов кишечной палочки и стрептококков (Малышев М.А., Брылин А.П., 2006). При недостатке цинка в рационе животные заболевают паракератозом. На пораженных участках кожи шерстный покров выпадает (Огуй В.Г. и др., 1981). 32 При дефиците цинка наблюдается нарушение развития в эмбриогенезе. Так, у эмбрионов кур отмечают искривление позвоночника, возникает уродство головы, отеки, аномалии развития головного мозга, глаз, внутренних органов. Недостаток цинка у цыплят вызывает нарушения эпителия желудочнокишечного тракта, наступает замедление роста, перья становятся ломкими, истонченными. У контурных перьев, особенно у маховых и хвостовых, в результате облома опахала остаются одни стержни, задерживается половое созревание, нарушается дыхание, утолщаются суставы ног и возникает перозис (Белецкий Е.М., 1995). Изучение скелета цыплят при недостатке цинка в кормах показало нарушение синтеза коллагена при выраженном снижении коллагеназы. Недостаток цинка в рационе кур родительского стада вызывает снижение выводимости яиц, высокую смертность цыплят и нарушение развития скелета и перьев. В некоторых случаях цинковый дефицит ассоциируют с эмбрионами, не имеющими крыльев и ног (Топорова Л., Топорова И., 2008). Марганец Марганец необходим для нормального обмена веществ и играет каталитическую роль в процессах обмена. Способность его в качестве катализатора и активизатора участвовать в реакциях гормонов, витаминов и ферментов обуславливает его физиологическую функцию, влияние на рост, развитие, нормальное проявление половой активности и другие биологические процессы. Марганец является биоэлементом, принимающим активное участие в окислительно-восстановительных процессах и кроветворении (Кабыш А.А., 2006). Этот микроэлемент входит в состав ферментов пируваткарбоксилазы и орнитиназы, необходимых для синтеза гликанов хрящевой ткани, повышает прочность скорлупы яиц, улучшает развитие эмбрионов кур (Манукян А., 2007; Околелова Т. и др., 2007). 33 Применение комплексонатов марганца и цинка, являющихся солями диэтилентриаминпентауксусной (ДТПУ) и оксиэтилидендифосфорной (ОЭДФ) кислот оказывают положительное действие на рост, развитие и физиологическое состояние животных, а также увеличение количества эритроцитов, лейкоцитов и содержание гемоглобина в крови (Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). Так, подкормки препаратами марганца с ОЭДФ увеличивают активность каталазы и пероксидазы крови у цыплят на 12 и 9%, эритроцитов на 0,8 млн/мкл. Аналогичными были различия и в содержании тиамина в грудной мышце, что свидетельствует об активном включении его в ферментные системы организма цыплят и нарастании уровня обменных процессов. Из всего вышеизложенного следует, что комплексонат марганца является эффективной кормовой добавкой при дефиците этого микроэлемента в кормах (Колганов В.А., Латышев В.И., Струговщиков В.Р., 2000). С наличием марганца марганецсодержащего метаболизм в фермента глюкозаминогликанов. организме животных глюкозилтрансферазы При дефиците и активности тесно этого связан элемента уменьшается уровень содержания глюкозаминогликанов в хрящевой ткани, а также понижается активность ряда ферментов углеводного обмена. У коров и свиноматок нарушаются воспроизводительные функции (нерегулярная течка, перегулы), снижается оплодотворяемость. Возможны рассасывание плодов и аборты; молочная продуктивность, а часто и жирность молока падают. У молодняка нарушается половое созревание и оссификация скелета, замедляется рост; отмечаются укорочение и слабость ног, иногда хромота и несгибаемость в суставах, а также повышенное жироотложение (чаще у поросят) (Топорова Л.В., Архипов А.В., Бессарабова Р.Ф., и др., 2004). 34 Дефицит марганца в организме птицы вызывает нарушение костеобразования, при котором сильно увеличен скакательный сустав, пяточное сухожилие соскакивает с мыщелка. При недостатке марганца происходит снижение яйценоскости, ухудшение прочности скорлупы и состояния оперения, снижается оплодотворяемость яиц и их выводимость (Бессарабов Б.Ф). Медь Химические свойства, благодаря которым медь играет важную роль в процессах обмена веществ, выражены у нее в большей степени, чем у других микроэлементов. Ионы меди по сравнению с ионами других металлов активнее взаимодействуют с белками, образуя устойчивые (хелатные) комплексы. Медь служит исключительно эффективным катализатором. Наконец, медь легко переходит из одного валентного состояния в другое, являясь как донором, так и акцептором электронов. Участие меди в метаболических процессах организма сопряжено главным образом ферментов-оксидаз: с функциональной активностью цитохромоксидазы, медьсодержащих церулоплазмина, супероксиддисмутазы и др. Они играют регулирующую роль в тканевом дыхании, что важно не только для эритроцитов, но и для клеток лимфоидномакрофагальной системы. Ряд дисмутаз фагоцитарных клеток содержит медь, цинк, марганец и железо. Эти ферменты играют ключевую роль в бактерицидной активности фагоцитов и представляют, вероятно, возможные места регуляции активности лизосомального аппарата клеток (Кузнецов С., Кузнецов А., 2003; Конопатов Ю.В., Макеева Е.Е. 2006). На усвоение меди влияют многие кормовые факторы, и прежде всего белок: повышение его уровня в рационе снижает отложение ее в печени. Недостаток меди приводит к следующим патологиям: 1. Нарушение синтеза гемоглобина и возникновение анемии 2. Развитие сахарного диабета, так как медь ингибирует инсулиназу 3. Кариес зубов, потому что медь входит в состав эмали 35 4. Диарея, лизуха, замедление роста 5. Энзоотическая атаксия у новорожденных ягнят У телят первым признаком недостатка меди является ходульная походка, особенно характерная для тазовых конечностей. При этом отмечают также кахексию, прогрессирующую в течение 4-5 месяцев. Возможна депигментация шерсти, начинающаяся вокруг глаз, затем распространяющаяся на лоб, нижнюю челюсть и другие части тела. Это происходит из-за недостатка меланина, в образовании которого необходим медьсодержащий фермент тирогеназа (Королев А.Ю., 2005). Некоторые тяжелые металлы (свинец, кадмий, ртуть, серебро, цинк, мышьяк) конкурируют с медью при всасывании, обуславливая ее недостаточность. Высокое содержание железа в рационе (150-400 мг/кг) тормозит поглощение меди и предохраняет организм от избыточного накопления ее у птицы (Кузнецов С., Кузнецов А., 2003). Недостаточность меди в рационе птицы приводит к снижению выводимости яиц; вызывает анемию, при которой красные кровяные тельца – малого размера и с низким уровнем гемоглобина, ядра эритроцитов бесформенные или удвоенные; нарушается кератинизация пера. Взаимосвязь между медью и цинком влияет на выводимость, при этом избыток цинка увеличивает дефицит меди. В период эмбрионального развития птицы при дефиците меди наблюдается высокая смертность на ранней стадии формирования кровеносной системы, уменьшается активность церулоплазмина плазмы, а также супероксиддисмутазы эритроцитов (Егоров И.А., Имангулов Ш.А., 2005; Топорова Л, Топорова И., 2008). Кобальт Биологическая роль кобальта в значительной степени связана с проявлением активности витамина В12 – цианкобаламина: образование метильной группы метионина из предшественников, повышение термостабильности SH – групп, поддержание активности коэнзима А. Действие данного витамина на организм обосновано многими факторами: он 36 регулирует кроветворение, влияет на азотный, нуклеиновый, углеводный, липидный, минеральный обмен, принимает участие в реакциях трансметилирования, активизирует аргиназу, карбоангидразу, щелочную фосфатазу, является остеогенным микроэлементом. Наиболее важную роль витамин В12 играет в эритропоэзе, недостаточность его и фолиевой кислоты (витамина В9), является причиной металопластических анемий и наиболее распространенной формы – злокачественной анемии. Дефицит фолиевой кислоты довольно частое явление. При ее недостаточности тормозится синтез нуклеопротеидов и созревание клеток, появляются аномальные предшественники эритроцитов – мегалоциты. Острый недостаток фолиевой кислоты вызывает анемию, кровоточивость слизистых оболочек рта, десен и кишечника, поражение пищеварительного тракта, развитие дерматитов (Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). Кобальт необходим для нормальной жизнедеятельности микрофлоры преджелудков жвачных и синтеза микробиального белка (Скрынникова Т.И., Есепенок В.А., 2006). Кобальт обеспечивает нормальный синтез гемоглобина и ускорение созревания эритроцитов в костном мозге. Установлено стимулирующее действие кобальта на систему кроветворения (Бакулин В.А., 2006). Недостаток кобальта приводит к развитию злокачественной гиперхромной анемии (с избыточным количеством гемоглобина), снижению плодовитости, а у овец к снижению качества шерсти (Королев А.Ю., 2005). У свиней ухудшается аппетит, снижается прирост живой массы; развиваются поносы, появляется анемия. При недостатке кобальта в рационах в крови и печени животных уменьшается содержание этого элемента и витамина В12 (Топорова Л.В., Архипов А.В., Бессарабова Р.Ф., и др., 2004). Потребность птицы в кобальте составляет 4-5мг/кг корма. Дача кобальта цыплятам в первые дни жизни способствует увеличению обмена азота и повышению содержания глобулинов сыворотки крови. 37 Дефицит рационов по кобальту вызывает cнижение аппетита, уменьшение количества гемоглобина и развитие анемии, нарушение функции щитовидной железы, задержку роста, снижение яйценоскости у несушек (Бакулин В.А., 2006; Бессарабов Б.Ф., 2007). Селен Селен обладает высокой биологической активностью. Он способен образовывать сложные органические соединения, участвующие во всех биохимических процессах организма (Овчинникова Т., 2005). Этот микроэлемент воздействует на процессы тканевого дыхания, регулируя скорость течения окислительно-восстановительных реакций (обмен глюкозы, цикл трикарбоновых повышает кислот, иммунобиологическую калиево-натриевый-кальциевый реактивность организма, обмен, регулирует усвоение и расход витаминов А, С, Е и К. Установлено влияние селена на белковый обмен, в частности, на обмен серосодержащих аминокислот, тироидных гормонов (R.G. Ellis et al, 1997 – цитировано по: Кабиров Г.Ф., Логинов Г.П., Хазипов Н.З., 2005). Кроме того селен является одним из микроэлементов, участвующих в работе антиоксидантной системы организма. Существует два способа антиоксидантной защиты. Первый способ, наиболее частый, когда используется неорганическая форма селена в рационе животных. В этом случае в период стресса организм пытается реагировать, используя антиоксидантные резервы и, что более важно, синтезируя дополнительные селенопротеины. При этом основным ограничением является отсутствие запасов селена в организме, что приводит к ограничению способности животных синтезировать дополнительные селенопротеины в ответ на возникшие стрессы. Таким образом, в результате стресса образование свободных радикалов усиливается, но организм не может адаптироваться к данным изменениям из-за упомянутых ограничений. Происходит снижение продуктивных и воспроизводительных качеств, так же как и нарушение иммунной функции животных. Это особенно актуально для 38 новорожденных животных, так как их антиоксидантная система незрелая и зависит от передачи антиоксидантов от матери через молозиво и молоко. Второй способ - это использование органической формы селена, главное преимущество которого заключается в создании резервов этого элемента в форме селенометионина в мышцах. В случае стрессовой ситуации при катаболизме белков в протеосомах селен освобождается и эффективно используется для синтеза дополнительных селенопротеинов, что позволяет усилить антиоксидантную защиту и предотвратить или снизить повреждающее действие повышенного образования свободных радикалов. Это особенно важно еще и потому, что в стрессовых условиях потребление корма животными падает. Полученные в результате синтеза селенопротеины могут предотвратить перекисное окисление липидов и поддержать иммунную систему и репродуктивные качества животных. В связи с тем, что селенометионин лучше переносится новорожденных животных возрастает с молозивом уровень их и молоком, у антиоксидантной активности. Более того, селенозависимый фермент йодотирониндиодиназа связан с активацией тироидного гормона и терморегуляцией всего организма. Поэтому более высокий уровень селена во втором способе может быть связан с лучшей терморегуляцией у новорожденных животных и, как результат, с повышением сохранности телят и поросят в первые дни жизни (Двоярская Ю.Е., Сурай П.Ф., 2006). Введение селеноорганического соединения СП-1 супоросным свиноматкам за две недели до опороса повлияло на иммунологические показатели крови поросят, что выразилось в повышении общего количества лейкоцитов, процента Т-лимфоцитов, а также повышение иммуноглобулинов А- и М- классов в сыворотке крови животных (Боряев Г.И. и др., 2004). По данным ряда авторов применение селеноорганических препаратов регулирует иммунные реакции в организме, которые способны выступать в качестве регуляторов процессов свободнорадикального окисления и оказывать стимулирующее действие на антиоксидантный механизм защиты 39 организма (Шевченко С. и др., 2005; Ивахник. Г., 2006; Фисинин В.И., Сурай П.Ф., Папазян Т.Т., 2006; Цогоева Ф., 2006). В случае с птицей селен переносится из корма в яйца и далее к развивающемуся эмбриону. По данным Paton N.D. (2000) при использовании органического селена в рационе кур его количество в снесенных яйцах было выше, чем при использовании селенистокислых форм. Двоярская Ю.Е., Сурай П.Ф. (2006) доказали, что эффективность переноса неорганической формы селена в яйца очень низкая. Таким образом, практически невозможно обогатить их селеном. Напротив, органическая форма селена «Сел-плекс» эффективно переносится в яйца и далее к эмбриону. Включение в рацион кур-несушек селеноорганических препаратов СелПлекс и Дафс-25 усиливает механизмы иммунной защиты, что выражается в повышении показателей лизоцимной активности, соответственно на 17,3% и 16,3%, бактерицидной активности сыворотки крови – на 26,3% и 24,9%, достоверном увеличении процессов гемопоэза, а также в повышении напряженности иммунитета к Ньюкаслской болезни птиц – на 1,01 log2, (Рубцов В., Алексеева С., 2006; Рубцов В.В., 2007). Дефицит селена не просто снижает иммунитет, а приводит к возникновению различных заболеваний, снижению продуктивности и даже падежу животных и птицы (Овчинникова. Т., 2005). Недостаток селена в рационах племенной птицы приводит к уменьшению вывода цыплят. Признаки дефицита – слабые цыплята, у которых отмечают миопатию мышц живота, у многих – параличи ног, вытянутые назад и вывернутые вверх. Часто при недостатке селена возникает экссудативный диатез, опухание суставов ног, нарушение выводимости яиц и аномалии перообразования (Топорова Л, Топорова И, 2008). Йод Йод входит в состав тиреоидных гормонов. В свою очередь роль этих гормонов в организме связана с регуляцией основного обмена, расхода углеводов, белков и жиров в организме, процессов теплообразования; они 40 влияют на рост, развитие и функции воспроизводства. Действие гормонов на обмен веществ связанно с их влиянием (через синтез дыхательных и других ферментов) на внутриклеточные процессы окисления, окислительного фосфорилирования и синтеза белка (Овчинникова Н.А., 2006; Сушков В.С. и др., 2007). Многие литературные данные свидетельствуют о том, что добавленные к корму микродозы йода сельскохозяйственной стимулируют рост и развитие молодняка птицы, повышают уровень естественной резистентности и сохранности, яйценоскость, оплодотворенность яиц (Шевченко С. и др., 2005; Гаврикова Л., 2007). Егоров И.А., Имангулов Ш.А. (2005) также отмечают, что этот элемент необходим для обеспечения оптимальной яйценоскости и нормального развития эмбрионов. Широко применяемые растворимые неорганические соединения йода быстро всасываются при поступлении в организм птицы с кормом, причем этот элемент, хорошо усваивается из йодидов калия или натрия, йодатов кальция и калия. Однако названные соединения весьма нестойки. Кроме того, неорганический йод легко теряется в процессе транспортировки, переработки, хранении, и поэтому заявленного количества йода продукты, обогащенные такими соединениями микроэлемента не содержат. (Шацких Е., Цыганова О., 2007; Ермолаев С.В., Тряпицина Н.В., 2006). Напротив, включение в рацион кур-несушек премикса «Йод-плюс» позволяет получать яйца с повышенным содержанием йода. Кроме того, наблюдается тенденция к повышению сохранности и интенсивности яйцекладки (Козлобаева Е., 2005). При йодной недостаточности задерживается рост и развитие эмбрионов, время вылупления цыплят иногда растягивается до нескольких дней, при этом у них увеличивается щитовидная железа, наблюдается снижение яйценоскости. (Королев А.Ю., 2005; Бессарабов Б.Ф., 2006). 41 При недостатке йода у сельскохозяйственных животных снижается функция щитовидной железы, угнетается биосинтез гормонов (тироксина и трийодтиронина), что ведет к нарушению окислительно-восстановительных процессов, биосинтезу белков и как, следствие этого, замедлению роста, развитию молодняка, расстройству воспроизводительной взрослых животных. У таких животных функции у неполноценные половые циклы, часто возникают аборты и рассасывание эмбрионов. Дефицит йода в организме может вызвать зобную болезнь. Особенно часто дефицит йода встречается у высокопродуктивных коров, что связано с большим выделением его с молоком, при этом молочная продуктивность и жирномолочность животных уменьшаются (Огуй В.Г., 1981; Топорова Л.В., Архипов А.В., Бессарабова Р.Ф., 2004). Таким образом, взрослых животных роль микроэлементов в организме молодых и хорошо изучена. Однако вопросы применения вышеуказанных препаратов для стимуляции эмбрионального развития требуют дальнейшего изучения. 42 ГЛАВА 2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ 2.1. Материалы и методы исследований Анализ многочисленных литературных данных свидетельствует о том, что одним из важнейших факторов создания устойчивого здоровья птицы на различных стадиях онтогенеза, успешного роста производства продукции и снижения ее себестоимости является поиск новых экологически безопасных способов, направленных на стимуляцию эмбриогенеза, роста и развития молодняка яичных кур и повышение их неспецифической резистентности и иммунобиологической реактивности. В связи с этим, мы изучали эффективность применения препарата АСД и комплекса микроэлементов для обработки инкубационных яиц с целью стимуляции эмбрионального и постэмбрионального развития цыплят кросса «Птичное». Исследования проводили в период с 2008 по 2010 гг. в цехах инкубации и выращивания ФГУП ППЗ «Птичное» Нарофоминского района, Московской области, а также в лаборатории кафедры зоогигиены имени А.К. Даниловой МГАВМиБ им. К.И. Скрябина. Во всех опытах использовали яйца кур для получения финального гибрида кросса «Птичное». Кросс «Птичное» - аутосексный, четырехлинейный обладает высокой продуктивностью, жизнеспособностью и конверсией корма. Приведенная ниже схема скрещивания предусматривает получение аутосексных родительских форм, так как птица линий Пк1 и Пк3 обладает рецессивным геном быстрой оперяемости kk, а линий Пк2 и Пк4 – доминантным геном медленной оперяемости K. Благодаря этому суточных цыплят родительских форм Пк12 и Пк34 легко разделить по скорости роста маховых и кроющих перьев крыла на петушков и курочек. Петушки Пк12 и Пк34 медленнооперяющиеся, у них в суточном возрасте маховые перья (второй ряд) короче кроющих (первый ряд) или 43 одинаковы по длине. При скрещивании родительских форм (Пк12×Пк34) получают гибридное потомство, аутосексное по цвету пуха в суточном возрасте: петушки имеют светло-желтую окраску, курочки – палевую или светлокоричневую с двумя полосками на спинке. Схема получения финального гибрида Прародительские формы ♂Пк 1 × ♀Пк 2 Родительские формы ♂Пк 3 × ♀Пк 4 ♂Пк 12 × ♀Пк 34 Финальный гибрид ♀Пк 1234 В соответствии с поставленными задачами было проведено 4 серии научно-хозяйственных опытов (11 экспериментов) и производственная проверка (табл. 1). В 1-й серии научно-хозяйственных экспериментов изучали влияние предынкубационной обработки яиц растворами АСД различной концентрации. Во 2-ой серии экспериментов определяли эффективность повторного применения АСД при переводе яиц на вывод. В опытах третьей серии устанавливали действие предынкубационной обработки яиц растворами комплекса микроэлементов, а в 4 серии изучали эффективность двукратной обработки этого препарата. Производственная проверка проведена для подтверждения экспериментальных данных и расчета экономической эффективности на больших партиях яиц и группах цыплят. Материалом для экспериментов были инкубационные яйца, а так же выведенные из них цыплята. В опытные и контрольные партии подбирали яйца от одного родительного стада при соблюдении равенства массы, сроков снесения и хранения. Возраст родительских стад составлял 230-270 дней. Средняя масса яйца – 54,8-59,5 г., плотность – 1,092-1,095 г/см3, толщина скорлупы – 380-400 мкм, кислотность желтка - 4,2-4,4 мг КОН, содержание каротина в желтке – 15,5-15,7 мкг/г, вит. А –7,2-8,6мкг/г. Срок хранения – 2-5 44 суток. Яйца опытных и контрольных партий инкубировали в машинах ИУП45 и ИУВ-15. Таблица 1 3. 4. 5. Количество посаженных на выращивание цыплят, гол 2. Количество проинкубированных яиц, шт. 1. 1 2011 - 2 2433 100 3 1507 - Двукратная обработка инкубационных яиц растворами препарата АСД Ф-2. 4 1581 - 5 1617 100 Предынкубационная обработка яиц растворами комплекса микроэлементов 6 1944 - 7 1618 100 8 1936 - 9 1193 - 10 1171 - 11 1217 100 - 3228 2640 Наименование исследований Предынкубационная обработка яиц растворами препарата АСД Ф-2. Двукратная обработка яиц растворами комплекса микроэлементов Производственная проверка обработки яиц препаратами АСД и комплексом микроэлементов № опыта Серии экспериментов Общая схема опытов 45 Режимы инкубации, плотность посадки, фронт кормления и поения, а также параметры микроклимата были аналогичными для всех опытных и контрольных групп в каждом исследовании и соответствовали зоогигиеническим и технологическим нормативам (НТП АПК 1.10.05.00101). Обработку яиц водными растворами (18-22°С) препаратов АСД и комплекса микроэлементов проводили методом орошения путем нанесения их на поверхность яиц с помощью пульверизатора. Кормление птицы осуществляли в соответствии с рекомендациями ВНИТИП по кормлению сельскохозяйственной птицы (2003). При проведении экспериментов учитывали следующие показатели: 1. Зоогигиенические: -температуру воздуха с помощью термометров и термографов. -относительную влажность с помощью психрометров и гигрографов. -освещенность люксметром Ю-116. 2. Зоотехнические: -показатели биоконтроля инкубации (отходы инкубации, выводимость яиц, вывод цыплят). -динамику живой массы цыплят за 5-6 недель выращивания, путем индивидуального взвешивания по 30 голов из контрольных и опытных групп. -сохранность поголовья путем ежедневного учета падежа. 3. Анатомо-морфологические: - интерьерные показатели суточных цыплят (масса сердца, печени, селезенки, фабрициевой сумки, остаточного желтка, мышечного и железистого желудков) - определение индексов развития внутренних органов 4. Биохимические: в сыворотке крови цыплят в суточном возрасте определяли: - количество общего белка (биуретовый метод) и отдельных его 46 фракций (Pre Alb, Alb, Post Alb, Tf, Cp, β2, Sα2, γ1, βLp) (методом электрофореза на пластинах ПААГ) - содержание лизоцима (по В.Г. Дорофейчуку (1986)) и бактерицидную активность (метод Смирновой О.В., Кузьминой Т.П. (1979)) 5. Биометрические: - экспериментальные данные статистически обрабатывали с применением методов, изложенных в пособиях Е.К Меркурьевой (1991 г.) и А.Д. Соболева (2006 г.) с использованием персонального компьютера по программе Microsoft Office Excel, 2003. 6. Экономическую эффективность применения препаратов: -рассчитывали по методике определения экономической эффективности использования результатов научно-исследовательских работ в животноводстве (Шатохин Ю.И. 1997). 47 2.2. Результаты исследований 2.2.1. Первая серия экспериментов – эффективность предынкубационной обработки яиц растворами АСД Ф-2 Для определения эффективности предынкубационной обработки инкубационных яиц кур растворами препарата, было проведено 3 научнохозяйственных эксперимента. 2.2.1.1. Опыт 1 В данном опыте изучали влияние предынкубационной обработки яиц кур растворами препарата АСД Ф-2 в различных концентрациях на некоторые показатели биоконтроля инкубации. Все партии яиц (кроме контроля), обрабатывали растворами препарата в диапазоне концентраций (от 0,1% до 1%), а контроль не обрабатывали (табл. 2). Таблица 2 Партии яиц Контроль Опытная 1 Опытная 2 Опытная 3 Опытная 4 Схема эксперимента Количество Обработка растворами яиц препарата, % 402 399 0,1 401 0,25 407 0,5 402 1,0 2.2.1.1.1. Показатели биоконтроля инкубации Обработка яиц растворами препарата не оказала существенного влияния на показатели биологического контроля инкубации (табл. 3). Однако следует отметить, что во всех опытных партиях наблюдается незначительное снижение количества неоплодотворенных яиц на 0,24-0,46% по сравнению с контролем, что очевидно можно объяснить, уменьшением «ложного неоплода» и, следовательно увеличением жизнеспособности эмбрионов на ранней стадии эмбриогенеза. Количество замерших в опытных 48 партиях (кроме 1 опытной) было ниже, чем в контроле на 0,25-0,31%. Кроме того, снизилась смертность зародышей в виде задохликов на 0,24-0,73% по сравнению с контролем. Отход инкубации в виде слабых во всех опытных партиях был в основном на уровне контроля. О некотором повышении жизнеспособности эмбрионов в опытных партиях свидетельствует увеличение таких показателей, как выводимость яиц (рис. 3) и вывод цыплят (рис. 4) на 0,22-1,09% и на 0,44-1,23% соответственно по сравнению с контролем. Различия по этим показателям между опытными партиями и контролем статистически недостоверны. Максимальный уровень выводимости яиц и вывода цыплят установлен в 4 опытной партии, при обработке яиц 1% раствором препарата. Исходя из полученных данных можно предположить, что испытанные концентрации препарата оказались недостаточными, чтобы вызвать значительное повышение жизнеспособности эмбрионов. 87,8 87,6 87,4 87,2 % 87,70 87,0 87,30 86,8 86,6 86,90 86,90 86,70 86,4 86,2 Контроль 1 опытная 2 опытная 3 опытная Группа Рисунок 3. Показатели выводимости яиц в 1 опыте 4 опытная 49 Таблица 3 Показатели биологического контроля инкубации, % Партия Контроль Неоплодотворенные яйца 6.72 ± 1.24 ∆ Кровяные кольца ∆ Замершие ∆ Задохлики ∆ Слабые ∆ - 2.99 ± 0.84 - 4.48 ± 1.03 - 3.23 ± 0.88 - 1.74 ± 0.65 - Выводимость яиц 86.67 ± 1.75 ∆ Вывод цыплят ∆ - 80.85 ± 1.96 - 1 опытная 6.26 ± 1.21 -0.46 3.50 ± 0.92 0.51 4.51 ± 1.03 0.03 2.50 ± 0.78 -0.73 1.75 ± 0.65 0.01 86.89 ± 1.74 0.22 81.45 ± 1.94 0.60 2 опытная 6.48 ± 1.22 -0.24 3.24 ± 0.88 0.25 4.23 ± 1.00 -0.25 2.99 ± 0.85 -0.24 1.74 ± 0.65 0.004 86.93 ± 1.74 0.26 81.29 ± 1.94 0.44 3 опытная 6.63 ± 1.23 -0.09 2.94 ± 0.83 -0.05 4.17 ± 0.99 -0.31 2.94 ± 0.83 -0.29 1.71 ± 0.64 -0.03 87,36 ± 1.70 0.69 81.57 ± 1.92 0.72 4 опытная 6.46 ± 1.22 -0.26 2.73 ± 0.81 -0.26 4.22 ± 1.00 -0.26 2.98 ± 0.84 -0.25 1.49 ± 0.60 -0.25 87.76 ± 1.68 1.09 82.08 ± 1.91 1.23 50 82,20 82,00 81,80 81,60 82,09 81,40 % 81,57 81,20 81,45 81,00 81,30 80,80 80,60 80,85 80,40 80,20 Контроль 1 опытная 2 опытная 3 опытная 4 опытная Группа Рисунок 4. Показатели вывода цыплят в 1 опыте. 2.2.1.2. Опыт 2 Учитывая результаты предыдущего эксперимента, в данном опыте изучали эффективность применения повышенных концентраций растворов препарата на показатели биоконтроля инкубации и выращивания молодняка (табл. 4). Опытные партии яиц (с 1 по 5), обрабатывали растворами препарата в расширенном диапазоне концентраций (1- 5%). Таблица 4 Партия яиц Контроль 1 опытная 2 опытная 3 опытная 4 опытная 5 опытная Схема эксперимента Количество Обработка растворами яиц препарата, % 408 404 1 408 2 404 3 405 4 404 5 51 2.2.1.2.1. Показатели биоконтроля инкубации В результате обработки инкубационных яиц водными растворами препарата более высоких концентраций удалось значительно снизить почти все отходы инкубации и увеличить вывод цыплят и выводимость яиц (табл. 5). Так, по сравнению с контролем отход яиц в опытных партиях в виде кровяных колец уменьшился в 1,5-1,7 раза, а количество замерших (кроме 1 и 5 опытных партий) в 1,1-1,4 раза по сравнению с контролем. В конце инкубации почти во всех опытных партиях установлено достоверное снижение задохликов в 1,3-1,9 раза. В 1, 2 и 5 опытных партиях не было слабых цыплят, тогда как в контроле этот показатель был на уровне 1%. Выводимость яиц (рис. 5) и вывод цыплят (рис. 6) во всех опытных партиях были выше, чем в контроле на 4,81-7,08% и 2,51-4,04% соответственно. Максимальная выводимость яиц, на 7,08% (p‹0,01) превышающая контроль, установлена в 3 опытной партии при использовании 3% раствора АСД. 90,00 88,00 86,00 84,00 88,39 % 82,00 80,00 87,34 87,96 86,13 87,66 81,31 78,00 76,00 Контроль 1 опытная 2 опытная 3 опытная 4 опытная Группа Рисунок 5. Показатели выводимости яиц во 2 опыте 5 опытная 52 Таблица 5 Показатели биологического контроля инкубации, % Партия Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Задохлики ∆ ∆ Выводимость яиц ∆ Контроль 2.94 ± 0.83 - 5.88 ± 1.16 - 3.19 ± 0.86 - 8.09 ± 1.34 - 0.98 ± 0.48 - 81.31 ± 1.95 - 78.92 ± 2.01 - 1 опытная 6.18* ± 1.19 3.24 3.46 ± 0.90 -2.42 3.96 ± 0.97 0.77 4.45* ± 1.02 -3.64 - -0.98 87.33* ± 1.70 6.02 81.93 ± 1.91 3.01 2 опытная 6.61* ± 1.23 3.67 3.92 ± 0.96 -1.96 2.94 ± 0.83 -0.25 4.65* ± 1.04 -3.44 - -0.98 87.66* ± 1.68 6.35 81.86 ± 1.90 2.94 3 опытная 6.18* ± 1.19 3.24 3.96 ± 0.97 -1.92 2.47 ± 0.77 -0.72 4.20* ± 0.99 -3.89 0.24 ± 0.24 -0.74 88.39** ± 1.64 7.08 82.92 ± 1.87 4.00 4 опытная 5.67 ± 1.15 2.73 3.45 ± 0.90 -2.43 2.22 ± 0.73 -0.97 4.93 ± 1.07 -3.16 0.74 ± 0.42 -0.24 87.95** ± 1.66 6.64 82.96 ± 1.86 4.04 5 опытная 5.44 ± 1.12 2,50 3.46 ± 0.90 -2.42 3.46 ± 0.90 0.27 6.18 ±1.19 -1.91 - -0.98 86.12 ± 1.76 4.81 81.43 ± 1.93 2.51 Слабые Примечание: здесь и далее *- p‹0,05; **- p‹0,01; ***- p‹0,001 по сравнению с контролем Вывод цыплят ∆ 53 83,00 82,00 81,00 80,00 81,93 82,92 81,86 82,96 81,44 % 79,00 78,00 78,92 77,00 76,00 Контроль 1 опытная 2 опытная 3 опытная 4 опытная 5 опытная Группа Рисунок 6. Показатели вывода цыплят во 2 опыте Прижизненную оценку развития зародыша проводили по степени замыкания аллантоиса в остром конце яиц на 11 сутки инкубации. Как видно из таблицы 6 в лучшей опытной группе получено 97% яиц I категории против 96% в контроле. Таблица 6 Категории яиц по степени замыкания аллантоиса, % (n = 136) Партия яиц Развитие аллантоиса по категориям I II III 96,3 2,5 1,2 Контроль 3 опытная 97,2 1,9 0,9 В процессе инкубации вследствие испарения воды и обмена газов яйцо уменьшается в весе. Происходит так называемая «усушка» яиц, уровень которой соответствует интенсивности обмена веществ развивающегося зародыша. В первой половине инкубации на 6-е и 12-е сутки установлена тенденция к меньшему испарению влаги в лучшей опытной группе, что имеет важное значение для развивающегося зародыша. Во вторую половину 54 инкубации на 18-е сутки наблюдается тенденция к увеличению усушки в опытной группе по сравнению с контролем, что является положительным фактором и свидетельствует о более интенсивном обмене веществ развивающегося эмбриона. За 18 суток инкубации «усушка» оказалась несколько большей в опытной группе и составила 13,3%, тогда как в контрольной группе не превышала 12,8% (табл. 7). Таблица 7 Потери в массе яиц в процессе инкубации (n = 136) Партия яиц Контроль 6 5,2 ∆ - 3 опытная 4,9 -0,3 Сутки инкубации 6-12 ∆ 3,9 3,8 -0,1 за ∆ 18 суток 12-18 4,3 ∆ - 5,1 0,8 12,8 - 13,3 0,5 2.2.1.2.2. Анатомические показатели цыплят Определение массы внутренних органов, после анатомической разделки цыплят в суточном возрасте, показывает степень их роста и развития в эмбриональный период, а также позволяет провести оценку их качества (табл. 8). Из данной таблицы видно, что при предынкубационной обработке яиц 3% раствором препарата установлена тенденция к повышению живой массы суточных цыплят на 3,1% по сравнению с контролем. У цыплят лучшей опытной группы уменьшилась масса остаточного желтка с желточным мешком на 13,1% по сравнению с контролем, масса мышечного и железистого желудков была на 5,1% выше, чем в контроле. 55 Таблица 8 Анатомические показатели цыплят в суточном возрасте, (n=5) Группа Масса цыпленка, г ∆, % Контроль 40,07 ± 0,74 - 3 опытная 41,33 3,14 ± 0,76 Масса остаточ. желтка с желточ. мешком, г 3,29 ± 0,44 2,86 ∆, % Масса печени, г ∆, % - 0,98 ± 0,05 - -13,07 ± 0,26 1,07 Масса мышеч. и железист. желудков, г 2,73 ± 0,07 9,18 ± 0,03 2,87 ∆, % - Масса сердца, г 0,29 ± 0,01 0,33 5,13 ± 0,07 ∆, % Масса селезенки, мг ∆, % Масса фабриц. сумки, мг ∆, % - 16,00 ± 4,00 - 50 ± 4,47 - 13,79 18,00 12,50 ± 2,00 ± 0,02* 52 4,00 ± 3,74 Таблица 9 Индексы развития внутренних органов цыплят в суточном возрасте, % Группа Контроль 3 опытная Остаточный желток с желточным мешком 8,15 ± 0,92 6,92 ± 0,63 ∆,% -1,23 Печень 2,46 ± 0,13 2,59 ± 0,08 ∆,% 0,13 Мышечн.и железист. желудки 6,82 ± 0,11 6,96 ± 0,21 ∆,% 0,14 Сердце 0,73 ± 0,03 0,82 ± 0,05 ∆,% 0,09 Селезенка 0,04 ± 0,01 0,04 ± 0,02 ∆,% - Фабрициева сумка 0,12 ± 0,01 0,13 ± 0,01 ∆,% 0,01 56 Кроме того, следует отметить тенденцию к увеличению массы таких внутренних органов, как печень, селезенка и фабрициева сумка на 9,2%, 12,5% и на 4% соответственно, а также достоверно увеличилась масса сердца на 13,8% (p‹0,05) по сравнению с контролем. О более интенсивном развитии эмбрионов свидетельствует тенденция к уменьшению индекса массы остаточного желтка у суточных цыплят в опытной группе на 1,23% по сравнению с контролем. В этой же группе индекс массы печени, желудков и сердца превосходили контроль на 0,13%, 0,14% и 0,09% соответственно (табл. 9). Однако различия по этим показателям между опытом и контролем были статистически недостоверны. На основании полученных данных можно считать, что предынкубационная обработка яиц не оказала отрицательного влияния на интерьерные показатели цыплят, в т.ч. и на развитие иммуннокомпетентных органов. 2.2.1.2.3. Некоторые показатели неспецифической резистентности Обработка яиц раствором препарата не оказала отрицательного влияния на некоторые показатели неспецифической резистентности цыплят. Так, при определении лизоцимной и бактерицидной активности в сыворотке крови цыплят не установлены существенные различия между опытной и контрольной группами (табл. 10). Количество лизоцима у цыплят опытной группы увеличилось на 1,4%, а бактерицидная активность повысилась на 2,8% по сравнению с контролем. Однако различия по этим показателям были статистически недостоверны. Таблица 10 Содержание лизоцима и бактерицидная активность сыворотки крови цыплят в суточном возрасте (n = 5) Группа Лизоцим, мкг/мл ∆, % Бактерицидная активность, % ∆, % Контроль 34,6 ± 1,61 - 40,9 ± 8,39 - 3 опытная 35,1 ± 6,20 1,45 43,7 ± 6,83 2,80 57 2.2.1.2.4. Биохимические исследования сыворотки крови Из таблицы 11 видно, что в сыворотке крови цыплят опытной группы достоверно увеличилось содержание общего белка на 3,0% (р<0,001) по сравнению с контролем. Достоверно возросло также содержание preALB на 4,4% (р<0,05), TF на 2,0% (р<0,01), 2 на 4,8% (р<0,01), Lp на 4,0% (р<0,05). Кроме того, наблюдается тенденция к повышению таких фракций белка, как АLB на 1,6%, postALB на 2,8%, Cp на 1,3%, S2 на 8,1%, 1 на 4,1%. Таблица 11 Содержание общего белка и белковых фракций в сыворотки крови цыплят в суточном возрасте (г/л) (n = 5) Группа Контроль 3 опытная Общий белок, г/л 39,37 ± 0,11 40,55 ± 0,07*** Pre Alb Alb Post Alb 2,97 ± 0,02 3,10 ± 0,04* 10,93 ± 0,07 11,10 ± 0,03 2,81 ± 0,05 2,89 ± 0,12 Tf Cp β2 Sα2 γ1 βLp 10,20 1,50 ± 0,04 1,52 ± 0,02 2,90 2,10 3,78 ± 0,02 ± 0,01 3,04 ± 0,02** 2,27 2,18 ± 0,07 2,27 ± 0,05 ± 0,01 10,40 ± 0,03** ± 0,10 ± 0,04 3,93 ± 0,04* 2.2.1.2.5. Зооветеринарные показатели С целью выявления биологического последействия препарата, были посажены в цех выращивания по 100 голов цыплят, полученные из контрольной и лучшей опытной группы. В первые 2 недели выращивания падеж молодняка в опытной группе был в 3 раза меньше, чем в контроле (табл. 12). Во все остальные периоды наблюдений различий между контролем и опытной группой не было установлено, кроме 6 недели выращивания, где падеж молодняка в опытной группе был на 1% выше, чем в контроле. Таким образом, можно сделать вывод о том, что эффект последействия препарата со временем уменьшается. Однако в целом за период выращивания падеж в опытной группе был на 1% меньше, чем в контроле. 58 Таблица 12 Динамика сохранности цыплят (n=100) За весь период Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол 35-42 Падеж, гол 28-35 Сохранность, % 21-28 Падеж, гол 14-21 Сохранность, % Контроль 2 опытная 7-14 Падеж, гол Группы цыплят 1-7 Сохранность, % Возраст в сутках 98 99 2 1 99 100 1 - 100 100 - 99 99 1 1 100 100 - 100 99 1 4 3 96 97 При изучении динамики живой массы цыплят в процессе роста установлена четко выраженная тенденция к повышению этого показателя (табл. 13). Как видно из таблицы, в первые 3 недели выращивания цыплята опытной группы превышали контроль по живой массе на 2,7-2,1% (р<0,0010,05). Однако в дальнейшем различия по этому показателю между опытом и контролем сглаживаются. Таблица13 Динамика живой массы, г (n=30) Возраст, сутки Контрольная Опытная ∆, % 7 14 21 28 35 67,40 ± 0,46 126,93 ± 1,09 193,43 ± 1,57 285,5 ± 2,44 392,53 ± 2,80 69,23 ± 0,26*** 130,43± 1,19* 197,53 ± 0,79* 290,13 ± 1,98 399,10 ± 1,48 2,7 2,8 2,1 1,6 1,7 При определении скорости ювенальной линьки не установлено достоверных различий между группами по нижеуказанному показателю (табл. 14). 59 Таблица14 Линька, % (n=30) Контрольная Опытная 6,33±0,89 8,00±0,60 29,67±2,11 31,00±2,21 Линька, дн. 30 60 ∆, % 1,67 1,33 2.2.1.3.Опыт 3 Этот эксперимент был проведен не только для изучения действия более высоких концентраций раствора препарата, но также и для подтверждения данных предыдущего опыта. Опытные партии обрабатывали 3%, 5% и 10% водными растворами препарата (таблица 15). Таблица 15 Партии яиц Контроль Схема эксперимента Количество Обработка растворами яиц препарата, % 375 - Опытная 1 378 3 Опытная 2 377 5 Опытная 3 377 10 2.2.1.3.1. Показатели биоконтроля инкубации На фоне более высокого, чем во 2-м эксперименте инкубационного качества яиц выводимость в 1 и 2 опытных партиях была на уровне 90%, что на 2,6-2,7% выше, чем в контроле и даже 10% раствор АСД не оказал отрицательного влияния на показатели биоконтроля (табл. 16). В 1 опытной партии, при обработке 3% раствором препарата отходы инкубации в виде неоплодотворенных яиц и кровяных колец уменьшились 60 Таблица 16 Показатели биологического контроля инкубации, % Партия Неоплодотворенные яйца ∆ Контроль 6.67 ± 1.28 - 1 опытная 4.76 ± 1.09 2 опытная 3 опытная ∆ Выводимость яиц ∆ 1.07 ± 0.53 - 87.43 ± 1.77 - 81.60 ± 2.00 - 0.31 - -1.07 90.00 ± 1.58 2.57 85.71 ± 1.79 4.11 4.77 ± 1.09 0.50 - -1.07 90.16 ± 1.57 2.73 85.14 ± 1.83 3.54 4.24 ± 1.03 0.03 - -1.07 88.00 ± 1.73 0.57 81.69 ± 1.99 0.09 ∆ Замершие ∆ Задохлики ∆ 3.73 ± 0.97 - 2.67 ± 0.83 - 4.27 ± 1.04 - -1.91 2.91 ± 0.86 -0.82 2.64 ± 0.82 -0.03 3.96 ± 1.00 5.57 ± 1.18 -1.10 2.12 ± 0.74 -1.61 2.38 ± 0.78 -0.29 7.16 ± 1.32 0.49 4.50 ± 1.06 0,77 2.38 ± 0.78 -0.29 Кровяные кольца Слабые Вывод цыплят ∆ 61 на 1,9 и 0,8% соответственно, замершие были на уровне контроля. Количество задохликов уменьшилось на 0,3%, а слабых не было вообще. Выводимость яиц (рис. 7) и вывод цыплят (рис. 8) в 1 опытной партии были выше, чем в контроле на 2,6% и 4,1% соответственно. При увеличении концентрации препарата до 5% показатели биоконтроля были в основном на уровне 1 опытной партии и превосходили контроль по выводимости яиц и выводу цыплят на 2,7 и 3,5% соответственно. И только при увеличении концентрации раствора препарата более чем в 3 раза по сравнению 1-ой опытной партии эффект стимуляции не проявлялся. Таким образом можно сделать вывод, что препарат оказывает стимулирующее воздействие в широком диапазоне концентраций (1-5%) с оптимумом в 3%. 90,50 90,00 89,50 89,00 % 88,50 90,00 88,00 90,17 87,50 87,00 88,00 87,43 86,50 86,00 Контроль 1 опытная 2 опытная Группа Рисунок 7. Показатели выводимости яиц в 3 опыте 3 опытная 62 86,00 85,00 84,00 83,00 % 85,15 85,71 82,00 81,70 81,00 81,60 80,00 79,00 Контроль 1 опытная 2 опытная 3 опытная Группа Рисунок 8. Показатели вывода цыплят 2.2.2. Оптимизация эффекта применения препарата АСД путем двукратной обработки яиц В данной серии экспериментов изучали возможность усиления эффекта стимуляции путем дополнительной обработки яиц при переводе на вывод с целью снижения таких отходов инкубации, как задохлики и некондиционные цыплята. 2.2.2.1. Опыт 4 В данном эксперименте изучали эффективность двукратного применения препарата (перед инкубацией и при переводе яиц на вывод). Для проведения эксперимента было подобрано 4 партии яиц. опытные партии перед инкубацией обрабатывали Все оптимальной концентрацией раствора АСД, установленной в 1-ой серии, а при переводе на вывод растворами этого же препарата в концентрации от 9 до 15%, что в 3-5 раз выше, чем при первоначальной обработке (табл. 17). 63 Таблица 17 Схема эксперимента Предынкубационная Количество обработка яиц растворами препарата, % 402 393 3 397 3 389 3 Партии яиц Контроль Опытная 1 Опытная 2 Опытная 3 Обработка растворами препарата, % 9 12 15 2.2.2.1.1. Показатели биоконтроля инкубации Двукратная обработка высококачественных инкубационных яиц (в контроле выводимость яиц и вывод цыплят составляли 89,2% и 84,6%) растворами препарата не оказала достоверного влияния на показатели биологического контроля инкубации (табл. 18). Из таблицы 18 видно, что в 1, 2 и 3-й опытных партиях наблюдалось незначительное снижение уровня таких отходов инкубации, как неоплодотворенные яйца, замершие и задохлики, что свидетельствует о тенденции к повышению жизнеспособности эмбрионов. Это подтверждается ростом таких показателей, как выводимость яиц (рис.9) и вывод цыплят (рис.10), которые в вышеуказанных партиях превосходили контроль на 0,842,0% и 0,91-2,06% соответственно. Максимальный эффект был достигнут во 2-ой опытной партии при повторной обработке на 19-е сутки 12% раствором препарата. В этой партии смертность эмбрионов в виде «задохликов» снизилась в 1,8 раза, а количество слабых было на уровне контроля. Выводимость яиц и вывод цыплят были на 2,0% и 2,06% соответственно выше, чем в контроле. Однако различия по этим показателям статистически недостоверны. по сравнению с контролем были 64 Таблица 18 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 5.22 ± 1.10 - 2.74 ± 0.81 - 4.48 ± 1.03 - 2.74 ± 0.81 - 1 опытная 5.08 ± 1.10 -0.14 3.05 ± 0.86 0.31 3.30 ± 0.90 -1.18 2.29 ± 0.75 2 опытная 5.03 ± 1.09 -0.19 3.27 ± 0.89 0.53 3.27 ± 0.89 -1.21 3 опытная 4.88 ± 1.09 -0.34 2.82 ± 0.84 0,08 3.59 ± 0.94 -0.89 Партия ∆ Выводимость яиц ∆ 0.25 ± 0.24 - 89.24 ± 1.58 - 84.58 ± 1.80 - -0.45 0.76 ± 0.43 0.51 90.08 ± 1.54 0.84 85.49 ± 1.77 0.91 1.51 ± 0.61 -1.23 0.25 ± 0.25 0.00 91.24 ± 1.45 2.00 86.64 ± 1.70 2.06 1.54 ± 0.62 -1.20 0.77 ± 0.44 0.52 90.81 ± 1.50 1.57 86.37 ± 1.73 1.79 Задохлики ∆ Слабые Вывод цыплят ∆ 65 91,50 91,00 90,50 91,25 90,00 % 90,08 89,50 89,00 90,81 89,24 88,50 88,00 Контроль 1 опытная 2 опытная 3 опытная Группа Рисунок 9. Показатели выводимости яиц в 4 опыте 87,00 86,50 86,00 85,50 86,65 86,38 2 опытная 3 опытная % 85,00 85,50 84,50 84,58 84,00 83,50 Контроль 1 опытная Группа Рисунок 10. Показатели вывода цыплят в 4 опыте 66 2.2.2.2.Опыт 5 В связи с недостоверностью полученных данных в предыдущем опыте, целью данного эксперимента явилось изучение влияния двукратной обработки на показатели биоконтроля инкубации, некоторые анатомические, биохимические показатели суточных цыплят, а также зооветеринарные показатели при их выращивании. Также как и в предыдущем эксперименте, было подобрано 4 партии яиц. Одна из которых была контрольной, а 1, 2 и 3 опытные партии обрабатывали как перед инкубацией, так и на 19-е сутки (табл. 19). Таблица 19 Партии яиц Контроль Опытная 1 Опытная 2 Опытная 3 Схема эксперимента Предынкубационная обработка Количество растворами яиц препарата, % 401 399 416 401 3 3 3 Обработка растворами препарата при переводе на вывод, % 6 12 24 2.2.2.2.1. Показатели биоконтроля инкубации Двукратная обработка (выводимость яиц и вывод яиц низкого инкубационного качества цыплят была на уровне 82,38% и 75,81% соответственно) оказала достоверное влияние на некоторые показатели биологического контроля инкубации (табл. 20). Установлено, что почти во всех опытных партиях происходит снижение отходов инкубации. В первую половину инкубации отход яиц в виде «неоплода», кровяных колец и замерших был ниже, чем в контроле на 0,5-2,0%, 1,2-3,3% и 0,3-3,5% соответственно. Во второй половине инкубации смертность эмбрионов в виде задохликов уменьшилась на 1,0-1,5% по сравнению с контролем. 67 Количество слабых цыплят в 1 опытной уменьшилось в 2 раза по сравнению с контролем, а во 2 и 3 опытных их не было вообще. В результате различия по выводимости яиц (рис. 11) и выводу цыплят (рис. 12) в опытных партиях с контролем составили 5,49-8,66% и 5,48-9,76% соответственно. Максимальный эффект стимуляции установлен во 2-ой опытной партии при обработке яиц по схеме 3%+12%. Так, отход яиц в виде «неоплода» и «кровяных колец» в этой партии уменьшился на 2% и 2,4% по сравнению с контролем. Аналогичная тенденция наблюдалась и в отношении других показателей, в частности количество замерших в данной группе уменьшилось в 1,8 раза, задохликов – в 2,6 раза. Выводимость яиц и вывод цыплят во 2-ой опытной партии достоверно возросли на 8,66% (р<0,001) и 9,76% соответственно по сравнению с контролем. 92,00 90,00 88,00 86,00 91,05 % 89,19 84,00 82,00 87,87 82,38 80,00 78,00 Контроль 1 опытная 2 опытная Группа Рисунок 11. Показатели выводимости яиц в 5 опыте 3 опытная 68 Таблица 20 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 7.98 ± 1.35 - 5.49 ± 1.13 - 7.73 ± 1.33 - 2.49 ± 0.77 - 0.50 ± 0.35 - 82.38 ± 1.98 - 75.81 ± 2.13 - 1 опытная 7.26 ± 1.29 -0.72 4.26 ± 1.01 -1.23 4.26* ± 1.01 -3.47 1.25 ± 0.55 1.24 0.25 ± 0.25 -0.25 89.18 ** ± 1.61 6.80 82.70* ± 1.89 6.89 2 опытная 6.00 ± 1.16 -1.98 3.12 ± 0.85 -2.37 4.32* ± 0.99 -3.41 0.96 ± 0.47 1.53 - -0.50 91.04*** ± 1.44 8.66 85.57 ± 1.72 9.76 3 опытная 7.48 ± 1.31 -0.50 2.24* ± 0.73 -3.25 7.48 ± 1.31 -0.25 1.49 ± 0.60 1.00 - -0.50 87.87* ± 1.69 5.49 81.29 ± 1.94 5.48 Партия Задохлики ∆ Слабые ∆ Выводимость яиц ∆ Вывод цыплят ∆ 69 86,00 84,00 82,00 85,58 80,00 82,71 % 78,00 81,30 76,00 74,00 75,81 72,00 70,00 Контроль 1 опытная 2 опытная 3 опытная Группа Рисунок 12. Показатели вывода цыплят в 5 опыте Как видно из таблицы 21 в лучшей опытной группе получено 97% яиц I категории против 95% в контроле. Таблица 21 Категории яиц по степени замыкания аллантоиса, % (n = 136) Партия яиц Развитие аллантоиса по категориям I II III 95,4 2,8 1,8 Контроль 2 опытная 97,2 1,7 1,1 Из таблицы 22 видно, что «усушка» яиц на 6-е и 12-е сутки во 2 опытной группе на 0,6% и 0,4% соответственно меньше, а на 18-е сутки на 0,6% больше, чем в контроле. Таблица 22 70 Потери массы яиц в процессе инкубации, % (n = 136) Партия яиц Контроль 6 5,1 ∆ - 2 опытная 4,5 -0,6 Сутки инкубации 6-12 ∆ 4,5 4,1 -0,4 12-18 4,0 ∆ - за 18 суток 13,0 4,6 0,6 12,6 ∆ -0,4 2.2.2.2.2. Анатомические показатели цыплят Благодаря стимулирующему действию препарата цыплята лучшей опытной группы превосходили контроль по живой массе, при этом различия между группами были достоверны и составляли 4,4% (р<0,01) (табл. 23). Следует отметить, что по массе мышечного и железистого желудков, сердца, селезенки и фабрициевой сумки эта группа превосходила контроль на 17,4% (р<0,05), 10,7%, 6,0% и 3,5% соответственно. Также как после однократной, инкубационных яиц у цыплят при двукратной обработке уменьшилась масса остаточного желтка с желточным мешком на 21,0% (р<0,01), при этом индекс массы остаточного желтка был достоверно ниже, чем в контроле на 2,6% (р<0,01). Однако индексы развития селезенки и фабрициевой сумки были на уровне контроля (табл. 24). 71 Таблица 23 Анатомические показатели цыплят в суточном возрасте, (n=5) Масса цыпленка, г Группа Контроль 1 опытная 38,81 ± 0,25 40,51 ± 0,15** ∆, % 4,38 Масса остаточ. желтка с желточ. мешком, г 4,20 ± 0,16 3,32 ± 0,07** ∆, % -20,95 Масса печени, г 1,30 ± 0,01 1,30 ± 0,01 ∆, % - Масса мышечн. и железист. желудков, г 3,33 ± 0,10 3,91 ± 0,11* ∆, % 17,42 Масса сердца, г 0,28 ± 0,01 0,31 ± 0,01 ∆, % Масса селезенки, мг 10,71 13,40 ± 0,24 14,20 ± 0,20 ∆, % Масса фабриц. сумки, мг 58,00 ± 2,00 60,00 ± 3,16 5,97 ∆, % 3,45 Таблица 24 Индексы развития внутренних органов цыплят в суточном возрасте, % Группа Контроль 1 опытная Остаточный желток с желточным мешком 10,82 ± 0,43 8,21 ± 0,18** ∆,% -2,61 Печень 3,35 ± 0,04 3,21 ± 0,03* ∆,% -0,14 Мышечн. и железист. желудки 8,59 ± 0,30 9,67 ± 0,29 ∆,% 1,08 Сердце 0,72 ± 0,02 0,78 ± 0,03 ∆,% 0,06 Селезенка 0,03 ± 0,02 0,04 ± 0,01 ∆,% 0,01 Фабрициева сумка 0,15 ± 0,01 0,13 ± 0,01 ∆,% - 72 2.2.2.2.3. Некоторые показатели неспецифической резистентности В сыворотке крови суточных цыплят наблюдалась тенденция к повышению некоторых показателей неспецифической резистентности организма. Так, бактерицидная активность возросла на 5,8%, а количество лизоцима было выше, чем в контроле на 5,3% (таблица 25). Таблица 25 Содержание лизоцима и бактерицидная активность сыворотки крови цыплят в суточном возрасте (n = 5) Группа Лизоцим, мкг/л ∆, % Бактерицидная активность, % ∆, % Контроль 31,9 ±5,44 - 37,46 ± 5,82 - 2 опытная 33,6 ± 5,69 5,33 43,22 ± 4,75 5,76 2.2.2.2.4. Гематологические исследования В крови цыплят лучшей опытной группы установлено достоверное повышение гемоглобина и гематокрита на 4,8% (р<0,001) и 1,7% (р<0,05), а также установлена тенденция к увеличению содержания эритроцитов на 4,5%, при этом скорость оседания эритроцитов уменьшилась на 10,5% (таблица 26). Таблица 26 Некоторые гематологические показатели цыплят в суточном возрасте (n = 5) Группа Контроль 2 опытная Гемоглобин, г/л 91,4 ± 0,12 95,8 ± 0,32*** Содержание эритроцитов, 1012/л 2,2 ± 0,04 2,3 4,8 ± 0,11 ∆, % ∆, % 4,5 Гематокрит, % ∆, % СОЭ, мм/ч 33,2 ± 0,49 34,9 ± 0,23* - 3,8 ± 0,2 3,4 ± ,24 1,7 ∆, % 10,5 73 2.2.2.2.5. Биохимические исследования сыворотки крови Биохимические исследования сыворотки крови суточных цыплят из лучшей опытной (обработка АСД в концентрациях 3%+12%) и контрольной групп подтвердили данные, полученные в предыдущих экспериментах. Следует отметить достоверное повышение количества общего белка в сыворотке крови цыплят опытной группы на 6,54% (р<0,01) по сравнению с контролем (табл. 27). В связи с этим наблюдается тенденция к увеличению всех фракций белков, в частности АLB на 2,4%, postALB на 9,8%, Cp на 3,1%, 2 на 12,2%, 1 на 7,3%, Lp на 5,7%, а содержание preALB, Tf и S2 достоверно возросло на 11,1% (р<0,05), 4,3% (р<0,05) и 20% (р<0,01) соответственно по сравнению с контролем. Таблица 27 Содержание общего белка и белковых фракций в сыворотке крови цыплят в суточном возрасте, г/л (n = 5) Группа Контроль 2 опытная Общий белок Pre Alb Alb Post Alb Tf Cp β2 Sα2 γ1 βLp 38,55 ± 0,09 41,07 ± 0,33** 2,87 ± 0,06 3,19 ± 0,07* 9,71 ± 0,11 9,94 ± 0,10 2,45 ± 0,12 2,69 ± 0,07 9,43 ± 0,09 9,84 ± 0,08* 1,93 ± 0,05 1,99 ± 0,01 2,95 ± 0,05 3,31 ± 0,08 2,30 ± 0,01 2,76 ± 0,08** 3,03 ± 0,05 3,25 ± 0,08 3,86 ± 0,11 4,08 ± 0,19 2.2.2.2.6. Зооветеринарные показатели Данные по сохранности молодняка представлены в таблице 28, из которой видно, что в первые 2 недели выращивания падеж в опытной группе был меньше, чем в контроле на 3%. В третью неделю падеж цыплят отсутствовал, а в дальнейшем различий между группами по этому показателю не было. В целом за весь период выращивания падеж цыплят в опытной группе был вдвое ниже, чем в контроле. 74 Таблица 28 Динамика сохранности цыплят (n=100) За весь период Группы цыплят Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол 35-42 Падеж, гол 28-35 Сохранность, % 21-28 Падеж, гол 14-21 Сохранность, % 7-14 Падеж, гол 1-7 Сохранность, % Возраст в сутках Контроль 2 опытная 98 100 2 - 99 100 1 - 100 100 - 99 99 1 1 98 98 2 2 100 100 - 6 3 94 97 Из таблицы 29 следует, что за период выращивания у цыплят лучшей опытной группы установлена тенденция к повышению живой массы. Так, в первые 3 недели выращивания цыплята опытной группы по живой массе достоверно превосходили контроль на 3,3-2,5% (р<0,01-0,05). В 5-ти недельном возрасте молодняк опытной группы в среднем превосходил контроль по этому показателю только на 2,1%. Следует отметить, что при двукратной обработке яиц раствором препарата (3%+12%) установлен более стабильный эффект последействия на живую массу цыплят, чем при однократной. Таблица 29 Динамика живой массы, г (n=30) Возраст, сутки Контрольная 2 опытная ∆,% 7 14 21 28 35 68,17 ± 0,65 126,90 ± 1,09 194,67 ± 1,71 294,9 ± 2,32 396,43 ± 4,61 70,43 ± 0,52** 131,03± 1,18** 199,47 ± 1,62* 301,70± 2,81 404,77± 4,89 3,3 3,3 2,5 2,3 2,1 Из таблицы 30 видно, что скорость ювенальной линьки в 30 суток была на 4,3% (р<0,001) выше, чем в контроле. 75 Таблица 30 Линька, % (n=30) Линька, сутки Контрольная Опытная ∆,% 30 60 5,33±1,04 30,33±2,51 9,67±0,35*** 32,33±2,01 4,34 2,00 2.2.3. Третья серия экспериментов – эффективность предынкубационной обработки яиц растворами комплекса микроэлементов С целью изучения эффективности воздействия однократной предынкубационной обработки инкубационных яиц растворами комплекса микроэлементов было проведено 2 научно-хозяйственных эксперимента. 2.2.3.1.Опыт 6 В данном опыте изучали влияние предынкубационной обработки яиц растворами комплекса микроэлементов разных концентраций. Одна из партий была контрольной, а остальные 4 опытные партии обрабатывали растворами изучаемого препарата в концентрациях от 0,05% до 0,5% (табл. 31). Таблица 31 Партии яиц Контроль Опытная 1 Опытная 2 Опытная 3 Опытная 4 Схема эксперимента Количество Обработка растворами яиц препарата, % 395 395 0,05 0,1 385 382 0,25 387 0,5 76 2.2.3.1.1. Показатели биоконтроля инкубации Исследования показали, что предынкубационная обработка яиц во всех вариантах оказала положительное влияние на показатели инкубации. Так, установлено уменьшение смертности зародышей на самых ранних стадиях эмбриогенеза. Количество кровяных колец и замерших в опытных партиях (кроме 1 и 4) уменьшилось в 1,6-2,3 и 1,1-1,2 раза соответственно по сравнению с контролем (табл. 32). Следует также отметить, что только во 2 опытной партии наблюдалась тенденция к уменьшению задохликов, тогда как в 1 опытной их количество было на уровне контроля, а в 3 и 4 опытных партиях количество задохликов даже превышало контроль. Количество слабых цыплят в 1 опытной партии уменьшилось в 1,5 раза по сравнению с контролем, во 2, 3 и 4 партиях слабых цыплят не было. Выводимость яиц (рис. 13) и вывод цыплят (рис. 14) в опытных партиях увеличились на 2,39-4,66% и 1,52-3,92% соответственно по сравнению с контролем. Максимальная выводимость на 4,7% превышающая аналогичный показатель в контроле, была получена во 2 опытной партии яиц, которую обрабатывали 0,1% раствором комплекса микроэлементов. 92,00 91,00 90,00 89,00 % 88,00 90,06 91,85 90,48 87,00 86,00 89,59 87,19 85,00 84,00 Контроль 1 опытная 2 опытная 3 опытная Группа Рисунок 13. Показатели выводимости яиц в 6 опыте 4 опытная 77 Таблица 32 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 7.09 ± 1.29 - 5.32 ± 1.12 - 3.80 ± 0.96 - 2.03 ± 0.70 - 1 опытная 8.35 ± 1.39 1.26 2.27* ± 0.75 -3.05 4.30 ± 1.02 0.50 2.02 ± 0.70 2 опытная 7.53 ± 1.34 0.44 3.11 ± 0.88 -2.21 3.11 ± 0.88 -0.69 3 опытная 6.54 ± 1.26 -0.55 3.14 ± 0.89 -2.18 3.40 ± 0.92 4 опытная 5.68 ± 1.17 -1.41 3.35 ± 0.91 -1.97 3.87 ± 0.98 Партия ∆ Выводимость яиц ∆ 0.76 ± 0,43 - 87.19 ± 1.74 - 81.01 ± 1.97 - 0,01 0.50 ± 0.35 -0.26 90.05 ± 1.57 2.86 82.53 ± 1.91 1.52 1.29 ± 0.57 0.74 - -0.75 91.85* ± 1.44 4.66 84.93 ± 1.82 3.92 -0.40 2.35 ± 0.77 0.32 - -0.75 90.47 ± 1.55 3.28 84.55 ± 1.84 3.54 0.07 2.58 ± 0.80 0.55 - -0.75 89.58 ± 1.59 2.39 84.49 ± 1.83 3.48 Задохлики ∆ Слабые Вывод цыплят ∆ 78 85,00 84,00 83,00 84,94 % 82,00 81,00 80,00 84,55 84,50 82,53 81,01 79,00 Контроль 1 опытная 2 опытная 3 опытная 4 опытная Группа Рисунок 14. Показатели вывода цыплят в 6 опыте 2.2.3.2. Опыт 7 Как и в предыдущем эксперименте, в данном опыте изучали эффективность предынкубационной обработки яиц более высокими концентрациями растворов препарата от 0,1 до 1% (табл. 33). Таблица 33 Партии яиц Контроль Опытная 1 Опытная 2 Опытная 3 Схема эксперимента Количество Обработка растворами яиц препарата, % 404 404 0,1 406 0,5 404 1 2.2.3.2.1. Показатели биоконтроля инкубации Так же как и в предыдущем эксперименте, в данном исследовании в опытных партиях яиц установлена тенденция к снижению всех категорий отходов инкубации. Так, отходы инкубации в виде «неоплода» уменьшились на 0,78-1,24% по сравнению с контролем. 79 Количество кровяных колец уменьшилось незначительно. Следует отметить также, что под влиянием препарата снизилась гибель эмбрионов, таких как замершие и задохлики на 0,74-1,49% и 0,25-1% соответственно, а количество слабых цыплят уменьшилось на 0,75-1% (табл. 34). Максимальный стимулирующий эффект установлен при применении 0,1% раствора комплекса микроэлементов. При этом выводимость яиц (рис. 15) возросла на 4,11%, а вывод кондиционного молодняка (рис. 16) на 4,7% по сравнению с контролем. Однако различия между опытом и контролем по этим показателям были статистически недостоверны. Очевидно это обусловлено нестабильностью стимулирующего эффекта однократного действия препарата. Полученная положительная тенденция позволяет предположить возможность усиления эффекта стимуляции при двукратной обработке инкубационных яиц растворами комплекса микроэлементов. 90,00 89,00 88,00 87,00 % 89,18 86,00 87,89 87,63 85,00 84,00 85,07 83,00 Контроль 1 опытная 2 опытная Группа Рисунок 15. Показатели выводимости яиц в 7 опыте 3 опытная 80 Таблица 34 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 7.18 ± 1.28 - 3.96 ± 0.97 - 4.70 ± 1.05 - 3.22 ± 0.87 - 1 опытная 6.18 ± 1.19 -1.00 3.71 ± 0.94 -0.25 3.21 ± 0.87 -1.49 2.22 ± 0.73 2 опытная 6.40 ± 1.21 -0.78 3.94 ± 0.96 -0.02 3.94 ± 0.96 -0.76 3 опытная 5.94 ± 1.17 -1.24 3.46 ± 0.90 -0.50 3.96 ± 0.97 -0.74 Партия ∆ Выводимость яиц ∆ 1.98 ± 0.69 - 85.07 ± 1.84 - 78.96 ± 2.02 - -1.00 0.99 ± 0.49 -0.99 89.18 ± 1.59 4.11 83.66 ± 1.83 4.70 2.21 ± 0.73 -1.01 1.23 ± 0.54 -0.75 87,89 ± 1.67 2.82 82.26 ± 1.89 3.30 2.97 ± 0.84 -0.25 1.23 ± 0.55 -0.75 87.63 ± 1.68 2.56 82.42 ± 1.89 3.46 Задох лики ∆ Слабые Вывод цыплят ∆ 81 84,00 83,00 82,00 81,00 % 80,00 83,66 79,00 78,00 82,27 82,43 78,96 77,00 76,00 Контроль 1 опытная 2 опытная 3 опытная Группа Рисунок 16. Показатели вывода цыплят в 7 опыте Из таблицы 35 видно, что в лучшей опытной группе получено 98% яиц I категории против 97% в контроле. Таблица 35 Категории яиц по степени замыкания аллантоиса, % (n = 136) Партия яиц Развитие аллантоиса по категориям I II III 96,8 2,3 0,9 Контроль 1 опытная 97,9 1,5 0,6 Из таблицы 36 видно, что «усушка» яиц на 6-е и 12-е сутки в 1 опытной группе на 0,7% и 0,2% соответственно меньше, а на 18-е сутки на 0,6% больше, чем в контроле, что указывает на более благоприятные условия для развивающегося зародыша. 82 Таблица 36 Потери массы яиц в процессе инкубации, % (n = 136) Сутки инкубации Партия яиц Контроль 6 6,1 ∆ - 6-12 4,4 ∆ - 12-18 4,2 ∆ - 3 опытная 5,4 -0,7 4,2 -0,2 4,8 0,6 за 18 суток ∆ 14,0 - 13,7 -0,3 2.2.3.2.2. Анатомические показатели цыплят Цыплята в суточном возрасте, выведенные из инкубационных яиц 1 опытной партии были более активные, подвижные и превосходили контроль как по живой массе на 5,6%, так и по массе внутренних органов. Повысилась масса печени и мышечного и железистого желудков на 4,1 и 8,1% соответственно, а масса остаточного желтка с желточным мешком снизилась в опытной партии на 18,9%, что связано с его интенсивным использованием (табл. 37). Кроме того, установлена тенденция к повышению массы селезенки и фабрициевой сумки на 10% и 16% соответственно. При этом снизился индекс массы остаточного желтка на 2,5% по сравнению с контролем и установлена тенденция к увеличению индексов развития желудков и фабрициевой сумки (табл. 38). 2.2.3.2.3. Некоторые показатели неспецифической резистентности Бактерицидная активность сыворотки крови суточных цыплят, полученных из яиц после предынкубационной обработки 0,1% раствором комплекса микроэлементов увеличилась на 3,2%, а количество лизоцима возросло на 6,45% (р<0,05) (табл. 39). 83 Таблица 37 Анатомические показатели цыплят в суточном возрасте, (n=5) Масса цыпленка, г Группа Контроль 1 опытная 40,94 ± 1,42 43,22 ± 1,14 ∆, % 5,57 Масса остаточ. желтка с желточ. мешком, г 4,49 ± 0,54 3,64 ± 0,33 ∆, % -18,93 Масса печени, г 0,97 ± 0,04 1,01 ± 0,02 ∆, % 4,12 Масса мышечн. и железист. желудков, г 2,60 ± 0,08 2,81 ± 0,09 ∆, % 8,08 Масса сердца, г 0,29 ± 0,03 0,29 ± 0,01 ∆, % Масса селезенки, мг - 20,00 ± 3,16 22,00 ± 2,00 ∆, % Масса фабриц. сумки, мг 10,00 50,00 ± 5,48 58,00 ± 3,74 ∆, % 16,00 Таблица 38 Индексы развития внутренних органов цыплят в суточном возрасте, % Группа Контроль 1 опытная Остаточный желток с желточным мешком 10,88 ± 0,97 8,38 ± 0,54 ∆,% -2,50 Печень 2,40 ± 0,13 2,34 ± 0,09 ∆,% -0,06 Мышечн. и железист. желудки 6,41 ± 0,33 6,50 ± 0,13 ∆,% 0,09 Сердце 0,71 ± 0,06 0,69 ± 0,03 ∆,% -0,02 Селезенка 0,05 ± 0,01 0,05 ± 0,01 ∆,% - Фабрициева сумка 0,12 ± 0,01 0,13 ± 0,01 ∆,% 0,01 84 Таблица 39 Содержание лизоцима и бактерицидная активность сыворотки крови цыплят в суточном возрасте (n = 5) Группа Лизоцим, мкг/л ∆, % Бактерицидная активность, % ∆, % Контроль 32,58 ± 0,70 - 38,5 ± 1,59 - 1 опытная 34,68 ± 0,64 6,45 41,7 ± 1,15 3,20 2.2.3.2.4. Биохимические исследования сыворотки крови Предынкубационная обработка яиц 0,1% раствором комплекса микроэлементов привела к достоверному повышению уровня общего белка в сыворотке крови на 2,7% (р<0,01), АLB на 1,5% (р<0,05), Tf на 3% (р<0,01), 2 на 7,5% (р<0,05) и S2 на 2,2% (р<0,01) по сравнению с контролем, а также отмечена тенденция к увеличению таких фракций белков, как preALB, postALB, Cp и 1 (табл. 40). Таблица 40 Содержание общего белка и белковых фракций в сыворотке крови цыплят в суточном возрасте, г/л (n = 5) Группа Контроль 1 опытная Общий белок Pre Alb Alb Post Alb Tf Cp β2 Sα2 γ1 βLp 38,73 ± 0,04 39,78 ± 0,19** 2,84 ± 0,03 2,88 ± 0,01 10,65 ± 0,04 10,81 ± 0,03* 2,40 ± 0,02 2,45 ± 0,02 10,11 ± 0,02 10,40 ± 0,04* 1,32 ± 0,02 1,33 ± 0,04 2,65 ± 0,04 2,85 ± 0,06* 2,27 ± 0,01 2,32 ± 0,04** 2,84 ± 0,02 3,07 ± 0,10 3,64 ± 0,03 3,67 ± 0,03 85 2.2.3.2.5. Зооветеринарные показатели При выращивании цыплят установлено, что молодняк лучшей опытной группы по жизнеспособности превосходил контроль (табл. 41). В первые 2 недели выращивания падеж молодняка в опытной группе был в 4 раза ниже, чем в контроле. В среднем за весь исследуемый период выращивания падеж в опытной группе был на 2% ниже, чем в контроле. Таблица 41 Динамика сохранности цыплят n=100 За весь период Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол 35-42 Падеж, гол 28-35 Сохранность, % 21-28 Падеж, гол 14-21 Сохранность, % Контроль 1 опытная 7-14 Падеж, гол Группы цыплят 1-7 Сохранность, % Возраст в сутках 98 99 2 1 98 100 2 - 99 98 1 2 99 99 1 1 100 99 1 99 100 1 - 7 5 У цыплят лучшей опытной группы повышению живой массы. 93 95 отмечалась тенденция к Наиболее значительная разница с контролем наблюдалась в первую и вторую неделю выращивания и составляла 2,8 (р<0,01) и 2,6% (р<0,05) соответственно. В дальнейшем эти различия постепенно сглаживались и к концу выращивания разница с контролем составила всего лишь 0,6% (табл. 42). Таблица 42 Динамика живой массы, г (n=30) Возраст, сутки (кол-во гол.) 7 14 21 28 35 Контрольная Опытная ∆,% 68,90 ± 0,41 127,6 ± 1,11 195,53 ± 1,89 289,83 ± 3,02 397,03 ± 4,63 70,83 ± 0,64** 130,9± 1,11* 199,63 ± 1,14 295,27 ± 2,54 399,57 ± 3,71 2,8 2,6 2,1 1,9 0,6 86 При определении скорости ювенальной линьки не установлено достоверных различий между группами по нижеуказанному показателю (табл. 43). Таблица 43 Линька, % (n=30) Линька, сутки Контрольная Опытная ∆,% 30 60 5,00±1,04 30,67±2,03 7,33±1,06 32,33±0,97 2,33 1,66 2.2.4. Четвертая серия экспериментов – эффективность двукратной обработки яиц растворами комплекса микроэлементов 2.2.4.1. Опыт 8 С учетом результатов третьей серии экспериментов, в которой определили оптимальную концентрацию раствора препарата для предынкубационной обработки, была разработана схема двукратного его применения. Опыт выполнен на 5 партиях яиц, которые (кроме контроля) перед инкубацией обрабатывали оптимальной концентрацией раствора комплекса микроэлементов, установленной в 3 серии, а при переводе на вывод применяли повышенные (1-5%) концентрации растворов препарата (табл. 44). Таблица 44 Схема эксперимента Партии яиц Количество яиц Предынкубационная обработка растворами препарата, % Контроль Опытная 1 Опытная 2 Опытная 3 Опытная 4 395 385 396 378 382 0,1 0,1 0,1 0,1 Обработка растворами препарата при переводе на вывод, % 1 3 5 87 2.2.4.1.1. Показатели биоконтроля инкубации при однократной и двукратной обработке яиц Двукратная обработка яиц растворами препарата оказала более существенное влияние на показатели биоконтроля инкубации, чем однократная. Из таблицы 45 видно, что во всех опытных партиях отходы инкубации в виде неоплодотворенных яиц, кровяных колец и замерших уменьшились на 0,4-1,9%, 1,7-2,4% и 0,1-1,3% соответственно по сравнению с контролем. Количество задохликов в 1 опытной партии (однократная обработка) снизилось в 1,1 раза по сравнению с контролем, а слабых было столько же как и в контроле. Тогда как в опытных партиях, где применяли двукратную обработку при переводе на вывод, задохликов было в 2-8 раза меньше, чем в контроле. Максимальный результат был отмечен во 2 опытной партии при двукратной обработке раствором препарата по схеме 0,1+1%. В этой партии количество задохликов достоверно уменьшилось в 8 раз (p‹0,05), а слабые цыплята отсутствовали. Вследствие снижения смертности эмбрионов, в особенности во второй половине инкубации, выводимость яиц (рис. 17) и вывод цыплят (рис. 18) во 2 опытной партии по сравнению с контролем были достоверно выше на 5,8% (p‹0,01) и 7,1% (p‹0,01), а по сравнению с 1 опытной партией (однократная обработка) - на 2,8% и 3,9%. Следует отметить, что положительные результаты при двукратной обработке яиц получены на фоне среднего инкубационного качества яиц (выводимость и вывод в контроле составили 87,6 и 82,5% соответственно). 88 Таблица 45 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 5.82 ± 1.17 - 5.06 ± 1.10 - 4.05 ± 0.99 - 2.03 ± 0.70 - 1 опытная 5.45 ± 1.15 -0.37 3.37 ± 0.92 -1.69 3.11 ± 0.88 -0.94 1.81 ± 0.68 2 опытная 4.04 ± 0.98 -1.78 3.28 ± 0.89 -1.78 2.77 ± 0.82 -1.28 3 опытная 4.76 ± 1.09 -1.06 2.64 ± 0.82 -2.42 3.96 ± 1.00 4 опытная 3.92 ± 0.99 -1.90 3.14 ± 0.89 -1.92 3.66 ± 0.96 Партия ∆ Выводимость яиц ∆ 0.51 ± 0.35 - 87.63 ± 1.70 -0.22 0.51 ± 0.36 - 0.25* ± 0.25 -1.78 - -0.09 1.05 ± 0.52 -0.98 0.39 1.04 ± 0.52 -0.99 Задох лики ∆ Вывод цыплят ∆ - 82.53 ± 1.91 - 90.65 ± 1.52 3.02 85.71 ± 1.78 3.18 -0.51 93,42** ± 1.27 5.79 89.64** ± 1.53 7.11 - -0.51 91,94 ± 1.43 4.31 87.56* ± 1.69 5.03 0.52 ± 0.36 0.01 91.28 ± 1.47 3.65 87.69* ± 1.68 5.16 Слабые 89 94,00 93,00 92,00 91,00 90,00 % 89,00 88,00 87,63 90,66 Контроль 1 опытная 93,42 91,94 91,28 87,00 86,00 85,00 84,00 2 опытная 3 опытная 4 опытная Группа Рисунок 17. Показатели выводимости яиц в 8 опыте 90,00 88,00 86,00 % 84,00 82,53 85,71 89,65 87,57 87,70 3 опытная 4 опытная 82,00 80,00 78,00 Контроль 1 опытная 2 опытная Группа Рисунок 18. Показатели вывода цыплят в 8 опыте 90 2.2.4.2. Опыт 9 Эксперимент является повторностью предыдущего исследования, выполненный на яйцах высокого инкубационного качества. Схема опыта приведена в таблице 46, из которой видно, что опытные партии подвергали двукратной обработке растворами препарата. Таблица 46 Схема эксперимента Партии яиц Количество яиц Предынкубационная обработка растворами препарата, % Контроль Опытная 1 Опытная 2 402 394 397 0,1 0,1 Обработка растворами препарата при переводе на вывод, % 1 3 2.2.4.2.1. Показатели биоконтроля инкубации Обработка яиц высокого инкубационного качества (вывод цыплят в контроле на уровне 85%) растворами препарата не оказала достоверного влияния на показатели биоконтроля инкубации (табл. 47). Из таблицы 47 видно, что при обработке яиц растворами комплекса микроэлементов в 1 и 2 опытных партиях наблюдается незначительное снижение таких отходов инкубации, как «неоплод», замершие и задохлики. Следует отметить, что выводимость яиц (рис. 19) и вывод цыплят (рис. 20) в опытных партиях была на уровне 89-92% и 84-88% соответственно, что на 2-3% выше, чем в контроле. Однако даже в этом эксперименте максимальный эффект стимуляции установлен в 1 опытной партии (0,1+1%). 91 Таблица 47 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Контроль 5.22 ± 1.10 - 1 опытная 5.07 ± 1.10 2 опытная 4.53 ± 1.04 Партия ∆ Выводимость яиц ∆ 0.75 ± 0.42 - 89.24 ± 1.58 - 84.58 ± 1.80 - -1.48 0.25 ± 0.25 -0.50 92.24 ± 1.38 3.00 87.56 ± 1.66 2.98 -1.23 0.75 ± 0.43 0.01 91.29 ± 1.44 2.05 87.15 ± 1.67 2.57 ∆ Замершие ∆ 2.74 ± 0.81 - 3.98 ± 0.97 - 2.74 ± 0.81 - -0.15 3.04 ± 0.86 0.30 2.79 ± 0.82 -1.19 1.26 ± 0.56 -0.69 2.77 ± 0.82 0.03 3.27 ± 0.89 -0.71 1.51 ± 0.61 Кровяные кольца Задох лики ∆ Слабые Вывод цыплят ∆ 92 92,50 92,00 91,50 91,00 90,50 % 90,00 89,50 89,24 91,29 92,25 89,00 88,50 88,00 87,50 Контроль 1 опытная 2 опытная Группа Рисунок 19. Показатели выводимости яиц в 9 опыте 88,00 87,50 87,00 86,50 86,00 % 85,50 85,00 87,56 87,15 84,58 84,50 84,00 83,50 83,00 Контроль 1 опытная Группа Рисунок 20. Показатели вывода цыплят в 9 опыте 2 опытная 93 2.2.4.3. Опыт 10 Целью данного эксперимента явилось продолжение определения стимулирующего влияния препарата в зависимости от исходного качества яиц. 1 и 2 опытные партии обрабатывались перед закладкой 0,1% раствором комплекса микроэлементов, а на 19-е сутки - 1-3% раствором препарата (табл. 48). Таблица 48 Схема эксперимента Партии яиц Количество яиц Предынкубационная обработка растворами препарата, % Контроль Опытная 1 Опытная 2 386 393 392 0,1 0,1 Обработка растворами препарата при переводе на ваывод, % 1 3 2.2.4.3.1. Показатели биоконтроля инкубации При двукратной обработке яиц среднего инкубационного качества (вывод цыплят в контроле составил 80%) растворами препарата выявлено достоверное положительное влияние на показатели биоконтроля инкубации (табл. 49). Из таблицы 49 видно, что в 1 опытной партии (обработка яиц по схеме 0,1%+1%) установлено снижение отходов инкубации почти по всем категориям. Так, количество замерших и задохликов достоверно снизилось в 10 и 3 раза соответственно по сравнению с контролем (p‹0,01), а слабые цыплята отсутствовали. Выводимость яиц была на 7,8% (p‹0,01) выше, чем в контроле. Тогда как во второй опытной партии (1%+3%) эффект стимуляции (увеличение выводимости яиц (рис. 21) и вывода цыплят (рис. 22) был почти в 1,5 раза ниже, чем в 1 опытной. 94 Таблица 49 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 4.15 ± 1.01 - 2.59 ± 0.80 - 2.59 ± 0.80 - 8.81 ± 1.44 - 1 опытная 6.61 ± 1.25 2.46 4.32 ± 1.02 1.73 0.25** ± 0.25 -2.34 3.30** ± 0.90 2 опытная 5.10 ± 1.11 0.95 3.57 ± 0.93 0.98 1.78 ± 0.66 -0.81 5.10* ± 1.11 Партия Задох лики ∆ Выводимость яиц ∆ 1.55 ± 0.62 - 83.78 ± 1.91 - 80.31 ± 2.02 - -5.51 - -1.55 91.55 ** ± 1.45 7.77 85.49 ± 1.77 5.18 -3.71 0.76 ± 0.44 -0.79 88.17 ± 1.67 4.39 83.67 ± 1.86 3.36 ∆ Слабые Вывод цыплят ∆ 95 86,00 85,00 84,00 83,00 82,00 % 85,50 81,00 83,67 80,31 80,00 79,00 78,00 77,00 Контроль 1 опытная 2 опытная Группа Рисунок 21. Показатели выводимости яиц в 10 опыте 92,00 90,00 88,00 86,00 % 84,00 83,78 91,55 88,17 82,00 80,00 78,00 Контроль 1 опытная Группа Рисунок 22. Показатели вывода цыплят в 10 опыте 2 опытная 96 2.2.4.4. Опыт 11 Цель данного эксперимента - установить влияние препарата на показатели биоконтроля на фоне низкого инкубационного качества яиц, а также изучение влияния двукратной обработки на биохимические, анатомоморфологические и зооветеринарные показатели цыплят. Опытные партии обрабатывали по схеме, представленной в таблице 50. Таблица 50 Схема эксперимента Партии яиц Количество яиц Предынкубационная обработка растворами препарата, % Контроль Опытная 1 Опытная 2 404 405 408 0,1 0,1 Обработка растворами препарата при переводе на вывод, % 1 3 2.2.4.4.1. Показатели биоконтроля инкубации при двукратной обработке яиц При обработке яиц низкого инкубационного качества (вывод цыплят в контроле был на уровне 76%) растворами препарата, так же как при использовании АСД, установлено максимальное стимулирующее действие на показатели биоконтроля (табл. 51). Как видно из таблицы 51, в опытных партиях на различных стадиях инкубации установлено значительное снижение эмбриональной смертности. Лучшие результаты, также как и в предыдущих опытах, были зарегистрированы в 1 опытной партии (0,1%+1%). Отходы инкубации в этой партии в виде кровяных колец и замерших были в 1,6 и 1,9 раза ниже по сравнению с контролем. Следует отметить снижение гибели зародышей в виде задохликов вдвое, а слабых в 4,6 раза (p‹0,05) по сравнению с контролем. Выводимость яиц (рис. 23) и вывод цыплят (рис.24) в 1 опытной партии достоверно возросли на 9,7% и 11% соответственно по сравнению с 97 контролем (p‹0,001). Тогда как во 2-й опытной партии (0,1%+3%) эти показатели составили 6,8% (p‹0,05) и 7,3% (p‹0,05) соответственно. 92,00 90,00 88,00 86,00 84,00 % 82,00 87,40 90,31 80,65 80,00 78,00 76,00 74,00 Контроль 1 опытная 2 опытная Группа Рисунок 23. Показатели выводимости яиц в 11 опыте 86,00 84,00 82,00 80,00 78,00 % 76,00 85,19 74,26 81,62 74,00 72,00 70,00 68,00 Контроль 1 опытная Группы Рисунок 24. Показатели вывода цыплят в 11 опыте 2 опытная 98 Таблица 51 Показатели биологического контроля инкубации, % Неоплодотворенные яйца ∆ Кровяные кольца ∆ Замершие ∆ Контроль 7.92 ± 1.34 - 5.69 ± 1.15 - 5.94 ± 1.17 - 3.96 ± 0.97 - 1 опытная 5.67 ± 1.15 -2.25 3.45 ± 0.90 -2.24 3.20 ± 0.87 -2.74 1.97 ± 0.69 2 опытная 6.61 ± 1.23 -1.31 3.92 ± 0.96 -1.77 4.16 ± 0.98 -1.78 2.20 ± 0.72 Партия Задохлики ∆ Выводимость яиц ∆ 2.23 ± 0.73 - 80.65 ± 2.04 - 74.26 ± 2.17 - -1.99 0.49* ± 0.34 -1.74 90.31*** ± 1.51 9.66 85.18*** ± 1.76 10.92 -1.76 1.47 ± 0.59 -0.76 87.40* ± 1.70 6.75 81.61* ± 1.91 7.35 ∆ Слабые Вывод цыплят ∆ 99 Из таблицы 52 видно, что в лучшей опытной группе получено 98% яиц I категории против 95% в контроле. Таблица 52 Категории яиц по степени замыкания аллантоиса, % (n = 136) Партия яиц Развитие аллантоиса по категориям I II III 94,9 3,2 1,9 Контроль 1 опытная 97,8 1,3 0,9 «Усушка» яйца на 6-е и 12-е сутки в 1 опытной группе на 1,1% и 0,4% соответственно меньше, а на 18-е сутки на 0,9% больше, чем в контроле, что указывает на более благоприятные условия для развивающегося зародыша (табл. 53) Таблица 53 Потери массы яиц в процессе инкубации, % (n = 136) Партия яиц Контроль 6 5,5 ∆ - 1 опытная 4,4 -1,1 Сутки инкубации 6-12 ∆ 4,1 3,7 -0,4 12-18 3,9 ∆ - 4,8 0,9 2.2.4.4.2. Анатомические показатели цыплят Полученные данные анатомо-морфологических за 18 суток ∆ 12,9 - 12,3 -0,6 исследований подтвердили предыдущие исследования (табл. 54). Живая масса цыплят в суточном возрасте лучшей опытной группы была достоверно выше на 2,3% (p‹0,01) по сравнению с контролем. Масса остаточного желтка достоверно уменьшилась на 13% (p‹0,05), при этом индекс массы остаточного желтка был достоверно ниже на 1,73% (p‹0,01) (табл. 55). Кроме того наблюдалась тенденция к увеличению массы мышечного и железистого желудков на 8,2%, сердца и селезенки на 7,1% и 4,5% соответственно, а фабрициевой сумки на 3,5%. 100 Таблица 54 Анатомические показатели цыплят в суточном возрасте, (n=5) Масса цыпленка, г Группа Контроль Контроль 38,74 ± 0,15 39,61 ± 0,19* Масса остаточного ∆, желтка с % желточным мешком, г 4,53 ± 0,10 3,94 2,24 ± 0,11* ∆, % 13,02 Масса печени, г 1,30 ± 0,01 1,30 ± 0,01 ∆, % - Масса мышечн. и железист. желудков, г 3,40 ± 0,05 3,68 ± 0,13 Масса сердца, г ∆, % 0,28 ± 0,01 0,30 ± 0,01 8,24 ∆, % Масса селезенки, мг 13,40 ± 0,24 14,00 ± 0,32 7,14 Масса фабриц. сумки, мг ∆, % 58,00 ± 2,00 60,00 ± 3,16 4,48 ∆, % 3,45 Таблица 55 Индексы развития внутренних органов цыплят в суточном возрасте, % Группа Контроль 1 опытная Остаточный желток с желточным мешком 11,70 ± 0,28 9,97 ± 0,30** ∆,% -1,73 Печень 3,36 ± 0,02 3,29 ± 0,02 ∆,% -0,07 мышечн. и железист. желудки 8,78 ± 0,14 9,31 ± 0,34 ∆,% 0,53 Сердце 0,72 ± 0,03 0,76 ± 0,03 ∆,% 0,04 Селезенка 0,03 ± 0,01 0,04 ± 0,01 ∆,% 0,01 Фабрициева сумка 0,15 ± 0,01 0,15 ± 0,01 ∆,% - 101 2.2.4.4.3. Некоторые показатели неспецифической резистентности В отличие от однократной обработки яиц в данном эксперименте при определении бактерицидной активности и содержания лизоцима установлены значительные различия между контролем и лучшей опытной группой (табл. 56). У цыплят опытной группы количество лизоцима достоверно увеличилось на 14,5% (р<0,05) по сравнению с контролем, а бактерицидная активность сыворотки крови возросла на 6,7% (р<0,01). Таблица 56 Содержание лизоцима и бактерицидная активность сыворотки крови цыплят в суточном возрасте (n = 5) Группа Лизоцим, мкг/л ∆, % Бактерицидная активность, % ∆, % Контроль 38,96 ± 0,92 - 47,2 ± 1,36 - 1 опытная 44,6 ± 1,67* 14,48 53,9 ± 1,73** 6,70 2.2.4.4.4. Гематологические исследования При двукратной обработке инкубационных яиц комплексом микроэлементов по схеме (0,1+1%) в крови цыплят лучшей опытной группы достоверно увеличилось количество гемоглобина на 7,3% (р<0,001), гематокрита на 2,0% (р<0,05), эритроцитов на 7,3% (р<0,05) при снижении СОЭ на 10,5% (табл. 57). 102 Таблица 57 Гематологические показатели цыплят в суточном возрасте (n = 5) Группа Контроль 1 опытная Гемоглобин, г/л 91,40 ± 0,12 98,10 ± 0,41*** Содержание эритроцитов, 1012/л 2,2 ± 0,04 2,36 7,3 ± 0,04* ∆, % ∆, % Гематокрит, % ∆, % СОЭ, мм/ч 33,2 ± 0,49 35,2 ± 0,20* - 3,8 ± 0,2 3,4 ± 0,24 10,5 7,3 2,0 ∆, % 2.2.4.4.5. Биохимические исследования сыворотки крови Из данных представленных в таблице 58 видно, что двукратная обработка яиц растворами препарата оптимальной концентрации оказала значительное влияние на некоторые показатели белкового обмена. При этом достоверно возросло количество общего белка на 5,5% (р<0,01), preALB 9,7% (р<0,05), АLB на 2,9% (р<0,05), PostAlb (р<0,05) на 5,9%, Tf на 6,7% (р<0,01) и 1 на 14,2% (р<0,05) по сравнению с контролем, а также наблюдалась тенденция к увеличению таких фракций белков, как Cp, 2 S2 и Lp. Таблица 58 Содержание общего белка и белковых фракций в сыворотке крови цыплят в суточном возрасте, г/л (n = 5) Группа Контроль 1 опытная Общий белок Pre Alb Alb Post Alb Tf Cp β2 Sα2 γ1 βLp 39,51 ± 0,12 41,69 ± 0,31** 2,88 ± 0,07 3,16 ± 0,02* 10,89 ± 0,02 11,21 ± 0,08* 2,53 ± 0,04 2,68 ± 0,04* 10,28 ± 0,02 10,97 ± 0,11** 1,33 ± 0,03 1,36 ± 0,05 2,79 ± 0,11 2,82 ± 0,11 2,36 ± 0,03 2,65 ± 0,12 2,68 ± 0,03 3,06 ± 0,11* 3,77 ± 0,03 3,79 ± 0,04 103 2.2.4.4.6. Зооветеринарные показатели При выращивании цыплят, выведенных из яиц контрольной и 1-ой опытной партии яиц установлено, что в первые две недели выращивания падеж цыплят в опытной группе был в 2,5 раза ниже, чем в контроле. В дальнейшем различия по этому показателю постепенно сглаживались. За весь период выращивания падеж в лучшей опытной группе был в 2 раза ниже по сравнению с контролем (табл. 59). Таблица 59 Динамика сохранности цыплят n=100 За весь период Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол Сохранность, % Падеж, гол 35-42 Падеж, гол 28-35 Сохранность, % 21-28 Падеж, гол 14-21 Сохранность, % Контроль 1 опытная 7-14 Падеж, гол Группы цыплят 1-7 Сохранность, % Возраст в сутках 97 99 3 1 98 99 2 1 99 99 1 1 99 100 1 - 100 100 - 99 99 1 1 8 4 92 96 В первую неделю выращивания цыплята лучшей опытной группы на 3% (р<0,05) превосходили контроль по живой массе. К концу выращивания разница с контролем составила 1,5% и была статистически недостоверна (табл. 60). Таблица 60 Динамика живой массы, г (n=30) Возраст, дн. Контрольная 1 опытная ∆,% 7 14 21 28 35 70,90 ± 0,55 129,93 ± 1,33 205,47 ± 3,46 310,37 ± 3,70 424,5 ± 4,29 73,03 ± 0,77* 133,47± 1,41 208,93 ± 1,74 316,17± 3,61 430,73± 3,50 3,0 2,7 1,7 1,9 1,5 104 Из таблицы 61 видно, что скорость ювенальной линьки в 30 суток была на 5,3% (р<0,01) выше по сравнению с контролем. Таблица 61 Линька, % (n=30) Линька, сутки Контрольная Опытная ∆ 30 60 5,33±1,04 29,67±2,06 10,67±1,43** 32,33±2,18 5,34 2,67 105 2.2.4.5. Производственная проверка Для подтверждения полученных результатов и расчета экономической эффективности была проведена производственная проверка применения водных растворов препаратов «АСД-Ф2» и железосодержащего комплекса микроэлементов фирмы «А-Био» для обработки инкубационных яиц в условиях ФГУП ППЗ «Птичное». Яйца были получены от родительского стада в возрасте 300 дней. Средняя масса яиц составляла 57,2 г., до инкубации они хранились 6 дней. По методу аналогов было сформировано 3 партии яиц. В новом варианте I применяли двукратную обработку яиц по схеме: 3% раствором АСД перед инкубацией и 12% при переводе на вывод. В новом варианте II применяли 0,1% раствор препарата комплекса микроэлементов перед инкубацией и дополнительно обрабатывали 1% раствором этого же препарата при переводе на вывод. В базовом варианте (контроль) инкубационные яйца дополнительной обработке не подвергали (табл. 62). Производственная проверка в основном подтвердила результаты научно-хозяйственных экспериментов. При применении обработанных яиц растворов АСД по схеме (3%+12%) вывод увеличился на 8,8%, тогда как двукратная обработка комплексом микроэлементов позволила увеличить вывод кондиционных цыплят на 8,0% по сравнению с базовым вариантом. Таблица 62 Некоторые показатели биологического контроля и выращивания цыплят Вариант Показатели Базовый Новый I Новый II 1 2 3 4 1075 1079 1074 Кол-во яиц 106 1 Обработка яиц растворами препарата, % 2 3 4 - 3+12 0,1 + 1 9,02 6,58 6,42 - -2,44 -2,59 2,98 2,31 2,51 - -0,65 -0,46 6,05 3,24 3,44 - -2,80 -2,60 4,37 1,94 2,32 ∆, % - -2,42 -2,04 Слабые, % 1,40 0,92 1,11 ∆, % - -0,46 -0,27 83,74 90,97 89,95 - 7,22 8,80 76,19 84,98 84,17 - 8,80 7,98 Получено кондиционных цыплят, гол. 819 917 904 Сохранность цыплят за 60 дней выращивания, % 96,6 98,4 97,9 - 1,8 1,3 Неоплодотворенные яйца и «ложный неоплод», % ∆, % Кровяные кольца, % ∆, % Замершие, % ∆, % Задохлики, % Выводимость яиц, % ∆, % Вывод цыплят, % ∆, % ∆, % 107 В расчете на 1000 заложенных яиц в новом варианте I было получено дополнительно 88, а варианте II – 80 кондиционных цыплят (табл. 63). Затраты на препарат для двукратной обработки 1000 яиц растворами АСД составили 18,75 руб., а комплексом микроэлементов – 0,07 руб. Стоимость дополнительных работ на две обработки, из расчета 30 руб./чел. час, составили 14 руб. Суммарные расходы на обработку 1000 яиц по новому варианту I составили: 14 + 18,75 = 32,75 руб. Суммарные расходы на обработку 1000 яиц по новому варианту II составили: 14 + 0,07 = 14,07 руб. Стоимость молодняка в суточном возрасте составляет 23,5 руб./шт. Дополнительная прибыль на 1000 заложенных яиц при реализации молодняка в суточном возрасте в новом варианте I составила: (88 × 23,5) – 32,75 = 2035,25 руб.; а в новом варианте II: (80 × 23,5) – 14,07 =1865,93 руб. При выращивании цыплят до 2-х месячного возраста установлено, что сохранность в новом варианте I по сравнению с базовым была выше на 1,8% и составила 98,4%. С учетом более высокого процента вывода на 1000 заложенных яиц было получено на 100 цыплят больше чем в базовом варианте. При реализационной стоимости одной молодки в 60 дней 143,00 руб. и ее себестоимости в 123,40 руб., дополнительная прибыль полученная на конец выращивания цыплят на 1000 заложенных яиц в новом варианте I составит: [(143 – 123,40) *100] + [(88 * 23,5) –32,75] = 3995,25 руб. 108 Тогда, как в новом варианте II сохранность была выше, чем в базовом варианте на 1,3% и составила 97,9%. Следовательно, на 1000 заложенных яиц, с учетом вывода, сохранности и суммарных затрат на обработку, дополнительная прибыль на конец выращивания составит: [(143 – 123,40) *88] + [(80 * 23,5) –14,07] = 3590,73 руб. Акт производственной проверки прилагается (приложение). Таблица 63 Эффективность различных схем обработки яиц растворами препаратов АСД-Ф2 и комплексом микроэлементов в расчете на 1000 заложенных яиц Показатель 1 Вывод, % ∆ с базовым вариантом % Получено кондиционных цыплят, гол. Получено дополнительно цыплят в суточном возрасте по сравнению с базовым вариантом, гол. Средняя стоимость суточного молодняка, руб./шт. Стоимость препарата, руб. Затраты препарата на обработку 1000 яиц, руб. Стоимость дополнительных работ по обработке яиц, в расчете на 1000 шт. заложенных яиц (общие затраты), руб. Дополнительно полученная прибыль на 1000 заложенных яиц при реализации суточного молодняка, руб. Сохранность молодняка до 2-х месяцев, % Базовый вариант 2 76,19 Новый вариант I 3 84,98 Новый вариант II 4 84,17 - 8,79 7,98 762 850 842 - 88 80 23,5 - 125,00 (0,1 л) 60,00 (1л) - 18,75 0,07 - 32,75 14,07 - 2035,25 1865,93 96,6 98,4 97,9 109 1 2 3 4 Получено цыплят на конец выращивания, на 1000 заложенных яиц, гол. 736 836 824 - 100 88 123,40 123,40 123,40 143,00 143,00 143,00 - 3995,25 3590,73 Дополнительно получено цыплят на конец выращивания, на 1000 заложенных яиц, гол. Себестоимость одной молодки в 60 дней, руб. Стоимость одной молодки в 60 дней, руб. Дополнительная прибыль, полученная на конец выращивания цыплят при двукратной обработке 1000 яиц с учетом повышения вывода и сохранности молодняка, руб. 110 ГЛАВА 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ С развитием птицеводства в нашей стране и переводом его на промышленную основу значительно возросло увеличиваться количество инкубируемых птицеводства инкубация утратила яиц. и будет непрерывно С интенсификацией сезонность. Многократное комплектование промышленных и родительских стад птицы молодняком разных сроков вывода (а не только весеннего вывода) потребовали непрерывной инкубации яиц в течение всего года. Однако качественные показатели инкубации в сравнении с увеличением количества ежегодно инкубируемых яиц и валовым выходом суточного молодняка возросли незначительно. В России ежегодно инкубируют около 4 млрд. яиц разных видов сельскохозяйственной птицы, вывод здорового молодняка не превышает в среднем 74-75%. Следовательно, около 1 млрд. яиц не используют ни для пищевых целей, ни для вывода молодняка. На получение этих яиц затрачивают корм, труд и электроэнергию. Экономический ущерб вследствие вышеуказанного весьма значителен. Подсчитано, что даже повышение вывода на 1% дает прибыль (Hurnik J., Webster A., 1984; Кавтарашвили А.Ш., 2003; Фисинин В.И., 2006; Кочиш И.И. и др., 2007). Болезни эмбрионов приводят не только к их гибели, но и к значительному увеличению процента слабого, некондиционного молодняка, подлежащего уничтожению, кроме того, понижается и жизнеспособность внешне здоровых особей. Птица, переболевшая в эмбриональный период, хуже растет и развивается, часто не в состоянии проявить в дальнейшем высокую мясную и яичную продуктивность (Кожемяка Н.В., 2001; Бессарабов Б.Ф., Садчиков С.Ю., 2003). Формирование каждого животного начинается в процессе индивидуального развития с момента оплодотворения яйцеклетки и 111 заканчивается образованием из зиготы сложного организма. Данный процесс включает в себя два взаимосвязанных явления: рост и развитие (Ильин П.А., Жабин Н.П., 1983; Николаев А.Д., Тельцов Л.П., 2006; Киселев В.Л., Киселев Л.Ю., 2008). Нормальный процесс роста и развития эмбрионов птицы может проходить только при адекватном соотношении эндогенных и экзогенных факторов. Следует отметить, что важны как недостаток, так и избыток элемента, его соединений (закон максимума). И то и другое вызывает заболевания, связанные в первую очередь с нарушением обмена веществ. В целом необходимо руководствоваться законом оптимума: для любого организма существуют оптимальные условия существования по любому экологическому фактору, выход за которые сопровождается его стрессовой (защитной реакцией), а преодоление определенных пределов может привести к летальному исходу. При этом варьирование содержания различных элементов в составе корма возможно в достаточно широких пределах (в организме они как бы «забуферены»), в то время как изменить количество микроэлемента, например в клетке, как правило, нельзя даже на процент (Егоров В.В., 2008). Даже при полноценном кормлении высокопродуктивные несушки, дающие до 300 яиц в год, не в состоянии обеспечить все снесенные яйца необходимым количеством витаминов, макро- и микроэлементов и биологически активных веществ. Эти вещества могут быть введены в яйца после снесения при обработке инкубационных яиц растворами дефицитных веществ, а также биостимуляторов (Careghi C. Et al., 2005; Decupere E. et al., 2001- 2008; Willemsen H. et al., 2010) В многочисленных экспериментах разработаны и доказаны эффективные схемы, дозы и способы применения биостимуляторов, которые 112 способствуют повышению резистентности цыплят на различных стадиях онтогенеза и в частности эмбриональной жизнеспособности, показателем которой может служить выводимость яиц (Stullin D. Et al., 1989; D'yakov V.M. et al., 1998; Найденский М.С., 1995-2007; Брюшинин Н.В., 2004; Тотоева М.Э., 2004; Кочиш О.И., 2005; Агеева К., 2006; Кузьмина С.В., 2006; Ручий О.С. 2007; Кочиш И.И., Бушина О.А., 2008 и др.). В нашей работе были впервые применены водные растворы препаратов АСД Ф-2 и комплекса микроэлементов при обработке инкубационных яиц для получения цыплят финального гибрида кросса «Птичное». АСД относится к адаптогенам, которые не содержат жизненно необходимых веществ для роста и развития организма, но при этом вызывает состояние его неспецифической повышенной сопротивляемости (Тимофеев Б.А. и др., 1983). Он содержит неорганические азотистые соединения в виде солей аммония (углекислого, уксуснокислого, сернокислого и др.) и органические соединения – карбоновые кислоты (уксусная, масляная, пропионовая, капроновая), амиды и аммонийные соли указанных кислот, первичные и вторичные амины, биологическую которые активность, при введении вызывая в организм стимуляцию проявляют различных физиологических функций организма (Дерябина З.И., 1980). В основе механизма стимулирующего действия лежит изменение интенсивности обмена веществ и, в первую очередь, белкового и нуклеинового обмена с преобладанием процессов анаболизма над процессами катаболизма. Повышение уровня белкового и нуклеинового обмена взаимосвязано с усилением активности ферментов. Результатом таких биохимических реакций является усиление интенсивности роста и продуктивности животных, стимуляция регенеративных процессов в тканях 113 при различных патологиях, более интенсивный синтез защитных белков, активация иммунобиологических реакций (Дерябина З.И., 1971). Вследствие наличия сульфгидрильных групп, участвующих в синтезе глутатиона, возможно образование глутатион-пероксидазы, обладающий значительным антиоксидантным действием, что имеет важное значение для профилактики перекисного окисления липидов (Архипов А.В., 2009). Известно, что в основе процессов обмена лежат химические реакции, катализируемые продуктами метаболизма. По-видимому, низкомолекулярные азотистые соединения, находящиеся в препарате АСД Ф-2, способны как и активные аналоги метаболитов включаться в химические соединения в организме. Их воздействие в первую очередь на клетки развивающегося эмбриона может быть связано с активацией ферментных систем, в том числе и нервной ткани, поскольку эти ферменты в 10 раз чувствительнее и активнее ферментов других тканей организма. Стимуляция организма препаратом АСД Ф-2 приводит к более быстрой адаптации к изменяющимся факторам среды, что сопровождается повышением физиологической и иммунобиологической устойчивости организма к различным неблагоприятным воздействиям, в том числе к патогенным (Дерябина З.И., 1971). В отличие от АСД комплексный микроэлементный препарат является биологически активной добавкой и содержит биогенные микроэлементы, а также пептиды, необходимые для нормальной жизнедеятельности на различных стадиях эмбрионального развития. С учетом эффективных концентраций растворов препаратов, было изучено 2 схемы их применения: однократная (перед закладкой на инкубацию) и двукратная (перед закладкой и на 19-е сутки инкубации). В своих исследованиях мы исходили из того, что в период эмбрионального 114 развития происходит неоднократная смена интегрирующих формообразовательные и биологических механизмов, физиологические процессы, проходящих с большой скоростью (Бессарабов Б.Ф., Садчиков С.Ю., 2003). В результате обмена веществ в процессе инкубации быстро увеличивается масса зародыша. Наиболее интенсивный его рост отмечается в начале инкубации, к концу ее скорость роста замедляется. Так, на вторые сутки скорость роста у куриных эмбрионов достигает 1400%, снижаясь к ее концу до 20-30%. (Шмальгаузен И.И., 1961). Поэтому в начальный период онтогенеза организм более восприимчив к внешним факторам и можно получить положительные сдвиги даже при малых и ультрамалых дозах стимуляторов. Это положение подчеркивает Фисинин В.И. (2009), который считает, что на ранних стадиях эмбриогенеза чувствительность генов к различным манипуляциям значительно выше, чем на более поздних. Применение биологически активных веществ в оптимальной дозе нормализует обмен веществ, повышает естественную резистентность организма и его устойчивость к различным стрессовым воздействиям в критические периоды развития. Такое благоприятное влияние биогенных стимуляторов, происходит, прежде всего, за счет активизации защитных сил организма (Лузбаев К.В., 1996, Лукичева В.А., 2003, Кочиш И.И., 2007 и др.). При этом, усиление биологического эффекта возможно в том случае, если резерв биологической системы еще не исчерпан, однако при достижении его максимума любое дополнительное воздействие того или иного фактора может вызвать угнетение и дополнительный стресс. Учитывая тот факт, что наши исследования выполнены при использовании яиц высокопродуктивной птицы, значимость их возрастает, и даже на этом фоне по ряду зоотехнических, биохимических и анатомических показателей получены положительные результаты. 115 В первой серии экспериментов, при испытании водных растворов АСД было установлено, что препарат оказывает положительное действие на показатели вывода и выводимости даже в низких концентрациях, что, вероятно, свидетельствует о его высокой биологической активности (таблица 64). 1,27 ± 0,32 1,75 85,01 ± 1,06 86,89 ± 1,21 ± 0,92 ± 1,03 ± 0,78** ± 0,65 ± 1,74 4,23 2,29 1,74 86,93 6,48 3,24 ± 1,22 ± 0,88 6,63 2,94 ± 1,23 ± 0,83 6,32 3,10 ± 0,85 ± 0,61 6,61 3,92 ± 1,23 ± 0,96 5,49 3,45 ± 0,81 ± 0,65 5,67 3,45 ± 1,15 ± 0,90 5,50 2,81 ± 0,81 ± 0,59 ± 1,00 ± 0,85* ± 0,65 ± 1,74 4,17 2,94 1,71 87,36 ± 0,99 ± 0,83* ± 0,64 ± 1,70 4,09 3,72 0,74 87,54 ± 0,69 ± 0,66 ± 0,30 ± 1,20 2,94 4,65 - 87,66 ± 0,83 ± 1,04 ± 1,68 2,55 4,09 0,12 89,17 ± 0,56 ± 0,70 ± 0,12** ± 1,14** 2,22 4,93 0,74 87,95 ± 0,73 ± 1,07 ± 0,42 ± 1,66 2,94 5,50 - 88,07 ± 0,60 ± 0,81 ± 1,19 ∆ Вывод цыплят 5,23 ± 0,64 2,50 Слабые 3,46 ± 0,53 4,51 Задохлики 5,40 4,22 ± 0,65 ± 0,58 6,26 3,50 Замершие Неоплодотво ренные яйца Контроль (1185) 1 опытная 0,1% (399) 2 опытная 0,25% (401) 3 опытная 0,5% (407) 4 опытная 1,0% (806) 5 опытная 2,0% (408) 6 опытная 3,0 % (782) 7 опытная 4,0% (405) 8 опытная 5,0% (781) Кровяные кольца Партия, р-р препарата, (кол-во яиц) Выводимость яиц Таблица 64 Влияние предынкубационной обработки яиц различными концентрациями растворов АСД на показатели биологического контроля инкубации (%) (первая серия экспериментов – средние данные по 3-м опытам) 1,88 80,42 ± 1,15 81,45 ± 1,94 ∆ 1,03 81,29 1,91 ± 1,94 0,87 81,57 2,35 ± 1,92 1,15 82,00 2,53 ± 1,35 1,58 81,86 2,65 4,16 ± 1,90 84,27 1,44 3,84 ± 1,30* 2,94 82,96 2,54 ± 1,86 3,06 83,22 ± 1,33 2,80 116 Это совпадает с исследованиями Постоева В.Н. (2005) и Горбанец Т.М., Лобач П.И., Божко И.Г., Мануйленко В.Г. (1984), которые проводили опыты на поросятах и цыплятах и установили значительное повышение резистентности этих животных. Была выявлена криволинейная зависимость эффекта стимуляции от концентраций растворов препарата, и максимальный положительный эффект получен в опытной партии, где применяли предынкубационную обработку 3% раствором препарата (рис. 25). При этом выводимость и вывод увеличивается на 4,2% и 3,8% соответственно по сравнению с контролем. Рисунок 25. Зависимость показателей выводимости яиц и вывода цыплят от концентрации раствора препарата в первой серии экспериментов. Следует отметить, что при учете выводимости цыплят большое значение имеет анализ динамики смертности зародышей по периодам инкубации. Распределение смертности зародышей по периодам отражает специфику нарушений зародышевого развития и используется для оценки условий инкубации. Гибель зародышей в начале инкубации совпадает с первым критическим периодом развития эмбрионов, наступающим на 4-5-й день инкубации. К этому времени в связи с усилением анаэробного гликолиза 117 накапливается большое количество молочной кислоты, которая при недостатке кислорода вызывает гибель эмбрионов в виде так называемого «кровяного кольца» (В. Фисинин, 2005). Во всех опытных группах в первой серии экспериментов отмечается уменьшение отходов инкубации в виде «кровяного кольца» на 0,3-1,4% по сравнению с контролем. Это, по-видимому, можно объяснить тем, что воздействие водных растворов АСД оказывается своеобразным толчком уже в первые дни инкубации для зародышей, испытывающих затруднение на самых ранних этапах эмбрионального развития. Аналогичные данные были получены Нестеровым В.В. (2001) в опытах на инкубационных яйцах при обработке слабыми растворами сукцината, глицина, а также глицината меди, при этом отходы инкубации в виде «кровь-кольца» были на 0,5-2,9% меньше, чем в контроле. Развивающийся зародыш в зависимости от качества яиц и условий инкубирования, практически постоянно испытывает дефицит кислорода, который усиливается в критические периоды. Обработка биологически активными веществами, содержащими вещества с выраженным антигипоксическим и антиоксидантным действием способны в некоторой степени снять дискомфорт и восстановить энергетические процессы даже в ослабленном организме (Кочиш И.И. и др., 2008) Азарнова Т.О. (2006), Констанди О.Х. (2000), Краснобаев Ю.В. (2010) доказали угасание эффекта стимуляции при однократной обработке яиц, даже при использовании оптимальных концентраций препаратов, а также усиление стимулирующего действия при применении двукратной обработки яиц. Выбор срока второй обработки - при переносе на вывод – обусловлен подготовкой зародыша к наклеву. Этот период относят к «критическим» изза того, что происходит смена типа дыхания – от аллантоисного к легочному 118 и высокими энергетическими затратами на проклев скорлупы. Поэтому дополнительное применение раствора препарата на этой стадии оправдано, что проявляется в снижении отходов инкубации в виде задохликов и слабых цыплят. Для повторной обработки инкубационных яиц концентрация растворов была увеличена в десятки раз. Использование растворов с подобными концентрациями препарата объясняется тем, что реакция биологической системы на воздействие зависит от уровня ее чувствительности. В период предынкубационной обработки мы воздействуем на зародыш, находящийся на стадии ранней гаструлы. Другими словами эмбрион представляет собой только несколько слоев клеток, тогда как на 18-19 сутки эмбриональное развитие цыпленка подходит к концу и вся биологическая система становится более устойчивой и менее реактивной (Краснобаев Ю.В., 2010). Во второй серии экспериментов была также установлена зависимость эффекта стимуляции от повторного применения концентраций растворов АСД на 19-е сутки, где максимальный стимулирующий эффект был получен в 3 опытной партии (рис. 26). Рисунок 26. Зависимость показателей выводимости яиц и вывода цыплят от концентрации раствора препарата во второй серии экспериментов 119 Выводимость яиц и вывод цыплят в лучшей опытной группе (обработка 3%+12% раствор АСД) достоверно увеличились на 5,3% и 5,9% (p‹0,01), а по сравнению с однократной обработкой первой серии (3% раствор АСД) на 2,0% и 1,8% соответственно (таблица 65). При этом количество задохликов в этой группе сократилось в 2,1 раза, а в лучшей опытной группе 1 серии только в 1,3. Таблица 65 Контроль (803) 1 опытная 3,0% + 6,0% (399) 2 опытная 3,0% + 9,0% (393) 3 опытная 3,0% + 12% (813) 4 опытная 3,0% + 15% (389) 5 опытная 3,0% + 24% (401) 6,60 4,11 ± 0,87 ± 0,70 7,26 4,26 6,10 ± 0,84 4,26 2,62 ± 0,56 1,25 0,37 ± 0,21 0,25 85,87 ± 1,27 89,18 ± 1,29 ± 1,01 ± 1,01 ± 0,55 ± 0,25 ± 1,61 3,30 2,29 0,76 90,08 5,08 3,05 ± 1,10 ± 0,86 5,53 3,19 ± 0,80 ± 0,61 4,88 2,82 ± 1,09 ± 0,84 7,48 2,24 ± 1,31 ± 0,73 ± 0,90* ± 0,75 ± 0,43 ± 1,54* 3,81 1,23 0,12 91,14 ± 0,67* ± 0,38* ± 0,12 ± 1,02** 3,59 1,54 0,77 90,81 ± 0,94* ± 0,62 ± 0,44 ± 1,50* 7,48 1,49 - 87,87 ± 1,31 ± 0,60 ± 1,69 ∆ Вывод цыплят Выводимость яиц Слабые Задохлики Замершие Кровяные кольца Неоплодотво ренные яйца Партия, р-р препарата, (кол-во яиц) Влияние двукратной обработки яиц различными концентрациями растворов АСД на показатели биологического контроля инкубации (%) (вторая серии экспериментов – средние данные по 2-м опытам) 3,32 80,20 ± 1,40 82,70 ± 1,89 ∆ 2,50 85,49 4,21 ± 1,77* 5,29 86,10 5,27 ± 1,21** 5,90 86,37 4,94 ± 1,73** 6,17 81,29 2,00 ± 1,94 1,09 Установлена зависимость между концентрациями растворов препарата для получения положительного эффекта и возрастом эмбрионов. Так, при однократной обработке положительный эффект по выводимости установлен при варьировании концентраций раствора от 0,1 до 5% (т.е. в 50 раз). При 120 обработке на 19-е сутки диапазон концентраций сужается от 6 до 24% (т.е. в 4 раза). Таким образом нами установлено впервые, что вторая обработка растворами АСД оказывает положительный эффект на жизнеспособность эмбрионов в конце инкубации в более узком диапазоне концентраций, чем при первой обработке. Очевидно, это объясняется с одной стороны возрастной чувствительностью эмбрионов к внешним воздействиям, а с другой тем, что на эффекты вторичной обработки накладываются биологические реакции первичной и взаимодействие становится более сложным, а эффект стимуляции при оптимальных дозах повышается. У цыплят, выведенных из яиц лучших опытных групп, как в первой, так и во второй серии экспериментов, по сравнению с контролем в суточном возрасте наблюдали более высокую живую массу. При двукратной обработке яиц (5 эксперимент второй серии опытов) различия по этому показателю по сравнению с контролем составили 4,4% (p‹0,01), а в сравнении с однократной обработкой яиц (2 эксперимент первой серии) 1,3%. Очевидно, увеличение живой массы цыплят в опытных группах связано с усилением анаболических процессов, вследствие более интенсивного использования питательных веществ белка и желтка, приводящих к более качественному развитию зародыша. Уменьшение массы остаточного желтка к концу инкубации также указывает на интенсификацию обменных процессов, протекающих в яйце в процессе инкубации, что облегчает процесс вылупления цыплят. Кроме того, у молодняка из лучших опытных групп по отношению к контролю наблюдалась тенденция к увеличению массы сердца, мышечного и железистого желудков и таких иммунокомпетентных органов как селезенка и фабрициева сумка, что свидетельствует о более высоком качественном уровне развитии молодняка. 121 Таким образом, нами установлено, что АСД оказывает эффективное стимулирующее влияние на эмбриогенез яичных цыплят, что сопровождается улучшением комплекса гематологических и биохимических показателей, а также показателей неспецифической резистентности. Так, при двукратной обработке яиц вышеуказанным препаратом в крови цыплят количество гемоглобина и гематокрита достоверно увеличилось на 4,8% (р<0,001) и 1,7% (р<0,05), эритроцитов на 4,5%, а скорость оседания эритроцитов уменьшилась на 10,5%. В сыворотке крови возросли: общий белок на 6,5% (р<0,01), защитные белки на 7,3-20%, тогда как при однократной обработке эти показатели повысились только на 3%, 4-8% соответственно по сравнению с контролем. В сыворотке крови суточных цыплят при двукратной обработке инкубационных яиц растворами АСД количество лизоцима увеличилось на 5,3%, а бактерицидная активность возросла на 5,8% по сравнению с контролем, тогда как при однократной обработке эти показатели были выше только на 1,5 и 3% соответственно. Оптимизация обменных процессов последействием, что обусловило повышение сопровождалась длительным живой массы цыплят и их сохранности в течение 3-6 недель выращивания. Так, при двукратном применении АСД в первые 3 недели цыплята опытной группы по живой массе достоверно превосходили контроль на 3,3-2,5% (р<0,01-0,05). В 5-ти недельном возрасте молодняк опытной группы превосходил контроль по этому показателю только на 2,1%. За весь период выращивания (6 недель) падеж цыплят в опытной группе был вдвое ниже, чем в контроле. По данным Кожемяка Н.В. (2005), Кавтарашвили А.Ш. (2004) и др. живая масса в 5 недельном возрасте коррелирует со всеми показателями продуктивности и жизнеспособности кур несушек за весь цикл яйцекладки. 122 Поэтому если в 5 недель выращивания живая масса выше, чем в контроле, то следовательно из цыплят опытных групп будут получены несушки не хуже, а даже лучше. Кроме того, сохранность цыплят при двукратной обработке яиц на 3% выше, чем в контроле против 1% при однократной обработке. Подобный эффект адаптогена был получен на поросятах при использовании лигфола, представляющий собой композицию гуминовых веществ, полученных путем гидролиза из природного лигнина. По данным Бузлама С.В. (2003) применение лигфола через 10 дней после его введения глубокосупоросным свиноматкам обеспечивает повышение общей резистентности поросят, что проявляется увеличением содержания гемоглобина на 4,6% (р<0,01), гематокрита на 1,4%, количества эритроцитов на 8,2%, общего белка на 5,6% (р<0,05) и фракций -, - и γглобулинов на 11,2, 16,2 и 18,3% соответственно по сравнению с контролем. Как показали наши исследования, стимулировать эмбриональное развитие можно не только путем применения тканевых препаратов, но также и с помощью препаратов, содержащих в своем составе микроэлементы и пептиды. В особенности такие как медь, цинк и марганец – важные элементы фермента супероксиддисмутазы. Они играют решающую роль в антиоксидантной защите организма. Цинк входит в состав свыше 300 различных ферментов и участвует в регуляции основных метаболических процессов. Селен осуществляет – составляющая эффективную связь более 25 селенопротеинов. различных Он антиоксидантов (Фисинин В.И., 2009). Так, в третьей серии экспериментов, при испытании водных растворов комплекса микроэлементов в концентрациях (от 0,05 до 1%) установлено, что препарат обладает стимулирующим действием в широком диапазоне концентраций (табл. 66). 123 Средние данные биологического контроля показывают, что применение оптимальной концентрации раствора комплекса микроэлементов (2 опытная партия) позволяет уменьшить отход яиц как в первую, так и во вторую половину инкубации. В результате во 2 опытной партии по сравнению с контролем выводимость яиц и вывод цыплят достоверно увеличились на 3,91 и 3,93% соответственно (табл. 66). Таблица 66 4,19 ± 0,57 4,30 2,43 ± 0,44 2,02 1,09 ± 0,30 1,26 86,62 ± 1,01 89,22 ± 1,39 ± 0,75* ± 1,02 ± 0,70 ± 0,56 ± 1,62 6,38 3,40 3,15 1,78 0,51 90,53 ± 0,71 ± 0,52 ± 0,50 ± 0,38 ± 0,20 ±0,88** 6,54 3,14 3,40 2,35 - 90,47 ± 1,26 ± 0,89 ± 0,92 ± 0,77 6,05 3,65 3,90 2,39 ± 1,55* 0,63 ± 0,66 ± 0,68 ± 0,54 ± 0,28 ± 1,15 5,94 3,46 3,96 2,97 1,23 87,63 ± 0,90 ± 0,97 ± 0,84 ± 0,55 2,60 ± 1,68 80,82 ± 1,13 81,77 ± 1,94 ∆ 0,95 84,75 3,91 ± 1,04* 3,93 84,55 3,85 88,72 ± 0,84 ± 1,17 ∆ Вывод цыплят 4,77 ± 0,61 2,27 Слабые Кровяные кольца 6,70 ± 0,72 8,35 Задохлики Неоплодотво ренные яйца Контроль (1194) 1 опытная 0,05% (395) 2 опытная 0,1% (1174) 3 опытная 0,25% (382) 4 опытная 0,5% (793) 5 опытная 1,0% (404) Замершие Партия, р-р препарата, (кол-во яиц) Выводимость яиц Влияние предынкубационной обработки яиц различными концентрациями растворов комплекса микроэлементов на показатели биологического контроля инкубации (%) (третья серия экспериментов – средние данные по 3-м опытам). ± 1,84 3,73 83,35 2,10 ± 1,32 2,53 82,42 1,00 ± 1,89 1,60 Также как в предыдущих экспериментах установлена криволинейная зависимость эффекта стимуляции от концентраций растворов комплекса микроэлементов, где максимальный результат был зарегистрирован во 2 124 опытной партии при предынкубационной обработке 0,1% раствором препарата (рис. 27). Рисунок 27. Зависимость показателей выводимости яиц и вывода цыплят от концентрации раствора препарата в третьей серии экспериментов Применение двукратной обработки усилило биологические эффекты от применения комплекса микроэлементов. Зависимость эффекта стимуляции от концентрации растворов препарата при двукратной обработке представлена на рис. 28. По средним данным в четвертой серии экспериментов (4 опыта) в лучшей опытной партии (1 опытная) (обработка 0,1%+1%) отходы инкубации в виде замерших, задохликов и слабых снизились в 2, 2,3 и 6,0 раза соответственно по сравнению с контролем, а выводимость яиц и вывод цыплят возросли на 6,8 (p‹0,001) и 6,4% (p‹0,001) (таблица 67). 125 Рисунок 28. Зависимость показателей выводимости яиц и вывода цыплят от концентрации раствора препарата в четвертой серии экспериментов Отходы зародышей в виде «замерших» совпадают с 2-мя критическими периодами на 8-11 день и 16-18 дни инкубации и связаны с нарушением углеводного обмена, гипоксемией и гипоксией. Уменьшение в лучшей опытной группе замерших эмбрионов в этот период, очевидно, объясняется стимулирующим влиянием комплекса микроэлементов на углеводный обмен эмбрионов и окислительные свойства крови, что подтверждают данные гематологических показателей. Так, в крови цыплят установлено увеличение гемоглобина на 7,3% (p‹0,001), гематокрита на 2,0% (p‹0,05), количества эритроцитов на 7,3% (p‹0,05). Отход эмбрионов в виде «задохликов» совпадает с последним критическим периодом в развитии эмбриона, испытывающие в этот момент дефицит кислорода. Можно предположить, что обработка инкубационных яиц водными растворами комплекса микроэлементов оказывает антигипоксическое действие, что и подтверждается в наших опытах. 126 Таблица 67 5,12 ± 0,63 2,18 ± 0,42*** 2,92 ± 0,48** 1,51 ± 0,35 0,25 ± 0,14*** 1,00 ± 0,28 84,59 ± 1,07 91,36 ± 0,83*** 88,95 ± 0,93** ∆ Вывод цыплят Выводимость яиц 4,19 ± 0,58 2,09 ± 0,41** 3,09 ± 0,50 Слабые Замершие 3,69 ± 0,54 3,60 ± 0,54 3,42 ± 0,52 Контроль (1192) Задохлики Кровяные кольца 5,79 ± 0,67 1 опытная 5,78 0,1%+1,0% ± (1192) 0,67 2 опытная 5,43 0,1%+3,0% ± (1197) 0,65 Партия, р-р препарата, (кол-во яиц) Неоплодотво ренные яйца Влияние двукратной обработки яиц различными концентрациями растворов комплекса микроэлементов на показатели биологического контроля инкубации (%) (четвертая серии экспериментов – средние данные по 4-м опытам). 79,70 ± 1,16 86,07 6,76 ± 1,00*** 84,12 4,36 ± 1,05** - ∆ - 6,37 4,42 Следует отметить, что эффективность стимуляции эмбриогенеза при обработке яиц растворами препарата зависит и от инкубационного качества яиц. На партиях с высоким инкубационным качеством яиц гораздо труднее добиться стимуляции, чем на яйцах с низкими показателями выводимости. Поэтому, наблюдавшийся в опыте 9 (обработка 0,1%+1% растворами комплекса микроэлементов) сравнительно невысокий зоотехнический эффект (повышение выводимости в опытных группах на 2,1-3,0%) можно объяснить тем, что использовали биологически полноценный материал (высокого инкубационного качества яйца, вывод в контроле составлял 84,6%). В тех же случаях, когда обрабатывали биологически неполноценные яйца (эксперимент 11), эффективность двукратной обработки (0,1%+1%) возрастала и выводимость в опытной группе возросла на 9,7% (вывод в контроле был на уровне 74,3%). 127 Оптимальная схема обработки яиц растворами комплекса микроэлементов послужила фактором внешней среды, в ответ на действие которого биологическая система (зародыш) отреагировала усилением процессов метаболизма. В результате эмбрионы развивались более интенсивно, а полученный молодняк имел более высокий иммунный статус, что выразилось в достоверном увеличении общего белка и его фракций, а также лизоцимной и бактерицидной активности. При двукратной обработке яиц растворами комплекса микроэлементов в сыворотке крови возросли: общий белок на 5,5% (p‹0,01), защитные белки на 1,1-14,2%, тогда как при однократной обработке эти показатели увеличились всего лишь на 2,7%, 2,2-8,1% соответственно по сравнению с контролем. В сыворотке крови суточных цыплят при однократном применении растворов комплекса микроэлементов наблюдалась только тенденция к увеличению таких показателей неспецифической резистентности, как лизоцим и бактерицидная активность на 6,5 и 3%, тогда как под действием двукратной обработки эти показатели достоверно увеличились на 14,5% (р<0,05) и 6,7% (р<0,01) соответственно по сравнению с контролем. На стимуляцию эмбриогенеза растворами комплекса микроэлементов в определенной степени указывает и его длительное физиологическое последействие, что выражается в повышении живой массы и сохранности цыплят в течение 1-6 недель выращивания. После двукратной обработки яиц по оптимальной схеме в первую неделю выращивания цыплята на 3% (р<0,05) превосходили контроль по живой массе, а в дальнейшем различия между группами сглаживались. В первые две недели выращивания падеж цыплят в опытной группе был в 2,5 раза ниже, чем в контроле. В дальнейшем различия по этому показателю постепенно сглаживались. За весь период выращивания (6 128 недель) падеж в опытной группе был в 2 раза ниже по сравнению с контролем. Наши данные в основном совпадают с исследованиями Краснобаева Ю.В. (2006-2009), который проводил обработку инкубационных яиц кросса «Конкурент-3» аналогичным комплексу микроэлементов препаратом «Хелавит» и установил его положительное влияние на показатели биоконтроля, а также биохимические показатели сыворотки крови. Однако, в отличие от хелавита, оптимальная доза которого при повторной обработке составляет 3%, оптимальная концентрация применявшегося комплекса микроэлементов при повторном применении в 3 раза меньше, а самое главное комплексный микроэлементный препарат значительно дешевле хелавита, примерно на 600 руб/л. Из всего вышеизложенного можно сделать вывод, что воздействие водными растворами АСД и комплекса микроэлементов вызывают изменения в условиях развития, не выходящие за пределы физиологической нормы, что имеет исключительно важное значение, так как обуславливает возможность сдвигов нормального развития в положительную сторону. Таким образом, можно предположить своеобразие ответной реакции организма птицы на различных этапах эмбриогенеза в ответ на воздействие различными адаптогенами. Своеобразие этой реакции заключается также в том, что при использовании оптимальных концентраций растворов препаратов на всем протяжении эмбрионального развития мы наблюдали только стимуляцию. Очевидно, это обусловлено влиянием на экспрессию генов, что позволяет регулировать метаболические процессы (Фисинин В.И., 2009). На основании полученных данных можно считать, что комплекс микроэлементов оказал более глубокий и разносторонний биологический эффект на эмбриональное и постэмбриональное развитие цыплят кросса 129 «Птичное» по сравнению с применением АСД Ф-2. Однако, учитывая данные производственной проверки, дополнительная прибыль на конец выращивания с учетом повышения вывода и сохранности цыплят при двукратной обработке инкубационных яиц оптимальными концентрациями растворов АСД составила 3995 рублей 73 копейки на 1000 заложенных яиц, что на 404 рубля 52 копейки больше, чем при обработке растворами комплекса микроэлементов. 130 ВЫВОДЫ 1. Стимулирующее действие препаратов АСД Ф-2 и комплекса микроэлементов зависит от исходного качества яиц, концентрации растворов препарата и кратности обработки. 2. Предынкубационная обработка яиц 3% раствором препарата АСД Ф-2 в среднем по трем опытам повысила выводимость яиц и вывод цыплят до 89,2% и 84,3% соответственно, что на 4,2% (р<0,01) и 3,9% (р<0,05) выше, чем в контроле. Максимальный стимулирующий эффект получен при использовании двукратной обработки яиц (3% раствором АСД Ф-2 перед инкубацией и 12% при переводе на вывод), что позволило повысить выводимость яиц и вывод цыплят на 5,3% (р<0,01) и 5,9% (р<0,01) по сравнению с контролем и на 2,0% и 1,8% по сравнению с однократной обработкой яиц. 3. После предынкубационной обработки яиц 3% раствором препарата увеличилась живая масса цыплят в суточном возрасте на 3,1%, масса сердца на 13,8% (р<0,05), печени на 9,2%, мышечного и железистого желудков на 5,1%, селезенки на 12,5%, фабрициевой сумки на 4%, при снижении массы остаточного желтка на 13,1%. После двукратной обработки яиц живая масса цыплят в суточном возрасте увеличилась на 4,4% (р<0,01), масса сердца на 10,7%, мышечного и железистого желудков на 17,4% (р<0,05), селезенки на 6,0%, фабрициевой сумки на 3,5%, при достоверном снижении массы остаточного желтка с желточным мешком на 21,0% (р<0,01) по сравнению с контролем. 4. Установлено стимулирующее действие АСД Ф-2 на некоторые гематологические и биохимические показатели крови цыплят в суточном возрасте. Так, при двукратной обработке яиц в крови цыплят повысилось содержание гемоглобина, эритроцитов и гематокрита до 95,8 г/л, 2,3х1012/л и 34,9% соответственно, что превышало контроль на 131 4,8% (р<0,001), 4,5% и 1,7% (р<0,05), при снижении СОЭ на 10,5%. В сыворотке крови возросли: общий белок на 6,5% (р<0,01), защитные белки на 7,3-20%, лизоцим на 5,3%, бактерицидная активность на 5,8% по сравнению с контролем. 5. При предынкубационной обработке яиц 0,1% раствором комплексом микроэлементов выводимость яиц и вывод цыплят в среднем по трем опытам превышала аналогичные показатели в контроле на 3,9% (р<0,01-0,05) соответственно (при выводимости яиц и выводе цыплят в контроле 86,6% и 80,8%). Максимальный стимулирующий эффект получен при двукратной обработке яиц (перед инкубацией – 0,1%, а при переводе на вывод 1% раствором препарата). Это позволило повысить выводимость яиц и вывод цыплят до 91,4% и 86,1% соответственно, что на 6,8% (р<0,001) и 6,4% (р<0,001) выше, чем в контроле и на 0,8% и 1,3%, чем при однократной обработке. 6. Использование препарата комплекса микроэлементов по оптимальной схеме (0,1%+1%) способствовало достоверному увеличению живой массы цыплят в суточном возрасте на 2,2% (р<0,05), массы сердца на 7,1%, мышечного и железистого желудков на 8,2%, селезенки на 4,5%, фабрициевой сумки на 3,5%, при достоверном уменьшении массы остаточного желтка на 13% (р<0,05). 7. Применение двукратной микроэлементов обработки яиц растворами комплекса улучшает ряд гематологических и биохимических показателей крови у цыплят. Так, в крови у суточных цыплят повысилось содержание гемоглобина, эритроцитов и гематокрита до 98,1 г/л, 2,36х1012/л и 35,2%, что превышало контроль на 7,3% (р<0,001), 7,3% (р<0,05) и 2,0% (р<0,05) соответственно, при снижении СОЭ на 10,5%. В сыворотке крови возросли: общий белок 132 на 5,5% (р<0,01), защитные белки на 1,1-14,2%, лизоцим на 14,5% (р<0,05), бактерицидная активность на 6,7% (р<0,01). 8. При двукратной обработке яиц растворами АСД, а также комплекса микроэлементов в оптимальных концентрациях получен эффект длительного последействия, который выражается в тенденции увеличению сохранности молодняка на к 3-4% по сравнению с контролем и прироста живой массы на 1,5-3%. 9. Производственной проверкой установлено, что при двукратной обработке яиц оптимальными концентрациями АСД и комплекса микроэлементов увеличились вывод цыплят на 8,8% и 8,0%, сохранность цыплят на 1,8% и 1,3% соответственно по сравнению с базовым вариантом. Это позволило получить дополнительную прибыль на 1000 инкубационных яиц с учетом повышения вывода и сохранности цыплят к концу выращивания в размере 3995,25 руб. и 3590,73 руб. (в ценах 2010 г.). 133 СВЕДЕНИЯ О ПРАКТИЧЕСКОМ ИСПОЛЬЗОВАНИИ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ 1. Результаты исследований внедрены в производственные условия ФГУП ППЗ «Птичное» Россельхозакадемии Нарофоминского района, Московской области (акт производственных испытаний от 02.07.2010 г.) и доведены до сведения специалистов птицеводческих хозяйств. 2. Экспериментальные данные преподавании курса лекций используют в учебном процессе при по зоогигиене студентам факультетов ветеринарной медицины, зоотехнологии и агробизнеса, а также при написании и издании учебной литературы. РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ НАУЧНЫХ ВЫВОДОВ Рекомендовать птицефабрикам повышения вывода цыплят и птицеводческим фермам, для финального гибрида кросса «Птичное» и их резистентности использовать двукратную обработку яиц по схеме: 3% раствором АСД перед инкубацией и 12% при переводе на вывод или 0,1% раствор препарата комплекса микроэлементов перед инкубацией и дополнительно обрабатывать 1% раствором этого же препарата при переводе яиц на вывод. 134 СПИСОК ЛИТЕРАТУРЫ 1. Агеева, К.М. Обработка яиц мясных кур экологически безопасным препаратом лимонтаром для стимуляции эмбрионального и постэмбрионального развития цыплят: дис… канд. биол. наук / К.М. Агеева; МГАВМиБ.- М., 2006.- 115 с. 2. Азарнова, Т.О. Применение экологически безопасного препарата рибав для стимуляции эмбрионального и постэмбрионального развития яичных цыплят: дис… канд. биол. наук. / Т.О. Азарнова; МГАВМиБ.М., 2006.- 125 с. 3. Багданова, О.С. Тканевой препарат при гипофункции яичников у коров / О.С. Багданова, Е.П. Дементьев // Соврем. пробл. интенсификации производства в АПК: сб. науч. тр.- М., 2005.- С. 46-49. 4. Бакулин, А.Ю. Влияние комплексоната микроэлементов на состояние и сохранность цыплят-бройлеров при промышленном выращивании /А.Ю. Бакулин // Вопросы вет. биологии: сб. науч. тр. / МВА им. К.И. Скрябина.- М., 1994.- С. 78-80. 5. Бакулин, А.Ю. Разработка зоогигиенических мероприятий в обеспечении здоровья и повышения энергии роста цыплят-бройлеров: автореф. дис… канд. с.-х. наук / А.Ю. Бакулин; МГАВМиБ.- М., 1995.16 с. 6. Бакулин, В.А. Болезни опорно-двигательной системы птиц незаразной этиологии / Бакулин В.А. // Зооиндустрия.- 2007.- № 8.- С. 4-7. 7. Бакулин, В.А. Болезни птиц: справочник / В.А. Бакулин.- СПб, 2006.688 с. 8. Басанкин, А.В. Применение янтарной кислоты из малеинового ангидрида в свиноводстве / А.В. Басанкин, В.А. Антипов // Соврем. подходы развития АПК: матер. международ. науч.-практ. конф., посвящ. 135-летию академии / Казан. ГАВМ.- Казань. 2008.- С.47-51. 135 9. Белецкий, Е.М. Влияние цинка на воспроизводительные и продуктивные качества индеек / Е.М. Белецкий // Матер. международ. науч.-практ. конф. ХЗВИ, посвящ. 140-летию со дня рождения проф. Кулешова П.Н.: сб. науч. трудов / Харьков. ЗВИ.- Харьков, 1995.- С. 8182. 10. Бессарабов, Б.Ф. Незаразные болезни птиц: учеб. пособие / Б.Ф. Бессарабов.- М.: Колосс, 2007.- 175 с. 11. Бессарабов, Б.Ф. Причины, вызывающие эмбриональные дистрофии и заболевания у птиц / Б.Ф. Бессарабов // Главный зоотехник.- 2006.№6.- С.49-51. 12. Бессарабов, Б.Ф. Стимуляция яичной продуктивности у самок перепелов препаратом АСД-Ф2 / Б.Ф. Бессарабов, И.И. Мельникова, Е.А. Лазуткина // Вет. медицина.- 2006.- № 2-3.- С. 37-38. 13. Бессарабов, Б.Ф. Эмбриональные и постэмбриональные заболевания сельскохозяйственной птицы / Б.Ф. Бессарабов, С.Ю. Садчиков; МГАВМиБ.- М., 2003. 14. Биологическая доступность микроэлементов для молодняка свиней из новых и традиционных кормовых средств / Б.Д. Кальницкий, С.Г. Кузнецов, А.П. Батаева, В.В. Пустовой // Сб. науч. тр. / ВНИИ физиологии, биохимии и питания с.-х. животных.- 1986.- С. 133-147. 15. Биохимические и физиологические аспекты взаимодействия витаминов и биоэлементов / Ю.И. Микулец, А.Р. Цыганов, А.Н. Тишенков и др.; ВНИТИП.- Сергиев Посад, 2004.- 192 с. 16. Брылин, А.П. Аминовитал – универсальный комплексный препарат для птицеводства / А.П. Брылин, Н.А. Листкова // Ветеринария Кубани.2008.- № 1.- С. 16-19. 17. Брюшинин, Н.В. Применение экологически безопасных препаратов для стимуляции эмбрионального и постэмбрионального развития 136 бройлеров, их резистентности и продуктивности: дис... канд. вет. наук / Н.В. Брюшинин; МГАВМиБ.- М., 2004.- 126 с. 18. Булашева, А.И. Влияние тканевого препарата на клеточное звено системы иммунитета при лечении субклинической формы мастита / А.И. Булашева // Вестн. науки КГАУ им. С.Сейфуллина.- Астана, 2005.Т.4, № 8. 19. Бурлаков, С.С. Влияние микродоз биологически активных соединений на эмбриональное и постэмбриональное развитие бройлеров: автореф. дис… канд. с.-х. наук / С.С. Бурлаков; РГАЗУ.- М., 2001.- 17 с. 20. Бушов, А.В. Эффективность использования хелатированных органическими лигандами Cu, Zn, J и при Mn, выращивании анемичных поросят / А.В. Бушов, Э.В. Тен // Науч. наследие П.Н. Кулешова и соврем. развитие зоотехн. науки и практики животноводства: сб. матер. международ. науч.-практ. конф., посвящ. 150-летию со дня рождения профессора П.Н. Кулешова, 26-29 октября 2004г.- М., 2005.- С.393-395. 21. Вагина, М.С. Изменение белковых фракций у цыплят-бройлеров в возрастном аспекте и под воздействием тканевого препарата ПДЭ / М.С. Вагина // Соврем. проблемы аграр. науки Верхневолжья: сб. ст.Иваново, 2004.- С. 84-86. 22. Вагина, М.С. Влияние применения экологически безопасного препарата ПДЭ для коррекции естественной резистентности цыплят бройлеров при выращивании их в клетках: дис…канд.вет.наук /М.С. Вагина; МГАВМиБ.-М.,2005. 23. Влияние различных железосодержащих препаратов на иммунную реактивность поросят / А.М. Алимов, Т.М. Галеев, М.А. Алимов, А.В. Иванов // Науч. основы обеспечения защиты животных от экотоксикантов, радионуклидов и возбудителей опасных инфекц. 137 заболеваний: матер. международ. симп.- Казань, 2005.- С. 32-36. 24. Воздействие Cu- и Mn-содержащими хелатными соединениями на активность фепмента антиоксидантной системы биохимической адаптации эритроцитов цыплят /Р.Х. Кармолиев, М.С. Найденский, В.А. Лукичева, В.А. Дудко // Вопросы физико-химической биологии в ветеринарии: сб. науч. тр./МГАВМиБ.-2002.-С.45-50. 25. Волчкова, Л.А. Повышение жизнеспособности телят при использовании экологически безопасных препаратов / Л.А. Волчкова // Матер. Всерос. науч.-метод. конф. по зоогигиене, посвящ. Даниловой А.К.: тез. докл. / МГАВМиБ им. К.И. Скрябина.- М., 2003.- С. 109. 26. Гаврикова, Л. Йодистый крахмал для бройлеров / Гаврикова Л. // Комбикорма.- 2007.- № 6.- С. 76-77. 27. Гогин, А.Е. Взаимосвязь хрома с минеральными веществами и жирорастворимыми витаминами в организме мясных цыплят: автореф. дис… канд. биол. наук / А.Е. Гогин.- Сергиев Посад, 2001.- 22 с. 28. Горобец А.И. Биологическая эффективность хелатных соединений микроэлементов в питании цыплят- бройлеров: автореф. дис... канд. биол. наук / А.И. Горобец.- Боровск, 1984.- 22 с. 29. Графов, Д. АСД-2Ф при субклинических микотоксикозах бройлеров /Д. Графов, Б. Бессарабов, Л. Гонцова // Птицеводство.- 2007.- № 5.- С. 2930. 30. Грицюк, В.А. Зоогигиеническое обоснование повышения резистентности, роста и развития гибридных цыплят кросса ломан коричневый путем использования биологически активных соединений: автореф. дис… канд. с.-х. наук / В.А. Грицюк; МГАВМиБ.- М., 2000.18 с. 31. Гуревичев, П.А. Изучение эффективности препаратов плаценты в условиях животноводческого комплекса / П.А. Гуревичев, Д.Н. 138 Уразаев, М.Н. Равилов // Вет. медицина.- 2005.- № 3-4.- С.48. 32. Двинская, Л.М. Эффективность использования телятами витаминов А и Е при различных их соотношениях в рационе / Л.М. Двинская, В.И. Дудин // Биохим. основы высокой продуктивности с.-х. животных: сб. науч. тр.- Боровск, 1986.- С.106-111. 33. Двоярская, Ю.Е. Органический селен и его роль в птицеводстве / Ю.Е. Двоярская, П.Ф. Сурай // Птицефабрика.- 2006.- № 4.- С. 23-25. 34. Дерябина, З.И. Изучение фармакологического действия препарата АСД Ф-2 / З.И. Дерябина // Труды Всесоюз. ин-та эксперим. Ветеринарии.М., 1971.- Т. 39.- С. 416. 35. Дерябина, З.И. Определение биологической активности препарата АСД Ф-2 / З.И. Дерябина // Ветеринария.- № 10.- С. 58-59. 36. Дерябина, З. Препарат антисептик-стимулятор Дорогова / З. Дорогова // Ветеринария.- 2000.- № 4-5.- С. 30-31. 37. Дерябина, З.И. Химико-фармакологическая характеристика препарата АСД / З.И. Дерябина, А.В. Николаев // Труды Всесоюз. ин-та эксперим. Ветеринарии.- М., 1968.- Т. 35.- С. 432. 38. Дорогов, А.В. Влияние препарата АСД фракции 2 на течение окислительных процессов в организме / А.В. Дорогов, З.И. Дерябина // Труды.- М.: Сельхозгиз, 1957.-Т.11.-С.453. 39. Дорогов, А. Применение препарата «АСД» в ветеринарной практике / А. Дорогов// Ветеринария.- 1951.-№10.-С.49-53. 40. Дядичкина, Л. Заболевания эмбрионов сельскохозяйственной птицы, вызванные нарушением режима инкубации яиц / Л. Дядичкина // Птицефабрика.- 2008.- № 9.- С. 19-23. 41. Дядичкина, Л. Эмбриональная смертность птицы / Дядичкина Л. // Птицеводство.- 2007.- № 4.- С. 8-9. 42. Егоров В.В. Вода и организм (новые факты и гипотезы): проблем. 139 лекция / В.В. Егоров; МГАВМиБ.- М., 2008.- 54 с. 43. Егоров, В.В. Макроэффекты микродоз. I. Химия в биологии: проблем. лекция / МГАВМиБ.- М., 2008.- 60 с. 44. Егоров, И.А. Совершенствование системы нормированного питания птицы высокопродуктивных кроссов в современных условиях / И.А. Егоров, Ш.А. Имангулова // Докл. РАСХН.- 2005.- № 5.- С. 36-38. 45. Ермолаев, С.В. Значение йода в организме животных и птиц / С.В. Ермолаев, Н.В. Тряпицина // Птицефабрика.- 2006.- № 4.- С.28-29. 46. Забудский, Ю.И. Особенности биологии развития цыплят в выводном инкубаторе / Ю.И. Забудский // Птицеводство.- 2004.- № 2.- С. 13-14. 47. Забудский, Ю.И. Адаптационные возможности организма цыплят в зависимости от продолжительности пребывания в инкубаторе / Ю.И. Забудский // С.-х. биология: Сер. Биология животных.- 2000.- № 4.- С. 87-92. 48. Забудский, Ю.И. Стресс-устойчивость рано и поздно вылупившихся цыплят разного пола в зависимости от продолжительности пребывания в инкубаторе / Ю.И. Забудский // С.-х. биология: Сер. Биология животных.- 2002.- № 6.- С. 80-84. 49. Зайцев, А. Влажная обработка инкубационных яиц. / А. Зайцев // Птицеводство.- 1991.- № 10.- С. 17. 50. Зоогигиенические и биохимические аспекты применения биологически активных веществ для стимуляции роста и развития птиц на различных этапах онтогенеза / Р.Х. Кармолиев, М.С. Найденский, В.А. Лукичева, В.И. Дудко // Материалы методической и научной конференции: сб. науч. тр./ МГАВМиБ.-2002.-С.265. 51. Ивахник, Г. Витамин Е и Селен в комбикормах для яичных кур / Г. Ивахник // Птицеводство.- 2006.- № 3.- С. 23-24. 52. Ильин, П.А. Основные закономерности эмбриогенеза ланцетника, 140 амфибий, птиц и млекопитающих и их научно-практическое значение в ветеринарной практике: лекция/ П.А. Ильин, Н.П. Жабин; Омский СХИ.-Омск, 1983.-35с. 53. Инкубация яиц сельскохозяйственной птицы: метод. рек. / В.И. Фисинин, Л.Ф.Дядичкина, Ю.С. Голдин и др.; ВНИТИП.- Сергиев Посад, 2005. 54. Использование полисолей микроэлементов в животноводстве и птицеводстве алтайского края / В.Г. Огуй, М.А. Аборнев, О.Х. Геворкян и др.- 1981. 55. Йод в кормлении кур-несушек: монография /Ф.И. Кизинов, О.В. Джиоев, Ф.Р. Такаева.- Владикавказ, 2006.- 43 с. 56. Кабиров, Г.Ф. Влияние хелаткомплексных соединений на иммунологическую реактивность и продуктивность животных / Г.Ф. Кабиров, Р.Х. Юсупов // Учен. Зап. / Казан. ГАВМ.- 2006.- С. 96-102. 57. Кабиров, Г.Ф. Использование хелатных форм микроэлементов в животноводстве / Г.Ф. Кабиров, Г.П. Логинов, Н.З. Хазипов; Казан. ГАВМ.- Казань, 2005.- 298 с.: ил. 58. Кабыш, А.А. Нарушение фосфорно-кальциевого обмена у животных на почве недостатка и избытка микроэлементов в зоне Южного Урала / А.А. Кабыш.- Челябинск, 2006. 59. Кавтарашвили, А. Выращивание ремонтного молодняка кур / А. Кавтарашвили // Птицеводство.-2004.-№5.-С.2-5. 60. Кавтарашвили, А. Ш. К вопросу повышения эффективности яичного птицеводства / А.Ш. Кавиарашвили, С.П. Риджал, Г.А. Кирдяшкина // Птица и птицепродукты.-2003.-№2.-С.15-19. 61. Кальницкий, Б.Д. Влияние уровня и источника марганца в рационе на активность металлоэнзимов, усвоение и распределение минеральных веществ в организме поросят / Б.Д. Кальницкий, С.Г. Кузнецов, А.П. 141 Батаева // Биохим. основы высокой продуктивности с.-х.: сб. науч. тр.Боровск, 1986.- Т. XXXII.- С. 141-154. 62. Кальницкий, Б.Д. Минеральные вещества в кормлении животных / Б.Д. Кальницкий.- Л.: Агропромиздат, 1985.- 205 с. 63. Кирилова, Ю.В. Действие препарата «Биостим» на морфобиохимический состав крови цыплят / Ю.В. Кирилова // Известия.- 2004.- № 3.- С. 145-146. 64. Кирюткин, Г. Возрождение препарата АСД / Г. Кирюткин, В. Абдрахманов, В. Шабанов // Животноводство России.- 2004.- № 10.С.46-47. 65. Кисилев, Л.Ю. Использование адаптогенов в промышленном птицеводстве: монография / Л.Ю.Кисилев, В.Л. Кисилев.- М., 2008.80с. 66. Кожемяка, Н.В. Ветеринарная технология защиты ремонтного молодняка яичных кур / Н.В. Кожемяка, А.Ш. Кавтарашвили // Веиеринария с.-х. животных.-2005.-№5.-С.13-18. 67. Кожемяка, Н.В. Предупреждение заболеваний, влияющих на на качество яиц и продуктивность кур / Н.В. Кожемяка // Птица и ее переработка.-2001.-№4.-С.25-27. 68. Колганов, В.А. Применение комплексонатов марганца с ОЭДФ в птицеводстве / В.А. Колганов, В.И. Латышев, В.Р. Струговщиков // Ветеринария и зоотехния: юбил. сб. науч. работ.- Саратов, 2000.- С.252254. 69. Комаров, Ф.И. Биохимические показатели в клинике внутренних болезней: справочник / Ф.И. Комаров, Б.Ф. Коровкин.- 4-е изд.- М.: МЕДпресс-информ, 2006.- 208 с. 70. Конопатов, Ю.В. Микроэлементы и регуляция активности иммунной системы / Ю.В. Конопатов, Е.Е. Макеева // Птицефабрика.- 2006.- № 4.- 142 С. 63-70. 71. Королев, А.Ю. Нарушения обмена веществ у животных / А.Ю. Королев.- 2005. 72. Костанди, О.X. Повышение резистентности цыплят яичных кроссов путем обработки инкубационных яиц органическими кислотами: автореф. дис... канд. вет. наук / О.X. Костанди; МГАВМиБ.- М., 2000.15 с. 73. Кочиш, И.И. Бицин повышает жизнеспособность эмбрионов / И.И. Кочиш, О.А. Бушина, Н.В. Пуговкина // Животноводство России.-2008.№9.-С.13-14. 74. Кочиш, И.И. Птицеводство: учебник для вузов / И.И. Кочиш, М.Г. Петраш, С.Б. Смирнов.- М.: КолосС, 2004.- 407 с. 75. Кочиш, И.И. Эффективное средство нового поколения для дезинфекции инкубационных яиц / И.И. Кочиш, О.А. Бушина // Птицеводство.-2008.№2.-С.15-16. 76. Кочиш, О.И. Аэрозольная предынкубационная обработка яиц мясных кур экологически безопасными препаратами (митомин и эмицидин): автореф. дис… канд. биол. наук / О.И. Кочиш; МГАВМиБ.- М., 2005.18 с. 77. Кочиш, О.И. Предынкубационная обработка яиц мясных кур митомином и эмицидином / О.И. Кочиш // Птицефабрика.-2005.-№9.С.52. 78. Краснобаев, Ю.В. Влияние предынкубационной обработки яиц препаратом «Хелавит» на показатели эмбрионального развития цыплят кросса «Птичное» / Ю.В. Краснобаев // Матер. международ. науч.практ. конф., посвящ. памяти Даниловой А.К. / МГАВМиБ.- М., 2006.С. 154-157. 79. Краснобаев, Ю.В. Обработка яиц мясных кур экологически безопасным 143 препаратом хелавитом для стимуляции эмбрионального и постэмбрионального развития бройлеров: дис… канд. биол. наук / Ю.В. Краснобаев; МГАВМиБ.- М., 2009. 80. Кузнецов, С. Микроэлементы в кормлении животных / С. Кузнецов, А. Кузнецов // Животноводство России.- 2003.- № 3.- С. 15-17. 81. Кузнецов, С. Минеральные вещества и витамины для производства премиксов / С. Кузнецов, С. Фраппа // Комбикорма.- 2000.- № 4.- С.3537. 82. Кузьмина, С.В. Влияние экологически безопасного препарата митомина на некоторые показатели эмбрионального и постэмбрионального развития перепелов: автореф. дис… канд. биол. наук / С.В. Кузьмина; МГАВМиБ.- М., 2006.- 18 с. 83. Кузьмина, С.В. Обработка инкубационных яиц перепелов естественными адаптогенами (митомином и сукцинатом натрия) с целью повышения вывода кондиционного молодняка / С.В. Кузьмина // Соврем. проблемы зоотехнии и агробизнеса: сб. науч. тр. / МГАВМиБ.М., 2003.- С. 61-65. 84. Лазарева, Н.Ю. Влияние экологически безопасных физико-химических факторов на эмбриональное развитие бройлеров: автореф. дис… канд. с.-х. наук / Н.Ю. Лазарева; МГАВМиБ.- М., 1998. 85. Лемешева, М. Аминокислотное питание птицы / М. Лемешева // Животноводство России.- 2006.- № 11.- С. 25-27. 86. Лохова, С. Хелатные соединения в комбикормах для бройлеров / С.Лохова // Животноводство России.- 2005.- № 10.- С. 14. 87. Лузбаев, К.В. Янтарная кислота, как стимулятор роста / К.В. Лузбаев, М.С. Найденский, С.В. Зубалий // Птицеводство.- 1996.- № 2.- С. 20-21. 88. Лукичева, В.А. Адаптогенный эффект обработки тнкубационных яиц глицинатом лития при окислительном стрессе, вызванном плановой 144 вакцинацией цыплят родительского стада / В.А. Лукичева // С.-х. биология: Сер. Биология животных.- 2009.- № 4.- С. 67-70. 89. Малышев, М.А. Профилактика заболеваний конечностей у бройлеров /М.А. Малышев, А.П. Брылин // Ветеринария.- 2006.- № 12.- С. 9-11. 90. Манукян, А. Марганец в комбикормах для бройлеров / А. Манукян // Птицеводство.- 2007.- № 3.- С. 9. 91. Материалы по фармакодинамике препарата АСД / Б.А. Тимофеев, В.П. Сироткина, Е.А. Чернышова и др. // Биол. и химиотерапевт. средства профилактики и лечения заболеваний продуктивности животных: сб. науч. тр.- М., 1983. 92. Механизм действия АСД / Б.А. Тимофеев, Е.Л. Щедрин, В.П. Сироткина, Е.А. Чернышова // Докл. ВАСХНИЛ.- 1987.-№ .- С. 93. Мороз, Т.А. эмбриональное Влияние антисептика-стимулятора Дорогова на развитие животных / Т.А. Мороз // Биология воспроизведения и технология искусств. осеменения с.-х. животных: сб. тр.- М., 1986.- С. 73-80. 94. Мороз, Т.А. Изучение действия антисептика-стимулятора Дорогова на организм самок животных / Т.А. Мороз //Теория и практика использования биологически активных веществ в животноводстве: тез. докл.- Киров, 1998.- С. 61-62. 95. Найденский, М.С. Повышение резистентности цыплят яичных кроссов путем обработки инкубационных яиц органическими кислотами / М.С. Найденский, Н.Ю. Лазарева, О.Х. Констанди; МГАВМиБ.- М., 2000.12 с. 96. Найденский, М.С. Экологически безопасные методы повышения вывода кондиционных цыплят / М.С. Найденский, В.В. Нестеров, Н.Ю. Лазарева // Био.- 2007.- № 10.- С. 23-24. 97. Найденский, М.С. Экологически безопасные способы обработки 145 инкубационных яиц / М.С. Найденский, Н.Ю. Лазарева, В.В. Нестеров; МГАВМиБ.- М., 1996.- 55 с. 98. Найденский, М.С. Экологически чистый способ стимуляции роста, развития и продуктивности животных и птицы. / М.С. Найденский, И.В. Савельева, Е.М. Храброва // Проблемы эколог. безопасности, технологии производства, переработки и хранения с.-х. продукции.Сергиев Посад, 1995.- С. 54-57. 99. Нестеров, В.В. Дезинфекция инкубационных яиц и стимуляция эмбрионального развития кур путем использования экологически чистых препаратов: автореф. дис… канд. с.-х. наук. / В.В. Нестеров; МГАВМиБ.- М., 2000.- 15 с. 100. Нестеров, В.В. Новые зоогигиенические приемы повышения жизнеспособности цыплят яичных кроссов: метод. рек. / В.В. Нестеров, М.Э. Тотоева, Л.А. Волчкова.- 2003.- 34 с. 101. Николаев, А.Д. Развитие птиц в раннем онтогенезе / А.Д. Николаев, Л.П. Тельцов // Лапшинские чтения: матер. Республ. науч.-практ. конф., посвящ. памяти С.А. Лапшина.- Саранск, 2006.- С. 203-207. 102. Нормирование кормления сельскохозяйственной птицы по доступным (усвояемым) незаменимым аминокислотам: метод. рек. / В.И. Фисинин, Ш.А. Имангулов, И.А. Егоров и др.; ВНИТИП.- Сергиев Посад, 2006. 103. Обработка инкубационных яиц естественными метаболитами для стимуляции эмбрионального и постэмбрионального развития цыплят / М.С. Найденский, Р.Х. Кармолиев, В.А. Лукичева и др. // Птицефабрика.-2005.-№9.-С.50-51. 104. Овчинникова, Н.А. Влияние микроэлемента йода на продуктивные и репродуктивные функции животных / Н.А. Овчинникова // Молодые ученые – агропром. производству Дальнего Востока: сб. науч. тр.Владивосток, 2006.- С. 157. 146 105. Овчинникова, Т. Селен: и яд и противоядие / Т. Овчинникова // Животноводство России.- 2005.- № 4.- С. 45. 106. Определение показателей качества препарата АСД-2 / В.Е. Абрамов, В.И. Абдрахманов, О.А. Дорогов и др. // Ветеринария.- 2004.- № 9.С.13-16. 107. Особенности йодного питания сельскохозяйственной птицы / В.С. Сушков, К.Н. Лобанов, М.В. Ступников, А.С. Рудаков // Соврем. проблемы технологии производства, хранения, переработки и экспертизы качества с.-х. продукции: матер. международ. науч.-практ. конф., 26-28 февр. 2007г.- Мичуринск, 2007.- С. 161-165. 108. Павленко, О. Микроэлементы для животных и птицы / О. Павленко //Комбикорма.- 2007.- № 6.- С. 15. 109. Пальчиков, А.Ю. Биохимические изменения в крови коров после введения ПДС / А.Ю. Пальчиков, Н.В. Безбородов, Г.Г. Шитов // Бюл. науч. работю.- Белгород, 2005.- С. 159. 110. Перепелкина, Л. Значение селена для обменных процессов / Л. Перепелкина // Птицеводство.- 2007.- № 7.- С. 40. 111. Пермяков, Н.С. Микроэлементы в рационах крупного рогатого скота / Н.С. Пермяков // АПК Сибири, Монголии Республики Казахстан в XXI веке: матер. 4-й международ. науч.-практ. конф.- Новосибирск, 2001.С. 332-333. 112. Пикалина, О.А. БМВД «Белкор» в кормлении цыплят-бройлеров кросса «Конкурент-3» / О.А. Пикалина // Инновации молодых ученых – сел. хозяйству России: сб. матер. Всерос. конф.- М.: Росинформагротех, 2006.- С. 84-87. 113. Пикалина, О.А. Белково-витаминно-минеральный концентрат на основе полножировой сои с хелатными соединениями в кормлении цыплятбройлеров: дис… канд. биол. наук/ О.А. Пикалина; МГАВМиБ.- М., 147 2007.- 129 с. 114. Полянцев, Н.И. Система ветеринарных мероприятий при воспроизводстве крупного рогатого скота / Н.И. Полянцев, В.В. Подберезный // Ветеринария.- 2004.- № 5.- С. 37-40. 115. Постоев, Н.Б. Применение антисептика-стимулятора Дорогова при опухолях кожи и молочных желез у животных / Н.Б. Постоев, О.А. Стародубова, Н.С. Кухаренко // Ветеринария.- 2008.- № 9.- С. 54-55. 116. Препарат АСД – стимулятор роста бройлеров / Т.М. Горбанец, П.И. Лобач, И.Г. Божко, В.Г. Мануйленко // Резервы повышения продуктивности птицы: сб.науч.тр.- Ставрополь, 1984.- С.69-71. 117. Продуктивность и резистентность цыплят-бройлеров при использовании рибав / Н.И. Онокиенко, Л.И. Головирина, Л.В. Газзави, Н.В. Черный // Матер. международ. науч.-практ. конф., посвящ. памяти Даниловой А.К. / МГАВМиБ.- М., 2006.- С. 137-139. 118. Продуктивность цыплят-бройлеров под влиянием препаратов на основе комплексов железа с рибофлавином и аминокислотами / А.П. Кебец, Н.М. Кебец, С.В. Егоров, А.А. Богатырев // С.-х. биология: Сер. Биология животных.- 2006.- № 6.- С. 49-52. 119. Промышленное птицеводство / И.А. Егоров, Ш.А. Имангулова, Т.М. Околелова и др.; ВНИТИП.- Сергиев Посад, 2005.- С. 221-226. 120. Промышленное птицеводство / Ред. В.И. Фисинин; ВНИТИП.- 4-е изд.Сергиев Посад, 2005.- 599 с. 121. Прохорова, М.И. Методы биохимических исследований / М.И. Прохорова.- Л.: Изд-во ЛГУ, 1982.- 138 с. 122. Пурецкий, В.М. Биологически активная добавка рибав в профилактике диспепсии у телят / В.М. Пурецкий, В.А. Прахт // Зоотехния.- 2005.- № 7.- С. 15. 123. Пчельников, Д.В. Влияние гемовита-плюс на показатели 148 неспецифической резистентности молодняка КРС / Д.В. Пчельников, В.А. Бабич // Вет. патология.- 2005.- № 2.- С.71-73. 124. Пчельников, Д.В. Влияние хелатных соединение микроэлементов на морфологический состав лейкоцитов сельскохозяйственных животных /Д.В. Пчельников // Вет. патология.- 2005.- № 2.- С. 47-48. 125. Рубцов, В.В. Коррекция иммунной защиты у кур при селеновой недостаточности селеноорганическими препаратами: автореф. дис… канд. вет. Наук / В.В. Рубцов; Иванов. ГСХА.- М., 2007.- 21 с. 126. Рубцов, С. Современные селеноорганические препараты / С. Рубцов, С. Алексеева // Птицеводство.- 2006.- № 8.- С. 14. 127. Ручий, О.С. Воздействие соединений марганца на иммунобиологические и биохимические процессы в организме цыплят бройлеров в онтогенезе: автореф. дис… канд. биол. наук / О.С. Ручий; МГАВМиБ.- М., 2007.- 24 с. 128. Скрынникова, Т. И. Микроэлементозы молодняка сельскохозяйственных животных: учеб. пособие / Т. И. Скрынникова, В. А. Есепенок; МГАВМиБ.- М., 2006.- 29 с. 129. Снытко, Т.А. Экологически безопасные способы повышения резистентности и продуктивности бройлеров на различных этапах онтогенеза: автореф. дис… канд. биол. наук / Т.А. Снытко; МГАВМиБ.М., 2003.- 16 с. 130. Соломатин, М.В. Влияние препарата рибав на повышение резистентности и специфического иммунитета цыплят против болезней Марека и Ньюкасла / М.В. Соломатин // Соврем. технолог. и селекц. аспекты развития животноводства России: матер. III международ. науч.-практ. конф., 18-21 окт. 2005г. /ВНИИЖ РАСХН, Рос. учеб. центр по эколог. безопасн. технологиям в животноводстве.- Дубровицы, 2005.- С. 243-246. 149 131. Танатаров, А.Б. Обоснование рационального использования микроэлементов в птицеводстве: автореф. дис… докт. с.-х. наук / А.Б. Танатаров.- Алма-Ата,2001.- 36 с. 132. Темираев, Р.Б. Хелатные соединения и витамин С в рационах цыплятбройлеров / Р.Б. Темираев, С.С. Лохова // Мясная индустрия.- 2006. № 2.- С. 63-65. 133. Топорова, Л. Влияние минеральных веществ на развитие эмбриона птиц / Л. Топорова, И. Топорова // Ветеринария с.-х. животных.- 2008.№ 12.- С. 44-48. 134. Топурия, Л.Ю. Влияние растительного иммуностимулятора на организм коров и их потомство / Л.Ю. Топурия // Матер. международ. науч.-практ. конф., посвящ. 35-летию организации ВНИВИ патологии, фармакологии и терапии.- Воронеж, 2005.- С. 200-203. 135. Тотоева, М.Э. Полифакторное экологически безопасное физикохимическое воздействие на эмбриогенез и некоторые показатели постэмбрионального развития цыплят яичных кроссов: дис… канд. биол. наук / М.Э. Тотоева; МГАВМиБ.- М., 2004.- 140 с. 136. Тюрев, Г.В. Использование тканевого препарата ПДЭ с целью профилактики послеродовых заболеваний коров и повышения иммунного статуса телят / Г.В. Тюрев, В.В. Харитонов, М.С. Вагина // Матер. международ. науч.-практ. конф., посвящ. памяти Даниловой А.К. / МГАВМиБ.- М., 2006.- С. 150-152. 137. Тюрев, Г.В. Эффективность применения тканевого препарата ПДЭ в птицеводстве / Г.В. Тюрев, М.С. Вагина, О.В. Новожилова // Матер. международ. науч.-практ. конф., посвящ. памяти Даниловой А.К. / МГАВМиБ.- М., 2006.- С. 148-150. 138. Фисинин, В.И. Какая связь между селеном и гриппом птиц / В.И. Фисинин, П.Ф. Сурай, Т.Т. Папазян // Птица и птицепродукты.- 2006.- 150 № 5.- С. 31-36. 139. Фисинин, В.И. Птицеводство России – стратегия инновационного развития / В.И. Фисинин; ВНИТИП.- М., 2009. 140. Фисинин, В.И. Эмбриональное развитие птицы / В.И. Фисинин, И.В. Журавлев, А.Г. Айдинян.- М.: Агропромиздат, 1990.- 240 с. 141. Хелаты в рационах птицы / Р. Темираев, С. Лохова, И. Кокоева, Д. Царукаева // Птицеводство.- 2006.- № 10.- С.35-36. 142. Хенниг, А. Минеральные вещества, витамины, биостимуляторы в кормление сельскохозяйственных животных / А. Хенниг.- М.: Колос, 1976.- С. 137-152. 143. Цогоева, Ф. Селеносодержащие препараты в рационах бройлеров / Ф. Цогоева // Птицеводство.- 2006.- № 11.- С. 47. 144. Цымбал, Р. А. Влияние микроэлементов (меди, цинка и марганца) на клинико-физиологические показатели кур: автореф. дис… канд. биол. наук / Р. А. Цымбал.- Омск, 2000.- 21с. 145. Шатохин, Ю.И. Методика определения экономической эффективности ветеринарных мероприятий / Ю.И. Шатохин; МГАВМиБ.- М. 1997.64с. 146. Шацких Е. Органическая форма йода в рационах для бройлеров / Е. Шацких, О. Цыганова // Птицеводство.- 2007.- № 8.- С. 22-23. 147. Швец, О.М. Применение нового препарата «янтарный биостимулятор» для коррекции метаболического и иммунного статуса животных / О.М. Швец // Вет. патология.- 2008.- № 1(24).- С. 92-95. 148. Шевченко, С. Влияние селена и йода на интенсивность роста цыплятбройлеров / С. Шевченко, А. Еранов, О. Глазунова // Птицеводство.2005.- № 12.- С. 10. 149. Шмальгаузен, И.И. Интеграция биологических систем и их саморегуляция / И.И. Шмальгаузен // Бюл. Моск. об-ва испытателей 151 природы.- 1961.- Т. 66, Вып.2.- С. 104-134. 150. Экологически безопасные высокоэффективные стимуляторы эмбрионального и постэмбрионального развития сельскохозяйственной птицы: метод. рек. / И.И. Кочиш, М.С. Найденский, Т.О. Азарнова, Ю.В. Краснобаев; МГАВМиБ.- М., 2008.- 31с. 151. Экологически безопасные способы стимуляции роста и развития бройлеров в онтогенезе / И.И. Кочиш, М.С. Найденский, Е.С. Елизаров, О.И. Кочиш; МГАВМиБ, ОНО ППЗ «Конкурсный».- 2007.- 104 с. 152. Эффективность применения экологически безопасных препаратов для стимуляции роста и развития цыплят современных яичных кроссов / И.И. Кочиш, М.С. Найденский, В.В. Нестеров и др. // Актуал. проблемы интенсивного развития животноводства: сб. науч. тр. /МГАВМиБ.2007.- Вып. 10, Ч. 1.- С. 260. 153. Aberle, E.D. Physiological responses of stress resistant pirs to react stress / E.D. Aberle, R.A. Morkol // Of animal science.- 1974.- V. 38, № 5.- P. 958. 154. Beisel, W.R. Single nutrients and immunity / W.R. Beisel // Amer. J. Clin. Nutr.- 1982.-V.5- 417 p. 155. Bindoli, A. Mitochondrial lipid by cuinene hydroperoxide and it's prevention by succinate / A. Bindoli, L. Cavalini, P. Jocelin // Bioh. Acta.- 1982.- V. 681, № 3.- P. 496. 156. Careghi, C. Tne effects of the spread of hatch and interaction with delayed feed access after hatch on broiler performance until seven days of age / C. Careghi, K. Tona, O. Onagbesan //Poultry Science.-2005.-V.84.-P.1314- 1320. 157. Decuypere, E. The endocrine interface of environmental and eggs factors affecting chick guality /E. Decuypere, V. Bruggeman // World's Poultry Science Journal.-2008.-V.64-P.309-321. 152 158. De Oliveira, J. Effects of In ovo Feeding on Turkey Embryos Development, Energy Status, Intestinal Maturation, Gene Expression and Post-hath Development// Thesis, North Carolina State University.-2007.-P.48-54. 159. Effect of nonhormonic preparations on embrionic and postembryonic development of laying hens/ D,yakov V.M., Naidensky M.S., Greezuk V.A., et al. // Abstracts. 10th European poultry conference.-Jerusalem,-1998.-P.83. 160. Elwyn, D. The role of serine and acetate in acid formation / D. Elwyn, D.B. Sprinson // J. Bio. Chem.- 1950.- V. 184.- P. 465. 161. Gilbert, L. Alternatives to Formaldehyde in Hatcheries / L. Gilbert // Poultry international.-1995.-№4.-P.56. 162. Hurnic, J.F. Determination of profitability: relative effects or mortality, weight gain and feed comsumption / J.F. Hurnic, A.B. Webster // XVII World's Poultry Congress.-Helsinki.-1984.-P.660-661. 163. Kondrashova, M.N. Succinic acid as a physiological signal molecule / M.N. Kondrashova, S.P. Volkova, V.I. Kuznetzov //Signal Molecules and Behaviont / Eds Winlow et al. Manchester Univ. Press.- 1991.- P. 294. 164. Mazurkievicy, M. The effects and physiological parameters of slaughter chickens / M. Mazurkievicy // Medicine Wet.-1992.-V.49,-№8.-P.368-371. 165. Naidensky, M.S. Ecologically clean method of stimulating growth and development of poultry / M.S. Naidensky, V.V. Nesterov, N. Yu. Lazareva // Proc. III Internat. Conference Ecology and Veterinary Medicine.-Kosice,1996.-P.47-48. 166. Rafal, P. The effect of gallistibol on the health and performance of broiler chickens / P. Rafal // Proceedings of the 81 international congress on animal hygiene.- 1994. 167. Stullin, H.J. The possible central role of GABA in thermoregulation in the shep / D. Stullin, J. Bligh // J. Therm. boil.-1989.-V.14, № 2.-P.87-94. 168. Szymkiewics, M.M. Effects of illumination of incubated chicken eggs on 153 embryonic and postembryonic development / M.M. Szymkiewics, Z. Rzeszewska, W. Wojtczak // Annals of Warsaw Agricultural University. Animal Science.-1985.-№ 19.-P.15-20. 169. The day-old chick, a crucial hinge between breeders and broilers / E. Decuypere, K. Tona, V. Bruggeman, F. Bamellis // World's Poultry Science Journal.-2001.-V.57-P.127-138. 170. The ecological way of stress prevention, growth and development stimulation of birds/ M.S. Naidensky, N.Yu. Lazareva, V.V. Nesterov, V.A. Greezuk // Proc. 9th Internat. Congress in Animal Hygience.-Helsink, 1997.V.2.-P.977-979. 171. Toutain, P.L. Prednisolone succinate and prednisolone acetate in cattle: Pharmacokinetics and action on the adrenal gland / P.L. Toutain, G.D. Koritz, M. Alvinerie, H. Pomyers // Am. Journal of Vet. Res.- 1985.- V. 46, № 3.- P. 719-725. 172. Tretter, L. Effect of succinate on mitochondrial lipid peroxidation / L. Tretter, GJ. Szambados et al. // J. Biolog. And Biomembr.- 1987.- V. 19, № 1.- P. 31. 173. Tyutyunnic, N.N. Succinic acid as stimulator of physiological processes and productivity in farm mink / Tyutyunnic N.N., Kozhevnikova L.K. // Scientifur.- 1996.- V. 20, № 1.- P. 85-91. 174. Velon, S.M. Treatment of oxalic lithiasis by succinic acid and it's derivatives / S.M. Velon, J. Thomas // Chem. Abstr.- 1981.- V. 74.- P. 11. 175. Willemsen, H. Delay in feed access and spread of hatch: importance of early nutrition / H. Willemsen, M. Debonne, Q. Swennen // World's Poultry Science Journal.-2010.-№ 2.-P.177-196. 176. Investigation of bacterial resistance to hatchery disinfectants / E.M. Willinghan, J.E. Sander, S.G. Thayer et al. // Avian Dis., 1996.-V.40.-№3. P.510-515. 154 ПРИЛОЖЕНИЯ 155 Приложение 1 Режим хранения инкубационных яиц Срок хранения, суток Температура, С Относительная влажность, % до 3 20 – 21 75 – 80 4–7 14 – 15 75 – 80 свыше 7 12 - 13 75 – 80 Приложение 2 Режим инкубации куриных яиц в инкубаторах ИУП-Ф-45 и ИУВ-Ф-15 Сутки инкубации Температура термометра, 0С сухого увлажненного 1-5 37,8-38,0 30,0-31,0 6-13 37,6 29,0 14-18,5 37,4 28,0 37,2 29,0 до наклева, далее не регулируется (до 36,0) 19-21,5 Положение вентиляционных заслонок закрыты открыты на 15-20 мм открыты на 15-20 мм открыты на 15-20 мм, за 3 ч до выборки цыплят полностью открыты 156 Приложение 3 Температурно-влажностный режим при выращивании молодняка птицы кросса «Птичное» Возраст, сутки 0 Температура воздуха, С Относительная влажность воздуха, % 1-7 33-30 50-60 8-14 31-29 60-70 15-21 30-28 60-70 22-28 28-26 60-70 29-35 26-24 60-70 36-42 20-18 60-70 43-49 20-18 60-70 50-56 20-18 60-70 57-63 20-18 60-70 157 Приложение 4 Световой режим при выращивании молодняка птицы кросса «Птичное» Показатель Возраст, сутки 1-7 Продолжитель ность освещения, ч. 20 8-14 Включение, Выключение, ч. ч. Освещенность, лк. 4-00 24-00 40-20 19 4-00 23-00 20-10 15-21 18 4-00 22-00 10-5 22-28 17 4-00 21-00 10-5 29-35 16 4-00 20-00 10-5 36-42 13-15 12-15 50-56 11-15 57-63 10-15 11-15 20-00 11-15 19-00 11-15 19-00 11-15 19-00 10-5 43-49 5-00 13-00 5-00 13-00 6-00 13-00 7-00 13-00 10-5 10-5 10-5 158 Приложение 5 Сырье Пшеница Структура рецептов комбикормов ПК2-1-2 КР ПК3-3-1 КР (5-30дн.),% (31-90дн.),% 51,20 45,00 Ячмень ---- 9,00 Шрот соевый 14,30 7,60 Рыбная мука 2 С 3,00 ---- Кукуруза 15,00 4,80 Шрот подсолнечный 10,00 16,50 Масло подсолнечное 2,10 ---- Кормовой зернопродукт ---- 10,00 Мука костная ---- 1,65 Кукурузный сух глютен 3,00 ---- Мука рыбная 2 С ---- 2,00 Метионин кормовой ---- 0,07 Известняк 0,29 1,30 Фосфат корм. обесфтор. 1,70 0,30 П6 1 У 1,50 ---- ПК-2 1% ---- 1,00 Соль поваренная ---- 0,29 159 Приложение 6 Состав премикса Витамины, г/т: 1 А Е Д3 К3 В1 В2 1 В3 В4 В5 В6 В12 Вс Н Микроэлементы, г/т: Железо Марганец Цинк Медь Йод Кобальт Селен Антиоксиданты, кг/т: Эндокс Микросорб Ферменты, кг/т: Роксазим G2 2 1200,0 млн МЕ/т 4500,0 300,0 млн МЕ/т 400,0 220,0 800,0 2 1200,0 40000,0 3000,0 300,0 3,0 70,0 10,0 3 1000,0 млн МЕ/т 1000,0 300,0 млн МЕ/т 300,0 100,0 400,0 3 1000,0 50000,0 2000,0 300,0 2,0 ---5,0 5000,0 10000,0 7000,0 800,0 100,0 100,0 20,0 1000,0 7000,0 7000,0 250,0 70,0 50,0 10,0 12,5 ---- ---50,0 10 8