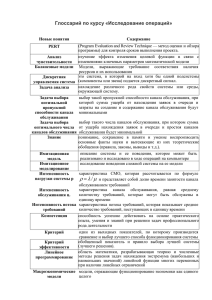
На правах рукописи СОКОЛОВА Ольга Сергеевна КОМПЛЕКСНЫЙ ПОДХОД К ИССЛЕДОВАНИЮ СТРУКТУРЫ
advertisement

На правах рукописи СОКОЛОВА Ольга Сергеевна КОМПЛЕКСНЫЙ ПОДХОД К ИССЛЕДОВАНИЮ СТРУКТУРЫ БЕЛКОВ НА ОСНОВЕ ЭЛЕКТРОННОЙ МИКРОСКОПИИ Специальность 03.01.02 - биофизика АВТОРЕФЕРАТ диссертации на соискание ученой степени доктора биологических наук Москва-2012 1 Работа выполнена на биологическом факультете Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Московский государственный университет имени М.В.Ломоносова». Научный консультант: Михаил Петрович Кирпичников , академик РАН, доктор биологических наук, профессор, декан биологического факультета МГУ имени М.В.Ломоносова Официальные оппоненты: Виктор Ионович Цетлин, член-корр. РАН, доктор химических наук, профессор, заведующий отделом молекулярных основ нейросигнализации Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН Наталья Александровна Чеботарева, доктор биологических наук, ведущий научный сотрудник лаборатории молекулярной организации биологических структур Института биохимии им. Н.А.Баха РАН Андрей Кимович Цатурян, доктор физико-математических наук, ведущий научный сотрудник лаборатории биомеханики НИИ механики МГУ имени М.В.Ломоносова. Ведущая организация: Федеральное государственное бюджетное учреждение науки Институт биофизики клетки Российской академии наук, г. Пущино. Защита состоится «22» ноября 2012 года в 14 часов на заседании диссертационного совета Д501.001.96 Биологического факультета Московского Государственного университета имени М.В. Ломоносова по адресу: Москва, Ленинские горы, д. 1, стр. 12, биологический факультет МГУ имени М.В.Ломоносова, ауд. 389. С диссертацией можно ознакомиться в библиотеке Биологического факультета МГУ имени М.В. Ломоносова. Автореферат разослан «16» октября 2012 г. Ученый секретарь Диссертационного Совета, доктор биологических наук М.Г.Страховская 2 «Мы не должны обижаться на тех ученых, которые вначале не поверили в электронный микроскоп» Э.Руска, Нобелевская лекция, 1986 г. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность темы Современная молекулярная биология стремительно расширяет круг знаний, область интересов перемещается от одиночных молекул к более сложным молекулярным машинам, растет потребность в структурной информации о комплексах нанобиообъектов. В настоящее время в мире расшифровано более 80000 атомных структур белков, в их числе мембранные белки, ионные каналы, аквапорины, рибосомальные субъединицы и др. Однако структура одиночного компонента может рассматриваться только как первый шаг к пониманию основ функционирования всей системы в целом. Известно, что изменение конформационного состояния белка отражается на его функциональной активности (Рубин, 2004). Знание структуры макромолекулярных комплексов дает возможность интерпретировать конформационные изменения в молекулах в процессе их активации и автоингибирования, а также при связывании с лигандами и/или плазматической мембраной. Признанными методами для изучения структуры и конформационных изменений в белковых молекулах являются: рентгеноструктурный анализ, ЯМР, метод спиновых меток, детекция люминисценции и спектроскопические методы (Вассерман, Коварский, 1986; Stock et al, 2005; Tyszka et al, 2005). Каждый из этих методов имеет свои преимущества и ограничения. Большинство методов способны детектировать лишь незначительные изменения полипептидной цепи и далеко не всеми методами можно определить, какая часть белка и как изменила свою конформацию. В то же время, современный метод просвечивающей электронной микроскопии (ПЭМ) макромолекул позволяет визуализировать не только трехмерную структуру, но и динамику самых разнообразных биологических нанообъектов с разрешением от 2-5 нм до атомного (0,2 нм). Метод ПЭМ не связан многими недостатками перечисленных выше структурных методов: в нем нет лимитирующего размера частиц, не обязательно наличие кристаллов, количество используемого материала достаточно мало, крио-модификация метода ПЭМ позволяет наблюдать молекулы в нативном водном окружении в состоянии, близком к физиологическому. В сочетании с методом реконструкции макромолекул (van Heel and Frank, 1981) и фиттингом кристаллических структур, ПЭМ белков 3 позволяет получить представление о трехмерной структуре и конформационных изменениях макромолекулярных комплексов. В данной диссертационной работе метод ПЭМ использовался для получения впервые цитоплазматических трехмерных глобулярных структур белков, а крупных также для мембранных изучения и основ формирования фибриллярных структур белками паутины, спидроинами. В последние пять лет изучению молекулярного строения мембранных белков (ионных каналов и транспортеров) уделяется особое внимание во всем мире в связи с разработкой новых эффективных лекарств против таких болезней, как рак (Wang et al, 1996), сердечные заболевания (Schmitt et al, 2000), эпилепсия (Misonou et al, 2005; Singh et al, 2006). Однако до сих пор многие ионные каналы не изучены в должной мере из-за сложностей с кристаллизацией мембранных белков. Расшифрованная атомная структура крупных актинсвязывающих белков (АСБ) была бы незаменима при разработке фармацевтических препаратов против целого ряда заболеваний, связанных с нарушением клеточной подвижности (Васильев, 1997; Geiger and Peeper, 2009). В тоже время атомных структур многих полноразмерных АСБ до сих пор получить не удалось. Относительно недавно в качестве материала для тканевой инженерии был предложен рекомбинантный белок паутины спидроин (Moisenovich et al, 2009). В связи с тем, что искусственные матриксы определяют механические свойства и форму имплантата, формируют субстрат для адгезии клеток, представляется актуальным исследовать четвертичную структуру входящего с их состав спидроина. Целью работы является разработка комплексного подхода к изучению четвертичной структуры белковых молекул на основе просвечивающей электронной микроскопии. Для достижения цели решаются следующие задачи: 1. Формулировка основных положений комплексного подхода к изучению четвертичной структуры белков; 2. Получение трехмерных структур ряда мембранных и цитоплазматических белков с разрешением 1,8-2,5 нм; 3. Построение молекулярных моделей белков на основе моделирования по гомологии и фиттинга; 4. Изучение конформационных перестроек в белковых молекулах активации, взаимодействии с лигандами и с плазматической мембраной; 4 при Научная новизна результатов В работе впервые: 1. Получены трехмерные структуры калиевых потенциал-зависимых каналов Kv1.1, Kv2.1, Kv10.2 и их транкированных мутантов с разрешением 2,0-2,5 нм; 2. Получены трехмерные структуры актинсвязывающих белков (mDia1, Arp2/3, Srv2, IRSp53) и их олигомеров с разрешением 1,8-2,5 нм; 3. Построены молекулярные модели полноразмерных белков: ионного канала Kv10.2, АСБ mDia1 и IRSp53 на основе моделирования по гомологии и фиттинга; 4. Показано наличие конформационных перестроек в цитоплазматических доменах калиевых потенциал-зависимых каналов при межмолекулярных взаимодействиях и активации; 5. Изучены структурные основы кластеризации потенциал-зависимых каналов семейства Kv10; 6. Определены конформации комплекса Arp2/3 в нативном состоянии и при связывании с лигандами и выяснена связь Arp2/3 с функциональной активностью клетки; 7. Показано, что автоингибирование формина mDia1 связано со стерическим блокированием сайтов связывания актина; 8. Предложена гипотеза изменения конформационного состояния формина в зависимости от его функционального состояния; 9. Определено олигомерное строение комплекса Srv2, и показано, что олигомер N-концевых доменов Srv2 способен разрезать полимеризованый Fактин в присутствии кофилина; 10. Изучены структурные основы активации и модификации плазматической мембраны I-BAR белками; 11. Разработана модель для изучения фолдинга белков паутины и изучена структура нанофибрилл спидроина I. Практическая значимость работы заключается в разработке методологического подхода к изучению структуры белковых молекул на основе электронной микроскопии и молекулярного моделирования. С использованием разработанного подхода были получены трехмерные структуры и изучены важные структурные особенности макромолекул и белок-белковых комплексов, которые до настоящего времени не были подвергнуты кристаллизации, и, следовательно, их атомная структура не была расшифрована. Полученные знания в дальнейшем могут быть применены при исследовании строения белков, белок-белковых 5 комплексов, и как структурные предпосылки для молекулярного моделирования (направленная доставка лекарств, дизайн новых лекарственных средств), а также для практической работы по детекции и анализу наночастиц биологического происхождения. Результаты моделирования in vitro процессов прядения паутины свидетельствуют о принципиальной возможности разработки биоматериалов с уникальными свойствами на основе рекомбинантных аналогов белков паутины путем имитации природных процессов формирования нитей паутины. Эти результаты используются при производстве матриксов для культивирования клеток в транспланталогии. Материалы диссертации используются при чтении курсов «Введение в методы микроскопии в биологии» студентам, обучающимся по специальности «Биоинженерия» на кафедре биоинженерии Биологического факультета МГУ имени М.В.Ломоносова. Современные методы, изложенные в диссертации, включены в разделы практикумов по биоинженерии на кафедре биоинженерии Биологического факультета МГУ имени М.В.Ломоносова, используются студентами и аспирантами при выполнении курсовых, дипломных, магистерских и диссертационных работ. Апробация работы Материалы работы были представлены на научных семинарах кафедры биоинженерии Биологического факультета МГУ имени М.В.Ломоносова (2006-2012), лаборатории электронной микроскопии ИКРАН им. А.В.Шубникова (2010) и кафедры биофизики Биологического факультета МГУ имени М.В.Ломоносова (2012), семинарах факультетов Биохимии и Биологии университета Брандайз (2001-2010), семинаре Института мембранной и системной биологии университета Лидс (2007). Основные результаты работы были доложены на следующих международных и отечественных съездах, конференциях, семинарах: Гордоновской конференции по ионным каналам (2000); 54 ежегодной конференции по структуре транспортных белков и каналов и 54 ежегодном симпозиуме Общества основных физиологов США (2000); Ежегодном симпозиуме биофизического общества США (2001); Гордоновских конференциях по узнаванию лигандов и молекулярному управлению (2001; 2002); 1 и 2 международных конференциях биологических мембранах по структуре, динамике и функции белков в (2001, 2003); Гордоновских конференциях по трехмерной электронной микроскопии (2002, 2007, 2008, 2010, 2012); Московских конференциях по вычислительной молекулярной биологии (2007, 2009); конференциях Федерации европейского биохимического общества (FEBS): 30th 6 FEBS Congress (2005), 32nd FEBS Congress (2007), 33rd FEBS Congress & 11th IUBMB Meeting (2008), 34th FEBS Congress (2009); Международной конференции по структуре F-BAR белков (2009), конференциях Американского микроскопического общества (2010-2012), ежегодных Генеральных ассамблеях проекта EDICT 7 рамочной программы Евросоюза (2007-2012); Конференции Жак Моход «Молекулярные основы моделирования и организации мембран» (2011), IV и V Российских симпозиумах «Белки и пептиды» (2009, 2011), Конференциях общества клеточных биологов США (2006, 2011), международной конференции «Нанотехнологии в онкологии» (2011), 1 международной конференции по новым методам в структурной биологии (2012), IV международном съезде биофизиков (2012). Публикации Всего по материалам диссертации опубликована 51 печатная работа, включая 24 статьи в реферируемых журналах, главу в коллективной монографии и два учебных пособия. Личный вклад автора Автором осуществлен выбор направления исследований и постановка задач. Эксперименты, анализ и интерпретация данных проведены лично автором, либо под ее непосредственным руководством или в соавторстве. Имена соавторов указаны в соответствующих публикациях. Структура работы Диссертация состоит из введения, 6 глав, заключения, выводов и списка литературы, содержащего 352 источника. Работа изложена на 219 страницах, содержит 7 таблиц и иллюстрирована 103 рисунками. ГЛАВА 1. КОМПЛЕКСНЫЙ ПОДХОД К ИЗУЧЕНИЮ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ МАКРОМОЛЕКУЛ В последнее десятилетие трансмиссионная (просвечивающая) электронная микроскопия (ПЭМ) превратилась в полноправный метод, применяемый в структурной биологии. Это стало возможным в связи со значительным улучшением методик электронной микроскопии и повышением возможностей компьютеров, применяемых для расчетов трехмерных структур. Электронная микроскопия расширяет возможности структурной биологии. Она предоставляет дополнительную информацию к другим методам структурной биологии, поскольку способна работать с большими макромолекулярными комплексами, которые могут находиться в различных конформациях одновременно, и требует только несколько микролитров раствора белка с небольшой (не более 1 мг/мл) концентрацией. Метод ПЭМ с успехом комбинируется с другими структурными методами, 7 позволяющими выявлять атомные структуры отдельных доменов. Фиттинг атомных структур в электронную плотность, рассчитанную по проекциям, полученным с использованием ПЭМ, позволяет интерпретировать меж- и внутримолекулярные взаимодействия в комплексах. 1.1. Принципы ПЭМ и реконструкции макромолекул Пучок ускоренных электронов, сформированный осветительной системой электронного микроскопа, взаимодействует с исследуемым объектом. Электроны, проходя через вещество объекта, упруго рассеиваются, то есть меняют свои траектории, а в результате и амплитуды, и фазы электронных волновых функций. Линза объектива собирает прошедшие через образец электроны в плоскости изображения, где формируется картина, которая содержит искомую информацию о структуре объекта. Основным следствием неупругого рассеяния электронов является накапливание их энергии в образце, приводящее к радиационному поражению проблемой (Frank, 2001). Радиационное поражение является серьезной в электронной микроскопии. Для того чтобы предотвратить радиационное поражение образец охлаждают. К сожалению, охлаждение не спасает полностью от повреждения, поэтому не рекомендуется подвергать образец избыточному электронному излучению. В результате отношение сигнал/шум оказывается низким. Низкое отношение сигнал/шум лимитирует количество информации, которую можно получить от одной молекулы. Следовательно, невозможно получить структуру с высоким разрешением от одной молекулы, для этого теоретически требуется, по крайней мере, 10,000 частиц, а на практике еще больше (Henderson, 1995). Реконструкция трехмерной структуры макромолекул становится возможной, только в том случае, если на препарате молекулярные комплексы находятся в виде изолированных частиц, как правило, отличающихся по своей ориентации. Метод реконструкции макромолекул заключается в получении трехмерных моделей белков с использованием множества двумерных проекций молекул (рис.1). Проекционные изображения отдельных молекул подвергают полосовой фильтрации и выравнивают относительно общей суммы каждого изображения путем его перемещения и вращения. На основе выровненных проекций получают суммарные изображения частиц белка, далее, с помощью последовательных математических операций рассчитывают угловую реконструкцию – трехмерную модель (3D) поверхности белковой частицы, каждая точка которой определена в пространстве с помощью трех углов Эйлера. 8 Начальная модель реконструкции; в этом используется заключается для дальнейшего итеративность улучшения метода. 3D Корректность полученной 3D-модели проверяется путем обратного проецирования ее на сферу Эйлера с оценкой ошибки реконструкции при сравнении проекций и соответствующих обратных проекций. Разработано множество методов проверки корректности 3D кристаллических плотность, модели, структур в числе отдельных иммуномечение, которых доменов мутагенез, в фиттинг существующих полученную мечение с электронную использованием электронноплотных наночастиц (Sokolova, 2004). Рисунок 1. Блок-схема метода трехмерной реконструкции макромолекул. 1.2. Построение молекулярных моделей белков на основе моделирования по гомологии. Эволюция белковых структур идет таким образом, что для произвольного белка существует единственный, термодинамически наиболее выгодный способ укладки основной цепи (нативный). В процессе эволюции мутации ДНК порождают изменчивость в белковой структуре и функции, что сказывается на жизнеспособности организма и, соответственно, естественном отборе. Вариации аминокислотных замен в гомологичных белках показывают, как структура приспосабливается к изменениям. Механизмы, стабилизирующие структуру белка, ограничивают конформационные изменения, а функциональные требования к структуре гомологичных белков накладывают дополнительные ограничения на структурные искажения. Таким образом, семейства родственных белков имеют 9 тенденцию к сохранению общих паттернов укладки. Поиск гомологий - это мост между аминокислотной структуры белка, последовательностью основанное на сходстве и с функцией. известными Предсказание структурами - моделирование структуры по гомологии - является весьма продуктивным подходом. Для интерпретации 3D структур белковых молекул, полученных с помощью ПЭМ, применяют фиттинг молекулярных структур отдельных доменов как имеющихся в базах данных, так и полученных в результате моделирования по гомологии. 1.3. Фиттинг - это метод молекулярного моделирования, который позволяет предсказать наиболее выгодную ориентацию и положение одной молекулы по отношению к другой (рис. 2). Различают жесткий и гибкий фиттинг. Метод жесткого фиттинга не учитывает конформационную подвижность белковых молекул. Фактически, жёсткий фиттинг можно свести к оценке энергии каждого конкретного комплекса. Гибкий фиттинг учитывает конформационную подвижность и может быть реализован с помощью автоматического перебора конформаций и ориентаций белковых молекул и оценке энергии взаимодействия. В результате, используя структуры отдельных доменов, возможно построить молекулярную модель полноразмерного белкового комплекса. Электронная плотность для интерпретации Атомная плотность, спроектированная на решетку прое кция фильтр * сглаживание по пространству = свертка с гауссовым ядром (g) Рассчитывается критерий совпадения для каждого поворота R и каждого смещения Т по всему пространству Рисунок 2. Схематическое представление процесса фиттинга атомной структуры в электронную плотность. 10 ГЛАВА 2. ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Объекты исследования: Объектами исследования являются рекомбинантные белки и макромолекулярные комплексы (ионные каналы и актинсвязывающие белки), а также атомные структуры отдельных доменов этих белков. Дизайн генов. Гены, кодирующие полноразмерные потенциал-зависимые ионные каналы в pmt3 векторе для экспрессии в клетках млекопитающих, были любезно предоставлены проф. К.Миллером (Kv1.1) и проф. Д.Вреем (Kv2.1, Kv10.2). Мутации (делеции и точечные мутации) проводили с использованием ПЦР и соответствующих праймеров. Корректность полученных мутантных генов проверяли с помощью секвенирования. Каждый ген, кодирующий потенциал-зависимый канал нес точечную мутацию в области поры (F425G) для увеличения сродства канала к токсину (Goldstein and Miller, 1992). Ген, кодирующий токсин желтого скорпиона (AgTx2) был предоставлен проф. К.Миллером. Гены, кодирующие АСБ, были любезно предоставлены проф. Б.Л.Гуде (Arp2/3, mDia1, Srv2/CAP) и проф. П.Лаппалайненом (IRSp53). Для экспрессии mDia1 использовалась конструкция, кодирующая транкированный формин (55 – 1255 а.к.). Предварительные биохимические эксперименты показали, что эта конструкция функционально не отличается от полноразмерного формина, но имеет значительно больший выход (Maiti et al, 2012). Структуры искусственных генов, кодирующих белки-аналоги спидроинов I и II были смоделированы на основе известных нуклеотидных последовательностей природных генов: ген 1f9 кодировал последовательность, аналогичную последовательности спидроина I паука Nephila clavipes (Xu and Lewis, 1990), а ген 2e12 – спидроина II паука N.madagascariensis (Motriuk-Smith et al, 2005). Мономеры рекомбинантных генов были получены в результате химико- ферментативного синтеза и амплифицированы в составе вектора. Экспрессия и очистка белков Полноразмерные и транкированные потенциал-зависимые каналы (Kv1.1, Kv2.1, Kv10.2) экспрессировали в эукариотических клетках (COS-1, COS-7, HEK293 или Vero). При очистке белков каналов использовали детергент CHAPS (2,5%). Для очистки на С-конец белков ионных каналов был амплифицирован 1D4 таг (TETSQVAPA) (Oprian et al, 1987). Очистка белков каналов производилась на аффинной колонке с пришитыми моноклональными антителами против 1D4, как 11 описано в (Sokolova et al, 2001; 2003). Выход целевого белка составил около 50 pМol. АСБ экспрессировали в дрожжах Pishia pastoris под контролем GALиндуцируемого промотора1, металлохелатной очищали хроматографии с (для использованием этого на аффинной либо белков были N-концы амплифицированы 6xHis либо GST таги) и последующей гель-фильтрации, как описано в (Rodal et al, 2005; Maiti et al, 2012; Chaudhry et al, 2012). Выход целевых белков составил 150-300 pМol. I-BAR домены и полноразмерный белок IRSp53 экспрессировали в клетках E.coli, выделяли из растворимой фракции клеток и очищали с использованием металлохелатной хроматографии и последующей гель-фильтрации. Выход целевого белка составил 1 мг/мл. Гибридную конструкцию, содержащую токсин (AgTx2), экспрессировали в E.coli, очищенный с помощью металлохелатной хроматографии слитый белок подвергали расщеплению трипсином, затем смесь разделяли на катионообменной колонке SP-Sephadex (Sigma) с последующей ВЭЖХ на колонке общей фазы С18, как описано в (Карлова с соавт., 2011). Спидроины I и II экспрессировали в дрожжах Pishia pastoris под контролем метанолиндуцибельного промотора АОХ-12, выделяли из водорастворимой фракции клеток и очищали с использованием высокоэффективной жидкостной хроматографии на колонке HiPrepSP, как описано в (Bogush et al, 2009). Связывание нейротоксина [H3]NEM-AgTx добавляли к клеткам и очищенному белку в концентрации 12.5 нM. Связывание производили при 4°С 30 мин, после чего несвязавшийся токсин отделяли с применением микрофильтров Microcon. Радиоактивность измеряли на жидкостном сцинтилляторе (Beckmann). Полученные данные позволяют предположить, что выделенный белок ионного канала сохраняет стабильность достаточно долго для проведения структурных исследований. Флуоресцентные тесты3 Цифровые изображения получали с помощью микроскопа LSM510 Meta (Carl Zeiss AG, Германия). Изображения записывали с помощью объектива Plan-Apochromat 100x/1.4 Oil Ph3. Для возбуждения флуоресценции метки Cy3 использовали гелийнеоновый 1 2 лазер (длина волны излучения 543 нм), В сотрудничестве с проф. Б.Л.Гуде, Brandeis University. В сотрудничестве с проф. В.Г.Дебабовым и В.Г.Богушем, ГосНИИгенетика. 12 для регистрации флуоресценции применяли фильтр с полосой пропускания 565–615 нм. Для обработки изображений использовали программное обеспечение Zeiss LSM 510Meta. Сканирующая электронная микроскопия Образцы паутины, высушенные на воздухе и покрытые нанометровым слоем золота, изучали в микроскопе Camscan S2 (Cambridge Instruments, UK). Изображения сохраняли на ПЗС камеру с помощью программного обеспечения MicroCapture (SMA, Russia). Моделирование по гомологии4 и фиттинг Для идентификации шаблонов был использован сервер SWISS-MODEL (Kiefer et al, 2009). Аминокислотные последовательности выравнивали с помощью программы T-COFFEE (Notredane et al, 2000). Построение моделей на основе выравнивания гомологичных аминокислотных последовательностей проводили в программе MODELLER (Eswar et al, 2006). Фиттинг проводили в полуавтоматическом режиме с использованием программ Situs (Wriggers, 2010) и UCSF Chimera (Pettersen et al, 2004). Моделирование взаимодействия I-BAR доменов с PIP Исследование проводилось в пакете Gromacs 3.3.1 (Berendsen et al, 1995) с силовым полем OPLS-AA (Jorgensen and Tirado-Rives, 1988) в случае полноатомного приближения. В случае крупно-зернистой молекулярной динамики использовалось силовое поле MARTINI (Marrink et al, 2007). Для исследования взаимодействия I-BAR домена с биологической мембраной методами использовались модельные липидные бислои, состоящие из 448 молекул фосфатидилхолинлипидов. использовали для POPC нейтрально (пальмитоил-олеил-фосфатидилхолин) заряженной мембраны; для отрицательно заряженной мембраны в один монослой дополнительно вносили заряженные липиды – PIP(4,5)PC (фосфоинозитид (4,5) фосфатидилхолин) в соотношении 1 PIP(4,5)PC: 4 POPC. ПЭМ макромолекул Очищенный белок (3 мкл) наносили на сеточки для электронной микроскопии, покрытые углеродной пленкой на 30 с, отсасывали фильтровальной бумагой и помещали на капли 1% уранилацетата для окраски (2 раза по 30 с). 3 4 В сотрудничестве с М.М.Мойсеновичем, Биофак МГУ. В сотрудничестве с проф. К.В.Шайтаном, Биофак МГУ. 13 избыток жидкости раствора (50 мкл) Изображения получали в электронном микроскопе Tecnai G-12 (FEI, Голландия) при ускоряющем напряжении 120 кВ в условиях низкой дозы электронов на квадратный ангстрем поверхности для предотвращения повреждения образцов под воздействием электронного пучка5. Изображения фиксировали с помощью ПЗС-камеры Eagle (FEI, Голландия) с увеличением 52 000 и дефокусом 1.4-3 мкм. Отбор изображений одиночных белковых молекул для последующего построения трехмерной (3D) структуры проводили вручную с помощью программы Signature (Chen & Grigorieff, 2007). Последующую обработку производили в программе IMAGIC (van Heel et al, 1996); был использован стандартный протокол (Van Heel, 1987). Изображения отдельных частиц были отфильтрованы от шума, нормализованы и выровнены по центру путем вращения изображений, их передвижения и сравнения с усредненным изображением. Разрешение полученных реконструкций измерялось с помощью метода объемной корреляции Фурье (van Heel & Schatz, 2005). ГЛАВА 3. ТРЕХМЕРНАЯ СТРУКТУРА И ДОМЕННОЕ СТРОЕНИЕ КАЛИЕВЫХ ПОТЕНЦИАЛ-ЗАВИСИМЫХ ИОННЫХ КАНАЛОВ Калиевые ионные каналы подразделяются в зависимости от их принципа функционирования на обратные ректификаторы, (Kir), Ca2+-активируемые каналы (KCa), двупоровые (K2P) и потенциал-зависимые (Kv) каналы. Потенциалзависимые калиевые каналы представляют собой очень разнообразную группу каналов, представленную двенадцатью семействами: Kv1-Kv12. К наиболее интенсивно изучающимся семействам каналов Kv, относятся Kv1 (Shaker), Kv2 (Shab), Kv4 (Shal), Kv7 (KVLOQ) и Kv10-12 (Ether-a-go-go). В фундаментальном аспекте одной из основных задач до сих пор остается получение трехмерных структур полноразмерных ионных каналов, так как кристаллизация мембранных белков значительна затруднена. Наличие у белков Kv каналов ротационной симметрии упрощает задачу восстановления 3D структуры по 2D проекциям, увеличивая в 4 раза отношение сигнал/шум. 3.1. Трехмерная структура канала Shaker (Kv1.1) и конформационные перестройки его С-концевого домена при взаимодействии с β-субъединицей Полученная нами впервые 3D реконструкция полноразмерного канала Kv1.1 (Shaker) (Sokolova et al, 2001; Sokolova et al, 2003) имеет разрешение 2,3 нм и 5 В сотрудничестве с чл.-корр. РАН, проф. Н.А.Киселевым, ИКРАН 14 представляет собой тетрамерный комплекс α-субъединиц, разделенный на две структурные части: мембранную и цитоплазматическую, которые соединены между собой тонкими линкерами, длиной 2-3 нм (рис. 3). Линкеры ограничивают «окна», достаточные для того, чтобы крупный (более 5Å в диаметре) N-концевой инактивационный пептид мог достичь порового комплекса для инактивации. Такая структура получила название «подвесная гондола» (Kobertz and Miller, 2000) и была впервые визуализована нами на примере канала Shaker (Sokolova et al, 2001). Данные о доменной структуре канала Shaker были подтверждены кристаллографическими исследованиями на канале, принадлежащем к тому же семейству (Kv1.2) (Long et al, 2005; 2007). Более того, нами и другими исследователями продемонстрировано, что двухслойная организация характерна для многих других ионных каналов (Kv4, Kv10, RyR). Е Б В Г Д Рисунок 3. Трехмерная структура каналa Shaker и локализация его С-концевого домена. (А) трехмерная структура альфа-субъединицы Shaker; (Б) трехмерная структура транкированного канала Shaker (ΔС); (В-Д) – определение локализации С-концевого домена путем сравнения структур на рис. (А) и (Б), различные ориентации. Стрелки указывают на разницу в области цитоплазматического домена. (Е) Интерпретация 3D структуры путем фиттинга кристаллических структур канала KcsA и T1 домена. Длина масштабного отрезка – 10 нм (Sokolova et al, 2001; 2003) Мембранный домен канала Shaker структурно подразделяется на субдомены D1 и D2 (рис. 3А,Б), включающие сенсор потенциала S4 и домены S1-S3, отсутствующие в бактериальном канале KcsA. Цитоплазматический домен объединяет комплекс N-концевых Т1 доменов и С-концевых участков. 15 До недавнего времени роль цитоплазматических доменов калиевых каналов была не определена. Сейчас становится ясно, что цитоплазматические домены вовлечены как во взаимодействия внутри тетрамера, так и в белок-белковые взаимодействия, регулирующие проводимость и мембранную локализацию канала. В данном разделе работы мы сосредоточились на исследовании конформационных изменений С-концевого участка канала Shaker методом мутагенеза с последующей ПЭМ. Для этой цели был экспрессирован и очищен мутантный канал, транкированный по С-концу (удалены 152 аминокислотных остатков) и рассчитана его 3D реконструкция с разрешением 2,3 нм (рис. 3). Связывание меченого нейротоксина (табл. 1) и дополнительные электрофизиологические исследования показали, что удаление С-концевых аминокислотных остатков незначительно влияет на активность канала (мы наблюдали сдвиг напряжения при активации на +12 mV), но ощутимо нарушает поверхностную экспрессию транкированных каналов в клетках (табл. 1). Таблица 1. Радиоактивность (pMol/чашка) связавшегося c порой канала [H3]NEM-AgTx. (WT – полноразмерный канал; ΔC – канал с удаленным С-концом). Образец Поверхность клетки Очищенный белок WT Shaker α-субъединица 0,97±0,02 0,33±0,015 ΔС Shaker α-субъединица 0,89±0,04 0,38±0,04 WT Shaker α-β комплекс 1,24±0,12 0,33±0,02 ΔС Shaker α-β комплекс 1,13±0,12 0,35±0,08 Путем сравнения выровненных относительно друг друга реконструкций полноразмерного и транкированного канала (рис. 3) было установлено, что в составе цитоплазматического домена канала С-конец образует компактную структуру (стрелки на рис. 3 и рис. 4А). Эта структура располагается по бокам Т1 домена, со стороны мембраны. При взаимодействии α-субъединицы канала с βсубъединицей, С-концевой домен перемещается в положение вблизи от активного центра β-субъединицы, проходя в общей сложности расстояние около 5 нм (рис. 4). Принимая во внимание факт, что при удалении С-концевого домена поверхностная экспрессия канала уменьшается (согласно результатам связывания [H3]-нейротоксина; табл. 1), можно сделать вывод о том, что С-концевой домен 16 способен контролировать поверхностную экспрессию канала путем активации βсубъединицы (Sokolova et al, 2003). Для уточнения этого предположения мы детально изучили канал, относящийся к семейству Kv2 (Shab), по имеющимся данным не ассоциированный с β-субъединицей. Рисунок 4. Конформационные изменения С-концевого домена (C) канала Shaker (А) при присоединении β-субъединицы (Б). Отмечены домены: Т1, S1-S4, поровый домен и С-концевой домен. Масштабный отрезок – 10 нм. (Sokolova et al, 2003) Б 3.2. Трехмерная структура канала Kv2.1 и локализация его С-концевых доменов. В отличие от канала Shaker, цитоплазматическая часть канала Kv2.1 имеет значительные размеры, а его С-концевые домены могут принимать участие в регулировании кинетики активации канала (см. обзоры: Pishalnikova and Sokolova, 2009; Wray, 2009). Массивный цитоплазматический С-конец этого канала содержит три структурных участка: линкер S6 (около 50 аминокислотных остатков), Srv2 домен (около 250 аминокислотных остатков) и CTA домен (около 100 аминокислотных остатков). Линкер S6 проявляет значительную гомологию среди Kv2 каналов и имеет структуру типа спираль-петля-спираль (Ju et al, 2003). С использованием FRET анализа (Kobrinsky et al., 2006) было показано, что при деполяризации дистальная часть C-конца канала Kv2 перемещается в периферическом направлении. На существующие взаимодействия между N- и С-концами указывают электрофизиологические данные (Ju et al, 2003). Однако до настоящего времени доменная структура канала Kv2.1 не была известна. Нами были получены две 3D структуры транкированного по С-концевому CTA мутантных каналов Kv2.1: домену (Kv2.1ΔCTA) и с полностью удаленным С-концом (включающим СТА и Srv2 домены) с разрешением 2,3 нм (Grizel et al, 2012, submitted). Путем визуального сравнения полученных структур между собой и со структурой полноразмерного человеческого канала Kv2.1 (Adair 17 et al, 2008), было установлено, что массивный цитоплазматический субдомен располагающийся внизу структуры является CTA доменом (рис. 5А). Рисунок 5. Трехмерная структура канала Kv2.1 и локализация С-концевых доменов: (А) полноразмерный канал Kv2.1 (из Adair et al, 2008), вид сбоку; (Б) канал Kv2.1∆CTA, вид в той же ориентации, что и на (А); (В) канал Kv2.1∆C, ориентация та же, что и на (А) и (Б). М1-М4 – субдомены мембранной части канала, Kv2 и CTA - С-концевые домены канала (Grizel et al, 2012) Выступы под мембраной, повернутые относительно мембранной части на 60°, одинаковые для структур полноразмерного канала и Kv2.1ΔCTA, имеют размеры 50х20Å и могут вместить 250 аминокислот, образующих домен Kv2 (с учетом плотности белка ~810Da/nm3 (Mattews, 1968)). Анализ трехмерных структур каналов обнаружил также различия в области мембранного домена, интерпретация этих различий приведена ниже. Таким образом, показано, что домены Kv2 и CTA частично окружают N-концевой Т1 домен. При этом четыре домена Kv2 расположены по бокам Т1 домена, а CTA-домены занимают дистальную часть. Следует отметить, что в отличие от других ионных каналов «окна» между мембранной и цитоплазматической частями канала при полученном разрешении не идентифицируются. Это отражает специфичность доменного строения каналов Shab. 3.3. Конформационные изменения мембранного домена канала Kv2.1 У полученных реконструкций каналов Kv2.1∆C и Kv2.1∆CТА, а также структуры полноразмерного канала (Adair et al, 2008) в области мембранного домена можно вычленить характерные субдомены M1-М4 (рис. 5). Расположение субдоменов M1, M3 и М4 аналогично у всех 3D структур; в то же время субдомен M2 испытывает значительные перемещения (до 1,5 нм). Он идентифицируется ближе к экстраклеточной части мембраны (в реконструкции канала Kv2.1∆C и Kv2.1WT) или на уровне мембраны (в реконструкции каналов Kv2.1∆CТА). 18 Известно, что при активации канала Kv2.1 происходят значительные конформационные изменения в положении сенсора потенциала S4. Этот процесс регулируется посредством цитоплазматических концов канала (Ju et al. 2003). Мы предположили, что разница в положении субдомена М4 может быть связана с изменением степени открытия канала при удалении С-концевого CТА домена. Для проверки этого предположения использовались молекулярные модели трансмембранной части канала Kv2.1 в открытой и закрытой конформациях, полученные путем моделирования по гомологии (рис. 6 А,Б). В качестве шаблонов использовались модели открытого и закрытого канала Kv1.2 (Han et al, 2008), основанные на модели активации (Pathak et al, 2007). Гомология между моделями и шаблонами составила 65%. Сравнение полученных моделей позволило однозначно установить, что при открытии канала происходит поворот лопасти S2S3 из центра канала к периферии, а S3-S4 перемещается в направлении внеклеточного пространства (рис.6 А,Б). В результате данного конформационного изменения субдомен М2 опускается ближе к цитоплазме (рис. 6В,Г). Эти данные хорошо иллюстрируют различия в 3D структурах мутантных каналов, наблюдаемые нами (рис. 5Б,В), а также говорят в пользу того, что структура полноразмерного канала Kv2.1 (Adair et al, 2008) была получена в открытом состоянии (рис. 5А). Рисунок 6. Интерпретация мационных конфоризменений мембранного домена канала Kv2.1. Молекулярные модели трансмембранной А части канала Kv2.1 в закрытой (А) и Б открытой (Б) конформациях. S3-S4 S3-S4 Фиттинг закрытой структуры в Kv2.1∆CТА (В) и открытой в Kv2.1∆C (Г) (одна субъединица) Отмечено положение В линкера S3-S4. Г 3.4.Кластеризация Kv2 каналов и роль СТА домена в этом процессе Известно, что полноразмерные каналы Kv2.1 экспрессируются на поверхности клеток в виде кластеров (Mohapatra and Trimmer, 2006; Tamkun et al., 19 2007), и полное удаление С-конца приводит к нарушению транспорта каналов в направлении плазмалеммы (Mohapatra et al., 2008). С использованием живых клеточных культур и флуоресцентно меченного нейротоксина (Карлова с соавт., 2011) мы показали, что каналы дикого типа (Kv2.1wt), а также каналы с удаленным С-концом (Kv2.1∆C, Kv2.1∆CTA) могут образовывать кластеры на поверхности мембраны. При этом общая площадь, занимаемая на поверхности клетки кластерами транкированных каналов, достоверно уменьшалась при удалении не только всего C-конца, но уже домена CTA (рис. 7Б). Таким образом, мы впервые показали, что способность каналов транспортироваться к клеточной мембране нарушается в результате делеции CTA-домена канала Kv2.1. Эти домены также участвуют в регуляции активационных свойств канала (Ju et al, 2003), что указывает на возможность выполнения ими роли отсутствующей у каналов Shab ß-субъединицы (Grizel et al, 2012б submitted). В Диаметр, нм Площадь кластеров Б Kv2WT ΔCTA ΔC Kv10 Рисунок 7. Кластеризация канала Kv10.2 (А) и участие С-концевых доменов каналов в поверхностной экспрессии канала Kv.2: (Б) относительная площадь, занимаемая каналами на поверхности клетки; (В) Средний диаметр кластеров исследуемых каналов Kv2.1 и Kv10.2 (nm). Мы впервые установили, что каналы Kv10.2 (heag2) тоже образуют кластеры в мембране клетки (рис. 7А), однако, их размеры были меньше, чем у Kv2.1WT (рис. 7В). Замечательной особенностью кластеров Kv10.2 является то, что они колокализуются с актиновым цитоскелетом (Карлова с соавт., 2011), что не показано для каналов Kv2.1. Эти различия во взаимодействии с актином можно объяснить значительными различиями в строении цитоплазматических доменов каналов Kv2.1 и Kv10.2 и в выполняемых ими функциях. Однако до сих пор структура каналов семейства Heag не была известна. 3.5. Трехмерная структура канала Kv10.2 и локализация его С-концевых доменов Субсемейство Ether-a-go-go характеризуется экстремально длинными N- и Cконцевыми последовательностями, в 20 состав которых входят несколько структурных доменов. В отличие от каналов семейств Kv1-Kv4, N-концевые домены у каналов Kv10 не являются тетрамеризационными (Cabral et al, 1998). Сконцевой участок содержит домен связывания циклических нуклеотидов (cNBD) и тетрамеризационный CAD домен (Zagotta et al, 2003). Делеция домена СAD приводит к синтезу нефункционального канала Kv10. Рассчитанная нами по данным ПЭМ 3D реконструкция канала Kv10.2 имеет классическую двухслойную организацию (рис. 8). Две структурные части реконструкции разделяют линкеры, образующие «окна». Размеры «окон» в нашей модели составляют около 0.25 х 0.3 нм, что согласуется с данными, полученными для канала Shaker (Sokolova et al., 2001). Выступ (около 3 нм в диаметре) на верхней части канала может являться результатом N-гликозилирования, о чем свидетельствует наличие выступа со сходными размерами на поверхности мембранного домена канала Shaker, также N-гликозилированного (см. выше). Цитоплазматическая часть канала массивная и, как и ожидалось, подразделяется на домены. Рисунок 8. 3D реконструкция канала Kv10.2. Слева направо: два боковых вида отличающихся друг от друга поворотом на 90˚, вид с внутриклеточной стороны. Масштабный отрезок равен 10 нм. М – трансмембранный домен; Р и D – цитоплазматические домены; О – окно. (Соколова с соавт., 2012) 3.6. Построение молекулярной модели полноразмерного канала Kv10.2 Для локализации цитоплазматических доменов канала Kv10.2 мы проводили фиттинг N- и С-концевых доменов Kv10.2 (рис. 9). Атомные модели доменов были получены в результате моделирования по гомологии. Для построения модели N-концевого домена PAS в качестве шаблона была выбрана структура гомологичного домена канала Herg (PDB код 2KXL). Для построения модели С-концевого cNBD-домена была использована кристаллическая структура человеческого cAMP-зависимого канала HCN4 (PDB код 3OTF). Перемещая отдельные мономеры cNBD в направлении, указанном 21 стрелками на рис 9В, мы встроили их в область субдоменов «D». В пользу этого варианта свидетельствует относительное соответствие объемов субдоменов и мономеров cNBD (рис. 9Г). Фиттинг N-концевых доменов (PAS) в область субдоменов «Р» позволил разместить их дальше от центральной оси канала, в непосредственном контакте с С-концевыми доменами (рис. 9Д, Е). Эта структура уточняет выдвинутую ранее гипотезу (Wray, 2009), предполагающую расположение компактного тетрамера cNBD-доменов в центре цитоплазматической части канала, а PAS-доменов – ближе к периферии. Поскольку наша структура канала Kv10.2 определялась в отсутствие лигандов, то можно предположить возможную перегруппировку Cконцевых доменов при связывании cAMP. В нашей реконструкции PAS-домены располагаются на 0.1 нм ближе к трансмембранной части, чем cNBD-домены, достаточно близко, чтобы взаимодействовать с S4-S5 линкером, и воздействовать, таким образом, на дезактивацию канала. Рисунок 9. Интерпретация трехмерной реконструкции канала Kv10.2. А. Фиттинг модели трансмембранного домена в верхнюю часть реконструкции канала Kv10.2; Б. Вид сбоку: ТМ - трансмембранный домен; В. вид снизу: фиттинг тетрамера cNBD доменов, моделированного по гомологии с кристаллической структурой человеческого цАМФзависимого канала HCN4 (PDB ID: 3OTF); Г. вид снизу: фиттинг cNBD доменов в область субдоменов «Р»; Д. Вид сбоку: фиттинг доменов PAS и cNBD в цитоплазматическую часть. ТМ – трансмембранный домен; Е. Вид снизу соавт., 2012) 22 (Соколова с 3.7. Гипотеза изменения конформационного состояния калиевых каналов при активации Наши структурные исследования структуры потенциал-зависимых каналов, в сочетании с данными мировой литературы позволили создать модель конформационных перестроек доменов потенциал-зависимого канала при его открытии (рис. 10) (Pischalnikova et al., 2009). Согласно этой модели, в результате деполяризации мембраны спираль S4 совершает движение в направлении внеклеточного пространства (стрелка 1, рис.10), а также в сторону (стрелка 2) и поднимает N-концевой конец линкера S4-S5 (стрелка 3), что приводит к его повороту вбок и вверх. Спираль S6 при этом открывает ворота канала (стрелка 5) (Yellen, 2002; Long et al. 2005, Pathak et al, 2007). Рисунок 10. Схема конформационных изменений в Kv каналах при активации. А. 3D схема одной субъединицы “закрытой” Kv канала конформации. в N- концевой T1 домен изображен как тетрамер. ванные стрелочки Пронумероуказывают предположительные направления движения спиралей при активации канала. (Pishalnikova and Sokolova, 2009). Б, В Кристаллические структуры Открытого (Б) и закрытого (В) Kv2.1 каналов, с разрешением Б 2 нм. Указаны субдомены М1- В М4. (Grizel et al, 2012). Следовательно, C-концевой домен, соединенный со спиралью S6, может двигаться во внешнем направлении (стрелка 6). У канала Shaker С-концевой 23 домен располагается близко к мембране и может, поэтому, взаимодействовать с линкером, либо непосредственно с основанием петли Т1-S1 (рис. 10). Эта гипотеза подтверждается нашими ПЭМ данными о структуре каналов Kv2.1 и Kv1.1. В структуре Kv2.1∆CTA субдомены М2 (спираль S2) находятся на уровне мембраны, что соответствует закрытому состоянию канала. В структурах Kv2.1∆C и Kv2.1WT субдомены М2 сдвигаются в сторону внутриклеточного пространства, что соответствует открытому каналу, причем амплитуда движения М3 значительна (~1,5 нм) (рис.10Б). Известно, что С-концевой домен канала Kv1.1 также испытывает значительные конформационные изменения при присоединении регуляторной β-субъединицы (Sokolova et al, 2003). Таким образом, в результате исследований 3D структур потенциалзависимых ионных каналов, представленных в главе 2, был открыт способ доменной организации альфа-субъединиц потенциал-зависимых калиевых каналов с характерным расположением цитоплазматических доменов в виде «подвесной гондолы». Данное расположение доменов связано со специфическими процессами инактивации Kv каналов. Были продемонстрированы конформационные изменения в потенциал-зависимых калиевых каналах при активации и присоединении лигандов. Показано, что С-концевой домен контролирует поверхностную экспрессию канала Shaker путем активации βсубъединицы. Цитоплазматические С-концевые CTA домены канала Kv2.1 несут функции отсутствующей у этого типа каналов β-субъединицы, контролируя степень поверхностной экспрессии канала. Каналы Kv10 способны организовываться в кластеры на поверхности клетки; в отличие от каналов Kv2, каналы Kv10 способны взаимодействовать с актиновым цитоскелетом посредством своего обширного цитоплазматического домена. ГЛАВА 4. КОНФОРМАЦИОННЫЕ ИЗМЕНЕНИЯ В АКТИНСВЯЗЫВАЮЩИХ БЕЛКАХ ПРИ АКТИВАЦИИ И ВЗАИМОДЕЙСТВИИ С ЛИГАНДАМИ Актиновый цитоскелет – одна из важнейших структур клетки, обеспечивающая не только подвижность различных клеточных образований, но и такие функции, как эндоцитоз, цитокинез, фагоцитоз, а также внутриклеточный транспорт. Одним из важных признаков опухолевой трансформации клеток считают изменения цитоскелета (Васильев, 1997). Регуляция работы актинового цитоскелета поддерживается большим набором актинсвязывающих белков (АСБ), отличающихся по строению и выполняемым 24 функциям (Goode & Eck, 2006). В цитоплазме многие АСБ в норме находятся в автоингибированном состоянии. До сих пор кристаллические структуры крупных мультидоменных АСБ не были получены. Наши исследования трехмерной структуры ряда АСБ позволили выдвинуть ряд гипотез о конформационных перестройках при активации и связывании с лигандами (Rodal et al, 2005; Соколова с соавт., 2011; Maiti et al, 2012; Chaudhry et al, 2012). 4.1.Трехмерная структура комплекса CAP/srv2 Комплекс CAP (у дрожжей Srv2) выполняет функции сборки-разборки актиновых мономеров (Goode and Eck, 2007). Суперспиральный (CC) N-концевой домен комплекса CAP/Srv2 на (отмечен рис. 11А) взаимодействует с аденилатциклазным комплексом (Gerst et al, 1991; Kawamukai et al, 2010) и участвует в формировании клеточного ответа путем активации Ras-белков. Последняя на сегодняшний день предложенная модель обновления актиновых филаментов (Quintero-Monzon et al., 2009) учитывает функции обоих концов CAP/Srv2 белка и предполагает ведущую роль С-концевого фрагмента в процессе нуклеотидного обмена. Однако остается невыясненной организация работы CAP/Srv2 в составе высокомолекулярного комплекса. Для того чтобы выяснить олигомерное строение полноразмерного белка CAP/Srv2, мы изучали его структуру с помощью ПЭМ (рис. 11Б). Комплекс имеет размеры около 30 нм в диаметре и содержит центральную часть, связанную линекерами с шестью периферическими глобулами. Так как полноразмерный комплекс не имеет фиксированной формы, центральная часть его, представляющая N-концевой олигомер, изучалась отдельно (Соколова с соавт., 2011; Chaudhry et al, 2012). Мы показали, что N-концевые фрагменты (N-Srv2) в растворе спонтанно олигомеризуются (рис. 11В). Олигомерная структура стабилизируется N-концевыми двойными спиралями СС доменов. Олигомер имеет размеры 10х10 нм и может вместить не более шести мономеров N-Srv2 (рис. 11Г), что свидетельствует о том, что N-Srv2 является гексамером. Эти данные центрифугирования были подтверждены (Quintero-Monzon et результатами al, 2009). дифференциального Удаление СС домена, ответственного за гексамеризацию, приводит к экспрессии нефункционального Srv2/CAP. Из полученных данных следует, что полноразмерный комплекс Srv2 (рис. 11Б) является гексамером и включает G-актин в соотношении 1:1 (6 молекул Srv2 + 6 молекул актина). 25 Д А Е Ж Б З Рисунок 11. Структура N-концевого гексамера Srv2. (А) строение мономера; (Б) ПЭМ полноразмерного Srv2; (В) 3D структура NSrv2; (Г) фиттинг мономеров; (Д) F-актин; (Е) В Г F-актин с кофилином; кофилином фрагмент и (Ж) N-Srv2; и (Ж) (З) фиттинг F-актин с увеличенный структуры (В) (стрелка). (Chaudhry et al, 2012) Функциональная роль Srv2/CAP изучалась в системах in vitro (Chaudhry et al, 2012). Было показано, что полноразмерный белок усиливает скорость сборки актина из мономеров в присутствии кофилина (Cof1) и нуклеаторов, а изолированный N-Srv2 усиливает разрезание актинового филамента в присутствии кофактора Cof1. Эта функция N-Srv2 активируется только в гексамерной организации (рис. 11Ж), в то время как мономеры не обладали разрезающей способностью. С помощью двухцветной TIRF микроскопии было показано, что N-Srv2 присоединяется только в тех местах филамента, которые уже декорированы Cof1, при этом добавление гексамерного N-Srv2 увеличивало декорирование филаментов в 4 раза и ускоряло разрезание, видимо, за счет стерических взаимодействий. Таким образом, впервые было установлено, что N-концевой домен Srv2/CAP участвует в разрезании актиновых филаментов и что эта функция осуществляется путем взаимодействия N-Srv2 и Cof1. Полученные данные однозначно свидетельствуют о новой роли N-Srv2 в обновлении актиновых филаментов. 4.2. Трехмерная структура формина mDia1 и основы его автоингибирования Роль форминов в клетке, как нуклеаторов актинового филамента впервые была определена в биохимических экспериментах с С-концевым фрагментом формина дрожжей Bni1, содержащим домены FH1 и FH2 (Sagot et al, 2002). 26 Кристаллические структуры изолированных доменов FH2 (Xu et al, 2004) и DID (Otomo et al, 2005; Rose et al, 2005) представляют собой димеры, однако до сих пор полноразмерный формин не был закристаллизован, и не было известно его олигомерное состояние. Более того, две опубликованные структуры N-концевых димеров отличаются конформацией (симметричная – Rose et al, 2005; ассиметричная – Otomo et al, 2005). До сих пор не было найдено объяснение этому феномену, исследователи пришли к неоднозначному выводу, что одна из конформаций, видимо, неверная, и обусловлена периодическими граничными условиями в ячейке. При этом было не ясно, какая именно структура является корректной. Полученная нами 3D структура молекулы автоингибированного формина mDia1 (55–1255) образована двумя слоями: на одном уровне располагается разветвленная структура (отмечена буквой «В» на рис.12А), а на другом – кольцевая структура (отмечена буквой «К» на рис. 12А). Для интерпретации 3D структуры мы использовали кристаллические структуры N- и C-концевых димеров (Otomo et al, 2005; Xu et al, 2004). Фиттинг N-концевого димера в область «вилки» (R=0.65) и С-концевого димера в область «кольца» (R=0,8) (рис. 12Б) позволил продемонстрировать, что полученная 3D реконструкция может вместить не более двух N- и двух C-концевых доменов, при этом актин-связывающие сайты Сконцевого домена (Xu et al, 2004) полностью перекрываются N-концевым доменом. Рисунок А 12. Структура автоингибированного В К mDia1(55-1255) (A) Три ориентации 3D структуры; (Б) фиттинг кристалл- лических структур (Xu et al, 2004; Otomo et al, 2005) в Б рассчитанную электронную плотность в той же ориентации, что и на (А) (Maiti et al, 2012) Представленные данные убедительно свидетельствуют в пользу того, что формин является димером, находящимся в автоингибированной конформации, Таким образом, мы впервые показали, что автоингибирование формина имеет 27 стерическую природу. Следует заметить, что полученная нами 3D реконструкция могла вместить только ассиметричную структуру N-концевого домена (Otomo et al, 2005) с достаточной точностью (R=0.65), в то время как симметричная структура N-конца (Rose et al, 2005) плохо коррелировала с нашей 3D структурой (R=0.3). Таким образом, можно сделать вывод о том, что в автоингибированной молекуле N-концевой домен формина принимает ассиметричную конформацию. Вероятно, что симметричная конформация N-концевого домена соответствует активированной молекуле. Исходя из полученных данных, активированный формин (в конформации, в которой актин-связывающие сайты доступны) должен представлять собой вытянутую молекулу. Для того чтобы продемонстрировать, что эта гипотеза верна, мы изучили другой эукариотический формин – Bni1 из дрожжей. В отличие от mDia1 он не имеет DID домена и поэтому постоянно находится в активированном состоянии (Sagot et al, 2002). В соответствии с высказанным нами предположением, на микрофотографиях очищенного Bni1 можно было увидеть вытянутые частицы, на одном конце которых находилось «кольцо», а на другом – разветвление. Б частица Рисунок 13. Конформационные изменения форминов при активации степени (А), выраженные компактизации в ПЭМ изображения молекулы, рассчиА Bni1 mDia1ΔC mDia1 FL танной как отношение х/у (Б). (Соколова с соавт., 2011). При изучении проекционных структур транкированного mDia1, с удаленным DAD доменом и сравнении линейных размеров полноразмерного формина (рис.13А) показано, что удаление регуляторного DAD домена формина приводит к удлинению проекционной структуры, что коррелирует с активностью молекулы. 28 Все вышесказанное позволило нам сформулировать гипотезу физиологического обновления формина в клетке (рис. 14). В соответствии с этой гипотезой в цитоплазме формин находится в автоингибированном состоянии. Для того, чтобы перевести его в активное состояние необходимо взаимодействие с НПФ (факторы, промотирующие нуклеацию), Rho GTPase и липидами (Maiti et al, 2012). В результате формин переходит в открытую конформацию; его актин-связывающие сайты становятся доступны, это инициирует нуклеацию актинового филамента. Формин при этом остается связанным с плазмалеммой частично через Rho GTPase (Seth et al. 2006), частично это взаимодействие может быть опосредовано DID доменом формина. После отсоединения активатора Rho, формин может какое-то время оставаться на «+» конце филамента, кепируя его. Будучи вытесненным кепирующими белками и/или другими факторами (Chesarone et al, 2010), формин снова возвращается в цитоплазму в автоингибированном состоянии. Кепирующие белки Автоингибированный Липиды НПФ Свободный Активированный мембрана Рисунок 14. Схема активации и обновления формина в клетке (Maiti et al, 2012). 29 4.3. Структура комплекса Arp2/3 и его взаимодействие с лигандами Формирование лидирующего края при движении клетки контролируется комплексом белков с общим названием Arp2/3. Сам по себе Arp2/3 комплекс имеет низкую способность к нуклеации, поэтому для его активации необходимы белки семейства WASP/WAVE (Shimada et al, 2004). Кристаллическая структура бычьего Arp2/3 комплекса была определена в 2001 году с разрешением 2,0Å (Robinson et al, 2001). Было отмечено, что структура субъединиц Arp2 и Arp3 гомологична структуре мономерного актина, поэтому было высказано предположение, что взаимодействие этих двух субъединиц и активатора (WASP) может служить сайтом нуклеации. Однако кристаллическая структура не давала ответ на вопрос, как происходит нуклеация, так как Arp2 и Arp3 находились слишком далеко друг от друга. В данном разделе главы 4 мы изучали проекционные и 3D структуры Arp2/3 комплекса и мутантов с различной нуклеаторной активностью и нашли, что Arp2/3 комплекс существует в растворе в виде смеси нескольких конформаций (рис.15AВ) – открытой, промежуточной и закрытой в различных соотношениях. Количество молекул в открытом состоянии прямо коррелирует с инактивацией нуклеирующей функции комплекса (Rodal et al, 2005). При добавлении активатора WASP мы наблюдали появление новой конформации – закрытого комплекса Arp2/3 с WASP (рис. 15Г). При этом WASP присоединялся в месте взаимодействия субъединиц Arp2 и Arp3, что соответствовало высказанным ранее предположениям (Robinson et al, 2001). При добавлении инактиватора Arp2/3 - коронин (Crn) - все молекулы, взаимодействующие с Crn, детектировались в открытой конформации (рис. 15Е). Это свидетельствует о том, что инактивация комплекса происходит путем стерического разделения в пространстве ответственных за нуклеацию субъединиц Arp2 и Arp3. Данная гипотеза была подтверждена с использованием недавно открытого инактиватора Arp2/3 комплекса – фактора созревания глии (GMF) (Shi et al, 2006). При добавлении GMF мы не наблюдали закрытой конформации, но появлялась дополнительная конформация – комплекс Arp2/3 с GMF. При сравнении проекционных структур Arp2/3 плотность регистрировалась и Arp2/3 с GMF, дополнительная электронная рядом с субъединицей р19. В результате индуцировалось конформационное изменение, поворачивающее субъединицу Arp3 и отдаляющее ее от Arp2, что выражается в инактивации нуклеаторной функции Arp2/3 комплекса (Ghandi et al, 2010). В результате проделанных 30 экспериментов мы смогли сформулировать гипотезу конформационных изменений в комплексе Arp2/3 при активации и инактивации (рис 16). А Б В Г Д Е Ж Рисунок 15. Проекционные структуры Arp2/3: открытая (А), промежуточная (Б) и закрытая (В). Конформация Arp2/3 в комплексе с WASP (Г) и в комплексе с Crn (Е). Д и Ж – соответствующие разностные пики (Rodal et al, 2005). Согласно этой гипотезе, активация Arp2/3 происходит в результате конформационного изменения, приближающего субъединицу Arp2 к Arp3, при этом вначале перемещается субъединица Arp2 (с образованием промежуточной конформации), а потом Arp3 (закрытая конформация). Субъединица p18, соединенная с Arp3, также перемещается. Активатор WASP, взаимодействуя с Arp2 и Arp3, формирует платформу для присоединения следующих мономеров актина. Не так давно 3D структура Arp2/3 с WASP была решена с использованием электронной томографии (Rouiller et al, 2008). А Б В . Рисунок 16. Гипотеза конформационных перестроек в комплексе Arp2/3 при активации и инактивации (Rodal et al, 2005). (А) открытая конформация – инактивированный комплекс; (Б) промежуточная конформация – субъединица Аrp2 перемещается; (В) закрытая конформация с WASP – активированный комплекс. Подписаны основные субъединицы, Crn и WASP. Стрелки показывают направление движения субъединиц (Rodal et al, 2005). 31 Полученные данные полностью подтвердили нашу гипотезу. Более того, методом SAXT было показано, что первый мономер актина на тупом конце филамента действительно взаимодействует вначале с Arp2, а потом с Arp3 (Bochlowska et al, 2008). Инактивация индуцируется взаимодействием с другими субъединицами комплекса (р35 и р19). Субъединицы p35 и p19 связаны друг с другом посредством следовательно, С-концевых альфа-спиралей конформационное изменение (Robinson одной et al, 2001), субъединицы может инициировать поворот другой. Субъединица р19 соединена с Arp2, соответственно Arp2 отдаляется от Arp3, инактивируя комплекс. В заключение, врезультате исследований, описанных в главе 4, были впервые разработаны актинсвязывающих детальные белков при модели конформационных регулировании динамики изменений цитоскелета и плазматической мембраны. Нуклеаторный комплекс Arp2/3 находится в клетке в трех основных конформациях (открытой, промежуточной и закрытой), отражающих функциональную активность клетки. Активация комплекса происходит при присоединении WASP, инактивация - при взаимодействии с коронином или GMF. Показано, что нуклеатор актина формин является автоингибированным димером. Автоингибирование имеет стерическую природу. Предложены гипотезы конформационных изменений формина в процессе онтогенеза клетки. Впервые обнаружено, что N-концевой домен комплекса Srv2/CAP представляет собой гексамер, в то время как С-конец димеризуется и образует комплекс с G-актином. N-концевой домен специфически взаимодействует с F-актином, усиливая его фрагментацию с участием кофилина. ГЛАВА 5. СТРУКТУРНЫЕ ОСНОВЫ МОДИФИКАЦИИ ПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ I-BAR БЕЛКАМИ При движении клетки скоординированные процессы полимеризации актина и взаимодействие актинового цитоскелета с клеточной мембраной толкают активный край клетки вперед и приводят к образованию филоподий. Эти процессы координируются актинсвязывающими белками (Pollard et al, 2000). Белки, которые способны одновременно связывать актин, и взаимодействовать с плазматической мембраной, модифицируя ее с образованием филоподий (Zimmerberg and Kozlov, 2006) объединяют в одно семейство. Все они содержат так называемые BAR (Bin, Amphiphysin, Rvs) или I-BAR (или invert-BAR) домены. Кристаллические структуры некоторых I-BAR доменов были опубликованы (Millard et al, 2005; Lee et al, 2007; 32 Pykalainen et al, 2011), однако механизм связывания I-BAR домена с мембраной до сих пор не известен. До недавнего времени предполагалось, что I-BAR взаимодействует с мембраной своей выгнутой стороной, по аналогии с F-BAR доменом (Frost et al, 2009). 5.1. Модификация липидных мембран I-BAR доменами Для изучения связывания I-BAR домена белка IRSp53 с POPC/PI(4,5)P2 липидов мембраной мы применили молекулярную динамику (в полноатомном и крупнозернистом приближении). Начальные стадии взаимодействия белка с мембраной проходили одинаково в обеих системах, что позволило нам использовать крупнозернистую модель для расчета взаимодействия I-BAR домена с мембраной в течение достаточно длительного времени (500 нс). Анализировали три системы, включающие липидный бислой и димерный I-BAR домен (рис. 17А) в различных ориентациях по отношению к мембране (рис. 17В). Изначальная ориентация I-BAR домена не сказывалась на его способности взаимодействовать с мембранами. Во всех исследованных нами системах белок ложился на мембрану через 10 нс. Это свидетельствует в пользу гидрофобных взаимодействий между мембраной и белком. В то же время, мы не наблюдали взаимодействия I-BAR домена с нейтрально заряженной мембраной, что демонстрирует наличие электростатических взаимодействий между белком и отрицательно заряженными липидами. Б А Рисунок 17. (А) Структура I-BAR домена; (Б) Изгибание I-BAR доменом мембраны; (В) Средние значения радиуса кривизны за 500 нс. Анализируемые системы: 1 – С-концы белка повернуты от мембраны; В 2 – вдоль «линии связывания липидов»; 3 – С-концы белка повернуты к мембране. (Левцова с соавт., 2011) 33 Большинство положительно заряженных аминокислот в исследуемом белке (в основном, лизин и аргинин) расположены на дистальных концах димера и вдоль стороны, противоположной С-концу. Во всех исследованных системах дистальные концы белка слегка погружались в область липидных головок (рис. 17Б). Это может объясняться тем, что на дистальных концах обоих мономеров в позиции 147 находится положительно заряженная аминокислота лизин (К147), которая одинаково доступна при любом положении димера относительно мембраны. Наблюдаемая динамика взаимодействия I-BAR домена с мембраной значительно отличалась от родственных им BAR доменов (Ferguson et al, 2009).У BAR доменов взаимодействие с мембраной начинается с дистальных концов и распространяется на центральную часть (Arkhipov et al, 2008). У I-BAR доменов мы вначале наблюдали взаимодействие между липидами и центральной частью димера. Это взаимодействие индуцировало образование кривизны мембраны уже на ранних стадиях белок-липидного взаимодействия. Природа этого взаимодействия – электростатическая и не стабилизировалась взаимодействием N-концевых спиралей с липидами, как это было предсказано для других белков (Saarikangas et al, 2009). В зависимости от положения белка, наблюдали различный изгиб мембраны (рис. 17В). Радиус кривизны мембраны в экспериментах флуктуировал от 100 до 200 нм. Это, видимо, связано с тем, что одиночный домен не способен стабильно изгибать мембрану. Однако, одиночный I-BAR димер эффективно связывается с мембраной не своей выгнутой стороной, а вдоль "линии связывания липидов" (Yamagishi et al, 2004). В случае если несколько таких доменов расположены достаточно близко, они могут взаимодействовать друг с другом, поворачиваясь к мембране. При этом кластеры отрицательно заряженных липидов мигрируют к дистальным концам доменов (Левцова с соавт., 2011), которые далее проникают в полярную область мембраны и вызывают образование филоподий. Предполагается, что актинсвязывающие домены, находящиеся на С-конце в составе полноразмерного белка стабилизируют образующуюся филоподию. Для того чтобы изучить эти процессы в 3D пространстве, мы впервые получили структуру полноразмерного I-BAR белка. 5.2. Cтруктура полноразмерного IRSp53 Считается, что в клетке белок IRSp53 находится в автоингибированном состоянии. На это указывает значительное увеличение числа филоподий в клетках, в которых был экспрессирован изолированный I-BAR домен, по 34 сравнению с клетками, в которых экспрессировали целый белок (Millard et al, 2005). Механизм автоингибирования белка пока не известен. Предполагается также, что активация белков происходит при взаимодействии с молекуламиактиваторами, которые изменяют конформацию и пространственное расположение доменов так, что они могут одновременно взаимодействовать с мембранами и актиновым цитоскелетом (Disanza et al, 2006). Изучение очищенного белка методом ПЭМ позволило заключить, что в растворе IRSp53 даже в отсутствие активатора представляет собой смесь молекул в открытой и закрытой конформациях. Преимущество метода ПЭМ состоит в том, что можно из смеси проекций выбрать те, которые находятся в определенной конформации. Используя только проекции с удлиненным фенотипом, мы получили 3D реконструкцию IRSp53 в открытой (предположительно активной) конформации (рис. 18). Реконструированная молекула имеет двухдоменное строение: вытянутый домен, имеющий размеры 10 х 1 нм, к которому посередине с помощью двух линкеров прикреплен глобулярный домен с размерами 5 х 8 нм. Построение молекулярной модели IRSp53 проводили с помощью фиттинга кристаллических структур N-концевого I-BAR домена белка IRSp53 (Yilmaz and Christofori, 2010) и доступных структур гомологичных доменов других белков. Рисунок 18. Трехмерное строение IRSp53 в открытой конформации. Слева направо: два боковых вида, отличающихся друг от друга на 90°, и вид сверху. Произведен фиттинг кристаллических структур I-BAR, SH3 и WH2 доменов. (Соколова с соавт. 2011) Фиттинг показал, что вытянутый домен является I-BAR доменом, так как кристаллическая структура последнего хорошо помещается в соответствующей части реконструкции. Компактный домен может поместить по две структуры гомологичных доменов SH3 и WH2, и остается достаточно места для двух CRIB доменов, структура которых до настоящего времени не известна. Полученная 3D 35 структура хорошо иллюстрирует гипотезу, представленную выше, объясняющую возможный механизм работы белков, содержащих I-BAR домены. Согласно этой гипотезе, I-BAR домен на одном конце белковой молекулы изгибает мембрану, с образованием филоподии, а другой конец молекулы стабилизирует образовывающийся вырост, посредством взаимодействия актинсвязывающего домена WH2 с растущим актиновым филаментом. Наличие в составе 3D структуры обособленных доменов, соединенных гибкими линкерами, способствует осуществлению этой функции. Таким образом, в главе 5 впервые представлена структура полноразмерного I-BAR белка IRSp53 в открытой конформации и построена модель модификации его I-BAR доменом негативно заряженной мембраны в процессе генерации филоподий. Моделирование показало, что взаимодействия IRSp53 с отрицательно заряженными липидами имеют как электростатическую, так и гидрофобную природу. ГЛАВА 6. ЧЕТВЕРТИЧНАЯ СТРУКТУРА СПИДРОИНОВ, ПРИМЕНЯЕМЫХ В ТРАНСПЛАНТАЛОГИИ Одной из важнейших задач современной регенеративной медицины является разработка технологий замены поврежденных или утраченных органов и тканей на сконструированные in vitro биоискусственные аналоги. Одним из элементов технологии создания биоискусственных органов является формирование матрикса из биосовместимых материалов, имитирующих структуру здоровой ткани. Выбор материала для матриксов обусловлен механической прочностью, эластичностью, биосовместимостью на белковом и клеточном уровнях, деградируемостью и пористостью, способностью поддерживать прикрепление, рост и пролиферацию клеток. В последние годы в этой связи наблюдается большой интерес к белкам каркасной нити пауков – спидроинам (Kim et al, 2005). Уникальные свойства белков паутины обусловлены их четвертичной структурой (Jin and Kaplan, 2003). Для изучения фолдинга спидроинов мы разработали модель in vitro (Bogush et al, 2009; Соколова с соавт., 2010). На модели было продемонстрировано, что прочность матрикса зависит не только от способа образования, но и от первичной структуры белка. В процессе образования синтетической нити происходит перестройка губчатого матрикса с образованием нанофибрилл. 36 А В Рисунок структура 19. Спиральная нанофибрилл, образованных спидроином I. (А) АСМ изображение; (Б) профиль высот, полученный с помощью АСМ; (В) ПЭМ Б изображение нано- фибриллы. Стрелки указывают на поворот спирали. (Bogush et al, 2009) С использованием АСМ и суперострого кантилевера с диаметром около 1 нм (Klinov et al, 2003) мы изучили периодическую структуру нанофибриллы (рис. 19А)6. С помощью ПЭМ показали, что нанофибриллы имеют толщину ~10 нм в широкой части и ~5 нм в узкой (стрелка на рис. 19В) и спиральную организацию, с шагом спирали ~40 нм (рис. 19В), что хорошо соотносится с данными АСМ. Линейные размеры нанофибрилл сходны с размерами амилоидных фибрилл, исследованных ранее с помощью ПЭМ (Jimenez et al, 2002; Sachse et al, 2006). Изучение моделирования сборки нанофибрилл и состоящих из них нитей в дальнейшем может дать ключ к пониманию механизма образования фибрилл в природных нитях паутины. Представленные в главе 6 результаты свидетельствуют о принципиальной возможности разработки биоматериалов с уникальными свойствами на основе рекомбинантных аналогов спидроинов путем имитации природных процессов формирования нитей паутины. ЗАКЛЮЧЕНИЕ Знание атомной структуры белковой молекулы позволяет интерпретировать функциональные изменения в молекуле в процессе ее активации и ингибирования. Для изучения структур белков, до настоящего времени не подвергшихся кристаллизации, перспективными являются комплексные методы, совмещающие структурные эксперименты с компьютерным молекулярным моделированием. При отсутствии кристаллических структур, моделирование 6 В сотрудничестве с Д.В.Клиновым, ИБХ РАН 37 может проводиться на основе выравнивания гомологичных аминокислотных последовательностей. В данном исследовании моделирование по гомологии проводилось для получения ряда структур мембранных и цитоплазматических доменов ионных каналов, а также глобулярных АСБ. Известно, что каналы эукариот достаточно гомологичны бактериальным каналам, для которых кристаллизация осуществлена более успешно (Doyle et al, 1998; Kuo et al, 2003). На современном уровне развития протеомики становится все более важным не только определение структуры и функции отдельных белков, но и оценка активности различных мутантов. В частности, мутации в генах, связанных с функционированием потенциал-зависимых ионных каналов, являются причиной таких тяжелых наследственных заболеваний, как глухота, эпилепсия (Ashcroft and Gribble, 2000; Weinreich and Jentsch, 2000; Keating and Sanguinetti, 2001), а также сердечная аритмия (Schmitt et al, 2000), рассеянный склероз (Judge and Bever, 2006) и болевой синдром (Beekwilder et al, 2002). В последние пять лет изучению молекулярного строения ионных каналов уделяется особое внимание во всем мире в связи с разработкой новых эффективных лекарств против этих болезней. Полученные нами с использованием комплексного подхода модели четвертичных структур мутантных ионных каналов Kv1, Kv2, Kv10 позволили изучить взаимное расположение и специфические взаимодействия цитоплазматических доменов этих каналов, и их роль в регуляции активности. В частности, сравнение структурных данных с результатами электрофизиологических экспериментов позволило сделать вывод о возможном влиянии цитоплазматических доменов на активацию/инактивацию каналов. Все больше данных свидетельствует о том, что наличие нанофибрилл в нитях паутины обеспечивает ее уникальные механические свойства (Bogush et al, 2008). Полученные в данном исследовании новые знания о четвертичной структуре и конформационных перестройках белков паутины – спидроинов имеют большое научное и практическое значение. Трехмерные матрицы на основе рекомбинантных спидроинов можно рассматривать в качестве перспективного материала для создания искусственных тканей и органов. Согласно имеющимся актинсвязывающих белков данным, являются нарушения в функционировании отличительной особенностью необластических клеток (Васильев, 1996; Frame et al, 2002). Недавно открытый в неметастазирующих раковых клетках белок MIM (Lee et al, 2002) и гомологичный ему белок IRSp53 представляют особый интерес для исследования, так как они 38 одновременно регулируют сборку актиновых филаментов и стимулируют образование филоподий (Yamagishi et al, 2004; Mattila et al, 2007). Результаты исследования ряда структур АСБ, представленные в данной работе, существенно дополнили и скорректировали наши представления о механизмах функционирования АСБ. Разработанный в данном исследовании комплексный подход к изучению четвертичной структуры белковых молекул на основе просвечивающей электронной микроскопии позволил получить новые молекулярные и структурные данные о строении ряда мембранных и цитоплазматических белков. Эти данные могут служить основой для дальнейших экспериментов по моделированию активации/инактивации, для планирования новых экспериментов по направленному мутагенезу и компьютерного дизайна новых лекарственных средств. ОСНОВНЫЕ ВЫВОДЫ: 1. Разработан комплексный подход к изучению четвертичной структуры белковых молекул на основе просвечивающей электронной микроскопии. 2. Получены трехмерные структуры ряда мембранных и цитоплазматических белков, до настоящего времени не подвергшихся кристаллизации. 3. С использованием трехмерных структур, моделирования по гомологии и фиттинга построены молекулярные модели ряда мембранных и цитоплазматических белков. 4. Показана принципиальная возможность использования просвечивающей электронной микроскопии в комплексе с молекулярным моделированием для изучения конформационных изменений в мембранных и цитоплазматических белках. 5. Показана возможность разработки биоматериалов с уникальными свойствами путем имитации в лабораторных условиях природных процессов формирования нитей паутины. ОСНОВНЫЕ ПУБЛИКАЦИИ ПО ТЕМЕ ДИССЕРТАЦИИ: Статьи в международных и отечественных журналах 1. O.Sokolova, L.Kolmakova-Partensky, N.Grigorieff. Three-dimensional structure of a voltage-gated potassium channel at 2.5 nm resolution. – Structure, 2001, v 9, pp. 215-220. 39 2. O.Sokolova, A.Accardi, D.Gutierrez, A.Lau, M.Rigney, N.Grigorieff. Conformational changes in the C terminus of Shaker K+ channel bound to the rat Kvbeta2-subunit. – Proc. Natl. Acad. Sci. U.S.A., 2003, v 100, pp. 12607-12612. 3. O.Sokolova. Structure of cation channels, revealed by single particle electron microscopy. FEBS Lett. 2004, v 564(3), pp. 251-256. 4. A.A.Rodal, O.Sokolova, D.Robins, S.Hippenmeyer, H.Riezman, N.Grigorieff, and B.L.Goode. Conformational changes in the Arp2/3 complex leading to actin nucleation. Nat. Struct. Mol. Biol., 2005, v 12(1), pp. 26-31. 5. E.L.Paley, L.Smelyanski, V.Malinovskii, P.R.Subbarayan, Y.Berdichevsky, N.Posternak, J.M.Gershoni, O.Sokolova, G.Denisova. Mapping and molecular characterization of novel monoclonal antibodies to conformational epitopes on NH2 and COOH termini of mammalian Tryptophanyl-tRNA Synthetase reveal link of the epitopes to aggregation and Alzheimer's disease. – Mol Immunol. 2007; 44(4):541-57. 6. E.L.Paley, G.Denisova, O.Sokolova, N.Posternak, X.Wang, and A.-L.Brownell. Tryptamine Induces Tryptophanyl-tRNA Synthetase-Mediated Neurodegeneration With Neurofibrillary Tangles in Human Cell and Mouse Models. – Neuro Molecular Medicine, 2007, v.9, pp. 55-82 7. N.Sinitsyna, I.Orshansky, O.Sokolova. Actin-binding proteins – how to reveal the conformational changes. - Journal of Bioinformatics and Computational Biology Vol. 6, No. 4, 2008, pp. 869–884 8. A.V.Pischalnikova and O.S.Sokolova. The domain and conformational organization in potassium voltage-gated ion channels. - Journal of Neuroimmune Pharmacology: Vol. 4, Iss. 1 (2009), pp 71-82. 9. Агапов И.И, Пустовалова О.Л., Мойсенович М.М., Богуш В.Г., Соколова О.С., Севастьянов В.И., Дебабов В.Г., Кирпичников М.П. Трехмерный матрикс из рекомбинантного белка паутины для тканевой инженерии. ДАН, 2009, Т. 426, № 1, cтр. 1–4 10. Пустовалова О.Л., Мойсенович М.М., Еремин П.С., Архипова А.Ю., Рамонова А.А., Соколова О.С., Богуш В.Г., Агапов И.И., Кирпичников М.П. Культивирование клеток на трехмерной матрице из рекомбинантного спидроина 1. Российский иммунологический журнал, 2009, Т. 3(12), №2, стр. 139-146. 11. V.G.Bogush, O.S.Sokolova, L.I.Davydova, D.V.Klinov, K.V.Sidoruk, N.G. Esipova, T.V.Neretina, I.A.Orchanskyi, V.Yu.Makeev, V.G.Tumanyan, K.V. Shayjtan, V.G.Debabov, M.P.Kirpichnikov. A novel model system for design of biomaterials based 40 on recombinant analogs of spider silk proteins. - J Neuroimmune Pharmacol. 2009, Vol 4(1):17-27. 12. О.С.Соколова, В.Г.Богуш, Т.В.Неретина, Д.В.Клинов, четвертичной структуры Л.И.Давыдова, В.Г.Дебабов, С.В.Полевова, М.П.Кирпичников. рекомбинантными аналогами С.А.Антонов, Формирование белков паутины. Молекулярная биология, 2010, т. 44, № 1, стр. 162-169 13. И.И.Агапов, А.С.Коньков, М.М.Мойсенович, А.Ю.Архипова, В.Г.Дебабов, Т.В.Васильева, О.С.Соколова, М.П.Кирпичников. О.Л.Пустовалова, В.Г.Богуш, Биодеградируемые В.И.Севастьянов, матриксы из регенерированного шелка Bombyx mori. Доклады академии наук, 2010, т. 433, № 5, с. 1–4 14. О.С.Соколова. Как увидеть «нано»? Природа, 2010, т.9, стр.38-43 15. Danilevich VN, Vasilenko EA, Pechnikova EV, Sokolova O.S., Grishin EV. Micro- And Nanoparticles Of Condensed DNA Produced During PCR With Taq-polymerase In Presence Of Plasmid Matrices. Mikrobiologiia. 2011 May-Jun;80(3):411-23. 16. М.Г. Карлова, А.В. Пищальникова, А.А. Рамонова, М.М. Мойсенович, О.С. Соколова, К.В. Шайтан. Тест-система для изучения фолдинга калиевых потенциал-зависимых каналов, экспрессируемых in vitro. Биофизика, 2011, т.56, вып.2, стр 272-279. 17. О.В.Левцова, И.Д.Давлетов, О.С.Соколова, К.В.Шайтан. Молекулярная динамика взаимодействий домена I-BAR белка IRSp53 с отрицательно заряженными мембранами. Биофизика, 2011, т.56, вып.2, стр 242-247. 18. Moisenovich MM, Pustovalova OL, Arhipova AY, Vasiljeva TV, Sokolova OS, Bogush VG, Debabov VG, Sevastianov VI, Kirpichnikov MP, Agapov II. In vitro and in vivo biocompatibility studies of a recombinant analogue of spidroin 1 scaffolds. J Biomed Mater Res A. 2011 96(1):125-31 19. Levtsova OV, Antonov MY, Naumenkova TV, Sokolova O.S.. Interaction of zervamicin IIB with lipid bilayers. Molecular dynamics study. Comput Biol Chem. 2011 35(1):34-9. 20. Agapov II, Moisenovich MM, Druzhinina TV, Kamenchuk YA, Trofimov KV, Vasilyeva TV, Konkov AS, Arhipova AY, Sokolova O.S., Guzeev VV, Kirpichnikov MP. Biocomposite scaffolds containing regenerated silk fibroin and nanohydroxyapatite for bone tissue regeneration. Dokl Biochem Biophys. 2011 440:228-30. 21. О.С.Соколова, К.В.Шайтан, А.В.Гризель, А.В.Попинако, М.Г.Карлова, М.П.Кирпичников. Трехмерная структура потенциал-зависимого человеческого 41 канала Kv10.2 по данным электронной микроскопии макромолекул и молекулярного моделирования. Биоорганическая химия, 2012, т. 2, стр. 1-8. 22. Maiti S, Michelot A, Gould C, Blanchoin L, Sokolova O, Goode BL. Structure and function of purified full-length formin mDia1. Cytoskeleton (Hoboken). 2012, 69(6):393405 23. M.M.Moisenovich, O.Pustovalova, J.Shackelford, T.V.Vasiljeva, T.V.Druzhinina, Y.A.Kamenchuk, V.V.Guzeev, O.S.Sokolova, V.G.Bogush, V.G.Debabov; M.P.Kirpichnikov, I.I.Agapov Tissue regeneration in vivo within recombinant spidroin1 scaffolds. J. Biomaterials 2012. 33(15):3887-98 24. А.В.Попинако, О.С.Соколова. Как предсказать неизвестную структуру белка. Природа, 2012, т. 7, стр. 33-38. Учебные пособия и монографии 25. О.С.Соколова Электронная микроскопия макромолекул. Сборник спецкурсов п/ред. М.П.Кирпичникова и К.В.Шайтана. М., 2007, стр 218-224. 26. О.С.Соколова, А.Г.Богданов, А.В.Гризель. Электронная микроскопия нанобиообъектов. М.: НОУДПО «Институт АйТи», 2011, -142 с. 27. Соколова О.С., Шаров Г.Г., Уласова Н.Ю., Печникова Е.В., Давлетов И.Д., Докрунова А.А. Архитектура актинсвязывающих белков и их полиморфизм при онкозаболеваниях. Сборник «Постгеномные методы исследования», 2011, стр.464491. Тезисы международных и отечественных конференций 28. Sokolova, O; Grigorieff, N. Physical location of T1 domain in the Shaker potassium channel. // Journal of general physiology 2000 Volume: 116 Issue: 1 Pages: 5A-6A 29. Kolmakova-Partensky, L; Sokolova, O; Miller, C, et al. Expression and purification of two cysteine mutants of Shaker potassium channel for EM gold labeling. // Biophysical Journal 2001 Volume: 80 Issue: 1 Part 2 30. Pages: 372A Sokolova, OS; Paley, EL Human Tryptophanyl-tRNA synthetase-derived peptides are linked to fibril formation and neurodegeneration // FEBS Journal 2005 V272 Pages: 537-538 31. Sokolova, O; Maiti, S; Grigorieff, N, et al Conformational changes in actin- binding proteins, revealed by single particle electron microscopy. // FEBS Journal 2007 V274 Pages: 107-107 42 32. Khasigov, P; Grachev, S; Kovalyov, L, et al. Glycoproteomic approach to the search of biomarkers in blood serum at prostate cancer. // FEBS Journal 2008 Volume: 275 Pages: 245-245 33. Sokolova, O; Bogush, V; Davydova, L, et al. The nanofibrils formation by the recombinant analogs of spidroins I and II // FEBS Journal 2008 V275 Pages: 372 34. Пищальникова А.В, Соколова О.С. Локализация С-концевых цитоплазматических доменов человеческого канала Kv2.1. // Сборник тезисов докладов Международного конкурса научных работ молодых ученых в области нанотехнологий. – М.: Роснано, 2008. –с.493-494 35. Sharov G.G., Sokolova O.S. Exploration the structure of N-terminus of recombinant CAP protein. // The reports of the third student symposium on bioengineering 25 October 2008. – Moscow: MSU press, 2008. p. 39-43 36. Пищальникова А.В., Соколова О.С. Локализация цитоплазматических доменов человеческого канала Kv2.1. // Сборник тезисов. Первая международная конференция 17-19 июня 2008 г. Современные достижения бионаноскопии.– М.: изд-во Физического факультета МГУ, 2008. – с.45 37. Карлова М.Г., Пищальникова А.В., Рамонова А.А., Мойсенович М.М., Соколова O.C. In-vitro флуоресцентный тест на правильность фолдинга калиевого потенциал-зависимого канала // Сборник тезисов. Вторая международная конференция 16-18 июня 2009 г. Современные достижения бионаноскопии. – М.: изд-во Физического факультета МГУ, 2009. – с.30 38. Sharov G.G., Chaudry F.A., Goode B.L., Sokolova O.S. Reconstruction of N- terminus of recombinant CAP/SRV2 protein, which participates in actin cytoskeleton turnover. // International Competition of scientific papers in nanotechnology for young researchers.- Moscow: Rusnano, 2009. p.837-838 39. Пищальникова А.В., Карлова М.Г., Рамонова А.А, Мойсенович М.М., Соколова О.С. Разработка флуоресцентного теста in-vitro на правильность фолдинга калиевых потенциал-зависимых каналов // Тезисы докладов четвертого студенческого симпозиума по биоинженерии 30 октября 2009. - М.: изд-во МГУ, 2009. – с.45-48. 40. Пищальникова А.В., Карлова М.Г., Рамонова А.А, Мойсенович М.М., Соколова О.С. Флуоресцентный метод скрининга лигандов калиевых потенциалзависимых каналов // Перспективы развития инноваций в биологии: Материалы III научно-практической конференции, 11-13 ноября 2009 г., Москва, МГУ имени М.В.Ломоносова, Биологический факультет. – М.: МАКС пресс, 2009. – с. 134 – 135. 43 41. Соколова О.С. Доменная организация и конформационные изменения белков, ассоциированных с клеточной поверхностью. Сборник трудов IV Российского симпозиума «Белки и пептиды» - Казань, 2009 с. 89 42. Sharov G.G., Chaudhry F.A., Goode B.L., Sokolova O.S. 3D-reconstruction of the structure of recombinant actin binding C-CAP domain using electron microsopy. // The reports of the Fourth International Conference «Progress and trends in BIONANOSCOPY» The MSU faculty of physics, 2010. p. 83-84 43. Пищальникова А.В., Соколова О.С. Получение потенциал-зависимого калиевого канала Heag2 для структурных исследований. Современные проблемы биохимии и биохимии и бионанотехнологии. Сборник трудов Всероссийской Виртуальной Интернет-конференции. Казань, 17-22 Ноября 2010 г. – Казань. Издательство Казанского Университета с. 129 – 131. 44. Соколова О.С., Карлова М.Г., Пищальникова А.В., Браже Н.А., Казакова Т.А., Новоселецкий В.Н., Максимов Г.В., Шайтан К.В. Изучение взаимодействия белков потенциал-зависимых ионных каналов человека с блокаторами, перспкетивными для создания фармакологических препаратов направленного действия // Труды первой международной научно-практической конференции «Постгеномные методы анализа в биологии, лабораторной практике и клинической медицине» М.,2010, Стр.114-115. 45. G.G.Sharov, F.A.Chaudhry, B.L.Goode and O.S.Sokolova Three-dimensional Structure and Oligomeric State of the N-terminal Peptide of CAP/Srv2 Complex Microscopy and Microanalysis, 2011, V17, Iss S2, pp 128 – 129. 46. O.S.Sokolova, E.L.Paley. Axon Loss and Mitochondria Damage in Mice brain after Tryptamine Treating. Microscopy and Microanalysis, 2011, V17. Iss S2, pp 186 – 187. 47. Шайтан К.В., Соколова О.С., Кирпичников М.П. Структурные и энергетические аспекты взаимодействия белков потенциал-зависимых каналов человека с лигандами (блокаторами). Сборник трудов V Российского симпозиума «Белки и пептиды» - Петрозаводск, 2011 с. 89 48. O.Sokolova, Y.Efremov, A.Dokrunova, O. Vorontsova, D.Bagrov inactivation of actin-binding protein affects elastic properties of eucaryotic cells. // International Jeque Monod Conference “Molecular basis for membrane remodelling and organization” CNRS, Strasbourgh, France. 2011, P. 59 49. Шаров Г.Г., Гуде Б.Л., Чаудри Ф.А., Соколова О.С. Реконструкция N- концевого фрагмента рекомбинантного 44 CAP/SRV2-белка, участвующего в обновлении актинового цитоскелета клетки. // Труды 5 интернациональной конференции «Успехи Бионаноскопии» М., 2011, Стр. 66-67. 50. Ю.М. Ефремов, А.А. Докрунова, Д.В. Багров, К.В. Шайтан, О.С. Соколова Атомно-силовая микроскопия как инструмент для измерения механических свойств клеток // Россия, Москва, Современные достижения бионаноскопии, Шестая международная конференция, сборник тезисов. – 2012. с. 22. 51. Ю.М. Ефремов, А.А. Докрунова, Д.В. Багров, О.В. Воронцова, К.В. Шайтан, О.С. Соколова Сравнение механических свойств нормальных и раковых клеток методом атомно-силовой микроскопии // Россия, Москва, Цитоморфометрия в медицине и биологии: фундаментальные и прикладные аспекты, V Всероссийская научно-практическая конференция, материалы. –2012. с. 39-40 45 Благодарности Выражаю искреннюю благодарность моим коллегам за плодотворное сотрудничество, постоянную поддержку и доброжелательную критику, без чего эта работа не могла бы состояться: М.П.Кирпичникову, К.В.Шайтану, В.О.Попову, Т.В.Калебиной, Г.Н.Давидовичу, И.И.Агапову, М.М.Мойсеновичу, А.В.Гризель (Пищальниковой), Н.Ю.Уласовой (Синицыной), Д.В.Багрову, М.Г.Карловой, Г.С.Глухову, В.Н.Новоселецкому, Е.С.Трифоновой, И.Д.Давлетову, О.В.Левцовой, Г.Г.Шарову, А.А.Докруновой, А.К.Шайтану, А.В.Попинако, Т.Б.Станишневой-Коноваловой, А.Г.Богданову, С.В.Полевовой, Т.В.Неретиной, (Биологический факультет МГУ), Н.А.Киселеву, Е.В.Печниковой (ИКРАН), Christopher Miller, Nikolaus Grigorieff, Bruce Goode, Ludmilla KolmakovaPartensky, Ludmilla Reshetnikova, Chen Xu, Matthias Wolf, Duncan Sousa (Brandeis University), В.Г.Богушу (ГосНИИГенетика), Д.В.Клинову (ИБХ), Dennis Wray, Louisa Stevens, Peter Henderson (Leeds University), Anna Moroni, Giorgio Scita (Milano University), Pekka Lappalainen (University Helsinki), Elena Paley (Nova University). Также я благодарю моих родных и близких за постоянную поддержку и понимание. Исследования, результаты которых представлены в диссертации, были поддержаны грантами РФФИ (№№ 07-04-12172, 08-04-01348, 08-04-91125, 08-0491759, 09-04-12146, 09-04-11518 и 11-04-11511), а также грантами CRDF (№ 2918), 7 Рамочной программы Евросоюза (EDICT, № 201924), Минобрнауки (ГК №№ 14.740.11.0255, 16.740.11.0373 и 14.740.11.0760) и междисциплинарной программы МГУ «Молекулярно-генетические основы заболеваний человека» (№ гос.рег. 01200955935). Автор являлась лауреатом стипендий фонда McNair (1999) и фонда Jane Coffin Childs (2000-2002), была награждена дипломом фонда «Культурная инициатива» за разработку обучающей базы данных и дипломами Рособразования РФ за руководство студенческими научными работами (2009, 2010). В 2012 г. автор стала лауреатом конкурса «Авангард Знаний» компании Астразенека. 46