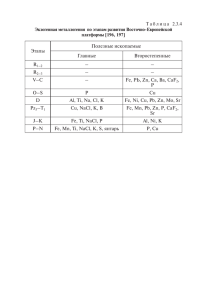
dissertation Skorkina M Yu - Астраханский государственный
advertisement

Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Белгородский государственный национальный исследовательский университет» На правах рукописи СКОРКИНА Марина Юрьевна МОРФОФИЗИОЛОГИЧЕСКИЙ АНАЛИЗ МЕХАНИЗМОВ РЕГУЛЯЦИИ ОБЪЕМА КЛЕТОК КРОВИ 03.03.01 - физиология Диссертация на соискание ученой степени доктора биологических наук Научный консультант Доктор биологических наук, профессор А.В. Муравьев Белгород - 2014 2 Оглавление ВВЕДЕНИЕ ................................................................................................................................ 4 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ ......................................................................................... 31 1.1. Физиологические основы регуляции объема клеток……………………...........31 1.1.1. Транспорт электролитов и регуляция клеточного объема................................ 32 1.1.2 Участие органических осмолитов в объемном гомеостазе клетки .................. 35 1.1.3 Волюмодетекторные и волюмоэффекторные механизмы регуляции объема клеток ................................................................................................ 37 1.1.4 Роль Са2+-сигнальных путей в регуляции объема клеток крови ......................... 41 1.1.5 Роль аденилатциклазных путей в регуляции объема клеток .............................. 46 1.2. Структурно-функциональная организация ядра и его участие в регуляции объема клетки………………………………………………………...……50 1.3. Цитоархитектоника клеток крови………………………………………….……54 1.3.1 Структурно-функциональная организация цитоскелета клеток крови ...................................................................................................................... 54 1.3.2 Топография клеток крови ....................................................................................... 60 1.3.3 Участие белков цитоскелета в образовании рельефа клеточной поверхности ................................................................................................... 63 1.3.4 Использование инструментария атомно-силовой микроскопии в исследовании цитоархитектоники клеток ................................................................. 67 ГЛАВА 2. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ...................................... 71 2.1. Морфофункциональные свойства лимфоцитов доноров и больных ХЛЛ………………………………………………………………………….71 2.1.1. Особенности цитоархитектоники и упруго-эластические свойства лимфоцитов доноров и больных ХЛЛ в физиологических условиях ............................. 71 2.1.2. Особенности цитоархитектоники и упруго-эластические свойства лимфоцитов доноров и больных ХЛЛ под влиянием функциональных нагрузок ......................................................................... 74 2.2. Регуляция объема лимфоцитов в тестах с осмотической нагрузкой (in vitro)…………………………………………….............84 2.2.1. Реакции осморегуляции лимфоцитов доноров ..................................................... 84 2.2.2. Влияние функциональных нагрузок на реакции регуляции объема лимфоцитов доноров в осмотических тестах (in vitro).............................................. 88 2.2.3 Реакции осморегуляции лимфоцитов больных ХЛЛ ........................................... 121 2.2.4. Влияние функциональных нагрузок на реакции регуляции объема лимфоцитов больных ХЛЛ в осмотических тестах (in vitro) ................................... 126 3 2.3. Цитоархитектоника лимфоцитов здоровых доноров и больных ХЛЛ в условиях гипоосмотической и функциональных нагрузок (in vitro)…………...…163 2.3.1 Рельеф поверхности лимфоцитов доноров в условиях гипоосмотической нагрузки ....................................................................... 163 2.3.2 Рельеф поверхности лимфоцитов больных ХЛЛ в условиях гипоосмотической нагрузки .......................................................................................... 169 2.3.3 Рельеф поверхности лимфоцитов доноров под влиянием функциональных нагрузок ....................................................................... 175 2.4. Морфофункциональные свойства эритроцитов лягушек……………...………..199 2.4.1. Особенности цитоархитектоники и упруго-эластические свойства эритроцитов лягушек ................................................................................... 199 2.4.2. Особенности цитоархитектоники и упруго-эластические свойства эритроцитов лягушек в условиях функциональных нагрузок ................... 202 2.4.2. Влияние Са2+ и верапамила на цитоархитектонику эритроцитов лягушек .................................................................................................... 205 2.5. Регуляция объема эритроцитов лягушек в тестах с осмотической нагрузкой (in vitro)…………………………………………………..208 2.5.1. Реакции осморегуляции эритроцитов лягушек .................................................. 208 2.5.2 Влияние функциональных нагрузок на реакции регуляции объема эритроцитов лягушек в осмотических тестах (in vitro)……………………...…….216 2.6. Цитоархитектоника эритроцитов лягушек в условиях гипотонической и функциональных нагрузок…………………………………..……256 2.6.1. Цитоархитектоника эритроцитов лягушек в условиях гипоосмотической нагрузки (in vitro) ............................................................................................................. 256 2.6.2 Цитоархитектоника эритроцитов лягушек под влиянием функциональных нагрузок ....................................................................... 262 Глава 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ ........................................ 286 ВЫВОДЫ ................................................................................................................................ 315 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ............................................................................... 317 СПИСОК СОКРАЩЕНИЙ ................................................................................................... 318 Список литературы ................................................................................................................ 319 4 ВВЕДЕНИЕ Актуальность темы исследования. В клеточном гомеостазе большее значение имеет сохранение объема и формы клеток. Сущность этой стратегии живых клеток представляет собой комплекс фундаментальных физиологических механизмов, которые были эволюционно выработаны и закреплены в адаптивном поведения клеточных популяций. Существенное изменение объема клеток является важным критерием, указывающим на трансформацию функционального состояния ткани, органа и организма в целом. Так, например, увеличение клеточного объема в условиях гипоосмотической нагрузки сопровождается активацией механизмов регуляции клеточного деления (McManus M.J. et al., 1995), экспрессии генов (Yancey P.H., 1994; Burg M.B. et al., 1997), синтеза белков (Stoll B. et al., 1992; Low S.Y. et al., 1996), апоптоза (Широкова А.В., 2007; Замай Т.Н., 2011). Тесная взаимосвязь между морфологией клетки и ее функциональным состоянием прослеживается не только в высокоспециализированных клеточных популяциях, но и описана исследователями в опухолевых недодифференцированных клеточных линиях (Holt P.J.L et al., 1972; Замай Т.Н., 2011; Казарян П.А. с соавт., 2011). В связи с этим особую актуальность приобретает проблема изучения регуляции объема клеток на основе адекватной кооперации регуляторных подсистем, одним из звеньев которых выступают элементы цитоскелета, определяющие морфологию клетки и свойства ее мембранного аппарата. Концепция работы основана на идее о привлечении в регуляцию объема клетки дополнительных мембранных структур, которые могут быть представлены образованиями плазмалеммы, например, в лимфоцитах (складками, филоподиями, ламелоподиями и т.д.), либо внутриклеточным резервным бассейном, например, в клетках, лишенных складчатости, но адгезирующих и перемещающихся на субстрате (фибробластах). Можно предполагать, что элементы цитоскелета выступа- 5 ют одновременно морфологической основой и центральным механизмом подсистемы регуляции объема на клеточном уровне. С одной стороны структуры цитоскелета участвуют в молекулярных механизмах передачи внутриклеточного сигнала и регуляции экспрессии генов (Percipalle P., Visa N., 2006; Fazal F. et al., 2007), контролируют работу мембранных каналов и транспортеров (Mazzocci C. et al., 2006), обеспечивают контакт клеток с субстратом и межклеточные контакты (Kellouche S. et al., 2010), движение (Leroy-Dudal J. et al., 2005), экто- и эндоцитоз, поддерживают форму клеток (Egea G. et al., 2006). Кроме того определенная жесткость подмембранного каркаса, позволяет клеткам использовать запасы мембранного материала, с целью сохранения морфологической целостности, а, следовательно, и выживания как здоровой, так и опухолевой клетки при действии экстремальных факторов среды. Следовательно, этот комплекс реакций клетки можно рассматривать как ее срочный адаптивный ответ, направленный на сохранение оптимального объёма и формы в данных условиях функционирования. Таким образом, описанные клеточные события укладываются в рамки важнейшей концепции физиологии – концепции адаптации (Эккерт Дж. С соавт., 1989). Степень разработанности темы исследования. В современной физиологии общепризнанной является модель ионной основы регуляции объема клеток в условиях гипотонии, которая лучше всего изучена на эритроцитах (Kregenow F.M. 1971; Cala P.M., 1980) и лимфоидных клетках (Roti-Roti L.W., Rothstein A., 1973). Клетки осуществляют регуляцию объема посредством мембранных переносчиков, изменяющих внутриклеточных концентраций K+, Na+,Cl- (Grinstein S., Foskett J.K., 1990; Okada Y. et al., 2009; Fahlke C., Ficher M., 2010), а также цитозольного Са 2+, запускающего полифосфатидилинозитный цикл (Орлов С.Н. с соавт., 1988; Авдонин П.В., Ткачук В.А., 1994). Показано, что работа ионных транспортеров регулируется с участием молекулярных сигнальных путей – аденилатциклазным (Эккерт Дж. с соавт., 1991; Tuvia S. et al., 1999; Kaloyianin M., Doukakis I., 2003) и Са2+-сигнальным (Ткачук В.А., 2001; Mohanty M.J. et al., 2001), которые реализуются с участием элементов цитоскелета. 6 Данные литературы об исследовании роли мембранного резерва в регуляции объема клеток разного типа фрагментарны и не оформлены в строгие теории и концепции. Имеются сведения об использовании мембранного резерва при образовании псевдоподий, миграции клеток (Чернявских С.Д. с соавт., 2012), формировании фагосом (Федорова М.З. с соавт., 2007), пассаже лейкоцитов через обменные капилляры, диаметр которых меньше размеров клетки (Федорова М.З., Левин В.Н., 2001; Tran-Son-Tay R., Nash G., 2007). Было показано, что величина мембранного резерва варьирует в зависимости от типа клеток и метода измерения. Мембранный резерв фибробластов составляет около 1% (Raucher D., Sheetz M., 1999), лимфоцитов - около 70% (Ross P.E., 1994), нейронов - находится в пределах от 50% до 300% (Wan X. et al., 1995), ооцитов Xenopus – более 500% (Zhang Y., Hamill O.P., 2000). В литературе имеются немногочисленные данные, свидетельствующие об участии микрофиламентов клетки в использовании ее мембранного резерва. В частности показано, что нарушение белковых взаимодействий цитоскелета увеличивает доступный мембранный резерв, используемый клетками, в то время как прирост плотности микротрубочек его снижает (Raucher D., Sheetz M., 1999). Как было сказано выше, одним из механизмов управления объемом клеток является осморегуляция. Несмотря на проведенные многочисленные исследования осморегуляторных реакций разных типов клеток (Карагодина З.В., 1984; Федорова М.З., 2001; Шпаков А.О., 2007; Shindo M. et al., 2000; Mohanty M.J., 2001; Bobak N., et al., 2011; Andronic J et al., 2013), в настоящее время остается не изученными точные механизмы поддержания клеточного объема и восстановления формы за счет использования поверхностных и внутриклеточных мембранных резервных бассейнов. Остается неясным, какая величина резерва, заложенного в складчатости клеточной мембраны, например, лимфоцита, и как она может быть использована в физиологических реакциях отдельных клеток и скоординированной тканевой адаптации. Кроме того, не установлена связь между изменением упруго-эластических свойств клеток и реализацией мембранного резерва в условиях адаптивного изменения объема и формы клеток. Остается не исследованным 7 влияние особенностей морфологии клеточной поверхности на физиологические реакции клеток в процессе их адаптации к действию различных факторов. Особый интерес, в этой связи, представляет количественная оценка запаса мембранного материала в недодифференцированных опухолевых клетках крови, для которых установлена значительная осмотическая устойчивость в гипотонической среде (Holt P.J.L., 1972; Васильев А.А. с соавт., 1995). Кроме того, остается открытым эволюционный вопрос о том, участвует ли мембранный резерва клеток низших позвоночных в регуляции их объема. Так, на эритроцитах лягушек, хорошо изучены механизмы ионной регуляции объема (Cala M.P., 1980; Gusev G.P.et al., 1997; 1999; Ziegler J.J., 2012). Однако известно, что в состоянии анабиоза (в зимний период жизненного цикла), при котором снижена функция выделительных органов, в организме накапливаются осмолиты и электролиты, что создает условия для изменения осмотического давления внеклеточной жидкости. Можно предположить, что эритроциты лягушек должны обладать механизмами регуляции, позволяющими им быстро реагировать на изменения осмолярности среды для адаптивного поддержания оптимального объема эритроцитов и клеток организма в целом. Таким образом, актуальность исследования адаптивных реакций, направленных на оптимизацию клеточного объема и формы обусловлена теоретическим и практическим интересом. Теоретическая значимость работы связана с изучением клеточных механизмов срочной адаптации, направленной на регуляцию объема дифференцированных и незрелых, например, опухолевых клеток крови, что является важным для понимания тканевых и органных изменений в условиях нормы и патологии. Практический аспект связан с выяснением роли элементов цитоскелета в механизмах использования дополнительных мембранных структур, что позволит расширить поиск физиологически активных веществ и химических соединений, которые могут быть основой для разработки лекарственных препаратов для диагностики и коррекции нарушений механизмов поддержания клеточного объема, а, следовательно, для нормализации функций тканей и органов. 8 С учетом вышесказанного была сформулирована цель исследования и поставлены основные задачи. Цель работы: исследование морфофизиологических механизмов поддержания объема, как важного элемента клеточного гомеостаза, на моделях осмотической нагрузки клеток крови в норме и при патологии Задачи исследования: 1. Изучить морфофизиологические особенности изменения объема клеток, на модели осмотической нагрузки субпопуляций лимфоцитов здоровых доноров и больных хроническим лимфобластным лейкозом. 2. Выявить морфофункциональные особенности клеточной поверхности лимфоцитов здоровых доноров и больных лейкозом. 3. Исследовать взаимосвязь между упруго-эластическими свойствами и морфологическими характеристиками лимфоцитов здоровых доноров и больных лейкозом. 4. Выявить механизмы, определяющие интенсивность использования дополнительных мембранных структур лимфоцитами здоровых доноров и больных лейкозом при увеличении и снижении жесткости клеточной поверхности. 5. Изучить особенности регуляции объема клеток крови низших позвоночных на модели осмотической нагрузки эритроцитов лягушки и оценить интенсивность использования ими мембранного резерва при изменениях жесткости клетки. Научная новизна Были разработаны модели для изучения изменений объема клеток и с помощью адекватного метода - атомно-силовой микроскопии (АСМ) исследованы морфофизиологические особенности лимфоцитов здоровых доноров и больных хроническим лимфобластным лейкозом. Получены новые данные, которые свидетельствуют о том, что снижение жесткости клеточной поверхности в опухолевых клетках сопряжено с перестройками ее структуры и может быть использовано в 9 качестве прогностического критерия при диагностике и лечении больных лейкозом. Новизна исследования заключается в том, что при изучении морфофизиологических реакций форменных элементов крови, данные получены на специально разработанных клеточных моделях, в условиях приближенных к in vivo, за счет использовании, влажной камеры для клеток, которая дает возможность избегать их фиксации во время сканирования методом АСМ. Это позволило получить новые данные и детально изучить морфологию мембраны нефиксированных клеток и выявить взаимосвязь между изменением упруго-эластических свойств мембранной поверхности и характером «рисунка» ее рельефа. Впервые установлена зависимость между использованием мембранного резерва в механизмах регуляции объема и упруго-эластическими свойствами лимфоцитов человека. Показано, что основным фактором, регулирующим использование мембранного резерва лимфоцитами здоровых лиц, является жесткость клеточного каркаса. В тоже время, для не полностью дифференцированных лимфоцитов больных ХЛЛ, а также для эритроцитов низших позвоночных (лягушек) жесткость не является однозначным лимитирующим фактором, регулирующим использование мембранных структур в физиологических реакциях. Теоретическая и практическая значимость работы Выполненное исследование содержит новые сведения об использовании клетками мембранных резервных структур в механизмах поддержании объемного гомеостаза. Полученные данные имеют важное теоретическое и практическое значение в оценке клеточных реакций и прогнозировании течения адаптационного процесса при воздействии разных, в том числе и экстремальных, факторов среды. Разработка и использование, в качестве наномеханического сенсора, модифицированных кантилеверов, созданных на основе полимерных микросфер, позволило получить новые объективные данные об упруго-эластических свойствах мягких биологических структур. Усовершенствованный и апробированный инструментарий на базе атомно-силовой микроскопии, дает возможность изучать 10 морфофункциональные профили нативных клеток крови и может быть рекомендован к применению в специально оборудованных клинико-диагностических лабораториях. Получение объективных данных о свойствах клеточных систем стало возможным благодаря созданию влажной камеры (патент на полезную модель РФ 98248), позволяющей сканировать клеточные поверхности на воздухе в полуконтактном режиме. А также благодаря разработке «Способа исследования нативных клеток крови» (патент РФ 2398234) и «Способа определения упругости клеток крови» (патент РФ 2466401). Комплексное исследование особенностей рельефа поверхности и жесткости как меры упругости лимфоцитов, позволяет на ранних стадиях диагностировать нарушение процессов дифференцировки и созревания форменных элементов крови, а также контролировать результаты терапевтических процедур, направленных на уничтожение аномальных клонов клеток. Перспективность использования разработанного подхода подтверждают результаты исследования крови больных ХЛЛ. Полученные данные о снижении упругости лимфоцитов больных лейкозом могут быть использованы в качестве диагностического и прогностического критерия при развитии опухолевых процессов в организме. Ядерные эритроциты лягушек, как клеточные модели, можно использовать в медико-биологических экспериментах для изучения клеточных механизмов морфофизиологических реакций. Результаты исследования используются в учебном процессе на кафедре анатомии и физиологии живых организмов НИУ «БелГУ» при написании учебных и методических пособий по дисциплинам: «Цитология» для студентов направления подготовки 020201.65 – Биология-Химия; 020200.62 – Биология; «Цитология и гистология» для студентов направления подготовки 020208.65 - Биохимия; «Иммунология» для студентов направления подготовки 020201.65 – Биология; 020208.65 – Биохимия; «Физиология крови» для магистрантов по направлению 020200.68.01 – Физиология человека и животных. 11 МЕТОДОЛОГИЯ И МЕТОДЫ ИССЛЕДОВАНИЯ Объект исследования, организация эксперимента Работа выполнена на базе кафедры анатомии и физиологии живых организмов НИУ БелГУ. Проведено 4 серии исследований, в двух из которых изучена кровь людей – здоровых доноров (200 обследованных) и больных хроническим лимфобластным лейкозом (ХЛЛ) (100 обследованных), в двух других – кровь лягушек Rana Ridibunda Pall. (200 особей). В первой серии экспериментов изучали динамику осморегуляторных реакций лимфоцитов здоровых доноров и больных ХЛЛ, а также зависимость между интенсивностью использования резервных бассейнов клетками в осмотических тестах in vitro и жесткостью клеточной поверхности. В экспериментальной части работы использовали венозную кровь здоровых доноров (100 человек) в возрасте от 25 до 45 лет, проходивших диспансеризацию на базе областной клинической больницы г. Белгорода. Исследована кровь больных ХЛЛ (50 человек) в возрасте от 17 до 46 лет, находящихся на лечении в гематологическом отделении областной клинической больницы г. Белгорода. Во второй серии исследований изучали особенности рельефа поверхности лимфоцитов здоровых доноров и больных ХЛЛ в фазу регуляторного увеличения и уменьшения объема клеток при проведении осмотической нагрузки in vitro. В работе использована кровь 100 здоровых доноров, в возрасте от 25 до 45 лет и кровь 50 больных ХЛЛ, в возрасте от 17 до 32 лет. В третьей серии изучали осморегуляторные реакции эритроцитов лягушек при проведении осмотических тестов in vitro, а также зависимость между интенсивностью использования резервных мембранных структур и жесткостью клеточной поверхности. Экспериментальная часть работы выполнена на половозрелых самцах лягушек Rana Ridibunda Pall. массой 42±2,0 г (100 особей). Опыты проведены в период физиологического анабиоза (январь-февраль), животных содержали при температуре +2 - +30 С, в стеклянных садках, наполненных водой на 3-5 см. Воду меняли ежедневно. Исследования выполнены с соблюдением всех требований Хельсинкской декларации по гуманному обращению с животными 12 (Хельсинкская декларация этических принципов, 2008) и директивами Совета Европейского Сообщества по защите животных, используемых в экспериментальных и других научных целях. Эритроциты лягушек использованы в качестве модельных объектов, которые обладают механизмами регуляции объема клеток, позволяющими им быстро реагировать на изменения осмолярности среды. Зимуя в состоянии анабиоза, во время которого снижена функция выделительных органов, в организме накапливаются осмолиты и электролиты, что создает условия для изменения осмотического давления внеклеточной жидкости. Кроме того, выбор периода анабиоза для изучения морфофизиологических свойств эритроцитов связан со стабильным клеточным составом эритроидного ростка кроветворения. Годовой жизненный цикл лягушек делится на две контрастные фазы: активную, включающую в себя размножение, питание и подготовку к зиме, и неактивную, когда животное, по данным электрофизиологических исследований (Карманова И.Г. с соавт., 1984), находится в одной из трех форм сна. По данным литературы в весенне-летний период в периферической крови бесхвостых амфибий присутствуют молодые эритроидные формы (базофильные и полихроматофильные эритробласты, нормобласты) на различных стадиях митоза, увеличивается содержание безъядерных форм (Хамидов Д.Х. с соавт., 1978). Весной в процесс эритропоэза вовлекаются красный костный мозг, печень, селезенка, стенка кишечника и почки. С наступлением осени процесс дифференцировки эритроидного ряда в гемопоэтических очагах немного ускоряется (Гольдберг Д.И. с соавт., 1973). В осенне-зимний период ведущую роль в гемопоэзе выполняет селезенка и стенка кишечника. Костный мозг становится центром кроветворения в поздневесенний и раннелетний период, к осени часть костного мозга замещается жировой тканью (Заварзин А.А., 1953). По данным собственных наблюдений в осенний период у лягушек учащается амитотическое деление зрелых эритроцитов (рисунок 1). 13 2 1 3 4 Рисунок 1 – Мазок периферической крови лягушек в период затухания гемопоэза Увеличение Х1600 1 – эритроцит, 2 – эритроцит, делящийся амитозом, 3 – безъядерный эритроцит; 4 – полихроматофильный нормобласт Описанные процессы регулируются высшими отделами центральной нервной системы – гипоталамусом, активность которого угнетается в зимний период. В результате наиболее существенно изменяется интенсивность эритропоэза, связанного со сложными ферментативными процессами гемоглобинообразования (Хамидов Д.Х. с соавт., 1978). В четвертой серии исследований изучали особенности цитоархитектоники эритроцитов лягушек в фазу регуляторного увеличения и уменьшения объема клеток при проведении осмотической нагрузки in vitro. Экспериментальная часть работы выполнена на половозрелых самцах Rana Ridibunda Pall., массой 46,24±1,9 г (100 особей), находящихся в состоянии физиологического анабиоза. Обоснование методик исследования Морфологической основой в поддержании объемного гомеостаза клеток выступает резерв мембраны, заложенный в ее складчатости (Зацепина Г.Н., с соавт.,1984; Тарасова И.М., 1985; Федорова М.З., Левин, 2001). Его биологическая роль, помимо активации волюмо-чувствительных путей транспорта ионов, заключается также в реализации механизмов рецепториндуцированного эндоцитоза (Pastan I., Willingham M.C., 1981; Steinman R.M. et al., 1983), специфических видов клеточной подвижности, в том числе и фагоцитоза (Федорова М.З. с соавт., 2007), 14 активации и стимуляции внутриклеточных метаболических реакций (Minton A.O., 2005; Al-Habori M., 2001). В качестве объектов исследования выбраны полноценные дифференцированные ядерные клетки крови (лимфоциты доноров и эритроциты лягушек), находящиеся в фазе G0, вышедшие из клеточного цикла. Лимфоциты больных ХЛЛ, также находятся в фазе G0, однако они представляют популяцию незрелых клеток, в которых на уровне ранних В-лимфоцитов происходит блокировка в их дальнейшей дифференцировке (Должиков А.А. с соавт., 2002; Воробьев И.А. с соавт., 2005; Ермолин А.Э., 2008). Эритроциты лягушек использованы в качестве модельных объектов, в которых хорошо изучены механизмы ионной регуляции объема (Cala M.P., 1980; Gusev G.P.et al., 1997; 1999; Ziegler J.J., 2002), однако работ посвященных изучению участия дополнительных мембранных структур в регуляции объема в доступной литературе не представлено. Цитоскелет эритроцитов лягушек содержит многие структурные компоненты характерные для делящихся клеток (Gambino J. et al., 1985). Выявление взаимосвязи между интенсивностью использования различных бассейнов резервных структур клетки и упругоэластическими свойствами мембран полноценных ядерных клеток продиктовано стремлением сравнить эволюционно закрепленные механизмы реагирования биологических систем разных уровней организации на снижение осмолярности среды. В связи с тем, что в задачи исследования входило изучения динамики объемной регуляции полноценных ядерных клеток крови, проводился соответствующий отбор и модификация объективных методов исследования. Для оценки относительной величины мембранного резерва клеток крови применяли динамическую пробу в виде осмотической нагрузки in vitro. При проведении нагрузок в качестве гипотонической среды для эритроцитов лягушки была выбрана концентрация хлорида натрия 0,2%, а для лимфоцитов человека – 0,4% хлорида. Выбор указанных концентраций обусловлен разной чувствительностью клеток низших и высших позвоночных животных к коллоидно-осмотическому лизису. Использованные концентрации хлорида натрия являются умеренно гипотоническими и со- 15 ответствуют предгемолитической стадии увеличения объема до порогового уровня (Бессонова С.В. с соавт., 2004), когда в регуляцию объема вовлечен мембранный резерв поверхностных запасов плазмалеммы, что согласуется с данными представленными в литературе (Головко С.И., 2010). В механизмах регуляции объема клеток потенциально важны элементы цитоскелета: они придают мембране свойства напряженности и метастабильности, кроме того, актин и актиноподобные белки, обладая сократимостью, могут маскировать и модифицировать осмотическое поведение клетки (Mills J.W., 1987). Следовательно, нормализация объема зависит не только от концентрации ионов, создаваемой работой соответствующей транспортной системы, но также от упруго-эластических характеристик мембраны и подмембранных белков. Макромолекулы цитоскелета обеспечивают высокую чувствительность клетки к изменению объема и препятствуют свободному току воды (Chen J. et al., 1994). С целью выявления зависимости между упруго-эластическими свойствами и интенсивностью использования резервных бассейнов клетками в осмотических тестах in vitro, в проведенном исследовании использован метод функциональных нагрузок, включающий инкубацию клеточных суспензий с адреналином, обзиданом, хлоридом кальция и верапамилом. Выбор указанных веществ связан с их непосредственным влиянием на элементы универсальных регуляторных сигнальных путей – аденилатциклазного (Kaloyianin M., Doukakis I., 2003) и Са2+-сигнального (Sechi S.A., Wehland J., 2000; Mohanty M.J. et al., 2001). В частности, использование адреналина и обзидана в качестве неселективного блокатора β-адренорецеторов, обусловлено участием βадренорецепторов в модуляции упруго-эластических свойств клеточной мембраны, посредством фосфорилирования белков цитоскелета (Tuvia S. et al., 1999). Известно, что β-адренергические рецепторы признаны основными подтипами адренергических рецепторов, присутствующими на поверхности лимфоцитов (Landmann R., 1992). Плотность их на мембране лимфоцитов составляет 10003000 (Tuvia S. et al., 1999). 16 Использование неселективного блокатора β-адренорецепторов - обзидана связано с его влиянием на элементы сигнальных путей (в частности адренорецепторов типа β), активируемых при клональной пролиферации лимфоцитов (Kohm A.P., Sanders V.M., 2001). По данным литературы, α-адренорецепторы в клетках крови не вовлекаются в регуляцию цАМФ, концентрация которого прямо пропорциональна деформируемости эритроцитов и трансформированных лимфоцитов, обладающих различным метастатическим потенциалом (Mittelman L. et al., 1994). Кроме того, в эритроцитах лягушек β-адренорецепторов связанные с элементами цитоскелета, быстро реагируют на незначительные дозы обзидана (Chuang D.M., Costa E., 1979). По данным литературы мембраны ядерных эритроцитов лягушек содержат систему атипичных β-адренорецепторов (Агалакова Н.И., 1996), которые одновременно обладают сходством с β1- и β2-адренорецепторами высших животных (Сергеев П.В., Шимановский В.Л., 1987; Cherksey B.D. et al., 1980). Выбор кальциевой нагрузки in vitro связан с тем что, ионы Са2+ являются универсальными мессенджерами, участвуют в регуляции активности элементов цитоскелета (Grinstein S. et al., 1982b; Grinstein S., Smith J.D., 1990). В некоторых типах клеток регуляторное сокращение объема зависит от притока Са2+ вовнутрь (Montrose-Rafizadeh C., Guggio W.B., 1991), в других типах – ответ связан с немедленным выходом Са2+ из клеточных депо (Terreros D.A., Kanli H., 1992). Кроме того, влияния адреналина, реализуются посредством регуляции концентрации эндогенного Са2+, однако по данным литературы, в лимфоцитах в отличие от других клеток крови выход Са2+ из внутриклеточных депо ничтожно мал (Rink T.G. et al., 1983), что связано с низким содержанием в них эндоплазматической сети (около 1%). В связи с этим, в проведенном исследовании была создана экспериментальная модель экзогенной кальциевой нагрузки, стимулирующая поступление ионов Са2+ из инкубационной среды через высокоселективные Са2+- каналы типа TRPV5, описанные в лимфоцитах здоровых доноров (Васильева И.О., Негуляев Ю.А., 2008). Выбор верапамила с одной стороны связан с тем, что он, взаимодействуя с сайтами связывания для ионов Са2+, препятствует их потоку в клетку из среды (Kalin W. et al., 1982), и тем самым, выступает в качестве блокатора каль- 17 циевых каналов, а с другой стороны, верапамил in vitro действует как ингибитор β-адренорецепторов, аналогично обзидану (Feldman R.D., Park G.D., 1985). Осмотические тесты in vitro Забор материала. Человеческую кровь получали путем венопункции в клинической лаборатории областной больницы г. Белгорода. Забор крови проводили с участием специализированного медперсонала в вакуумные пробирки Vacuette K3E, содержащие сухую ЭДТА К3 в концентрации 2,0 мг (0,006843 моль/литр) на 1 мл крови. ЭДТА предотвращает свертывание крови путем блокирования ионов Са2+, не влияет на гематологические параметры, морфологию клеток крови и сохраняет функциональную активность лимфоцитов (Гордиенко А.Д., Кудокоцева Е.В., 1980). Кровь для исследований у лягушек Rana Ridibunda Pall. брали путем пункции сердца. Стабилизацию крови проводили гепарином (5 Ед/мл). Гипоосмотическая нагрузка. Динамику осморегуляторных реакций клеток крови изучали с использованием метода комплексного исследования, разработанного рядом авторов (Федорова М.З., Левин В.Н., 1997), на основе известных методик (Зацепина Г.Н. с соавт.,1984; Тарасова И.М., 1985; Mela M.J., 1967). Полученную кровь здоровых доноров и больных ХЛЛ центрифугировали 10 мин. при 1500 об/мин. Удаляли верхний слой плазмы. Собирали нижнюю часть плазмы, богатую лейкоцитами и лейкоцитарное кольцо. Примесь эритроцитов разрушали 0,83% раствором хлорида аммония (Зиман Ю.И., Редькин А.П., 1987; Романова А.Ф., 2000; Карпищенко А.И., 2002). Клетки дважды отмывали изотоничным буферным раствором (раствор Дульбекко, рН=7.4). Эритроциты лягушек выделяли из цельной крови, путем центрифугирования 5 мин при 1500 об/мин и последующего ресуспендирования в среде Хенкса, получали 1 мл суспензии. Каждую полученную суспензию клеток делили на три пробы по 10 мкл в каждой. К первой пробе добавляли 50 мкл аутологичной плазмы, ко второй – 50 мкл умеренно-гипотонического раствора (0,4% раствор хлорида натрия для лимфоцитов человека и 0,2% раствор для эритроцитов лягушек), к третьей – 50 мкл 18 изотонического раствора (0,9% раствор хлорида натрия для лимфоцитов человека и 0,65% раствор для эритроцитов лягушек). Формировали однослойные суспензионные препараты из каждой пробы, в которых через каждые 30 сек в течение 10 минут, а затем дополнительно через каждые 15, 30 и 60 мин регистрировали изображения клеток с помощью комплекса аппаратно-программной визуализации морфологических препаратов, анализа и регистрации оптических и морфологических показателей «ВидеоТесТ» (регистрационное удостоверение № 29/20010702/6102-04 от 16.02. 2004 г.). На полученных изображениях измеряли габаритные размеры 100 клеток и ядер. По измеренным габаритным размерам вычисляли значения морфометрических индексов по соответствующим формулам (Выгодский М.Я., 1974; Головко С.И., 2010): 1) для лимфоцитов: = (1) (2) где V – объем (мкм3), S – площадь поверхности (мкм2), r – радиус (мкм). 2) для эритроцитов (Скоркина М.Ю. с соавт., 2004; Головко С.И., 2010) = (3) (4) где V – объем (мкм3), S – площадь поверхности (мкм2), a – большая полуось (мкм), b – средняя полуось (мкм), c - малая полуось (мкм). Ядерно-цитоплазматические отношения рассчитывали как отношение площади поверхности ядра к площади поверхности цитоплазмы. Об осморегуляторных реакциях клеток судили по коэффициенту осмотического натяжения мембран и показателю использования ими запасов мембранного резерва. Расчет коэффициента осмотического натяжения мембраны осуществляли по формуле (Федорова М.З., Левин В.Н., 2001): 19 уг (5) из где Кos - коэффициент осмотического натяжения мембраны (усл. ед), Sуг – площадь поверхности клеток/ядер в умеренно-гипотоническом растворе NaCl (мкм2), Sиз – площадь поверхности клеток/ядер в изотоническом растворе NaCl (мкм2). Рассчитывали абсолютный мембранный резерв для клеток контрольной пробы: (6) где MR – абсолютный мембранный резерв (мкм-1); S – площадь поверхности клетки/ядра в аутологичной плазме (мкм2), V – объем клетки/ядра в аутологичной плазме (мкм3). Относительный мембранный резерв рассчитывали для клеток, помещенных в гипотоническую среду: уг из (7) где MR – относительный мембранный резерв (мкм-1); Sуг/из – площадь поверхности клеток/ядер в умеренно-гипотоническом /изотоническом растворе NaCl (мкм2), Sp – площадь поверхности клеток/ядер в аутологичной плазме (мкм2), Vp – объем клеток/ядер в аутологичной плазме (мкм3). Интенсивность использования относительного мембранного резерва клетками в гипотонической среде оценивали, вычисляя процент относительного мембранного резерва, используемого клеткой от абсолютного мембранного резерва, принимаемого за 100%. Тесты с функциональными нагрузками. С целью выявления зависимости между интенсивностью использования резервных бассейнов клетками в осмотических тестах in vitro и жесткостью клеточной поверхности в проведенном иссле- 20 довании использован метод функциональных нагрузок, включающий инкубацию клеточных суспензий с адреналином, обзиданом, хлоридом кальция и верапамилом. Адреналиновую нагрузку осуществляли путем инкубации 30 мкл клеточной суспензии в 150 мкл среды Хенкса, содержащей 10-9ммоль/л адреналина в течение 15 мин. Лимфоциты человека инкубировали в термостате при температуре 370С, эритроциты лягушек – при комнатной температуре. Пробу с обзиданом проводили путем инкубации 30 мкл суспензии в 150 мкл среды Хенкса, содержащей 109 ммоль/л обзидана в течение 15 мин. Кальциевую нагрузку осуществляли путем инкубации 30 мкл лимфоцитов в 150 мкл среды Хенкса, содержащей 10-6 ммоль/л Са2+ в течение 15 мин при температуре 370С. Пробу с верапамилом проводили путем инкубации 30 мкл суспензии лимфоцитов в 150 мкл среды Хенкса, содержащей10-6 ммоль/л верапамила в течение 15 мин при температуре 370С. По окончании времени воздействия функциональных нагрузок, пробы центрифугировали, 5 мин при 1500 об/мин, надосадочную жидкость убирали и выполняли осмотические тесты in vitro как описано выше. Методы изучения топографии клеток крови В работе проведено исследование топографии форменных элементов крови в фазу регуляторного увеличения и уменьшения объема клеток, а также под влиянием функциональных нагрузок. В работе применены методы АСМ-сканирования для изучения рельефа и морфофункциональных свойств клеточных линий, без нарушения их морфологической целостности (Hansma P.K., Hoh J.H., 1994; Kasas S. et al., 1997). Результаты АСМ-сканирования интегрируют морфологические изображения клеток с механическими свойствами клеточной поверхности, такими как клеточная эластичность в 2D-разрешении, силу клеточно-поверхностного или клеточно-клеточного взаимодействия (Simone A., Durrieu M.C., 2006). Подготовка фиксированных образцов клеток. Особенности цитоархитектоники мембран при проведении осмотических тестов изучали методом полуконтактной АСМ на фиксированных препаратах. В первой серии пробоподготовки изучали ультраструктурные особенности мембран в условиях гипоосмотической 21 нагрузки. По 10 мкл клеточной суспензии из каждой пробы разливали в 8 пластиковых пробирок Эппендорфа, в каждую из которых вносили по 50 мкл умеренно гипотонического раствора (0,2% для эритроцитов лягушек и 0,4% для лимфоцитов человека). Параллельно в следующие 8 пробирок разливали 10 мкл клеточной суспензии, в каждую из которых добавляли по 50 мкл изотонического раствора (0,65% раствор NaCl для эритроцитов лягушек и 0,9% раствор NaCl для лимфоцитов человека). В каждую из пробирок последовательно через 30, 60, 90, 120, 150, 180, 300 и 900 с инкубации добавляли по 10 мкл 25% раствора глутарового альдегида (MERCK, Германия). Контролем являлась проба, состоящая из 10 мкл клеточной суспензии, в которую добавляли 50 мкл аутологичной плазмы и фиксировали 10 мкл 25% раствора глутарового альдегида. Из каждой пробы делали мазки. Фиксация глутаровым альдегидом была использована для сохранения естественного состояния цитоскелета мембраны, а также уменьшения деформации АСМзонда (Swihard A.H. et al., 2001). Готовые препараты помещали на столик атомно-силового микроскопа ИНТЕГРА Вита (конфигурация на базе инвертированного оптического микроскопа Olympus IX-71; производитель NT MDT, Зеленоград, 2009) и осуществляли сканирование 20 клеток из каждой пробы с частотой развертки 0,6-0,8 Hz, используя кантилеверы серии NSG03, с жесткостью 1,1Н/м и радиусом закругления 10 нм. На полученных сканах строили кривые профиля участков поверхности размером 3,5Χ3,5 мкм, на которых измеряли габаритные размеры и подсчитывали количество глобулярных выступов, а также углублений, образовавшихся в мембране после нагрузок (рисунок 2). 22 Рисунок 2 – АСМ-изображение и вид профиля поверхности лимфоцита вдоль линии сканирования: 1- глобулярные выступы, 2 –углубления По оси абсцисс – длина участка (мкм), по оси ординат – высота структур (нм) Дополнительно проведено 4 серии пробоподготовки, в которых изучали рельеф поверхности клеток крови под влиянием функциональных нагрузок с последующим наложением гипоосмотической нагрузки. Готовили пробы: по 200 мкл суспензии эритроцитов и лимфоцитов в каждой инкубировали с 1000 мкл среды Хенкса, содержащей: адреналин (10-9ммоль/л; 1 проба), обзидан (109 ммоль/л; 2 проба), хлорид кальция (10-6 ммоль/л; 3 проба) и верапамил (10-6 ммоль/л; 4 проба) в течение 15 мин при комнатной температуре (эритроциты лягушек) при температуре 370С (лимфоциты доноров и больных ХЛЛ). По истечении времени инкубации пробы центрифугировали, отбирали надосадочную жидкость, затем проводили гипоосмотическую нагрузку как описано выше. По окончании воздействия гипоосмотической нагрузки готовили фиксированные препараты, которые сканировали при тех же условиях и анализировали, как описано выше. Основой принцип работы АСМ заключается в сканировании определенного участка поверхности с помощью микроскопического зонда. Для регистрации силового взаимодействия между зондом и поверхностью используется оптическая система, состоящая из лазера и полупроводниковых фотодиодов (Миронов В.Л., 2004). 23 В полуконтактном режиме сканирования происходит частичный контакт зонда с поверхностью образца. В режиме “прерывистого контакта” (tapping mode), кантилевер совершает колебания с частотой, близкой к собственной резонансной частоте в плоскости, перпендикулярной образцу. В каждом периоде колебаний острие в нижней точке касается образца (рисунок 3). Рисунок 3 – Схема рабочей части АСМ Колебания создаются миниатюрным пьезоманипулятором (биморфом), к которому прикреплено основание кантилевера. При приближении кантилевера к поверхности резонансная кривая смещается. Резонансный пик удаляется от выбранной частоты, и амплитуда колебаний уменьшается. Амплитуда колебаний кантилевера зависит от расстояния до поверхности, и ее изменения регистрируются системой оптического контроля. Чем ближе кантилевер к поверхности, тем больше градиент силы взаимодействия зонд/образец, тем дальше сдвигается резонансная частота и сильнее уменьшается амплитуда колебаний. Система обратной связи отводит кантилевер от образца, поддерживая амплитуду колебаний постоянной (Руководство, 2006). В “тэппинг” моде при сканировании над образцом кантилевер вибрирует на заранее выбранной частоте (собственной резонансной частоте или несколько меньшей), с постоянной заранее выбранной амплитудой, описывая при этом контуры исследуемой поверхности. В резонансном режиме сканирования время контакта зонда и образца существенно меньше, по сравнению с контактным режимом сканирования, тем самым силовое воздействие на образец со стороны зонда также минимизировано. Помимо этого в режиме прерывистого контакта минимизирована тангенциальная составляющая силы взаимодействия 24 между зондом и образцом (сила трения), а воздействие сводится к легкому вдавливанию объекта в подложку. Именно поэтому резонансный режим используется для изучения “мягких объектов”, адсорбированных на твердой подложке (Wojcikiewicz E. et al., 2004). Подготовка нативных образов клеток для атомно-силовой спектроскопии (АСС). Упруго-эластические свойства клеток крови изучали методом эластографии путем сканирования суспензий во влажной камере, при этом использовали модифицированные кантилеверы, приготовленные на основе полимерных микросфер. В основе метода эластографии лежит измерение степени деформации поверхности образца при взаимодействии его с вершиной зонда АСМ (Alonso J.L., Goldman W.H., 2003). Для работы с клетками использовали модифицированные АСМ-зонды в виде полусфер с радиусом закругления 5 мкм (патент РФ № 2466401). Применение микросфер в качестве наномеханического сенсора позволяет разработать модель для определения упругости мягких биологических образцов независимо от их толщины, которые прикреплены к жестким подложкам. По данным литературы оценка модуля Юнга мягких образцов, выполненная в режиме силовой спектроскопии, согласуется с макроскопическими измеренными значениями, при условии, что микросферы используются в качестве измерительных щупов (Dimitriadis E.K. et al., 2002). Проводили разделение проб крови на эритроциты и лимфоциты. Лимфоциты здоровых доноров и больных ХЛЛ получали путем центрифугирования проб крови, дважды отмывали изотоничным буферным раствором Дульбеко (рН 7,4) и ресуспендировали в среде Хенкса 199. Кровь лягушки центрифугировали 5 мин при 2000 об/мин. Плазму отбирали, эритроциты отмывали и ресуспендировали в среде Хенкса (pH 7.4), содержащей 80 г NaCl, 4 г KCl, 1 г MgSO4X7H2O, 1 г MgCl2X6H2O, 0,6 г Na2HPO4, 0,6 г KH2PO4, 10 г глюкозы, 1,4 г CaCl2. Готовили суспензионные препараты клеток крови, путем нанесения капли суспензии на обезжиренное предметное стекло (патент № 2398234). С целью со- 25 хранения жизнеспособности клеток перед сканированием их помещали во влажную камеру (патент РФ № 98248). Влажная камера разработана и запатентована коллективом авторов (патент РФ № 98248). Полезная модель относится к устройствам для исследования нативных клеток и может быть использована для изучения клеток крови методом АСМ. Влажная камера для исследования нативных клеток включает (рисунок 4) чашку из пластикового материала (1), на дне которой установлены рельсы (2), с возможностью крепления на них предметного стекла (3) с исследуемым образцом (4). Сверху, на ободе чашки, закреплена эластичная мембрана (5) с отверстием (6) для кантилевера (7). Чашка крепится на сменное основание столика микроскопа (8). Рисунок 4 – Влажная камера для исследования нативных клеток Для АСМ спектроскопии рекомендованы способы измерения упругости зондами с «мягкой балкой», константа жесткости которых находится в пределах 10-2-10-1 Н/м, позволяющих исследовать очень мягкие биологические образцы. Однако, главным недостатком этих способов является малый радиус АСМ-зонда, который легко нарушает целостность биологической мембраны, протыкая ее острием вершины. Применение микросфер в качестве наномеханического сенсора позволило разработать модель для определения упругости мягких биологических образцов независимо от их толщины, которые прикреплены к жестким подложкам. По данным литературы оценка модуля Юнга мягких образцов, выполненная в режиме силовой спектроскопии, согласуется с макроскопическими измеренными значе- 26 ниями, при условии, что микросферы используются в качестве измерительных щупов (Dimitriadis E.K. et al., 2002). При выполнении работы кантилеверы изготавливали следующим способом: готовили густой раствор желатина, в котором ополаскивали типлесс, сушили его на воздухе в течение 3-5 минут, не доводя до превращения желатина в гель. Готовили суспензию исследуемых клеток крови (эритроцитов лягушек, лимфоцитов здоровых доноров и больных ХЛЛ). Суспензию из каждой пробы наносили на один край предметного стекла, на противоположный край помещали водную суспензию полых полимерных микросфер (PS, производитель Micropartieles GmbH, Германия, 2011). Укладывали препарат во влажную камеру, насыщенную парами воды. Проводили процедуру силовой микроскопии на участке препарата, где расположены микросферы, осуществляя подвод к отдельно лежащему шарику (патент РФ № 2466401 заявка № 2011109741, дата приоритета 15.03.2011). Таким образом, чтобы один шарик прикрепился к поверхности типлесса. В результате получали кантилевер с радиусом закругления 5 мкм (рисунок 5). Рисунок 5 – Вид модифицированного кантилевера Затем изменяли область сканирования, перемещаясь на противоположный край препарата, где располагалась суспензия клеток, и осуществляли процедуру силовой микроскопии. Получали силовые кривые отвода и подвода. Рассчитывали упругость клеток с помощью программного обеспечения Nova исходя из следующего алгоритма. 27 Алгоритм расчета модуля Юнга. В качестве экспериментальных данных для определения локальной упругости клеток были использованы силовые кривые, которые получали в широком диапазоне как до, так и после контакта кантилевера с поверхностью объекта. Силовые кривые использовали для вычисления силы взаимодействия зонда и образца. Полученные кривые преобразовывали из системы координат «ток рассогласования (DFL, nA) – высота (µm)» (рисунок 6а) в систему координат «сила (DFL, nN) – высота (µm)» (рисунок 6б). Процедуру преобразования осуществляли, используя скрипт DFL_to_Force программного обеспечения Nova (НТ-МДТ, Зеленоград, 2009). Рисунок 6 – Силовые кривые лимфоцита больного ХЛЛ: а – первоначальный вид силовой кривой в системе координат «ток рассогласования фотодиода (DFL, нA) от высоты (мкм)», б – преобразованная кривая, с помощью скрипта DFL_to_Force программы «Nova», в системе координат «сила (DFL, нН) от высоты (мкм)». На силовой кривой указаны значения DX (нм), DY (нН), Y (нН), необходимые для вычисления глубины проникновения зонда в образец. На преобразованных силовых кривых (рисунок 6б) находили значения DX (nm), DY (nN), Y (nN), по которым рассчитывали глубину проникновения зонда в образец (Israelachvili J., 1992): (8) где ΔZ – преобразованное значение силовой кривой по DX (nm); SetPoint – функциональный параметр, который определяет величину входного сигнала цепи обратной связи при сканировании (nA), 28 DFL0 - преобразованное значение силовой кривой по Y (nA); ΔDFL - преобразованное значение калибровки силовой кривой по DY (nN). Силу прижатия зонда к образцу находили исходя из закона Гука: (9) где – жесткость зонда (Н/м), – глубина проникновения зонда в образец (нм). Модуль Юнга системы образец-игла рассчитывали исходя из формулы (Capella B., Dieter G., 1999): (10) где F – сила, действующая на образец (Н), R- радиус закругления зонда (мкм), Δh – глубина проникновения зонда в поверхность образца (нм), E- модуль Юнга (µРа). Методы статистической обработки Результаты экспериментальных исследований обработаны методами вариационной статистики с использованием пакета анализа «Microsoft Excel 7.0» на персональном компьютере (Лапач С.Н. с соавт., 2001). Проводили подсчет средних арифметических, среднеквадратического отклонения, коэффициента вариации. Экспериментальные данные представлены в виде среднеарифметических значений с их средними стандартными ошибками. Статистический анализ результатов экспериментов проведен с применением критерия Стьюдента для 5%-го уровня значимости (Лакин Г.Ф., 1968; Смолянинов В.В., 1980; Бурдун Г.Д., Марков Б.Н., 1985; Платонов А.Е., 2000). 29 Основные положения, выносимые на защиту: 1. Регуляция объема лимфоцитов здоровых доноров в условиях осмотической нагрузки направлена на сохранение целостности клетки и связана с использованием запасов мембранного материала, заложенного в складчатости плазмалеммы. 2. Морфофизиологические свойства опухолевых клонов клеток тесно связаны с адаптивными реакциями, направленными на поддержание микрореологических свойств лимфоцитов для их эффективного пассажа через пути микроциркуляции крови. 3. Вовлечение поверхностных резервных структур плазмалеммы в регуляцию объема лимфоцитов здорового человека зависит от жесткости клетки. 4. Лимфоциты больных ХЛЛ регулируют свой объем без использования дополнительного резерва плазмалеммы, что подтверждено отсутствием взаимосвязи между изменением жесткости клетки и отсутствием осморегуляторных реакций в гипотонической среде. 5. Эритроциты лягушек имеют иной механизм сохранения клеточного объема, поскольку не обладают скоординированными механизмами, позволяющими использовать резервы плазмалеммы в механизмах регуляции объема. Степень достоверности, полученных результатов обусловлена теоретическим анализом результатов и выводов, наличием репрезентативной выборки объектов, адекватной целям и задачам исследования, личным участием автора во всех сериях экспериментального исследования, проведенных с помощью современных методик и сертифицированного высокоточного отечественного оборудования в области микроскопии (атомно-силовой микроскоп, система видеорегистрации и документирования изображений «ВидеоТест»), соответствующих компьютерных программ обработки и анализа изображений, большим объемом фактического материала, который обработан с использованием традиционных методов статистики, применяемых в биологических исследованиях, получением патентов на изобретения и полезные модели, публикацией данных диссертации в монографиях, статьях, докладах на международных конференциях и научных семинарах. 30 Апробация результатов работы Материалы, изложенные в диссертации, доложены и обсуждены на международных конференциях «Биология – наука XXI века» (Пущино 2004, 2006, 2007, 2009), «Актуальные проблемы сохранения устойчивости живых систем» (Белгород 2004), «Микроциркуляция и гемореология» (Ярославль 2005, 2007, 2009, 2011, 2013), Всероссийской научной конференции «Клиническая гемостазиология и гемореология в сердечнососудистой хирургии» (Москва, 2005), съездах физиологов СНГ (Сочи, 2005, 2011), ХХ съезде физиологического общества им. И.П. Павлова (Москва, 2007), Международном конгрессе ветеринарных фармакологов «Эффективные и безопасные лекарственные средства» (Санкт-Петербург, 2008), IX конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2008), Х Международной научно-практической конференции «Живые объекты в условиях антропогенного пресса» (Белгород, 2008), VIII Молодежной научной конференции Коми УрО РАН «Физиология человека и животных: от эксперимента к клинической практике» (Сыктывкар, 2009), Международной научно- методической конференции, посвященной 200-летию со дня рождения Ч. Дарвина «Современные проблемы эволюционной биологии» (Брянск, 2009), III Евразийском конгрессе по медицинской физике и инженерии «Медицинская физика 2010» (Москва, 2010), X II Российском симпозиуме по растровой электронной микроскопии и аналитическим методам исследования твердых тел (Черноголовка, 2011), XI Международном совещании и II школы по эволюционной физиоло- гии, посвященным памяти академика Л.А. Орбели (Санкт-Петербург, 2011), VII Сибирском съезде физиологов Сибири (Красноярск, 2012), региональном отраслевом форуме «Медицинская биотехнология. Биофармацевтическая промышленность» (Белгород, 2012), научном семинаре в рамках академического сотрудничества между НИУ «БелГУ» и лабораторией ERRMECE университета СержиПонтуаз (Франция, Париж, 2013). 31 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Физиологические основы регуляции объема клеток Поддержание объема представляет собой фундаментальный физиологический механизм, который является необходимым условием для выживания клетки (Chamberlin M.E., Strange K., 1989; Strange K. et al., 1995; Al-Habori M., 2001). Особенно важно поддержание объема для форменных элементов крови, поскольку его изменения отражают функциональную активность клеток и обуславливают деформационные свойства эритроцитов, их кислородтранспортную функцию (Guizouaran H., Motais R., 1999), пролиферацию, миграцию и дифференцировку лейкоцитов (Голованов М.В., 1991; Голованов М.В., Дерягин Е.Б., 1992; Kasas S. et al., 2005). Клетки обладают широким спектром волюмодетекторных и волюмоэффекторных механизмов, которые избирательно реагируют на характер и силу объемных возмущений (Strange K., 1994b; Emma F. et al., 1997; McLeod R.J., Hamilton J.R., 1999). Постоянство клеточного объема непрерывно поддерживается за счет работы ион транспортных систем, аккумуляции или удаление органических осмолитов и метаболитов (Чеботарева Н.А., 2007), а также тонкой регуляции селективной мембранной проницаемости (Бессонова С.В. с соавт., 2004). В гипоосмотических условиях восстановление объема клеток достигается за счет оттока клеточных растворимых веществ, осмоэффекторов и осмотически связанного оттока воды (Chamberling M.E., Strange K., 1993; Hoffman E.K. et al., 1993). Основными адаптивными механизмами ауторегуляции клеточного объема выступают активный транспорт ионов посредством насосов (Lytle C., McManus T., 2002; Hoffman E.K. et al., 2009), модификация функций ионных каналов (Bonangelino C.J. et al., 2002), обусловленная изменением рН среды (Cala P.M., Maldonado H.M., 1994), а также трансформация элементов цитоскелета (Critchley D.R., 2000; Sechi A.S., Wehland J., 2000). 32 1.1.1. Транспорт электролитов и регуляция клеточного объема Волюморегуляторные механизмы животных клеток всесторонне изучены и проанализированы в ряде литературных обзоров (Grinstein S., Foskett J.K., 1990; Lewis S.A., Donaldson P., 1990; McCatry N.A., O’Neil R.G., 1992; Land F. et al., 1998; Musch M.W. et al., 1998; Park J.H. et al., 1998; Hoffman E.K., 2000; Mohanty M.J. et al., 2001; Strange K., 2004; Fahkle C., Fisher M., 2010). Объемная регуляция имеет важное значение в клетках, испытывающих анизотоническое состояние, индуцированное изменением во внеклеточной осмолярности (McManus M.L. et al., 1995; Lang F. et al., 1998), которое обычно сопровождается соответствующим током воды, а также увеличением или уменьшением объема клетки. Процесс, восстановления объема клетки в результате гипоосмотического увеличения объема или сморщивания клетки называется регуляторное уменьшение (RDV) или увеличение объема (RVI). RVD происходит медленнее и осуществляется путем выборочного повышения проницаемости плазмалеммы, в результате чего облегчается отток внутриклеточных осмолитов, которые противодействуют движущей силе воды (Grinstein S., Foskett J.K., 1990; Lewis S.A., Donaldson P., 1990; McCarty N.A., O’Niel R.J., 1992; Strange K., 1994; Hoffman K., 2000). Продолжительность RVD варьирует от нескольких часов в случае клеток головного мозга (Polock A.S., Arieff A.I., 1980) и эритроцитов (Poznansky M., Solomon A.K., 1972), до нескольких минут в лимфобластах мыши (Buckhold-Shank B., Smith N.E., 1976) и опухолевых клетках Эрлиха (Hendill K.B., Hoffman E.K., 1974). Среди эукариотических клеток самый быстрый ответ наблюдается в лимфоцитах периферической крови человека. Уменьшение их объема происходит за 5 мин, причем конечный восстановленный объем достигает значений изотонического раствора в единичных случаях (Ben-Sasson S.R. et al., 1975). 33 Механизм RVD связан с потерей клетками млекопитающих К+ и Cl- (Grinstein S. et al., 1982a; Hoffman E.K. et al., 1984; Sarkadi B.et al., 1984a). В некоторых типах клеток при RVD активируется K+- Cl- - симпорт или K+/H+ и Cl-/ HCO3- антипорт (Kregenow F.M., 1981; Parker J.C., 1983; Larson M., Spring K.B., 1984; Lauf P.K., 1985). Изменение K-Cl- потоков во время RVD происходит посредством электропроводящих путей (Grinstein S. et al., 1982a; Hoffman E.K. et al., 1984; Sarkadi B. et al., 1984a) и электронейтральных котранспортных путей (Schmidt W.F., McManus T.J., 1977; Cala P.M., 1980; Dunham P.B., Ellory J.C., 1981; Larson M., Spring K.M., 1984; Lauf P.K., 1985; Lewis S.A., Donaldson P., 1990). Установлено, что RVD связано с уменьшением содержания К+-электрохимического градиента и обусловлено увеличением проницаемости мембраны для этого катиона. Направление и величина нормализации объема изменяется в зависимости от направления калиевого концентрационного градиента. В частности, на лимфоцитах человека показано, что во время RVD они теряют до 22% внутриклеточного К+ и 26% клеточной воды (Grinstein S., 1982b), следовательно, движение К+ из клетки сопровождает RVD, внутрь – RVI. Немаловажную роль в регуляции объема лимфоцитов исследователи отводят работе Na+/K+-насоса, обеспечивающего быстрое и долговременное изменение интенсивности ионных потоков через плазмалемму (Лопина О.Д., 2001; Clausen T., 1996; Therein A.G., Blostein R., 2000; Glynn I.M., 2002; Shiriener-Bobis G., 2002). Показано, что регуляция Т-клеточного ответа посредством ИЛ-2, обеспечивается повышением транспортной активности натриевого насоса и возрастание экспрессии каталитической α-субъединицы Na+-K+ - АТФазы (Карицкая И.А. с соавт., 2005; Marakhova I.I. et al., 2005). Установлено, что активность натриевого насоса контролируется посредством внутриклеточных киназных путей через JAK/STAT и ERR ½-MAP (Карицкая И.А. с соавт., 2008). Ионная основа гипотонического регулирования объема изучалась на нескольких системах и лучше всего рассмотрена на эритроцитах (Kregenow F.M., 1971; Cala P.M., 1980) и лимфоидных клетках (Roti-Roti L.W., Rothstein A., 1973). К настоящему моменту идентифицированы транспортные пути, активирующиеся 34 при набухании и сжатии клеток. При сжатии клеток показана стимуляция Na+-K+2Cl- - котранспорта, Na+/H+-обмена, Cl- / HclO3- -обмена (Eveloff J.L., Calamia J., 1986). При набухании клеток активируется K+-Cl- - котранспорт, K+ и Cl- - каналы, а также K+/H+ и Cl-/HClO3- -обмен (Eveloff J.L., Warnock D.J., 1987). Ключевую роль в регуляции клеточного объема многих типов клеток играет Na+-H+ обмен. Рядом работ показано участие Na/H-обменника в регуляции внутриклеточного рН, клеточного объема, пролиферации тканей, трансэпителиальном транспорте ионов (Noel J., Pouvssegur J., 1995; Wakabayshi S. et al., 1997; Counillon I., Poussegur J., 2000). В настоящее время, установлено присутствие различных изоформ Na/H-обменника в эритроцитах животных разных уровней организации. В частности, из эритроцитарных мембран млекопитающих выделено и клонировано шесть изоформ Na/H- обменника (NHE1-NHE6), работу которых связывают с патогенезом гипертонической болезни (Orlov S.N., et al., 1998). В ядерных эритроцитах форели выявлена форма Na/H- обменника (β-NHE), которая активируется катехоламинами (Borgese F. et al., 1992; Malaper M. et al., 1997). В эритроцитах земноводных Amphiuma tridacticum выделена изоформа обменника atNHE1 (McLean L.A. et al., 1999), которая активируется при сжатии клеток в гипертонической среде (Cala P.M., 1986) и не активируется катехоламинами (Tufts B.I. et al., 1987). В эритроцитах жабы Bufo marinus (Tufts B.I. et al., 1987a) и лягушки Rana temporaria (Gusev G.P. et al., 1996) установлено отсутствие влияния βадренергических агонистов на транспорт Na+. Однако, при сочетанном воздействии изопротеринола и блокатора фосфодиэстераз показана стимуляция Na/Hобмена в эритроцитах лягушки Rana pipiens (Rudolph S.A., Greengard P., 1980; Palfrev C.H., Greengard P., 1981). В целом в эритроцитах лягушек Na+/H+обменник функционирует как волюмочувствительный и волюморегуляторный элемент, активируясь при сжатии до тех пор, пока клетка не восстановит свой объем до исходного (Cala P.M., 1980; Siebens A.W., Kregenow F.M., 1985), при этом его работа не подчинена рН зависимому контролю (Cala P.M., Maldonado H.M., 1994). В лимфоцитах человека Na+/H+-обменник активируется при осмотическом сжатии, однако не участвует в объемной регуляции (Rotin D, Grinstein S., 35 1989). В случае снижения рН лимфоцитов ниже нормы Na+/H+-обменник функционирует как рН регуляторный потенциал активируемый канал, поглощая Na+ в обмен на Н+, до восстановления нормального уровня рН, а затем отключается (Grinstein S. et al., 1983; Grinstein S. et al., 1985). 1.1.2 Участие органических осмолитов в объемном гомеостазе клетки Органические осмолиты, содержащиеся в клетке в высокой концентрации, играют ключевую роль в объемном гомеостазе (Chamberlin M.E., Strange K., 1989; Yancey P.H., 1994; Burg M.B. et al., 1997; Lang F. et al., 1998) и могут функционировать как цитопротекторы, эволюционно сформированные из рудиментарных механизмов сохранения водного баланса низших позвоночных (Timasheff S.N., 1992; Storey K.B., 1997; Yancey P.H., 2001; Storey K.B., Storey J.M., 2004; Costanzo J.P., Richard E.L., 2005; Muir T.J. et al., 2007). Функциональная роль осмолитов заключается в создании и поддержании осмолярности, не затрагивая остальных функций клеток (Garcia-Perer A., Burg M.B., 1991). В связи с сохранением функции клетки под воздействием высоких концентраций органических осмолитов в современной физиологии используется термин «совместимые осмолиты» (Brown A.D., Simpson J., 1972). В животных клетках органические осмолиты делятся на три основных класса: полионы (сорбитол, миоинозитол), аминокислоты и их производные (таурин, аланин, пролин, глутамин глутамиат, аспартат) и метиламины (бетаин, глицерофосфатхолин) (Yancey P.H. et al., 1982; Garcia-Perer A., Burg M., 1991; Law R.O., 1991; Kinne R.K.H., 1993). Осмолиты выполняют ряд структурных функций: 1) участвуют в стабилизации макромолекул, препятствуя неблагоприятному влиянию неорганических (K+, 36 Na+ и Cl-) и органических ионов, например спермина (Arakawa T., Timasheff S.N., 1985; Viera A., Caruso-Neves C., 1993); 2) защищают клетку от температурного воздействия (Paleg L.G. et al., 1981; Santoro M.M. et al., 1992); 3) облегчают сборку компонентов клеточной мембраны (Kolena J. et al., 1992); 4) предотвращают дестабилизацию белков под влиянием мочевины (Yancey P.H., Burg M.B., 1990; Coelho-Sampaio T. et al., 1994; Burg M.B. et al., 1996). Накоплению осмолитов в клетке способствует их активное поступление, синтез или замедление скорости деградации. Регуляция объема клеток посредством осмолитов представляет более медленный процесс (в течение часов) по сравнению с транспортом и захватом электролитов, так как сопряжена с транскрипцией определённых генов, кодирующих белки-переносчики и синтез ферментов (Yancey P.H., 1994; Burg M.B. et al., 1997). Одним из широко используемых осмолитов в процессе RVD, в том числе и форменными элементами крови, является таурин (Goldstein L., Brill S.R., 1991; Strange K., Jackson P.S., 1995). RVD путем потери таурина осуществляется через Cl2-канал (Jackson P.S. et al., 1994), и опосредованно гепоксилином, кальмодулином, инозитолтрифосфатом (Leite M.V., Goldstein L., 1987, Hoffman E.K. et al., 1988; Dahl S.V. et al., 1991; Margalit A. et al., 1993; Lambert I.H., 1994; Thoroed S.M. et al., 199; Thoroed S.M., Fugelli K., 1994 b,c). Регуляция потери метаболитов и клеточного объема протекает в присутствии АТФ (Jackson P.S. et al. 1994; 1996). Показано, что падение АТФ ниже критического уровня инициирует закрытие осмолитного канала, что тем самым предотвращает потерю основных метаболитов. Считается доказанным необходимость присутствия АТФ, которая фосфорилирует тирозин в процессе потери таурина (Mush M.W. et al, 1998). В эритроцитах низших позвоночных (рыб, лягушек) регуляция объема клеток идет путем потери таурина, γ-аминомаслянной кислоты (ГАМК), К+, Cl(Fugelli K., Thoroed S.M., 1986; Thoroed S.M., Fugelli K., 1994a). Ученые полагают, что в активации таурин чувствительных осмотических каналов участвует Са2+/кальмодулин (Thoroed S.M., Fugelli K., 1994b). Кроме того, экспериментально показано участие лейкотриенов в потере таурина. В присутствии ингибитора 5- 37 липооксингеназы, который преобразует арахидоновую кислоту в лейкотриен А4, а также антогонистов рецептора D4 лейкотриена, объем регулирующая потеря таурина была полностью блокирована (Thoroed S.M., Fugelli K., 1994 b,c). 1.1.3 Волюмодетекторные и волюмоэффекторные механизмы регуляции объема клеток Клеточное набухание и сжатие модифицируют большое число функций, включая механизмы регуляции объема посредством внутриклеточных сигнальных механизмов. Осмотическое поведение клетки и нормализация ее объема зависит не только от концентрации ионов и осмолитов, но и от упруго-эластических характеристик плазмалеммы, подмембранных актинов и актиноподобных белков, обладающих ярко выраженной сократительной способностью (Mills J.W., 1987). Макромолекулы цитоскелета одновременно являются волюмодетекторными и волюмоэффекторными упругими полимерными внутриклеточными элементами, участвующими в регуляции объема клеток (Chen J. et al., 1994; Doctor B.R. et al., 1997). Они препятствуют свободному току воды (Смирнова Е.А. с соавт., 1987), изменяют упруго-эластические свойства мембраны, что отражается на транспортной активности клетки (Сторожок С.А., 1998). Метастабильность мембран, создаваемая взаимодействием белкового каркаса и липидного бислоя с участием элементов цитоскелета, обуславливает модификацию функциональной активности ряда ионтранспортных систем (Орлов С.Н., Гурло Т.Г., 1991), работа которых зависит от трансмембранного и электрического потенциала, а также осмотического давления (Конев С.В., 1987; Lang F., Waldegger S., 1997). Структура элементов цитоскелета изменяется в течении процессов увеличения объема или сжатия клетки. При набухании клетки увеличивается концентра- 38 ция ионов Са2+ (Cornet M. et al., 1994; Erickson G.R. et al., 2003), в результате чего актиновые филаменты деполимеризуются (Ziyadeh F.N. et al., 1992; Mills J.W. et al., 1994; Moran J. et al., 1996) и могут связываться с гельзолином (Stossel T.P., 1989). Деполимеризация сопровождается деградацией фосфотидилинозитол 4,5бифосфата, ингибирующего взаимодействие профилина с филаментами (Lassing I., Lindberg U., 1988a). Процессы деполимеризации и полимеризации обратимы (Ziyadeh F.N. et al., 1992). На искусственно смоделированных экспериментальных системах показано, что актиновые филаменты замедляют осмотически управляемый ток воды через полупроницаемые мембраны (Ito T.K. at el., 1987), посредством стерического взаимопроникновения актиновых филаментов и деформации отдельных нитей актина под влиянием энергии потока воды (Edwards S., Evans K., 1982). Клеточная сеть актиновых филаментов содержит относительно короткие нити связанные нековалентно в различных направлениях посредством актин-сшивающих белков (ABP) (Ito T.K. et al., 1992), которые, в свою очередь, выступают эффективными стимуляторами гелеобразования актина (Hartwig J.H., Stossel T.P., 1981; Gorlin G.R. et al., 1990). ABP организуют перпендикулярное ветвление актиновых филаментов, благодаря чему, создается максимальное количество стержнеобразующих цепей в трехмерной сети, при минимальных контактах сшивки (Hartwig J.H., Stossel T.P., 1989). В результате гель актина, сшитый с помощью ABP, обладает высокой эластичностью и напоминает ковалентно сшитый синтетический полимер (Janmey P.A., Stossel T.P., 1986; Janmey P.A. et al., 1990). Влияние ABP на гелеобразование актина и расход воды представляет физиологическую защиту клеток по периферии от увеличения объема или усадки при колебаниях осмотического давления. Концентрация актина в клетке в среднем составляет 10-20 мг/мл. Колебания давления в районе 10мОсм диапазона детектируется ABP-зависимой сетью актина, которая сопротивляется такому напряжению без сопровождения потока воды через мембрану (Hoffman E.K., Simonses L.O., 1989; Ito T. et al., 1992). При значительном гипотоническом напряжении клеток крови непрерывность белкового каркаса нарушается, что влечет за собой реорганизацию цитоске- 39 лета, обусловленную изменением натяжения и радиуса кривизны мембраны, и является естественным сигнальным фактором активации механочувствительных каналов. Механочувствительные каналы являются универсальными сенсорными преобразователями механической силы в живых клетках (Martinac B., 2004). Исследователи указывают на их раннее эволюционное происхождение, первоначально они возникли как клеточные осморегуляторы (Sachs F., 1988; Kung C., Saimi Y., 1995), а позже стали использоваться в регуляции размера и объема клеток (Chtistensen O., 1987), а также в более специализированные формы механотрансдукции – гравитация у растений (Pickard B.G., Ding J.P., 1992), сократимость сердца у животных (Sigurdson W.J. et al., 1992; Kohl P., Sachs F., 2001). В клетках эукариот установлено присутствие двух основных типов каналов – стрейч-активируемые (SA) и стрейч-инактивируемые (SI) ионные каналы (Sachs F., Morris C.E., 1998). Механочувствительные каналы реагируют на механические силы вдоль плоскости мембраны (Sokabe M. et al., 1991; Sokabe M., Sachs F., 1990), активируются напряжением 10-3 Н/м (Sachs F., 1998) и открываются при растяжении мембраны (Crajowski W. et al., 2005). Доказано, что такие силы реализуются в условиях трансмембранной осмолярности в несколько миллиосм (Martinac B., 1993; Sachs F., 2004). Механочувствительные каналы управляют регуляцией клеточного объема, посредством высокой чувствительности для К+ или анионов (Sackin H., 1994; Kolajova M. et al., 2001; Mohanty M.J. et al., 2001). Однако, они являются неселективными катионными каналами, через которые протекает ток ионов K+, Na+ и Ca2+ (Kondratev D., Giallitelli M.F., 2009). Полагают, что в основе активации механочувствительных каналов лежит высвобождение жирных кислот из билипидного бислоя при растяжении мембраны (Ordway R.W. et al., 1992). Одновременно с этим растяжением активируются молекулы спектрина (Sokabe M. et al., 1991; Hamill O.P., Martinac B., 2004; Kung C.A., 2005). Несмотря на широкий спектр работ, посвященных механизмам функционирования механочувствительных каналов, вопрос об их непосредственном участии в регуляции клеточного объема остается спорным (Sackin H., 1994; Hoffmann E.K. et al., 2009). 40 В активации ионных механочувствительных каналов могут участвовать микрофиламенты как напрямую (Sachs F., Morris C.E., 1998; Martinac B., 2004), так и опосредованно, через актинсвязывающие белки цитоплазмы (Foskett J.K., Spring K.R., 1985). В клетках крови регуляция проводимости ионных каналов SAC осуществляется посредством актинсвязывающего белка филамина, активируемого растяжением (Glogauer M. et al., 1998). В передаче механического сигнала через внеклеточные адгезионные контакты участвует филамин и кортикальный слой актина (Комалетдинова Ф.М., Пинаев Г.П., 2006). Полагают, что встраивание каналов в мембрану при растяжении протекает при непосредственном участии элементов цитоскелета, а работа каналов регулируется посредством киназ и фосфолипидов (Kondratev D, Giallitelli M.F., 2009). При этом активация каналов при растяжении мембраны сохраняется при разрушении актиновой сети (Sokabe M.et al., 1991). Функционально актиновые филаменты цитоскелета могут служить биологическими «электрическими» проводами, передающими электрический ток в форме ионных движений, что имеет значение в сигнальных внутриклеточных механизмах и реализации функциональной связи с мембранными ионными каналами (Cantiello H.F. et al., 1991a; Prat A.G., 1993). Показано, существование вокруг актиновых филаментов жестко «привязанных» ионных облаков (Parodi M. et al., 1985), которые могут двигаться вдоль длинных актиновых полимеров (Oosawa F., 1970). Учитывая, эффективный радиус облака вокруг актиновых филаментов около 8 нм (Zimm B.H., 1986; Pollard T.D., Cooper J.A., 1986), исследователи полагают, что актиновые филаменты могут существовать в сложной динамической сети и сохранять электрическое экранирование друг от друга. Стимуляция актиновых филаментов генерирует солитоноподобные нелинейные волновые структуры, которые образуются за счет конденсации ионов вокруг актиновых филаментов. Эти волны выполняют биологическую роль в качестве внутриклеточных сигнальных механизмов (Lin E.G., Cantiello H.F.,1993). Молекулы актина принимают участие в регуляции активности каскадов вторичных мессенджеров: протеинкиназы С (Rosales O.R., Sumpio B.E., 1992), 41 аденилатциклазы (Watson P.A., 1991) и фосфолипазы А2 (Thoroed S.M. et al., 1994), в ответ на механическую деформацию цитоскелета (Cantiello H.F. et al., 1991;Grajkowski W. et al., 2005). Показана связь актиновых филаментов с одиночными открытыми ионными каналами (Cantiello H.F. et al., 1991; Cantiello H.F. et al., 1993; Prat A.G. et al., 1993), в частности с α- субъединицей Na+-K+-АТФазы (Devarajan P. et al., 1995) и натриевыми каналами напряжения в клетках головного мозга (Srinivasan Y. et al., 1988). Методом patch-clamp установлено участие актиновых микрофиламентов в активации хлоридных каналов в эпителиальных клетках почки (Suzuki M. et al., 1993; Schwiebert E.M., 1994) и клетках миеломы (Levitan L. et al., 1995). Таким образом, воздействие механических сил на клетку посредством сложных молекулярных взаимодействий запускает внутриклеточные сигнальные процессы. В передачу механического сигнала вовлечены компоненты цитоскелета – филамин, актиновые микрофиламенты и микротрубочки. В фибробластах описан новый белок CLIP-170, который взаимодействует с растущими концами микротрубочек, а также с β-актином и филамином (D’Addario M. et al., 2001), причем он способен перемещаться от центра организации микротрубочек к периферии клетки (D’Addario M. et al., 2003). 1.1.4 Роль Са2+-сигнальных путей в регуляции объема клеток крови В объемную регуляцию ион-транспортных систем вовлечены различные механизмы внутриклеточной сигнализации. Известен целый ряд функций плазматической мембраны, реализация которых опосредована определенной концентрацией внутриклеточного Са2+, таких как транспорт одновалентных катионов, анионный обмен, спектрин-актиновые взаимодействия (Карагодина З.В., 1984; Cala 42 P.M. et al., 1986; Wong S.M.E., Chase H.S., 1986; Foskett J.K., 1994; Hoffman E.K., 2000; Tinel H. et al., 2000). В некоторых случаях RVD зависит от притока Cа2+ через плазмалемму (Wong S.M. et al., 1990; Montrose-Rafizadeh C., Guggino W.B., 1991), в то время как в других типах клеток ответ опосредуется высвобождением Са2+ из внутриклеточных депо (Negulescu P.A. et al., 1992; Terreros D.A., Kanli H., 1992). Высказано предположение о том, что Са2+ напрямую может активировать ионные каналы во время RVD (Hazama A., Okada Y., 1988; McCarty N.A., O’Neil R.G., 1992). В частности, цитозольный Са2+ контролирует активацию объем регуляторного К+-транспорта во время увеличения объема лимфоцитов, причем этот эффект опосредован кальмодулином (Grinstein S. et al., 1982b; Cala P.M., 1983; Hoffman E.K. et al., 1984; Foskett J.K., Spring K.R., 1985; Sarkadi B. et al., 1985; Davis C.W., Finn A.L., 1987), а также волюморегуляторных Cl- -каналов (Hazama A., Okada Y., 1988). В ответ на повышение Са2+ возрастает К+-проводимость необходимая для восстановления объема (Bergeron L.J. et al., 1996). Основным сенсором, регистрирующим увеличение концентрации цитозольного Са 2+, выступает цитоплазматический рецептор Р2. В результате пара Са2+-Р2 запускает работу К+каналов (Wong S.M.E., Chase H.S., 1986; Light D.B. et al., 2002). Открытие Сазависимых К+ -каналов наблюдается в области концентраций 1-2 мкМ Са2+ (Орлов С.Н., Шевченко А.С., 1978; Simons T.G.B., 1976). На эритроцитах собаки крови показано увеличение проницаемости их мембран для Са2+ во время увеличения объема (Parker J.C., 1979), при этом выход воды из осмотически набухших эритроцитов требует внешнего Са2+ (Parker J.C. et al., 1975). Повышение концентрации внутриклеточного Са2+ в одной из фаз R D исследователи связывают с внеклеточным происхождением в случае лимфоцитов человека (Sarkadi B. et al., 1984b) и мочевого пузыря лягушки (Davis C.W., Finn A.L., 1987), а также высвобождением Са2+ из внутриклеточных депо в эритроцитах утки (Kregenow F.M., 1971), клетках асцитной опухоли Эрлиха (Hoffman E.K. et al., 1984) и модифицированных стволовых клетках (Roy G., Sauve R., 1987). Участие цитозольного Са2+ в активации Cl- проводимости при R D основаны на наблюдении Cl-транспорта при усадке клеток асцитной опухоли Эрлиха под 43 влиянием ионофора А23187 (Hoffman E.K. et al., 1986), а также в лимфоцитах при осмотическом набухании (Hoffman E.K., 1985; 1986; Cahalan M.D., Lewis R.S., 1988). Кроме того, волюморегуляторные анионные пути могут быть активированы в Са2+-обедненных клетках (Grinstein S. et al., 1982b). В клетках крови изменение концентрации внутриклеточного Са2+ связано с активацией клеточных киназ и фосфатаз, регуляцией цитоскелет связывающих белков, транскрипционным контролем и модуляцией поверхностных рецепторов (Schraff O., Foder B., 1993; Revankar C.M. et al., 2006). Возрастание Са2+ в клетках крови осуществляется путем высвобождения из внутриклеточных депо, либо путем активационного входа через плазмалемму из окружающей среды. В отличие от других типов клеток в лимфоцитах периферической крови при инкубации в гипотонической среде наблюдается незначительное увеличение компартментализованного Са2+ из внутриклеточных депо (Rink T.J. et al., 1983), что связано с малым содержанием ЭПС в лимфоцитах (около 1% от общего объема). В связи с чем, необходимый для активации лимфоцитов уровень внутриклеточного Са2+ обеспечивается за счет входа экстраклеточного Са2+ через ионные каналы в течение нескольких часов (Feske S., 2007; Gwack Y. et al., 2007). Принято считать, что в электрически невозбудимых клетках крови функционируют катионные каналы суперсемейства белков TRP (transient receptor potential channels), включающее 29 белков, которые осуществляют дозозависимый вход экзогенного Са2+ (Montell C. et al., 2002; Chapham D.E., 2003). Полагают, что эти каналы участвуют в кальциевой сигнализации клеток крови. В клетках лимфобластной лейкемии установлена эндогенная экспрессия высокоселективных Са2+-каналов TRPV5 и TRPV6, подобных каналам TRPV5 в нормальных Тлимфоцитах человека (Semenova S.B. et al., 2005; Семенова С.Б., Негуляев Ю.А., 2006; Васильева И.О. с соавт., 2008). Посредством каналов CRAC (calcium release activated calcium channel) осуществляется основное поступление эндогенного Са2+ (Hoth M., Penner R., 1992; Zweifach A., Lewis R.S., 1993). Однако к настоящему времени каналы CRAC пока не идентифицированы. В настоящее время открыт белок Orail, который возможно 44 является кандидатом эндогенных каналов CRAC в лимфоцитах (Feske S. et al., 2006). Повышение внутриклеточной концентрации Са2+ в Т-лимфоцитах, при связывании TCR с антигеном запускает транскрипционные программы, в результате чего секретируются эффекторные цитокины (Dolmetsch R.E. et al., 1997). Повышение концентрации Са2+ в В-лимфоцитах ответственно за увеличение К+проводимости (Grinstein S. et al., 1982a). В лимфоцитах идентифицировано три типа К+-каналов: Са2+-активируемых (СТХ-чувствительные), Са2+-независимые (СТХ-чувствительные), СТХ-нечувствительные каналы. Предполагают, что СТХчувствительные Са2+ активируемые К+-каналы могут быть активированы при постоянном токе Са2+ в процессе R I в ответ на растяжение мембраны(Grinstein S., Smith J.D., 1990). В литературе приведены доказательства участия Са2+ зависимых внутриклеточных мессенджеров и ферментов (таких как кальмодулин, фосфолипаза А2, эйказаноиды и киназы) в регуляции клеточного объема (McCarty N.A., O’Neil R.G., 1992; Strange K., 1994a; Rubera I. et al., 1997; Hoffman E.K., 2000; Tinel H. et al., 2000). Полагают, что вторичные мессенджеры (инозитолтрифосфат, циклические нуклеотиды) играют ключевую роль в процессах мобилизации Са2+ из внутриклеточных депо, в результате чего активируются К+-каналы, ответственные за регуляторное восстановление объема (Christensen By. S. et al., 1988). Кроме того, от уровня внутриклеточного Са2+ зависит участие элементы цитоскелета в регуляции объем, поскольку он запускает полимеризацию актина (Mills J.W. et. al., 1994a; Hoffman E.K., 2000). Ионы Са2+ оказывают существенное влияние на межмолекулярные взаимодействия белков мембранного цитоскелета (Сторожок С.А. с соавт., 1997). Получены данные о вовлечении кальмодулина в Са2+ инициируемое изменение проницаемости эритроцитов для К+ (Lackington I., Orrego M., 1981; Орлов С.Н., Кравцов Г.М., 1989). Включение Са2+ в регуляцию механических свойств мембраны эритроцита обеспечивается кальмодулинзависимой активацией аддуцина, модулирующего спектрин-актиновое взаимодейст- 45 вие, и кальцийзависимой протеинкиназы С, что приводит к фосфорилированию белковых комплексов цитоскелета (Сторожок С.А. 1998). Кальцийзависимая регуляция свойств мембраны изменяет скорость трансмембранного ионного обмена. Попадая в клетку Са2+, активируя фосфодиэстеразу, вызывает потерю фосфоинозитида внутренней поверхности бислоя с выделением 1,2-диацил-sn-глицерола (Alan D., Michell H., 1978; Ткачук В.А., 2001), кроме того, активирует Са-завивимую протеинкиназу (King L.E. et al., 1977; Allen D.W., Cadman S., 1979; Siegel D.L. et al., 1980; Croall D.E., 1986) и при высоких концентрациях стимулирует активность эндогенных трансглютаминаз (Anderson D.R. et al., 1977; Palek J. et al., 1978; Lorand L. et al., 1983), которые вызывают необратимую перекрестную сшивку элементов цитоскелета (Siefring G.E.Jr. et al., 1978). В частности показано, уменьшением скорости обмена анионов (Motais R. et al., 1981) и Na,K-котранспорта (Garay R.P., 1982), при увеличении Са2+свыше 10 мкМ в эритроцитах. Молекулы спектрина подвергаются перекрестному сшиванию за счет активации трансглютаминазы, что является причиной изменения морфологии эритроцитов. Кроме того, Са2+ нагрузка на эритроциты приводит к снижению связывания цитоскелета с мембраной (Anderson R.A., Lovrien R.E., 1984; Pasternack G.R. et al., 1985), посредством активации протеинкиназы С, которая осуществляет Са2+-зависимое фосфорилирование белка полосы 4.1., в результате снижается сила связи спектрина и актина (Cohen C.M., Foley S.F., 1982; Eder P.S. et al., 1986; Chandra R. et al., 1987). При увеличении концентрации внутриклеточного Са2+ включается система обратной связи, его удаление осуществляется через Са2+-АТФазу плазматических мембран (PMCA), Na+/Ca2+-обменник (NCX) (Пестов Н.Б. с соавт., 2003). Наиболее полно PMCA изучена в эритроцитах человека, в которых установлено присутствие двух изоформ РМСА1 и РМСА4. Увеличение количества РМСА в мембранах происходит в ответ на первичное повышение концентрации внутриклеточного Са2+ (Пестов Н.Б. с соавт., 2003). Эффективность ее функционирования зависит от анионного состава среды. Установлено, что фосфат в концентрации 10мМ активирует АТФ-азную активность РМСА в 2,5 раза (Waisman D.M. et al., 1981). 46 РМСА эритроцитов связана и регулируется кальмодулином (Yao Y. et al., 1996). Повышение внутриклеточной концентрации Са2+ вызывает активацию кальмодулина (Foder B., Schraff O., 1981). 1.1.5 Роль аденилатциклазных путей в регуляции объема клеток В регуляции клеточного объема определенная роль отводится гормонам, которые изменяют состояние элементов цитоскелета и модифицируют работу ионных переносчиков (Сторожок С.А. с соавт., 1997). Во многих типах клеток катехоламины вызывают активацию мембранного транспорта, в результате чего клетка претерпевает регуляторное изменение объема (Kaloyianni M., Doukakis I., 2003). В невозбудимых клетках крови при связывании β-адренергических агонистов с мембранными рецепторами происходит усиление фосфорилирования (Nelson M.J., Huestis W.H., 1980), в результате чего активируется мембранная β-форма фосфолипазы С, посредством сопряженных с рецепторами ГТФ-связывающих Gбелков. Образование комплекса между G-белком и рецептором инициирует замещение в активном центре ГДФ на ГТФ, в результате чего G-белок приобретает способность связываться с фосфолипазой С. Высказано предположение, ионы Са2+ изменяют активность киназ и фосфатаз, посредством фосфорилирования. Эндогенная АТФ регулирует процессы фосфорилирования и дефосфорилирования белков, поэтому концентрация пула АТФ влияет на активность объемрегулирующих транспортных систем (Mosior M. et al., 1990; Lauf P.K. et al., 1992; Mosior M. et al., 1992). Гидролизуя трифосфоинозитид (ТФИ), фосфолипаза С образует два вторичных мессенджера – инозитол-1,4,5-трифосфат (PIP3) и диацилглицерол (DAG). 47 PIP3 диффундирует к ЭПС и связывается с рецептором-каналоформером, что приводит к выходу Са2+ из ЭПС. DAG, оставаясь связанным с плазмалеммой соединяется с протеинкиназой С, которая фосфорилирует белки цитоскелета, хроматина и мембран, а также повышает сродство протеинкиназы С к Са2+, что приводит к активации процессов фосфорилирования в клетке (Авдонин П.В., Ткачук В.А., 1994). Эритроциты лягушек и форели особенно чувствительны к высоким уровням циркулирующих катехоламинов, которые увеличивают концентрацию внутриклеточного Na+ и вызывают набухание клетки (Baroin A. et al., 1984; Sorensis B., Weber R., 1995; Kaloyianni M., Rasidaki A., 1996; Kaloyanni M. et al., 1997). Набухание эритроцитов лягушек Rana balcanica исследователи связывают с работой Na/H– обменника (Kaloyianni M. et al., 1997; 1999), функциональная активность которого контролируется уровнем внутриклеточного рН и опосредована увеличением концентрации сАМФ, посредством взаимодействия гормонов с мембранными рецепторами βα1 и α2- типа в красных клетках Rana balcanica (Kaloyianni M., Rasidaki A., 1996; Kaloyanni M. et al., 1997; 2000a; 2000b). Увеличение объема эритроцитов лягушек после обработки их адреналином сопряжено c транспортом глюкозы. Установлено, что эритроцитарные мембраны лягушек лишены транспортеров глюкозы. Увеличение транспорта глюкозы происходит путем совместного механизма с ионами Na+ в процессе осмотического увеличения объема после обработки адреналином. Следовательно, транспорт глюкозы опосредован механизмами катехоламинчувствительного увеличения объема клеток (Kaloyainni M., Doukakis I., 2003). Стимуляция катехоламинами транспорта сахаров показана на красных клетках птиц (Simons T.J., 1983; Tiihonen K. et al., 1995) и рыб (Kirk K., et al., 1992; Tse Ch. M., Yuong J.D., 1990). В эритроцитах форели норадреналиновый сигнальный каскад оказывает тормозящее действие на процессы активации объем регулирующего транспорта, в то время как адреналин и изопротеринол вызывают набухание клеток. Взаимодействие норадреналина (1,0 ммоль/л) с β-адренорецепторами в изоосмотической среде при физиологической концентрации Na+ приводит к набуханию клеток. В 48 течение 4-х ч инкубации эритроциты постепенно набухают в такой же степени, как и при изменении осмолярности среды с 330 mOsmol kg 21 K до 255 mOsmol kg 21 K (Fugelli K., Thoroed S.M., 1986). В отличие от клеток, помещенных в гипотонические условия, норадреналин стимулированные клетки не уменьшают свой объем по отношению к первоначальному (Thoroed S.M. et al., 1995). Эритроциты млекопитающих, в отличие от низших позвоночных, не обладают катехоламининдуцированным набуханием (Nikinmaa M., 1992). Катехоламиновые рецепторы описаны в клетках многих позвоночных. Например, эритроциты камбалы (Fugelli K., Reiersen L.O., 1978; Fugelli K., Thoroed S.M., 1986), радужной форели (Tetens V. et al., 1988) и индейки (Andrè C. et al., 1981) содержат β1-рецепторы. Рецепторы эритроцитов лягушек (Mukherjee C. et al., 1975) имеют высокое сродство к β2-рецепторам человека (Sager G., 1983) и крысы (Kaiser G., et al., 1978). β1 и β2- рецепторы эритроцитов млекопитающих характеризуются следующей чувствительностью к катехоламинам соответственно ISOP>NA>A и ISOP>A>NA (Lands A.M. et al., 1967; Stene-Larsen G., 1981). Функциональная активность адренорецепторов на поверхности клеток непостоянна и регулируются процессами фосфорилирования и интернализации (Ariens E.J., Simons A.M., 1980; Cherksey B.D. et al., 1980; Briggs M.M., Lefcowitz R.J., 1982). Одним из характерных физиологических состояний β- адренорецепторов является их десенсебилизация (Remold-O’Donell E., 1974), которая коррелируют со снижением β-рецептор опосредованного цАМФ (DeVellis J., Brooker G., 1974; Franklin T.J. et al., 1975; Johnson G.L. et al., 1978), а в некоторых случаях и потерей β-адренорецпторов (Mickey J.V. et al., 1975; Kebabian J.W. et al., 1975; Shear M.P. et al., 1976). Отсутствие способности к реагированию без уменьшения плотности рецепторов предполагает функциональное разобщение в β-рецептораденилатциклазной системе и представляет один из механизмов обратной связи в симпатоадреналовой системе (Feldman R.O. et al., 1983). Распознавание адреналина, норадреналина и синтетических аналогов катехоламинов осуществляется посредством белков клеточной мембраны – адренорецепторов (Авакян О.М., 1988; Каверина Н.В., 1980). В настоящее время выделены 49 и очищены α- и β- адренорецепторы, исследованы их структура и функции, выделено четыре подтипа β-адренорецепторов (Перцева М.Н., 1989). Связующим звеном между адренорецептором и сигнальными путями внутри клетки являются Gбелки (Сергеев П.В., Шимоновский Н.Л., 1987). За связывание с адренорецепторами конкурируют адреноблокаторы и катехоламины. Адреноблокаторы препятствуют активации адренорецепторов (Перцева М.Н., 1976; Каверина Н.В. с соавт., 1980; Авакян О.М, 1988). Адреноблокаторы могут действовать на разные типы и подтипы адренорецепторов. Так, пропраналол блокирует β1- и β2-адренорецепторы (неселективный β-адреноблокатор). Метопролол, бетаксолол и атенолол блокируют преимущественно β 1- адренорецепторы (селективные β1-адреноблокаторы), хотя могут влиять и на β2адренорецепторы (Каверина Н.В. с соавт.,1977). Важную роль в осуществлении адренергической рецепции играют тиоловые группы белков (Манухин Б.Н., 1968). Возможно взаимопревращение α- и β- адренорецепторов друг в друга при изменении условий среды (Veuter J.C., Fraster C.M. 1983). Адреналин оказывает стимулирующее влияние на рецепторы иммунных клеток, изменяя их активность (Boxer L.A. et al., 1980; Wenisch C. et al., 1996; Rainer T.H. et al., 1999). На поверхности иммунных клеток присутствуют α- и βадренорецепторы. Установлено, что β-адренергическая стимуляция в отличие от α-адренергической подавляет функции лейкоцитов (Hozn N.A. et al., 2005). Адреналин, связываясь с α2- и β2-адренорецепторами, изменяет функциональную активность лимфоцитов (Coupade C. et al., 2007). β2-адренорецепторы представлены на поверхности всех лимфоцитов за исключением Th2 (Sanders V. et al., 1997). Ингибирование пролиферации Th1 происходит через систему цАМФ/протеинкиназа А (Feldman R. et al., 1987; Bauman G. et al., 1994). Данный эффект наблюдали во время стимуляции β2-адренорецепторов Th1, при которой возрастала концентрация сАМФ и протеинкиназы А, на фоне прекращения пролиферации лимфоцитов (Minakuchi R. et al., 1990). Различное иммуномодулирующее действие α- и βадренергической стимуляции является следствием активации различных внутриклеточных путей. На молекулярном уровне α-адренергическая стимуляция акти- 50 вирует ядерный фактор –кВ, посредством которого активируется протеинканаза С и увеличивается концентрация внутриклеточного Са2+ (Exton J.H., 1985; Le Tulzo Y., et al., 1997), тогда как β-адренергическая стимуляция приводит к увеличению цАМФ, которая стимулирует работу протеинкиназы А, мигрируя в ядро, протеинкиназа А блокирует ядерный фактор - –кВ (Shirakawa F., Mizel S.B., 1989; Barnes P.J., 1995). 1.2. Структурно-функциональная организация ядра и его участие в регуляции объема клетки В современной науке разработана концепция ядерной архитектуры (Taddei A. et al., 2004; Misteli T., 2005). Клеточные ядра представляют собой высоко динамичные структуры, в которых компартменты взаимодействуют друг с другом, что приводит к их высокой реактивности (Foster H.A., Bridger J.M., 2005). Ядерная архитектура является результатом морфологической и функциональной гетерогенности в расположении субъядерных отсеков. Субъядерный отсек определяется как макроскопическая область внутри ядра, морфофункционально отличающаяся от других отсеков (Misteli T., 2005). В ядре выделяют два отсека – ядреное тело и хромосомная территория. Полагают, что хромосомные домены проделывают в нуклеоплазме каналы, создавая пористую структуру, увеличивающую доступную площадь поверхности для различных ядерных факторов (Creme T., Cremer C., 2001). В настоящее время гетерохроматиновые отсеки считаются большими репозиториями репрессирующих факторов (Taddei A. et al., 2004). Ученые выдвигают идею о существовании тонкой надстройки крупных доменов хроматина, хромосомных территорий и субъядерных отсеков посредством метилирования ДНК и модификации гистонов (Espada J., Esteller M., 2007). 51 В составе генома эукариот выделены фракции конститутивного, факультативного гетерохроматина и эухроматина (Grunau C., 2004). С периферической частью ламины тесно связаны гетерохроматин и теломерные области хромосом, в то время как с внутриядерной частью ламины связаны участки инициации, репликации и транскрипции ДНК (Bridger J.M. et al., 1993; Moir R.D. et al., 1995). В условиях гипотонии все компартменты интерфазного ядра вместе с хроматином и ядрышками декомпактизуются (Зацепина О.В. с соавт., 1982; Киреев И.И. с соавт., 1990). Подобная картина установлена и в митотических клетках (Жарская О.О., Зацепина О.В., 2005). Причем, компактные округлые хромоцентры разрыхляются и принимают вид кластеров, состоящих из глобул и фибрилл (Голышев С.А. с соавт., 2008). В клетках человека позиционирование хромосом не наследуется, а создается заново в ранней G1 фазе (Walter J. et al., 2003; Thomson I. et al., 2004). Установлено, что корреляции между структурой хроматина и активностью генов не так сильны, как считалось ранее (Gilbert N. et al., 2005). В условиях злокачественной трансформации клеток происходит изменение ядерной архитектуры и генной функции. В частности изменяется форма ядра, организация хроматина, текстура доменов хромосом, размер ядра, размер и количество ядрышек (Zink D. et al., 2004). Ведущая роль в регуляции жизнедеятельности клетки принадлежит кариолемме, состоящей из внешней и внутренней мембран, разделенных перинуклеарным пространством. Внутренняя ядерная мембрана и ядерные поровые комплексы контактируют с филаментами внутриядерного матрикса – ламиной (Kiseleva E. et al., 2004). Согласно данным конфокальной микроскопии во многих типах клеток млекопитающих, в том числе и в форменных элементах крови, ядерная оболочка может образовывать глубокие инвагинации, диаметром 200-400 нм, простирающихся во внутреннее пространство (Fricker M. et al., 1997). За расположение ядра в цитоплазме клетки отвечают белки несприны, расположенные в наружной ядерной мембране и в большинстве ЭПС (Zhang Q. et al., 2001; Young R.G., Kothary R., 52 2005). Несприны включают спектринсодержащие повторы, обнаруженные в плазмалемме и ряде цитоплазматических белков, таки как дистрофин и α-актин (Worman H.J., Courvalin J., 2005). Несприны тесно связаны с белками семейства 4.1, которые вместе с актином входят в состав филаментов цитоскелета ядра и прикрепляются к ядерным поровым комплексам (Kiseleva E. et al., 2004). Установлена связь ядерной оболочки с внеклеточным матриксом посредством белка наружной ядерной мембраны ядо-насприн-3, который соединяясь с промежуточными филаментами цитоскелета, с помощью белка плектина, связывается с интегринами плазмалеммы (Wilhelsmen K. et al., 2006). Ядерно-цитоплазматическая активность клеток обеспечивается транспортом регуляторных факторов через ядерные поры (Губанова Н.В., Киселева Е.В., 2007). В структуре ядерной поры выделяют периферический канал около 5 нм, через который диффундируют ионы и мелкие нейтральные белки (Gӧrlich D., Kutay U., 1999; Kiseleva E. et al., 2000). Согласно данным электронной микроскопии ядерные поры связаны с филаментами ламины (Akey C.W., 1989; Goldberg M.W., Allen T.D., 1996), и обеспечивают ядерно-цитоплазматический транспорт. Согласно данным сравнительного электронно-микроскопического анализа ядерный поровый комплекс у высших животных и низших растений имеет консервативную и сходную структуру (Губанова Н.В. с соавт., 2006). Он обеспечивает транспорт около 400 молекул различных веществ за секунду (Macara I.G., 2001). Ионы и молекулы диаметром меньше 9 нм пассивно диффундируют через периферические каналы и центральный канал поры. Более крупные белки, РНП-частицы, транспортируются через поры посредством активного транспорта с помощью малой ГТФазы Ran. Направление ядерно-цитоплазматического транспорта обеспечивает градиент концентраций Ra-ГТФ/Ran-ГДФ и фактор NTF2 (Smith A. et al., 1998; Ribbeck K. et al., 1999), который вовлечен в формирование ламины и одновременно функционирует как транскрипционный фактор (Сорокин А.В. с соавт., 2007). Диффузия белков через ядерные поры является энергозависимым процессом и связана с селективным фильтром в центральном канале (Ohba T. et al., 2004). К настоящему времени изучен целый ряд белков, транспортируемых между цито- 53 плазмой и ядром, включающий факторы транскрипции, транспортные рецепторы, регуляторы клеточного цикла и множество РНК-связанных белков, рецепторы стероидных гормонов (Gӧrlich D., Kutay U., 1999; Pines J., 1999; Yang J., Kornbluth S., 1999; Cartwirght P., Helin K., 2000; Shyu A.B., Wilkinson M.F., 2000). В условиях осмотического стресса исследователи указывают на два основных механизма регуляции ядерно-цитоплазматического транспорта. Один из которых связан с миграцией Са2+-связывающего белка – кальмодулина в ядро, за счет свободной диффузии, либо посредством энергозависимого транспорта. При чем тип транспорта, а также распределение кальмодулина между ядром и цитоплазмой зависят от уровня Са2+ в цитозоле и взаимодействия его с кальцийсвязывающими белками, которые транспортируются в ядро при помощи факторов транскрипции с затратой энергии (Pruschy M. et al., 1994). Второй механизм связан с транспортом ядерно-цитоплазматических сигнал регуляторных факторов, таких как Hog1 и TonEBP. При снижении осмолярности среды установлено ингибирование транспорта из ядра белка высоко осмолярного глицерол сигнального пути (Hog1p). Основной механизм ингибирования связан с процессом фосфорилирования белка Hog1p киназой Pbs2p по остаткам Tr174 и Tyr176, что делает недоступным фактор транскрипции NES для связывания с экспортином 1 (Ferrigo P. et al., 1998). Одним из уникальных осморегуляторных механизмов для позвоночных считается NLS транспорт фактора TonEBP, который имеет различное цитоплазматическое распределение в зависимости от тоничности среды в пределах от 135 до 500 mOsmmol/kg (Yoshida T. et al., 2006; Zhang Z. et al., 2005). При тоничности среды 135 mOsmmol/kg около 30% от общего объема TonEBP локализуется в ядре, при увеличении осмолярности среды до 500 mOsmmol/kg – в ядре обнаруживается около 60% TonEBP. Установлено, что изменение тонуса окружающей среды приводит к перераспределению фактора TonEBP между ядром и цитоплазмой за 30 мин (Kwon M.S. et al., 2008). Импорт фактора TonEBP в ядро опосредован рецептором NLS (Kwon M.S. et al., 2008), а экспорт TonEBP в ответ на гипотонию не зависит от экспрессии рецептора CRM1 и дискретных единиц NES (Nakielny S., Dreyfuss G., 1999). 54 1.3. Цитоархитектоника клеток крови 1.3.1 Структурно-функциональная организация цитоскелета клеток крови В клетках крови цитоскелет представлен тремя основными видами филаментов, состоящих из белковых субъединиц – актиновые микрофиламенты, микротрубочки и промежуточные филаменты. Элементы цитоскелета принимают участие в пространственном расположении клетки, обеспечивают ее биохимические и биофизические связи с внеклеточным матриксом, координируют клеточные движения и изменения формы (Fletcher D.A., Mullins R.D., 2010). Согласно данным литературы элементы цитоскелета участвуют в регуляции работы ионных каналов (Negulaev Yu. A. et al., 1996; 2000; Shumilina E.V. et al., 2003; Mazzocci C. et al., 2006), передаче внутриклеточного сигнала и регуляции экспрессии генов (Ingber D., Folkman J., 1989; De Lanerolle P., Cole A.B., 2002; Ingber D.E., 2002), транспорте мРНК и транскрипции (Bassel C.J., Singer R.H., 1997; Grummt I., 2006; Miralles F., Visa N., 2006; Percipalle P., Visa N., 2006), регуляции активности ферментов (Su Y. et al., 2005). С актиновыми структурами цитоскелета связаны поддержание формы клеток, движение, экто- и эндоцитоз (Egea G. et al., 2006). Архитектура сетей цитоскелета контролируется несколькими классами регуляторных белков: 1) факторы, способствующие формированию нитей; 2) capping-белки, заканчивающие точки роста; 3) полимеразы, обеспечивающие быстрый и устойчивый рост нитей; 4) деполимеризующие факторы, разбирающие нити; 5) сшивающие и стабилизирующие белки, которые организуют сетевые структуры более высокого порядка (Фултон А., 1987; Fletcher D.A., Mullins R.D., 2010). Деполимеризация структур цитоскелета происходит под влиянием экзо- и эндогенных сигнальных веществ., в результате чего глобулярный G-актин может обратимо полимеризоваться в F-актин (Pantaloni D. et al., 2001; Dos Remedios C.G. et al., 2003; Pollard T.D., Borysi G.G., 2003; Winder S.J., Ayscough K.R., 2005). Ак- 55 тиновые глобулярные белки из мономеров G-актина имеют участки связывания нуклеотидов (АТФ, цАМФ, цГМФ) и бивалетных катионов (Ca2+, Mg2+, Mn2+). В результате полимеризации они образуют экономичный тип структур – спиральные филаменты, которые полярны (головные и хвостовые части имеют различное химическое строение). Актинсвязывающие белки способствуют нуклеации новых актиновых филаментов, например, Arp/2 комплекс, формины, леомодин (Chesarone M.A., Goode B.I., 2009), либо инициируют разрывы и деполимеризацию актина, такие как АДФ/кофилины, гельзолин (Ono S., 2007). Ряд актинсвязывающих белков, локализованных под поверхностью мембраны, такие как эзрин (Kaul S.C. et al., 1999), зиксин Nix D.A. et al., 2001), паксилин (Woods A.J. et al., 2002), α-актинин (Бабаков В.Н. с соавт., 2004), филамин (Ozzane D.M. et al., 2000; Loy C.J. et al., 2003), способны мигрировать в ядро и одновременно выступать матрицами для взаимодействия с сигнальными молекулами. У млекопитающих в клетках мезенхимального происхождения, в том числе в форменных элементах крови выделен филамин А (Feng Y., Walsh C.A., 2004). Фрагменты молекул филамина А мигрируют в ядро вместе со связанными адренергическими рецепторами, где запускают экспрессию генов, взаимодействуя с ДНК (Ozzane D.M. et al., 2000; Loy C.J. et al., 2003). Актинсвязывающий белок филамин (ABP280) способен формировать ветвящиеся структуры из актина (Hartwig J.H., Stossel T.P., 1975), которые сосредоточены в клетках на концах стресс-фибрилл (Weihing R.R., 1985) и ведущем крае ламелоподий (Alberts B. et al., 2002). Подвижность клеток во многом зависит от содержания в них филамина. При низком содержании филамина в клетке формируются ортогональные структуры, а при высоком – образуются пучки параллельно ориентированных нитей актина (Комалетдинова Ф.М., Пинаев Г.П., 2006). Точная реконструкция актинового цитоскелета требует жесткой пространственной и временной регуляции сборки и организации актиновых филаментов. Деятельность большого числа актинсвязывающих белков регулируют фосфоинозитиды, особенно PIP2, который ускоряет полимеризацию актина, а также подавляет разборку актиновых филаментов на клеточной мембране (Barret C. et al., 56 2000; Balla T., 2005; Carvalho K. et al., 2008). Одним из первых доказательств существования тесной связи между фосфоинозитидами и актиновым цитоскелетом было представлено в работах Anderson R.A., Marchesi V.T. (1985), которые показали, что PIP2 увеличивает взаимодействие между актиновыми микрофиламентами и плазматической мембраной в красных клетках крови. Позднее было установлено, что PIP2 непосредственно связывается с профилином, выступающим актинмономер-изолирующим белком, это вызывает высвобождение G-актина из профилин-актинового комплекса (Lassing I., Lindberg U., 1985; 1988a; 1988b). Деятельность актинового цитоскелета регулируется белками семейства малых ГТФаз – Rho-семейство, WASP, Arf, ERM, механизмы реорганизации которых хорошо изучены (Nisimotoa Y., Ogawa H., 2002; Vadlamudi R.K. et al., 2002; Stossel T.P., Hartwig J.H., 2003; Brakebusch C., Fӓssler R., 2003; Tigges U. et al., 2003; Woo M.S. et al., 2004; Gkretsi V. et al., 2005; Wu C., 2005). Установлено, что, фосфоинозитиды, PIP3 взаимодействуют с регуляторами из семьи Rho ГТФаз, что вызывает образование специализированных нитей актина в клетках (Chatah N.E., Abrams C.S., 2001; Heasman S.J., Ridley A.J., 2008; Hilpela P. et al., 2004). Члены семейства VASP и ERM белков объединяют актин-ремодулирующие сигналы, поступающие от PIP2 и Rho-ГТФаз, которые передают на актиновые филаменты в лейкоцитах крови (Pestonjamasp K. et al., 1995; Roy C. et al., 1997; Miki H., Takenawa T., 1999). Мультимолекулярный комплекс, включающий белки Ena/VASP и WASP, образуется при участии Т-клеточного рецептора (Sechi S.A., Wehland J., 2000), что имеет важное значение при ремоделировании актинового цитоскелета в процессе активации Т-лимфоцитов (Krause M. et al., 2000). С белками семейства Rho взаимодействует филамин А посредством белка мигфилина (Takafuta T. et al., 1998; Tu Y. et al., 2003). Взаимодействие мигфилина и филамина с интегринами и белком Mig-2, входящими в состав фокальных контактов (Gkretsi V. et al., 2005; Wu C., 2005), приводит к реорганизации системы актиновых филаментов, формирующих адгезионные контакты (Stossel T.P., Hartwig J.H., 2003). Для актиновых филаментов характерна множественность тканеспецифичных форм (Фултон А., 1987). В клетках крови выделено две изоформы актина – β 57 и γ, причем соотношение между этими изоформами различно (Хайтлина С.Ю., 2007). Эритроциты позвоночных содержат β-актин, локализованный под клеточной мембраной в морфологических структурах – ламелле и на концах стрессфибрилл (Pinder J.C., Gratzer W.S., 1983). В лейкоцитах присутствуют две изоформы актина β и γ. β-актин локализован в участках клетки, задействованных в передвижении, а именно раффлах мембран, псевдоподиях и на краю цитоплазмы в ламелле. В покоящихся частях клетки локализован γ-актин (Hoock T.C. et al., 1991). Установлено, что в клетках крови соотношение между β- и γ-актинами поддерживается на постоянном уровне. Регуляция этого соотношения осуществляется вследствие сегрегации мРНК, с помощью механизмов посттрансляционных модификаций, а также различной скоростью полимеризации изоформ актина (Prochniewicz E., Yanagida T., 1981; Toyama S., Toyama S., 1988; Khaitlina S.Yu. et al., 1999; Khaitlina S.Yu., Hinssen H., 2000). Установлена корреляция между распределением мРНК β-актина и направлением, а также интенсивностью движения клетки (Kislauski E.H. et al., 1997). Микрофиламенты принимают активное участие в транспорте мРНК β-актина (Sundell C.L., Singer R.H., 1991). Посттрансляционные модификации β-актина связаны с аргинилированием N-концевого аминокислотного остатка. Показано взаимодействие N –конец β-актина с актинсвязывающими белками, такими как профилин (Larrson H., Lindberg U., 1988; Ohshima S. et al., 1989), плазмин/фимбрин (Hofer D. et al., 1997; Prassler J. et al., 1997), эзрин (Schuster C., Herman I.M., 1995; Yao X. et al., 1995; 1996) и дистрофин/утрофином (Winder B.J. et al., 1995). С клеточной мембраной β-актин связан посредством кэпирующего белка β-cap73 (Welch A.Y. et al., 2005). Актиновые структуры клетки функционируют в тесной взаимосвязи с промежуточными филаментами. Винкулин является одним из распространенных белков промежуточных филаментов в клетках крови. Биохимическими исследованиями установлена глобулярная структура винкулина, который содержит головной домен, соединенный с удлиненным хвостовым доменом через пролин богатый участок. Винкулин связан с актином в сайтах фокальной адгезии, он выступа- 58 ет основным белком, участвующим в адгезии к субстрату (Гершович П.М. с соавт., 2009). В неактивном состоянии головная и хвостовая части молекулы взаимодействуют друг с другом (Johnson R.P., Craig S.W., 1995), при активации это взаимодействие нарушается присутствием PIP2 (Gilmore A.P., Burridge K., 1996). Несмотря на то, что PIP2 индуцированные взаимодействия винкулина с F-актином были установлены в двух независимых исследованиях (Gilmore A.P., Burridge K., 1996; Weekes J. et al., 1996), более поздние эксперименты свидетельствуют, что PIP2 ингибирует связывание винкулина с F-актином (Steimle P.A., et al., 1999). Этот факт согласуется с установленным явлением частично перекрываемых винкулин связанных сайтов для F-актина с сайтами для PIP2 (Critchelly D.R., 2000). Винкулин выступает мультипосредником в реакциях между F-актином и PIP2 и участвует в координации адгезивных сборок. В частности, исследования, выполненные in vitro, показывают, что PIP2 индуцирует олигомеризацию винкулиновых хвостов (Hüttelmaier S. et al., 1998), а F-актин способствует образованию винкулиновых хвостов димеров (Johnson R.P., Craig S.W.. 2000). Помимо промежуточных филаментов актиновый кортекс клетки связан с микротрубочками. В основе таких процессов как подвижность, деление, движение кортикального слоя клетки лежит взаимодействие микротрубочек и актина (Desai A., Mitchison T.J., 1997; Canman J.C. et al., 2000; Mandato C.A. et al., 2000; Glotzer M., 2001; Wittmann T., Warerman-Storer C.M., 2001; Small J.V. et al., 2002; Kuriyama B.A. et al., 2002). Одним из ключевых молекулярных механизмов, реализующих влияние микротрубочек на клеточные реакции, является их взаимодействие с компонентами гормональных систем, в том числе аденилатциклазного пути. Причем с одной стороны они выступают мишенями регуляторного действия гормонов, а с другой – определяют активность гормональных сигнальных систем (Roychowdhury S., Rasenick M., 2008; Dave R.H. et al., 2009). Микротрубочки построены из молекул тубулина, имеют α-β димерную структуру, содержат связанный ГТФ или ГДФ (Dustin P., 1980). При сборке микротрубочек описано два типа контактов между тубулиновыми димерами – «голо- 59 ва-хвост» и латеральные. Контакты «голова-хвост» более прочные, чем латеральные, поэтому при деполимеризации полимера от конца микротрубочки наблюдается отслаивание фрагментов протофиламентов (Mandelkow E.M. et al., 1991). Скорости полимеризации и деполимеризации микротрубочек измерены в разных клетках и зависят от их типа (Shelden E., Wadsworth P., 1993; Dhamodharan R., Wadsworth P., 1995; Danowski B.A., 1989; Rodionov V.I. et al., 1999). Большинство микротрубочек организовано радиально, своими плюс-концами они направлены в сторону края клетки (Vorobjev A.I. et al., 1999; Komorova Y.A. et al., 2002; Воробьев А.И., Малый И.В., 2008). Такой тип организации микротрубочек называется протяженной радиальной цепью, которая характерна для интерфазных клеток (Alberts B. et al., 2002). Реорганизация плюс-концов описывается процессом динамической нестабильности и представляет собой чередующиеся фазы роста и укорочения (Mitchinson T., Kirschner M., 1984). γ-Тубулин, катанин и нинеин расположены на минус-конце микротрубочек. Нуклеация микротрубочек происходит с участием γ-тубулина (Moritz M. et al., 1995; Vogel J.M. et al., 1997; Martin O.C. et al., 1998; Oegema K. et al., 1999; Moritz M. et al., 2000; Moritz M., Agard D.A., 2001). Отсоединение микротрубочек от центросомы протекает с участием катанина (Ahmad F.J. et al., 1999). Заякоревание минус конца микротрубочки на материнской центриоли происходит посредством белка нинеина (Mogensen M.M. et al., 2000; Piel M. et al., 2000). На плюс-конце микротрубочек установлена колокализация цитоплазматического линкерного белка CLIP-170 (Rickard J.E., Kreis T.E., 1990; Diamantopoulos G.S. et al., 1999), белков семейства ЕВ (ЕВ1, ЕВ2, ЕВЗ), состав которых консервативен от дрожжей до человека (Tirnauer J.S., Bierer B.E., 2000), CLASP (Hoogenraad C.C. et al., 2000; Akhmanova A. et al., 2001). Показана связующая роль плюс-концевых белков микротрубочек между микротрубочками и актиновыми филаментами. Взаимодействие микротрубочек и микрофиламентов построено по типу функциональной кооперации. Один из типов функциональных взаимодействий микротрубочек протекает посредством сигнальных каскадов, с помощью белка RhoA, в результате чего формируются стресс-фибриллы (Cook T.A. et al., 1998). 60 Другой тип взаимодействий – структурный осуществляется посредством кросслинкерных белков, связывающих микротрубочки и актиновые филаменты (Svitkina T.M. et al., 1996; Fuchs E., Karakesisoglou I., 2001; Rodriguez O.C. et al., 2003). Кроме того, существуют данные о непосредственном участии моторных белков во взаимосвязи между микротрубочками и актиновыми филаментами (Huang J.D. et al., 1999; Fukata M. et al., 2002). 1.3.2 Топография клеток крови Совокупность морфологических образований на поверхности клетки представляет топографию (рельеф) клеточной поверхности. Обилие морфологических образований на поверхности клеток тесно связано с пространственной и функциональной организацией цитоскелетных структур. К настоящему моменту известно, что образование агрегированных доменов и выпячиваний на поверхности мембраны сопровождается концентрацией в этих местах фосфорилированных белков цитоскелета – α-актинина (Бабаков В.Н. с соавт., 2004). Часто на поверхности мембраны генерируется и движется локальная волна деформации, при этом в зону образования спикул втягиваются белки цитоскелета, в первую очередь αактинин, которые за счет своего сокращения или расслабления реализуют динамику поверхностной мембраны. Кроме того, изоформы немышечных α-актининов способны траснлоцироваться в ядро и взаимодействовать с факторами транскрипции, что обеспечивает быструю передачу сигнала (Poch M.T. et al., 2004; Goffart S. et al., 2006). По данным литературы в различных типах клеток – в эритроцитах (Peterson M.A. et al., 1991; Tuvia S.S. et al., 1992; Strey H.M. et al.,1995; Levin S.V., Korenstein R., 1991), моноцитах, лимфоцитах, фибробластах, кардиомиоцитах 61 (Kroll A.J. et al., 1990), а также в Т- и В-клетках лимфомы мышей (Mittelman L.S. 1991) зафиксированы обратимые субмембранные колебания поверхности клеточной мембраны в диапазоне с частотой 0,3-30 Гц. Эти колебания состоят из локальных перемещений (0,25 мм2) элементов цитоскелета вне плоскости поверхности (20-300 нм), которые отражают изгиб и деформируемость мембраны. Самый высокий уровень колебаний клеточной поверхности был установлен для Т-клеток лимфомы, обладающих высоким метастатическим потенциалом по сравнению с нормальными субпопуляциями Т-лимфоцитов (Mittelman L.S. et al., 1994). В эритроцитах субмембранные колебания поверхности рассматриваются как тепловые флуктуации мембранного скелетного комплекса (Strey H.M. et al., 1995). Установлено, что колебания поверхности зависят от концентрации внутриклеточной MgATP (Levin S.V., Korenstein R., 1991). Показана 3 – 5-ти минутная задержка между процессом АТФ истощения и фактическим изменением формы эритроцита (Ferrel J., Huesris W.H., 1984; Backman L., 1986). Согласно экспериментальным данным, представленным в литературе, большая активность АТФазы в скелете красных клеток связана с F-актином (Sato S.Y. et al., 1986), причем F-актин АТФазная активность локализована на растущем конце микротрубочек (Podolski J.L., Steck S.L., 1988). Полученные факты дают ряду ученых полагать, что растущий конец актиновых филаментов ответственен за Mg-АТФ стимулированные колебания мембранной поверхности клеток крови (Tuvia S et al., 1998; Tuvia S. et al., 1999). Эти данные согласуются с исследованиями изменения формы эритроцитов с вовлечением в процесс актинсократительной системы (Weed I., 1969; Schrier S.L., 1981). В эритроцитах человека показано существование мембранного связанного миозина II (Fowler V.M. et al., 1985; Wong A.J. et al., 1985; Der Terrossian E. et al., 1994) Mg-АТФазная активность которого модулируется белком полосы 4.1 (Pasternak G.R., Racusen R.H., 1989). По данным растровой электронной микроскопии на поверхности клеток идентифицировано три типа образований: фибриллярные, ламилярные и бульбарные (Ровенский Ю.А., 1979). К фибриллярным образованиям поверхности относят 62 микроворсинки, филлоподии, реснички и жгутики. Микроворсинки являются своеобразными резервными структурами клеточной поверхности. Согласно расчетам микроворсинка диаметром 0,1 мкм, длинной 3 мкм может резервировать поверхность клетки площадью 1 мкм2 (Porter K.R. et al., 1973). Ученые полагают, что физиологическая роль такой резервной поверхности заключается в усиленном транспорте питательных веществ и освобождении метаболитов, в частности в опухолевых клетках HeLa число микроворсинок зависит от концентрации глюкозы в среде (Willoch M., 1967). Кроме того, запасенная в микроворсинках поверхность используется процессах изменения формы клетки и распластывания на субстрате (Hodges G.M., 1970). Ламелярные образования представлены ламелоподиями, рафлами и складками. Рафлы представляют собой пластинчатые выросты, располагающиеся чаще всего на свободной сферической поверхности лимфоцитов. Рафлы принимают участие в метаболических процессах, обеспечивая дополнительную поглощающую поверхность площадью около 100 мкм2, приходящуюся на один рафл (Porter K.R. et al., 1973). Бульбарные образования представлены выростами сферической формы. Пузырьковые структуры на клеточной поверхности в функциональном плане представляют собой зарезервированную клеточную поверхность (Erickson C.A., Trinkaus J.P., 1976). Появление бульбарных образований на поверхности клеток часто наблюдаются при помещении их в гипотонический раствор, либо при воздействии неблагоприятных факторов, вызывающих перестройки в архитектуре цитоскелетных сетей. Физиологическая функция бульбарных образований, по мнению исследователей, заключается в дистанционной информагенности (Федченко Н.Н. с соавт., 2003). При отрыве от клеточной поверхности бульбарные образования представляют собой цитомеры – небольшие фрагменты цитоплазмы, окруженные мембранной. Цитомеры продуцируются многими типами клеток при значительных механических нагрузках и метастазировании опухолей (Федченко Н.Н., 2007). Установлено, что в лимфоцитах на продукцию цитомеров расходуется часть микроворсинок, которые могут встраиваться в цитоплазматическую мем- 63 брану других клеток и выполнять функцию маркеров иммунологической общности клеток организма (Федченко Н.П., 1995; Федченко Н.Н. с соавт., 2003). Методом сканирующей электронной микроскопии (СЭМ) было показано, что морфология нейтрофилов (ПМЯЛ) состоит из множества хребтов и складок, имеет нерегулярный вид (Salsbuty A.J., Clarke J.A., 1967; Bain B., 1971; Michaelis T.W. et al., 1971). Лимфоциты более округлые и симметричные по сравнению с ПМЯЛ. Активация макрофагов и лимфоцитов химическими раздражителями и митогенами увеличивает гетерогенность поверхности (Clarke J.A., 1968; Carr I. et al., 1969) и способствует появлению на одном из концов клеток уроподов, используемых для передвижения (Marshall W.H., Roberts K.B., 1965). В передней части лимфоцитов идентифицированы псевдоподии, которые используются для маневрирования (McFarland W. et al., 1966). Развитие уроподов в лимфоцитах наблюдается только при их культивировании на твердых подложках (Holt P.J.L., 1972). Полагают, что уроподы представляют собой участки РНК, которые могут отрываться с поверхности лимфоцита и нести информацию другим клеткам (Weiss L., 1968). 1.3.3 Участие белков цитоскелета в образовании рельефа клеточной поверхности Характер рельефа поверхности мембраны, а также радиус ее кривизны тесно связаны с количеством актин-связывающих белков, которые создают мембранную кривизну и способствуют формированию выпячиваний или выступов на плазмалемме (McMahon H.T., Gallop J.L., 2005; Insall R.H., Machesky L.M., 2009; Itoh T., Takenawa T., 2009). В образовании широко распространенных структур поверхности - микроворсинок принимает участие эзрин, который связан с актино- 64 выми филаментами (Gould K.L. et al., 1986; Pakkamen R. et al., 1987; Berryman M. et al., 1993). Эзрин является представителем малых ГТФаз семейства ERM, входит в состав белков полосы 4.1, включен в цитоскелет эритроцитов. Эзрин соединяет гликофорины мембран с подмембранной актин-спектриновой сетью (Anderson R.A., Lovrien R.E., 1984). В колониях лейкоцитарных клеток идентифицирован представитель семейства ERM радиксин, который присутствует в фокальных контактах и межклеточных адгезивных контактах (Goslin K. et al., 1989; Sato N. et al., 1992). Помимо этого в клетках крови обнаружен третий член семейства ERM – моезин, который колокализован вместе с F-атином в поверхностных структурах (Goslin K. et al., 1989). Результаты экспериментальных работ показывают, что эзрин и моезин могут взаимодействовать друг с другом напрямую без дополнительных клеточных белков, в связи с чем, они рассматриваются в качестве посредников между плазмалеммой и актиновым кортексом (Gary R., Bretscher A., 1993). Актиновые филаменты участвуют во многих формах клеточного передвижения. Хорошо изученной структурой лидирующего края мигрирующих лимфоцитов является ламелоподия. Ламелоподии состоят из сети актиновых филаментов, которые образуют путем их скоординированной полимеризации от плазматической мембраны. Ключевую роль в ламелоподиозависимой миграции клеток играют фосфоинозитиды, вызывая сборку актиновых филаментов в плазмалемме и регулируя направление клеточного движения во время хемотаксиса (Le Clainche C., Carlier M.F., 2008). В организации кортикального цитоскелета ламелоподий ключевая роль принадлежит белку филамину, который поддерживает механическую стабильность плазмалеммы. Образование связи между актиновым цитоскелетом и плазмалеммой посредством филамина зависит от степени его фосфорилирования (Stossel T.P. et al., 2001). В образовании мембранных рафлов и ламелоподий принимают участие актинсвязываюшие белки из семейства малых ГТФаз, в частности стимуляция клеток крови фактором роста тромбоцитов (PDFG), приводит к активации Rac, которая управляет образованием ламеллоподий и рафлов (Ridley A.J. et al., 1992). Мембранный рафлинг контролирует рибосомальная S-6 киназа (RSK), она фосфо- 65 рилирует филамин по остаткам серина (Ser2152), что приводит к формированию рафлов (Woo M.S. et al., 2004; Vadlamudi R. et al., 2004). Активация белков семейства Rho с участием бомбезина или лизофосфатидиновой кислоты индуцирует образование стресс-фибрилл и локальных адгезий (Ridley A.J., Hall A., 1992). Еще один класс мелких ГТФаз – Arf (АДФрибозалиновй фактор) – участвует в метаболизме PIP2. Arf регулирует движение мембраны и перестройки цитоскелета, связанные с образованием мембранных выступов и складок. В частности, установлена колокализация факторов Arf6 и Rac в мембране, которые в таком виде участвуют в клатрин-опосредованном эндоцитозе и Fc-зависимом фагоцитозе (Donaldson J.C., Jackson C.L., 2000). Вскипание мембраны происходит при многих клеточных событиях, например, апоптозе, цитокинезе и признано одной из форм клеточного движения (Charras G., Paluch E., 2008; Fackler O.T., Grosse R., 2008). Пузырьки представляют собой локальные разрушения между кортикальным цитоскелетом и мембраной. Пузырь расширяется на 1-2 мкм в плоскости мембраны и имеет жизненный цикл около 1 мин. Локальные разрушения мембранного цитоскелета запускают специфические внеклеточные сигналы (Charras G.T. et al., 2006; Charras G.T., Paluch E., 2008). Сила, расширяющая плазмолемму, создает внутреннее гидростатическое давление в клетке и не связана с силами, возникающими при полимеризации актина (Saarikangas J. et al., 2010). Согласно современным данным, повышение концентрации PIP2 поддерживает в мембране актин-мембранные взаимодействия посредством белков семейства ERM (например, эзрина) и тем самым подавляет образование мембранных пузырьков. В тоже время потеря таких компонентов, как кортикального F-актина, ERM протеинов, PIP2, инициирует образование пузырьков на поверхности (Raucher D. et al., 2000; Sheetz M.P., et al., 2006; Wang Y. et al., 2008). Особую роль пузырьковой мембранной миграции исследователи отводят в раковых клетках, которые используют протеаз независимые амебоидно-подобные движения для инвазии в трехмерный внеклеточный матрикс при помощи экранных пузырьковых структур (Sahai E., 2005). 66 Ключевую роль во взаимодействии между плазмалеммой и актиновым цитоскелетом играет PIP2 (Miki H. et al., 1996; Imai K. et al., 1999; Pearson M.A. et al., 2000), который локализуется в актин богатых структурах и высоко динамичных регионах клеточной мембраны (Tall E.G. et al., 2000). Высокая концентрация PIP2 сопровождается обширной полимеризацией актина (Shibasaki Y. et al., 1997) и стимулирует образование микроворсинок (Matsui T. et al., 1999). Показана зависимость между энергией, необходимой для разрыва локальных адгезий между плазмалеммой и актиновым цитоскелетом, и изменением уровня PIP2 в плазмалемме. В частности секвестирование или гидролиз PIP2 в плазмалемме уменьшает энергию необходимую для смещения плазмалеммы относительно актиновых филаментов, что сопровождается резким изменением формы (Raucher et al., 2000). Адгезивными актин-богатыми мембранными выступами на клеточной поверхности являются подосомы и инвадоподии. Эти структуры принимают участие в деградации внеклеточного матрикса. Они включают простые молекулярные архитектурные композиции Rho семейства ГТФаз, динамин, актин-зародышевые протеины (Arp 2/3, формины), актин-сшивающие и адгезивные белки (актинин, винкулин, заксин) (Chellaiah M.A., 2006; Oikawa T. et al., 2008). Подосомы характерны для клеток лейкоцитарного ряда, а инвадоподии присутствуют в раковых клетках. Установлено, что появление инвадоподий на поверхности трансформированных клеток связано с аномально регулируемой фосфоинозитидной сигнализацией (Wymann M.P., Schneiter R., 2008). 67 1.3.4 Использование инструментария атомно-силовой микроскопии в исследовании цитоархитектоники клеток Атомно-силовая микроскопия (АСМ) представляет инструментарий, позволяющий поучать изображения с высоким пространственным разрешением живых и фиксированных клеток крови (Bischoff G., Hein H.J., 2003; Alessandrini A., Facci P., 2005). АСМ позволяет исследовать микро- и наномеханические свойства клеточных структур, пространственное распределение локального модуля упругости в пределах одной клетки (Hansma H.J., 2001). Контрастность изображения генерируется путем мониторинга сил, возникающих между зондом и сканируемой поверхностью (Mozafari M.R. et al., 2005). Разрешение АСМ на воздухе в вертикальном направлении составляет 0,1-0,5 нм, в горизонтальном – 1-5 нм. Чувствительность и разрешение метода зависят от характеристик кантилевера (Alessandrini A., Facci P., 2005). АСМ стал универсальным методом измерений сил в наноскопических системах. К настоящему времени измерены силы Ван-дер-Ваальса, гидратации и электростатического взаимодействия (Weis R.M., McConell H.M., 1982; Leng Y., Williams C.C., 1993; Manne S., Gaub H.E., 1995; Weis R.M., Drickamer K., 1996), упругое трение, описаны свойства поверхности (Erlandsson R. et al., 1988; Marti O. et al., 1990; Hoh J., Angel A., 1993; Radmacer M. et al., 1996). Исследованы силы, действующие между отдельными химическими группами (Frisbie C.D. et al., 1994) и ковалентные силы между зондом и поверхностью (Jarvis S.P. et al., 1997; Grandbois M. et al., 1999), описаны характеристики механических контактов между клетками на уровне одной молекулы (Gaub H.E., Fernandes J.M., 1998; ClausenSchaumann H. et al., 2000; Benoit M., Gaub H.E., 2002), разработаны модификации режима силовой спектроскопии, позволяющие изучать рецепторы клеточной поверхности (Grandbois M. et al., 2000). 68 Различные техники АСМ предполагают использование модифицированных кантилеверов. Для исследования лектиновых рецепторов на поверхности эритроцитов применяют HPL-функционализированные зонды, к которым привязывают лектин с помощь полимерного спейсера (Hinterdorfer P. et al., 1996). С использованием таких зондов показано, что достаточно нескольких десятков nH, чтобы извлечь из мембраны эритроцита лектиновые рецепторы (Grandbais M. et al., 2000). Одним из перспективных направлений с использованием АСМ является изучение упруго-эластических свойств клеточной поверхности. Для расчета модуля Юнга предложено несколько подходов. Часто оценка упругих свойств биологических объектов проводится с использованием модели Герца (Rotsch C. et al., 1999; Wojcikiewicz E.P. et al., 2003; Mahaffy R.E. et al., 2004). Однако некоторые авторы отмечают, что вследствие гетерогенности клеточной поверхности, оценка упругих свойств согласно модели Герца предполагает ошибки (Kuznetsova T.G. et al., 2007). Альтернативным подходом для изучения упругих свойств клеток, является метод, основанный на теории упругих оболочек, осуществляемый в режиме силовой спектроскопии (Timoshenko S.P., Woinowsky-Krieger S. 1970; A-Hassan E. et al., 1998; Scheffer L. et al., 2001). Эта теория рассматривает оболочки клеток, заполненных жидкостью, поэтому модуль Юнга оценивают по отношению между эффективным модулем Юнга, толщиной оболочки и модулем изгиба. Несмотря на технические и методологические проблемы, возникающие при измерении модуля Юнга, ученые отмечают, что как относительный параметр он может быть использован в экспериментальных работах (Rotsch C. et al., 1997; Vinckier A., Semenza G., 1998; Kuznetsova T.G. et al., 2007). При использовании различных моделей в изучении упруго-эластических свойств клеток большинство исследователей сходится во мнении о высокой изменчивости параметра модуля Юнга при изменении внешних условий и обработке клеток различными химическими агентами. АСМ методом были изучены нативные (Nowakowski R. et al., 2001; Kamruzzahan A.S.M. et al., 2004), фиксированные эритроциты, отсканированные на воздухе (Gould S.A.C., 1990) и помещенные в буфер, отсканированные в жидкой среде красные клетки крови (Butt H.E. et al., 69 1990). Установлено, что в фиксированных эритроцитах модуль упругости возрастает. Однако, фиксация структур улучшает изображения топографии и цитоскелета клеток (Schroff S.G. et al., 1995; Hofmann U.G. et al., 1997). В белых клетках крови, выявлена четкая взаимосвязь между распределением локальной жесткости и миграцией. При движении клеток жестокость в области ядра снижается (Nagayama M. et al., 2001). В ламелоподиях фибробластов жесткость снижена по сравнению с телом клетки. Исследователи связывают этот факт с избытком конденсации сети актина в лидирующем крае и снижением активности цитоскелета в ядерной области клетки (Haga H. et al., 2000). При использовании препаратов цитохалазина B и D, латрункулина, обеспечивающих разборку структур цитоскелета, было установлено снижение модуля упругости на лидирующем крае фибробластов, при этом реорганизация микротрубочек не влияла на эластичность клетки (Rotsch C., Radmacher R., 2000). При изучении упругих свойств биологических объектов особое значение имеет их связь с подложкой (Yang F., 1998; Chadwick R.S., 2002). Применение специальных стекол, покрытых polyL-лизином для прочной адгезии клеток, вызывает специфические деформации мембраны вследствие перестановок компонентов белково-липидного слоя (Dulinska I et al., 2006). Установлено, что рост клеток и их выживание зависят от жесткости подложки. Например, желатиновые покрытия с жесткость меньше 100 Па не поддерживают выживание здоровых клеток в культуре (Wang H.B. et al., 2000). Выявлена высокая степень корреляции между изменением фосфорилирования по остаткам тирозина в структурах цитоскелета и жесткостью зондирующей аппаратуры (Pelham R.J., Wang Y., 1997). Показано, что изменения упругих свойств клеток крови коррелируют с неоднородностью цитоскелета и происходят за счет реконструкции его компонентов (Ohashi T. et al., 2002). Изменение жесткости подложки может инициировать транскрипцию с определенных генов, осуществляющих регуляцию рецепторов адгезии (Yeng T., et al., 2005). Некоторые аспекты клеточной структуры как веерообразная морфология в культуре фибробластов или распространенность актиновых стресс-фибрилл, ко- 70 торые широко изучаются в лабораторных условиях, в естественных условиях встречаются довольно редко. Причины такого явления исследователи связывают с различиями в эластичности биологических поверхностей (Pelham R.J., Wang Y., 1997; Lo C.M. et al., 2000; Wang H.B. et al., 2000), т.к. в условиях in vivo клетки функционируют в трехмерных матрицах, в отличие от роста культуры на твердой подложке (Bard J.B., Hay E.D., 1975; Greenburg G., Hay E.D., 1982). Причем не все клетки чувствительны к жесткости подложки, исключение представляют нейтрофилы. Нейтрофилы расширяют свой актиновый кортекс по периферии, причем они не в состоянии генерировать большие силы тяги (Evans E. et al., 1993). Исследования показывают, что окружность нейтрофилов остается постоянной как на стекле, так и на геле с жесткостью от 2 до 1000 Па (Yeng T. et al., 2005). 71 ГЛАВА 2. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ 2.1. Морфофункциональные свойства лимфоцитов доноров и больных ХЛЛ 2.1.1. Особенности цитоархитектоники и упруго-эластические свойства лимфоцитов доноров и больных ХЛЛ в физиологических условиях В данной главе приведены данные относительно морфологии и рельефа поверхности лимфоцитов доноров и больных ХЛЛ, помещенных в аутологичную плазму, т.е. в условиях максимально приближенных к нативным. Лимфоциты доноров (рисунок 7а) и больных ХЛЛ (рисунок 7б) характеризуются округлой формой, большую часть клетки занимает ядро, выступающее над поверхностью. а б Рисунок 7 – АСМ-изображение лимфоцитов доноров (а) и больных ХЛЛ (б) На поверхности лимфоцитов, помещенных в аутологичную плазму, были выявлены структурные неоднородности рельефа в виде глобулярных выступов и углублений в мембране (рисунок 8). 72 Рисунок 8 – Рельеф участка мембраны лимфоцитов здоровых доноров в аутологичной плазме (стрелками показаны углубления в мембране и глобулярные выступы) Высота глобулярных выступов составила 41,3±3,7 нм, их количество 36±0,9. Количество углублений в мембране составило 18±1,1, их габаритные размеры были в пределах: 17,3±0,6 нм – глубина, 221,8±24,0 нм – диаметр. В периферической крови больных ХЛЛ идентифицированы лимфобласты разнообразной формы – от округлой до неправильной (рисунок9). Рисунок 9 – АСМ-изображение лимфобластов больного ХЛЛ (стрелками показаны различные формы бластов) Морфологические образования, идентифицированные методом АСМ на поверхности лимфоцитов доноров (рисунок 10а) и больных ХЛЛ (рисунок 10б) представлены глобулярными выступами и углублениями. 73 2 1 1 2 б а Рисунок 10 – Рельеф поверхности лимфоцитов: а - доноров, б - больных лимфобластным лейкозом: 1- глобулярные выступы, 2 –углубления Конфигурация поверхности лимфоцитов больных ХЛЛ носила ярко выраженный рифленый характер по сравнению с лимфоцитами доноров. Для нее было характерно увеличенное число глобулярных образований на 247% (р<0,05) и снижение их высоты на 42,6% (р<0,05; таблица 1). Таблица 1 - Цитоархитектоника и механические свойства лимфоцитов доноров и больных ХЛЛ Параметры структур и упруго-эластических свойств поверхности Глобулярные высту- Высота, нм пы Количество Углубления в мемДиаметр, нм бране Глубина, нм Количество Модуль Юнга, µРа Жесткость Глубина погружения кантилевера, нм Потенциальный относительный мембранный резерв клетки, мкм-1 Потенциальный относительный мембранный резерв ядра, мкм-1 Потенциальный относительный мембранный резерв клетки и ядра, рассчитан исходя из отношения площади поверхности структуры к ее объему Лимфоциты доноров 41,3±3,7 36±0,9 221,8±24,0 17,3±0,6 18±1,1 3,50±0,20 345,20±3,74 Лимфоциты больных ХЛЛ 17,6±0,9* 125±1,1* 149,4±12,9* 8,01±0,9* 40±2,3* 1,80±0,01* 1035,20±7,32* 0,46±0,002 0,51±0,005 0,57±0,003 0,59±0,005 *- Статистически достоверные различия между значениями доноров и больных лейкозом по критерию Стьюдента при р<0,05. Число углублений в мембране лимфоцитов больных ХЛЛ возросло на 122% (р<0,05), их диаметр и глубина уменьшились соответственно на 67,4% и 46,3% 74 (р<0,05) по сравнению с габаритными размерами углублений на поверхности клеток в группе доноров. Модуль Юнга лимфоцитов больных лейкозом был снижен на 51,4% (р<0,05), глубина погружения кантилевера возросла на 199% (р<0,05) по сравнению с лимфоцитами доноров. Эти изменения указывают на увеличение способности клеточной поверхности сопротивляться упругим деформациям и повышение их упруго-эластических свойств. 2.1.2. Особенности цитоархитектоники и упруго-эластические свойства лимфоцитов доноров и больных ХЛЛ под влиянием функциональных нагрузок 2.1.2.1. Влияние адреналина и обзидана на топографию лимфоцитов доноров и больных ХЛЛ Лимфоциты доноров. В условиях активации и блокады β-адренорецепторов рельеф поверхности лимфоцитов приобрел рифленость по сравнению со структурой мембраны в плазме (рисунок 11). а б 75 в Рисунок 11 – Рельеф поверхности лимфоцитов доноров: а – в условиях адреналиновой нагрузки; б – при обработке клеток обзиданом; в – в аутологичной плазме Инкубация лимфоцитов с обзиданом приводит к увеличению высоты глобулярных образований поверхности на 83,5% (р<0,05), при этом их количество соответствует значениям в плазме. Наблюдаемая на сканограммах шероховатость поверхности, после обработки клеток адреналином, сопровождается увеличением количества глобулярных выступов на 27,7% (р<0,05), при этом высота их снизилась на 42,4% (р<0,05) по сравнению с размерами глобул в плазме (контроль; таблица 2). Таблица 2 - Цитоархитектоника и механические свойства лимфоцитов доноров под влиянием адреналина и обзидана Параметры структур и упругоэластических свойств поверхности Глобулярные Высота, нм Количество выступы Диаметр, нм Углубления Глубина, нм в мембране Количество Модуль Юнга, µРа Жесткость Глубина погружения кантилевера, нм Плазма (контроль) 41,30±3,7 36±0,9 221,8±24,0 17,30±0,60 18±1,1 3,50±0,20 345,20±3,74 Адреналин Обзидан 17,54±0,53* 46±1,1* 63,79±1,15* 5,64±0,15* 10±2,3* 5,49±0,37* 155,12±23,48* 75,78±8,80*^ 35±1,6^ 110,12±1,32*^ 13,65±1,76^ 17±1,9^ 2,79±0,29*^ 468,48±15,46*^ *- Статистически достоверные различия между значениями в пробах с адреналином и обзиданом по сравнению с плазмой по критерию Стьюдента при р<0,05. ^ - Статистически достоверные различия между значениями в пробах с обзиданом по сравнению с адреналиновой нагрузкой по критерию Стьюдента при р<0,05. После адреналиновой нагрузки произошло заметное сокращение числа углублений в мембране на 55,5% (р<0,05) по сравнению с плазмой, их диаметр и глубина уменьшились соответственно на 28,7% и 32,6% (р<0,05). Под влиянием 76 обзидана выявлено достоверное уменьшение диаметра углублений на 50% (р<0,05) по сравнению с контролем. В условиях адреналиновой нагрузки модуль Юнга лимфоцитов здоровых доноров увеличился на 57% (р<0,05), а глубина погружения кантилевера в мембрану уменьшилась на 45% (р<0,05) по сравнению с контролем. Под влиянием обзидана модулю Юнга снизился на 20% (р<0,05) по сравнению с контролем, при этом глубина погружения кантилевера возросла на 73,7% (р<0,05). Под влиянием блокатора β-адренорецепторов высота глобулярных образований возросла примерно в 4 раза, при этом их количество снизилось на 24% (р<0,05) по сравнению с адреналиновой нагрузкой (см. таблица 2). В пробах с обзиданом количество углублений в мембране увеличилось в 1,7 раза, при этом их диаметр и глубина возросли соответственно на 73% и 142% (р<0,05) по сравнению с адреналиновой нагрузкой. В условиях блокады β-адренорецепторов улучшились упруго-эластические свойства мембран, модуль Юнга снизился на 21% (р<0,05), глубина погружения кантилевера возросла на 202% (р<0,05) по сравнению с клетками, проинкубированными с адреналином. Лимфоциты больных ХЛЛ. Рельеф поверхности лимфоцитов больных ХЛЛ под влиянием адреналина (рисунок 12а) и обзидана (рисунок 12б) был менее структурирован по сравнению с контролем (лимфоциты больных ХЛЛ в аутологичной плазме; рисунок 12в). а б 77 в Рисунок 12 – Рельеф поверхности лимфоцитов больных ХЛЛ: а – в условиях адреналиновой нагрузки; б – при обработке клеток обзиданом; в – в аутологичной плазме Количество углублений в мембране уменьшилось на 70% (р<0,05), при этом их глубина увеличилась на 344% (р<0,05), а диаметр сократился на 93,7% (р<0,05) по сравнению с контролем. Под влиянием адреналиновой нагрузки число глобулярных выступов сократилось на 79% (р<0,05), а их высота возросла на 314% (р<0,05) по сравнению с контролем (таблица 3). Таблица 3 - Цитоархитектоника и механические свойства лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана Параметры структур и упругоэластических свойств поверхности Глобулярные Высота, нм выступы Количество Углубления в Диаметр, нм мембране Глубина, нм Количество Модуль Юнга, µРа Жесткость Глубина погружения кантилевера, нм Плазма (контроль) 17,6±0,9 125±1,1 149,4±12,9 8,01±0,9 40±2,3 1,80±0,01 1035,20±7,32 Адреналин 72,85±1,3* 26±0,9* 9,29±1,89* 35,54±3,57* 12±1,36* 4,19±0,31* 258,01±31,07* Обзидан 15,72±0,9^ 24±0,4* 0,88±0,10*^ 14,88±2,93*^ 9±0,2*^ 2,58±0,41^ 973,76±16,45*^ *- Статистически достоверные различия между значениями в пробах с адреналином и обзиданом по сравнению с плазмой по критерию Стьюдента при р<0,05. ^ - Статистически достоверные различия между значениями в пробах с обзиданом по сравнению с адреналиновой нагрузкой по критерию Стьюдента при р<0,05. Под влиянием обзидана число выступов уменьшилось на 80,8% (р<0,05), их высота достоверно не отличалась от значений контроля (см. таблицу 3). Количество углублений в мембране снизилось на 77,5% (р<0,05), их диаметр уменьшился 78 на 99,4% (р<0,05), а глубина увеличилась на 85,7% (р<0,05) по сравнению с контролем. Модуль Юнга лимфоцитов больных ХЛЛ под влиянием адреналина увеличился на 133% (р<0,05), в тоже время при инкубации клеток с обзиданом достоверной разницы с контролем не выявлено. Глубина погружения кантилевера в мембрану под влиянием адреналина и обзидана снизилась соответственно на 75% и 6% (р<0,05) по сравнению с контролем. В условиях блокады β-адренорецепторов высота глобулярных образований на мембране лимфоцитов больных ХЛЛ уменьшилась на 78% (р<0,05), при этом их количество находилось в пределах недостоверных различий по сравнению с пробами после адреналиновой нагрузки. Под влиянием обзидана диаметр, глубина и количество углублений уменьшились соответственно на 90,5%, 58% и 25% (р<0,05) по сравнению с адреналиновой нагрузкой. В условиях блокады βадренорецепторов упруго-эластические свойства мембран улучшились, глубина погружения кантилевера возросла в 3,7 раза, а модуль Юнга снизился на 61,5% (р<0,05) по сравнению с адреналиновой нагрузкой. Анализируя влияние адреналина и обзидана на упруго-эластические свойства лимфоцитов видно, что поверхность клеток больных ХЛЛ более «мягкая» по сравнению с лимфоцитами доноров. В условиях адреналиновой нагрузки жесткость лимфоцитов больных ХЛЛ снижена на 23,7% (р<0,05), при этом глубина погружения кантилевера увеличена на 39,8% (р<0,05) по сравнению с клетками доноров (таблица 4). Таблица 4 - Модуль Юнга лимфоцитов доноров и больных ХЛЛ Доноры Больные ХЛЛ Глубина погруГлубина погруПробы Модуль Юнга, Модуль Юнга, жения кантилежения кантилеµРа µРа вера, нм вера, нм Адреналин 5,49±0,37 155,12±23,48 4,19±0,31* 258,01±31,07* Обзидан 2,79±0,29 468,48±15,46 2,58±0,41 973,76±16,45* *- Статистически достоверные различия между значениями доноров и больных лейкозом по критерию Стьюдента при р<0,05. 79 Под влиянием обзидана достоверных различий в значениях модуля Юнга между пробами крови доноров и больных лейкозом не выявлено, однако в группе больных глубина погружения кантилевера возросла на 107,8% (р<0,05). 2.1.2.2. Влияние Са2+ и верапамила на архитектуру лимфоцитов доноров и больных ХЛЛ Лимфоциты доноров. Под влиянием ионов Са2+ на поверхности лимфоцитов идентифицированы небольшие глобулярные образования и углубления в виде кластеров (рисунок 13а). В аутологичной плазме поверхность клеток была сглажена, на ней видны углубления (рисунок 13б). При обработке клеток верапамилом поверхность мембран «вскипала», на ней появились бульбарные образования виде округлых пузырьков, углубления в мембране практически исчезли (рисунок 13в). б а 80 в Рисунок 13 – Рельеф поверхности лимфоцитов доноров: а – после инкубации клеток с ионами Са2+; б – при обработке клеток верапамилом; в – в аутологичной плазме Выраженная шероховатость поверхности, наблюдаемая на сканах участков мембран как после Са2+-нагрузки, так и после воздействия блокатора Са2+-каналов – верапамила, сопровождалась увеличением количества глобулярных выступов. В условиях кальциевой нагрузки число глобулярных выступов возросло на 139% (р<0,05), а их высота снизилась на 36% (р<0,05) по сравнению с количеством и размерами глобул в плазме. Под влиянием верапамила, число глобулярных выступов увеличилось на 41,6% (р<0,05), а их высота снизилась на 32% (р<0,05) по сравнению с плазмой (таблица 5). Таблица 5 – Цитоархитектоника и механические свойства лимфоцитов доноров под влиянием ионов Са2+ и верапамила Параметры структур и упругоПлазма (кон- Хлорид кальВерапамил эластических свойств поверхности троль) ция Высота, нм 41,30±3,7 26,47±1,64* 28,06±2,12* Глобулярные выступы Количество 36±0,9 86±2,8* 51±3,4*^ Диаметр, нм 221,8±24,0 194,37±1,16 163,64±1,87 Углубления в Глубина, нм 17,30±0,6 14,93±2,08 6,90±0,69*^ мембране Количество 18±1,1 51±2,6* 8±0,69*^ Модуль Юнга, µРа 3,50±0,20 2,31±0,26* 2,55±0,41* Жесткость Глубина погружения 345,20±3,74 835,77±10,02* 120,23±12,02*^ кантилевера, нм *- Статистически достоверные различия между значениями в пробах с хлоридом кальция и верапамилом по сравнению с плазмой по критерию Стьюдента при р<0,05. ^ - Статистически достоверные различия между значениями в пробах с верапамилом по сравнению с кальциевой нагрузкой по критерию Стьюдента при р<0,05. 81 В условиях кальциевой нагрузки количество углублений на поверхности мембраны возросло на 183% (р<0,05), их габаритные размеры были в пределах не достоверных различий с контролем. Под влиянием верапамила количество углублений их глубина уменьшилось соответственно на 55,5% и 60% (р<0,05), а диаметр практически не изменился по сравнению с аналогичными структурами, присутствующими на поверхности лимфоцитов в контроле. Под влиянием функциональных нагрузок модуль Юнга снизился на 34% (р<0,05) в условиях кальциевой нагрузки и на 27% (р<0,05) в пробах с верапамилом, при этом глубина погружения кантилевера возрастала соответственно на 142% и 248% (р<0,05) по сравнению с контролем. Под влиянием верапамила количество глобулярных выступов на поверхности мембраны и углублений уменьшилось соответственно на 40,7% и 84% (р<0,05), при этом высота глобул и диаметр углублений практически не отличались от таковых в пробах с хлоридом кальция. Под влиянием блокатора Са2+ каналов глубина погружения кантилевера снизилась на 85,6% (р<0,05) по сравнению с кальциевой нагрузкой. Лимфоциты больных ХЛЛ. В условиях кальциевой нагрузки (рисунок 14а) конфигурация поверхности лимфоцитов больных ХЛЛ приобрела рифленность по сравнению с контролем (рисунок 14в). На мембране хорошо прослеживались крупные глобулы, которые придавали поверхности складчатый вид. При обработке клеток верапамилом на поверхности были идентифицированы бульбарные образования, в виде сферических выступов (рисунок 14б). а б 82 в Рисунок 14 – Рельеф поверхности лимфоцитов больных ХЛЛ: а – после инкубации клеток с ионами Са2+; б – при обработке клеток верапамилом; в – в аутологичной плазме Под влиянием кальциевой нагрузки количество глобулярных выступов на мембране сократилось на 58,4% (р<0,05), а их высота значительно увеличилась на 796% (р<0,05). Число углублений в мембране уменьшилось в 2 раза, при этом существенно увеличилась их глубина на 371% (р<0,05), диаметр сократился на 97,5% (р<0,05) по сравнению с контролем. Под влиянием верапамила количество глобулярных выступов и углублений в мембране уменьшилось соответственно на 81,6% и 90% (р<0,05) по сравнению с контролем. Высота глобулярных образований увеличилась на 158% (р<0,05), диаметр углублений сократился на 96% (р<0,05), а их глубина возросла на 191,7% (р<0,05) по сравнению с контролем (таблица 6). Таблица 6 - Цитоархитектоника и механические свойства лимфоцитов больных ХЛЛ под влиянием ионов Са2+ и верапамила Параметры структур и упругоэластических свойств поверхности Высота, нм Глобулярные Количество выступы Диаметр, нм Углубления в Глубина, нм мембране Количество Модуль Юнга, µРа Жесткость Глубина погружения кантилевера, нм Плазма (контроль) 17,6±0,9 125±1,1 149,4±12,9 8,01±0,9 40±2,3 1,80±0,01 1035,20±7,32 Хлорид кальция 157,8±14,3* 52±1,3* 3,65±0,66* 37,74±1,06* 20±0,6* 4,42±0,78* 508,58±13,95* Верапамил 45,43±3,9*^ 23±0,3*^ 5,65±0,28* 23,37±0,15* 4±0,2*^ 3,01±0,61* 541,19±15,92* *- Статистически достоверные различия между значениями в пробах с хлоридом кальция и верапамилом по сравнению с плазмой по критерию Стьюдента при р<0,05. ^ - Статистически достоверные различия между значениями в пробах с верапамилом по сравнению с кальциевой нагрузкой по критерию Стьюдента при р<0,05. 83 Под влиянием ионов Са2+ модуль упругости лимфоцитов больных лейкозом увеличился на 145,5% (р<0,05) по сравнению с контролем. Под влиянием верапамила достоверных различий между опытной и контрольной пробами не выявлено, хотя наблюдалась тенденция к увеличению жесткости клеток после действия блокатора Са2+-каналов. Глубина погружения кантилевера после кальциевой и верапамиловой нагрузок снизилась соответственно на 51% и 47,7% (р<0,05) по сравнению с контролем. Анализируя структуру поверхности лимфоцитов в условиях активации и блокады элементов Са2+ сигнальных путей видно, что кальциевая нагрузка оказывает наиболее выраженное влияние на рельеф поверхности клеток. Так под влиянием верапамила, количество и высота глобулярных образований на мембране снизилось соответственно на 55,8% и 71,2% (р<0,05), при этом число углублений сократилось в 5 раз по сравнению с пробами, проинкубированными с ионами Са2+. Анализируя изменения упруго-эластических свойств лимфоцитов под влиянием ионов Са2+ видно, что в группе больных ХЛЛ жесткость клеток возросла практически в 2 раза, при этом глубина погружения кантилевера снизилась на 39% (р<0,05) по сравнению с лимфоцитами доноров (таблица 7). Таблица 7 - Жесткость лимфоцитов доноров и больных ХЛЛ Доноры Больные лейкозом Глубина погруГлубина погруПробы Модуль Юнга, Модуль Юнга, жения кантилежения кантилеµРа µРа вера, нм вера, нм Хлорид кальция 2,31±0,26 835,77±10,02 4,42±0,78* 508,58±13,95* Верапамил 2,55±0,41 1202,23±12,02 3,01±0,61 541,19±15,92* *- Статистически достоверные различия между значениями доноров и больных лейкозом по критерию Стьюдента при р<0,05. Под влиянием верапамила достоверно выраженных различий в значениях модуля Юнга между лимфоцитами доноров и больных лейкозом не выявлено, однако, глубина погружения кантилевера в мембрану лимфоцитов больных лейкозом ХЛЛ уменьшилась на 55% (р<0,05) по сравнению с лимфоцитами доноров. 84 2.2. Регуляция объема лимфоцитов в тестах с осмотической нагрузкой (in vitro) 2.2.1. Реакции осморегуляции лимфоцитов доноров В условиях гипоосмотической нагрузки диаметр, объем, и площади поверхности лимфоцитов возросли в течение первых 360 секунд инкубации. Наиболее выраженное увеличение объема происходит на 180 (21,34%; р<0,05) и 240 (28,29%; р<0,05) секундах (таблица 8). Таблица 8 – Морфометрические параметры лимфоцитов в гипоосмотической среде ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 14,53±0,15* 13,75±0,11 1629,99±50,39* 1382,41±34,70 666,29±13,64* 596,76±9,96 60 14,91±0,13* 13,88±0,09 1755,85±49,20* 1417,93±29,78 700,89±12,82* 607,92±8,50 90 14,87±0,12* 13,43±0,16 1738,58±42,02* 1311,43±42,38 696,86±11,29* 572,91±12,74 120 14,82±0,14* 13,72±0,10 1724,56±46,96* 1368,81±31,64 692,50±12,66* 593,38±9,06 150 14,92±0,11* 13,77±0,12 1751,92±39,01* 1392,82±37,28 700,86±10,24* 599,30±10,67 180 15,03±0,14* 13,83±0,11 1797,48±19,25* 1404,44±36,69 711,89±13,02* 603,38±10,29 210 14,91±0,15* 13,77±0,12 1763,17±56,14* 1386,87±36,78 701,99±14,66* 598,19±10,46 240 15,05±0,16* 13,48±0,12 1814,23±57,23* 1300,90±34,42 715,22±15,27* 573,18±10,05 270 14,93±0,13* 13,92±0,11 1761,54±49,28* 1428,98±33,15 702,39±12,87* 610,88±9,48 300 14,76±0,17* 13,51±0,13 1714,46±62,07* 1315,46±39,69 688,14±16,07* 576,66±11,39 330 14,91±0,14* 13,67±0,12 1757,57±51,73* 1360,44±36,54 700,97±13,62* 590,39±10,58 360 14,56±0,13* 13,68±0,12 1634,54±42,59* 1364,00±37,38 668,47±11,60* 591,47±10,59 390 13,78±0,15 13,51±0,08 1391,80±43,30 1300,96±25,51 599,37±12,76 574,59±7,39 420 13,80±0,17 13,56±0,11 1407,65±52,43 1322,00±30,72 602,71±15,06 579,96±9,06 450 14,06±0,16* 13,56±0,11 1480,80±47,88* 1320,37±31,09 624,41±13,77* 579,47±9,11 480 14,01±0,17* 13,58±0,12 1470,66±52,98* 1330,22±33,35 620,75±15,14* 581,97±9,81 510 14,06±0,17* 13,63±0,10 1485,71±50,36* 1340,81±30,33 625,41±14,47* 585,59±8,89 540 14,81±0,12* 13,88±0,12 1714,35±40,64* 1422,61±37,37 690,47±10,94* 608,42±10,63 570 14,68±0,16* 13,64±0,11 1684,85±52,94* 1346,72±33,19 680,71±14,64* 586,94±9,62 600 14,65±0,15* 13,97±0,11 1668,77±51,49* 1447,05±36,07 676,88±13,76* 615,74±10,13 900 15,04±0,15* 13,68±0,12 1804,91±53,00* 1359,09±35,63 713,36±14,09* 590,27±10,18 1800 14,50±0,17* 13,69±0,12 1629,51±56,76* 1365,38±38,73 665,05±15,62* 591,75±10,83 3600 14,48±0,10* 13,01±0,11 1601,28±34,54* 1169,62±33,22 660,12±9,50* 533,87±9,61 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Возвращение морфометрических параметров клеток к значениям изотонического раствора произошло на 390 секунде, длительность реакции составила 60 85 секунд. Затем, начиная с 450 секунды и до конца инкубации, размеры клеток возрастали. На протяжении всего времени инкубации отмечалось увеличение диаметра, объема и площади поверхности ядер лимфоцитов. На 30 секунде объем ядер увеличился на 21% (р<0,05), 270 секунде – на 30,5% (р<0,05), к концу времени воздействия (3600 с) наблюдался максимальный прирост объема на 39% (р<0,05) по сравнению с изотоническим раствором (таблица 9). Таблица 9 – Морфометрические параметры ядер лимфоцитов ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 11,31±0,09* 10,42±0,09 765,38±18,98* 604,39±16,63 403,46±6,78* 343,42±6,24 60 11,64±0,10* 10,75±0,11 834,32±22,07* 666,95±19,75 426,89±7,54* 366,26±7,30 90 11,66±0,09* 10,59±0,09 838,62±20,38* 633,32±16,62 428,61±6,95* 354,46±6,19 120 11,74±0,10* 10,78±0,13 856,17±22,93* 680,12±32,96 434,28±7,74* 368,98±10,14 150 11,73±0,12* 10,85±0,09 856,03±25,18* 678,95±16,05 433,83±8,59* 371,69±5,86 180 11,78±0,13* 10,75±0,09 871,15±29,72* 659,00±16,33 438,28±9,96* 364,47±5,99 210 11,97±0,13* 10,82+0,11 913,35±30,40* 676,82±20,68 452,48±9,99* 370,19±7,44 240 11,94±0,12* 10,67±0,09 905,28±28,97* 646,10±16,29 450,03±9,53* 359,60±6,06 270 11,98±0,11* 10,61±0,09 912,93±26,57* 634,74±15,59 453,01±8,68* 355,40±5,92 300 11,71±0,12* 10,72±0,10 853,89±24,45* 656,10±18,85 433,12±8,49* 362,81±6,94 330 11,63±0,14* 10,61±0,09 841,39±30,35* 633,84±16,15 427,98±10,22* 355,00±6,05 360 11,33±0,13* 10,46±0,08 776,92±27,03* 607,58±14,31 405,96±9,43* 345,38±5,43 390 11,15±0,13* 10,67±0,08 739,95±25,17* 642,79±15,30 393,02±9,01* 358,66±5,57 420 11,27±0,14* 10,66±0,09 765,99±28,53* 642,75±15,96 401,74±10,02* 358,37±6,00 450 11,27±0,14* 10,67±0,09 766,42±27,96* 644,84±15,80 401,95±9,88* 359,29±5,81 480 11,11±0,12* 10,66±0,09 729,17±23,12* 645,14±16,93 389,61±8,19* 359,01±6,41 510 11,30±0,11* 10,74±0,08 765,46±21,52* 655,78±15,07 402,82±7,63* 363,51±5,55 540 11,54±0,12* 10,75±0,08 816,71±25,62* 657,62±14,02 420,23±8,77* 364,40±5,14 570 11,72±0,13* 10,78±0,09 858,18±27,25* 664,70±16,99 434,16±9,36* 366,54±6,11 600 11,59±0,11* 10,83±0,08 825,94±24,02* 671,49±14,94 423,65±8,29* 369,39±5,44 900 11,74±0,13* 10,87±0,09 863,52±29,23* 682,71±17,55 435,71±9,89* 373,05±6,34 1800 11,43±0,17* 10,40±0,11 807,06±33,92* 603,09±21,21 414,72±12,11* 342,39±7,55 3600 11,55±0,10* 9,78±0,08 815,13±21,82* 498,17±13,61 420,28±7,51* 302,26±5,34 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Принимая во внимание, что характерной чертой лимфоцитов является превалирование площади поверхности ядра над цитоплазмой, а также выраженный эффект деконденсации хроматина под воздействием гипотонической среды, в проведенном исследовании были проанализированы ЯЦО в лимфоцитах, а также 86 изменения коэффициента осмотического натяжения плазмалеммы и кариолеммы. В гипотонической среде ЯЦО возросли на 30 секунде воздействия на 5% (р<0,05), к 270 секунде – на 9% (р<0,05), а к концу инкубации – на 11% (р<0,05) по сравнению с изотоническим раствором. Снижение ЯЦО в гипотонической среде на 8% (р<0,05) отмечалось к 90 секунде инкубации (рисунок 15), в этот период площадь поверхности клетки возросла на 18%, ядра – на 17,3% (р<0,05). усл. ед. 0,68 0,66 0,64 0,40% 0,62 0,90% 0,6 0,58 0,56 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 15 – Изменение ЯЦО лимфоцитов Установлен феномен увеличения объема ядер в гипотонической среде, сопровождающийся возрастанием значения коэффициента осмотического натяжения мембраны. В первые 360 секунд инкубации увеличение объема клеток протекало менее выражено по сравнению с ядрами (рисунок 16). усл.ед. 1,45 1,4 1,35 1,3 1,25 1,2 1,15 1,1 1,05 1 плазмалемма кариолемма 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 16 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы лимфоцитов 87 Воздействие умеренно гипотонического раствора на степень натяжения мембран клетки сильнее всего отразились на кариолемме. На 30 секунде инкубации коэффициент осмотического натяжения кариолеммы на 5% (р<0,05) превысил значения коэффициента натяжения плазмалеммы, к 90 секунде – на 10% (р<0,05), а к 150 секунде воздействия их значения были одинаковы и составили 1,18±0,03 усл. ед. К концу инкубации коэффициент осмотического натяжения кариолеммы превысил значения плазмалеммы на 14% (р<0,05). Использование мембранного резерва лимфоцитами в гипотонической среде увеличилось по сравнению с относительным мембранным резервом, задействованным в изотоническом растворе (таблица 10). Таблица 10 – Значения относительного мембранного резерва лимфоцитов (мкм-1) Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 900 1800 3600 Плазмалемма, усл. ед. 0,4% NaCl 0,9% NaCl 0,13±0,01* 0,08±0,01 0,15±0,01* 0,08±0,01 0,15±0,01* 0,08±0,01 0,15±0,01* 0,07±0,01 0,16±0,01* 0,07±0,01 0,16±0,01* 0,08±0,01 0,16±0,01* 0,08±0,01 0,17±0,01* 0,05±0,01 0,16±0,01* 0,09±0,01 0,14±0,01* 0,06±0,01 0,16±0,01* 0,07±0,01 0,13±0,01* 0,07±0,01 0,06±0,01 0,05±0,01 0,07±0,01* 0,22±0,01 0,09±0,01* 0,06±0,01 0,08±0,01 0,06±0,01 0,09±0,01 0,07±0,01 0,14±0,01* 0,09±0,01 0,13±0,03* 0,07±0,01 0,13±0,01* 0,09±0,01 0,16±0,01* 0,07±0,01 0,12±0,01* 0,06±0,01 0,12±0,01* 0,08±0,01 Кариолемма, усл. ед. 0,4% NaCl 0,9% NaCl 0,11±0,01* 0,03±0,01 0,15±0,02* 0,02±0,01 0,15±0,01* 0,03±0,01 0,16±0,02* 0,04±0,01 0,16±0,02* 0,06±0,01 0,17±0,02* 0,04±0,01 0,19±0,02* 0,06±0,01 0,19±0,02* 0,04±0,01 0,19±0,01* 0,02±0,01 0,16±0,02* 0,04±0,02 0,15±0,02* 0,03±0,01 0,11±0,02* 0,05±0,01 0,09±0,01* 0,04±0,01 0,11±0,02* 0,03±0,01 0,11±0,02* 0,04±0,01 0,08±0,01* 0,03±0,01 0,11±0,02* 0,04±0,0,1 0,14±0,02* 0,05±0,01 0,16±0,02* 0,05±0,01 0,14±0,02* 0,05±0,01 0,16±0,02* 0,06±0,01 0,12±0,02* 0,02±0,01 0,14±0,02* 0,06±0,01 Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). * 88 На 390 секунде относительный мембранный резерв, используемый клетками на поддержание объема в гипотонической среде, не отличался от резерва, задействованного в изотоническом растворе. При этом на 420 секунде использование мембранного резерва клетками в изотонической среде увеличилось на 214% (р<0,05) по сравнению с гипотоническим раствором. Использование резерва кариолеммой возрастало на протяжении всего времени инкубации. В результате проведенного анализа можно констатировать, что реакция лимфоцитов на умеренно гипотонический раствор проявляется феноменом увеличения объема клеток и ядер. Использование мембранного резерва ядром в ответ на снижение ионной силы раствора происходит интенсивнее, по сравнению с клеткой в целом. Длительность реакции регуляторного сокращения объема клеток в гипотонической среде составляет 60 секунд. Регуляторного сокращения объема ядер в гипотоническом растворе не установлено. 2.2.2. Влияние функциональных нагрузок на реакции регуляции объема лимфоцитов доноров в осмотических тестах (in vitro) 2.2.2.1. Регуляция объема лимфоцитов в условиях адреналиновой нагрузки Механизмы действия гормонов на клетку разнообразны и затрагивают различные системы внутриклеточной регуляции и метаболизма. Известно, что адреналин, выполняя триггерную функцию, активирует транспортные мембранные системы, в результате чего клетки претерпевают регуляторные изменения объема. В проведенном исследовании были изучено влияние физиологических концентраций адреналина на реализацию осморегуляторных реакций в лимфоцитах доноров в условиях воздействия умеренно гипотонической и изотонической нагру- 89 зок. Под влиянием адреналиновой нагрузки установлено увеличение диаметра, объема и площади поверхности лимфоцитов в течение первых 480 секунд инкубации в умеренно гипотонической среде (таблица 11). Таблица 11 – Морфометрические параметры лимфоцитов под влиянием адреналиновой нагрузки ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 13,49±0,12* 12,73±0,12 1300,60±35,57* 1093,69±31,18 578,83±10,37* 510,96±9,79 60 13,56±0,08* 12,77±0,11 1313,55±24,67* 1101,96±27,83 578,82±7,24* 513,97±8,82 90 13,36±0,11* 12,53±0,13 1260,33±29,78* 1044,29±30,63 562,39±8,97* 495,25±9,88 120 13,21±0,11* 12,32±0,14 1217,38±29,44* 996,55±31,93 549,50±8,89* 479,62±10,41 150 13,21±0,11* 12,33±0,13 1218,78±29,69* 996,59±29,00 549,95±8,86* 480,08±9,52 180 13,02±0,11* 12,20±0,14 1166,53±29,78* 968,77±31,84 533,89±9,12* 470,54±10,54 210 13,51±0,10* 12,09±0,12 1200,49±27,16* 939,21±26,71 544,54±8,41* 461,62±8,87 240 13,16±0,11* 12,35±0,11 1204,25±27,85* 997,39±26,75 545,57±8,68* 480,79±8,61 270 13,19±0,14* 12,26±0,11 1221,53±37,23* 976,37±25,74 549,73±11,21* 474,02±8,44 300 12,96±0,12* 12,03±0,13 1153,17±31,03* 925,87±28,46 529,57±9,59* 456,92±9,45 330 13,03±0,12* 12,03±0,09 1171,37±30,04* 920,27±22,28 535,29±9,29* 455,98±7,42 360 12,79±0,12* 12,44±0,12 1112,24±31,14* 1018,78±28,42 516,74±9,83* 487,40±9,21 390 12,78±0,12* 12,44±0,09 1108,80±32,13* 1015,93±22,48 515,61±9,99* 487,28±7,31 420 12,83±0,11* 12,29±0,09 1118,47±29,01* 979,68±22,55 519,03±9,09* 475,55±7,35 450 12,72±0,12* 12,18±0,10 1093,09±31,49* 953,94±23,46 510,75±9,84* 467,00±7,69 480 12,73±0,13* 12,19±0,11 1095,92±30,87* 958,53±25,20 511,58±9,89* 468,26±8,27 510 12,73±0,13 12,53±0,11 1095,09±31,88 1040,31±27,37 511,23±10,11 494,90±8,63 540 12,36±0,25 12,67±0,09 1031,74±32,30 1073,72±23,87 488,96±12,60 505,64±7,48 570 12,58±0,11 12,51±0,10 1054,87±26,61 1034,62±24,87 499,22±8,57 493,06±7,91 600 12,73±0,12* 12,29±0,11 1094,31+39,38* 984,84±27,19 511,25±9,58* 476,69±8,69 900 12,34±0,14 12,00±0,10 1001,51±32,79* 914,97±23,28 481,00±10,78* 454,15±7,63 1500 12,24±0,13 12,25±0,12 976,22±30,91 976,18±27,78 473,14±10,13 473,69±9,03 3600 12,09±0,12 11,92±0,08 937,99±26,11 888,56±17,48 461,30±8,68 445,95±5,86 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). На 30 секунде инкубации, объем и площадь поверхности клеток возросли соответственно на 16% и 12% (р<0,05), 120 секунде – на 18% и 13% (р<0,05), а к 270 секунде – на 20% и 14% (р<0,05) по сравнению с изотоническим раствором. Регуляторное сокращение объема лимфоцитов до значений изотонического раствора наблюдали в течение 90 секунд (с 510 по 570 секунды). На 600 секунде объем клеток увеличился на 53% (р<0,05), а к концу инкубации (3600 с) восстановился до значений изотонического раствора. Под влиянием адреналина геометрические параметры ядер увеличивались в течение первых 330 секунд воздействия умеренно-гипотонического раствора. 90 Возрастание объема и площади поверхности ядра на 22% и 15 % (р<0,05) по сравнению с изотоническим раствором наблюдали на 30 секунде (таблица 12). Таблица 12 – Морфометрические параметры ядер лимфоцитов под влиянием адреналиновой нагрузки ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 10,99±0,09* 10,13±0,09 704,36±18,71* 550,09±13,87 381,30±6,77* 323,49±5,44 60 10,61±0,12* 10,03±0,08 636,49±19,86* 536,17±15,27 355,79±7,56* 317,67±6,09 90 10,57±0,09* 10,08±0,08 625,21±17,56* 541,75±13,00 352,04±6,56* 320,94±5,09 120 10,62±0,12* 9,89±0,09 637,53±29,10* 511,44±13,42 356,15±7,62* 308,04±5,44 150 10,51±0,08* 9,84±0,08 612,27±13,74* 502,54±16,96 347,69±5,18* 304,69±4,83 180 10,38±0,11* 9,94±0,07 594,62±17,70* 518,45±11,49 340,19±6,86* 311,21±4,61 210 10,26±0,09* 9,79±0,07 572,67±16,48* 495,76±10,72 331,98±6,30* 302,09±4,36 240 10,51±0,09* 9,87±0,09 613,20±14,43* 510,17±14,17 347,88±5,59* 307,37±5,78 270 10,46±0,09* 9,85±0,08 606,29±16,26* 504,63±12,29 344,96±6,26* 305,48+4,98 300 10,02±0,10* 9,73±0,07 534,09±15,82* 485,77±11,02 316,77±6,26* 297,94±4,54 330 10,31±0,11* 9,76±0,08 583,27±18,04* 491,33±12,13 335,74±7,01* 300,02±5,04 360 10,25±0,09 10,14±0,15 569,79±15,62 563,88±32,18 331,00±5,99 326,18±10,64 390 10,15±0,10 9,97±0,08 555,88±16,72 522,61±11,95 325,29±6,51 312,80±4,80 420 10,17±0,11 9,91±0,08 559,78±17,79 513,73±12,31 326,60±6,95 309,19±4,92 450 10,26±0,10* 9,84+0,07 572,70±16,54* 501,59±9,95 331,86±6,53* 304,58±4,05 480 10,04±0,10 9,94±0,07 538,26±16,28 517,91±11,39 318,34±4,64 311,02±4,53 510 10,02±0,11 9,99±0,09 536,10±17,38 529,04±13,81 317,26±6,88 315,13±5,45 540 10,02±0,11 10,10±0,08 535,45±16,81 544,81±13,02 317,10±6,69 321,52±5,16 570 10,11±0,09 9,92±0,07 546,94±15,38 514,46±10,65 322,02±5,98 309,71±4,29 600 10,16±0,11 9,88±0,08 557,45±17,45 510,46±13,07 325,71±6,89 307,78±5,17 900 9,87±0,10 9,82±0,08 510,99±15,85 500,10±11,47 307,38±6,44 303,78±4,645 1500 9,53±0,10 9,59±,0,8 459,95±14,34 466,63±11,39 286,58±5,98 289,86±4,94 3600 9,76±0,08* 9,31±0,08 491,84±11,71* 427,01±10,66 300,32±4,81* 273,24±4,57 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Впоследствии интенсивность увеличения объема ядра снизилась, так на 120 секунде, объем ядра и площадь поверхности возросли соответственно на 19% и 13,5% (р<0,05), 270 секунде – на 17% и 11% (р<0,05), 330 секунде - на 15% и 10% (р<0,05), к окончанию инкубации (3600 с) – на 13% и 9% (р<0,05). Под влиянием адреналина выявлено развитие двух реакций регуляторного сокращения объема ядра до значений изотонического раствора: первая реакция длительностью 90 секунд (с 360 по 420 секунды), вторая –1020 секунд (с 480 по 1500 секунды). Изменения ЯЦО носили колебательный характер (рисунок 17). 91 усл.ед. 0,7 0,68 0,66 0,4% NaCl 0,9 % NaCl 0,64 0,62 0,6 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 17 – ЯЦО лимфоцитов в условиях активации β-адренорецепторов Показатель ЯЦО снижался практически на протяжении всего времени воздействия (с 60 по 900 секунду), а к концу инкубации возрастал на 6% (р<0,05) по сравнению с изотоническим раствором. Достоверные различия значений ЯЦО между гипо- и изотонической средой обнаружены на 210, 300, 330 и 3600 секундах инкубации. Выявлены две временные точки, когда показатели ЯЦО в гипо- и изотонической средах были равны, они приходились на 150 и 1500 секунды. 2.2.2.2. Регуляция объема лимфоцитов в пробах в обзиданом Под влиянием неспецифического блокатора β-адренорецепторов – обзидана, наблюдалось увеличение диаметра, объема и площади поверхности лимфоцитов в первые 240 секунд инкубации в умеренно гипотонической среде по сравнению с изотоническим раствором (таблица 13). 92 Таблица 13 – Морфометрические параметры лимфоцитов под влиянием обзидана ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 13,07±0,09* 11,68±0,09 1178,29±25,66* 845,08±19,86 538,00±7,84* 430,92±6,71 60 12,54±0,09* 11,68±0,11 1040,37±22,25* 846,68±24,84 495,21±7,07* 430,75±8,39 90 12,39±0,08* 11,71±0,10 1000,99±19,28* 850,86±22,94 482,86±6,21* 432,51±7,68 120 12,22±0,12* 11,75±0,10 968,19±28,51* 858,28±22,62 471,02±9,19* 434,96±7,77 150 12,56±0,09* 11,96±0,10 1043,69±21,66* 905,65±22,77 496,34±6,86* 451,04±7,59 180 12,45±0,09* 11,85±0,08 1017,06±21,95* 875,78±17,59 487,74±7,07* 441,64±5,87 210 12,25±0,11* 11,71±0,08 973,19±25,62* 846,78±18,35 473,03±8,34* 431,61±6,25 240 12,30±0,09* 11,86±0,09 981,79±21,65* 882,57±21,72 476,37±6,94* 443,43±7,25 270 12,14±0,08 12,02±0,10 942,15±18,69 919,76±22,90 463,72±6,07 455,71±7,66 300 12,27±0,09* 11,79±0,09 975,92±23,51* 867,16±20,24 474,26±7,55* 438,34±6,92 330 12,13±0,12* 11,69±0,10 948,29±28,36* 848,05±23,49 464,52±9,14* 431,47±7,85 360 12,16±0,09* 11,84±0,09 950,86±22,89* 876,05±19,92 466,04±7,55* 441,47±6,64 390 11,93±0,08 11,71±0,08 894,61±19,61 845,76±18,21 447,79±6,45 431,34±6,18 420 12,05±0,10 11,80±0,08 924,85±23,37 866,06±17,42 457,40±7,69 438,37±5,89 450 12,21±0,08* 11,85±0,08 959,53±20,01* 875,43±16,99 469,27±6,53* 441,56±5,75 480 11,79±0,07 11,67±0,09 861,82±15,95 841,29±21,12 437,06±5,42 429,41±7,22 510 11,75±0,10 11,57±0,11 859,06±22,32 820,81±25,67 435,37±7,51 421,98±8,25 540 12,13±0,07* 11,68±0,11 938,97±17,41* 844,81±23,03 462,78±5,71* 430,28±7,95 570 11,±0,1094* 11,63±0,08 900,61±23,27* 829,69±16,89 449,33±7,68* 425,95±5,83 600 12,12±0,08* 11,59±0,09 937,25±17,96* 823,76±19,4*9 462,12±5,97* 423,64±6,61 900 11,75±0,09* 11,45±0,08 855,67±20,04* 790,26±15,34 434,53±6,73* 412,41±5,43 1500 11,59±0,07* 11,29±0,07 819,38±15,84* 758,36±15,19 422,51±5,47* 401,23±5,31 3600 11,94±0,08* 11,50±0,11 800,61±16,96 806,54±22,24 415,88±5,87* 417,21±7,70 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). В ходе инкубации клеток в гипотонической среде выявлено три временных интервала, в течение которых наблюдали регуляторное сокращение их объема до значений изотонического раствора. Первый интервал установлен на 270 секунде, его длительность составила 30 секунд, второй и третий интервалы, длительностью по 60 секунд каждый из которых приходился соответственно на 390 и 480 секунды. В условиях блокады β-адренорецепторов реакция увеличения объема ядер в умеренно гипотонической среде, длительностью 450 секунд, чередовалась с периодами регуляторного сокращения объема до значений изотонической среды, длительностью 30 секунд (на 480 секунде инкубации) и 60 секунд (на 900 секунде), которые вновь сменялись увеличением размеров ядер соответственно до 600 и 3600 секунды включительно. К окончанию инкубации (3600 с) диаметр и объем ядер в умеренно гипотонической среде увеличились соответственно на 1,5% и 4% (р<0,05) по сравнению с изотоническим раствором (таблица 14). 93 Таблица 14 – Морфометрические параметры ядер лимфоцитов под влиянием обзидана ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 10,14±0,09* 9,13±0,09 553,18±16,42* 404,58±11,41 324,36±6,29* 263,32±5,04 60 9,90±0,10* 9,14±0,09 515,99±16,41* 406,45±12,79 309,43±6,45* 263,89±5,53 90 9,92±0,09* 9,18±0,08 518,18±13,31* 410,62±11,20 310,76±5,43* 266,03±4,87 120 10,04±0,08* 9,11±0,09 543,13±12,49* 401,09±11,54 320,93±4,94* 261,79±5,03 150 10,03±0,09* 9,43±0,07 533,99±13,47* 442,36±10,12 317,13±5,37* 279,89±4,31 180 9,84±0,07* 9,37±0,10 503,44±11,56* 437,48±14,36 305,15±4,61* 277,05±6,02 210 10,02±0,08* 9,38±0,09 531,39±15,11* 439,00±13,53 316,39±5,11* 277,83±5,76 240 9,78±0,08* 9,30±0,09 495,82±13,08* 427,25±12,41 301,78±5,26* 273,04±5,27 270 9,59±0,09* 9,29±0,09 467,73±14,08* 425,49±12,31 289,95±5,78* 272,23±5,34 300 9,79±0,08* 9,25±0,08 495,41±12,25* 419,08±10,93 301,76±4,92* 269,79±4,67 330 9,91±0,09* 9,27±0,08 515,43±14,97* 422,27±11,34 309,46±5,92* 271,09±4,83 360 9,72±0,09* 9,09±0,09 487,07±14,51* 400,35±12,57 297,88±5,91* 261,22±5,51 390 9,65±0,08* 9,25±0,09 474,06±11,54* 419,41±11,64 293,05±4,70* 269,74±5,07 420 9,76±0,08* 9,35±0,08 491,64±12,13* 432,73±10,88 300,21±4,92* 275,65±4,67 450 9,54±0,09* 9,20±0,07 461,32±14,15* 410,97±9,21 287,29±5,75* 266,55±3,97 480 9,27±0,09 9,20±0,07 422,36±12,62 411,28±9,32 270,8±5,37 266,64±4,06 510 9,51±0,07* 9,09±0,08 453,97±9,96* 397,35±10,61 284,86±4,16* 260,34±4,61 540 9,67±0,08* 9,19±0,08 478,01±12,69* 411,30±11,24 294,54±5,09* 266,37±4,80 570 9,74±0,07* 9,11±0,08 487,61±11,03* 399,20±10,12 298,73±4,47* 261,23±4,41 600 9,64±0,08* 8,86±0,08 474,21±11,73* 367,98±9,96 293,27±4,83* 247,29±4,49 900 9,57±0,09 9,39±0,08 464,68±13,55 437,79±11,99 288,84±5,45 277,69±4,99 1500 9,11±0,07* 8,85±0,09 399,65±8,96* 368,26±10,67 261,60±3,96* 247,27±4,81 3600 9,09±0,07* 8,95±0,07 396,33±8,77* 379,07±8,91 260,18±3,86* 252,48±3,99 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Под влиянием обзидана ЯЦО в умеренно гипотонической среде увеличились: на 120 секунде инкубации – на 11,6% (р<0,05), 360 секунде – на 9% (р<0,05), 600 секунде – 7,8% (р<0,05). К окончанию воздействия ЯЦО в гипо- и изотоническом растворах были равны (рисунок 18). усл.ед. 0,72 0,7 0,68 0,66 0,4% NaCl 0,64 0,9% NaCl 0,62 0,6 0,58 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 18 – ЯЦО лимфоцитов под влиянием обзидана 94 На представленном графике прослеживается цикличный характер в изменении ЯЦО под влиянием обзидана как в умеренно гипотоническом, так и в изотоническом растворе. Длительность первого периода возрастания ЯЦО составила 150 секунд, второго и третьего – по 240 секунд каждый. 2.2.2.3 Относительный мембранный резерв, используемый лимфоцитами в условиях активации и блокады β-адренорецепторов В проведенном исследовании было проанализировано влияние адреналина и обзидана на развитие осморегуляторных реакций лимфоцитов в гипотонической среде. В качестве контроля использованы морфометрические показатели лимфоцитов в гипотонической среде, а в качестве опытных проб – показатели в той же среде, но после инкубации клеток с адреналином (1 группа проб) и обзиданом (2 группа проб). Установлена реакция уменьшения диаметра и объема лимфоцитов в умеренно гипотоническом растворе, как в условиях активации, так и блокады βадренорецепторов (таблица 15). Таблица 15 – Морфометрические параметры лимфоцитов доноров под влиянием адреналина и обзидана Время, с 30 60 90 120 150 180 210 240 270 300 330 контроль 14,53±0,15 14,91±0,13 14,87±0,12 14,82±0,14 14,92±0,11 15,03±0,14 14,91±0,15 15,05±0,16 14,93±0,13 14,76±0,17 14,91±0,14 Диаметр, мкм адреналин 13,49±0,12* 13,56±0,08* 13,36±0,11* 13,21±0,11* 13,21±0,11* 13,02±0,11* 13,51±0,10* 13,16±0,11* 13,19±0,14* 12,96±0,12* 13,03±0,12* обзидан 13,07±0,09* 12,54±0,09* 12,39±0,08* 12,22±0,12* 12,56±0,09* 12,45±0,09* 12,25±0,11* 12,30±0,09* 12,14±0,08* 12,27±0,09* 12,13±0,12* контроль 1629,99±50,39 1755,85±49,20 1738,58±42,02 1724,56±46,96 1751,92±39,01 1797,48±19,25 1763,17±56,14 1814,23±57,23 1761,54±49,28 1714,46±62,07 1757,57±51,73 Объем, мкм3 адреналин 1300,60±35,57* 1313,55±24,67* 1260,33±29,78* 1217,38±29,44* 1218,78±29,69* 1166,53±29,78* 1200,49±27,16* 1204,25±27,85* 1221,53±37,23* 1153,17±31,03* 1171,37±30,04* обзидан 1178,29±25,66* 1040,37±22,25* 1000,99±19,28* 968,19±28,51* 1043,69±21,66* 1017,06±21,95* 973,19±25,62* 981,79±21,65* 942,15±18,69* 975,92±23,51* 948,29±28,36* 95 Продолжение таблицы 15 ВреДиаметр, мкм мя, с контроль адреналин 360 14,56±0,13 12,79±0,12* 390 13,78±0,15 12,78±0,12* 420 13,80±0,17 12,83±0,11* 450 14,06±0,16 12,72±0,12* 480 14,01±0,17 12,73±0,13* 510 14,06±0,17 12,73±0,13* 540 14,81±0,12 12,36±0,25* 570 14,68±0,16 12,58±0,11* 600 14,65±0,15 12,73±0,12* 900 15,04±0,15 12,34±0,14* 1500 14,50±0,17 12,24±0,13* 3600 14,48±0,10 12,09±0,12* обзидан 12,16±0,09* 11,93±0,08* 12,05±0,10* 12,21±0,08* 11,79±0,07* 11,75±0,10* 12,13±0,07* 11, 94±0,10* 12,12±0,08* 11,75±0,09* 11,59±0,07* 11,94±0,08* контроль 1634,54±42,59 1391,80±43,30 1407,65±52,43 1480,80±47,88 1470,66±52,98 1485,71±50,36 1714,35±40,64 1684,85±52,94 1668,77±51,49 1804,91±53,00 1629,51±56,76 1601,28±34,54 Объем, мкм3 адреналин 1112,24±31,14* 1108,80±32,13* 1118,47±29,01* 1093,09±31,49* 1095,92±30,87* 1095,09±31,88* 1031,74±32,30* 1054,87±26,61* 1094,31+39,38* 1001,51±32,79* 976,22±30,91* 937,99±26,11* обзидан 950,86±22,89* 894,61±19,61* 924,85±23,37* 959,53±20,01* 861,82±15,95* 859,06±22,32* 938,97±17,41* 900,61±23,27* 937,25±17,96* 855,67±20,04* 819,38±15,84* 800,61±16,96* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в умеренно гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Уменьшение диаметра лимфоцитов наблюдали в пробах с обзиданом: на 60 секунде инкубации диаметр клеток был снижен на 19% (р<0,05) по сравнению с контролем, а после адреналина – на 10% (р<0,05). Объем клеток под влиянием адреналиновой нагрузки на 30 секунде инкубации снижен на 25% (р<0,05;) 60 секунде – на 34% (р<0,05) по сравнению с контролем. Объем клеток под влиянием обзидана на 30 секунде уменьшен на 38% (р<0,05), на 60 секунде – на 68% (р<0,05) по сравнению с контролем. Размеры ядер лимфоцитов в умеренно гипотонической среде также как и клеток были снижены в условиях активации и блокады β-адренорецепторов (таблица 16). Таблица – 16 Морфометрические параметры ядер лимфоцитов доноров под влиянием адреналина и обзидана Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 контроль 11,31±0,09 11,64±0,10 11,66±0,09 11,74±0,10 11,73±0,12 11,78±0,13 11,97±0,13 11,94±0,12 11,98±0,11 11,71±0,12 11,63±0,14 11,33±0,13 11,15±0,13 Диаметр, мкм адреналин 10,99±0,09* 10,61±0,12* 10,57±0,09* 10,62±0,12* 10,51±0,08* 10,38±0,11* 10,26±0,09* 10,51±0,09* 10,46±0,09* 10,02±0,10* 10,31±0,11* 10,25±0,09* 10,15±0,10* обзидан 10,14±0,09* 9,90±0,10* 9,92±0,09* 10,04±0,08* 10,03±0,09* 9,84±0,07* 10,02±0,08* 9,78±0,08* 9,59±0,09* 9,79±0,08* 9,91±0,09* 9,72±0,09* 9,65±0,08* контроль 765,38±18,98 834,32±22,07 838,62±20,38 856,17±22,93 856,03±25,18 871,15±29,72 913,35±30,40 905,28±28,97 912,93±26,57 853,89±24,45 841,39±30,35 776,92±27,03 739,95±25,17 Объем, мкм3 адреналин 704,36±18,71* 636,49±19,86* 625,21±17,56* 637,53±29,10* 612,27±13,74* 594,62±17,70* 572,67±16,48* 613,20±14,43* 606,29±16,26* 534,09±15,82* 583,27±18,04* 569,79±15,62* 555,88±16,72* обзидан 553,18±16,42* 515,99±16,41* 518,18±13,31* 543,13±12,49* 533,99±13,47* 503,44±11,56* 531,39±15,11* 495,82±13,08* 467,73±14,08* 495,41±12,25* 515,43±14,97* 487,07±14,51* 474,06±11,54* 96 Продолжение таблицы 16 ВреДиаметр, мкм Объем, мкм3 мя, с контроль адреналин обзидан контроль адреналин обзидан 420 11,27±0,14 10,17±0,11* 9,76±0,08* 765,99±28,53 559,78±17,79* 491,64±12,13* 450 11,27±0,14 10,26±0,10* 9,54±0,09* 766,42±27,96 572,70±16,54* 461,32±14,15* 480 11,11±0,12 10,04±0,10* 9,27±0,09* 729,17±23,12 538,26±16,28* 422,36±12,62* 510 11,30±0,11 10,02±0,11* 9,51±0,07* 765,46±21,52 536,10±17,38* 453,97±9,96* 540 11,54±0,12 10,02±0,11* 9,67±0,08* 816,71±25,62 535,45±16,81* 478,01±12,69* 570 11,72±0,13 10,11±0,09* 9,74±0,07* 858,18±27,25 546,94±15,38* 487,61±11,03* 600 11,59±0,11 10,16±0,11* 9,64±0,08* 825,94±24,02 557,45±17,45* 474,21±11,73* 900 11,74±0,13 9,87±0,10* 9,57±0,09* 863,52±29,23 510,99±15,85* 464,68±13,55* 1500 11,43±0,17 9,53±0,10* 9,11±0,07* 807,06±33,92 459,95±14,34* 399,65±8,96* 3600 11,55±0,10 9,76±0,08* 9,09±0,07* 815,13±21,82 491,84±11,71* 396,33±8,77* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в умеренно гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Уменьшение морфометрических параметров ядер наблюдали в пробах, проинкубированных с обзиданом. Под влиянием обзидана на 60 секунде воздействия в гипотонической среде диаметр и объем ядер снижены соответственно на 17,6% и 62% (р<0,05), а в условиях адреналиновой нагрузки – на 9,7% и 31% (р<0,05) по сравнению с контролем. На 240 секунде воздействия диаметр и объема ядер уменьшены соответственно на 22,0% и 82,5% (р<0,05) под влиянием обзидана, и 13,6% и 47,6% (р<0,05) под влиянием адреналина по сравнению с контролем. К концу инкубации (3600 с) диаметр и объем ядер лимфоцитов были снижены на 22% и 51,4% (р<0,05) в условиях блокады β-адренорецепторов, на 15,5% и 40% (р<0,05) в условиях активации β-адренорецепторов по сравнению с контролем. Коэффициент осмотического натяжения плазмалеммы на 30 секунде был снижен на 20,6% (р<0,05) в пробах с адреналиновой нагрузкой, и увеличен на 12% (р<0,05) по сравнению с контролем в пробах с обзиданом (таблица 17). Таблица 17 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы лимфоцитов доноров Время, с 30 60 90 120 150 180 210 240 Плазмалемма, усл. ед. контроль адреналин обзидан 1,11±0,03 0,92±0,02* 1,26±0,03* 1,16±0,03 1,14±0,03 1,18±0,03 1,16±0,03 1,16±0,03 1,13±0,02 1,18±0,04 1,17±0,03 1,09±0,03 1,17±0,03 1,17±0,03 1,11±0,02 1,16±0,03 1,15±0,03 1,14±0,02 1,15±0,03 1,19±0,03 1,08±0,03 1,25±0,04 1,16±0,03 1,06±0,02* Кариолемма, усл. ед. контроль адреналин обзидан 1,17±0,04 0,94±0,02* 1,26±0,04 1,25±0,04 1,14±0,03* 1,20±0,04 1,29±0,04 1,11±0,03* 1,19±0,03* 1,24±0,04 1,17±0,03 1,25±0,03 1,18±0,03 1,15±0,02 1,15±0,03 1,23±0,03 1,10±0,03* 1,12±0,03* 1,23±0,03 1,11±0,03* 1,17±0,02 1,28±0,04 1,15±0,03* 1,14±0,03* 97 Продолжение таблицы 17 ВреПлазмалемма, усл. ед. Кариолемма, усл. ед. мя, с контроль адреналин обзидан контроль адреналин обзидан 270 1,13±0,03 1,17±0,03 1,07±0,02 1,31±0,04 1,15±0,03* 1,09±0,03* 300 1,18±0,04 1,18±0,03 1,11±0,02 1,22±0,04 1,08±0,03* 1,13±0,03* 330 1,18±0,03 1,19±0,03 1,06±0,02* 1,24±0,04 1,14±0,03* 1,21±0,03 360 1,13±0,03 1,07±0,02 1,09±0,02 1,19±0,03 1,04±0,02* 1,12±0,03 390 1,03±0,02 1,07±0,03 1,03±0,02 1,11±0,03 1,05±0,02 1,08±0,03 420 1,02±0,03 1,11±0,03* 1,06±0,02 1,14±0,04 1,07±0,03 1,10±0,03 450 1,08±0,04 1,11±0,03 1,07±0,02 1,12±0,03 1,09±0,03 1,08±0,02 480 1,06±0,04 1,11±0,03 1,03±0,02 1,12±0,04 1,03±0,02* 1,03±0,03* 510 1,05±0,04 1,05±0,03 1,04±0,02 1,14±0,03 1,02±0,03* 1,11±0,02 540 1,13±0,03 0,99±0,02* 1,09±0,02 1,15±0,02 0,99±0,02* 1,12±0,03 570 1,15±0,03 1,02±0,02* 1,06±0,02 1,19±0,03 1,05±0,02* 1,16±0,03 600 1,10±0,03 1,09±0,03 1,10±0,02 1,16±0,03 1,07±0,03* 1,21±0,03 900 1,21±0,03 1,08±0,03* 1,06±0,02* 1,19±0,03 1,02±0,02* 1,05±0,02* 1500 1,14±0,04 1,02±0,03* 1,06±0,02* 1,25±0,04 1,00±0,03* 1,07±0,02* 3600 1,25±0,03 1,04±,002* 1,01±0,02* 1,42±0,04 1,11±0,03* 1,04±0,02* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в умеренно гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Под влиянием адреналиновой нагрузки на протяжении большей части инкубации коэффициент осмотического натяжения плазмалеммы уменьшался по сравнению с контролем. Лишь на 420 секунде коэффициент натяжения плазмалеммы возрос на 8% (р<0,05) по сравнению с контролем. Под влиянием обзидана, начиная с 60 секунды и до конца воздействия, коэффициент осмотического натяжения плазмалеммы был снижен. Коэффициент осмотического натяжения кариолеммы под влиянием адреналина на 30 с инкубации был снижен на 24,5% (р<0,05;), а под влиянием обзидана – увеличен на 7% (р<0,05) по сравнению с контролем (см. таблицу 17). В дальнейшем на протяжении инкубации лимфоцитов в умеренногипотонической среде, коэффициент осмотического натяжения ядер уменьшался как в пробах после адреналина, так и после обзидана. К окончанию инкубации под влиянием адреналина и обзидана коэффициент осмотического натяжения снижен соответственно на 28% и 36,5% (р<0,05) по сравнению с контролем. Анализируя влияния адреналина и обзидана на динамику ЯЦО в условиях гипоосмотического увеличения объема видно, что под влиянием адреналина в первые 30 секунд инкубации ЯЦО возросли на 7,5% (р<0,05), а обзидана были в пределах недостоверных различий с контролем (рисунок 19). 98 усл. ед. 0,7 0,69 0,68 0,67 0,66 0,65 0,64 0,63 0,62 0,61 0,6 контроль адреналин обзидан 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 19 – ЯЦО лимфоцитов доноров в гипотонической среде под влиянием адреналина и обзидана В целом динамика ЯЦО носила циклический характер, что свидетельствует о реализации в системе клетка-ядро механизмов перераспределения площади поверхности ядра и цитоплазмы. Установлено, что увеличение показателя ЯЦО после воздействия обзидана, наблюдалось с периодичностью в 120 секунд на 90, 210 и 330 секундах инкубации. При этом четко прослеживались временные периоды (150, 240, 360, 480, 600, 1500 секунды), когда показатель ЯЦО как после активации, так и блокады β-адренорецепторов был одинаков. Интервал между этими периодами составлял 90, 120 и 900 секунд. Таким образом, по мере увеличения времени инкубации возрос временной интервал между включением механизмов, обеспечивающим возвращение клетки в состояние равновесия. Использование относительного мембранного резерва лимфоцитами и ядрами в условиях активации и блокады β-адренорецепторов снижалось на протяжении всего времени инкубации. Цикличность в интенсивности использования мембранного резерва в ответ на снижение осмолярности среды наблюдали, начиная с 60 секунды и до конца инкубации с интервалом в 90 секунд. Под влиянием адреналиновой нагрузки максимальное использование относительного мембранного резерва лимфоцитами (≈15%) наблюдали на 60 секунде, в то время как ядрами (≈16%) – на 30 секунде инкубации. Под влиянием обзидана использование мембранного резерва клетками (≈6%) отмечено на 30 секунде инкубации, при этом ядра не участвовали в реакциях увеличения объема (рисунок 20). 99 мкм -1 0,2 0,18 0,16 0,14 0,12 0,1 0,08 0,06 0,04 0,02 0 контроль адреналин обзидан 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 20 – Относительный мембранный резерв, используемый лимфоцитами под влиянием адреналина и обзидана. Использование поверхностного резерва плазмалеммы под влиянием обзидана было снижено на 30 секунде инкубации на 77% (р<0,05), в то время как под влиянием адреналина на 60 секунде инкубации – на 93% (р<0,05) по сравнению с контролем (см. рисунок 20.). Максимальное использование внутриклеточных резервов мембранного бассейна ядром (≈16%) под влиянием адреналиновой нагрузки отмечалось на 30 секунде инкубации (рисунок 21). мкм-1 0,25 0,2 контроль 0,15 адреналин 0,1 0,05 0 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 21 – Относительный мембранный резерв, используемый ядром под влиянием адреналина и обзидана. В условиях блокады β-адренорецепторов осморегуляторных реакций со стороны ядра не выявлено. Таким образом, в условиях активации и блокады β-адренорецепторов установлено снижение использования поверхностного и внутриклеточного мембран- 100 ного резерва лимфоцитами и их ядрами в реакциях гипоосмотического увеличения объема. 2.2.2.4 Сравнительный анализ регуляции объема лимфоцитов в изотонической среде в условиях активации и блокады β-адренорецепторов Известно, что резерв плазмалеммы позволяет клеткам животных совершать быстрые изменения формы в буферном растворе, при этом в регуляции объема в большей степени задействованы поверхностные бассейны мембраны, заложенные в складчатости плазмалеммы. В проведенном исследовании были проанализированы морфометрические параметры лимфоцитов и интенсивность использования ими резервных мембранных структур в изотонической среде. В качестве контроля использованы показатели лимфоцитов в изотоническом растворе без функциональных нагрузок, опытных проб – показатели в изотоническом растворе под влиянием адреналина и обзидана. В результате проведенных экспериментов установлена реакция регуляторного сокращения объема клеток и уменьшения их диаметра как после активации, так и после блокады β-адренорецепторов. В пробах, проинкубированных с адреналином, на 30 секунде в изотоническом растворе диаметр лимфоцитов уменьшился на 8% (р<0,05), объем – на 26,4% (р<0,05), с обзиданом – соответственно на 17,7% и 63,5% (р<0,05) по сравнению с контролем (таблица 18). Таблица 18 – Морфометрические параметры лимфоцитов доноров под влиянием адреналина и обзидана в изотонической среде Время, с 30 60 90 контроль 13,75±0,11 13,88±0,09 13,43±0,16 Диаметр, мкм адреналин 12,73±0,12* 12,77±0,11* 12,53±0,13* обзидан 11,68±0,09* 11,68±0,11* 11,71±0,10* контроль 1382,41±34,70 1417,93±29,78 1311,43±42,38 Объем, мкм3 адреналин 1093,69±31,18* 1101,96±27,83* 1044,29±30,63* обзидан 845,08±19,86* 846,68±24,84* 850,86±22,94* 101 Продолжение таблицы 18 ВреДиаметр, мкм Объем, мкм3 мя, с Контроль Адреналин Обзидан Контроль Адреналин Обзидан 120 13,72±0,10 12,32±0,14* 11,75±0,10* 1368,81±31,64 996,55±31,93* 858,28±22,62* 150 13,77±0,12 12,33±0,13* 11,96±0,10* 1392,82±37,28 996,59±29,00* 905,65±22,77* 180 13,83±0,11 12,20±0,14* 11,85±0,08* 1404,44±36,69 968,77±31,84* 875,78±17,59* 210 13,77±0,12 12,09±0,12* 11,71±0,08* 1386,87±36,78 939,21±26,71* 846,78±18,35* 240 13,48±0,12 12,35±0,11* 11,86±0,09* 1300,90±34,42 997,39±26,75* 882,57±21,72* 270 13,92±0,11 12,26±0,11* 12,02±0,10* 1428,98±33,15 976,37±25,74* 919,76±22,90* 300 13,51±0,13 12,03±0,13* 11,79±0,09* 1315,46±39,69 925,87±28,46* 867,16±20,24* 330 13,67±0,12 12,03±0,09* 11,69±0,10* 1360,44±36,54 920,27±22,28* 848,05±23,49* 360 13,68±0,12 12,44±0,12* 11,84±0,09* 1364,00±37,38 1018,78±28,42* 876,05±19,92* 390 13,51±0,08 12,44±0,09* 11,71±0,08* 1300,96±25,51 1015,93±22,48* 845,76±18,21* 420 13,56±0,11 12,29±0,09* 11,80±0,08* 1322,00±30,72 979,68±22,55* 866,06±17,42* 450 13,56±0,11 12,18±0,10* 11,85±0,08* 1320,37±31,09 953,94±23,46* 875,43±16,99 480 13,58±0,12 12,19±0,11* 11,67±0,09* 1330,22±33,35 958,53±25,20* 841,29±21,12* 510 13,63±0,10 12,53±0,11* 11,57±0,11* 1340,81±30,33 1040,31±27,37* 820,81±25,67* 540 13,88±0,12 12,67±0,09* 11,68±0,11* 1422,61±37,37 1073,72±23,87* 844,81±23,03* 570 13,64±0,11 12,51±0,10* 11,63±0,08* 1346,72±33,19 1034,62±24,87* 829,69±16,89* 600 13,97±0,11 12,29±0,11* 11,59±0,09* 1447,05±36,07 984,84±27,19* 823,76±19,49 900 13,68±0,12 12,00±0,10* 11,45±0,08* 1359,09±35,63 914,97±23,28* 790,26±15,34* 1500 13,69±0,12 12,25±0,12* 11,29±0,07* 1365,38±38,73 976,18±27,78* 758,36±15,19* 3600 13,01±0,11 11,92±0,08* 11,50±0,11* 1169,62±33,22 888,56±17,48* 806,54±22,24* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Наиболее выраженную реакцию уменьшения диаметра лимфоцитов и сокращения их объема наблюдали под влиянием обзидана. На 60 секунде диаметр и объем лимфоцитов были снижены соответственно на 18% и 67,5 % (р<0,05) в пробах с обзиданом, и на 8,7% и 28,7% (р<0,05) – в пробах с адреналином по сравнению с контролем. К окончанию времени инкубации диаметр и объем лимфоцитов как после активации, так и после блокады β-адренорецепторов были практически равны, но по сравнению с контролем достоверно ниже. Геометрические размеры ядра в изотоническом растворе уменьшились как под влиянием адреналина, так и обзидана (таблица 19). Таблица 19 - Морфометрические параметры ядер лимфоцитов доноров под влиянием адреналина и обзидана в изотонической среде Время, с 30 60 90 120 150 180 контроль 10,42±0,09 10,75±0,11 10,59±0,09 10,78±0,13 10,85±0,09 10,75±0,09 Диаметр, мкм адреналин 10,13±0,09* 10,03±0,08* 10,08±0,08* 9,89±0,09* 9,84±0,08* 9,94±0,07* обзидан 9,13±0,09* 9,14±0,09* 9,18±0,08* 9,11±0,09* 9,43±0,07* 9,37±0,10* контроль 604,39±16,63 666,95±19,75 633,32±16,62 680,12±32,96 678,95±16,05 659,00±16,33 Объем, мкм3 адреналин 550,09±13,87* 536,17±15,27* 541,75±13,00* 511,44±13,42* 502,54±16,96* 518,45±11,49* обзидан 404,58±11,41* 406,45±12,79* 410,62±11,20* 401,09±11,54* 442,36±10,12* 437,48±14,36* 102 Продолжение таблицы 19 ВреДиаметр, мкм Объем, мкм3 мя, с контроль адреналин обзидан контроль адреналин обзидан 210 10,82+0,11 9,79±0,07* 9,38±0,09* 676,82±20,68 495,76±10,72* 439,00±13,53* 240 10,67±0,09 9,87±0,09* 9,30±0,09* 646,10±16,29 510,17±14,17* 427,25±12,41* 270 10,61±0,09 9,85±0,08* 9,29±0,09* 634,74±15,59 504,63±12,29* 425,49±12,31* 300 10,72±0,10 9,73±0,07* 9,25±0,08* 656,10±18,85 485,77±11,02* 419,08±10,93* 330 10,61±0,09 9,76±0,08* 9,27±0,08* 633,84±16,15 491,33±12,13* 422,27±11,34* 360 10,46±0,08 10,14±0,15* 9,09±0,09* 607,58±14,31 563,88±32,18* 400,35±12,57* 390 10,67±0,08 9,97±0,08* 9,25±0,09* 642,79±15,30 522,61±11,95* 419,41±11,64* 420 10,66±0,09 9,91±0,08* 9,35±0,08* 642,75±15,96 513,73±12,31* 432,73±10,88* 450 10,67±0,09 9,84+0,07* 9,20±0,07* 644,84±15,80 501,59±9,95* 410,97±9,21* 480 10,66±0,09 9,94±0,07* 9,20±0,07* 645,14±16,93 517,91±11,39* 411,28±9,32* 510 10,74±0,08 9,99±0,09* 9,09±0,08* 655,78±15,07 529,04±13,81* 397,35±10,61* 540 10,75±0,08 10,10±0,08* 9,19±0,08* 657,62±14,02 544,81±13,02* 411,30±11,24* 570 10,78±0,09 9,92±0,07* 9,11±0,08* 664,70±16,99 514,46±10,65* 399,20±10,12* 600 10,83±0,08 9,88±0,08* 8,86±0,08* 671,49±14,94 510,46±13,07* 367,98±9,96* 900 10,87±0,09 9,82±0,08* 9,39±0,08* 682,71±17,55 500,10±11,47* 437,79±11,99* 1500 10,40±0,11 9,59±,0,08* 8,85±0,09* 603,09±21,21 466,63±11,39* 368,26±10,67* 3600 9,78±0,08 9,31±0,08* 8,95±0,07* 498,17±13,61 427,01±10,66* 379,07±8,91* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Выраженное снижение объема ядра наблюдали в пробах с обзиданом. Так на 30 секунде диаметр и объем ядра сократились на 14% и 49,4% (р<0,05) под влиянием обзидана, и на 3% и 9,8% (р<0,05) под влиянием адреналина по сравнению с контролем. На 240 секунде под влиянием обзидана диаметр и объем ядра уменьшились на 14,7% и 51% (р<0,05), а адреналина – соответственно на 8% и 27% (р<0,05) по сравнению с контролем. К окончанию инкубации (3600 с) диаметр и объем ядра под влиянием адреналиновой и обзидановой нагрузок были снижены по сравнению с контролем. Динамика ЯЦО на протяжении всего времени инкубации носила циклический характер. В целом ЯЦО после воздействия адреналина возросли и оставались повышенными на протяжении всего времени инкубации. Под влиянием обзидана ярко выраженных различий с контролем в ЯЦО не выявлено (рисунок 22). 103 усл.ед. 0,7 0,68 0,66 контроль 0,64 адреналин 0,62 обзидан 0,6 0,58 0,56 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 22 – ЯЦО лимфоцитов доноров в изотонической среде под влиянием адреналина и обзидана Анализируя использование мембранного резерва лимфоцитами и ядрами в изотонической среде, установлено снижение интенсивности использования резервных мембранных структур в реакциях поддержания объема. Под влиянием адреналиновой нагрузки максимальное использование относительного мембранного резерва (≈2%) лимфоцитами отмечено на 60 секунде инкубации, в то время как ядро не принимало участия в осморегуляторных реакциях (рисунок 23). мкм -1 0,1 0,09 0,08 0,07 0,06 0,05 0,04 0,03 0,02 0,01 0 контроль адреналин 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 23 – Относительный мембранный резерв, используемый клетками в контроле в изотонической среде под влиянием адреналина 104 Под влиянием адреналина использование относительного мембранного резерва клетками было снижено на 60 секунде на 93% (р<0,05) по сравнению с контролем. Под влиянием обзидана не установлено участия клеток и ядер в осморегуляторных реакциях. Таким образом, активация β-адренорецепторов способствует снижению использования мембранного резерва лимфоцитами в изотонической среде. При этом ядро не принимает участия в осморегуляторных реакциях в изотоническом растворе, как в условиях активации, так и блокады β-адренорецепторов. 2.2.2.5 Регуляция объема лимфоцитов доноров в условиях кальциевой нагрузки Известно, что гипотонические растворы индуцируют работу Са2+ каналов и стимулируют увеличение свободного кальция в цитозоле, в связи с чем, в проведенном исследовании было изучено участие экзогенного Са2+ в механизмах осмотической регуляции объема клетки. В результате проведенных экспериментов установлено увеличение диаметра, объема и площади поверхности лимфоцитов под влиянием кальциевой нагрузки в течение первых 210 секунд инкубации в гипотонической среде по сравнению с изотоническим раствором. На 30 секунде инкубации диаметр, объем и площадь поверхности лимфоцитов были увеличены соответственно на 3,5%, 9,5% и 6,7% (р<0,05) (таблица 20). Таблица 20 – Морфометрические параметры лимфоцитов под влиянием кальциевой нагрузки ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 13,99±0,10* 13,50±0,14 1446,49±30,74* 1309,81±41,22 616,89±8,77* 575,71±12,11 60 13,80±0,11* 12,92±0,15 1389,01±33,14* 1152,21±39,76 600,06±9,57* 527,89±12,19 105 Продолжение таблицы 20 ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 90 13,71±0,12* 13,18±0,14 1364,62±34,89* 1218,27±38,49 592,68±10,24* 548,45±11,72 120 13,60±0,11* 12,96±0,18 1329,14±33,03* 1172,39±47,39 582,61±9,56* 532,57±14,71 150 13,84±0,10* 13,37±0,17 1399,16±30,77* 1281,59±50,64 603,29±8,82* 565,80±14,79 180 13,92±0,11* 13,04±0,16 1424,84±33,77* 1188,39±46,80 610,34±9,72* 538,22±13,83 210 13,80±0,13* 13,20±0,14 1393,27±37,82* 1224,89±40,96 600,71±10,95* 550,38±12,01 240 12,79±0,17 13,07±0,14 1125,15±43,17 1187,03±38,16 518,69±13,56 539,11±11,46 270 13,85±0,14* 13,28±0,16 1409,65±42,58* 1251,57±46,71 604,96±12,07* 557,61±13,53 300 13,97±0,12* 13,19±0,16 1443,26±36,72* 1227,56±45,37 615,29±10,52* 550,48±13,29 330 13,78±0,15* 13,24±0,15 1394,22±46,66* 1238,82±43,58 589,92±13,21* 554,12±12,85 360 13,73±0,14* 13,18±0,16 1375,12±41,38* 1223,69±46,63 595,01±11,91* 549,15±13,58 390 13,62±0,13* 13,08±0,14 1342,44±39,21* 1180,55±39,07 585,69±11,39* 536,85±11,92 420 13,74±0,15* 13,14±0,17 1384,42±46,44* 1216,57±45,99 596,92±13,41* 546,79±13,78 450 13,95±0,18* 13,08±0,14 1457,13±71,53* 1194,81±40,84 615,75±17,69* 541,11±12,19 480 13,79±0,14* 13,26±0,13 1395,78±44,63* 1238,32±39,28 600,66±12,65* 554,67±11,55 510 13,51±0,11* 13,16±0,12 1305,08±33,40* 1208,88±34,73 575,46±9,69* 546,25±10,47 540 13,89±0,13* 13,05±0,12 1414,20±41,51* 1179,86±35,75 607,49±11,9* 537,46±10,45 570 13,76±0,11* 12,86±0,12 1377,02±33,63* 1128,72±33,38 596,54±9,69* 521,76±10,18 600 13,66±0,15* 13,08±0,15 1357,36±43,92* 1195,86±44,10 589,43±12,68* 541,17±12,78 900 13,63±0,13 13,31±0,16 1344,68±39,23 1259,47±45,93 586,34±11,43 559,34±13,53 1800 12,81±0,13 1125,04±35,74 520,29±10,85 3600 12,55±0,14 1053,80±35,59 497,63±11,21 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). К 120 секунде диаметр, объем, и площадь поверхности возросли соответственно на 5%, 12% и 8,5% (р<0,05) по сравнению с изотоническим раствором. Включение осморегуляторных механизмов клеток в гипотонической среде происходило на 240 секунде, когда морфометрические параметры лимфоцитов достигли значений изотонического раствора. Начиная с 270 и по 900 секунды инкубации, размеры клеток в гипотонической среде увеличились. Однако, на 1800 секунде увеличения объема в пробах после кальциевой нагрузкой наблюдали гибель клеток и появление теней. Увеличение размеров ядра в гипотонической среде протекало в течение первых 420 секунд инкубации. Выявлен циклический характер изменения геометрических параметров ядра, которые возрастали с интервалами в 120 секунд. На 30 секунде инкубации диаметр, объем, и площадь поверхности ядра увеличились соответственно на 7%, 19,5% и 13,5% (р<0,05); 150 секунде – 10,4%, 26,6% и 19,2% (р<0,05); 240 и 360 секундах воздействия соответственно на 7,4%, 20%, 14% 106 (р<0,05) и 9,3%, 24,2%, 17,3% (р<0,05) по сравнению с изотоническим раствором (таблица 21). Таблица 21 – Морфометрические параметры ядра лимфоцитов под влиянием кальциевой нагрузки ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 11,09±0,09* 10,31±0,10 723,01±18,50* 582,29±17,82 388,14±6,63* 335,51±6,77 60 10,86±0,09* 10,26±0,15 678,97±17,86* 582,41±24,69 372,07±6,61* 333,85±9,56 90 11,03±0,09* 10,29±0,12 710,78±17,94* 582,±20,5032 383,74±6,51* 334,79±8,03 120 11,23±0,09* 10,25±0,13 750,46±19,75* 576,96±22,59 397,79±7,00* 332,39±8,69 150 10,89±0,10* 9,76±0,14 685,36±18,83* 502,41±22,21 374,24±6,99* 302,46±8,84 180 11,15±0,09* 9,94±0,11 733,06±18,13* 524,35±18,33 391,81±6,43* 312,40±7,20 210 11,03±0,09* 10,15±0,14 709,81±17,19* 562,41±22,43 383,51±6,21* 326,49±8,84 240 11,09±0,10* 10,27±0,12 723,49±20,55* 579,36±19,18 387,89±7,47* 333,94±7,52 270 11,04±0,09* 10,42±0,13 712,16±18,31* 606,17±22,30 384,21±6,65* 343,78±8,46 300 10,99±0,10* 10,24±0,12 704,73±19,29* 574,85±20,92 381,32±7,02* 331,89±8,07 330 11,01±0,11* 10,23±0,14 708,48±20,17* 576,03±23,05 382,60±7,44* 331,63±9,16 360 11,00±0,12* 9,98±0,15 710,27±22,78* 538,22±23,58 382,65±8,36* 316,41±9,48 390 10,89±0,09* 10,32±0,14 683,39±18,22* 591,41±22,27 373,69±6,64* 337,73±8,88 420 11,08±0,10* 9,97±0,15 720,61±20,15* 537,93±24,09 387,00±7,19* 316,29±9,55 450 10,91±0,13 10,77±0,11 694,25±24,58 664,49±20,82 376,56±8,87 366,28±7,59 480 10,74±0,10 10,57±0,10 656,99±18,09 626,16±18,26 363,87±6,75 352,23±6,90 510 10,84±0,11 10,59±0,10 677,55±21,56 630,33±17,71 371,00±7,81 353,89±6,71 540 10,68±0,09* 10,28±0,11 646,65±17,95* 579,03±18,59 360,09±6,61* 333,96±7,25 570 10,96±0,10* 10,37±0,12 698,81±19,95* 594,73±20,07 379,06±7,26* 339,79±7,72 600 10,88±0,11* 10,48±0,12 684,07±20,13* 612,83±20,86 373,64±7,32* 346,74±7,90 900 10,66±0,11* 9,93±0,12 643,41±19,78* 524,60±19,18 358,53±7,33* 312,18±7,69 1800 9,79±0,11 500,54±16,90 302,32±6,86 3600 9,71±0,12 490,64±18,64 298,42±7,59 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). В течение 90 секундного (с 450 по 510 секунды) периода наблюдали регуляторное уменьшение объема ядра до значений изотонической среды. Начиная с 540 и по 900 секунду, размеры ядра увеличились: к концу инкубации диаметр, объем, и площадь поверхности возросли соответственно на 6,8%, 18,5% и 13% (р<0,05) по сравнению с изотоническим раствором. Динамика ЯЦО носила выраженный циклический характер. Длина циклов увеличения ЯЦО составила 120 секунд. В течение первого цикла (30-120 с) происходил подъем ЯЦО в среднем на 7,2% (р<0,05), в конце второго (120-240 с) и третьего (240-360 с) циклов – соответственно на 19% и 9% (р<0,05). Снижение 107 ЯЦО наблюдали в конце четвертого (360-480 с) и пятого (510-600 с) циклов соответственно на 9% и 3% (р<0,05) по сравнению с изотоническим раствором (рисунок 24). усл. ед. 0,85 0,8 0,75 0,7 0,4% NaCl 0,65 0,9% NaCl 0,6 0,55 0,5 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 24 – ЯЦО под влиянием кальциевой нагрузки Существенное увеличение показателя ЯЦО наблюдали на 240 секунде (19,2%; р<0,05), в этот же период объем клетки уменьшался на фоне увеличения объема ядра (см. таблица 20, 21). 2.2.2.6 Регуляция объема лимфоцитов доноров в пробах с верапамилом Верапамил, являясь блокатором медленных Са2+-каналов L-типа, существенно снижает уровень цитозольного кальция при гипотоническом шоке, в связи с этим в проведенном исследовании была изучена его в роль в механизмах развития осморегуляторных реакций. На 30 секунде инкубации диаметр, объем, и площадь поверхности лимфоцитов увеличились соответственно на 4%, 11,5% и 8% (р<0,05) по сравнению с изотоническим раствором. На 60 секунде параметры кле- 108 ток находились в пределах недостоверных различий с изотонической средой, а на 90 секунде диаметр, объем, и площадь поверхности лимфоцитов вновь возросли на 3%, 11% и 7% (р<0,05) соответственно (таблица 22). Таблица 22 – Морфометрические параметры лимфоцитов под влиянием верапамила ВреДиаметр, мкм Объем, мкм3 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 13,38±0,13* 12,83±0,15 1271,62±37,69* 1124,64±35,94 60 13,06±0,12 12,87±0,17 1181,29±33,64 1144,35±41,95 90 13,21±0,14* 12,83±0,1 1225,82±37,07* 1130,44±41,58 120 13,13±0,14* 12,68±0,15 1205,28±37,28* 1090,50±38,59 150 12,98±0,16 12,58±0,16 1169,17±40,91 1066,48±38,59 180 13,02±0,16 12,62±0,15 1180,87±40,46 1073,76±36,83 210 13,24±0,14* 12,51±0,17 1235,26±37,89* 1052,83±41,34 240 13,35±0,14* 12,83±0,15 1265,44±37,24* 1127,07±36,23 270 13,08±0,18 12,95±0,15 1202,67±46,93 1159,96±38,84 300 13,24±0,19 12,93±0,18 1250,44±49,20 1165,27±46,42 330 13,12±0,18 12,95±0,15 1211,96±46,29 1156,81±36,92 360 13,15±0,19 12,86±0,18 1224,55±49,34 1142,38±45,37 390 13,14±0,17 12,73±0,13 1215,22±44,68 1095,65±32,98 420 13,04±0,18 12,66±0,15 1193,94±47,50 1081,39±35,86 450 13,11±0,16* 12,61±0,14 1203,65±41,87* 1068,02±34,23 480 12,91±0,17 12,68±0,17 1152,02±42,36 1095,89±12,69 510 13,28±0,14* 12,76±0,15 1244,55±39,01* 1107,75±37,31 540 13,36±0,13* 12,65±0,15 1266,67±37,50* 1081,45±37,63 570 12,94±0,16* 12,40±0,17 1157,77±40,35* 1025,32±39,29 600 12,94±0,15* 12,51±0,14 1155,04±37,81* 1043,32±34,72 900 12,99±0,17* 12,27±0,15 1177,19±45,55* 988,03±34,12 1500 13,04±0,15* 12,02±0,16 1184,39±39,53* 933,14±37,08 3600 12,64±0,13* 12,02±0,15 1071,72±33,08* 931,75±34,52 * Достоверность различий значений в 0,4% растворе NaCl по NaCl по критерию Стьюдента (р<0,05). Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 564,84±11,14* 519,78±11,42 537,93±10,25 524,78±13,31 559,95±11,29* 520,67±13,03 544,57±11,54* 508,65±12,21 532,84±12,75 500,93±12,38 536,43±12,70 503,56±11,83 553,68±11,53* 496,07±13,21 562,81±11,39* 520,45±11,56 541,98±14,54 530,42±12,04 556,08±15,13 530,45±14,57 545,01±14,26 529,64±11,63 548,21±15,18 523,73±14,08 546,31±13,77 511,21±10,49 539,29±14,59 506,22±11,43 543,32±12,90* 502,31±10,86 527,27±13,20 509,57±13,46 556,45±11,66* 514,31±11,79 563,31±11,20* 505,96±11,94 529,49±12,49* 487,44±12,84 529,04±11,77* 494,24±11,20 534,53±14,04* 476,37±11,23 537,81±12,25* 457,63±12,33 503,83±10,29* 457,72±11,48 сравнению со значениями в 0,9% Увеличение морфометрических параметров клеток наблюдали в течение 60 секунд, а затем, начиная со 150 по 180 секунды, параметры вновь возвращались к значениям изотонического раствора. Следующее увеличение морфометрических параметров клеток продолжительностью в 60 секунд, было зафиксировано на 210 секунде, при этом диаметр, объем и площадь поверхности возросли на 5,5%, 14,7% и 10,4% (р<0,05) по сравнению с изотоническим раствором. В интервале с 270 по 420 секунды достоверных различий в параметрах клеток между гипо- и изотоническим раствором не выявлено. Начиная с 450 секунды и до конца инкубации (3600 с) наблюдали увеличение размеров клеток. На 3600 секунде диаметр, 109 объем и площадь поверхности лимфоцитов увеличились соответственно на 5%, 13% и 9% (р<0,05) по сравнению с изотоническим раствором. Увеличение объема ядра в гипотонической среде протекало в течение первых 150 секунд, затем на 180 секунде наблюдали реакцию регуляторного уменьшения объема ядра до значений изотонического раствора, и с промежутком в 30 секунд, вновь протекала реакция увеличения объема ядра. На протяжении большего времени инкубации в умеренно гипотонической среде размеры ядра достоверно не отличались от таковых в изотоническом растворе (таблица 23). Таблица 23 – Морфометрические параметры ядра лимфоцитов под влиянием верапамила ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 10,18±0,10* 9,78±0,14 560,89±16,46* 505,67±20,28 327,26±6,49* 303,93±8,49 60 10,30±0,09* 9,74±0,15 579,72±16,60* 499,74±21,45 334,68±6,39* 301,15±8,98 90 10,35±0,11* 9,85±0,13 589,19±16,72* 514,01±19,37 338,17±6,67* 307,66±8,02 120 10,29±0,09* 9,76±0,14 576,04±14,87* 499,67±20,01 333,49±5,81* 301,68±8,25 150 10,22±0,12* 9,83±0,13 568,87±18,38* 509,53±18,89 329,93±7,33* 305,99±7,79 180 10,11±0,13 9,80±0,15 553,41±19,89 508,92±21,18 323,54±7,96 305,08±8,76 210 10,26±0,12* 9,85±0,13 576,23±19,29* 512,38±18,99 332,61±7,67* 307,19±7,75 240 10,29±0,12 10,17±0,11 583,22±20,32 560,42±16,81 335,24±7,88 326,91±6,77 270 10,14±0,17 9,92±0,11 567,33±26,45 516,72±16,76 327,13±10,56 309,59±6,67 300 9,99±0,16 10,04±0,14 540,39±22,47 543,60±20,79 317,28±9,37 319,31±8,39 330 10,08±0,14 9,90±0,12 551,27±21,42 519,64±18,18 322,14±8,67 310,2±7,47 360 9,98±0,16 9,98±0,09 541,25±23,42 526,68±14,14 317,39±9,69 314,05±5,73 390 9,99±0,15 9,86±0,12 529,68±21,83 512,34±17,43 318,18±9,12 307,54±7,14 420 9,93±0,14 9,79±0,12 536,96±20,82 502,14±17,84 316,61±8,47 303,22±7,39 450 10,12±0,14 9,81±0,13 556,84±20,87 506,77±18,91 324,50±8,46 304,86±7,81 480 10,10±0,13 9,77±0,14 552,82±20,18 501,76±20,53 323,21±8,04 302,45±8,38 510 9,86±0,15 9,81±0,11 519,16±22,43 501,72±15,39 308, 86±9,27 303,64±6,36 540 9,81±0,14 9,84±0,12 510,02±20,79 509,61±17,28 305,62±8,62 306,42±7,14 570 9,84±0,16 9,62±0,13 523,79±23,16 478,55±17,97 310,61±89,45 293,37±7,59 600 9,94±0,16 9,71±0,12 534,07±24,11 490,38±17,69 311,48±9,84 298,44±7,35 900 9,88±0,18 9,27±0,12 528,29±26,86 426,21±16,19 311,26±10,91 271,69±6,91 1500 10,12±0,16* 9,08±0,16 561,99±23,75* 409,37±20,48 325,67±9,67* 262,83±8,95 3600 9,83±0,08* 8,95±0,15 502,08±12,99* 392,09±19,49 304,34±5,25* 255,43±8,65 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Под влиянием верапамила на 30 секунде воздействия выраженных различий в ЯЦО между гипо- и изотоническими средами не выявлено (рисунок 25). 110 усл. ед. 0,66 0,64 0,62 0,4%NaCl 0,6 0,9% NaCl 0,58 0,56 0,54 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 25 – ЯЦО под влиянием верапамила На 60 секунде ЯЦО возросли на 8% (р<0,05), затем находились в пределах недостоверных различий с изотоническим раствором, а к 540 секунде были снижены на 12,7% (р<0,05). К концу инкубации (3600 секунда) ЯЦО в гипотонической среде увеличились на 7% (р<0,05) по сравнению с изотоническим раствором. 2.2.2.6 Относительный мембранный резерв, используемый лимфоцитами доноров в условиях активации и блокады Са2+ - каналов Проанализировав влияние Са2+ и верапамила на развитие осморегуляторных реакций видно, что в условиях гипотонической нагрузки геометрические параметры клеток уменьшались. Под влиянием верапамила на 30 секунде инкубации диаметр и объем клеток были снижены на 8,5% и 28% (р<0,05), а под влиянием кальциевой нагрузки соответственно на 4% и 11% (р<0,05) по сравнению с контролем (таблица 24). 111 Таблица 24 – Морфометрические параметры лимфоцитов под влиянием Са2+ и верапамила ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 30 14,53±0,15 13,99±0,10* 13,38±0,13* 1629,99±50,39 1446,49±30,74* 1271,62±37,69* 60 14,91±0,13 13,80±0,11* 13,06±0,12* 1755,85±49,20 1389,01±33,14* 1181,29±33,64* 90 14,87±0,12 13,71±0,12* 13,21±0,14* 1738,58±42,02 1364,62±34,89* 1225,82±37,07* 120 14,82±0,14 13,60±0,11* 13,13±0,14* 1724,56±46,96 1329,14±33,03* 1205,28±37,28* 150 14,92±0,11 13,84±0,10* 12,98±0,16* 1751,92±39,01 1399,16±30,77* 1169,17±40,91* 180 15,03±0,14 13,92±0,11* 13,02±0,16* 1797,48±19,25 1424,84±33,77* 1180,87±40,46* 210 14,91±0,15 13,80±0,13* 13,24±0,14* 1763,17±56,14 1393,27±37,82* 1235,26±37,89* 240 15,05±0,16 12,79±0,17* 13,35±0,14* 1814,23±57,23 1125,15±43,17* 1265,44±37,24* 270 14,93±0,13 13,85±0,14* 13,08±0,18* 1761,54±49,28 1409,65±42,58* 1202,67±46,93* 300 14,76±0,17 13,97±0,12* 13,24±0,19* 1714,46±62,07 1443,26±36,72* 1250,44±49,20* 330 14,91±0,14 13,78±0,15* 13,12±0,18* 1757,57±51,73 1394,22±46,66* 1211,96±46,29* 360 14,56±0,13 13,73±0,14* 13,15±0,19* 1634,54±42,59 1375,12±41,38* 1224,55±49,34* 390 13,78±0,15 13,62±0,13* 13,14±0,17* 1391,80±43,30 1342,44±39,21* 1215,22±44,68* 420 13,80±0,17 13,74±0,15* 13,04±0,18* 1407,65±52,43 1384,42±46,44* 1193,94±47,50* 450 14,06±0,16 13,95±0,18* 13,11±0,16* 1480,80±47,88 1457,13±71,53* 1203,65±41,87* 480 14,01±0,17 13,79±0,14* 12,91±0,17* 1470,66±52,98 1395,78±44,63* 1152,02±42,36* 510 14,06±0,17 13,51±0,11* 13,28±0,14* 1485,71±50,36 1305,08±33,40* 1244,55±39,01* 540 14,81±0,12 13,89±0,13* 13, 36±0,13* 1714,35±40,64 1414,20±41,51* 1266,67±37,50* 570 14,68±0,16 13,76±0,11* 12,94±0,16* 1684,85±52,94 1377,02±33,63* 1157,77±40,35* 600 14,65±0,15 13,66±0,15* 12,94±0,15* 1668,77±51,49 1357,36±43,92* 1155,04±37,81* 900 15,04±0,15 13,63±0,13* 12,99±0,17* 1804,91±53,00 1344,68±39,23* 1177,19±45,55* 1500 14,50±0,17 13,04±0,15* 1629,51±56,76 1184,39±39,53* 3600 14,48±0,10 12,64±0,13* 1601,28±34,54 1071,72±33,08* * Достоверность различий значений после воздействия Са2+/верапамила по сравнению с результатами измерений в гипотонической среде (контроль) по критерию Стьюдента (р<0,05). В целом с увеличением времени воздействия гипотонического раствора наблюдали уменьшение морфометрических параметров клеток. К окончанию воздействия (1800 с) в условиях кальциевой нагрузки при снижении осмолярности среды лимфоциты погибали, в то время как под влиянием верапамила их диаметр и объем уменьшились на 14,5% и 49% (р<0,05) по сравнению с контролем. Размеры ядра в гипотонической среде также уменьшались как под влиянием Са2+, так и верапамила. Причем реакцию на верапамил наблюдали сразу на 30 секунде, в то время как на кальциевую нагрузку – на 60 секунде (таблица 25). Таблица 25 – Морфометрические параметры ядра лимфоцитов доноров под влиянием Са2+ и верапамила Время, с 30 60 90 контроль 11,31±0,09 11,64±0,10 11,66±0,09 Диаметр, мкм Са2+ 11,09±0,09 10,86±0,09* 11,03±0,09* верапамил 10,18±0,10* 10,30±0,09* 10,35±0,11* контроль 765,38±18,98 834,32±22,07 838,62±20,38 Объем, мкм3 Са2+ 723,01±18,50 678,97±17,86* 710,78±17,94* верапамил 560,89±16,46* 579,72±16,60* 589,19±16,72* 112 Продолжение таблицы 25 ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 120 11,74±0,10 11,23±0,09* 10,29±0,09* 856,17±22,93 750,46±19,75* 576,04±14,87* 150 11,73±0,12 10,89±0,10* 10,22±0,12* 856,03±25,18 685,36±18,83* 568,87±18,38* 180 11,78±0,13 11,15±0,09* 10,11±0,13* 871,15±29,72 733,06±18,13* 553,41±19,89* 210 11,97±0,13 11,03±0,09* 10,26±0,12* 913,35±30,40 709,81±17,19* 576,23±19,29* 240 11,94±0,12 11,09±0,10* 10,29±0,12* 905,28±28,97 723,49±20,55* 583,22±20,32* 270 11,98±0,11 11,04±0,09* 10,14±0,17* 912,93±26,57 712,16±18,31* 567,33±26,45* 300 11,71±0,12 10,99±0,10* 9,99±0,16* 853,89±24,45 704,73±19,29* 540,39±22,47* 330 11,63±0,14 11,01±0,11* 10,08±0,14* 841,39±30,35 708,48±20,17* 551,27±21,42* 360 11,33±0,13 11,00±0,12* 9,98±0,16* 776,92±27,03 710,27±22,78* 541,25±23,42* 390 11,15±0,13 10,89±0,09 9,99±0,15* 739,95±25,17 683,39±18,22 529,68±21,83* 420 11,27±0,14 11,08±0,10 9,93±0,14* 765,99±28,53 720,61±20,15 536,96±20,82* 450 11,27±0,14 10,91±0,13 10,12±0,14* 766,42±27,96 694,25±24,58 556,84±20,87* 480 11,11±0,12 10,74±0,10* 10,10±0,13* 729,17±23,12 656,99±18,09* 552,82±20,18* 510 11,30±0,11 10,84±0,11* 9,86±0,15* 765,46±21,52 677,55±21,56* 519,16±22,43* 540 11,54±0,12 10,68±0,09* 9,81±0,14* 816,71±25,62 646,65±17,95* 510,02±20,79* 570 11,72±0,13 10,96±0,10* 9,84±0,16* 858,18±27,25 698,81±19,95* 523,79±23,16* 600 11,59±0,11 10,88±0,11* 9,94±0,16* 825,94±24,02 684,07±20,13* 534,07±24,11* 900 11,74±0,13 10,66±0,11* 9,88±0,18* 863,52±29,23 643,41±19,78* 528,29±26,86* 1800 11,43±0,17 10,12±0,16* 807,06±33,92 561,99±23,75* 3600 11,55±0,10 9,83±0,08* 815,13±21,82 502,08±12,99* * 2+ Достоверность различий значений после воздействия Са /верапамила по сравнению с результатами измерений в гипотонической среде (контроль) по критерию Стьюдента (р<0,05). Под влиянием верапамила диаметр и объем ядра уменьшались на протяжении всего времени инкубации, а кальциевой нагрузки - в течение первых 360 секунд, затем с 390 по 450 секунды размеры практически достигли значений в контроле, а потом вновь уменьшались до момента гибели клеток. Наиболее выраженные реакции наблюдали на 60 секунде, под влиянием кальциевой нагрузки диаметр и объем ядра уменьшились соответственно на 6,7% и 21% (р<0,05), под влиянием верапамила – на 13% и 44% (р<0,05) по сравнению с контролем. В условиях кальциевой нагрузки, значения коэффициента осмотического натяжения плазмалеммы в первые 240 секунд были в пределах недостоверных различий с контролем, при этом в условиях блокады – наблюдали незначительное и кратковременное его снижение на 9,4% (р<0,05) (в течение 30 секунд), а затем вновь возрастание до контрольных значений (таблица 26). 113 Таблица 26 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы лимфоцитов под влиянием Са2+ и верапамила ВреПлазмалемма, усл. ед. Кариолемма, усл. ед. мя, с контроль Са2+ верапамил контроль Са2+ верапамил 30 1,11±0,03 1,09±0,03 1,12±0,04 1,17±0,04 1,17±0,03 1,12±0,04 60 1,16±0,03 1,17±0,03 1,06±0,04* 1,25±0,04 1,16±0,04 1,16±0,04 90 1,16±0,03 1,09±0,02 1,09±0,04 1,29±0,04 1,18±0,04 1,13±0,04* 120 1,18±0,04 1,13±0,03 1,10±0,04 1,24±0,04 1,24±0,04 1,15±0,04 150 1,17±0,03 1,09±0,03 1,09±0,04 1,18±0,03 1,30±0,04* 1,12±0,04 180 1,16±0,03 1,16±0,03 1,09±0,04 1,23±0,03 1,29±0,03 1,09±0,04* 210 1,15±0,03 1,11±0,03 1,16±0,04 1,23±0,03 1,23±0,04 1,11±0,04 240 1,25±0,04 0,99±0,04* 1,11±0,04* 1,28±0,04 1,19±0,04 1,04±0,03* 270 1,13±0,03 1,11±0,03 1,04±0,04 1,31±0,04 1,15±0,03* 1,08±0,04* 300 1,18±0,04 1,14±0,03 1,10±0,05 1,22±0,04 1,18±0,04 1,04±0,05* 330 1,18±0,03 1,11±0,03 1,06±0,04* 1,24±0,04 1,20±0,04 1,08±0,04 360 1,13±0,03 1,11±0,03 1,09±0,05 1,19±0,03 1,27±0,05* 1,03±0,04 390 1,03±0,02 1,11±0,04 1,09±0,04 1,11±0,03 1,16±0,05 1,05±0,04 420 1,02±0,03 1,13±0,04 1,10±0,04 1,14±0,04 1,29±0,05* 1,07±0,03 450 1,08±0,04 1,17±0,04 1,11±0,04 1,12±0,03 1,04±0,03 1,11±0,05 480 1,06±0,04 1,09±0,02 1,08±0,04 1,12±0,04 1,05±0,03 1,10±0,04 510 1,05±0,04 1,07±0,03 1,11±0,04 1,14±0,03 1,06±0,03 1,04±0,04 540 1,13±0,03 1,11±0,03 1,14±0,03 1,15±0,02 1,99±0,07* 1,03±0,04* 570 1,15±0,03 1,16±0,03 1,14±0,05 1,19±0,03 1,14±0,03 1,09±0,04* 600 1,10±0,03 1,11±0,03 1,10±0,04 1,16±0,03 1,09±0,03 1,08±0,04 900 1,21±0,03 1,07±0,03 1,15±0,04 1,19±0,03 1,18±0,04 1,16±0,04 1800 1,14±0,04 1,21±0,04 1,25±0,04 1,31±0,06 3600 1,25±0,03 1,14±0,04 1,42±0,04 1,27±0,05 * Достоверность различий значений после воздействия Са2+/верапамила по сравнению с результатами измерений в гипотонической среде (контроль) по критерию Стьюдента (р<0,05). На 240 секунде коэффициент осмотического натяжения плазмалеммы в условиях кальциевой нагрузки был снижен на 26% (р<0,05), в то же время под влиянием верапамила – на 12,6% (р<0,05) по сравнению с контролем. Выявленное уменьшение коэффициента осмотического натяжения мембраны на 13% (р<0,05) к окончанию инкубации в условиях кальциевой нагрузки свидетельствует о том, что гибель клеток не была вызвана гипоосмотическим лизисом. Коэффициент осмотического натяжения кариолеммы под влиянием Са2+ в первые 120 секунд инкубации находился в пределах недостоверных различий с контролем, к 150 секунде возрос на 9% (р<0,05), затем снизился (270 секунда) – на 14% (р<0,05), а во второй половине инкубации увеличился. Под влиянием верапамила коэффициент осмотического натяжения кариолеммы был снижен на 114 протяжении всего времени воздействия. Достоверные различия с контролем обнаружены на 90, 180, 240 - 300, 540 и 570 секундах инкубации (см. таблица 26). Выявленное увеличение коэффициента осмотического натяжения кариолеммы на фоне снижения его у плазмалеммы свидетельствует о ведущей роли ядра в гибели клеток в умеренно гипотоническом растворе под влиянием кальциевой нагрузки. Под влиянием кальциевой нагрузки ЯЦО увеличились на 240 секунде инкубации на 18% (р<0,05) по сравнению с контролем (рисунок 26). усл.ед. 0,85 0,8 0,75 контроль 0,7 Са2+ 0,65 верапамил 0,6 0,55 0,5 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 26 – ЯЦО лимфоцитов в гипотонической среде под влиянием Са2+ и верапамила Под влиянием верапамила ЯЦО был снижены на протяжении всего времени инкубации. Наиболее существенные различия по сравнению с контролем наблюдали на 300, 360-420 и 900 секундах инкубации. Под влиянием Са2+ и верапамила использование мембранного резерва клеткой и ядром снижалось на протяжении всего времени инкубации. Максимальное вовлечение мембранного резерва клеткой (≈24%) наблюдали на 30 секунде инкубации, в это же время под влиянием верапамила лимфоциты задействовали ≈19,5% поверхностных резервных структур плазмалеммы (рисунок 27). 115 мкм -1 0,2 0,18 0,16 0,14 0,12 0,1 0,08 0,06 0,04 0,02 0 контроль кальций верапамил 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 27 – Относительный мембранный резерв, используемый лимфоцитами под влиянием Са2+ и верапамила Под влиянием Са2+ и верапамила использование мембранного резерва лимфоцитами было снижено соответственно на 15% и 93% (р<0,05) по сравнению с контролем. На 240 секунде инкубации использование резервного бассейна плазмалеммы под влиянием Са2+ уменьшилось на 47% (р<0,05), а под влиянием верапамила – на 94% (р<0,05) по сравнению с контролем. Использование внутриклеточных резервов ядром в тестах с осмотической нагрузкой in vitro представлено на рисунке 28. мкм-1 0,25 0,2 0,15 0,1 контроль кальций 0,05 0 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 28 – Относительный мембранный резерв, используемый ядром под влиянием кальция 116 На 30 секунде инкубации под влиянием кальциевой нагрузки ядро использовало на 27% (р<0,05) больше запасов относительного мембранного резерва по сравнению с контролем. На 120 секунде инкубации ядро задействовало одинаковый процент внутриклеточных резервов, как в контроле, так и в условиях кальциевой нагрузки (≈28%). Под влиянием кальциевой нагрузки на 360 секунде инкубации использование мембранного резерва ядром увеличилось на 18% (р<0,05) по сравнению с контролем. Таким образом, под влиянием кальциевой нагрузки использование лимфоцитами поверхностного мембранного резерва плазмалеммы уменьшилось, а внутриклеточных резервных бассейнов ядром – увеличилось. Под влиянием блокатора кальциевых каналов – верапамила установлено снижение интенсивности использования мембранного резерва клеткой, при этом ядро не участвовало в реакциях осморегуляции. 2.2.2.8 Сравнительный анализ регуляции объема лимфоцитов в изотонической среде в условиях активации и блокады Са2+-каналов В результате проведенных экспериментов установлено, что под влиянием Са2+ и верапамила происходит уменьшение размеров клеток в изотонической среде (таблица 27). 117 Таблица 27 – Морфометрические параметры лимфоцитов под влиянием Са2+ и верапамила ВреДиаметр, мкм Объем, мкм3 мя, с контроль Са2+ верапамил контроль Са2+ верапамил 30 13,75±0,11 13,50±0,14 12,83±0,15* 1382,41±34,70 1309,81±41,22 1124,64±35,94* 60 13,88±0,09 12,92±0,15* 12,87±0,17* 1417,93±29,78 1152,21±39,76* 1144,35±41,95* 90 13,43±0,16 13,18±0,14 12,83±0,10* 1311,43±42,38 1218,27±38,49 1130,44±41,58* 120 13,72±0,10 12,96±0,18* 12,68±0,15* 1368,81±31,64 1172,39±47,39* 1090,50±38,59* 150 13,77±0,12 13,37±0,17 12,58±0,16* 1392,82±37,28 1281,59±50,64 1066,48±38,59* 180 13,83±0,11 13,04±0,16* 12,62±0,15* 1404,44±36,69 1188,39±46,80* 1073,76±36,83* 210 13,77±0,12 13,20±0,14* 12,51±0,17* 1386,87±36,78 1224,89±40,96* 1052,83±41,34* 240 13,48±0,12 13,07±0,14* 12,83±0,15* 1300,90±34,42 1187,03±38,16* 1127,07±36,23* 270 13,92±0,11 13,28±0,16* 12,95±0,15* 1428,98±33,15 1251,57±46,71* 1159,96±38,84* 300 13,51±0,13 13,19±0,16* 12,93±0,18* 1315,46±39,69 1227,56±45,37* 1165,27±46,42* 330 13,67±0,12 13,24±0,15* 12,95±0,15* 1360,44±36,54 1238,82±43,58* 1156,81±36,92* 360 13,68±0,12 13,18±0,16* 12,86±0,18* 1364,00±37,38 1223,69±46,63* 1142,38±45,37* 390 13,51±0,08 13,08±0,14* 12,73±0,13* 1300,96±25,51 1180,55±39,07* 1095,65±32,98* 420 13,56±0,11 13,14±0,17* 12,66±0,15* 1322,00±30,72 1216,57±45,99* 1081,39±35,86* 450 13,56±0,11 13,08±0,14* 12,61±0,14* 1320,37±31,09 1194,81±40,84* 1068,02±34,23* 480 13,58±0,12 13,26±0,13 12,68±0,17* 1330,22±33,35 1238,32±39,28 1095,89±12,69* 510 13,63±0,10 13,16±0,12* 12,76±0,15* 1340,81±30,33 1208,88±34,73* 1107,75±37,31* 540 13,88±0,12 13,05±0,12* 12,65±0,15* 1422,61±37,37 1179,86±35,75* 1081,45±37,63* 570 13,64±0,11 12,86±0,12* 12,40±0,17* 1346,72±33,19 1128,72±33,38* 1025,32±39,29* 600 13,97±0,11 13,08±0,15* 12,51±0,14* 1447,05±36,07 1195,86±44,10* 1043,32±34,72* 900 13,68±0,12 13,31±0,16 12,27±0,15* 1359,09±35,63 1259,47±45,93 988,03±34,12* 1500 13,69±0,12 12,81±0,13 12,02±0,16* 1365,38±38,73 1125,04±35,74 933,14±37,08* 3600 13,01±0,11 12,55±0,14 12,02±0,15* 1169,62±33,22 1053,80±35,59 931,75±34,52* * 2+ Достоверность различий значений после воздействия Са /верапамила по сравнению с результатами измерений в изотонической среде (контроль) по критерию Стьюдента (р<0,05). Под влиянием кальциевой нагрузки установлено четыре временных интервала, в течение которых наблюдали регуляторное уменьшение объема с последующим его восстановлением до контрольных значений. Первые два интервала длительностью по 30 секунд отмечали на 60 и 120 секундах инкубации, при этом объем клеток сократился соответственно на 23% и 17% (р<0,05). Третий интервал был самым продолжительным – в течение 270 секунд (180-450 с). В начале этого периода на 180 секунде объем клеток уменьшился на 18% (р<0,05), а в конце (450 секунда) – на 10,5% (р<0,05) по сравнению с контролем. В конце четвертого периода, продолжительностью 90 секунд (510-600 секунды), объем лимфоцитов уменьшился на 21% (р<0,05). Продолжительность периодов регуляторного возрастания объема клеток до контрольных значений составила 30 секунд. К окончанию инкубации наблюдали восстановление размеров клеток. 118 Под влиянием кальциевой нагрузки регуляторное уменьшение объема ядра протекало в течение 360 секунд (60-420 секунды) инкубации (таблица 28). Таблица 28 – Морфометрические параметры ядра лимфоцитов под влиянием Са2+ и верапамила ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 30 10,42±0,09 10,31±0,10 9,78±0,14* 604,39±16,63 582,29±17,82 505,67±20,28* 60 10,75±0,11 10,26±0,15* 9,74±0,15* 666,95±19,75 582,41±24,69* 499,74±21,45* 90 10,59±0,09 10,29±0,12* 9,85±0,13* 633,32±16,62 582,±20,5032* 514,01±19,37* 120 10,78±0,13 10,25±0,13* 9,76±0,14* 680,12±32,96 576,96±22,59* 499,67±20,01* 150 10,85±0,09 9,76±0,14* 9,83±0,13* 678,95±16,05 502,41±22,21* 509,53±18,89* 180 10,75±0,09 9,94±0,11* 9,80±0,15* 659,00±16,33 524,35±18,33* 508,92±21,18* 210 10,82+0,11 10,15±0,14* 9,85±0,13* 676,82±20,68 562,41±22,43* 512,38±18,99* 240 10,67±0,09 10,27±0,12* 10,17±0,11* 646,10±16,29 579,36±19,18* 560,42±16,81* 270 10,61±0,09 10,42±0,13 9,92±0,11* 634,74±15,59 606,17±22,30 516,72±16,76* 300 10,72±0,10 10,24±0,12* 10,04±0,14* 656,10±18,85 574,85±20,92* 543,60±20,79* 330 10,61±0,09 10,23±0,14* 9,90±0,12* 633,84±16,15 576,03±23,05* 519,64±18,18* 360 10,46±0,08 9,98±0,15* 9,98±0,09* 607,58±14,31 538,22±23,58* 526,68±14,14* 390 10,67±0,08 10,32±0,14* 9,86±0,12* 642,79±15,30 591,41±22,27* 512,34±17,43* 420 10,66±0,09 9,97±0,15* 9,79±0,12* 642,75±15,96 537,93±24,09* 502,14±17,84* 450 10,67±0,09 10,77±0,11 9,81±0,13* 644,84±15,80 664,49±20,82 506,77±18,91* 480 10,66±0,09 10,57±0,10 9,77±0,14* 645,14±16,93 626,16±18,26 501,76±20,53* 510 10,74±0,08 10,59±0,10 9,81±0,11* 655,78±15,07 630,33±17,71 501,72±15,39* 540 10,75±0,08 10,28±0,11* 9,84±0,12* 657,62±14,02 579,03±18,59* 509,61±17,28* 570 10,78±0,09 10,37±0,12* 9,62±0,13* 664,70±16,99 594,73±20,07* 478,55±17,97* 600 10,83±0,08 10,48±0,12* 9,71±0,12* 671,49±14,94 612,83±20,86* 490,38±17,69* 900 10,87±0,09 9,93±0,12* 9,27±0,12* 682,71±17,55 524,60±19,18* 426,21±16,19* 1500 10,40±0,11 9,79±0,11* 9,08±0,16* 603,09±21,21 500,54±16,90* 409,37±20,48* 3600 9,78±0,08 9,71±0,12 8,95±0,15* 498,17±13,61 490,64±18,64 392,09±19,49* * 2+ Достоверность различий значений после воздействия Са /верапамила по сравнению с результатами измерений в изотонической среде (контроль) по критерию Стьюдента (р<0,05). С 450 секунды и в течение последующих 90 секунд морфометрические параметры ядер увеличились до контрольных значений, а затем вновь уменьшались до конца инкубации В условиях блокады медленных Са2+-каналов верапамилом уменьшение размеров ядер наблюдали на протяжении всего времени воздействия. Сокращение объема ядра на 33% (р<0,05) по сравнению с контролем отмечали на 60 секунде от начала инкубации. К окончанию воздействия (1500 секунда) объем ядра уменьшился на 47% (р<0,05) по сравнению с контролем. Под влиянием кальциевой нагрузки на 90 секунде инкубации ЯЦО увеличились на 8% (р<0,05), а в пробах с верапамилом – уменьшились на 11% (р<0,05) по 119 сравнению с контролем. Статистически достоверное снижение ЯЦО после кальциевой нагрузки отмечали на 150 секунде инкубации (14,5%; р<0,05), в то время как в пробах с верапамилом находились в пределах недостоверных различий с контролем. В последующие секунды инкубации изменения ЯЦО носили колебательный характер, их значения были в пределах недостоверных различий с контролем (рисунок 29). усл.ед. 0,72 0,7 0,68 0,66 контроль 0,64 Са 2+ 0,62 верапамил 0,6 0,58 0,56 0,54 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 29 – ЯЦО лимфоцитов в изотонической среде под влиянием Са2+ и верапамила В условиях кальциевой нагрузки, начиная с 450 секунды и до конца инкубации, ЯЦО увеличились, а под воздействием верапамила – снизились. Ответная реакция ядра на увеличение концентрации цитозольного Са2+ выражалась увеличением ЯЦО в первые 60 секунд, а также начиная с 450 секунды и до конца инкубации. Это подтверждает выдвинутую ранее идею о решающей роли ионов Са2+ в передаче сигналов в ядро. В условиях кальциевой нагрузки использование мембранного резерва клеткой было снижено на протяжении всего времени инкубации (рисунок 30). 120 мкм -1 0,1 0,09 0,08 0,07 0,06 0,05 0,04 0,03 0,02 0,01 0 контроль кальций 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 30 – Относительный мембранный резерв, используемый лимфоцитами под влиянием кальция в изотонической среде Под влиянием Са2+, максимальное использование поверхностного резерва плазмалеммы, наблюдали на 30 секунде инкубации (≈15%), что на 14% (р<0,05) ниже по сравнению с величиной резерва задействованного в контроле. В условиях блокады элементов Са2+ сигнальных путей клетка не использовала резервные бассейны мембраны в механизмах регуляции объема. Под влиянием Са2+-нагрузки использование мембранного резерва ядром увеличилось в течение первых 90 секунд инкубации в среднем на 33% (р<0,05) по сравнению с контролем (рисунок 31). мкм-1 0,07 0,06 0,05 0,04 контрол ь 0,03 0,02 0,01 0 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 31 – Относительный мембранный резерв, используемый ядром под влиянием Са2+ в изотонической среде 121 В интервале со 150 по 180 секунды ядро не использовало дополнительные резервы в реакциях осморегуляции. На 270 секунде отмечали максимальное использование мембранного резерва ядром (≈16%), что превышало значения в контроле на 150% (р<0,05). Начиная с 330 секунды и до конца инкубации, мембранный резерв используемый ядром после кальциевой нагрузки практически не отличался от величины резерва задействованного в контроле. Под влиянием верапамила, осморегуляторных реакций со стороны ядра не выявлено. 2.2.3 Реакции осморегуляции лимфоцитов больных ХЛЛ В данной главе представлены результаты изменения объема лимфоцитов больных ХЛЛ в гипотонической среде по сравнению с этими же клетками, помещенными в изотонический раствор. В результате проведенных экспериментов выявлено увеличение размеров клеток в течение первой минуты инкубации в гипотонической среде. На 30 секунде воздействия диаметр, объем и площади поверхности лимфоцитов увеличились соответственно на 5%, 16,7% и 10% (р<0,05) по сравнению с показателями изотоническом растворе (таблица 29). Таблица 29 – Морфометрические параметры лимфоцитов больных ХЛЛ Время, с 30 60 90 120 150 180 210 Диаметр, мкм 0,4% NaCl 0,9% NaCl 10,53±0,09* 9,98±0,10 9,71±0,09* 9,23±0,09 9,42±0,09 9,15±0,11 9,53±0,07 9,49±0,09 9,38±0,09 9,43±0,09 9,47±0,09 9,27±0,08 9,73±0,08* 9,39±0,09 Объем, мкм3 0,4% NaCl 0,9% NaCl 618,11±16,77* 529,38±17,35 486,46±14,87* 418,13±12,54 442,86±12,96 408,82±15,12 457,02±10,37 452,74±12,48 438,87±13,40 444,58±11,62 450,58±12,56 420,51±10,56 487,89±12,68* 440,52±13,75 Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 349,42±6,38* 314,77±6,60 297,61±5,99* 268,98±5,48 279,64±5,42 264,53±6,33 286,09±4,29 283,91±5,23 277,82±5,67 280,56±4,98 282,99±5,24 270,49±4,46 298,54±5,22* 278,46±5,79 122 Продолжение таблицы 29 ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 240 9,47±0,09 9,23±0,09 450,26±12,61 417,98±12,68 282,83±5,29 268,97±5,42 270 9,55±0,10 9,31±0,08 464,44±15,16 426,45±11,01 288,38±6,17 272,95±4,69 300 9,55±0,07* 8,98±0,09 460,75±11,10* 385,96±12,93 287,55±4,58* 254,85±5,57 330 9,21±0,07* 9,71±0,09 412,30±8,90* 485,89±13,83 267,16±3,86* 297,52±5,67 360 9,22±0,09 9,47±0,11 417,04±13,27 450,05±16,11 268,41±5,71 282,06±6,65 390 9,23±0,07* 9,66±0,09 415,08±9,49* 479,23±14,4 268,29±4,09* 294,72±5,78 420 9,43±0,07* 9,17±0,09 442,99±9,81* 409,20±11,83 280,24±4,13* 265,31±5,09 450 9,41±0,06* 9,07±0,07 438,16±7,89* 394,62±9,58 278,43±3,37* 259,29±4,22 480 9,25±0,08 9,13±0,13 418,81±10,71 409,75±16,39 269,74±4,54 264,27±7,25 510 8,92±0,07* 9,32±0,10 374,44±9,06* 430,50±13,98 250,42±3,97* 274,10±,94 540 8,11±0,07* 9,24±0,12 282,43±6,99* 423,83±18,06 207,44±3,43* 270,37±7,45 570 9,06±0,06* 9,39±0,11 391,59±8,02* 442,04±16,14 258,23±3,49* 278,75±6,54 600 9,06±0,07* 9,32±0,10 392,78±9,19* 430,78±14,59 258,55±4,04* 274,13±6,12 900 9,52±0,07 9,77±0,12 456,30±10,74 499,33±18,58 285,71±4,50 302,12±7,41 1500 8,62±0,06* 9,29±0,09 337,77±7,53* 427,50±13,74 233,89±3,45* 272,87±5,84 3600 7,94±0,07* 8,55±0,08 264,86±7,11* 331,47±8,92 198,66±3,51* 230,63±4,22 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). В течение последующих 90 секунд наблюдали реакцию регуляторного уменьшения размеров клеток до значений изотонического раствора. Увеличение размеров лимфоцитов установлено на 210 секунде, а затем спустя 90 секунд на 300 секунде диаметр, объем и площадь поверхности клеток возросли на 6%, 16% и 11% (р<0,05) по сравнению с показателями в изотоническом растворе. С 330 по 390 секунды инкубации диаметр, объем и площадь поверхности клеток уменьшились соответственно на 5,5%, 7,8% и 11% (р<0,05) по сравнению с контролем. В интервале 420-450 секунды инкубации вновь наблюдали увеличение размеров клеток, а с 510 и до конца воздействия – их уменьшение. На 3600 с диаметр, объем и площадь поверхности лимфоцитов сократились соответственно на 7,7%; 25% и 16% (р<0,05) по сравнению с контролем. Периоды увеличения объема ядра чередовались с фазами регуляторного уменьшения их объема до значений изотонического раствора. Наиболее выраженная реакция была на 30 секунде инкубации: диаметр, объем и площадь поверхности возросли на 17%, 43% и 31% (р<0,05), и на 120 секунде – соответственно на 14,7%; 38% и 27,5% (р<0,05) по сравнению со значениями в изотоническом растворе (таблица 30). 123 Таблица 30 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ Время, с Диаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 9,22±0,12* 7,64±0,09 420,57±15,75* 238,81±8,74 269,23±6,89* 184,78±4,51 60 7,72±0,09 7,56±0,10 246,14±8,28 232,59±9,37 188,71±4,29 181,26±4,89 90 7,82±0,07* 7,27±0,16 252,94±6,55* 212,16±8,29 192,68±3,32* 169,87±5,09 120 8,65±0,09* 7,37±0,08 345,03±10,72* 212,73±6,49 236,53±5,02* 171,41±3,52 150 7,66±0,08* 7,38±0,10 239,08±7,41* 215,67±8,86 185,29±3,81* 172,35±4,68 180 7,66±0,08 7,49±0,07 239,36±8,08 223,05±6,65 185,24±4,19 176,98±3,51 210 7,72±0,08* 7,46±0,08 244,41±7,42* 221,48±7,31 188,05±3,84* 175,93±3,90 240 7,56±0,08 7,77±0,08 229,99±7,75 249,93±8,17 180,45±3,96 190,73±4,17 270 7,48±0,08* 7,73±0,09 222,95±7,06* 247,20±8,90 176,79±3,77* 189,12±4,55 300 7,61±0,07 7,47±0,08 233,22±6,58 245,95±7,13 182,41±3,43 188,93±3,67 330 7,65±0,06 7,87±0,11 236,75±5,65 263,37±10,98 18,47±2,94 196,70±5,59 360 7,66±0,08 7,74±0,09 239,29±7,86 247,99±9,22 185,36±3,93 189,52±4,59 390 7,64±0,07* 7,32±0,08 236,44±6,74* 209,57±7,17 184,12±3,42* 169,48±3,92 420 7,61±0,07 7,44±0,10 233,99±7,07 221,62±8,66 182,72±3,64 175,54±4,67 450 9,28±0,07* 7,29±0,09 421,11±8,88* 208,35±7,66 270,98±3,85* 168,64±4,19 480 8,58±0,07* 7,11±0,09 333,75±8,63* 192,76±7,27 231,79±4,00* 160,02±4,14 510 7,72±0,06* 7,17±0,10 242,40±5,12* 198,59±8,26 187,50±2,68* 162,99±4,58 540 7,53±0,05 7,49±0,07 224,59±4,58 222,36±6,34 178,24±2,43 176,70±3,33 570 7,71±0,06 7,49±0,12 241,82±5,61 228,50±10,99 187,11±2,93 178,41±5,81 600 7,63±0,06 7,49±0,11 235,17±5,91 227,52±9,71 183,58±3,10 178,38±5,15 900 7,64±0,07 7,54±0,09 236,02±6,54 229,82±8,57 183,89±3,39 180,01±4,53 1500 7,31±0,07* 7,57±0,09 207,59±6,44* 232,14±8,72 168,64±3,48* 181,24±4,54 3600 6,74±0,07 6,87±0,07 162,73±4,62 172,64±5,62 143,45±2,78 149,04±3,26 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Выявлено увеличение размеров ядра в интервале с 390 по 510 секунды. Максимум реакции отмечен на 450 секунде: диаметр, объем и площади поверхности увеличились соответственно на 21%, 50,5% и 38% (р<0,05) по сравнению со значениями в изотоническом растворе. К окончанию воздействия происходит уменьшение размеров ядра и восстановление их до значений в контроле. Установлено циклическое изменение показателя ЯЦО в умеренно гипотонической среде. Первый цикл увеличения ЯЦО приходился на 30 - 150 секунды инкубации, второй –450 - 900 секунды. Выявлена высокая степень корреляции (r=1) в изменении ЯЦО и площади поверхности ядра. Увеличение ЯЦО наблюдали на 120 секунде (26,5%; р<0,05), а также 390-900 секундах. С 240 по 300 секунды ЯЦО снизились в среднем на 12% (р<0,05) по сравнению со значениями в изо- 124 тоническом растворе. К окончанию воздействия ЯЦО в гипотонической среде возросли на 15% (р<0,05; рисунок 32). усл.ед. 1,05 1 0,95 0,9 0,85 0,8 0,75 0,7 0,65 0,6 0,55 30 0,4% NaCl 0,9% NaCl 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 32 – ЯЦО лимфоцитов больных ХЛЛ В условиях гипотонической среды кариолемма интенсивнее участвовала в процессах осморегуляции, что отразилось на динамике коэффициента осмотического натяжения. В течение первых 150 секунд инкубации коэффициент осмотического натяжения кариолеммы возрос по сравнению с плазмалеммой. Наибольшее увеличение его установлено на 30 секунде (24,6%; р<0,05), 120 секунде (26,6%; р<0,05) и 450 секунде (35%; р<0,05) по сравнению со значениями коэффициента осмотического натяжения плазмалеммы (рисунок 33). усл. ед. 1,9 1,7 1,5 плазмалемма 1,3 кариолемма 1,1 0,9 0,7 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 33 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы лимфоцитов больных ХЛЛ 125 Увеличение коэффициента осмотического натяжения плазмалеммы наблюдали на 270 секунде инкубации (37,4%; р<0,05). Увеличение размеров клеток и ядра в гипотонической среде происходило синхронно. В интервалы времени 210 и 420 секунды инкубации, значения коэффициента осмотического натяжения плазмалеммы и кариолеммы были в пределах 1,09±0,03 усл. ед. В тоже время, сравнивая размеры лимфоцитов в гипотонической среде с размерами этих же клеток в аутологичной плазме видно, что диаметр лимфоцитов ХЛЛ в гипотонической среде снижен на протяжении всего времени инкубации (рисунок 34). мкм 14 12 10 8 плазма 6 0,4% NaCl 4 2 0 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 34 – Изменения диаметра лимфоцитов больных ХЛЛ в условиях гипотонической нагрузки (in vitro) Аналогичную картину наблюдали при сравнении размеров ядра лимфоцитов больных ХЛЛ в гипотонической среде и аутологичной плазме. Таким образом, лимфоциты больных ХЛЛ не используют резервные бассейны плазмалеммы и внутриклеточные запасы мембранного материала в осморегуляторных реакциях. 126 2.2.4. Влияние функциональных нагрузок на реакции регуляции объема лимфоцитов больных ХЛЛ в осмотических тестах (in vitro) 2.2.4.1 Регуляция объема лимфоцитов в условиях адреналиновой нагрузки Под влиянием адреналиновой нагрузки в умеренно гипотонической среде набухание клеток наблюдали в первые 30 секунд инкубации: диаметр, объем и площадь поверхности возросли соответственно на 4,5%; 12,8% и 8,7% (р<0,05) по сравнению с изотоническим раствором. Затем на протяжении всего времени инкубации отмечено чередование реакций уменьшения размеров клеток и их восстановления до значений изотонической среды (таблица 31). Таблица 31 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием адреналиновой нагрузки ВреДиаметр, мкм мя, с 0,4% NaCl 0,9% NaCl 30 13,87±0,13* 13,25±0,12 60 13,55±0,12 13,23±0,11 90 13,16±0,11 13,41±0,12 120 12,65±0,10* 13,11±0,12 150 13,49±0,11 13,33±0,11 180 12,78±0,12* 13,52±0,11 210 13,13±0,12 13,29±0,12 240 13,24±0,12 13,10±0,11 270 12,84±0,11 12,95±0,11 300 12,82±0,12 12,74±0,13 330 13,13±0,10 12,94±0,11 360 12,55±0,11* 12,97±0,11 390 12,90±0,10 12,89±0,12 420 12,72±0,12 12,87±0,11 450 12,40±0,10* 13,00±0,09 480 12,51±0,09* 13,17±0,11 510 12,56±0,12* 12,96±0,09 540 12,75±0,11 12,94±0,11 570 12,56±0,09 12,76±0,12 600 12,62±0,11 12,85±0,12 900 12,59±0,17 12,76±0,09 1500 12,33±0,08* 12,76±0,09 3600 12,37±0,13* 12,71±0,11 * Достоверность различий значений в критерию Стьюдента (р<0,05). Объем, мкм3 0,4% NaCl 0,9% NaCl 1413,24±39,36* 1232,40±33,61 1315,53±33,81 1222,76±30,16 1206,28±30,55 1275,60±33,42 1069,19±24,77* 1192,98±32,02 1296,58±32,74 1252,70±30,10 1108,20±31,74* 1305,79±32,38 1198,94±33,14 1242,84±32,45 1231,25±33,87 1189,34±30,36 1120,49±28,99 1147,94±28,83 1116,24±30,71 1097,47±33,47 1196,35±27,31 1146,42±30,92 1046,70±26,77* 1154,13±30,78 1134,16±27,00 1134,49±30,52 1090,47±29,74 1128,54±29,44 1008,34±24,75* 1159,94±25,17 1031,52±22,79* 1208,17±31,64 1051,96±30,35* 1148,38±25,35 1097,40±29,00 1147,02±27,86 1047,64±24,12 1101,77±30,02 1064,12±26,63 1124,49±30,33 1077,35±24,50 1096,5±23,70 988,94±20,46* 1096,55±23,70 1006,86±31,58* 1086,07±26,29 0,4% растворе NaCl по сравнению Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 606,39±11,21* 553,54±10,09 578,41±9,96 551,11±8,99 545,95±9,32 566,55±9,98 504,11±7,76* 541,73±9,75 573,04±9,47 560,08±9,06 515,53±9,79* 575,71±9,55 543,41±10,05 556,85±9,72 553,12±10,24 540,81±9,28 519,78±8,88 528,29±8,84 518,12±9,57 511,90±10,35 543,29±8,39 527,59±9,41 496,69±8,46* 530,07±9,23 524,21±8,36 523,88±9,42 510,16±9,34 522,18±9,09 484,59±7,98* 532,38±7,79 492,36±7,15* 546,50±9,49 497,90±9,53* 528,78±7,88 512,52±8,96 528,07±8,65 497,29±7,69 513,13±9,32 502,22±8,45 520,76±9,43 478,82±6,62 512,86±7,38 478,82±6,62* 512,86±7,38 483,18±10,06* 509,18±8,35 со значениями в 0,9% NaCl по 127 Выраженное регуляторное уменьшение объема, диаметра и площади поверхности лимфоцитов наблюдали на 180 (11,5%; 4%; 7,5%; р<0,05) и 480 (17%; 5,3%; 6%; р<0,05) секундах инкубации по сравнению с показателями в изотоническом растворе. К окончанию инкубации (3600 с) диаметр, объем и площадь поверхности клеток снизились на 2,7%; 7,8% и 5,4% (р<0,05). Установлены периоды регуляторного восстановления параметров клеток в умеренно гипотонической среде до значений изотонического раствора. Длительность этих циклов в начале инкубации составила 30 и 60 секунд, а по мере продолжительности воздействия удлинилась до 90 и 120 секунд. В условиях снижения осмолярности среды произошло увеличение размеров ядра на 30, 210 и 240 секундах инкубации (таблица 32). Таблица 32 - Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием адреналиновой нагрузки ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 11,56±0,10* 11,23±0,09 817,72±11,84* 749,84±19,31 421,13±7,59* 397,66±6,80 60 11,31±0,11 11,06±0,09 766,09±12,37 716,89±18,53 403,08±7,55 385,86±6,72 90 11,19±0,09 11,17±0,10 742,17±18,11 738,15±19,50 395,07±6,44 393,39±6,98 120 10,86±0,09 11,07±0,10 676,62±16,65 719,52±19,59 371,39±6,16 386,67±7,04 150 10,90±0,09* 11,66±0,21 685,29±17,42* 873,64±6,85 374,48±6,41* 433,44±7,83 180 11,02±0,10 11,19±0,11 708,50±19,56 743,05±12,12 382,7±7,01 394,93±7,49 210 11,64±0,08* 11,10±0,12 831,07±17,15* 729,39±12,49 426,40±5,89* 389,47±8,67 240 11,36±0,11* 10,98±0,09 778,38±12,94* 701,78±18,62 407,36±7,69* 380,34±6,79 270 11,08±0,08 10,95±0,09 718,66±16,65 693,62±16,87 386,82±5,95 377,66±6,13 300 10,88±0,11 10,71±0,11 683,94±19,56 652,31±12,13 373,64±7,19 361,82±7,42 330 11,22±0,07 11,03±0,11 742,84±13,65 712,68±12,53 395,84±4,89 384,03±7,41 360 10,67±0,10* 11,06±0,11 644,76±18,30* 718,15±19,89 359,27±6,83* 386,08±7,24 390 10,86±0,09 10,60±0,09 677,26±17,29 631,11±16,40 371,59±6,28 354,44±6,17 420 10,82±0,09 10,86±0,08 671,04±17,86 676,06±15,88 369,7±6,51 371,38±5,73 450 10,78±0,09* 11,29±0,12 662,74±17,81* 765,76±15,22 366,13±6,51* 402,35±8,82 480 10,77±0,09 10,87±0,11 661,99±16,43 682,59±12,00 366,02±6,09 373,11±7,27 510 10,78±0,09 10,86±0,11 663,36±17,26 679,54±19,73 366,44±6,31 371,97±7,28 540 10,58±0,09 10,79±0,08 627,18±16,19 662,26±15,28 352,96±6,14 366,34±5,56 570 10,67±0,09 10,65±0,09 643,83±17,42 640,14±18,21 359,08±6,49 357,61±6,71 600 10,73±0,08 10,58±0,10 652,55±15,01 627,92±17,26 362,74±5,51 353,03±6,59 900 10,72±0,09* 10,44±0,10 653,03±17,45* 604,26±18,09 362,58±6,37* 343,93±6,85 1500 10,62±0,11 10,56±0,08 636,46±12,20 622,47±14,82 355,84±7,50 351,41±5,58 3600 10,50±0,11 10,65±0,09 615,31±19,00 638,49±16,29 348,02±7,12 357,29±6,01 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Диаметр, объем и площадь поверхности ядра на 30 секунде инкубации возросли на 2,8%; 8,3% и 5,5% (р<0,05), затем отмечен 90 секундный период умень- 128 шения объема ядра. На 150 секунде морфометрические параметры ядра уменьшились: диаметр – на 7% (р<0,05), объем – на 27,5% (р<0,05) и площадь поверхности – на 15,7% (р<0,05). В интервале 210-240 секунды вновь наблюдали набухание ядра: диаметр, объем и площадь поверхности увеличились соответственно на 4,6%; 12,2% и 8,7% (р<0,05) по сравнению с изотоническим раствором. В последующие секунды инкубации установлено чередование периодов увеличения и уменьшения объема ядра. К окончанию времени воздействия морфометрические параметры ядра в гипо- и изотоническом растворах были практически одинаковыми. Выявлена высокая степень корреляции между динамикой ЯЦО и изменениями объема клеток и ядер на протяжении всего времени инкубации (рисунок 35). усл. ед. 0,81 0,79 0,77 0,75 0,73 0,4% NaCl 0,71 0,9% NaCl 0,69 0,67 0,65 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 35 – ЯЦО лимфоцитов больных ХЛЛ под влиянием адреналиновой нагрузки Снижение ЯЦО в гипотоническом растворе на 150 секунде (18%; р<0,05) кореллировали с уменьшением размеров ядра в этот период (r=1). Возрастание показателя ЯЦО к 180 секунде на 8% (р<0,05), кореллировали с увеличением размеров клеток в этот период (r=0,99). Динамика ЯЦО в последующие секунды инкубации (с 210 по 450 секунды) носила циклический характер, достоверных различий между значениями в гипо- и изотонической средах не выявлено. Увеличение ЯЦО произошло на 480 и 1500 секундах на 8% (р<0,05) по сравнению с изо- 129 тоническим раствором. К окончанию воздействия достоверных различий в показателе ЯЦО между гипо- и изотоническим растворами не установлено. Под влиянием адреналиновой нагрузки на 30 секунде инкубации использование мембранного резерва лимфоцитами в гипотонической среде увеличилось на 45% (р<0,05), на 180 секунде - снизилось на 71% (р<0,05), а к 600 секунде вновь возросло на 66% (р<0,05) по сравнению с изотоническим раствором (таблица 33). Таблица 33 – Значения относительного мембранного резерва лимфоцитов больных ХЛЛ (мкм-1) в условиях адреналиновой нагрузки Время, Плазмалемма, усл. ед. Кариолемма, усл. ед. с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 0,11±0,01* 0,06±0,01 0,19±0,02 0,16±0,02 60 0,07±0,01 0,05±0,01 0,16±0,02 0,13±0,02 90 0,05±0,01 0,06±0,01 0,15±0,02 0,15±0,02 120 0,07±0,01* 0,04±0,01 0,11±0,01 0,13±0,02 150 0,07±0,01 0,06±0,01 0,11±0,01* 0,21±0,03 180 0,02±0,01* 0,07±0,01 0,12±0,01* 0,15±0,01 210 0,04±0,01 0,06±0,01 0,21±0,02* 0,14±0,02 240 0,05±0,01 0,04±0,01 0,17±0,02 0,13±0,02 270 0,02±0,01 0,03±0,01 0,13±0,01 0,11±0,02 300 0,02±0,01 0,01±0,001 0,11±0,02 0,08±0,01 330 0,04±0,01 0,03±0,01 0,15±0,01 0,13±0,02 360 0,02±0,01 0,03±0,01 0,08±0,01* 0,13±0,01 390 0,03±0,01 0,03±0,01 0,10±0,01 0,07±0,01 420 0,01±0,001 0,02±0,001 0,10±0,02 0,10±0,01 450 0 0,03±0,01 0,09±0,01* 0,16±0,01 480 0 0,05±0,01 0,09±0,01 0,11±0,01 510 0,01±0,001 0,03±0,02 0,09±0,01 0,11±0,02 540 0,01±0,001 0,03±0,01 0,07±0,01 0,09±0,01 570 0,01±0,001 0,02±0,01 0,08±0,01 0,08±0,02 600 0,06±0,01* 0,02±0,01 0,09±0,01 0,07±0,02 900 0,01±0,002 0 0,09±0,02 0,05±0,01 1800 0 0,01±0,002 0,08±0,02 0,06±0,01 3600 0 0,01±0,002 0,06±0,02 0,08±0,01 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). В течение первых 120 секунд использование ядром внутриклеточных мембранных резервных бассейнов в условиях адреналиновой нагрузки при снижении осмолярности среды достоверно не отличалось от показателей изотонического раствора. На 150 секунде гипотонического воздействия использование мембран- 130 ного резерва ядром снизилось на 47% (р<0,05), на 210 секунде – возросло на 50% (р<0,05), а к 360 секунде – вновь снизилось на 38,5% (р<0,05) по сравнению со значениям изотонического раствора. Таким образом, под влиянием адреналиновой нагрузки выявлена синхронизация в периодах увеличения и снижения объема в системе клетка-ядро. Увеличение объемов клетки и ядра установлено в течение первых 30-ти секунд инкубации. Регуляторные реакции уменьшения объема ядра в гипотонической среде происходят на 30 секунд медленнее, чем у клетки в целом. Наблюдалась цикличность в использовании мембранного резерва, как клеткой, так и ядром. 2.2.4.2 Регуляция объема лимфоцитов в пробах с обзиданом Под влиянием неизбирательного блокатора β-адренорецепторов – обзидана, размеры лимфоцитов в гипотонической среде уменьшились. Выраженная реакция уменьшения объема, диаметра и площади поверхности клеток отмечалась на 60 и 300 секундах инкубации (таблица 34). Таблица 34 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием обзидана Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 Диаметр, мкм 0,4% NaCl 0,9% NaCl 11,11±0,11 10,94±0,16 10,77±0,10* 11,26±0,14 10,68±0,08* 10,97±0,11 10,65±0,09 10,94±0,18 10,46±0,08 10,69±0,12 10,57±0,09 10,80±0,12 10,40±0,08 10,73±0,12 10,13±0,11* 10,49±0,11 10,16±0,10* 10,57±0,11 10,23±0,08* 10,81±0,11 10,24±0,10 10,29±0,13 10,32±0,08* 10,68±0,11 10,39±0,09 10,64±0,12 10,35±0,08 10,59±0,11 Объем, мкм3 0,4% NaCl 0,9% NaCl 727,38±12,12 707,64±13,80 663,07±18,58* 764,07±17,93 642,06±13,88* 701,77±12,00 641,77±17,50 716,36±12,06 604,29±14,74 652,38±13,02 626,50±18,32 672,93±12,97 593,37±13,18 359,51±12,35 552,71±17,84* 615,65±20,74 556,94±17,45* 628,86±11,12 565,65±13,51* 671,56±12,22 570,37±17,26 584,29±12,23 580,02±13,99* 647,88±10,05 593,51±15,92 641,41±12,42 586,06±14,27 630,52±19,71 Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 389,17±7,82 379,89±11,39 366,10±6,84* 401,13±9,87 358,93±5,19* 379,88±7,83 358,36±6,40 380,87±14,98 344,49±5,58 361,51±8,31 352,51±6,67 368,94±8,49 340,54±4,98 364,08±8,23 323,88±6,87* 347,83±7,74 325,622±6,72* 352,87±7,73 329,68±5,25* 368,83±7,73 330,92±6,65 335,45±8,36 335,26±5,32* 360,12±7,53 340,14±6,10 357,50±7,89 337,53±5,48 353,68±7,33 131 Продолжение таблицы 34 ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 450 10,35±0,09 10,50±0,10 586,41±16,18 618,31±12,13 337,41±6,11 348,61±8,19 480 10,30±0,08 10,45±0,10 575,94±12,58 605,35±18,19 333,82±4,90 344,35±6,84 510 10,13±0,09 10,25±0,10 550,02±14,37 571,78±17,01 323,35±5,69 331,53±6,53 540 10,04±0,08* 10,49±0,11 534,13±13,11* 615,75±19,94 317,32±5,09* 347,99±7,49 570 10,17±0,09 10,38±0,11 556,24±14,60 594,41±18,53 325,81±5,70 340,08±6,99 600 10,02±0,09* 10,30±0,09 532,35±14,35* 582,82±12,40 316,36±5,65* 335,23±7,71 900 10,21±0,08 10,25±0,09 563,04±13,69 570,24±16,47 328,64±5,32 331,05±6,28 1500 9,97±0,07 9,95±0,10 523,02±10,89 522,58±15,88 313,11±4,41 312,16±6,28 3600 9,45±0,08 9,73±0,12 446,34±11,09 493,17±12,00 281,48±4,59 299,53±7,65 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). На 60 секунде объем, диаметр и площадь поверхности клеток снизились соответственно 15%, 4,5% и 9,5% (р<0,05), а на 300 секунде – на 18,7%; 5,7% и 11,8% (р<0,05) по сравнению с изотоническим раствором. На протяжении всего времени инкубации периоды уменьшения объема чередовались с интервалами его увеличения. Продолжительность периодов уменьшения объема клеток первоначально составила 90 секунд, затем сократилась до 30 секунд и к концу инкубации вновь достигла 90 секундных значений. Восстановление морфометрических параметров клеток до значений изотонического раствора происходит к окончанию инкубации. Под влиянием обзидана в умеренно гипотонической среде размеры ядра были снижены на протяжении часовой инкубации. Выраженное сокращение морфометрических параметров ядра установлено в течение 60-ти секундного интервала с 270 по 330 секунды воздействия (таблица 35). Таблица 35 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием обзидана Время, с 30 60 90 120 150 180 210 240 Диаметр, мкм 0,4% NaCl 0,9% NaCl 9,35±0,09 9,47±0,12 9,21±0,10 9,33±0,11 9,22±0,10 9,21±0,12 9,04±0,09 8,96±0,09 9,04±0,09 8,99±0,09 8,94±0,08 9,04±0,08 8,98±0,07 9,05±0,09 8,77±0,08 8,99±0,08 Объем, мкм3 0,4% NaCl 0,9% NaCl 433,49±12,49 455,09±17,58 416,90±14,74 433,34±15,07 417,91±4,57 418,57±15,45 393,14±13,08 383,45±12,30 392,65±12,98 386,69±11,98 378,43±10,55 391,54±10,47 382,86±9,07 393,96±11,88 357,62±9,55 385,36±10,92 Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 275,77±5,20 283,82±7,27 268,16±6,14 275,04±6,44 268,60±6,11 26852±6,68 258,74±5,67 253,79±5,43 257,81±5,58 255,34±5,22 251,94±4,62 257,76±4,62 254,20±3,94 258,61±5,13 242,62±4,40 254,92±4,84 132 Продолжение таблицы 35 ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 270 8,71±0,08* 9,02±0,11 349,97±9,33* 393,21±14,99 239,22±4,22* 257,53±6,49 300 8,45±0,09* 9,04±0,09 320,56±10,21* 391,95±11,79 225,32±4,65* 257,69±5,17 330 8,85±0,07* 9,12±0,11 366,60±9,53* 405,53±14,88 246,77±4,26* 263,03±6,38 360 8,97±0,09 8,96±0,11 384,26±12,24 384,19±13,98 254,20±5,34 254,05±6,05 390 8,74±0,08* 8,98±0,09 354,17±9,76* 384,74±12,27 241,07±9,76* 254,41±5,34 420 8,93±0,09 9,01±0,08 378,98±12,61 387,81±10,79 251,78±5,48 256,06±4,75 450 8,56±0,09* 9,02±0,11 335,19±11,69* 393,22±14,91 231,78±5,39* 257,63±6,37 480 8,67±0,08 8,77±0,09 345,39±9,57 359,11±12,24 237,02±4,41 242,79±5,47 510 8,81±0,11 8,97±0,12 336,32±14,39 387,29±15,14 245,51±6,41 254,82±6,61 540 8,37±0,08* 8,88±0,11 311,35±9,61* 374,75±14,47 220,98±4,52* 249,47±6,74 570 8,24±0,08* 8,88±0,09 296,61±8,49* 372,45±11,65 214,12±4,05* 248,98±5,18 600 8,21±0,08* 8,85±0,09 293,92±8,58* 367,96±11,54 212,80±4,07* 246,99±5,11 900 8,48±0,07 8,48±0,08 322,39±8,32 323,01±9,38 226,52±3,88 226,62±4,34 1500 8,25±0,08 8,31±0,09 298,78±8,94 306,57±11,21 215,02±4,34 218,37±5,16 3600 7,85±0,07 8,05±0,10 256,64±7,42 279,38±11,24 194,42±3,69 204,97±5,34 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Наиболее выраженная реакция протекала на 300 секунде: объем, диаметр и площадь поверхности уменьшились соответственно на 22%, 7% и 14% (р<0,05) по сравнению с изотоническим раствором. С 360 по 510 секунды инкубации наблюдали попеременное чередование 30ти секундных циклов уменьшения размеров ядра и восстановления его параметров до значений изотонического раствора. Затем следовал 60-ти секундный интервал (с 540 по 600 секунды инкубации) в ходе которого объем, диаметр и площадь поверхности ядра максимально уменьшались соответственно на 25,5%, 7,7% и 16% (р<0,05). К окончанию часовой инкубации размеры ядра в гипо- и изотоническом растворах находились в пределах недостоверных различий. Изменения параметра ЯЦО в умеренно гипотонической и изоосмотической средах носили циклический характер (рисунок 36). 133 усл.ед. 0,83 0,81 0,79 0,77 0,75 0,4% NaCl 0,73 0,9% NaCl 0,71 0,69 0,67 0,65 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 36 – ЯЦО лимфоцитов больных ХЛЛ под влиянием обзидана В течение первых 420 секунд инкубации достоверных различий между показателями исследуемых групп не выявлено. Снижение ЯЦО в умеренно гипотонической среде отмечали на 450, 570 и 600 секундах, оно не превысило 10-12% (р<0,05) по сравнению с изотоническим раствором. Под влиянием обзидана использование мембранного резерва клеткой при инкубации в умеренно гипотонической среде уменьшилось на 60, 150 и 210 секундах инкубации соответственно на 46%, 50% и 71% (р<0,05) по сравнению с изотоническим раствором (таблица 36). Таблица 36 – Значения относительного мембранного резерва лимфоцитов (мкм-1) под влиянием обзидана Время, Плазмалемма, усл. ед. Кариолемма, усл. ед. с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 0,11±0,02 0,09±0,01 0,15±0,02 0,18±0,03 60 0,07±0,02* 0,13±0,02 0,13±0,02 0,14±0,02 90 0,06±0,02 0,09±0,02 0,13±0,02 0,13±0,03 120 0,06±0,02 0,10±0,03 0,09±0,02 0,08±0,02 150 0,03±0,01* 0,06±0,01 0,10±0,03 0,09±0,02 180 0,05±0,02 0,07±0,02 0,08±0,01 0,09±0,02 210 0,02±0,01* 0,07±0,02 0,09±0,02 0,09±0,02 240 0 0,04±0,01 0,05±0,01 0,09±0,02 270 0 0,05±0,01 0,03±0,001 0,09±0,02 300 0,05±0,01 0,08±0,02 0 0,09±0,02 330 0,08±0,02* 0,02±0,001 0,06±0,01* 0,11±0,02 360 0,01±0,001* 0,06±0,01 0,08±0,02 0,09±0,02 390 0,02±0,01* 0,06±0,01 0,05±0,01 0,09±0,02 420 0,01±0,001* 0,05±0,01 0,08±0,01 0,09±0,02 134 Продолжение таблицы 36 Время, Плазмалемма, усл. ед. Кариолемма, усл. ед. с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 450 0,02±0,01 0,04±0,01 0,02±0,001* 0,09±0,02 480 0,01±0,001 0,03±0,01 0,04±0,01 0,05±0,02 510 0 0,01±0,001 0,07±0,01 0,08±0,02 540 0 0,04±0,01 0 0,06±0,01 570 0,004±0,001* 0,03±0,01 0 0,06±0,01 600 0 0,02±0,001 0 0,06±0,01 900 0,004±0,001* 0,08±0,01 0 0 1800 0 0 0 0 3600 0 0 0 0 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). В использовании мембранного резерва ядром достоверных различий между гипо- и изотонической средами не выявлено, за исключением 330 и 450 секунды воздействия, когда значения относительного мембранного резерва используемого ядром в гипотонической среде уменьшились соответственно на 45,5% и 78% (р<0,05). Анализируя осморегуляторные реакции лимфоцитов больных ХЛЛ, приходим к заключению, что в условиях блокады β-адренорецепторов развитие реакций уменьшения объема ядра запаздывает от клетки на 210 секунд. Под влиянием обзидана наблюдается «сморщивание» лимфоцитов при снижении осмолярности среды, при этом регуляторное уменьшение объема на уровне клетки начинается на 210 секунд раньше, чем ядра. Снижение интенсивности использования резерва кариолеммой в гипотонической среде более выражено по сравнению с плазмалеммой. 135 2.2.4.3 Относительный мембранный резерв, используемый лимфоцитами больных ХЛЛ в условиях активации и блокады β-адренорецепторов В условиях как активации, так и блокады β-адренорецепторов, морфометрические параметры лимфоцитов больных ХЛЛ увеличились в пробах с гипотонической нагрузкой (таблица 37). Таблица 37 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана ВреДиаметр, мкм Объем, мкм3 мя, с Контроль Адреналин Обзидан Контроль Адреналин Обзидан 30 10,53±0,09 13,87±0,13* 11,11±0,11* 618,11±16,77 1413,24±39,36* 727,38±12,12* 60 9,71±0,09 13,55±0,12* 10,77±0,10* 486,46±14,87 1315,53±33,81* 663,07±18,58* 90 9,42±0,09 13,16±0,11* 10,68±0,08* 442,86±12,96 1206,28±30,55* 642,06±13,88* 120 9,53±0,07 12,65±0,10* 10,65±0,09* 457,02±10,37 1069,19±24,77* 641,77±17,50* 150 9,38±0,09 13,49±0,11* 10,46±0,08* 438,87±13,40 1296,58±32,74* 604,29±14,74* 180 9,47±0,09 12,78±0,12* 10,57±0,09* 450,58±12,56 1108,20±31,74* 626,50±18,32* 210 9,73±0,08 13,13±0,12* 10,40±0,08* 487,89±12,68 1198,94±33,14* 593,37±13,18* 240 9,47±0,09 13,24±0,12* 10,13±0,11* 450,26±12,61 1231,25±33,87* 552,71±17,84* 270 9,55±0,10 12,84±0,11* 10,16±0,10* 464,44±15,16 1120,49±28,99* 556,94±17,45* 300 9,55±0,07 12,82±0,12* 10,23±0,08* 460,75±11,10 1116,24±30,71* 565,65±13,51* 330 9,21±0,07 13,13±0,10* 10,24±0,10* 412,30±8,90 1196,35±27,31* 570,37±17,26* 360 9,22±0,09 12,55±0,11* 10,32±0,08* 417,04±13,27 1046,70±26,77* 580,02±13,99* 390 9,23±0,07 12,90±0,10* 10,39±0,09* 415,08±9,49 1134,16±27,00* 593,51±15,92* 420 9,43±0,07 12,72±0,12* 10,35±0,08* 442,99±9,81 1090,47±29,74* 586,06±14,27* 450 9,41±0,06 12,40±0,10* 10,35±0,09* 438,16±7,89 1008,34±24,75* 586,41±16,18* 480 9,25±0,08 12,51±0,09* 10,30±0,08* 418,81±10,71 1031,52±22,79* 575,94±12,58* 510 8,92±0,07 12,56±0,12* 10,13±0,09* 374,44±9,06 1051,96±30,35* 550,02±14,37* 540 8,11±0,07 12,75±0,11* 10,04±0,08* 282,43±6,99 1097,40±29,00* 534,13±13,11* 570 9,06±0,06 12,56±0,09* 10,17±0,09* 391,59±8,02 1047,64±24,12* 556,24±14,60* 600 9,06±0,07 12,62±0,11* 10,02±0,09* 392,78±9,19 1064,12±26,63* 532,35±14,35* 900 9,52±0,07 12,59±0,17* 10,21±0,08* 456,30±10,74 1077,35±24,50* 563,04±13,69* 1500 8,62±0,06 12,33±0,08* 9,97±0,07* 337,77±7,53 988,94±20,46* 523,02±10,89* 3600 7,94±0,07 12,37±0,13* 9,45±0,08* 264,86±7,11 1006,86±31,58* 446,34±11,09* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в умеренно гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Существенное увеличение размеров клеток в гипотонической среде было более выражено под влиянием адреналина по сравнению с обзиданом. На 30 секунде инкубации диаметр и объем лимфоцитов возросли соответственно на 24% и 56% (р<0,05) в условиях активации β-адренорецепторов, и на 5,5 и 17,7% (р<0,05) 136 – их блокады. Интенсивное набухание лимфоцитов в пробах с адреналином и обзиданом сохранилось в течение всего времени инкубации. В гипоосмотической среде ядро, также как и клетка в целом набухало на протяжении всего времени инкубации (таблица 38). Таблица 38 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана ВреДиаметр, мкм Объем, мкм3 мя, с Контроль Адреналин Обзидан Контроль Адреналин Обзидан 30 9,22±0,12 11,56±0,10* 9,35±0,09 420,57±15,75 817,72±11,84* 433,49±12,49* 60 7,72±0,09 11,31±0,11* 9,21±0,10* 246,14±8,28 766,09±12,37* 416,90±14,74* 90 7,82±0,07 11,19±0,09* 9,22±0,10* 252,94±6,55 742,17±18,11* 417,91±4,57* 120 8,65±0,09 10,86±0,09* 9,04±0,09* 345,03±10,72 676,62±16,65* 393,14±13,08* 150 7,66±0,08 10,90±0,09* 9,04±0,09* 239,08±7,41 685,29±17,42* 392,65±12,98* 180 7,66±0,08 11,02±0,10* 8,94±0,08* 239,36±8,08 708,50±19,56* 378,43±10,55* 210 7,72±0,08 11,64±0,08* 8,98±0,07* 244,41±7,42 831,07±17,15* 382,86±9,07* 240 7,56±0,08 11,36±0,11* 8,77±0,08* 229,99±7,75 778,38±12,94* 357,62±9,55* 270 7,48±0,08 11,08±0,08* 8,71±0,08* 222,95±7,06 718,66±16,65* 349,97±9,33* 300 7,61±0,07 10,88±0,11* 8,45±0,09* 233,22±6,58 683,94±19,56* 320,56±10,21* 330 7,65±0,06 11,22±0,07* 8,85±0,07* 236,75±5,65 742,84±13,65* 366,60±9,53* 360 7,66±0,08 10,67±0,10* 8,97±0,09* 239,29±7,86 644,76±18,30* 384,26±12,24* 390 7,64±0,07 10,86±0,09* 8,74±0,08* 236,44±6,74 677,26±17,29* 354,17±9,76* 420 7,61±0,07 10,82±0,09* 8,93±0,09* 233,99±7,07 671,04±17,86* 378,98±12,61* 450 9,28±0,07 10,78±0,09* 8,56±0,09* 421,11±8,88 662,74±17,81* 335,19±11,69* 480 8,58±0,07 10,77±0,09* 8,67±0,08 333,75±8,63 661,99±16,43* 345,39±9,57 510 7,72±0,06 10,78±0,09* 8,81±0,11* 242,40±5,12 663,36±17,26* 336,32±14,39* 540 7,53±0,05 10,58±0,09* 8,37±0,08* 224,59±4,58 627,18±16,19* 311,35±9,61* 570 7,7±0,06 10,67±0,09* 8,24±0,08* 241,82±5,61 643,83±17,42* 296,61±8,49* 600 7,63±0,06 10,73±0,08* 8,21±0,08* 235,17±5,91 652,55±15,01* 293,92±8,58* 900 7,64±0,07 10,72±0,09* 8,48±0,07* 236,02±6,54 653,03±17,45* 322,39±8,32* 1500 7,31±0,07 10,62±0,11* 8,25±0,08* 207,59±6,44 636,46±12,20* 298,78±8,94* 3600 6,74±0,07 10,50±0,11* 7,85±0,07* 162,73±4,62 615,31±19,00* 256,64±7,42* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Под влиянием адреналиновой нагрузки на 30 секунде инкубации диаметр и объем ядра увеличились на 20% и 48,5% (р<0,05), а под влиянием обзидана – были в пределах недостоверных различий с контролем. На 90 секунде объем клеток в пробах с адреналином почти в два раза превышал аналогичные значения в пробах, проинкубированных с обзиданом. К окончанию инкубации диаметр и объем ядра возросли под влиянием адреналина соответственно на 35,8% и 73,5% (р<0,05), а под воздействием обзидана – на 16% и 36,5% (р<0,05) по сравнению с контролем. 137 Несмотря на выявленные реакции увеличения объема клетки и ядра при снижении осмолярности среды в условиях активации и блокады β- адренорецепторов, установлено снижение коэффициента осмотического натяжения плазмалеммы в течение первых 480 секунд, а кариолеммы – 240 секунд. Коэффициент осмотического натяжения плазмалеммы снизился на 90 секунде (4%; р<0,05) в пробах с адреналином, и на 60 секунде (19%; р<0,05) в пробах с обзиданом по сравнению с контролем (таблица 39). Таблица 39 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана ВреПлазмалемма, усл. ед. Кариолемма, усл. ед. мя, с Контроль Адреналин Обзидан Контроль Адреналин Обзидан 30 1,13±0,03 1,11±0,03 1,07±0,04 1,50±0,06 1,07±0,03* 1,00±0,03* 60 1,12±0,03 1,06±0,02 0,94±0,03* 1,08±0,04 1,06±0,03 0,99±0,03 90 1,09±0,03 0,98±0,03* 0,96±0,02* 1,14±0,03 1,02±0,03* 1,04±0,04* 120 1,02±0,03 0,94±0,02* 0,98±0,03 1,39±0,04 0,98±0,03* 1,04±0,03* 150 1,00±0,03 1,03±0,02 0,97±0,03 1,11±0,03 0,91±0,03* 1,03±0,03 180 1,06±0,03 0,91±0,03* 0,97±0,03* 1,07±0,03 0,99±0,03 0,99±0,03 210 1,09±0,03 0,99±0,02* 0,96±0,03* 1,09±0,03 1,12±0,03 1,00±0,03* 240 1,08±0,03 1,04±0,03 0,96±0,03* 0,97±0,03 1,09±0,03* 0,97±0,03 270 1,55±0,05 0,99±0,02* 0,95±0,03* 0,97±0,03 1,04±0,02 0,96±0,03 300 1,14±0,02 1,03±0,03* 0,91±0,02* 0,98±0,03 1,05±0,03 0,89±0,03 330 0,91±0,02 1,05±0,03* 1,01±0,03* 0,97±0,03 1,05±0,02* 0,97±0,03 360 0,98±0,03 0,95±0,02 0,95±0,02 1,00±0,03 0,95±0,03 1,03±0,04 390 0,93±0,03 1,01±0,02 0,98±0,03 1,11±0,03 1,06±0,02 0,97±0,03* 420 1,07±0,02 0,99±0,03* 0,98±0,03* 1,07±0,04 1,00±,02 1,00±0,03 450 1,08±0,02 0,92±0,02* 0,99±0,03* 1,66±0,05 0,93±0,03* 0,93±0,03* 480 1,06±0,04 0,91±0,02* 0,99±0,02* 1,49±0,04 0,99±0,02* 1,00±0,03* 510 0,94±0,03 0,95±0,02 0,99±0,02 1,20±0,04 1,00±0,03* 1,00±0,04* 540 0,79±0,02 0,98±0,02* 0,94±0,03* 1,02±0,02 0,97±0,02 0,92±0,03* 570 0,94±0,02 0,98±0,02 0,97±0,02 1,11±0,04 1,02±0,03 0,88±0,02* 600 0,96±0,02 0,98±0,03 0,97±0,03 1,08±0,04 1,05±0,03 0,88±0,03* 900 0,97±0,03 1,03±0,04 1,00±0,02 1,05±0,03 1,07±0,03 1,02±0,03 1500 0,87±0,02 0,94±0,02* 1,02±0,02* 0,96±0,03 1,03±0,03 1,02±0,03 3600 0,88±0,03 0,96±0,03 0,97±0,03* 0,99±0,03 0,98±0,02 0,97±0,03 * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). На 330 секунде коэффициент осмотического натяжения плазмалеммы и кариолеммы увеличился после адреналиновой нагрузки соответственно на 13% и 7,6% (р<0,05). В пробах, проинкубированных с обзиданом, на 330 секунде значения коэффициента кариолеммы не отличались от контрольных, а плазмалеммы - 138 возросли на 10 % (р<0,05). В дальнейшем наблюдали снижение значений коэффициента осмотического натяжения плазмалеммы и кариолеммы в условиях активации и блокады β-адренорецепторов. Изменения показателя ЯЦО в умеренно гипотонической среде после функциональных нагрузок носили менее выраженный характер, по сравнению с контролем. На 30 секунде инкубации наблюдали снижение ЯЦО после адреналиновой нагрузки на 11% (р<0,05), после обзидана - на 8% (р<0,05) по сравнению с контролем (рисунок 37). усл.ед. 1,05 1 0,95 0,9 контроль 0,85 адреналин 0,8 обзидан 0,75 0,7 0,65 0,6 30 90 150 210 270 330 390 450 510 570 900 3600 с . Рисунок 37 – ЯЦО лимфоцитов больных ХЛЛ в гипотонической среде под влиянием адреналина и обзидана Спустя минуту, от начала инкубации отмечали не продолжительный 60-ти секундный подъем показателя ЯЦО, причем после воздействия обзидана он был более выражен (12%; р<0,05), по сравнению с адреналином (8%; р<0,05) относительно контроля. В интервале со 180 по 420 секунды ЯЦО в пробах с адреналином и обзиданом увеличился по отношению к контролю. На 450 и 540 секундах инкубации показатель ЯЦО снизился под влиянием адреналиновой нагрузки соответственно на 26% и 25% (р<0,05), а обзидана – на 40,5% и 23% (р<0,05) по сравнению с контролем. В целом в течение первых 150 секунд инкубации наиболее выраженное снижение ЯЦО отмечали под воздействием адреналина, а к концу инкубации с 510 и до 3600 секунды – под влиянием обзидана. 139 Максимальное использование клеткой резерва плазмалеммы (≈22%) в гипотонической среде, как под влиянием адреналина, так и обзидана наблюдали на 30 секунде инкубации. Под влиянием адреналина ядро интенсивнее использовало внутриклеточные резервы (≈32%), чем в пробах с обзиданом (≈25,4%). Причем максимальное использование внутриклеточных резервных бассейнов ядром, под влиянием адреналина наблюдали на 210 секунде, а обзидана – на 30 секунде инкубации (рисунок 38). мкм-1 0,25 0,2 адреналин клетка 0,15 адреналин ядро обзидан клетка 0,1 обзидан ядро 0,05 0 30 60 90 120 150 180 210 240 270 300 360 с Рисунок 38 – Относительный мембранный резерв, используемый ядрами и лимфоцитами больных ХЛЛ под влиянием адреналина и обзидана в гипотонической среде Таким образом, в условиях активации и блокады β-адренорецепторов интенсивность использования мембранного резерва лимфоцитами больных ХЛЛ и их ядрами, увеличилась при снижении осмолярности среды. Выявленные особенности в проницаемости плазмалеммы и кариолеммы свидетельствуют о развитии регуляторных реакций в клетке, направленных на поддержание баланса между внутри и внеклеточной средой. При этом очевидно, что равновесные потоки веществ внутри клетки между ядром и цитоплазмой устанавливаются на 180 секунд быстрее, чем между клеткой и внеклеточной средой. 140 2.2.4.4 Сравнительный анализ регуляции объема лимфоцитов больных ХЛЛ в изотонической среде в условиях активации и блокады β-адренорецепторов В изотонической среде морфометрические параметры лимфоцитов увеличились как в условиях активации, так и блокады β-адренорецепторов (таблица 40). Таблица 40 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана в изотонической среде ВреДиаметр, мкм Объем, мкм3 мя, с Контроль Адреналин Обзидан Контроль Адреналин Обзидан 30 9,98±0,10 13,25±0,12* 10,94±0,16* 529,38±17,35 1232,40±33,61* 707,64±13,80* 60 9,23±0,09 13,23±0,11* 11,26±0,14* 418,13±12,54 1222,76±30,16* 764,07±17,93* 90 9,15±0,11 13,41±0,12* 10,97±0,11* 408,82±15,12 1275,60±33,42* 701,77±12,00* 120 9,49±0,09 13,11±0,12* 10,94±0,18* 452,74±12,48 1192,98±32,02* 716,36±12,06* 150 9,43±0,09 13,33±0,11* 10,69±0,12* 444,58±11,62 1252,70±30,10* 652,38±13,02* 180 9,27±0,08 13,52±0,11* 10,80±0,12* 420,51±10,56 1305,79±32,38* 672,93±12,97* 210 9,39±0,09 13,29±0,12* 10,73±0,12* 440,52±13,75 1242,84±32,45* 359,51±12,35* 240 9,23±0,09 13,10±0,11* 10,49±0,11* 417,98±12,68 1189,34±30,36* 615,65±20,74* 270 9,31±0,08 12,95±0,11* 10,57±0,11* 426,45±11,01 1147,94±28,83* 628,86±11,12* 300 8,98±0,09 12,74±0,13* 10,81±0,11* 385,96±12,93 1097,47±33,47* 671,56±12,22* 330 9,71±0,09 12,94±0,11* 10,29±0,13* 485,89±13,83 1146,42±30,92* 584,29±12,23* 360 9,47±0,11 12,97±0,11* 10,68±0,11* 450,05±16,11 1154,13±30,78* 647,88±10,05* 390 9,66±0,09 12,89±0,12* 10,64±0,12* 479,23±14,4 1134,49±30,52* 641,41±12,42* 420 9,17±0,09 12,87±0,11* 10,59±0,11* 409,20±11,83 1128,54±29,44* 630,52±19,71* 450 9,07±0,07 13,00±0,09* 10,50±0,12* 394,62±9,58 1159,94±25,17* 618,31±12,13* 480 9,13±0,13 13,17±0,11* 10,45±0,10* 409,75±16,39 1208,17±31,64* 605,35±18,19* 510 9,32±0,10 12,96±0,09* 10,25±0,10* 430,50±13,98 1148,38±25,35* 571,78±17,01* 540 9,24±0,12 12,94±0,11* 10,49±0,11* 423,83±18,06 1147,02±27,86* 615,75±19,94* 570 9,39±0,11 12,76±0,12* 10,38±0,11* 442,04±16,14 1101,77±30,02* 594,41±18,53* 600 9,32±0,10 12,85±0,12* 10,30±0,12* 430,78±14,59 1124,49±30,33* 582,82±12,40* 900 9,77±0,12 12,76±0,09* 10,25±0,09* 499,33±18,58 1096,5±23,70* 570,24±16,47* 1500 9,29±0,09 12,76±0,09* 9,95±0,10* 427,50±13,74 1096,55±23,70* 522,58±15,88* 3600 8,55±0,08 12,71±0,11* 9,73±0,12* 331,47±8,92 1086,07±26,29* 493,17±12,00* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Под влиянием адреналина и обзидана на 30 секунде инкубации диаметр и объем клеток возросли соответственно на 33%, 133% и 9,6%, 34% (р<0,05) по сравнению с контролем. К середине инкубации на 360 секунде диаметр и объем клеток увеличились соответственно на 37% и 156% (р<0,05) в пробах с адренали- 141 ном, и на 12,7% и 44% (р<0,05) пробах с обзиданом по сравнению с контролем. К концу часовой инкубации диаметр и объем клеток увеличился на 48,6% и 227% (р<0,05) в пробах с адреналиновой нагрузкой, и на 14% и 49% (р<0,05) в пробах, обработанных обзиданом. Морфометрические параметры ядра увеличилась как в условиях активации, так и блокады β-адренорецепторов (таблица 41). Таблица 41 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана в изотонической среде ВреДиаметр, мкм Объем, мкм3 мя, с Контроль Адреналин Обзидан Контроль Адреналин Обзидан 30 7,64±0,09 11,23±0,09* 9,47±0,12* 238,81±8,74 749,84±19,31* 455,09±17,58* 60 7,56±0,10 11,06±0,09* 9,33±0,11* 232,59±9,37 716,89±18,53* 433,34±15,07* 90 7,27±0,16 11,17±0,10* 9,21±0,12* 212,16±8,29 738,15±19,50* 418,57±15,45* 120 7,37±0,08 11,07±0,10* 8,96±0,09* 212,73±6,49 719,52±19,59* 383,45±12,30* 150 7,38±0,10 11,66±0,21* 8,99±0,09* 215,67±8,86 873,64±6,85* 386,69±11,98* 180 7,49±0,07 11,19±0,11* 9,04±0,08* 223,05±6,65 743,05±12,12* 391,54±10,47* 210 7,46±0,08 11,10±0,12* 9,05±0,09* 221,48±7,31 729,39±12,49* 393,96±11,88* 240 7,77±0,08 10,98±0,09* 8,99±0,08* 249,93±8,17 701,78±18,62* 385,36±10,92* 270 7,73±0,09 10,95±0,09* 9,02±0,11* 247,20±8,90 693,62±16,87* 393,21±14,99* 300 7,47±0,08 10,71±0,11* 9,04±0,09* 245,95±7,13 652,31±12,13* 391,95±11,79* 330 7,87±0,11 11,03±0,11* 9,12±0,11* 263,37±10,98 712,68±12,53* 405,53±14,88* 360 7,74±0,09 11,06±0,11* 8,96±0,11* 247,99±9,22 718,15±19,89* 384,19±13,98* 390 7,32±0,08 10,60±0,09* 8,98±0,09* 209,57±7,17 631,11±16,40* 384,74±12,27* 420 7,44±0,10 10,86±0,08* 9,01±0,08* 221,62±8,66 676,06±15,88* 387,81±10,79* 450 7,29±0,09 11,29±0,12* 9,02±0,11* 208,35±7,66 765,76±15,22* 393,22±14,91* 480 7,11±0,09 10,87±0,11* 8,77±0,09* 192,76±7,27 682,59±12,00* 359,11±12,24* 510 7,17±0,10 10,86±0,11* 8,97±0,12* 198,59±8,26 679,54±19,73* 387,29±15,14* 540 7,49±0,07 10,79±0,08* 8,88±0,11* 222,36±6,34 662,26±15,28* 374,75±14,47* 570 7,49±0,12 10,65±0,09* 8,88±0,09* 228,50±10,99 640,14±18,21* 372,45±11,65* 600 7,49±0,11 10,58±0,10* 8,85±0,09* 227,52±9,71 627,92±17,26* 367,96±11,54* 900 7,54±0,09 10,44±0,10* 8,48±0,08* 229,82±8,57 604,26±18,09* 323,01±9,38* 1500 7,57±0,09 10,56±0,08* 8,31±0,09* 232,14±8,72 622,47±14,82* 306,57±11,21* 3600 6,87±0,07 10,65±0,09* 8,05±0,10* 172,64±5,62 638,49±16,29* 279,38±11,24* * Достоверность различий значений после воздействия адреналина/обзидана по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). Наиболее выраженное увеличение ядра в изотонической среде наблюдали под влиянием адреналина на протяжении всего времени инкубации. На 30 секунде диаметр и объем ядра увеличились на 47% и 214% (р<0,05) под влиянием адреналина, и на 24% и 90,5% (р<0,05) под влиянием обзидана. К окончанию часовой инкубации в пробах с адреналиновой нагрузкой диаметр и объем ядра возросли на 142 55% и 269% (р<0,05), в пробах, проинкубированных с обзиданом – на 17,7% и 62% (р<0,05) по сравнению с контролем. Показатель ЯЦО в изотонической среде после функциональных нагрузок на клетку был повышен на протяжении всего времени инкубации (рисунок 39). усл.ед. 0,85 0,8 0,75 контроль 0,7 адреналин обзидан 0,65 0,6 0,55 30 90 150 210 270 330 390 450 510 570 900 3600 с . Рисунок 39 – ЯЦО лимфоцитов больных ХЛЛ под влиянием адреналина и обзидана в изотонической среде На 30 секунде инкубации под влиянием обзидана в изотонической среде ЯЦО увеличились на 30,5% (р<0,05), адреналиновой нагрузки – на 24% (р<0,05) по сравнению с контролем. В интервале с 60 по 120 секунды прирост площади поверхности ядра к цитоплазме был более выражен в пробах с адреналином по сравнению с обзиданом. Затем со 180 по 380 секунды ситуация менялась и ЯЦО возрастали в пробах с обзиданом. К окончанию инкубации ЯЦО как после активации, так и после блокады β-адренорецепторов были практически равны, но по отношению к контролю – повышены. В пробах, проинкубированных с адреналином, интенсивность использования клеткой поверхностного резерва плазмалеммы в изотоническом растворе была снижена по сравнению с пробами, обработанными обзиданом. Максимальное использование относительного мембранного резерва (≈14%) клеткой под влиянием адреналиновой нагрузки отмечали на 180 секунде, в то же время, под влиянием 143 обзидана (≈25,5%) – на 60 секунде инкубации. Ядро интенсивно использовало внутриклеточные мембранные резервы в процессах регуляции объема в изотонической среде, как под влиянием адреналина, так и обзидана. В условиях адреналиновой нагрузки максимальное использование относительного мембранного резерва ядром (≈35,6%) наблюдали на 150 секунде, а под влиянием обзидана (≈30,5%) – на 30 секунде инкубации (рисунок 40). мкм-1 0,25 0,2 адреналин клетка 0,15 ядреналин ядро обзидан клетка 0,1 обзидан ядро 0,05 0 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 40 – Относительный мембранный резерв, используемый ядром и лимфоцитами больных ХЛЛ под влиянием адреналина и обзидана в изотонической среде Таким образом, в условиях активации и блокады β-адренорецепторов использование мембранного резерва лимфоцитами и их ядрами в изотоническом растворе увеличилось. 144 2.2.4.5. Регуляция объема лимфоцитов больных ХЛЛ в условиях кальциевой нагрузки Под влиянием кальциевой нагрузки, в течение первых 90 секунд инкубации лимфоцитов, реакции регуляции объема в гипотонической среде не выявлены. Начиная со 120 секунды воздействия диаметр, объем и площади поверхности лимфоцитов увеличились соответственно на 3%, 9% и 6% (р<0,05) по сравнению с изотоническим раствором. В интервале со 150 по 360 секунды параметры клеток в гипо- и изотоническом растворах были в пределах не достоверных различий (таблица 42). Таблица 42 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием Са2+ нагрузки ВреДиаметр, мкм мя, с 0,4% NaCl 0,9% NaCl 30 12,22±0,10 12,05±0,09 60 12,08±0,09 12,33±0,09 90 12,12±0,10 12,09±0,09 120 12,30±0,11* 11,95±0,09 150 11,99±0,09 11,96±0,11 180 11,96±0,11 11,94±0,08 210 12,11±0,09 11,89±0,09 240 11,97±0,09 12,04±0,11 270 12,01±0,11 12,07±0,11 300 12,15±0,12 12,04±0,10 330 11,81±0,09 11,79±0,11 360 11,96±0,12 11,79±0,11 390 12,05±0,12* 11,71±0,10 420 12,15±0,11* 11,75±0,10 450 12,13±0,13 12,30±0,09 480 11,99±0,12 12,04±0,11 510 12,57±0,11* 11,98±0,07 540 12,16±0,12* 11,82±0,09 570 11,87±0,16 11,65±0,08 600 11,96±0,11 12,15±0,16 900 11,49±0,15* 12,18±0,13 1500 11,61±0,12* 12,54±0,08 3600 11,48±0,14* 12,89±0,11 * Достоверность различий значений в критерию Стьюдента (р<0,05). Объем, мкм3 Площадь поверхности, мкм2 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 964,75±15,07 926,12±12,51 470,40±8,07 457,92±7,43 931,53±12,87 990,43±14,09 459,91±6,92 478,95±7,65 942,45±14,16 934,07±23,30 463,12±7,94 460,63±7,27 986,00±17,23* 901,85±11,56 477,04±8,75* 449,94±7,18 911,65±12,79 905,91±15,03 453,11±7,45 450,85±8,25 906,34±14,17 899,39±19,67 451,05±8,09 448,69±6,52 938,17±12,95 887,68±12,47 462,15±6,83 445,34±6,78 905,83±13,23 927,15±17,63 451,14±7,55 457,56±9,05 918,0±15,28 932,97±16,99 454,93±8,19 459,64±8,76 952,26±17,47 922,84±14,45 465,89±8,96 456,61±8,01 871,11±12,07 868,03±13,63 439,50±7,39 438,19±7,99 907,23±16,51 869,95±14,64 451,02±8,82 438,72±8,29 928,85±18,49* 849,01±11,79 458,02±9,27* 431,96±7,45 948,85±16,31* 859,52±12,78 465,04±8,42* 435,46±7,66 948,22±13,37 982,50±12,93 464,16±9,82 476,46±7,39 915,88±16,85 924,39±15,44 453,85±8,93 456,98±8,33 1052,55±29,05* 905,26±16,97 498,29±9,11* 451,63±5,58 955,78±19,00* 874,78±11,35 466,83±9,43* 440,79±7,25 899,05±17,46 835,00±17,55 446,55±9,09 427,68±6,07 907,60±16,12 961,33±16,43 451,22±8,66 467,29±9,86 816,32±11,54* 963,14±12,52 418,78±10,97* 468,79±10,38 831,55±15,11* 1040,39±22,26 425,45±8,58* 495,28±6,91 809,09±19,34* 1133,62±29,90 416,88±10,03* 523,67±9,25 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по 145 Реакцию увеличения объема лимфоцитов длительностью 60 секунд наблюдали на протяжении двух интервалов (390-420 секунды и 510-540 секунды). Начиная с 900 секунды и до конца инкубации, объем клеток в гипотонической среде уменьшился по сравнению с изотоническим раствором. К окончанию инкубации (3600 секунда) диаметр, объем и площадь поверхности лимфоцитов снизились соответственно на 12%, 40% и 26% (р<0,05) по сравнению с изотоническим раствором. Под влиянием Са2+-нагрузки установлено чередование периодов увеличения и снижения объема ядра, длительностью соответственно 30 и 60 секунд каждый. В интервале с 60 по 120 секунды диаметр, объем и площадь поверхности ядра увеличились соответственно на 3, 8 и 5% (р<0,05; 60 секунда) и 5%, 14% и 9% (р<0,05; 120 секунда) по сравнению с изотоническим раствором (таблица 43). Таблица 43 – Морфометрические параметры ядра лимфоцитов больных ХЛЛ под влиянием Са2+ нагрузки ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 9,15±0,07 9,07±0,08 404,68±9,62 395,40±10,60 263,74±4,15 259,44±4,67 60 9,19±008* 8,95±0,07 410,55±10,56* 380,53±10,02 266,16±4,51* 252,96±4,42 90 9,29±0,08* 8,85±0,08 424,47±10,98* 367,44±10,58 272,14±4,62* 246,95±4,72 120 9,31±0,08* 8,89±0,09 426,25±10,57* 373,72±10,99 272,95±4,50* 249,70±4,88 150 9,02±0,09 8,99±0,09 391,29±12,65 386,32±11,66 257,24±5,49 255,19±5,17 180 9,29±0,09* 9,02±0,09 425,12±12,68* 391,89±12,69 27,20±5,39* 257,45±5,58 210 9,27±0,09* 9,02±0,08 424,39±13,38* 389,41±10,97 271,58±5,73* 256,74±4,81 240 9,29±0,08* 8,88±0,09 425,22±11,85* 371,46±10,85 272,26±5,06* 248,69±4,85 270 9,48±0,10* 8,96±0,07 454,08±15,68* 379,79±9,51 283,91±6,39* 252,72±4,21 300 9,25±008 9,18±0,09 419,33±11,44 410,98±11,52 269,79±4,91 266,12±5,01 330 8,85±0,10 9,04±0,09 370,43±13,34 392,45±11,99 247,69±5,89 257,86±5,27 360 9,21±0,10* 8,86±0,07 416,41±14,94* 367,89±9,34 267,88±6,24* 247,39±4,18 390 9,08±0,08* 8,85±0,08 396,67±11,32* 366,96±10,36 259,89±4,92* 246,82±4,56 420 8,87±0,09* 9,13±0,08 371,54±12,71* 403,37±10,51 248,36±5,61* 262,98±4,60 450 9,43±0,11 9,26±0,08 446,49±14,87 420,14±11,15 280,76±6,25 270,21±4,75 480 9,12±0,10* 9,32±0,08 404,43±14,18* 428,59±11,16 262,72±6,09* 273,85±4,76 510 9,00±0,12 9,19±0,08 392,08±15,27 410,53±10,63 256,81±6,78 266,12±4,57 540 8,49±0,16* 9,09±0,09 336,78±17,85* 398,98±11,43 230,33±8,34* 260,90±4,96 570 8,49±0,13* 9,08±0,13 331,58±14,89* 404,06±16,75 229,00±6,99* 261,62±7,45 600 8,79±0,15* 9,01±0,12 369,91±19,28* 392,96±15,93 245,58±8,50* 257,16±6,89 900 9,06±0,13* 9,41±0,12 401,45±17,95* 445,47±17,03 260,37±7,70* 279,88±7,06 1500 8,94±0,09* 9,44±0,10 379,63±11,96* 447,44±14,57 252,13±5,32* 281,28±6,05 3600 9,03±0,11* 10,07±0,09 393,77±15,08* 541,87±14,97 257,79±6,48* 319,99±5,98 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). 146 Следующий период увеличения объема ядра наблюдали в интервале со 180 по 270 секунды. На 270 секунде диаметр, объем и площадь поверхности увеличились на 6%, 19,5% и 12% (р<0,05). Начиная с 420 секунды и до конца инкубации, морфометрические параметры ядра уменьшились. Причем сокращение ядра в объеме вначале было незначительным и составило 8,5% (р<0,05) на 420 секунде, а к 3600 секунде – на 37,6% (р<0,05) по сравнению с контролем. Изменения показателя ЯЦО кореллировали с реакциями регуляторного увеличения объема и сморщивания ядра. В течение первых 300 секунд инкубации показатель ЯЦО в гипотонической среде увеличился: на 60 - 90 секундах – на 9% (р<0,05), на 180 с – 5% (р<0,05), 240 с – 11% (р<0,05), а к 270 – на 14% (р<0,05) по сравнению с контролем. В интервале с 420 по 570 секунды инкубации ЯЦО снизился: на 420 секунде – на 13% (р<0,05), 510 – на 13% (р<0,05), 540 – на 15,6% (р<0,05), а к 570 – на 17% (р<0,05). К окончанию инкубации различия в значениях ЯЦО между гипо- и изотонической средами были не достоверны (рисунок 41). усл. ед. 0,68 0,66 0,64 0,62 0,6 0,58 0,56 0,54 0,52 0,5 0,4% NaCl 0,9% NaCl 30 90 150 210 270 330 39 450 510 570 900 3600 с . Рисунок 41 – ЯЦО лимфоцитов больных ХЛЛ под влиянием Са2+ нагрузки В течение первых 360 секунд наблюдали циклический характер в использовании дополнительных мембранных структур клетками. В изотоническом растворе вовлечение резервных мембранных структур произошло интенсивнее, чем в гипотонической среде (рисунок 42). 147 мкм-1 0,1 0,09 0,08 0,07 0,06 0,4 % NaCl 0,05 0,9 %NaCl 0,04 0,03 0,02 0,01 0 30 90 150 210 270 330 390 450 510 570 900 3600 с . Рисунок 42 – Относительный мембранный резерв лимфоцитов больных ХЛЛ под влиянием Са2+ нагрузки Под влиянием кальциевой нагрузки использование мембранного резерва плазмалеммой увеличилось на 30 и 120 секундах соответственно на 33% и 75% (р<0,05) по сравнению с изотоническим раствором. С увеличением времени инкубации использование мембранного резерва клеткой снизилось и к концу воздействия осморегуляторные реакции в гипотонической среде отсутствовали. В изотоническом растворе, наоборот, с увеличением времени инкубации использование мембранного резерва лимфоцитами возросло, максимум наблюдали на 3600 секунде инкубации (см. рисунок 42). Под влиянием кальциевой нагрузки интенсивное использование резервных структур ядром в гипотонической среде протекало в течение первых 270 секунд инкубации, при этом в изотоническом растворе вовлечение внутриклеточных резервных структур кариолеммой произошло на 450 и сохранилось до конца инкубации (рисунок 43). 148 мкм-1 0,012 0,01 0,008 0,4 % NaCl 0,006 0,9 % NaCl 0,004 0,002 0 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 43 – Относительный мембранный резерв ядер лимфоцитов больных ХЛЛ под влиянием Са2+ нагрузки Увеличение объема ядра в гипотонической среде под влиянием Са2+нагрузки протекало на 60 секунд быстрее, чем клеток. Общей реакцией явилось уменьшение объема клеток и их ядра в гипотонической среде во второй половине времени инкубации. Причем реакция на уровне ядра началась на 480 секунд раньше, чем на уровне целой клетки. 2.2.4.6 Регуляция объема лимфоцитов больных ХЛЛ в пробах с верапамилом Под влиянием верапамила увеличение объема клеток при снижении осмолярности среды наблюдали на 90 секунде и в интервале с 390 по 540 секунды инкубации. В остальные периоды инкубации достоверных различий в морфометрических параметрах лимфоцитов между гипо- и изотоническими средами не выявлено (таблица 44). 149 Таблица 44 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием верапамила ВреДиаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 12,59±0,11 12,72±0,09 1055,84±28,10 1085,77±25,75 199,46±8,80 509,31±7,88 60 12,69±0,11 12,86±0,12 1082,32±26,77 1125,92±28,91 507,96±8,46 521,31±9,13 90 12,50±0,13* 12,13±0,09 1039,27±34,48* 942,85±23,38 493,35±10,62* 463,44±7,52 120 12,60±0,13 12,53±0,12 1063,34±33,55 1044,24±30,14 501,13±10,37 495,36±9,64 150 12,49±0,12 12,25±0,09 1035,16±32,13 969,59±22,61 492,36±9,97 472,31±7,27 180 12,46±0,09 12,52±0,10 1020,29±23,77 1036,89±24,57 488,59±7,59 493,78±7,90 210 12,37±0,09 12,37±0,11 998,18±12,99 1001,93±26,52 481,74±6,82 482,31±8,50 240 12,48±0,11 12,38±0,12 1027,33±25,83 1005,97±28,97 490,58±8,27 483,25±9,30 270 12,28±0,11 12,50±0,09 980,09±25,60 1031,76±24,70 475,36±8,20 492,17±7,86 300 12,46±0,11 12,36±0,13 1024,09±27,97 1002,86±30,26 489,31±8,83 481,16±9,83 330 12,10±0,10 12,32±0,11 937,50±24,85 990,87±26,47 461,46±8,04 478,69±8,57 360 12,14±0,10 12,42±0,11 946,29±23,62 1014,74±26,12 464,47±7,74 486,41±8,52 390 12,87±0,09* 12,34±0,11 1124,28±25,10* 994,72±16,00 521,38±7,75* 480,06±8,32 420 12,83±0,11* 12,21±0,11 1118,00±29,03* 965,87±26,99 518,97±8,93* 470,44±8,79 450 12,88±0,11* 12,29±0,11 1129,71±30,17* 983,58±25,87 522,56±9,10* 476,32±8,52 480 12,63±0,09* 12,27±0,09 1063,65±23,78* 975,77±22,09 502,43±7,54* 474,33±7,19 510 12,46±0,12 12,17±0,11 1025,53±28,83 954,54±25,02 489,63±9,15 467,01±8,15 540 12,44±0,10* 12,11±0,09 1017,02±26,85* 939,91±23,12 487,28±8,34* 462,42±7,60 570 12,21±0,09 12,36±0,09 961,09±23,35 996,02±21,68 469,48±7,43 480,97±7,04 600 12,51±0,09 12,26±0,09 1034,78±25,09 973,03±23,66 493,14±7,88 473,31±7,58 900 12,49±0,13 12,21±0,11 1036,93±33,91 964,39±27,71 492,69±10,46 470,02±8,74 1500 12,40±0,13 12,23±0,11 1015,12±31,63 968,48±26,37 485,78±10,16 471,32±8,70 3600 11,94±0,09 12,00±0,09 899,04±21,11 913,02±21,42 449,09±6,96 453,68±7,13 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). На 180 секунде инкубации диаметр, объем и площадь поверхности ядра уменьшились соответственно на 3%; 9,8 % и 6,4% (р<0,05), на 270 секунде – на 3,4%; 10,5% и 7% (р<0,05) и 330 секунде – на 3%; 8,8% и 5,8% (р<0,05) по сравнению с изотоническим раствором. В интервале с 420 и по 480 секунды наблюдали реакцию увеличения объема ядра. К 480 секунде диаметр объем и площадь поверхности ядра возросли соответственно на 4%; 12% и 8% (р<0,05) по сравнению с контролем. Начиная с 510 и по 570 секунды, вновь наблюдали сморщивание ядер. К окончанию инкубации разницы в размерах ядер между исследуемыми пробами не выявлено (таблица 45). 150 Таблица 45 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием верапамила Вре- Диаметр, мкм Объем, мкм3 Площадь поверхности, мкм2 мя, с 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 0,4% NaCl 0,9% NaCl 30 9,42±0,09 9,64±0,08 443,85±14,04 473,16±11,66 279,93±5,75 292,63±4,82 60 9,57±0,08 9,62±0,09 463,74±11,89 471,71±13,81 288,68±4,89 291,73±5,55 90 9,53±0,09 9,64±0,09 460,00±14,28 474,51±13,61 286,67±5,87 282,85±5,60 120 9,69±0,12 9,73±0,08 487,63±18,35 487,77±12,53 297,33±7,39 298,49±5,19 150 9,41±0,10 9,59±0,09 442,93±14,14 468,33±13,12 279,41±5,95 290,42±5,33 180 9,49±0,08* 9,80±0,09 453,59±11,82* 498,37±14,37 284,40±4,93* 302,62±5,73 210 9,72±0,09 9,58±0,09 487,00±14,68 465,63±12,65 297,88±5,89 289,28±5,29 240 9,45±0,09 9,60±0,10 44715±12,68 471,29±14,74 281,48±5,36 291,22±6,16 270 9,17±0,09* 9,49±0,09 411,06±13,65* 454,27±13,14 265,81±5,76* 284,48±5,41 300 9,56±0,08 9,51±0,09 461,78±11,59 457,85±15,05 287,87±4,85 285,65±6,13 330 9,23±0,08* 9,49±0,08 416,00±11,07* 452,49±11,47 268,37±4,85* 283,98±4,83 360 9,51±0,09 9,65±0,07 456,41±13,37 474,78±10,18 28,24±5,65 293,51±4,23 390 9,71±0,07 9,52±0,09 482,15±10,19 457,39±12,43 296,58±4,18 285,86±5,22 420 9,84±0,08* 9,55±0,09 504,53±12,69* 463,36±13,57 305,37±5,15* 288,13±5,71 450 9,75±0,09* 9,47±0,09 491,36±12,96* 451,52±13,52 299,91±5,34* 283,17±5,69 480 9,82±0,07* 9,42±0,09 498,73±10,74* 444,96±13,61 303,30±4,37* 280,34±5,79 510 9,55±0,08* 9,79±0,08 460,24±11,32* 497,03±12,79 287,24±4,78* 302,27±5,24 540 9,60±0,08 9,66±0,09 467,90±11,96 477,34±12,35 290,42±4,89 294,21±5,15 570 9,45±0,09* 9,91±0,09 447,19±12,8* 516,43±14,66 281,52±5,35* 309,89±5,84 600 9,48±0,09 9,52±0,09 451,72±12,79 458,68±14,57 283,44±5,32 286,04±6,01 900 9,78±0,11 9,57±0,09 499,67±17,87 465,36±13,94 302,48±7,06 288,98±5,72 1500 9,64±0,11 9,53±0,10 477,99±16,41 461,04±14,57 293,63±6,83 286,96±6,11 3600 9,24±0,08 9,38±0,09 417,67±11,51 437,82±12,87 269,08±4,90 277,43±5,53 * Достоверность различий значений в 0,4% растворе NaCl по сравнению со значениями в 0,9% NaCl по критерию Стьюдента (р<0,05). Показатель ЯЦО на протяжении почти всего времени инкубации в умеренно гипотонической среде был снижен (рисунок 44). усл. ед. 0,66 0,65 0,64 0,63 0,62 0,61 0,6 0,59 0,58 0,57 0,56 0,4% NaCl 0,9% NaCl с 30 90 150 210 270 330 390 450 510 570 900 3600 Рисунок 44 – ЯЦО лимфоцитов больных ХЛЛ под влиянием верапамила . 151 Достоверные различия значений ЯЦО между исследуемыми пробами наблюдали на 90 секунде (8,5%; р<0,05), 510 секунде (10%; р<0,05), 540 секунде (5%; р<0,05) и 570 секунде (6,5%; р<0,05). Под влиянием верапамила использование клеткой резервных структур плазмалеммы при снижении осмолярности среды наблюдали в интервалах с 30 по 120 секунды и во второй половине инкубации, начиная с 390 и по 480 секунды (рисунок 45). мкм-1 0,06 0,05 0,04 0,03 0,4 % NaCl 0,02 0,9 % NaCl 0,01 0 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 45 – Относительный мембранный резерв лимфоцитов больных ХЛЛ под влиянием верапамила. В изотонической среде использование мембранных резервов плазмалеммы увеличилось на 60 секунде – на 66% (р<0,05), 420 секунде – на 60% (р<0,05) по сравнению с гипотоническим раствором (см. рисунок 45). Под влиянием верапамила интенсивное использование мембранного резерва ядром как в гипо-, так и в изотонической средах наблюдали ближе к окончанию инкубации. В гипотонической среде ядро использовало внутриклеточные резервы на 390 и 450 секундах, а в изотоническом растворе – на 570 и 3600 секундах инкубации (рисунок 46). 152 мкм-1 0,035 0,03 0,025 0,02 0,4% NaCl 0,015 0,9% NaCl 0,01 0,005 0 30 120 210 300 390 480 570 1500 с . Рисунок 46 – Относительный мембранный резерв ядер лимфоцитов больных ХЛЛ под влиянием верапамила. Таким образом, анализируя развитие осморегуляторных реакций лимфоцитов больных ХЛЛ в условиях блокады Са2+-сигнальных путей можно отметить асинхронность и разнонаправленность реакций ядра и клетки в целом. Клетка начинала увеличиваться в размерах на 90 секунде, затем следовал период уменьшения ее объема в течение 240 секунд, который вновь сменялся фазой увеличения объема с 390 по 540 секунды инкубации. Ядро в гипотонической среде уменьшалось в размерах в течение первых 330 секунд, и лишь начиная с 420 и по 570 секунды – ее размеры увеличивались, задействовав внутриклеточные мембранные резервы в процессах регуляции объема. Длительность периодов увеличения размеров ядра и клетки были одинаковы и составили 150 секунд, но реакция уменьшения объема ядра развивалась на 300 секунд позже, чем у клетки в целом. 153 2.2.4.7 Относительный мембранный резерв, используемый лимфоцитами больных ХЛЛ в условиях активации и блокады кальциевых каналов В условиях активации и блокады Са2+ сигнальных путей морфометрические параметры лимфоцитов больных ХХЛЛ увеличивались на протяжении всего времени инкубации в гипотонической среде (таблица 46). Таблица 46 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием Са2+ и верапамила в гипотонической среде ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 30 10,53±0,09 12,22±0,10* 12,59±0,11* 618,11±16,77 964,75±15,07 1055,84±28,10 60 9,71±0,09 12,08±0,09* 12,69±0,11* 486,46±14,87 931,53±12,87 1082,32±26,77 90 9,42±0,09 12,12±0,10* 12,50±0,13* 442,86±12,96 942,45±14,16 1039,27±34,48 120 9,53±0,07 12,30±0,11* 12,60±0,13* 457,02±10,37 986,00±17,23 1063,34±33,55 150 9,38±0,09 11,99±0,09* 12,49±0,12* 438,87±13,40 911,65±12,79 1035,16±32,13 180 9,47±0,09 11,96±0,11* 12,46±0,09* 450,58±12,56 906,34±14,17 1020,29±23,77 210 9,73±0,08 12,11±0,09* 12,37±0,09* 487,89±12,68 938,17±12,95 998,18±12,99 240 9,47±0,09 11,97±0,09* 12,48±0,11* 450,26±12,61 905,83±13,23 1027,33±25,83 270 9,55±0,10 12,01±0,11* 12,28±0,11* 464,44±15,16 918,0±15,28 980,09±25,60 300 9,55±0,07 12,15±0,12* 12,46±0,11* 460,75±11,10 952,26±17,47 1024,09±27,97 330 9,21±0,07 11,81±0,09* 12,10±0,10* 412,30±8,90 871,11±12,07 937,50±24,85 360 9,22±0,09 11,96±0,12* 12,14±0,10* 417,04±13,27 907,23±16,51 946,29±23,62 390 9,23±0,07 12,05±0,12* 12,87±0,09* 415,08±9,49 928,85±18,49 1124,28±25,10 420 9,43±0,07 12,15±0,11* 12,83±0,11* 442,99±9,81 948,85±16,31 1118,00±29,03 450 9,41±0,06 12,13±0,13* 12,88±0,11* 438,16±7,89 948,22±13,37 1129,71±30,17 480 9,25±0,08 11,99±0,12* 12,63±0,09* 418,81±10,71 915,88±16,85 1063,65±23,78 510 8,92±0,07 12,57±0,11* 12,46±0,12* 374,44±9,06 1052,55±29,05 1025,53±28,83 540 8,11±0,07 12,16±0,12* 12,44±0,10* 282,43±6,99 95,78±19,00 1017,025±26,85 570 9,06±0,06 11,87±0,16* 12,21±0,09* 391,59±8,02 899,05±17,46 961,09±23,35 600 9,06±0,07 11,96±0,11* 12,51±0,09* 392,78±9,19 907,60±16,12 1034,78±25,09 900 9,52±0,07 11,49±0,15* 12,49±0,13* 456,30±10,74 816,32±11,54 1036,93±33,91 1500 8,62±0,06 11,61±0,12* 12,40±0,13* 337,77±7,53 831,55±15,11 1015,12±31,63 3600 7,94±0,07 11,48±0,14* 11,94±0,09* 264,86±7,11 809,09±19,34 899,04±21,11 * Достоверность различий значений после воздействия Са2+/верапамила по сравнению с результатами измерений в гипотонической среде (контроль) по критерию Стьюдента (р<0,05). Под влиянием верапамила увеличение размеров клеток в гипотонической среде было более выражено по сравнению с кальциевой нагрузкой. На 30 секунде инкубации объем и диаметр лимфоцитов, проинкубированных с верапамилом, возросли, соответственно на 71% и 19,5% (р<0,05), по сравнению с контролем. В этот же период, в пробах с Са2+ объем и диаметр клеток увеличились на 56% и 154 16% (р<0,05). Наиболее выраженное увеличение размеров клеток отмечали на 360 секунде: объем и диаметр возросли на 117% и 30% (р<0,05) в пробах с Са2+нагрузкой, и на 127% и 32% (р<0,05) с верапамилом. К концу инкубации (3600 с) наблюдали максимальное увеличение размеров клеток, объем и диаметр увеличился на 205,5% и 44,5% (р<0,05) в пробах с кальцием и на 239,5% и 50% (р<0,05) с верапамилом по сравнению с контролем. Ядро клетки также увеличивалось в размерах, как в условиях активации, так и блокады Са2 сигнальных путей (таблица 47). Таблица 47 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием Са2+ и верапамила гипотоническом растворе ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 30 9,22±0,12 9,15±0,07 9,42±0,09 420,57±15,75 404,68±9,62 443,85±14,04 60 7,72±0,09 9,19±008* 9,57±0,08* 246,14±8,28 410,55±10,56 463,74±11,89 90 7,82±0,07 9,29±0,08* 9,53±0,09* 252,94±6,55 424,47±10,98 460,00±14,28 120 8,65±0,09 9,31±0,08* 9,69±0,12* 345,03±10,72 426,25±10,57 487,63±18,35 150 7,66±0,08 9,02±0,09* 9,41±0,10* 239,08±7,41 391,29±12,65 442,93±14,14 180 7,66±0,08 9,29±0,09* 9,49±0,08* 239,36±8,08 425,12±12,68 453,59±11,82 210 7,72±0,08 9,27±0,09* 9,72±0,09** 244,41±7,42 424,39±13,38 487,00±14,68 240 7,56±0,08 9,29±0,08* 9,45±0,09* 229,99±7,75 425,22±11,85 44715±12,68 270 7,48±0,08 9,48±0,10* 9,17±0,09* 222,95±7,06 454,08±15,68 411,06±13,65 300 7,61±0,07 9,25±008* 9,56±0,08* 233,22±6,58 419,33±11,44 461,78±11,59 330 7,65±0,06 8,85±0,10* 9,23±0,08* 236,75±5,65 370,43±13,34 416,00±11,07 360 7,66±0,08 9,21±0,10* 9,51±0,09* 239,29±7,86 416,41±14,94 456,41±13,37 390 7,64±0,07 9,08±0,08* 9,71±0,07* 236,44±6,74 396,67±11,32 482,15±10,19 420 7,61±0,07 8,87±,09* 9,84±0,08* 233,99±7,07 371,54±12,71 504,53±12,69 450 9,28±0,07 9,43±0,11 9,75±0,09* 421,11±8,88 446,49±14,87 491,36±12,96 480 8,58±0,07 9,12±0,10* 9,82±0,07* 333,75±8,63 404,43±14,18 498,73±10,74 510 7,72±0,06 9,00±0,12* 9,55±0,08* 242,40±5,12 392,08±15,27 460,24±11,32 540 7,53±0,05 8,49±0,16* 9,60±0,08* 224,59±4,58 336,78±17,85 467,90±11,96 570 7,70±0,06 8,49±0,13* 9,45±0,09* 241,82±5,61 331,58±14,89 447,19±12,8 600 7,63±0,06 8,79±0,15* 9,48±0,09* 235,17±5,91 369,91±19,28 451,72±12,79 900 7,64±0,07 9,06±0,13* 9,78±0,11* 236,02±6,54 401,45±17,95 499,67±17,87 1500 7,31±0,07 8,94±0,09* 9,64±0,11* 207,59±6,44 379,63±11,96 477,99±16,41 3600 6,74±0,07 9,03±0,11* 9,24±0,08* 162,73±4,62 393,77±15,08 417,67±11,51 * 2+ Достоверность различий значений после воздействия Са /верапамила по сравнению с результатами измерений в гипотонической среде (контроль) по критерию Стьюдента (р<0,05). В гипотонической среде под влиянием верапамила увеличение объема ядра было более выражено. На 60 секунде диаметр и объема ядра увеличились на 24 и 87% (р<0,05), в пробах, проинкубированных с верапамилом, и на 19% и 67% 155 (р<0,05) – с Са2+. В последующие секунды инкубации выявленная тенденция сохранялась, и к концу на 3600 секунде диаметр и объем ядра увеличился на 37% и 157% (р<0,05) под влиянием верапамила, и34% и 142% (р<0,05) под влиянием Са2+. Несмотря на установленную реакцию увеличения объема клеток и их ядер при снижении осмолярности среды после активации и блокады Са2+-каналов, значения коэффициента осмотического натяжения мембран клетки изменялись циклически (таблица 48). Таблица 48 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы лимфоцитов больных ХЛЛ под влиянием кальция и верапамила ВреПлазмалемма, усл. ед. Кариолемма, усл. ед. 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 30 1,13±0,03 1,04±0,02* 0,99±0,02* 1,50±0,06 1,03±0,02* 0,97±0,03* 60 1,12±0,03 0,97±0,02* 0,99±0,02* 1,08±0,04 1,07±0,02 1,00±0,02* 90 1,09±0,03 1,02±0,02 1,07±0,03 1,14±0,03 1,12±0,03 0,99±0,03* 120 1,02±0,03 1,08±0,03 1,04±0,04 1,39±0,04 1,11±0,02* 1,00±0,03* 150 1,00±0,03 1,02±0,02 1,05±0,03 1,11±0,03 1,02±0,03* 0,98±0,03* 180 1,06±0,03 1,01±0,02 0,99±0,02* 1,07±0,03 1,08±0,03 0,95±0,02 210 1,09±0,03 1,05±0,02 1,01±0,02* 1,09±0,03 1,07±0,03 1,04±0,02 240 1,08±0,03 1,00±0,02* 1,03±0,03 0,97±0,03 1,11±0,03* 0,98±0,02 270 1,55±0,05 1,00±0,02* 0,97±0,02* 0,97±0,03 1,14±0,03* 0,94±0,02 300 1,14±0,02 1,03±0,02* 1,03±0,03* 0,98±0,03 1,03±0,03 1,03±0,03 330 0,91±0,02 1,02±0,03 0,98±0,03 0,97±0,03 0,98±0,03 0,96±0,02 360 0,98±0,03 1,04±0,02 0,98±0,03 1,00±0,03 1,09±0,03 0,98±0,02 390 0,93±0,03 1,07±0,03* 1,10±0,03* 1,11±0,03 1,07±0,03* 1,06±0,03* 420 1,07±0,02 1,08±0,02 1,12±0,03 1,07±0,04 0,96±0,03* 1,08±0,03 450 1,08±0,02 0,98±0,02* 1,11±0,02 1,66±0,05 1,05±0,03* 1,08±0,03* 480 1,06±0,04 1,00±0,02 1,07±0,02 1,49±0,04 0,97±0,02* 1,10±0,03* 510 0,94±0,03 1,11±0,02* 1,06±0,03* 1,20±0,04 0,98±0,03* 0,96±0,03* 540 0,79±0,02 1,07±0,03* 1,07±0,03* 1,02±0,02 0,91±0,04* 1,00±0,03 570 0,94±0,02 1,06±0,03* 0,98±0,02 1,11±0,04 0,91±0,04* 0,93±0,03* 600 0,96±0,02 0,99±0,03 1,05±0,02* 1,08±0,04 0,98±0,04* 1,01±0,03 900 0,97±0,03 0,91±0,03 1,06±0,02* 1,05±0,03 0,96±0,04* 1,06±0,03 1500 0,87±0,02 0,86±0,02 1,05±0,03* 0,96±0,03 0,91±0,03 1,03±0,03* 3600 0,88±0,03 0,82±0,02 0,99±0,02* 0,99±0,03 0,82±0,02* 0,99±0,03 * Достоверность различий значений после воздействия Са2+/верапамила по сравнению с результатами с контролем по критерию Стьюдента (р<0,05). В течение первой минуты инкубации значения коэффициента осмотического натяжения плазмалеммы как после активации, так и после блокады Са2+каналов снизились соответственно на 30 секунде – на 8,6% и 14% (р<0,05), 60 секунде – на 13% и 15,4% (р<0,05) по сравнению с контролем. Затем наблюдали временной интервал, в течение которого значения коэффициента осмотического 156 натяжения в исследуемых группах были практически сходны с контрольными. При этом длительность равновесного интервала под влиянием кальциевой нагрузки составила 120 секунд (с 90 по 210 секунды), а под влиянием верапамила – 60 секунд (с 90 по 150 секунды). В последующие секунды инкубации наблюдали снижение коэффициента осмотического натяжения плазмалеммы: в пробах с Са2+ в интервале со 240 по 300 секунды, с верапамилом – 180 по 300 секунды. На 300 секунде отмечали одинаковые значения коэффициента в условиях активации и блокады Са2+-каналов, которые были ниже относительно контроля на 10% (р<0,05). Затем следовал 60-ти секундный интервал равновесного состояния, при этом значения между исследуемыми пробами практически не различались. На 390 секунде происходило возрастание коэффициента осмотического натяжения плазмалеммы на 18% (р<0,05) после кальциевой нагрузки и 15% (р<0,05) под влиянием верапамила. Начиная с 510 секунды и до конца инкубации значения коэффициента осмотического натяжения мембраны увеличились как в пробах с Са 2+, так и с верапамилом. Общей тенденцией в изменении значений коэффициента осмотического натяжения в условиях активации и блокады Са2+-каналов является его снижение в первые 300 секунд инкубации в гипотоническом растворе, несмотря на то, что клетка в этот момент увеличивается в размерах. При этом выявлена обратная зависимость, чем сильнее набухает клетка, тем больше выражено уменьшение коэффициента осмотического натяжения. Коэффициент осмотического натяжения кариолеммы при инкубации в среде со сниженной осмолярностью был снижен под влиянием Са2+ нагрузки в течение первых 150 секунд инкубации, верапамила – 180 секунд. Наиболее выраженную реакцию кариолеммы наблюдали в первые 30 секунд инкубации, когда уменьшение коэффициента после активации и блокады Са2+-каналов составляло соответственно 45,6% и 54,6% (р<0,05) по сравнению с контролем. Увеличение коэффициента осмотического натяжения кариолеммы после Са2+-нагрузки установлено на 240 и 270 секундах инкубации на 14% и 21% (р<0,05), при этом в пробах, проинкубированных с верапамилом в этот период изменений в натяжении кариолеммы по сравнению с контролем не выявлено. Начиная с 390 секунды и до конца 157 инкубации, значения коэффициента осмотического натяжения кариолеммы были снижены. Анализируя участие плазмалеммы и кариолеммы в развитии осморегуляторных реакций, приходим к выводу о существовании механизмов внутриклеточной координации, регулирующих степень натяжения плазмалеммы и кариолеммы в гипотонической среде. Так на 300 секунде инкубации в клетке устанавливается равновесие, значения коэффициентов осмотического натяжения плазмалеммы и кариолеммы как под влиянием кальция, так и верапамила, значения составили 1,03±0,03 усл. ед. Затем, начиная с 390 секунды, реакции мембран были разнонаправлены: коэффициент осмотического натяжения плазмалеммы увеличился, а кариолеммы снизился по отношению к контролю. Показатель ЯЦО в контроле был достоверно выше практически на протяжении всего времени инкубации (рисунок 47). усл. ед. 0,95 0,85 контроль 0,75 кальций 0,65 верапамил 0,55 0,45 30 90 150 210 270 330 390 450 510 570 900 3600 с . Рисунок 47 – ЯЦО лимфоцитов больных ХЛЛ, под влиянием кальция и верапамила в гипотонической среде В течение первых 210 секунд изменения ЯЦО в пробах проинкубированных как с кальцием, так и с верапамилом, были одинаковы: на 30 секунде показатель ЯЦО уменьшился на 36,8%, 120 секунде – 36%, 150 секунде – 17% (р<0,05). В интервале с 240 по 420 секунды достоверных различий между исследуемыми группами не выявлено. В промежутке времени с 450 по 900 секунды отмечали снижение ЯЦО как под влиянием Са2+, так и верапамила. Показатель ЯЦО на 450 секун- 158 де инкубации, в пробах с Са2+ уменьшился на 56% (р<0,05), а в пробах с верапамилом – на 67% (р<0,05) по сравнению с контролем. На 540 секунде показатель ЯЦО после кальциевой нагрузки снизился на 69% (р<0,05), а после воздействия верапамила – на 41% (р<0,05). Более выраженное сокращение площади поверхности ядра по отношению к площади поверхности цитоплазмы под влиянием ионов Са2+ к концу инкубации свидетельствует о развитии дисрегуляторных реакций в клетке. Под влиянием кальциевой нагрузки наблюдали интенсивное использование лимфоцитами и ядрами мембранных резервных бассейнов. Вовлечение в регуляцию объема бассейнов плазмалеммы (≈7,8%) под влиянием кальциевой нагрузки наиболее интенсивно протекало в течение первых 120 секунд инкубации, причем максимальное использование внутриклеточных резервов (≈5%) ядром наблюдали на 270 секунде (рисунок 48). мкм-1 0,045 0,04 0,035 кальций клетка 0,03 кальций ядро 0,025 0,02 верапамил клетка 0,015 верапамил ядро 0,01 0,005 0 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 48 – Относительный мембранный резерв ядер и лимфоцитов больных ХЛЛ под влиянием кальция и верапамила в гипотонической среде Сравнивая использование мембранного резерва ядром и клеткой в гипотонической среде под влиянием кальция и верапамила видно, что внутриклеточные мембранные резервные были задействованы в меньшей степени по сравнению с поверхностными структурами плазмалеммы. Таким образом, в лимфоцитах больных ХЛЛ, проинкубированных с Са 2+ и верапамилом, помещенных в гипотоническую среду, наблюдали увеличение ис- 159 пользования мембранного резерва ядром и клеткой. Установлен циклический характер в использовании дополнительных резервных структур мембранами. Интенсивное увеличение объема клеток реализовалось в течение 330 секунд, в то время как их ядер – 270 секунд. Следовательно, лимфоцитам больных ХЛЛ свойственна асинхронность по времени (60 секунд) в развитии осморегуляторных реакций на уровне плазмалеммы и кариолеммы. 2.2.4.8 Сравнительный анализ регуляции объема лимфоцитов больных ХЛЛ в изотонической среде в условиях активации и блокады Са2+-каналов В изотонической среде морфометрические параметры лимфоцитов, проинкубированных с Са2+ и верапамилом возросли в течение часовой инкубации (таблица 49). Таблица 49 – Морфометрические параметры лимфоцитов больных ХЛЛ под влиянием Са2+ и верапамила в изотоническом растворе Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 контроль 9,98±0,10 9,23±0,09 9,15±0,11 9,49±0,09 9,43±0,09 9,27±0,08 9,39±0,09 9,23±0,09 9,31±0,08 8,98±0,09 9,71±0,09 9,47±0,11 9,66±0,09 9,17±0,09 9,07±0,07 9,13±0,13 Диаметр, мкм Са2+ верапамил 12,05±0,09* 12,72±0,09* 12,33±0,09* 12,86±0,12* 12,09±0,09* 12,13±0,09* 11,95±0,09* 12,53±0,12* 11,96±0,11* 12,25±0,09* 11,94±0,08* 12,52±0,10* 11,89±0,09* 12,37±0,11* 12,04±0,11* 12,38±0,12* 12,07±0,11* 12,50±0,09* 12,04±0,10* 12,36±0,13* 11,79±0,11* 12,32±0,11* 11,79±0,11* 12,42±0,11* 11,71±0,10* 12,34±0,11* 11,75±0,10* 12,21±0,11* 12,30±0,09* 12,29±0,11* 12,04±0,11* 12,27±0,09* контроль 529,38±17,35 418,13±12,54 408,82±15,12 452,74±12,48 444,58±11,62 420,51±10,56 440,52±13,75 417,98±12,68 426,45±11,01 385,96±12,93 485,89±13,83 450,05±16,11 479,23±14,4 409,20±11,83 394,62±9,58 409,75±16,39 Объем, мкм3 Са2+ 926,12±12,51* 990,43±14,09* 934,07±23,30* 901,85±11,56* 905,91±15,03* 899,39±19,67* 887,68±12,47* 927,15±17,63* 932,97±16,99* 922,84±14,45* 868,03±13,63* 869,95±14,64* 849,01±11,79* 859,52±12,78* 982,50±12,93* 924,39±15,44* верапамил 1085,77±25,75* 1125,92±28,91* 942,85±23,38* 1044,24±30,14* 969,59±22,61* 1036,89±24,57* 1001,93±26,52* 1005,97±28,97* 1031,76±24,70* 1002,86±30,26* 990,87±26,47* 1014,74±26,12* 994,72±16,00** 965,87±26,99* 983,58±25,87* 975,77±22,09* 160 Продолжение таблицы 49 ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 510 9,32±0,10 11,98±0,07* 12,17±0,11* 430,50±13,98 905,26±16,97* 954,54±25,02* 540 9,24±0,12 11,82±0,09* 12,11±0,09* 423,83±18,06 874,78±11,35* 939,91±23,12* 570 9,39±0,11 11,65±0,08* 12,36±0,09* 442,04±16,14 835,00±17,55* 996,02±21,68* 600 9,32±0,10 12,15±0,16* 12,26±0,09* 430,78±14,59 961,33±16,43* 973,03±23,66* 900 9,77±0,12 12,18±0,13* 12,21±0,11* 499,33±18,58 963,14±12,52* 964,39±27,71* 1500 9,29±0,09 12,54±0,08* 12,23±0,11* 427,50±13,74 1040,39±22,26* 968,48±26,37* 3600 8,55±0,08 12,89±0,11* 12,00±0,09* 331,47±8,92 1133,62±29,90* 913,02±21,42* * Достоверность различий значений после воздействия Са2+/верапамила по сравнению с результатами измерений в изотонической среде (контроль) по критерию Стьюдента (р<0,05). Увеличение размеров клеток наблюдали в течение первой минуты воздействия: объем и диаметр лимфоцитов возросли на 33,5% и 137% (р<0,05) в пробах с Са2+, 39% и 169% (р<0,05) – с верапамилом. К концу инкубации диаметр и объем лимфоцитов увеличился на 51% и 242% (р<0,05) в пробах с Са2+, на 40% и 175% (р<0,05) с верапамилом. В течение всего времени инкубации в изотонической среде, наблюдали увеличение размеров ядра клеток, проинкубированных с Са2+ и верапамилом. Реакции увеличения объема ядра под влиянием кальциевой нагрузки и верапамила наблюдали в первые 30 секунд инкубации: диаметр и объем возросли на 18,7% и 65,5% (р<0,05), под влиянием верапамила – на 26% и 59% (р<0,05) по сравнению с контролем (таблица 50). Таблица 50 – Морфометрические параметры ядер лимфоцитов больных ХЛЛ под влиянием Са2+ и верапамила в изотонической среде Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 контроль 7,64±0,09 7,56±0,10 7,27±0,16 7,37±0,08 7,38±0,10 7,49±0,07 7,46±0,08 7,77±0,08 7,73±0,09 7,47±0,08 7,87±0,11 7,74±0,09 7,32±0,08 7,44±0,10 7,29±0,09 7,11±0,09 Диаметр, мкм Са2+ 9,07±0,08* 8,95±0,07* 8,85±0,08* 8,89±0,09* 8,99±0,09* 9,02±0,09* 9,02±0,08* 8,88±0,09* 8,96±0,07* 9,18±0,09* 9,04±0,09* 8,86±0,07* 8,85±0,08* 9,13±0,08* 9,26±0,08* 9,32±0,08* верапамил 9,64±0,08* 9,62±0,09* 9,64±0,09* 9,73±0,08* 9,59±0,09* 9,80±0,09* 9,58±0,09* 9,60±0,10* 9,49±0,09* 9,51±0,09* 9,49±0,08* 9,65±0,07* 9,52±0,09* 9,55±0,09* 9,47±0,09* 9,42±0,09* контроль 238,81±8,74 232,59±9,37 212,16±8,29 212,73±6,49 215,67±8,86 223,05±6,65 221,48±7,31 249,93±8,17 247,20±8,90 245,95±7,13 263,37±10,98 247,99±9,22 209,57±7,17 221,62±8,66 208,35±7,66 192,76±7,27 Объем, мкм3 Са2+ 395,40±10,60* 380,53±10,02* 367,44±10,58* 373,72±10,99* 386,32±11,66* 391,89±12,69* 389,41±10,97* 371,46±10,85* 379,79±9,51* 410,98±11,52* 392,45±11,99* 367,89±9,34* 366,96±10,36* 403,37±10,51* 420,14±11,15* 428,59±11,16* верапамил 473,16±11,66* 471,71±13,81* 474,51±13,61* 487,77±12,53* 468,33±13,12* 498,37±14,37* 465,63±12,65* 471,29±14,74* 454,27±13,14* 457,85±15,05* 452,49±11,47* 474,78±10,18* 457,39±12,43* 463,36±13,57* 451,52±13,52* 444,96±13,61* 161 Продолжение таблицы 50 ВреДиаметр, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 510 7,17±0,10 9,19±0,08* 9,79±0,08* 198,59±8,26 410,53±10,63* 497,03±12,79* 540 7,49±0,07 9,09±0,09* 9,66±0,09* 222,36±6,34 398,98±11,43* 477,34±12,35* 570 7,49±0,12 9,08±0,13* 9,91±0,09* 228,50±10,99 404,06±16,75* 516,43±14,66* 600 7,49±0,11 9,01±0,12* 9,52±0,09* 227,52±9,71 392,96±15,93* 458,68±14,57* 900 7,54±0,09 9,41±0,12* 9,57±0,09* 229,82±8,57 445,47±17,03* 465,36±13,94* 1500 7,57±0,09 9,44±0,10* 9,53±0,10* 232,14±8,72 447,44±14,57* 461,04±14,57* 3600 6,87±0,07 10,07±0,09* 9,38±0,09* 172,64±5,62 541,87±14,97* 437,82±12,87* * Достоверность различий значений после воздействия Са2+/верапамила по сравнению с результатами измерений в изотонической среде (контроль) по критерию Стьюдента (р<0,05). На 180 секунде в пробах, обработанных верапамилом, увеличение объема ядра было более интенсивным, диаметр и объем возросли соответственно на 31% и 123% (р<0,05), в то время как под влиянием кальциевой нагрузки - на 20% и 76% (р<0,05). Максимальное возрастание размеров ядра наблюдали к окончанию инкубации: на 3600 секунде диаметр и объем ядра увеличились на 46,5% и 214% (р<0,05) под влиянием кальциевой нагрузки, и на 36,5% и 154% (р<0,05) под влиянием верапамила. Показатель ЯЦО на протяжении всего времени инкубации в опытных группах проб был снижен по сравнению с контролем (рисунок 49). усл. ед 0,8 0,75 0,7 контроль 0,65 кальций верапамил 0,6 0,55 0,5 30 90 150 210 270 330 390 450 510 570 900 3600 с . Рисунок 49 – ЯЦО лимфоцитов больных ХЛЛ под влиянием Са2+ и верапамила в изотонической среде 162 Достоверное снижение показателя ЯЦО под влиянием Са2+ и верапамила наблюдали на 60 секунде инкубации соответственно на 28% и 19% (р<0,05) по сравнению с контролем. Начиная с 510 секунды и до конца инкубации 3600 секунда, достоверных различий в значениях ЯЦО между анализируемыми группами не выявлено. В ходе инкубации лимфоцитов в изотоническом растворе использование мембранного резерва клетками увеличилось, как под влиянием Са2+, так и верапамила. В условиях кальциевой нагрузки наблюдали более выраженное использование клетками резервов плазмалеммы (≈7,8%) на 60 секунде инкубации. Под влиянием верапамила максимальное использование клеткой резервов плазмалеммы (≈2%) так же отмечалось на 60 секунде воздействия (рисунок 50). мкм-1 0,045 0,04 0,035 кальций клетки 0,03 кальций ядра 0,025 верапамил клетки 0,02 верапамил ядра 0,015 0,01 0,005 0 30 60 90 120 150 180 210 240 270 300 330 360 с Рисунок 50 – Относительный мембранный резерв ядра и лимфоцитов больных ХЛЛ под влиянием Са2+ и верапамила в изотонической среде Ядро лимфоцитов в изотонической среде практически не использовало внутриклеточные мембранные структуры в реакциях осморегуляции. Таким образом, в изотонической среде лимфоциты, больных ХЛЛ, интенсивно использовали дополнительные мембранные структуры поверхностного бассейна плазмалеммы. Причем более выраженная реакция протекала на уровне клетки, ядро не участвовало в осморегуляторных реакциях. 163 2.3. Цитоархитектоника лимфоцитов здоровых доноров и больных ХЛЛ в условиях гипоосмотической и функциональных нагрузок (in vitro) 2.3.1 Рельеф поверхности лимфоцитов доноров в условиях гипоосмотической нагрузки Структурные перестройки в рельефе мембран лимфоцитов, возникающие под влиянием гипо- и изотонических нагрузок, визуализировали на небольших участках поверхности, площадью 12,25 мкм2 в режиме полуконтактного АСМсканирования. В условиях гипоосмотической нагрузки установлено изменение числа глобулярных выступов и углублений в мембране в интервале 30-60 секунды инкубации (рисунок 51 1а – 1в). 1а 1б 2а 2б 164 1в 1г 2в 2г 1д 2д 1е 2е 165 1ж 2ж 1з 2з Рисунок 51 – Рельеф поверхности лимфоцитов доноров в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з - 900 секундах инкубации В изотоническом растворе в этот период существенных изменений не произошло (рисунок 51 2а-2в). На 120 секунде инкубации в гипотонической среде на поверхности мембран преобладали углубления (рисунок 51 1г), а в изотоническом растворе глобулярные выступы объединились и образовали конгломераты (рисунок 51 2г). На 150 секунде инкубации в гипотонической среде на мембране лимфоцитов появились небольшие структурные выросты, которые сохранились до конца инкубации, при этом высота их снизилась, в результате чего рельеф поверхности был сглажен (рисунок 51 1д-1з). В изотоническом растворе на 150 секунде наблюдали ярко выраженную шероховатость поверхности за счет большого количества мелких глобулярных выступов, в дальнейшем их количество уменьшилось. К окончанию инкубации в рельеф поверхности наблюдали шероховатость (рисунок 51 2д-2з). 166 На 30 секунде инкубации количество глобулярных выступов снизилось на 44% (р<0,05), а их размеры возросли на 37,5% (р<0,05) по сравнению с изотоническим раствором (таблица 51). Таблица 51 – Размеры и количество глобулярных выступов на поверхности лимфоцитов доноров Время инкуГипотонический раствор Изотонический раствор бации, с высота, нм количество высота, нм количество 30 35,82±2,45* 47±1,2* 22,39±1,90 84±2,9 60 20,58±1,08* 130±3,1* 36,39±4,05 22±0,4 90 20,45±1,61* 71±2,5* 82,67±7,16 34±1,9 120 21,08±2,75* 48±0,9 44,36±4,48 49±1,0 150 41,70±3,31 32±1,4* 38,27±2,70 154±5,2 180 27,86±2,09* 61±2,8* 46,17±5,27 25±1,3 300 28,92±1,76* 71±3,7* 50,05±6,59 32±4,6 900 24,28±2,06 76±3,1* 29,25±4,96 23±1,7 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 60 секунде воздействия количество глобулярных выступов на поверхности мембраны лимфоцитов, помещенных в гипотонический раствор, увеличилось на 83% (р<0,05), при этом их высота снизилась на 43% (р<0,05) по сравнению с изотоническим раствором. В последующие 60 секунд инкубации в гипотоническом растворе сохранилась выявленная тенденция к увеличению числа глобулярных выступов при уменьшении их высоты. На 150 секунде достоверных различий в размерах выступов не обнаружено, но их количество уменьшилось на 79% (р<0,05) по сравнению с изотоническим раствором. Начиная со 180 секунды и до конца воздействия (900 секунда) наблюдали увеличение количества глобулярных выступов на фоне снижения их высоты. На 30 секунде инкубации в гипотонической среде количество углублений на участке мембраны уменьшилось на 65,4% (р<0,05), при этом диаметр углублений увеличился на 47% (р<0,05), а их глубина была в пределах не достоверных различий с изотоническим раствором (таблица 52). 167 Таблица 52 – Габаритные размеры углублений в мембране и их количество на поверхности лимфоцитов доноров Время инкубации, с Гипотонический раствор Изотонический раствор диаметр, глубина, количе- диаметр, глубина, количенм нм ство нм нм ство 30 428,0±72,1* 24,2±3,3 18±0,6* 225,8±15,5 21,3±2,3 52±1,3 60 301,8±11,4* 18,7±0,7* 117±1,4* 137,4±17,9 8,0±0,5 8±0,4 90 145,7±7,3* 10,6±0,6* 49±0,9* 177,5±13,1 22,2±3,7 4±0,1 120 173,6±3,7* 14,1±0,6 33±0,7* 155,1±14,3 15,7±3,7 10±0,9 150 209,3±1,9* 27,7±4,6* 7±0,2* 126,5±7,6 11,9±1,8 20±1,1 180 149,4±1,7* 7,5±0,9 16±0,5* 94,4±6,1 12,0±2,9 5±0,3 300 189,1±1,6* 15,1±1,7 7±0,1* 141,2±6,2 17,8±2,0 4±0,1 900 266,6±1,6* 21,5±1,7* 42±1,6* 93,2±8,0 6,08±1,1 5±0,7 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. Выраженные изменения цитоархитектоники поверхности лимфоцитов произошли на 60 секунде инкубации в гипотонической среде. В этот период увеличилось количество углублений в мембране (на 136%; р<0,05) и их габаритные размеры: диаметр – на 119,6% (р<0,05), глубина – на 133% (р<0,05) по сравнению с изотоническим раствором. На 90 секунде инкубации диаметр и глубина углублений в мембране уменьшились соответственно на 18% и 52% (р<0,05), но их количество превысило аналогичные значения в изотонической среде на 112% (р<0,05). Начиная со 120 секунды и до конца инкубации (900 секунда) габаритные размеры углублений в мембране увеличились в условиях снижения осмолярности среды, при этом их количество возросло к 120 секунде – на 230% (р<0,05), а к 150 секунде снизилось – на 65% (р<0,05). Начиная со 180 секунды, наблюдали увеличение количества углублений в мембране, и к 900 секунде оно превысило показатели изотонического раствора на 740% (р<0,05). Изменения цитоархитектоники поверхности наиболее интенсивно произошли в течение первых 60-ти секунд инкубации в гипотонической среде (рисунок 52). 168 160 140 120 100 80 выступы 60 углубления 40 20 0 30 60 90 120 150 180 300 900 с Рисунок 52 – Изменение количества глобулярных выступов и углублений в мембране лимфоцитов доноров в гипотонической среде Установлена корреляционная зависимость между изменением количества углублений в мембране и числом глобулярных выступов (r=0,88) при снижении осмолярности среды. В изотоническом растворе не установлено ярко выраженных структурных преобразований поверхности мембран (рисунок 53). 180 160 140 120 100 80 60 40 20 0 выступы углубления 30 60 90 120 150 180 300 900 с Рисунок 53 – Изменение количества глобулярных выступов и углублений в мембране лимфоцитов доноров в изотонической среде Число глобулярных выступов возросло на 30 и 150 секундах инкубации, а количество углублений уменьшилось, начиная с 60 секунды и до окончания инкубации. Тесных корреляционных связей между изменением числа глобулярных выступов и углублений в мембране не выявлено (r=0,55). 169 2.3.2 Рельеф поверхности лимфоцитов больных ХЛЛ в условиях гипоосмотической нагрузки На 30 секунде инкубации рельеф поверхности лимфоцитов больных ХЛЛ как в гипо- (рисунок 54 1а), так и в изотонической средах (рисунок 54 2а), был сглажен, глобулярные выступы присутствовали в незначительном количестве. 1а 2а 1б 2б 1в 2в 170 1г 1д 1е 1ж 2г 2д 2е 2ж 171 1з 2з Рисунок 54 – Рельеф поверхности лимфоцитов больных ХЛЛ в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з – 900 секундах инкубации Во временном интервале с 30 по 150 секунды в гипотонической среде произошло увеличение шероховатости клеточной поверхности (рисунок 54 1б-1д), при этом, начиная с 90 секунды инкубации, высота отдельных глобулярных выступов увеличивалась (рисунок 54 1в), в результате чего укрупнялись глобулы и появлялись кластеры (рисунок 54 1г, 1д). В изотоническом растворе аналогичная ситуация укрупнения глобулярных структур и дальнейшей кластеризации наблюдали во временном интервале со 120 по 180 секунды инкубации (рисунок 54 2г2е). На 180 секунде инкубации в гипотонической среде на поверхности были идентифицированы небольшие одиночные глобулы (рисунок 54 1е). На 300 секунде в гипотонической среде в мембране лимфоцитов появились крупные углубления (рисунок 54 1ж), в то время как в изотоническом растворе, на поверхности клеток присутствовали крупные глобулярные кластеры и незначительное количество мелких углублений (рисунок 54 2 ж). К окончанию воздействия (900 секунда), как в гипо- (рисунок 54 1з), так и в изотонической средах (рисунок 54 2з) на поверхности лимфоцитов присутствовали глобулярные образования. В течение первых 60 секунд инкубации высота глобулярных образований на поверхности мембраны увеличилась: на 30 секунде – на 97% (р<0,05), 60 секунде – на 57,5% (р<0,05) по сравнению с высотой выступов в изотоническом растворе. 172 При этом достоверных различий в количестве глобул между гипо- и изотонической средами не выявлено (таблица 53). Таблица 53 – Размеры и количество глобулярных выступов на поверхности лимфоцитов больных ХЛЛ Время ин- Гипотонический раствор Изотонический раствор кубации, с высота, ни количество высота, нм количество 30 51,47±5,62* 19±1,6 26,17±1,23 15±2,4 60 31,94±5,10* 23±1,8 20,28±2,03 17±2,1 90 23,63±1,28* 109±3,8* 31,89±1,52 20±2,3 120 26,24±3,33 41±2,6* 29,98±1,60 103±4,1 150 39,69±1,14* 38±1,3* 31,21±1,54 18±2,5 180 29,38±3,39 25±2,4 30,65±2,70 27±2,6 300 26,76±1,67* 21±2,1 48,44±3,80 23±2,1 900 71,81±5,65* 50±3,8 15,50±1,14 59±1,8 *- Статистически достоверные различия между значениями в гипо- и изотоническом растворе по критерию Стьюдента при р<0,05. На 90 секунде количество глобул возросло на 81,6% (р<0,05), а их высота снизилась на 26% (р<0,05) по сравнению с изотоническим раствором. На 120 секунде инкубации число глобулярных выступов уменьшилось на 60% (р<0,05), при этом высота их практически не отличалась от аналогичных значений в изотоническом растворе. На 150 секунде число глобул и их высота возросли соответственно на 52,6% и 21,3% (р<0,05) по сравнению с изотоническим раствором. На 300 секунде высота глобулярных выступов уменьшилась на 44,7% (р<0,05), а к окончанию воздействия на 900 секунде – увеличилась на 78,4% (р<0,05) по сравнению с изотоническим раствором. На 30 секунде инкубации в гипотонической среде на мембране лимфоцитов больных ХЛЛ количество углублений возросло на 80% (р<0,05), их диаметр и глубина увеличились соответственно на 34% и 117% (р<0,05) по сравнению с изотоническим раствором (таблица 54). Таблица 54 – Габаритные размеры углублений в мембране и их количество на поверхности лимфоцитов больных ХЛЛ Время инкубации, с 30 Гипотонический раствор диаметр, нм глубина, нм количество 116,52±6,10* 16,10±2,70* 18±2,3* Изотонический раствор диаметр, глубина, лоличество нм нм 86,80±5,80 7,41±0,32 10±1,8 173 Продолжение таблицы 54 Время Гипотонический раствор Изотонический раствор инкуба- диаметр, нм глубина, нм количе- диаметр, глубина, количество ции, с ство нм нм 60 85,67±9,76 8,76±0,43 9±0,7 85,00±3,21 8,66±0,44 10±1,8 90 147,83±6,70* 7,99±0,75 54±3,5* 89,30±7,93 7,83±0,11 10±1,9 120 106,41±9,12 9,18±0,98 17±1,2 93,35±7,73 6,28±0,80 17±1,3 150 125,57±7,44* 12,50±1,03* 14±1,0* 72,17±8,00 5,94±0,28 9±1,1 180 112,58±11,26* 11,37±1,33* 12±1,3* 77,02±4,73 3,87±0,37 38±2,6 300 113,00±9,08* 3,80±0,56 24±1,6* 86,00±1,20 4,14±0,65 5±0,8 900 99,63±1,43 10,30±1,07* 10±1,8* 86,21±2,97 2,54±0,27 19±2,6 *- Статистически достоверные различия между значениями в гипо- и изотоническом растворе по критерию Стьюдента при р<0,05. На 90 и 300 секундах в гипотонической среде число углублений в мембране лимфоцитов увеличилось соответственно на 81,5% и 79% (р<0,05) по сравнению с изотоническим раствором. Причем их диаметр возрос на 39,5% (на 90 секунде) и на 24%(р<0,05; на 300 с), а глубина не отличалась от значений, характерных для изоосмотической среды. На 150 секунде в гипотонической среде количество углублений в мембране, их диаметр и глубина увеличились соответственно на 35,7%, 35% и 110% (р<0,05) по сравнению с размерами структур в изотоническом растворе. На 180 секунде габаритные размеры углублений увеличились, но их количество снизилось на 68% (р<0,05) по сравнению с изотоническим раствором. К окончанию воздействия на 900 секунде число углублений в гипотонической среде снизилось на 47,4% (р<0,05), при этом их глубина возросла на 75% (р<0,05), а диаметр не отличался от значений, установленных для структур в изотоническом растворе. При снижении осмолярности среды существенные перестройки поверхности лимфоцитов больных ХЛЛ произошли на 90 секунде инкубации, когда увеличилось количество глобулярных выступов и углублений в мембране (рисунок 55). 174 140 120 100 80 60 выступы 40 углубления 20 0 30 60 90 120 150 180 300 900 с Рисунок 55 – Количество структурных образований на поверхности лимфоцитов больных ХЛЛ в гипотонической среде Выявлена положительная корреляционная связь между изменением количества глобулярных выступов и углублений в мембране (r=0,73) в гипотонической среде. В изотоническом растворе преобладали процессы перестройки глобулярного компонента мембран (рисунок 56). 120 100 80 выступы 60 углубления 40 20 0 30 60 90 120 150 180 300 900 с Рисунок 56 – Количество структурных образований на поверхности лимфоцитов больных ХЛЛ в изотонической среде Увеличение количества глобул наблюдали на 120 секунде. Число углублений в мембране возросло на 180 секунде инкубации. Корреляционных связей ме- 175 жду изменением числа глобулярных выступов и углублений в мембране в изотоническом растворе не выявлено (r=0,23). Таким образом, изменения цитоархитектоники лимфоцитов больных ХЛЛ при снижении осмолярности среды, протекали на 30 секунд быстрее по сравнению с изменениями в изоосмотической среде. 2.3.3 Рельеф поверхности лимфоцитов доноров под влиянием функциональных нагрузок 2.3.3.1 Особенности цитоархитектоники лимфоцитов доноров под влиянием адреналиновой нагрузки Под влиянием адреналиновой нагрузки в условиях гипоосмотического воздействия в течение первых 60 секунд инкубации лимфоцитов рельеф поверхности был сглажен (рисунок 57 1а, 1б) по сравнению с изотоническим раствором (рисунок 57 2а, 2б). На 90 и 120 секундах глобулярные образования на поверхности мембран укрупнились, в результате чего появились конгломераты, причем в гипотонической среде (рисунок 57 1в, 1г) эти процессы были более выражены по сравнению со структурными преобразованиями поверхности в изотоническом растворе (рисунок 57 2в, 2г). Начиная со 150 секунды и до конца инкубации, в гипотонической среде наблюдали уменьшение шероховатости поверхности, исчезновение глобул на мембране (рисунок 57 1д-1е), при этом в изотонической среде глобулярные конгломераты на поверхности клеток становились все крупнее по мере увеличение времени инкубации (рисунок 57 2д-2 е). 176 1а 1б 2а 2б 1в 2в 1г 2г 177 1д 2д 1е 2е 1ж 2ж 1з 2з Рисунок 57 – Рельеф поверхности лимфоцитов доноров под влиянием адреналиновой нагрузки в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з – 900 секундах инкубации 178 Количество глобулярных выступов на поверхности мембраны лимфоцитов снизилось в течение первых 90 секунд воздействия по сравнению с изотоническим раствором. На 30 секунде инкубации число глобулярных выступов уменьшилось на 70% (р<0,05), а их высота возросла на 45% (р<0,05) по сравнению с изотоническим раствором (таблица 55). Таблица 55 – Размеры и количество глобулярных выступов на поверхности лимфоцитов доноров под влиянием адреналиновой нагрузки Время инГипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 59,28±4,79* 51±2,6* 40,81±2,03 170±0,4 60 33,25±9,17* 11±3,1* 155,77±1,58 33±0,2 90 62,70±4,4 95±1,9* 75,64±4,84 254±1,4 120 41,05±1,37* 23±2,4* 84,18±9,29 48±1,8 150 40,47±3,85 55±1,8* 37,81±3,04 67±0,7 180 85,89±1,27* 57±1,3 33,31±2,86 62±2,8 300 62,65±9,9 27±1,7* 78,60±3,86 117±0,6 900 44,11±5,46* 19±0,8 72,81±1,21 18±0,8 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. К 60 секунде инкубации высота и общее количество глобул на поверхности клетки в гипотонической среде уменьшились соответственно на 78,6% и 67% (р<0,05). На 90 секунде достоверных различий в размерах глобулярных структур в гипо- и изотонических средах не выявлено, но их общее количество уменьшилось на 62,5% (р<0,05) в пробах с гипотоническим раствором. В интервале 120-150 секунды воздействия габаритные размеры глобулярных выступов и их общее количество было снижено по сравнению с изотонической средой. На 180 секунде наблюдали увеличение высоты глобул на 158% (р<0,05), при этом их количество находилось в пределах не достоверных различий с изотоническим раствором. К окончанию инкубации (900 секунда) высота глобулярных образований снизилась на 65% (р<0,05), а их количество соответствовало значениям изотонической среды. Количество углублений в мембране увеличилось в пробах с гипотоническим раствором. На 30 секунде воздействия диаметр углублений уменьшился на 179 38% (р<0,05), а их глубина возросла на 35% (р<0,05), при этом общее количество углублений в мембране увеличилось на 1000% (р<0,05) по сравнению с изотоническим раствором (таблица 56). Таблица 56 – Габаритные размеры углублений в мембране и их количество на поверхности лимфоцитов под влиянием адреналиновой нагрузки Время Гипотонический раствор Изотонический раствор инкуба- диаметр, глубина, количество диаметр, глубина, количеции, с нм нм нм нм ство 30 37,87±1,55* 4,68±0,34* 33±2,6* 61,33±1,50 3,03±0,62 3±0,2 60 76,00±1,07 5,43±1,89 3±0,6 90 82,25±6,22* 4,05±0,43* 4±0,2* 115,85±8,31 12,71±1,99 7±1,4 120 54,50±3,50* 3,47±0,50* 10±1,8* 42,78±2,71 7,30±1,01 18±3,4 150 54,40±3,02 6,07±0,90 15±1,3* 66,14±7,46 7,57±1,53 7±1,9 180 48,07±3,02* 4,95±0,7 26±2,4* 80,00±0,98 6,35±0,55 2±0,7 300 44,50±3,25* 13,24±6,97 12±0,9 130,78±1,56 7,94±1,58 9±1,6 900 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 90 секунде воздействия общее количество углублений в мембране и их габаритные размеры сократились соответственно на 43%, 29% и 68% (р<0,05) по сравнению с изотоническим раствором. На 120 секунде инкубации глубина углублений уменьшилась на 52,5% (р<0,05), диаметр возрос на 27% (р<0,05), а общее их количество сократилось на 44% (р<0,05) по сравнению с изотонической средой. На 150 секунде количество углублений в мембране возросло на 114% (р<0,05), а их габаритные размеры были в пределах недостоверных различий с изотоническим раствором. На 180 секунде диаметр углублений уменьшился на 40% (р<0,05), при этом их глубина была в пределах не достоверных различий с изотонической средой, а количество возросло на 53%(р<0,05). К окончанию времени воздействия (900 секунда) углублений в мембране как в гипо-, так и в изотонической средах не выявлено. Проанализировав динамику изменения количества глобулярных выступов и углублений на поверхности мембраны лимфоцитов в гипотонической среде под влиянием адреналиновой нагрузки, приходим к выводу, что структурные перестройки поверхности протекают на 90 секунде инкубации (рисунок 58). 180 120 100 80 60 выступы углубления 40 20 0 30 60 90 120 150 180 300 с 900 Рисунок 58 – Количество структурных образований на поверхности лимфоцитов в гипотонической среде под влиянием адреналина В этот период максимальное увеличение количества глобулярных выступов сопровождалось резким снижением числа углублений в мембране (r=1). В изотоническом растворе наблюдали аналогичную картину (рисунок 59). 300 250 200 150 выступы 100 углубления 50 0 30 60 90 120 150 180 300 900 с Рисунок 59 – Количество структурных образование на поверхности лимфоцитов в изотонической среде под влиянием адреналина Структурные перестройки поверхности в изотонической среде начались на 30 секунде инкубации, ярко выраженный характер приобрели к 90 секунде воздействия. Установлена тесная корреляция (r=1) между увеличением количества глобулярных выступов и снижением числа углублений в мембране. 181 2.3.3.2 Особенности цитоархитектоники лимфоцитов доноров под влиянием обзидана В рельефе лимфоцитов под влиянием блокатора β-адренорецепторов обзидана в гипотонической среде структурные перестройки поверхности наблюдали на 30 секунде инкубации, в виде появления мелких шероховатостей (рисунок 60 1а), при этом в изотоническом растворе образовывались крупных глобулярные конгломераты (рисунок 60 2б). 1а 2а 1б 2б 182 1в 1г 2в 2г 1д 2д 1е 2е 183 1ж 2ж 1з 2з Рисунок 60 – Рельеф поверхности лимфоцитов доноров при инкубации с обзиданом в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з – 900 секундах инкубации В интервале с 60 по 120 секунды инкубации в гипотонической среде рельеф поверхности был сглажен (рисунок 60 1б -1г), в изотонической среде продолжился процесс укрупнения и слияния глобулярных выступов в единичные конгломераты, представляющие собой выросты на поверхности мембраны (рисунок 60 2б2г). На 150 - 180 секундах в гипотонической среде на мембране лимфоцитов наблюдали глобулярные выступы (рисунок 60 1д, 1е), которые укрупнились и образовали небольшие конгломераты (рисунок 60 1ж). Параллельно в изотоническом растворе произошло рассредоточение по поверхности крупных глобул (рисунок 60 2д), с последующим сглаживанием рисунка рельефа (рисунок 60 2е, 2ж). На 900 секунде инкубации на мембране лимфоцитов как в гипо-, так и в изотонической средах были идентифицированы крупные углубления в виде кратеров (рисунок 60 1з, 2 з). 184 Под влиянием обзидана в гипотонической среде на 30 секунде инкубации высота глобулярных выступов снизилась на 34% (р<0,05), при этом их количество было в пределах недостоверных различий с изотоническим раствором (таблица 57). Таблица 57 – Размеры и количество глобулярных выступов на поверхности мембраны лимфоцитов под влиянием обзидана Время ин- Гипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 58,50±6,41* 37±4,2 88,36±7,6 44±2,9 60 53,00±3,95* 58±3,5* 16,61±2,3 13±1,4 90 22,10±1,02* 117±3,9* 32,75±5,08 29±3,1 120 72,73±3,05* 18±1,9* 36,94±3,3 57±1,2 150 25,64±2,53* 34±1,4* 45,97±2,9 52±0,7 180 43,0±3,24 27±0,7* 51,96±5,8 37±1,6 300 38,96±3,21* 31±1,6 53,50±4,1 32±0,9 900 27,44±2,79* 49±3,5* 68,14±8,04 29±2,8 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 60 секунде воздействия гипотонической среды количество глобулярных выступов и их высота увеличились соответственно на 77,5% и 70% (р<0,05) по сравнению с изотоническим раствором. На 90 секунде число глобул на поверхности возросло на 75% (р<0,05), а их высота снизилась на 32,5% (р<0,05) по сравнению с изотоническим раствором. В интервале 120-150 секунды наблюдали увеличение высоты глобулярных выступов на фоне сокращения их количества. Начиная с 300 секунды и до конца инкубации (900 секунда) в гипотонической среде отмечали снижение числа глобулярных выступов. В гипотонической среде количество углублений в мембране было снижено по сравнению с изотоническим раствором (таблица 58). Таблица 58 – Габаритные размеры углублений на поверхности мембраны лимфоцитов под влиянием обзидана Время инкубации, с 30 60 90 Гипотонический раствор диаметр, нм глубина, нм количество 52,78±4,11* 7,22±0,70* 9±1,3 102,00±13,9 9,45±1,70 7±1,8 222,20±5,50 14,72±1,50 2±0,4 Изотонический раствор диаметр, нм глубина, нм количество 121,57±9,68 18,37±3,50 7±0,2 - 185 Продолжение таблицы 58 Время Гипотонический раствор Изотонический раствор инкубадиаметр, нм глубина, нм количе- диаметр, нм глубина, нм количеции, с ство ство 120 115,91±7,70 3,92±0,54* 10±1,9* 97,26±6,69 13,24±1,72 23±1,3 150 119,65±10,1 5,54±1,20 9±1,2 180 86,98±10,31* 20,11±3,68* 13±2,3 130,80±8,1 5,96±0,90 13±2,9 300 87,82±4,10* 10,07±1,58 9±0,8* 114,90±8,01 7,23±0,8 25±1,8 900 142,36±2,01* 3,42±0,57 6±0,3 70,66±7,55 5,17±1,07 9±3,1 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотонический растворе по критерию Стьюдента при р<0,05. Сокращение числа углублений наблюдали на 120 секунде (56,5%; р<0,05) и 300 секунде (64%; р<0,05) по сравнению с изотонической средой. На 180 и 900 секундах количество углублений в мембране между исследуемыми группами не различалось. На 30 секунде инкубации в гипотонической среде габаритные размеры углублений уменьшились: диаметр – на 56,5% (р<0,05), глубина – на 61% (р<0,05) по сравнению с изотоническим раствором. В дальнейшем в интервале с 60 по 150 секунды габаритные размеры углублений в гипотонической среде увеличились, при этом в изотоническом растворе углублений в структуре мембран не выявлено. На 180 секунде диаметр углублений уменьшился на 33,5% (р<0,05), а их глубина возросла на 70% (р<0,05) по сравнению с изотоническим раствором. К 900 секунде воздействия диаметр углублений увеличился на 101,5% (р<0,05), причем их глубина и количество были в пределах недостоверных различий с изотоническим раствором. Структурные преобразования поверхности мембран лимфоцитов при снижении осмолярности среды в условиях блокады β-адренорецепторов произошли в течение первых 90 секунд инкубации (рисунок 61). 186 140 120 100 80 60 выступы 40 углубления 20 0 30 60 90 120 150 180 300 900 с Рисунок 61 – Количество структурных образований на поверхности лимфоцитов в гипотонической среде под влиянием обзидана Увеличение количества глобулярных выступов в гипотонической среде коррелируют (r=0,89) с уменьшением числа углублений в мембране. В изоосмотических условиях, наблюдали цикличность в изменении рельефа поверхности. Резкое увеличение количества глобулярных выступов на 30 секунде инкубации, сменилось уменьшением их числа в последующие 60 и 90 секунды, при этом с поверхности мембраны полностью исчезли углубления (рисунок 62). 70 60 50 40 30 выступы 20 углубления 10 0 30 60 90 120 150 180 300 900 с Рисунок 62 – Количество структурных образований на поверхности лимфоцитов в изотонической среде под влиянием обзидана На 120 секунде возросло число углублений в мембране и выступов на ее поверхности, которое впоследствии уменьшилось к концу инкубации. Тесных кор- 187 реляционных зависимостей между изменением количества глобулярных выступов и углублений в мембране в изотонической среде не выявлено (r=0,26). 2.3.3.3 Особенности цитоархитектоники лимфоцитов доноров в условиях кальциевой нагрузки Под влиянием Са2+-нагрузки в течение первых 90 секунд инкубации в гипои изотонической средах выявлена шероховатость поверхности (рисунок 63 1а, 2а, 1б, 2, 1 в, 2в). В гипотонической среде детали рельефа были мельче в течение первых 60 секунд инкубации, а затем, начиная с 90 секунды, глобулярные выступы образовали крупные конгломераты на поверхности клетки (рисунок 63 1в). 1а 1б 2а 2б 188 1в 2в 1г 2г 1д 1е 2д 2е 189 1ж 2ж 2з 1з Рисунок 63 – Рельеф поверхности лимфоцитов здоровых доноров после обработки кальцием в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з – 900 секундах инкубации Процесс укрупнения глобул в изотоническом растворе наблюдали, начиная с 60 секунды воздействия (рисунок 63 2б). На 120 секунде в гипотоническом растворе рельеф поверхности был сглажен (рисунок 63 1г), при этом в изотоническом растворе поверхность представлена мелкодисперсными глобулярными образованиями (рисунок 63 2г). В промежутке со 150 по 300 секунды выявленная тенденция сглаживания рисунка поверхности в исследуемых пробах продолжилась, однако была наиболее выражено в изотоническом растворе (рисунок 63 1д, 2д, 1е, 2е, 1ж, 2ж). К окончанию инкубации на 900 секунде на мембранах лимфоцитов в гипотоническом растворе образовались углубления (рисунок 63 1з), при этом в изотоническом растворе рельеф поверхности был еще более сглаженным (рисунок 63 2з). 190 Размеры и число глобулярных структур на поверхности клеток представлено в таблице 59. Таблица 59 – Размеры и количество глобулярных выступов на поверхности лимфоцитов доноров под влияние кальциевой нагрузки Время ин- Гипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 25,31±1,60* 105±1,6* 18,25±1,14 57±2,4 60 13,68±0,89* 86±2,4* 22,32±0,91 66±1,1 90 26,34±1,68 50±0,8* 26,12±4,06 72±1,9 120 21,56±2,14* 34±1,6* 8,71±1,27 60±3,6 150 105,21±1,47* 23±0,7* 37,49±8,23 13±0,6 180 85,12±9,13 27±1,7* 73,18±8,20 21±1,3 300 31,59±2,15* 40±2,7* 90,83±2,32 32±1,2 900 7,89±0,48* 65±1,3* 89,93±2,05 6±1,9 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. Как видно из таблицы 59 на 30 секунде инкубации количество глобулярных выступов возросло на 84% (р<0,05), их высота увеличилась на 39% (р<0,05) по сравнению с изотоническим раствором. На 60 секунде инкубации число выступов превысило аналогичный показатель в изотоническом растворе на 30% (р<0,05), но высота глобул на поверхности мембраны снизилась на 39 % (р<0,05). В промежутке 90 - 120 секунды количество выступов на мембране уменьшилось, а их размеры были в пределах не достоверных различий с изотоническим раствором. Начиная со 150 секунды, количество глобул на поверхности мембраны возросло, и к окончанию инкубации (900 секунда) превысило аналогичные значения в изотоническом растворе на 91% (р<0,05). На 150 секунде высота глобулярных выступов увеличилась на 14 % (р<0,05), а на 300 и 900 секундах – снизилась соответственно на 65,2% и 91,3% (р<0,05) по сравнению с изотоническим раствором. В условиях гипотонической нагрузки под влиянием Са2+-нагрузки число углублений в мембране уменьшилось в течение первых 180 секунд инкубации, а затем, начиная с 300 секунды – возросло на 28% (р<0,05), к окончанию воздействия 191 (900 секунда) – на 136% (р<0,05) по сравнению с количеством углублений, выявленных на мембране лимфоцитов в изотоническом растворе (таблица 60). Таблица 60 – Габаритные размеры углублений в мембране и их количество на мембране лимфоцитов доноров под влиянием кальциевой нагрузки Время Гипотонический раствор Изотонический раствор инкуба- глубина, диаметр, нм количе- глубина, нм диаметр, нм количеции, с нм ство ство 30 10,82±0,97 123,79±7,61* 29±3,2* 11,10±0,96 51,95±2,72 38±1,7 60 4,71±0,34* 96,16±5,82* 32±1,9* 13,34±0,88 53,94±3,28 38±1,7 90 8,25±1,01 116,29±9,38 21±2* 10,29±1,80 116,25±6,79 60±3,7 120 7,68±1,09* 66,31±6,43 13±0,6* 3,83±0,20 63,04±3,27 55±2,1 150 12,1±2,61 85,60±7,79 5±0,8 180 31,81±1,14 94,80±1,04* 10±2,6* 60,17±1,46 170,67±3,52 6±0,7 300 9,33±1,08* 107,92±6,03* 25±1,9* 26,35±6,14 229,67±1,47 18±1,3 900 8,04±1,04 65,63±3,07* 73±3,6* 9,80±1,20 167,80±1,59 5±0,9 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 30 секунде в гипотонической среде диаметр углублений увеличился на 138% (р<0,05), при этом их глубина практически не изменилась по сравнению со значениями в изотоническом растворе. На 60 секунде глубина углублений уменьшилась на 64,7% (р<0,05), а диаметр - возрос на 78,3% (р<0,05). На 120 секунде глубина углублений увеличилась на 100,5% (р<0,05), при этом их диаметр не отличался от значений диаметр в изотоническом растворе. Начиная со 180 секунды и до конца инкубации, наблюдали тенденцию к уменьшению габаритных размеров углублений, при этом к концу инкубации достоверных различий между значениями в гипо- и изотонической средах не выявлено. Анализируя количественные структурные перестройки поверхности в гипотонической среде под влиянием кальциевой нагрузки видно, что основные изменения касаются глобулярных образований поверхности, которые появлялись в большом количестве уже на 30 секунде инкубации, а затем их число постепенно сократилось по мере увеличения времени инкубации (рисунок 64). 192 120 100 80 60 выступы углубления 40 20 с 0 30 60 90 120 150 180 300 900 Рисунок 64 –Количество структурных образований на поверхности лимфоцитов в гипотонической среде под влиянием Са2+-нагрузки Начиная со 180 секунды инкубации, в мембране появились углубления, и к окончанию воздействия их количество преобладало над числом глобулярных выступов. В изотонической среде структурные перестройки поверхности под влиянием кальциевой нагрузки в течение первых 60 секунд инкубации были связаны с увеличением количества глобулярных выступов при неизменном числе углублений. На 90 секунде инкубации синхронно увеличилось число глобул и углублений на мембране лимфоцитов, а затем наблюдали сглаживание рельефа поверхности, за счет постепенного сокращения количества структурных образований на мембране (рисунок 65). 80 70 60 50 40 30 20 10 0 выступы углубления 30 60 90 120 150 180 300 900 с Рисунок 65 – Количество структурных образований на поверхности лимфоцитов в изотонической среде под влиянием Са2+-нагрузки 193 Тесных корреляционных связей между изменением количества глобулярных выступов и углублений в мембране в гипотонической среде не выявлено (r=0,5), а в изотоническом растворе установлена корреляционная зависимость (r=0,94) между изучаемыми параметрами. 2.3.3.4 Особенности цитоархитектоники лимфоцитов доноров под влиянием верапамила Под влиянием верапамила в гипотонической среде наблюдали укрупнение глобулярных структур (рисунок 66 1а, 1б) и образование кластеров (рисунок 66 1в, 1г). В целом интервале 30-180 секундах инкубации отмечали сглаживание рисунка рельефа поверхности (рисунок 66 1д, 1е). 1а 2а 194 1б 1в 1г 1д 2б 2в 2г 2д 195 1е 2е 1ж 2ж 1з 2з Рисунок 66– Рельеф поверхности лимфоцитов доноров под влиянием верапамила в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з – 900 секундах инкубации В изотоническом растворе в период с 30 по 120 секунды инкубации поверхность лимфоцитов была структурирована и представлена мелкими глобулярными выступами и углублениями в мембране (рисунок 66 2а, 2б, 2в, 2г). На 150 секунде появились крупные глобулы (рисунок 66 2д), которые впоследствии на 180 секунде исчезли (рисунок 66 2е). К окончанию инкубации в интервале 300-900 секунды на поверхности лимфоцитов в гипотонической среде появились глобулярные вы- 196 ступы (рисунок 66 1ж, 1з), в то время как в изотоническом растворе наблюдали сглаживание рельефа поверхности (рисунок 66 2ж, 2з). На 30 секунде инкубации в гипотонической среде под влиянием верапамила число глобулярных выступов уменьшилось на 58% (р<0,05), их высота снизилась на 85,4% (р<0,05) по сравнению с изотоническим раствором (таблица 61). Таблица 61 – Размеры и количество глобулярных выступов на поверхности лимфоцитов доноров под влиянием верапамила Время инГипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 8,04±1,26* 33±3,2* 55,16±4,60 78±3,4 60 44,72±4,3 33±3,1 38,51±2,69 38±2,6 90 144,10±2,6* 19±1,6 65,97±11,02 16±1,1 120 71,80±4,4* 91±4,6* 35,11±2,44 40±3,1 150 53,28±7,76* 49±0,9* 109,24±9,9 22±2,0 180 64,86±7,31 21±1,8* 70,76±4,59 64±3,1 300 16,59±1,07* 38±2,1* 35,94±4,50 22±0,5 900 25,91±3,44* 38±2,1 68,00±5,60 38±1,4 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 90 секунде высота глобул увеличилась на 118,4% (р<0,05), а их количество практически не изменилось по сравнению с изотоническим раствором. На 120 секунде количество глобул на поверхности мембраны возросло на 127% (р<0,05), а их высота увеличилась на 104,5% (р<0,05). Начиная со 150 секунды, и до конца инкубации высота глобул снизилась, а их количество возросло на 150 секунде (123%; р<0,05), на 180 секунде – снизилось на 67,2% (р<0,05), а к концу инкубации сравнялось со значениями в изотоническом растворе. Под влиянием верапамила в изотонической среде на 30 секунде инкубации углублений в мембране не выявлено. На 60 секунде появились небольшие углубления, диаметр и глубина которых были снижены на 57,4% и 81% (р<0,05) по сравнению со значениями в изотоническом растворе (таблица 62). 197 Таблица 62 – Габаритные размеры углублений и их количество на мембране лимфоцитов доноров под влиянием верапамила Время Гипотонический раствор Изотонический раствор инкуба- глубина, диаметр, нм количест- глубина, диаметр, количеции, с нм во нм нм ство 30 13,98±2,20 179,37±1,47 27±1,2 60 4,66±0,60* 102,70±9,35* 8±1,6* 24,60±3,72 241,10±2,73 20±3,6 90 13,72±1,42 146,95±10,5 23±1,8 120 11,98±2,60 119,60±1,34* 9±1,4* 17,59±2,35 104,18±6,26 44±3,1 150 5,30±0,90 65,87±6,80 17±2,4 180 15,23±3,70 99,48±1,25* 5±0,9* 8,54±1,00 61,84±4,20 11±1,9 300 5,03±0,80 49,78±3,56* 22±0,4* 6,60±0,69 83,24±5,10 28±1,4 900 7,96±0,93 104,45±9,24 47±1,3* 8,26±1,04 99,00±6,21 19±2,4 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 90 секунде инкубации углубления в мембране в гипотонической среде вновь исчезли и появились на 120 секунде. В этот период их количество было ниже на 79,5% (р<0,05), а диаметр – больше на 15% (р<0,05) по сравнению с изотоническим раствором. На 180 секунде инкубации габаритные размеры углублений увеличились, а их количество уменьшилось на 54,5% (р<0,05). К окончанию инкубации на 900 секунде габаритные размеры углублений в мембране были в пределах не достоверных различий со значениями в изотонической среде, а их количество возросло на 147,4% (р<0,05). Проведя количественный анализ структурных преобразований поверхности лимфоцитов в гипотонической среде видно, что максимум глобулярных образований, появляющихся в мембране, пришелся на 120 секунду инкубации, при этом углубления в мембране в этот период только начали появляться и их максимум был отмечен к концу инкубации – 900 секунда (рисунок 67). 198 120 100 80 60 выступы 40 углубления 20 0 30 60 90 120 150 180 300 с 900 Рисунок 67 – Количество структурных образований на поверхности лимфоцитов в гипотонической среде под влиянием верапамила В изотоническом растворе число глобулярных выступов изменялось циклически, достигая максимума на 30 и 180 секундах инкубации, в то время как количество углублений в мембране достигало своего максимального значения лишь на 120 секунде воздействия (рисунок 68). 90 80 70 60 50 40 выступы 30 углубления 20 10 с 0 30 60 90 120 150 180 300 900 Рисунок 68 – Количество структурных образований на поверхности лимфоцитов в гипотонической среде под влиянием верапамила Тесных корреляционных связей между изучаемыми параметрами как в гипотонической (r=-0,11), так и в изотонической среде (r=-0,17) не выявлено. 199 2.4. Морфофункциональные свойства эритроцитов лягушек В настоящей главе представлены экспериментальные данные о морфологии и свойствах эритроцитов лягушек, которые выбраны в качестве модельных объектов, у которых изучены и широко представлены в литературе механизмы ионной регуляции объема клеток. Однако, эти клетки обладают дополнительным мембранным резервом, согласно данным полученным Головко С.И., Федоровой М.З. (2011). Предполагаем, что этот резерв может быть задействован клетками в регуляции объема в состоянии физиологического анабиоза, во время которого снижена функция выделительных органов, в организме накапливаются осмолиты и электролиты, что создает условия для изменения осмотического давления внеклеточной жидкости. 2.4.1. Особенности цитоархитектоники и упруго-эластические свойства эритроцитов лягушек Эритроциты лягушек имеют эллипсоидную форму с центрально расположенным ядром, в центре которого наблюдается углубление (рисунок 69 а), связанное с особенностями расположения хроматина - в виде центральных скоплений, реже – по периферии ядра (рисунок 69 б). 200 а б Рисунок 69 – АСМ-изображения нативного эритроцита лягушки (стрелкой показана локализация хроматина): а -3-D-скан; б – кривая профиля поверхности Форму ядерных эритроцитов поддерживают структуры цитоскелета в виде микротрубочек, которые выполняют опорную функцию. Микротрубочки образуют по периферии клетки мощный белковый валик, от которого к ядерной мембране отходят более тонкие микрофиламенты (рисунок 70). 1 2 Рисунок 70 –3-D- скан тени мембраны эритроцита лягушки: 1 – белковый валик по периферии клетки; 2 – микрофиламенты На малых полях сканирования хорошо видна ячеистая структура цитоскелета теней мембран эритроцитов лягушек (рисунок 71а), представленная отдельными микрофиламентами (рисунок 71б), диаметр которых находится в пределах 1,12±0,10 мкм. 201 б а Рисунок 71 – Участки элементов цитоскелета мембран эритроцитов лягушек(малые поля сканирования): а – ячеистая сеть; б – отдельная микротрубочка Рельеф поверхности нативных эритроцитов лягушек, отсканированных в аутологичной плазме, характеризуется наличием небольшого количества глобулярных образований и углублений в мембране (рисунок 72). 1 2 Рисунок 72 – 3-D-скан участка поверхности нативного эритроцита лягушки в плазме: 1- углубления в виде кластеров, 2 – глобулярные выступы Углубления представляют собой кластеры, диаметр которых составлял 171,62±12,25 нм, глубина – 16,85±1,25 нм. Высота глобулярных образований (см. рисунок 73) порядка 48,12±8,62 нм, их количество на участке поверхности не превышало 8±0,02. Модуль Юнга эритроцитов лягушек составлял 2,37±0,15 µРа, глубина погружения кантилевера – 694,92±7,54 нм. Потенциальный относительный мембранный резерв эритроцита лягушки составил 0,54±0,002 мкм-1, ядра клетки – 1,17±0,01 мкм-1. 202 2.4.2. Особенности цитоархитектоники и упруго-эластические свойства эритроцитов лягушек в условиях функциональных нагрузок 3.4.2.1. Цитоархитектоника эритроцитов лягушек под влиянием адреналина и обзидана Под влиянием адреналиновой нагрузки эритроциты утратили эллипсоидную форму (рисунок 73а), а в пробах с обзиданом – наоборот вытянулась по длинной оси (рисунок 73б) по сравнению с контролем (рисунок 73в). Под влиянием адреналина в области ядра идентифицировано углубление (см. рисунок 73а). В пробах с обзиданом ядро приобрело выпуклую форму, приподнялось над поверхностью, его рельеф сглажен скоплений хроматина не наблюдалось, изредка видны небольшие углубления в мембране (см. рисунок 73б). а б в Рисунок 73 – Сканы нативных эритроцитов лягушки: а – под влиянием адреналина; б – под влиянием обзидана; в – контроль (клетки в плазме) Под влиянием адреналина и обзидана существенно увеличились линейные размеры эритроцитов и их ядер (таблица 63). 203 Таблица 63 – Морфометрические параметры эритроцитов лягушек под влиянием адреналина и обзидана Параметры А, мкм В, мкм С, мкм ε, усл. ед. V, мкм3 S, мкм2 Контроль клетка 9,19±0,02 5,77±0,01 1,07±0,03 0,77±0,01 84,02±1,19 96,70±1,28 ядро 3,47±0,03 2,68±0,03 0,95±0,01 0,61±0,01 8,44±0,08 20,90±0,94 Адреналин клетка 29,30±0,21* 20,13±0,13* 3,95±0,03* 0,72±0,01* 2456,16±39,95* 1027,87±2,61* ядро 10,82±0,12* 7,42±0,01* 1,45±0,02* 0,70±0,01* 125,46±3,73* 140,47±2,61* Обзидан клетка 27,32±0,24* 13,73±0,23* 2,69±0,04* 0,86±0,03* 1106,46±41,89* 629,91±14,43* ядро 9,52±0,14* 5,88±0,09* 1,15±0,02* 0,76±0,01* 72,13±3,22* 97,54±2,76* * – Достоверность различий между значениями в пробах с адреналином/обзиданом и контролем по критерию Стьюдента (р<0,05). А - большая ось эллипса, В - средняя ось эллипса, С - малая ось эллипса, ε -коэффициент эксцентричности, V – объем, S - площадь поверхности Выраженные изменения морфометрических параметров эритроцитов установлены под влиянием адреналина. Так, объем и площадь поверхности увеличены соответственно на 282% и 963% (р<0,05) в условиях активации, и на 121,6% и 551% (р<0,05) блокады β-адренорецепторов по сравнению с контролем. Коэффициент эксцентричности снижен на 6,5% (р<0,05) в пробах с адреналином, и увеличен на 11,7% (р<0,05) в пробах с обзиданом по сравнению с контролем. Под влиянием адреналиновой нагрузки на поверхности мембраны глобулярные образования укрупнялись (рисунок 74а), по сравнению с контролем (рисунок 74в). Под воздействием обзидана визуальных изменений в рельефе участков поверхности не выявлено (рисунок 74б). а б 204 в Рисунок 74 – Сканограммы участков мембраны эритроцитов лягушек: а – под влиянием адреналина; б - под влиянием обзидана; в – контроль В пробах, проинкубированных с адреналином, количество глобулярных выступов на участке мембраны эритроцитов уменьшилось на 50% (р<0,05), а их высота возросла на 254% (р<0,05), по сравнению с контролем (таблица 64). Таблица 64 – Цитоархитектоника эритроцитов лягушек под влиянием адреналина и обзидана Типы структур поверхности Контроль Адреналин Обзидан Глобулярные Высота, нм 48,12±8,62 170,24±15,60* 34,69±3,70^ выступы Количество 24±2,56* 15±1,08* 21±2,04 Углубления в Диаметр, нм 171,62±12,25 786,12±10,29* 277,67±13,34*^ мембране Глубина, нм 16,85±1,25 26,98±2,23* 29,66±1,38* Количество 8±0,2 16±0,4* 9±0,15*^ Модуль Юнга, µРа 2,37±0,15 3,89±0,01* 2,16±0,05^ Жесткость Глубина погружения 694,92±7,54 209,23±1,50* 693,11±4,14^ кантилевера, нм * – Достоверность различий между значениями в пробах с адреналином/обзиданом и контролем по критерию Стьюдента (р<0,05). С увеличением высоты глобулярных выступов под влиянием адреналина жесткость клеток возросла на 64% (р<0,05), а глубина погружения кантилевера уменьшилась на 70% (р<0,05) по сравнению с контролем (см. таблица 64). Под влиянием адреналиновой нагрузки количество углублений в мембране клеток возросло на 100% (р<0,05), при этом их диаметр и глубина увеличились соответственно на 358% и 60% (р<0,05) по сравнению с контролем. Под влиянием обзидана число углублений увеличилось на 12,5% (р<0,05), а их диаметр и высота возросли соответственно на 62% и 76% (р<0,05) по сравнению с контролем. 205 В условиях адреналиновой нагрузки жесткость эритроцитов достоверно возрастает в 1,8 раза по сравнению с их блокадой. Под влиянием обзидана число глобулярных образований и углублений в мембране снижено соответственно на 80% и 43,7% (р<0,05) по сравнению с адреналиновой нагрузкой. 2.4.2. Влияние Са2+ и верапамила на цитоархитектонику эритроцитов лягушек Форма клеток и ядер под влиянием ионов Са+ существенно не изменилась и сохранилась эллипсоидной. В области перинуклеарного пространства выявлено углубление, хроматин равномерно распределен в виде небольших скоплений по всей площади ядра (рисунок 75а), подобно расположению хроматина в контроле (рисунок 75в). а б в Рисунок 75 – Сканы нативных эритроцитов лягушки: а – под влиянием ионов Са2+; б – под влиянием верапамила; в – контроль (клетки в плазме) 206 В пробах, инкубированных с верапамилом, установлено увеличение высоты ядра, оно выступало над поверхностью, рельеф его сглажен, скопления хроматина не визуализированы (рисунок 75б). Под влиянием кальциевой нагрузки и верапамила увеличились геометрические параметры эритроцитов и их ядер, причем наиболее выраженное влияние на их размеры наблюдалось в пробах с верапамилом (таблица 65) Таблица 65 – Морфометрические параметры эритроцитов лягушек под влиянием ионов Са2+ и верапамила Параметры А, мкм В, мкм С, мкм ε, усл. ед. V, мкм3 S, мкм2 Контроль клетка ядро 9,19±0,02 3,47±0,03 5,77±0,01 2,68±0,03 1,07±0,03 0,95±0,01 0,77±0,01 0,61±0,01 84,02±1,19 8,44±0,08 96,70±1,28 20,90±0,94 СаCl2 клетка ядро 26,63±0,35* 9,67±0,10* 14,84±0,23* 6,19±0,08* 2,91±0,05* 1,21±0,01* 0,82±0,004* 0,74±0,01* 1312,44±40,58* 79,48±2,35* 686,17±15,04* 104,19±0,01* Верапамил клетка ядро 16,39±0,18* 7,09±0,11* 14,10±0,10* 5,19±0,07* 3,21±0,03* 1,39±0,02* 0,81±0,01* 0,71±0,01* 1588,81±39,9* 114,25±4,5* 788,05±12,15* 130,37±3,39* * – Достоверность различий между значениями в пробах с кальцием/верапамилом и контролем по критерию Стьюдента (р<0,05). А - большая ось эллипса, В - средняя ось эллипса, С - малая ось эллипса, ε - коэффициент эксцентричности, V – объем, S - площадь поверхности Под влиянием верапамила высота клетки и ядра возросла соответственно на 200% и 46,3% (р<0,05), а в условиях кальциевой нагрузки – на 172% и 27,4% (р<0,05) по сравнению с контролем. Под влиянием кальциевой нагрузки и верапамила рельеф поверхности участков мембран эритроцитов был сглажен (рисунок 76а, б) по сравнению с контролем (рисунок 76в). а б 207 в Рисунок 76 – Сканы участков мембраны эритроцитов лягушек в контроле (в) под влиянием Са2+ (а) и верапамила (б) Четко очерченные глобулярные структуры были идентифицированы на сканах в пробах с Са2+, в пробах с верапамилом – они отсутствовали. Количество глобулярных выступов как под влиянием Са2+, так и верапамила уменьшилось соответственно на 25% и 45,8% (р<0,05) по сравнению с контролем (таблица 66). Таблица 66 – Цитоархитектоника эритроцитов лягушек под влиянием Са2+и верапамила Типы структур поверхности Контроль CaCl2 Верапамил Глобулярные Высота, нм 48,12±8,62 22,38±2,46* 45,84±6,13 выступы Количество 24±2,56 18±0,37* 13±0,65* Углубления в Диаметр, нм 171,62±12,25 222,80±17,94* 138,00±13,59 мембране Глубина, нм 16,85±1,25 6,13±1,02* 6,30±0,25* Количество 8±0,02 9±0,75 4±0,03* Модуль Юнга, µРа 2,37±0,15 1,46±0,08* 1,77±0,12* Жесткость Глубина погружения 694,92±7,54 1797,98±21,25* 1301,84±17,98* кантилевера, нм * – Достоверность различий между значениями в пробах с кальцием/верапамилом и контролем по критерию Стьюдента (р<0,05). Под влиянием кальциевой нагрузки высота глобулярных образований снижена на 53,5% (р<0,05), а диаметр углублений в мембране увеличен на 29,8% (р<0,05), причем их глубина уменьшена на 63,8% (р<0,05) по сравнению с контролем. В условиях кальциевой нагрузки, как клетки, так и ядра сохраняют эллипсоидную форму, при этом упругость эритроцитов снизилась на 38,4% (р<0,05), 208 глубина погружения кантилевера в клетку возросла на 158,7% (р<0,05) по сравнению с контролем. Под влиянием верапамила число углублений в мембране было снижено на 45,8% (р<0,05), их диаметр достоверно не отличался от значений в контроле, а глубина уменьшена – на 62,6% (р<0,05). Жесткость клеток снижена на 25,3% (р<0,05), глубина погружения кантилевера возросла на 87,5% (р<0,05) по сравнению с контролем. 2.5. Регуляция объема эритроцитов лягушек в тестах с осмотической нагрузкой (in vitro) 2.5.1. Реакции осморегуляции эритроцитов лягушек При помещении эритроцитов лягушек в гипотонический раствор размеры клеток уменьшились, выявленная тенденция сохранилась на протяжении всего времени инкубации (таблица 67). Таблица 67 – Линейные размеры эритроцитов лягушек гипотонической среде Время, с 30 60 90 120 150 180 210 240 270 300 330 360 Короткая ось эллипса, мкм 0,65% NaCl 0,2% NaCl 0,65% NaCl 18,56±0,25 10,25±0,18* 10,89±0,22 16,89±0,15 10,34±0,14* 12,33±0,07 16,88±0,17 10,59±0,14* 12,53±0,09 17,54±0,12 10,54±0,11* 11,69±0,07 0,65% NaCl 0,2% NaCl 0,65% NaCl 17,60±0,17 10,73±0,12* 12,13±0,11 17,19±0,14 10,57±0,11* 12,01±0,06 17,77±0,18 10,57±0,12* 12,32±0,08 17,56±0,15 10,44±0,11* 12,13±0,06 17,65±0,17 10,57±0,11* 12,25±0,08 17,94±0,17 10,77±0,09* 12,08±0,07 18,07±0,21 10,80±0,09* 12,10±0,08 17,63±0,17 10,67±0,11* 12,18±0,08 Длинная ось эллипса, мкм 0,2% NaCl 15,44±0,32* 16,14±0,21* 16,34±0,22* 16,10±0,22* 0,2% NaCl 16,44±0,22* 16,08±0,22* 15,97±0,21* 15,94±0,21* 15,87±0,22* 16,13±0,21* 15,80±0,22* 15,68±0,23* Высота, мкм 0,2% NaCl 2,01±0,03* 2,03±0,03* 2,08±0,03* 2,07±0,02* 0,2% NaCl 2,10±0,02* 2,07±0,02* 2,07±0,02* 2,05±0,02* 2,07±0,02* 2,11±0,02* 2,12±0,02* 2,09±0,02* 0,65% NaCl 2,13±0,04 2,41±0,01 2,46±0,02 2,29±0,03 0,65% NaCl 2,38±0,02 2,36±0,01 2,42±0,01 2,38±0,01 2,40±0,01 2,37±0,01 2,38±0,02 2,39±0,01 209 Продолжение таблицы 67 Короткая ось эллипса, Высота, мкм мкм 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 390 15,23±0,26* 16,77±0,26 10,47±0,12* 12,24±0,13 2,05±0,02* 2,40±0,03 420 15,64±0,22* 17,86±0,24 10,66±0,11* 11,58±0,11 2,09±0,02* 2,27±0,02 450 15,66±0,24* 17,78±0,17 10,60±0,11* 11,57±0,11 2,08±0,02* 2,27±0,02 480 15,49±0,23* 17,43±0,17 10,47±0,13* 11,89±0,07 2,05±0,02* 2,33±0,01 510 15,60±0,22* 17,32±0,17 10,53±0,10* 11,86±0,06 2,07±0,02* 2,33±0,01 540 14,83±0,24* 17,44±0,19 10,28±0,11* 12,04±0,08 2,02±0,02* 2,36±0,02 570 15,31±0,22* 17,62±0,17 10,61±0,10* 12,02±0,08 2,08±0,02* 2,36±0,01 600 15,57±0,21* 17,84±0,20 10,63±0,09* 12,05±0,09 2,08±0,02* 2,36±0,02 900 15,11±0,28* 16,67±0,12 10,72±0,11* 11,85±0,06 2,10±0,02* 2,32±0,01 1800 15,04±0,25* 16,36±0,13 10,72±0,11* 11,64±0,06 2,10±0,02* 2,28±0,01 3600 15,84±0,38 16,23±0,11 11,06±0,20* 11,92±0,06 2,17±0,04* 2,34±0,01 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с Длинная ось эллипса, мкм На 30 секунде воздействия длинная и короткая оси, а также высота клеток уменьшились соответственно на 20%, 6,3% и 6,0% (р<0,05) по сравнению с изотоническим раствором. Наиболее выраженное снижение размеров клеток наблюдали на 210 секунде – длинная и короткая оси эритроцитов уменьшились соответственно на 11,3% и 16,5% (р<0,05). Снижение высоты клеток отмечали на 60 секунде на 18,7% (р<0,05), 210 секунде – на 16,9% (р<0,05) и 390 секунде – на 17% (р<0,05). К концу инкубации (3600 с) различия в линейных размерах клеток в гипо- и изотонической инкубационных средах были незначительными. Короткая и длинная оси эллипса, а также высота клеток в гипотонической среде уменьшились соответственно на 7,8%; 2,4% и 7,8% (р<0,05) по сравнению с изотоническим раствором. При снижении осмолярности среды уменьшился объем, и сократилась площадь поверхности эритроцитов. Выявленная тенденция сохранилась на протяжении всего времени инкубации (таблица 68). Таблица 68 – Морфометрические параметры эритроцитов в условиях гипоосмотической ангрузки Время, с 30 Коэффициент эксцентричности 0,2% NaCl 0,65% NaCl 0,71±0,01* 0,79±0,01 Объем, мкм3 0,2% NaCl 345,04±16,27* 0,65% NaCl 463,60±19,46 Площадь поверхности, мкм2 0,2% NaCl 201,67±6,31* 0,65% NaCl 254,05±6,33 210 Продолжение таблицы 68 Вре- Коэффициент эксценОбъем, мкм3 Площадь поверхности, мкм2 мя, с тричности 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 60 0,75±0,01* 0,66±0,01 364,28±12,16* 532,74±8,58 211,94±4,61* 265,87±3,09 90 0,74±0,01* 0,65±0,01 387,94±13,24* 553,20±11,70 220,21±4,99* 271,00±4,08 120 0,74±0,01 0,72±0,01 378,44±11,43* 494,84±6,24 216,36±4,55* 258,83±2,00 150 0,74±0,01* 0,70±00,1 400,75±12,07* 536,13±10,33 224,83±4,72* 270,76±3,44 180 0,74±0,01* 0,69±0,01 385,28±11,95* 514,79±7,21 217,78±4,69* 262,71±2,66 210 0,73±0,01 0,70±0,01 383,15±11,67* 556,47±8,54 216,35±4,67* 277,78±3,06 240 0,74±0,01* 0,69±0,01 369,39±10,74* 534,39±7,07 212,49±4,32* 270,52±2,67 270 0,72±0,01 0,69±0,01 379,89±11,83* 547,32±8,77 215,13±4,67* 274,41±3,09 300 0,72±0,01 0,72±0,01 397,82±10,68* 542,18±9,64 222,30±4,26* 274,69±3,31 330 0,69±0,01 0,72±0,01 392,72±10,88* 547,54±9,57 219,02±4,35* 277,17±3,47 360 0,70±0,01 0,70±0,01 382,86±11,79* 540,69±8,73 215,03±4,76* 272,53±3,11 390 0,69±0,01 0,67±0,03 358,54±12,96* 521,17±15,75 205,17±5,22* 262,04±5,57 420 0,71±0,01 0,74±0,01 383,27±12,11* 500,40±13,45 214,76±4,80* 262,24±4,94 450 0,71±0,01 0,74±0,01 379,46±12,05* 495,81±11,44 213,68±4,86* 260,45±3,91 480 0,71±0,01 0,72±0,01 369,05±12,06* 510,74±8,77 209,33±4,96* 263,15±3,30 510 0,71±0,01 0,71±0,01 370,33±10,93* 505,17±8,48 211,04±4,45* 261,12±3,23 540 0,69±0,06 0,70±0,01 336,21±11,62* 523,08±9,55 196,24±4,79* 266,66±3,54 570 0,67±0,01* 0,72±0,01 368,87±10,92* 530,38±10,9 208,91±4,43* 269,52±3,77 600 0,70±0,01 0,72±0,01 374,06±10,48* 536,78±11,13 212,08±4,18* 272,80±4,01 900 0,66±0,01 0,67±0,01 376,77±12,93* 487,21±6,72 210,08±5,39* 251,97±2,49 1800 0,66±0,01 0,67±0,01 366,39±10,93* 460,91±6,23 207,13±4,63* 242,82±2,38 3600 0,68±0,01 0,65±0,01 421,83±22,56* 479,94±6,46 226,76±8,61* 247,36±2,36 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Выраженное снижение объема и площади поверхности клеток в гипотонической среде наблюдали на 60 секунде инкубации соответственно на 46,2% и 26,9% (р<0,05), 210 секунде – на 45% и 29% (р<0,05) и 540 секунде – на 51% и 36% (р<0,05) по сравнению с изотоническим раствором. В проведенном исследовании был рассчитан коэффициент эксцентричности, характеризующий форму эритроцита и степень его удлиненности. В гипотонической среде на 30 секунде инкубации клетка округлилась, при этом коэффициент эксцентричности снизился на 11,3% (р<0,05) по сравнению с его значениями в изотонической среде (см. таблицу 68). На 60 -90 секундах в условиях сниженной осмолярности среды коэффициент эксцентричности возрос на 12% (р<0,05), что свидетельствует о вытягивании клетки и приобретении эллипсоидной формы. В интервале со 150 по 270 секунды значения коэффициента эксцентричности в гипотонической среде увеличились по сравнению с изотоническим раствором. На 330 секунде в гипотонической среде коэффициент эксцентричности вновь снизил- 211 ся на 4% (р<0,05), клетка округлилась. Начиная с 360 секунды и до конца инкубации ярко выраженных различий в форме эритроцитов между гипо- и изотоническими средами не выявлено. В гипотонической среде размеры ядра в течение первых 90 секунд инкубации изменились: длинная ось ядра на 30 секунде инкубации уменьшилась на 17% (р<0,05), на 60 секунде – на 6% (р<0,05), на 90 секунде – на 14,6% (р<0,05); при этом короткая ось ядра и его высота увеличились на 30 секунде соответственно на 5% и 6 % (р<0,05), 60 секунде – на 21% и 23% (р<0,05), 90 секунде – на 9% и 10% (р<0,05) по сравнению с изотоническим раствором (таблица 69). Таблица 69 – Линейные размеры ядра эритроцитов лягушек в гипотонической среде Длинная ось эллипса, Короткая ось эллипса, Высота, мкм мкм мкм 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 6,69±0,11* 7,82±0,12 5,35±0,09 5,09±0,08 1,05±0,02* 0,99±0,01 60 7,35±0,16* 7,78±0,09 5,92±0,16* 4,88±0,07 1,16±0,03* 0,96±0,01 90 7,01±0,15* 8,15±0,16 5,42±0,16* 4,97±0,09 1,06±0,03* 0,98±0,02 120 7,87±0,31* 6,96±0,16 6,16±0,32* 4,84±0,13 1,21±0,06* 0,95±0,02 150 8,62±0,16* 7,72±0,24 7,21±0,16* 4,88±0,11 141±0,03* 0,96±0,02 180 9,02±0,17* 7,63±0,22 7,61±0,15* 4,78±0,07 1,49±0,03* 0,94±0,01 210 8,98±0,18* 5,09±0,15 7,44±0,13* 3,85±0,07 1,46±0,02* 0,99±0,03 240 8,88±0,17* 8,24±0,17 7,58±0,12* 5,13±0,13 1,49±0,02* 1,00±0,03 270 8,95±0,15* 8,21±0,11 7,42±0,14* 5,06±0,09 1,46±0,03* 0,99±0,02 300 8,95±0,15* 7,55±0,16 7,24±0,14* 5,05±0,10 1,42±0,03* 0,99±0,02 330 8,47±0,19* 8,47±0,13 6,97±0,18* 4,94±0,10 1,37±0,04* 0,98±0,02 360 8,58±0,22* 7,45±0,18 7,07±0,19* 4,97±0,10 1,39±0,04* 0,98±0,02 390 7,16±0,18* 7,71±0,13 4,36±0,09* 4,88±0,11 1,40±0,04* 0,96±0,02 420 8,48±0,22* 7,13±0,13 6,77±0,22* 4,65±0,13 1,33±0,04* 0,91±0,03 450 8,91±0,21* 7,58±0,16 7,26±0,18* 4,87±0,07 1,43±0,03* 0,95±0,01 480 8,54±0,21* 7,59±0,16 7,00±0,20* 4,84±0,07 1,37±0,04* 0,99±0,01 510 8,67±0,23* 7,45±0,14 7,08±0,21* 4,72±0,11 1,39±0,04* 0,93±0,02 540 8,57±0,21* 7,57±0,14 7,06±0,18* 4,87±0,10 1,38±0,07* 0,95±0,02 570 8,58±0,24* 7,43±0,15 6,88±0,19* 4,46±0,09 1,35±0,04* 0,89±0,02 600 8,44±0,19* 7,12±0,12 7,03±0,19* 4,70±0,11 1,38±0,04* 0,92±0,02 900 8,88±0,18* 7,25±0,12 7,05±0,18* 5,01±0,09 1,38±0,04* 0,98±0,02 1800 9,08±0,13* 7,47±0,13 7,38±0,16* 5,07±0,08 1,44±0,03* 0,99±0,01 3600 8,94±0,14* 7,25±0,09 7,24±0,15* 4,87±0,09 1,42±0,03* 0,95±0,02 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с Начиная со 120 секунды и до конца инкубации, в гипотонической среде линейные размеры ядра увеличились, за исключением 180 секунды на которой ко- 212 роткая ось уменьшилась на 6,2% (р<0,05) и 330 секунды, когда значения длинной оси ядра в гипо- и изотоническом растворах были равны. Высота ядра в гипотонической среде существенно возросла на 180 секунде (57%; р<0,05) и 570 секунде (52%; р<0,05) по сравнению со значениями в изотоническом растворе. К окончанию инкубации (3600 с) короткая и длинная оси ядра, а также высота превысили аналогичные показатели в изотонической среде соответственно на 48%, 23% и 48% (р<0,05). Объем и площадь поверхности ядра эритроцитов в гипотонической среде увеличились и оставались повышенными на протяжении всего времени инкубации (таблица 70). Таблица 70 – Морфометрические параметры ядра эритроцитов в гиптонической среде Время, с Коэффициент эксценОбъем, мкм3 Площадь поверхности, мкм2 тричности 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,58±0,02* 0,74±0,01 40,74±1,87 42,72±1,88 40,74±1,87* 50,75±1,36 60 0,57±0,02* 0,76±0,01 58,86±4,59* 38,83±1,37 58,86±4,59* 47,99±1,04 90 0,61±0,02* 0,77±0,01 45,54±4,11 42,11±1,75 45,54±4,11* 51,11±1,38 120 0,61±0,02* 0,69±0,02 68,82±9,12* 34,12±2,05 68,82±9,12* 42,90±1,68 150 0,54±0,02* 0,76±0,02 93,48±5,10* 38,64±2,72 93,48±5,10* 47,83±2,23 180 0,52±0,02* 0,75±0,02 110,21±5,81* 36,02±1,49 110,21±5,81* 45,94±1,43 210 0,54±0,02* 0,72±0,02 104,56±4,70* 42,37±2,78 104,56±4,70* 49,83±1,96 240 0,48±0,03* 0,76±0,02 106,26±4,05* 45,76±2,87 106,26±4,05* 53,46±1,99 270 0,54±0,02* 0,77±0,01 104,02±4,74* 43,82±1,74 104,02±4,74* 52,36±1,28 300 0,57±0,02* 0,70±0,02 99,55±4,34* 40,82±2,07 99,55±4,34* 48,65±1,67 330 0,54±0,02* 0,79±0,01 89,65±5,33* 44,48±2,07 89,65±5,33* 53,37±1,53 360 0,54±0,02* 0,72±0,02 92,33±5,32* 38,67±2,13 92,33±5,92* 47,11±1,73 390 0,56±0,01* 0,76±0,02 96,11±6,09* 38,40±1,91 96,11±6,09* 47,52±1,43 420 0,57±0,03* 0,74±0,02 85,18±6,43* 32,57±1,90 85,18±6,43* 42,04±1,48 450 0,54±0,03* 0,75±0,02 100,19±5,67* 37,13±1,39 100,19±5,67* 46,55±1,18 480 0,55±0,02* 0,75±0,01 90,80±6,24* 36,76±1,41 90,80±6,24* 46,33±1,19 510 0,55±0,02* 0,76±0,01 94,76±6,67* 34,79±1,76 94,76±6,67* 44,45±1,43 540 0,54±0,02* 0,75±0,02 92,24±6,22* 37,36±1,78 92,24±6,22* 46,54±1,37 570 0,58±0,02* 0,79±0,01 88,18±5,19* 31,28±1,77 88,18±5,90* 41,99±1,54 600 0,53±0,02* 0,73±0,02 89,78±5,86* 32,64±1,50 89,78±5,86* 42,23±1,13 900 0,59±0,02* 0,69±0,02 96,59±5,86* 37,76±1,42 96,59±5,86* 45,99±1,04 1800 0,56±0,02* 0,70±0,02 107,68±5,42* 40,42±1,59 107,68±5,42* 48,20±1,23 3600 0,57±0,02* 0,72±0,01 101,27±5,01* 36,28±1,47 101,27±5,01* 44,93±1,09 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Увеличение объема и площади поверхности ядра наблюдали на 60 секунде инкубации соответственно на 14% и 24% (р<0,05), 180 секунде – на 206% и 96,5% 213 (р<0,05), 450 секунде – на 169% и 81,7% (р<0,05) и 570 секунде – на 182% и 86% (р<0,05) по сравнению со значениями в изотоническом растворе. К окончанию инкубации (3600 секунда), объем и площадь поверхности ядра возросли соответственно на 179,5% и 86% (р<0,05). В гипотонической среде, с увеличением времени ее воздействия, ядро постепенно теряло эллипсоидную форму. Ядро стало более округлым, что подтверждается числовыми значениями коэффициента эксцентричности, который был снижен на протяжении всего времени воздействия (см. таблицу 64). Выраженное снижение коэффициента эксцентричности ядра в гипотонической среде отмечали на 60 секунде (33%; р<0,05), 180 секунде (44%; р<0,05), 240 секунде (61,7%; р<0,05), 450 и 540 секундах (38,8%; р<0,05) по сравнению с изотоническим раствором. К концу инкубации (3600 секунда) коэффициент эксцентричности ядра в гипотонической среде был снижен на 26% (р<0,05). В гипотонической среде отмечено увеличение показателя ЯЦО на протяжении всего времени инкубации (рисунок 77). усл.ед. 0,7 0,6 0,5 0,4 0,20% 0,3 0,65% 0,2 0,1 0 с Рисунок 77 – ЯЦО эритроцитов лягушек в гипотонической среде Установлена тесная корреляционная связь между изменением объема ядра и показателя ЯЦО в гипотонической среде (r=0,88): с увеличением объема ядра, возрастали ЯЦО. Увеличение показателя ЯЦО при гипотонической нагрузке на клетку наблюдали на 180 секунде (183%; р<0,05), 450 секунде (271%; р<0,05), 570 214 секунде (246%; р<0,05) и к концу инкубации (105%; р<0,05) по сравнению с изотоническим раствором. Значения коэффициента осмотического натяжения кариолеммы превышали аналогичные показатели плазмалеммы на протяжении всего периода воздействия гипотонической нагрузки (рисунок 78). усл. ед. 2,5 2 1,5 плазмалемма 1 кариолемма 0,5 0 с . Рисунок 78 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы эритроцитов лягушек в гипотонической среде Коэффициент осмотического натяжения кариолеммы возрос на 60 секунде инкубации на 77% (р<0,05), 120 секунде – на 165% (р<0,05), 450 секунде – на 577% (р<0,05), 570 секунде – на 622% (р<0,05) и 3600 секунде – на 565% (р<0,05) по сравнению со значениями коэффициента плазмалеммы. В гипотонической среде клетка не использовала резервы плазмалеммы в осморегуляторных реакциях, в отличие от ядра, которое интенсивно включалось в осморегуляторные реакции, вовлекая в регуляцию объема внутриклеточные мембранные резервы. На 270 секунде инкубации ядро использовало ≈55% мембранного резерва, а к концу инкубации (1800 секунда) ≈89% резерва (рисунок 79). В изотоническом растворе ядро не участвовало в осморегуляторных реакциях. 215 мкм-1 1,2 1 0,8 0,6 0,4 0,2 0 30 90 150 210 270 330 390 450 510 570 900 3600 с Рисунок 79 – Относительный мембранный резерв, используемый ядром эритроцитов в гипотонической среде Таким образом, при снижении осмолярности среды установлена реакция увеличения объема ядра эритроцитов лягушек, протекающая параллельно с уменьшением морфометрических параметров клеток. Выявленный феномен возрастания объема ядра на фоне сокращения размеров клетки сопровождается увеличением показателя ЯЦО, коэффициента осмотического натяжения кариолеммы и интенсивностью использования ею резервных структур. Ядро потеряло удлиненную форму, и округлилось, о чем свидетельствует уменьшение значений коэффициента эксцентричности, в то время как клетка сохранила форму эллипсоида практически на протяжении всего времени инкубации в гипотонической среде. 216 2.5.2 Влияние функциональных нагрузок на реакции регуляции объема эритроцитов лягушек в осмотических тестах (in vitro) 2.5.2.1. Регуляция объема эритроцитов в условиях адреналиновой нагрузки Под влиянием адреналиновой нагрузки в гипотонической среде размеры эритроцитов лягушек уменьшились и оставались таковыми на протяжении всего времени инкубации (таблица 71). Таблица 71 – Линейные размеры эритроцитов лягушек под влиянием адреналиновой нагрузки Короткая ось эллипса, Высота, мкм мкм 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 13,24±0,13* 18,01±0,32 10,01±0,07* 11,57±0,32 1,96±0,01* 2,26±0,06 60 14,93±0,13* 17,08±0,16 9,65±0,07* 11,26±0,19 1,89±0,01* 2,21±0,04 90 15,91±0,17* 18,14±0,14 9,55±0,07* 11,32±0,27 1,87±0,01* 2,22±0,05 120 16,41±0,17* 17,87±0,31 9,62±0,07* 11,26±0,19 1,88±0,01* 2,21±0,04 150 16,75±0,17* 17,46±0,25 9,48±0,07* 11,07±0,24 1,85±0,01* 2,17±0,05 180 17,41±0,17* 18,13±0,22 9,74±0,07* 11,44±0,18 1,91±0,01* 2,24±0,04 210 17,72±0,17 17,51±0,29 9,98±0,07* 11,16±0,27 1,95±0,01* 2,19±0,05 240 17,20±0,18* 18,17±0,26 9,69±0,07* 10,99±0,22 1,90±0,01* 2,16±0,04 270 17,95±0,16 18,05±0,32 9,73±0,07* 10,90±0,15 1,91±0,01* 2,14±0,03 300 17,79±0,16* 18,71±0,34 9,89±0,07* 11,39±0,14 1,94±0,01* 2,23±0,03 330 17,92±0,17* 18,48±0,32 9,73±0,07* 11,24±0,15 1,91±0,01* 2,21±0,03 360 17,90±0,16 17,99±0,19 9,65±0,07* 11,04±0,14 1,89±0,01* 2,17±0,03 390 18,27±0,15 17,99±0,19 9,98±0,08* 11,04±0,14 1,96±0,02* 2,17±0,03 420 18,02±0,16 18,29±0,27 9,91±0,08* 11,19±0,19 1,96±0,02* 2,19±,04 450 18,36±0,16* 17,59±0,29 10,03±0,09* 11,46±0,15 1,97±0,02* 2,25±0,03 480 17,93±0,18 17,79±0,25 10,07±0,08* 11,44±0,12 1,97±0,01* 2,24±0,02 510 17,90±0,16 17,88±0,24 10,02±0,09* 11,54±0,15 1,96±0,02* 2,26±0,03 540 18,06±0,19 17,82±0,31 9,95±0,09* 11,18±0,14 1,95±0,02* 2,19±0,03 570 18,06±0,18 18,31±0,18 9,98±0,09* 11,44±0,12 1,96±0,02* 2,24±0,02 600 17,99±0,17 18,02±0,21 9,99±0,09* 11,44±0,8 1,96±0,02* 2,24±0,03 900 17,56±0,15 17,66±0,23 9,94±0,08* 11,09±0,21 1,95±0,02* 2,18±0,04 1800 18,08±0,20 17,89±0,36 10,59±0,11* 11,13±0,20 2,08±0,02* 2,18±0,04 3600 17,80±012 17,46±0,27 11,20±0,09 11,05±0,19 2,19±0,02* 2,16±0,04 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с Длинная ось эллипса, мкм 217 На 30 секунде инкубации длинная и короткая ось эритроцитов уменьшились соответственно на 36% и 15,5% (р<0,05), высота клеток снизилась на 15% (р<0,05) по сравнению с изотоническим раствором. На 90 секунде наблюдали уменьшение длинной и короткой осей клетки на 14% и 18% (р<0,05), высоты клетки – на 19% (р<0,05) по сравнению с изотоническим раствором. В последующие секунды инкубации различия в линейных размерах между клетками в гипо- и изотонической средах были менее выраженные. Начиная с 390 секунды воздействия, длинная ось эритроцитов в гипотоническом растворе увеличилась на 1,5% (р<0,05), к 450 секунде – на 4,3% (р<0,05), при этом короткая ось и высота клеток уменьшились на 10,6% (р<0,05; 390 секунда), 450 секунде – на 14 % (р<0,05) по сравнению с изотонической средой. К окончанию инкубации достоверных различий в линейных размерах клеток, находящихся в гипо- и изотоническом растворах не выявлено. Морфометрические параметры эритроцитов под влиянием адреналиновой нагрузки снизились в течение первых 90 секунд инкубации в гипотонической среде (таблица 72). Таблица 72 – Морфометрические параметры эритроцитов лягушек под влиянием адреналиновой нагрузки Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 Коэффициент эксцентричности 0,2% NaCl 0,65% NaCl 0,60±0,01* 0,75±0,02 0,74±0,01 0,77±0,01 0,77±0,01 0,77±0,01 0,79±0,01 0,77±0,01 0,80±0,07 0,76±0,01 0,81±0,005 0,77±0,08 0,81±0,005 0,76±0,01 0,81±0,005 0,79±0,01 0,83±0,006 0,79±0,01* 0,82±0,005 0,78±0,01* 0,83±0,005 0,79±0,01* 0,83±0,004 0,78±0,01* 0,83±0,004 0,78±0,01* 0,82±0,005 0,78±0,01* 0,83±0,005 0,75±0,01* 0,82±0,005 0,75±0,01* 0,82±0,005 0,76±0,01* 0,82±0,005 0,77±0,01* Объем, мкм3 0,2% NaCl 273,12±4,01* 286,41±4,19* 298,41±4,31* 311,04±4,25* 309,55±4,65* 341,69±595* 365,42±6,46* 333,95±5,93* 349,84±5,21* 360,54±6,45* 350,71±5,88* 345,18±6,02* 377,71±7,66* 366,41±7,16* 382,43±7,82* 376,76±7,29* 372,90±7,52* 371,84±8,32* 0,65% NaCl 498,82±24,67 469,97±15,65 482,56±22,70 468,07±17,86 442,22±17,75 490,61±18,06 455,11±22,59 456,33±20,42 441,90±13,71 504,31±18,07 482,72±17,28 452,98±12,02 452,98±12,02 473,48±17,73 477,88±16,18 478,87±11,58 492,69±14,99 459,58±13,13 Площадь поверхности, мкм2 0,2% NaCl 0,65% NaCl 168,70±1,64* 263,09±7,56 181,33±1,73* 25314±5,10 190,34±1,97* 258,63±6,64 197,10±1,32* 253,53±6,18 198,23±2,08* 243,41±5,72 212,09±2,54* 261,60±6,05 221,35±2,62* 247,16±7,94 208,52±2,46* 251,45±6,62 217,75±2,14* 247,21±5,12 220,23±2,48* 268,88±6,85 217,64±2,42* 261,60±6,39 215,67±2,39* 249,39±4,17 277,91±2,83* 249,99±4,17 223,07±2,72* 257,56±6,05 229,82±2,83* 254,94±5,92 226,05±2,90* 256,49±4,88 224,39±2,85* 260,78±5,13 224,84±3,21* 251,04±5,15 218 Продолжение таблицы 72 ВреКоэффициент эксценОбъем, мкм3 Площадь поверхности, мя, с тричности мкм2 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 570 0,82±0,005 0,77±0,01* 374,62±8,35* 494,42±11,47 225,84±3,26* 264,01±3,85 600 0,82±0,005 0,77±0,01* 374,48±8,26* 488,87±1592 225,35±3,17* 260,28±5,55 900 0,81±0,004 0,77±0,01* 365,01±7,82* 449,62±15,05 219,71±2,97* 246,81±5,13 1800 0,80±0,005 0,77±0,01* 432,67±10,27 460,56±21,38 243,26±4,07 251,44±7,86 3600 0,77±0,004 0,77±0,01 467,42±2,25 442,51±16,84 252,31±3,21 243,38±5,98 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). На 30 секунде инкубации, объем и площадь поверхности эритроцитов уменьшились соответственно на 83% и 56% (р<0,05), 60 секунде – на 64% и 40% (р<0,05), 90 секунде – на 62% и 36% (р<0,05) по сравнению с изотоническим раствором. В дальнейшем наблюдали менее выраженные различия между морфометрическими параметрами клеток в гипо- и изотонической средах. На 390 секунде инкубации объем клеток сократился на 20% (р<0,05), а площадь поверхности возросла на 11% (р<0,05), вследствие увеличения длинной оси клетки в этот период на 1,5% (р<0,05). К окончанию инкубации достоверных различий между морфометрическими параметрами клеток в гипо- и изотонической средах не выявлено. Под влиянием адреналиновой нагрузки на 30 секунде инкубации наблюдали изменение формы эритроцитов. Они стали округлые, их коэффициент эксцентричности уменьшился на 25% (р<0,05) по сравнению с изотоническим раствором (см. таблицу 72). С 60 по 240 секунды форма клеток в гипо- и изотоническом растворах была практически одинаковой. Начиная с 270 и по 1800 секунды инкубации, эритроциты в гипотоническом растворе удлинились и приобрели выраженную узко-эллипсоидную форму. Коэффициент эксцентричности клетки увеличился на 5% (р<0,05) в интервале с 270 по 420 секунды, на 11% (р<0,05) с 450 по 480 секунды, на 6% (р<0,05) с 510 по 1800 с инкубации. К окончанию воздействия значения коэффициента эксцентричности эритроцитов в гипо- и изотонической средах были одинаковыми. Линейные размеры ядра эритроцитов в гипотонической среде изменялись: на 30 секунде инкубации длинная ось ядра и его высота уменьшились соответст- 219 венно на 27% и 52% (р<0,05), при этом размер короткой оси не отличался от значений в изотоническом растворе (таблица 73). Таблица 73 – Линейные размеры ядер эритроцитов лягушек под влиянием адреналиновой нагрузки Длинная ось эллипса, Короткая ось эллипса, Высота, мкм мкм мкм 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 5,58±0,28* 7,09±0,23 4,69±0,16 4,63±0,18 0,89±0,04* 1,85±0,08 60 7,33±0,31 7,96±0,16 5,48±0,22* 4,62±0,13 1,07±0,04* 0,90±0,02 90 6,03±0,25* 8,11±0,19 4,16±0,16* 4,73±0,12 0,81±0,03* 0,92±0,02 120 5,74±0,16* 8,03±0,18 4,45±0,15 4,88±0,15 0,87±0,03* 0,96±0,03 150 6,73±0,28* 7,78±0,25 5,14±0,18 4,57±0,23 1,01±0,03* 0,89±0,04 180 5,52±0,24* 7,68±0,25 3,99±0,14* 4,51±0,20 0,78±0,03* 0,88±0,04 210 5,68±0,22* 8,06±0,19 3,97±0,12* 5,22±0,15 0,78±0,02* 1,02±0,03 240 5,92±0,19* 7,67±0,26 4,26±0,14* 5,01±0,24 0,84±0,03* 0,98±0,05 270 5,95±0,18* 7,51±0,35 4,32±0,15 4,51±0,19 0,85±0,03 0,88±0,04 300 6,18±0,17* 7,38±0,15 4,64±0,12 4,86±0,13 0,91±0,02 0,95±0,03 330 5,73±0,18* 7,78±0,13 3,91±0,11* 5,34±0,15 0,77±0,02* 1,05±0,03 360 5,64±0,18* 8,35±0,27 4,74±0,16 5,19±0,16 0,93±0,03 1,02±0,03 390 5,64±0,18* 8,35±0,27 4,74±0,16 5,19±0,16 0,93±0,03 1,02±0,03 420 6,27±0,16* 7,92±0,16 4,44±0,14* 4,98±0,11 0,87±0,03* 0,98±0,02 450 6,45±0,18* 7,76±0,19 4,46±0,15* 5,04±0,13 0,87±0,03* 0,99±0,02 480 6,26±0,18* 8,41±0,24 4,39±0,14* 5,37±0,13 0,87±0,03* 1,05±0,03 510 9,44±0,13* 7,44±0,16 8,04±0,13* 5,08±0,10 1,58±0,02* 0,99±0,02 540 5,96±0,15* 7,95±0,18 4,30±0,16* 5,26±0,12 0,89±0,03* 1,03±0,02 570 9,82±0,15* 7,78±0,14 8,33±0,14* 4,93±0,07 1,63±0,03* 0,96±0,01 600 8,31±0,29* 7,19±0,09 6,64±0,29* 4,74±0,07 1,30±0,06* 0,93±0,01 900 6,68±0,24* 8,84±0,36 4,79±0,29 5,11±0,12 0,93±0,06 1,00±0,02 1800 8,88±0,24 8,76±0,24 6,79±0,15* 5,22±0,13 1,33±0,03* 1,02±0,02 3600 9,43±0,15* 8,50±0,14 7,89±0,13* 5,14±0,08 1,55±0,02* 1,00±0,01 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с На 60 секунде инкубации ядро удлинилось по короткой оси на 19% (р<0,05), при этом увеличилась его высота на 18,8% (р<0,05), а значения длинной оси были в пределах не достоверных различий с изотоническим раствором. На 90 секунде воздействия длинная и короткая оси ядра, а также их высота уменьшились соответственно на 34%, 14% и 13,5% (р<0,05) по сравнению с изотоническим раствором. В интервале со 120 по 480 секунды инкубации в гипотонической среде длинная и короткая оси ядра уменьшались, в этот же период высота ядра также снизилась, за исключением 150 секунды, когда наблюдали ее увеличение на 13% 220 (р<0,05). На 510, 570 и 600 секундах инкубации в гипотонической среде линейные размеры ядра увеличились. Длинная и короткая оси ядра, а также их высота возросли на 510 секунде соответственно на 27%; 58% и 60% (р<0,05), на 570 секунде – на 26%, 40% и 70% (р<0,05), на 600 секунде – на 16%; 40% и 39,8% (р<0,05) по сравнению с изотоническим раствором. Установленная реакция увеличения линейных размеров ядра сохранилась до конца инкубации в гипотонической среде. Объем и площадь поверхности ядра на 30 секунде инкубации в гипотонической среде уменьшились соответственно на 39% и 31% (р<0,05) по сравнению с изотоническим раствором (таблица 74). Таблица 74 – Морфометрические параметры ядра эритроцитов лягушек под влиянием адреналиновой нагрузки Вре- Коэффициент эксценОбъем, мкм3 Площадь поверхности, мя, с тричности мкм2 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,49±0,03* 0,70±0,03 24,27±3,12* 33,66±3,10 32,27±3,02* 42,39±2,32 60 0,63±0,03* 0,80±0,01 48,26±3,51* 35,64±2,23 52,58±3,08 46,19±1,79 90 0,70±0,02* 0,78±0,02 22,88±2,66* 37,63±1,86 32,40±2,38* 47,93±1,37 120 0,57±0,04* 0,76±0,02 24,17±1,87* 40,16±2,44 32,88±1,56* 49,23±1,74 150 0,61±0,03* 0,80±0,02 39,69±3,34 34,94±4,43 45,59±2,87 45,12±3,51 180 0,65±0,03* 0,78±0,04 19,00±1,71* 32,27±2,41 28,51±1,87* 43,17±1,73 210 0,68±0,03* 0,75±0,02 19,35±1,82* 46,19±346 29,00±1,73* 53,41±2,47 240 0,66±0,03* 0,74±0,02 23,04±2,01* 41,43±4,64 32,45±1,84* 49,02±3,41 270 0,67±0,02* 0,77±0,03 24,18±2,51* 31,89±2,78 33,29±2,17* 42,54±2,44 300 0,63±0,03* 0,74±0,02 28,06±1,82* 36,74±2,22 36,82±1,58* 45,58±1,73 330 0,69±0,03* 0,71±0,02 18,60±1,37* 46,84±2,82 28,62±1,38* 52,93±1,96 360 0,50±0,04* 0,76±0,02 26,90±2,30* 48,12±3,89 34,73±196* 55,14±3,03 390 0,50±0,04* 0,76±0,02 26,90±2,30* 48,12±3,89 34,73±1,96* 55,14±3,03 420 0,68±0,02* 0,76±0,02 26,47±2,08* 40,96±2,09 35,72±1,78* 49,84±1,58 450 0,69±0,02 0,73±0,03 27,51±2,33* 40,89±2,22 36,77±1,92* 49,31±1,58 480 0,68±0,03 0,75±0,02 25,14±1,91* 50,32±2,96 34,35±1,61* 57,01±2,19 510 0,45±0,02* 0,70±0,02 126,94±5,08* 70,07±1,91 98,11±2,49* 48,01±1,47 540 0,61±0,03* 0,72±0,02 26,15±2,28* 45,85±2,32 34,80±1,89* 52,95±1,75 570 0,52±0,02* 0,76±0,01 141,26±6,05* 39,43±1,48 105,72±2,92* 48,53±1,24 600 0,57±0,03* 0,74±0,01 81,27±7,68* 33,59±1,09 72,49±4,89* 43,14±0,89 900 0,64±0,05* 0,79±0,02 33,32±4,70* 47,84±3,09 41,01±3,33* 56,59±2,67 1800 0,63±0,01* 0,78±0,02 86,07±5,51* 49,79±2,89 77,67±3,48* 57,56±2,23 3600 0,51±0,02* 0,78±0,01 122,76±4,95* 47,03±1,74 96,18±2,54* 55,09±1,31 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). 221 На 60 секунде объем и площадь поверхности увеличились на 35% и 14% (р<0,05), а начиная с 90 и по 480 секунду инкубации, вновь произошло уменьшение морфометрических параметров ядра. Наиболее выраженное сокращение объема ядра и площади поверхности наблюдали на 180 секунде соответственно на 70% и 51% (р<0,05), и 330 секунде – на 152% и 85% (р<0,05) по сравнению с изотоническим раствором. Начиная с 510 секунды и до конца инкубации (3600 секунда) морфометрические параметры ядра увеличились. На 510 секунде инкубации в гипотонической среде объем ядра возрос на 81% (р<0,05), а площадь поверхности увеличилась на 104% (р<0,05), на 570 секунде – соответственно на 258% и 118% (р<0,05), а к 3600 секунде – на 161% и 75% (р<0,05) по сравнению с изотоническим раствором. В гипотонической среде ядро приобрело округлую форму по мере увеличения времени инкубации. Коэффициент эксцентричности ядра был существенно снижен на 30 секунде (на 43%; р<0,05), 510 секунде (на 55%; р<0,05), 3600 секунде (на 53%; р<0,05) по сравнению с изотоническим раствором. Показатель ЯЦО в гипотонической среде возрос на 60 секунде на 55% (р<0,05), 150 секунде – на 28% (р<0,05), а начиная с 210 и по 480 секунды – снизился (рисунок 80). усл.ед. 0,6 0,5 0,4 0,65% NaCl 0,3 0,2% NaCl 0,2 0,1 0 с . Рисунок 80 – ЯЦО эритроцитов лягушек под влиянием адреналиновой нагрузки 222 Наиболее выраженное снижение ЯЦО на 46% (р<0,05) наблюдали в интервале 330-390 секундах гипотонического воздействия. На 510 секунде ЯЦО увеличивались на 155% (р<0,05), 570 секунде – на 142% (р<0,05), к концу инкубации (3600 секунды) – на 62,5% (р<0,05) по сравнению с изотоническим раствором. Таким образом, под влиянием адреналиновой нагрузки в гипотонической среде наблюдали уменьшение геометрических параметров эритроцитов, снижение интенсивности использования ими мембранного резерва поверхностного бассейна плазмалеммы. Регуляторное сокращение объема ядра и снижение интенсивности использования им внутриклеточных бассейнов мембранного резерва наблюдали на протяжении всего времени гипотонического воздействия. 2.5.2.2. Регуляция объема эритроцитов в пробах с обзиданом Под влиянием обзидана в гипотонической среде линейные размеры эритроцитов лягушек уменьшились. Выявленная тенденция сохранилась в течение всего времени инкубации (таблица 75). Таблица 75 – Линейные размеры эритроцитов лягушек под влиянием обзидана Время, с 30 60 90 120 150 180 210 240 270 300 Короткая ось эллипса, мкм 0,65% NaCl 0,2% NaCl 0,65% NaCl 17,47±0,44 9,62±0,07* 11,40±0,29 18,15±0,32 9,58±0,09* 12,02±0,21 17,80±0,26 9,81±0,07* 11,56±0,24 17,78±0,27 9,76±0,08* 11,43±0,17 18,00±0,23 9,64±0,09* 11,91±0,22 17,76±0,26 10,27±0,10* 12,58±0,17 18,78±0,72 10,40±0,10* 12,11±0,32 17,61±0,23 10,46±0,09* 12,53±0,11 18,59±0,24 10,38±0,09* 12,51±0,18 18,59±0,24 10,38±0,08* 12,51±0,18 Длинная ось эллипса, мкм 0,2% NaCl 13,22±0,11* 14,09±0,19* 15,41±0,18* 14,86±0,15* 15,46±0,16* 17,04±0,18* 17,14±0,20* 17,54±0,17 17,36±0,16* 17,36±0,16* Высота, мкм 0,2% NaCl 1,89±0,01* 1,88±0,02* 1,92±0,01* 1,91±0,01* 1,89±0,02* 2,01±0,02* 2,04±0,02* 2,05±0,02* 2,03±0,02* 2,04±0,02* 0,65% NaCl 2,24±0,06 2,36±0,04 2,27±0,05 2,24±0,03 2,34±0,04 2,47±0,03 2,38±0,06 2,46±0,03 2,45±0,03 2,45±0,03 223 Продолжение таблицы 75 ВреКороткая ось эллипса, Длинная ось эллипса, мкм Высота, мкм мя, с мкм 0,2% NaCl 0,65% NaCl 0.2%NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 330 17,64±0,17* 18,08±0,28 10,43±0,08* 12,75±013 2,05±0,02* 2,50±0,03 360 17,68±0,14* 18,08±0,28 10,46±0,08* 12,75±0,13 2,05±0,02* 2,50±0,03 390 17,86±0,15 17,95±0,20 10,59±0,09* 11,91±0,15 2,08±0,02* 2,34±0,03 420 17,59±0,16 17,95±0,20 10,51±0,09* 11,91±0,15 2,06±0,01* 2,34±0,03 450 17,38±0,18* 18,27±0,21 10,54±0,09* 12,31±0,15 2,07±0,02* 2,41±0,03 480 18,07±0,21 17,97±0,17 10,72±0,09* 12,09±0,12 2,10±0,02* 2,37±0,02 510 17,48±0,19* 18,12±0,11 10,47±0,09* 12,30±0,09 2,06±0,02* 2,42±0,02 540 17,47±0,17 17,88±0,13 10,28±0,11* 12,59±0,11 2,02±0,02* 2,47±0,02 570 17,54±0,21 17,66±0,12 10,51±0,10* 12,23±0,09 2,06±0,02* 2,40±0,02 600 17,69±0,17 17,49±0,14 10,45±0,11* 12,04±0,09 2,06±0,02* 2,36±0,02 900 17,72±0,17* 16,88±0,11 10,52±0,09* 12,27±0,11 2,06±0,02* 2,41±0,02 1800 18,04±0,31* 17,52±0,15 11,28±0,12* 12,24±0,13 2,21±0,02* 2,40±0,02 3600 18,21±0,15* 17,56±0,11 11,25±0,15* 12,09±0,09 2,21±0,03* 2,37±0,02 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). В течение первых 60 секунд гипотонической нагрузки, длинная, короткая оси клетки и ее высота уменьшились соответственно на 22,3%; 21% и 20,3% (р<0,05) по сравнению со значениями в изотоническом растворе. Размеры длинной оси эритроцитов уменьшились постепенно в течение трех временных интервалов: первый длительностью 210 секунд, второй – 180 секунд, третий – 60 секунд. Причем эти интервалы чередовались с 30-ти секундными промежутками времени (240, 480 и 600 секунды) в течение которых, значения длинной оси клетки достоверно не отличались от таковых в изотоническом растворе. К окончанию инкубации с 900 по 3600 секунды длинная ось эритроцитов увеличилась в среднем на 4% (р<0,05). Короткая ось клеток и высота уменьшились при помещении клеток в гипотонический раствор. Выявленная тенденция сохранились на протяжении всего периода воздействия гипотонической среды. Объем и площадь поверхности эритроцитов в условиях гипотонической нагрузки сократились Выраженное сокращение объема и площади поверхности клетки наблюдали на 30 секунде соответственно на 46,5% и 35,6% (р<0,05), 60 секунде – на 50% и 37,8% (р<0,05) и 150 секунде – на 42,5% и 30,3% (р<0,05) по сравнению с изотоническим раствором (таблица 76). 224 Таблица 76 – Морфометрические параметры эритроцитов лягушек под влиянием обзидана Коэффициент эксценОбъем, мкм3 Площадь поверхности, тричности мкм2 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,67±0,01* 0,75±0,01 258,19±4,96* 482,59±23,0 163,82±2,12* 254,46±9,22 60 0,68±0,01* 0,74±0,01 271,92±6,13* 543,38±23,11 171,81±2,88* 276,30±7,62 90 0,74±0,01 0,76±0,01 310,66±6,62* 494,24±24,48 191,58±2,96* 260,51±8,18 120 0,74±0,01 0,76±0,01 295,83±6,09* 479,88±17,06 184,06±2,59* 256,55±5,88 150 0,76±0,01 0,74±0,01 303,96±7,46* 529,06±23,01 189,08±3,13* 271,42±7,14 180 0,79±0,01* 0,69±0,01 377,34±8,54* 582,46±20,88 221,21±3,43* 284,42±6,75 210 0,77±0,01* 0,73±0,01 388,87±9,59* 562,33±22,64 225,29±3,74* 280,06±7,69 240 0,78±0,01* 0,69±0,01 398,54±8,11* 571,59±17,19 230,63±3,04* 280,75±5,59 270 0,78±0,01* 0,73±0,01 388,49±8,21* 602,02±19,96 226,58±3,05* 294,70±6,21 300 0,79±0,01* 0,73±001 388,49±8,21* 602,02±19,96 228,58±3,05* 294,70±6,21 330 0,79±0,01* 0,69±0,03 398,43±8,06* 607,70±17,98 231,06±3,10* 293,26±6,04 360 0,79±0,01* 0,69±0,03 401,59±7,67* 607,70±17,97 232,44±2,81* 293,26±6,04 390 0,79±0,01* 0,74±0,01 416,09±8,37* 526,41±14,99 237,76±3,01* 270,52±4,85 420 0,79±0,01* 0,74±0,01 402,60±7,95* 526,41±14,99 232,25±2,89* 270,52±4,85 450 0,78±0,01* 0,73±0,01 401,56±8,47* 574,54±17,41 230,70±3,27* 285,42±5,72 480 0,79±0,005* 0,74±0,01 432,24±10,13* 542,27±13,06 243,77±3,87* 275,22±4,31 510 0,78±0,01* 0,73±0,01 399,83±8,82* 568,58±10,09 230,66±3,41* 282,88±3,16 540 0,79±0,01* 0,70±0,01 385,80±8,83* 586,14±11,84 225,88±3,49* 286,14±3,66 570 0,78±0,01* 0,71±0,01 404,80±9,95* 540,46±9,46 23286±3,84* 274,30±2,39 600 0,79±0,01* 0,72±0,01 403,04±10,09* 524,66±9,75 232,55±3,61* 267,39±3,23 900 0,79±0,01* 0,67±0,01 407,91±9,17* 529,79±8,81 234,58±3,39* 264,67±3,11 1800 0,76±0,01* 0,71±0,01 483,16±16,65* 546,70±10,06 258,19±2,64* 273,06±3,73 3600 0,77±0,01* 0,72±0,01 481,92±12,37* 533,71±7,81 258,15±4,19* 269,95±2,84 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с В течение первой минуты инкубации в гипотонической среде клетка теряла эллипсоидную форму и округлялась, вследствие чего коэффициент эксцентричности уменьшился на 10,6% (р<0,05) на 30 секунде и на 8% (р<0,05) на 60 секунде инкубации по сравнению с изотоническим раствором. В интервале с 90 по 150 секунды форма клетки в гипо- и изотонической средах была одинаковой. Начиная со 180 секунды и до конца инкубации, клетки в гипотонической среде приобрели эллипсоидную форму, коэффициент эксцентричности возрос в среднем на 14% (р<0,05). При снижении осмолярности среды ядро эритроцита набухало на протяжении всего времени инкубации (таблица 77). 225 Таблица 77 – Линейные размеры ядра эритроцитов лягушек под влиянием обзидана Короткая ось эллипса, Высота, мкм мкм 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 5,97±0,21* 7,54±0,25 4,92±0,24 4,66±0,12 0,96±0,05 0,91±0,03 60 6,72±0,17* 7,30±0,20 5,23±0,14* 4,68±0,12 1,03±0,03* 0,92±0,02 90 9,09±0,14* 7,21±0,27 7,40±0,14* 4,19±0,12 1,45±0,03* 0,82±0,02 120 13,43±0,49* 7,16±0,16 8,99±0,15* 4,20±0,16 1,76±0,03* 0,82±0,03 150 13,51±0,48* 7,09±0,25 8,93±0,17* 4,52±0,16 1,75±0,03* 0,88±0,03 180 9,10±0,06* 7,50±0,21 7,69±0,06* 4,83±0,13 1,51±0,01* 0,95±0,02 210 9,00±0,07* 7,57±0,17 7,47±0,13* 4,76±0,11 1,47±0,02* 0,93±0,02 240 8,84±0,11* 7,17±0,20 7,36±0,14* 4,53±0,17 1,44±0,03* 0,89±0,03 270 8,82±0,10* 7,37±0,21 7,29±0,14* 4,67±0,09 1,43±0,03* 0,92±0,02 300 8,82±0,10* 7,37±0,21 7,29±0,14* 4,67±0,09 1,43±0,03* 0,92±0,02 330 8,69±0,12* 6,69±0,14 7,14±0,16* 4,56±0,12 1,40±0,03* 0,89±0,02 360 8,89±0,10* 6,35±0,16 7,38±0,13* 4,02±0,08 1,45±0,02* 0,79±0,01 390 8,94±0,10* 6,42±0,18 7,51±0,13* 4,22±0,09 1,47±0,02* 0,83±0,02 420 9,01±0,17* 6,42±0,18 7,47±0,15* 4,22±0,09 1,46±0,03* 0,83±0,02 450 8,87±0,11* 6,71±0,15 7,32±0,14* 4,24±0,14 1,43±0,03* 0,83±0,02 480 8,86±0,12* 6,60±0,12 7,24±0,15* 4,52±0,12 1,42±0,03* 0,88±0,02 510 8,94±0,11* 6,53±0,08 7,36±0,15* 4,35±0,08 1,44±0,03* 0,85±0,02 540 8,79±0,12* 6,82±0,14 7,15±0,16* 4,54±0,09 1,40±0,03* 0,89±0,02 570 8,81±0,09* 7,25±0,07 7,27±0,13* 4,69±0,05 1,43±0,03* 0,92±0,01 600 9,02±0,11* 7,17±0,09 7,19±0,13* 4,63±0,06 1,41±0,02* 0,91±0,01 900 9,00±0,09* 6,57±0,07 7,32±0,12* 4,10±0,07 1,44±0,02* 0,80±0,01 1800 8,94±0,10* 6,55±0,07 7,28±0,11* 4,08±0,06 1,43±0,02* 0,80±0,01 3600 9,45±0,10* 6,60±0,08 7,54±0,11* 4,09±0,07 1,48±0,02* 0,80±0,01 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с Длинная ось эллипса, мкм Значения длинной оси ядра увеличились на 30 секунде инкубации на 26% (р<0,05), при этом высота и размер короткой оси не отличались от значений в изотоническом растворе. Выраженное увеличение габаритных размеров клеток наблюдали на 120 и 150 секундах воздействия. На 120 секунде длинная и короткая оси ядра увеличились соответственно на 87,5% и 114% (р<0,05), высота – на 115% (р<0,05), 150 секунде – на 90,5%; 97,5% и 99% (р<0,05) по сравнению с изотоническим раствором. К окончанию воздействия (3600 секунда) высота ядра и его линейные размеры возросли соответственно на 46%; 42% и 84% (р<0,05) по сравнению с изотоническим раствором. Геометрические параметры ядра в гипотонической среде увеличились, начиная с 90 секунды и до окончания инкубации (таблица 78). 226 Таблица 78 – Морфометрические параметры ядра эритроцитов лягушек под влиянием обзидана Коэффициент эксценОбъем, мкм3 Площадь поверхности, тричности мкм2 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,53±0,04* 0,76±0,03 32,13±3,57 34,43±271 38,62±2,84 44,36±218 60 0,61±0,02* 0,76±0,01 39,16±2,58 33,26±2,34 45,46±2,02 43,22±1,96 90 0,56±0,02* 0,79±0,02 103,84±4,56* 26,48±1,71 86,78±2,44* 37,95±1,71 120 0,65±0,02* 0,79±0,02 252,22±16,67* 26,67±2,23 160,32±8,07* 37,79±1,81 150 0,67±0,02* 0,75±0,03 256,38±17,30* 30,00±2,23 161,44±8,18* 40,37±1,89 180 0,52±0,01* 0,73±0,03 110,99±1,92* 36,29±1,96 90,23±0,97* 45,67±1,54 210 0,54±0,01* 0,76±0,02 105,74±3,29* 35,67±1,82 87,08±1,94* 45,45±1,39 240 0,54±0,01* 0,76±0,02 101,66±3,53* 31,32±2,67 84,63±2,18* 41,23±2,23 270 0,55±0,01* 0,75±0,02 99,96±3,77* 33,66±1,97 83,64±2,23* 43,59±1,72 300 0,55±0,01* 0,75±0,02 99,96±3,77* 33,66±1,97 83,64±2,23* 43,59±1,72 330 0,56±0,01* 0,72±0,02 98,05±4,47* 29,65±1,95 81,59±2,62* 39,00±1,59 360 0,54±0,01* 0,75±0,01 103,57±3,70* 21,61±1,17 85,41±2,11* 32,39±1,13 390 0,53±0,01* 0,73±0,02 108,01±4,04* 24,22±1,52 87,51±2,23* 34,51±1,52 420 0,55±0,01* 0,73±0,02 111,63±6,23* 24,22±1,52 89,24±3,26* 34,51±1,44 450 0,55±0,01* 0,76±0,02 103,06±3,83* 25,33±1,62 84,92±2,30* 35,92±1,39 480 0,56±0,01* 0,70±0,02 101,28±4,21* 28,75±1,77 83,96±2,49* 38,09±1,41 510 0,54±0,02* 0,72±0,01 104,64±4,29* 26,24±1,18 85,64±2,39* 36,14±0,95 540 0,56±0,02* 0,72±0,02 99,09±4,39* 29,81±1,65 82,47±2,62* 39,49±1,34 570 0,55±0,01* 0,75±0,01 99,99±3,72* 33,22±0,88 83,40±2,16* 42,96±0,68 600 0,59±0,01* 0,75±0,01 101,69±3,86* 32,24±1,09 84,66±2,28* 42,06±0,90 900 0,56±0,01* 0,77±0,01 103,26±3,41* 23,64±1,00 85,65±1,96* 34,19±0,86 1800 0,55±0,02* 0,76±0,01 99,66±3,28* 23,23±0,77 84,05±1,87* 33,88±0,69 3600 0,58±0,01* 0,76±0,01 113,03±3,71* 23,62±0,92 91,91±1,97* 34,29±0,83 * Статистически достоверные различия значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с Увеличение объема ядра и площади поверхности наблюдали в течение 60 секунд – с 90 по 150 секунды инкубации. На 90 секунде увеличение объема и площади поверхности ядра составило 292% и 129% (р<0,05), на 120 секунде соответственно –845% и 324% (р<0,05), на 150 секунде –754% и 289% (р<0,05) по сравнению с изотоническим раствором. Со 180 секунды и до конца инкубации интенсивность увеличения объема ядра снизилась. Так на 180 секунде, объем и площадь поверхности ядра возросли на 296% и 97,5% (р<0,05), на 240 секунде – соответственно на 224% и 105% (р<0,05), на 300 секунде – на 196% и 92% (р<0,05), на 3600 секунде – на 378,5% и 168% (р<0,05) по сравнению с изотоническим раствором. 227 В гипотонической среде ядро теряло эллиптическую форму и приобрело округлое очертание. Коэффициент эксцентричности ядра уменьшился наиболее выражено на 30, 90 и 180 секундах инкубации соответственно на 30,2%, 29% и 28,7% (р<0,05) по сравнению с изотоническим раствором. Увеличение объема ядра в гипотонической среде, под влиянием обзидана, сопровождалось увеличением показателя ЯЦО. В течение 60 секунд, с 90 по 150 секунды инкубации, значения ЯЦО существенно увеличились (рисунок 81). усл.ед. 1,2 1 0,8 0,2% NaCl 0,6 0,65% NaCl 0,4 0,2 0 с . Рисунок 81 – ЯЦО эритроцитов лягушек под влиянием обзидана Таким образом, под влиянием обзидана установлено уменьшение морфометрических параметров клеток в гипотонической среде, отсутствие осморегуляторных реакций. При этом в течение первых 60 секунд инкубации в гипотонической среде клетка округлилась, а начиная со 180 секунды, приобрела эллиптическую форму. Ядро эритроцитов увеличилось в объеме при снижении осмолярности среды. Наиболее ярко выраженную реакцию увеличения объема ядра при гипотонической нагрузке наблюдали в течение 180 секунд (со 120 по 300 секунды). 228 2.5.2.3. Относительный мембранный резерв, используемый эритроцитами лягушек в условиях активации и блокады β-адренорецепторов В проведенном исследовании было проанализировано влияние адреналина и обзидана на развитие осморегуляторных реакций эритроцитов лягушек и их ядер в условиях гипотонической нагрузки. В качестве контроля использованы данные клеток, помещенные в гипотоническую среду, но без адреналиновой нагрузки и обзидана. Под влиянием адреналиновой нагрузки на 30 секунде инкубации клетка приобрела округлую форму в гипотонической среде, ее коэффициент эксцентричности уменьшился на 15,5% (р<0,05) по сравнению с контролем. Под влиянием обзиданом округлая форма клеток сохранилась в течение первых 60 секунд инкубации в гипотоническом растворе (таблица 79). Таблица 79 – Морфометрические параметры эритроцитов в гипотоническом растворе под влиянием адреналина и обзидана Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 900 Коэффициент эксцентричности, мкм контроль адреналин обзидан L 0,71±0,01 0,60±0,01* 0,67±0,01* 0,75±0,01 0,74±0,01L 0,68±0,01* 0,74±0,01 0,77±0,01 0,74±0,01 0,74±0,01 0,79±0,01*L 0,74±0,01 L 0,74±0,01 0,80±0,07* 0,76±0,01 0,74±0,01 0,81±0,005* 0,79±0,01* 0,73±0,01 0,81±0,005*L 0,77±0,01* L 0,74±0,01 0,81±0,005* 0,78±0,01* 0,72±0,01 0,83±0,006*L 0,78±0,01* 0,72±0,01 0,82±0,005*L 0,79±0,01* 0,69±0,01 0,83±0,005*L 0,79±0,01* L 0,70±0,01 0,83±0,004* 0,79±0,01 0,69±0,01 0,83±0,004*L 0,79±0,01* 0,71±0,01 0,82±0,005*L 0,79±0,01* L 0,71±0,01 0,83±0,005* 0,78±0,01* 0,71±0,01 0,82±0,005*L 0,79±0,01* 0,71±0,01 0,82±0,005*L 0,78±0,01* 0,69±0,06 0,82±0,005*L 0,79±0,01* L 0,67±0,01 0,82±0,005* 0,78±0,01* 0,70±0,01 0,82±0,005*L 0,79±0,01* 0,66±0,01 0,81±0,004*L 0,79±0,01* контроль 345,04±16,27 364,28±12,16 387,94±13,24 378,44±11,43 400,75±12,07 385,28±11,95 383,15±11,67 369,39±10,74 379,89±11,83 397,82±10,68 392,72±10,88 382,86±11,79 358,54±12,96 383,27±12,11 379,46±12,05 369,05±12,06 370,33±10,93 336,21±11,62 368,87±10,92 374,06±10,48 376,77±12,93 Объем, мкм3 адреналин 273,12±4,01*L 286,41±4,19* 298,41±4,31* 311,04±4,25* 309,55±4,65* 341,69±5,95*L 365,42±6,46 333,95±5,93*L 349,84±5,21*L 360,54±6,45*L 350,71±5,88*L 345,18±6,02*L 377,71±7,66L 366,41±7,16L 382,43±7,82L 376,76±7,29L 372,90±7,52L 371,84±8,32* 374,62±8,35L 374,48±8,26L 365,01±7,82L обзидан 258,19±4,96* 271,92±6,13* 310,66±6,62* 295,83±6,09* 303,96±7,46* 377,34±8,54 388,87±9,59 398,54±8,11 388,49±8,21 388,49±8,21 398,43±8,06 401,59±7,67 416,09±8,37* 402,60±7,95 401,56±8,47 432,24±10,13* 399,83±8,82 385,80±8,83* 404,80±9,95* 403,04±10,09* 407,91±9,17* 229 Продолжение таблицы 79 ВреКоэффициент эксцентричности, мкм Объем, мкм3 мя, с контроль адреналин обзидан контроль адреналин обзидан 1800 0,66±0,01 0,80±0,005*L 0,76±0,01* 366,39±10,93 432,67±10,27*L 483,16±16,65* 3600 0,68±0,01 0,77±0,004* 0,77±0,01 421,83±22,56 467,42±2,25 481,92±12,37* * Статистически достоверные различия значений род влиянием адреналина/обзидана по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Статистически достоверные различия значений под влиянием адреналиновой нагрузки по сравнению с обзиданом по критерию Стьюдента (р<0,05). В промежутке времени с 60 по 90 секунды воздействия в гипотонической среде в пробах с адреналином форма клетки не отличалась от таковой в контроле, а начиная со 120 секунды и до конца инкубации, коэффициент эксцентричности эритроцитов увеличился по сравнению с контролем, клетки приобрели эллиптическую форму. В пробах с обзиданом наблюдали аналогичную реакцию удлинения клеток, но она началась на 180 секунде. Причем под влиянием адреналиновой нагрузки коэффициент эксцентричности возрос в среднем на 5% (р<0,05) по сравнению с обзиданом. На 30 секунде инкубации объем эритроцитов под влиянием адреналина уменьшился на 26% (р<0,05), обзидана – на 34% (р<0,05) по сравнению с контролем. В течение первых 60 секунд инкубации более выраженное уменьшение объема эритроцитов в гипотонической среде наблюдали в пробах с обзиданом. На 90 секунде ситуация менялась. Уменьшение объема эритроцитов под влиянием адреналиновой нагрузки составило 30% (р<0,05) по сравнению с контролем, а под влиянием обзидана – 25% (р<0,05). В интервале со 180 по 360 секунды в пробах с адреналином объем эритроцитов уменьшился по сравнению с контролем и обзиданом. С 360 секунды и до конца инкубации объем клетки увеличился под влиянием обзидана. На 1500 секунде объема эритроцитов под влиянием адреналина увеличился на 18% (р<0,05), в этот же период под влиянием обзидана – на 32% (р<0,05) по сравнению с контролем. Под влиянием адреналина коэффициент эксцентричности ядра на 30 секунде инкубации в гипотонической среде уменьшился на 18,4% (р<0,05) по сравнению с контролем. Под влиянием обзидана форма ядер существенно не изменилась в течение первых 60 секунд воздействия гипотонической среды (таблица 80). 230 Таблица 80 – Морфометрические параметры ядра эритроцитов в гипотонической среде под влиянием адреналина и обзидана ВреКоэффициент эксцентричности, мкм Объем, мкм3 мя, с контроль адреналин обзидан контроль адреналин обзидан 30 0,58±0,02 0,49±0,03*L 0,53±0,04 40,74±1,87 24,27±3,12* 32,13±3,57* 60 0,57±0,02 0,63±0,03 0,61±0,02 58,86±4,59 48,26±3,51* 39,16±2,58* L L 90 0,61±0,02 0,70±0,02* 0,56±0,02* 45,54±4,11 22,88±2,66* 103,84±4,56* 120 0,61±0,02 0,57±0,04*L 0,65±0,02* 68,82±9,12 24,17±1,87*L 252,22±16,67* 150 0,54±0,02 0,61±0,03* 0,67±0,02* 93,48±5,10 39,69±3,34*L 256,38±17,30* 180 0,52±0,02 0,65±0,03*L 0,52±0,01 110,21±5,81 19,00±1,71*L 110,99±1,92 L L 210 0,54±0,02 0,68±0,03* 0,54±0,01 104,56±4,70 19,35±1,82* 105,74±3,29 240 0,48±0,03 0,66±0,03*L 0,54±0,01* 106,26±4,05 23,04±2,01*L 101,66±3,53 270 0,54±0,02 0,67±0,02*L 0,55±0,01 104,02±4,74 24,18±2,51*L 99,96±3,77 L L 300 0,57±0,02 0,63±0,03* 0,55±0,01 99,55±4,34 28,06±1,82* 99,96±3,77 330 0,54±0,02 0,69±0,03*L 0,56±0,01 89,65±5,33 18,60±1,37*L 98,05±4,47 360 0,54±0,02 0,50±0,04 0,54±0,01 92,33±5,32 26,90±2,30*L 103,57±3,70 L 390 0,56±0,01 0,50±0,04 0,53±0,01 96,11±6,09 26,90±2,30* 108,01±4,04 420 0,57±0,03 0,68±0,02*L 0,55±0,01 85,18±6,43 26,47±2,08*L 111,63±6,23* 450 0,54±0,03 0,69±0,02*L 0,55±0,01 100,19±5,67 27,51±2,33*L 103,06±3,83 480 0,55±0,02 0,68±0,03*L 0,56±0,01 90,80±6,24 25,14±1,91*L 101,28±4,21 L L 510 0,55±0,02 0,45±0,02* 0,54±0,02 94,76±6,67 126,94±5,08* 104,64±4,29 540 0,54±0,02 0,61±0,03*L 0,56±0,02 92,24±6,22 26,15±2,28*L 99,09±4,39 570 0,58±0,02 0,52±0,02 0,55±0,01 88,18±5,19 141,26±6,05*L 99,99±3,72 600 0,53±0,02 0,57±0,03 0,59±0,01* 89,78±5,86 81,27±7,68L 101,69±3,86 900 0,59±0,02 0,64±0,05*L 0,56±0,01 96,59±5,86 33,32±4,70*L 103,26±3,41 1800 0,56±0,02 0,63±0,01*L 0,55±0,02 107,68±5,42 86,07±5,51*L 99,66±3,28 3600 0,57±0,02 0,51±0,02*L 0,58±0,01 101,27±5,01 122,76±4,95* 113,03±3,71 * Статистически достоверные различия значений под влиянием адреналина/обзидана по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Статистически достоверные различия значений под влиянием адреналиновой нагрузки по сравнению с обзиданом по критерию Стьюдента (р<0,05). На 90 секунде коэффициент эксцентричности ядра в пробах с адреналином увеличился на 15% (р<0,05) по сравнению с контролем и 25% (р<0,05) по сравнению с обзиданом. В интервале с 360 по 390 секунды ядро приобрело округлую форму, при этом значения коэффициента эксцентричности во всех исследуемых пробах достоверно не различались. В период с 420 по 510 секунды коэффициент эксцентричности ядра в пробах с адреналином увеличился в среднем на 24% (р<0,05) по сравнению с контролем и пробами с обзиданом. На 30 секунде инкубации объем ядра, под влиянием адреналина и обзидана уменьшился соответственно на 68% и 27% (р<0,05) по сравнению с контролем. Уменьшение объема ядра под влиянием адреналина наблюдали на 180, 330 и 450 секундах инкубации соответственно на 82,7%, 79% и 72,5% (р<0,05) по сравнению с контролем. На 510 секунде объем ядра под влиянием адреналина увеличил- 231 ся по сравнению с контролем и пробами с обзиданом соответственно на 34% и 21% (р<0,05). К окончанию инкубации (3600 секунда) объем ядра в пробах с адреналином превысил значения контроля на 21% (р<0,05). Коэффициент осмотического натяжения плазмалеммы эритроцитов под влиянием адреналина и обзидана уменьшился в течение первых 90 секунд инкубации в гипотонической среде. В пробах, обработанных обзиданом, наблюдали снижение коэффициента осмотического натяжения мембраны на 60 секунде инкубации на 56% (р<0,05) по сравнению с контролем (таблица 81). Таблица 81 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы эритроцитов лягушек под влиянием адреналина и обзидана ВреПлазмалемма, усл. ед. Кариолемма, усл. ед. мя, с контроль адреналин обзидан контроль адреналин обзидан 30 0,80±0,03 0,71±0,03 0,77±0,02 0,94±0,04 0,87±0,11 0,86±0,70 60 0,86±0,02 0,75±0,02*L 0,55±0,03* 1,24±0,07 1,18±0,08L 1,06±0,08 90 0,84±0,02 0,69±0,02* 0,65±0,04* 1,01±0,07 0,65±0,04*L 2,46±0,13* 120 0,89±0,02 0,71±0,02 0,71±0,02 1,51±0,13 0,71±0,05*L 2,57±0,14* L 150 0,84±0,02 0,76±0,03* 0,68±0,03* 1,73±0,10 1,07±0,14*L 2,25±0,11* 180 0,84±0,02 0,69±0,02*L 0,77±0,02* 2,00±0,09 0,64±0,06*L 2,03±0,08* L 210 0,76±0,02 0,81±0,04* 0,79±0,05 1,81±0,08 0,58±0,07*L 1,96±0,08 L 240 0,79±0,01 0,76±0,03 0,81±0,02 1,68±0,07 0,67±0,05*L 2,17±0,17* 270 0,77±0,02 0,86±0,02*L 0,74±0,02 1,67±0,06 0,84±0,06*L 2,05±0,08* L 300 0,83±0,02 0,81±0,03 0,74±0,02* 1,79±0,07 0,85±0,05*L 2,05±0,08* 330 0,70±0,02 0,84±0,04* 0,80±0,02* 1,49±0,08 0,59±0,04*L 2,47±0,10* L 360 0,79±0,02 0,92±0,03* 0,82±0,02* 1,75±0,09 0,63±0,06*L 3,00±0,11* 390 0,59±0,02 0,92±0,03*L 0,87±0,02* 1,76±0,09 0,63±0,06*L 3,01±0,17* L 420 0,79±0,04 0,93±0,03* 0,87±0,02* 1,87±0,13 0,72±0,04*L 3,20±0,20* L 450 0,78±0,02 0,95±0,04* 0,84±0,02* 1,82±0,08 0,74±0,05*L 2,75±0,17* 480 0,80±0,03 0,87±0,02L 0,94±0,03* 1,72±0,09 0,63±0,05*L 2,48±0,10* 510 0,78±0,02 0,85±0,02* 0,85±0,01* 1,87±0,11 2,09±0,08L 2,60±0,09* 540 0,70±0,02 0,87±0,04* 0,82±0,01* 1,74±0,09 0,65±0,04*L 2,43±0,13* 570 0,77±0,02 0,85±0,03* 0,88±0,02* 1,90±0,13 2,10±0,13L 2,01±0,07 600 0,72±0,03 0,86±0,03* 0,90±0,02* 1,87±0,09 1,77±0,15L 2,24±0,07* 900 0,90±0,02 1,03±0,05* 0,92±0,03 1,81±0,09 0,77±0,09*L 4,98±0,24* 1800 0,9±0,02 0,98±0,05* 0,96±0,03* 1,89±0,08 1,39±0,09*L 2,57±0,09* 3600 1,03±0,04 1,06±0,04* 1,00±0,06 1,94±0,08 1,78±0,08L 2,79±0,13* * Статистически достоверные различия значений под влиянием адреналина/обзидана по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Статистически достоверные различия значений под влиянием адреналиновой нагрузки по сравнению с обзиданом по критерию Стьюдента (р<0,05). На 120 и 3600 секундах инкубации коэффициент осмотического натяжении плазмалеммы во всех исследуемых пробах был практически одинаковым, что 232 свидетельствует об установлении равновесия между потоками веществ в клетку и из нее. Начиная со 150 секунды инкубации в пробах с адреналином, изменения коэффициента осмотического натяжения плазмалеммы, протекали циклически. 60-ти секундные периоды уменьшения коэффициента натяжении плазмалеммы чередовались с 90 секундными циклами увеличения коэффициента натяжения плазмалеммы. Под влиянием обзидана коэффициент осмотического натяжения плазмалеммы увеличился по сравнению с контролем и пробами с адреналином в период с 330 по 3600 секунды инкубации. Коэффициент осмотического натяжения кариолеммы под влиянием адреналина снизился, а обзидана – увеличился на протяжении практически всего времени инкубации в гипотонической среде по сравнению с контролем (см. таблицу 81). Под влиянием адреналиновой нагрузки ни клетка, ни ядро не участвовали в осморегуляторных реакциях. В условиях блокады β-адренорецепторов клетки не участвовали в реакциях осморегуляции и не использовали мембранный резерв плазмалеммы, в то время как ядро вовлекало ≈73% внутриклеточного мембранного резерва в реакциях регуляции объема на 120 секунде инкубации в гипотонической среде. Таким образом, под влиянием адреналина в гипотонической среде объем эритроцитов и их ядер уменьшился, коэффициент осмотического натяжения мембран снизился, и использование мембранного резерва клеточными структурами уменьшилось. Под влиянием обзидана в гипотонической среде ядра эритроцитов приобрели округлую форму вследствие интенсивного увеличения объема. В условиях блокады β-адренорецепторов коэффициент осмотического натяжения кариолеммы увеличился, ядро интенсивно использовало внутриклеточные бассейны мембранного резерва. 233 2.5.2.4 Сравнительный анализ регуляции объема эритроцитов в изотонической среде в условиях активации и блокады β-адренорецепторов При инкубации эритроцитов в изотонической среде в течение первых 150 секунд коэффициент эксцентричности клеток увеличился как в пробах с адреналином, так и с обзиданом (таблица 82). Таблица 82 – Морфометрические параметры эритроцитов в изотонической среде под влиянием адреналина и обзидана Вре- Коэффициент эксцентричности, мкм Объем, мкм3 мя, с контроль адреналин обзидан контроль адреналин обзидан 30 0,79±0,01 0,75±0,02 0,75±0,01 463,60±19,46 498,82±24,67 482,59±23,0 60 0,66±0,01 0,77±0,01* 0,74±0,01* 532,74±8,58 469,97±15,65*L 543,38±23,11 90 0,65±0,01 0,77±0,01* 0,76±0,01* 553,20±11,70 482,56±22,70* 494,24±24,48 120 0,72±0,01 0,77±0,01* 0,76±0,01* 494,84±6,24 468,07±17,86 479,88±17,06 150 0,70±00,1 0,76±0,01* 0,74±0,01* 536,13±10,33 442,22±17,75*L 529,06±23,01 180 0,69±0,01 0,77±0,08*L 0,69±0,01 514,79±7,21 490,61±18,06L 582,46±20,88* 210 0,70±0,01 0,76±0,01* 0,73±0,01 556,47±8,54 455,11±22,59*L 562,33±22,64 240 0,69±0,01 0,79±0,01*L 0,69±0,01 534,39±7,07 456,33±20,42*L 571,59±17,19 270 0,69±0,01 0,79±0,01*L 0,73±0,01 547,32±8,77 441,90±13,71*L 602,02±19,96* 300 0,72±0,01 0,78±0,01*L 0,73±001 542,18±9,64 504,31±18,07*L 602,02±19,96* L 330 0,72±0,01 0,79±0,01* 0,69±0,03 547,54±9,57 482,72±17,28*L 607,70±17,98* 360 0,70±0,01 0,78±0,01*L 0,69±0,03 540,69±8,73 452,98±12,02*L 907,70±17,97* L 390 0,67±0,03 0,78±0,01* 0,74±0,01* 521,17±15,75 452,98±12,02*L 526,41±14,99 420 0,74±0,01 0,78±0,01*L 0,74±0,01 500,40±13,45 473,48±17,73L 526,41±14,99 L 450 0,74±0,01 0,75±0,01 0,73±0,01 495,81±11,44 477,88±16,18 574,54±17,41* 480 0,72±0,01 0,75±0,01 0,74±0,01 510,74±8,77 478,87±11,58*L 542,27±13,06 510 0,71±0,01 0,76±0,01* 0,73±0,005 505,17±8,48 492,69±14,99L 568,58±10,09* L L 540 0,70±0,01 0,77±0,01* 0,70±0,01 523,08±9,55 459,58±13,13* 586,14±11,84* 570 0,72±0,01 0,77±0,01*L 0,71±0,01 530,38±10,9 494,42±11,47*L 540,46±9,46 600 0,72±0,01 0,77±0,01*L 0,72±0,01 536,78±11,13 488,87±15,92*L 524,66±9,75 900 0,67±0,01 0,77±0,01*L 0,67±0,01 487,21±6,72 449,62±15,05*L 529,79±8,81* L 1800 0,67±0,01 0,77±0,01* 0,71±0,01* 460,91±6,23 460,56±21,38L 546,70±10,06 3600 0,65±0,01 0,77±0,01*L 0,72±0,01* 479,94±6,46 442,51±16,84L 533,71±7,81* * Статистически достоверные различия значений под влиянием адреналина/обзидана по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Статистически достоверные различия значений под влиянием адреналиновой нагрузки по сравнению с обзиданом по критерию Стьюдента (р<0,05). Под влиянием адреналина в изотонической среде наблюдали наиболее выраженные изменения формы. На 60 секунде инкубации коэффициент эксцентрич- 234 ности эритроцитов увеличился на 26% (р<0,05) в пробах с адреналином, и на 12% (р<0,05) в пробах с обзиданом. Наиболее выраженное увеличение коэффициента эксцентричности эритроцитов наблюдали на 240 и 900 секундах соответственно на 14,5% и 15% (р<0,05) по сравнению с контролем. К окончанию воздействия коэффициент эксцентричности клеток в пробах с адреналином и обзиданом возрос соответственно на 18% и 10% (р<0,05) по сравнению с контролем. В изотонической среде объем эритроцитов под влиянием адреналиновой нагрузки уменьшился и оставался таковым на протяжении всего времени инкубации, при этом, в пробах преинкубированных с обзиданом – увеличился по сравнению с контролем (см. таблицу 82). На 60 секунде инкубации объем эритроцитов под влиянием адреналиновой нагрузки сократился на 11,8% (р<0,05) по сравнению с контролем и 13,5% (р<0,05) по сравнению с пробами, обработанными обзиданом. Существенное уменьшение объема клеток, под влиянием адреналина отмечали на 270 и 360 секундах, соответственно на 19% и 16% (р<0,05) по сравнению с контролем, и на 26,5% и 50% (р<0,05) по сравнению с пробами, проинкубированными с обзиданом. К окончанию инкубации (3600 с) значения объема эритроцитов после адреналиновой нагрузки практически восстановились до контрольных, а в пробах с обзиданом были повышены на 11,2% (р<0,05) по сравнению с контролем. Изменения формы ядра эритроцитов под влиянием адреналина и обзидана наблюдали в течение 150 секунд от начала инкубации клеток в изотонической среде, а так же в конце с 900 по 3600 секунды. Под влиянием адреналина на 30 секунде инкубации коэффициент эксцентричности ядра снизился на 5,4% (р<0,05) по сравнению с контролем и 8% (р<0,05) по сравнению с пробами с обзиданом (таблица 83). Таблица 83 – Морфометрические параметры ядер эритроцитов в изотонической среде под влиянием адреналина и обзидана Время, с 30 60 90 Коэффициент эксцентричности, мкм контроль адреналин обзидан 0,74±0,01 0,70±0,01*L 0,76±0,03 0,76±0,01 0,80±0,01*L 0,76±0,01 0,77±0,01 0,78±0,02 0,79±0,02 Объем, мкм3 контроль 42,72±1,88 38,83±1,37 42,11±1,75 адреналин 33,66±3,10* 35,64±2,23 37,63±1,86L обзидан 34,43±2,71* 33,26±2,34 26,48±1,71* 235 Продолжение таблицы 83 Вре- Коэффициент эксцентричности, мкм Объем, мкм3 мя, с контроль адреналин обзидан контроль адреналин обзидан 120 0,69±0,02 0,76±0,02* 0,79±0,02* 34,12±2,05 40,16±2,44L 26,67±2,23* L 150 0,76±0,02 0,80±0,02* 0,75±0,03 38,64±2,72 34,94±4,43 30,00±2,23* 180 0,75±0,02 0,78±0,04L 0,73±0,03 36,02±1,49 32,27±2,41 36,29±1,96 L 210 0,72±0,02 0,75±0,02 0,76±0,02 42,37±2,78 46,19±3,46 35,67±1,82* 240 0,76±0,02 0,74±0,02 0,76±0,02 45,76±2,87 41,43±4,64L 31,32±2,67* 270 0,77±0,01 0,77±0,03 0,75±0,02 43,82±1,74 31,89±2,78* 33,66±1,97* 300 0,70±0,02 0,74±0,02 0,75±0,02 40,82±2,07 36,74±2,22 33,66±1,97* 330 0,79±0,01 0,71±0,02* 0,72±0,02* 44,48±2,07 46,84±2,82L 29,65±1,95* L 360 0,72±0,02 0,76±0,02 0,75±0,01 38,67±2,13 48,12±3,89 21,61±1,17* 390 0,76±0,02 0,76±0,02 0,73±0,02 38,40±1,91 48,12±3,89L 24,22±1,52* L 420 0,74±0,02 0,76±0,02 0,73±0,02 32,57±1,90 40,96±2,09 24,22±1,52* 450 0,75±0,02 0,73±0,03 0,76±0,02 37,13±1,39 40,89±2,22L 25,33±1,62* L 480 0,75±0,01 0,75±0,02 0,70±0,02 36,76±1,41 50,32±2,96* 28,75±1,77* 510 0,76±0,01 0,70±0,02* 0,72±0,01* 34,79±1,76 70,07±1,91*L 26,24±1,18* 540 0,75±0,02 0,72±0,02 0,72±0,02 37,36±1,78 45,85±2,32*L 29,81±1,65* 570 0,79±0,01 0,76±0,01 0,75±0,01* 31,28±1,77 39,43±1,48 33,22±0,88 600 0,73±0,02 0,74±0,01 0,75±0,01 32,64±1,50 33,59±1,09 32,24±1,09 L 900 0,69±0,02 0,79±0,02* 0,77±0,01* 37,76±1,42 47,84±3,09* 23,64±1,00* 1800 0,70±0,02 0,78±0,02* 0,76±0,01* 40,42±1,59 49,79±2,89L 23,23±0,77* L 3600 0,72±0,01 0,78±0,01* 0,76±0,01* 36,28±1,47 47,03±1,74* 23,62±0,92* * Статистически достоверные различия значений под влиянием адреналина/обзидана по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Статистически достоверные различия значений под влиянием адреналиновой нагрузки по сравнению с обзиданом по критерию Стьюдента (р<0,05). На 60, 120 и 150 секундах инкубации коэффициент эксцентричности ядра увеличился в среднем на 5% (р<0,05) по сравнению с контролем. Под влиянием обзидана коэффициент эксцентричности возрос к 120 секунде на 14,5% (р <0,05) по сравнению с контролем и 4% (р<0,05) по сравнению с пробами, обработанными адреналином. В интервалах 180-300 и 360-480 секунды статистически достоверных различий между значениями коэффициента эксцентричности ядра в исследуемых пробах не выявлено. На 330 секунде коэффициент эксцентричности ядра в пробах, как под влиянием адреналиновой нагрузки, так и обзидана, был снижен соответственно на 10% и 8,8% (р<0,05) по сравнению с контролем. К окончанию инкубации (3600 секунда) в изотоническом растворе коэффициент эксцентричности ядра увеличился в пробах с адреналином на 8% (р<0,05), с обзиданом – на 5% (р<0,05) по сравнению с контролем. 236 Под влиянием, как адреналина, так и обзидана объем ядра в изотонической среде в первые 30 секунд инкубации снизился соответственно на 21,2% и 19,4% (р<0,05) по сравнению с контролем. Под влиянием обзидана наблюдали более выраженное уменьшение объема ядра, начиная с 90 секунды и до конца инкубации (см. таблица 83). Под влиянием адреналина ядро увеличило свой объем, начиная с 330 секунды и до конца инкубации в изотонической среде. На 510 секунде воздействия объем ядра в изотонической среде под влиянием адреналиновой нагрузки увеличился на 101% (р<0,05) по сравнению с контролем и 167% (р<0,05) по сравнению с пробами, проинкубированными с обзиданом. К окончанию инкубации (3600 секунда) объем ядра под влиянием адреналиновой нагрузки превышал значения в контроле и пробах, обработанных обзиданом соответственно на 30 и 99% (р<0,05). В условиях как активации, так и блокады β-адренорецепторов в изотонической среде не выявлено развитие осморегуляторных реакций и использование мембранных бассейнов ни клетками, ни ядрами. Таким образом, под влиянием адреналина в изотоническом растворе клетка и ядро приобрели эллипсоидную форму. Коэффициент эксцентричности клетки возрос, а ее объем уменьшился, в результате чего клетка не задействовала мембранные резервы в регуляции объема. 2.5.2.5 Регуляция объема эритроцитов в условиях кальциевой нагрузки Под влиянием кальциевой нагрузки в условиях гипоосмотического воздействия линейные размеры эритроцитов лягушек уменьшились. Выявленная осо- 237 бенность сохранилась на протяжении большего времени инкубации в гипотоническом растворе (таблица 84). Таблица 84 – Линейные размеры эритроцитов лягушек под влиянием кальциевой нагрузки Время, с 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 900 1800 3600 Короткая ось эллипса, мкм 0,65% NaCl 0,2% NaCl 0,65% NaCl 23,57±0,24 12,12±0,14* 12,72±0,22 23,90±0,21 11,77±0,11* 12,43+0,18 23,72±0,25 11,58±0,13* 12,23±0,27 23,07±0,23 11,64±0,12* 13,51±0,16 24,25±0,28 11,81±0,15* 13,39±0,20 24,83±0,27 11,39±0,13* 13,±0,1663 23,88±0,26 11,40±0,11* 13,±0,1838 23,66±0,33 11,23±0,13* 13,24±0,16 23,76±0,19 11,42±0,18* 12,73±0,17 23,44±0,36 11,20±0,17* 11,88±0,26 23,12±0,20 11,27±0,09* 13,32±0,15 24,77±0,23 11,33±0,12* 13,64±0,16 24,13±0,22 11,38±0,11* 13,38±0,15 23,65±0,26 11,33±0,11* 13,1±0,156 23,74±0,21 11,15±0,11* 12,37±0,16 23,26±0,35 11,19±0,12* 12,27±0,27 23,64±0,21 11,01±0,12* 13,52±0,15 24,82±0,23 11,08±0,12* 13,55±0,13 23,72±0,24 11,07±0,15** 13,43±0,15 23,68±0,27 11,43±0,13* 13,14±0,13 24,31±0,23 13,42±0,16* 13,62±0,14 23,78±0,23 12,97±0,12* 13,31±0,13 23,75±0,18 13,66±0,13* 12,64±0,16 Длинная ось эллипса, мкм 0,2% NaCl 18,75±0,25* 19,82±0,24* 21,09±0,28* 21,09±0,28* 21,35±0,29* 21,79±0,28* 21,50±0,30* 21,89±0,29* 21,97±0,33* 21,94±0,36* 21,78±0,24* 21,79±0,26* 21,52±0,29* 21,22±0,28* 21,52±0,28* 21,69±0,28* 21,41±0,33* 21,67±0,28* 22,24±0,35* 22,08±0,25* 24,32±0,26 23,08±0,23 22,96±0,22 Высота, мкм 0,2% NaCl 2,38±0,03* 2,31±0,02* 2,28±0,02* 2,27±0,02* 2,32±0,03* 2,23±0,02* 2,24±0,02* 2,20±0,02* 2,24±0,03* 2,19±0,03* 2,21±0,02* 2,22±0,02* 2,23±0,02* 2,22±0,02* 2,19±0,02* 2,19±0,02* 2,16±0,02* 2,17±0,02* 2,17±0,03* 2,24±0,03* 2,63±0,03 2,55±0,02 2,68±0,02* 0,65% NaCl 2,49±0,04 2,44±0,03 2,40±0,05 2,65±0,03 2,63±0,04 2,67±0,03 2,63±0,03 2,59±0,03 2,49±0,03 2,33±0,05 2,61±0,03 2,68±0,03 2,63±0,03 2,58±0,03 2,43±0,03 2,41±0,05 2,65±0,03 2,66±0,03 2,63±0,03 2,58±0,03 2,67±0,03 2,61±0,02 2,48±0,03 Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). * На 30 секунде инкубации длинная и короткая оси клетки уменьшились соответственно на 20,4% и 4,7% (р<0,05), а высота снизилась – на 4,4% (р<0,05) по сравнению с изотоническим раствором. В последующие секунды инкубации сохранилась тенденция к уменьшению размеров клетки. К концу воздействия, начиная с 900 и по 3600 секунды, наблюдали набухание клетки в гипотонической среде. На 3600 секунде короткая ось эритроцита и его высота увеличились соответственно на 8% и 7% (р<0,05) по сравнению с изотоническим раствором. 238 Морфометрические параметры клеток в гипотонической среде уменьшились. Выраженное снижение объема и сокращение площади поверхности эритроцитов наблюдали на 30 секунде, соответственно на 28% и 22,4% (р<0,05), 180 секунде – на 38% и 27% (р<0,05), 360 секунде – на 39% и 27,5% (р<0,05) и 540 секунде – на 41,3% и 29% (р<0,05) по сравнению с изотоническим раствором (таблица 85). Таблица 85 – Морфометрические параметры эритроцитов лягушек под влиянием кальциевой нагрузки Время, с Коэффициент эксцентричОбъем, мкм3 Площадь поверхности, мкм2 ности 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,73±0,01* 0,84±0,006 571,03±14,01* 796,66±28,65 391,81±6,23* 505,06±11,21 60 0,79±0,01* 0,85±0,005 573,14±14,01* 766,63±23,18 398,74±6,65* 497,23±9,15 90 0,82±0,01 0,85±0,006 592,01±16,54* 750,18±34,18 413,01±7,73* 486,69±13,62 120 0,82±0,07* 0,81±0,005 598,14±16,34* 874,98±24,15 415,79±7,62* 530,92±9,56 150 0,82±0,07 0,83±0,005 626,33±16,35* 912,82±34,01 427,84±8,11* 550,31±13,28 180 0,84±0,01 0,83±0,005 590,74±16,52* 958,06±27,69 416,55±7,59* 571,05±10,81 210 0,84±0,01 0,82±0,006 582,97±15,08* 887,06±26,15 412,29±7,39* 540,20±9,81 240 0,85±0,005 0,82±0,007 582,02±18,46* 862,18±27,07 413,14±8,59* 530,07±10,97 270 0,84±0,007 0,84±0,005 607,00±21,14* 800,42±21,99 421,15±9,99* 508,07±8,49 300 0,84±0,007 0,86±0,005 582,85±23,74* 714,19±27,67 410,99±10,29* 471,49±12,37 330 0,85+0,004* 0,81±0,005 575,81±13,52* 853,52±22,09 411,24±6,39* 523,26±8,71 360 0,84±0,005 0,83±0,003 584,42±15,74* 963,60±26,65 414,28±7,30* 571,89±10,45 390 0,84±0,006 0,83±0,005 580,69±15,54* 896,99±22,38 411,52±7,27* 545,30±8,44 420 0,83±0,006 0,82±0,006 564,41±13,23* 853,43±23,95 403,59±6,45* 528,48±9,52 450 0,84±0,005 0,84±0,005 556,84±14,05* 756,23±20,31 401,93±6,86* 492,07±8,16 480 0,85±0,005 0,84±0,006 567,09±15,29* 755,50±28,87 406,62±7,33* 485,46±12,67 510 0,84±0,006 0,82±0,004 545,31±14,81* 899,68±23,73 396,17±7,79* 542,37±9,24 540 0,85+0,006 0,83±0,004 554,53±14,73* 945,27±22,61 401,58±7,07* 566,80±8,83 570 0,85±0,005 0,82±0,006 566,86±15,85* 889,24±23,80 407,42±7,94* 539,69±9,16 600 0,84±0,006 0,82±0,007 600,48±15,29* 849,01±21,64 422,32±6,86* 525,77±8,78 900 0,83±0,005 0,82±0,005 918,43±25,68* 938,40±23,70 552,63±10,05* 560,63±9,09 1800 0,82±0,004 0,82±0,005 808,15±18,50* 875,25±20,05 507,05±7,56* 535,35±7,85 3600 0,79±0,006* 0,84±0,005 887,59±20,06* 789,42±20,63 534,59±7,85* 504,30±8,07 * Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). К окончанию инкубации на 3600 секунде клетка набухала, ее объем и площадь поверхности возросли на 12% и 6 % (р<0,05) по сравнению с изотоническим раствором. В течение первой минуты инкубации в гипотонической среде форма эритроцита из эллиптической преобразовалась в округлую, при этом коэффициент эксцентричности на 30 секунде снизился на 13 % (р<0,05), 60 секунде – на 7% 239 (р<0,05) по сравнению с изотоническим раствором. В последующие секунды инкубации клетка вновь приобрела удлиненную форму, статистически достоверных различий по коэффициенту эксцентричности между эритроцитами в гипо- и изотонической средах не выявлено (см. таблица 85). В конце инкубации на 3600 секунде коэффициента эксцентричности эритроцита уменьшился на 6% (р<0,05) по сравнению с изотоническим раствором. В гипотонической среде высота и короткая ось ядра существенно увеличились, при этом выраженных изменений размеров длинной оси не наблюдали (таблица 86). Таблица 86 – Линейные размеры ядер эритроцитов лягушек под влиянием кальциевой нагрузки Короткая ось эллипса, Высота, мкм мкм 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 7,88±0,20 8,29±0,36 5,36±0,13 4,74±0,15 1,05±0,02* 0,93±0,03 60 8,21±0,30 8,14±0,30 5,67±0,13 5,19±0,18 1,11±0,03* 1,01±0,04 90 8,76±0,17 9,76±0,47 6,59±0,19* 5,23±0,24 1,29±0,04* 1,02±0,04 120 8,33±0,20 8,20±0,28 5,71±0,21* 4,85±0,14 1,12±0,04* 0,95±0,03 150 8,63±0,17 8,22±0,24 6,42±0,22* 4,85±0,14 1,26±0,04* 0,94±0,03 180 8,03±0,18 8,29±0,29 5,36±0,15* 4,93±0,14 1,05±0,03 0,96±0,03 210 7,61±0,18 8,17±0,23 5,50±0,13* 4,90±0,13 1,08±0,02* 0,78±0,01 240 8,03±0,18 7,85±0,24 6,02±0,17* 4,84±0,16 1,18±0,03* 0,95±0,03 270 7,86±0,19 7,97±0,26 5,97±0,19* 4,87+0,16 1,17±0,04* 0,96±0,03 300 8,73±0,18* 7,97±0,26 6,26±0,14* 4,87±0,16 1,22±0,03* 0,96±0,03 330 8,87±0,27* 7,89±0,22 5,78±0,22* 4,71±0,13 1,13±0,04* 0,78±0,01 360 8,73±0,26* 7,88±0,22 5,57±0,18* 4,71±0,13 1,09±0,03* 0,92±0,02 390 8,06±0,25 8,00±0,28 5,61±0,12* 4,69±0,14 1,10±0,02* 0,92±0,03 420 8,84±0,26 8,00±0,28 6,54±0,19* 4,69±0,14 1,28±0,04* 0,92±0,03 450 8,65±0,28 8,64±0,23 5,54+0,21* 5,03±0,10 1,09±0,04* 0,98±0,02 480 8,52±0,19 8,65±0,23 6,09±0,19* 5,03±0,10 1,19±0,04* 0,99±0,02 510 8,44±0,27 8,65±0,23 5,93±0,17* 5,03±0,10 1,16±0,03* 0,98±0,02 540 8,29±0,22 8,65±0,23 6,09±0,19* 5,03±0,10 1,19±0,04* 0,99±0,02 570 9,10±0,19* 8,25+0,33 6,55±0,21* 4,80±0,16 1,28±0,04* 0,94±0,03 600 9,09±0,33* 8,25±0,33 5,79+0,25* 4,81±0,16 1,13±0,04* 0,94±0,03 900 10,51±0,21* 8,64±0,23 6,92±0,27* 5,03±0,10 1,36±0,05* 0,99±0,02 1800 10,82±0,32 8,65±0,23 7,19±0,33* 5,03+0,10 1,41±0,06* 0,98±0,02 3600 10,32±0,07 8,65±0,23 7,34±0,19* 5,03±0,10 1,44±0,04* 0,98±0,02 * Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с Длинная ось эллипса, мкм 240 На 30 секунде инкубации размер короткой оси ядра и его высота увеличились на 13 % (р<0,05), 90 секунде – на 26% (р<0,05), 150 секунде – на 34% (р<0,05) по сравнению с изотоническим раствором. Увеличение размеров длинной оси ядра наблюдали в интервале с 300 по 360 секунды инкубации в среднем на 10% (р<0,05). Максимальное увеличение линейных размеров ядра зафиксировано на 3600 секунде, когда длинная и короткая оси ядра, а также его высота возросли соответственно на 19%, 46% и 47% (р<0,05) по сравнению с изотоническим раствором. Объем и площадь поверхности ядра увеличились практически на протяжении всего времени инкубации в гипотонической среде (таблица 87). Таблица 87 – Морфометрические параметры ядра эритроцитов лягушек под влиянием кальциевой нагрузки Время, с Коэффициент эксцентричности 0,2% NaCl 0,65% NaCl 30 0,71±0,02* 0,81±0,02 60 0,69±0,03* 0,75±0,02 90 0,63±0,02 * 0,83±0,02 120 0,71±0,02* 0,79±0,02 150 0,64±0,02* 0,79±0,01 180 0,72±0,02 0,78±0,02 210 0,65±0,02* 0,78±0,01 240 0,64±0,02* 0,77±0,02 270 0,63±0,02* 0,78±0,01 300 0,67±0,02* 0,77±0,01 330 0,72±0,03 0,78±0,01 360 0,74±0,02 0,78±0,01 390 0,69±0,03* 0,79±0,01 420 0,64±0,02* 0,79±0,01 450 0,74±0,03 0,79±0,01 480 0,67±0,02* 0,79±0,01 510 0,67±0,03* 0,79±0,01 540 0,64±0,03* 0,79±0,01 570 0,66±0,03* 0,79±0,02 600 0,75±0,02 0,79±0,02 900 0,71+0,03* 0,79±0,01 1800 0,73±0,02* 0,79±0,01 3600 0,68±0,02* 0,79±0,01 * Достоверность различий значений в по критерию Стьюдента (р<0,05). Объем, мкм3 Площадь поверхности, мкм2 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 47,23±3,05* 39,86±3,62 73,62±2,90* 67,39±4,33 55,82±3,76* 46,62±4,23 81,75±3,69* 73,34±4,52 83,16±6,72* 55,97±4,69 103,78±5,00* 85,99±5,06 58,10±4,81* 49,53±4,09 83,62±4,56 79,68±4,45 79,37±7,39* 40,97±3,18 99,82±5,54* 68,24±3,66 48,69±3,05 43,14±3,27 74,95±2,97 70,29±3,60 49,54±3,22 42,15±2,73 74,76±3,04 69,07±2,98 61,81±4,48* 39,67±3,53 86,12±3,96* 65,88±3,82 60,49±4,85* 41,11±3,68 84,33±4,43* 67,48±4,00 73,00±4,81* 41,11±3,68 96,73±3,83* 67,48+4,00 63,93±5,31* 37,55±2,66 89,55±4,95* 64,02±2,98 57,47±4,45* 37,55±2,66 84,13±4,13* 64,02+2,98 52,95±3,19* 37,95±3,07 79,20±3,25* 64,71±3,55 80,83±6,32* 37,95±3,07 102,98±5,24* 64,71±3,55 56,54±5,12 46,62±2,52 83,14±4,66 74,55±2,83 68,38±5,38* 46,62±2,52 92,21±4,59* 74,56±2,83 63,02±4,82* 46,62±2,52 88,19±4,27* 74,56±2,83 64,93±4,76* 46,62±2,52 89,42±4,18* 74,56±2,83 81,33±5,19* 40,86±3,58 104,62±3,97* 68,19±4,13 65,81±6,99* 40,86±3,58 91,49±6,01* 68,19±4,13 110,96±9,56* 46,62±2,52 127,55±6,69* 74,55±2,83 138,29±13,69* 46,62±2,52 142,71±9,96* 74,55±2,83 125,90±8,57* 46,62±2,52 136,33±5,85* 74,55±2,83 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl 241 Объем ядра возрастал циклически, первый период от начала инкубации и до 150 секунды, второй период длительностью 180 секунд (с 240 по 420 секунды) и третий период с 480 секунды и до конца воздействия. Периоды увеличения объема ядра чередовались с 30-ти секундными интервалами, в течение которых значения объема и площади поверхности в гипотонической среде были максимально приближены к показателям изоосмотического раствора. Существенное увеличение объема и площади поверхности ядра наблюдали на 90 секунде инкубации соответственно на 48,5% и 20,6% (р<0,05), 420 секунде – на 113% и 59% (р<0,05), 900 секунде – на 197% и 91% (р<0,05) по сравнению с изотоническим раствором. В течение всего периода инкубации в гипотонической среде коэффициент эксцентричности ядра был снижен, что свидетельствует о приобретении ими сферической формы. На 30 секунде коэффициент эксцентричности уменьшился на 12% (р<0,05), на 90 секунде – на 24% (р<0,05), на 420 секунде – на 18% (р<0,05), к концу инкубации на 3600 секунде – на 14% (р<0,05) по сравнению с изотоническим раствором. При снижении осмолярности среды, показатель ЯЦО был увеличен на протяжении всего времени инкубации (рисунок 82). усл.ед. 0,35 0,3 0,25 0,2 0,65% NaCl 0,15 0,2% NaCl 0,1 0,05 0 с . Рисунок 82 – ЯЦО эритроцитов лягушек под влиянием кальциевой нагрузки 242 Анализируя диапазон изменений ЯЦО можно заключить, что интенсивность увеличения объема ядра в течение инкубации постепенно снизилась. Так на 30 секунде показатель ЯЦО увеличился на 46% (р<0,05), на 150 секунде – 107,7% (р<0,05), на 270 секунде – 92% (р<0,05), а к концу воздействия (3600 секунда) – на 73,3% (р<0,05). Таким образом, под влиянием кальциевой нагрузки в гипотонической среде геометрические параметры клеток уменьшились. Размеры ядра эритроцитов в гипотонической среде увеличились, оно приобрело округлую форму, вследствие чего снизился коэффициент эксцентричности. 2.5.2.6 Регуляция объема эритроцитов в пробах с верапамилом Под влиянием верапамила линейные размеры эритроцита в гипотонической среде увеличились в течение первых 150 секунд инкубации. На 60 секунде длинная и короткая оси клетки, а также их высота увеличились соответственно на 10%; 11% и 11,3% (р<0,05), 120 секунде – на 10%; 13% и 42% (р<0,05) по сравнению с размерами клетки в изотоническом растворе (таблица 88). Таблица 88 – Линейные размеры эритроцитов лягушек под влиянием верапамила Время, с 30 60 90 120 150 180 210 240 270 Длинная ось эллипса, мкм 0,2% NaCl 0,65% NaCl 25,47±0,26* 23,78±0,45 25,83±0,24* 23,55±0,22 25,73±0,24* 23,62±0,19 25,94±0,24* 23,62±0,26 25,58±0,24* 23,97±0,26 25,44±0,24 24,66±0,36 25,49±0,22* 24,52±0,19 25,16±0,22* 24,03±0,29 24,74±0,22* 23,72±0,21 Короткая ось эллипса, мкм 0,2% NaCl 0,65% NaCl 15,65±0,19 15,56±0,22 16,57±0,18* 14,91±0,18 16,72±0,15* 14,95±0,18 17,09±0,18* 15,11±0,19 17,11±0,17* 15,40±0,19 16,08±0,17 15,91±0,26 16,13±0,13 15,92±0,20 16,25±0,15* 15,84±0,19 16,11±0,17 15,93±0,16 Высота, мкм 0,2% NaCl 3,07±0,04 3,25±0,03* 3,28±0,03* 3,35±0,03* 3,36±0,03* 3,15±0,03 3,16±0,02 3,19±0,03 3,16±0,03 0,65% NaCl 3,05±0,04 2,92±0,03 2,93±0,03 2,36±0,04 3,02±0,04 3,12±0,05 3,12±0,04 3,11±0,04 3,12±0,03 243 Продолжение таблицы 88 Длинная ось эллипса, мкм Короткая ось эллипса, мкм Высота, мкм Время, с 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 300 24,60±0,21* 23,71±0,24 16,25±0,16* 15,46±0,18 3,19±0,03 3,09±0,03 330 25,21±0,22* 23,64±0,25 16,51±0,19* 15,67±0,17 3,24±0,04* 3,07±0,03 360 24,94±0,21* 23,68±0,26 16,41±0,16* 15,66±0,16 3,22±0,03* 3,07±0,03 390 24,93±0,22* 23,01±0,22 16,26±0,14* 15,26±0,21 3,19±0,03* 2,99±0,04 420 25,12±0,23* 23,18±0,19 16,43±0,17* 15,41±0,20 3,22±0,03* 3,02±0,04 450 24,83±0,23 24,34±0,25 16,32±0,17 15,86±0,23 3,20±0,03* 3,11±0,04 480 25,06±0,24* 24,05±0,24 16,58±0,19* 15,83±0,18 3,25±0,04* 3,10±0,03 510 24,88±0,24* 24,22±0,26 16,51±0,17* 15,79±0,18 3,24±0,03* 3,09±0,03 540 24,88±0,21* 23,02±0,29 16,31±0,19* 15,19±0,18 3,16±0,04* 2,98±0,03 570 25,22±0,18* 23,29±0,23 16,23±0,17* 15,13±0,16 3,18±0,03* 2,96±0,03 600 25,47±0,22* 23,16±0,21 16,64±0,15* 14,88±0,17 3,27±0,03* 2,92±0,03 900 25,35±0,21* 22,33±0,23 16,42±0,14* 14,78±0,20 3,22±0,03* 2,90±0,04 1800 25,63±0,34* 23,16±0,27 16,71±0,19* 15,24±0,15 3,28±0,04* 2,99±0,03 3600 25,30±0,24* 22,56±0,29 16,98±0,18* 14,74±0,21 3,33±0,04* 2,89±0,04 * Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). На 180 секунде инкубации линейные размеры клетки в гипотонической среде были в пределах не достоверных различий с изотоническим раствором. Начиная с 210 секунды и до конца инкубации, длинная ось клетки увеличилась. Короткая ось уменьшилась с 240 и по 3600 секунды. На 3600 с размер длинной оси эритроцита увеличился на 12% (р<0,05), а короткой – уменьшился на 15% (р<0,05) по сравнению с изотоническим раствором. Высота клетки в гипотоническом растворе возросла в интервале с 60 по 150 секунды в среднем на 11% (р<0,05) по сравнению с изотоническим раствором. Со 180 по 270 секунды статистически достоверных различий в высоте клеток между исследуемыми группами не выявлено. Начиная с 300 секунды и до конца инкубации, вновь наблюдали увеличение высоты эритроцитов: наиболее выражено на 900 секунде – на 11% (р<0,05) и 3600 секунде – на 15% (р<0,05) по сравнению с изотоническим раствором. Под влиянием верапамила в гипотонической среде на 30 секунде инкубации форма эритроцита удлинилась, коэффициент эксцентричности увеличился на 5% (р<0,05), при этом значения объема и площади поверхности были в пределах не достоверных различий по сравнению с изотоническим раствором (таблица 89). 244 Таблица 89 – Морфометрические параметры эритроцитов лягушек под влиянием верапамила Время, с Коэффициент эксцентричОбъем, мкм3 Площадь поверхности, мкм2 ности 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,78±0,010* 0,74±0,010 1293,81±36,00 1210,15±60,12 502,25±8,65 470,39±14,74 60 0,76±0,006 0,77±0,006 1470,19±38,79* 1084,15±28,99 541,04±9,06* 442,98±7,15 90 0,75±0,008 0,77±0,008 1486,59±33,09* 1092,18±27,53 543,86±7,85* 445,23±6,69 120 0,74±0,008 0,76±0,005 1576,81±38,31* 1115,09±30,38 561,05±8,56* 450,01±7,28 150 0,74±0,008 0,76±0,008 1549,05±37,13* 1174,94±30,06 554,44±8,52* 465,62±7,30 180 0,77±0,006 0,75±0,008 1362,52±35,20 1312,42±69,62 516,43±8,40 496,95±15,02 210 0,77±0,006 0,75±0,008 1366,69±25,40 1289,20±36,12 518,26±6,33 493,52±8,21 240 0,76±0,006 0,74±0,007 1374,76±31,92* 1250,42±35,44 516,83±7,62* 481,74±8,80 270 0,75±0,005 0,73±0,009 1331,46±34,48 1242,74±28,66 504,42±8,28* 478,29±6,65 300 0,74±0,007 0,75±0,008 1341,84±31,61* 1171,65±29,68 505,58±7,25* 463,10±7,22 330 0,75±0,008 0,74±0,006 1421,85±36,69* 1201,07±30,21 526,14±8,19* 468,80±7,42 360 0,75±0,008 0,74±0,006 1386,01±29,71* 1202,61±31,02 517,25±6,84* 469,49±7,97 390 0,75±0,006 0,74±0,006 1361,27±28,11* 1113,97±33,69 512,44±6,87* 444,87±8,21 420 0,75±0,008 0,74±0,006 1401,63±31,75* 1140,92±31,81 521,78±7,46* 452,11±7,27 450 0,75±0,008 0,75±0,008 1368,39±33,19 1272,19±39,07 512,61±7,79 488,12±9,15 480 0,74±0,007 0,75±0,008 1430,06±40,57* 1246,58±32,01 526,40±9,25* 481,37±7,66 510 0,74±0,007 0,75±0,008 1400,65±33,80* 1248,79±32,43 519,51±7,74* 483,20±7,91 540 0,76±0,007 0,74±0,006 1342,09±36,33* 1099,89±30,36 567,44±8,31* 442,45±7,02 570 0,76±0,006 0,75±0,008 1374,05±32,15* 1101,12±26,26 516,94±7,34* 445,11±6,64 600 0,75±0,007 0,76±0,004 1456,68±29,64* 1062,28±27,07 535,84±7,01* 435,39±6,72 900 0,76±0,006 0,74±0,006 1410,82±28,52* 1012,72±30,48 525,89±6,74* 417,79±7,58 1800 0,75±0,007 0,74±0,006 149653±66,91* 111364±28,21 543,49±4,11* 446,73±7,58 3600 0,74±0,006 0,75±0,008 1514,09±4048* 1016,37±34,69 545,05±9,26* 420,65±8,93 * Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Начиная с 60 секунды и до конца воздействия, форма клетки в гипотонической среде оставалась эллипсоидной, объем и площадь поверхности увеличились. В течение первого цикла с 60 по 150 секунды, объем и площадь поверхности возросли в среднем на 36% и 22% (р<0,05) по сравнению с изотоническим раствором. В период со 180 по 210 секунды в гипотонической среде изменений морфометрических параметров не зафиксировано. В течение второго цикла с 240 по 420 секунды, объем эритроцитов и площадь поверхности увеличились в среднем на 18% и 12% (р<0,05) по сравнению с изотоническим раствором. В течение третьего цикла с 480 по 3600 секунды увеличение объема и площади поверхности было максимальным и составило в среднем 49% и 29,5% (р<0,05) по сравнению с изотонической средой. Под влиянием верапамила при снижении осмолярности среды в первые 90 секунд инкубации наблюдали увеличение длинной оси ядра в среднем на 6% 245 (р<0,05), при этом короткая ось и высота не изменились по сравнению с изотоническим раствором (таблица 90). Таблица 90 – Линейные размеры ядер эритроцитов лягушек под влиянием верапамила Длинная ось эллипса, Короткая ось эллипса, Высота, мкм мкм мкм 0,65% 0,2% NaCl 0,65% 0,2% NaCl 0,2% NaCl 0,65% NaCl NaCl NaCl 30 10,10±0,13* 9,32±0,14 7,40±0,13 7,28±0,13 1,45±0,02 1,43±0,03 60 10,03±0,16* 9,50±0,13 7,04±0,11 7,35±0,14 1,38±0,02 1,44±0,03 90 9,85±0,15* 9,34±0,15 7,05±0,09 7,04±0,12 1,38±0,02 1,38±0,02 120 9,69±0,12 9,78±0,17 6,93±0,11* 7,46±0,14 1,36±0,02* 1,46±0,03 150 9,88±0,13 9,82±0,11 6,61±0,13* 7,51±0,12 1,29±0,02* 1,47±0,02 180 9,83±0,11* 9,35±0,13 6,69±0,11* 7,36±0,10 1,31±0,02* 1,44±0,02 210 9,34±0,12 9,52±0,12 6,49±0,09* 7,51±0,11 1,27±0,02* 1,47±0,02 240 9,48±0,12* 9,05±0,12 6,70±0,12* 7,08±0,09 1,31±0,02* 1,39±0,02 270 9,51±0,11* 9,12±0,12 6,69±0,09* 7,32±0,12 1,31±0,02* 1,43±0,02 300 9,54±0,12* 9,16±0,09 6,98±0,09* 7,43±0,09 1,37±0,02** 1,46±0,02 330 9,44±0,13 9,21±0,12 6,78±0,08* 7,41±0,12 1,33±0,01* 1,45±0,02 360 9,39±0,13 9,15±0,10 7,02±0,08 7,19±0,10 1,38±0,02* 1,41±0,02 390 9,42±0,09* 9,01±0,11 7,08±0,09 7,22±0,09 1,39±0,02* 1,41±0,02 420 9,23±0,14* 8,60±0,11 6,69±0,08 6,95±0,12 1,31±0,01* 1,36±0,02 450 9,62±0,14* 9,08±0,11 7,12±0,11 7,41±0,09 1,39±0,02* 1,45±0,02 480 9,34±0,11 9,20±0,12 7,11±0,13 7,22±0,11 1,39±0,02* 1,41±0,02 510 9,28±0,11 9,39±0,13 6,79±0,11* 7,24±0,09 1,33±0,02* 1,42±0,02 540 9,32±0,10 9,23±0,13 6,81±0,09* 7,47±0,08 1,34±0,02* 1,47±0,02 570 9,50±0,14* 8,95±0,11 6,64±0,08* 7,04±0,11 1,30±0,02* 1,38±0,02 600 9,12±0,11* 8,82±0,12 6,59±0,08* 6,96±0,11 1,29±0,02* 1,37±0,02 900 9,31±0,12* 8,78±0,11 6,37±0,11* 7,21±0,11 1,25±0,02* 1,41±0,02 1800 9,42±0,12 9,25±0,13 6,38±0,07* 7,57±0,09 1,25±0,01* 1,48±0,02 3600 9,15±0,13 8,88±0,11 6,59±0,08* 7,33±0,10 1,29±0,02* 1,44±0,02 * – Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). Время, с В интервале со 120 по 330 секунды короткая ось ядра в гипотонической среде уменьшилась в среднем на 13% (р<0,05), при этом длинная ось увеличилась в интервале с 390 по 450 секунды в среднем на 6% (р<0,05) по сравнению с изотоническим раствором. Высота ядра в гипотоническом растворе оставалась сниженной на протяжении практически всего времени инкубации. Выраженное снижение высоты ядра наблюдали на 210 и 540 секундах воздействия соответственно на 13,6% и 8,8% (р<0,05) по сравнению с изотоническим раствором. К окончанию инкубации на 3600 секунде короткая ось ядра и его высота снизились в среднем на 10% (р<0,05) по сравнению с изотоническим раствором. 246 Под влиянием верапамила коэффициент эксцентричности ядра в гипотонической среде увеличился на 30 секунде – на 12% (р<0,05), 180 секунде – 22% (р<0,05), 450 секунде – 16% (р<0,05), 1800 секунде – на 33% (р<0,05) и к концу инкубации – на 24,5% (р<0,05) по сравнению с изотоническим раствором (таблица 91). Таблица 91 – Морфометрические параметры ядер эритроцитов лягушек под влиянием верапамила Время, с Коэффициент эксцентричОбъем, мкм3 Площадь поверхности, мкм2 ности 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 0,2% NaCl 0,65% NaCl 30 0,66±0,02* 0,59±0,02 115,83±4,81 104,46±4,87 95,46±2,31* 87,47±2,53 60 0,68±0,02* 0,60±0,02 103,56±3,95 104,03±4,95 89,78±2,11 89,66±2,45 90 0,67±0,02 0,62±0,02 101,64±3,37 97,26±4,08 88,36±1,89* 84,32±2,25 120 0,67±0,02 0,61±0,02 96,83±3,38* 114,62±5,35 85,44±1,74* 93,71±2,68 150 0,72±0,02* 0,61±0,02 90,62±4,29* 115,05±3,83 82,87±2,12* 94,25±1,87 180 0,72±0,01* 0,59±0,02 92,01±3,37* 105,69±3,51 83,59±1,79 88,50±1,94 210 0,69±0,02* 0,58±0,02 81,59±2,54* 111,70±37,7 76,94±1,48* 91,71±1,92 240 0,69±0,01* 0,60±0,02 89,75±3,73* 94,59±3,11 81,23±2,12 82,29±1,77 270 0,69±0,01* 0,57±0,02 88,72±2,65* 102,46±4,08 81,09±1,55 86,02±2,11 300 0,65±0,02* 0,56±0,01 96,46±2,97* 105,14±3,11 84,88±1,62 87,58±1,60 330 0,68±0,01* 0,56±0,02 89,70±2,47* 105,94±4,23 81,39±1,51* 87,87±2,14 360 0,64±0,02* 0,59±0,02 95,86±2,78* 98,47±3,41 84,16±1,64 84,41±1,76 390 0,64±0,02* 0,57±0,02 97,66±2,59* 97,71±3,09 85,11±1,37 83,62±1,66 420 0,66±0,02* 0,57±0,01 85,86±2,61 87,72±3,73 78,82±1,66 77,28±2,07 450 0,64±0,02* 0,55±0,02 101,84±3,67 103,98±3,59 87,60±1,99 86,75±1,86 480 0,62±0,02* 0,59±0,02 98,95±4,08 100,11±3,62 85,06±2,06 85,32±1,95 510 0,66±0,02* 0,61±0,02 89,92±3,59* 102,65±3,48 80,67±1,97* 87,23±1,91 540 0,66±0,01* 0,55±0,02 89,46±2,62* 106,75±3,00 80,79±1,42* 88,67±1,68 570 0,69±0,01* 0,59±0,02 87,05±2,79* 92,96±3,41 80,24±1,69 81,10±1,89 600 0,66±0,02* 0,58±0,02 81,75±1,98 89,81±3,63 76,42±1,11 79,06±1,99 900 0,70±0,02* 0,55±0,01 78,94±2,99* 96,19±4,34 75,32±1,69* 81,89±2,21 1800 0,72±0,01* 0,54±0,02 79,61±2,24* 110,45±3,67 76,29±1,42* 90,29±1,95 3600 0,66±0,02* 0,53±0,02 82,55±2,53* 99,37±3,22 76,85±1,51* 83,69±1,72 * Достоверность различий значений в 0,2% растворе NaCl по сравнению со значениями в 0,65% NaCl по критерию Стьюдента (р<0,05). На 30 секунде инкубации в гипотонической среде площадь поверхности ядра увеличилась на 9% (р<0,05), при этом объем достоверно не изменился по сравнению с изотоническим раствором. Начиная со 120 секунды и до конца инкубации, морфометрические параметры ядра в гипотонической среде уменьшились (см. таблица 85). На 120 секунде, объем и площадь поверхности ядра уменьшились соответственно на 15,5% и 8,8% (р<0,05), 210 секунде – на 27% и 16% 247 (р<0,05), 330 секунде – на 15% и 7,4% (р<0,05), к концу инкубации (3600 секунда) – на 17% и 8% (р<0,05) по сравнению с изоосмотической средой. Значения ЯЦО в гипотонической среде под влиянием верапамила были снижены на протяжении всего времени инкубации (рисунок 83). усл. ед. 0,22 0,2 0,18 0,65% NaCl 0,16 0,2% NaCl 0,14 0,12 0,1 с Рисунок 83 – ЯЦО эритроцитов лягушек под влиянием верапамила На 60 секунде инкубации показатель ЯЦО снизился на 17,6% (р<0,05), 210 секунде – на 20% (р<0,05), 540 секунде – на 25% (р<0,05) и к концу воздействия – на 43% (р<0,05) по сравнению с изотоническим раствором. Таким образом, под влиянием верапамила в гипотонической среде высота, объем, и площадь поверхности в системе клетка-ядро уменьшились, вследствие чего снизился показатель ЯЦО. Использование клеткой поверхностных резервов плазмалеммы и ядром, внутриклеточных мембранных бассейнов не установлено. 248 2.5.2.7 Относительный мембранный резерв, используемый эритроцитами под влиянием Са2+ и верапамила Под влиянием ионов Са2+ и верапамила форма клеток становилась более вытянутой по сравнению с контролем. В качестве контроля использованы данные эритроцитов, помещенных в гипотоническую среду, без воздействия функциональных нагрузок. Так коэффициент эксцентричности на 30 секунде инкубации в пробах с верапамилом увеличился на 10% (р<0,05) по сравнению с контролем. В пробах с Са2+ изменения формы отмечали на 60 секунде, при этом коэффициент эксцентричности возрос на 5% (р<0,05) по сравнению с контролем (таблица 92). Таблица 92 – Морфометрические параметры эритроцитов под влиянием Са2+ и верапамила в гипотонической среде ВреКоэффициент эксцентричности, мкм Объем, мкм3 2+ 2+ мя, с контроль Са верапамил контроль Са верапамил 30 0,71±0,01 0,73±0,01L 0,78±0,010* 345,04±16,27 571,03±14,01*L 1293,81±36,00* 60 0,75±0,01 0,79±0,01*L 0,76±0,006 364,28±12,16 573,14±14,01*L 1470,19±38,79* L 90 0,74±0,01 0,82±0,01* 0,75±0,008 387,94±13,24 592,01±16,54*L 1486,59±33,09* L 120 0,74±0,01 0,82±0,07* 0,74±0,008 378,44±11,43 598,14±16,34*L 1576,81±38,31* L 150 0,74±0,01 0,82±0,07* 0,74±0,008 400,75±12,07 626,33±16,35*L 1549,05±37,13* 180 0,74±0,01 0,84±0,01*L 0,77±0,006* 385,28±11,95 590,74±16,52*L 1362,52±35,20* 210 0,73±0,01 0,84±0,01*L 0,77±0,006* 383,15±11,67 582,97±15,08*L 1366,69±25,40* 240 0,74±0,01 0,85±0,005*L 0,76±0,006* 369,39±10,74 582,02±18,46*L 1374,76±31,92* 270 0,72±0,01 0,84±0,007*L 0,75±0,005* 379,89±11,83 607,00±21,14*L 1331,46±34,48* 300 0,72±0,01 0,84±0,007*L 0,74±0,007 397,82±10,68 582,85±23,74*L 1341,84±31,61* L 330 0,69±0,01 0,85+0,004* 0,75±0,008* 392,72±10,88 575,81±13,52*L 1421,85±36,69* 360 0,70±0,01 0,84±0,005*L 0,75±0,008* 382,86±11,79 584,42±15,74*L 1386,01±29,71* 390 0,69±0,01 0,84±0,006*L 0,75±0,006* 358,54±12,96 580,69±15,54*L 1361,27±28,11* 420 0,71±0,01 0,83±0,006*L 0,75±0,008* 383,27±12,11 564,41±13,23*L 1401,63±31,75* 450 0,71±0,01 0,84±0,005*L 0,75±0,008* 379,46±12,05 556,84+14,05*L 1368,39±33,19* 480 0,71±0,01 0,85±0,005*L 0,74±0,007* 369,05±12,06 567,09±15,29*L 1430,06±40,57* 510 0,71±0,01 0,84±0,006*L 0,74±0,007* 370,33±10,93 545,31±14,81*L 1400,65±33,80* 540 0,69±0,06 0,85+0,006*L 0,76±0,007* 336,21±11,62 554,53±14,73*L 1342,09±36,33* 570 0,67±0,01 0,85±0,005*L 0,76±0,006* 368,87±10,92 566,86±15,85*L 1374,05±32,15* 600 0,70±0,01 0,84±0,006*L 0,75±0,007* 374,06±10,48 600,48±15,29*L 1456,68±29,64* 900 0,66±0,01 0,83±0,005*L 0,76±0,006* 376,77±12,93 918,43±25,68*L 1410,82±28,52* 1800 0,66±0,01 0,82±0,004*L 0,75±0,007* 366,39±10,93 808,15±18,50*L 149653±66,91* 3600 0,68±0,01 0,79±0,006*L 0,74±0,006* 421,83±22,56 887,59±20,06*L 1514,09±4048* * Достоверность различий значений под влиянием кальция/верапамила по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Достоверность различий значений под влиянием кальциевой нагрузки по сравнению с верапамилом по критерию Стьюдента (р<0,05). 249 Под влиянием ионов Са2+ на 90 секунде инкубации коэффициент эксцентричности увеличился на 10% (р<0,05) по сравнению с контролем и на 9% (р<0,05) по сравнению с пробами, обработанными верапамилом (см. таблица 86). К окончанию инкубации на 3600 секунде коэффициент эксцентричности эритроцитов в пробах с Са2+ увеличился на 16% (р<0,05), в пробах с верапамилом – на 9% (р<0,05) по сравнению с контролем. Объем клеток в гипотонической среде как после кальциевой нагрузки, так и после верапамила увеличился. Наиболее выраженные изменения объема клеток отмечали в пробах с верапамилом (см. таблица 92). Стремительное увеличение объема эритроцита, как в условиях активации, так и блокады элементов кальциевых сигнальных путей под влияние Са2+, так и верапамила, наблюдали в течение первых 150 секунд инкубации в гипотонической среде. Так на 30 секунде объем под влиянием кальция возрос на 65,5% (р<0,05), под влиянием верапамила – на 275% (р<0,05) по сравнению с контролем, на 90 секунде – соответственно на 53% и 283% (р<0,05), на 150 секунде – на 556% и 385% (р<0,05). К окончанию инкубации на 3600 секунде прирост объема в пробах, с Са2+ – составил 110% (р<0,05), в пробах с верапамилом – 259% (р<0,05) по сравнению с контролем. Под влиянием кальция и верапамила в гипотонической среде коэффициент эксцентричности ядра увеличился, причем наиболее выражено в пробах с Са2+ (таблица 93). Таблица 93 – Морфометрические параметры ядер эритроцитов под влиянием кальция и верапамила в гипотонической среде Время, с 30 60 90 120 150 180 210 240 270 300 330 360 Коэффициент эксцентричности, мкм контроль Са2+ верапамил 0,58±0,02 0,71±0,02* 0,66±0,02* 0,57±0,02 0,69±0,03* 0,68±0,02* 0,61±0,02 0,63±0,02 0,67±0,02 0,61±0,02 0,71±0,02* 0,67±0,02 L 0,54±0,02 0,64±0,02* 0,72±0,02* 0,52±0,02 0,72±0,02* 0,72±0,01* 0,54±0,02 0,65±0,02* 0,69±0,02* 0,48±0,03 0,64±0,02* 0,69±0,01* 0,54±0,02 0,63±0,02* 0,69±0,01* 0,57±0,02 0,67±0,02* 0,65±0,02* 0,54±0,02 0,72±0,03* 0,68±0,01* L 0,54±0,02 0,74±0,02* 0,64±0,02* контроль 40,74±1,87 58,86±4,59 45,54±4,11 68,82±9,12 93,48±5,10 110,21±5,81 104,56±4,70 106,26±4,05 104,02±4,74 99,55±4,34 89,65±5,33 92,33±5,32 Объем, мкм3 Са2+ 47,23±3,05L 55,82±3,76L 83,16±6,72*L 58,10±4,81L 79,37±7,39 48,69±3,05*L 49,54±3,22*L 61,81±4,48*L 60,49±4,85*L 73,00±4,81 63,93±5,31*L 57,47±4,45*L верапамил 115,83±4,81* 103,56±3,95* 101,64±3,37* 96,83±3,38* 90,62±4,29 92,01±3,37* 81,59±2,54* 89,75±3,73* 88,72±2,65* 96,46±2,97 89,70±2,47 95,86±2,78 250 Продолжение таблицы 93 ВреКоэффициент эксцентричности, мкм Объем, мкм3 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 390 0,56±0,01 0,69±0,03* 0,64±0,02* 96,11±6,09 52,95±3,19*L 97,66±2,59 420 0,57±0,03 0,64±0,02* 0,66±0,02* 85,18±6,43 80,83±6,32 85,86±2,61 L L 450 0,54±0,03 0,74±0,03* 0,64±0,02* 100,19±5,67 56,54±5,12* 101,84±3,67 480 0,55±0,02 0,67±0,02* 0,62±0,02* 90,80±6,24 68,38±5,38*L 98,95±4,08 510 0,55±0,02 0,67±0,03* 0,66±0,02* 94,76±6,67 63,02±4,82*L 89,92±3,59 540 0,54±0,02 0,64±0,03* 0,66±0,01* 92,24±6,22 64,93±4,76*L 89,46±2,62 570 0,58±0,02 0,66±0,03* 0,69±0,01* 88,18±5,19 81,33±5,19 87,05±2,79 600 0,53±0,02 0,75±0,02*L 0,66±0,02* 89,78±5,86 65,81±6,99*L 81,75±1,98 900 0,59±0,02 0,71+0,03* 0,70±0,02* 96,59±5,86 110,96±9,56L 78,94±2,99* L 1800 0,56±0,02 0,73±0,02* 0,72±0,01* 107,68±5,42 138,29±13,69* 79,61±2,24* 3600 0,57±0,02 0,68±0,02* 0,66±0,02* 101,27±5,01 125,90±8,57*L 82,55±2,53* * Достоверность различий значений под влиянием кальция/верапамила по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Достоверность различий значений под влиянием кальциевой нагрузки по сравнению с верапамилом по критерию Стьюдента (р<0,05). На 30 секунде инкубации коэффициент эксцентричности ядра в пробах с Са2+ возрос на 22% (р<0,05), в пробах с верапамилом – на 14% (р<0,05) по сравнению с контролем, на 150 секунде – соответственно на 18% и 33% (р<0,05), на 450 секунде – на 37% и 18% (р<0,05), к окончанию инкубации – на 19% и 14% (р<0,05). Объем ядра в пробах с Са2+ в течение первых 60 секунд инкубации достоверно не различался с контролем, но существенно был снижен по сравнению с пробами, проинкубированными с верапамилом (см. таблица 837На 90 секунде объем ядра под влиянием кальциевой нагрузки возрос на 83% (р<0,05) по сравнению с контролем, но при этом был ниже аналогичного показателя в пробах, обработанных верапамилом на 22% (р<0,05). Под влиянием верапамила в течение первых 120 секунд инкубации в гипотонической среде объем ядра увеличился в среднем на 106% (р<0,05) по сравнению с контролем. В интервале со 180 по 270 секунды инкубации объем ядра в опытных пробах был снижен по сравнению с контролем. В интервале с 330 по 600 секунды наблюдали уменьшение объема ядра в пробах, проинкубированных с Са2+, при этом в пробах с верапамилом выраженных различий с контролем не установлено. К окончанию инкубации на 3600 секунде объем ядра под влиянием кальциевой нагрузки увеличился на 24,3% (р<0,05), а под влиянием верапамила – снизился на 23% (р<0,05) по сравнению с контролем. 251 Коэффициент осмотического натяжения плазмалеммы в гипотонической среде увеличился под влиянием верапамила, и снизился – в условиях кальциевой нагрузки (таблица 94). Таблица 94 – Коэффициент осмотического натяжения плазмалеммы и кариолеммы эритроцитов под влиянием кальция и верапамила ВреПлазмалемма, усл. ед. Кариолемма, усл. ед. 2+ мя, с контроль Са верапамил контроль Са2+ верапамил 30 0,80±0,03 0,53±0,02*L 1,09±0,03* 0,94±0,04 1,15±0,08* 1,13±0,04* 60 0,86±0,02 0,76±0,02*L 1,24±0,03* 1,24±0,07 1,16±0,09 1,03±0,03* L 90 0,84±0,02 0,83±0,04 1,23±0,02* 1,01±0,07 1,10±0,08* 1,09±0,04* 120 0,89±0,02 0,74±0,02*L 1,26±0,03* 1,51±0,13 1,16±0,09*L 0,94±0,03* 150 0,84±0,02 0,77±0,03*L 1,21±0,03* 1,73±0,10 1,30±0,08*L 0,89±0,03* 180 0,84±0,02 0,69±0,02*L 1,06±0,03* 2,00±0,09 1,15+0,08*L 0,96±0,02* 210 0,76±0,02 0,74±0,02L 1,06±0,02* 1,81±0,08 1,14±0,07*L 0,86±0,02* 240 0,79±0,01 0,76±0,02L 1,09±0,03* 1,68±0,07 1,44±0,12*L 1,01±0,04* 270 0,77±0,02 0,81±0,03L 1,06±0,02* 1,67±0,06 1,38+0,12*L 0,96±0,03* 300 0,83±0,02 0,92±0,03L 1,10±0,02* 1,79±0,07 1,55±0,12*L 0,98±0,03* 330 0,70±0,02 0,81±0,02*L 1,13±0,02* 1,49±0,08 1,54±0,14L 0,95±0,03* 360 0,79±0,02 0,75±0,02L 1,11±0,02* 1,75±0,09 1,40±0,11*L 1,00±0,08* 390 0,59±0,02 0,79±0,02*L 1,17±0,03* 1,76±0,09 1,28±0,12*L 1,03±0,02* 420 0,79±0,04 0,81±0,02L 1,17±0,02* 1,87±0,13 1,73±0,14L 1,05±0,04* 450 0,78±0,02 0,83±0,02L 1,06±0,02* 1,82±0,08 1,31±0,12*L 1,03±0,03* 480 0,80±0,03 0,88±0,03L 1,11±0,03* 1,72±0,09 1,39±0,10*L 1,02±0,03* 510 0,78±0,02 0,76±0,02L 1,08±0,02* 1,87±0,11 1,36±0,09*L 0,95±0,03* 540 0,70±0,02 0,74±0,02L 1,16±0,03* 1,74±0,09 1,39±0,09*L 0,93±0,02* 570 0,77±0,02 0,81±0,02L 1,17±0,02* 1,90±0,13 1,66±0,14*L 1,02±0,03* 600 0,72±0,03 0,82±0,02*L 1,24±0,02* 1,87±0,09 1,45±0,13*L 1,00±0,03* 900 0,90±0,02 1,04±0,03*L 1,28±0,03* 1,81±0,09 1,81±0,09L 0,94±0,02* 1800 0,90±0,02 0,96±0,02L 1,24±0,01* 1,89±0,08 1,96±0,16L 0,86±0,03* 3600 1,03±0,04 1,06±0,03L 1,28±0,03* 1,94±0,08 1,54±0,08*L 0,93±0,02* * Достоверность различий значений под влиянием кальция/верапамила по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Достоверность различий значений под влиянием кальциевой нагрузки по сравнению с верапамилом по критерию Стьюдента (р<0,05). На 30 секунде инкубации коэффициент осмотического натяжения плазмалеммы под влиянием кальциевой нагрузки был снижен на 33,7% (р<0,05), а под влиянием верапамила – увеличен на 36% (р<0,05) по сравнению с контролем. На 300 секунде инкубации коэффициент осмотического натяжении мембраны под влиянием кальция увеличился на 11% (р<0,05) по сравнению с контролем, но оставался сниженным на 19,5% (р<0,05) по сравнению с пробами, проинкубированными с верапамилом. К окончанию инкубации коэффициент осмотического натя- 252 жения плазмалеммы под влиянием верапамила увеличился на 24% (р<0,05), а под влиянием кальция находился в пределах не достоверных различий с контролем. Коэффициент осмотического натяжения кариолеммы в пробах с Са2+ и верапамилом в течение первых 90 секунд увеличился, а затем, начиная со 120 секунды и до конца инкубации, снизился (см. таблица 88). На 30 секунде под влиянием кальциевой нагрузки коэффициент осмотического натяжения кариолеммы возрос на 22% (р<0,05), под влиянием верапамила – на 20% (р<0,05) по сравнению с контролем. На 120 секунде коэффициент осмотического натяжения кариолеммы под влиянием кальция и верапамила был снижен соответственно на 23% и 37,7% (р<0,05), 300 секунде – на 13,4% и 44,7% (р<0,05), 570 секунде – на 12,6% и 46% (р<0,05). Как видно из данных таблица 83, более выраженное уменьшение коэффициента осмотического натяжения кариолеммы произошло в пробах под влиянием верапамила. В условиях гипоосмотической нагрузки клетки не использовали дополнительных мембранных структур в регуляции объема. Однако на уровне ядра, было установлено использование относительного мембранного резерва (рисунок 84). мкм-1 1,2 1 0,8 0,6 0,4 0,2 0 30 90 150 210 270 330 390 контроль 450 510 Са2+ 570 с 900 3600 Рисунок 84 – Относительный мембранный резерв, используемый ядром эритроцитов в гипотонической среде под влиянием кальциевой нагрузки 253 Как видно из рисунока 85 использование резерва ядром начиналось на 90 секунде воздействия, а затем к концу инкубации. На 570 секунде наблюдали использование около 22% мембранного резерва ядром в гипотонической среде. Таким образом, под влиянием ионов Са2+ в гипотонической среде объем эритроцитов лягушек увеличился, однако клетка не использовали дополнительные мембранные резервы в регуляции объема, о чем свидетельствует увеличение коэффициента осмотического натяжения клеточных мембран. Объем ядра изменялся циклически, периоды увеличения объема, сменялись его уменьшением, ядро задействовало мембранные резервы в регуляции объема наиболее интенсивно по второй половине времени инкубации. 2.5.2.8 Сравнительный анализ регуляции объема эритроцитов в изотонической среде под влияние ионов Са2+ и верапамила Морфометрические параметры эритроцитов в изотоническом растворе были увеличены на протяжении всего времени инкубации как пробах с Са 2+, так и с верапамилом по сравнению с контролем (таблица 95). В качестве контроля взяты параметры клеток, помещенных в изотонический раствор, но без функциональных нагрузок. Таблица 95 – Морфометрические параметры эритроцитов под влиянием кальция и верапамила в изотонической среде Время, с 30 60 90 120 150 180 210 Коэффициент эксцентричности, мкм контроль Са2+ верапамил 0,79±0,01 0,84±0,006*L 0,74±0,010* 0,66±0,01 0,85±0,005*L 0,77±0,006* 0,65±0,01 0,85±0,006*L 0,77±0,008* 0,72±0,01 0,81±0,005*L 0,76±0,005* 0,70±00,1 0,83±0,005*L 0,76±0,008* 0,69±0,01 0, 3±0,005*L 0,75±0,008* 0,70±0,01 0,82±0,006L* 0,75±0,008* Объем, мкм3 контроль 463,60±19,46 532,74±8,58 553,20±11,70 494,84±6,24 536,13±10,33 514,79±7,21 556,47±8,54 Са2+ 796,66±28,65*L 766,63±23,18*L 750,18±34,18*L 874,98±24,15*L 912,82±34,01*L 958,06±27,69*L 887,06±26,15*L верапамил 1210,15±60,12* 1084,15±28,99* 1092,18±27,53* 1115,09±30,38* 1174,94±30,06* 1312,42±69,62* 1289,20±36,12* 254 Продолжение таблицы 95 ВреКоэффициент эксцентричности, мкм Объем, мкм3 2+ 2+ мя, с контроль Са верапамил контроль Са верапамил 240 0,69±0,01 0,82±0,007*L 0,74±0,007* 534,39±7,07 862,18±27,07*L 1250,42±35,44* 270 0,69±0,01 0,84+0,005*L 0,73±0,009* 547,32±8,77 800,42±21,99*L 1242,74±28,66* L 300 0,72±0,01 0,86±0,005* 0,75±0,008* 542,18±9,64 714,19±27,67*L 1171,65±29,68* 330 0,72±0,01 0,81±0,005*L 0,74±0,006* 547,54±9,57 853,52±22,09*L 1201,07±30,21* L 360 0,70±0,01 0,83±0,003* 0,74±0,006* 540,69±8,73 963,60±26,65*L 1202,61±31,02* L 390 0,67±0,03 0,83±0,005* 0,74±0,006* 521,17±15,75 896,99±22,38*L 111397±33,69* 420 0,74±0,01 0,82±0,006*L 0,74±0,006 500,40±13,45 853,43±23,95*L 1140,92±31,81* L 450 0,74±0,01 0,84±0,005* 0,75±0,008 495,81±11,44 756,23±20,31*L 1272,19±39,07* L 480 0,72±0,01 0,84±0,006* 0,75±0,008* 510,74±8,77 755,50±28,87*L 1246,58±32,01* L 510 0,71±0,01 0,82±0,004* 0,75±0,008* 505,17±8,48 899,68±23,73*L 1248,79±32,43* 540 0,70±0,01 0,83±0,004*L 0,74±0,006* 523,08±9,55 945,27±22,61*L 1099,89±30,36* L 570 0,72±0,01 0,82±0,006* 0,75±0,008* 530,38±10,9 889,24±23,80*L 1101,12±26,26* L 600 0,72±0,01 0,82±0,007* 0,76±0,004* 536,78±11,13 849,01±21,64*L 1062,28±27,07* 900 0,67±0,01 0,82±0,005*L 0,74±0,006* 487,21±6,72 938,40±23,70*L 1012,72±30,48* L 1800 0,67±0,01 0,82±0,005* 0,74±0,006* 460,91±6,23 875,25±20,05*L 1113,64±28,21* L 3600 0,65±0,01 0,84±0,005* 0,75±0,008* 479,94±6,46 789,42±20,63*L 1016,37±34,69* * Достоверность различий значений после воздействия кальция/верапамила по сравнению со значениями в изотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Достоверность различий значений после кальциевой нагрузки по сравнению с верапамилом по критерию Стьюдента (р<0,05). На 60 секунде коэффициент эксцентричности клетки увеличился на 28% (р<0,05) в пробах с Са2+, и на 16% (р<0,05) с верапамилом, на 240 секунде – соответственно на 18% и 7% (р<0,05), к концу инкубации (3600 секунда) на 29% и 15% (р<0,05) по сравнению с контролем. Под влиянием кальциевой нагрузки на 60 секунде инкубации объем клетки увеличился на 44% (р<0,05), под влиянием верапамила – на 103,5% (р<0,05), на 240 секунде – соответственно на 61% и 133%(р<0,05), к концу инкубации – на 64% и 112% (р<0,05) по сравнению с контролем. Коэффициент эксцентричности ядра под влиянием кальция был повышен в первые 120 секунд инкубации в среднем на 8% (р<0,05), а затем, бóльшую части времени его значения не отличались от контроля. Под влиянием верапамила коэффициент эксцентричности был снижен, ядро приобрело округлую форму. К окончанию инкубации на 3600 секунде коэффициент эксцентричности ядра в пробах с Са2+ увеличился на 10% (р<0,05), в пробах с верапамилом – снизился на 38% (р<0,05) по сравнению с контролем (таблица 96). 255 Таблица 96 – Морфометрические параметры ядра эритроцитов под влиянием кальция и верапамила в изотонической среде Вре- Коэффициент эксцентричности, мкм Объем, мкм3 мя, с контроль Са2+ верапамил контроль Са2+ верапамил L 30 0,74±0,01 0,81±0,02* 0,59±0,02* 42,72±1,88 39,86±3,62L 104,46±4,87* 60 0,76±0,01 0,75±0,02L 0,60±0,02* 38,83±1,37 46,62±4,23L 104,03±4,95* L L 90 0,77±0,01 0,83±0,02* 0,62±0,02* 42,11±1,75 55,97±4,69* 97,26±4,08* 120 0,69±0,02 0,79±0,02*L 0,61±0,02* 34,12±2,05 49,53±4,09*L 114,62±5,35* 150 0,76±0,02 0,79±0,01L 0,61±0,02* 38,64±2,72 40,97±3,18L 115,05±3,83* 180 0,75±0,02 0,78±0,02L 0,59±0,02* 36,02±1,49 43,14±3,27L 105,69±3,51* L L 210 0,72±0,02 0,78±0,01 0,58±0,02* 42,37±2,78 42,15±2,73 111,70±37,7* 240 0,76±0,02 0,77±0,02L 0,60±0,02* 45,76±2,87 39,67±3,53L 94,59±3,11* 270 0,77±0,01 0,78±0,01L 0,57±0,02* 43,82±1,74 41,11±3,68L 102,46±4,08* L L 300 0,70±0,02 0,77±0,01* 0,56±0,01* 40,82±2,07 41,11±3,68 105,14±3,11* 330 0,79±0,01 0,78±0,01L 0,56±0,02* 44,48±2,07 37,55±2,66L 105,94±4,23* 360 0,72±0,02 0,78±0,01L 0,59±0,02* 38,67±2,13 37,55±2,66L 98,47±3,41* L L 390 0,76±0,02 0,79±0,01 0,57±0,02* 38,40±1,91 37,95±3,07 97,71±3,09* 420 0,74±0,02 0,79±0,01L 0,57±0,01* 32,57±1,90 37,95±3,07L 87,72±3,73* 450 0,75±0,02 0,79±0,01L 0,55±0,02* 37,13±1,39 46,62±2,52L 103,98±3,59* 480 0,75±0,01 0,79±0,01L 0,59±0,02* 36,76±1,41 46,62±2,52L 100,11±3,62* L L 510 0,76±0,01 0,79±0,01 0,61±0,02* 34,79±1,76 46,62±2,52 102,65±3,48* 540 0,75±0,02 0,79±0,01L 0,55±0,02* 37,36±1,78 46,62±2,52L 106,75±3,00* 570 0,79±0,01 0,79±0,02L 0,59±0,02* 31,28±1,77 40,86±3,58*L 92,96±3,41* L L 600 0,73±0,02 0,79±0,02 0,58±0,02* 32,64±1,50 40,86±3,58* 89,81±3,63* 900 0,69±0,02 0,79±0,01L 0,55±0,01* 37,76±1,42 46,62±2,52*L 96,19±4,34* 1800 0,70±0,02 0,79±0,01*L 0,54±0,02* 40,42±1,59 46,62±2,52L 110,45±3,67* 3600 0,72±0,01 0,79±0,01*L 0,53±0,02* 36,28±1,47 46,62±2,52*L 99,37±3,22* * Достоверность различий значений по влиянием кальция/верапамила по сравнению со значениями в гипотонической среде без нагрузок (контроль) по критерию Стьюдента (р<0,05). L Достоверность различий значений под влиянием кальциевой нагрузки по сравнению с верапамилом по критерию Стьюдента (р<0,05). В условиях Са2+ нагрузки объем ядра в изотонической среде увеличивался на 90 и 120 секундах инкубации соответственно на 33% и 45% (р<0,05), а также в конце инкубации на 1800 и 3600 секундах – на 15% и 28,5% (р<0,05) по сравнению с контролем. Существенное увеличение объема ядер в изотонической среде наблюдали в пробах, обработанных верапамилом на протяжении всего времени инкубации (см. таблица 96). В изотонической среде под влиянием кальциевой нагрузки ядро использовало ≈33% внутриклеточного мембранного резерва ядром на 420 секунде инкубации. При этом клетки не использовали мембранный резерв плазмалеммы в осморегуляторных реакциях. Под влиянием верапамила использование мембранных резервных бассейнов в системе клетка-ядро не выявлено. 256 Таким образом, под влиянием ионов Са2+ в изотонической среде объем эритроцита увеличился, но при этом он сохранил эллипсоидную форму, в результате коэффициента эксцентричности клетки был повышен. Несмотря на увеличение объема эритроцита, использование ими мембранного резерва не выявлено. В условиях кальциевой нагрузки ядро практически не изменило своего объема, и формы на протяжении большего времени инкубации, лишь к концу воздействия наблюдали реакцию регуляторного увеличения объема. 2.6. Цитоархитектоника эритроцитов лягушек в условиях гипотонической и функциональных нагрузок 2.6.1. Цитоархитектоника эритроцитов лягушек в условиях гипоосмотической нагрузки (in vitro) В условиях гипоосмотической нагрузки в течение первых 60-ти секунд инкубации на поверхности мембраны эритроцитов идентифицировано сферообразное углубление в области расположения ядерной мембраны (рисунок 85 1а, 1б). Диаметр углубления был в пределах 225,50±20,98 нм, глубина – 52,03±4,02 нм. В интервале с 90 по 150 секунды кольцо трансформировалось в дугообразный валик (рисунок 85 1в-1д). На 120 секунде на поверхности эритроцитов видны изрезанные окончания валика (рисунок 85 1г). Начиная со 180 секунды и до конца инкубации, границы валика исчезли, вследствие увеличения объема ядра, рельеф поверхности был сглажен (рисунок 85 1е-1з). 257 1а 2а 1б 2б 1в 1г 2в 2г 258 1д 2д 1е 2е 1ж 1з 2ж 2з Рисунок 85 – Рельеф поверхности эритроцитов в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з - 900 секундах инкубации 259 В изотоническом растворе на 30 секунде инкубации были выявлены глобулярные выступы, при этом четко очерченная область перинуклеарного пространства отсутствовала (рисунок 85 2а). На 60 секунде инкубации появились границы ядреной мембраны, в виде изрезанного валика (рисунок 85 2б), которые затем исчезли к концу инкубации. В интервале с 90 по 150 секунды на поверхности ядра появились глобулярные выступы (рисунок 85 2в-2д), которые на 180 секунде исчезли, при этом в области перинуклеарного пространства появилось кольцо в виде углубления диаметром 200,86±13,04 нм, глубиной 57,25±1,59 нм (рисунок 85 2е). В интервале 300-900 секунды инкубации на поверхности мембраны обнаружены глобулярные образования (рисунок 85 2ж, 2з). На 30 секунде инкубации количество глобулярных выступов в гипотонической среде возросло на 74% (р<0,05), высота их существенно не изменилась по сравнению с изотоническим раствором (таблица 97). Таблица 97 – Размеры и количество глобулярных выступов на поверхности эритроцитов лягушек Время инГипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 56,11±8,89 38±1,5* 48,31±6,86 10±2 60 31,16±2,74* 38±1,18 65,54±6,9 42±6 90 20,84±3,15* 33±3,26 70,8±7,57 32±4 120 70,74±6,92* 21±1,88* 41,90±7,15 55±3 150 60,94±6,99* 25±2,14 93,50±5,10 23±2 180 42,11±2,97 33±3,15* 44,78±6,51 22±3 300 43,37±6,50 13±0,84* 5612±7,19 18±4 900 56,76±6,09* 24±2,19 38,36±3,68 23±2 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. В период с 60 по 90 секунды инкубации высота глобул снизилась соответственно на 52,4% и 70,5% (р<0,05), а их количество было в пределах не достоверных различий с изотоническим раствором. На 120 секунде высота глобул увеличилась на 69% (р<0,05), их количество снизилось на 62% (р<0,05), к концу инкубации высота глобул превысила аналогичные значения в изотоническом растворе 260 на 48% (р<0,05), а их количество находилось в пределах не достоверных различий. В течение первых 90 секунд инкубации количество углублений в мембране уменьшилось, их габаритные размеры увеличились (таблица 98). Таблица 98 – Габаритные размеры углублений в мембране и их количество на поверхности эритроцитов лягушек Время Гипотонический раствор Изотонический раствор инкубаглубина, нм диаметр, нм количеглубина, диаметр, нм количеции, с ство нм ство 30 25,12±5,68* 312,00±16,38* 12±0,3* 8,30±0,13 210,64±9,89 14±0,46 60 13,68±3,97 274,22±18,71* 9±0,2* 17,73±1,25 387,05±16,26 26±2,40 90 31,32±1,83* 339,75±16,08* 8±0,87* 20,72±3,94 204,92±18,50 13±1,6 120 18,41±1,85* 284,36±14,40* 11±2,14 12,22±2,48 183,2±13,77 10±1,47 150 19,82±7,42 233,5±16,39* 10±0,97 16,55±1,55 90,75±14,25 12±1,97 180 8,77±0,11* 206,00±18,74* 4±0,96 21,28±7,04 245,40±16,03 5±0,63 300 15,9±0,66* 183,00±14,37* 3±0,15* 21,48±0,69 241,8±16,65 5±0,21 900 14,28±3,36* 293,00±15,83* 6±1,24* 7,30±0,31 180,00±15,10 3±0,11 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 30 секунде инкубации глубина углублений и их диаметр увеличились соответственно на 202,6 и 48% (р<0,05), их количество сократилось на 16,7% (р<0,05) по сравнению с изоосмотической средой. На 90 секунде инкубации число углублений уменьшилось на 62,5% (р<0,05), их глубина и диаметр возросли соответственно на 51% и 65,8% (р<0,05) по сравнению с изотоническим раствором. К концу инкубации количество углублений в мембране возросло на 100% (р<0,05), а их глубина и диаметр увеличились соответственно на 95,6% и 62,8% (р<0,05) по сравнению с изотоническим раствором. В гипотонической среде установлено циклическое изменение картины рельефа поверхности. В течение первых 90 секунд инкубации количество глобул и углублений на поверхности мембраны увеличилось, а к концу инкубации уменьшилось (рисунок 86). 261 45 40 35 30 25 20 15 10 5 0 выступы углубления 30 60 90 120 150 180 300 900 с . Рисунок 86– Количество глобулярных выступов и углублений на мембране эритроцитов в гипотонической среде В изотонической среде количество углублений на поверхности мембраны увеличилось к 60 секунде инкубации, а затем постепенно снизилось. Число глобулярных образований на мембране изменилось не равномерно, оно возросло на 60 и 120 секундах, а затем снизилось и осталось практически не низменным до конца инкубации (рисунок 87). 70 60 50 40 30 выступы 20 углубления 10 0 30 60 90 120 150 180 300 900 с Рисунок 87 – Количество глобулярных выступов и углублений на мембране эритроцитов в изотонической среде Таким образом, в условиях гипоосмотического воздействия изменения цитоархитектоники эритроцитов произошли не только в области цитоплазматического пространства, но и затронули перинуклеарную часть клетки. Установлено, 262 что в течение первых 90 секунд инкубации в области перинуклеарного пространства на поверхности мембраны образовалась глубокая складка, которая затем, по мере увеличения объема превратилась в валик и к 120 секунде полностью расправилась, в результате четко были видны изрезанные края кариолеммы. В течение следующих 90 секунд инкубации, клетка максимально увеличилась в объеме и границы мембраны на сканах исчезли. Количество глобулярных выступов на поверхности мембраны увеличилось на 30 секунде инкубации, а в последующие периоды снизилось или находилось в пределах не достоверных различий с изотоническим раствором. Высота глобул на протяжении большего времени инкубации возросла. Число углублений в мембране вначале воздействия снизилось, а затем к концу – увеличилось. 2.6.2 Цитоархитектоника эритроцитов лягушек под влиянием функциональных нагрузок 2.6.2.1. Цитоархитектоника эритроцитов в условиях адреналиновой нагрузки Под влиянием адреналиновой нагрузки в гипотонической среде рельеф поверхности эритроцитов был сглажен в течение первых 60 секунд инкубации (рисунок 88 1а, 2а). В изотоническом растворе с период с 30 по 60 секунды воздействия на поверхности присутствовали глобулярные выступы (рисунок 88 2а), которые на 60 секунде инкубации укрупнились и образовали глобулы (рисунок 89 2б). На 90 секунде в гипотонической среде в области перинуклеарного пространства был идентифицирована складка, глубина которой не превысила 49,86±1,45 нм (рисунок 88 1в), при этом в изотоническом растворе также была выявлена не- 263 большая инвагинация мембраны, глубина которой составила 8,23±1,14 нм (рисунок 88 2в). 1а 2а 1б 2б 1в 2в 1г 2г 264 1д 2д 1е 2е 1ж 2ж 1з 2з Рисунок 88 – Рельеф поверхности эритроцитов, преинкубированных с адреналином, в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з - 900 секундах инкубации 265 В интервале 120-150 секунды инкубации в гипотонической среде на поверхности мембраны в области расположения хроматина появились небольшие глобулярные выступы (рисунок 88 1г), границы ядра исчезли, а к 150 секунде мембрана в области ядра вновь образовала валик, оканчиваясь в области цитоплазмы изрезанными волнистыми структурами (рисунок 88 1д). Поверхность эритроцитов в изотоническом растворе в интервале 120-150 секундах была пронизана углублениями, без каких-либо структурных особенностей (рисунок 88 2г, 2 д). Со 180 секунды и до конца инкубации в гипотонической среде на поверхности в незначительном количестве присутствовали углубления в и единичные глобулярные выступы (рисунок 88 1е-1з). Для изотонического раствора в этот период была характерна схожая ситуация, при этом глобулярные образования на мембране присутствовали в большем количестве (рисунок 88 2е-2з). На 30 секунде инкубации в гипотонической среде под влиянием адреналина высота и количество глобулярных выступов уменьшилось соответственно на 41,1% и 50% (р<0,05) по сравнению с изотоническим раствором (таблица 99). Таблица 99 – Размеры и количество глобулярных выступов на поверхности эритроцитов лягушек под влиянием адреналина Время ин- Гипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 44,50±6,01* 15±1,25* 75,61±7,29 30±2,48 60 43,13±4,10 26±1,64* 40,83±3,11 32±1,98 90 57,95±4,99 23±1,87 68,26±5,58 19±1,34 120 45,07±5,73* 26±2,03* 82,33±9,65 10±1,78 150 49,84±9,44* 25±1,13* 98,60±8,54 7±0,65 180 51,24±7,16* 22±2,36* 104,67±2,67 8±0,74 300 27,91±2,85* 33±0,98* 67,48±1,22 19±0,42 900 51,44±9,27 11±0,37* 49,30±6,00 20±1,23 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. В интервале со 120 по 300 секунды инкубации высота глобул снизилась, а их количество увеличилось. Так на 120 секунде высота глобул снизилась на 45,2% (р<0,05), количество увеличилось на 160% (р<0,05), 150 секунде – соответственно на 49,5% и 72% (р<0,05), 180 секунде – на 51% и 175% (р<0,05), 300 секунде – 266 58,6% и 74% (р<0,05) по сравнению с изотоническим раствором. К концу инкубации различия между высотой глобул в гипо- и изотонических средах отсутствовали, а их количество в гипотонической среде снизилось на 45% (р<0,05). Под влиянием адреналиновой нагрузки количество углублений в мембране возросло на протяжении первых 90 секунд инкубации. Так, на 30 секунде количество углублений увеличилось на 33% (р<0,05), 60 секунде – на 50% (р<0,05), 90 секунде – на 70,5% (р<0,05) по сравнению с изотоническим (таблица 100). Таблица 100 – Габаритные размеры углублений в мембране и их количество в рельефе эритроцитов лягушек под влиянием адреналина Время инкубации, с Гипотонический раствор Изотонический раствор глубина, диаметр, нм количеглубина, диаметр, нм количенм ство нм ство 30 6,70±0,06* 201,33±14,11* 8±0,5* 24,23±1,02 242,50±10,49 6±0,33 60 32,95±1,62* 347,66±15,09* 6±0,97* 6,65±1,83 181,75±15,43 4±0,10 90 47,69±8,54* 321,41±29,08 17±2,41* 26,90±1,01 317,6±16,46 5±0,69 120 14,96±1,96* 391,00±25,49* 8±0,69 29,60±1,01 249,87±27,15 8±0,78 150 12,37±1,27 230,19±14,28 16±1,15 180 33,62±6,25* 326,17±17,28* 6±0,33* 10,76±2,62 174,00±14,37 13±1,65 300 13,17±2,46 363,67±19,42* 12±1,77 11,46±0,66 203,33±15,86 13±1,22 900 11,75±0,55* 329,50±14,50* 2±0,07* 7,49±1,74 291,00±12,28 5±0,11 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 120 секунде инкубации количество углублений на мембране в гипо- и изотонической среде было одинаковым, а на 150 секунде в изотоническом растворе – они отсутствовали. Начиная со 180 секунды и до конца инкубации, в гипотонической среде количество углублений в мембране уменьшилось. К концу инкубации в гипотоническом растворе число углублений сократилось на 60% (р<0,05) по сравнению с изотоническим раствором. На 30 секунде инкубации в гипотонической среде габаритные размеры углублений уменьшились: глубина – на 72% (р<0,05), диаметр – на 16,9% (р<0,05) по сравнению с изотоническим раствором. В интервале 60-90 секунды габаритные размеры углублений в мембране увеличились. На 120 секунде диаметр углублений увеличился на 56,5% (р<0,05), а их глубина – уменьшилась на 97,8% (р<0,05) 267 по сравнению с изотоническим раствором. Начиная со 180 секунды и до конца инкубации, в гипотонической среде габаритные размеры углублений увеличились. Проанализировав динамику изменения количества глобулярных выступов и углублений в мембране под влиянием адреналиновой нагрузки, при снижении осмолярности среды приходим к выводу, что структурные перестройки поверхности произошли циклически с 30-ти секундными интервалами. При этом тесных корреляционных связей между изменением числа глобул и углублений в мембране не выявлено (r=0,51; рисунок 89). 40 35 30 25 20 выступы 15 углубления 10 5 0 30 60 90 120 150 180 300 900 с Рисунок 89 – Количество глобулярных выступов и углублений в мембране эритроцита в гипотонической среде под влиянием адреналина В изотонической среде перестройки в рельефе поверхности произошли в течение первых 90 секунд воздействия (рисунок 91). 268 40 35 30 25 20 выступы 15 углубления 10 5 0 30 60 90 120 150 180 300 900 с Рисунок 90– Количество глобулярных выступов и углублений в мембране эритроцита в изотонической среде под влиянием адреналина Существенно возросло количество глобул, а число углублений в мембране увеличивалось лишь к концу инкубации. 2.6.2.2 Цитоархитектоника эритроцитов в пробах с обзиданом Под влиянием обзидана на 30 секунде инкубации в гипоосмотической среде в области перинуклеарного пространства была идентифицирована инвагинация мембраны вглубь клетки, глубина которой составила 195,60±12,04 нм (рисунок 91 1а). Выявленная структура сохранилась на 60 секунде инкубации, при этом ее глубина сократилась до 85,97±3,67 нм (рисунок 91 1б). В изоосмотической среде в период с 30 по 60 секунды на поверхности мембраны присутствовали глобулярные выступы и небольшие углубления (рисунок 91 2а, 2б). На 90-120 секундах в гипотонической среде мембрана в области ядра приподнялась над поверхностью клетки, инвагинации исчезли (рисунок 91 1в, 1г). В изотоническом растворе в этот период поверхность была гладкой и без особенностей (рисунок 91 2в), однако на 269 120 секунде мембрана в области перинуклеарного пространства образовала небольшое углубление внутрь клетки, размером 48,69±1,85 нм (рисунок 91 2г). 1а 2а 1б 2б 1в 2в 270 1г 2г 1д 2д 1е 2е 1ж 2ж 271 2з 1з Рисунок 91 – Рельеф поверхности эритроцитов, преинкубированных с обзиданом, в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з - 900 секундах инкубации На 150, 180 секундах инкубации в гипотонической среде мембрана образовала высокий валик вокруг хроматина, который окончился в цитоплазме изрезанными краями (рисунок 91 1д, 1е), при этом в изотоническом растворе рельеф поверхности был большей частью сглажен, изредка присутствовали углубления в мембране (рисунок 91 2д, 2е). К концу инкубации 300-900 секунды рельеф поверхности в гипо- (рисунок 91 1ж, 1з) и изотонической (рисунок 91 2ж, 2з) средах практически не отличался, на мембране присутствовали глобулярные образования и небольшие углубления. Под влиянием обзидана в гипотонической среде изменение числа и размеров глобул на поверхности эритроцитов протекало циклически. Снижение числа выступов и уменьшения их размеров сменилось увеличением их числа размеров глобул значений изотонического раствора. Количество глобулярных выступов и их высота на 30 секунде инкубации в гипотонической среде снизились соответственно на 43,3% и 51,5% (р<0,05) по сравнению с изоосмотическим раствором (таблица 101). Таблица 101 – Размеры и количество глобулярных выступов на поверхности эритроцитов лягушек под влиянием обзидана Время инкубации, с 30 60 Гипотонический раствор высота, нм количество 41,78±5,50* 17±1,69* 43,51±6,22 26±1,14* Изотонический раствор высота, нм количество 86,13±7,00 30±2,18 44,04±4,95 14±0,29 272 Продолжение таблицы 101 Время инГипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 90 67,61±6,04* 41±2,18* 91,25±3,60 20±011 120 64,19±6,52 18±0,23* 58,46±6,79 26±1,15 150 43,78±4,64* 13±0,11* 128,12±3,07 23±0,67 180 36,53±3,90* 18±0,60 61,26±7,69 16±0,78 300 60,60±6,61* 16±0,34 36,16±3,65 17±0,18 900 63,73±7,11* 19±0,15* 82,18±3,03 14±0,12 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 60 секунде инкубации количество глобул в гипотонической среде возросло на 85,7% (р<0,05), при этом их высота не отличалась от значений изотонической среды. На 90 секунде высота глобул снизилась на 26% (р<0,05), а их количество увеличилось на 105% (р<0,05) по сравнению с изотоническим раствором. На 150 секунде воздействия в гипотонической среде количество глобулярных выступов и их высота уменьшились соответственно на 43,5% и 65,8% (р<0,05). К концу инкубации (900 с) число глобул увеличилось на 35,7% (р<0,05), а их высота снизилась на 22,4% (р<0,05) по сравнению с изотоническим раствором. Под влиянием обзидана количество углублений в мембране достоверно увеличилось, начиная с 60 секунды инкубации клеток в гипотонической среде. На 60 секунде в гипотонической среде количество углублений в мембране возросло на 70,5% (р<0,05), а затем в период с 90 по 150 секунды уменьшилось по сравнению с изотоническим раствором. В последующие секунды инкубации число углублений в мембране увеличилось и к концу инкубации (900 секунда) превысило значения изотонического раствора на 166% (р<0,05) (таблица 102). Таблица 102 – Габаритные размеры углублений в мембране и их количество на поверхности эритроцитов лягушек под влиянием обзидана Время инкубации, с 30 60 90 120 Гипотонический раствор глубина, нм диаметр, нм Изотонический раствор глубина, нм диаметр, нм 40,87±1,27 13,49±1,79* 8,77±0,28* 19,83±4,13* 33,28±3,48 7,50±0,46 21,17±1,79 50,21±1,32 количество 148,00±8,55* 19±0,80 310,94±13,50* 17±1,16* 274,67±13,46 3±0,08* 375,33±15,59* 3±0,08* 258,19±16,40 206,40±18,73 279,54±13,72 253,12±11,48 количество 21±1,58 5±0,08 13±1,08 9±0,79 273 Продолжение таблицы 102 Время Гипотонический раствор Изотонический раствор инкуба- глубина, нм диаметр, нм количеглубина, нм диаметр, нм количестции, с ство во 150 535,86±25,9* 413,15±18,14* 13±1,85* 196,96±29,78 323,95±19,37 21±1,27 180 119,35±19,63* 334,38±19,14* 21±1,47* 25,79±1,45 246,83±14,31 12±1,01 300 49,92±1,70* 439,00±19,60* 4±0,02 9,22±0,32 301,75±15,54 4±0,94 900 61,72±1,24* 408,25±18,30* 8±0,66* 13,50±0,83 338,67±18,50 3±0,04 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. В интервале с 30 по 90 секунды инкубации в гипотонической среде габаритные размеры углублений уменьшились, в последующие временные периоды диаметр и глубина углублений возросли. В частности, на 60 секунде диаметр углублений и их глубина увеличились соответственно на 50,6% и 79,8% (р<0,05), 150 секунде – на 27,5% и 63% (р<0,05), 300 секунде – на 45,5% и 81,5% (р<0,05), к концу инкубации (900 с) – на 17% и 78% и (р<0,05) по сравнению с изотоническим раствором. Проанализировав изменения рельефа поверхности под влиянием обзидана в гипотонической среде, видно, что в течение первых 30-ти секунд инкубации на поверхности эритроцита увеличилось количество углублений, а в последующие 60 секунд инкубации – число глобулярных выступов (рисунок 92). 50 45 40 35 30 25 20 15 10 5 0 выступы углубления 30 60 90 120 150 180 300 900 с Рисунок 92 – Количество глобулярных выступов и углублений на мембране эритроцитов в гипотонической среде под влиянием обзидана 274 В изотонической среде структурные перестройки поверхности в основном были связаны с изменением числа глобулярных выступов (рисунок 93). 35 30 25 20 15 выступы 10 углубления 5 0 30 60 90 120 150 180 300 900 с Рисунок 93 – Количество глобулярных выступов и углублений на мембране эритроцита в изотонической среде под влиянием обзидана Установлена корреляционная зависимость между изменением числа глобул и углублений в мембране (r=0,75). В изотонической среде увеличение количества глобулярных образований в рельефе поверхности сопровождалось снижением числа углублений в мембране, за исключением 30 и 150 секунд инкубации. 2.6.2.3 Цитоархитектоника эритроцитов в условиях кальциевой нагрузки Под влиянием кальциевой нагрузки на 30 секунде инкубации в гипотонической среде на поверхности мембраны эритроцита образовались глобулярные конгломераты (рисунок 94 1а), которые исчезли к 60 секунде (рисунок 94 1б), а затем вновь появились, придавая вид шероховатой поверхности в области расположения хроматина (рисунок 94 1в). В изотоническом растворе на 30 секунде в области перинуклеарного пространства мембрана образовала складку в виде ва- 275 лика с неровными краями (рисунок 94 2а). На 60 секунде инкубации складка исчезла, при этом ядро приподнялось над поверхностью эритроцита (рисунок 94 2б), а к 90 секунде – вновь появилась складка в виде валика с изрезанными краями (рисунок 94 2в). На 120, 150 секундах инкубации рельеф поверхности клеток между гипо- (рисунок 94 1г, 1д) и изотоническим (рисунок 94 2г, 2д) растворами существенно не различался. В этот период на поверхности клетки присутствовали углубления. 1а 1б 1в 2а 2б 2в 276 1г 2г 1д 2д 1е 2е 1ж 2ж 277 1з 2з Рисунок 94 – Рельеф поверхности эритроцитов, преинкубированных с Са2+, в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з - 900 секундах инкубации На 180 секунде в гипотонической среде существенных изменений в рельефе не наблюдали (рисунок 94 1е), а в изоосмотической среде появились глобулярные выступы (рисунок 94 2е). На 300 и 900 секундах инкубации на поверхности эритроцитов в гипотонической среде наблюдали слабоструктурированную складку мембраны в области расположения ядра (рисунок 94 1ж) и незначительное количество мелких глобул и углублений (рисунок 94 1з). В изотоническом растворе к концу инкубации на мембране располагалось небольшое количество углублений и одиночные глобулы (рисунок 94 2ж), которые образовали глобулярные конгломераты (рисунок 94 2з). Под влиянием Са2+- нагрузки число глобулярных выступов оставалось сниженным на протяжении всего времени инкубации клеток в гипотонической среде (таблица 103). Таблица 103 – Размеры и количество глобулярных выступов на поверхности эритроцитов лягушек под влиянием Са2+-нагрузки Время инкубации, с 30 60 90 120 150 180 300 Гипотонический раствор высота, нм количество 63,55±1,40 13±1,07* 68,89±4,74 6±0,47* 47,04±2,86* 20±2,15* 121,93±18,3* 3±0,01* 56,01±6,13 20±0,18* 59,07±11,41 18±0,67* 57,22±4,06* 16±0,74* Изотонический раствор высота, нм количество 58,71±5,59 43±1,87 60,4±5,52 19±0,22 93,79±5,76 26±1,67 89,43±0,44 12±0,48 52,67±5,60 16±0,11 63,71±7,09 14±0,29 26,28±3,18 22±1,87 278 Окончание таблицы 103 Время ин- Гипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 900 35,39±3,93 15±0,64* 37,72±4,46 22±1,87 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. Высота глобул в гипотонической среде в течение первых 60 секунд инкубации практически не отличалась от аналогичных показателей в изотоническом растворе. На 90 секунде число выступов уменьшилось на 23% (р<0,05), на 120 секунде – на 76% (р<0,05), на 300 секунде – на 27,3% (р<0,05), к концу воздействия на 900 секунде высота глобул между исследуемыми группами сравнялась. Под влиянием Са2+-нагрузки в гипотонической среде на 30 секунде инкубации количество углублений их глубина увеличились соответственно на 144% и 93% (р<0,05), а диаметр – уменьшился на 26,4% (р<0,05) по сравнению с изотоническим раствором (таблица 104). Таблица 104 – Габаритные размеры углублений на мембране и их количество на поверхности эритроцитов под влиянием Са 2+ -нагрузки Время Гипотонический раствор Изотонический раствор инкуба- глубина, нм диаметр, нм количест- глубина, диаметр, нм количеции, с во нм ство 30 26,48±1,73* 338,14±21,38* 22±1,87* 13,72±1,74 459,67±15,15 9±0,12 60 11,01±2,03 343,25±25,74* 4±0,06 9,07±0,31 265,67±9,33 3±0,05 90 18,94±0,84 294,86±22,13 14±0,18* 24,02±3,81 288,55±15,95 9±0,18 120 31,04±19,94* 403,13±13,59* 15±0,11* 19,55±2,78 154,75±17,08 4±0,07 150 16,57±2,48 364,50±14,76 6±0,09 180 14,73±1,19* 301,71±19,91* 7±0,08 53,43±1,18 336,37±21,25 8±0,02 300 3,92±0,42 215,75±25,89 4±0,03 900 14,45±2,41 402,44±12,97* 9±0,06* 13,54±1,56 265,82±23,16 11±0,74 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. В последующие секунды инкубации в гипотонической среде (60-120 секунды) число углублений в мембране увеличилось. На 60 секунде диаметр углублений возрос на 87% (р<0,05), при этом их глубина практически не изменилась по сравнению с изотоническим раствором. На 90 секунде инкубации количество углублений увеличилось на 55,5% (р<0,05), при этом их габаритные размеры не из- 279 менились. На 150 и 300 секундах в гипотонической среде углубления на поверхности мембраны отсутствовали. К концу инкубации на 900 секунде число углублений снизилось на 18,2% (р<0,05), а их диаметр возрос – на 51,4% (р<0,05) по сравнению с изотоническим раствором. Анализируя перестройки рельефа поверхности в гипотонической среде видно, что в течение первых 30-ти секунд инкубации произошло увеличение числа глобулярных выступов и углублений в мембране по сравнению с последующими секундами воздействия (рисунок 95). 50 45 40 35 30 25 выступы 20 углубления 15 10 5 с 0 30 60 90 120 150 180 300 900 Рисунок 95 – Количество глобулярных выступов и углублений в мембране эритроцитов в гипотонической среде под влиянием Са2+ -нагрузки В дальнейшем число выступов на мембране снизилось, а углублений – увеличилось. Появление в рельефе поверхности большого количества глобулярных конгломератов сопровождалось полным исчезновением углублений на мембране на 150 и 300 секундах инкубации. В изотонической среде в течение первых 60 секунд инкубации число структурных образований на поверхности эритроцита уменьшилось (рисунок 96). 280 25 20 15 выступы 10 углубления 5 с 0 30 60 90 120 150 180 300 900 Рисунок 96 – Изменение количества глобулярных выступов и углублений на мембране эритроцитов в изотонической среде под влиянием Са2+-нагрузки Начиная с 90 секунды и до конца инкубации, наблюдали структуризацию поверхности и увеличение количества глобул и углублений на мембране. 2.6.2.4. Цитоархитектоника эритроцитов под влиянием верапамила Под влиянием верапамила на 30 секунде инкубации как в гипо-, так и в изотоническом растворе в рельефе поверхности присутствовали не многочисленные углубления в мембране, мембрана в области ядра была приподнята над поверхностью клетки, четких очертаний не наблюдали (рисунок 97 1а, 2а). 1а 2а 281 1б 1в 1г 1д 2б 2в 2г 2д 282 1е 2е 1ж 2ж 1з 2з Рисунок 97 – Рельеф поверхности эритроцитов, преинкубированных с Са2+, в гипо- (1) и изотоническом (2) растворах на: а – 30, б – 60, в – 90, г – 120, д – 150, е – 180, ж – 300, з - 900 секундах инкубации На 60 секунде инкубации в гипотонической среде мембрана в области перинуклеарного пространства приобрела четкие контуры (рисунок 97 1б), а в изотоническом растворе – образовала валик, который в области цитоплазмы заканчивался изрезанными краями (рисунок 97 2б). На 90 секунде инкубации контуры 283 мембраны в области валика были размыты (рисунок 97 1в), но к 120 секунде в области хроматина появилась шероховатость, мембрана в области перинуклеарного пространства была приподнята над поверхностью и образовывала складки (рисунок 97 1г). В изотонической среде на 90 секунде инкубации валик был структурирован, а в центре ядра сосредоточены узелки и скопления хроматина (рисунок 97 2в), которые к 120 секунде инкубации исчезли, и рельеф поверхности приобрел гладкий вид (рисунок 97 2г). В интервале 150-180 секунды инкубации на поверхности присутствовали глобулярные выступы и углубления, причем их количество было незначительным, поэтому в целом рельеф мембран был сглажен как в гипо(рисунок 97 1д, 1е), так и в изотонической среде (рисунок 97 2д, 2е). На 300 секунде в гипотоническом растворе было хорошо выражено перинуклеарное пространство, ядро при этом приподнято над поверхностью (рисунок 97 1ж), такая картина сохранилась и на 900 секунде (рисунок 97 1з). В изотоническом растворе на 300 секунде наблюдали одиночные глобулярные выступы (рисунок 97 2ж), число которых уменьшилось на 900 секунде, при этом мембрана в области ядра приподнялась над поверхностью клетки, аналогично, как в гипотоническом растворе (рисунок 97 2з). Под влиянием верапамила на 60 секунде в гипотонической среде количество глобулярных выступов и их высота уменьшились соответственно на 26,9% и 22,8% (р<0,05) по сравнению с изотоническим раствором (таблица 105). Таблица 105 – Размеры и количество глобулярных выступов на поверхности эритроцитов лягушек под влиянием верапамила Время ин- Гипотонический раствор Изотонический раствор кубации, с высота, нм количество высота, нм количество 30 46,98±5,11 13±1,16 41,47±5,82 16±0,87 60 69,89±5,07* 19±1,24* 90,58±7,91 26±2,13 90 35,92±4,76 10±1,11* 48,40±6,25 23±1,96 120 56,62±9,09 16±2,41* 65,24±6,68 8±0,22 150 54,57±4,94 22±2,36* 63,88±6,39 9±0,17 180 40,27±8,50 17±1,05 49,22±7,15 16±0,19 300 48,30±5,72 11±0,18* 59,41±6,85 18±0,14 900 42,25±8,57 11±0,18* 34,19±3,64 9±0,06 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. 284 Начиная со 120 секунды и до конца инкубации, размеры глобул не изменились по сравнению с изотоническим раствором. Количество глобулярных структур увеличилось на 120 и 150 секундах соответственно на 100% и 144% (р<0,05), на 300 секунде – снизилось на 38,9% (р<0,05), а к концу инкубации – вновь возросло на 22% (р<0,05) по сравнению с изотоническим раствором. Под влиянием верапамила на 90 секунде инкубации в гипотонической среде количество углублений в мембране уменьшилось на 37,5% (р<0,05), при этом различия в их габаритных размерах были не достоверны между гипо- и изотонической средой (таблица 106). Таблица 106 –Габаритные размеры углублений в мембране и их количество на поверхности эритроцитов под влиянием верапамила Время Гипотонический раствор Изотонический раствор инкуба- глубина, диаметр, нм количеглубина, диаметр, нм количестции, с нм ство нм во 30 22,18±2,15 235,43±12,57 7±0,15 60 26,75±1,49 508,00±17,30 6±0,03 30,3±1,77 544,50±19,97 6±0,08 90 19,32±2,73 242,45±25,31 10±1,15* 18,95±3,76 300,37±28,27 16±0,55 120 15,39±1,94* 248,12±16,63 8±0,79* 35,61±1,89 229,00±11,62 6±0,04 150 21,50±1,85 219,67±27,66* 3±0,08 22,83±1,18 391,25±18,34 4±0,02 180 14,00±2,44* 274,43±29,72 7 ±0,04* 30,67±1,94 254,25±13,42 4±0,02 300 19,45±2,67 304,00±16,28 4±0,06 16,36±1,57 293,00±13,75 5±0,08 900 44,14±2,38* 267,87±16,18 8±0,15* 14,25±1,67 257,40±22,64 10±0,36 *- Статистически достоверные различия между значениями в гипотоническом растворе по сравнению со значениями в изотоническом растворе по критерию Стьюдента при р<0,05. На 120 и 180 секундах инкубации число углублений в мембране возросло соответственно на 33% и 75% (р<0,05), а их глубина уменьшилась на 56,8% и 54,3% (р<0,05) по сравнению с изотоническим раствором. К концу инкубации (900 секунда) в гипотонической среде число углублений снизилось на 20% (р<0,05), а их глубина увеличилась на 67,7% (р<0,05) по сравнению с изотоническим раствором. Под влиянием верапамила установлен циклический характер в изменении количества глобулярных выступов и углублений в мембране (рисунок 98). Увеличение количества углублений отмечались на 90 секунде, а глобулярных образований – на 60 и 150 секундах инкубации. 285 25 20 15 выступы 10 углубления 5 0 30 60 90 120 150 180 300 900 с Рисунок 98 – Количество глобулярных выступов и углублений в мембране эритроцита в гипотонической среде под влиянием верапамила В изотоническом растворе углубления в мембране появились спустя 60 секунд от начала инкубации, при этом их максимальное количество наблюдали на 90 секунде (рисунок 99). 30 25 20 15 выступы 10 углубления 5 с 0 30 60 90 120 150 180 300 900 Рисунок 99 – Количество глобулярных выступов и углублений в мембране эритроцита в изотонической среде под влиянием верапамила В течение первых 90 секунд инкубации в изотоническом растворе количество глобул увеличилось, затем резко уменьшилось, а в последующие 180-300 секунды инкубации вновь возросло. 286 Глава 3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ Мембранный резерв клеток, представленный поверхностными структурами, в виде складчатости, и внутриклеточным бассейном, в виде экзоцитозных мембранных вставок, активно используется клетками крови в процессах регуляции объема во время осмотического стресса. Результаты экспериментального исследования, представленные в настоящей работе, позволяют утверждать, что для адекватного изучения морфофизиологических реакций форменных элементов крови, необходимо создать условия приближенные к нативным, учитывающие динамический характер находящихся во взаимосвязи структурных компонентов мембраны, которые определяют тактику реагирования клеток на снижение осмолярности среды. Анатомической основой мембранного резерва плазмалеммы выступают инвагинации (углубления в мембране) и эвагинации (глобулярные образования, микроворсинки, филоподии) (Raucher D., Sheetz M.P., 1999). Несмотря на сходство в морфологии и особенностях строения мембраны (Бондарев А.А., 1990), конфигурация клеточной поверхности и характер ее специализированных образований весьма различен и зависит от типа клеток, степени их созревания и дифференцировки поверхностных маркеров (Модестова Е.В., 1988; Лобовская Л.В., 1985; Новодержкина Ю.К. с соавт., 2004; Soligo D. et al., 1988; Polliack A., 1993). В проведенном исследовании изучено использование запасов мембранного резерва форменными элементами крови в тестах с осмотической нагрузкой. Установлено, что использование дополнительных мембранных структур в регуляции объема зрелых клеток крови определяется упруго-эластическими свойствами клеточного каркаса и сопровождается изменением «рисунка» морфологии плазмалеммы. С использованием метода атомно-силовой микросокпии выявлены структуры рельефа поверхности лимфоцитов здоровых доноров в физиологических усло- 287 виях, которые представлены глобулярными выступами и углублениями на поверхности мембраны, а также продемоснтрированы перестройки конфигурации поверхности, сопровождающие развитие адаптивного клеточного ответа на снижение осомлярности среды и функциональные нагрузки. Осморегуляторные реакции лимфоцитов здоровых доноров носят циклический характер и состоят из чередующихся периодов регуляторного увеличения и уменьшения объема. Изменение объема лимфоцитов доноров в гипотонической среде анализировали в сравнении с аналогичным показателем в изотоническом растворе. Длительность периода увеличения объема лимфоцитов в гипотонической среде составила 360 секунд. Длительность периода регуляторного уменьшения объема лимфоцитов была 60 секунд, который наблюдали в интервале с 390 по 450 секунды инкубации. Лимфоциты использовали дополнительные мембранные структуры в регуляции объема как в гипо-, так и в изотонической средах. В гипотонической среде происходило постепенное увеличение использования резерва плазмалеммой, достигая максимума (≈36%) на 240 секунде, а затем наблюдали чередование периодов увеличения и снижения использования резерва до конца инкубации. В изотоническом растворе вовлечение дополнительных мембранных структур клетками в регуляцию объема наблюдали на протяжении первых 420 секунд. Максимальное использование резервных структур (≈48%) в изотонической среде отмечали на 420 секунде, а затем происходило уменьшение процента резервных структур, задействованных в регуляции объема. Использование лимфоцитами мембранного резерва плазмалеммы в условиях изотонической среды в течение длительного времени инкубации свидетельствует о развитии реакций дисрегуляции. Выявленная реакция подтверждает данные литературы, согласно которым при помещении клеток в изоосмотическую среду, набухание происходит тем интенсивнее, чем значительнее подавляется их дыхание, даже если осмолярность раствора соответствует осмолярности плазмы (Финкинштейн Я.Д., 1983). Объем ядра лимфоцитов доноров был увеличен на протяжении всего времени инкубации. В интервале 30-300 секунды инкубации наблюдали увеличения ис- 288 пользования дополнительных мембранных структур ядром в гипотонической среде. Максимальное использование резервной поверхности ядром (≈33%) отмечали на 240-270 секундах. В изотонической среде ядро задействовало минимальные запасы резерва, максимум использования структур (≈10,5%) протекало на 150 секунде. Наблюдаемое чередование фаз регуляторного увеличения объема и восстановления его до значений изотонической среды в системе клетка-ядро зависит от стратегий реагирования лимфоцита на изменение осмолярности среды. Одна из тактик реагирования связана с использованием мембранного резерва, а другая с работой ион-транспортных мембранных переносчиков. В умеренно- гипотонической среде клетки используют поверхностные бассейны плазмалеммы. Учитывая, что значительная часть запасов поверхности мембраны, представленных в виде складчатости, может разворачиваться, в проведенном исследовании изучены особенности цитоархитектоники в различные фазы изменения объема клеток. В фазу увеличения объема лимфоцитов доноров в первые 30 секунд воздействия гипотонической средой для поверхности лимфоцитов здоровых доноров было характерно снижение числа глобулярных образований, и увеличение их высоты по сравнению с изотоническим раствором. В последующие 60 секунд инкубации в гипотоническом растворе сохранилась тенденция к увеличению числа глобулярных выступов при уменьшении их высоты. Начиная со 180 секунды и до конца инкубации, количество глобул увеличилось, но их высота снизилась. В гипотонической среде изменения в рельефе поверхности протекали на 90 секунд быстрее по сравнению с изотоническим раствором. Перестройки рельефа поверхности лимфоцитов здоровых доноров в гипотонической среде тесно связаны с архитектурой подмембранного цитоскелета. Увеличение размеров глобул на поверхности лимфоцитов здоровых доноров при снижении осмолярности среды указывает на перестройки высоко динамичных регионов подмембранного цитоскелета, содержащих богатые актином структуры (Tall E.A. et al., 2000). Доказано, что пространственная конфигурация динамичных 289 регионов клеточных мембран регулируется фосфоинозитидным сигнальным путем (Sechi S.A., Wehland J., 2000), тригеррным лигандом которого выступают ионы эндогенного Са2+, выходящие из внутриклеточных депо в ответ на снижение осмолярности среды (Light D.B. et al., 2002). Высказано предположение, согласно которому сопротивление актиновой сети току воды во время осмотического увеличения объема, является одним из решающих механизмов, инициирующих появление глобул, выступов и протрузий на поверхности (Ito T. et al., 1992). Одна из теорий связывает такое поведение мембраны с осмотическим набуханием актинового геля после разрыва актиновых филаментов белком гельзолином (Oster G.F., Perelson A.S., 1987). В снижении числа глобулярных выступов заложена компенсаторная реакция клетки, направленная на использование резерва поверхности для снятия литического напряжения в мембране. При этом увеличение высоты отдельных глобул, вероятно, связано с образованием локальных областей дезагрегированного актинового кортекса (Ito T. et al., 1992). Другим механизмом, позволяющим клетке сохранить сублитическое напряжение в мембране, является работа насосов и утечка осмолитов (Morris C.E., Homann U., 2001). Известно, что во время регуляторного увеличения объема клеток происходит поступление К+ во внутрь клетки, в то время как при возвращении объема к исходным значениям поток K+ направлен из клетки (Grinstein S. et al., 1982). Потеря К+ лимфоцитами опосредуется увеличением уровня цитоплазматического Са2+, выход которого из внутриклеточных депо запускает сниженная осмолярность среды (McCarty N.A., O’Neil R., 1992; Foskett J.K., 1994). Повышение концентрации цитозольного Са2+ усиливает работу Ca2+ индуцированных К+ каналов (Гардош каналы), выкачивающих К+ (Berkefeld H. et al., 2010) и увеличивает Cl--проводимость клетки (Grinstein S., Smith J.D., 1990). Для лимфоцитов описаны объем-чувствительные Cl-ионные каналы, которые индуцируют Cl- проводимость в осмотически набухших клетках (Grinstein S., 1982a). Основной целью проведенных опытов с функциональными нагрузками было выявить взаимосвязь между упруго-эластическими свойствами клеток и интенсивностью использования ими мембранного резерва в тестах с осмотической на- 290 грузкой in vitro. В условиях адреналиновой нагрузки жесткость лимфоцитов здоровых доноров увеличилась, при этом в рельефе клеток появилось обилие глобулярных выступов со сниженной высотой. В параллельных опытах с обзиданом жесткость клеток снизилась, при этом число глобулярных структур увеличилось, а их количество практически не изменилось. Наблюдаемые изменения рельефа поверхности, вероятнее всего, связаны с высоким сродством обзидана к липидному бислою мембран, который оказывает мембранно-стабилизирующее действие (Думплис М.А., Кудряшова Н.И., 1983), изменяет его свойства (Ferreire Q. et al., 2006), подавляет аденилатциклазу и уменьшает образование цАМФ (Anderson R. et al., 1996). В условиях адреналиновой нагрузки длительность периода регуляторного увеличения объема лимфоцитов в гипотонической среде возросла до 450 секунд, что на 90 секунд больше, чем в клетках без нагрузки. В гипотонической среде клетка задействовала максимум мембранного резерва (≈15%) на 60 секунде инкубации, в это же время в изотоническом растворе лимфоциты задействовали ≈2% резервной поверхности. Ядро использовало ≈16% резерва на 30 секунде инкубации в гипотоническом растворе, при этом в изотонической среде ядро не использовало дополнительные резервы внутриклеточного бассейна. Длительность и реализация периодов регуляторного сокращения объема в системе клетка-ядро по времени не совпадали. Изменение объема ядра протекало на 90 секунд быстрее, чем клетки в целом. Рельеф поверхности в течение первых 60 секунд воздействия гипотонической среды был сглажен, количество глобулярных структур снижено. В период с 90 по 120 секунды инкубации глобулы укрупнились и появились кластеры, кроме того увеличилось количество углублений, габаритные размеры которых сократились по сравнению со структурами в изотоническом растворе. Под влиянием обзидана, фаза регуляторного увеличения объема лимфоцитов составила 240 секунд. В системе клетка-ядро, изменения объема клетки протекали на 210 секунд быстрее по сравнению с ядром. Продолжительность периода регуляторного сокращения объема, как на уровне клетки, так и на уровне ядра составила в среднем 30 секунд. Максимальное использование резерва плазмалеммы 291 (≈6%) клеткой наблюдали на 30 секунде инкубации в гипотонической среде. В пробах с обзиданом, ядро не использовало дополнительные мембранные структуры, как при снижении осмолярности среды, так и в изотоническом растворе. В гипотонической среде рисунок рельефа поверхности в первые 90 секунд инкубации был сглажен, количество и высота глобулярных образований на поверхности мембраны – снижены. В интервале со 120 по150 секунды инкубации в гипотонической среде высота глобул возросла, но их количество оставалось сниженным, что указывает на процессы укрупнения белковых структур в мембране и их перестройку. Число углублений в мембране и их габаритные размеры уменьшились. Снижение числа углублений на поверхности привело к ее расправлению и увеличению площади поверхности. В целом, под влиянием адреналина жесткость мембраны возросла, вследствие этого в гипотонической среде клетка имела ограниченные ресурсы для вовлечения поверхностного бассейна плазмалеммы в осморегуляторные реакции. Снижение упругости клетки практически в 1,5 раза привело к увеличению длительности фазы регуляторного увеличения объема в 1,25 раза по сравнению с клетками без нагрузки, при этом объем задействованных дополнительных мембранных структур уменьшился практически в 2 раза. В условиях блокады β- адренорецепторов жесткость мембраны снизилась в 1,25 раза, при этом длительность фазы регуляторного увеличения объема возросла в 1,5 раза, однако объем дополнительных мембранных структур, задействованных в гипотонической среде, снизился в 6 раз. Очевидно, адреналиновая нагрузка, увеличив жесткость цитоскелета, явилась лимитирующим фактором в использовании клетками значительной части запасов присутствующих на поверхности. В литературе имеются данные о влиянии жесткости цитоскелета на размер резервуара мембраны. Показано, что при увеличении плотности микротрубочек, повышающих жесткость цитоскелета, величина доступного для использования мембранного резерва снижается (Raucher D. et al., 1999). Объем ядра клетки, как в условиях активации, так и блокады βадренорецепторов в гипотонической среде уменьшался. Ядро клетки не задейст- 292 вовало в регуляции объема дополнительные структуры. Полученные данные свидетельствуют о том, что упруго-эластические свойства клеток определяют длительность реализации реакций регуляторного увеличения и уменьшения объема. При инкубации лимфоцитов с хлоридом кальция жесткость лимфоцитов здоровых доноров снизилась, в рельефе поверхности наблюдали обилие глобулярных выступов со сниженной высотой. Под влиянием блокатора Са2+-каналов верапамила жесткость клеток снизилась по сравнению с контролем. На поверхности возросло число глобулярных структур, присутствовали небольшие бульбарные выросты. Существенных различий в жесткости и рельефе поверхности клеток под влиянием кальциевой нагрузки и верапамила не выявлено. Снижение жесткости лимфоцитов в условиях кальциевой нагрузки может быть связано с изменением агрегатного состояния белков цитоскелета, которые при увеличении экзогенного Са2+ в среде, под влиянием актин фрагментирующих белков виллина и гельзолина, переходят из состояния геля в состояние золя (Фултон А., 1987). Обилие глобулярных выступов на поверхности в условиях кальциевой нагрузки может быть связано с формированием актинсвязывающих доменов в подмембранном пространстве. Так по данным ряда авторов формирование выпячиваний или выступов на плазмалемме зависит от формирования актиновых агрегатов в подмембранном пространстве (McMahon H.T., Gallop J.L., 2005; Insall R.H., Machesky L.M., 2009; Itoh T., Takenawa T., 2009). Механизм образования аткинсвязывающих доменов протекает с участием кальций-мобилизирующих рецепторов с образованием циклических нуклеотидов, в частности PIP2, в результате активации полифосфатидилинозитного цикла (Евстигнеева Р.П., 1985). Высокая концентрация PIP2 в динамичных регионах мембраны, богатых актиновыми структурами (Tall E.G. et al., 2000), запускает полимеризацию актина (Shibasaki Y. et al., 1997) и стимулирует появление большого числа глобулярных выступов. Противоположная ситуация происходит под влиянием неселективного блокатора кальциевых каналов – верапамила, который оказывает влиянием на фосфоинозитидный обмен (Авдонин П.В., Ткачук В.А., 1994). Появление на поверхности лимфоцитов бульбарных образований под влиянием верапамила, предпо- 293 ложительно может быть связано с утратой клеткой PIP2. По данным литературы, снижение внутриклеточной концентрации PIP2, инициирует образование локальных разрушений между кортикальным цитоскелетом и мембраной (Charras G.T. et al., 2006; Wang Y. et al., 2008). В условиях кальциевой нагрузки длительность периода регуляторного увеличения объема лимфоцитов в гипотонической среде составила 210 секунд, т.е. протекала на 150 секунд быстрее по сравнению с пробами без нагрузки. Фаза регуляторного сокращения объема клетки протекала на 30 секунд быстрее по сравнению с контролем. В системе клетка-ядро выявлена асинхронность в длительности протекания реакций. На это указывают следующие данные: фаза увеличения объема ядра удлинилась на 210 секунд по сравнению с клеткой, длительность периода сокращения объема ядра возросла на 60 секунд по сравнению с клеткой. Использование мембранного резерва лимфоцитами доноров под влиянием кальциевой нагрузки в гипотонической среде постепенно снижалось по мере увеличения времени инкубации. Максимальное использование относительного мембранного резерва клеткой (≈24%) наблюдали на 30 секунде, в то время как ядром (≈28%) – на 120 секунде инкубации в гипотонической среде. При этом ядро задействовало ≈23% резервной поверхности на 210 секунде инкубации. В изотонической среде максимальное использование мембранного резерва клеткой отмечали также на 30 секунде, однако процент вовлеченных структур не превышал ≈15%, при этом ядро использовало резервные структуры (≈16%) на 450 секунде инкубации. В течение первых 30 секунд воздействия гипотонической средой на поверхности клетки возросло число и высота глобулярных выступов. По мере продолжения фазы увеличения объема клетки, число и высота глобулярных структур снизились. К окончанию инкубации число глобул вновь увеличилось, а их высота была снижена по сравнению с изотоническим раствором. Под влиянием верапамила периоды регуляторного увеличения объема лимфоцитов, длительностью 30 и 60 секунд, чередовались с такими же по длительности периодами уменьшения объема, в течение первых 450 секунд 294 инкубации в гипотонической среде. Увеличение объема ядра наблюдали в течение 150 секунд, затем в течение 60-ти секунд объема ядра достигал значений изотонического раствора и вновь возрастал к концу инкубации. Использование ≈19,5% резерва лимфоцитами в гипотонической среде наблюдали на 30 секунде инкубации, при этом ядро не задействовало резервные структуры в регуляции объема. Рельф поверхности в гипотонической среде был сглажен в течение первых 60 секунд воздействия. Увеличение высоты глобулярных структур наблюдали в интервале 90-120 секунды инкубации, при этом на 120 секунде достоверно возросло количество глобул по сравнению с изотоническим раствором. К окончанию инкубации в интервале 300-900 секунды на поверхности лимфоцитов в гипотонической среде появились глобулярные выступы, в то время как в изотоническом растворе наблюдали сглаживание рельефа поверхности. Сравнивая реакции клеточной поверхности под влиянием Са2+ и верапамила в фазу увеличения объема видно, что под влиянием Са2+ число морфологических образований на мембране возрастает. Это указывает на ведущую роль экзогенного Са2+ в сигнальных механизмах перестройки структур цитоскелета (Hoffman E.K., 2000). Внроятно, динамические перестройки поверхности во время увеличения объема клеток вызваны влиянием ионов Са2+ на межмолекулярные взаимодействия белков мембранного цитоскелета. Доказано, что внутриклеточный Са2+ изменяет агрегатное состояние актинового цитоскелета, запуская полимеризацию актина, посредством фосфоинозитидного пути сигнализации (Mills J.W. et al., 1994; Сторожок С.А. с соавт., 1997; Sechi S.A., Wehland J., 2000). В целом под влиянием Са2+ и верапамила установлено снижение жесткости мембраны лимфоцитов, что позволяло клеткам использовать бóльшие запасы мембранного бассейна при снижении осмолярности среды по сравнению с адреналиновой нагрузкой (рисунок 100). 295 % 40 35 30 25 20 15 10 5 0 клетка ядро контроль адреналин обзидан кальций верапамил Рисунок 100 – Использование мембранного резерва в системе клетка-ядро (%) при снижении осмолярности среды Длительность периода увеличения размеров лимфоцитов сокращается на 240 секунд по сравнению с адреналиновой нагрузкой и на 150 секунд по сравнению с контролем. Под влиянием экзогенного Са2+ ядро активно участвует в осморегуляторных реакциях и задействует приблизительно такой же объем резервных структур, что и клетка, это свидетельствует о ведущей роли ионов Са2+ в передаче сигнала в ядро при понижении осмолярности среды. Под влиянием верапамила, несмотря на снижение жесткости поверхности, клетка использует меньший процент резервных структур в поддержании объема, длительность фазы регуляторного увеличения объема возрастает на 180 секунд по сравнению с кальциевой нагрузкой и 330 секунд по сравнению с контролем, при этом ядро не участвует в реакциях осморегуляции. Известно, что верапамил in vitro действует как ингибитор β- адренорецепторов, причем β2-адренорецепторы более селективны к верапамилу (Feldman R.D., Park G.D., 1985). Сравнивая эффекты, двух блокаторов обзидана и верапамила установили, что жесткость клеток под влиянием этих веществ находится примерно в одинаковых пределах 2,6-2,8 µРа. Однако длительность фазы регуляторного увеличения объема клетки под влиянием верапамила возрастает на 210 секунд, при этом использование мембранного резерва увеличивается в 3,2 раза по сравнению с обзиданом. Рельеф поверхности в фазу увеличения объема клетки сглажен как под влиянием верапамила, так и обзидана. Выявленные эффекты верапамила могут быть вызваны его влиянием на биомембраны. Верапамил 296 встраивается в липидный бислой в непосредственной близости от полярно/неполярного интерфейса мембраны, вызывает анизотропию и расширение порядка в цепи полярных областей головки липидов (Suwalsky M. et al., 2010). Не исключено, что изменения в ацильной цепи липидов влияют на скорость реакции и объем мембранных структур задействованных при набухании клетки. Снижение жесткости клетки под влиянием верапамила и обзидана может быть связано с их ингибирующим действием изопротеринол активированной аденилатциклазы, которая в активном состоянии связывается с β-адренорецептором (Feldman R.D., Park G.D., 1985). Объем клеток является одним из компонентов в регуляции клеточного цикла на стадии пролиферации, которая стимулируется осмотическим набуханием (Dubois J.M., Rouzarie-Dubois B., 2004; Lang F. et al., 2000). В проведенном экспериментальном исследовании изучено участие резервных бассейнов мембран в патологически недодифференцированных лимфоидных клетках больных ХЛЛ, находящихся в G0 фазе цикла. Лимфоциты больных ХЛЛ характеризуются увеличенными размерами, крупным ядром, занимающим почти 85-90% от объема клетки. Рельеф поверхности представлен обилием глобулярных образований и углублений на поверхности мембраны, габаритные размеры которых снижены по сравнению с лимфоцитами здоровых доноров, что придает поверхности клетки вид рифленности. Жесткость лимфоцитов больных ХЛЛ снижена по сравнению с клетками здоровых доноров. Выявленные особенности цитоархитектоники опухолевых клонов лимфоцитов связаны с их физиологическим состоянием и этиологией данного заболевания. Согласно данным ряда авторов опухолевая трансформация происходит на уровне ранних В-лимфоцитов с последующим блоком в их дифференцировке и пролиферацией клона опухолевых клеток (Должиков А.А. с соавт., 2002; Воробьев А.И. с соавт., 2008; Ермолин А.Э., 2008). Причем увеличение объема патологической популяции лимфоидных клеток происходит не за счет их пролиферации, а в результате «блокировки» процесса созревания на антигензависимом этапе дифференцировки В-клеток (Казанцева И.А., 1981; Foon K.A. et al., 1990). Выявленное снижение модуля Юнга в опухолевых клетках согласуется 297 с данными литературы. По данным параллельных исследований, выполненные на АСМ и конфокальном лазерном сканирующем микроскопе, установлена тесная связь между снижением модуля Юнга в клетках крови больных лейкозом и организацией актиновых филаментов. Выявлены существенные различия в организации F-актина в опухолевых лимфоцитах, которые в два раза тоньше и их содержание гораздо меньше, чем в лимфоцитах здоровых доноров (Cai X. et al., 2010). Снижение толщины и содержания актиноподобных структур в лимфоцитах больных ХЛЛ приводит к трансформации морфофункциональной активности клеточной поверхности. Часть исследователей склонна рассматривать обилие морфологических образований на стадии недодифференцированных клеток со сниженным уровнем внутриклеточного цАМФ и, как следствие, изменением натяжения актин-миозиновой системы (Ровенских Ю.А., 1979), в результате чего нарушается реорганизация цитоскелетных структур. Снижение модуля Юнга лимфоцитов больных ХЛЛ указывает на увеличение способности клеточной поверхности сопротивляться упругим деформациям и повышение их упруго-эластических свойств. Выявленные изменения в жесткости являются важной компенсаторноприспособительной реакцией, протекающей на фоне лимфоцитоза, характерного для данного типа заболевания (Schirren C.A. et al., 1995), что позволяет более податливым клеткам легче деформироваться в капиллярах и продвигаться по сосудам. Известно, что клетки у больных ХЛЛ более резистентны к гипотоническому шоку, чем нормальные лимфоциты здоровых доноров (Holt P.J.L., 1972). Для лимфоцитов больных ХЛЛ характерно чередование фаз увеличения и сокращения объема в гипотонической среде, что указывает на быстрое установление водноосмотического баланса в опухолевых клетках при снижении осмолярности среды (Веренинов А.А. с соавт., 1995). В условиях как гипо-, так и изотонической среды объем клетки и ядра лимфоцитов больных ХЛЛ уменьшился при сравнении с лимфоцитами помещенным в аутологичную плазму. Однако, сравнивая реакции клетки и ядра между гипо- и изотоническим раствором установлено чередование периодов изменения объема 298 (большее или меньшее сжатие клетки и ядра). В ядре реакции изменения объема протекают интенсивнее, чем в клетке. В частности в первую фазу увеличения объема, которая на уровне клетки длилась 60 секунд, в ядре протекали две последовательно сменяющие друг друга фазы увеличения и уменьшения объема, длительностью по 30 секунд каждая. В дальнейшем по мере увеличения времени инкубации в момент прохождения фазы уменьшения объема клетки, в ядре регистрировали фазу увеличения объема и наоборот. Изменения объема лимфоцитов больных ХЛЛ при снижении осмолярности среды протекали без участия резервных бассейнов мембраны, что было подтверждено данными по изучению рельефа поверхности клеток. В течение первых 30 секунд инкубации на поверхности появились углубления, при этом их диаметр увеличился, а глубина не изменилась, т.е. поверхность растягивалась. По данным литературы при максимальном набухании до 10 раз, липидный слой может растягиваться до предела 3% (Nichol J.A., Hutter O.F., 1996; Hamill O.P., Martinac B., 2001). Впоследствии, в условиях гипоосмотической нагрузки на поверхности лимфоцитов больных ХЛЛ образовались агрегированные домены и выпячивания в виде пузырьковых образований. Изменения картины рельефа поверхности лимфоцитов больных ХЛЛ в гипотонической среде протекали на 60 секунд быстрее по сравнению с лимфоцитами здоровых доноров. В целом, лимфоциты больных ХЛЛ в гипотонической среде уменьшаются в объеме, что подтверждает известный факт большей резистентности этих клеток к гипотоническому шоку по сравнению с лимфоцитами здоровых людей (Holt P.J.L., 1972). Тем не менее, при сравнении реакций на гипотоническое воздействие в сравнении с изотонической средой установлено чередование периодов большего и меньшего уменьшения объема клеток. В регуляции объема лимфоциты больных ХЛЛ и их ядра не использовали дополнительные мембранные структуры. Возможно, установленный факт объясняется работой ряда мембранных переносчиков, что приводит к быстрому установлению водно-осмотического баланса без использования дополнительных резервных бассейнов плазмалеммы. Одним из таких переносчиков выступает Na/H-теплообменник (NHE1), который распо- 299 ложен на лидирующем крае мигрирующих клеток (Lagana A. et al., 2000; Denker S.P., Barber D.L., 2002; Chiang Y. et al., 2008). Показано, что активация NHE1 на переднем крае клетки выступает посредником притока осмолитов и способствует формированию локального осмотического градиента, который запускает аквапорин опосредованный ток воды (Schwab A., 2001; Schwab A. et al., 2007). Механизмы, участвующие в активации NHE1 были детально изучены на моделях раковых клеток, в которых было показано вовлечение в этот процесс cAMP PKA-P0ROCK-p38 MAPK сигнального пути (Cardone R.A. et al., 2005). Появление на поверхности лимфоцитов больных ХЛЛ в гипотонической среде «агрегированных доменов» в виде пузырьков не исключает факт их внутрикдеточного происхождения. Согласно работе Groulx N. et al. (2006) появление пузырьковых образований на мембране происходит вследствие нарушения организации актинового цитоскелета и указывает на вовлечение в объемную регуляцию элементов внутриклеточного мембранного бассейна в виде экзоцитозных эндомембранных вставок. Образование агрегированных доменов на плазмалемме опухолевых клеток связано с локальными разрушениями, возникающими между кортикальным цитоскелетом и мембраной (Charras G., Paluch E., 2008). Агрегированные домены на плазмалемме используются раковыми клетками при инвазии во внеклеточный матрикс (Sahai E., 2005). Механизм их образования связан с потерей клеткой кортикального F-актина и ERM протеинов (Raucher D. et al., 2000; Sheetz M.P., et al., 2006; Wang Y. et al., 2008). По данным экспериментальных исследований Negulaev Yu.A. et al. (1996), актиновые филаменты вовлечены в управление пассивным транспортом натрия через ионные каналы в клетках больных лейкемией. Показано, что проводимость и кинетические свойства Na-каналов в клетках больных лейкозом сходны с Na-селективными каналами, описанными ранее в макрофагах здоровых доноров (Negulaev Yu.A., Vedernikova E.A., 1994). В тоже время, доказано отсутствие прямой зависимости между работой натриевых каналов в клетках больных лейкозом и организацией актинового цитоскелета (Negulaev Yu.A. et al., 1996). 300 В экспериментах с функциональными нагрузками на лимфоциты больных ХЛЛ не установлено однозначной зависимости между жесткостью клеточной поверхности и интенсивностью использования клеткой мембранного резерва в нагрузочных тестах in vitro. Под влиянием адреналина жесткость лимфоцитов больных ХЛЛ возросла, при этом число глобулярных структур на мембране лимфоцитов больных ХЛЛ снизилось, а их высота увеличилась. В пробах с обзиданом жесткость лимфоцитов увеличилась, при этом число глобул на поверхности снизилось, а их высота находилась в пределах недостоверных различий с контролем. После адреналиновой нагрузки наблюдали чередующиеся фазы увеличения и уменьшения объема лимфоцитов больных ХЛЛ в течение первых 300 секунд инкубации в гипотонической среде. Длительность фазы регуляторного увеличения объема клеток составила 30 секунд, снижения объема – 90 секунд. Начиная с 360 секунды объем клетки и ядра в гипотонической среде постепенно уменьшался с увеличением времени инкубации. На 30 секунде инкубации в гипотонической среде клетка (≈22%) и ядро (≈32%) максимально вовлекали мембранный резерв в регуляцию объема. В изотонической среде набухание клетки протекало медленнее, и лишь на 180 секунде она задействовала ≈14% мембранного резерва, в то время как ядро ≈35,6% использовало на 150 секунде. Под влиянием обзидана в течение первых 30 секунд инкубации в гипотонической среде наблюдали набухание клетки и ядра. Длительность периода регуляторного снижения объема составила 30 секунд. Причем при снижении осмолярности среды фазы регуляторного снижения объема на уровне клетки протекали на 210 секунд быстрее, чем на уровне ядра. Максимальное использование относительного мембранного резерва клеткой (≈22%) и ядром (≈25%) отмечали на 30 секунде инкубации в гипотонической среде. В изотоническом растворе клетка использовала ≈25% мембранного резерва на 60 секунде, а ядро ≈30,5% – на 30 секунде инкубации. В целом, адреналиновая нагрузка привела к увеличению жесткости лимфоцитов больных ХЛЛ, также как и в клетках здоровых, однако реакция увеличения 301 объема в клетках больных протекает в течение первых 30 секунд инкубации, в отличие от здоровых клеток, где она длится 450 секунд. В условиях блокады βадренорецепторов жесткость клеток повышена по сравнению с контролем, но снижена практически в два раза по сравнению с адреналиновой нагрузкой, тем не менее, длительность увеличения объема клетки составляет также 30 секунд, процент используемого мембранного резерва одинаков с адреналиновой нагрузкой и составляет ≈22%. Несмотря на то, что под влиянием адреналина жесткость мембран лимфоцитов больных ХЛЛ увеличилась, так же, как и у здоровых доноров, в гипотонической среде в опухолевых клетках наблюдали более выраженные реакции увеличения объема. Однако, при сравнении значений модуля Юнга лимфоцитов между группами больных и здоровых видно, что в условиях адреналиновой нагрузки жесткость лимфоцитов больных ХЛЛ ниже, чем здоровых. Выявленные особенности реакции опухолевых клеток могут быть связаны с аномально регулируемой в них фосфоинозитидной сигнализацией. В экспериментальных работах показано изменение качественного и количественного состава практически всех классов мембранных фосфолипидов, снижение уровня АТФ на фоне повышения нарушения синтеза цАМФ (Wymann M.P., Schneiter R., 2008). В мембранах лимфоцитов больных ХЛЛ ингибируется активность фосфоинозит специфичной фосфодиэстеразы, катализирующей синтез полифосфоинозитидов (Казарян П.А. с соавт., 2011). В условиях гипоосмотической нагрузки лимфоциты больных ХЛЛ использовали практически одинаковые запасы мембранных структур, как под влиянием адреналина, так и обзидана. Не исключено, что выявленные колебания в изменении объема клеток больных ХЛЛ с одной стороны, являются следствием нарушения баланса катионов Na+ и K+, а с другой стороны связаны, по данным литературы, с вовлечением в объемную регуляцию таурина. Рядом работ продемонстрировано повышенное содержание K+ в лимфоцитах больных ХЛЛ (Flahavan E. et al., 1973), которое снижает активность Na+/K+-АТФазы (Block J.B., Bonting S.L., 1964). Для опухолевых клеток характерна также аномально высокая концентрация 302 катионов Na+, которая является необходимым условием увеличения размеров клеток и поддержания их митотического потенциала (Замай Т.Н., 2011). Кроме того, наблюдаемое сжатие лимфоцитов больных ХЛЛ в гипотонической среде под влиянием блокатора β-адренорецепторов, а также под влиянием адреналина (во второй половине инкубации), вероятно связано с участием органического осмолита таурина в реализации фазы регуляторного уменьшения объема клеток. В лимфоцитах человека описаны Cl-каналы, активируемые таурином (Vinton N.E. et al., 1987; Fazzino F. et al., 2006). Показано, что комплекс Tau-Cl тормозит транскрипционную активность ядерного фактора В, ответственного за синтез провоспалительных цитокинов (Schuller-Levis G. et al., 1990). Таким образом, уменьшение размеров популяций опухолевых клеток в гипотонической среде в условиях активации и блокады элементов аденилатциклазных сигнальных путей, может являться индикатором подавления пролиферативной активности клеток. Под влиянием кальциевой нагрузки, а также в опытах с верапамилом жесткость лимфоцитов больных ХЛЛ увеличилась. Кроме того, в этих сериях экспериментов обнаружены сходные реакции в изменении рельефа поверхности: число глобул и углублений уменьшилось, а их габаритные размеры увеличились. В условиях Са2+-нагрузки в течение первых 90 секунд инкубации не выявлено реакций изменения объема. Непродолжительное увеличение объема клетки в течение 30 секунд наблюдали на 120 секунде, а затем объем клетки вновь возвращался к значениям изотонического раствора. В системе клетка-ядро установлена асинхронность в развитии фаз увеличения и уменьшения объема. Реакция регуляторного увеличения объема ядра лимфоцитов больных ХЛЛ в гипотонической среде протекала на 60 секунд быстрее, чем клетки в целом. При этом длительность фазы уменьшения объема на уровне клетки увеличилась на 210 секунд по сравнению с ядром. Общей реакцией было уменьшение объема клеток и ядер в гипотонической среде во второй половине инкубации. Причем реакция на уровне ядра началась на 480 секунд раньше, чем на уровне целой клетки. Максимальное использование мембранного резерва клеткой (≈8%) наблюдали на 120 секунде, а ядром (≈0,67%) – на 240 секунде инкубации в гипотонической среде. В изотони- 303 ческом растворе относительный мембранный резерв как клеткой (≈11,7%), так и ядром (≈5%) использовался лишь к концу инкубации (на 1800 секунде). В пробах с верапамилом изменений объема клеток не выявлено в течение первых 60 секунд. 30-ти секундный период увеличения объема лимфоцитов наблюдали на 90 секунде воздействия, который сменялся периодом уменьшения объема длительностью 240 секунд. Объем ядра в гипотонической среде уменьшился в течение первых 330 секунд воздействия. В течение первых 150 секунд реакция ядра на гипоосмотическую нагрузку не выявлена. На 180 секунде воздействия объем ядра уменьшался, затем следовал 60-ти секундный период восстановления его значений до изотонической среды. В интервале 420-570 секунды объем ядра возрастал. Длительность периода увеличения объема в системе клетка - ядро была одинакова и составила 150 секунд, но реакция увеличения объема ядра реализовалась на 30 секунд позже, чем у клетки в целом. Периоды уменьшения объема ядра совпали по времени с фазами уменьшения объема клетки. Максимальное использование относительного мембранного резерва клеткой (≈6%) в гипотонической среде наблюдали на 390 секунде инкубации, ядром (≈1,4%) – на 420 секунде, в изотонической среде соответственно ≈10% на 420 секунде и ≈3,4% на 600 секундах инкубации. Установленное увеличение жесткости лимфоцитов опухолевых клонов под влиянием экзогенного Са2+ и формирование коротких глобулярных выступов в виде инвадоподий може укзывать на приобретение ими локомоторного типа. Согласно данным ряда авторов малые ГТФазы из семейства Rho-NWASP-ARP 2/3 под влиянием Са2+ запускают полимеризацию актина, в результате чего на поверхности формируются инвадоподии (очень короткие выступы, заполненные актином), функциональная роль которых – разрушение экстрацеллюлярного матрикса и образование метастатических дорожек (Hall A., 2005; Kedrin D., 2007). В то же время увеличение жесткости мембран в клоне опухолевых клеток может явиться пусковым механизмом апоптоза. Согласно экспериментальным данным, опубликованным ранее, увеличение жесткости лейкозных клеток под действием химиотерапевтических агентов, воз- 304 действующих на сигнальные Са2+ -пути, приводит к реорганизации актинового цитоскелета и вызывает их гибель (Levee M.G. et al., 1996; Grzanka A., 2001; Grzanka A. et al., 2003; 2004; 2006). Экспериментально установлено, что в опухолевых лимфоцитах, больных ХЛЛ хорошо выражены микротрубочки, в то время как промежуточные филаменты практически отсутствуют (Zauli D. et al., 1988). Причем как увеличение, так и уменьшение концентрации внутриклеточного Са2+ может вызывать апоптоз опухолевых клонов клеток (Trump B.F., Berezesky I.K., 1995; Mason R.P., 1999). Выявленная в эксперименте тенденция к увеличению жесткости лимфоцитов больных ХЛЛ под влиянием верапамила, также не исключает возможности запуска процессов апоптоза. Согласно данным ряда исследователей, блокаторы кальциевых каналов (верапамил, нифедепин, ризорцин) активируют механизмы апоптоза трансформированных клеток, тем самым тормозят их аномальную пролиферацию посредством уменьшения внутриклеточной концентрации Са2+ (Janis R.A. et al., 1987; Shamash J. et al., 1994; El-Azzouzi B. et al., 1994). Таким образом, длительность реакции регуляторного увеличения объема опухолевых лимфоцитов под влиянием выполненных функциональных нагрузок одинакова и составляет 30 секунд. Под влиянием адреналина, обзидана, Са 2+ и верапамила жесткость клеток повышается в 1,5 – 2,7 раза, однако величина вовлекаемого мембранного резерва в регуляцию объема, как в условиях блокады, так и активации β-адренорецепторов составляет ≈22%, а в условиях активации и блокады Са2+ каналов – соответственно ≈8% и ≈6%. Снижение использования мембранного резерва в условиях гипотонической среды под влиянием кальциевой нагрузки связано с наблюдаемым нами явлением сжатия клетки и ядра на протяжении большего времени инкубации. В литературе представлены данные, что в опухолевых клетках механизм регуляторного уменьшения объема тесно связан с гипотонически индуцированным МЕК 1/2 сигнальным путем (Shen M.G. et al., 2002). С другой стороны ионы Са2+, поступающие из среды в лимфоциты больных ХЛЛ, могут выступать в качестве митогенного сигнала, который стимулирует аномальный рост клеток (Masson R.P., 1999). Доказано, что в клетках хронической миело- 305 идной лейкемии Са2+ запускает процессы пролиферации (Witkowski J.M. et al., 2002). Согласно данным литературы содержание Са2+ в клетках больных ХЛЛ значительно снижено по сравнению со здоровыми донорами (Yarom R. et al., 1976). Способность регулировать объем клеток с использование дополнительных мембранных структур присуща не только клеткам высокоорганизованных животных, но и клеткам хладнокровных. В работе Головко С.И. (2009) «установлено наличие эволюционной закономерности складчатости плазмалеммы клеток крови: филогенез эритроцитов идет в сторону уменьшения резерва цитоплазматической мембраны, а лейкоцитов – в сторону увеличения» [цит. Головко С.И., 2009. с.5]. В проведенном исследовании изучено использование дополнительных мембранных структур ядерными эритроцитами лягушек, находящихся в состоянии физиологического анабиоза. Клеточная поверхность эритроцитов лягушек в физиологических условиях имеет сглаженный рельеф, с преобладанием углублений. Глобулярные белковые образования единичны, в виде сфер рассеяны по поверхности. При инкубации клеток в гипоосмотической среде их объем был снижен на протяжении всего времени инкубации, периоды восстановления их размеров до значений изотонического раствора отсутствовали. Клетки не использовали дополнительные мембранные резервы регуляции объема. Ядро увеличивалось в размерах практически на протяжении всего времени воздействия. Максимальное использование резерва ядром наблюдали на 270 (≈55%) и 1800 (≈89%) секундах инкубации. В течение первых 60-ти секунд инкубации эритроцитов в гипотонической среде на поверхности мембраны идентифицировано сферообразное углубление в области перинуклеарного пространства. В интервале с 90 по 150 секунды кольцо трансформировалось в дугообразный валик. На 120 секунде на поверхности эритроцитов видны изрезанные окончания валика. Начиная со 180 секунды и до конца инкубации, границы валика исчезли, вероятно, вследствие увеличения объема ядра. К окончанию воздействия на поверхности клеток появились бульбарные 306 структуры. Количество глобулярных выступов и углублений на поверхности мембраны по мере уменьшения объема клеток снизилось, но их высота и диаметр увеличились. Выявленные перестройки цитоархитектоники поверхности при снижении осмолярности среды, предположительно могут быть связаны с изменением конфигурации элементов цитоскелета. Виментиновые микрофиламенты пронизывают клетку и соединяют пространство между ядром и поверхностными цитоскелетными сетями (Gambino J. et al,, 1984), состоящими частично из белка актина и протеинов спектринового типа (Barlett D.G. et al., 1982), а также маргинальными группами микротрубочек, которые участвуют в деформации клеток во время механического напряжения (Josep-Silverstein J.A., Cohen W.D, 1984). Под влиянием адреналина жесткость эритроцитов увеличилась, количество глобулярных выступов уменьшилось, а их высота возросла по сравнению с контролем. Появление в рельефе поверхности мембраны крупных глобулярных образований не исключает факт их внутриклеточного происхождения в виде эндомембранных пузырьков, которые используются клеткой в механизмах объемной регуляции. Эритроциты утрачивают эллипсоидную форму, объем их резко возрастает. В архитектуре ядра отмечено присутствие отдельных нитей хроматина. Перестройки архитектуры поверхности под влиянием адреналина могут быть связаны с выходом ионов Са2+ из внутриклеточных депо (Авдонин П.В.., Ткачук В.А., 1994). Доказано, что признаком увеличения внутриклеточной концентрации ионов Са2+ в эритроцитах лягушек является приобретение ими округлой формы (Gambino J. et al., 1984). Увеличение количества глобулярных образований на мембране эритроцитов под действием адреналина, согласуется с результатами, полученными ранее методом темнопольной световой микроскопии (Kroll A.Yu. et al., 1990; Levin S.V., Korenstein R., 1991). Показано, что под влиянием физиологических доз адреналина возрастает амплитуда мембранных флуктуаций, природа которых связана с повышением концентрации цАМФ (Tuvia S. et al., 1999). По данным ряда авторов, βадренергические стимуляторы активируют Na+/H+-обменник в эритроцитах лягу- 307 шек, в результате чего увеличивается приток Na+ в клетку и как следствие активируется работа Na+-K+ насоса, выкачивающего Na+ во внеклеточное пространство в обмен на приток К+ (Palfrey H.C. et al., 1980; Palfrey H.C., Geengard P.,1981; Kalloyanni M et al., 1999). В пробах, проинкубированных с обзиданом, форма клетки изменилась, она вытянулась и стала ланцетовидной, ядро выступало над поверхностью. Объем клетки практически не изменился по сравнению с контролем. Под влиянием обзидана существенного изменения жесткости эритроцитов не установлено, однако по сравнению с адреналином жесткость клеток существенно снизилась. Под влиянием адреналина в тестах с осмотической нагрузкой реакции регуляции объема в системе клетка-ядро не выявлены. Однако, в условиях блокады βадренорецепторов клетка не использует мембранные структуры, а ядро задействует около ≈73% мембранных резервных структур на 120 секунде инкубации в гипотонической среде. Установленное повышение упругости эритроцитов под влиянием адреналиновой нагрузки является лимитирующим фактором в использовании клеткой мембранного резерва в гипо- и изотонической средах. Перестройки в рельефе поверхности эритроцитов, сопровождающие уменьшение объема клеток в гипотонической среде под влиянием адреналина, направлены на снижение высоты глобул и увеличение их количества, в то время как под влиянием обзидана реакции снижения высоты глобул и уменьшения их количества сменялись увеличением их числа и размеров до значений изотонического раствора. Под влиянием адреналиновой нагрузки в течение 120 секунд инкубации в гипотонической среде количество углублений в мембране возросло, их габаритные размеры уменьшились, начиная со 180 секунды и до конца инкубации, число углублений в мембране снизились, их размеры увеличились. Под влиянием обзидана в гипотонической среде на 30 секунде инкубации число углублений в мембране возросло, а в последующие секунды инкубации наблюдали рост числа глобулярных выступов. Анализируя вышеизложенное, приходим к выводу о том, что адреналин выступает важным регулятором поведения эритроцитов лягушек при снижении ос- 308 молярности среды в условиях анабиоза, т.к. защищает клеточные структуры от чрезмерного увеличения объема при колебаниях осмолярности среды. Под влиянием кальциевой нагрузки жесткость эритроцитов снизилась, на поверхности эритроцитарных мембран уменьшилось число глобулярных структур и их высота. Аналогичную картину наблюдали при инкубации клеток с верапамилом. В гипотонической среде объем клетки уменьшался на протяжении всего времени инкубации. В ядре наблюдали смены фаз регуляторного увеличения (длительностью 150 секунд) и уменьшения (длительностью 60 секунд) объема. Максимальное использование мембранного резерва ядром в гипотонической среде наблюдали на 420 (≈22%) и 570 (≈34%) секундах воздействия. При инкубации эритроцитов с верапамилом с последующим наложением гипоосмотической нагрузки реакций изменения объема в системе клетка-ядро не выявлено. В целом, объем эритроцитов лягушек уменьшается при проведении тестов с гипоосмотической нагрузкой. Причем одинаковые реакции клеток наблюдали как в пробах без функциональных нагрузок, так и с ними. Ядро использует мембранный резерв в тестах с осмотической нагрузкой. Под влиянием адреналина реакций осморегуляции со стороны ядра не выявлено, а в условиях блокады βадренорецепторов наблюдали интенсивное набухание ядра и использование им дополнительных мембранных структур. Аналогичный эффект был установлен в опытах с кальциевой нагрузкой: на фоне уменьшения объема клетки в гипотонической среде, ядро набухало и вовлекало в регуляцию объема резервные структуры. Вероятно, механизм изменения формы эритроцитов и уменьшения их объема в пробах с гипотонической нагрузкой реализуется посредством влияния внутриклеточного Са2+, концентрация которого увеличивается при снижении тоничности среды (Light D.B. et al., 2002). На ядерных эритроцитах аллигатора показано, что «сморщивание» клеток в гипотонии сопровождается увеличением концентрации внутриклеточного Са2+ (Pore S., 2009). Посредством кальмодулина Са2+ вызывает деполимеризацию маргинальных групп микротрубочек (Gambino G. et al., 1984). 309 Не исключено, что изменение количества и размеров глобулярных структур на поверхности клетки связано с влиянием внутриклеточного Са2+ на структуры цитоскелета. Кроме того, в эритроцитах лягушек кальций активированные протеазы вызывают перестройки промежуточных виментиновых филаментов (Traub P., Nelson W.J., 1982). Таким образом, в проведенном экспериментальном исследовании проанализировано использование мембранных резервов форменными элементами крови, задействованных в регуляции объема при снижении осмолярности среды. Установлено, что в умеренно-гипотонической среде лимфоциты здоровых доноров используют поверхностные запасы плазмалеммы, в виде складчатости, которые разворачиваются, изменяя рисунок рельефа. В процессы регуляции объема ядро клеток вовлекает внутриклеточные запасы. Причем процентное соотношение как внутриклеточных, так и поверхностных мембранных бассейнов, используемых лимфоцитами практически одинаково. При снижении осмолярности среды, лимфоциты больных ХЛЛ не используют мембранный резерв плазмалеммы. Значительное снижение жесткости лимфоцитов больных ХЛЛ, вследствие незрелости цитоскелетных структур, позволяет клеткам привлекать внутриклеточные ресурсы и быстро встраивать их в мембрану, о чем свидетельствуют данные полуконтактного АСМ-сканирования. Жесткость элементов цитоскелета выступает одним из основных факторов, влияющих на использование лимфоцитами здоровых доноров резервных бассейнов плазмалеммы. Увеличение жесткости лимфоцитов под влиянием адреналиновой нагрузки приводит к уменьшению использования относительного мембранного резерва, как клетками, так и ядрами практически в два раза (рисунок 101). 310 100 90 80 70 лимфоциты здоровых 60 ядра здоровых 50 лимфоциты больных ХЛЛ 40 ядра лимфоцитов больных ХЛЛ 30 эритроциты 20 ядра эритроцитов 10 0 без адреналин обзидан нагрузок кальций верапамил Рисунок 101 – Относительный мембранный резерв (%), используемый клеткой и ядром в гипотоническом растворе под влиянием функциональных нагрузок Сглаживание рельефа поверхности и максимальное использование мембранного резерва под влиянием адреналиновой нагрузки в течение первых 60 секунд инкубации, указывает на участие в процессе регуляции объема резервов плазмалеммы. Под влиянием неселективного блокатора β-адренорецепторов объем используемых резервных структур лимфоцитами сокращается в 2,5 раза. Вместе с тем, жесткость не является однозначным лимитирующим фактором в использовании клетками дополнительных мембранных структур, на что указывают результаты экспериментального исследования, выполненные на лимфоцитах больных ХЛЛ и эритроцитах лягушек. Несмотря на увеличение жесткости лимфоцитов больны ХЛЛ (рисунок 102) под влиянием адреналина относительная величина мембранного резерва, используемого как клетками, так и ядрами, превосходит аналогичные показатели в группе здоровых доноров. 311 µPa 7 6 5 4 3 2 1 0 плазма адреналин обзидан кальций верапамил лимфоциты здоровых лимфоциты больных ХЛЛ эритроциты лягушек Рисунок 102 – Жесткость форменных элементов крови под влиянием функциональных нагрузок Жесткость лимфоцитов здоровых доноров и больных ХЛЛ под влиянием обзидана одинакова, при этом максимальная величина относительного мембранного резерва используемого лимфоцитами больных ХЛЛ составляет ≈22%, а в группе здоровых доноров – ≈6%. Установленный факт, в совокупности с данными о присутствии в рельефе поверхности бульбарных образований, указывает на активное использование незрелыми опухолевыми клетками внутриклеточных мембранных резервов в процессах регуляции объема. В эритроцитах лягушек под влиянием адреналина жесткость возрастает, при этом клетки не используют мембранный резерв в регуляции объема. В условиях блокады β-адренорецепторов клетка не привлекает дополнительные мембранные структуры в регуляцию объема при снижении осмолярности среды. Однако, ядро, в условиях активации β-адренорецепторов адреналином, не использует внутриклеточные резервы, а в условиях блокады – активно привлекает в регуляцию объема до 73% внутриклеточных мембранных структур. Под влиянием Са2+ нагрузки жесткость лимфоцитов здоровых доноров снижается, но несмотря на это, мембранный резерв используемый клетками в два раза меньше, чем в пробах без нагрузки. В гипотонической среде под влиянием кальциевой нагрузки увеличивается количество и размеры глобулярных образо- 312 ваний, что придает поверхности еще более выраженный вид складчатости. Не исключено, что появление дополнительных структур на поверхности мембраны связано с образованием областей дезагрегированного актина, это приводит к дисбалансу в использовании мембранного резерва лимфоцитами. В модельных экспериментах, описанных ранее в литературе, поток воды в клетку формирует осмотический градиент, распространяющийся по мембране, в результате чего на поверхности образуются области дезагрегированного актина, причем их сопротивление потоку воды возрастает при добавлении экзогенного Са 2+ in vitro (Yin H.L. et al., 1980). Повышение жесткости лимфоцитов больных ХЛЛ под влиянием кальциевой нагрузки ограничивает использование ими мембранного резерва в гипотонической среде. В течение первых 30 секунд, лимфоциты больных ХЛЛ привлекают в поддержание объема короткие глобулярные выступы в виде инвадоподий. В эритроцитах лягушек под влиянием кальциевой нагрузки жесткость клеток снижается. В условиях гипотонической нагрузки ядро активно использует внутриклеточные резервные структуры, в отличие от клеток. На поверхности клеток идентифицированы участки глобулярных конгломератов, появляющихся к концу инкубации, что указывает на развитие процессов дезорганизации в системе элементов цитоскелета. Деполимеризация маргинальных пучков микротрубочек под влиянием экзогенного Са2+ посредством белка кальмодулина может приводить к появлению крупных глобул на поверхности (Gambino G. et al., 1984). Очевидно, что в лимфоцитах здоровых доноров жесткость цитоскелета играет определенную роль в ограничении использования мембранного резерва. Установленный факт согласуется с данными литературы, согласно которым при увеличении плотности микротрубочек величина мембранного резерва снижается, в тоже время дезорганизация в сети цитоскелета увеличивает мембранный резерв клетки (Raucher D., Sheetz M.P., 1999). Использование клетками мембранного резерва в нагрузочных тестах отчасти зависит от упруго-эластических свойств клеточной мембраны и клетки в целом. Увеличение жесткости лимфоцитов доноров ограничивает скорость реализа- 313 ции реакций регуляторного увеличения и снижения объема, а также определяет величину мембранного резерва задействованного в поддержании объема. Вместе с тем, в лимфоцитах больных лейкозом, а также в эритроцитах лягушек такая зависимость отсутствует. На схеме представлена концепция, обобщающая полученные экспериментальные данные в ходе выполненного исследования с известными научными фактами, представленными в литературных источниках. Снижение интенсивности использования мембранного резерва Увеличение интенсивности использования мембранного резерва Снижение жесткости клетки Увеличение жесткости клетки Увеличение числа глобулярных выступов со сниженной высотой Адреналин Мембранная форма адренорецепторов (Reiner T.H.et al., 1999) Экзогенный Са 2+ Полимеризация актина (Shibasaki Y. et al., 1997) Фосфорилирование фосфолипазы С (Moisor M. et al., 1990) Гидролиз ТФИ (Авдонин П.В., Ткачук В.А., 1994) Активация полифосфатидил инозитного цикла (Tall E.G. et al., 2000) PIP3 DAG ЭПС Увеличение сродства Са2+ к ПКС Эндогенный Са2+ (Rink T. J. et al., 1983) Высокая концентрация PIP2, формирование актинсвязывающих доменов в подмембранном пространстве (Insall R.H., Machesky L.M., 2009) Ca2+ селективные каналы TRPV5 в лимфоцитах (Васильева И.О., Негуляев Ю.А., 2008) Фосфорилирование белков цитоскелета (Hoffman E.K., 2000) Схема. Концепция, обобщающая полученные автором экспериментальные данные, с общеизвестными научными фактами. 314 В лимфоцитах здоровых доноров использование мембранного резерва клетками в физиологических реакциях зависит от жесткости ее поверхности. Использование мембранного резерва клеткой имеет важное компенсаторно- приспособительное значение, направленное на снижение литического напряжения в мембране. Не исключено, что возникновение в процессе эволюции поверхностного резервного бассейна плазмалеммы позволило клеткам высокоорганизованных животных совершать быстрые флуктуации объема в буферном растворе в условиях непродолжительного и незначительного снижения осмолярности среды без привлечения ион-транспортных мембранных переносчиков. 315 ВЫВОДЫ 1. В физиологических условиях осмотической нагрузки лимфоциты реализуют адаптивный комплекс морфофизиологических реакций, направленных на снятие литического «напряжения» в мембране, который проявляется в увеличении высоты глобулярных структур на фоне сокращения их числа. Использование мембранного резерва лимфоцитами в нормальных физиологических условиях для регуляции клеточного объема зависит от жесткости клетки. 2. Установлена возможность регуляторного изменения использования мембранного резерва. Было показано, что повышение жесткости лимфоцитов на 36% под стимулирующим влиянием адреналиновой нагрузки, сопровождается уменьшением использования мембранного резерва, как клеткой, так и ядром почти в 2 раза. Тогда как снижение жесткости лимфоцитов на 34% в условиях нагружения клеток Са2+ стимулирует увеличение использования мембранного резерва, как клеткой, так и ядром в 1,5 раза. 3. Установленные морфофункциональные свойства лимфоцитов больных хроническим лимфобластным лейкозом позволяют им осуществлять компенсаторноприспособительные реакции, направленные на улучшение реологических свойств крови в условиях лейкоцитоза, характерного для данного типа заболевания. Поверхность лимфоцитов больных лейкозом имеет «рифленый» характер и представлена обилием глобулярных образований и углублений. Жесткость клеток снижена практически в два раза по сравнению с лимфоцитами здоровых доноров. Это указывает на их потенциально более высокую деформируемость в путях микроциркуляции. 4. Установлена определенная взаимосвязь между жесткостью клетки и морфологией ее поверхности. Так с увеличением жесткости поверхности нормальных лимфоцитов существенно возрастает число глобулярных структур на фоне сни- 316 жения их высоты, при снижении жесткости – увеличивается высота глобул при неизменном их количестве. 5. В лимфоцитах больных хроническим лимфобластным лейкозом не установлено тесной зависимости между использованием мембранного резерва в регуляции объема и жесткостью клеточной поверхности. С увеличением жесткости клетки на 233% под влиянием адреналиновой нагрузки клетка включает только ≈22% мембранного резерва плазмалеммы и ≈32% резерва кариолеммы на поддержание своего объема при снижении осмолярности среды. В условиях кальциевой нагрузки жесткость лимфоцитов возрастает на 245%, при этом в регуляции объема используется не более ≈6% запаса плазмалеммы и ≈1,5% кариолеммы в условиях гипотонической нагрузки. 6. Морфофизиологические реакции эритроцитов лягушек в гипотонической среде связаны с увеличением числа и высоты глобулярных структур на фоне уменьшения объема клеток в условиях гипотонической нагрузки. Эритроциты лягушек не используют мембранный резерв в осморегуляторных реакциях. Ядро в эти клеточные ответы включает около 89% внутриклеточных резервных структур. 7. Установлена взаимосвязь между изменением упруго-эластических свойств эритроцитов со структурными перестройками поверхности. Увеличение жесткости клеток под влиянием адреналина в 1,8 раза сопровождается снижением числа глобулярных структур с увеличенной высотой, в то время как снижение жесткости поверхности под влиянием обзидана протекает на фоне неизменного числа и высоты глобул. Однако под влиянием верапамила и кальциевой нагрузки снижение жесткости клетки сопровождается уменьшением, как числа, так и высоты глобулярных образований поверхности, что свидетельствует об участии элементов кальциевых сигнальных путей в механизмах перестройки элементов цитоскелета. 8. В эритроцитах лягушек зависимость между жесткостью клетки и интенсивностью использовании ею мембранного резерва в механизмах регуляции объема не выявлена. Увеличение жесткости клетки на 64% под влиянием адреналина со- 317 провождается уменьшением объема клеток в гипотонической среде и отсутствием реакций регуляции объема в системе клетка-ядро. Снижение жесткости эритроцитов под влиянием кальциевой нагрузки на 62%, сопровождается уменьшением объема клетки в гипотонической среде, при этом ядро задействует ≈29% резервных структур в регуляции объема. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. Разработанный инструментарий на базе атомно-силовой микроскопии, по- зволяющий сканировать на воздухе в полуконтактном режиме («Способ исследования нативных клеток крови» патент РФ 2398234 и «Способ определения упругости клеток крови» патент РФ 2466401), может быть рекомендован для достижения оптимального уровня диагностического обследования больных лейкозом. 2. С целью ранней диагностики нарушения процесса дифференцировки кле- точных элементов и прогноза дальнейшего течения лейкозов может быть рекомендован комплексный подход, заключающийся в исследовании рельефа поверхности, объемной морфометрии и упругости лимфобластных форм с использованием инструментария атомно-силовой микроскопии. 318 СПИСОК СОКРАЩЕНИЙ АСМ – атомно-силовая микроскопия сАМФ – циклический аденозинмонофосфат СЭМ – сканирующая электронная микроскопия ИЛ – интерлейкин ПКС – протеинкиназа С ТФИ – трифосфоинозитид ХЛЛ – хроничекий лимфобластный лейкоз ЭПС – эндоплазматическая сеть ЯЦО – ядерно-цитоплазматические отношения ABP – актин-сшивающий белок DAG - диацилглицерол PIP2 – инозитол – 4, 5 - бифосфат PIP3 – инозитол – 1,4,5 - трифосфат PMCA – Са – АТФаза плазматических мембран RVI – регуляторное увеличение объема RVD – регуляторное сокращение объема SA – стрейч-активируемые каналы SI – стрейч-инактивируемые каналы 319 Список литературы 1. Авакян, О.М. Вещества, действующие на симпатоадреналовую систему / О.М. Авакян. – Ереван: Изд-во АН АрмССР, 1980. – 259 с. 2. Авакян, О.М. Физиологическая регуляция функций / О.М. Авакян. – М.: Медицина, 1988. – 256 с. 3. Авдонин, П.В. Рецепторы и внутриклеточный кальций / П.В. Авдонин, В.А. Ткачук. - М.: Наука, 1994. - 288 с. 4. Агалакова, Н.И. Транспорт одновалентных катионов через мембрану эритроцитов лягушек Rana Temporaria и Rana Ridibunda: автореф. дис. … канд. биол. наук: 03.00.04 / Агалакова Наталья Ивановна. – СПб., 1996. – 21 с. 5. Антонова, Т.В. Оценка течения инфекционного процесса по состоянию мембран лимфоцитов периферической крови / Т.В. Антонова, С.Л. Николаенко, Д.А. Лиознов // Клиническая лабораторная диагностика. – 1999. – № 7. – С. 2324. 6. Аряев, Н.Л. Ультраструктурные, транспортные и функционально- метаболические особенности биологических мембран клеток крови ребенка в различные возрастные периоды / Н.Л. Аряев // Педиатрия. – 1982. – № 4. –С. 46. 7. Бабаков, В.Н. Альфа-актинин и субъединица р65/RelA транскрипционного фактора NF-kβ в клетках AU31 локализуются совместно и мигрируют в ядро при действии эпидермального фактора роста / В.Н. Бабаков, Д.Е. Бобков, О.А. Петухова, Л.В. Туроверова, И.В. Кропачева, Е.П. Подольская, Г.П. Пинаев // Цитология. – 2004. – Т. 46, № 12. – С. 1065-1073. 8. Баггие, У. Лейкоцитарная обструкция капилляров in vitro / У. Баггие, М. Брэйд // Вестник АМН СССР. – 1988. – №2. – С. 27-31. 9. Бессонова, С.В. Чувствительность эритроцитов человека и некоторых видов животных к коллоидно-осмотическому лизису / С.В. Бессонова, Б.А. 320 Ташмухамидов, Р.З. Сабиров // Журнал эволюционной биохимии и физиологии. – 2004. – Т.40, № 1. – С.87-89. 10. Белоус, А.М. Роль белков цитоскелета в изменении стабильности клеток при температурно-осмотическом воздействии / А.М. Белоус, А.К. Гулевский, Л.А. Байбичук, В.В. Резанцев, Н.Г. Землянских // Криобиология. – 1990. – № 4. – С. 3-13. 11. Бондарев, А.А. Введение в биомембранологию / А.А. Бондарев. – М.: Изд-во МГУ, 1990. – 208с. – С. 87-89. 12. Бурдун, Г.Д. Основы метрологии / Г.Д. Бурдун, Б.Н. Марков. – М.: Изд-во стандартов, 1985. – 256 с. 13. Васильева, И.О. Кальциевые каналы TRPV5 и TRPV6 в Т-клетках человека / И.О. Васильева, Ю.А. Негуляев, И.И. Марахова, С.Б. Семенова // Цитология. – 2008. – Т.50, №1. – С. 953-957. 14. Веренинов, А.А. Роль ионных транспортеров в долговременной регуляции объема животных клеток в условиях анизотонии. Математическая модель и реальные лимфоидные клетки / А.А. Веренинов. Л.Н. Глушакова, А.А. Рубашкин // Цитология. – 1995. – Т. 37, № 12. – С. 1151-1166. 15. Воробьев, И.А. Иммунофенотипирование опухолей системы крови и лимфатических опухолей / И.А. Воробьева, О.А. Худолеева, Т.Д. Рощупкина, Е.М. Герцов // Гематология и трансфузиология. – 2005. – Т. 50, № 3. – С. 8-14. 16. Воробьев, А.И. Об отношении длины и динамики микротрубочек, краевой эффект и свойства протяженности радиальной сети / А.И. Воробьев, И.В. Малый // Цитология. – 2008. – Т. 50, № 6. – С. 477-485. 17. Выгодский, М.Я. Справочник по элементарной математике / М.Я. Выгодский. ‒ М.: Наука, 1974. ‒ 416 с. 18. Гершович, П.М. Цитоскелет и адгезия культивируемых стромальных клетокпредшественников костного мозга человека при моделировании эффектов микрогравитации / П.М. Гершович, Ю.Т. Гершович, Л.Б. Буравкова // Цитология. – 2009. – Т. 51. № 11. – С. 896-904. 19. Голованов, М.В. Новая концепция строения двойного электрического слоя на 321 поверхности клетки в условиях действия электролита высокой концентрации / М.В. Голованов // Биофизика. – 1991. – Т. 36, вып. 3. – С. 463-466. 20. Голованов, М.В. Поведение плазматической мембраны и примембранного слоя (гликокаликса) в электролите высокой концентрации / М.В. Голованов, Е.Б. Дерягин // Бюллетень экспериментальной биологии и медицины. – 1992. – Т. 114, №8. – С. 210-212. 21. Головко, С.И. Сравнительная характеристика мембранного резерва ядерных клеток крови позвоночных животных: автореф. дис. … канд. биол. наук: 03.03.01 / Головко Сергей Иванович. – Ярославль, 2010. – 15 с. 22. Голышев, С.А. модификаций Роль гистонов метилирования в организации ДНК и и посттрансляционных поддержании структуры гетерохроматиновых доменов (хромоцентров) / С.А. Голышев, П.Н. Вихреева, Е.В. Шеваль, Г.И. Кирьянов, В.Ю. Поляков // Цитология. – 2008. – Т. 50, №11. – С. 972-982. 23. Гольдберг, Д.И. Гематология животных / Д.И. Гольдберг, Е.Д. Гольдберг, Н.Г. Шубин. – Томск: Изд-во ТГУ, 1973. – 178 с. 24. Гордиенко, А.Д. Изучение функционального состояния митохондрий в клеточных суспензиях, экспонированных в растворе криопротектора / А.Д. Гордиенко, Е.В. Кудокоцева // Криобиология и криомедицина. – 1980. – Вып. 7. – С. 32-34. 25. Губанова, Н.В. Структурная организация, функция и динамика ядерных пор / Н.В. Губанова, К.Н. Морозова, Е.В. Киселева // Цитология. – 2006. – Т. 48, № 11. – С. 887-899. 26. Губанова, Н.В. Структурная организация и функция ядерной оболочки / Н.В. Губанова, Е.В. Киселева // Цитология. – 2007. – Т. 49, № 4. – С. 257-269. 27. Гусев, Н.Б. Внутриклеточные Са2+-связывающие белки. Часть 2. Структура и механизмы функционирования / Н.Б. Гусев // Соросовский образовательный журнал – 1998. – № 5. – С. 10-16. 28. Гусев, Н.Б. Протеинкиназы: строение, классификация, свойства и биологическая роль / Н.Б. Гусев // Соросовский образовательный журнал – 322 2000. – Т. 6, № 12. – С. 4-12. 29. Гусев, Г.П. Активация Na/H-обмена в эритроцитах лягушки Rana Ridibunda / Г.П. Гусев, Т.И. Иванова // Журнал эволюционной биохимии и физиологии. – 2003. – Т. 39, №4. – С. 351-355. 30. Должиков, А.А. Клиническая морфология лимфом / А.А. Должиков, В.А. Нагорный., А.В. Тверской. – М.: Медицина, 2002. – 306 с. 31. Думплис, М.А. Антиаритмические средства: классификация, структура, механизм действия / М.А. Думплис, Н.И. Кудряшова // Химико- исследования липидов фармацевтический журнал. – 1983. – №10. – С.1159-1169. 32. Евстигнеева, Р.П. Структурно-функциональные биологических мембран / Р.П. Евсигнеева // Матер.V Всесоюзн. Биохим. Съезд. – М.: Наука, 1985. – Т. 1. – С. 168. 33. Ермолин, А.Э. Дифференциальная диагностика и лечение острых и хронических лейкозов / А.Э. Ермолин. – М.: Медицина, 2008. – 200с. 34. Жарская, О.О. Индукция преждевременной сборки предшественников ядрышка в метафазных клетках CV1 и HeLa с помощью обратимого гипотонического шока / О.О.Жарская, О.В. Зацепина // Цитология. – 2005. – Т. 47, № 10. – С. 874-881. 35. Жмакин, А.И. Физические основы криобиологии / А.И. Жмакин // Успехи физических наук. – 2008. – Т. 178, № 3. – С. 243-266. 36. Заварзин, А.А. Очерки эволюционной гистологии крови и соединительной ткани / А.А. Заварзин. – Москва -Ленинград: АНССР, 1953. – 716 с. 37. Замай, Т.Н. Ионный механизм регуляции роста популяция нормальных и опухолевых клеток в организме: автореф. дис. …. докт. биол. наук: 03.03.01; 14.03.03 / Замай Татьяна Николаевна. – Новосибирск, 2011. – 42 с. 38. Зацепина, О.В. Формирование ядерной оболочки вокруг метафазных хромосом в гипотонической среде / О.В. Зацепина, В.Ю. Поляков, Ю.С. Ченцов // Цитология. – 1982. – Т. 24, №1. – С. 5-10. 39. Зацепина, Г.Н. Термодинамический потенциал воды в лимфоцитах животных в различных состояниях жизнедеятельности / Г.Н. Зацепина, И.М. Тарасова, 323 И.Н. Толох // Журнал физиологической химии. – 1984. – Т. 58, вып. 8. – С.21032105. 40. Зацепина, Г.Н. Кинетика осморегуляции лимфоцитов / Г.Н. Зацепина, Ч.Х. Сон, О.В. Тарнопольская О.В. – М., 1987. – 12 с. - Деп. В ВИНИТИ 12.06.87, № 4304-В87. 41. Зацепина, Г.Н. Изменение адаптационной способности и кинетики адаптации Т-лимфоцитов к гипотонии в патологических состояниях организма млекопитающих / Г.Н. Зацепина, С.В. Егудина, О.В. Тарнопольская // Биофизика. – 1992. – Т.37, вып.1. – С. 142-148. 42. Зиман, Ю.И. Угнетение нестимуллированными лимфоцитами спонтанной миграции лейкоцитов под агаром / Ю.И. Зиман, А.П. Редькин // Иммунология. – 1987. – №1. – С. 71-73. 43. Каверина, Н.В. Адреноблокирующие средства / Н.В. Каверина, Г.А. Маркова, Г.А. Бендиков, Р.С. Мирзоян // Фармакология моноаминоэргических процессов. – М.: Медицина, 1977. – С. 147-166. 44. Каверина, Н.В. Современные аспекты фармакологии антиангинальных средств / Н.В. Каверина, Ю.Б. Розонов, Г.Г. Чичканов. – М.: Медицина, 1980. – 240 с. 45. Казанцева, И.А. Патология митозов в опухолях человека / И.А. Казанцева. – Новосибирск: Наука, 1981. – 144 с. 46. Казарян, П.А. Мембранные аспекты патогенеза и терапии лимфопролиферативных заболеваний / П.А. Казарян, С.С. Дагбашян, А.А. Галоян // Доклады Национальной академии наук Армении. Биохимия. – 2011. – Т. 111, №1. – С. 59-68. 47. Камкин, А.Г. Потенциалоуправляемые кальциевые каналы (часть I) / А.Г. Камкин, И.С. Киселева, С.И. Кирищук, И.Т. Лозинский // Успехи физиологических наук. – 2006. – Т. 36, № 4. – С. 3-33. 48. Каппуччинелли, П. Подвижность живых клеток / П. Каппуччинелли. – М.: Мир, 1982. – 126 с. 49. Карагодина, З.В. Асимметрия гидрофобных зон мембран эритроцитов и ее особенности при спонтанной генетической гипертензии: дис. … канд. биол. 324 наук: 03.00.02 / Карагодина Зоя Васильевна. - М.,1984. – 156 с. 50. Карицкая, И.А. Регулируемая интерлейкином-3 экспрессия Na+-K+-АТФаза в активированных лимфоцитах человека / И.А. Карицкая, Н.Д. Аксенов, Т.А. Виноградова, И.И. Марахова // Цитология. – 2005. – Т.47, №1. – С. 28-37. 51. Карицкая, И.А. Долговременная регуляция Na+/K+-насоса в лимфоцитах человека: роль JAK/STAT и MAP киназных сигнальных путей / И.А. Карицкая, Н.Д. Аксенов, И.О. Васильева, Е.Г. Стрелкова, И.И. Марахова // Цитология. – 2008. – Т. 50, № 4. – С. 329-337. 52. Карманова, И.Г. Содержание цитоплазматических белков и РНК в клетках преоптического ядра лягушки при гинобиозе (к вопросу об эволюционной основе возникновения зимней спячки) / И.Г. Карманова, Д.И. Попова, Е.Ж. Хомутцкая, Н.Н. Демин, Н.Л. Рубинская // Докл. Ан СССР. – 1984. –Т. 274. – С. 473-475. 53. Карпищенко, А.И. Медицинские лабораторные технологии / А.И. Карпищенко. – СПб.: Интермедика, 2002. – Т. 1. – 408 с. 54. Киреев, И.И. Динамика структурной реконструкции митотических хромосом после деконденсации in vitro / И.И. Киреев, О.В. Зацепина, В.Ю. Поляков, Ю.С. Ченцов // Цитология. – 1990. – Т. 32, №5. – С. 449-454. 55. Комалетдинова, Ф.М. Роль филамина в проведении внутриклеточного сигнала / Ф.М. Комалетдинова, Г.П. Пинаев // Цитология. – 2006. – Т. 48, № 11. – С. 924-934. 56. Конев, С.В. Структурная лабильность биологических мембран и регуляторные процессы / С.В. Конев. – М.: Наука и техника, 1987. – 240 с. 57. Кругликов, Г.Г. Атлас функциональной морфологии клеток крови и соединительной ткани (сканирующая и трансмиссионная электронная микроскопия) / Г.Г. Кругликов, М.И. Пекарский. – М.: Медицина, 2005. – 176 с. 58. Кулапина, О.И. Проницаемость мембран эритроцитов у больных с инфекционной патологией / О.И. Кулапина, В.Ф., Киричук, И.А. Утц, Е.Г. Кулапина, И.А. Зайцева // Критические технологии мембран. – 2005. – Т.1, № 25. – С. 3-11. 325 59. Лакин, Г.Ф. Биометрия / Г.Н. Лакин. – М.: Высшая школа, 1968. – 288 с. 60. Лапач, С.Н. Статистические методы в медико-биологических исследованиях с использованием Excel / С.Н. Лапач, А.В. Чубенко, П.Н. Бабич. – Киев: Мориан, 2001. – 408 с. 61. Лебедев, Д.В. Измерения модуля Юнга биологических объектов в жидкой среде с помощью специального зонда атомно-силового микроскопа / Д.В. Лебедев, А.П. Чукланов, А.А. Бухураев, О.С. Дружинина // Письма в ЖТФ. – 2009. – Т. 35, № 8. – С. 54-61. 62. Лобовская, Л.В. Поверхностная архитектоника и электрофоретическая подвижность интактных и консервированных тромбоцитов: дис. … канд. мед. наук: 03.00.02 / Лобовская Л.В. – М., 1985. – 182с. 63. Лопина, О.Д. Взаимодействие каталитической субъединицы Nа+,K+-АТФазы с клеточными белками и другими эндогенными регуляторами / О.Д. Лопина // Биохимия. – 2001. – Т. 66, №10. – С. 1389-1400. 64. Макрегор, Г. Методы работы с хромосомами / Г. Макрегор, Дж. Варли. – М.: Мир, 1986. – 268 с. 65. Манухин, Б.Н. Физиология адренорецепторов / Б.Н. Манухин. – М.: Наука, 1968. – 236 с. 66. Матюхина, Т.Г. Атомно-силовая микроскопия эритроцитарных мембран / Т.Г. Матюхина, С.О. Пантелей, Т.А. Кузнецова // Доклады СЗМ. – 2004. – С. 97101. 67. Миронов, В.Л. Основы сканирующей зондовой микроскопии / В.Л. Миронов. – Нижний Новгород, 2004. – 114 с. 68. Модестова, Е.В. Исследование нуклеолярного аппарата лимфоцитов периферической крови людей, переболевших инфекционным мононуклеозом / Е.В. Модстова // Лабораторное дело. -1988. – № 10. – С. 41-42. 69. Новодержкина, Ю.К., Конфигурация и поверхность клеток крови в норме и патологии / Ю.К. Новодержикина. З.Г. Шишканова, Г.И. Козинец. – М.: Триада-фарм, 2004. – 152 с. 70. Орлов, С.Н. О возможном механизме действия мембранно-связанного кальция 326 на активность аденозинтрифосфатазы и проницаемости эритроцитов для одновалентных катионов / С.Н. Орлов, А.С. Шевченко // Биохимия. – 1978. – Т.43, №2. – С. 208-215. 71. Орлов, С.Н. О механизме индукции ионного транспорта при сжатии эритроцитов / С.Н. Орлов, Н.И. Покудин, Ю.В. Котиявцев // Внутриклеточная сигнализация. – М.: Наука, 1988. – С. 118-127. 72. Орлов, С.Н. Участие кальмодулина в регуляции электрического потенциала плазматической мембраны внутриклеточным кальцием / С.Н. Орлов, Г.М. Кравцов // Биохимия. – 1989. – Т.48, №9. – С.1447-1455. 73. Орлов, С.Н. Механизмы активации транспорта ионов при изменении объема клетки / С.Н. Орлов, Т.Г. Гурло // Цитология. – 1991. – Т. 33, №11. – С. 101-111. 74. Орлов, С.Н. Регуляция объема клеток: механизмы, сопряженные клеточные реакции и патофизиологическое значение / С.Н. Орлов, К.Н. Новиков // Физиологический журнал им. И.М. Сеченова. – 1996. – Т. 82, № 8-9. – С. 1-15. 75. Пат. 2268463 Российская Федерация МПК G01N 33/48, G01N 33/49 Способ оценки активности эритропоэза [Текст] / Липунова Е.А., Скоркина М.Ю., Зеленцова А.С., Никитин В.М.; заявитель и патентообладатель БелГУ. – № 2004111098; заявл. 12.04.04; опубл. 20.01.2006. 76. Пат. 2398243 Российская Федерация МПК G01N 33/49 Способ исследования нативных клеток [Текст] / Скоркина М.Ю., Чернявских С.Д.,Сладкова Е.А., Забиняков Н.А.; заявитель и патентообладатель НИУ «БелГУ». – № 2009125268; заявл. 01.07.2009; опубл. 27.08.2010. 77. Пат. на полезную модель № 98248 Российская Федерация МПК G 01N Влажная камера для исследования нативных клеток крови [Текст] / Скоркина М.Ю., Федорова М.З., Чернявских С.Д.; заявитель и патентообладатель НИУ «БелГУ». – № 2010105541; заявл. 16.025.2010; опубл. 10.10.2010. 78. Перцева, М.Н. Циклический аденозиномонофосфат и ионы кальция в механизме действия катехоламинов / М.Н. Перцева // Успехи современной биологии. – 1976. – Т. 82, №4. – С. 18-33. 79. Перцева, М.Н. Молекулярные основы развития гормонокомпетентности / 327 М.Н. Перцева. – Л.: Наука, 1989. – 251 с. 80. Пестов, Н.Б. Регуляция Са2+-АТФазы плазматических мембран / Н.Б. Пестов, Р.И. Дмитриев, М.И. Шахпаронов // Успехи биологической химии. – 2003. – Т. 43. – С. 99-138. 81. Платонов, А.Е. Статистический анализ в медицине и биологии: задачи, терминология, логика, компьютерные методы / А.Е. Платонов. – М.: Изд-во РАМН, 2000. – 52 с. 82. Ровенский, Ю.А. Растровая электронная микроскопия нормальных и опухолевых клеток / Ю.А. Ровенский. – М.: Медицина, 1979. – 152 с. 83. Романова, А.Ф. Справочник по гематологии / А.Ф. Романова. – Ростов Н/Д.: Феникс, 2000. – 384 с. 84. Руководство пользователя «Зондовая нанолаборатория Интегра Вита». – Зеленоград: Copyright НТМДТ, 2006. – 57 с. 85. Семенова, миелоидной С.Б. Эндогенные лейкемии котранспортирующие человека / С.Б. каналы Семенова, Ю.А. в клетках Негуляев // Биологические мембраны. – 2006. – Т.23, № 4. – С. 321-329. 86. Сергеев, П.В. Рецепторы физиологически активных веществ / П.В. Сергеев, Н.Л. Шимоновский. – М.: Медицина, 1987. – 400 с. 87. Смирнова, Е.А. Устойчивость разных типов клеток к действию гипотонии / Е.А. Смирнова, Н.Н. Казачкина, В.И. Гребенщикова, Ю.С. Ченцов // Цитология.– 1987. – Т.XXIX, № 1. – С. 47-53. 88. Смолин, Ю.Н. Влияние ионной силы среды на осмотические свойства эритроцитов / Ю.Н. Смолин, В.И. Сарабаш, А.В. Команов // Биофизика. – 1980. - Т.25, № 2. – С. 343-344. 89. Смолянинов, В.В. Математические модели биологических тканей / В.В. Смолянинов. – М.: Наука, 1980. – 368 с. 90. Сорокин, А.В. Ядерно-цитоплазматический транспорт белков / А.В. 91. Сорокин, Е.Р. Ким , Л.П. Овчинников // Успехи биологической химии. – 2007. – Т. 47. – С. 89-128. 92. Сторожок, С.А. Молекулярная структура мембран эритроцитов и их 328 механические свойства / С.А. Сторожок, А.Г. Санников, Ю.М. Захаров. – Тюмень: ТГУ, 1997. – 130 с. 93. Сторожок, С.А. Роль белков цитоскелета эритроцитов в обеспечении их способности к упругой деформации / С.А. Сторожок // Материалы XVII съезд физиологов России. – Ростов Н/Д, 1998. – С. 172. 94. Тарасова, И.М. Изменение физико-химических свойств лимфоцитов в процессах развития индуцированного канцерогенеза и общей реакции на повреждения: дис. … канд. физ.-мат. наук: 03.00.02 / Тарасова Ирина Михайловна – М., 1985. – 187 с. 95. Ткачук, В.А. Мембранные рецепторы и внутриклеточный кальций / В.А. Ткачук // Соросовский образовательный журнал. – 2001. – Т. 7, №1. – С. 10-15. 96. Федорова, М.З. Метод комплексного исследования геометрии, площади поверхности, резервных возможностей мембраны и осморегуляции лейкоцитов крови / М.З. Федорова, В.Н. Левин // Клиническая лабораторная диагностика. – 1997. – № 11. – С. 44-46. 97. Федорова, М.З. Функциональные свойства и реактивность лейкоцитов крови при измененных состояниях организма, вызванных факторами различной природы: автореф. дис. … докт. биол. наук: 03.00.13; 14.00.16 / Федорова Марина Зотовна. – Ярославль, 2001. – 42 с. 98. Федорова, М.З. Использование мембранного резерва лимфоцитами крови при деформации и в условиях гипотонии / М.З. Федорова, В.Н. Левин // Биологические мембраны.– 2001. - Т.18, № 14. – С. 306-311. 99. Федорова, М.З. Сравнительная оценка «мембранного резерва» клеток крови земноводных и млекопитающих / М.З. Федорова, С.В. Надеждин, С.И. Головко, Е.В. Зубарева // Журнал эволюционной биохимии и физиологии. - 2007. – Т.43, № 5. – С. 419-422. 100. Федченко, Н.П. Эндотелиомер – новый форменный элемент крови / Н.П. Федченко // Вестник проблем современной медицины. – 1995. – № 7. – С. 12-16. 101. Федченко, Н.Н. Цитомеры – новый тип информогенных форменных элементов организма / Н.Н. Федченко, Н.П. Федченко, В.И. Гарец // Вопросы 329 морфологии XXI века. – 2003. – С. 298-306. 102. Федченко, Н.Н. Новые теоретические и патоморфологические подходы к проблеме метастазирования опухолей / Н.Н. Федченко // Морфология. – 2007. – Т.1, №12. – С. 12-17. 103. Финкинштейн, Я.Д. Осморегулирующая система организма высших животных / Я.Д. Финкинштейн. – Новосибирск: Наука, Сиб. Отд-е, 1983. – 124 с. 104. Фултон, А. Цитоскелет: Архитектура и хореография клеток / А. Фултон. – М.: Мир, 1987. – 120 с. 105. Хамидов, Д.Х. Кровь и кроветворение у позвоночных животных / Д.Х. Хамидов, А.Т. Акилов, А.А. Туронев. – Ташкент: Фан, 1978. – 168 с. 106. Хайтлина, С.Ю. Механизмы сегрегации изоформ актина в клетке / С.Ю. Хайтлина // Цитология. – 2007. – Т. 49, № 5. – С. 345-354. 107. Чеботарева, Н.А. Влияние молекулярного краудинга на ферменты гликолиза / Н.А. Чеботарева // Успехи биологической химии. – 2007. – Т. 47. – С. 233-258. 108. Чернявских, С.Д. Перестройка актинового цитоскелета в ядерных эритроцитах и лейкоцитах рыб, лягушек и птиц при миграции / С.Д. Чернявских, М.З. Федорова, Т. В. Ван, К.Д. Хыу // Цитология. – 2012. – Т. 54, №5. – С.412-416. 109. Широкова, А.В. Апоптоз. Сигнальные пути и изменение ионного и водного баланса клетки / А.В. Широкова // Цитология. – 2007. – Т. 49, №5. – С. 385-394. 110. Шпаков, А.О. Молекулярные механизмы сопряжения гормональных рецепторов с G-белками в аденилатциклазной сигнальной системе позвоночных и беспозвоночных: автореф. дис. … докт. биол. наук: 03.00.04 / Шпаков Андрей Олегович. – Спб., 2007. – 40 с. 111. Эккерт, Р. Физиология животных: механимы и адаптации: в 2 т. / Рю Эккерт, Д. Рэндел, Дж. Огастин. – М.: Мир, 1991. – 1 т. – 423 с. 112. Agalakova, N.A. Temperature effect on ion transport across the erythrocyte membrane of the frog Rana Temporaria / N.A. Agalakova, A.V. Lapin, G.P. Gusev // Comparative Biochemestry and Physiology. – 1997. – V. 170 (9). – P. 411-418. 330 113. A-Hassan, E. Microelastic mapping of living cells by atomic force microscopy / E. A-Hassan, W.F. Heinz, M.D. Antonic, N.P. D'Costa, S. Nageswaran,C.N. Schoenenberger, J.H. Hoh // Biophys. J. – 1998. – V. 74 (3). – P. 1564-1578. 114. Ahmad, F.J. An essential role for katanin in severing microtubules in the neuron / F.J. Ahmad, W. Yu, F.J. McNally, P.W. Baas // J. Cell Biol. – 1999. – V. 145(2). – P. 305-315. 115. Akey, C.W. Interactions and structure of the nuclear pore complex revealed by cryo-electron microscopy // J. Cell biol. – 1989. – V. 109. – P. 955-970. 116. Akhmanova, A. Clasps are CLIP-115 and -170 associating proteins involved in the regional regulation of microtubule dynamics in motile fibroblasts / A. Akhmanova, C.C. Hoogenraad, K. Drabek, T. Stepanova, B. Dortland, T. Verkerk, W. Vermeulen, B.M. Burgering, C.I. De Zeeuw., F. Grosveld, N. Galjart // Cell. – 2001. – V. 104(6). – P. 923-935. 117. Alan, D. A calcium-activated polyphosphoinositide phospho-diesterase in the plasma membrane of human and rabbit erythrocytes / D. Alan, H. Michell // Biochem. Byophys. Acta. – 1978. – V. 508 (2). – P. 277-286. 118. Alberts, B. Molecular biology of the cell / B. Alberts, R.J. Lewis, M. Raff, D. Bray. – New York: Garland Publ., 2002. – 1042 p. 119. Alessandrini, A. AFM: a versatile tool in biophysics / A. Alessandrini, P. Facci // Meas. Sci. Technol. – 2005. – V. 16. – P. R65-R92. 120. Al-Habori, M. Macromolecular crowding and its role as intracellular signaling of cell volume regulation / M. Al-Habori // The international journal of biochemistry and cell biology. – 2001. – V. 33(9). – P. 844-864. 121. Allen, D.W. Calcium-induced erythrocyte membrane changes. The role of adsorption of cytosol proteins and proteases / D.W. Allen, S. Cadman // Biochim. Biophys. Acta. – 1979. – V. 551. – P. 1-9. 122. Alonso, J.L. Feeling the forces: atomic force microscopy in cell biology / J.L. Alonso, W.H. Goldman // Life Sci. – 2003. – V. 72. – P. 2553-2560. 123. Anderson, D.R. Calcium-promoted changes of the human erythrocyte membrane. Involvement of spectrin, transglutaminase, and protease / D.R. Anderson, J.L. Davis, 331 K.L. Carraway // J. Biol. Chem. – 1977. – V. 252. – P. 6617-6623. 124. Anderson, R.A. Glycophorin is linked by Band 4.1 protein to the human erythrocyte membrane skeleton / R.A. Anderson, R.E. Lovrien // Nature. – 1984. – V. 307. – P. 655-658. 125. Anderson, R. Membrane stabilizing anti-oxidative interactions of propranalol and dexpropranalol with neutrophils / R. Anderson, G. Ramafi, A.J. Theron // Biochemical Pharmacology. – 1996. – V. 52 (2). – P. 341-349. 126. André, C. Identification and chemical characterization of β-adrenergic receptors in intact turkey erythrocytes / C. André, G. Vauquelin, J.P. De Backer, A.D. Srosberg // Biochem. Pharmac. – 1981. – V. 30. – P. 2787-2795. 127. Andronic. J.L. Identification of two-pore domain potassium channels as potent modulators of osmotic volume regulation in human T lymphocytes / J.L. Andronic, N. Bobak, S. Bittner, P. Ehling, C. Kleinschnitz, A.M. Herrmann, H. Zimmermann, M. Sauer, H. Wiendl, T. Budde, S.G. Meuth, V.L. Sukhorukov // Biochim Biophys Acta. – 2013. – V. 1828 (2). – P. 699-707. 128. Arakawa, T. The stabilization of proteins by osmolytes / T. Arakawa, S.N. Timasheff // Biophys. J. – 1983. – V. 47. – P.411-414. 129. Ariens, E.J. Receptors and receptor mechanism / E.J. Ariens, A.M. Jimans // Adrenergic activators and inhibitors. – Berlin-New York. – 1980. – V. 1. – P. 63-88. 130. Backman, L. Shape control in human red blood cells / L. Backman // J. Cell Sci. – 1986. – V. 80. – P. 281-288. 131. Bain, B. Scanning electron microscopy of cultured lymphocytes / B. Bain // Proceedings of the 5th Leukocyte Culture Conference. – New York: Academic Press, 1971. – P.175. 132. Balla, T. Inositol-lipid bindings motifs: signal integrators through protein-lipid and protein-protein interactions / T. Balla // J. Cell Sci. – 2005. – V. 18. – P. 20932104. 133. Bard, J.B. The behavior of fibroblasts from the developing avian cornea. Morphology and movement in site and in vitro / J.B. Bard, E.O. Hay // J. Cell Biol. – 1975. – V. 67. – P. 400-418. 332 134. Barnes, P.J. Beta-adrenergic receptors and their regulation / P.J. Barnes // Am. J. Respir. Crit. Care Med. – 1995. – V. 152. – P. 838-860. 135. Baroin, A. A transient sodium hydrogen exchange system induced by catecholamines in erythrocytes of rainbow trout Salmo gairdneri / A. Baroin, F. Garcia-Romeu, T. La Mare, T. Motais // J. Physiol. – 1984. – V. 356. – P. 21-31. 136. Barlett, D.C. The cytoskeletal system of nucleated erythrocytes II. Presence of a high molecular weight calmodulin-binding protein / D.C. Barlett, R.K. Carlin, G.A. Scheele,W.D. Cohen // J. Cell Biol. – 1982. – V. 95. – P. 278-284. 137. Barret, C. Mutagenesis of the phosphatidylinositol 4,5-biphosphate (PIP2) binding site in the NH2-terminal domain of ezrin correlates with its altered cellular distribution / C. Barret, C. Roy, P. Montcourcier, P. Mangeat, V. Niggli // J. Cell Biol. – 2000. – V. 151. – P. 1067-1080. 138. Bassel, C.G. mRNA and cytoskeletal filaments / C.G. Bassel, R.H. Singer // Curr. Opin Cell Biol. – 1997. – V. 9. – P. 109-115. 139. Bauman, G. Induction of cAMP dependent protein kinase (PKA) activity in Tcells after stimulation of the prostaglandin E2 or the beta-adrenergic receptors: relationship between PKA activity and inhibition of anti-CD3 monoclonal antibody induced T cell proliferation / G. Bauman, M. Bartix, M. Brooks // Cell Immunol. – 1994. – V. 158. – P. 182-194. 140. Benoit, M. Measuring cell adhesion forces with the atomic force microscope at the molecular level / M. Benoit, H.E. Gaub // Cell Tisscus Organs. – 2002. – V. 172. – P. 174-189. 141. Ben-Sasson, S.R. Osmotic behavior of normal and leukemic lymphocytes / S.R. Ben-Sasson, R. Shaviv, Z. Bentwich, S. Slavins, F. Doljanski // Blood. – 1975. – V. 46. – P. 891-899. 142. Bergeron, L.J. Potassium conductance activated during regulatory volume decrease by mud puppy red blood cell / L.J. Bergeron., A.J. Stever, D.B. Light // Am. J. Physiol. – 1996. – V. 270. – P. R801-R810. 143. Berkefeld, H. Ca2+-activated K+ channels: from protein complexes to function / H. Berkefeld, B. Falker, U. Schulte // Physiol. Rev. – 2010. – V. 90. – P. 1437-1459. 333 144. Berryman, M. Ezrin is concentrated in the apical microvilli of a wide variety of epithelial cells whereas moesin is found primarily in endothelial cells / M. Berryman, Z. Franck, A. Bretscher// J. Cell Sci. – 1993. – V. 105. - P. 1025-1043. 145. Bershadsky, A.D. Cytoskeleton / A.D. Bershadsky, J.M. Vasiliev. – N.Y.; plenum Press. – 1988. – 298p. 146. Bischoff, G. Micro- and nanostructures of biological system / G. Bischoff, H.J. Hein. – Aachen: Shaker Verlag, 2003. – V. 1. – 160 p. 147. Block, J.B. Sodium-potassium activated adenosine-triphosphatase and cation transport in normal and leukemic human leukocytes / J.B. Block, S.L. Bonting // Enzymol. Biol. Clin. – 1964. – V. 41. – P. 183-198. 148. Bobak, N. Volume regulatiom of murine T lymphocytes relies on voltagedependent and two-pore domain potassium channels / N. Bobak, S. Bittner, J. Andronic, S. Hartmann, F. Mühlpfordt, T. Schneider-Hohendorf, K. Wolf, C. Schmelter, K. Gӧbel, P. Meuth, H. Zimmermann, F. Dӧring // Biochim. Biophys. Acta. – 2011. – V. 1808 (8). – P. 2036-2044. 149. Bonangelino, C.J. Osmotic stress-induced increase of phosphatidylinositol 3,5biphosphate requires Vac 14p, on activator of the lipid kinase Fab 1p / C.J. Bonangelino, J.J. Nau, J.E. Duex, M. Brinkman, A.E. Wurmser, J.D. Gary, S.D. Emr, L.S. Weisman // J. Cell Biol. – 2002. – V. 156. – P. 1015-1028. 150. Borgese, F. Cloning and expression of a cAMP-acctivated Na+/H+-exchanger: evidence that the cyto-plasmic domain mediates hormonal regulation / F. Borgese, C. Sardet, M. Cappadoro, J. Pouyssergur., R. Motais // Proc. Natl. Acad. Sci. USA. – 1992. – V. 89. – P. 6765-6769. 151. Boxer, L.A. Diminished polymorphonuclear leuko-cyte adherence: function dependent on release of cyclic AMP by endothelial cell after stimulation of betareceptors by epinephrine / L.A. Boxer, J.M. Allen, R.L. Baeher // J. Clin. Invest. – 1980. – V. 66. – P. 268-274. 152. Brakebusch, C. The integrin-actin connection, an eternal love affair / C. Brakebusch, R. Fӓssler // EMBO J. – 2003. – V. 22. – P. 2324-2333. 153. Bratosin, D. Programmed cell death in nature erythrocytes: a model for 334 investigating death effectors pathways operating in the absence of mitochondria / D. Bratosin, J. Estraquier, F. Petit, D. Arnoult // Cell death and differentiation. – 2001. – V. 8. – P. 1143-1156. 154. Bridger, J.M. Internal lamin structures within G1 nuclei of human dermal fibroblasts / J.M. Bridger, I.R. Kill, M. O’Farrell, C.J. Hutchison // J. Cell Sci. – 1993. – V. 104. – P. 297-306. 155. Briggs, M.M. The β-adrenergic receptor system: a model for the transmembrane regulation of adenylatecyclase / M.M. Briggs, R.J. Lefcowitz // Cellular regulation of secretion and release; ed. M.P. Conn. –- New York., 1982. – P. 23-50. 156. Brown, A.D. Water relation of sugar-tolerant yeasts: the role of intracellular polyols / A.D. Brown, J. Simpson // J. Gen. Microbiol. – 1972. – V. 72. – P. 589-591. 157. Buckhold-Shank, B. Regulation of cellular growth by sodium pump activity / B. Buckhold-Shank, N.E. Smith // J. Cell Physiol. – 1976. – V. 87. – P. 377-388. 158. Burg, M.B. Glycerophosphocholine and betaine counteract the effect of urea on pyruvate kinase / M.B. Burg, E.D. Kwon, E.M. Peters // Kidney Int. – 1996. – V. 50. – P. S100-S104. 159. Burg, M.B. Regulation of gene expression by hypertonicity / M.B. Burg, E.D. Kwon, D. Kültz // Annu. Rev. Physiol. – 1997. – V. 59. – P. 437-455. 160. Butt, H.J. Imaging cells with the atomic force microscopy / H.J. Butt, E.K. Wolff, S.A.C. Gould, B.D. Northern, C.M. Peterson, P.K. Hansma // J. Struct. Biol. – 1990. – V. 105. – P. 54-61. 161. Butt, H.J. Force measurements with the atomic force microscope: Technique, interpretation and application / H.J. Butt, B. Capella, M. Keppel // Surf. Sci. Rep. – 2005. – V. 59. – P. 1-15. 162. Cahalan, M.D. Role of potassium and chloride channels in volume regulation by T-lymphocytes / M.D. Cahalan, R.S. Lewis // In. Cell Physiology of blood red / ed. R.B. Gunn. – New York: University Press., 1988. – P. 281-302. 163. Cai, X. Connection between biomechanics and cytoskeleton structure of lymphocyte and Jurkut cells: An AFM study / X. Cai, X. Xing, J. Cai, Q. Chen, S. Wu, F. Haung // PMID. – 2010. – 41(3). – P. 257-262. 335 164. Cala, P.M. Volume regulation by Amphiuma red blood cells. The membrane potential and its implication regarding the nature of the ion-flux pathways / P.M. Cala // J. of General Physiology. – 1980. – V. 76. – P. 683-708. 165. Cala, P.M. Volume sensitive ion fluxes in Amphiuma red blood cells: general principles governing Na-H and K-H exchange transport and Cl--HCO3- exchange coupling / P.M. Cala // Curr. Topics Membrane Transport. – 1986. – V. 27. – P. 193218. 166. Cala, P.M. Cell volume regulation by Amphiuma red blood cells. The role of Ca2+ as a modulator of alkali metal/H+ exchange / P.M. Cala // J. of General Physiology. – 1983. – V. 82. – P. 761-784. 167. Cala, P.M. Volume regulation by Amphiuma red blood cells: cytosolic free Ca and alkali metal-H exchange / P.M. Cala, L.J. Mandel, E. Murphy // American J. of Physiology. – 1982. – V. 250. – P. C423-C429. 168. Cala, P.M. pH Regulatory Na/H exchange / P.M. Cala, H.M. Maldonado // J. Gen. Physiol. – 1994. – V. 103. – P. 1035-1054. 169. Canman, J.C. The role of pre- and post-anaphase microtubules in the cytokinesis phase of the cell cycle / J.C. Canman, D.B. Hoffman,E.D. Salmon // Curr Biol. – 2000. –V. 10. – P. 611-614. 170. Cantiello, H.F. Osmotically induced electrical signals from actin filaments / H.F. Cantiello, C.R. Patenaude, K.S. Zaner // Biophys. J. – 1991. – V. 59. – P. 1284-1289. 171. Cantiello, H.F. Actin filaments control epithelial Na+ channel activity / H.F. Cantiello, J. Stow, A.G. Prat, D.A. Ausiello // Am. J. Physiol. – 1991a. – V. 261. – P. 882-888. 172. Cantiello, H.F. Actin-binding protein contributes to cell volume regulatory ion channel activation in melanoma cells / H.F. Cantiello, A.G. Prat, J.V. Bonventre, G.C. Cunningham, J. Hartwig, D.A. Ausiello // J. Biol. Chem. – 1993. – V. 268. – P. 4596-4599. 173. Capella, B. Force-distance curves by atomic force microscopy / B. Capella, G. Dieter // Surf. Sci. Rep. – 1999. – V. 34. – P. 1-104. 174. Cardone, R.A. Protein kinase A gating of a pseudopodial-located 336 RhoA/ROCK/p38/NHE1 signal module regulates invasion in breast cancer cell line / R.A. Cardone, A. Bagorda, A. Bellizi, G. Busco, L. Guerra, A. Paradiso, V. Casavola, M. Zaccolo, S.J. Reshkin // Mol. Biol. Cell. – 2005. – V. 16. – P. 31173127. 175. Carr, I. The surface structure of mouse peritoneal cells a study with the scanning electron microscope / I. Carr, J.A. Clarke, A.J. Salsbury // J. Micros. – 1969. – V. 89. – P. 105-111. 176. Cartwright, P. Nucleocytoplasma shutting of transcription factors / P. Cartwright, K. Helin// Cell Mol. Life Sci. – 2000. – V. 57. – P. 1193-1206. 177. Carvalho, K. Giant unilamellur vesicles containing phosphatidylinositol (4,5) biphosphate: characterization and fun-ctionality / K. Carvalho, L. Ramos, C. Roy, C. Picart // Biophys. J. – 2008. – V. 95. – P. 4348-4360. 178. Chadwick, R.S. Axisymmetric indentation of a thin incompressible layer / R.S. Chadwick // SIAM. J. Appl. Math. – 2002. – V. 62(15). – P.6375-6378. 179. Chamberlin, M.E. Anisosmotic cell volume regulation: A comparative view / M.E. Chamberlin, K. Strange // Am. J. Physiol. – 1989. – V. 257. – P. C159-C173. 180. Chandra, R. Membrane phospholipid organization in calcium-loaded human erythrocytes / R. Chandra, P.S. Joshi, V.K. Bajpai,C.M. Gupta // Biochimica et Biophysica Acta. – 1987. – V. 902. – P. 253-262. 181. Chapham, D.E. TRP channels as cellular sensors / D.E. Chapham // Nature. – 2003. – V. 426 – P. 517-524. 182. Charras, G.T. Reassembly of contractile actin cortex in cell blebs / G.T. Charras, C.K. Hu, M. Coughlin, T.J. Mitchison // J. Cell Biol. – 2006. – V. 175. – P. 477-490. 183. Charras, G.T. Blebs Lead the way: to migrate without lamellopodia / G.T. Charras, E. Paluch // Nat. Mol. Cell Biol. – 2008. – V. 9 – P. 730-736. 184. Chatan, N.E. G-protein-coupled receptor activation induces the membrane translocation and activation of phosphatidylinositol-4-phophate 5-kinase I alpha by a Rac- and Rho-dependent pathway / N.E. Chatan, C.S. Abrams // J. Biol. Chem. – 2001. – V. 276. – P. 34059-34065. 185. Chellaiah, M.A. Regulation of podosomes by integrin alpha, beta 3 and Rho 337 GTPase-facilitated phosphoinositide signaling / M.A. Chellaiah // Eur. J. Cell Biol. – 2006. – V. 85. – P. 311-317. 186. Chen, J. Cytoskeletal dissociation of ezzin during renal anoxia: role in microvillar injury / J. Chen, R.B. Doctor, L.J. Mandel. // Am J. Physiol. – 1994. – V. 267. – P. C784-C795. 187. Cherksey, B.D. Cytoskeletal constraint of the β-adrenergic receptor in frog erythrocyte membrane / B.D. Cherksey, J.A. Zadunaisky, R.B. Murphy // Proc. Natl. Acad. Sci. USA. – 1980. – V. 77. – P. 6401-6405. 188. Chesarone, M.A. Actin nucleation and elongation factors: mechanisms and interplay / M.A. Chesarone, B.L. Goode // Curr. Opin. Cell Biol. – 2009. – V. 21. – P.28-37. 189. Chiang, Y. EGF upregulates Na+/H+ exchanger NHE1 by post-translational regulation that is important for cervical cancer cell invasiveness / Y. Chaing, C.Y. Chou, K.F. Hsu, Y.F. Huang, M.R. Shen // J. Cell Physiol. – 2008. – V. 214. – P. 810-819. 190. Christensen, O. Mediation of cell volume regulation by Ca2+ influx through stretch-activated channels / O. Christensen // Nature. – 1987. – V. 330. – P. 66-68. 191. Christensen, By.S. Inositol triphosphate may be a second messenger in regulatory volume decrease in Ehrlich mouse ascites tumor cells / By.S.Christensen, I.K. Hoffman, T.S. Saermark, L.O. Simonsen // J. Physiol. – 1988. – V. 403. – P. 577588. 192. Chuang, D.M. β-adrenergic receptors of frog erythrocytes. Biochemical squeal following stimulation with isoproterenol / D.M. Chuang, E. Costa // Neurochemical Research. – 1979. – V. 4 (61). – P. 777-793. 193. Clarke, J.A. The effects of various antisera on the surface sensitized rat lymph node cells / J.A. Clarke, A.J. Salsbury, D.A. Willonghby // J. Path. Bact. – 1968. – V.96. – P. 235-242. 194. Clausen, T. Long-and short-term regulation of Na+, K+-pump in skeletal muscle / T. Clausen // News Physiol. Sci. – 1996. – V. 11. – P. 24-30. 195. Clausen-Schauman, H. Force spectroscopy with single bio-molecules / H. 338 Clausen-Schauman, M. Seitz, R. Krautbauer, H. Gaub // Curr. Opin. Chem. Biol. – 2000. – V. 4. – P. 524-530. 196. Coelho-Sampaio, T. Betaine counteracts urea-indeuced conformational changes and uncoupling of the human erythrocyte Ca2+ pump / T. Coelho-Sampaio, S.T. Ferreria, E.J. Castro, A. Vieyra // Eur. J. Biohem. – 1994. – V. 221. – P. 1103-1110. 197. Cohen, C.M. The role of band 4.1 in the association of actin with erythrocytes membranes / C.M. Cohen, S.F. Foley // Biochim Biophys. Acta. – 1982 – V. 688 (3). – P. 691-701. 198. Cook, T.A. Gundersen G.G. Rho guanosine triphosphatase mediates the selective stabilization of microtubules induced by lysophosphatidic acid / T.A. Cook, T. Nagasaki // J. Cell Biol. – 1998. – V. 141 (1). – P. 175-185. 199. Cornet, M. Effects of anisosmotic conditions on the cytoskeletal architecture of cultured PC12 cells / M. Cornet, Y. Isobe, L.F. Lemanski // J. Morphol. – 1994. – V. 222. – P. 269-286. 200. Costanzo, J.P. Cryoprotection by urea in a terrestrially hibernating frog / J.P. Costanzo, E.L. Richard // The J. of experimental biology. – 2005. – V. 208. – P. 4079-4089. 201. Counillon, L. The expanding family of eucaryotie Na+/H+ exchange / L. Counillon, J. Poussegur // J. Biol. Chem. – 2000. – V. 275. – P. 1-4. 202. Coupade, C. β2-adrenergic receptor dependent sexual dimorphism for murine leukocyte migration / C. Coupade, A.S. Brown, P.F. Dazin, J.D. Levine, P.G. Green // J. Neuroimmunal. – 2007. – V. 186 (2). – P. 54-69. 203. Crajokowski, W. Surface changes of the mechanosensitive channels MscS upon its activation, inactivation and closing / W. Crajokowski, A. Kulalski, P. Koprowski // Biophysical J. – 2005 – V. 88. – P. 3050-3059. 204. Cremer, T. Chromosome territories, nuclear architecture and gene regulation in mammalian cells / T. Cremer, C. Cremer // Nat. Rev. Genet. – 2001. – V. 2. – P. 292301. 205. Critchley, D.R. Focal adhesions – the cytoskeletal connection / D.R. Critchley // Curr. Opin. Cell Biol. – 2000. – V. 12. – P. 133-139. 339 206. Croall, D.E. Limited proteolysis of the erythroid membrane skeleton by calcium dependent proteinoses / D.E. Croall, J.C. Morrow, G.N. De Martino // Biophys. Acta. – 1986. – V. 882. – P. 287-296. 207. D’Addario, M. Cytoprotection against mechanical forces deliverd through beta integrins requires induction of filamin A / M. D’Addario, P.D. Arora, J. Fan, B. Ganss, R.P. Ellen, C.A.G. McCulloch // J. Biol. Chem. – 2003. – V. 276. – P. 3196931977. 208. D’Addario, M. Regulation of tension-induced mechanotranscriptional signals by the microtubule network in fibroblasts / M. D’Addario, P.D. Arora, R.P. Ellen, C.A.G. McCulloch // J. Biol. Chem. – 2003. – V. 278. – P. 53090-53097. 209. Dahl, S.V. Role of eicosanoids, inositol phosphates and extracellular Ca2+ in cellvolume regulation of rat liver / S.V. Dahl, C. Hallbrucker, F. Lang, D. Hӓussinger // Eur. J. Biochem. – 1991. – V. 198. – P. 73-83. 210. Danowski, B.A. Fibroblast contractility and actin organization are stimulated by microtubule inhibitors / B.A. Danowski // J. Cell Sci. – 1989. – V. 93 (2). – P. 255266. 211. Dave, R.H., Heterotrimeric G-proteins interact directly with cytoskeletal components to modify microtubule-dependent cellular processes / R.H. Dave, W.Yu.J.Z. Saengsawang, R. Donati, M. Rasenick // Neurosignals. – 2009. – V. 17. – P. 100-108. 212. Davis, C.W. Interaction of sodium transport, cell volume and calcium in frog urinary bladder / C.W. Davis, A.L. Finn // J. of General Physiology. – 1987. – V. 89. – P. 687-702. 213. De Lanerolle, P. Cytoskeletal proteins and gene regulation / P. De Lanerolle, A.B. Cole // Sci. STKE. – 2002. – V. 139. – P. PE30. 214. Denker, S.P. Cell migration requires both ion translocation and cytoskeletal anchoring by the Na-H exchanger NHE1 / S.P. Denker, D.L. Barber // J. Cell Biol. – 2002. – V. 159. – P. 1087-1096. 215. Der Terrossian, E. Purification and characterization of erythrocyte caldesmone / E. Der Terrossian, C. Deprette, I. Lebbar, R. Cassoly // Eur. J. Biochem. – 1994. – V. 340 219. – P. 503-511. 216. Desai, A. Microtubule polymerization dynamics / A. Desai, T.J. Mitchinson // Ann. Rev. CM Develop. Biol. – 1997. – V. 13. – P. 83-117. 217. Devarajan, P. Ankyrin bind to two distinct cytoplasmic domains of Na,K-ATPase a subunit / P. Devarajan, P.A. Scaramuzzino, J.S. Morrow // Proc. Nat. Acad. Sci. USA. – 1995. – V. 91. – P. 2965-2969. 218. De Vellis, J. Reversal of catecholamine refractoriness by inhibitors of RNA and protein synthesis / J. De Vellis, G. Brooker // Science (Wash DC). – 1974. – V. 186. – P. 1221-1223. 219. Dhamodharan, R. Modulation of microtubule dynamic instability in vivo by brain microtubule associated proteins / R. Dhamodharan, P. Wadsworth // J. Cell Sci. – 1995. – V. 108 (4). – P. 1679-1689. 220. Diamantopoulos, G.S. Dynamic localization of CLIP-170 to microtubule plus ends is coupled to microtubule assembly / G.S. Diamantopoulos, F. Perez, H.V. Goodson, G. Batelier, R. Melki, T.E. Kreis, J.E. Rickard // J. Cell Biol. – 1999. – V. 144(1). – P. 99-112. 221. Dimitriadis, E.K. Determination of elastic moduli of thin layers of soft material using the atomic force microscope / E.K. Dimitriadis, F. Horkay, J. Maresca, B. Kachar, R.S. Chadwick // Biophys. J. – 2002. – V. 82. – P. 2798-2810. 222. Doctor, B.R. Loss of plasma membrane structural support in ATP-depleted renal epithelia / B. R. Doctor, D.N. Zhelev, L.J. Mandel // Am. J. Physiol. – 1997. – V. 272. – P. C439-C449. 223. Dolmetsch, R.E. Differential activation of transcription factors induced by Ca 2+ response amplitude and duration / R.E. Dolmetsch, R.S. Lewis, C.C. Goodnow, J.L. Healy // Nature. – 1997. – V. 386. – P. 855-858. 224. Donaldson, J.G. Regulations and effectors of the ARF GTPase / J.G. Donaldson, C.L. Jackson // Curr. Opin. Cell Biol. – 2000. – V. 12. – P. 475-482. 225. Dong, C. Mechanics of leukocyte deformation and adhesion to endothelium in shear flow / C. Dong, J. Cao, E.J. Struble // Ann. Biomad. Eng. – 1998. – V.27 (3). – P. 298-312. 341 226. Dos Remedois, C.G. Actin binding proteins: regulation of cytoskeletal microfilaments / C.G. Dos Remedois, D. Chabra, M. Kekic, I.V. Dedova, M. Tsubakinara, D.A. Berry, N.J. Nosworthy // Physiol. Rev. – 2003. – V. 83. – P. 433473. 227. Dubois, J.M. The influence of cell volume changes on tumor cell proliferation / J.M. Dubois, B. Rouzaire-Dubois // Eur. Biophys. J. – 2004. – V. 33. – P. 227-232. 228. Dulinska, I. Stiffness of normal and pathological erythrocytes studied by means of atomic force microscopy / I. Dulinska, M. Targosz, W. Strojny, M. Lekva, P. Czuba, W. Balwierz, M. Szymonski // J. Biochem. Biophys. Meth. – 2006. – V. 66. – P. 1-11. 229. Dunham, P.B. Passive potassium transport in low potassium sheep red cells: dependence upon cell volume and chloride / P.B. Dunham, J.C. Ellory // J. of Physiology. – 1981. – V. 318. – P. 511-530. 230. Dustin, P. Microtubules / P. Dustin // Sci. Ann. J. – 1980. – V. 243 (2). – P. 6676. 231. Eder, P.S. Phosphorylation reduces the affinity of protein 4.1 for spectrin / P.S. Eder, C.J. Soong, M. Tao // Biochemistry. – 1986. – V. 25. – P. 1764-1770. 232. Edwards, S. Dynamics of highly entangled rod-like molecules / S. Edwards, K. Evans // J. Chem. Soc. Faraday Trans. II. – 1982. – V. 78. – P. 113-121. 233. Egea, G. Actin dynamics at the Golgi complex in mammalian cells / G. Egea, F. Lazaro-Dieguer, M. Vivella M. // Curr. Opin. Cell Biol. – 2006. – V. 18. – P. 168178. 234. El-Azzouzi, B. Cadmium induced apoptosis in a human T cell line / B. ElAzzouzi, G.T. Tsangaris, O. Pellegrini // Toxicology. – 1994. – V. 88. – P. 127-139. 235. Elenkov, I.J. The sympathetic nerve – an integrative interface two supersystems: the brain and immune system / I.J. Elenkov, R.L. Wilder, G.P. Chrousos, E.S. Vizi // Pharmacol. Rev. – 2000. – V. 52. – P. 595-638. 236. Emma, F. Intracellular electro bytes regulate the volume set paint of the organic osmolyte (anion channel VSOAC) / F. Emma, M. McManus, K. Strange // Am. J. Physiol. Cell Physiol. – 1997. – V. 272. – P. C1766-C1775. 342 237. Erickson, C.A. Microvilli and blebs as sources of reserve surface membrane during cell spreading / C.A. Erickson, J.P. Trinkaus // Exp. Cell Res. – 1976. – V. 99. – P. 375-384. 238. Erickson, G.R. Hypo-osmotic stress induces calcium- dependent actin reorganization in articular chondrocytes / G.R. Erickson, D.L. Northrup, F. Guilak // Osteoarthritis Cartilage. – 2003. – V. 11. – P. 187-197. 239. Erlandsson, R. Atomic scale friction between the muscovite mica cleavage plane and a tungsten tip / R. Erlandsson, G. Hadziioannou, C.M. Mate, G.M. McCelland, S. Chiang // J. Chem. Phys. – 1988. – V. 89. – P. 5190-5193. 240. Espada, J. Epigenic control of nuclear architecture / J. Espada, M. Esteller // Cell Mol. Life Sci. – 2007. – V. 64. – P. 449-457. 241. Evans, E. Synchrony of cell spreading and contraction force as phagocytes engulf large pathogens / E. Evans, A. Leung, D. Zhelev // J. Cell Biol. – 1993. – V. 122. – P. 1295-1300. 242. Eveloff, J.L. Effect of hyperosmolarity and phorbol esters on cation fluxes in medullary in mending limb cells (mTALH) / J.L. Eveloff, J. Calamia // Kidney Int. – 1986. – V. 29. – P. 395. 243. Eveloff, J.L. Activation of ion transport system during volume regulation / J.L. Eveloff, P.G. Warnock // Amer. J. Physiol. – 1987. – V. 252. – P. F1-F10. 244. Exton, J.H. Mechanisms involved in alpha-adrenergic phenomena / J.H. Exton // Am. J. Physiol. – 1985. – V. 248. – P. 633-647. 245. Fackler, O.T. Cell motility through plasma membrane blebbing / O.T. Fackler, R. Grosse // J. Cell Biol. – 2008. – V. 181. – P. 879-884. 246. Fahlke, C. Physiology and pathophysiology of Cl C-K/barthin channels / C. Fahkle, M. Fischer // Frontiers in physiology. – 2010. – V. 1. – P. 1-12. 247. Fazal, F. Evidence for actin cytoskeleton-dependent and independent pathways for RelA/p65 nuclear translocation in endothelial cells / F. Fazal, M. Minhajuddin, K.M. Bijli, J.L. Mc Grath, A. Rahman // J. Biol. Chem. – 2007. – V. 282. – P. 39403950. 248. Fazzino, F. Taurine transport and transporter localization in peripheral blood 343 lymphocytes of controls and major depression patients / F. Fazzino, M. Urbina, S. Mata, L. Lima // Adv. Exp. Med. Biol. – 2006. – V. 583. – P. 423-436. 249. Feldman, R.O. Dynamic regulation of leukocyte beta adrenergic receptor-agonist interactions by physiological changes in circulating catecholamines / R.O. Feldman, L.E. Limbird, J. Nadean, G.A. Fitz-Gerald, D. Robertson // J. Clin. Invest. – 1983. – V. 72. – P. 164-170. 250. Feldman, R.D. The interaction of verapamil and norverapamil with betaadrenergic receptors / R.D. Feldman, G.D. Park, C.Y. Lai // Circulation. – 1985. – V. 72. – P. 547-554. 251. Feldman, R. Beta adrenergic receptor mediated suppression of interleukin 2 receptors in human lymphocytes / R. Feldman, G. Hunningshake, W. McArdle // J. Immunal. – 1987. – V. 139. – P.3355-3359. 252. Feng, Y. The many faces of filamin: a versatile molecular scaffold for cell motility and signaling / Y. Feng, C.A. Walsh // Nature CM. Biol. – 2004. – V. 6. – P. 1034-1038. 253. Ferell, J. Phosphoinosite metabolism and the morphology of human erythrocytes / J. Ferell, W.H. Huestis // J. Cell Biol. – 1984. – V. 98. – P. 1992-1998. 254. Ferreira, Q. Resolution of racemic propranalol in liquid membranes containing TA-B-cyclodextrin / Q. Ferreira, I.M. Coelhoso, N. Ramalhete, H.M.C.Marques // Seperetion Science and Technology. – 2006. – V. 41 (16). – P. 3553-3568. 255. Ferrigo, P. Regulated nucleo/cytoplasmic exchange of HOG1 MAPK requires the importin beta homolog NMD5 and XPO1 / P. Ferrigo, F. Posas, D. Koepp, H. Saito, P.A. Silver // EMBO J. – 1998. – V. 17(19). – P. 5606-5614. 256. Feske, S. A mutation in Orail causes immune deficiency by abroading CRAC channel function / S. Feske, Y. Gwack, M. Prakria, S. Srikanth, S.H. Puppel, B. Tanasa, P.G. Hogan, R.S. Lewis, N. Daly, A. Pao // Nature. – 2006. – V. 441. – P. 179-185. 257. Feske, S. Calcium signaling in lymphocyte activation and descase / S. Feske // Nat. Rev. Immunoll. – 2007. – V. 7. – P. 690-702. 258. Flahvan, E. Increased potassium in lymphocytes from patients with chronic 344 lymphatic leukemia / E. flahvan, H. Smyth, R.D. Thornes // Br. J. Cancer. – 1973. – V. 28. – P. 354-357. 259. Fletcher, D.A. Cell mechanics and the cytoskeleton / D.A. Fletcher, R.D. Mullins // Nature. – 2010. – V. 469 (7280). – P. 485-492. 260. Foder, B. Decrease of apparent calmodulen affinity of erythrocytes (Ca2++Mg2+)ATPase at low Ca2+ concentrations / B. Foder, O. Scharff // Biochim. Biophys. Acta. – 1981. – V. 649. – P. 367-376. 261. Foon, K.A. Chronic lymphocytic leukemia: new insight into biology and therapy/ K.A. Foon, K.R. Rai, R.P. Gale R.P. // Ann. Inter. Med. – 1990. – V. 113. – P. 525530. 262. Foskett, J.K. Involvement of calcium and cytoskeleton in gallbladder epithelial cell volume regulation / J.K. Foskett, K.R. Spring // Am. J. Physiol. – 1985. – V. 248. – P. C27-C36. 263. Foskett, J.K. The role of calcium in the control of volume regulatory transport pathways / J.K. Foskett // Cellular and molecular physiology of cell volume regulation. – 1994. – P. 259-277. 264. Foster, H.A. The genome and the nucleus: marries made by evolution. Genome organization and nuclear architecture / H.A. Foster, J.M. Bridger // Chromosome. – 2005. – V. 114. – P. 212-229. 265. Fowler, V.M. Human erythrocyte myosin: Identification and purification / V.M. Fowler, J.Q. Davis, V. Bennett // J. CM. Biol. – 1985. – V. 100. – P. 47-55. 266. Franklin, T.J. Desensitization of beta-adrenergic receptors in human fibroblasts in tissue culture / T.J. Franklin, W.P. Morris, P.A. Twose // Mol. Pharmacol. – 1975. – V. 11. – P. 485-491. 267. Fricker, M. Interphase nuclei of many mammalian cell types contain deep, dynamic, tubular membrane-bound invaginations of the nuclear envelope / M. Fricker, M. Hollinshead, N. White, D. Vaux // J. Cell. Biol. – 1997. – V. 136. – P. 531-544. 268. Frisbie, C.D. Functional group imaging by chemical force microscopy / C.D. Frisbie, L.F. Rorshyai, A. Noy, M.C. Wrighton, C. Lieber C. // Science. – 1994. – V. 345 265. – P. 2071-2074. 269. Fuchs, E. Bridging cytoskeletal intersections / E. Fuchs, I. Karakesisoglou // Genes Dev. 2001. – V. 15 (1). – P. 1-14. 270. Fugelli, K. Volume regulation in flounder erythrocytes. The effect of osmolality on taurine influx / K. Fugelli, L.O. Reiersen L.O. // Osmotic in volume regulation / ed. C.B. Jorgensen, E. Skadhouge. – Copenhagen: Munkgaard, 1978. – P. 418-432. 271. Fugelli, K. Taurine transport associated with cell volume regulation in flounder erythrocyte under anisosmotic / K. Fugelli, S.M. Thoroed // J. Physiol. Lond. – 1986. – V. 374. – P. 245-261. 272. Fukata, M. Racl and Cdc42 capture microtubules through IQGAP1 and CLIP-170 / M. Fukata, T. Watanabe, J. Noritake, M. Nakagawa, M. Yamaga, S. Kuroda, Y. Matsuura, A. Iwamatsu, F. Perez, K. Kaibuchi // Cell. – 2002. – V. 109 (7). – P. 873885. 273. Gambino, J. Studies on the cytoskeletal and nuclear architecture of Xenopus erythrocytes / J. Gambino, J.A. Weatherbee, R.H. Gavin, R.A. Eckhart // J. Cell Sci. – 1984. – V. 72. – P. 275-294. 274. Gambino, J. Xenopus marginal band disassembly by calcium-activated cytoplasmic factors / J. Gambino, M.J. Ross, J.A. Weatherbee // J. Cell sci. – 1985. – V. 79. – P. 199-215. 275. Garay, R.P. Inhibition of the Na+/K+ cotransport system by cyclic AMP and intracellular calcium in human red cells / R.P. Garay // Biochem. Biophys. Acta. – 1982. – V. 688. – P. 786-792. 276. Garcia-Perer, A. Role of organic osmolytes in adaptation of renal cells to high osmolality / A. Garcia-Perer, M.B. Burg // J. Mem. Biol. – 1991. – V. 119. – P. 1-13. 277. Gary, R. Heterotypic and homotypic associations between ezrin and moesin, two putative membrane-cytoskeletal linking protein / R. Gary, A. Bretscher // Proc. Natl. Acad. Sci. USA. – 1993. – V. 90. – P. 10846-10850. 278. Gaub, H.E. The molecular elasticity of individual proteins studied by AFMrelated techniques / H.E. Gaub, J.M. Fernander // AvH-Magazine. – 1998. – V. 71. – P. 11-18. 346 279. Gilbert, N. Chromatin architecture of the human genome: gene-rich domains are enriched in open chromatin fibers / N. Gilbert, S. Boyle, H. Fiegler, K. Woodfine, N.P. Carter, W. Bickmore // Cell. – 2005. – V. 118. – P. 555-566. 280. Gilmore, A.P. Regulation of vinculin binding to talin and actin by phosphatidylinositol-4,5-biphosphate / A.P. Gilmore, K. Burridge // Nature. – 1996. – V. 381. – P. 531-535. 281. Gkretsi, V. Physical and functional association of migfilin with cell-cell adhesion / V. Gkretsi. V., J. Zhang, Y. Tu, K. Cneh, D.B. Stolz, Y. Yang, S.C. Watkins, C. Wu // J. Cell sci. – 2005. – V. 118. – P. 647-710. 282. Glogauer, M., The role of actin-binding protein 280 in integrin-dependent mechanoprotection / M. Glogauer, P. Arora, D. Chou, P.A. Janmey, G.P. Downey, C.A.G. McCulloch // J. Biol. Chem. – 1998. – V. 273. – P. 1689-1698. 283. Glotzer, M. Animal cell cytokinesis / M. Glotzer // Annu Rev. Cell Dev. Biol. – 2001. – V. 17. – P. 351-386. 284. Glynn, I.M. A hundred years of sodium pumping / I.M.A. Glynn // Annu. Rev. Physiol. – 2002. – V. 64. – P. 1-18. 285. Goffarts, S. Alpha-actin and BAT 1 interaction with cytochrome C promoter upon skeletal muscle differentiation / S. Goffarts, A. Franko, C.S. Clemen, R.J. Weisner // Current. Genetic. – 2006. – V. 49. – P. 125-135. 286. Goldberg, M.W. The nuclear pore complex and lamina: three-dimensional structures and interactions determined by field emission in-lens scanning electron microscopy / M.W. Goldberg, T.D. Allen // J. Mol. Biol. – 1996. – V. 257. – P. 848865. 287. Goldstein, L. Vilume-activated taurine efflux from skate erythrocytes: possible band 3 involvement / L. Goldstein, S.R. Brill // Am. J. Physiol. – 1991. – V. 260. – P. R1014-R1020. 288. Gorlin, J.R. Human endothelial actin-binding protein (ABP280 nonmuscle filamin): a molecular leaf spring / J.R. Gorlin, R. Yamin, M. Egan, M. Stewart, T.P. Stossel, D.J. Kwiatowski // J. Cell Biol. – 1990. – V. 111. – P. 1089-1105. 289. Goslin, K. The role of cytoskeleton in organizing growth cones: a microfilament- 347 associated growth cone component depends upon microtubules for its localization / K. Goslin, E. Birgbauer, G. Banker, F. Solomon // J. Cell Biol. – 1989. – V. 109 (4 Pt.1) – P. 162-1631. 290. Gould, K.L. The protein-tyrosine kinase substrate, p81, is homologous to a chicken microvillar core protein / K.L. Gould, J.A. Cooper, A. Bretscher, T. Hunter // J. Cell Biol. – 1986. – V. 102 (2). – P. 660-669. 291. Gould, S.A.C. From atoms to integrated circuit chips, blood cells, and bacteria with the atomic force microscope / S.A.C. Gould, B. Drake, C.B. Prater, A.L. Weisenhorn, S. Manne, H.G. Hansma, P.K. Hansma // J. Vac. Sci. Technol. – 1990. – V. A8. – P. 369-373. 292. Gӧrlich, D. Transport between the cell nucleus and the cytoplasm / D. Gӧrlich, U. Kutay // Annu. Rev. Call Dev. Biology. – 1999. – V. 15. – P. 607-660. 293. Grajkowski, W. P. Surface changes of the mechanosesitive channels MscS upon its activation, inactivation and closing / W.P. Grajkowski, A. Kubalski, N. Koprowski // Biophysical. J. – 2005. – V. 88. – P. 3050-3059. 294. Grandbois, M. How strong a covalent bond? / M. Grandbois, M. Beyer, M. Rief, H. Clause-Schaumann, H. Gaub // Science. – 1999. – V. 283. – P. 1727-1730. 295. Grandbois, M. Affinity imaging of red blood cells using an atomic force microscope / M. Grandbois, W. Dettman, M. Benoit, H.E. Gaube // The J. of Histochemestry and aytochemestry. – 2000. – V. 48 (5). – P. 719-724. 296. Greenburg, G. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells / G. Greenburg, E.D. Hay // J. Cell Biol. – 1982. – V. 95. – P. 333-339. 297. Grinstein, S. Volume-induced increase of anion permeability in human lymphocytes / S. Grinstein, C.A. Clarke, A. Dupre, A. Rothstein // J. of General Physiol. – 1982a. – V. 80. – P. 801-823. 298. Grinstein, S. Volume regulation by human lymphocytes. Role of calcium / S. Grinstein, A. Dupre, A. Rothstein // The J. of General physiology. – 1982b. – V. 79. – P. 849-868. 299. Grinstein, S. Activation of Na/H changes in lymphocytes by osmotically induced 348 volume changes and by cytoplasmatic acidification / S. Grinstein, C.A. Clarke, A. Rothstein // J. of General Physiol. – 1983. – V. 82. – P. 619-638. 300. Grinstein, S. Response of lymphocytes to anisosmotic media: regulating behavior / S. Grinstein, A. Rothstein, B. Sarkadi, E.W. Gelfand // Amer. J. Physiol. – 1984. – V. 46. – P. C204-C215. 301. Grinstein, S. Mechanism of osmotic activation of Na/H exchange in rat thymic lymphocytes / S. Grinstein, S. Cohen, A. Rothstein // J. of General Physiol. – 1985. – V. 85. – P. 765-787. 302. Grinstein, S. Calcium-independent cell volume regulation in human lymphocytes / S. Grinstein, J.D. Smith // The J. of General physiology. – 1990. – V. 95. – P. 97120. 303. Grinstein, S. Ionic mechanisms of cell volume on regulation in leukocytes / S. Grinstein, J.K. Foskett // Annu. Rev. Physiol. – 1990. – V. 52. – P. 399-414. 304. Grosu, L. Contributions of the CLUG physiology school to the study of capillary permeability for macromolecules / L. Grosu, E. Rosenteld // Rev. Roum. physiol. – 1992. – V.29 (1). – P. 23-31. 305. Groulx, N. Membrane reserves and hypotonic cell swelling / N. Groulx, F. Bourdreault, S.N. Orlov, R. Grygorczyk // J. Memebr. Biol. – 2006. – V. 214. – P. 43-56. 306. Gruia-Gray, J. Alteration to the cytoskeleton of erythrocytes infected with frog erythrocytes virus: a fluorescence and electron microscopic study / J. Gruia-Gray, S.S. Desser // Biochem. Cell Biol. – 1992. – V. 70 (2). – P. 123-128. 307. Grummt, I. Actin and myosin as transcription on factors / I. Grummt // Curr. Opin. Genet. Develop. – 2006. – V. 16. – P. 191-196. 308. Grunay, C. Mapping of the juxtacentromeric heterochromatin-euchromatin frontier of human chromosome 21 / C. Grunay, J. Buard, M.E. Brun, A. De Sario // Genome Res. – 2006. – V. 16. – P. 1198-1207. 309. Grzanka, A. Actin distribution patterns in HL-60 leukemia cells treated with at opposed / A. Granka // Acta Histochem. – 2001. – V. 103. – P. 453-464. 310. Grzanka, A. Cytoskeletal reorganization during process of apoptosis induced by 349 cytostatic drugs in K-562 and HL-60 leukemia cell lines / A. Granka, D. Grzanka, M. Orlikowska // Biochem. Pharmacol. – 2003. – V. 66. – P. 1611-1617. 311. Grzanka, A. Fluorescence and ultrastructural localization of actin distribution patterns in the nucleus of HL-60 and K-562 cell lines treated with cytostatic drugs / A. Granka, D. Grzanka, M. Orlikowska // Oncol. Rep. – 2004. – V. 11. – P, 765-770. 312. Guizouaran, H. Swelling activation of transport pathways in erythrocytes effects of Cl- ionic strength and volume changes / H. Guizouaran, R. Motais // Am. J. Physiol. Cell Physiol. – 1999. – V. 276. – P. 210-220. 313. Gusev, G.P. Activation of the Na+-K+-pump in frog erythrocytesby catecholamines and phosphodiesterase blockers / G.P. Gusev, N.I. Agalakova, A.V. Lapin // Biochem. Pharmacol. – 1996. – V. 52. – P. 1347-1353. 314. Gwack, Y. Signaling to transcription: store-operated Ca2+ entry end NFAT activation in lymphocytes / Y. Gwack, S. Feske, S. Srikanth, P.G. Hogan, A. Rao // Cell Calcium. – 2007. – V. 42. – P. 145-156. 315. Haga, H. Time-lapse viscoelastic imaging of living fibroblasts using force modulation mode in AFM / H. Haga, M. Nagayama, K. Kawabata, E. Ito, T. Ushiki, T. Sambongi // J. Electron Microsc. – 2000. – V. 49 (3). – P. 473-481. 316. Hall, A. Rho GTPases and the control of cell behavior / A. Hall // Biochem. Soc.Trans. – 2005. – V. 33. – P. 891-895. 317. Hamill, O.P. Molecular basis of mechanotransduction in living cells / O.P. Hmill, B. Martinac // Physiol. Rev. – 2001. – V. 81. – P. 685-740. 318. Hansma, P.K. Boimolecular imaging with the atomic force microscopy / P.K. Hansma, J.H. Hoh // Annu. Rev. Bioohys. Chem. - 1994. - V. 23. - P. 1115-1139. 319. Hansma, H.J. Surface biology of DNA by atomic force microscopy /H.J. Hansma // Annu. Rev. Phys. Chem. – 2001. – V. 52. – P. 71-92. 320. Hartwig, J.H. Isolation and properties of actin, myosin and a new actin protein in rabbit alveolar macrophages / J.H. Hartwig, T.P. Stossel // J. Biol. Chem. – 1975. – V. 250. - P. 5696-5705. 321. Hartwig, J.H. Structiure of macrophage actin-binding protein molecules insolution and interacting with F-actin / J.H. Hartwig, T.P. Stossel // J. Mol. Biol. – 350 1981. – V. 145. – P. 563-581. 322. Hazama, A. Ca2+- sensitivity of volume- regulatory K+ and Cl- - channels in cultured human epithelial cells / A. Hazama, Y. Okada // J. of Physiology. – 1988. – V. 402. – P. 687-702. 323. Heasman, S.J. Mammalian Rho GTPase: new insights in to their functions from in vivo studies / S.J. Heasman, A.J. Ridley // Nat. Rev. Moll. Cell Biol. – 2008. – V. 9. – P. 690-701. 324. Hendill, K.B. Cell volume regulation in Ehrlich ascities tumor cells / K.B. Hendill, E.K. Hoffman // J. Cell Physiol. – 1974. – V. 84. – P. 115-126. 325. Hinterdorfer, P. Detection and localization of individual antibody-antigen recognition events by atomic force microscopy / P. Hinterdorfer, W. Baumgartner, H.J. Gruber, K. Schilcher, H. Schindler // Proc. Acad. Sci. USA. – 1996. – V. 93. – P.3477-3481. 326. Hilpela, P. Regulation of the actin cytoskeleton by PI(4,5)P2 and PIP(3,4,5)P3 / P. Hilpela, M.K. Vartiainen, P. Lappalainen // Curr. Top Microbiol. Immunol. – 2004. – V. 282. – P. 117-163. 327. Hodges, G.M. A scanning electron microscope study of cell surface and cell contacts of “spantaneously” trnansformed cell in vitro / G.M.A. Hodges // Eur. J. Cancer. – 1970. – V. 6. – P. 235-239. 328. Hofer, D. Sorting of actin isoforms in chicken auditory hair cells / D. Hofer, W. Ness, D. Drenckhahn // J. Cell Sci. – 1997. – V. 110. – P. 765-770. 329. Hofman, U.G. Investigating the cytoskeleton of chicken cardiocytes with the atomic force microscope / U.G. Hofman, C. Rotch, W.J. Parak, M. Radmacher // J. Struct. Biol. – 1997. – V. 119. – P. 84-91. 330. Hoffman, E.K. Volume-induced increase of K+ and Cl- - permeabilities in Ehrlich ascites tumor cells role of internal Ca2+ / E.K. Hoffman, L.O. Simonsen, I.H. Lambert // J. of Membrane Biology. – 1984. – V. 78. – P.211-222. 331. Hoffman, E.K. Volume-dependent NaCl cotransport and volume-induced increase in K+ and Cl- permeability in Ehrlich cells / E.K. Hoffman // Federation Proceeding. – 1985. – V. 44. – P. 2513-2519. 351 332. Hoffman, E. K. Taurine transport associated with the cell volume regulation in floured erythrocytes under anisoosmotic conditions / E.K. Hoffman, S.M. Thoroed // J. Physiol. Sci. Lond. – 1986. – V. 374. – P. 245-261. 333. Hoffman, E.K. Anion transport system in the plasma membrane of vertebrate cells / E.K. Hoffman //Biochem. et Biophys. Acta. – 1986. – V. 864. – P. 1-31. 334. Hoffman, E.K. Mechanisms in volume regulation in Ehrlich ascities tumor cells / E.K. Hoffman, I.H. Lambert, L.O. Simonsen // Renal Physiol. Biochem. – 1988. – V. 11. – P. 221-247. 335. Hoffman, E.K. Membrane mechanisms in volume and pH regulation in vertebrate cells / E.K. Hoffman, L.O. Simonsen // Physiol. Rev. – 1989. – V. 69. – P. 315-382. 336. Hoffman, E.K. Cell volume regulation: intracellular transmission / E.K. Hoffman, L.O. Simonsen, I.H. Lambert // Adv. Comp. Env. Physiol. – 1993. – V. 14. – P. 187248. 337. Hoffman, E.K. Intracellular signaling involved in volume regulatory decrease / E.K. Hoffman // Cell Physiol. Biochem. – 2000. – V. 10. – P. 273-288. 338. Hoffman, E.K. Physiology of cell volume regulation in vertebrates / E.K. Hoffman, I.H. Lambert, S.F. Pedersen // Physiol. Rev. – 2009. – V. 89 (1). – P. 1936277. 339. Hoh, J. Friction affects on force measurements with an atomic force microscope / J. Hoh, A. Angel // Langmuir. – 1993. – V. 9. – P. 3310-3312. 340. Holt, P.J.L. Surface structure of normal and leukaemic lymphocytes / P.J.L. Holt, S.C. Pal, D. Catovsky, S. Lewis // Clin. Exp. Immunol. – 1972. – V. 10. – P. 555570. 341. Hoock, T.C. β-Actin and its mRNA are localized at the plasma membrane and the regions of moving cytoplasm the cellular response to injury / T.C. Hook, P.M. Newcamb, I. Herman // J. Cell Biol. – 1991. – V. 112. – P. 653-654. 342. Hoogenraad, C.C. Functional analysis of CLIP-115 and its binding to microtubules / C.C. Hoogenraad, A. Akhmanova, F. Grosveld, C.I. De Zeeuw, N. Galjart // J. Cell Sci. – 2000. – V. 13 (12). – P. 2285-2297. 343. Hoth, M. Depletion of intracellular calcium stores activates a calcium current in 352 mast cells / M. Hoth, R. Penner // Nature. – 1992. – V. 355. – P. 353-356. 344. Hozn, N.A. Epinephrine enchanges platelet – neutrophil adhesion in whole blood in vitro / N.A. Hozn, D.M. Anatase, K.E. Hecker, J.H. Baumert, T. Robizsch, R. Rossaint // International Anasthesia Research Society (Anesth. Annal.) – 2005. – V. 100. – P. 520-526. 345. Huang, J.D. Direct interaction of microtubule- and actin-based transport motors / J.D. Huang, S.T. Brady, B.W. Richards, D. Stenolen, J.H. Resau, N.G. Copeland, N.A. Jenkins // Nature. – 1999. – V. 397(6716). – P. 267-270. 346. Hüttelmaier, S. The interaction of cell-contact proteins VASP and vinculin is regulated by phosphatidylinositol-4,5-biphosphate / S. Hüttelmaier, O. Mayboroda, B. Harbeck, T. Jarchou, B.M. Jockusch, M. Rudiger // Curr. Biol. – 1998. – V. 8. – P. 479-488. 347. Imai, K. The plekstrin homology domain of the Wiskott-Aldrich syndrome protein is involved in the organization / K. Imai, S. Nonoyama, H. Miki, T. Morio, K. Fukami, Q. Zhu, A. Aruffo,H.D. Ochs, J. Yata, T. Takenawa // Clin. Immunol. – 1999. – V. 92. – P. 128-137. 348. Ingber, D. Mechanochemical switching between growth and differentiation during fibroblast growth factor-stimulated angiogenesis in vitro: role of extracellular matrix / D. Ingber, J. Folkman // J. Cell Biol. – 1989. – V. 109. – P. 317-330. 349. Ingber, D.E. Opposing views on tensegrity as a structural framework understanding cell mechanics / D.E. Ingber // J. of Applied. Physiology. – 2000. – V. 89. – P. 1663-1670. 350. Ingber, D.E. Mechanical signaling and the cellular response to extracellular matrix in angiogenesis and cardiovascular physiology / D.E.Ingber // Circ. Res. – 2002. – V. 91. – P. 877-887. 351. Insall, R.H. Actin dynamics at the leading edge: From simple machinery to complex networks / R.H. Insall, L.M. Machesky // Dev. Cell. – 2009. – V. 17. – P. 310-322. 352. Islam, D. Peripheral blood cell, preparation influences level of expression of leukocyte cell surface markers as assessed with quantitative multicolor flow 353 cytometry / D. Islam, A. Lindberg A., B. Christensson // Cytometry. – 1995. – V. 22. – P. 128-134. 353. Ito, T.K. Nonideality of volume flows and phase transitions of F-actin solutions in response to osmotic stress / T.K. Ito, K.S. Zaner, T.P. Stossel // Biophys. – 1987. – V.51. – P. 745-753. 354. Ito, T. Regulation of water flow by actin-binding protein-induced actin gelation / T. Ito, A. Suzuki, T.P. Stossel // Biophys. J. – 1992. – V. 61. – P. 1301-1305. 355. Itoh, T. Mechanisms of membrane deformation by lipid-binding domains / T. Itoh, T. Takenawa // Prog. Lipid. Res. – 2009. – V. 48. – P. 298-305. 356. Jackson, P.S. The volume-sensitive organic osmolyte-anion channel VSOAC in regulated by nonhydrolytic ATP binding / P.S. Jackson, R. Mortison, K. Strange // Am. J. Physiol. (Cell Physiol. 36). – 1994. – V. 267. – P. C1203-C1209. 357. Jackson, P.S Swelling – activated anion conductance in skate hepatocytes: regulation by cell Cl and ATP / P.S. Jackson, K. Churchwell, M. Ballatori, J.L. Boyer, K. Strange // Am. J. Physiol. (Cell Physiol. 39). – 1996. – V. 270. – P. C57C66. 358. Janis, R.A. Drug action and cellular calcium regulation / R.A. Jains, P.J. Silver, D.J. Triggle // Adv. Drug Res. – 1987. – V. 16. – P. 309-591. 359. Janmey, P.A. Kinetics of actin monomer exchange at the slow growing ends of actin filaments and their relation to elongation of filaments shortened by gelsolin / P.A. Janmey, T.P. Stossel // Muscle Res. Cell Motil. – 1986. – V. 7. – P. 445-454. 360. Janmey, P.A. Resemblance of actin-binding protein-actin gels to covalently cross linked networks / P.A. Janmey, S. Hvidt, J. Lamb, T.P. Stossel // Nature (Lond). – 1990. – V. 345. – P. 89-92. 361. Jarvis, S.P. Tip-surface interactions studied using a force controlled atomic force microscope in ultrahigh vacuum / S.P. Jarvis, S.I. Jamamoto, H. Jamada, H. Tokumoto, J.B. Pethica // Appl. Phys. Lett. – 1997. – V. 70. – P. 2238-2240. 362. Johnson, G.L. Role of beta-adrenergic receptors in catecholamine-induced desensitization of adenylate cyclase in human astrocytoma cells / G.L. Johnson, B.B. Wolte, T.K. Harden T.K, P.B. Molinoff, J.P. Perkins // J. Biol. Chem. – 1978. – V. 354 253. – P. 1472-1480. 363. Johnson, R.P. F-actin binding site masked by the intramolecular association of vinculin head and tail domains / R.P. Johnson, S.W. Craig // Nature. – 1995. – V. 373. – P. 261-264. 364. Johnson, R.P. Actin activates a cryptic dimerization potential of the vinculin tail domain / R.P. Johnson, S.W. Craig // J. Biol. Chem. – 2000. – V. 275. – P. 95-105. 365. Johnson, M.W. Hypoxia induced changes in lung fluid balance in humans is associated with beta-2-adrenergic receptors density of lymphocytes / M.W. Johnson, B.J. Taylor, M.L. Hulsebus, B.D. Johnson, E.M. Shyder // Respir. Physiol. Neurobiol. – 2012. – V. 183 (2). – P. 159-165. 366. Joseph-Silverstein, J.A. Taxol-induced stabilization and reassembly of functional marginal bands in erythrocytes at 00C / J.A. Joseph-Silverstein, W.D. Cohen // J. Cell Biol. – 1983. – V. 97. – P. 212a. 367. Kageyama, K. The maximum and minimum water content and cell volume of human erythrocytes in vitro / K. Kageyama, Y. Onoyama, H. Kogawa, E. Gato, K. Tanolec // Biophys. Chem. – 1989. – V. 34. – P. 79-82. 368. Kaiser, G. Identification and quantification of β-adrenoreceptor sites in red bload cells from rats / G. Kaiser, G. Wiemer, G. Kremer, J. Dietz, D. Palm // NaunynSchmiedeberg’s Arch. Pharmac. – 1978. – V. 305. – P. 41-50. 369. Kaloyianni, M. The adrenergic responses of Rana Ridibunda red bload cells: effect of hypoxia / M. Kaloyianni, A. Rasidaki // J. Exp. Zool. – 1996. – V. 276. – P. 175-185. 370. Kaloyianni, M. Metallic effects and cellular volume response induced by noradrenaline in nucleated erythrocytes / M. Kaloyianni, G. Giannisis, P. Gavriil, A. Boukla // J. Exp. Zool. – 1997. – V. 279. – P. 357-346. 371. Kaloyianni, M. Influence noradrenaline on the respiratory status, of Rana Balcanica red cell suspension under normoxia, hypoxia and hypercapnia: alpha 1receptor involvement / M. Kaloyianni, N. Giagtroglu, D. Economidis // Cytobios. – 1999. – V. 98. – P. 77-94. 372. Kaloyianni, M. Adrenergic regulation of Rana Balcanica erythrocytes pyruvate 355 kinase / M. Kaloyianni, C. Cotoglou, N. Giagtzoglou N. // J. Comp. Physiol. B. – 2000a. – V. 170. – P. 85-90. 373. Kaloyianni, M. Metabolic effect induced by epinephrine in Rana Balcanica erythrocytes under normoxic and hypoxic conditions / M. Kaloyianni, I. Papaefthimion, V. Simeonidon // Cell Biochem. Funct.– 2000b. – V. 18. – P. 187199. 374. Kaloyianni, M. Effect of adrenaline on glucose transport in red cells of Rana Balcanica / M. Kaloyianni, I. Doukakis // Gen. Physiol. Biophys. – 2003. – V. 22. – P. 69-80. 375. Kamruzzaham, A.S.M. Imaging morphological details and pathological differences of red blood cells using tapping-mode AFM / A.S.M. Kamruzzaham, F. Keinberg , M.S. Cordula, J. Berg, R. Huss // Biol. Chem. – 2004. – V. 385. – P. 955960. 376. Kasas, S. Biological applications of the AEM: from single molecules to organs / S. Kasas, N.H. Thonson, B.L. Smith, P.K. Hansma, J. Miklossy, H.G. Hansma // Int. J. Imaging Syst. Tehnd. – 1997. – V. 8. – P. 151-161. 377. Kasas, S. Superficial and deep changes of cellular mechanical properties following cytoskeleton disassembly / S. Kasa, X. Wang, H. Hirling, R. Marsault, R. Huni R. // Cell motility and the cytoskeleton. – 2005. – V. 62. – P. 124-132. 378. Kaul, S.C. Identification of a 55-kDa ezrin-telated protein that induces cytoskeletal changes and localizes to the nucleolus / S.C. Kaul, R. Kawai, H. Natura, Y. Mitsui, R.R. Reddel, R. Wadhwa // Exp. Cell Res. – 1999. – V. 250. – P. 51-61. 379. Kebabian, J.M. Rapid changes in rat pineal beta adrenergic receptors: Alteration in 1-[3H]alprenolol binding and adenylate cyclase / J.M. Kebabian, J. Kutz, A. Romero, J. Axelrod // Proc. Natl. Acad. Sci USA. – 1975. – V. 72. – P. 3735-3739. 380. Kedrin, D. Cell motility and cytoskeletal regulation in invasion and metastasis / D. Kedrin, J.van Rheenen, L. Hernandez, J. Condeelis, J.E. Segal // J. Mammary Gland Biol. Neoplasia. – 2007. – V. 12 (2-3). – P. 143-152. 381. Kellouche, S. Initial formation of IGROV1 ovarian cancer cells aggregates involves vitronectin / S. Kellouche, J. Fernandes, J. Leroy-Dudal, O. Gallet, L. 356 Poulain, F. Carreiras // Tumor Biology. – 2010. – V. 31(2). – P.129-39. 382. Khaitlina, S.Yn. Correlation between conformational changes and polymerizability in scallop β-like actin and skeletal muscle α-actin / S.Yn. Khaitlina, O.Yn. Antropova, I.M. Kuznetsova, K.K. Turoverov, J.H. Collins // Arch. Biochem. – 1999. – V. 368. – P. 105-111. 383. Khaitlina, S.Yn. Comparison of rabbit skeletal muscle α-actin and scallop adductor muscle β-like actin at different steps of spontaneous and gelsolin inducednucleated polymerization / S.Yn. Khaitlina, H. Hinssen // J. Muscle Res. Cell Motility. – 2000. – V. 21. – P.349. 384. King, L.E. Calcium effect on human erythrocytes membrane proteins / L.E. King, M. Morrison // Biochim. Biophys. Acta. – 1977. – V. 471. – P. 162-168. 385. Kinne, R.K.H. The role of organic osmolytes in osmoregulation: from bacteria to mammals/ R.K.H. Kinne // J. Exp. Zool. – 1993. – V. 256. – P. 346-355. 386. Kirk, K. Transport of organic substrates via a volume-activated channel / K. Kirk, J.C. Ellory, J.D. Joung // J. Biol. Chem. – 1992. – V. 267. – P. 23475-23478. 387. Kiseleva, E. The nuclear pore complex: structure, function and dynamics / E. Kiseleva, M.W. Goldberg, J. Cronshaw, T.D. Allen // Crit. Rev. Encar. Gene. Exp. – 2000. – V. 10. – P. 101-112. 388. Kiseleva, E. Actin- and protein-4.1-containing filaments pore complexes to subnuclear organelles in Xenopus oocyte nuclei / E. Kiswlwva, S.P. Drummond, M.W. Goldberg, S.A. Rutherford, T.D. Allen, K.L. Wilson // J. Cell Sci. – 2004. – V. 1177. – P. 2481-2490. 389. Kislauskis, E.H. β-actin messenger RNA localization and protein synthesis augment cell mobility / E.H. Kislauskis, X. Zhu, R.H. Singer // J. Cell Biol. – 1997. – V. 136. – P. 1236-1270. 390. Kohl, P. Mehanoelectric feedback in cardiac cells / P. Kohl, F. Sachs // Philos. Trans. R. Soc. Lond. B. Biol. Sci. – 2001. – V. 359. – P. 1173-1185. 391. Kohm, A.P. Norepinephrine and β2-adrenergic receptor stimulation regulate CD4+T and B lymphocyte function in vitro and in vivo 0 A.P. Kohm, V.M. Sanders // Pharmacologycal Reviews. – 2001. – V. 53. (4). – P. 487-525. 357 392. Kolajova, M. Developmentally regulated cell cycle depended of swelling activated anion channel activity in the mouse embryo / M. Kolajova, M.A. Hammer, J.L. Collins, J.M. Baltz // Development. – 2001. – V. 128. – P. 3427-3434. 393. Kolena, J. Osmolytes improve the reconstitution of luteinizing hormone/human chorionic gonadotropin receptors into proteoliposomes / J. Kolena, K. Matejcikova, G. Srenkelava // Moll. Cell Endocrinol. – 1992. – V. 83. – P. 201-209. 394. Komarova, Y.A. Life cycle of MTs: persistent growth in the cell interior, asymmetric transition frequencies and effects of the cell boundary / Y.A. Komarova, I.A.Vorobjev, G.G. Borisy // J. Cell Sci. – 2002. – V. 15. – P. 3527-3539. 395. Kondratev, D. Increments in the concentrations of sodium and calcium in cell compartments of stretched mouse ventricular myocytes / D. Kondratev, M.F. Giallitelli // Cell Calcium. – 2009. – V. 34. – P. 193-203. 396. Krause, M. Fyn-binding protein (Fyb)/SLP-76-associated protein (SLAP), Ena/vasodilator- stimulated phosphoprotein (VASP) proteins and the Arp2/3 complex link T cell receptor (TCR) signaling to the actin cytoskeleton / M. Krausw, A.S. Scehi, M. Konradt, D. Monner, F.B. Gertler, J. Wehland // J. Cell Biol. – 2000. – V. 149. – P. 181-194. 397. Kregenow, F.M. The response of duck erythrocytes to nonhemolytic hypotonic media. Evidence for a volume- controlling / F.M. Kregenow // J. of General physiology. – 1971. – V. 58. – P. 372-395. 398. Kregenow, F.M. Osmoregulatory salt transporting mechanism: control of cell volume in anisotonic media / F.M. Kregenow // Annual Review of Physiology. – 1981. – V. 43. – P. 493-505. 399. Kroll, A.Yn. Local mechanical oscillations of the cell surface within range 0.23.0 Hrz / A.Yn. Kroll, M.G. Grinfeldt, S.V. Levin, A.O. Smilgavichus // Eur. Biophys. J. – 1990. – V. 19. – P. 93-99. 400. Kung, C. Solute sensing is solvent sensing, a speculation / C. Kung, Y. Saimi // J. Eukaryot. Microbiol. – 1995. – V. 42. – P. 199-200. 401. Kung, C. A possible unifying principle for mechanosensation / C. Kung // Nature. – 2005. – V. 436. – P. 647-654. 358 402. Kuriyama, R. CHOI, a mammalian kinesin-like protein, interacts with F-actin and is involved in the terminal phase of cytokinesis / R. Kuriyama, C. Gustus, Y. Terada, Y. Uetake, J. Matuliene // J Cell Biol. – 2002. – V. 156(5). – P. 783-790. 403. Kuznetsova, T.G. Atomic force microscopy probing of cell elasticity / T.G. Kuznetsova, M.N. Starodubtseva, N.I. Yegorenkov, S.A. Chizhik, R.I. Zhdanov // Micron. – 2007. – V. 38. – P. 824-833. 404. Kwon, M.S. Novel nuclear localization signal regulated by ambient tonicity in vertebrates / M.S. Kwon, S.D. Lee, J.A. Kim, E. Colla,Y.J. Choi, P.G. Suh // The J. of Biological Chemistry. – 2008. – V. 283. – P. 22400-22409. 405. Lackington, I. Inhibition of calcium-activated potassium conductance of human erythrocytes by calmodulin inhibitory drugs / I. Lackington, M. Orrego // FEBS Lett. – 1981. – V. 133. - №1. – P, 103-106. 406. Lagana, A. Regulation of the formation of tumor cell pseudopodia by the Na +/H+ exchanger NHE1 / A. Lagana, J. Vadnais, P.U. Le, T.N. Nguyen, R. Laprade, I.R. Nabi, J. Noel // J. Cell Sci. – 2000. – V. 113. – P. 3649-3662. 407. Lambert, I.H. Eicosanoids and cell volume regulation / I.H. Lambert // Cellular and molecular physiology of cell volume regulation / ed. K. Strange. – Boca Raton: CRC Press, 1994. – P. 273-292. 408. Land, F. The diversity of volume regulatory mechanisms / F. Land, G.L. Bush, H. Volke // Cell Physiol. Biochem. – 1998. – V.8. – P. 1-45. 409. Landmann, R. Beta-adrenerguc receptors in human leucocyte population / R. Landmann // Eur. Clin. Invest. – 1992. – V. 1. – P. 30-36. 410. Lands, A.M. Differentiation of receptor systems activated by simpathomimetic amines / A.M. Lands, A. Armold, J.P. McAuliff, F.P. Luduena, T.G.Jr. Brown // Nature. – 1964. – V. 214. – P. 597-598. 411. Lang, F. Regulating cell volume / F. Lang, S. Waldegger // Am. Sci. – 1997. – V. 85. – P. 456-463. 412. Lang, F. Functional significance of cell volume regulatory machanisms / F. Lang, G.L. Busch, M. Ritter, H. Volkl, S. Waldeggers, E. Gulbins, D. Haussinger // Physiol. Rev. – 1998. – V. 78. – P.247-306. 359 413. Lang, F. The involvement of caspases in the CD95 (Fas/Apo-1) but not swellinginduced cellular taurine release from Jurkat T-lymphocytes / F. Lang, J. Madlung, D. Siemen, C. Ellory, A. Lepple-Wienhues, E. Gulbins. // Pflügers Arch. – 2000. – V. 440. –P. 93-99. 414. Larson, M. Volume regulation by Nectures gallbladder: basolateral KCl exit / M. Larson, K.M. Spring // J. of Membrane Biology. – 1984. – V. 81. – P.219-232. 415. Larrson, H. The effect of divalent cations on the interactions between calf spleen profiling and different actins / H. Larrson, U. Lindberg // Biochem. Biophys. Acta. – 1988. – V. 953. – P. 95-105. 416. Lassing, I. Specific interaction between phosphatidylinositol 4,5-biphosphate and profilactin / I. Lassing, U. Lindberg // Nature. – 1985. – V. 314. – P. 472-474. 417. Lassing, I. Specificity of the interactions between phosphetidylinositol 4,5biphosphate and the profiling-actin complex / I. Lassing, U. Lindberg // J. Cell Biochem. – 1988a. – V. 37. – P. 255-267. 418. Lassing, I. Evidence that the phosphatidylinasitol cycle is linked to cell motility / I. Lassing, U. Lindberg // Exp. Cell Res. – 1988b. – V. 174. – P. 1-15. 419. Lauf, P.K. K+:Cl- cotransport: sulfhydryls, divalent cations. And the mechanism of volume activation in a red cell / P.K. Lauf // J. of Membrane biology, - 1985. – V. 88. – P. 1-13. 420. Lauf, P.K. Erythrocyte K-Cl cotransport: properties and regulation / P.L. Lauf, J. Bauer, N. Adrogna // Am. J. Physiol. – 1992. – V. 263. – P. C917-C932. 421. Law, R.O. Amino acids as volume-regulatory osmolytes in mammalian cells/ R.O. Law // Comp. Biochem. Physiol. A. Physiol. – 1991. – V. 99. – P. 263-277. 422. Le Clainche, C. Regulation of actin assembly associated with protrusion and adhesion in cell migration / C. Le Clainche, M.F. Carlier // Physiol. Rev. – 2008. – V. 88. – P. 489-513. 423. Leite, M.V. Ca2+ ionophore and phorbolester stimulate taurine efflux from skate erythrocytes / M.V. Leite, L. Goldstein // J. exp. Zool. – 1987. V. 242. – P 95-87. 424. Leng, Y. Molecular charge mapping with the electrostatic force microscope / Y. Leng, C.C. Williams // SPIE Scann Probe Micros II. – 1993. – V. 1855. – P. 35-39. 360 425. Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves av integrins and the participation of MMP2 / J. Leroy-Dudal, C. Demeillers, O. Gallet, E. Pauthe, R. Agniel, P. Gauduchon, F. Carreiras //International Journal of Cancer. – 2005. – V. 114(4). – P. 531-543. 426. Le Tulzo, Y. Hemorrhage increases cytokine expression in lung mononuclear cels in mice: involvement of catecholamines in nuclear factor-kappa B regulation and cytokine expression / Y. Le Tuzo, R. Shenkar, D. Kaneko // J. Cell Invest. – 1997. – V. 99. – P. 1516-1524. 427. Levee, M.G. Actin polymerization and depolymerization during apoptosis in HL60 cells / M.G. Levee, M.I. Dabrowska, J.L. Lelli, D.B. Hinshaw // Am. J. Physiol. – 1996. – V. 271. – P. C1981-C1992. 428. Levin, S.V. Membrane fluctuations in erythrocytes are linked to Mg ATPdependent dynamic assembly of the membrane skeleton / S.V. Levin, R. Korenstein // Biophys. J. – 1991. V. 60. – P. 733-737. 429. Levitan, L. Modulation of a volume-regulated chloride current by F-actin // L. Levitan, C. Almonte, P. Mollard, S.S. Garber // J. Membr. Biol. – 1995. – V. 147. –P. 283-294. 430. Lewis, S.A. Ion channels and cell volume regulation: chaos in an organized system / S.A.Lewis, P. Donaldson // News Pharmacol. Sci. – 1990. – V. 5. – P. 112119. 431. Light, D.B. Cell swelling increases intracellular calcium in Nectures erythrocytes / D.B. Light, A.J. Attwood, C. Siegel, L. Baumann // J. of Cell Science. – 2002. – V. 116. – P. 101-109. 432. Lin, E.G. A novel method to study the electrodynamic behavior of actin filaments evidence for cable-like properties of actin / E.G. Lin, H.F. Cantiello // Biophysical J. – 1993. – V. 65. – P. 1371-1378. 433. Lo, C.M. Cell movement is guided by the rigidity of the substrate / C.M. Lo, H.B. Wang, M. Dembo, J.L. Wang // Biophys. J. – 2000. – V. 79. – P. 144-152. 434. Lorand, L. Degradation of transmembrane proteins in Ca2+-enriched Human erythrocytes / L. Lorand, O.J. Bjerrum, M. Hawkins, L. Lowe-Krentz, G.E. Seifing // 361 J. Biol. Chem. – 1983. – V. 258 (8). – P. 5300-5305. 435. Low, S.Y. Modulation of glycogensythesis in rat skeletal muscle by changes in cell volume / S.Y. Low, M.J. Rennie, P.M. Taylor // J. of Physiology. – 1996. – V. 495 (2). – P. 292-303. 436. Loy, C.J. Filamin-A fragment localizes to the nucleus to regulate androgene receptor and coactivator functions / C.J. Loy, K.S. Sim, E.L. Yong // PNAS. – 2003. – V. 100. – P. 4562-4567. 437. Lytle, C. Coordinate modulation of Na-K-2Cl cotransport and K-Cl-cotransport by cell volume and chloride / C. Lytle, T. McManus // Am. J. Cell Physiol. – 2002. – V. 283 (5). – P. C1422-1431. 438. Macara, I.G. Transport into and out of the nucleus / I.G. Macara // Micro. Biol. Mol. Rev. – 2001. – V. 65. – P. 570-594. 439. Mahaffy, R.E. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy / R.E. Mahaffy, S. Park, E. Gerde, J. Kӓs, S.K. Shin // Biophys. – 2004. – V. 86. – P. 1777-1793. 440. Malapert, M. Regulation of Na+/H+ antiporter in trout red blood cells / M. Malpert, H. Guizouaran, B. Fievet, R. Jahns, F. Garcia-Romey, R. Motais, F. Borgese // J. Exp. Biol. – 1997. V. 200 (Pt. 2). – P. 353-360. 441. Mandato, C.A. Microtubule-actomyosin interactions in cortical flow and cytokinesis / C.A. Mandato, H.A. Benink, W.M. Bernent // Cell Motil Cytoskeleton. – 2000. – V. 45(2). – P. 87-92. 442. Mandelkow, E.M. Microtubule dynamics and microtubule caps: a time-resolved cryo-electron microscopy study / E.M. Mandelkow, E. Mandelkow, R.A. Milligan // J. Cell Biol. – 1991. – V. 114(5). – P. 977-991. 443. Manne, S, Molecular organization of surfactants at solid-liquid interfaces / S. Manne, H.E. Gaube // Science. – 1995. – V. 270. – P. 1480-1482. 444. Marakhova, I.I. Interleukin-2-dependent regulation of Na/K pump in human lymphocytes / I.I. Marakhova, I.A. Karitskay, N.D. Aksenov, V.V. Zenin, T.A. Vinogradova // FEBS Lett. – 2005. – V. 579. – P. 2773-2780. 445. Margalit, A. Hepoxilin A2 is the endogenous lipid mediator opposing hypotonic 362 swelling of human intact platelets / A. Margalit, Y. Sofer, S. Grossman, D. Reynaud, C.R. Pace-Asciak, A.A. Livne // Proc. Nath. Acad. Sci. USA. – 1993. – V. 90. – P. 2589-2592. 446. Marshall, W.H. Continuous cinematography of human lymphocytes cultured with a phytohaemagglutinin including observations on cell division and interphase / W.H. Marshall, K.B. Roberts // Quart. J. Pgysiol. – 1965. – V. 50. – P. 361-374. 447. Marti, O. Friction and force on an atomic scale / O. Marti, J. Colchero, Mlynek J. // Nanotechnology. – 1990. – V. 1. – P. 141-144. 448. Martin, O.C. Xgrip l09: a gamma tubulin-associated protein with an essential role in gamma tubulin ring complex (gammaTuRC) assembly and centrosome function / O.C. Martin, R.N. Gunawardane, A. Iwamatsu, Y. Zheng // J. Cell Biol. – 1998. – V. 141(3). – P. 675-687. 449. Martinac, B. Mechanosensitive ion channels: biophysics and physiology / B. Martinac // Thermodynamics of membrane receptors and channels / ed. M.B. Jackson. – Boca Raton: CRC Press, 1993. – P. 327-351. 450. Martinac, B. Mechanosensetive ion channels: molecules of mechanotransduction / B. Martinac // J. of Cell Science. – 2004. – V. 117. – P. 2449-2460. 451. Mason, R.P. Effects of calcium channel blockers on cellular apoptosis / R.P. Mason // Cancer. – 1999. – V. 85 (10). – P. 2093-2102. 452. Matsui, T. Activation of ERM proteins in vivo by Rho involves phosphatidylinosytol-4-phosphate 5-kinase and not ROCK kinases / T. Matsui, S. Yonemura, S. Tsukita, S. Tsukita // Curr. Biol. – 1999. – V. 9. – P. 1259-1262. 453. Mazzocci, C. Interaction of epithelial ion channels with the actin based cytoskeleton / C. Mazzocci, D.J. Benos, P.R. Smith // Amer. J. Physiol. Renal. Physiol. – 2006. – V. 291. – P. F1113-1122. 454. McCarty, N.A., Calcium signaling in cell volume regulation / N.A. McCarty, R.G. O’Neil // Physiol. Rev. – 1992. – V. 72. – P. 1037-1061. 455. McFarland, W. Functional anatomy of the lymphocyte in immunological reactions in vitro / W. McFarland, D.H. Helman, J.E. Moorhead // J. Exp. Med. – 1966. – V. 124. – P. 851-858. 363 456. McLeod, R.J. Ca2+/calmodulin kinase II and decreases in intracellular pH are required to active K+ channels after substantial swelling in villus epithelial cells / R.J. McLeod, J.R. Hamilton // J. Membr. Biol. – 1999. – V. 172. – P. 59-66. 457. McLean, L.A. Cloning and expression of the Na+/H+ exchanger from Amphiuma RBCs resemblance to mammalian NHE1 / L.A. McLean, S. Zia, F.A. Gorin, P. Cala // Am. J. Physiol. – 1999. – V. 276. – P. C1025-1037. 458. McMahon, H.T. Membrane curvature and mechanisms of dynamic cell membrane remodeling / H.T. McMahon, J.L. Gallop // Nature. – 2005. – V. 438. – P. 590-596. 459. McManus, M.L. Regulation of cell volume in health and disease / M.L. McManus, K.B. Churchwell, K. Strange // New Engl. J. Medicine. – 1995. – V. 333. – P. 1260-1266. 460. Mela, M.J. Elastic mathematical theory of cells and mitochondria in swelling process. I. The membranous stress and modulus of elasticity of sea urchin eggs / M.J. Mela // Biophys. J. – 1967. – V. 7. – P. 95-101. 461. Michaelis, T.W. Surface morphology of human leucocytes / T.W. Michaelis, N.R. Larrimer, E.N. Metz, S.P. Balcerzak // Blood. – 1971. – V. 37. – P. 23-30. 462. Michison, T. Dynamic instability of microtubule growth / T. Michinson, M. Kirschner // Nature. – 1984. – V. 312. – P. 237-242. 463. Mickey, J.V. Subsensitivity of adenylate cyclase and decreased beta-adrenergic receptor binding after chronic exposure to (-) isoproterinol in vitro / J.V. Mickey, R. Tate, R.J. Lefkowitz // J. Biol. Chem. – 1975. – V. 250. – P. 5727-5729. 464. Miki, H. N-WASP, a novel actin-depolymerizing protein, regulates the cortical cytoskeletal rearrangement in a PIP2-dependent manner downstream of tyrosine kinases / H. Miki, K. Miura, T. Takenava T. // EMBO J. – 1996. – V. 15. – P. 53265335. 465. Miki, H. pH domains in WASP- a bug in the system? / H. Miki, T. Takenawa // Trends Cell Biol. – 1999. – V. 9. – P. 212. 466. Mills, J.W. The cell cytoskeleton: possible role in volume control / J.W. Mills // Current Topics Membrane Trans. – 1987. – V. 90. – P. 75-101. 364 467. Mills, J.W. Evidence for the role of actin filaments in regulating cell swelling / J.W. Mills, E.M. Schwiebert, B.A. Stanton // J. Exp. Zool. – 1994. – V. 268. – P. 111-120. 468. Mills, J.W. The cytoskeleton and cell volume regulation / J.W. Mills, E.M. Schwiebert, B.A. Stanton // Cellular and molecular physiology of cell volume regulation / ed. K. Strange. – Boca Raton: CRC Press, 1994a. – P. 241-258. 469. Minakuchi, R. Delineation of the mechanisms of inhibition of Tall activation by PGE2 / R. Minakuchi, M. Wacholtz, L. Davis // J. Immunol. – 1990. – V. 145. – P. 2612-2625. 470. Minton, A.O. Influence of macromolecular crowding upon the stability and state of association of proteins: predictions and observation / A.O. Minton // J. Pharm. Sci. – 2005. – V. 94. – P. 1668-1675. 471. Miralles, F. Actin in transcription and transcription regulation / F. Miralles, N. Visa // Curr. Opin. Cell Biol. – 2006. – V. 18. – P. 261-266. 472. Misteli, T. Concepts in nuclear architecture / T. Misteli // Bio Essays. – 2005. – V. 27. – P. 477-487. 473. Mittelman, L.S. Fast cell membrane displacements in B lymphocytes: Modulation by dihydrocytochalasin B and colhicine / L.S. Mittelman, S. Levin, R. Korenstein // FEBS. – 1991. – V. 293. – P. 207-210. 474. Mittelman, L.S. Direct correlation between cell membrane fluctuations, cell filterability and metastatic potential of lymphoid cell lines / L.S. Mittelman, S. Levine, H. Verchucren, P. De-Baetselier, R. Korenstein // Biochem. Biophys. Res. Commun. – 1994. – V. 203. – P. 899-906. 475. Mogensen, M.M. Microtubule minus-end anchorage at centrosomal and noncentrosomal sites: the role of ninein / M.M. Mogensen, A. Malik, M. Piel, V. Bouckson-Castaing, M. Bornens // J. Cell Sci. – 2000. – V. l13 (Pt 17). – P. 30133023. 476. Mohanty, M.J. Hypotonic swelling-induced Ca2+ release by an IP3-intensive Ca2+store / M.J. Mohanty, M. Ye, X. Li, N.F. Rossi // Am. J. Physiol. Cell Physiol. – 2001. – V. 281. – P. 555-562. 365 477. Moir, R.D. The dynamic properties and possible functions of nuclear lamins / R.D. Moir, T.P. Spann, R.O. Goldman // Int. Re. Cytol. – 1995. – V. 162. – P. 141182. 478. Montell, C. The TRP channels, a remarkable functional family / C. Montell, L. Birnbaumer, V. Flockezzi // Cell. – 2002. – V. 108. – P. 595-598. 479. Montrose-Rafizadeh, C. Role intracellular calcium in volume regulation by rabbit medullary thick ascending limb cells / C. Montrose-Rafizadeh, W.B. Guggio // Am. J. Physiol. – 1991. – V. 260. – P. F402-F409. 480. Moran, J. Changes of actin cytoskeleton during swelling and regulatory volume decrease in cultured astrocytes / J. Moran, H. Pasantes-Morales, M. Sabanero, I. Meza // Am. J. Physiol. – 1996. – V. 271. – P. C1901-C1907. 481. Moritz, M. Microtubule nucleation by gamma-tubulin-containing rings in the centrosome / M. Moritz, M.B. Braunfeld, J.W. Sedat, B. Alberts, D.A. Agard // Nature. – 1995. – V.378 (6557). – P. 638-640. 482. Moritz, M. Structure of the gamma-tubulin ring complex: a template for microtubule nucleation / M. Moritz, M.B. Braunfeld, V. Guenebaut, J. Heuser, D.A. Agard // Nat. Cell Biol. – 2000. – V. 2(6). – P. 365-370. 483. Moritz, M. Gamma-tubulin complexes and microtubule nucleation / M. Moritz, D.A. Agard // Curr Opin. Struct. Biol. – 2001. –V. 11(2). – P, 174-181. 484. Morris, C.E. Cell surface area regulation and membrane tension / C.E. Morris, U. Homann // J. Memebr. Biol. – 2001. – V. 179. – P. 79-102. 485. Mosior, M. Carbachol-stimulated phospharylation of the Na-K-Cl cotransporter / M. Mosior, M. Bobrowska, J. Gomulkiewicz // Biochimica et biophysica acta. – 1990. – V. 1022 (3). – P. 355-360. 486. Mosior, M. Effect of the level of ATP and state of spectrin on osmotic properties of bovine erythrocytes / M. Mosior, W.A. Bialas, J. Gomulkiewicz // General Physiol and biophysics. – 1992. – V. 11 (5). – P. 499-506. 487. Motais, R. Chloride permeability in human red cells: influence of membrane protein rearrangement resulting from ATP depletion and calcium accumulation / R. Motatis, A. Baroin, S. Baloly // J. Memebrane Biol. – 1981. – V. 62 (3). – P. 195- 366 206. 488. Mozafari, M.R. A review of scanning probe microscopy investigations of liposome-DNA complexes / M.R. Mozafari, C.J. Reed, C. Rostorm, V. Hasirci // J. Liposome Res. – 2005. – V. 15. – P. 93-107. 489. Muir, T.J. Osmotic and metabolic response to hydration and urea-boarding in a dormant terrestrially hibernating frog / T.J. Muir, J.P. Costanzo, R.E. Jr. Lee // J. Comp. Physiol. B. – 2007. – V. 177. – P. 917-926. 490. Mukherjee, C. Identification of adenylate cyclase-coupled β-adrenergic receptors in frog erythrocytes with (-)-[3H] alprenol / C. Mukherjee, M.G. Caron, M. Coverstone, R.Z. Lefkowitz // J. Biol. Chem. – 1975. – V. 250. – P. 4869-4876. 491. Mullanus, M.J. Tissue- and transformation-specific phosphotyrosyl proteins in verbB-transformed cells / M.J. Mullanus, D.C. Conolly, N.J. Mairle // J. Virol. – 1995. – V. 69 (6). – P. 3631-3638. 492. Musch, M.W. Hypotonic-stimulated taurine efflux in skate erythrocytes: regulation by tyrosine phosphatase activity / M.W. Musch, E.M. Davis-Amaral, K.L. Leibowitz, L. Goldstein // Am. J. Physiol. Regulatory Integrative Comp. Physiol. – 1998. – V. 274. – P. 1677-1686. 493. Nakielhy, S. Transport of proteins and RNAs in and out of the nucleus / S. Nakielhy, G. Dreyfuss // Cell. – 1999. – V. 99. – P. 677-690. 494. Nagayama, M. Drastic change of local stiffness distribution correlating to cell migration in living fibroblasts / M. Nagayama, H. Haga, K. Kawabata // Cell Motil. Cytoskelet. – 2001. – V. 50 (4). – P. 173-179. 495. Negulescu, P.A. Volume-sensitive Ca influx and release from intracellular pools in gastric parietal cells / P.A. Negulescu, B. Munck, T.E. Machen // Am. J. Physiol. – 1992. – V. 263. – P. C584-C589. 496. Negulyaev, Yu.A. Sodium-selective channels in membranes of rat macrophages / Yu.A. Negulyaev, E.A.Vedernikova // J. Membr. Biol. – 1994. – V. 138. – P. 37-45. 497. Negulyaev, Yu.A. Disruption of actin filaments increases the activity of sodiumconducting channels in human myeloid leukemia cells / Yu.A. Negulyaev, E.A. Vedernikova, A.V. Maximov // Mol. Biol. Cell. – 1996. – V. 7. – P. 1857-1864. 367 498. Negulyaev, Yu.A. Na channel activity in leukemia cells is directly controlled by actin polymerization / Yu.A. Negulyaev, S. Yu. Khaitlina, H. Hinssen, E.V. Shumilina, E.A. Vedernikova // J. Biol. Chem. – 2000. – V. 275. – P. 40933-40937. 499. Nelson, M.J. Evidence that calcium acts as an intracellular messenger for adrenergic responses in human erythrocytes / M.J. Nelson, W.H. Huestis // Biochem. Biophys. Acta. – 1980. – V. 600 (2). – P. 398-405. 500. Nichol, J.A. Tensile strength and dilatational elasticity of giant sarcolemmal vesicles shed from rabbit muscle / J.A. Nichol, O.F. Hutter // J. Physiol. – 1996. – V. 493 (Pt.1). – P. 187-198. 501. Nikinmaa, M. Membrane transport and control of hemoglobin-oxygen affinity in nucleated erythrocytes / M. Nikinmaa // Physiol. Rev. – 1992. – V. 172. – P. 301-321. 502. Nisimotoa, Y. Interaction between p21-activated protein kinase and Rac during differentiation of HL-60 human promyelocytic leukemia cell induced by all transretinoic acid / Y. Nisimota, H. Ogawa // Eur. J. Biochem. – 2002. – V.269. – P. 26222629. 503. Nix, D.A. Targeting of zyxin to sites of actin membrane interaction and to the nucleus / D.A. Nix, J. Fradelizi, S. Bockholt, B. Menichi, D. Lovard, E. Friederich, M.C. Beckerle // J. Biol. Chem. – 2001. – V. 276. – P. 34759-34767. 504. Noel, J. Pouyssegur J. Hormonal regulation pharmacology, and membrane sorting of vertebrate Na+/H+ exchange isoforms / J. Noel // Am. J. Physiol. – 1995. – V. 268. – P. C283-C296. 505. Nowakowski, R. Imaging erythrocytes under physiological conditions by atomic force microscopy / R. Nowakowski, P. Luckham, P. Winlove // Biochem. Biophys. Acta. – 2001. – V. 1514. – P. 170-176. 506. Oegema, K. Characterization of two related Drosophila gamma-tubulin complexes that differ in their ability to nucleate microtubules / K. Oegema, C. Wiese, O.C. Martin, R.A. Milligan, A. Iwamatsu, T.J. Mitchison, Y. Zheng // J. Cell Biol. – 1999. – V. 144(4). – P. 721-733. 507. Ohashi, T. Experimental and numerical analyses of local mechanical properties measured by atomic force microscopy for sheared endothelial cells / T. Ohashi, Y. 368 Ishii, Y. Ishikawa, T. Matsumoto, M. Sato // Biomed. Mater. Eng. – 2002. – V. 12. – P. 319-327. 508. Ohba, T. Energy- and temperature-dependent transport of integral proteins to the inner nuclear membrane via the nuclear pore / T. Ohba, E.C. Schimer, T. Nishimoto, L. Gerace // J. Cell Biol. – 2004. – V. 167. – P. 1051-1062. 509. Ohshima, S. Isolation of profiling from embryonic chicken skeletal muscle and evaluation of its interaction with different actin isoforms / S. Ohshima, H. Abe, T. Obinata // J. Biochem. – 1989. – V. 105. – P. 855-857. 510. Oikawa, T. Sequential signals towards podosome formation in NH-scr cells / T. Oikawa, T. Itoh, T. Takenawa // J. Cell Biol. – 2008. – V. 182. –P. 157-169. 511. Okada, Y. Pathophysiology and purrles of the volume-sensitive outwardly rectifying anion channel / Y. Okada, K. Sato, T. Numota // The J. of Physiology. – 2009. – V. 587. – P. 2141-2149. 512. Ono, S. Mechanism of depolymerization and severing of actin fiaments and it’s significant in cytoskeletal dynamics / S. Ono // Int. Rev. Cytol. – 2007. – V. 258. – P. 1-82. 513. Oosawa, F. Counterion fluctuation and dielectric dispersion in linear polyelectrolytes / F. Oasawa // Biopolymers. – 1970. – V. 9. – P. 677-688. 514. Ordway, R.W. Two distinct mechanisms of ion channel activation by membrane stretch: evidence that endogenous fatty acids mediate stretch activation of K + channels / R.W. Ordway, S. Petrou, M.I. Kirber, J.V. Walsh, J.J. Singer // Bophys. J. – 1992. – V. 61. – P. A391. 515. Orlov, S.N. Can we use erythrocytes for the study of the activity of ubiquitous Na+-H+-exchanger (NHE-1) essential hypertension / S.N. Orlov, S.R. Kuznetsov, N.I. Pokudin, J. Tremblay, P. Hamet P. // Am. J. Hypertens. – 1998. – V. 12. – P. 774783. 516. Oster, G.F. The physics of cell motility / G.F. Oster, A.S. Perelson // J. Cell Sci. – 1987. – V. 8. – P. 35-54. 517. Ozanne, D.M. Androgen receptor nuclear translocation is facilitated by the f-actin cross-linking protein filamin / D.M. Ozanne, M.E. Brady, S. Cook, L. Gaughan, E.N. 369 David, C.N.H. Rolson // Mol. Endocrinol. – 2000. – V. 14. – P. 1618-1626. 518. Pakkamen, R. Microvillus-specific Mr 75.000 plasma membrane protein of human choriocarcinome cells / R. Pakkamen, K. Hedman, O. Turunen, T. Wahlstrom, A. Vaheri // J. Histochem. Cytochem. – 1987. – V. 35. – P. 809-816. 519. Paleck, J. Polymerization of red cell membrane protein contributes to spheroechinocyte shape irreversibility / J. Paleck, P.A. Liu, S.C. Liu // Nature. – 1978. – V. 274. – P. 505-507. 520. Paleg, L.G. Proline, betaine and other organic solutes protect enzymes against heat inactivation / L.G. Paleg, T.J. Douglas, A. Van Daal, D.B. Keech // Aust. J. Plant Physiol. – 1981. – V. 8. – P. 107-114. 521. Palfrey, H.C. Activation of amiloride-sensetive Na permeability in frog erythrocyte by cyclic AMP and other stimuli / H.C. Palfrey, A. Stapleton, P. Greengard // J. Gen. Physiol. – 1980. – V. 76. – P. 25a. 522. Palfrey, H.C. Hormone-sensitive ion transport systems in erythrocytes as models for epithelial ion pathways / H.C. Palfrey, P. Greengard // Ann. N.Y. Acad. Sci. – 1981. – V. 372. – P. 291-308. 523. Pantaloni, D. Mechanism of actin-based motility / D. Pantaloni, C. Le Clainche, M.F. Carlier // Science. – 2001. – V. 292. – P. 1502-1506. 524. Park, J.H. Swelling detection for volume regulation in the primitive eukaryote Giardia Intenstinalis: a common feature of volume detection in present-day eukaryotes / J.H. Park, M.R. Edwards, P.J. Schofied // The FASEB J. – 1998. – V. 12. – P. 571-579. 525. Parker, J.C. Role of calcium in volume regulation by dog red blood cells / J.C. Parker, H.J. Gitelman, P.S. Glosson, D.L. Leonard // J. Gen. Physiol. – 1975. – V. 65. – P. 84-96. 526. Parker, J.C. Active and passive Ca movements in dog red blood cell and resealed ghosts / J.C. Parker // Anm. J. Physiol. – 1979. – V. 237. – P. C10-C16. 527. Parker, J.C. Hemolytic action of potassium salts on dog red blood cells / J.C. Parker // American J. of Physiology. – 1983. – V. 244. – P. C313-C317. 528. Parodi, M. Toward molecular electronics. Self-scanning of molecular wires / M. 370 Parodi, B. Bianco, A. Chiabrera // Cell Biophys. – 1985. – V. 7. – P. 215-235. 529. Pastan, I. Receptor-mediated endocytosis of hormones in cultured cells / I. Pastan, M.C. Willingham // Ann. Rev. Physiol. – 1981. – V. 43. – P. 239-250. 530. Pasternack, G.R. Interactions between protein 4.1 and band 3 / G.R. Pasternack, R.A. Anderson, T.L. Leto, V.T. Marchesi // J. Biol. Chem. – 1985. – V. 260. – P. 3676-3683. 531. Pasternack, G.R. Erythrocyte protein 4.1 binds and regulates myosin / G.R. Pasternack, R.H. Rausen // Proc. Natl. Acad. Sci. USA. – 1989. – V. 86. – P. 97129718. 532. Pearson, M.A. Structure of the ERM protein moesinreveals the FERM domain fold masked by an extended actin binding tail domain / M.A. Pearson, P. Reczek, A. Bretscher, P.A. Karplus // Cell. – 2000. – V. 101. – P. 259-270. 533. Pelham, R.J. Cell locomotion and focal adhesion are regulated by substrate / R.J. Pelham, Y. Wang // Proc. Natl. Acad. Sci. USA. – 1997. – V. 94. – P. 13661-13665. 534. Percipalle, P. Molecular functions of nuclear actin in transcription / P. Percipalle, N. Visa // J. Cell Biol. – 2006. – V. 172. – P. 967-971. 535. Pestonjamasp, K. Moesin ezrin and p205 are actin-binding proteins associated with neutrophil plasma membrane / K. Pestonjamasp, M.R. Amieva, C.P. Strassel, W.M. Nauseef, H. Furthmayr, E.J. Luna // Mol. Biol. Cell. – 1995. – V. 6. – P. 247259. 536. Peterson, M.A. Theoretical and phase contrast microscope eigenmade analysis of erythrocyte flicker: amplitudes / M.A. Peterson, H. Stey, E. Sackman // J. Phys. II France. – 1991. – V. 2. – P. 1273-1285. 537. Pickard, B.G. Gravity sensing by higher plants / B.G. Pickard, J.P. Ding // Comparative aspects of mechanoreceptor systems / ed. F. Ito. – Berlin: SpringerVerlag, 1992. – P. 81-110. 538. Piel, M. The respective contributions of the mother and daughter centrioles to centrosome activity and behavior in vertebrate cells / M. Piel, P. Meyer, A. Khodjakov, C.L. Rieder, M. Bornens // J. Cell Biol. – 2000. – V. 149 (2). – P. 317330. 371 539. Pinder, J.C. Structural and dynamic states of actin in the erythrocyte / J.C. Pinder, W.S. Gratzer // J. Cell Biol. – 1983. – V. 96. – P. 768-775. 540. Pines, J. Four-dimensional control of the cell cycle / J. Pines // Nat. Cell Biol. – 1999. – V. 1. – P. 73-79. 541. Poch, M.T. Two distinct classes of CCAAT box elements that bund nuclear factor-Y/a-actinin-r: potential role in human CYPIAI regulation / M.T. Poch, L. AlKassim, S.M. Smolinski, R.N. Hines // Toxicol. Applied. Pharmacol. – 2004. – V. 199. – P. 239-250. 542. Podolski, J.L. Association of deoxyribonuclease I with the pointed ends of actin filaments in human red blood cell membrane skeletons / J.L. Podolski, S.L. Steck // J. Biol. Chem. – 1988. – V. 263. – P. 638-645. 543. Pollard, T.D. Actin and actin-binding proteins. A critical evaluation of mechanism and functions / T.D. Pollard, J.A. Cooper // Annu. Rev. Biochem. – 1986. – V. 55. – P. 987-1035. 544. Pollard, T.D. Cellular motility driven by assembly and disassembly of actin filaments / T.D. Pollard, G.G. Borysi // Cell. – 2003. – V. 113. – P. 453-465. 545. Polliack, A. A scanning electron microscopy atlas of normal and malignant leukocytes / A. Polliack, G. Lambertenghi-Ddeliliers, D. Soligo. – Harwood Academic Publiisher, 1993. – 95 p. 546. Polock, A.S. Abnormalities of cell volume regulation and their functional consequences / A.S. Polock, A.I. Ariff // Am. J. Physiol. – 1980. – V. 239. – P. F195-F205. 547. Pore, S. The role of Ca2+ and K+ in the regulatoey volume decrease mechanism of Aligator mississippiensis erythrocytes / S. Pore // Eukarion. – 2009. – V. 5 – 25p. 548. Porter, K.R. A scanning electron microscope study of surface features of viral and spontaneous transformers of mouse Balb/3T3 cells / K.R. Porter, G.J. Todaro, V. Fonte // J. Cell. Biol. – 1973. – V. 59. – P. 633-643. 549. Poznansky, M. Regulation of human red cell volume by linked cation fluxes / M. Poznansky, A.K. Solomon // J. Memebr. Biol. – 1972. – V. 10. – P. 259-266. 550. Prassler, J. Interaction of a Dictiostellium member the plastin/fimbin family with 372 actin filament and actin-myosin complexes / J. Prassler, S. Stocker, G. Marriott, M. Heidecker, J. Kellermann, G. Gerisch // Mol. Biol. Cell. – 1997. – V. 8. – P. 83-95. 551. Prat, A.G. Activation of epithelial Na+ channels by protein kinase A requires actin filaments / A.G. Prat, A.M. Bertorello, D.A. Ausiello, H.F. Cantiello // Am. J. Physiol. – 1993. – V. 265. – P. C224-C233. 552. Prochniewicz, E. Comparison of intermonomer interactions within polymers of chicken gizzard and rabbit skeletal muscle actins / E. Prochniewicz, T. Yanagida // J. Biochem. – 1981. – V. 89. – P. 1215-1221. 553. Pruschy, M. Facilitated nuclear transport of calmodulin in tissue culture cells / M. Pruschy, Y. Ju, L. Spitz, E. Carafoli, D.S. Goldfarb // J. Cell boil. – 1994. – V. 127. – P. 1527-1536. 554. Radmacher, M. Measuring the visco-elastic properties of human platelets with the atomic force microscope / M. Radmacher, M. Fritz, C.M. Kacher, J.P. Cleveland, P.K. Hansma // Biophys. J. – 1996. – V. 70. – P. 556-567. 555. Rainer, T.H. Adrenaline upregulates monocyte L-selectin in vitro / T.H. Rainer, N. Lam, R.A. Cocks // Resuscitation. – 1999. – V. 43. – P. 47-55. 556. Raucher, D. Characteristic of a membrane reservoir buffering membrane tension / D. Raucher, M. Sheetz // Biophysical J. – 1999. – V. 77. – P. 1992-2002. 557. Raucher, D. Phosphatidylinositol 4,5-biphosphate function as a second messenger that regulates cytoskeleton-plasma membrane adhesion / D. Raucher, T. Stauffer, W. Chen, K. Shen, S. Guo, J.D. York, M.P. Sheetz, T. Meyer // Cell. – 2000. – V. 100. – P. 221-228. 558. Remold-O’Donnell, E. Stimulation and desensitization of macrophage adenylate cyclase by prostaglandins and catecholamines/ E. Remold-O’Donnell // J. Biol. Chem. – 1974. – V. 249. – P. 3615-3621. 559. Revankar, C.M. Ca2+ homeostasis in polymorphonuclear leukocytes from chromic myeloid leukemia patients / C.M. Revankar, S.H. Advani, N.R. Naik, R. Altered // Mol. Cancer. – 2006. – V. 275. – P. 55-65. 560. Ribbeck, K. The translocation of transportin-cargo complexes trough nuclear pores is independent of both Ran and energy / K. Ribbeck, U. Kutay, E. Paraskeva, 373 D. Gӧrlich // Curr. Biol. – 1999. – V. 9. – P. 47-50. 561. Rickard, J.E. Identification of a novel nucleotide-sensitive microtubule-binding protein in HeLa cells / J.E. Rickard, T.E. Kreis // J. Cell Biol. – 1990. – V. 110 (5). – P. 1623-1633. 562. Ridley, A.J. The small GTP-binding protein Rho regulates the assembly of local adhesion and actin stress fibers in response to growth factors / A.J. Ridley, A. Hall // Cell. – 1992. – V. 70. – P. 389-399. 563. Ridley, A.J. The small GTP protein Rac regulates growth factor-induced membrane ruffling / A.J. Ridley, H.F. Paterson, C.L. Johnston, D. Diekmann, A. Hall // Cell. – 1992. – V. 70. – P. 401-410. 564. Rink, T.J. Volume restoration in osmotically swollen lymphocytes does not involve change in cytolic pH or free Ca2+ concentration / T.J. Rink, A. Sanchez, S. Grinstein, A. Rothstein // Biochimica at Biophysica Acta. – 1983. – V. 762. – P. 593596. 565. Ritter, L.S. Leukocyte accumu-lation and hemodynamic changes after stroke / L.S. Ritter, J.A. Orozco J.A. P.M. Coull, P.F. McDonagh // Stroke. – 2000. – V.31. – P. 1153-1161. 566. Rodionov, V. Centrosomal control of microtubule dynamics / V. Rodionov, E. Nadezhdina, G. Borisy // Proc. Natl. Acad. Sci. USA. – 1999. – V. 96(1). – P. 115120. 567. Rodriguez, O.C. Conserved microtubule-actin interactions in cell movement and morphogenesis / O.C. Rodriguez, A.W. Schaefer, C.A. Mandato, P. Forscher, W.M. Bement, C.M. Waterman-Storer // Nat. Cell Biol. – 2003. – V. 5 (7). – P. 599-609. 568. Rosales, O.R. Proteinkinase C is a mediator of the adaptation of vascular endothelial cells to cyclic strain in vitro / O.R. Rosales, B.E. Sumpio // Cell Transplatation. – 1992. –V. 1. – P. 43-50. 569. Ross, P.E. Membrane chloride conductance and capacitance in Jurkat Tlymphocytes during osmotic swelling / P.E. Ross, S.S. Garber, M.D. Cahalan // Biophys. J. – 1994. – V. 66. – P. 169-178. 570. Rotin, D. Impaired cell volume regulation in Na+-H+ exchange-deficient mutants / 374 D. Rotin, S. Grinstein // Amer. J. of Physiol. – 1989. –V. 257. – P. C1158-C1165. 571. Roti-Roti, L.W. Adaptation of mouse leukemic cells (L51784) to anisotonic media / L.W. Roti-Roti, A. Rothstein // Exp. Cell Res. – 1973. –V. 79. – P. 295-310. 572. Rotsch, C. AFM imaging and elasticity measurements on living rat liver macrophages / C. Rotsch, F. Braet, E. Wisse, M. Radmacher // Cell Biol. Int. – 1997. – V. 21 (11). – P. 685-696. 573. Rotsch, C. Dimensional and mechanical dynamics of active and stubble edges in motile fibroblasts investigated by using atomic force microscopy / C. Rotsch, K. Jacobson, M. Radmacher // Proc. Natl. Acad. Sci. USA. – 1999. – V. 96. – P. 921926. 574. Rotsch, C. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study 0 C. Rotsch, R. Radmacher // Biophys. J. – 2000. – V. 78 (1). – P. 520-535. 575. Roy, G. Effect of anisotonic media on volume, ion and amino acid content and membrane potential of kidney cells (MDck) in culture / G. Roy, R. Sauve // J. of Membrane Biology. – 1987. – V. 100. – P. 83-96. 576. Roy, C. A dual involvement of the amino-terminal domain of ezrin in F- and Gactin binding / C. Roy, M. Martin, P. Mangeat // J. Biol. Chem. – 1997. – V. 272. – P. 20088-20095. 577. Roychowdhury, S. Submembraneous microtubules cytoskele-ton iregulation of microtubule assembly by heterotrimeric G proteins / S. Roychowdhury, M. Rasenick // FEBS. – 2008. – V. 275. – P. 4654-4663. 578. Rubera, I. Cl- and K+ conductance activated by cell swelling in primary cultured of rabbit distal bright convoluted tubules / I. Rubera, M.Taue, C. Poujeol, M.T. Bohn, M. Bidet, G. Le Penzis, P. Poujeol // Am. J. Physiol. – 1997. – V. 273. – P. F680F697. 579. Rudolph, S.A. Effects of cathecholamines and prostaglandin E on cyclic AMP, cation fluxes, and protein phosphorylation in the frog erythrocyte / S.A. Rudolph, P.E. Greengard // J. Biol. Chem. – 1980. – V. 255. – P. 8534-8540. 580. Saarkingas, J.Regulation of the actin cytoske-leton-plasma interplay by 375 phosphoinositides / J. Saarkinagas, H. Zhaoo, P. Lappalainen // Physiol. Rev. – 2010. – V. 90. – P. 259-289. 581. Sachs, F. Mechanical transduction in biological systems / F. Sachs // Ctit. Rev. Biochem. Eng. – 1988. – V. 16. – P. 141-169. 582. Sachs, F. Stretch-activated cationic channels in the heart / F. Sachs // Cardiac Mechano-electronic Feedback and Arrhythmias, From Pippette to Patient / ed. P. Kohl, M.R. Franz, F. Sachs. – Elsevier Publication (in press), 2004. – p. 96-102. 583. Sachs, F. Mechanosensitive ion channels in nonspecialized cells / F. Sachs, C.E. Morris // Rev. Physiol. Biochem. Pharmacol. – 1998. – V. 132. – P. 1-77. 584. Sackin, H. Stretch-activated ion channels / H. Sackin // Cellular and molecular physiology of cell volume regulation / ed. K. Strange. – Boca Raton, FL: CRC, 1994. – P. 215-240. 585. Sager, G. β2-adrenergic receptor on intact human erythrocytes / G. Sager // Biochem. Pharmac. – 1983. – V. 32. – P. 1946-1949. 586. Sahai, E. Mechanisms of cancer cell invasion / E. Sahai // Curr. Opin. Genet. Dev. – 2005. – V. 15. – P. 87-96. 587. Salsbury, A.J. New method for detecting changes in the surface appearance of human red blood cells / A.J. Salsbury, J.A. Clarke // J. Clin. Path. – 1967. – V. 20. – P. 603-610. 588. Sanchez, D. Noncontact measurement on the local mechanical properties of living cells using pressure applied via a pipette / D. Sanchez, N. Johnson, C. Li, P. Novak, J. Rneinlaender, Y. Zhonig, U. Amand // Biophys. J. - 2008. – V. 95. – P. 3017-3027. 589. Sanders, B. Differential expression of the β2-adrenergic receptor by Th1 and Th2 clones. Implications for cytokine production and B cell help / B. Sanders, R. Baker, S. Ramer-Quinn // J. Immunol. – 1997. – V. 158. – P. 4200-4210. 590. Santoro, M.M. Increased thermal stability of proteins in the presence of naturally occuring osmolytes / M.M. Santoro, Y. Liu, S.M.A. Khan, L.X. Hou, D.W. Bolen // Biochemistry. – 1992. – V. 31. – P. 5278-5283. 591. Sarkadi, B. Volume regulation of chinese hamster ovary cells in anisosmotic media / B. Sarkadi, L. Attisano, S. Grinstein, M. Buchwald, A. Rothestein // 376 Biochem. et Biophys. Acta. – 1984a. – V. 774. – P. 159-168. 592. Sarkadi, B. Ionic events during the volume response of human peripheral blood lymphocytes to hypotonic media. I. Distinction betwenn volume-activated Cl- and K+ conductance pathways / B. Sarkadi, E. Mack, A. Rothstein // J. of General Physiol. – 1984b. – V. 83. – P. 497-512. 593. Sarkadi, B. Cation and anion transport pathways in volume regulatory response of human lymphocytes to hypoosmotic media / B. Sarkadi, R. Cheung, E. Mack, E.W. Grinstein, A. Rothestein // American J. of Physiol. – 1985. – V. 428. – P. C480-C487. 594. Sato, S.Y. Characterization of human erythrocyte cytoskeletal ATPase / S.Y. Sato, Y. Jinbu, M. Nakau // J. Biochem. – 1986. – V. 100. – P. 643-649. 595. Sato, N. A gene family consisting of ezrin, radixin and moesin. Its specific localization of actin filament/plasma membrane association sites / N. Sato, N. Funagma, A. Nagauchi, S. Yonemura, S.Tsukita // J. Cell Sci. – 1992. – V. 103 (pt.1). – P. 131-143. 596. Scheffer, L. Atomic force pulling: probing the local elasticity of the cell membrane / L. Scheffer, A. Bilter, E. Ben-Jacob, R. Karenstein // Eur. Biophys. J. – 2001. – V. 30. – P. 83-90. 597. Schiener-Bobis, G. The sodium pump. Its molecular properties and mechanics of ion transport / G. Schiener-Bobis // Eur. J. Biochem. – 2002. – V. 269. – P. 24242433. 598. Schirren, C.A. Adhesion molecules on freshly recovered T leukemia promote tumor-directed lympholysis / C.A. Schirren, H. Volpel, S.C. Meuer // Blood. – 1992. – V. 79. – P. 138-143. 599. Schmidt, W.F. Oubain-intensive salt and water, movements in duck red cells. I. Kinetics of cation transport under hypotonic conditions / W.F. Schmidt, T.J. McManus // J. of General Physiology. – 1977. – V. 70. – P. 59-79. 600. Schraff, O. Regulation of cytosolic calcium in blood cells / O. Schraff, B. Foder // Physiol. Rev. – 1993. – V. 73. – P. 547-582. 601. Schrier, S.L. Actin activated ATPase human red cell membrane / S.L. Schrier, B. Hardy, I. Junga, L. Ma // Blood. – 1981. – V. 58. – P. 953-962. 377 602. Schroff, S.G. Dynamics micromechanical properties of cultured rat atrial myocytes measured by atomic force microscopy / S.G. Schroff, P.R. Saner, R. Lal // Am. J. Physiol. Cell Physiol. – 1995. – V. 269. – P. C286-C292. 603. Schuller-Levis, G. Immunologic consequences of taurine deficiency in cats / G. Schuller-Levis, P.P. Menta, R. Rudelli, J. Sturman // J. Leukoc. Biol. – 1990. – V. 47. – P. 321-331. 604. Schwab, A. Function and spatial distribution of ion channels in transporters in cell migration / A. Schwab // Am. J. Physiol. – 2001. – V. 280. – P. F739-F747. 605. Schwab, A. Cells move when ions and water flow / A. Schwab, X. NechyporukZloy, A. Fabian, C. Stack // Pflüger Arch. – 2007. – V. 453. – P. 421-432. 606. Schweiebert, E.M. Actin-based cytoskeleton regulates a chloride channel and cell volume in renal cortical collecting duct cell line / E.M. Schweiebert, J.M. Mills, B.A. Stantoin // J. Biol. Chem. – 1994. – V. 269. – P. 7081-7089. 607. Sechi, S.A. The actin cytoskeleton and plasma membrane connection: PtdIns (4,5) P2 influences cytoskeletal protein activity at the plasma membrane / S.A. Sechi, J. Wehland // J. Cell Science. – 2000. – V. 113. – P. 3685-3695. 608. Semenova, S.B. Properties of Mg2+-dependent cation channels in human leukemia K562 cells / S.B. Semenova, A.F. Fomina, I.O. Vassilieva, Y.A. Negulyaev // J. Cell Physiol. – 2005. – V. 205. – P. 372-378. 609. Shamash, J. Apoptosis and cell prolife ration control induced by pulsed calcium channels blockade in a low grade lymphoma cell line expressing BCL-2 / J. Shamash, D.C. Davies, T.A. Lister // Blood. – 1994. – V. 84. – P. 448A. 610. Shear, M.P. Agonist-specific refractoriness induced by isoproterinol / M.P. Shear, P.A. Insel, K.L. Melmon, P. Coffino // J. Biol. Chem. – 1976. – V. 251. – P. 75727276. 611. Shen, M.R. Osmotic shrinkage of human cervical cancer cells induces an extracellular Cl—dependent nonselective cation channel, which requires p38 MAPK / M.T. Shen, Ch.Y. Chou, K.F. Hsu, C. Ellory // The J. of Biol. Chem. – 2002. – V. 277 (48). – P. 45776-45784. 612. Sheetz, M.P. Continuous membrane-cytoskeleton adhesion requires continuous 378 accommodation to lipid and cytoskeleton dynamics / M.P. Sheetz, J.E. Sable, H.G. Dobereiner // Annu. Rev. Biophys. Biochem. Struct. – 2006. – V. 35. – P. 417-434. 613. Shelden, E. Observation and quantification of individual microtubule behavior in vivo: microtubule dynamics are cell-type specific / E. Shelden, P. Wadsworth // J. Cell Biol. – 1993. – V. 120(4). – P. 935-945. 614. Shibasaki, Y. Massive actin polymerization induced by phosphatidylinositol-4phosphate 5-kinase in vivo / Y. Shibasaki, H. Ishihara, N. Kizuki, T. Asano, Y. Oka, Y. Yazak // J. Biol. Chem. – 1997. – V. 272. – P. 7578-7581. 615. Shindo, M. A novel type of ATP block on a Ca2+-activated K+ channel from bullfrog erythrocytes / M. Shindo, Imai Y., Sokma Y. // Biophys. J. – 2000. – V. 79. – P. 287-297. 616. Shirakawa, F. In vitro activation and nuclear translocation of NF-kappa B catalyzed by cyclic AMP-dependent protein kinase and protein kinase / F. Shirakawa, S.B.C. Mizel // Moll. Cell Biol. – 1989. – V. 9. – P. 2424-2430. 617. Shumilina, E.V. Regulation of sodium channel activity by capping of actin filaments / E.V. Shumilina, Yu.A. Negulaev, E.A. Morachevskaya, H. Hinssen, S.Yu. Khaittlina // Mol. Biol. Cell. – 2003. – V. 14. – P. 1709-1716. 618. Shuster, C. Indirect association of ezrin with F-ctin isoform specificity and calcium sensitivity / C. Shuster, I.M. Herman // J. Cell Biol. – 1995. – V. 128. – P. 837-848. 619. Shyu, A.B., The double lives of setting mRNA binding proteins / A.B. Shyu, M.F. Wilkinson // Cell. – 2000. – V. 102. – P. 135-138. 620. Siebens, A.W. Volume-regulatory responses of Amphiuma red cells in anisosmotic media. The effect of amiloride / A.W. Siebens, F.M. Kregenow // J. of General Physiology. – 1985. – V. 86. – P. 527-564. 621. Siefrine, G.E.Jr. Enzymatic basis for the Ca2+ induced cross-linking of membrane proteins in intact human erythrocytes / G.E.Jr. Siefrine, A.B. Apostol, P.T. Velosco, L. Korand // Biochemestry. – 1978. – V. 17 (13). – P. 2598-2604. 622. Siegel, D.L. The effect of endogenous proteases on the spectrin binding proteins of human erythrocytes / D.L. Siegel, S.R. Goodman, D. Branton // Biochim. Biophys. 379 Acta. – 1980. – V. 598. – P. 517-527. 623. Sigurdson, W.J. Calcium imaging of mechanically induced fluxes in tissue cultured chick heart, the role of stretch activated ion channels / W.J. Sigurdson, A. Ruknudin, F. Sachs // Am. J.Physiol. – 1992. – V. 262. – P. H1110-H1115. 624. Simone, A. Strategies and results of atomic force microscopy in the study of cellular adhesion / A. Simone, M.C. Durrie // Micron. – 2006. – V. 37. – P. 1-13. 625. Simons, T.J. Carbocyanine dyes inhibit Ca-dependent K-efflux from human red cell ghosts / T.J. Simons // Nature. – 1976. – V. 264 (5585). – P. 467-469. 626. Simons, T.J. Characterization o sugar transport in the pigeon red blood cells / T.J. Simons // J. Physiol (London). – 1983. – V. 338. – P. 477-499. 627. Small, J.V. How do microtubules guide migrating cells? / J.V. Small, B. Geiger, I. Kaverina, A. Bershadsky // Nat. Rev, Mol. Cell Biol. – 2002. – V. 3 (12). – P. 957964. 628. Smith, A. Nuclear import of Ran is mediated by NTF2 / A. Smith, A. Brownawell, I.G. Macara // Curr. Biol. – 1998. – V. 8. – P. 1403-1406. 629. Sokabe, M. The structure and dynamics of patch clamped membrane, a study using differential interference contrast microscopy / M. Sokabe, F. Sachs // J. Cell Biol. – 1990. – V. 111. – P. 599-606. 630. Sokabe, M. Quantitative video microscopy of patch clamped membranes stress, strain, capacitance and stretch channel activation / M. Sokabe, F. Sachs, Z. Jing // Biophys. J. – 1991. – V. 59. – P. 722-728. 631. Soligo, D. Immuno-scanning electron microscopy of human leukemic cells / D. Soligo, E. Lambertenghi-Deliliers // Haematologica. – 1988. – V. 73. – P. 273-278. 632. Sorensis, B. Effects of oxygenation and the stress hormones adrenaline and cortisol no the viscosity of blood from the trout Oncorhynchus Mykiss / B. sorensis, P. Weber // The J. of Exp. Biology. – 1995. – V. 198. – P. 953-959. 633. Srinivasan, Y. Ankyrin and spectrin associate with voltage-dependent sodium channels in brain / Y. Srinivasan, L. Elmer, J. Davis, V. Benett, K. Angelides // Nature. – 1988. – V. 333. – P. 177-180. 634. Steimle, P.A. Polyphosphoinositides inhibit the interaction of vinculin with actin 380 filaments / P.A. Steimle, J.D. Hoffert, N.B. Adey, S.W. Craig // J. Biol. Chem. – 1999. – V. 274. – P. 18414-18420. 635. Steinman, R.M. Endocytosis and recycling of plasma membrane / R.M. Steinman, I.S. Mellman, W.A. Muller, Z.A. Cohn // J. Cell Biology. – 1983. – V. 96. – P. 1-27. 636. Stene-Larsen, G. Comparative aspects of cardiac adrenoreceptors: characterization of the β2-adrenoceptor as a common adrenaline-receptor in vertebrate hearts / G. Stene-Larsen // Comp. Biochem. Physiol. – 1981. – V. 70C. – P. 1-12. 637. Stoll, B. Liver cell volume and protein synthesis / B. Stoll, W. Gerok, F. Lang, D. Haussinger // Biochem. J. – 1992. – V. 287. – P. 217-222. 638. Storey, K.B. Organic solutes in freezing tolerance / K.B. Storey // Comp. Biochem. Physiol. – 1997. – V. 117. – P. 319-326. 639. Storey, K.B. Physiology, biochemistry, and molecular biology of vertebrate freeze tolerance: the wood frog / K.B. Storey, J.M. Storey // Life the frozen state / ed. B.J. Fuller, N. Lane, E.E. Benson. – Washington, DC: CRC Press, 2004. – P. 243274. 640. Stossel, T.T. The cortical cytoplasmic actin gel / T.T. Stossel, P.A. Janmey, K.S. Zanner // Cytomechanics / ed. J. Bererter-Hahn, O.R. Andersen, W.E. Reif. – Berlin: Springer-Verlag, 1987. – P. 131-153. 641. Stossel, T.P. From signal to pseudopod. How cell control cytoplasmic actin assembly / T.P. Stossel // J. Biol. Chem. – 1989. – V. 264. – P. 18261-18264. 642. Stossel, T.P. Filamins as integrators of cell mechanics and signaling / T.P. Stossel, J. Condeelis, L. Cooletoy, H.J. Hartwig, A. Noegel, M. Schleicher, S.S. Shapiro // Mol. Cell Biol. – 2001. – V. 2. – P. 138-145. 643. Stossel, T.P. Filling gaps in signaling to actin cytoskeletal remodeling / T.P. Stossel, J.H. Hartwig // Develop. Cell. – 2003. – V.4. – P. 444-445. 644. Strange, K. Cellular and molecular physiology of cell volume regulation / K. Strange. – Boca-Rarton: CRC Press, 1994a. – 234p. 645. Strange, K. Are all cell volume changes the same? / K. Strange // New Physiol. Sci. – 1994b. – P. 223-228. 646. Strange, K. Swelling-activated organic osmolyte efflux: a new role for anion 381 channels / K. Strange, P.S. Jackson // Kidney Int. – 1995. – V. 48. – P. 994-1003. 647. Strange, K. Cellular and molecular physiology of volume-sensitive anion channels / K. Strange, F. Emma, P.S. Jackson // Am. J. Physiol. – 1996. – V. 270. – P. C711-C730. 648. Strange, K. Cellular volume homeostasis / K. Strange // Adv. Physiol. Educ. – 2004. – V.28. – P. 155-159. 649. Strey, H.M. Measurements of erythrocyte membrane elasticity by flicker eigenmode decomposition / H.M. Strey, M.A. Peterson, E. Sackman // Biophys. J. 1995. – V. 69. – P. 478-488. 650. Su, Y. Cytoskeletal regulation of nitric oxide synthesis / Y. Su, D. Kondeikiv, E.R. Block // Cell Biochem. Biophys. – 2005. – V. 43. – P. 439-449. 651. Sundell, C.L. Requirement of microfilaments in sorting of actin messenger RNA / C.L. Sundell, R.H. Singer // Science. – 1991. – V. 253. – P. 1275-1277. 652. Suwalsky, M. Human erythrosytes and neuroblastoma cells are affected in vitro by Au (III) ions / M. Suwalsky, R. Gonzales, F. Villena, L.F. Aguilar, C.P. Sotomayor, S. Bolognin, P. Zatta // Biochem. Biophys. Res. Commun. – 2010. – V. 397 (2). – P. 226-231. 653. Suzuki, M. F-actin network may regulate a Cl-channel in renal proximal tubulle cells / M. Suzuki, K. Miyazaki, M. Ikeda, Y. Kawaguchi, O. Sakai // J. Memebr. Biol. – 1993. – V. 134. – P. 31-39. 654. Svitkina, T.M. Plectin sidearms mediate interaction of intermediate filaments with microtubules and other components of the cytoskeleton / T.M. Svitkina, A.B. Verkhovsky, G.G. Borisy // J. Cell Biol. – 1996. – V. 135(4). – P. 991-1007. 655. Taddei, A. The function of nuclear architecture. A genetic approach / A. Naddei, F. Hediger, F.R. Neumann, S. Gasser // Annu. Rev. Genet. – 2004. – V. 38. – P. 305345. 656. Takafuta, T. Human α-filamin is a new protein interacts with the cytoplasmic tail of glycoprotein Ib alpha / T. Takafuta, G. Wu, G.F. Murphy, S.S.Shapiro // J. Biol. Chem. – 1998. – V. 273. – P. 7531-7538. 657. Takeuchi, M. Structure of the erythrocyte membrane skeleton as observed by 382 atomic force microscopy / M. Takeuchi, H. Miyamoto, Y. Sako, H. Komizu, A. Kusumi // Biophys. J. – 1988. – V. 74. – P. 2171-2183. 658. Tall, E.A. Dynamics of phosphatydylinositol 4,5-biphosphate in actin-rich structures / E.A. Tall, I. Spector, S.N. Pentyala, I. Bitter, M.J. Rebecehi // Curr. Biol. – 2000. – V. 10. – P. 743-746. 659. Tetens, V. Potency of adrenaline and noradrenaline for β-adrenergic proton extrusion from red cells of rainbow trout Salmo gairdneri / V. Tetens, G. Lykkeboe, N.J. Christensen // J. Exp. Biol. – 1988. – V. 134. – P. 267-280. 660. Terreros, D.A. Role of intracellular calcium in renal proximal tubule cell volume regulation / D.A. Terros, H. Kanli // Am. J. Physiol. – 1992. – V. 263. – P. R10861092. 661. Therien, A.G. Mechanisms of sodium pump regulation / A.G. Therien, R. Blostein // Amer. J. Physiol. – 2000. – V. 279. – P. C541-C566. 662. Thomson, I. The radial positioning of chromatin is not inherited through mitosis but is established de novo in early G1 / I. Thomson, S. Gilchrist, W. Bickmore, J.R. Chubb // Curr. Biol. – 2004. – V. 14. – P. 166-172. 663. Thoroed, S.M. Cell swelling stimulates the Ca2+-sensitive, cytosolic phospholipase A2 in Ehrlich ascites tumor cells / S.M. Thoroed, I.H. Lambert, H.S. Hansen, E.K. Hoffman // Acta. Physiol. Scand. – 1994. – V. 151. – P. 25A. 664. Thoroed, S.M. Free amino compounds and cell volume regulation in erythrocytes from different marine fish species under hyposmotic conditions: the role of a taurine channel / S.M. Thoroed, K. Fugelli // J. Comp. Physiol. – 1994a. – V. 164. – P. 1-10. 665. Thoroed, S.M. The Na+-independent taurine influx in flounder erythrocytes and its association with the volume regulatory taurine efflux / S.M. Thoroed, K. Fugelli // J. Exp. Biol. – 1994b. – V. 186. – P. 245-268. 666. Thoroed, S.M. The role of leukotriens D4 in the activation of the osmolalitysensitive taurine channel in erythrocytes from marine fish species / S.M. Thoroed, K. Fugelli // Acta. Physiol. Scand. – 1994c. – V. 151. – P. 27A. 667. Thoroe, S.M., The osmolality-sensitive taurine channel in flounder erythrocytes stimulated by noradrenaline under hypoosmotic conditions / S.M. Thoroe, M. 383 Soergaard, E.J. Cragoe, K. Fugelli // The J. of Exp. Biol. – 1995. – V. 198. – P. 311324. 668. Tiihonen, K. Glucose transport in carp erythrocyte: individual variation and effects of osmotic swelling, extracellular pH and catheholamines / K. Tiihonen, M. Nikihmaa, J. Lappivaara // J. Exp. Biol. – 1995. – V. 198. – P. 577-683. 669. Tigges, U. The F-actin cross-linking and focal adhesion protein filamin-α is a ligand and in vivo substrate for protein kinase Ca / U. Tigges, B. Koch, J. Wissing, B.M. Jockusch, W.H. Ziegler // J. Biol. Chem. – 2003. – V. 278. – P. 23561-23569. 670. Timasheff, S.N. A physiochemical basis for the selection of osmolytes by nature / S.N. Timasheff // Water and Life / ed. G.N. Somero, C.B. Osmond, C.L. Bolis. – Berlin: Springer-Verlag, 1992. – P. 70-84. 671. Timoshenko, S.P. Theory of plates and shells / S.P. Timoshenko, S. WoinowskyKrieger. – New York: McGraw-Hill, 1970. – 645 p. 672. Tinel, H. Calcium signaling during RVD of kidney cells / H. Tinel, E. KinneSafran, R.K.H. Kinne // Cell Physiol. Biochem. – 2000. – V. 10. – P. 297-302. 673. Tirnauer, J.S. EB1 proteins regulate microtubule dynamics, cell polarity, and chromosome stability / J.S. Tirnauer, B.E. Bierer // J. Cell Biol. – 2000. – V. 149(4). – P. 761-766. 674. Toyama, S. Functional alterations in β`-actin from a KB cell mutant resistant to cytochalasin B / S. Toyama // J. Cell Biol. – 1988. – V. 107. – P. 1499-1504. 675. Tran-Son-Tay, R. Mechanical properties of leukocytes and their effects on the circulation / R. Tran-Son-Tay, G. Nash // Handbook of Hemoreheology and Hemodynamics / ed. O.G. Baskurt, M.R. Hardeman, H.J. Meiselman, M.W. Rampling. – IOS. Press. Amsterdam, 2007. – p. 127-152. 676. Traub, P. Intermediate filament (10nm) proteins and the Ca2+-activated proteinase specific for vimentin and desmin in the cells from fish to man: An example of evolutionary conversation / P. Traub, W.J. Nelson // J. Cell Sci. – 1982. – V. 57. – P. 25-49. 677. Trump, B.F. Calcium-mediated cell injury and cell death / B.F. Trump, I.K. Berezesky // FASEK. – 1995. – V. 9. – P. 219-228. 384 678. Tse, Ch.M. Glucose transport in fish erythrocytes: variable cytohalasin-Bsensitive hexose transport activity in the common cell (Anguilla japonica) and transport deficiency in the paddyfied eel (Monopterus albus) and rainbow trout (Salmo gairdneir) / Ch.M. Tse, J.D. Young // J. Exp. Biol. – 1990. – V. 148. – P. 367-383. 679. Tu, Y. Migfilin and Mig-2 link focal adhesion to filamin and the actin cytoskeleton and function in cell shape modulation / Y. Tu, S. Wu, K. Chen, C. Wu // Cell. – 2003. – V. 113. – P. 37-47. 680. Tufts, B.I. Ion exchange mechanism on the erythrocyte membrane of the aquatic Salamander, Amphiuma tridactylum / B.I. Tufts, M. Nikinmaa, J.F. Steffensen, D.J. Randel // J. Exp. Biol. – 1987. – V. 133. – P. 329-338. 681. Tufts, B.I. The effects of foreed activity on circulating catecholamines and pH and water content of erythrocytes in the toad / B.I. Tufts, D.C. Mense, D.J. Randal // J. Exp. Biol. – 1987a. – V. 128. – P. 411-418. 682. Tuvia, S. Oxygenation-Deoxygenation cycle of erythrocytes modulates the submicron cell membrane fluctuations / S. Tuvia, S. Levin, R. Korenstein // Biophys. J. – 1992. – V. 63. – P. 599-602. 683. Tuvia, S. Mechanical fluctuatios of the membrane-skeleton are dependent on Factin ATPase in human erythrocytes / S. Tuvia, S. Levin, A. Bitlr, R. Korenstein // The J. of Cell Biol. – 1998. – V. 141 (7). – P. 1551-1561. 684. Tuvia, S. β-adrenergic agonists regulate cell membrane fluctuations of human erythrocytes / S. Tuvia, A. Moses, N. Gylayev, S. Levin, R. Korenstein // J. of Physiol. – 1999. – V. 516 (3). – P. 781-792. 685. Vadlamudi, R.K. Filamin is essential in actin cytoskeletal assembly mediated by p21-bactivated kinase 1 / R.K. Vadlamudi, F. Li, L. Adam, D. Nguyen, Y. Ohta, T. Stassel, R. Kumor // Nature Cell Biol. – 2002. – V. 4. – P. 681-690. 686. Veuter, J.C. The structure of α- and β-adrenergic receptors / J.C. Veuter, C.M. Fraster // Trends Pharmocol. Sci. – 1983. – V. 4.N6. – P. 256-258. 687. Viera, A. Interactions of the regulatory ligands Mg2+ and MgATP2 kith the renal plasma membrane Ca2+-ATPase: effects of osmolytes that stabilize or destabilize 385 protein structure / A. Viera, C. Caruzo-Nevec // Braz. J. Med. Biol. Res. – 1993. – V. 26. – P. 373-381. 688. Vinckier, A. Measuring elasticity of biological materials by atomic force microscopy / A. Vinckier, G. Semenza // FEBS Lett. – 1998. – V. 430. – P. 12-16. 689. Vinton, N.E. Taurine concentrations in plasma, blood cells, and urine of children undergoing long-term total parenteral nutrion / N.E. Vinton, S.A. Laidlaw, M.E. Amet, J.D. Koople // Pediatr. Res. – 1987. – V. 21. – P. 399-403. 690. Vogel, J.M. Centrosomes isolated from Spisula solidissima oocytes contain rings and an unusual stoichiometric ratio of alpha/beta tubulin / J.M. Vogel, T. Stearns, C.L. Rieder, R.E. Palazzo // J. Cell Biol. – 1997. – V. 137 (l). –P. 193-202. 691. Vorobjev, I.A. Contribution of plus and minus and pathways to microtubule turnover / I.A. Vorobjev, V.I. Rodionov, I.V. Maly, G.G. Borisy // J. Cell Sci. – 1999. – V. 112. – P. 227-2285. 692. Waisman, D.M. Studies of the Ca2+ transport mechanism of human erythrocyte inside-out plasma membrane vesicles. II Stimulation of the Ca2+ pump by phosphate / D.M. Waisman, J.M. Gimble, D.B.P. Goodman, H. Rasmussen // J. Biol. Chem. – 1981. – P. 415-419. 693. Wakabayashi, S. Molecular physiology of vertebrate Na+/H+ exchangers / S. Wakabayashi, M. Shigekawa, J. Pouyssegur // Physiol. Rev. – 1997. – V. 77. – P. 5174. 694. Walter, J. Chromosome order in Hela cells changes during mitosis and early G 1, but is stably maintained during subsequent interphase stages / J. Walter, L. Schermell, M. Cremer, S. Tashiro, T. Cremer // J. Cell Biol. – 2003. – V. 160. – P. 685-697. 695. Wan, X. Responses of neurons to extreme osmomechanical stress / X. Wan, J.A. Harris, C.E.J. Morris // Membr. Biol. – 1995. – V. 145. – P. 21–31. 696. Wang, H.B. Substrate flexibility regulates growth and apoptosis of normal but not transformed cells / H.B. Wang, M. Dembo, Y.L. Wang // Am. J. Physiol. Cell Physiol. – 2000. – V. 279. – P. C1345-C1350. 697. Wang, Y. Loss of PIP5KIγ, unlike other PIP5KI isoforms, impairs the integrity of 386 the membrane cytoskeleton in murine megakoryocytes / Y. Wang, R.I. Litvinov, X. Chen, T.L. Bach, L. Lian, B.G. Petrich, S.J. Monkley, Y. Konaho, D.R. Critchly, T. Sasaki, M.J. Birhbaum, J.W. Weisel, J. Hartwig, C.S. Abrams // J. Clin. Invest. – 2008. – V. 118. – P. 812-819. 698. Watson, P.A. Function follows form: generation of intracellular signal by cell deformation / P.A. Watson // FASEB J. – 1991. – V. 5. – P. 2013-2019. 699. Weed, I. Metabolic dependence of red cell deformability / I. Weed, P.L. La Celle, E.W. Merrill // J. Clin. Invest. – 1969. – V. 48. – P. 795-809. 700. Weekes, J. Acidic phospholipids inhibit intramolecular association between the N-and C-terminal regions of vinculin exposing actin-binding and protein kinase C phosphorylation sites / J. Weeks, S.T. Barry, D.R. Gitchley // Biochem. J. – 1996. – V. 314. – P. 827-832. 701. Weihing, R.R. The filamins: properties and functions / R.R. Weihing // Can. J. biochem. – 1985. – V. 63. – P. 397-413. 702. Weis, L. Some comments on RNA as a component of the cell periphery / L. Weis // Wistar Inst. Symp. Monogr. -1968. – V. 8. – P. 73-89. 703. Weiss, R.M. Molecular basis of cell-cell recognition / R.M. Weiss, H.M. McConell // Cell Funct. Differ. – 1982. – V. 102 (Pt. A). – P. 331-336. 704. Weiss, W. Structural basis of lectin-carbohydrate recognition / W. Weiss, K. Drickamer // Annu. Rev. Biochem. – 1996. – V. 65. – P. 441-473. 705. Welch, A.Y. Arf6 modulates the beta-actin specific capping protein, beta-cap 73 / A.Y. Welch, K.N. Riley, C. D’Souza-Schorey, I.M. Herman // Method Enrymol. – 2005. – V. 404. – P. 377-487. 706. Wenisch, C. High-close catecholamine treatment decreases polymorphonuclear leukocyte phagocytic capacity and reactive oxygen production / C. Wenisch, B. Parschalk, A. Weiss // Clin. Diagh. Lab. Immunol. – 1996. – V. 3. – P. 423-428. 707. Wilhelsmen, K. Nesprin-3, a novel outer nuclear membrane protein, associates with the cytoskeletal linker protein plectin / K. Wilhelsmen, S. Litjens, I. Kuikman, N. Tshinbalanga, H. Jansen, I. van den Bout, K. Raymond, A. Sonnehbery // J. Cell Biol. – 2006. – V. 171. – P. 799-810. 387 708. Willoch, M. Changes in HeLa cell ultrastructure under conditions of reduced glucose supply / M. Willoch // Acta. Path. Microbiol. Scand. – 1967. – V. 71. – P. 3545. 709. Winder, B.J. Utrophin actin binding domain: analysis of actin binding and cellular targeting / B.J. Winder, L. Hemmings, S.K. Maciver, S.J. Boltob, J.M. Tinsley, K.E. Davies, D.R. Kritchley, K. Kendrick-Jones // J. Cell Sci. – 1995. – V. 108. – P. 63-71. 710. Winder, S.J. Actin-binding proteins / S.J. Winder, K.R. Ayscouyh // J. Cell Sci. – 2005. – V. 118. – P. 651-654. 711. Witkowski, J.M. Modulation of the activity of calcium-activated neutral proteases (calpains) in chronic lymphocytic leukemia (B-CLL) cells / J.M. Witkowski, E. Zmuda-Trrebiatowska, J.M. Swiercz, M. Cichorek, H. Ciepluch, K. Lewandowski, E. Bryl, A. Hellmann // Blood. – 2002. – V. 100 (5). – P. 1802-1809. 712. Wittmann, T. Cell motility: can Rho GTPases and microtubules point the way? / T. Wittmann, C.M. Waterman-Storer // J Cell Sci. – 2001. – V.14 (Pt. 21). – P. 379537803. 713. Wojcikiewicz, E.P. Force and compliance measurements on living cells using atomic force microscopy (AFM) / E.P. Wojcikiewicz, X. Zang, Y. Moy // Biol. Proced. Online. – 2003. – V. 6(1). – P. 1-9. 714. Wong, A.J. Myosin from human erythrocytes / A.J. Wong, D.P. Kiehart, T.D. Pollard // J. Biol. Chem. – 1985. – V. 260. – P. 46-49. 715. Wong, S.M., Cell swelling increases intracellular free [Ca2+]i in cultured toad bladder cells / S.M. Wong, M.C. DeBell, H.S. Chase // Am. J. Physiol. – 1990. – V.258. – P. F292-F296. 716. Wong, S.M.E. Role of intracellular calcium in cellular volume regulation / S.M.E. Wong, H.S. Chase // Amer. J. of Physiol. – 1986. – V. 250. – P. C849-C852. 717. Woo, M.S. Ribosomal S6 kinase (RSK) regulates phosphorylations of filamin-a on an important regulatory site / M.S. Woo, Y. Ohta, I. Rabinovitz, T.P. Stossel, J. Blonis // Mol. Cell Biol. – 2004. – V. 24. – P. 3025-3035. 718. Woods, A.J. Paxillin associate with poly(A)-binding protein 1 at the dense 388 endoplasmic reticulum and the leading adge of migrating cells / A.J. Woods, M.S. Roberts, J. Choudhary, S.T. Barry, Y. Mazaki, H. Sabe, I. Morley, D.R. Critchley, J.C. Norman // J. Biol. Chem. – 2002. – V. 277. – P. 6428-6437. 719. Wormun, H.J. Nuclear envelope, nuclear lamina, and inherited disease / H.J. Wormun. J.C. Courvalin // Iht. Rev. Cytol. – 2005. – V. 246. – P. 246-231-279. 720. Wu, C. Migfilin and its biding partners from cell biology to human diseases / C. Wu // J. Cell Sci. – 2005. – V. 118. – P. 659-664. 721. Wymann, M.P., Schneiter R. Lipid signaling in discose / M.P. Wymann // Nat. Rev. Moll. Cell Biol. – 2008. – V. 9. – P. 162-176. 722. Yancey, P.H. Compatible and counteracting solutes / P.H. Yancey // Cellular and molecular physiology of cell volume regulation / ed. K. Strange. – Boca-Raton, FL: CRC, 1994. – P. 81-109. 723. Yancey, P.H. Water, stress, osmolytes and proteins / P.H. Yancey // Am. Zool. – 2001. – V. 41. – P. 699-709. 724. Yancey, P.H. Living with water stress: evolution of osmolyte systems / P.H. Yancey, M.E. Clark, S.C. Hand, R.D. Bowlus, G.N. Somero // Science. – 1982. – V. 217. – P. 1214-1222. 725. Yancey, P.H. Counteracting effects of urea and betaine in mammalian cells in culture / P.H. Yancey, M. Burg // Am. J. Physiol. – 1990. – V. 258. – P. R198-R204. 726. Yang, F. Indentation of an incompressible elastic layer / F. Yang // Mech. Materials. – 1998. – V. 30. – P. 275-286. 727. Yang, J. All aboard the cyclin train: subcellular trafficking of cyclins and their CDK partners / J. Yang. S. Kornbluth // Trends Cell Biol. – 1999. – V. 9 (6). – P. 207-210. 728. Yao, X. Polarized distribution of actin isoforms in gastric parietal cells / X. Yao, C. Chaponnier, G. Gabbiani, J.C. Forte // Mol. Biol. Cell. – 1995. – V. 6. – P. 541557. 729. Yao, X. Biochemical characterization of ezrin-actin interaction / X. Yao, L. Cheng, J.G. Forte // J. Biol. Chem. – 1996. – V. 271. – P. 7224-7229. 730. Yao, Y. Dynamics structure of the calmodulin-binding domain of the plasma 389 membrane Ca-ATPase in native erythrocyte ghost membranes / Y. Yao, J. Gao, T.C. Squier // Bichemestry. – 1996. – V. 35(37). – P. 12015-12028. 731. Yarom, R. Electron microscopic X-ray microanalysis of normal and leukemic human lymphocytes / R. Yarom, T.A. Hall, A. Polliack // Proc. Natl. Acad. Sci. USA. – 1976. – V. 73 (10). – P. 3690-3694. 732. Yeng, T. Effects of substrate stiffness ob cell morphology cytoskeletal structure and adhesion / T. Yeng, P.C. Georges, L.A. Flanagan, B. Marg, M. Ortiz, M. Funaki, N. Zahir, W. Ming, V. Weaver, P. Zanmey // Cell motility and the cytoskeleton. – 2005. – V. 60. – P. 24-34. 733. Yin, H.L. Ca2+ control of acting elation with actin filaments and regulation of acting elation / H.L. Yin, K.S. Zaner, T.P. Stossel // J. Biol. Chem. – 1980. – V. 255. – P. 9494-9500. 734. Yoshida, T. Transcription regulation of ompF and ompC by a single transcription factor ompR / T. Yoshida, L. Qin, L.A. Egger, M. Inouye // J. Biol. Chem. – 2006. – V. 281 (25). – P. 17114-171123. 735. Young, R.G. Spectrin repeat proteins in the nucleus / R.G. Young, R. Kothary // Bio Essays. – 2005. – V. 27. – P. 144-152. 736. Zauli, D. Cytoskeleton otganization of normal and neoplastic lymphocytes and lymphoid cell lines of T and B origin / D. Zauli, M. Gobbi, C. Crespi, P.L. Tazzari, F. Miserocchi, A. Tassinazi // Br. J. Haematol. – 1988. – V. 68 (4). – P. 405-409. 737. Zhang, Q. Nesprins: a novel family of spectrin-repeat-containing proteins that localize to the nuclear membrane in multiple tissue / Q. Zhang, J.N. Skepper, F. Yang, J.D. Davies, L. Heggi, P.C. Roberts, P.L. Weissber, J.A. Elis, C.M. Shanehan // J. Cell. Sci. – 2001. – V. 114. – P. 4485-4498. 738. Zhang, Y. On the discrepancy between whole cell and membrane patch mechanosensitivity in Xenopus oocytes / Y. Zhang, O.P. Hamill // J. Physiol. – 2000. – V. 523(Pt 1). – P. 101–115. 739. Zhang, Z. Ataxia telangiectasia-mutated, aDNA damage-inducible kinase, contributes to high NaCl-induced nuclear localization of transcription factor TonEBP/OREBP / Z. Zhang, J.D. Ferraris, C.E. Irarrazabab, N.I. Dmitrieva, J.H. 390 Dark, M.B. Burg // Am. J. Physiol. – 2005. – V. 289. – P. F506-F511. 740. Ziegler, J.J. The role of various membrane transport mechanisms on erythrocyte osmotic resistance to lysing in the American Bullfrog (Rana Catesbelana): a thesis master of biological science / Ziegler Jenifer J. – Emporia State University, 2012. – 40 p. 741. Zimm, B.H. Use of the Poisson-Boltzmann equation to predict ion condensation around polyelectrolytes / B.H. Zimm // Coulombic interactions in macromolecular systems / ed. J.M. Comstock. – Washington: DC, 1986. – P. 212-215. 742. Zink, D. Nuclear structure in cancer cells / D. Zink, A.H. Fisher, J.A. Nickerson //Nature Rev. Cancer. -2004. – V. 6. – P. 677-687. 743. Ziyaden, F.N. Hypotonicity and cell volume regulation in shark rectal gland: role of organic osmolytes and F-actin / F.N. Ziyaden, J.W. Mills, A. Klinzdler // Am. J. Physiol. – 1992. – V. 262. – P. F468-F479. 744. Zweifach, A. Mitogen-regulated Ca2+ current of T-lymphocytes is activated by depletion of intracellular Ca2+ stores / A. Zweifach, R.S. Lewis // Proc. Nat. Acad. Sci. USA. – 1993. – V. 90. – P. 6295-6299.