Контрольная работа №3. РЕШЕНИЯ.
advertisement
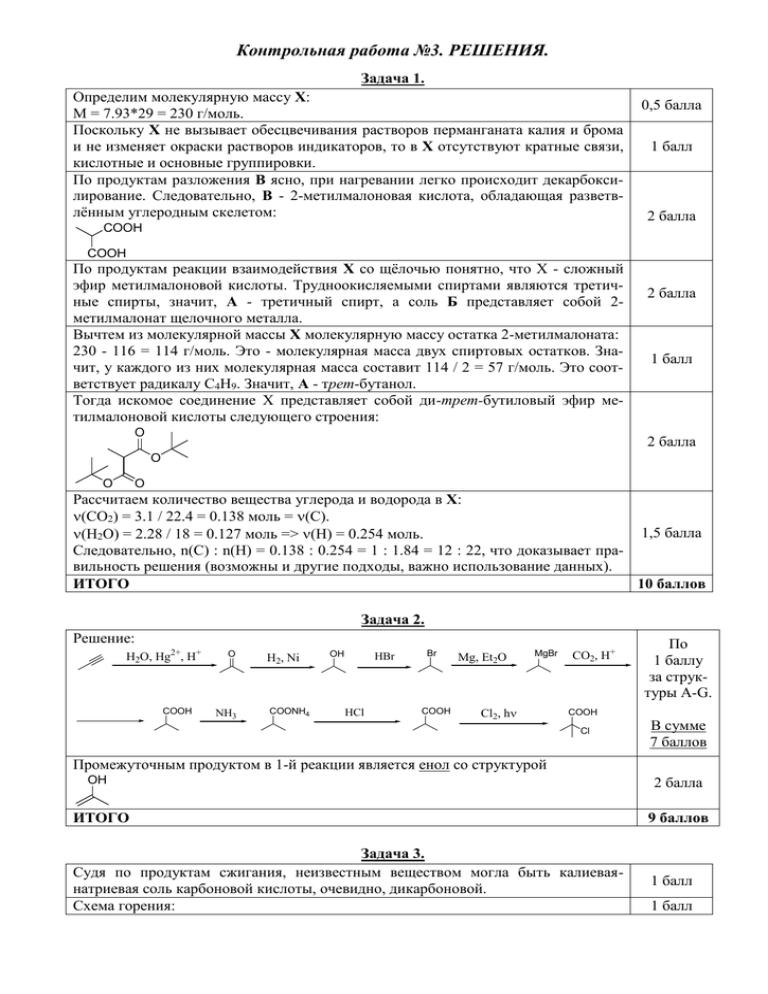
Контрольная работа №3. РЕШЕНИЯ. Задача 1. Определим молекулярную массу Х: M = 7.93*29 = 230 г/моль. Поскольку Х не вызывает обесцвечивания растворов перманганата калия и брома и не изменяет окраски растворов индикаторов, то в X отсутствуют кратные связи, кислотные и основные группировки. По продуктам разложения В ясно, при нагревании легко происходит декарбоксилирование. Следовательно, В - 2-метилмалоновая кислота, обладающая разветвлённым углеродным скелетом: 0,5 балла 1 балл 2 балла COOH COOH По продуктам реакции взаимодействия Х со щёлочью понятно, что Х - сложный эфир метилмалоновой кислоты. Трудноокисляемыми спиртами являются третичные спирты, значит, А - третичный спирт, а соль Б представляет собой 2метилмалонат щелочного металла. Вычтем из молекулярной массы Х молекулярную массу остатка 2-метилмалоната: 230 - 116 = 114 г/моль. Это - молекулярная масса двух спиртовых остатков. Значит, у каждого из них молекулярная масса составит 114 / 2 = 57 г/моль. Это соответствует радикалу C4H9. Значит, А - трет-бутанол. Тогда искомое соединение Х представляет собой ди-трет-бутиловый эфир метилмалоновой кислоты следующего строения: O 2 балла 1 балл 2 балла O O O Рассчитаем количество вещества углерода и водорода в Х: (CO2) = 3.1 / 22.4 = 0.138 моль = (C). 1,5 балла (H2O) = 2.28 / 18 = 0.127 моль => (H) = 0.254 моль. Следовательно, n(C) : n(H) = 0.138 : 0.254 = 1 : 1.84 = 12 : 22, что доказывает правильность решения (возможны и другие подходы, важно использование данных). ИТОГО 10 баллов Задача 2. Решение: H2O, Hg2+, H+ COOH O NH3 H2, Ni COONH4 OH HBr HCl Br COOH Mg, Et2O MgBr Cl2, h CO2, H+ По 1 баллу за структуры А-G. COOH Cl В сумме 7 баллов Промежуточным продуктом в 1-й реакции является енол со структурой OH 2 балла ИТОГО 9 баллов Задача 3. Судя по продуктам сжигания, неизвестным веществом могла быть калиеваянатриевая соль карбоновой кислоты, очевидно, дикарбоновой. Схема горения: 1 балл 1 балл CaHbOcKdNae + O2 = (a-d/2)CO2 + (d/2)K2CO3 + (e/2)Na2CO3 + (b/2)H2O Найдём количества веществ продуктов реакции: (CO2) = 2.016 / 22.4 = 0.09 моль; (K2CO3) = 2.07 / 138 = 0.015 моль; (Na2CO3) = 1.59 / 106 = 0.015 моль; (H2O) = 1.08 / 18 = 0.06 моль. Тогда количества веществ элементов: (C) = 0.09 + 0.015 + 0.015 = 0.12 моль; (Na) = (K) = 0.015 * 2 = 0.03 моль; (H) = 0.06 * 2 = 0.12 моль. Отношение количеств элементов: a:b:d:e = 0.12 : 0.12 : 0.03 : 0.03 = 4 : 4 : 1 : 1. Следовательно, брутто-формула соединения - C4H4KNa Если это действительно соль дикарбоновой кислоты, то должно быть ещё как минимум 4 атома кислорода. Тогда простейшая брутто-формула - C4H4KNaO4. если в кислоте содержался 1 атом калия, то её количество вещества равно 0.03 моль, а молекулярная масса M = 6.3 / 0.03 = 210 г/моль. M(C4H4KNaO4) = 178 г/моль. Не хватает 32 г/моль, что может соответствовать ещё двум атомам кислорода. Тогда искомое вещество - тартрат натрия-калия (калий-натрий виннокислый): OH KOOC COONa 1 балл 1 балл 0.5 балла 1 балл 0.5 балла 2 балла OH ИТОГО Задача 4. Брутто-формула алифатических одноатомных спиртов СnH2n+2O. Запишем схематично возможные процессы, протекающие в системе: 1) CnH2n+2O + CnH2n+2O = CnH2n+1OCnH2n+1 + H2O; 2) CnH2n+2O + CxH2x+2O = CxH2x+1OCnH2n+1 + H2O; 3) CxH2x+2O + CxH2x+2O = CxH2x+1OCxH2x+1 + H2O; 4) CnH2n+2O = CnH2n + H2O; 5) CxHyOH = CxH2x + H2O; Поскольку в продуктах только 4 органических соединения, то один из спиртов не подвергается дегидратации или не образует сложного эфира в таких условиях. В первом случае это может быть метанол, во втором случае - трет-бутанол. Рассмотрим первый случай, которому соответствуют реакции 1-4. Тогда спирт X метанол с молекулярной массой 32 г/моль. Поскольку органические вещества образовались в равных мольных соотношениях, то в каждой из реакций выделится по 14.4 / 4 = 3.6 г воды (3.6 / 18 = 0.2 моль соответственно). Тогда каждого органического соединения тоже образовалось по 0.2 моль. Составим уравнение: (14n+1+16+14n+1)*0.2+(14n+1+31)*0.2+46*0.2+14n*0.2=52.8 Решив уравнение, получим n=3. Значит, второй спирт - один из пропанолов (пропанол-1 или пропанол-2). Проверим, является ли правильным также и второй вариант. В этом случае спирт N - трет-бутанол с молекулярной массой 74 г/моль. Этому случаю будут соответствовать уравнения 2-5 и каждого продукта также образуется по 0.2 моль. Составим уравнение: (14n+1+14x+1+16)*0.2+(14x+1+14x+1+16)*0.2+14n*0.2+14х*0.2=52.8 Упростив уравнение, получим соотношение n + 2x = 8.14 Это уравнение не имеет целых корней и, следовательно, второй случай невозможен. 8 баллов 5 баллов 2 балла 1 балл 1 балл 1 балл 2 балла ИТОГО 12 баллов Задача 5. В твёрдых жирах содержатся остатки предельных карбоновых кислот (в жидких непредельные). Поэтому общей формулой жира в задаче будет следующая: H2C O-C(O)CnH2n+1 HC O-C(O)CmH2m+1 H2C O-C(O)CxH2x+1 2 балла Найдём общее количество вещества гидроксида калия: m(KOH) = 38*1.18*0.25 = 11.21 г, (KOH) = 11.21 / 56 = 0.2 моль. При нейтрализации расходуется 40.2*1.06*0.12 = 5.11 г соляной кислоты. (HCl) = 5.11 / 36.5 = 0.14 моль. HCl + KOH = KCl + H2O Тогда в избытке 0.14 моль гидроксида калия, а в реакцию вступило 0.2 - 0.14 = 0.06 моль KOH. Поскольку для полного омыления жира необходим тройной эквивалент щёлочи, то количество вещества жира составит 0.02 моль, а его молекулярная масса будет равна 13.32 / 0.02 = 666 г/моль. Вычтем из молекулярной массы жира молекулярную массу глицеринового фрагмента. Тогда суммарная молекулярная масса кислотных остатков составит 666 - 41 = 625 г/моль. При избыточном подкислении раствора в осадке могут быть только длинноцепные карбоновые кислоты, поскольку H2C O-C(O)R1 HC O-C(O)R2 H2C O-C(O)R3 + 3KOH R1COOK + R2COOK + R3COOK + HOCH2CH(OH)CH2OH 2 балла 2 балла 1 балл 2 балла RCOOK + H+ = RCOOH + K+. Из длинноцепных карбоновых кислот наиболее часто в твёрдых жирах встречаются две из них - стеариновая C17H35COOH с молекулярной массой 284 г/моль и 2 балла пальмитиновая C15H31COOH с молекулярной массой 256 г/моль. Пусть жир содержал х остатков стеариновой и y остатков пальмитиновой кислот. Тогда 0.02*284x + 0.02*256y = 10.8 Упростив, находим 284х + 256у = 540, что возможно только при х = у = 1. 2 балла Итак, жир содержит один остаток стеариновой и один остаток пальмитиновой кислоты. Вычислим молекулярную массу третьего остатка: M = 666 - 283 - 255 - 41 = 87 г/моль. Это соответствует остатку масляной кислоты 1 балл С3Н7СОО. Возможной формулой жира является любая, содержащая 1 остаток стеариновой, 1 балл один остаток пальмитиновой и один остаток масляной кислоты в молекуле. ИТОГО 15 баллов Задача 6. 1) Определим состав вещества А: 48.60 8.10 43.30 ∶ ∶ = 4.05 ∶ 8.10 ∶ 2.71 = 1.5 ∶ 3 ∶ 1 = 3 ∶ 6 ∶ 2 12 1 16 Это соединение С3H6O2. 0,5 балла за расчёт и бруттоформулу Определим вещество Д: 54.54 9.09 36.37 1 балл за ∶ ∶ = 4.545 ∶ 9.09 ∶ 2.273 = 2 ∶ 4 ∶ 1 расчёт и 12 1 16 Д имеет состав С2H4O. Судя по реакции с гидросульфитом натрия, вещество Д - структуру уксусный альдегид (этаналь) - CH3C(O)H. Реакция с гидросульфитом натрия: SO3Na 1 балл O + NaHSO3 OH Продукт реакции действительно содержит 32 / 148 = 0.216 (21.6 %) серы. Тогда: COOH 1) KOH 2) HCl COOH OH 0,5 балла N HCN HOH O OH NH3 + HCN Cl2 COOH HONO Cl N 1) NH3 2) HCl COOH NH2 По 1 баллу за структуры А, Б, В, Г, Е, Ж. HCl, H2O NH2 или В сумме 6 баллов COOH NH3+Cl- 2) Механизмы: А→Б: Радикальное замещение; Б→В: Нуклеофильное замещение с последующим кислым гидролизом; Б→Г: Нуклеофильное замещение с последующим кислым гидролизом; Е→Г: Электрофильное присоединение (ответ «гидролиз» допустим); Д→Е: Нуклеофильное присоединение; Д→Ж: Нуклеофильное присоединение; Ж→В: Электрофильное присоединение (ответ «гидролиз» допустим); В→Г: Элиминирование (верен и ответ «диазотирование с отщеплением»). 3) Для Г характерны структурная и оптическая типы изомерии. ИТОГО По 0,5 балла за верный ответ. В сумме 4 балла. 1 балл 14 баллов