Жгутиковым протистам
advertisement
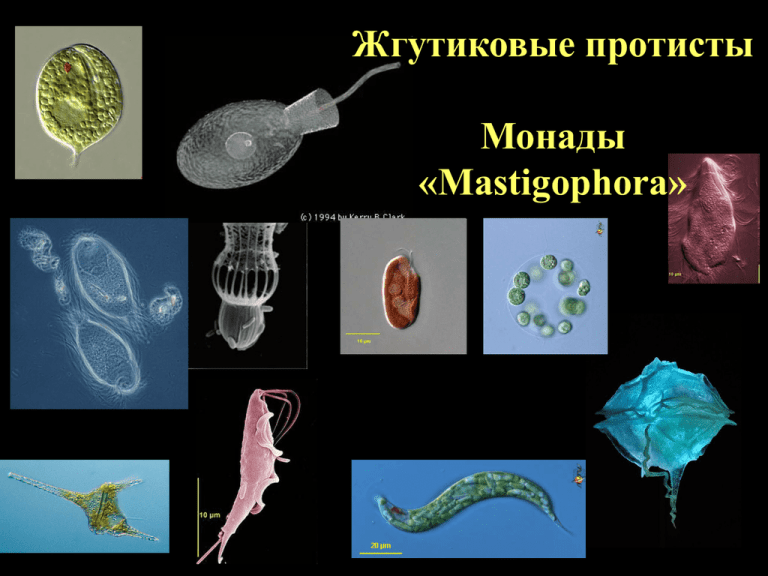
Жгутиковые протисты Монады «Mastigophora» Butschli, 1881 Тип Protozoa Класс Mastigophora От «ЕДИНОЙ ФИЛОГЕНЕТИЧЕСКОЙ ВЕТВИ» Levine et al., 1980 Подцарство Protozoa Тип Sarcomastigophora Кл. Mastigophora п/кл. Phytomastigina п/кл. Zoomastigina Leedale, 1974 18 царств, из них 7 царств - жгутиконосцы Cavalier-Smith, 1978 7 царств, из них 6 царств - жгутиконосцы До «неродственных» групп, «КОНСТРУКТИВНОГО ПРИНЦИПА ОРГАНИЗАЦИИ КЛЕТКИ» Монадная организация клетки встречается во всех филогенетических стволах эукариот. Это конструктивный принцип организации клетки Rhizaria Hacrobia Archaeplastida Alveolata Opisthokonta Heterokonta Excavata Amoebozoa Основные группы жгутиковых протистов т. Choanomonada т. Chlorophyta т. Cryptophyta т. Dinophyta т. Euglenozoa н/т. Ochrophyta т. Labyrinthomorpha т. Opalinata т.Diplomonadida т. Parabasalia Основные группы жгутиковых протистов Archaeplastida Hacrobia Alveolata Opisthokonta Choanomonada Chlorophyta Cryptophyta Dinophyta Excavata Heterokonta Euglenozoa Ochrophyta Labyrinthomorpha Opalinata Diplomonadida Parabasalia Количество жгутиков Двужгутиковые Chlamydomonas sp. Одножгутиковые Protoopalina sp. Многожгутиковые мастигонемы Изоконтные Анизоконтные Жгутики сходны по строению, но разной длины Жгутики одинаковы по длине и строению Гетероконтные Жгутики различаются по строению Мастигонемы, выявляемые у Chlamydomonas sp. методом иммунофлюоресцентного анализа (из Nakamura et al., 1996) На поверхности ундулиподий часто присутствуют мастигонемы и чешуйки Мастигонемы Entosiphon sp. ундулиподия Mamiella gilva чешуйки Piramimonas tetrarhynchus Основные группы жгутиковых протистов Archaeplastida Hacrobia Alveolata Opisthokonta Choanomonada Chlorophyta Cryptophyta Dinophyta Excavata Heterokonta Euglenozoa Ochrophyta Labyrinthomorpha Opalinata Diplomonadida Parabasalia Компоненты жгутикового аппарата Клеточная мембрана 1. Ундулиподия 2. Кинетосома 2. Кинетосома 3. Корешковый аппарат 1. У н д у л и п о д и я Радиальные спицы •п о п е р е ч н ы й с р е з В-микротрубочка А-микротрубочка Нексиновые мостики Trypanosoma sp. Мембрана Динеиновые ручки Центральный дуплет микротрубочек Центральный футляр Периферические дуплеты микротрубочек Параксиальный тяж Срезы через жгутик воротничкового Жгутиконосца (тип Choanomonada) 1 3 2 4 Поперечный срез через кинетосому жгутика в верхней ее части в нижней ее части ундулиподия Корешковый аппарат кинетосомы Protoopalina sp. корешки а Ундулирующая мембрана Trypanosoma sp. Рис. 19. Пелликула и жгутик Trypanosoma sp., поперечный срез (а – электронограмма, б – схема). Оригинальное фото А. О. Фролова. Различное строение ундулирующей мембраны трихомонад (т. Parabasalia). Направление движения клеток у разных жгутиконосцев Прикрепление и внедрение Trypanosoma rangeli в клетки кишечного эпителия Rhodinus prolixus (из de Oliveira, de Souza, 2001). Типы организации поверхностного аппарата 1. Тубулемма (Euglenozoa: Kinetoplastida) Trypanosoma sp. Плазматическая мембрана микротрубочки 2. Пелликула эвгленоидного типа (Euglenozoa) Микротрубочки Euglena oxyuris Белковые пластины Cyclidiopsis sp. Euglena mutabilis, метаболирующее движение 3. Пелликула Dinophyta Peridinium sp. Ceratium sp. Минеральные Альвеолы пластины Клеточная мебрана Ceratium hirudinella 4. Клеточная стенка (Chlorophyta) Фибриллы целлюлозы «Домики» Dinobrion sp. (Chrysophyta) Кокколиты некоторых представителей Haptophyta Питание жгутиконосцев АВТОТРОФИЯ • Хлорофиллы A, C2 α, β каротины • Тилакоиды – по два, с фикобилинами • Запасное питательное вещество – крахмал • Нуклеоморф Cryptophyta • 4 мембраны вокруг хлоропласта • Хлорофиллы A, C1, С2, С3 α-каротин, β-каротин, γ-каротин • Тилакоиды по 3 • Запасное питательное вещество – хризоламинарин, жир. Ochrophyta Xanthophyta Chrysophyta Haptophyta • 4 мембраны вокруг хлоропласта • Хлорофиллы A, C1, С2 α-каротин, β-каротин • Тилакоиды по 3 • Запасное питательное вещество – крахмал (в цитоплазме). • 3 мембраны вокруг хлоропласта Dinophyta • Хлорофиллы A, В β-каротин • Тилакоиды по 3 • Запасное питательное вещество – парамилон (в цитоплазме). • 3 мембраны вокруг хлоропласта Euglenozoa • Хлорофиллы A, В β-каротин • Тилакоиды в стопках - гранах • Запасное питательное вещество – крахмал (в хлоропласте). • 2 мембраны вокруг хлоропласта Chlorophyta небольшое отступление Симбиогенетическая гипотеза от К.С. Мережковского (1905) и А.С.Фаминцына (1907) до Linn Margulis (Origin of Eukaryotic Cells, 1970) Я МХ Первичный эндосимбиоз с Альфапротеобактерией Первичный эндосимбиоз с цианобактерией Я Я ХЛ Rhodophyta ХЛ Chlorophyta Симбиогенетическая гипотеза происхождения ДНК-содержащих органоидов Я Я МХ Я ХЛ ХЛ Rhodophyta Rhodophyta Вторичный эндосимбиоз. Использование хлоропласта Rhodophyta Вторичный эндосимбиоз. Использование всей клетки Rhodophyta МХ Я Я ри ХЛ МХ Dinophyta ХЛ НМФ Cryptophyta (без нуклеоморфы – представители Ochrophyta) Я МХ Я ХЛ Chlorophyta Вторичный эндосимбиоз. Использование хлоропласта Chlorophyta Я ХЛ МХ Euglenozoa группа жгутиконосцев тип Cryptophyta тип Euglenozoa тип Prasinom onada тип Euchlorom onada тип Dinophyta тип Chlorophyta тип Eustigm atophyta тип Chrysophyta тип Xanthophyta тип Haptophyta бесцветны е фаготрофны е формы формы + + + + + + + + + + + + + + + + + + + + Из: Серавин, 1984 Питание жгутиконосцев ГЕТЕРОТРОФИЯ Bodo saltans (тип Euglenozoa, класс Kinetoplastida) Peranema sp. тип Euglenozoa, класс Euglenoidea тип Choanomonada Salpingoeca rosetta одиночная клетка Salpingoeca rosetta колония Цитоскелет и отдельные органоиды жгутиконосцев Campylomonas sp. Proteomonas sp. Cryptophyta цитоскелет Tritrichomitus sp. Tetratrichomonas sp. Trichomitopsis sp. Trichomonas sp. Trichomitus sp. т. Parabasalia Trichomonas muris Joenia sp. (т. Parabasalia: Trichonymphida) пельта ундулиподии жгутов ядро парабазальное тело аксостиль Форма крист митохондрий пластинчатые пузырьковидные трубчатые ампуловидные Tubulicristata Lamellicristata т.Cryptophyta т.Dinophyta т.Chlorophyta н/т.Ochrophyta т.Labyrinthomorpha т.Opalinata т.Choanomonada т.Euglenozoa кинетопласт ядро (Euglenozoa: Kinetoplastida) Кинетопласт (Euglenozoa: Kinetoplastida) Схема строения зоны сочленения митохондрии и кинетосомы жгута у Trypanosomatida. Ядерный аппарат, размножение и жизненные циклы жгутиконосцев Opalina ranarum Giardia lamblia Diplomonadida Opalina spp. Opalinata Dinophyta («мезокариоты») Упаковка хроматина в «мезокариотном» ядре Dinophyta Упаковка хроматина в ядре эукариотной клетки Dinophyta («мезокариоты») •Крупное ядро без нуклеосом. •Постоянно конденсированные хромосомы. •Кольцевая ДНК – плотно упакована. •Небольшое (по сравнению с другими эукариотами) количество гистонов. • Во время деления ядра хромосомы связаны не с центриолями, а с ядерной оболочкой. Митоз закрытого типа. т.Chlorophyta полузакрытый ортомитоз т.Cryptophyta открытый ортомитоз т.Dinophyta т.Choanomonada закрытый внеядерный плевромитоз полузакрытый ортомитоз т.Euglenozoa Ochrophyta т.Opalinata т.Labyrinthomorpha открытый ортомитоз закрытый ортоплевромитоз т.Parabasalia закрытый внеядерный плевромитоз Основные группы жгутиковых протистов Archaeplastida Hacrobia Alveolata Opisthokonta Choanomonada Chlorophyta Cryptophyta Dinophyta Excavata Heterokonta Euglenozoa Ochrophyta Labyrinthomorpha Opalinata Diplomonadida Parabasalia Гидрогеносомы Trichomonas foetus Figure 1. Electron micrographs of Trichomonas foetus. (a) Seven hydrogenosomes (H) can be identified in the cytoplasm (A, axostyle; G, Golgi apparatus; N, nucleus). (b) At higher magnification, the double membrane that surrounds the hydrogenosomes can be identified (M, marginal plate). Scale bar: 1 micrometer. (c) Trichomonas vaginalis (viewed through light microscopy) after a BSTP reaction in the presence of hydrogen, which allows the cytochemical identification of hydrogenase activity (Zwart et al. 1988). The natural size of the cell is approximately 10 × 45 micrometers. Modified from Hackstein and colleagues (2001) 1 - пируват-ферредоксин оксидоредуктаза; 4 – гидрогеназа; 2 – ацетат-сукцинат СоА трансферраза; 3 – сукцинат тиокиназа Figure 5. Metabolic scheme for a generalized type II anaerobe (e.g., Trichomonas vaginalis; Müller 1993, 1998). Pyruvate is formed in the cytoplasm (C) by glycolysis, imported into the hydrogenosome (H), and metabolized to acetate and carbon dioxide (CO2) under formation of molecular hydrogen (H2). ATP (adenosine triphosphate) is formed by substrate-level phosphorylation by the enzymes acetate succinyl CoA transferase (2) and succinate thiokinase (3). ATP is exported by the ADP/ATP carrier (5). The electrons resulting from the oxidative decarboxylation of pyruvate are transferred to a ferredoxin by pyruvate:ferredoxin oxidoreductase (1) and to protons by an iron hydrogenase (4). Recently, the presence of an NADH (nicotinamide adenine dinucleotide, reduced form) dehydrogenase has been postulated, which must be able to transfer electrons from reduced NAD (nicotinamide adenine dinucleotide) to the hydrogenase (Dyall et al. 2004b, Hrdy et al. 2004). Abbreviation: N, nucleus. Modified from Hackstein and colleagues (2001) Бесполое (агамное) размножение жгутиконосцев Бинарное деление клетки Cyclidiopsis sp. т. Euglenozoa: Euglenoidea Бесполое (агамное) размножение жгутиконосцев Бинарное деление монотомия равномерное деление клетки надвое с последующей стадией роста. (Euglenozoa: Euglenoidea) Euglena sp. Choanomonada: Агамное размножение Monosiga sp. Агамное размножение: бинарное деление п а л и н т о м и я: серия равномерных делений клетки надвое без стадии роста. Eudorina sp. (Chlorophyta) Каждая клетка колонии способна к делению Агамное размножение Палинтомия Volvox sp. (Chlorophyta) К делению способны только некоторые клетки Агамное размножение множественное деление Chlamydomonas sp. (Chlorophyta) Агамное размножение: множественное деление Leischmania sp. Giardia lamblia циста трофозоиты Diplomonadida Glossina palpales Gl.morsitans Trypanosoma brucei gambiense Tr. brucei rhodesiense Euglenozoa: Kinetoplastida Trypanosoma brucei gambiense Представители типа Parabasalia кл. Trichonymphida в кишечнике термитов Parabasalia: Trichonymphida Trichonympha sp. Зиготическая редукция Pseudotrichonympha grassi (Hypermastigina) из кишечникеа термита. A — под микроскопом в фазовом контрасте. B — то же при окраске люминесцентным красителем, выявляющим ядро. C — то же при использовании метода FISH (fluorescence in situ hybridization); зеленым цветом выделяются бактерии — внутриклеточные симбионты простейших, желтым — масса перерабатываемой древесины. Длина масштабной линейки 100 мкм. Фото из дополнительных материалов к обсуждаемой статье в Science Pseudotrichonympha grassii в кишечнике термита Coptotermes formosanus. желтым цветом показана симбиотическая бактерия (CfPt1-2 symbiont). Частицы древесины из кишечника термита заглатываются простейшим и находятся далее в пищевой вакуоли (food vacuole), где и происходит лизис целлюлозы и гемицеллюлозы. Моносахариды и водород, образующиеся при разложении целлюлозы, используются как источники энергии для азотфиксации (N2 fixation), которую проводят бактерии. Как выводятся соединения азота, пока неясно.

