Автореферат - Институт экологии и генетики микроорганизмов
advertisement

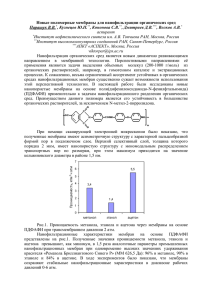
На правах рукописи КОРШУНОВА Ирина Олеговна ВЛИЯНИЕ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ НА МОРФОФУНКЦИОНАЛЬНЫЕ И НАНОМЕХАНИЧЕСКИЕ СВОЙСТВА РОДОКОККОВ 03.02.03 Микробиология Автореферат диссертации на соискание ученой степени кандидата биологических наук Пермь – 2016 Работа выполнена в лаборатории алканотрофных микроорганизмов ФГБУН Института экологии и генетики микроорганизмов УрО РАН, Пермь Научный руководитель: Доктор биологических наук Куюкина Мария Станиславовна Официальные оппоненты: доктор медицинских наук, заведующий отделом лабораторной диагностики инфекций, передающихся половым путем, и дерматозов ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава России Дерябин Дмитрий Геннадьевич, кандидат биологических наук, начальник отдела учебно-методического и научного обеспечения ГБОУ ВПО «Пермский государственный медицинский университет имени академика Е.А. Вагнера» Минздрава России Чемурзиева Наталья Вадимовна Ведущая организация: Казанский (Приволжский) федеральный университет, кафедра микробиологии (420008, г. Казань, ул. Кремлевская, 18) Защита диссертации состоится 28 апреля 2016 г. в 10.00 часов на заседании диссертационного совета ДМ 004.019.01 в Институте экологии и генетики микроорганизмов УрО РАН по адресу 614081, г. Пермь, ул. Голева, д. 13. Факс: (342) 280 92 11. Автореферат диссертации размещен на официальном сайте Министерства образования и науки РФ (http://vak.ed.gov.ru) и на сайте Института экологии и генетики микроорганизмов УрО РАН (http://www.iegm.ru). С диссертацией можно ознакомиться в библиотеке ИЭГМ УрО РАН и на сайте ИЭГМ УрО РАН (http://www.iegm.ru). Автореферат разослан «___» ___________ 2016 г. Ученый секретарь диссертационного совета, кандидат биологических наук Максимова Юлия Геннадьевна 3 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность проблемы. При получении ароматизаторов, фармацевтических препаратов, химически чистых реактивов часто используют бактериальные штаммы, устойчивые к органическим растворителям (Schmid et al., 2001; Heipieper et al., 2007). Проведение биокатализа в органической или водно-органической среде позволяет увеличить выход целевых продуктов трансформации водонерастворимых субстратов и облегчить процесс их выделения, а также снизить вероятность образования побочных продуктов и обеспечить термодинамическое равновесие реакционной системы (Безбородов и др., 2008; Bhattacharyya et al., 2012; Zingaro et al., 2013). При этом растворители используют в виде однофазных органических систем, двухфазных систем, состоящих из водной среды и гидрофобного растворителя, или смеси водной среды и гидрофильного растворителя (Carrea, Riva, 2000; Schmid et al., 2001). В качестве биокатализаторов применяют целые клетки или ферменты микроорганизмов. Использование целых клеток снижает стоимость производства и число этапов пробоподготовки, а также обеспечивает защиту ферментов от денатурации под действием растворителей (Ishige et al., 2005). Известно, что органические растворители нарушают структурную и функциональную целостность мембран, приводя к гибели бактериальных клеток. Обнаружена корреляция между токсичностью растворителя и степенью его гидрофобности, измеряемой как коэффициент распределения в системе н-октанол-вода logPO/W (Sikkema et al., 1995). Как правило, чем выше значение logPO/W, тем ниже токсичность растворителя. Однако в литературе имеются противоречивые сведения о воздействии растворителей на различные группы микроорганизмов и не выяснены до конца закономерности формирования устойчивых к растворителям фенотипов (Isken, de Bont, 1998; Segura et al., 1999; Duque et al., 2010). Перспективными агентами биотехнологии являются актинобактерии рода Rhodococcus, способные к селективной трансформации широкого спектра сложных органических веществ и устойчивые к экстремальным физико-химическим факторам среды (de Carvahlo, 2010; Kuyukina, Ivshina, 2010; Ivshina et al., 2012). Поэтому актуально исследование механизмов устойчивости родококков к воздействию растворителей. Возможность изучения структуры поверхности и наномеханических свойств микроорганизмов в физиологических условиях среды обеспечивает атомно-силовая микроскопия (АСМ) (Dufrêne, 2002). Сравнительно недавно появились работы с использованием совмещенных систем сканирования, в частности АСМ и конфокального лазерного сканирующего микроскопа (КЛСМ), перспективные для анализа морфологических, упругомеханических и наноструктурных перестроек бактериальных клеток под действием органических растворителей (Flores, TocaHerrera, 2009). Цель настоящей работы – исследование влияния органических растворителей на морфофункциональные и наномеханические свойства актинобактерий рода Rhodococcus, отбор устойчивых штаммов, перспективных для биотехнологического использования. Основные задачи исследования: 1. Изучить влияние органических растворителей на жизнеспособность родококков и отобрать наиболее устойчивые штаммы. 4 2. Исследовать динамику морфофункциональных перестроек бактериальных клеток при воздействии органических растворителей. 3. Определить упругомеханические и адгезионные характеристики устойчивых к растворителям родококков. 4. Оценить роль эффлюксных насосов в формировании устойчивости родококков к органическим растворителям. Научная новизна. Установлено, что актинобактерии рода Rhodococcus устойчивы к гидрофобным (logPO/W ≥ 2,5) и чувствительны к гидрофильным (logPO/W ≤ 0,9) растворителям. При этом отдельные представители R. opacus, R. ruber и ‘R. longus’ характеризуются множественной устойчивостью к органическим растворителям. Выявлено 1,2–7,0-кратное повышение степени жизнеспособности родококков в присутствии растворителей при культивировании в богатой питательной среде LB по сравнению с клетками, выращенными в минеральной среде RS. Показана способность родококков к диссоциации в присутствии н-декана или циклогексана с формированием более устойчивых к растворителям R-форм. С помощью комбинированного КЛСМ-АСМ сканирования впервые изучена динамика морфологических перестроек родококков под воздействием растворителей, выявлены изменения микро- и нанорельефа (на 14–79 и 1,3–2,5 нм соответственно) и увеличение (на 5–9 %) относительной площади поверхности жизнеспособных клеток. В режиме силового АСМ-картирования обнаружено снижение модуля упругости и перераспределение адгезивных участков на поверхности бактериальных клеток под воздействием растворителей. Выявленные изменения морфологических и наномеханических свойств коррелировали с повышением количества суммарных липидов (на 9–42 %) и скорости дыхания (на 3–34 мкл/мин) устойчивых к растворителям родококков. Впервые показано участие H+- и Na+-зависимых эффлюксных насосов в формировании устойчивости родококков к воздействию органических растворителей. Теоретическое и практическое значение работы. Полученные данные расширяют представление о механизмах устойчивости актинобактерий рода Rhodococcus к воздействию органических растворителей. Выявленные адаптационные механизмы включают изменение морфофизиологических и наномеханических свойств клеток, а также активацию работы эффлюксных насосов. В результате исследования отобраны штаммы R. opacus ИЭГМ 57, ИЭГМ 58, R. ruber ИЭГМ 326, ИЭГМ 343, ‘R. longus’ ИЭГМ 32, ИЭГМ 69, ИЭГМ 589, обладающие множественной устойчивостью к органическим растворителям и перспективные для биотехнологического использования. Предложен способ количественной оценки влияния растворителей на бактерии с помощью комбинированного КЛСМ-АСМ-сканирования, включающий дифференцированное определение морфометрических и наноупругих показателей живых и мертвых клеток. Данный способ и устойчивые к растворителям штаммы родококков могут быть использованы при оптимизации процессов биокатализа в двухфазных водно-органических системах. Основные положения, выносимые на защиту: 1. Актинобактерии рода Rhodococcus устойчивы к гидрофобным (logPO/W ≥ 2,5) и чувствительны к гидрофильным (logPO/W ≤ 0,9) растворителям. Отдельные представители R. opacus, R. ruber и ‘R. longus’ характеризуются множественной устойчивостью к органическим растворителям. 5 2. Воздействие органических растворителей приводит к изменению морфофизиологических характеристик родококков (относительной площади и шероховатости клеточной поверхности, количества суммарных липидов и дыхательной активности, а также диссоциации и агрегации клеток). 3. Воздействие органических растворителей приводит к изменению наномеханических свойств родококков, в частности к снижению их эластичности и перераспределению адгезивных участков клеточной поверхности. 4. В формировании устойчивости родококков к органическим растворителям принимают участие H+ и Na+-зависимые эффлюксные насосы. Апробация работы и публикации. Основные результаты исследований доложены и обсуждены на VI–VIII Всероссийском с международным участием Конгрессе молодых ученых-биологов «Симбиоз-Россия», Иркутск, 2013; Екатеринбург, 2014; Новосибирск, 2015; 18-ой и 19-ой международной Пущинской школе-конференции молодых ученых «Биология – наука XXI века», Пущино, 2014, 2015; II Всероссийской школе-конференции молодых ученых «Современные проблемы микробиологии, иммунологии и биотехнологии», Пермь, 2015; 18th International Microscopy Congress, Прага, Чехия, 2014; 12th Mutinational Congress on Microscopy, Эгер, Венгрия, 2015. По теме диссертации опубликовано 11 печатных работ, в том числе 3 статьи в журналах, входящих в утвержденный ВАК перечень рецензируемых научных изданий и международную систему научного цитирования Scopus (Прикладная биохимия и микробиология, Journal of Microbiological Methods). Объем и структура работы. Работа изложена на 128 страницах машинописного текста, содержит 9 таблиц и 27 рисунков. Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, результатов и их обсуждения, заключения, выводов и списка цитируемой литературы, включающего 239 наименований работ, в том числе 28 отечественных и 211 зарубежных авторов. Связь работы с крупными программами и собственный вклад автора. Работа выполнена в соответствии с планом НИР Института экологии и генетики микроорганизмов УрО РАН и является частью исследований, проводимых по теме «Изучение функционального и видового разнообразия микроорганизмов, полезных для экоценозов и практической деятельности человека» (номер госрегистрации 01201353247). Работа поддержана Программой фундаментальных исследований Президиума РАН «Молекулярная и клеточная биология» (12-П-4-1052), грантом Российского фонда фундаментальных исследований 14-14-00643 и Госзаданием 6.1194.2014/К Минобрнауки РФ. Научные положения и выводы базируются на результатах собственных исследований автора. 6 СОДЕРЖАНИЕ РАБОТЫ ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Бактериальные штаммы и условия культивирования. В работе использовали 29 штаммов, принадлежащих к 6 видам R. erythropolis (5 штаммов), R. fascians (5 штаммов), ‘R. longus’ (4 штамма), R. opacus (5 штаммов), R. rhodochrous (5 штаммов) и R. ruber (5 штаммов), и поддерживаемых в Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ, WDCM # 768; www.iegmcol.ru). Культуры выделены из различных природных источников и способны к биотрансформации сложных органических соединений. Родококки выращивали в жидкой питательной среде LB (Sigma-Aldrich, США) на орбитальном шейкере при 28 оС и 160 об/мин в течение 28 ч. Клетки осаждали центрифугированием, дважды отмывали 0,05 М натрий-фосфатным буфером (НФБ) и ресуспендировали в НФБ, растворителе или системе растворитель–водная среда до достижения показателя оптической плотности ОП600нм 0,5. Определение жизнеспособности родококков после воздействия органических растворителей. В работе использовали органические растворители с различной степенью гидрофобности: н-декан, logPO/W 5,6; н-гексан, logPO/W 3,5; циклогексан, logPO/W 3,2; толуол, logPO/W 2,5; бутанол-1, logPO/W 0,88; изобутанол, logPO/W 0,81; этилацетат, logPO/W 0,73; ацетон, logPO/W -0,23; этанол, logPO/W -0,29; ацетонитрил, logPO/W -0,33. Инкубирование родококков в присутствии растворителей проводили в НФБ, минеральной среде RS (Ivshina et al., 1998) без добавления дополнительного источника углерода или богатой питательной среде LB. В отдельных случаях клетки инкубировали в чистых растворителях. В качестве биотического контроля использовали суспензию клеток без добавления растворителя, абиотических контролей – растворитель, НФБ или стерильную среду. Жизнеспособность бактериальных клеток оценивали микролуночным методом (Hayashi et al., 2003) с помощью селективного окрашивания йодонитротетразолия хлоридом (ИНТХ) (Sigma-Aldrich, США). Для этого в 96-луночные полипропиленовые планшеты (Медполимер, Санкт-Петербург) вносили суспензию бактериальных клеток (ОП600нм 0,5) в среде RS и растворитель в концентрации 20, 50, 80 об. % или в виде паров и инкубировали на микропланшетном шейкере-инкубаторе Titramax 1000 (Heidolf-Instruments, Германия) при 28 ºС, 750 об/мин в течение 24 ч. По окончании инкубирования измеряли ОП630нм окрашенной ИНТХ суспензии на микропланшетном фотометре Multiscan Ascent (Thermo Electron Corporation, Финляндия) с программным обеспечением Ascent Software v.2.6 (Thermo Labsystems, Финляндия). Жизнеспособность (в %) клеток рассчитывали по сравнению с ОП630нм контрольной (без внесения растворителя) суспензии. При изучении влияния среды инкубирования и плотности культуры на устойчивость родококков к растворителям в суспензию (ОП600нм 0,5 или 1,0) клеток в НФБ, RS или LB вносили растворитель в тех же концентрациях и инкубировали при 28 оС, 1000 об/мин в течение 1–5 сут. После окрашивания суспензии ИНТХ образующийся формазан экстрагировали этилацетатом. Концентрацию формазана в этилацетате определяли на спектрофотометре Lambda EZ 201 (Perkin-Elmer, США) с использованием кварцевых кювет шириной 10 мм при длине волны 480 нм. Число жизнеспособных клеток рассчитывали по калибровочному графику зависимости ОП480нм раствора формазана в этилацетате от концентрации клеток (КОЕ/мл), определенной высевом на питательный агар. 7 Под множественной устойчивостью понимали способность родококков сохранять высокую жизнеспособность при воздействии нескольких гидрофобных и гидрофильных растворителей. Исследование влияния органических растворителей на структурноморфологические особенности родококков. Исследование морфологии и структуры поверхности бактериальных клеток проводили с использованием совмещенной системы сканирования, состоящей из атомно-силового микроскопа Asylum-MFP-3D-BIO (Asylum Research, США) и конфокального лазерного сканирующего микроскопа Olympus FV1000 (Olympus Corporation, Япония), на базе кабинета микроскопии Пермского государственного национального исследовательского университета. Для этого каплю (15–20 мкл) клеточной суспензии помещали на покровное стекло, смешивали с эквивалентным объемом флуоресцентного красителя LIVE/DEAD® BacLightTM Bacterial Viability Kit (Invitrogen, США) и подсушивали на воздухе в темноте в течение 10–15 мин. Препарат промывали деионизированной водой и сканировали с помощью КЛСМ с использованием иммерсионного объектива (х100, числовая апертура 1,4). Для возбуждения флуоресценции SYTO9 и пропидиум иодида применяли аргоновый лазер (λ = 488 нм) с 505/525-нм барьерным фильтром и гелий-неоновый лазер (λ = 543 нм) с 560/660-нм барьерным фильтром, соответственно. Изображения размером 0,12х0,12 мм (с разрешением 1600х1600 пикселей) получали со скоростью 40 нм/пиксель. Анализ изображений проводили с помощью программы FV10-ASW 3.1 (Olympus Corporation, Япония). Затем КЛСМ-изображения импортировали в программное обеспечение АСМ (Igor Pro 6.22A, WaveMetrics, США) и проводили АСМ-сканирование нужной области на воздухе в полуконтактном режиме с помощью кантилеверов АС240ТS (Olympus Corporation, Япония) со скоростью 0,2 Гц. Размеры АСМ-изображений составляли 10–12 мкм или 200 нм. Размеры и среднеквадратичную шероховатость поверхности бактериальных клеток рассчитывали по данным с канала высоты (Height). Объем и площадь клеток рассчитывали по формулам, приведенным Newmann с соавт. (2012) и Kongpol с соавт. (2012). Наномеханические свойства родококков изучали в режиме силовой АСМспектроскопии. Перед сканированием проводили иммобилизацию клеток на модифицированной поли-L-лизином (Sigma-Aldrich, США) подложке. Сканирование иммобилизованных клеток проводили в НФБ с использованием кантилеверов TR400PB (Olympus Corporation, Япония). Получали АСМ-изображения размером 10 мкм в контактном режиме со скоростью 1 Гц, затем проводили силовое картирование сканированной области путем приближения зонда к образцу и регистрации силовых кривых в каждой точке (32х32 = 1024 точки), в результате чего получали карты адгезии зонда кантилевера к поверхности бактериальных клеток. Исследование влияния органических растворителей на физиологические свойства родококков. Определение дыхательной активности родококков проводили с помощью 6-канального респирометра Micro-Oxymax® (Columbus Instruments, США) в стеклянных флаконах Micro-Oxymax® вместимостью 300 мл, содержащих 100 мл бактериальной суспензии (ОП600нм 0,5) в НФБ, среде RS или LB, 20 об. % н-декана или 1 об. % этанола. Постоянное перемешивание (400 об/мин) осуществляли с помощью многоместной магнитной мешалки RT 10 (Power IKAMAG, Германия) в течение 24 ч при температуре 25±2 оС. Оценивали скорость 8 потребления О2 и выделения СО2. В качестве контроля использовали бактериальную суспензию в НФБ, среде RS или LB без добавления растворителя. Для определения активности эффлюксных насосов в колбы Эрленмейера объемом 100 мл вносили суспендированные в среде LB бактериальные клетки (ОП600нм 0,05), н-декан, н-гексан, циклогексан в концентрации 20 об. % или толуол, бутанол-1, этанол, ацетон, этилацетат, ацетонитрил в концентрации 1 об. %, а также ингибиторы эффлюкных насосов в субингибиторных концентрациях. В качестве ингибиторов использовали 10 мМ орто-ванадат натрия, 0,025 мМ парокситина гидрохлорид и 0,1 мМ фениларгинин β-нафтиламида (ФАβН) дигидрохлорид (SigmaAldrich, США). Подобранные концентрации растворителей, а также ингибиторов не оказывали подавляющего воздействия на рост родококков. В качестве биотического контроля использовали варианты опытов без добавления (1) ингибиторов; (2) растворителей; (3) растворителей и ингибиторов. В качестве абиотического контроля использовали стерильную питательную среду LB. Суспензии инкубировали на орбитальном шейкере при 28 оС и 160 об/мин. Рост бактерий контролировали путем измерения ОП600нм через каждые 6 или 12 ч. Суммарные клеточные липиды экстрагировали традиционным методом (Кейтс, 1975). При этом 50 мг сухой биомассы суспендировали в 1 мл дистиллированной воды с последующим добавлением 3 мл смеси хлороформметанол (2:1). Полученную смесь встряхивали в течение 2 мин и оставляли на 24 ч, затем центрифугировали при 3000 об/мин в течение 10 мин и отбирали хлороформенный слой. Процедуру повторяли, экстракт объединяли с ранее полученным, переносили в предварительно взвешенную круглодонную колбу и упаривали на роторном испарителе при 60 оС. После этого колбу взвешивали до достижения постоянной массы на аналитических весах AUW 120D (Shimadzu, Япония). Количество общих липидов выражали в процентах от сухой массы клеток. Биоинформационный анализ генов эффлюксных насосов. Поиск нуклеотидных последовательностей, соответствующих генам устойчивости к веществам с лекарственной активностью (drug/multidrug resistance) и генам, кодирующим белки эффлюксных насосов (efflux protein), проводили в полном геноме R. ruber ИЭГМ 231, расшифрованном ранее (Ivshina et al., 2014) и опубликованном в открытых базах данных DDBJ/EMBL/GenBank под номерами CCSD01000001–CCSD01000115, с использованием базы данных MicroScope (https://www.genoscope.cns.fr/agc/microscope). Поиск и анализ гомологичных последовательностей осуществляли по базам данных GenBank (http://www.ncbi.nlm.nih.gov). Статистическая обработка результатов. Статистическую обработку результатов осуществляли с помощью компьютерной программы Microsoft Office Exel 2003 (Microsoft Corporation, США). Рассчитывали среднее арифметическое, стандартное отклонение, стандартную ошибку. Достоверность различий между двумя несвязанными выборками оценивали с помощью расчета t-критерия Стьюдента в программе STATISTICA 8 (StatSoft, США). 9 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ Исследование жизнеспособности родококков в присутствии органических растворителей. По результатам определения жизнеспособности родококков в присутствии органических растворителей, наблюдалось четкое распределение исследованных штаммов по группам с относительно высокой (№№ 1, 3, 5, 7, 9, 11, 13, 15, 17, 19) и низкой (№№ 2, 4, 6, 8, 10, 12, 14, 16, 18, 20) устойчивостью (рисунок 1, 2). Родококки характеризовались сравнительно высокими показателями жизнеспособности при воздействии гидрофобных растворителей (н-декана, н-гексана, циклогексана) со значением logPO/W > 3. Так, при инкубировании с н-деканом наблюдалось увеличение числа жизнеспособных клеток для штаммов из 1-ой группы на 9–73 % по сравнению с контролем. Родококки из 2-ой группы также сохраняли высокую (85–97 %) жизнеспособность при концентрации н-декана ≤ 20 об. %, хотя их выживаемость снижалась до 36–38 % в присутствии 50 и 80 об. % растворителя. Рисунок 1 – Влияние гидрофобных органических растворителей на выживаемость родококков. Время инкубирования – 24 ч. I – пары, II – 20 об. %, III – 50 об. %, IV – 80 об. %. Приведены средние значения для групп родококков с высокими (№№ 1, 3, 5, 7) и с низкими (№№ 2, 4, 6, 8) показателями жизнеспособности: R. erythropolis ИЭГМ 24 (6, 8), ИЭГМ 186 (2, 3, 6, 8), ИЭГМ 268 (6, 8), ИЭГМ 271 (2), ИЭГМ 767 (2, 6, 7), R. fascians ИЭГМ 35 (3, 5, 7), ИЭГМ 170 (2, 3, 5, 8), ИЭГМ 173 (2, 4, 5, 8), ИЭГМ 278 (2, 4, 6, 8), ИЭГМ 526 (2, 4, 6, 8), ‘R. longus’ ИЭГМ 29 (1, 4), ИЭГМ 32 (1, 4, 6, 7), ИЭГМ 69 (1, 4, 6, 7), ИЭГМ 589 (6, 8), R. opacus ИЭГМ 57 (2, 3, 6, 8), ИЭГМ 58 (2, 3, 6, 7), ИЭГМ 249 (2, 4, 6, 8), ИЭГМ 263 (2, 4, 6, 8), ИЭГМ 717 (1, 3, 6, 8), R. rhodochrous ИЭГМ 66 (3, 6, 8), ИЭГМ 67 (2, 3, 6, 8), ИЭГМ 608 (2, 4, 6, 8), ИЭГМ 639 (2, 3, 6, 8), ИЭГМ 647 (1, 4, 6, 8), R. ruber ИЭГМ 219 (2, 4, 6, 8), ИЭГМ 231 (2, 4, 6, 8), ИЭГМ 235 (3, 6, 8), ИЭГМ 326 (2, 3, 6, 8), ИЭГМ 343 (2, 3, 6, 8). Подчеркнуты наиболее устойчивые к растворителям штаммы родококков. По нашим данным, н-гексан оказывал менее выраженный токсический эффект на исследованные штаммы родококков. Так в присутствии растворителя во всех 10 использованных концентрациях наблюдался рост родококков из 3-ей группы на уровне 11–59 % по сравнению с контролем. Жизнеспособность родококков из 4-ой группы также увеличивалась на 4–28 % по сравнению с контролем при воздействии 50 и 80 об. % н-гексана. Использование растворителя в более низкой (≤ 20 об. %) концентрации вызывало 12–26 %-ное снижение жизнеспособности родококков из данной группы. Жизнеспособность устойчивых к циклогексану родококков (5-ая группа) составляла 98–122 %, тогда как для чувствительных штаммов (6-ая группа) отмечена 39–60 % гибель клеток. Толуол во всех исследованных концентрациях оказывал сильное ингибирующее воздействие на родококки из 8-ой группы, для которых показатель выживаемости составлял 26–41 %. При этом жизнеспособность устойчивых штаммов родококков (из 7-ой группы) снижалась лишь на 6–14 %, а отдельные представители R. fascians ИЭГМ 35, ‘R. longus’ ИЭГМ 32, ИЭГМ 69, R. opacus ИЭГМ 58 оказались способными расти в присутствии толуола. Рисунок 2 – Влияние гидрофильных органических растворителей на выживаемость родококков. Время инкубирования – 24 ч. I – пары, II – 20 об. %, III – 50 об. %, IV – 80 об. %. Приведены средние значения для групп родококков с высокими (№№ 9, 11, 13, 15, 17, 19) и с низкими (№№ 10, 12, 14, 16, 18, 20) показателями жизнеспособности: R. erythropolis ИЭГМ 24 (12, 14, 16, 20), ИЭГМ 186 (12, 14, 16, 20), ИЭГМ 268 (12, 14, 16, 20), ИЭГМ 767 (12, 14, 16, 20), R. fascians ИЭГМ 35 (12, 14, 16, 20), ИЭГМ 170 (12, 14, 16, 20), ИЭГМ 173 (9, 12, 14, 16, 17, 20), ИЭГМ 278 (12, 14, 16, 20), ИЭГМ 526 (10, 12, 14, 16, 18, 20), ‘R. longus’ ИЭГМ 29 (1, 4), ИЭГМ 32 (11, 13, 15, 19), ИЭГМ 69 (11, 13, 16, 18, 19), ИЭГМ 589 (11, 13, 15, 19), R. opacus ИЭГМ 57 (10, 11, 13, 15, 17, 19), ИЭГМ 58 (9, 12, 14, 16, 17, 20), ИЭГМ 249 (10, 12, 14, 16, 17, 20), ИЭГМ 263 (8, 12, 14, 16, 20), ИЭГМ 717 (9, 12, 14, 16, 17, 20), R. rhodochrous ИЭГМ 66 (12, 14, 16, 17, 20), ИЭГМ 67 (12, 14, 16, 17, 20), ИЭГМ 608 (10, 12, 14, 16, 18, 20), ИЭГМ 639 (10, 12, 14, 16, 20), ИЭГМ 647 (9, 12, 14, 16, 17, 20), R. ruber ИЭГМ 219 (9, 12, 14, 16, 17, 20), ИЭГМ 231 (9, 12, 14, 16, 17, 20), ИЭГМ 235 (12, 14, 16, 18, 20), ИЭГМ 326 (9, 12, 13, 15, 17, 19), ИЭГМ 343 (9, 12, 14, 16, 17, 20). Подчеркнуты наиболее устойчивые к растворителям штаммы родококков. 11 Как видно из рисунка 2, родококки чувствительны к воздействию более гидрофильных (logPO/W < 1) растворителей, таких как бутанол-1, изобутанол, этилацетат, ацетон, этанол и ацетонитрил. Так, представители 9-ой группы сохраняли лишь 25–39 %-ную жизнеспособность при инкубировании с бутанолом-1. Еще более низкие показатели выживаемости (5–21%) зафиксированы для штаммов из 10-ой группы. Воздействие изобутанола в концентрациях 50 и 80 об. % приводило к 76–84 %-ной гибели родококков из 12-ой группы, тогда как при концентрации растворителя менее 50 об. % они сохраняли 60 %-ную жизнеспособность. Наиболее высокую устойчивость к изобутанолу проявляли представители 'R. longus’ ИЭГМ 69 и ИЭГМ 589, для которых зарегистрирован 30 %-ный рост числа жизнеспособных клеток в присутствии 80 об. % растворителя. При воздействии этилацетата сохранялась 42–60 %-ная жизнеспособность родококков из 13-ой группы, однако данный показатель для чувствительных штаммов (14-ая группа) не превышал 22 %. В присутствии ацетона наблюдалось 75–78 %-ное снижение жизнеспособности родококков из 16-ой группы, тогда как устойчивые к данному растворителю штаммы (15-ая группа) характеризовались 45–68 %-ной выживаемостью. Под воздействием этанола наблюдалось 20–80 %-ное сохранение жизнеспособности родококков из 17-ой группы, однако выживаемость чувствительных к данному растворителю штаммов (18-ая группа) составляла лишь 8–36 % в зависимости от концентрации этанола. Под влиянием ацетонитрила наблюдалось снижение жизнеспособности родококков из 19-ой и 20-ой групп на 48–50 % и 78–80 %, соответственно. Следует отметить, что нами не обнаружено строгой зависимости токсического действия органических растворителей от их концентрации. Напротив, в некоторых случаях наблюдалось увеличение числа жизнеспособных клеток при повышении концентрации растворителя (см. рисунок 1, 2). В случае использования гидрофобных растворителей выявленный факт может быть связан со способностью родококков использовать данные соединения в качестве ростовых субстратов (de Carvalho, 2010), а в случае гидрофильных растворителей – с агрегацией бактериальных клеток (Cassidy et al., 1996). Установлено, что отдельные штаммы родококков обладали множественной устойчивостью к гидрофильным и гидрофобным растворителям. Так, представители ‘R. longus’ ИЭГМ 32, ИЭГМ 589 проявляли устойчивость к н-декану, толуолу, изобутанолу, этилацетату, ацетону, ацетонитрилу, а ‘R. longus’ ИЭГМ 69 – к н-декану, толуолу, бутанолу-1, изобутанолу, этилацетату, ацетонитрилу. Клетки R. opacus ИЭГМ 57, ИЭГМ 58 и R. ruber ИЭГМ 326, ИЭГМ 343 сохраняли высокие показатели выживаемости при воздействии н-гексана, изобутанола, бутанола-1, этилацетата, ацетона, этанола и ацетонитрила. Детальное исследование влияния органических растворителей на морфологические, наномеханические и функциональные характеристики родококков проведено с использованием штамма R. ruber ИЭГМ 231, обладающего высокой степенью адгезии к углеводородным субстратам, способного к синтезу биосурфактантов и биодеградации фармполлютантов (Рубцова и др., 2012; Philp et al., 2002; Ivshina et al., 2012). Устойчивость родококков к органическим растворителям в зависимости от условий культивирования. Как видно из рисунка 3, наиболее выраженное (67–100 %) негативное действие на родококки оказывали растворители в чистом виде либо в двухфазной системе растворитель–буферный раствор (1:1), вызывая 85–100 %-ную гибель бактериальных клеток. Наличие минеральных солей в среде 12 RS, напротив, способствовало повышению (на 2–70 %) выживаемости клеток при воздействии растворителей. В богатой питательной среде LB родококки сохраняли сравнительно высокую (30–97 %) жизнеспособность и проявляли способность к росту в присутствии н-декана, циклогексана и этанола. Полученные результаты подтверждают данные (Zingaro et al., 2013) о влиянии компонентов среды культивирования на выживаемость бактерий в присутствии растворителей. Рисунок 3 – Сравнение показателей выживаемости R. ruber ИЭГМ 231 при инкубировании в разных средах в присутствии органических растворителей. 1 – н-декан, 2 – н-гексан, 3 – циклогексан, 4 – толуол, 5 – бутанол-1, 6 – изобутанол, 7 – этилацетат, 8 – ацетон, 9 – этанол, 10 – ацетонитрил. I – растворитель, II – растворитель : НФБ (1:1), III – растворитель : среда RS (1:1), IV – растворитель : среда LB (1:1). При высеве клеток R. ruber ИЭГМ 231 на питательный агар после инкубирования в н-декане или циклогексане наблюдалась диссоциация колоний на гладкие (S) и шероховатые (R) формы. Известно, что R-формы актинобактерий характеризуются утолщенной клеточной стенкой с повышенным содержанием в ней липидов и устойчивостью к неблагоприятным факторам среды (Милько, Егоров, 1991). По нашим данным, после селекции R-форм и повторного инкубирования их в присутствии н-декана или циклогексана регистрировалось 3–12-кратное повышение жизнеспособности родококков (рисунок 4). Рисунок 4 – Выживаемость неадаптированных (I) и адаптированных* (II) клеток R. ruber ИЭГМ 231 в присутствии органических растворителей. 1 – н-декан, 2 – смесь н-декана : НФБ (1:1), 3 – циклогексан, 4 – смесь циклогексана : НФБ (1:1). *Клетки предварительно инкубировали в присутствии растворителя в течение 24 ч. 13 На рисунке 5 показано влияние плотности клеточной суспензии на жизнеспособность родококков в присутствии растворителей. Оказалось, что показатель выживаемости в экспериментах с изначально большим числом клеток в 1,5–3,0 раза выше, что, по-видимому, объясняется способностью родококков к агрегации в неблагоприятных условиях среды (рисунок 6). Рисунок 5 – Влияние плотности исходной суспензии на выживаемость R. ruber ИЭГМ 231 в присутствии органических растворителей. Время инкубирования – 24 ч. I – ОП600нм = 1,0, II – ОП600нм = 0,5. 1 – циклогексан, 2 – циклогексан : НФБ (1:1), 3 – толуол, 4 – толуол : НФБ (1:1). Как видно из рисунка 6, после воздействия растворителя наблюдается гибель бактериальных клеток на поверхности агрегатов. При этом, вследствие защиты клеток, находящихся внутри агрегатов, сохраняется высокая жизнеспособность клеточной популяции даже при повышенных концентрациях токсичных растворителей (Cassidy et al., 1996). А Б Рисунок 6 – КЛСМ-АСМ изображения R. ruber ИЭГМ 231 до (А) и после (Б) 24 ч инкубирования в присутствии растворителей. Светящиеся зеленым цветом – живые, красным – мертвые клетки. Морфофункциональные свойства родококков при инкубировании в органических растворителях. На рисунке 7 приведены 3D-изображения живых и мертвых клеток при воздействии на них органических растворителей. 14 А Б 15 В Г 16 Д Е Рисунок 7 – КЛСМ (I), АСМ (II), 3D КЛСМ-АСМ (III) изображения и нанопрофилометрия (IV) клеток R. ruber ИЭГМ 231 в контроле (А) и после 24 ч инкубирования в присутствии н-декана (Б), толуола (В), бутанола-1 (Г), этанола (Д) и ацетонитрила (Е). Размер линейки на КЛСМ-изображении – 5 мкм. 17 В клеточной популяции R. ruber ИЭГМ 231 после инкубации в присутствии растворителей выделялись три фракции: живые (зеленые, толерантные), мертвые (красные, чувствительные) и поврежденные (зелено-оранжевые, частично устойчивые) клетки. Так, воздействие н-декана и циклогексана приводило к нарушению целостности клеточной мембраны и гибели бактерий, что регистрировалось в виде красного флуоресцентного окрашивания мертвых клеток на фоне зеленого свечения живых клеток в контрольных образцах (см. рисунок 7). При этом в присутствии н-гексана, толуола, бутанола-1, этилацетата, ацетона, этанола или ацетонитрила регистрировалось характерное «двойное» (зелено-оранжевое) свечение (см. рисунок 7, рисунок 8), проявляющееся на отдельных участках или полностью заполняющее бактериальную клетку и свидетельствующее, по-видимому, о возможном повреждении клеточной мембраны жизнеспособных клеток. А Б Рисунок 8 – КЛСМ-изображения R. ruber ИЭГМ 231 до (А) и после (Б) воздействия толуола. Графики интенсивности флуоресценции SYTO9 (зеленый) и пропидиум иодида (красный) при нормальном (А) и «двойном» (Б) окрашивании. Результаты анализа динамики полученных размерных характеристик клеток R. ruber ИЭГМ 231 под воздействием растворителей приведены в таблице 1. Инкубирование родококков в течение 24 ч в присутствии н-декана, циклогексана и толуола приводило к уменьшению размеров живых клеток. Длина их снижалась на 0,4–1,0 мкм, ширина – 0,1–0,3 мкм, площадь поверхности – 3,4–5,1 мкм2, объем – 1,1–1,9 мкм3 по сравнению с изначальными размерами клеток. Согласно закону Бергмана, чем меньше размер живого объекта, тем выше отношение площади его поверхности к объему (S/V), т.е. относительная площадь контакта объекта с окружающей средой (Newmann et al., 2005; Kongpol et al., 2012). Нами зафиксировано увеличение относительной площади живых клеток на 0,3–0,5 мкм-1 после инкубирования в присутствии н-декана и циклогексана, тогда как воздействие толуола вызывало уменьшение данного показателя на 0,6 мкм-1 по сравнению с контрольными значениями. Следовательно, происходило увеличение площади контакта родококков с относительно нетоксичными н-деканом и циклогексаном и, напротив, снижение данного показателя при контакте клеток с токсичным толуолом, что может служить адаптационным механизмом устойчивости бактерий 18 к данным растворителям. После 120 ч наблюдалось равномерное снижение показателя S/V живых клеток на 0,2–0,9 мкм-1 в контроле и в присутствии н-декана и циклогексана. Отмечено повышение на 0,5–1,6 мкм-1 показателя S/V родококков, погибших в первые сутки инкубирования с н-деканом и циклогексаном, тогда как в дальнейшем этот показатель не менялся. Нами не обнаружено адаптивных изменений размерных параметров поврежденных клеток, что может быть связано с быстрой потерей жизнеспособности родококков под действием высокотоксичных растворителей (бутанола-1, этилацетата, этанола и ацетонитрила). Таблица 1 – Морфометрические параметры клеток R. ruber ИЭГМ 231, инкубированных в присутствии органических растворителей Длина, мкм Контроль (в НФБ) н-Декан Циклогексан Толуол Контроль (в НФБ) н-Декан Циклогексан Толуол Бутанол-1 Этилацетат Этанол Ацетонитрил 2,9±1,0 2,6±1,1 2,4±0,7 2,3±0,5* 2,2±0,8* 1,7±0,5* 2,8±0,8 3,0±1,0 2,3±0,4 2,5±1,0 2,3±0,6 2,4±0,7 2,0±0,5 2,4±0,6 2,5±0,7 2,8±0,9 2,5±0,7 2,4±0,8 2,2+0,5 2,3+0,5 2,5±0,6 2,4±0,5 2,6±0,9 2,7±0,9 Ширина, мкм Площадь поверхности (S), мкм2 Живые клетки 0,9±0,2 9,1±3,5 1,0±0,2 9,3±3,0 0,8±0,1 6,9±2,2* 1,0±0,1 8,4±1,9* 0,9±0,2 7,2±2,8* 0,9±0,2 6,6±2,2* 1,0±0,1 9,6±2,2 0,9±0,1 9,9±2,7 Мертвые клетки 1,0±0,3 8,9±3,6 0,8±0,1 7,6±2,4 0,9±0,1 7,5±2,1 0,9±0,2 7,6±2,0 0,7±0,1 5,2±1,3* 1,0±0,2 9,1±2,2* 0,9±0,1 8,7±1,9 0,9±0,1 9,1±1,9 Поврежденные клетки 0,8±0,1 7,6±1,6 0,7±0,1 6,4±1,6 1,0+0,2 8,4+4,1 1,0+0,1 7,0+0,8 0,9±0,1 8,4±2,2 1,0±0,2 9,4±1,4 0,8±0,1 7,3±1,9 0,9±0,1 8,4±2,6 Объем (V), мкм3 Площадь поверхности/ объем (S/V), мкм-1 1,8±1,1 1,9±0,8 1,2±0,5* 1,7±0,6 1,3±0,8* 1,3±0,6* 2,0±0,6 2,0±0,7 5,6±1,0 5,2±0,7 6,1±0,6 5,2±0,7 5,9±1,1 5,7±1,1* 5,0±0,4* 5,1±0,4 1,9±1,3 1,4±0,6 1,4±0,6* 1,4±0,6 0,8±0,3* 1,9±0,8* 1,7±0,5 1,7±0,4 5,2±1,2 5,8±0,7 5,7±0,8 5,7±0,8 6,8±0,8* 5,0±0,6* 5,1±0,4 5,3±0,2* 1,4±0,4 1,0±0,3 1,8+1,6 1,8+0,6 1,6±0,6 2,0±0,5 1,2±0,5 1,6±0,6 5,8±0,7 6,4±0,9 5,3+0,8 4,2+0,7 5,3±0,6 4,9±0,5 6,1±0,8 5,6±0,8 Примечание. В числителе указаны значения после 24 ч, в знаменателе – после 120 ч инкубирования. *Данные достоверно отличаются от контрольных при р < 0,05. 19 Путем варьирования размеров АСМ-сканирования были получены данные о микрорельефе (размер 10–12 мкм) и нанорельефе (размер 200 нм) бактериальных клеток после взаимодействия с растворителями (рисунок 9). 1А 1Б 1В 2А 2Б 2В Рисунок 9 – АСМ-изображения (А, Б) и профили (В) R. ruber ИЭГМ 231 после инкубирования в присутствии толуола. 1 – микрорельеф, 2 – нанорельеф. Количественный анализ полученных данных (60–100 клеток/скан) АСМпрофилометрии позволил выявить (рисунок 10) увеличение высоты микрорельефа родококков под действием растворителей на 3–57 %. При воздействии гидрофобных растворителей зафиксировано снижение амплитуды нанорельефа на 33–54 %, тогда как воздействие гидрофильных растворителей, напротив, приводило к 29–104 %-му увеличению данного показателя. При этом шероховатость микрорельефа мертвых клеток под действием органических растворителей практически не изменялась, а колебания данных значений не превышали 11 %. Рисунок 10 – Влияние органических растворителей на степень шероховатости поверхности клеток R. ruber ИЭГМ 231. Размеры сканирования: I – 10 мкм (микрорельеф), II – 200 нм (нанорельеф). 1 – н-декан, 2 – н-гексан,3 – циклогексан, 4 – толуол, 5 – бутанол-1, 6 –этилацетат, 7 – ацетон, 8 – этанол, 9 – ацетонитрил. 20 Выявленные противоположные тенденции в изменении микро- и нанорельефа под воздействием различных растворителей могут быть связаны с разноплановым характером структурных изменений клеточной оболочки бактерий (Dufrêne, 2002; Dorobantu et al., 2012). Нами выявлено повышение количества суммарных липидов на 9–42 % в клетках R. ruber ИЭГМ 231 после инкубирования в присутствии органических растворителей (таблица 2), что можно рассматривать в качестве одного из приемов защиты от их воздействия. При этом наиболее выраженное (в 2 раза) повышение липидного компонента наблюдалось при воздействии гидрофобного н-декана. Таблица 2 – Содержание общих липидов в клетках R. ruber ИЭГМ 231 после инкубирования в присутствии органических растворителей Растворитель Суммарные липиды, % от сухого веса Контроль (в LB) 41,9 ± 7,0 н-Декан 83,9 ± 2,3* н-Гексан 59,6 ± 3,7* Циклогексан 53,0 ± 16,7 Толуол 64,0 ± 3,0* Бутанол-1 66,2 ± 4,2 Этилацетат 50,7 ± 7,8 Ацетон 61,2 ± 6,5* Этанол 67,9 ± 3,7* Ацетонитрил 52,6 ± 8,3 Примечание. *Данные достоверно отличаются от контрольных при р < 0,05. Как видно из рисунка 11, максимальная респираторная активность (24–66 мкл/мин) клеток наблюдалась при инкубировании их в богатой питательной среде LB в присутствии растворителей, тогда как в минеральной среде RS и НФБ – снижение показателей скорости дыхания на 58–77 % и 88–96 % соответственно. А Б Рисунок 11 – Динамика дыхательной активности клеток R. ruber ИЭГМ 231 при инкубировании в НФБ (линия 3, 4), среде RS (линия 2, 5) и LB (линия 1, 6) в присутствии н-декана (А) и этанола (Б). 21 Сравнительный анализ показателей дыхательной активности родококков в присутствии гидрофобных (н-декана) и гидрофильных (этанола) растворителей (таблица 3) выявил повышение скорости респирации в 0,7–16,6 раз при инкубировании бактериальных клеток в присутствии н-декана, обусловленное возможностью использования данного растворителя в качестве источника углерода и энергии. При инкубировании родококков в НФБ и минеральной среде RS с этанолом показатели дыхания снижались в 0,9–1,6 раза, а в богатой питательной среде LB – не отличались от контрольных значений. Таблица 3 – Дыхательная активность (мкл/мин) клеток R. ruber ИЭГМ 231 в присутствии н-декана и этанола Контроль / н-Декан Контроль / Этанол Потребление О2 Выделение СО2 Потребление О2 Выделение СО2 1,4 ± 0,9 0,9 ± 0,1 4,4 ± 0,2 2,2 ± 0,2 4,5 ± 0,7* 2,9 ± 0,3* 3,0 ± 0,2* 1,4 ± 0,2* 1,6 ± 0,6 0,7 ± 0,1 11,5 ± 0,5 12,5 ± 4,3 14,7± 0,8* 11,6 ± 2,8* 10, 0 ± 0,4* 7,4 ± 0,4* 32,6 ± 1,3 32,0 ± 7,5 23,5 ± 0,5 21,7 ± 4,4 66,2 ± 1,1* 47,7 ± 0,8 24,2 ± 1,1 23,5 ± 4,2 НФБ Cреда RS Среда LB Примечание. *Данные достоверно отличаются от контрольных при р < 0,05. Влияние органических растворителей на упругомеханические свойства родококков. Полученные данные АСМ-индентирования поверхности живых клеток выявили уменьшение модуля упругости от 1,4 до 0,3–0,8 МПа после воздействия всех использованных растворителей (рисунок 12), что свидетельствует о снижении жесткости связей между компонентами клеточной стенки. Очевидно, действие органических растворителей приводило к структурно-механическим перестройкам родококков, в частности появлению более эластичных участков клеточной оболочки. Модуль Юнга, МПа 1,5 * 1,2 * * * * 0,9 * 0,6 * 0,3 0 1 2 3 4 5 6 7 8 Рисунок 12 – Изменение упругости клеток R. ruber ИЭГМ 231 после инкубирования в присутствии органических растворителей. 1 – контроль, 2 – н-декан, 3 – н-гексан, 4 – циклогексан, 5 – толуол, 6 – бутанол-1, 7 – этанол, 8 – ацетонитрил. *Данные достоверно отличаются от контрольных при р < 0,05. Анализ карт адгезии зонда кантилевера к поверхности бактериальных клеток, полученных в режиме силовой АСМ-спектроскопии (рисунок 13), выявил незначительное (на 0,2 нН) увеличение показателя упругих сил взаимодействия между зондом кантилевера и поверхностью клеток, инкубированных в присутствии 22 циклогексана, по сравнению с контрольными клетками (рисунок 14). Воздействие на клетки толуола, напротив, приводило к снижению силы адгезии на 42 %, а этанола – к уменьшению данного показателя в 6,5 раз. А Б В Рисунок 13 – АСМ-изображение (А) и карты адгезии (Б, В) зонда кантилевера к поверхности клеток R. ruber ИЭГМ 231. Черным контуром отмечены зоны, соответствующие расположению клеток на АСМ-изображении. Как видно из гистограмм распределения показателей адгезии, приведенных на рисунке 14, при воздействии использованных растворителей снижалось число высокоадгезивных (> 10 нН) сайтов на поверхности клеток и, наоборот, повышалось количество низкоадгезивных (< 5 нН) участков. По-видимому, воздействие органических растворителей приводило к денатурации белков и растворению липидных компонентов клеточной стенки и мембраны бактерий (McDonnell, Russell, 1999) и, как следствие, снижению упругомеханических и адгезионных показателей. А Б В Г Рисунок 14 – Гистограммы распределения показателей адгезии кантилевера АСМ к поверхности клеток R. ruber ИЭГМ 231 после инкубирования в присутствии органических растворителей. А – контроль, Б – циклогексан, В – толуол, Г – этанол. Указаны среднеквадратическое значение сил адгезии ± стандартное отклонение. 23 Активация эффлюксных насосов при формировании устойчивости родококков к органическим растворителям. Предварительно подобранные субингибиторные концентрации ингибиторов эффлюксных насосов не оказывали выраженного подавляющего действия на рост родококков, при этом выявлено увеличение продолжительности лаг-фазы в среде с парокситином и ФАβН. Установлено, что в присутствии н-гексана и циклогексана парокситин и ФАβН практически полностью подавляют рост клеток (рисунок 15, линия 4 и 5), что указывает на вероятное участие H+- и Na+-зависимых эффлюкных насосов в формировании устойчивости родококков к данным растворителям. Напротив, присутствие в среде орто-ванадата не оказывало ингибирующего воздействия на бактериальный рост, так как АТФ-зависимые насосы, по-видимому, не участвуют в выведении избытка растворителей из клеток. При этом длительность (78–96 ч) лаг-фазы роста родококков в среде с растворителем и орто-ванадатом совпадала с таковой в присутствии одного растворителя (рисунок 15, линии 2 и 3). А Б Рисунок 15 – Влияние ингибиторов эффлюксных насосов на рост клеток R. ruber ИЭГМ 231 в присутствии органических растворителей. А – н-гексан, Б – циклогексан. 1 – контроль без растворителя, 2 – контроль с растворителем, 3 – орто-ванадат, 4 – парокситин, 5 – ФАβН. Результаты проведенного биоинформационного анализа генома R. ruber ИЭГМ 231 по поиску генов, кодирующих белки устойчивости к фармакологически активным веществам и эффлюксные насосы, представлены в таблице 4. Выявленные нами нуклеотидные последовательности при сравнении с таковыми, опубликованными в базе данных GenBank, характеризовались наиболее высоким (89–99%) сходством с фрагментами генома R. aetherivorans IcdP1, кодирующими транспортные белки (Qu et al., 2015). При сравнении обнаруженных нуклеотидных последовательностей из R. ruber ИЭГМ 231 с генами acrA, acrB, tolC из Escherichia coli K-12 (substr. MG1655, номер эталонной последовательности в GenBank NC_000913.3) и генами mexA, mexB, oprM из Pseudomonas aeruginosa PAO1 (номер эталонной последовательности NC_002516.2), кодирующими структурные белки Н+-зависимых эффлюксных насосов семейства RND, степень перекрытия нуклеотидных последовательностей составляла не более 2 %. Это свидетельствует об отсутствии гомологии между генами транспортных каналов из грамотрицательных бактерий и таковыми из родококков. Полученные данные могут указывать на наличие у актинобактерий рода Rhodococcus уникальных нуклеотидных последовательностей, кодирующих белки эффлюксных насосов. Таблица 4 – Результаты сравнительного анализа нуклеотидных последовательностей R. ruber ИЭГМ 231 (номера в GenBank CCSD01000001–CCSD01000115) и R. aetherivorans IcdP1 (номер в GenBank CP011341.1) Ген Продукт czcD Белок системы эффлюкса катионов CzcD emrB Гомолог белка В мультиустойчивости к веществам с лекарственной активностью Белок подсемейства EmrB/QacA устойчивости к веществам с лекарственной активностью Предполагаемый транспортер эффлюкса веществ с лекарственной активностью – – – – – Транспортер подсемейства Bcr/CflA, обеспечивающий устойчивость к веществам с лекарственной активностью Белок подсемейства MFS мультиустойчивости к веществам с лекарственной активностью Транспортер антибиотиков семейства ABC Локус Номер в базе данных MicroScope Сходство с R. aetherivorans IcdP1 / Продукт 1057156…1058088 3443399…3444370 2261857…2263386 Размер гена (п.н.) 933 972 1530 RHRU231v1_330072 RHRU231v1_600003 RHRU231v1_450049 99% / Транспортер катионов С/о 94% / Транспортер веществ с лекарственной активностью 560535…562163 2871899…2873434 5838435…5839922 1629 1536 1488 RHRU231v1_200048 RHRU231v1_480072 RHRU231v1_960069 2268190…2269830 1641 RHRU231v1_450058 С/о С/о 96% / Транспортер веществ с лекарственной активностью 91% / Транспортер подсемейства MFS 3126446…3127867 1422 RHRU231v1_560022 3706371…3707567 1197 RHRU231v1_710017 853615…854895 1281 RHRU231v1_230213 3779304…3780803 1500 RHRU231v1_710087 99% / Транспортер веществ с лекарственной активностью 91% / Транспортер веществ с лекарственной активностью 88% / Транспортер подсемейства Bcr/CflA, обеспечивающий устойчивость к веществам с лекарственной активностью 93% / Транспортер подсемейства MFS 4575362…4576528 1167 RHRU231v1_810021 92% / Транспортер подсемейства MFS 2392880…2394514 1635 RHRU231v1_450270 89% / Транспортер антибиотиков семейства ABC Примечание. «–» – нет названия гена, с/о – сходство отсутствует. ВЫВОДЫ 1. Установлено, что исследованные коллекционные штаммы актинобактерий рода Rhodococcus устойчивы (жизнеспособность клеток составляет от 72 до 119 %) к гидрофобным (logPO/W ≥ 2,5) и чувствительны (жизнеспособность клеток составляет от 22 до 46 %) к гидрофильным (logPO/W ≤ 0,9) растворителям. Отдельные представители R. opacus ИЭГМ 57, ИЭГМ 58, R. ruber ИЭГМ 326, ИЭГМ 343 и ‘R. longus’ ИЭГМ 32, ИЭГМ 69, ИЭГМ 589 характеризуются множественной устойчивостью к органическим растворителям. 2. Показано, что родококки, устойчивые к воздействию органических растворителей, характеризуются изменением степени шероховатости (микрорельефа – на 14–79 нм, нанорельефа – на 1,3–2,5 нм) клеточной поверхности, а также увеличением относительной площади поверхности клеток (на 5–9 %), респираторной активности (на 3–34 мкл/мин) и количества суммарных липидов (на 9–42 %). 3. На примере R. ruber ИЭГМ 231 обнаружено, что воздействие гидрофобных и гидрофильных растворителей приводит к изменению наномеханических свойств родококков, в частности к снижению модуля упругости (на 0,6–1,1 МПа) и перераспределению адгезивных участков клеточной поверхности. 4. Выявлено участие H+- и Na+-зависимых эффлюксных насосов в выведении избытка органических растворителей (н-гексана, циклогексана) из клеток R. ruber ИЭГМ 231, что подтверждается наличием в геноме родококков характерных нуклеотидных последовательностей транспортных белков. Список работ, опубликованных автором по теме диссертации Статьи в изданиях, рекомендованных ВАК Минобрнауки РФ 1. Методы иммобилизации микроорганизмов для динамических атомносиловых исследований (обзор) / М.С. Куюкина, И.О. Коршунова, Е.В. Рубцова, И.Б. Ившина // Прикладная биохимия и микробиология. – 2014. – Т. 50, № 1. – С. 7–16. 2. Assessment of bacterial resistance to organic solvents using a combined confocal laser scanning and atomic force microscopy (CLSM/AFM) / M.S. Kuyukina, I.B. Ivshina, I.O. Korshunova, E.V. Rubtsova // Journal of Microbiological Methods. – 2014. – V. 107. – P. 23–29. 3. Влияние органических растворителей на жизнеспособность и морфофункциональные свойства родококков / И.О. Коршунова, О.Н. Писцова, М.С. Куюкина, И.Б. Ившина // Прикладная биохимия и микробиология. – 2016. – Т. 52, № 1. – C. 53–61. Публикации в других журналах и сборниках 1. Коршунова, И.О. Исследование влияния циклогексана и толуола на жизнеспособность и морфологические особенности клеток Rhodococcus ruber ИЭГМ 231 / И.О. Коршунова, Е.В. Рубцова // Сборник тезисов VI Всероссийского с международным участием Конгресса молодых ученыхбиологов «Симбиоз-Россия 2013». Иркутск, 2013. – С. 83–85. 2. Коршунова, И.О. Изучение влияния органических растворителей на жизнеспособность и морфологию поверхности клеток родококкков / И.О. Коршунова // Материалы 18-й международной Пущинской школыконференции молодых ученых «Биология – наука XXI века». Пущино, 2014. – С. 215. 26 3. Korshunova, I.O. Viability and surface properties of the solvent-resistant Rhodococcus ruber IEGM 231 / I.O. Korshunova, M.S. Kuyukina, I.B. Ivshina // 18th International Microscopy Congress. Prague, Czech Republic, 2014. – LS-6-P-2131. 4. Писцова, О.Н. Скрининг штаммов из региональной профилированной коллекции алканотрофных микроорганизмов по устойчивости к действию органических растворителей / О.Н. Писцова, И.О. Коршунова // Сборник тезисов VII Всероссийского с международным участием Конгресса молодых ученыхбиологов «Симбиоз-Россия 2014». Екатеринбург, 2014. – С. 83–85. 5. Писцова, О.Н. Устойчивость актинобактерий рода Rhodococcus к воздействию гидрофильных органических растворителей / О.Н. Писцова, И.О. Коршунова // Материалы 19-ой Международной Школы-конференции «Биология – наука 21 века». Пущино, 2015. – С. 37. 6. Возможные механизмы устойчивости Rhodococcus ruber к воздействию н-декана / И.О. Коршунова, Е.В. Рубцова, М.С. Куюкина, И.Б. Ившина // Российский иммунологический журнал. – 2015. – Т. 9(18), № 2(1). – С. 642–644. 7. Korshunova, I.O. Nanoscale microscopic analysis of organic solvent effects on Rhodococcus ruber cells / I.O. Korshunova, M.S. Kuyukina, I.B. Ivshina // 12th Multinational Congress on Microscopy. Eger, Hungary, 2015. – P. 428–430. 8. Коршунова, И.О. Активация работы эффлюксных насосов как возможный механизм устойчивости родококков к органическим растворителям / И.О. Коршунова // Сборник тезисов VIII Всероссийского с международным участием Конгресса молодых ученых-биологов «Симбиоз-Россия 2015». Новосибирск, 2015. – С. 84. КОРШУНОВА Ирина Олеговна ВЛИЯНИЕ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ НА МОРФОФУНКЦИОНАЛЬНЫЕ И НАНОМЕХАНИЧЕСКИЕ СВОЙСТВА РОДОКОККОВ 03.02.03 Микробиология АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата биологических наук Подписано в печать 27.02.2016 г. Формат 60×90/16. Усл. печ. л. 1. Тираж 120 экз. Заказ Набор компьютерный. Отпечатано в Федеральном государственном бюджетном учреждении науки Институте экологии и генетики микроорганизмов Уральского отделения Российской академии наук 614081, г. Пермь, ул. Голева, 13