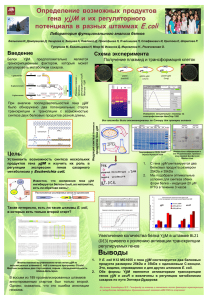
Селекция бактерий E.coli на способность увеличивать
advertisement

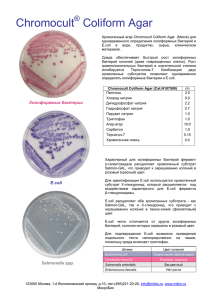
Селекция бактерий E.coli на способность увеличивать продолжительность жизни C.elegans Аннотация: На настоящий момент выявлен целый ряд биологических путей, участвующих в старении организма. Большое число данных путей и тесная взаимосвязь многих из них заставляет взглянуть на старение как на комплексное явление. Исследования на модельных животных показали, что изменение этих путей по отдельности может приводить к увеличению продолжительности жизни. Однако для того, чтобы добиться более существенных успехов в продлении жизни организма необходимо учитывать взаимосвязь механизмов старения и воздействовать не на один, а сразу на несколько процессов. Однако в рамках традиционных подходов выявить оптимальные комбинации и дозы регуляторных веществ, препятствующих старению, трудоемко и затруднительно, кроме того, трудно добиться длительного действия препаратов. Проект направлен на разработку нового подхода, позволяющего выявить оптимальные комбинации веществ и их доз, приводящие к продлению жизни организма. Для данной цели предлагается использовать модель C.elegans и E.coli (кишечный симбионт C.elegans). Предлагается провести селекцию E.coli на способность значительно продлевать жизнь организму хозяина. Показано, что ряд веществ, выделяемых E.coli влияет на физиологию и продолжительность жизни C.elegans. Таким образом, изучение выведенного в результате селекции штамма позволит определить оптимальный баланс веществ, необходимый для удлинения жизни C.elegans. Также это позволит выявить набор биологических путей C.elegans, одновременная модуляция которых сопровождается увеличением продолжительности жизни. В ходе данной работы не только будет разработан метод выявления эффективных комбинаций и доз геропротекторов, но и будет продемонстрирована возможность разработки лекарства, продлевающего жизнь, на основе селекции клеток, живущих в организме хозяина. Причем в дальнейшем могут быть использованы как клетки симбионтов, так и некоторые популяции клеток самого организма. Описание проекта: Caenorhabditis elegans является удобной моделью для изучения генетики старения. Его геном хорошо изучен, продолжительность жизни в лабораторных условиях невелика и составляет 2-3 недели, а также к настоящему моменту выявлен целый ряд генов и несколько сигнальных путей, вовлеченных в регуляцию его продолжительности жизни. Особый интерес для генетики старения представляют взаимоотношения C.elegans с микробиотой. Бактерии составляют пищу C.elegans, однако некоторые виды также являются его кишечными симбионтами и оказывают влияние на физиологию и продолжительность жизни хозяина. Наиболее изученными симбионтами C.elegans являются бактерии Escherichia coli. В геноме E.coli выявлено несколько мутаций, приводящих к продлению жизни хозяина. Так, мутации в гене убиквитина Q (Larsen and Clarke, 2002), некодирующей РНК DsrA (Liu et al., 2012), а также в гене фолатного метаболизма aroD (Virk et al., 2012) и в гене О антигена (Browning et al., 2013) увеличивают продолжительность жизни C.elegans. Способность бактерий E.coli модулировать продолжительность жизни С.elegans делает возможным проведение селекции бактерий с целью отбора штаммов, способных значительно продлевать жизнь хозяину. Планируется выведение штаммов, увеличивающих продолжительность жизни С.elegans не менее чем на 50%. Для достижения данной цели будет создана система направленной эволюции бактерий E.coli. Будет индуцировано генетическое разнообразие бактерий, а затем будет проводиться селекция штаммов, продлевающих жизнь C.elegans в наибольшей степени. Для индукции генетического разнообразия может быть использован один из нескольких методов синтетической биологии, разработанных для получения микроорганизмов со сложными фенотипами (для тех случаев, когда неизвестно, какие именно гены и мутации определяют возникновение данного фенотипа). Использование таких подходов позволяет в десятки раз ускорить проведение селекции по сравнению с использованием классических методов случайного мутагенеза. Первым подходом является глобальное репрограммирование транскриптома (gTME – global transcription machinery engineering) (подробно описано в обзоре Cobb et al., 2013). Подход основывается на внесении изменений в регуляторные системы бактерии, что позволяет сразу изменить экспрессию тысяч генов E.coli и создать наибольшее разнообразие фенотипов. Кроме того, изменение регуляторных систем может сильнее влиять на изменение экспрессии определенных генов, нежели даже мутации в самих этих генах. С этой целью могут быть внесены изменения, например, в ген фактора инициации транскрипции σ70 (Alper and Stephanopoulos, 2007) или в ген α-субъединицы РНКполимеразы (Klein-Marcuschamer, et al., 2009). Будет создана библиотека штаммов E.coli, несущих различные изменения в гене белка транскрипционного аппарата. Затем будет проведена селекция штаммов на способность увеличивать продолжительность жизни C.elegans. Вторым подходом, позволяющим значительно ускорить эволюцию микроорганизмов в лабораторных условиях, является «перемешивание» ДНК (genome shuffling). Данный подход позволяет осуществить рекомбинацию генетического материала нескольких родительских штаммов для получения штаммов бактерий, комбинирующих полезные мутации родительских клеток (подробно описано в обзорах Cobb et al., 2013, Gong et al., 2009). Для создания набора родительских штаммов генетическое разнообразие бактерий будет индуцировано путем выращивания на среде с мутагеном. Затем будет проведена селекция штаммов на способность увеличивать продолжительность жизни C.elegans. У нескольких отобранных штаммов будет индуцировано «перемешивание» ДНК для получения штамма, комбинирующего полезные свойства исходных штаммов. В дополнение приводим описание третьего подхода, отличающегося от первых двух тем, что в данном случае геном E.coli модифицируется введением дополнительных генов. Подход основывается на том, что дцРНК (двухцепочечные РНК), вырабатываемые E.coli, способны подавлять экспрессию генов C.elegans. Поскольку показано, что отсутствие продуктов ряда генов C.elegans может приводить к существенному увеличению продолжительности жизни, представляет интерес исследование эффекта подавления экспрессии нескольких генов одновременно. Будет создана библиотека штаммов E.coli, содержащих случайный набор из нескольких (4-5) генов дцРНК, подавляющих экспрессию генов C.elegans. Затем будет проведена селекция штаммов на способность увеличивать продолжительность жизни C.elegans. Для повышения эффективности отбора возможно совмещение всех трех подходов в разных комбинациях, а также проведение нескольких циклов каждого из подходов. Полученный в результате селекции штамм E.coli будет изучен с целью выявления веществ (потенциальных геропротекторов) и их баланса, приводящих к увеличению жизни C.elegans. Кроме того, в случае успешного выведения штамма E.coli будет продемонстрирована возможность разработки лекарства, продлевающего жизнь, на основе селекции клеток, живущих в организме хозяина (симбионтов). Созданное таким образом лекарство будет состоять из целого ряда веществ, доза и динамика экскреции которых будет оптимизирована путем селекции клеток, её вырабатывающих. Задачи проекта: 1) Провести селекцию бактерий E.coli на способность увеличивать продолжительность жизни C.elegans. 2) Изучить генетические особенности отобранного в результате селекции штамма E.coli и выявить комбинацию веществ (геропротекторов), вырабатываемых E.coli и увеличивающих продолжительность жизни C.elegans. План экспериментов: В экспериментах планируется использовать C.elegans линии N2 (Brenner, 1973). В качестве исходного штамма бактерий, на котором будут выращиваться C.elegans, будет использоваться непатогенный штамм E.coli OP50 (Brenner, 1973), повсеместно использующийся для выращивания C.elegans в лабораторных условиях. 1 этап На первом этапе будет проведена селекция бактерий E.coli штамма OP50 на способность увеличивать продолжительность жизни C.elegans. Для этого может быть использована одна из нижеперечисленных схем экспериментов или их комбинация. 1 схема экспериментов (рис.1(А)) (1) Создание библиотеки штаммов E.coli с измененной последовательностью гена белка транскрипционного аппарата Глобальное репрограммирование транскриптома бактерий OP50 будет производиться путем внесения изменений в регуляторные системы E.coli. Перспективным является изменение последовательности гена rpoD, кодирующего главный сигма фактор σ70. У прокариот σ70 является фактором инициации транскрипции и определяет предпочтение РНК-полимеразы к тому или иному промотору. Таким образом, изменяя последовательность гена rpoD, можно добиться изменения транскрипции целого спектра генов. Ранее данный подход уже был успешно использован для получения штаммов E.coli, устойчивых к этанолу, продуцирующих повышенное количество ликопина, а также устойчивых одновременно к этанолу и к SDS (sodium dodecyl sulfate) (Alper and Stephanopoulos, 2007). Альтернативным вариантом является внесение изменений в ген rpoA (α-субъединицы РНК-полимеразы) E.coli. α-субъединица РНК-полимеразы участвует в узнавании промотера, а также взаимодействует с рядом репрессоров и активаторов транскрипции. Ранее данный подход уже был успешно использован для получения новых свойств E.coli, таких как повышенная устойчивость к бутанолу, а также высокий уровень продукции L-тирозина и гиалуроновой кислоты (Klein-Marcuschamer, et al., 2009). В данных работах требовалось провести от 1 до 3х циклов глобального репрограммирования транскриптома для получения штаммов с нужными свойствами. В последовательность выбранного гена белка транскрипционного аппарата будут внесены случайные мутации путем использования ПЦР, характеризующейся высокой частотой ошибок (error-prone PCR). Полученные мутантные последовательности будут клонированы в плазмиды, которые будут использованы для трансформации бактерий. Особенностью данного подхода является то, что трансформированная клетка будет содержать 2 варианта гена белка транскрипционного аппарата: немодифицированную последовательность в геноме и модифицированную – в плазмиде. В результате будут выявлены мутанты, которые будут проявляться в присутствии немутантной последовательности белка транскрипционного аппарата. (2) Селекция полученных мутантных штаммов E.coli на способность увеличивать продолжительность жизни C.elegans Перед проведением селекции штаммов на способность продлевать жизнь C.elegans можно провести этап предварительной селекции, где будут отсеяны штаммы с пониженной или, наоборот, увеличенной скоростью роста и наличием ауксотрофных мутаций. Целью данной селекции является исключение из числа анализируемых штаммов тех, которые в связи со своей сниженной или, наоборот повышенной пролиферативной активностью могут изменять калорийность диеты C.elegans и, таким образом, модулировать скорость его развития и продолжительность жизни. Кроме того, штаммы с повышенной скоростью роста могут быть патогенны для C.elegans. Для успешного выявления бактерий, обладающих способностью увеличивать продолжительность жизни C.elegans, требуется проанализировать несколько тысяч различных штаммов. Поскольку исследовать каждый из них на способность продлевать жизнь C.elegans слишком трудоемко, предлагается анализировать по 3 штамма одновременно. Будет исследована продолжительность жизни C.elegans (не менее 5 особей в группе), выращенных на комбинации из 3 штаммов E.coli. Будет протестировано не менее 100 (предпочтительнее использовать 400-500) комбинаций. В случае, если какая-то из комбинаций штаммов приведет к удлинению жизни C.elegans, каждый из данных штаммов будет протестирован по отдельности. В ходе эксперимента будут отобраны штаммы, выращивание на которых приводит к наибольшей продолжительности жизни C.elegans. Полученные данные могут быть подтверждены повторной трансформацией бактерий плазмидами, содержащими отобранные последовательности генов белка транскрипционного аппарата, и последующей проверкой способности полученных штаммов продлевать жизнь C.elegans. Для дальнейшего улучшения фенотипа полученных штаммов E.coli могут быть проведены описанные ниже эксперименты. (3) Секвенирование последовательности гена белка транскрипционного аппарата, приводившей к наибольшему продлению жизни C.elegans. Повторение этапов (1)→(2)→(3) с последовательностью гена белка транскрипционного аппарата, приводившей к наибольшему продлению жизни C.elegans. 2 схема экспериментов (рис.1(Б)) (1) Индукция случайных мутаций у E.coli штамма OP50 Случайные мутации в геноме E.coli будут индуцированы путем добавления в среду, на которой выращиваются бактерии, химического мутагена (напр., нитрозогуанидин). Альтернативным вариантом является использование транспозонного мутагенеза или индукция мутагенеза путем использования гена-мутатора (напр., mutD5). (2) Селекция полученных мутантных штаммов E.coli на способность увеличивать продолжительность жизни C.elegans Селекция мутантных штаммов E.coli будет проводиться по аналогии с пунктом (2) схемы эксперимента 1. Будет отобрано несколько штаммов с наиболее подходящим фенотипом. (3) «Перемешивание» ДНК (DNA shuffling) бактерий, отобранных в результате селекции Данный подход позволяет осуществить рекомбинацию генетического материала одновременно более чем двух родительских штаммов для получения новых штаммов, комбинирующих полезные мутации исходных клеток. В основе подхода лежит слияние протопластов нескольких родительских штаммов, которое может быть индуцировано химическим (ПЭГ – полиэтиленгликолем), электрическим или лазерным воздействием. Ранее данный подход был успешно использован для получения штаммов Streptomyces fradiae, продуцирующих повышенное количество тилозина (Zhang et al., 2002), для увеличения устойчивости к кислоте у Lactobacillus (Patnaik et al., 2002), а также для получения штаммов Sphingobium chlorophenolicum, способных эффективнее разрушать пентахлорофенол (Dai and Copley, 2004). Применимость данного подхода для грамотрицательных бактерий была показана на E.coli, хотя эффективность в данном случае ниже, чем для грамположительных бактерий в связи с особенностями клеточной стенки (Dai et al., 2005). В данных работах проводили по 1-2 циклов «перемешивания» ДНК для получения штаммов с нужными свойствами. У отобранных на этапе (2) штаммов будет индуцировано слияние протопластов. Поскольку ранее было показано, что повторное слияние протопластов (recursive protoplast fusion) приводит к более высокому уровню рекомбинации между штаммами (Zhang et al., 2002), предлагается провести 3-4 цикла слияния протопластов. (4) Селекция полученных мутантных штаммов E.coli на способность увеличивать продолжительность жизни C.elegans Селекция мутантных штаммов E.coli будет проводиться по аналогии с пунктом (2) схемы эксперимента 1. Будет отобрано несколько штаммов с наиболее подходящим фенотипом. Для отобранных штаммов с целью дальнейшего улучшения фенотипа этапы (3)→(4) могут быть повторены ещё раз. Отобранный таким образом один или несколько штаммов может быть использован для повторного проведения экспериментов по схеме 2. Возможно объединение схем экспериментов 1 и 2, если исходным в схеме 2 будет служить штамм, полученный в результате селекции по схеме 1. В результате экспериментов по схеме 1 будет получен штамм несущий отобранную последовательность гена белка транскрипционного аппарата на плазмиде. В случае использования данного штамма в схеме экспериментов 2, возможно, более эффективным, будет являться перенос данного гена с плазмиды в хромосому E.coli. (А) Создание набора мутантных последовательностей гена белка транскрипционного аппарата E.coli Трансформация бактерий плазмидами, содержащими мутантные последовательности Селекция бактерий Секвенирование отобранного гена (Б) Индукция случайных мутаций у бактерий E.coli Селекция 2-3 цикла «Перетасовка» ДНК отобранных штаммов 1-2 цикла Селекция «Перетасовка» ДНК отобранных штаммов Селекция Рис. 1. Схемы проведения искусственного отбора штаммов E.coli с нужным фенотипом. (А) – схема 1; (Б) – схема 2. 3 схема экспериментов (рис. 3) Данная схема отличается от двух предыдущих тем, что в данном случае генетическое разнообразие E.coli индуцируется путем введения дополнительных генов. Будут использованы последовательности, кодирующие дцРНК (двуцепочечные РНК), подавляющие экспрессию генов C.elegans. Выращивание C.elegans на среде с бактериями E.coli, вырабатывающими определенные дцРНК, является распространенным подходом для подавления экспрессии генов C.elegans (Timmons and Fire, 1998). Поскольку показано, что отсутствие продуктов ряда генов C.elegans может приводить к существенному увеличению продолжительности жизни, представляет интерес исследование эффекта подавления экспрессии нескольких генов C.elegans одновременно. В рамках данного подхода будет исследовано влияние комбинаций дцРНК на продолжительность жизни C.elegans. (1) Создание библиотеки штаммов E.coli, содержащих случайный набор из 4 генов дцРНК, подавляющих экспрессию генов C.elegans Будет создан набор плазмид, содержащих случайную комбинацию из 4 последовательностей, кодирующих дцРНК, подавляющих экспрессию определенных генов C.elegans. Единовременное встраивание в плазмиду бόльшего количества последовательностей имеющимися на данный момент методами клонирования затруднительно. Комбинации последовательностей будут составлены из набора 400-600 генов дцРНК, комплементарных мРНК наиболее изученных генов C.elegans. Для получения плазмид, содержащих 4 последовательности, могут быть использованы различные подходы, в том числе основанные на сайт-специфичной рекомбинации (Gateway), на гомологичной рекомбинации (напр., In-fusion), на ПЦР (CPEC - circular polymerase extension cloning) или на лигировании (Gibson Assembly Cloning). 1 группа генов 2 группа генов Рис. 2. Создание последовательностей 3 группа генов 4 группа генов плазмиды, содержащей случайную комбинацию из 4 Для получения плазмид, содержащих случайную комбинацию из 4 генов дцРНК, может быть использован следующий подход. Исходный набор из 400-600 генов дцРНК может быть разделен на 4 группы по 100-150 последовательностей. Последовательности каждой группы будут модифицированы 1м из 4х типов фланкирющих сайтов (при помощи ПЦР или лигирования). Для сборки плазмиды со встроенными 4мя генами необходимо сочетание 4х последовательностей с разными фланкирующими сайтами. Таким образом, в состав плазмиды будет включаться 1 случайная последовательность из пула 100-150 последовательностей с одинаковыми фланкирующими участками (рис.2). Полученные таким образом плазмиды будут использованы для трансформации бактерий E.coli. (2) Селекция полученных мутантных штаммов E.coli на способность увеличивать продолжительность жизни C.elegans Для успешного выявления штаммов, обладающих способностью увеличивать продолжительность жизни C.elegans, требуется проанализировать не менее 100 (предпочтительнее использовать 400-500 и более) штаммов. Будет проанализировано не менее 5 особей C.elegans, выращенных на одном и том же штамме. В ходе эксперимента будут отобраны штаммы, выращивание на которых приводит к наибольшей продолжительности жизни C.elegans. Будет отобрано несколько штаммов с наиболее подходящим фенотипом. Таким образом, будут выявлены плазмиды с комбинациями дцРНК, приводящими к наибольшему продлению жизни C.elegans. (3) Исследование влияния комбинаций 2х плазмид на продолжительность жизни C.elegans В случае если на этапе (2) будут отобраны несколько штаммов, то может быть исследовано действие комбинации содержащихся там плазмид на продолжительность жизни C.elegans. Для данной цели возможно выращивание C.elegans одновременно на 2х (или более) штаммах, отобранных на этапе (2). Таким образом, будет исследовано влияние одновременного подавления экспрессии 8 и более генов C.elegans. Альтернативным подходом является трансформация бактерий комбинацией 2х плазмид, отобранных на этапе (2) и использование полученных штаммов для выращивания C.elegans. Кроме того, для трансформации могут быть использованы плазмиды, содержащие комбинацию из 8 генов дцРНК, отобранных на этапе (2). Также, сочетание генов дцРНК может быть оптимизировано для выявления комбинации максимально продлевающей жизнь C.elegans. С этой целью могут быть созданы новые плазмиды, несущие другую комбинацию дцРНК, отобранных на этапе (2) и использованы для трансформации E.coli. Селекция штаммов E.coli будет проводиться по аналогии с пунктом (2) схемы экспериментов 3. Будет отобрано несколько штаммов с наиболее подходящим фенотипом. Данная схема может быть, как использована самостоятельно, так и применена для улучшения фенотипа штаммов, полученных в результате отбора по схеме 1 или 2. Создание набора плазмид, содержащих случайную комбинацию 4х генов дцРНК Трансформация бактерий Селекция Исследование влияния комбинаций 2х и более плазмид на продолжительность жизни C.elegans Рис. 3. Схема проведения искусственного отбора штаммов E.coli с нужным фенотипом (схема 3) 2 этап На втором этапе будет исследован отобранный в результате селекции штамм E.coli. Будут изучены генетические особенности данного штамма, проанализирован его транскриптом и протеом с целью выявления тех веществ, действие которых на C.elegans приводит к увеличению продолжительности жизни. Также будет более детально исследовано влияние полученного штамма на физиологию и продолжительность жизни C.elegans. (1) Оценка влияния выведенного штамма E.coli на продолжительность жизни C.elegans Будет определена средняя и максимальная продолжительность жизни C.elegans, выращенных на среде со штаммом, полученным в результате селекции, и на среде с исходным штаммом OP50. (2) Оценка влияния выведенного штамма E.coli на скорость развития и количество потомства C.elegans Будет исследовано влияние штамма, полученного в результате селекции, на скорость развития и количество потомства C.elegans по сравнению с исходным штаммом OP50. (3) Анализ генома, транскриптома и протеома выведенного штамма E.coli Будет секвенирован геном выведенного штамма E.coli, и будут выявлены мутации, возникшие у исходного штамма OP50 в ходе селекции. Будет проанализирован транскриптом и протеом выведенного штамма и исходного штамма OP50 с целью веществ, действие которых на C.elegans приводит к увеличению продолжительности жизни. Литература 1) Larsen P.L., Clarke C.F. Extension of life-span in Caenorhabditis elegans by a diet lacking coenzyme Q // Science, 2002, V.295(5552), P.120-3., doi: 10.1126/science.1064653 2) Liu H., Wang X., Wang H-D., Wu J., Ren J., Meng L., Wu Q., Dong H., Wu J., Kao T-Y., Ge Q., Wu Z-X., Yuh C-H, Shan G. Escherichia coli noncoding RNAs can affect gene expression and physiology of Caenorhabditis elegans // Nature communications, 2012, V3:1073, doi: 10.1038/ncomms2071 3) Virk B., Correia G., Dixon D.P, Feyst I., Jia J., Oberleitner N., Briggs Z., Hodge E., Edwards R., Ward J., Gems D., Weinkove D. Excessive folate synthesis limits lifespan in the C. elegans: E. coli aging model // BMC Biology, 2012, V.10, P.67, doi:10.1186/1741-7007-10-67 4) Browning D.F., Wells T.J., Franca F.L.S., Morris F.C., Sevastsyanovich Y.R., Bryant J.A., Johnson M.D., Lund P.A., Cunningham A.F., Hobman J.L., May R.C., Webber M.A., Henderson I.R. Laboratory adapted Escherichia coli K-12 becomes a pathogen of Caenorhabditis elegans upon restoration of O antigen biosynthesis // Molecular Microbiology, 2013, V.87(5), P.939– 950., doi:10.1111/mmi.12144 5) Cobb R.E., Sun N., Zhao H. Directed evolution as a powerful synthetic biology tool // Methods, 2013, V.60, P.81–90., http://dx.doi.org/10.1016/j.ymeth.2012.03.009 6) Alper H., Stephanopoulos G., Global transcription machinery engineering: A new approach for improving cellular phenotype // Metabolic Engineering, 2007, V.9, P.258–267., doi:10.1016/j.ymben.2006.12.002 7) Klein-Marcuschamer D., Santos C.N.S., Yu H., Stephanopoulos G. Mutagenesis of the bacterial RNA polymerase alpha subunit for improvement of complex phenotypes // Appl. Environ. Microbiol., 2009, V.75(9), P.2705-2710, DOI: 10.1128/AEM.01888-08 8) Gong J., Zheng H., Wu Z., Chen T., Zhao X. Genome shuffling: Progress and applications for phenotype improvement // Biotechnology Advances, 2009, V.27, P.996–1005, doi:10.1016/j.biotechadv.2009.05.016 9) Brenner S.The genetics of Caenorhabditis elegans // Genetics, 1974, V.77, P.71-94. 10) Zhang Y-X., Perry K., Vinci V.A., Powell K., Stemmer W.P.C., del Cardayre S.B. Genome shuffling leads to rapid phenotypic improvement in bacteria // Nature, 2002, V.415(7), P.644-646, doi:10.1038/415644a 11) Patnaik R., Louie S., Gavrilovic V., Perry K., Stemmer W.P., Ryan C.M., del Cardayre S: Genome shuffling of Lactobacillus for improved acid tolerance // Nat. Biotechnol., 2002, V.20(7), P.707-712, doi:10.1038/nbt0702-707 12) Dai M., Copley S.D Genome shuffling improves degradation of the anthropogenic pesticide pentachlorophenol by Sphingobium chlorophenolicum ATCC 39723 // Appl. Environ. Microbiol., 2004, V.70(4), P.2391-2397, doi: 10.1128/AEM.70.4.2391-2397.2004 13) Dai M., Ziesman S., Ratcliffe T., Gill R.T., Copley S.D: Visualization of protoplast fusion and quantitation of recombination in fused protoplasts of auxotrophic strains of Escherichia coli // Metab. Eng., 2005, V.7(1), P.45-52, http://dx.doi.org/10.1016/j.ymben.2004.09.002 14) Timmons L., Fire A. Specific interference by ingested dsRNA // Nature, 1998, V.395, P.854, doi:10.1038/27579. Проект подготовили: Шубина А.Н., Глинин Т.С.