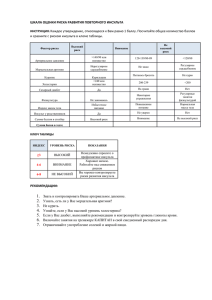
Алгоритм проведения системной тромболитической терапии при
advertisement

Лихачев С.А., Кулеш С.Д., Савицкий С.Э. РНПЦ неврологии и нейрохирургии, Гродненский государственный медицинский университет, Гродненская областная клиническая больница Алгоритм проведения системной тромболитической терапии при ишемическом инсульте ВВЕДЕНИЕ Мозговой инсульт является одной из ведущих причин заболеваемости и смертности населения во всем мире [7, 19]. Внутривенное введение рекомбинантного тканевого активатора плазминогена (rtPA) остается наиболее полезным доказанным вмешательством при неотложной терапии ишемического инсульта [10, 11]. Впервые клиническое применение rtPA для системной (внутривенной) тромболитической терапии (сТЛТ) ишемического инсульта (инфаркта мозга) было разрешено в США в 1996 г., при этом главным основанием являлись результаты мультицентрового испытания, проведенного Национальным институтом неврологических заболеваний и инсульта (NINDS), США. Анализ 624 случаев ишемического инсульта (ИИ) показал, что в группе rtPA уровень восстановления функционального дефицита был на 30% выше по сравнению с группой плацебо [30]. В 1996 г. были опубликованы первые рекомендации по сТЛТ Совета по инсульту Американской кардиологической ассоциации [9], а также Американской академии неврологии [27], основой которых явился протокол исследования NINDS. В 2007 г. опубликованы рекомендации последнего пересмотра по ведению ИИ Совета по инсульту Американской кардиологической ассоциации и Американской ассоциации по проблеме инсульта (AHA/ASA), VI раздел которых посвящен сТЛТ [10]. В Европейском Союзе клиническое применение rtPA для сТЛТ при ИИ разрешено с 2002 г. [8], рекомендации 2008 г. по ведению ИИ и транзиторных ишемических атак Европейской организации по проблеме инсульта (ESO) содержат раздел, посвященный сТЛТ [31]. В 2007 г. опубликованы методические рекомендации НИИ инсульта Российского государственного медицинского университета по сТЛТ при ИИ [6]. В Республике Беларусь клиническое использование 16 Практикующему врачу rtPA при ИИ стало возможным после внесения изменений в инструкцию по применению лекарственного средства «Актилизе» (алтеплаза, «Boehringer Ingelheim»), одобренное Министерством здравоохранения Республики Беларусь 30.10.2006 г. [2]. В 2008 г. в Беларуси опубликованы Национальные рекомендации по диагностике и лечению инсульта [1], в которых имеется раздел по внутривенному тромболизису. В 2009 г. вышли в свет методические рекомендации РНПЦ неврологии и нейрохирургии по сТЛТ при ИИ [5]. Несмотря на большое количество нормативных и рекомендательных публикаций по данной лечебной технологии, имеется необходимость детализировать формулировки показаний и противопоказаний, а также перечень обязательных и дополнительных диагностических процедур, так как в указанных выше источниках имеется ряд несоответствий и разночтений, а также нечеткость формулировок. Между тем, сТЛТ при ИИ требует очень строгого соблюдения всех показаний и противопоказаний, что не допускает их произвольного толкования. Кроме того, необходимо унифицировать подход к оценке эффективности и безопасности данного метода. ЦЕЛЬ РАБОТЫ Разработать детализированный алгоритм сТЛТ ишемического инсульта для использования в клинической практике медицинских учреждений Республики Беларусь. МАТЕРИАЛЫ И МЕТОДЫ Литературный поиск проведен в базах данных «Medline», «Current Contents», «Российская медицина» ГЦНМБ по ключевым словам «ишемический инсульт», «тромболизис», «лечение», «реканализация», «активатор плазминогена», «алтеплаза», «показания», «противопоказания», «обследование» и их сочетаниям. Ручной поиск был проведен по источникам «Журнал неврологии и психиатрии им. Корсакова», «Неврологический журнал», «Анналы клинической и экспериментальной неврологии», а также по спискам литературы отобранных статей. Глубина поиска 15 лет – с 1995 по 2009 гг. Анализировались обзорные статьи и рекомендации, опубликованные на русском и английском языках. Сделан предварительный анализ результатов проведения сТЛТ в условиях Гродненской областной клинической больницы, а также предложения по организации реперфузионной терапии, полученные в процессе личных консультаций с членами Экспертной группы по проблеме инсульта Европейской федерации неврологических обществ (EFNS Stroke Panel). Рассмотрены показания и противопоказания для сТЛТ, перечень обязательных и дополнительных диагностических процедур, технология введения алтеплазы, сопутствующая терапия, критерии оценки эффективности и безопасности лечения. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Раздел показаний для сТЛТ при ИИ в «Инструкции по медицинскому применению лекарственного препарата Актилизе» (далее – Инструкция) [2] и ряде других источников [1, 6, 8, 11, 16, 25, 31] является очень кратким и включает клинический диагноз ИИ после исключения «Неврология и нейрохирургия в Беларуси» № 4 (04), 2009 17 Алгоритм проведения системной тромболитической терапии при ишемическом инсульте внутричерепного кровоизлияния с помощью методов нейровизуализации (рентгеновской компьютерной томографии (РКТ) или магнитнорезонансной томографии (МРТ)), 3-часовой временной интервал, возраст от 18 до 80 лет. По нашему мнению, целесообразно детализировать показания вследствие следующих причин. Во-первых, в ряде случаев неврологический дефицит при ИИ является легким (малым), не приводящим пациента к зависимости от окружающих; использование тромболизиса в таких случаях будет сопровождаться превышением риска над возможной пользой лечения. Указание тяжести неврологического дефицита в показаниях может способствовать принятию правильных организационных решений на догоспитальном этапе (изменение направления потока больных, связанные с проведением реперфузионной терапии вне пределов базового ангионеврологического отделения). В рекомендациях AHA/ASA [10] подчеркнуто, что сТЛТ показана больным с измеримым (measurable) неврологическим дефицитом, имея в виду оценку по шкале инсульта NIH (Национальных институтов здоровья США [15]). Минимальное количество баллов не указано, однако в ряде обзорных публикаций неврологический дефицит менее 4 баллов по шкале инсульта NIH признается легким и не требующим проведения сТЛТ [21, 24, 28]. Конкретные примеры такого дефицита указаны в рекомендациях АНА 1996 г.: изолированные дизартрия, гипестезия или атаксия, легкий парез [9, 14, 26]. Во-вторых, установлению времени начала симптомов инсульта следует уделять особое внимание, так как соблюдение 3 часового интервала является одним из основополагающих требований при указанной терапии. Задача облегчается при остром развитии симптомов в присутствии очевидца, так как нарушения речи и угнетение сознания вследствие инсульта затрудняют получение анамнестических сведений от самого больного. В случаях, когда инсульт развивается во время ночного сна или в отсутствии очевидца, временем начала необходимо считать момент, когда пациента последний раз наблюдали бессимптомным. С учетом изложенного, уточненная формулировка – показание для сТЛТ с использованием алтеплазы: острый ишемический инсульт у пациента в возрасте от 18 до 80 лет в течение первых 3 часов от начала развития симптомов инсульта после исключения внутричерепного кровоизлияния с помощью методов нейровизуализации (РКТ/МРТ) и наличия следующих условий: неврологический дефицит инвалидизирующий (приводит к зависимости от окружающих и/или оценивается в 4 и более баллов по шкале инсульта NIH); время начала симптомов инсульта четко определено. С целью унификации противопоказаний с международными нормативными документами внесены дополнения в противопоказания, указанные в Инструкции, на основе рекомендаций AHA/ASA [10] (Д1), а также Европейской лицензии [8] (Д2). Предложены коррекции формулировок противопоказаний следующих типов: К1 – с целью большей определенности; К2 – в соответствии с Европейской лицензией [8]; К3 – в соответствии с рекомендациями АНА 1996 г. [9]; К4 – в соответствии с рекомендациями AHA/ASA [10]; К5 – с использованием единиц измерения СИ. Противопоказания объединены в один блок и пронумерованы, последовательность соответствует таковой в Инструкции. 18 Практикующему врачу Противопоказания для проведения сТЛТ при ишемическом инсульте (Д/К – дополнение/корректировка противопоказаний Инструкции): 1. значительное кровотечение в настоящее время или в течение предыдущих 6 месяцев; 2. кровотечение (любой интенсивности) из желудочно-кишечного тракта или мочевых путей в течение предыдущих 21 дней (Д1); 3. геморрагический диатез (тромбоцитопатия, коагулопатия или вазопатия); 4. прием пациентом пероральных антикоагулянтов (варфарин, фенилин), если значение международного нормализованного отношения (МНО) > 1,3 в момент принятия решения о ТЛТ (К1); 5. любые повреждения центральной нервной системы в анамнезе (новообразования, аневризмы, хирургические вмешательства на головном или спинном мозге) (К2); 6. внутричерепное кровоизлияние в анамнезе (субарахноидальное, внутримозговое, субдуральное); 7. подозрение на наличие внутричерепного кровоизлияния; 8. тяжелая неконтролируемая артериальная гипертензия (систолическое АД ≥ 180 мм рт. ст. или диастолическое АД ≥ 110 мм рт. ст. [35]) (К1); 9. обширное хирургическое вмешательство или значительная травма в течение предыдущих 3 месяцев (К2); 10. травматичный или длительный (>2 мин) наружный массаж сердца, роды в течение предыдущих 10 дней; 11. недавняя (менее 10 дней) пункция недоступного прижатию (некомпремируемого) кровеносного сосуда (например, подключичной или яремной вены); 12. тяжелые заболевания печени, в том числе печеночная недостаточность, цирроз, портальная гипертензия (варикозное расширение вен пищевода) и активный гепатит; 13. геморрагическая ретинопатия и другие геморрагические заболевания глаз; 14. бактериальный эндокардит, перикардит; 15. перенесенный инфаркт миокарда в течение 3 предыдущих месяцев (Д1); 16. острый панкреатит; 17. документально подтвержденная язвенная болезнь желудка или двенадцатиперстной кишки (острая или обострение хронической), язвенный колит (острый или обострение хронического) в течение последних трех месяцев (К1, К2); 18. варикозное расширение вен пищевода, артериальные аневризмы, артериовенозные мальформации (Д2, К2); 19. новообразование с повышенным риском развития кровотечения; 20. повышенная чувствительность к компонентам препарата (активный ингредиент – алтеплаза; вспомогательные вещества – L-аргинин, фосфорная кислота, полисорбат) (К1); 21. начало симптомов ишемического инсульта более чем за 3 часа до начала инфузии, или отсутствие точных сведений о времени начала симптомов; 22. малый неврологический дефицит (изолированные дизартрия, гипестезия или атаксия, легкий парез [9]), соответствующий 0–3 бал«Неврология и нейрохирургия в Беларуси» № 4 (04), 2009 19 Алгоритм проведения системной тромболитической терапии при ишемическом инсульте лам по шкале инсульта NIH, или быстрый регресс симптоматики (до малого неврологического дефицита или до полного исчезновения) к моменту начала инфузии (К1, К3); 23. тяжелый инсульт по клиническим данным – более 25 баллов по шкале инсульта NIH; 24. тяжелый инсульт по данным нейровизуализации (гиподенсивность или ранние ишемические изменения [17] в более 1/3 полушария при бесконтрастной РКТ) (К4); 25. судорожный припадок в начале инсульта; 26. перенесенный инсульт (любой тип) в течение 3 предыдущих месяцев; 27. среднетяжелая или тяжелая черепно-мозговая травма в течение предыдущих 3 месяцев (К1); 28. перенесенный инсульт (все типы, любые сроки) и наличие сахарного диабета; 29. применение гепарина в предшествующие 48 часов, если активированное частичное тромбопластиновое время (АЧТВ) превышает верхнюю границу нормы в момент принятия решения о ТЛТ (К1); 30. применение антиагрегантов на момент инфузии и в течение первых 24 часов после инфузии; 31. число тромбоцитов менее 100 × 109/л (К5); 32. систолическое артериальное давление ≥ 180 мм рт. ст. или диастолическое артериальное давление ≥ 110 мм рт. ст., или необходимость применения интенсивной терапии (внутривенное введение препаратов) для снижения артериального давления до этих границ (К1) [35]; 33. уровень глюкозы в крови менее 2,7 ммоль/л или более 22,2 ммоль/л (К5); 34. беременность или кормление грудью. Следует отметить, что большинство противопоказаний основано на мнении экспертов, так как данных соответствующих рандомизированных контролируемых испытаний нет. В настоящее время по результатам недавних исследований [20, 34] временной интервал в рекомендациях ESO (обновление в январе 2009 г. [32]) расширен до 4,5 часов (п. 21), однако изменения в инструкцию по применению (в т.ч. в странах Европейского союза) пока не внесены. В п. 24 указаны только РКТ-критерии тяжелого инсульта, так как аналогичные критерии для МРТ-исследования не выработаны. П. 25 позволял исключить паралич Тодда при доступности только бесконтрастной РКТ; последние рекомендации ESO допускают использование сТЛТ у пациентов с судорожным припадком в начале инсульта, если доказана связь неврологического дефицита с острой церебральной ишемией путем использования мультимодальных визуализационных критериев [31]. Внося пояснения в п. 29, необходимо уточнить, что имеется лишь ориентировочная верхняя граница нормы АЧТВ (35,1 [22]), так как каждая лаборатория определяет референтные значения данного показателя в соответствии с используемыми реактивами. Первая часть п. 30 не имеет аналогов в американских и Европейских рекомендациях и в последующих версиях инструкции для применения может быть переведена в раздел «Меры предосторожности». Объем диагностических исследований при проведении сТЛТ определяется Инструкцией [2], методическими рекомендациями [1, 10, 31], а также «Клиническими протоколами диагностики и лечения больных 20 Практикующему врачу с патологией нервной системы» (Приложение 7 к Приказу МЗ РБ № 274 от 19.05.2005 г.) [3]. При поступлении в стационар пациенту, имеющему показания для сТЛТ, делают общий анализ крови (включая количество тромбоцитов), биохимическое исследование крови (глюкоза, мочевина, креатинин, билирубин, АлАТ, АсАТ), измеряют показатели коагулограммы (АЧТВ, МНО, тромбиновое время, фибриноген, этаноловый тест, спонтанный фибринолиз, гематокрит), определяют группу крови, проводят общий анализ мочи и запись ЭКГ. При этом в режиме неотложного анализа – эритроциты, гемоглобин, тромбоциты, гликемия, АЧТВ, МНО, запись ЭКГ. В настоящее время учреждения здравоохранения Республики Беларусь, оказывающие помощь больным инсультом, имеют различную оснащенность аппаратами для нейровизуализации. Согласно текущим требованиям регламентирующих документов достаточным является использование бесконтрастной РКТ. Низкопольные аппараты для МРТ («Образ 2М» (0,15 Тл) и аналоги) недостаточно эффективны и надежны для выявления и дифференцировки внутричерепных кровоизлияний, поэтому не могут использоваться при отборе пациентов для сТЛТ при ИИ. Высокопольные МР-томографы (напряженность поля 1 Тл и более) дают возможность с достаточной достоверностью выявить внутричерепное кровоизлияние с помощью специальных режимов на основе градиентного эха (Т2*) и FLAIR (подавление сигнала свободной воды). Современные аппараты для МРТ и РКТ позволяют не только исключить внутричерепное кровоизлияние, но и визуализировать зону ишемии в мозге, а также детектировать тромбоз. Это достигается с помощью так называемых мультимодальных визуализационных критериев: режимы диффузионно-взвешенной визуализации (DWI), перфузионновзвешенной визуализации (PWI) и магнитно-резонансная ангиография (MRA) для МР-исследования, а также перфузионная КТ (PCT) и КТангиография (CTA) при РКТ-исследовании на мультисрезовых спиральных томографах. В рекомендациях ESO указано, что «использование мультимодальных визуализационных критериев может быть полезно при отборе пациентов для тромболизиса, но не рекомендуется для рутинного использования в клинической практике» [31]. Церебральная катетеризационная ангиография (дигитальная субтракционная ангиография, DSA) не является обязательным диагностическим методом при отборе больных ИИ для сТЛТ. Ее выполнение целесообразно, если планируется интраартериальное введение алтеплазы (селективный тромболизис). Дуплексное сканирование прецеребральных артерий и транскраниальная допплерография также не входят в обязательный перечень обследований пациентов с инсультом перед проведением сТЛТ. Однако их использование может оказать существенную пользу в случаях, когда отсутствуют данные о состоянии мозгового кровотока, например, после проведения только бесконтрастной РКТ. Кроме того, длительная (в течение 2 часов от начала лечения) транскраниальная допплерография обеспечивает воздействие ультразвука на тромб и способствует более быстрому и полному его лизису [12]. Алтеплазу при сТЛТ больных ИИ вводят внутривенно в дозе 0,9 мг препарата на кг массы тела (максимальная доза 90 мг). Для получения «Неврология и нейрохирургия в Беларуси» № 4 (04), 2009 21 Алгоритм проведения системной тромболитической терапии при ишемическом инсульте конечной концентрации алтеплазы 1 мг/мл (восстановленный раствор) во флакон Актилизе, содержащий сухое вещество, должен быть добавлен весь объем прилагаемого растворителя (воды для инъекций). Первоначально 10% общей дозы назначается болюсным введением, затем оставшаяся часть восстановленного раствора разводится физиологическим раствором (минимальная концентрация 0,2 мг/мл, дальнейшее разведение водой для инъекций или растворами на основе углеводов не допускается) и проводится инфузия в течение 60 минут. Препарат Актилизе нельзя смешивать с другими лекарственными средствами ни во флаконе для инфузии, ни в общей системе для внутривенного введения. Сопутствующая терапия определяется «Клиническими протоколами диагностики и лечения больных с патологией нервной системы» [3], при этом в первые 24 часа после начала сТЛТ следует избегать применения ацетилсалициловой кислоты или внутривенного введения гепарина. Если применение гепарина требуется по другим показаниям, то его доза не должна превышать 10 000 МЕ в день, а препарат вводится подкожно. Целевое АД в первые сутки от начала лечения: систолическое – менее 180 мм рт. ст., диастолическое – менее 110 мм рт. ст. В течение суток необходимо избегать внутримышечных инъекций, катетеризирования центральных вен, катетеризирования мочевого пузыря из-за повышенного риска кровотечения. С целью унификации оценки эффективности и безопасности сТЛТ целесообразно использовать критерии и их периодичность международного регистра тромболитической терапии при ИИ в рамках продолжающегося обсервационного исследования SITS-MOST [33]. Они включают: измерение тяжести неврологического дефицита по шкале инсульта NIH через 2, 24 часа и 7 суток от начала лечения; нейрорадиологическое исследование в сроки 22–36 часов (и факультативное на 7-е сутки); наличие побочных эффектов; возникновение симптомного внутримозгового кровоизлияния; оценку степени ограничения жизнедеятельности по модифицированной шкале Рэнкина [29] через 3 месяца после ИИ; 90-дневную летальность. Симптомное внутримозговое кровоизлияние определяется в исследовании SITS-MOST как локальное или отдаленное паренхимное кровоизлияние 2 типа [13, 18], которое подтверждается при нейрорадиологическом исследовании в сроки 22–36 часов после сТЛТ и сочетается с утяжелением неврологического дефицита по шкале инсульта NIH на 4 и более баллов по сравнению с исходным уровнем либо наименьшим уровнем в период от начала терапии до 24 часов, либо приводящее к смерти [33]. Эффективность сТЛТ определяется как состояние функциональной независимости от окружающих через 3 месяца после ИИ, что соответствует значениям модифицированной шкале Рэнкина 0–2 баллов. Анализ результатов сТЛТ в рамках научных исследований может включать ряд дополнительных критериев – индекс Бартела, шкалу исходов Глазго и др. [20, 30]. Последовательность действий при проведении сТЛТ представлена следующим образом: 1. выявление пациента, имеющего показания для ТЛТ, и его экстренная госпитализация; 2. предварительный анализ показаний и противопоказаний; 22 Практикующему врачу 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. экстренное лабораторное обследование; экстренное нейрорадиологическое обследование (РКТ/МРТ); окончательный анализ показаний и противопоказаний; принятие решения о ТЛТ; направление в отделение реанимации и интенсивной терапии (палату интенсивной терапии); введение алтеплазы; сопутствующая терапия; мониторинг жизненно важных функций, неврологического статуса и лабораторных показателей через 2 часа от начала введения алтеплазы; мониторинг жизненно важных функций, неврологического статуса и лабораторных показателей через 24 часа от начала введения алтеплазы; повторное нейрорадиологическое исследование через 24–36 часов; перевод в неврологическое отделение через 24–48 часов; мониторинг неврологического статуса и лабораторных показателей через 7 суток от начала введения алтеплазы; повторное нейрорадиологическое исследование через 7 суток; выписка из стационара в плановые сроки; мониторинг неврологического статуса и степени ограничения жизнедеятельности по шкале Рэнкина через 3 месяца. ВЫВОДЫ Таким образом, разработан детализированный алгоритм сТЛТ ишемического инсульта с уточнением и конкретизацией показаний, противопоказаний, перечня диагностических процедур, технологии введения алтеплазы, критериев оценки эффективности и безопасности лечения, что позволит обеспечить активное и унифицированное внедрение данной терапевтической технологии в практику медицинских учреждений Республики Беларусь. Электронные методические материалы по данному вопросу доступны на сайте кафедры неврологии Гродненского государственного медицинского университета [4]. ЛИТЕРАТУРА 1. Диагностика и лечение инсульта: рекомендации / РНПЦ неврологии и нейрохирургии; авт.сост. С.А. Лихачев, А.В. Астапенко, Э.К. Сидорович и др. – Минск, 2008. – 70 с. 2. Инструкция по медицинскому применению лекарственного препарата Актилизе [Электронный ресурс] / Кафедра неврологии Гродн. гос. мед. ун-та. – Гродно, 2009. – Режим доступа: http://www.grsmu.by/show.php?n=379. – Дата доступа: 15.10.2009. 3. Клинические протоколы диагностики и лечения больных с патологией нервной системы // Здравоохранение. – 2009. – № 4. – С. 62–74. 4. Методические материалы для проведения системной тромболитической терапии при ишемическом инсульте [Электронный ресурс] / Кафедра неврологии Гродн. гос. мед. унта. – Гродно, 2009. – Режим доступа: http://www.grsmu.by/show.php?n=379. – Дата доступа: 15.10.2009. «Неврология и нейрохирургия в Беларуси» № 4 (04), 2009 23 Алгоритм проведения системной тромболитической терапии при ишемическом инсульте 5. Системная тромболитическая терапия при инфаркте мозга: рекомендации для врачей / РНПЦ неврологии и нейрохирургии МЗ РБ; авт.-сост. С.А. Лихачев и др. – Минск, 2009. – 27 с. 6. Системная тромболитическая терапия при ишемическом инсульте: метод. рекомендации / НИИ инсульта РГМУ; авт.-сост. Н.А. Шамалов; под ред. В.И. Скворцовой. – Москва, 2007. – 70 с. 7. Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Сосудистые заболевания головного мозга: Эпидемиология. Основы профилактики. – М.: МЕДпресс-информ, 2006. – 256 с. 8. Actilyse [Electronic resource] / European Agency for the Evaluation of Medicinal products – Mode of access: http://emc.medicines.org.uk/emc/assets/c/html/displaydoc.asp?documentid=308. – Date of access: 16.10.2009. 9. Adams H.P. Jr., Brott T., Furlan A. et al. // Circulation. – 1996. – Vol. 94. – P. 1167–1174. 10. Adams H.P. Jr., del Zoppo G.J., Alberts M.J. et al. // Stroke. – 2007. – Vol. 38. – P. 1655–1711. 11. Albers G.W., Amarenco P., Easton J.D., Sacco R.L., Teal P. // Chest. – 2008. – Vol. 133 (suppl.). – 630S–669S. 12. Alexandrov A.V. // Stroke. – 2009. – Vol. 40, № 3 (Suppl. 1). – S107–S110. 13. Berger C., Fiorelli M., Steiner T. et al. // Stroke. – 2001. – Vol. 32. – P. 1330–1335. 14. Broderick J. P., Hacke W. // Circulation. – 2002. – Vol. 106. – P. 1563–1569. 15. Brott T., Adams H.P. Jr., Olinger C.P. et al. // Stroke. – 1989. – Vol. 20. – P. 864–870. 16. Brott T., Bogousslavsky J. // N. Engl. J. Med. – 2000. – Vol. 343. – P. 710–722. 17. Demchuk A.M., Hill M.D., Barber P.A. et al. // Stroke. – 2005. – Vol. 36. – P. 2110–2115. 18. Derex L., Nighoghossian N. // J. Neurol. Neurosurg. Psychiatry. – 2008. – Vol. 79. – P. 1093–1099. 19. Donnan G. A., Fisher M., Macleod M., Davis S. M. // Lancet. – 2008. – Vol. 371.– P. 1612–1623. 20. Hacke W., Kaste M., Bluhmki E. et al. // New Engl. J. Med. – 2008 – Vol. 359. – P. 1317–1329. 21. Hjort N., Butcher K., Davis S.M. et al. // Stroke. – 2005. – Vol. 36. – P. 388–397. 22. Kratz A., Ferraro M., Sluss P.M., Lewandrowski K.B. // N. Engl. J. Med. – 2004. – Vol. 351. – P. 1548– 1563. 23. Meschia J.F., Miller D.A., Brott T.G. // Mayo Clin. Proc. – 2002. – Vol. 77. – P. 542–551. 24. Nedeltchev K., Schwegler B., Haefeli T. et al. // Stroke. – 2007. – Vol. 38. – P. 2531–2535. 25. Norris J.W., Buchan A., Cote R. et al. // Can. J. Neurol. Sci. – 1998. – Vol. 25. – P. 257–259. 26. Parsons M.W. // Int. J. Stroke. – 2008. – Vol. 3. – P. 41–50. 27. Practice advisory: thrombolytic therapy for acute ischemic stroke – summary statement: report of the Quality Standards Subcommittee of the American Academy of Neurology // Neurology. – 1996. – Vol. 47. – P. 835–839. 28. Smith E.E., Abdullah A.R., Petkovska I. et al. // Stroke. – 2005. – Vol. 36. – P. 2497–2499. 29. van Swieten J.C., Koudstaal P.J., Visser M.C., Schouten H.J., van Gijn J. // Stroke. – 1988. – Vol. 19. – P. 604–607. 30. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group // N. Engl. J. Med. – 1995. – Vol. 333. – P. 1581–1587. 31. The European Stroke Organisation (ESO) Executive Committee and the ESO Writing Committee: Guidelines for management of ischaemic stroke and transient ischaemic attack 2008 // Cerebrovasc. Dis. – 2008. – Vol. 25. – P. 457–507. 32. The European Stroke Organisation (ESO) Executive Committee and the ESO Writing Committee: Guidelines for management of ischaemic stroke and transient ischaemic attack 2008 [Electronic resource] / European Stroke Organisation – Mode of access: http://www.eso-stroke.org/pdf/ESO Guidelines_update_Jan_2009.pdf. – Date of access: 16.10.2009. 33. Wahlgren N., Ahmed N., Dávalos A. et al. // Lancet. – 2007. – Vol. 369. – P. 275–282. 34. Wahlgren N., Ahmed N., Dávalos A. et al. // Lancet. – 2008. – Vol. 372. – P. 1303-1309. 35. 1999 WHO – ISH guidelines for the management of hypertension // J. Hypertension. – Vol. 17. – P. 151–183. 24