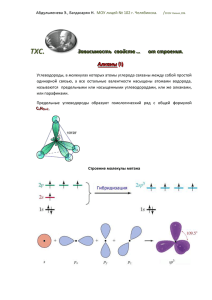
СХЕМЫ по органической химии, составленные обучающимися
advertisement
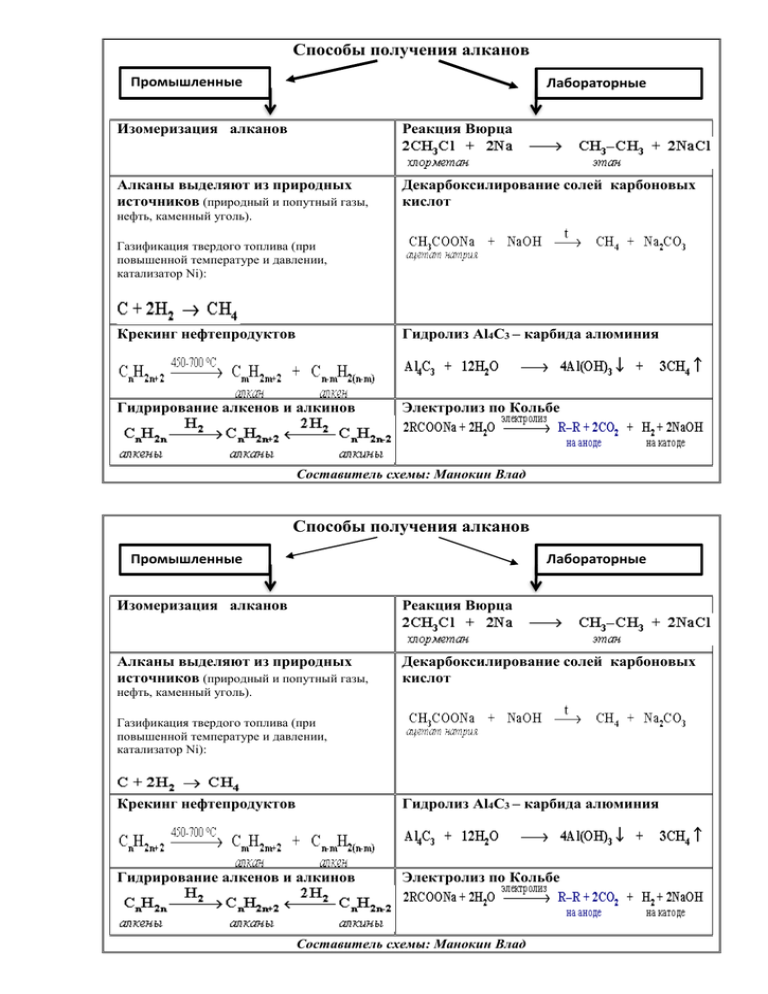
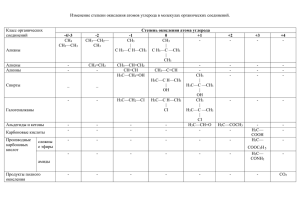
Способы получения алканов Промышленные Лабораторные Изомеризация алканов Реакция Вюрца Алканы выделяют из природных источников (природный и попутный газы, Декарбоксилирование солей карбоновых кислот нефть, каменный уголь). Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): Крекинг нефтепродуктов Гидролиз Al4C3 – карбида алюминия Гидрирование алкенов и алкинов Электролиз по Кольбе Составитель схемы: Манокин Влад Способы получения алканов Промышленные Лабораторные Изомеризация алканов Реакция Вюрца Алканы выделяют из природных источников (природный и попутный газы, Декарбоксилирование солей карбоновых кислот нефть, каменный уголь). Газификация твердого топлива (при повышенной температуре и давлении, катализатор Ni): Крекинг нефтепродуктов Гидролиз Al4C3 – карбида алюминия Гидрирование алкенов и алкинов Электролиз по Кольбе Составитель схемы: Манокин Влад ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ (Составитель схемы Петрякова Алина) А) галогенирование CH2=CH-CH3+Cl2 CH2Cl-CHCl-CH3 Качественной реакцией на кратную связь является обесцвечивание бромной воды Б) гидрирование CH2=CH-CH3+Н2 CH3-CH2-CH3 В) гидрогалогенирование CH2=CH-CH3+НCl CH3-CHCl-CH3 Присоединение протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода) Г) гидратация Присоединение протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода) : Полное окисление: C2H4 + 3O2 = 2CO2+ 2H2O Реакция Вагнера - качественная реакция на кратную связь (происходит обесцвечивание раствора) Окисление перманганатом калия в нейтральной или слабощелочной среде Окисление перманганатом калия в подкисленом серной кислотой растворе происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы: 5 CH3-CH=CH-CH3 + 8 KMnO4 + 12 H2SO4 → 10 CH3-COOH + 4 K2SO4 + 8 MnSO4 + 12 H2O Если двойная связь находится на конце молекулы, то одним из продуктов является муравьиная кислота, которая легко окисляется до углекислого газа и воды: 5 CH3-CH2-CH=CH2 + 2 KMnO4 + 3 H2SO4 → 10 CH3-СН2 - COOH +СО2 + K2SO4 + 2 MnSO4 + 4 H2O H3C – C = CH + Br2 Вод. H3C – C = CH I I Br Br Br Br I I H3C – C – CH I I Br Br CH3 – CH2 - CH3 H3C – C = CH + Br2 I I Br Br HC = C – CH3 + 2H2 Р. Кучерова Hg2+ HC = CH + HOH CH2 = CH I OH H3C – C = CH + 2HCl CH3 СНО Cl I H3C – C – CH3 I Cl 3HC = CH + 8KMnO4 + H2O O O II II 3 C – C + 8KOH + 8Mn+4O2 I I HO OH 3HC = CH + 4K2Cr2O7 + 16H2SO4 O O II II 3C – C + 4K2SO4 + 4Cr2(SO4)3+16H2O I I HO OH t0, кат. 2CH = CH H2C = CH – C = CH CH3 I t0, 3HC = C – CH3 H3C - HC = CH + 2Na NaC = CNa + H2 HC = CH + 2Cu+1Cl - CH3 CuC = CCu + 2 HCl HC = CH + 2[Ag(NH30)2]OH AgC = CAg + + 4NH3 + 2H2O • Способы получения алкинов • Пиролиз метана •Составитель схемы Высоцкая Елена Дегидрогалогенирование дигалогеналканов Действие избытком спиртового раствора щелочи Отщепление водорода по правилу Зайцева • Термоокислительный пиролиз метана c образованием ацетилена, оксида углерода (II) и водорода • Карбидный (СaC2) способ получения ацетилена