Пути решения проблемы безопасности применения клеточных
advertisement

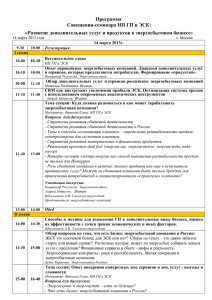
Н.Д.БУНЯТЯН Пути решения проблемы безопасности применения клеточных технологий С овременная медицина активно использует клеточные технологии для лечения разных нозологических групп заболеваний, причиной которых является аномальное поведение отдельных клеточных популяций организма. Внедрению методов клеточной терапии способствуют такие Н.Д.Бунятян. факторы, как перманентный дефицит донорских органов, высокая себестоимость трансплантаций органов и тканей, опасность развития осложнений, а также высокий процент инвалидизации и гибели пациентов, прошедших через процедуру трансплантации органов. Приоритеты в изучении стволовых клеток (СК) отечественной наукой были определены еще в начале XX века, когда в 1908 г. выдающийся русский ученый гистолог и эмбриолог А.А.Максимов обосновал концепцию существования СК в кроветворной ткани [2]. Его научную эстафету в начале 70-х гг. приняли советские ученые А.Я.Чертков и И.Л.Фриденштейн, которые и заложили основы науки о стволовых клетках. СК способны превращаться в клетки всех типов тканей: клетки крови, внутренних органов, мышечных, костных и эпидермальных тканей, нейроны и др. (рис.). Актуальность проблемы применения стволовых клеток не вызывает сомнений, однако существенными препятствиями на пути внедрения клеточных технологий в широкую клиническую практику служат несколько причин. В первую очередь, это религиозные и этические проблемы, связанные с использованием для получения СК эмбрионов человека. Большинство известных способов извлечения СК сопровождаются разрушающими процедурами: деструкцией оплодотворенных яйцеклеток и эмбрионов на ранних стадиях развития. Существуют также чисто техниН.Д.БУНЯТЯН, зам. генерального директора по научной работе ФГУ «Научный центр экспертизы средств медицинского применения» Росздравнадзора, д.ф.н., проф., bunyatyan@regmed.ru SUMMARY N.D.BUNYATYAN. The issue of safe use of cell technology. The modern medical science actively uses cell technologies for the treatment of various illnesses caused by abnormal functioning of certain cell groups in the human body. Studies on the use of cell and gene technologies based on stem cells in Russia have not been carried out properly so far and the majority of companies providing stem cell-based therapies have not got licenses for that kind of activity. Standard approaches and quality assurance systems for the control of stem technologies should be developed to ensure the safety of their clinical use. It is also necessary to create a common global database for the induction of stem cells and develop a specially tailored legal framework providing a comprehensive regulatory basis for the complete variety of cell technology applications. ческие препятствия: несовершенная и недостаточная нормативно-правовая база в области клеточных технологий; дефицит донорского материала; отсутствие доказательной базы выраженных и пролонгированных клинических эффектов у больных с хроническими системными и аутоиммунными заболеваниями. Основной целью любой клеточной терапии является восстановление, замещение или улучшение функций поврежденных тканей или органов. Клетки, используемые для данного процесса, могут отбираться как у самого пациента, так и у донора или животного. Типы человеческих клеток, используемых в клеточной терапии, могут быть различными, в том числе и стволовыми. В нашей стране в большинстве случаев источником клеток для клеточных технологий являются именно СК, которые можно разделить на 2 основных типа: эмбриональные (ЭСК) и региональные (РСК). ЭСК возникают на ранних стадиях развития зародыша и представляют собой клетки, способные дифференцироваться в любую из клеток взрослого организма, или плюрипотентные, способные дифференцироваться во все типы клеток эмбриона, внезародышевых тканей и взрослого организма. Именно эти клетки являются в ВЕСТНИК РОСЗДРАВНАДЗОРА № 6-2009 45 Пути решения проблемы безопасности применения клеточных технологий ми спинного мозга с использованием ЭСК. Объем заяворганизме истинно стволовыми. На ки, поданной в разрешительный орган, — 22 тыс. стра2—4 сутки развития зародыша (стадия ниц. Исследование началось летом 2009 г. и проводитморулы) формируются СК, которые в услося калифорнийской биотехнологической компанией виях in situ способны развиваться до стадии взрослого Geron Corporation. В клеточном продукте этой корпораорганизма [1]. ции — GRNOPC1 — используются не сами ЭСК, а выдеРСК являются наиболее зрелым типом СК, обнаружиленные из них прогенеторные олигодендроциты. Осваемых в виде редких включений во многих тканях и новная цель исследования — оценка эффективности и органах сформировавшегося плода и взрослого оргабезопасности ЭСК для здоровья человека [1, 6, 7]. низма. Происхождение РСК, а также их свойства пока Больным в течение 2-х недель после получения изучены недостаточно, поэтому представления о них не травмы спинного мозга производятся однократные всегда точны. Морфологически РСК трудно идентифиинъекции препарата СК. В исследовании принимают цировать, однако эти клетки экспрессируют некоторые участие 10 пациентов, парализованных ниже области уникальные маркеры (люминофоры), которые позволяют выявлять их в тканях [8]. РСК, как и ЭСК, относят к Рисунок числу недифференцированных клеток, которые длительное время циклично репопулируют, продолжиРанний эмбрион, сформировантельность этого периода опный при iv vitro оплодотворении ределяется сроками сохранности процессов самообновления клеток в органах и тканях. Значительные возможРанний эмбрион, сформированный путем переноса ядра ности применения клонов ЭСК для клеточной заместиСтволовая клетка тельной терапии положительно оцениваются в экономически развитых странах (США, Англии, Германии, Пуповинная кровь Японии и др.). Однако, соили эмбриональная ткань гласно инструкции Национального Института Здоровья (National Institutes of Взрослая клетка Health, NIH), в США до недавнего времени действовал запрет на государственное финансирование экспегруди. По предварительным прогнозам, подсаженные риментов по выделению СК из эмбрионов человека. клетки должны стимулировать регенерацию поврежДанный запрет был введен в 2001 г. Президентом денной нервной ткани, благодаря чему будет запуСША Д.Бушем, считавшим, что использование эмбриощен процесс восстановления чувствительности и нов человека для получения СК равносильно лишению подвижности парализованных нижних конечностей. жизни. Но, несмотря на это, работа по разработке метоТак, проводимые ранее экспериментальные исследодов получения и терапевтического использования СК вания на животных позволяют предположить, что проводилась рядом частных биотехнологических коминъекция ЭСК в область травмирования спинного паний и лабораторий, таких как Stem Cell Inc., WiCell, мозга может привести к восстановлению структуры и Geron Corporation и др. функциональности поврежденных нервных волокон. В начале марта 2009 г. Президент США Б.Обама подОдна из влиятельных организаций пациентов писал указ, снявший запрет на финансирование из (Patients Coalition for Urgent Research), играющая опрефедерального бюджета исследований ЭСК человека на деляющую роль в распределении средств на биомедитерритории США. В это же время FDA выдало официальцинские цели, провела мониторинг для уточнения коное разрешение на проведение в США первых клиничеличества пациентов в США, нуждающихся в клиничесских испытаний методики лечения пациентов с травма- 46 ВЕСТНИК РОСЗДРАВНАДЗОРА № 6-2009 Пути решения проблемы безопасности применения клеточных технологий ких технологиях, основанных на использовании СК человека. Анализ показал, что только по таким основным нозологическим группам заболеваний, как сердечнососудистые, онкологические, аутоиммунные, диабет, остеопороз, болезнь Альцгеймера и Паркинсона, повреждения позвоночника, пороки развития и др., число потенциальных пациентов приближается к 128 млн. человек. В этот список не включены больные с глубокими ожогами и ранами другой этиологии, для лечения которых также могут быть необходимы СК. На сегодняшний день есть все основания полагать, что в США поддержка фундаментальных и прикладных исследований СК человека получит статус национальной программы, и на ее реализацию будет выделено значительное бюджетное финансирование [5]. В Европе британская компания ReNeuron Group недавно получила разрешение на клинические испытания лечения инсульта методом трансплантации фетальных клеток. Предварительно специалистами компании проведена серия лабораторных экспериментов, которые показали, что фетальные клетки могут стимулировать регенерацию тканей головного мозга, поврежденных в результате инсульта. Однако препятствием к продолжению данных разработок служит запрет Европейского патентного агентства от 27.11.2008 на патентование инновационных разработок в области эмбриональных СК человека, а без патентной защиты пропадает стимул продолжать инвестирования в научные исследования компаний, занимающихся СК. Министры по охране окружающей среды ЕС в октябре 2008 г. одобрили рекомендации по развитию клеточных технологий. В рекомендациях содержатся технические детали регулирования терапии взрослыми СК и тканевой инженерии в странах ЕС. В то же время разработанные правила оставляют за каждым государством — членом ЕС право наложения запрета на исследование ЭСК человека по этическим причинам и ограничения продажи лекарственных средств, произведенных с применением клеточных технологий. По данным правилам лекарственные препараты, получаемые с помощью ЭСК, должны пройти оценку эффективности и безопасности специальным комитетом Европейского агентства по лекарственным средствам (European Medicines Agency, EMEA). Также ЕМЕА должно разработать методики для испытания качества препаратов, произведенных на основе СК человека. В России исследования в области применения клеточной и генной терапии с использованием СК до сих пор не получили должного развития. Хотя необходимо отметить, что уровень отечественных научных разработок в ряде областей использования СК для клеточной заместительной терапии соответствует уровню зарубежных достижений, о чем свидетельствуют материалы симпозиума «Биология стволовых клеток», прошедшего в ноябре 2005 г. в Институте биологии развития им. Н.К.Кольцова РАН, а также Британско-российское совещание «Стволовые клетки: законодательство, исследования и инновации. Международные перспективы сотрудничества», прошедшего в Москве в марте 2007 г. [3, 8, 9]. В нашей стране активно изучаются возможности клеточной терапии и, в частности, СК при терапии раневых повреждений и ряде других восстановительных тканевых процессов. Так, изучены возможности СК при восстановлении кроветворения после радиационных поражений; разрабатываются методики восстановления эпителиальной и соединительной тканей человека; начаты исследования способности ЭСК и клеток-предшественников к дифференцировке в различные типы соматических клеток. Были достигнуты определенные успехи в применении СК крови, печени, поджелудочной железы, нервной системы. Более 20 лет назад в нашей стране в клиническую практику вошла трансплантация гемопоэтических СК костного мозга. Сегодня благодаря этому методу многие злокачественные заболевания крови стали принципиально излечимыми. В последнее время гемопоэтические СК стали применять и для лечения других, негематологических нозологий, связанных, как правило, с патологиями иммунной системы и онкологией. В ортопедической практике стромальные СК костного мозга стали применяться для восстановления больших костных дефектов после переломов и разрушения суставных тканей. Существует значительный потенциал использования СК в кардиохирургической клинике: в Российском кардиологическом научно-производственном комплексе Росздрава и НИИ кардиологии ТНЦ СО РАМН накоплен большой опыт использования СК в лечении хронической сердечной недостаточности и ишемической кардиомиопатии. Нейтральные СК эмбрионов человека применяются при терапии нейродегенеративных заболеваний — болезнь Паркинсона, болезнь Гентингтона и др. Однако подобные исследования в клинической практике сдерживают нерешенные этические вопросы, связанные с источником получения СК — человеческим эмбрионом [1, 4]. В ряде научно-исследовательских центров России получены культуры СК млекопитающих и человека, ведутся исследования по изучению возможности трансформации этих клеток в различные тканевые цитофенотипы, включая миобласты, кардиомиоциты, нервные и глиальные клетки под действием как традиционно используемых, так и новых, предложенных отечественными исследователями индукторов направленной дифференцировки СК. Однако на сегодняшний день в России не проводится ни одного официально разреВЕСТНИК РОСЗДРАВНАДЗОРА № 6-2009 47 Пути решения проблемы безопасности применения клеточных технологий шенного Росздравнадзором клинического испытания в области клеточных технологий и ЭСК. Клеточная терапия — относительно молодая отрасль биологии и медицины, история которой насчитывает чуть более века. Такой короткой истории недостаточно для полноценной апробации, а следовательно, и нормативного, и законодательного оформления данных исследований и клинической практики. В мире действует ряд законов, ограничивающих работу с ЭСК человека. Несмотря на это, в ряде стран гемопоэтические СК, полученные из пуповинной крови новорожденных, костного мозга и периферической крови взрослого человека, уже прошли клинические испытания и успешно применяются в клинике. Все большую популярность приобретают СК взрослого организма — мезенхимальные СК, которые проходят 3-ю стадию клинических исследований в США, Великобритании и Корее. В Швейцарии и Германии закон позволяет проведение научных исследований с импортированными линиями ЭСК, а также с ЭСК животных и тканей взрослого человека. Но клонирование человека в перечисленных выше странах запрещено. Эксперименты с ЭСК и создание банков этих клеток, создание и клонирование предимплантационных зародышей (до 14-го дня развития) для изолирования линий эмбриональных СК разрешены в Великобритании, Бельгии и Швеции. В странах ЕС в настоящее время формируется нормативно-правовая база в области исследований, разработки и применения инновационных биомедицинских клеточных продуктов и технологий на уровне законов. При этом в странах ЕС планируется введение единой разрешительной системы в сфере обращения инновационных биомедицинских клеточных продуктов и технологий. В Российской Федерации большинство организаций, предлагающих различные услуги по терапии с использованием СК, не имеют лицензий на технологию с использованием стволовых клеток, а тем более на оказание платных услуг населению с применением этих технологий. Вся деятельность в косметологии и других областях медицины нелегальна и незаконна, однако СК сомнительного происхождения широко применяются в медицинской практике. Легальная коммерческая деятельность сегодня разрешена только в области «банкирования» стволовых клеток, лицензию на этот вид деятельности на сегодняшний день имеет целый ряд компаний. Однако в связи с высокой стоимостью подобных услуг в отсутствии законодательной и нормативной базы достаточно быстро развивается теневой (контрафактный) сегмент на рынке клеточных технологий. Сложившаяся ситуация может дискредитировать метод, который потенциально можно исполь- 48 ВЕСТНИК РОСЗДРАВНАДЗОРА № 6-2009 зовать для заместительной терапии при поражениях клеток жизненно важных органов. При этом запретительные меры могут еще значительнее поднять стоимость таких услуг и усугубят уже существующий теневой бизнес. В то же время бесконтрольное применение терапии СК может привести к негативным последствиям, в первую очередь, в связи с неизученностью долгосрочного отложенного эффекта. В соответствии с современной терминологией клеточная терапия — это лечение и (или) профилактика болезней человека путем трансплантации живых клеток, которые были отобраны, размножены и фармакологически обработаны (или изменены) вне организма реципиента. Чаще всего применяются СК, но их использование не является обязательным условием. Например, при лечении диабета практикуется пересадка специализированных β-клеток, выделяющих инсулин; есть первые опыты пересадки гепатоцитов (клеток печени). Однако юридически такого понятия, как «клеточная терапия», в России пока не существует [2, 5, 6]. В 2002 г. в Российской Федерации принят Закон «О временном запрете на клонирование человека» (№54ФЗ от 20 мая 2002 г.), предполагающий временный (5летний) мораторий на клонирование человека. Законодательные ограничения на работы с ЭСК с целью эксперимента у нас отсутствуют. Поскольку периодический статус предимплантационных зародышей не определен, законодательство о правах человека не распространяется на внутриутробное развитие, а права зародышей могут быть защищены только средствами биоэтики. Т.е. ситуация аналогична сложившейся в Великобритании, Бельгии и Швеции. Действующее законодательство РФ содержит положения по стандартизации методов получения и очистки гемопоэтических СК, предварительной подготовке донора, перечень необходимых клинических и общих анализов, а также правильной подготовке реципиента к трансплантации данных клеток [6]. Однако целостное нормативное регулирование в области применения клеточных технологий в России отсутствует. Проблема сложна и неоднозначна и требует комплексного решения в виде подготовки как отдельного закона, так и поправок к уже действующим законодательным актам с учетом этических и религиозных особенностей в нашей стране. Законодательство РФ в области исследования и использования стволовых клеток развивается спонтанно, не сформировано в виде единой системы и не подчинено общим принципам, а интуитивно исходит из концепции наименьшего вреда. Обычно к клеточным технологиям применяют ряд общих требований и положений действующей законодательной базы. Они, к сожалению, не охватывают всех направлений работы со СК, например, таких как получение (забор), обработка, контроль качества, хранение, транспортировка человечес- Пути решения проблемы безопасности применения клеточных технологий ких тканей и клеток, особенности их доклинических и клинических исследований, требования к разрешению на их применение в медицинской практике [1, 3]. Так, на территории РФ деятельность, связанную со СК, регламентируют следующие документы: Закон РФ №5142-1 «О донорстве крови и ее компонентов», Основы законодательства Российской Федерации №5487-1 «Об охране здоровья граждан», Федеральный закон №86-ФЗ «О лекарственных средствах», Федеральный закон №279-ФЗ «О внесении изменений в Закон РФ «О трансплантации органов и (или) тканей человека», Приказ Минздрава РФ №345 «О создании экспертного совета по рассмотрению научных исследований в области развития клеточных технологий и внедрению их в практическое здравоохранение», Указание Минздрава РФ №387-У «О признании утратившими силу документов о клеточных препаратах», Временная инструкция Экспертного совета Минздрава России о порядке исследований в области клеточных технологий и их использования в учреждениях здравоохранения, Отраслевая Программа Президиума РАМН «Новые клеточные технологии — медицине», Приказ Минздрава России №67 «О применении вспомогательных репродуктивных технологий (ВРТ) в терапии женского и мужского бесплодия», Приказ Минздрава России №325 «О развитии клеточных технологий в Российской Федерации», Приказ Министерства здравоохранения и социального развития РФ №488 «Об утверждении административного регламента Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по выдаче разрешений на применение новых медицинских технологий». Приведенный выше перечень документов свидетельствует о пробелах в регулировании и различиях в нормативных требованиях российского законодательства к научным исследованиям и применению стволовых клеток в медицинской практике по сравнению с западноевропейскими нормами. Это может привести, с одной стороны, к исключению российских разработок из мирового научного процесса в области развития клеточных технологий, а с другой — к превращению нашей страны в потребителя биомедицинских клеточных продуктов и технологий, не соответствующих требованиям надлежащего качества и потенциально опасных для здоровья человека. Основной задачей на сегодняшний день является формирование единой классификации продуктов и методов, связанных с использованием клеточных технологий. С учетом глобализации, охватывающей все сферы человеческих отношений, и, одновременно, различий в законодательстве государств необходимо четкое регулирование в отношении перемещения из одной страны в другую объектов клеточных технологий. Необходимо разрабатывать методы стандартизации и экспертизы качества медицинских клеточных технологий с целью обеспечения безопасности их клинического применения. Требуется создание глобальных информационных баз индукции стволовых клеток и их дифференцировки in vitro. На уровне законодательных органов необходимо: внесение изменений и дополнений в существующую законодательную базу; разработка узкоспециализированного законопроекта, нормирующего все разделы работы с клеточными технологиями (стволовыми клетками); формирование единой системы научных и технических терминов, закрепленных юридически в соответствующих законах или подзаконных нормативно-правовых актах. ИСТОЧНИКИ 1. Бунятян Н.Д., Яворский А.Н., Ряженов В.В. и соавт. Стволовые клетки: проблемы контроля, безопасности, разработки и применения. // журнал Врач. — 2009. — № 6. — с. 2—5. 2. Деев Р.В. Научное наследие Александра Максимова и современность // Клеточная трансплантология и тканевая инженерия — 2005; 1 (1): с. 4–8. 3. Тезисы докладов Британско-российского совещания в сотрудничестве с Европейской Комиссией «Стволовые клетки: законодательство, исследования и инновации. Международные перспективы сотрудничества». /Посольство Великобритании, М., 2007. — 273 С. 4. Шевченко Ю.Л. Медико-биологические и физиологические основы клеточных технологий в сердечно-сосудистой хирургии. — СПб.: Наука, 2006. 287 с. 5. Josephson R. Molecular cytogenetics: making it safe for human embryonic stem cells to enter the clinic. // Expert. Rev. Mol. Diagn. — 2007; 7 (4): р. 395–406. 6. Uezumi A., Ojima K., Fukada S. Functional heterogeneity of side population cells in skeletal muscle. // Biochem. Biophys. Res. Commun. — 2006; 341: р. 864–73. 7. Style guides and resources [Electronic resource]. // Celltranspl.ru: [official web-site] www.celltranspl.ru/static/pdf/issue6/ 9—12.pdf > 8. Style guides and resources [Electronic resource]. // Kardio.ru: [official web-site] http://www.kardio.ru/profi_1/pr/stvb.htm. 9. Style guides and resources [Electronic resource]. // celltranspl.ru [official web-site] http://www.celltranspl.ru/news/news1014. ВЕСТНИК РОСЗДРАВНАДЗОРА № 6-2009 49