Современные тенденции лечения повреждений периферических нервов
advertisement

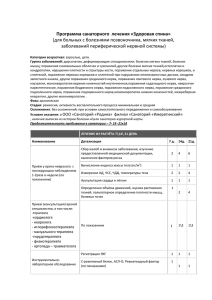
ПРАКТИЧЕСКАЯ МЕДИЦИНА ‘1-2 (69) сентябрь 2013 г. / том 2 99 УДК 616.833-001-08 Современные тенденции лечения повреждений периферических нервов Р.Ф. МАСГУТОВ, А.А. РИЗВАНОВ, А.А. БОГОВ (мл.), А.Р. ГАЛЛЯМОВ, А.П. КИЯСОВ, А.А. БОГОВ Республиканская клиническая больница МЗ РТ, г. Казань Казанский (Приволжский) федеральный университет Масгутов Руслан Фаридович старший научный сотрудник Травматологического центра 420064, г. Казань, ул. Оренбургский Тракт, д. 138 тел. 8-950-314-02-93, е-mail: masgut@gmail.com В обзоре освещены современные методы терапии травмы периферических нервов в сочетании с классическими хирургическими способами лечения данной патологии. Представлены потенциальные стимуляторы посттравматической регенерации периферических нервов, ключевыми из которых являются сосудистый эндотелиальный фактор роста и основной фактор роста фибробластов, играющих роль узловых молекул в патофизиологии нейрорегенерации. Ключевые слова: травма периферического нерва, нейротрофические факторы. Current trends for treatment of peripheral nerves injuries R.F. MASGUTOV, A.A. RIZVANOV, A.A. BOGOV (jr.), A.R. GALLYAMOV, A.P. KIYASOV, A.A. BOGOV Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan Kazan (Volga region) Federal University The review describes current treatment methods of peripheral nerve injuries in combination with classical surgical treatments of this pathology. Are presented potential stimulators of posttraumatic regeneration of peripheral nerves, where the key stimulators are vascular endothelial growth factor and basic fibroblast growth factor, which are basic molecules in the pathophysiology of neuroregeneration. Key words: peripheral nerve injury, neurotrophic factors. Повреждения периферических нервов остаются одной из актуальных проблем современной травматологии и составляют 3-10% от всех травм опорнодвигательного аппарата [1]. Между тем травмы и заболевания периферической нервной системы приводят к стойкой утрате трудоспособности у 60-63% пациентов, более того, почти 80% этой группы составляют лица молодого трудоспособного возраста [2]. Повреждения периферических нервов оказывают существенное влияние на качество жизни в связи с потерей функции и повышения риска развития вторичной инвалидности от падений, переломов и других травм. В представленном обзоре литературе дан анализ исследований последних лет, которые открывают новую страницу в понимании патофизиологии посттравматической регенерации периферического нерва и направляют как специалистов фундаментальных направлений, так и практикующих врачей на изучение и возможности клинического применения ростовых факторов, которые непосредственно принимают участие в восстановлении периферического нерва после его травмы. Патогенез травмы периферического нерва При повреждении нерва основным звеном патогенеза является деструкция нейронов. Нейроны, формирующиеся в процессе развития, соединены в сложные коммуникационные сети для передачи информации от периферических рецепторов сенсорных нейронов в ЦНС (головного и спинного мозга), а также для передачи команд из центральной нервной системы на эффекторные органы, такие как скелетные мышцы, иннервируемые мотонейронами. Периферический нерв состоит из аксона нейрона, шванновских клеток, фибробластов, а также элементов кровоснабжения нерва. Соединительная ткань известная как эндоневрий окружает периферические аксоны. В периферических нервах аксоны сгруппированы в фасцикулы, окруженные соединительной тканью. Ключевой клеткой для периферических нервов является шванновская клетка. Шванновские клетки образуют осевые цилиндры, их мембрана богата липидами, которые покрывают аксон и называется миелиновой оболочкой. Шванновские клетки с миелиновой оболочкой аксонов поддерживают и направляют аксоны актуальные проблемы медицины том 2 100 ПРАКТИЧЕСКАЯ МЕДИЦИНА ‘1-2 (69) сентябрь 2013 г. / том 2 Таблица 1. Влияние нейротрофических факторов на выживание чувствительных нейронов в постнатальном периоде Нейротрофический фактор Наличие (+) или отсутствие (–) эффекта Авторы NGF + – Horie, Akahori, 1994; Lindsay, 1996 BDNF – + Lindsay, 1996; Acheson et al., 1995 NT-3 + Acheson et al., 1995 GDNF + Leclere et al., 1997 во время регенерации нерва после его травмы. Тело нервной клетки является местом синтеза практически всех белков и органелл в клетке. Сложный процесс, известный как антероградный транспорт, непрерывно транспортирует вещества из тела клетки нейрона через аксон к его периферическому концу — в синапс. Эти транспортируемые вещества включают нейротрансмиттеры, которые обеспечивают связь между нейроном и тканями органа по узкой синаптической щели или, как в случае иннервации двигательных нейронов мышц, нервно-мышечном синапсе. С другой стороны, клетки-мишени, например, миоциты, экспрессируют вещества, которые действуют как нейротрофические факторы. Некоторые из этих веществ упаковываются и передаются путем ретроградного транспорта от синапса через аксон к телу нейрона. Таким образом, нейрон и его клетка-мишень постоянно информированы о статусе связи между ними. Было высказано предположение, что информация от клеток-мишеней принимает форму факторов, которые поддерживают существующие соединения нейронов и способствуют регенерации поврежденных нервных клеток. Несмотря на регенерацию, обширные травмы периферического нерва могут привести к параличам всей конечности или дистальных отделов конечностей. Прогноз восстановления при травмах периферических нервов лучше там, где повреждение шванновских клеток минимально [3]. Нейротрофические факторы в механизме регенерации периферического нерва За полвека исследований выявлено, что нейротрофические факторы способствуют выживанию и процессу роста нейронов. Восстановление нейрона критически зависит от количества нейротрофического фактора. После травмы нервов, периферическая нервная система млекопитающих реагирует путем экспрессии нейротрофических факторов, которые доступны из аутокринных или паракринных источников. Известны три основные группы нейротрофических факторов: 1) нейротрофины; 2) нейротрофические факторы семейства GDNF (англ. Glial cell line-derived neurotrophic factor) и 3) нейротрофические цитокины [4]. Повреждение периферического нерва вызывает ретроградную дегенерацию спинальных ганглиев, что сказывается преимущественно на кожных нейронах малого диаметра. Результаты исследований показывают, что кожные нейроны более чувствительны к повреждениям периферического нерва, чем мышечные, но их регенеративные способности не отличаются друг от друга [5]. Выживаемость нейронов после аксотомии является необходимым условием для регенерации, которой способствуют множество трофических факторов из нескольких источников, в том числе нейротрофины, ней- ропоэтические цитокины, инсулиноподобный фактор роста (англ. Insulin Growth Factor, IGF), факторы из глиальных клеток — семейства GDNF и др. Так, после перерезки нерва увеличивается количество нейронов, экспрессирующих м-РНК мозгового нейротрофического фактора (англ. Brain Derived Neurotrophic Factor [6]. Выработка м-РНК BDNF в ответ на травму нерва показана не только в нейронах, но и в клетках-сателлитах [7]. После лигирования спинномозговых нервов уровень м-РНК фактора роста нервов (англ. Nerve Growth Factor, NGF) в спинальных ганглиях возрастает в 4 раза и поддерживается в течение 3 недель [8]. При этом подъем уровня м-РНК BDNF длится не более трех суток и менее выражен по сравнению с NGF. Трансформирующий фактор роста β (TGFβ) служит митогеном для шванновских клеток и нейротрофическим фактором для некоторых дифференцирующихся нейронов. В интактных спинальных ганглиях TGFβ и его рецептор экспрессируются преимущественно в малых нейронах и в клетках-сателлитах, окружающих средние и большие нейроны [7]. После повреждения седалищного нерва крысы в эксперименте в клетках-сателлитах увеличивается экспрессия TGFβ, что сопровождается возрастанием уровня экспрессии его рецепторов практически во всех субпопуляциях нейронов [7]. In vitro GDNF стимулирует рост аксонов чувствительных нейронов, преимущественно малых, не экспрессирующих рецепторы нейротрофинов и выявляемых при помощи изолектин-B4 [9]. Эти авторы установили, что в той же культуре GDNF поддерживает выживание чувствительных нейронов, но не выявили их принадлежности к конкретным субпопуляциям (табл. 1). Установлено, что часть нейронов, экспрессирующих trkA и реагирующих, таким образом, на NGF, в конце эмбрионального и в постнатальном периоде перепрограммируется на действие другого нейротрофического фактора, а именно GDNF. В нейронах этой субпопуляции начинают экспрессироваться оба компонента рецептора GDNF — GFRa и тирозинкиназа c-ret [10]. Происходит ли подобное перепрограммирование при регенерации чувствительных нейронов, остается неясным. Регенераторный рост центральных отростков нейронов различного фенотипа поддерживают конкретные нейротрофические факторы. Так, рост аксонов, экспрессирующих NF200 и принадлежащих субпопуляции больших проприоцептивных нейронов, стимулирует только один представитель семейства нейротрофинов — нейротрофин-3 (NT-3) [11] (табл. 2). Из тех же нейротрофинов только NGF поддерживает рост аксонов пептидергических ноцицептивных нейронов. И только один нейротрофический фактор является универсальным стимулятором роста аксонов больших, малых пептидергических и малых непептидергических нейронов. Этим фактором является GDNF [11]. актуальные проблемы медицины том 2 ПРАКТИЧЕСКАЯ МЕДИЦИНА ‘1-2 (69) сентябрь 2013 г. / том 2 101 Таблица 2. Экспрессия нейротрофинов и их рецепторов нейронами спинальных ганглиев (по результатам экспериментов на нокаутных мышах, [12] Нейротрофин/ Рецептор Численность популяции нейронов в% Модальность NGF 80 Ноцицепторы, терморецепторы, низкопороговые механорецепторы trkA 80 Ноцицепторы, терморецепторы, низкопороговые механорецепторы trkB 30 Механорецепторы (Майсснера) NT-3 60 Проприорецепторы, рецепторы волос и механорецепторы trkC 20-30 Проприорецепторы После перерезки седалищного нерва усиливается экспрессия рецептора GDNF, но количество нейронов, реагирующих на этот нейротрофический фактор, не изменяется [13]. При этом объем популяции нейронов, содержащих trkA и отвечающих на действие NGF, после перерезки нерва уменьшается. Эти данные указывают на различный характер регуляции активности генов рецепторов нейротрофических факторов в субпопуляциях нейронов спинальных ганглиев в ответ на аксотомию. Для судьбы отдельных нейронов важно присутствие нейротрофических факторов, которые способны активировать антиапоптозные внутриклеточные пути [14]. В списке факторов, влияющих на регенерацию нервных волокон, важное место занимают цитокины. Имеются данные о нейропротекторном действии интерлейкина1b в отношении нейронов коры, которое может реализоваться через влияние этого цитокина на выработку нейротрофических факторов, например, NGF [15]. С другой стороны, in vitro показано, что интерлейкин-1b не влияет на выживание нейронов спинальных ганглиев, но ускоряет рост их отростков [16] и вместе с оксидом азота поддерживает в пептидергических нейронах экспрессию циклооксигеназы-2, что усиливает секрецию вещества «Р» [17]. Высказано предположение, что данный цитокин стимулирует секрецию нейротрофических факторов ненервными (шванновскими) клетками [16], расположенными в потенциальном пространстве роста аксонов. Представление об активации интерлейкином-1b регенерации нервных проводников основано на данных о стимулирующем влиянии продуцируемого макрофагами интерлейкина-1 на образование NGF шванновскими клетками in vitro и in vivo. Шванновские клетки in vitro и в регенерирующем нерве сами синтезируют интерлейкины и экспрессируют их рецепторы, что свидетельствует о возможной аутокринной регуляции. Нейроны также способны синтезировать цитокины. У интактных крыс до 80% нейронов спинального ганглия экспрессируют интерлейкин-1b [18]. Это преимущественно большие и средние нейроны. Данный цитокин экспрессируется в незначительной части малых пептидергических нейронов. Присутствие рецепторов интерлейкина-1 выявлено в большинстве нейронов спинального ганглия, а также в окружающих нейроны клетках-сателлитах [18], что свидетельствует об участии интерлейкина-1b в ауто/паракринной регуляции функции чувствительных нейронов. Травмированные нейроны должны перейти от режима передачи к режиму роста и начать продуцировать белки, такие как, например, GAP-43 (англ. Growth Associated Protein), тубулин и актин, а также другие нейропептиды и цитокины, которые имеют потенциал для стимуляции аксональной регенерации. Аксоны должны достигать дистального отрезка нерва при условии, когда поддержка их роста осуществляется в достаточной степени. Шванновские клетки в дистальном отрезке нерва проходят через фенотипические изменения, которые должны быть благоприятны для аксональной регенерации. Шванновские клетки играют незаменимую роль в содействии регенерации за счет увеличения ими синтеза поверхностных молекул клеточной адгезии, таких как N-CAM (англ. Neural Cell Adhesion Molecule), Ng-CAM/L1 (англ. Neuron Glia Cell Adhesion Molecule), N-кадгерин и L2/HNK-1, путем изменения базальной мембраны, которая содержит многие белки внеклеточного матрикса, таких как ламинин, фибронектин и тенасцин. Аксональной регенерации могут способствовать факторы, которые повышают потенциал роста аксонов нейронов и оптимизируют регенерацию дистального конца нерва в сочетании с его оперативным лечением [19]. Основные методы лечения повреждения нервов являются: нейрорафия, нейрорафия с последующей дистракцией нерва, аутонервная пластика, эндопротезирование биодеградирующими материалами (например: neuragen® nerve guide). Перспективными потенциальными стимуляторами регенерации периферических нервов являются сосудистый эндотелиальный фактор роста (англ. Vascular Endothelial Growth Factor, VEGF), основной фактор роста фибробластов (англ. basic Fibroblast Growth Factor, bFGF или FGF2) и NGF. Эффект NGF иллюстрирует исследование по трансплантации в поврежденный седалищный нерв крысы микрокапсул, содержащих NGF в чистом виде. В группе с NGF количество восстановленных аксонов было большим, расположение нервных волокон было более упорядоченным, проводимость нерва восстанавливалась в разы быстрее, чем в контрольной группе. Также в сравнении с контрольной группой животных было отмечено, что в послеоперационном периоде раны заживали значительно быстрее [20]. Основной фактор роста фибробластов считается мощным средством для улучшения восстановления после повреждения нейронов, однако экзогенно применяемый bFGF неэффективен из-за кратковременного эффекта. Для усиления эффекта в естественных условиях разработана новая система доставки потенциальных стимуляторов путем внедрения bFGF в желатин гидрогель, который медленно биодеградирует. В этом исследовании эффекты bFGF-гидрогеля при актуальные проблемы медицины том 2 102 ПРАКТИЧЕСКАЯ МЕДИЦИНА Рисунок 1. Плазмида, содержащая сосудистый эндотелиальный фактор роста (VEGF) и основной фактор роста фибробластов (FGF2) Масгутов Р.Ф. и др. Клеточная трансплантология и тканевая инженерия, 2011 травматическом повреждении лицевого нерва были исследованы на морских свинках. Лицевой нерв был обнажен и зажат в вертикальной части с использованием микрощипцов. Животные были подвергнуты одной из следующих трех процедур: группа А — контроль, без введения bFGF; группа В, одноразовое введение bFGF в нерв; группа С, применение bFGF-гидрогеля. Шесть недель спустя функции лицевого нерва были оценены тремя тестами: наблюдения за мимикой, электрофизиологические тестирования и гистологические исследования. Результаты показали, что одноразовое применение bFGF не влияло посттравматическое восстановление нерва. В группе с применением гидрогеля достигнуты лучшие результаты во всех тестах [21]. Местное применение VEGF индуцирует, по крайней мере, два события: пролиферацию шванновских клеток и образование новых сосудов, которые играют важную роль в процессе регенерации нервов. Однако результаты показывают, что эффект от предварительной обработки факторами роста является локальным и ограниченным и не влияет на синтез нейропептидов [22]. Преодоление диастаза периферического с помощью биодеградирующией трубки из политетрафторэтилена (ПТФЭ) является относительно новым, но хорошо зарекомендовавшим хирургическим подходом для восстановления дефектов нервных стволов до 4 см между его концами на разных уровнях верхней конечности [23]. ЛИТЕРАТУРА 1. Берснев В.П. Хирургия позвоночника, спинного мозга и периферических нервов / Е.А. Давыдов, Е.Н. Кондаков // Специальная литература. — СПб, 1998. — С. 368. 2. Кубицкий А.А. Хирургическое лечение повреждений периферических нервов верхней конечности методами тракционного удлинения и аутонервной пластики: автореф. дис. … канд. мед. наук / А.А. Кубицкий. — Казань, 2002. — 24 с. 3. Massing M.W., Robinson G.A., Marx C.E., Alzate O., Madison R.D. Frontiers in Neuroscience. Alzate O., editor // Source Neuroproteomics. — Boca Raton (FL): CRC Press; 2010. — Chapter 15. 4. Boyd J.G., Gordon T. Neurotrophic factors and their receptors in axonal regeneration and functional recovery after peripheral nerve injury // Mol Neu- ‘1-2 (69) сентябрь 2013 г. / том 2 Восстановление периферического нерва с помощью трубки из ПТФЭ и введением факторов роста фибробластов также подтверждается в другом исследовании. В данном исследовании bFGF был помещен в эндопротез для седалищного нерва крысы. Кроме того, в послеоперационном периоде, животные системно получали 1 мг/кг/сут FK506 (такролимус) — мощный иммунодепрессант с нейротрофическими свойствами. Регенерация нерва оценивалась с помощью стандартных двигательных (индекс седалищного нерва) тестов и тестов на чувствительность, начиная со 2-й недели после операции. Животные, которые получали bFGF и FK506, показали значительно более быстрое восстановление после травмы, чем у контрольной группы [24]. После повреждения периферического нерва Шванновские клетки начинают экспрессировать bFGF, что нехарактерно для интактного нерва. Данный фактор рассматривается в качестве узловой молекулы в патофизиологии травмы периферических нервов [25]. В исследовании по восстановлению лицевого нерва после его перерезки и дальнейшего сшивания на крысах было показано, что у животных с введением bFGF восстановление нерва произошло раньше, а количество миелинизированных волокон было большим, чем у животных без введения bFGF [26]. Кроме того, на модели преодоления диастаза седалищного нерва крысы при помощи аутонервной вставки показано, что введение мультицистронной плазмиды pBUD-VEGF-FGF2 (Рис 1), экспрессирующей клонированные гены VEGF и bFGF человека, в центральный и периферический отрезки нерва, а также непосредственно в аутонервную вставку стимулирует реваскуляризацию и регенерацию периферического нерва. В эксперименте с аутонервной вставкой введение pBUD-VEGF-FGF2 в область повреждения нерва приводит к двукратному увеличению количества S100-иммунопозитивных (шванновских) клеток в прилежащих к диастазу участке периферического отрезка нерва [27, 28]. Заключение Таким образом, сочетание классических хирургических способов восстановления нервных стволов и методов прямой терапии ростовыми факторами ускоряет аксональный рост, стимулирует реваскуляризацию нерва, что подтверждается многочисленными экспериментальными исследованиями и, в итоге, улучшает результаты посттравматического восстановления функции реиннервации поврежденного органа или ткани. Благодарность Выполнение данного научного исследования финансируется за счет темы государственного автономного учреждения здравоохранения «Республиканская клиническая больница Министерства здравоохранения Республики Татарстан» «Усовершенствование и разработка новых методов лечения у больных с повреждением плечевого сплетения и периферических нервов». robiol. — 2003 Jun. — Vol. 27, № 3. — Р. 277-324. 5. Welin D., Novikova L.N., Wiberg M., Kellerth J.O., Novikov L.N. Survival and regeneration of cutaneous and muscular afferent neurons after peripheral nerve injury in adult rats // Exp Brain Res. — 2008 Mar. — Vol. 186, № 2. — Р. 315-23. 6. Zhou X.F. et al. Injured primary sensory neurons switch phenotype for brain-derived neurotrophic factor in the rat // Neuroscience. — 1999. — Vol. 92, № 3. — P. 841‑853. 7. Zhou X.F. et al. Satellite-cell-derived nerve growth factor and neurotrophin-3 are involved in noradrenergic sprouting in the dorsal root ganglia following peripheral nerve injury in the rat // Eur. J. Neurosci. — 1999. — Vol. 11, № 5. — P. 1711‑1722. 8. Shen H., Chung J., Chung K. Expression of neurotrophin mRNAs in актуальные проблемы медицины том 2 ПРАКТИЧЕСКАЯ МЕДИЦИНА ‘1-2 (69) сентябрь 2013 г. / том 2 the dorsal root ganglion after spinal nerve injury // Brain Res. Mol. — 1999. — Vol. 64. — P. 186‑192. 9. Leclere P. et al. Effects of glial cell line-derived neurotrophic factor on axonal growth and apoptosis in adult mammalian sensory neurons in vitro. Neuroscience. — 1997. — Vol. 5. — P. 545‑558. 10. Molliver D.C. et al. IB4 binding DRG neurons switch from NGF to GDNF dependence in early postnatal life // Neuron. — 1997. — Vol. 19, № 4. — P. 4849‑4861. 11. Ramer M., Priestley J., McMahon S. Functional regeneration of sensory axons into adult spinal cord // Nature. — 2000. — Vol. 403. — P. 312‑316. 12. Farinas I., Cano-Jaimeza M., Bellmunta E., Soriano M. Regulation of neurogenesis by neurotrophins in developing spinal sensory ganglia // Brain Research Bulletin. — 2002. — Vol. 57, № 6. — P. 809‑816. 13. Kashiba H., Hyon B., Senba E. Glial cell line-derived neurotrophic factor and nerve growth factor receptor mRNAs are expressed in distinct subgroups of dorsal root ganglion neurons and are differentially regulated by peripheral axotomy in the rat // Neuroscience Letters. — 1998. — Vol. 4. — P. 107‑110. 14. Mattson M.P., Lindvall O. Neurotrophic factor and cytokine signaling in the aging brain // Greenwich. JAI Press. — 1997. — P. 299‑345. 15. Strijbos P., Rothwell N. Interleukin-1 beta attenuates excitatory amino acid-induced neurodegeneration in vitro: Involvement of nerve growth factor // J. Neurosci. — 1995. — Vol. 15, № 5. — P. 3468‑3474. 16. Horie H., Sakai I., Akahori Y., Kadoya T. IL-1 beta enhances neurite regeneration from transected-nerve terminals of adult rat DRG // Neuroreport. — 1997. — Vol. 8, № 8. — P. 1955-1959. 17. Morioka N. et al. Nitric oxide synergistically potentiates interleukin-1 beta-induced increase of cyclooxygenase-2 mRNA levels, resulting in the facilitation of substance P release from primary afferent neurons: involvement of cGMP-independent mechanisms // Neuropharmacology. — 2002. — Vol. 43, № 5‑10. — P. 868‑876. 18. Copray J.C. et al. Expression of interleukin-1 beta in rat dorsal root ganglia // Neuroimmunology. — 2001. — Vol. 118, № 8. — P. 203‑211. 19. Fu S.Y., Gordon T. The cellular and molecular basis of peripheral 103 nerve regeneration // Mol Neurobiol. — 1997. — Vol. 1-2. — P. 67-116. 20. Song M., Chen S.Z., Han H., Xiong Y. An experimental study on repair of peripheral nerve injury by transplantation of microcapsulated NGFexpressing NIH 3T3 cells // Zhonghua Zheng Xing Wai Ke Za Zhi. — 2005. — Vol. 1. — Р. 53-7. 21. Komobuchi H., Hato N., Teraoka M., Wakisaka H., Takahashi H., Gyo K., Tabata Y., Yamamoto M. Basic fibroblast growth factor combined with biodegradable hydrogel promotes healing of facial nerve after compression injury: an experimental study // Acta Otolaryngol. — 2010. — Vol. 130, № 1. — Р. 173-8. 22. Sondell M., Lundborg G., Kanje M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularization of acellular nerve grafts // Brain Res. — 1999 Nov 6. — Vol. 846, № 2. — Р. 219-28. 23. Stanec S., Stanec Z. Reconstruction of upper-extremity peripheralnerve injuries with ePTFE conduits // J Reconstr Microsurg. — 1998 May. — Vol. 14, № 4):227-32. 24. Lanzetta M., Gal A., Wright B., Owen E. Effect of FK506 and basic fibroblast growth factor on nerve regeneration using a polytetrafluoroethylene chamber for nerve repair // Int Surg. 2003. — Vol. 88, № 1. — Р. 47-51. 25. Borin A., Cruz O.L., Ho P.L., Testa J.R., Fukuda Y. The action of topical basic fibroblast growth factor in facial nerve regeneration // Otol Neurotol. — 2010 Apr. — Vol. 31, № 3. — Р. 498-505. 26. Toledo R.N., Borin A., Cruz O.L., Ho P.L., Testa J.R., Fukuda Y. The action of topical basic fibroblast growth factor in facial nerve regeneration // Otol Neurotol. 2010. — Vol. 31, № 3. — Р. 498-505. 27. Масгутов Р.Ф., Салафутдинов И.И., Богов А.А. (мл.), Трофимова А.А., Ханнанова И.Г., Муллин Р.И., Исламов Р.Р., Челышев Ю.А., Богов А.А., Ризванов А.А. Стимуляция посттравматической регенерации седалищного нерва крысы с помощью плазмиды, экспрессирующей сосудистый эндотелиальный фактор роста фибробластов. Клеточная трансплантология и тканевая регенерация. — 2011. — Т. VI, № 3. 28. Челышев Ю.А., Мухамедшина Я.О., Шаймарданова Г.Ф., Николаев С.И. Прямая доставка терапевтических генов для стимулирования посттравматической нейрорегенерации // Неврологический вестник. — 2012. — T. XLIV, вып. 1. — С. 76-83. актуальные проблемы медицины том 2