Типы кристаллических решеток» 8 класс
advertisement

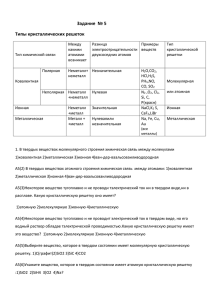
Конспект урока по химии в 8 классе. Тема урока: «Кристаллические решетки». Методическая разработка модульного урока по химии в 8 классе с использованием ИКТ учителя химии ГБОУ Гимназии № 2072 Асановой Натальи Алексеевны Цель урока: познакомить учащихся с понятием «кристаллическая решетка», изучить типы кристаллических решеток и показать зависимость физических свойств веществ от типа кристаллической решетки. Оборудование и реактивы: компьютер, ЖК - телевизор с функциями монитора, магнитофон, модели кристаллических решеток, на столах учащихся – кварц, сера, флюорит, стеклянная колба, фарфоровая чашка, спиртовка, бензойная кислота. Ход урока. 1. Организационный момент. 2. Итоги контрольной работы по теме «Классы неорганических веществ» 3. Эпиграф к уроку: «Познать сущее нельзя извне, можно только изнутри» (Н.Бердяев) Звучит музыка. 4. Мотивация. Как разнообразен мир музыки, так разнообразен и мир веществ. Рано или поздно каждый человек задает себе вопросы: «Почему воздух всегда – зимой и летом – газообразный?», «Почему в чайнике вода закипает и превращается в пар, а железо при тех же условиях остается твердым?», «Почему газы летают в пространстве, а жидкости текут и льются?» 5. Ознакомление с целью урока. 6. Организация целевого пространства. А) Какие агрегатные состояния веществ вы знаете? Какое вещество на Земле находится сразу в трех агрегатных состояниях? Вспомните физику и обсудите, от чего зависит агрегатное состояние воды? Б) Обсуждение в группах. Учащиеся вспоминают, что агрегатное состояние веществ зависит от их химической природы. Так, при комнатной температуре все металлы (кроме ртути) твердые, а среди неметаллов половина – газы. Вещества температурой кипения ниже окружающей температуры находятся в газообразном состоянии. Вывод. Агрегатное состояние воды (и других веществ) зависит от температуры, при которой находится вещество. Агрегатное состояние веществ зависит также от характера его частиц (атомов, молекул или ионов), их взаимного расположения УЭ- 1 Цель: уметь различать два вида твердых веществ Дайте характеристику аморфным веществам. Приведите примеры аморфных веществ (Для 1 и 3 группы) Цель: уметь различать два вида твердых веществ Дайте характеристику кристаллическим веществам. Приведите примеры кристаллических веществ. (Для 2 и 3 группы) Найдите по учебнику и по приложению №1 характеристику об аморфных веществах. Подготовьте устный ответ. Найдите по учебнику и по приложению №1 характеристику о кристаллических веществах. Подготовьте устный ответ. Вывод по УЭ – 1 Аморфные вещества не имеют определенной температуры. Они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относятся шоколад, жевательная резинка, пластмассы, смолы, пластилин, воск, стекло, резина и т.п. Кристаллические вещества имеют строго определенную температуру плавления и, главное, характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов. К кристаллическим веществам относятся: лед, кварц, железо, поваренная соль. УЭ- 2 Цель: изучить разные по форме кристаллы и дать определение кристалла. 1. Рассмотрите под лупой различные вещества: кварц SiO2 , серу, флюорит СаF2 . Опишите, что вы видите. 2.Пользуясь учебником и словарем С.И.Ожегова, ответьте на вопрос «Что такое кристаллы?» 3. Почему кристаллы различных веществ разнообразны по форме? 1. Лабораторная работа №1 в парах 2. Определение кристалла запишите в тетрадь 3. Подготовьте устный ответ 4. Используйте приложение №2 Вывод по УЭ – 2 Кристалл – это твердое вещество, имеющее определенное упорядоченное строение. Если рассмотреть под лупой различные кристаллические вещества, то можно заметить, что частицы, из которых состоит кристалл, располагаются в определенном порядке, образуя кристаллическую решетку. Кристаллы имеют разную форму – куба, параллелепипеда, призмы и др. Например: кристаллы кварца иглистые, имеют плоские грани и похожи на лед. У серы ромбические кристаллы желтого цвета. Кристаллы флюорита темные, непрозрачные. Разные по форме кристаллы имеют разные кристаллические решетки. УЭ- 3 Цель: познакомиться с типами кристаллических решеток. 1. Какие кристаллические решетки называются ионными? 2. Исследуйте макет кристаллической решетки хлорида натрия. 3. Заполните таблицу №1 4. Сделайте вывод, какими свойствами обладают вещества с ионной кристаллической решеткой. 5. Какие вещества имеют ионную кристаллическую решетку? (1 группа) Цель: познакомиться с типами кристаллических решеток. 6. Какие кристаллические решетки называются атомными? 7. Исследуйте макет кристаллической решетки алмаза. 8. Заполните таблицу №1 9. Сделайте вывод, какими свойствами обладают вещества с атомной кристаллической решеткой. 10. Какие вещества имеют такую же кристаллическую решетку? (2 группа) Лабораторная работа №2 в парах Используйте учебник и приложение №3. Подготовьте рассказ о кристаллической решетке выданного вещества. Лабораторная работа №2 в парах Используйте учебник и приложение №3. Подготовьте рассказ о кристаллической решетке выданного вещества. Цель: познакомиться с типами кристаллических решеток. 11. Какие кристаллические решетки называются металлическими? 12. Исследуйте макет кристаллической решетки натрия. 13. Заполните таблицу №1 14. Сделайте вывод, какими свойствами обладают вещества с металлической кристаллической решеткой. 15. Какие вещества имеют металлическую кристаллическую решетку? (3 группа) Лабораторная работа №2 в парах Используйте учебник и приложение №3. Подготовьте рассказ о кристаллической решетке выданного вещества. Цель: познакомиться с типами кристаллических решеток. 16. Какие кристаллические решетки называются молекулярными? 17. Исследуйте макет кристаллической решетки воды. 18. Заполните таблицу №1 19. Сделайте вывод, какими свойствами обладают вещества с такой кристаллической решеткой. 20. Какие вещества имеют такую же кристаллическую решетку? (4 группа) Лабораторная работа №2 в парах Используйте учебник и приложение №3. Подготовьте рассказ о кристаллической решетке выданного вещества. Таблица №1 Кристаллические решетки, вид связи и свойства веществ Тип решетки Ионная Виды частиц в узлах решетки Ионы (катионы и анионы) Вид связи между частицами Примеры веществ Наиболее характерные физические свойства Ионная Соли, оксиды и гидроксиды типичных металлов Тугоплавкие, нелетучие, твердые, многие растворимы в воде и проводят электрический ток в растворе и расплаве Атомная Атомы Ковалентная Алмаз, кремний, бор, кварц. Молекулярная Молекулы Между молекуламислабые силы межмолекулярного притяжения, а вот внутри молекулпрочная ковалентная связь При обычных условиях газы или жидкости, или твердые вещества с низкой температурой плавления: органические вещества (нафталин), вода, углекислый газ и др. Металлы и сплавы Металлическая Атом-ионы УЭ- 4 Металлическая Цель: познакомиться с явлением возгонки (сублимации) Определение возгонки (сублимации) записать в химический словарь. Твердые, нерастворимые, тугоплавкие, как вещества с ионной кристаллической решеткой, но часто в превосходной степени – очень твердые, очень прочные и т.д. Легкоплавкие, летучие, в твердом виде хрупкие, способны к возгонке, имеют малую твердость Ковкие, пластичные, тягучие, электро- и теплопроводные, имеют металлический блеск и т.д. Лабораторная работа №3 На треножник ставится подставка с отверстием для фарфоровой чашки. В нее насыпают немного бензойной кислоты, рядом помещают веточку растений, пограничника, который стоит «на посту». Все это сверху покрывают стеклянным колоколом. Чашечку с бензойной кислотой снизу подогревают – под колоколом начинается «метель». Через некоторое время после прекращения нагревания все предметы под колоколом оказываются покрытыми инеем. Возгонка или сублимация – переход твердого вещества в газообразное состояние, минуя жидкую фазу. Характерно для веществ с молекулярной кристаллической решеткой УЭ-5 Цель: познакомиться с законом постоянства состава. Закон постоянства состава записать в тетрадь. Найдите по учебнику закон постоянства состава и выучите наизусть. Работайте индивидуально. УЭ- 6 Цель: проверка знаний, умений, навыков по теме. Проводится кодированный диктант: если правильное предложение учащиеся пишут «да», а если неправильное - то пишут «нет». Диктант. 1. Нафталин – легкоплавкое, кристаллическое вещество, потому что имеет молекулярную кристаллическую решетку. 2. Слово «кристалл» пишется с одной буквой «л». 3. Вещества с атомной кристаллической решеткой – твердые, тугоплавкие, нелетучие. 4. Для веществ с металлической кристаллической решеткой характерным свойством является хрупкость. 5. Кристаллическая решетка графита состоит из атомов углерода. Контроль правильности выполнения диктанта проводят методом взаимопроверки. УЭ-7 Цель: использование полученных на уроке знаний при решении тестов ЕГЭ. ЕГЭ – 2007 А1. Вещества с атомной кристаллической решеткой 1)очень твердые и тугоплавкие 2)хрупкие и легкоплавкие 3)проводят электрический ток в растворах 4)проводят электрический ток в расплавах А2. Молекулярное строение имеет 1) алмаз 2) азот 3) кремний 4) поваренная соль А3. У веществ с низкой температурой плавления кристаллическая решетка 1) атомная 2) ионная 3) молекулярная 4) металлическая А4. Молекулярный тип кристаллической решетки реализуется в строении: 1) NaCI 2) SiO2 3) Н2О 4) Ba(NO)2 УЭ- 8 УЭ - 9 Подведение итогов ( рефлексия ) Прочитайте цель занятия. Достигли вы цели? С какими трудностями вы столкнулись? Как вы думаете: каким образом можно улучшить свою работу в дальнейшем? Домашнее задание: смоделировать кристаллическую решетку любого вещества, прочитать 22 параграф. Работайте в парах.