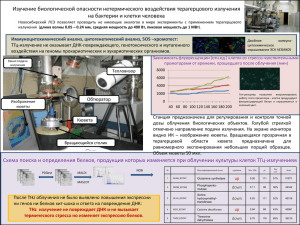
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ
advertisement

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ им. Н.И. ПИРОГОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИИ На правах рукописи МАЧНЕВА ТАТЬЯНА ВЯЧЕСЛАВОВНА ФОТОДИНАМИЧЕСКИЙ МЕХАНИЗМ ТЕРАПЕВТИЧЕСКОГО ДЕЙСТВИЯ ЛАЗЕРНОГО И СВЕТОДИОДНОГО ИЗЛУЧЕНИЯ 03.01.02 - биофизика Диссертация на соискание ученой степени доктора медицинских наук Научный консультант: зав. каф. общей и медицинской биофизики РНИМУ им. Н.И. Пирогова МЗ РФ доктор биологических наук, профессор Осипов Анатолий Николаевич Москва 2015 2 ОГЛАВЛЕНИЕ 1. ВВЕДЕНИЕ............................................................................................................... 14 2. ОБЗОР ЛИТЕРАТУРЫ .......................................................................................... 29 2.1. Лазерное и светодиодное излучение. Основные характеристики........... 29 2.2. Применение лазерного и светодиодного излучений в медицине ............ 33 2.3. Эффекты низкоинтенсивных лазерного и светодиодного излучений на биологические клетки ............................................................................................. 38 2.3.1. Действие низкоинтенсивных лазерного и светодиодного излучений на разные виды биологических клеток ...................................................................... 38 2.3.2. Действие низкоинтенсивных лазерного и светодиодного излучений на лейкоциты и макрофаги ......................................................................................... 40 2.3.2.1. Явление прайминга лейкоцитов и макрофагов ................................... 41 2.3.2.2. Действие низкоинтенсивных лазерного и светодиодного излучений на лейкоциты и макрофаги ................................................................................. 44 2.4. Эффекты низкоинтенсивных лазерного и светодиодного излучений на биологические ткани ............................................................................................... 47 2.4.1. Действие низкоинтенсивных лазерного и светодиодного излучений на разные виды биологических тканей...................................................................... 47 2.4.2. Раневой процесс как модель для исследования на тканевом уровне воздействия на биологические объекты ............................................................... 49 2.4.3. Действие низкоинтенсивного лазерного и светодиодного излучений на биологические ткани при заживлении ран ........................................................... 52 2.5. Системные эффекты низкоинтенсивных лазерного и светодиодного излучений на уровне организма ............................................................................ 57 2.5.1. Основные клинические эффекты действия низкоинтенсивных лазерного и светодиодного излучений на организм ............................................................. 57 3 2.5.2. Эндотоксический шок как модель для исследования системных эффектов на уровне организма .............................................................................. 62 2.5.3. Эндотоксический шок и действие низкоинтенсивных лазерного или светодиодного излучений ...................................................................................... 69 2.6. Научные теории действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты...................................... 72 2.6.1. Основные группы теорий действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты........................................ 72 2.6.2. Современные теории действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты........................................ 74 2.6.3. Фотодинамическая теория действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты........................................ 80 2.7. Порфирины, как возможные первичные фотоакцепторы при действии низкоинтенсивного излучения в видимом диапазоне ...................................... 91 2.7.1. Порфирины в организме человека .............................................................. 91 2.7.2. Порфирины как фотосенсибилизаторы ...................................................... 96 3. МАТЕРИАЛЫ И МЕТОДЫ ............................................................................... 102 3.1. Реактивы ........................................................................................................... 102 3.2. Животные ......................................................................................................... 102 3.3. Методы исследования .................................................................................... 104 3.3.1. Процедуры получения крови ..................................................................... 104 3.3.1.1. Процедура получения крови человека ............................................... 104 3.3.1.2. Процедура получения крови крыс ...................................................... 104 3.3.2. Модель экспериментальной кожной раны у крыс................................... 105 3.3.2.1. Процедура создания экспериментальной кожной раны у крыс....... 105 4 3.3.2.2. Планиметрия и фотографирование экспериментальных кожных ран .............................................................................................................................. 105 3.3.2.3. Патоморфологические исследования экспериментальных кожных ран ........................................................................................................................ 107 3.3.3. Модель экспериментального эндотоксического шока............................ 107 3.3.4. Процедуры получения плазмы крови, клеток лейкоцитарной фракции крови и раневого экссудата, эритроцитов крови и перитонеальных макрофагов крыс ........................................................................................................................ 108 3.3.4.1. Процедура выделения клеток лейкоцитарной фракции крови человека .................................................................................................. 108 3.3.4.2. Процедура выделения перитонеальных макрофагов крыс .............. 109 3.3.4.3. Культивирование макрофагов перитонеального экссудата крыс.... 109 3.3.4.4. Процедура получения раневого экссудата и выделения полиморфноядерных клеток лейкоцитарной фракции раневого экссудата крыс ..................................................................................................................... 110 3.3.4.5. Процедура выделения плазмы крови, полиморфноядерных клеток лейкоцитарной фракции и эритроцитов крови крыс ..................................... 111 3.3.5. Процедура экстракции липидов из эритроцитов крови крыс ................ 112 3.3.6. Измерение люминол-зависимой хемилюминесценции .......................... 112 3.3.6.1. Получение сыворотки крови и опсонизация зимозана ..................... 114 3.3.6.2. Измерение люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции крови человека ........................................................ 114 3.3.6.3. Измерение люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции раневого экссудата крыс ........................................ 115 3.3.6.4. Измерение люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции крови крыс ............................................................... 116 5 3.3.7. Определение внутриклеточной продукции активных форм кислорода перитонеальными макрофагами крыс................................................................. 116 3.3.8. Определение содержания ионов нитрита (NO2¯ ) по методу Грисса ..... 117 3.3.8.1. Определение содержания ионов нитрита в среде культивирования перитонеальных макрофагов крыс ...................................................................... 119 3.3.8.2. Определение содержания ионов нитрита в исследованиях на модели экспериментальной раны ..................................................................................... 119 3.3.9. Определение продукции пероксинитрита перитонеальными макрофагами крыс................................................................................................. 120 3.3.10. Регистрация продуктов окисления липидов .......................................... 122 3.3.10.1. Определение накопления ТБК-активных продуктов ...................... 122 3.3.10.1.1. Определение накопления ТБК-активных продуктов в суспензии клеток лейкоцитарной фракции крови человека ......................................... 122 3.3.10.1.2. Определение накопления ТБК-активных продуктов в раневом экссудате .......................................................................................................... 123 3.3.10.2. Определение диеновых коньюгатов в суспензии клеток лейкоцитарной фракции крови человека ........................................................ 124 3.3.10.3. Регистрация флуоресценции цис-паринариевой кислоты для измерения окисления липидов мембран эритроцитов крови крыс .............. 125 3.3.10.4. Оценка уровня липопероксильных радикалов в раневых экссудатах крыс методом хемилюминесценции, активированной кумарином С-525 в присутствии ионов двухвалентного железа .................................................... 126 3.3.11. Определение супероксиддисмутазной активности ............................... 129 3.3.11.1. Определение супероксиддисмутазной активности перитонеальных макрофагов крыс ................................................................................................ 130 3.3.11.2. Определение супероксиддисмутазной активности раневого экссудата крыс.................................................................................................... 131 6 3.3.11.3. Определение супероксиддисмутазной активности плазмы крови крыс ..................................................................................................................... 131 3.3.12. Определение антиоксидантной активности раневого экссудата в системе на основе азодиизобутирамидина гидрохлорида (АДБА) ................. 131 3.3.13. Измерение антиоксидантной активности раневого экссудата в модельной системе при окислении суспензии фосфолипидных липосом, индуцированном ионами двухвалентного железа ............................................. 133 3.3.13.1. Получение общей фракции фосфолипидов из желтков куриных яиц .............................................................................................................................. 134 3.3.13.2. Приготовление многослойных фосфолипидных липосом ............. 134 3.3.13.3. Измерение антиоксидантной активности раневого экссудата в модельной системе при окислении суспензии фосфолипидных липосом, индуцированном ионами двухвалентного железа.......................................... 135 3.3.14. Измерение флуоресценции эндогенных порфиринов в раневых экссудатах и плазме крови крыс......................................................................... 136 3.3.14.1. Измерение флуоресценции эндогенных порфиринов в раневых экссудатах крыс с помощью флуориметра Hitachi MPF-4 ............................ 136 3.3.14.2. Измерение флуоресценции эндогенных порфиринов в раневых экссудатах и плазме крови крыс с помощью оптического спектрометра FS-003V ............................................................................................................... 137 3.4. Источники и процедура облучения ............................................................. 140 3.4.1. Источники излучения ................................................................................. 140 3.4.2. Расчет дозы облучения ............................................................................... 141 3.4.3. Процедура облучения ................................................................................. 141 3.4.3.1. Процедура облучения суспензии полиморфноядерных клеток лейкоцитарной фракции крови человека ........................................................ 141 7 3.4.3.2. Процедура облучения суспензии перитонеальных макрофагов крыс .............................................................................................................................. 142 3.4.3.3. Процедура облучения крыс ................................................................. 143 3.4.3.3.1. Процедура облучения крыс при использовании модели экспериментальной раны ............................................................................... 143 3.4.3.3.2. Процедура облучения крыс при использовании модели эндотоксического шока .................................................................................. 143 4. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ................................................................... 146 4.1. Инициирование низкоинтенсивным лазерным излучением перекисного окисления липидов мембран лейкоцитов при облучении in vitro ................ 146 4.1.1. Инициирование низкоинтенсивным лазерным излучением перекисного окисления липидов мембран клеток лейкоцитарной фракции крови и зависимость этого эффекта от дозы облучения ................................................. 148 4.1.2. Инициирование низкоинтенсивным лазерным излучением перекисного окисления липидов мембран клеток лейкоцитарной фракции крови в присутствии экзогенного фотосенсибилизатора протопорфирина IX ............ 150 4.2. Влияние низкоинтенсивного лазерного излучения на продукцию активных форм кислорода и азота лейкоцитами и макрофагами при облучении in vitro. ................................................................................................... 153 4.2.1. Изменение продукции активных форм кислорода клетками лейкоцитарной фракции крови при увеличении продуктов окисления липидов мембран под действием лазерного излучения ................................................... 154 4.2.2. Влияние антиоксидантов на индуцированное лазерным облучением изменение продукции активных форм кислорода клетками лейкоцитарной фракции крови ....................................................................................................... 157 8 4.2.3. Увеличение продуктов окисления липидов и повышенное изменение хемилюминесцентного ответа лейкоцитов при лазерном облучении в присутствии протопорфирина IX ........................................................................ 161 4.2.4. Влияние низкоинтенсивного лазерного излучения на продукцию активных форм кислорода и азота перитонеальными макрофагами крыс ..... 163 4.2.4.1. Влияние низкоинтенсивного лазерного излучения на внутриклеточную продукцию активных форм кислорода перитонеальными макрофагами крыс сразу после облучения ..................................................... 163 4.2.4.2. Изменения супероксиддисмутазной активности, а также продукции оксида азота и пероксинитрита перитонеальными макрофагами крыс через 24 часа после лазерного облучения ................................................................. 168 4.3. Влияние низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами при облучении in vivo. ................ 175 4.3.1. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата при облучении поверхности экспериментальной кожной раны ............................. 175 4.3.1.1. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата при облучении in vivo и их зависимость от дозы и длины волны излучения ..... 176 4.3.1.2. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата после введения индуктора синтеза эндогенных порфиринов и облучения in vivo ................................................................................................................... 182 4.3.1.3. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата после введения экзогенных фотосенсибилизаторов и облучения in vivo .... 188 9 4.3.2. Системные эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами крови крыс при облучении ушной раковины крыс................................................................ 192 4.3.2.1. Эффекты воздействия низкоинтенсивного лазерного излучения на активность лейкоцитов крови при облучении in vivo и их зависимость от дозы и длины волны излучения........................................................................ 192 4.3.2.2. Эффекты воздействия низкоинтенсивного лазерного излучения на активность лейкоцитов крови при ведении липополисахарида B и облучении in vivo ................................................................................................................... 197 4.3.2.3. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами крови после введения экзогенных фотосенсибилизаторов протопорфирина IX и додециламида хлорина e6 и облучения in vivo .......................................................................... 203 4.4. Влияние низкоинтенсивного лазерного облучения in vivo на антиокислительную активность раневого экссудата и плазмы крови крыс .................................................................................................................................... 213 4.4.1. Эффекты воздействия низкоинтенсивного лазерного излучения на антиокислительную активность раневого экссудата крыс при облучении поверхности экспериментальной кожной раны................................................. 213 4.4.1.1. Эффекты воздействия низкоинтенсивного лазерного излучения на антиокислительную активность раневого экссудата в системе на основе азодиизобутирамидина гидрохлорида (АДБА) и их зависимость от дозы и длины волны излучения .................................................................................... 213 4.4.1.2. Эффекты воздействия низкоинтенсивного лазерного излучения на супероксиддисмутазную активность раневого экссудата крыс и их зависимость от дозы и длины волны излучения ............................................ 217 4.4.1.3. Влияние низкоинтенсивного лазерного облучения ран на супероксиддисмутазную активность раневого экссудата крыс при введении 10 экзогенных фотосенсибилизаторов - феофорбида а или протопорфирина IX .............................................................................................................................. 221 4.4.2. Системные эффекты воздействия низкоинтенсивного лазерного излучения на антиокислительную активность плазмы крови крыс при облучении ушной раковины крыс ....................................................................... 224 4.4.2.1. Эффекты воздействия низкоинтенсивного лазерного облучения in vivo на супероксиддисмутазную активность плазмы крови крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения .............................................................................................................................. 224 4.4.2.2. Эффекты воздействия низкоинтенсивного лазерного облучения in vivo в присутствии экзогенных фотосенсибилизаторов на супероксиддисмутазную активность плазмы крови крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения ............................................ 226 4.5. Влияние низкоинтенсивного лазерного облучения in vivo на процессы перекисного окисления липидов в раневом экссудате и в плазме крови крыс .......................................................................................................................... 232 4.5.1. Эффекты низкоинтенсивного лазерного излучения на процессы перекисного окисления липидов в раневом экссудате при облучении поверхности экспериментальной кожной раны................................................. 232 4.5.1.1. Снижение концентрации ТБК-активных продуктов в раневых экссудатах крыс под действием низкоинтенсивного лазерного излучения 233 4.5.1.2. Влияние низкоинтенсивного лазерного излучения на уровень липопероксильных радикалов в раневых экссудатах крыс при регистрации хемилюминесценции раневого экссудата, активированной кумарином С-525 в присутствии ионов двухвалентного железа ................................................. 234 11 4.5.1.3. Влияние низкоинтенсивного лазерного излучения на изменения антиокислительной активности и окисленности раневого экссудата при Fe2+индуцированном перекисном окислении липидов в липосомах .................. 239 4.5.2. Системные эффекты воздействия низкоинтенсивного лазерного излучения на процессы перекисного окисления липидов в плазме крови крыс при облучении ушной раковины крыс................................................................ 244 4.5.2.1. Эффекты воздействия низкоинтенсивного лазерного излучения на окисление липидов мембран эритроцитов крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения ............................................ 246 4.5.2.2. Эффекты воздействия низкоинтенсивного лазерного излучения в присутствии экзогенных фотосенсибилизаторов на окисление липидов мембран эритроцитов крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения ................................................................................................ 249 4.6. Влияние низкоинтенсивного лазерного излучения на скорость заживления экспериментальных кожных ран у крыс ................................... 254 4.6.1. Ускорение заживления экспериментальных кожных ран у крыс под действием низкоинтенсивного лазерного облучения и зависимость этого эффекта от дозы и длины волны излучения ....................................................... 254 4.6.2. Влияние заживления низкоинтенсивного экспериментальных лазерного кожных ран излучения у крыс на скорость при введении аминолевулиновой кислоты ................................................................................. 259 4.6.3. Влияние низкоинтенсивного лазерного излучения на скорость заживления экспериментальных кожных ран у крыс при введении экзогенных фотосенсибилизаторов - феофорбида а или протопорфирина IX .................... 263 4.7. Сравнение биологических эффектов низкоинтенсивного лазерного и светодиодного излучения...................................................................................... 265 12 4.7.1. Влияние лазерного или светодиодного облучения in vitro на продукцию оксида азота и супероксиддисмутазную активность перитонеальных макрофагов крыс ................................................................................................... 266 4.7.2. Влияние лазерного или светодиодного облучения поверхности ран на изменения функциональной активности лейкоцитов раневого экссудата ..... 273 4.7.3. Влияние низкоинтенсивного лазерного и светодиодного облучения ран на концентрацию оксида азота в раневом экссудате крыс ............................... 276 4.7.4. Влияние низкоинтенсивного лазерного и светодиодного облучения ран на перекисное окисление липидов и антиокислительную активность раневого экссудата крыс ....................................................................................................... 279 4.7.4.1. Влияние низкоинтенсивного лазерного и светодиодного излучения на накопление ТБК-активных продуктов в раневом экссудате крыс .......... 279 4.7.4.2. Влияние низкоинтенсивного лазерного и светодиодного излучения на изменения антиокислительной раневого экссудата в системе на основе азодиизобутирамидина гидрохлорида (АДБА) .............................................. 281 4.7.4.3. Влияние низкоинтенсивного лазерного и светодиодного облучения ран на изменения супероксиддисмутазной активности раневого экссудата .............................................................................................................................. 283 4.7.5. Влияние низкоинтенсивного лазерного и светодиодного излучения на скорость заживления и гистологическую картину экспериментальных кожных ран у крыс............................................................................................. 286 4.8. Роль эндогенных порфиринов в биологических эффектах низкоинтенсивного лазерного излучения ......................................................... 293 4.8.1. Регистрация эндогенных порфиринов: разработка методики, определение количества и динамики содержания эндогенных порфиринов в раневых экссудатах крыс ..................................................................................... 294 13 4.8.2. Роль эндогенных порфиринов в эффектах низкоинтенсивного лазерного излучения при облучении поверхности экспериментальных кожных ран у крыс ........................................................................................................................ 305 4.8.3. Флуоресцентное измерение количества эндогенных порфиринов в плазме крови крыс ................................................................................................ 311 4.8.4. Зависимость эффектов низкоинтенсивного лазерного облучения in vivo на индекс прайминга лейкоцитов крови и супероксиддисмутазную активность плазмы крови от количества эндогенных порфиринов в плазме крови крыс 316 5. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ .................................. 322 6. ВЫВОДЫ ................................................................................................................ 334 7. ЗАКЛЮЧЕНИЕ ..................................................................................................... 337 8. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ............................................................ 339 9. СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ .................. 340 10. БЛАГОДАРНОСТИ ............................................................................................ 341 11. СПИСОК ЛИТЕРАТУРЫ ................................................................................. 343 14 1. ВВЕДЕНИЕ Актуальность исследования Лазерное и светодиодное излучение низкой интенсивности, принадлежащее оптическому диапазону спектра, широко применяется в медицине уже более полувека [1-7]. Однако механизм действия таких излучений до сих пор остается малоизученным [1, 8-12]. В результате этого эффективность и безопасность использования низкоинтенсивных лазерного и светодиодного излучений в медицине не соответствуют оптимальным набором характеристик действия (например, длины волны и дозы излучения) и индивидуальных особенностей пациента. Параметры светового воздействия на организм чаще всего подбираются врачами эмпирически или по прецеденту. Для выработки научного решения этого вопроса необходимо прежде всего установить молекулярно-клеточный механизм биологического действия таких излучений. Данный механизм должен учитывать различные уровни организации биологических объектов: от клетки к ткани и организму, а также природу первичного фотоакцептора квантов излучения. В результате установления молекулярно-клеточного механизма и выявления природы первичного хромофора станет возможным индивидуальный подход к пациенту при проведении низкоинтенсивной фототерапии и переход от эмпирического подхода к выбору научно обоснованных условий облучения. Еще одной проблемой в данной области медицины является выбор источника облучения [4, 13-16] - или лазера с когерентным и поляризованным излучением, или светодиода, не обладающего такими параметрами, но являющегося более дешевым и доступным источником, обеспечивающим достаточную мощность излучения. Необходимо отметить, что в научной литературе данная проблема дискутируется и есть несколько работ, отражающих противоположные точки зрения и светодиодное излучение эмпирически, не имея 15 научного экспериментального обоснования, используется в практической медицине наряду с лазерным. Степень разработанности Исследование механизмов фототерапии приобрели особое распространение после изобретения лазера. Разными авторами предложено несколько теорий о механизмах действия низкоинтенсивного лазерного излучения в оптическом диапазоне спектра на биологические объекты. В настоящее время предпочтение отдается гипотезам о фотохимическом действии света, подразумевающим обязательное наличие первичного фотоакцептора [1, 9, 12, 17-24]. Наиболее значимы работы двух научных школ - школы, возглавляемой академиком РАН, профессором Владимировым Владимиров Ю.А. в 1994 Ю.А. г. и школы предложил профессора три Кару механизма Т.Й. действия низкоинтенсивного лазерного излучения [20]. Один из этих механизмов основан на фотодинамическом действии низкоинтенсивного излучения. Он предполагает наличие фотосенсибилизатора (которым, возможно, являются эндогенные порфирины), как первичного акцептора излучения. Согласно данному предложенному механизму фотосенсибилизированные реакции, вызванные низкоинтенсивным лазерным излучением, в присутствии кислорода вызывают перекисное окисление липидов мембран лейкоцитов, что является причиной изменения концентрации цитозольного кальция и, в результате, изменения активности клеток. Автор предположил, что именно это и ведет впоследствии к терапевтическому эффекту. Данная гипотеза оставалась теоретической пока нами не были исследованы некоторые этапы данного механизма на молекулярноклеточном уровне in vitro [25-32]. В этих исследованиях было установлено фотоиндуцированное изменение активности лейкоцитов крови, изменение уровня кальция в цитоплазме этих клеток, накопление продуктов окисления в эритроцитах крови, в липопротеинах плазмы крови и в модельной системе 16 (липосомы). Добавление к образцам экзогенных фотосенсибилизаторов порфиринового ряда усиливало наблюдаемые процессы. На этом этапе наших исследований не было проведено экспериментов по регистрации продуктов окисления липидов мембран собственно лейкоцитов. Соответственно не было возможности сравнить процесс накопления продуктов окисления и изменения функциональной активности лейкоцитов после облучения. Кроме того, оставался неизученным вопрос фотодинамического действия низкоинтенсивного - как механизм излучения реализует отсроченные во времени эффекты низкоинтенсивной лазерной терапии. Так же не было проведено исследований воплощения данного механизма при действии низкоинтенсивных излучений видимого диапазона in vivo, что не позволяло определить все этапы реализации эффектов излучения от клетки к организму, начиная от поглощения фотона и заканчивая терапевтическим эффектом. Кроме того, не было сравнительного исследования эффективности низкоинтенсивных лазерного (когерентного) и светодиодного (некогерентного) излучения. Главным неизученным вопросом оставалась природа первичных фотоакцепторов, в качестве которых предлагались, в частности, эндогенные порфирины. Единственным косвенным доказательством их роли являлось усиление наблюдаемого нами изменения индекса прайминга лейкоцитов после облучения in vitro в присутствии экзогенных фотосенсибилизаторов порфиринового ряда. Научная новизна В данной работе впервые исследовано действие низкоинтенсивного лазерного и светодиодного излучений видимого диапазона спектра одновременно 17 на разных уровнях организации биологических объектов: клеточном, тканевом и организменном и на основе единого молекулярно-клеточного фотодинамического механизма, который позволяет объяснить процессы терапевтического действия низкоинтенсивного светового излучения на разных этапах, начиная от поглощения кванта света и заканчивая терапевтическим эффектом. Впервые экспериментально доказаны основные этапы фотодинамического механизма действия низкоинтенсивных лазерного и светодиодного излучений in vitro, а также предложено и исследовано воплощение этого механизма при облучении in vivo. Установлена и объяснена зависимость биологических эффектов лазерного и светодиодного излучений от дозы и длины волны излучения. Кроме того, впервые показано, что отсроченные эффекты низкоинтенсивного лазерного излучения могут опосредоваться макрофагами, а эффекты сразу после облучения - лейкоцитами. Впервые экспериментально доказана роль эндогенных порфиринов как первичных акцепторов квантов низкоинтенсивного светового излучения в биологических объектах. Показано соответствие уровня эндогенных порфиринов и фотобиологических эффектов, а именно - индуцированных лазерным излучением изменений супероксиддисмутазной активности плазмы крови и раневых экссудатов, а также продукции активных форм кислорода лейкоцитами. В рамках фотодинамического механизма действия низкоинтенсивных видимых излучений впервые проведен сравнительный анализ и экспериментально доказано, что лазерное (когерентное) и светодиодное (некогерентное) излучения как in vitro, так и in vivo оказывают аналогичные биологические эффекты. Теоретическая и практическая значимость Данное исследование позволяет понять терапевтический механизм действия низкоинтенсивного лазерного и светодиодного излучения, начиная от поглощения 18 кванта света первичным акцептором и заканчивая собственно клиническим эффектом, который может быть как положительным (терапевтическим), так и отрицательным. В работе экспериментально доказана реализация основных этапов фотодинамического механизма действия низкоинтенсивного излучения в оптическом диапазоне спектра для различных длин волн и доз облучения. Выявлена роль эндогенных фотосенсибилизаторов - порфиринов в указанных явлениях. В результате данного исследования твердо установлено, что биологические эффекты низкоинтенсивных лазерного и светодиодного излучения определяются тремя параметрами: дозой излучения, длиной волны излучения, содержанием эндогенных порфиринов в биологическом образце. Поэтому данная работа позволяет в будущем разработать точную медицинскую методику индивидуального подбора характеристик излучений (например, дозы и длины волны) для проведения низкоинтенсивной лазерной терапии, основываясь на количестве эндогенных порфиринов в плазме крови или других биологических жидкостях пациента. В результате повысится эффективность фототерапии и снизится риск отрицательного действия данного лечения на часть пациентов. Также в данной работе разработана методика определения следовых количеств эндогенных порфиринов в биологических жидкостях. Это может быть использовано в будущей медицинской методике для определения индивидуальных параметров излучения при проведении фототерапии. Другая область применения - проведение исследований в экспериментальной медицине и биологии. Кроме того, показано усиление эффектов низкоинтенсивной лазерной терапии в условиях генерализованной патологии (на модели экспериментального эндотоксического шока). Это необходимо учитывать при выборе условий облучения в практической медицине и при разработке методики индивидуального 19 выбора условий облучения для лечения конкретной патологии каждого индивидуального пациента. Путем проведения сравнительного исследования действия низкоинтенсивных лазерного (когерентного) и светодиодного (некогерентного) излучений выявлено отсутствие существенных различий в действии лазерного и светодиодного излучений, что может явиться основанием для соответствующих клинических исследований. В результате возможно применение в практической медицине более дешевых, доступных и миниатюрных светодиодных источников излучений. Тем ни менее, при схожей направленности действия когерентного лазерного и некогерентного светодиодного излучений, количественные характеристики эффектов несколько отличаются друг от друга, что необходимо учитывать при выборе параметров излучений при проведении лечения. Применение экзогенных фотосенсибилизаторов в данной работе использовалось для доказательства роли фотосенсибилизированных реакций в реализации фотодинамического механизма низкоинтенсивной световой терапии. Однако кроме этого, результаты работы с данными веществами позволили оценить их эффективность и влияние на активность лейкоцитов, макрофагов и антиокислительную активность раневых экссудатов и плазмы крови. Это может быть применено в фотодинамической терапии при использовании данных фотосенсибилизаторов в клинической практике для повышения эффективности лечения. Кроме того, это может быть применено для оценки механизмов действия, безопасности и эффективности новых фотосенсибилизаторов в фотодинамической терапии. Методология и методы исследования В работе проведено несколько групп экспериментов на биологических клетках (человека и лабораторных животных), тканях (лабораторных животных) и на целом организме (лабораторные животные). Для этого на клеточном уровне 20 использовались клетки лейкоцитарной фракции крови человека или крыс и перитонеальные макрофаги крыс, а также эритроциты крови крыс. На тканевом уровне использовалась модель экспериментальной кожной раны (Слуцкий, 1969) у крыс и исследовались ткани раневой поверхности и раневой экссудат. На организменном уровне. использовались лабораторные животные (крысы) и модель эндотоксического шока (Victor, 1999; Karima, 1999; Козлов 2006) (исследовали клетки, плазму и сыворотку крови). Для проведения исследований выделялись компоненты крови: клетки лейкоцитарной фракции, эритроциты, плазму или сыворотку. Также выделялись перитонеальные лейкоцитарной макрофаги фракции крыс, раневых раневые экссудатов, экссудаты образцы крыс тканей и клетки раневых поверхностей. Кроме того, проводилась экстракция липидов из мембран эритроцитов крови крыс. Также проводилось выделение фосфолипидов из желтков куриных яиц (Folch, 1957) и получались многослойные фосфолипидные липосомы (Bangham, 1965). Для исследования фотобиологических эффектов на указанных объектах проводилось их облучение низкоинтенсивными монохроматическими лазерными и немонохроматическими светодиодными источниками в видимом диапазоне спектра. Облучение в разных экспериментах проводилось без и в присутствии экзогенных фотосенсибилизаторов порфиринового ряда. Для исследования вопроса о первичном фотоакцепторе применялся флуоресцентный метод определения эндогенных порфиринов в раневом экссудате и плазме крови крыс. Флуоресцентный метод был разработан для данных объектов исследования и условий эксперимента. Облучение проводилось в разных дозах излучения, сопоставимых с дозами, используемыми в низкоинтенсивной лазерной терапии. Применялось низкоинтенсивное излучение в трех диапазонах видимого спектра электромагнитных волн: "синем", "зеленом" и "красном". Изучались процессы изменения продукции активных форм кислорода и азота лейкоцитами и макрофагами, перекисного окисления липидов, изменения 21 антиокислительной активности. Для этого, в основном, использовались хемилюминесцентные, флуоресцентные и спектрофотометрические методы. Для изучения изменений функциональной активности клеток лейкоцитарной фракции и макрофагов использовался метод люминол-зависимой хемилюминесценции, активированной зимозаном. Также для регистрации продукции активных форм кислорода применялся флуоресцентный метод с применением внутриклеточного зонда 2,7-дихлорфлуоресциндиацетата (Rota, 1999; Hempel, 1999), а также метод Грисса (Шебзухов, 1988; Ding, 1988) для определения ионов нитрита и флуоресцентный метод регистрации окисления дигидрородамина 123 (Kooy, 1994) для определения продукции пероксинитрита. Для оценки уровня накопления продуктов окисления липидов в исследуемых объектах регистрировалось накопление ТБК-активных продуктов (Yagi, 1984; Гаврилов, 1987) и диеновых коньюгатов (Recknagel, 1984). Кроме того, для изучения уровня окисления липидов использовался флуоресцентный метод с цис-паринариевой кислотой (Kagan, 1998). Также проводилась оценка уровня липопероксильных радикалов методом хемилюминесценции, активированной кумарином С-525 в присутствии ионов двухвалентного железа (Владимиров 1991, 2001, 2005). При исследовании изменений антиокислительной активности (АОА) изучаемых объектов применялся метод оценки АОА в модельной системе на основе азодиизобутирамидина гидрохлорида (Lissi, 1995) и в модельной системе окисления суспензии двухвалентного фосфолипидных железа (Дремина, липосом, 1993). индуцированном Также был ионами использован спектрофотометрический метод с нитросиним тетразолием для определения СОДактивности, модифицированный Г.И. Клебановым (Клебанов, 1990). В исследованиях с экспериментальными кожными ранами крыс также использовался методы планиметрии (Стручков, 1975) и фотографирования ран и патоморфологическое исследование биологических тканей раневой поверхности. Во всех сериях экспериментов проводили контрольные эксперименты и статистическую обработку данных. 22 Поиск научной литературы в данной работе осуществлялся при использовании международных ресурсов PubMed, ScienceDirect, Scopus и российского ресурса eLibrary. Статистическая обработка данных проводилась стандартными методами математической статистики. Результаты экспериментов представлены в виде (среднее значение ± стандартная ошибка средней), если не указано иначе. Достоверность различий в некоторых экспериментах определялась с помощью непараметрического критерия Манна-Уитни (указано в соответствующих разделах). Положения, выносимые на защиту 1. В основе терапевтического действия низкоинтенсивного лазерного и светодиодного излучения в видимом диапазоне спектра, как один из основных, лежит фотодинамический механизм. В рамках такого механизма первичными фотоакцепторами являются фотосенсибилизаторы - эндогенные порфирины. Индуцируемые светом фотосенсибилизированные реакции в присутствии кислорода приводят к окислению мембранных липидов, к изменению уровня антиокислительной защиты, к активации и продукции активных форм кислорода и азота клетками как in vitro, так и in vivo на разных уровнях организации биологических объектов. Разное содержание эндогенных фотосенсибилизаторов может приводить к различным по степени выраженности эффектам при действии излучений с разными длинами волн и разными дозами облучения. 2. Низкоинтенсивное лазерное излучение (НИЛИ) в терапевтических дозах сразу после облучения приводит к накоплению продуктов окисления липидов мембран лейкоцитов крови и к последующему изменению функциональной активности этих клеток. Данные изменения зависят от дозы облучения и усиливаются в присутствии экзогенных 23 фотосенсибилизаторов порфиринового ряда. Применение антиоксидантов устраняет эффекты НИЛИ. 3. Отсроченное во времени действие низкоинтенсивного лазерного излучения опосредуется реализацией фотодинамического механизма в макрофагах и связанно с продукцией активных форм кислорода и азота и соответствующим изменением СОД-активности. Данные процессы зависят от дозы облучения. 4. Низкоинтенсивное лазерное излучение влияет на продукцию активных форм кислорода лейкоцитами при облучении in vivo и этот эффект зависит от дозы и длины волны излучения и усиливается при введении экзогенных фотосенсибилизаторов или индуктора синтеза эндогенных порфиринов, а также в условиях экспериментальной патологии. 5. Низкоинтенсивное лазерное излучение влияет на антиокислительную активность и процесс перекисного окисления липидов раневого экссудата и плазмы крови крыс при облучении in vivo и эти эффекты зависят от дозы и длины волны излучения и усиливаются при введении экзогенных фотосенсибилизаторов, а также в условиях экспериментальной патологии . 6. Низкоинтенсивное лазерное излучение влияет на скорость заживления экспериментальных кожных ран и этот эффект зависит от дозы, длины волны излучения и от присутствия в области раны экзогенных фотосенсибилизаторов или индуктора синтеза эндогенных порфиринов. 7. Низкоинтенсивное лазерное (когерентное) и светодиодное (некогерентное) излучения оказывают аналогичные биологические эффекты, которые зависят от дозы облучения. 8. Эффективность действия низкоинтенсивного лазерного облучения in vivo зависит от количества эндогенных порфиринов в биологических жидкостях (при фиксированной дозе и длине волны облучения). 24 Внедрение результатов исследования в практику Результаты исследования используются в курсах преподавания общей и медицинской биофизики на кафедрах общей и медицинской биофизики медикобиологического факультета и физики и математики педиатрического факультета ГБОУ ВПО РНИМУ имени Н.И. Пирогова МЗ РФ. Результаты исследования были применены для усовершенствования процедуры проведения фотодинамической терапии опухолей в Государственном научном центре лазерной медицины ФМБА России и в Российском онкологическом научном центре им. Н.Н. Блохина МЗ России. По результатам данной работы используется индивидуальный методический подход при проведении фотодинамической терапии, основанный на учете длины волны и дозы облучения, а также концентраций фотосенсибилизаторов, что позволяет перейти от эмпирического выбора условий облучения к индивидуальному лечебному воздействию, характерному для каждого пациента. Кроме того, учтены результаты исследований с применением экзогенных фотосенсибилизаторов. Так же результаты данного исследования внедрены в практическую деятельность отделений № 45 физиотерапии и № 30 челюстно-лицевой хирургии ГКБ № 1 им. Н.И. Пирогова Департамента здравоохранения города Москвы, клиники "Псориаз-центр" (ООО медицинский центр "Компания Александр") и кафедры челюстно-лицевой хирургии и стоматологии ГБОУ ВПО РНИМУ им. Н.И. Пирогова МЗ РФ для проведения низкоинтенсивной лазерной терапии. Пациентам с заведомо высоким уровнем эндогенных порфиринов (острый воспалительный процесс, интоксикация, порфирии...) низкоинтенсивная терапия проводится в меньших дозах облучения или противопоказана. Также учтено возможное применение светодиодных источников наряду с лазерными. 25 Апробация результатов Диссертация апробирована 20 ноября 2015 года на объединенной научнопрактической конференции сотрудников кафедры общей и медицинской биофизики медико-биологического факультета, кафедры физики и математики педиатрического факультета и отдела медицинской биофизики ГБОУ ВПО РНИМУ имени Н.И. Пирогова МЗ РФ. Основные положения работы представлены на 17-ти симпозиумах и конференциях: II Всероссийском съезде фотобиологов (Пущино, 1998), 8th International laser physics workshop (Будапешт, Венгрия, 1999), III съезде фотобиологов России (Воронеж, 2001), Международной научно-практической конференции Северо-Западного региона РФ (Санкт-Петербург, 2001), 1st International conference “Skin and Environment” (Moscow – St. Petersburg, 2005), международном симпозиуме “Молекулярные механизмы регуляции функции клетки” (Тюмень, 2005), 4-ой национальной научно-практической конференции с международным участием “Активные формы кислорода, азота, антиоксиданты и здоровье человека” (Смоленск, 2005), Одиннадцатой Российской гастроэнтерологической неделе (Москва, 2005), Всероссийской конференции молодых ученых и II школе им. Академика Н.М.Эммануэля “Окисление, окислительный стресс, антиоксиданты” (Москва 2006), 5-th National Scientific Practical Conference with International Participation "Reactive oxygen species, nitric oxide, antioxidants and human health" (Смоленск, 2007), Fifth international conference on porphyrins and phthalocyanines ICPP-5 (Москва, 2008), научно-практической конференции «Медико-биологические науки для теоретической и клинической медицины» (Москва, 2008), научно-практической конференции «Биологически активные вещества: фундаментальные и прикладные вопросы получения и применения» (Крым, 2009), конференции и семинарах по научным направлениям Программы фундаментальных исследований Президиума РАН «Фундаментальные науки - медицине» (Москва, 2009), Десятом съезде 26 Белорусского общественного «Молекулярные, мембранные объединения и фотобиологов клеточные основы и биофизиков функционирования биосистем» (Минск, Беларусь, 2012), IV съезде биофизиков России: Симпозиум III "Физика - медицине и экологии" (Нижний Новгород, 2012), International Symposium "Topical problems of biophotonics - 2015" (Нижний Новгород, 2015). По теме диссертации опубликовано 40 печатных работ, из них 18 – в рецензируемых изданиях, входящих в "Перечень российских рецензируемых научных журналов, в которых должны быть опубликованы основные научные результаты диссертаций ..." Высшей аттестационной комиссии Министерства образования и науки РФ. Объем и структура диссертации Диссертация состоит из следующих разделов: "Введение", "Обзор литературы", "Результаты исследований" (8 глав), "Обсуждение результатов", "Выводы", "Заключение", "Практические рекомендации", "Благодарности" и "Списка литературы", включающего 368 источников. Общий объем диссертации составляет 388 страниц, она содержит 29 таблиц и иллюстрирована 84 рисунками. 27 Цель исследования: установить основные этапы фотодинамического механизма терапевтического действия лазерного и светодиодного излучений видимого диапазона спектра при облучении in vitro и in vivo на разных уровнях организации биологических объектов: клеточном, тканевом и организменном. Задачи исследования: 1. Исследовать процесс перекисного окисления липидов мембран клеток лейкоцитарной фракции крови при низкоинтенсивном лазерном облучении in vitro. 2. Исследовать изменение продукции активных форм кислорода клетками лейкоцитарной фракции крови при низкоинтенсивном лазерном облучении in vitro и сопоставить полученные данные с накоплением продуктов окисления липидов в мембранах клеток. Провести данные исследования без и в присутствии экзогенных фотосенсибилизаторов порфиринового ряда, а также без и в присутствии антиоксидантов. 3. Изучить изменение продукции активных форм кислорода и азота перитонеальными макрофагами как сразу, так и через сутки после низкоинтенсивного лазерного облучения in vitro. 4. Исследовать изменение продукции активных форм кислорода лейкоцитами раневого экссудата при низкоинтенсивном лазерном облучении in vivo, изучить зависимости эффектов от дозы и длины волны излучения. Провести данные исследования без и в присутствии экзогенных фотосенсибилизаторов порфиринового ряда. 5. Исследовать изменение продукции активных форм кислорода клетками лейкоцитарной фракции крови крыс при низкоинтенсивном лазерном облучении in vivo, изучить зависимости эффектов от дозы и длины волны излучения. Провести данные исследования без и в присутствии экзогенных фотосенсибилизаторов порфиринового экспериментальной патологии. ряда, а также в условиях 28 6. Исследовать изменение антиокислительной активности раневого экссудата и плазмы крови крыс при низкоинтенсивном лазерном облучении in vivo, изучить зависимости эффектов от дозы и длины волны излучения. Провести данные исследования фотосенсибилизаторов без и порфиринового в присутствии ряда, а также экзогенных в условиях экспериментальной патологии. 7. Исследовать процесс перекисного окисления липидов в раневом экссудате и в плазме крови крыс при низкоинтенсивном лазерном облучении in vivo, изучить зависимости эффектов от дозы и длины волны излучения. Провести данные исследования фотосенсибилизаторов без и порфиринового в присутствии ряда, а также экзогенных в условиях экспериментальной патологии. 8. Исследовать влияние низкоинтенсивного лазерного излучения на скорость заживления экспериментальных кожных ран у крыс в зависимости от дозы и длины волны излучения, в также от присутствия в раневых тканях экзогенных фотосенсибилизаторов или индуктора синтеза эндогенных порфиринов. 9. Провести сравнительное исследование биологической эффективности низкоинтенсивного лазерного (когерентного) и светодиодного (некогерентного) излучения, а именно: влияние на продукцию активных форм кислорода и азота макрофагами и лейкоцитами при облучении in vitro, на перекисное окисление липидов и антиокислительную активность при облучении in vivo, на скорость заживления и гистологическую картину экспериментальных кожных ран при облучении in vivo. 10. Разработать методику определения следовых количеств эндогенных порфиринов в биологических жидкостях (раневом экссудате и плазме крови). Оценить зависимость эффектов низкоинтенсивного лазерного облучения in vivo от количества эндогенных фиксированной дозе и длине волны облучения). порфиринов (при 29 2. ОБЗОР ЛИТЕРАТУРЫ 2.1. Лазерное и светодиодное излучение. Основные характеристики Излучения в оптическом диапазоне спектра электромагнитных волн составляют инфракрасное, видимое и ультрафиолетовое излучения. Основными характеристиками являются длина волны λ (и, следовательно, частота ν) излучения: λ = с/ν, где с - скорость света. Единицы измерения: длины волны - м (нм чаще используют для оптического диапазона), частоты - с-1 [18]. Примерные диапазоны длин волн: 10 - 400 нм - ультрафиолетовое, 400 - 800 нм - видимое, 800 нм до 1000 мкм - инфракрасное излучения [33]. В данной работе рассматривается видимый диапазон спектра, без учета инфракрасного и ультрафиолетового диапазонов. Кроме того, оптическое излучение характеризуется энергией квантов света: ε = hν = hc/λ, где h - постоянная Планка. Единица измерения энергии квантов - Дж [18]. Однако в медицине энергетические параметры обычно рассматривают не применительно к одному кванту, а в более общем представлении. При этом используют понятия потока, интенсивности и дозы излучения. Поток излучения - это энергия, переносимая за единицу времени через поверхность площадью S за единицу времени: Ф = dE/dt. Единица измерения - Вт [18]. Интенсивность излучения - это поток, падающий на единицу площади поверхности, перпендикулярной направлению распространения света: I = Ф/S. Единица измерения - Вт/м2 [18]. Доза излучения (Д) - произведение интенсивности на длительность облучения; характеризует энергию света, переносимую за определенное время t через единицу площади образца: Д = It. Единица измерения - Дж/м2 [18]. 30 Применение оптического излучения в медицине получило мощный импульс благодаря развитию в середине XX века квантовой электроники и созданию оптических квантовых генераторов - лазеров [34]. Лазеры, как источники оптического излучения, позволяют сконцентрировать энергию электромагнитной волны на небольшой площади. В медицине это позволило направлять излучение непосредственно на поврежденный участок или необходимую точку воздействия. Кроме того, лазерное излучение является монохроматичным, то есть характеризуется определенной длиной волны излучения. К настоящему времени медицинской практикой для лечения различных патологий эмпирически подобраны лазерные излучения различных длин волн. Почему же лазерное излучение обладает такими уникальными свойствами, как концентрация энергии и монохроматичность? Причина кроется в создании инверсной заселенности атомов и когерентности излучения. Когерентностью называется согласованное протекание нескольких колебательных согласованности может или быть волновых процессов [35]. различной. Различают временную Степень и пространственную когерентность [35, 36]. Временная когерентность лазерного пучка определяет когерентности, его при монохроматичность котором сохраняется и характеризуется постоянный временем сдвиг фаз. Пространственная когерентность определяется постоянным сдвигом фаз волн в разных точках пространства и характеризуется длиной пространственной когерентности (или радиусом когерентности) - расстоянием, на котором пространственная когерентность будет сохраняться. Световые волны естественного солнечного света имеют радиус когерентности всего 50 мкм [35], в то время как, например, излучение гелий-неонового лазера может обладать радиусом когерентности более километра [36]. Обычно излучение, испускаемое при самопроизвольном переходе атомов из одного состояния в другое, не является когерентным, так как каждый атом 31 начинает и заканчивает излучение независимо от других [33]. Такое излучение называют спонтанным. Однако атом можно "вынудить" перейти из верхнего энергетического уровня на нижний с испусканием излучения под действием внешнего электромагнитного поля. Такое излучение называют вынужденным или индуцированным. Испускаемые при этом фотоны одинаковы по энергии и направлению движения, а излучение в целом - монохроматическое и когерентное. Это свойство и положено в основу устройства лазеров. В веществе создают состояние с так называемой инверсной (перевернутой) заселенностью (такие вещества называют "активной средой"). При этом больше половины атомов находится в возбужденном состоянии. Такая система атомов способна усиливать и генерировать электромагнитное излучение. Режим генерации достигается за счет создания положительной обратной связи. При этом часть сигнала с выхода устройства подается на его вход, поддерживая процесс излучения до тех пор, пока существует инверсная заселенность уровней. Одним из приемов создания механизма положительной обратной связи в лазерах является применение зеркал, отражающих поток фотонов. Достаточно одному атому совершить переход с инверсного уровня на основной с испусканием фотона, как возникает лавина фотонов. Отражаясь от зеркала фотоны на своем пути вызывают вынужденное излучение у новых атомов и процесс продолжается [33, 35, 37]. В результате основными особенностями лазерного излучения являются пространственная когерентность, временная когерентность (монохроматичность), очень малая расходимость световых пучков, большая мощность. У некоторых типов лазеров достигается мощность излучения 1016 Вт/м2, в то время, как мощность излучения Солнца составляет около 104 Вт/м2 [33, 35]. За работы в области усиления и генерации электромагнитного излучения в 1964 году был присуждена Нобелевская премия. Лауреатами стали два советских 32 физика - Н.Г. Басов и А.М. Прохоров и один американский физик - Ч. Таунсон [33, 35]. В настоящее время создано несколько видов лазеров, которые могут излучать в импульсном или непрерывном режимах. Это твердотельные лазеры (например, рубиновый лазер импульсного режима излучения), газовые (например гелий-неоновый лазер непрерывного излучения), полупроводниковые лазеры непрерывного действия. В рубиновом лазере инверсная заселенность создается мощной вспышкой лампы, в гелий-неоновом - электрическим разрядом, в полупроводниковых - электрическим током. Существуют и мощные газодинамические лазеры непрерывного действия. В них инверсная заселенность создается при расширении и адиабатном охлаждении сверхзвуковых газовых потоков, нагретых до нескольких тысяч кельвин [35, 37, 38]. 33 2.2. Применение лазерного и светодиодного излучений в медицине Излучение в оптическом диапазоне спектра электромагнитных волн применялось в медицине издревле. В трудах античных и средневековых натурфилософов и врачей упоминалось о роли солнечного излучения в лечении [38]. Первым ученым и врачом, получившим мировое признание в области применения света в медицине стал датский физиотерапевт исландского происхождения - Нильс Рюберг Финзен (Финсен). Он, в частности, показал эффективность применения света в красном диапазоне спектра для лечения оспы, а в ультрафиолетовом диапазоне - для лечения туберкулеза кожи (волчанки). В 1903 году Н.Р. Финсену была присуждена Нобелевская премия по физиологии и медицине за изучение и применение света в терапии некоторых патологий [18]. С изобретением лазеров в середине XX столетия - использование излучений видимого диапазона спектра в медицине приобрело "второе дыхание". В настоящее время в медицинской практике лазерное излучение используют в трех направлениях: высокоэнергетическое - в хирургии, лазерное излучение средних интенсивностей - в фотодинамической терапии (в сочетании с фотосенсибилизатором), низкоэнергетическое - в терапии [15, 18]. Также лазерное излучение широко используется в различных методах диагностики. Излучение высокоэнергетических или высокоинтенсивных лазеров приводит к нагреву, обугливанию, испарению тканей . При этом интенсивность воздействия составляет около 100 Вт/см2. При этом используются твердотельные, аргоновые, эксимерные, углекислотные лазеры с различными длинами волн излучения - от инфракрасной до ультрафиолетовой области [18]. В фотодинамической терапии используют лазерное излучение средней или низкой интенсивности в сочетании с фотосенсибилизаторами. Длину волны 34 излучения выбирают, исходя из спектральных характеристик фотосенсибилизатора, диапазон составляет от 600 до 1200 нм [39]. Дозы облучения составляют 10 - 500 Дж/см2 [40]. Низкоинтенсивная лазерная терапия (НИЛТ) в настоящее время - это метод локального воздействия электромагнитным излучением оптического спектра с малой выходной мощностью - от 2 до 50 мВт в России [41] и от 1 до 500 мВт в разных странах [1, 9, 42]. При этом используют излучения с длиной волны от 400 до 1100 нм, а доза облучения составляет 0,01 - 100 Дж/см2 [1, 9], а интенсивность воздействия - 0,01 - 10 Вт/см2 [1]. Необходимо отметить, что в последние 15 - 20 лет, с появлением мощных миниатюрных светодиодов, в медицине все активнее используется их излучение, не являющееся монохроматическим [4, 42-44]. Диапазон применения низкоинтенсивного лазерного и светодиодного излучений в медицине необычайно широк. Наибольшее распространение они нашли в общей терапии внутренних болезней [9, 14, 41], в стоматологии [9, 14, 41, 42], офтальмологии [14], дерматологии [14, 41, 42, 45], косметологии [46], неврологии [14, 41, 42], травматологии [14], спортивной медицине [14], оториноларингологии [14, 41] и других областях. При этом главными преимуществами низкоинтенсивной лазерной терапии являются неинвазивность и безболезненность. Это решает многие психологические, санитарно- гигиенические проблемы, а также делает это лечение доступным для определенных категорий пациентов (дети, пожилые, пациенты с сопутствующими заболеваниями...). Однако необходимо отметить, что среди методик НИЛТ существует и инвазивный подход - внутривенное облучение крови, так называемое ВЛОК. Этот метод обычно применяют при лечении сердечнососудистых заболеваний. В современный период в медицине, ветеринарии и биологии используют различные виды лазеров: твердотельные (например, рубиновый), газовые 35 (например, гелий-неоновый), полупроводниковые (роль активной среды выполняет полупроводниковый переход; т.н. "лазерные диоды"). В НИЛТ наибольшее распространение получили гелий-неоновый лазер (длина волны излучения 632,8 нм), твердотельный КТР-лазер (или Nd:YAG лазер, где активная среда - алюмо-иттриевый гранат, легированный ионами неодима; 532 нм), лазеры на парах меди (510 нм), гелий-кадмиевый лазер (441,6 нм), азотный лазер (337 нм), рубиновый лазер (694 нм), криптоновый (521, 530, 568, 647 нм) [1, 38] и другие. Необходимо отметить, что наиболее часто применяют низкоинтенсивное лазерное излучение в красной области видимого спектра [1], так как оно имеет большую глубину проникновения в биологические ткани по сравнению с синей и зеленой областями спектра. Например "красное" низкоинтенсивное лазерное излучение проникает на 1 - 2 мм в кожу, достигая глубоких слоев дермы, а "синее" и "зеленое"излучения - на 0,3 - 0,5 мм, оставаясь в базально-клеточном слое или в верхних слоях дермы [45]. Необходимо отметить, что в последнее десятилетие в медицине стали широко применять полупроводниковые лазеры (лазерные диоды). Они дешевле и компактнее других лазеров при той же мощности излучения. Однако такие диоды не позволяют проводить воздействие в узком диапазоне спектра. Лазерные диоды выпускают с различными длинами волн излучения. Так, например, в медицине используют полупроводниковые лазеры на основе кристаллов Ga-N (520-530 нм), Ga-Al-As лазер (805 или 650 нм), Ga-As (904 нм) [1, 38]. Одними из первых исследований воздействия низкоинтенсивного лазерного излучения на биологические объекты стали работы Е. Mester и сотр. [6, 7] в конце 60-х годов ХХ столетия, т.е. не прошло и десяти лет после изобретения лазеров. В Российской Федерации низкоинтенсивная лазерная терапия официально применяется как в государственных, так и в частных лечебных учреждениях. НИЛТ в нашей стране развивается уже более сорока лет. Терапевтическое применение низкоинтенсивного лазерного излучения видимого диапазона в СССР 36 началось в 1972 году, когда Министерство здравоохранения разрешило применение гелий-неонового лазера малой мощности в терапии [47]. В настоящее время в России производится и применяется несколько десяткой различных видов и модификаций медицинских лазеров. Применение лазерного излучения в медицине регулируется Минздравом России. Так, например, согласно приказов Минздравсоцразвития России № 277 и 278 от 23 ноября 2004 года рекомендовано применение низкоинтенсивного лазерного излучения при оказании санаторнокурортной помощи больным с болезнями печени, желчного пузыря, желчевыводящих путей и поджелудочной железы, пищевода, желудка и двенадцатиперстной кишки, кишечника [48, 49]. Согласно приказа Минздравсоцразвития России №197 от 27 марта 2006 года "Об организации деятельности родильного дома (отделения)" в палате (на посту) интенсивной терапии и реанимации для беременных и родильниц в родильных домах (отделениях) необходимо наличие минимум одного лазерного терапевтического аппарата [50]. В научно-исследовательской и практической работе по применению лазеров учувствовали несколько институтов и предприятий. Так, например, с 1976 года лазеротерапия исследуется и применяется в Центральном НИИ курортологии и физиотерапии (в настоящее время: Федеральное государственное бюджетное учреждение «Российский научный центр медицинской реабилитации и курортологии» Министерства здравоохранения Российской Федерации) в Москве [51]. В 1986 году согласно приказу Министерства Здравоохранения в СССР был создан Всесоюзный Научный Центр лазерной хирургии (в настоящее время - это Государственный Научный Центр лазерной медицины), в котором применяют и исследуют не только высокоэнергетические лазеры для хирургии, но и низкоэнергетическое лазерное излучение [52]. Необходимо отметить, что в различных странах применение НИЛИ ограничено, так как до сих пор неясны молекулярно-клеточные механизмы действия такого излучения [42]. Например, в США использование лазеров в 37 медицине регулирует федеральный исполнительный департамент Министерства здравоохранения и социальных служб США - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA). Данное управление в настоящий период пока разрешает использование акупунктуре низкоэнергетических для обезболивания, медицинских при лазеров этом лазеры только при называются биостимулирующими [8]. Агентство отмечает, что возможно расширение использования таких лазеров с получением достаточных данных о положительных и отрицательных эффектах [8]. Тем не менее, помимо России, низкоинтенсивное излучение в видимом диапазоне используется в медицине некоторых стран Европы, Азии и в Канаде [42]. 38 2.3. Эффекты низкоинтенсивных лазерного и светодиодного излучений на биологические клетки В настоящее время широко описано действие низкоинтенсивных излучений в видимом диапазоне спектра на различных уровнях организации биологических объектов: клеточном, тканевом и организменном. При этом использованы различные виды биологических объектов и моделей. Эти экспериментальные данные позволяют представить общую картину процессов, развивающихся в ответ на действие низкоинтенсивных излучений видимого диапазона. Однако все эти результаты разрозненны, не охватывают одновременно всю структуру иерархии: от клетки к организму. Кроме того, первичные механизмы зачастую рассматриваются отдельно от механизмов клеточных, тканевых и организменных. В результате мы имеем огромное количество экспериментальных работ, не объединенных общей идеей. В одном нашем исследовании охватить все современные работы не представляется возможным. В связи с этим в данном разделе мы наиболее подробно остановимся на наиболее значимых, с нашей точки зрения, биологических объектах и механизмах и постараемся объединить их общей идеей единого механизма действия. 2.3.1. Действие низкоинтенсивных лазерного и светодиодного излучений на разные виды биологических клеток В настоящее время существует огромное количество работ, посвященных исследованию действия света на различные виды биологических клеток [53-63]. При этом отмечают пролиферацию клеток, изменение их активности и продукции специфичных данным клеткам веществ, адгезию и хемотаксис [53]. В видимом диапазоне спектра показаны эффекты НИЛИ различных длин волн. Например, при исследовании фотоиндуцированной пролиферации клеток 39 использовались излучения разных длин волн. Так Lan C.C. с соавт. наблюдали стимуляцию пролиферации меланоцитов в культуре при облучении гелийнеоновым лазером (красная область спектра) [61]. При этом авторы отмечают зависимость эффектов от таких параметров, как длина волны и доза облучения. Anwer A.G. с соавт. показали изменение пролиферации и митохондриальной активности стволовых клеток, выделенных из жировой ткани, при облучении низкоинтенсивным лазером с длиной волны излучения 532 нм (зеленая область спектра) [56]. При небольших дозах облучения (P = 0,153 Вт/м2, время облучения 30, 45 и 60 с) авторы наблюдали активацию изучаемых процессов. Увеличение дозы (P = 0,153 Вт/м2, время облучения 180 и 300 с) приводило к ингибированию. Применение излучения лазера в синей области спектра (405 нм) приводило к увеличению внутриклеточной концентрации кальция и выбросу гистамина в культуре тучных клеток [64]. В обзоре, посвященном влиянию НИЛИ на пролиферацию различных культур клеток отмечается по разным данным усиление пролиферации клеток в интервале длин волн от 600 до 700 нм (красная область спектра) при дозах облучения от 0,5 до 4 Дж/см2 [55]. Так, например, при облучении низкоинтенсивным лазером в красном диапазоне спектра (635 нм, 1,875 мВт/см2) авторы наблюдали существенное усиление пролиферации в культуре эндотелиальных клеток и снижение концентрации растворимого рецептора sVEGFR-1, основная функция которого - торможение работы васкулоэндотелиального фактора роста (VEGF). Тем самым авторы объясняют механизм лазер-индуцированного ангиогенеза [60]. Liao X. с соавт. изучали влияние излучения гелий-неонового лазера (632,8 нм; 2 Дж/см2) на культуру эпидермальных клеток человека [62]. Авторы показали фотоиндуцированную стимуляцию пролиферации и миграции клеток in vitro, при этом не обнаружено влияния на дифференциацию клеток. Предметом исследований является и низкоинтенсивное немонохроматическое видимое излучение. Так, Lavi R. с сотр. наблюдали увеличение концентрации внутриклеточного кальция и АФК (гидроперекиси и 40 супероксид-анион радикала) в кардиомиоцитах крыс при облучении низкоинтенсивным широкополосным светом в интервале длин волн от 400 до 800 нм [65]. Ankri R. с соавт. зарегистрировали продукцию оксида азота при облучении сперматозоидов и эндотелиальных клеток немонохроматическим излучением разных длин волн [66]. При этом синий свет оказался более эффективным, чем красный. Asai T. с соавт. наблюдали стимулирование пролиферации и дифференциации культуры остеогенных клеток при облучении светодиодами с длиной волны излучения около 630 нм [58]. При этом на "молодые" культуры клеток (7 дней культивирования) влияние оказывали большие дозы облучения (3 Дж/см2), а на "старые" (15 дней) - малые (0,5 Дж/см2). Такие исследования еще раз подчеркивают необходимость индивидуального подхода при определении параметров излучения в терапии. Volpato L.E. с соавт., изучая действие низкоинтенсивных излучений лазерного и светодиодного источников, излучающих в красной области спектра, на культуру фибробластов обнаружили увеличение жизнеспособности клеток, а также способности их к пролиферации и стимуляцию митохондриального дыхания. При этом достоверных различий в эффектах когерентного и некогерентного излучений не обнаружено. 2.3.2. Действие низкоинтенсивных лазерного и светодиодного излучений на лейкоциты и макрофаги Как мы уже отмечали, в большом многообразии данных мы более подробно остановимся на тех биологических объектах, которые, с нашей точки зрения, наиболее важны для построения единой концепции механизмов действия низкоинтенсивных излучений в видимом диапазоне спектра. В случае "клеточного" уровня организации такими объектами являются клетки, способные 41 к праймингу - лейкоциты и макрофаги. В связи с этим, сначала будет рассмотрено явление прайминга. После этого мы рассмотрим влияние низкоинтенсивных излучений видимого диапазона на клетки лейкоцитарной фракции и макрофаги. 2.3.2.1. Явление прайминга лейкоцитов и макрофагов Уровень функциональной активности клеток, способных к фагоцитозу, не является величиной постоянной и изменяется в зависимости от состояния организма [16, 67]. Явление, отражающее способность таких клеток при определенных условиях увеличивать свой функциональный потенциал получило название прайминга (priming) или предстимуляции [68-70]. Прайминг состоит в том, что предварительная обработка клеток с небольшим количеством стимулятора (первый стимул), действие которого не вызывает их прямую активацию, сопровождается, тем не менее, увеличением ответа фагоцитов на последующую стимуляцию (второй стимул). При прайминге функциональный ответ клеток на второй стимул в несколько раз превышает величину ответа на этот же стимул без прайминга [16, 67, 68]. При этом также увеличивается скорость развития ответа клеток на стимуляцию. Для оценки эффективности предстимуляции (прайминга) фагоцитов было введено понятие индекса предстимуляции (ИП): ИП = А /А0 1 где А0 - активность клеток без предстимуляции, А- ответ предстимулированных клеток на второй стимул Известно, что прайминг фагоцитов может вызываться широким набором самых разнообразных воздействий и факторов: иммунные комплексы [71], 42 фрагменты комплемента [72], лимфокины [73], ионофоры кальция [67], адгезия и агрегация клеток лейкоцитарной фракции [74] и др. При этом прайминг может быть кратковременный и пролонгированный. Кратковременный прайминг наблюдается при взаимодействии клеток с первым стимулом не более одного часа (2 - 60 мин.), пролонгированный прайминг - в течении 5 - 40 часов [75]. Кроме времени инкубации с первым стимулом существуют и другие критерии различия двух видов прайминга: выраженность ответа на второй стимул, чувствительность к ингибиторам синтеза белка и др. [67]. Кратковременный прайминг, как правило, характеризуется значением индекса прайминга не более 2 - 3 [72, 76] и не зависит от влияния ингибиторов синтеза белка [75, 77]. Показано, что ключевой стадией кратковременного прайминга является увеличение концентрации цитозольного кальция. Так, было показано, что инкубация полиморфноядерных клеток лейкоцитарной фракции крови с ионофором кальция - иономицином в концентрации 10-9 М, вызывала их прайминг и увеличение хемилюминесцентного ответа клеток на последующую стимуляцию [75, 78] Пролонгированный прайминг, как правило, характеризуется значением индекса прайминга более 10 [67] и зависит от влияния ингибиторов синтеза белка [75, 77]. Механизмы прайминга исследуются до сих пор, однако многое уже известно. Так, показано, что в результате предстимуляции происходит экспрессия рецепторного аппарата клеток [79, 80]. Причины такой экспрессии отличаются в случае кратковременного и пролонгированного прайминга. В случае пролонгированного прайминга, вероятно, происходит синтез компонентов рецепторного аппарата de novo, что доказано эффективностью применения ингибиторов синтеза белков. В случае кратковременного прайминга время инкубации с первым стимулом недостаточно для осуществления внутриклеточных синтетических процессов. Применение ингибиторов синтеза 43 белков также не дает эффекта. Предполагается, что при кратковременном прайминге происходит экспрессия т. н. предсуществующих или “таинственных” рецепторов [75, 81], появление которых может быть следствием активации кальций-зависимых ферментов частичного (кальпаинов), протеолиза присутствующих в лейкоцитах [82] и осуществляющих частичный протеолиз ряда белков. Считается, что именно повышение концентрации цитозольного кальция является основополагающим событием для прайминга [67, 68]. Помимо активации кальпаинов, увеличение содержания цитозольного кальция может запускать две системы промежуточных мессенджеров диацилглицерол [83, 84]. Вероятно, все эти инозитол трифосфат и процессы и приводят к кратковременному праймингу фагоцитов. В настоящее время предполагается, что "таинственными" рецепторами могут быть так называемые толл-подобные рецепторы, играющие ключевую роль в развитии клеточного иммунитета. При этом в прайминге лейкоцитов могут участвовать толл-подобные рецепторы TLR8 [85]. В развитии прайминга важную роль может играть и перекисное окисление липидов (ПОЛ). Известно, что ПОЛ клеточных мембран вызывает увеличение ионной проницаемости вообще [86] и транспорта Cа2+ в частности [87, 88], так как при этом происходит формирование гидроперекисных каналов для ионов кальция. В работе [89] было исследовано влияние липосом различной степени окисленности на зимозан-индуцированную хемилюминесценцию клеток лейкоцитарной фракции. ПОЛ липосом инициировали инкубацией липосом в кипящей водяной бане. Степень окисления липосом оценивали по накоплению ТБК-активных продуктов окисления липидов. Обнаружили, что окисленные липосомы существенно влияли на хемилюминесцентный ответ клеток лейкоцитарной фракции. Интересно, что данный эффект наблюдали и при разделении клеток и липосом диализной мембраной. По мнению авторов в 44 данном случае в индукции прайминга клеток лейкоцитарной фракции вероятно участвовали долгоживущие гидроперекиси липидов. Следовательно, можно предположить, что, в случае инициации лазерным облучением фотосенсибилизированного свободнорадикального окисления липидов мембран лейкоцитов, увеличение проницаемости мембран для кальция в итоге может приводить к праймингу клеток. 2.3.2.2. Действие низкоинтенсивных лазерного и светодиодного излучений на лейкоциты и макрофаги Роли лейкоцитов и макрофагов в реализации эффектов низкоинтенсивных излучений видимого диапазона придается особое значение, о чем свидетельствует большое количество работ по этой теме. Данному вопросу уделяется большое внимание и в нашей лаборатории. Ранее в нашей лаборатории, под руководством профессора Клебанова Г.И. изучено влияние низкоинтенсивного лазерного излучения в красном диапазоне спектра на изменение активности лейкоцитов крови человека. Показано дозозависимое изменение функциональной активности клеток, возрастание концентрации внутриклеточного кальция и влияние окисленных липопротеинов плазмы крови на указанные процессы при облучении низкоинтенсивным гелийнеоновым лазером [25, 27, 32, 90]. Как уже отмечалось выше, изменение продукции активных форм кислорода (АФК) является одним из главных эффектов низкоинтенсивных излучений в видимом диапазоне. Kushibiki, T. с соавт. измеряли уровень АФК в различных клетках и, в том числе в культуре макрофагов [91]. Измерения проводили с помощью флуоресцентного CM-H2DCFDA-зонда, позволяющего регистрировать внутриклеточный уровень АФК. Было показано увеличение уровня активных форм кислорода в клетках при облучении синим лазером (6 и 12 Дж/см2). При облучении в красной области спектра эффекта не наблюдалось. Авторы 45 предположили, что в данных условиях эксперимента дозы облучения были малы для накопления достаточного количества АФК, которое мог бы зарегистрировать используемый флуоресцентный зонд. Как уже отмечалось выше, существует много работ, посвященных изучению роли лейкоцитов и макрофагов в реализации эффектов низкоинтенсивных излучений видимого диапазона. При этом исследования проводятся на разных уровнях организации биологических объектов: клеточном, тканевом и организменном. Carlos, F. P. с соавт. изучали влияние НИЛИ в красном диапазоне спектра (длина волны излучения 660 нм, доза облучения 2.5 Дж/см2) на развитие воспалительной реакции у крыс на модели зимозан-индуцированного артрита [92]. НИЛИ снижало количество лейкоцитов в синовиальной жидкости и продукцию ими медиаторов острой фазы воспаления (интерлейкинов 1 и 6). При этом наблюдалась меньшая деградация коллагеновой соединительной ткани в суставе по сравнению с группой , не получавшей облучения. Souza N.H.C. с соавт. исследовали действие низкоинтенсивных излучений на культуру макрофагов. При облучении клеток красным излучением (длина волны 660 нм) в дозе 7,5 Дж/см2. При этом моделировали воспалительную реакцию, инкубируя клетки с бактериальным липополисахаридом (ЛПС) и интерфероном гамма. Авторы наблюдали увеличение митохондриальной активности клеток (оценивали по активности митохондриальной сукцинат дегидрогеназы) при инкубации с ЛПС и интерфероном, однако облучение приводило эти значения к контрольным (без воспаления) [93]. Излучение гелий-неонового лазера (632,8 нм) в разных дозах облучения (0,2 Вт/м2, время облучения 5 - 180 с) влияло и на функциональную активность перитонеальных макрофагов и лимфоцитов селезенки мышей [94]. Если время облучения клеток не превышало 60 с, наблюдали стимуляцию секреторной активности клеток, что выражалось в росте продукции интерлейкина 2, интерферона гамма и интерлейкина 6 в лимфоцитах, фактора некроза опухолей альфа, оксида азота и интерлейкина 6 в макрофагах и повышении активности 46 естественных киллерных клеток. Более длительная экспозиция (до 180 с) либо не влияла на синтез некоторых цитокинов (интерлейкин 2 в лимфоцитах и интерлейкин 6 в макрофагах), либо оказывало угнетающее действие, проявляющееся в снижении продукции интерлейкина 6 и интерферона гамм в лимфоцитах, оксида азота в макрофагах и подавлении активности естественных киллерных клеток [94]. 47 2.4. Эффекты низкоинтенсивных лазерного и светодиодного излучений на биологические ткани Существует низкоинтенсивных большое лазерного количество и работ, светодиодного посвященных излучений на действию различные биологические ткани. При этом одной из наиболее обсуждаемых является тема о воздействии света на раневой процесс и фотоиндуцированные изменения в раневых тканях. Рассмотрим сначала действие низкоинтенсивных лазерного и светодиодного излучений на разные виды биологических тканей, а потом более подробно остановимся на влиянии этих излучений на раневой процесс. 2.4.1. Действие низкоинтенсивных лазерного и светодиодного излучений на разные виды биологических тканей В настоящее время существует огромное количество работ, посвященных исследованию действия низкоинтенсивных лазерного и светодиодного излучений на различные виды биологических тканей. При этом на тканевом уровне наблюдаются следующие эффекты: сокращение длительности фаз воспаления, уменьшение интерстициального отека тканей, изменение скорости кровотока и ангиогенез, регенераторный и пролиферативный эффекты и другие [1, 14, 95-109]. Так, Alves A.N. с соавт. провели анализ литературы с 2006 по 2013 года по исследованиям воздействия НИЛТ на мышечные ткани. Авторы отмечают в большей части исследований стимулирующий эффект низкоинтенсивного лазерного излучения на ангиогенез мышечной ткани после повреждений, модулирование уровня факторов роста и ускорение воспалительной реакции [95]. При этом отмечается зависимость обнаруженных эффектов от параметров излучения и процедуры облучения. Необходимо отметить, что в литературе есть результаты, подтверждающие этапы возможного фотодинамического действия низкоинтенсивных видимых 48 излучений. А именно - изменение процессов перекисного окисления липидов и антиоксидантного статуса биологических тканей, а также изменение функциональной активности тканевых макрофагов или клеток лейкоцитарной фракции, мигрирующих в ткани при патологических процессах. Так, Mileva M. с соавт. исследовала влияние низкоинтенсивного излучения He-Ne лазера на процессы накопления продуктов ПОЛ в гомогенате хрусталика и во влаге камер глаза при лечении катаракты [110]. Показано фотоиндуцированное снижение уровня диеновых коньюгатов и ТБК-активных продуктов, накапливающихся в исследованных средах при развитии катаракты. Малиновская С.Л с соавт. обнаружили индуцированное низкоинтенсивным излучением в красном диапазоне спектра (использовался гелий-неоновый лазер) снижение накопления продуктов окисления липидов в тканях миокарда крыс после ишемии-реперфузии [111]. При этом измеряли накопление диеновых коньюгатов и малонового диальдегида (МДА). Интересно, что авторы использовали для сравнения и излучение источника широкополосного красного света с длиной волны 640 ± 70 нм. Оказалось, что такое немонохроматическое излучение оказывает сходное с лазерным излучением действие. Сравнению эффектов монохроматического и немонохроматического излучений придается особое внимание. Есть даже работы, в которых используют только светодиодное низкоинтенсивное излучение, полагая, что оно по действию не отличается от лазерного. Так, Ekizer A. с соавт. изучали процессы новообразования кости у крыс после ортопедического расширения межчелюстных швов [97]. При этом использовали светодиодный источник, излучающий в красном диапазоне спектра (длина волны 618 нм, мощность 20 мВт/см2). После ежедневных сеансов в течение 10 дней авторы провели гистоморфометрический анализ костной ткани и обнаружили в опытной группе (с облучением) существенное ускорение скорости образования кости, увеличение количества остеобластов, остеокластов и новообразованных сосудов. 49 2.4.2. Раневой процесс как модель для исследования на тканевом уровне воздействия на биологические объекты Рана - это повреждение организма, сопровождающееся нарушением целостности покровных тканей, то есть кожи и слизистых оболочек [112]. При повреждении соседних тканей, кроме кожи, говорят о глубокой ране [113]. Совокупность биологических процессов, последовательно и закономерно развивающихся в ране при ее заживлении, называется раневым процессом [113]. Каждая рана особенно опасна развитием бактериальной микрофлоры и появлением т.н. раневой инфекции [112, 114]. Т.е. помимо локального тканевого дискомфорта и нарушения местных функций на уровне биологических тканей, раневой процесс является звеном в общем системном ответе организма. С другой стороны, в развитии раневого процесса активное участие принимают различные виды биологических клеток [114]. Тем самым раневой процесс является удобной моделью для исследований на разных уровнях организации биологических объектов: от клетки к организму. Исследования на тканевом уровне изучения биологических объектов часто проводят с использованием модели экспериментальной раны в связи с легким доступом к получению и изучению раневых тканей и экссудатов. Существует несколько подходов к классификации раневого процесса, но большинство авторов выделяют три основных стадии в процессе заживления раны [96, 113]: I. II. III. фаза воспаления фаза регенерации, образования и созревания грануляционной ткани фаза реорганизации рубца и эпителизации. При этом воспалительная фаза включает два периода: период сосудистых изменений и период очищения раны от некротических тканей. В воспалительной фазе происходит адгезия и дальнейшая миграция клеток лейкоцитарной фракции через стенки капилляров и венул. В последствии эти клетки лейкоцитарной фракции участвуют в очищении раны от микробов и некротических тканей [113]. 50 Миграции клеток лейкоцитарной фракции способствует длительная вазодилатация микрососудов и развитие их повышенной проницаемости, вскоре после короткой начальной вазоконстрикции [115]. Длительность течения первой фазы может колебаться в широких пределах. Однако при неосложненном варианте течения раневого процесса длительность первой фазы составляет в среднем 3-5 суток [113]. Помимо клеток лейкоцитарной фракции важную роль в течении первой фазы раневого процесса играют фибробласты и фиброциты, участвующие в продукции компонентов межклеточного матрикса, в частности коллагена. К окончанию первой фазы раневого процесса начинается синтез коллагена, а также местный фибринолиз фибрина, выпавшего в рану [113]. Первая фаза (воспаления) постепенно переходит во вторую (регенерации). При этом происходит два основных процесса: замещение фибрина капиллярами и коллагеном и эпителизация раны за счет миграции эпителиальных клеток. Возникающая грануляционная ткань является ключевым фактором обеспечивающим успешное заживление раны. Именно грануляции участвуют в секреции раневого экссудата - жидкости желтоватого цвета, содержащей большое количество лейкоцитов и обладающей бактерицидными и некролитическими свойствами. Грануляционная ткань постепенно заполняет полость раны и на нее мигрируют эпителиальные клетки. Длительность этой фазы в среднем составляет 10 -30 суток [113]. Вторая фаза раневого процесса плавно сменяется третьей фазой, которая длится в среднем 2 - 3 месяца. При этом происходят сбалансированные процессы по организации коллагеновой и фиброзной тканей, сопровождающиеся повышением прочности рубца. Завершающим этапом является окончательная эпителизация раны (начавшаяся еще во второй фазе) [113]. Необходимо отметить, что среди прочего, одним из синдромов, сопровождающих раневой процесс, является болевой синдром. Его усиление происходит в первой (воспалительной) фазе заживления раны вследствие 51 местного отека тканей. Местный отек возникает в результате деструктивных процессов в ране. В области воспаления отмечается значительная активация окислительных процессов и нарушение электролитного баланса, обусловленное перемещением внутриклеточного калия во внеклеточное пространство, а натрия и воды внутрь клеток. Нарушаются клеточные структуры и метаболические процессы. В условиях кислородной недостаточности преобладает анаэробный тканевой обмен, происходит накопление молочной кислоты развивается выраженный тканевой ацидоз. Прогрессирующий ацидоз значительно усиливает явления местного отека тканей, что сопровождается дополнительной ишемией тканей и усилением болевого синдрома [113]. Воспалительная стадия характеризуется также гиперпродукцией активных форм кислорода (АФК). При этом развитие раневого процесса с одной стороны взаимосвязано с образованием АФК, а с другой стороны повышенное образование радикалов кислорода тормозит заживление ран [16]. Известно, что активные формы кислорода запускают ряд свободнорадикальных реакций, в частности перекисное окисление липидов. Перекисная деградация мембранных липидов, клеточных белков и нуклеиновых кислот может являться причиной формирования апоптоза и некроза в области раневого дефекта и в прилегающих тканях. Так было обнаружено накопление продуктов окисления липидов в тканях резаных ран крыс в воспалительной фазе раневого процесса [116]. После, с заживлением раны, количество ТБК-реактивных продуктов окисления липидов снижалось. Авторы обнаружили, что на 2, 4, и 7 дни после операции снижался уровень внутриклеточных и внеклеточных антиоксидантов. Например, активность супероксиддисмутазы, количество аскорбата и витамина Е снижались на 60 - 70%. При этом активность СОД полностью не восстанавливалась и к 14-му дню после операции. Вероятно, снижение антиоксидантного резерва и является результатом гиперпродукции АФК и развития ПОЛ [16, 116]. Причинами повышенного образования АФК в области раны могут быть "кислородный взрыв" фагоцитов (нейтрофилов и макрофагов) и активация 52 системы ксантин - ксантин оксидаза. Фагоциты мигрируют в область раны, что было описано выше. А система ксантин - ксантин оксидаза активируется вследствие ишемии - реперфузии вследствие смены первоначальной вазоконстрикции вазодилатацией [16, 113]. Очевидно, что раневой процесс является сложным и многогранным, при этом хорошо изученным и легко получаемым экспериментально. Модель экспериментальной кожной раны можно использовать для широкого круга исследований, включая механизмы свободнорадикальных реакций, инициируемых или контролируемых различными факторами. Важно, что существует целый ряд методов исследования раневого процесса - от регистрации скорости заживления ран до изучения активности и количества клеток в области раны и до измерения уровня ферментов, антиоксидантов, продуктов окисления в раневых тканях и экссудатах. 2.4.3. Действие низкоинтенсивного лазерного и светодиодного излучений на биологические ткани при заживлении ран Влияние низкоинтенсивного излучения оптического диапазона на течение раневого процесса изучается довольно давно, учитывая начало обширного использования таких излучений в медицине с изобретением лазера. Уже с начала 1980-х годов появились первые подобные работы. Один из первопроходцев в исследовании биологических эффектов НИЛИ - Mester E. и соавт. в работе 1985го года подвели некоторые итоги применения НИЛИ в медицине и биологии с 1965 по 1985 года и рекомендовали применение лазеров для ускорения заживления ран при незаживающих язвах [117]. Jongsma F.H. с соавт. исследовали действие НИЛИ на открытые кожные раны у крыс [118]. При этом использовался аргоновый лазер с длинами волн излучения 488 и 514.5 нм, дозы облучения составляли 1 и 4 Дж/см2. Авторами было указано влияние на процесс заживления ран и длины волны, и дозы излучения. При этом отмечались 53 неоднозначность эффектов. Появились и работы, в которых не было отмечено эффекта на раневой процесс. Так McCaughan J.S. Jr с соавт. [119] исследовали влияние низкоинтенсивного излучения аргонового лазера (доза облучения 2 Дж/см2) на процесс заживления ран у морских свинок. Авторы не обнаружили эффекта для данной длины волны и дозы лазерного излучения. Подобные результаты еще раз подтверждают необходимость поиска механизмов действия низкоинтенсивного видимого излучения для предметного подбора параметров облучения с целью получения требуемого эффекта. В настоящее время низкоинтенсивное лазерное излучение широко используется в лечении ран и активно изучаются механизмы действия НИЛИ на заживление ран [45, 62, 96, 99, 103, 104]. Показано ускорение заживления ран, уменьшение болевых ощущений при этом процессе и улучшение качества рубца. Так, Araujo C.E. с соавт. изучали заживление экспериментальных кожных ран у крыс при облучении He-Ne лазером (дл на волны излучения 632.8 нм) [104]. Доза облучения составляла 1 Дж/см2, время облучения - 3 мин. Облучение проводили на 1, 5, 8, 12, и 15 дни после операции. После 15-го дня ткани раневой поверхности были исследованы авторадиографическими и иммуногистохимическими методами. Авторы обнаружили снижение воспаления, ускорение эпителизации, активацию фибробластов и увеличение количества волокон коллагена в области облучения (т.е. в области раны) по сравнению с контрольной группой. Pereira M.C. с соавт. исследовали заживление экспериментальных кожных ран у крыс при облучении лазером в красном диапазоне спектра (длина волны 670 нм, доза облучения - 4 Дж/см2) [120]. Авторы обнаружили интенсификацию воспалительной фазы раневого процесса, увеличение количества полиморфноядерных и тучных клеток в ране, вазодилатацию. Все наблюдаемые процессы происходили в течении 6 - 24 часов после проведения операции. 54 Silveira P.C. с соавт. изучали эффекты НИЛИ разных длин волн и доз облучения на окислительный стресс и фиброгенез на модели экспериментальных кожных ран у крыс [121]. Оказалось, в частности, что излучение гелий-неонового лазера (632,8 нм; 7 сеансов облучения; дозы 1 и 3 Дж/см2) приводит к ускорению заживления ран, снижению уровня накопления продуктов ПОЛ и к активации антиоксидантных ферментов - СОД и каталазы. Kilik R.с соавт. исследовали действие низкоинтенсивного излучения в красном диапазоне спектра на заживление экспериментальных открытых кожных ран у здоровых мышей и мышей с экспериментальным диабетом [96]. Авторами проведен гистологический анализ тканей раневой поверхности с определением количества клеток лейкоцитарной фракции, эндотелиальных клеток, волокон коллагена, скоростью формирования новообразованных кровеносных сосудов в динамике раневого процесса. В работе был использован диодный (GaAlAs) лазер с длиной волны излучения 635 нм. Исследователи наблюдали ускорение стадии воспаления и эпителизации раны, а так же процессов образования коллагена и неоангиогенеза в обеих группах - без диабета и с диабетом. Интересно, что авторы данного исследования сравнили эффективность НИЛИ разной мощности излучения (1, 5, и 15 мВт/см2), при этом доза облучения была одинаковая (5 Дж/см2). Облучение проводили ежедневно в течение шести дней после операции. Статистически значимые эффекты были обнаружены при использовании НИЛИ мощностью 5 и 15 мВт/см2. При этом возрастал уровень продукции коллагена и скорость неоангиогенеза. Максимальная эффективность была обнаружена для НИЛИ мощностью 15 мВт/см2 и для группы мышей с диабетом. Такие исследования позволяют расширить рамки понимания выбора характеристик и режимов облучения для повышения эффективности НИЛТ. Также подобные работы важны для понимания первичных механизмов действия 55 НИЛИ, где немаловажно оценивать длину волны, дозу и мощность излучения. Кроме того, изучение перспектив применения НИЛИ в лечении диабетических ран является актуальным для данной патологии. Необходимо отметить, что вопрос сравнительного анализа по применению монохроматического лазерного и немонохроматического светодиодного излучений наиболее активно исследуется именно в области исследований, посвященных фотоиндуцированному заживлению ран [103]. Использование низкоинтенсивного излучения светодиодов в лечении ран особенно актуально в связи с разной площадью и локализацией раневого процесса, т.к. в этом случае светодиодные источники более удобны в силу разнообразия форм и размеров. Большинство авторов не находят существенных различий в эффектах низкоинтенсивного монохроматического лазерного и немонохроматического светодиодного излучений на раневой процесс [4, 44, 45, 103, 105]. При этом исследования проводятся не только при использовании излучений в красной области спектра. Так, Adamskaya N. с соавт. применили низкоинтенсивное светодиодное излучение в синей области спектра (470 нм) при изучении заживления экспериментальных кожных ран у крыс. Другая опытная группа животных облучалось светодиодами, излучающими в красной области спектра (630 нм). Авторы наблюдали ускорение заживления ран и синтеза мРНК в обоих случаях с некоторыми отличиями в степени выраженности эффектов. Fushimi T. с соавт. сравнили действие светодиодов, излучающих в синем (456 нм), зеленом (518 нм) и красном (638 нм) диапазонах спектра на заживление кожных ран у мышей [107]. Авторы обнаружили однонаправленное действие низкоинтенсивных излучений - ускорение заживления ран, увеличение количества мРНК и белков, секретируемых фибробластами. Однако наиболее эффективными оказались излучения в красном и, особенно, в зеленом диапазонах спектра. Исходя из предлагаемого нами фотодинамического механизма с эндогенными порфиринами в качестве первичных фотоакцепторов, мы можем предположить, что такие 56 результаты получены вследствие того, что использовались одинаковые дозы облучения и не было получено дозовой зависимости. Однако существуют и работы, в которых отмечено влияние особенных свойств лазерного излучения на раневой процесс. Так, например, Ribeiro M.S. с соавт. установили, что скорость заживления ран у крыс зависела от направления плоскости поляризации излучения He-Ne лазера [122]. 57 2.5. Системные эффекты низкоинтенсивных лазерного и светодиодного излучений на уровне организма В данном разделе будут рассмотрены системные эффекты низкоинтенсивных излучений видимого диапазона спектра на организм в клинических и экспериментальных условиях. Для оценки действия лазерного и светодиодных излучений в норме и в условиях генерализованной патологии - в качестве одной из таких патологий будет использован эндотоксический шок. 2.5.1. Основные клинические эффекты действия низкоинтенсивных лазерного и светодиодного излучений на организм Низкоинтенсивное излучение видимого диапазона спектра широко применяется в современной клинической практике. Как уже отмечалось выше, эти излучения нашли применение в общей терапии внутренних болезней [9, 13, 15, 14, 41, 123], в стоматологии [9, 14, 41, 42], офтальмологии [14], дерматологии [14, 41, 42, 45], косметологии [46], неврологии [14, 41, 42], травматологии [14], спортивной медицине [14, 124], оториноларингологии [14, 41], хирургии [125] и других областях. В практической медицине отмечают вазоактивный, местный обезболивающий, противовоспалительный, спазмолитический и другие эффекты [9, 12, 13, 126]. Одним из наиболее изученных результатов применения низкоинтенсивного видимого излучения является изменение (чаще - стимуляция) микроциркуляции. Этот и другие терапевтические эффекты показаны при лечении таких патологий, как диабетическая стопа [13], ревматоидный артрит [127], псориаз [128], пиелонефрит [13], ишемическая болезнь сердца [129] и других. В спортивной медицине НИЛТ применяют для повышения выносливости спортсменов, за счет увеличения энергетического обмена в мышцах [130]. 58 Так, Волотовская А.В. с соавт. наряду с традиционными методами использовали НИЛТ для пациентов с ишемической болезнью сердца [129]. Применяли НИЛИ в красном диапазоне спектра (632,8 нм, 14 мВт). Авторы наблюдали положительный терапевтический эффект, улучшение показателей гемостаза, сопровождавшийся увеличением активности антиоксидантных ферментов и снижением уровня продуктов ПОЛ. Отмечается, что максимальное фотоиндуцированное увеличение активности получено для супероксиддисмутазы. Авторы отмечают, что в качестве индикатора для выбора параметров излучения можно использовать параметры АОА и уровень продуктов ПОЛ крови. Необходимо отметить, что в современной медицине в подавляющем большинстве случаев используются лазерные источники низкоинтенсивного излучения [13, 15, 38, 41, 131, 132]. Светодиодные источники не нашли широкого применения в силу малой изученности их эффективности. Тем ни менее они являются весьма перспективными, так как являются более доступными, негабаритными и универсальными. Тем ни менее есть немало работ, посвященных сравнению эффектов низкоинтенсивных лазерного и светодиодного излучений при различных патологиях. Так, Pontinen P.J. с соавт. исследовали влияние некогерентного излучения светодиода и когерентного излучения лазеров в красном диапазоне спектра на микроциркуляцию крови в сосудах кожи головы при лечении алопеции [43]. Авторы обнаружили, что действие красного излучения определялось в основном дозой излучения, а не когерентностью. Светодиодные источники низкоинтенсивного излучения, в частности в красной области спектра, активно используются в спортивной медицине. При этом в экспериментах на животных [124] и в клинических исследованиях [5] наблюдается активация синтеза АТФ в мышечной ткани, быстрое увеличение мышечной массы при тренировках и восстановление основных функций мышц, поврежденных при чрезмерных нагрузках. Nadur-Andrade, N. с соавт. изучали возможности снижения отека при действии яда змей семейства ботропсов [133]. При этом в качестве источников излучения были использованы лазерный (длина волны излучения - 685 нм, доза облучения 2,2 Дж/см2) и светодиодный (635 нм, 4 59 Дж/см2) источники. Авторы наблюдали индуцированное облучением снижение отека, при этом принципиальных различий в действии источников не обнаружили. Тем ни менее необходимо отметить, что доза и время облучения лазером была в 2 раза меньше, чем светодиодом. Nishioka, M. A. с соавт. обнаружили большую эффективность светодиодного излучения, чем лазерного при приживлении ткани после трансплантации [134]. Авторы использовали светодиодное (длина волны излучения 660 нм) и лазерное (670 нм) низкоинтенсивные излучения при пересадки тканей кожномышечного абдоминального слоя у крыс. При этом определяли процент заживления и уровень кровоснабжения приживляемой ткани. Дозы облучения составляли 0,14 и 2,49 Дж/см2 для лазера и 2,49 Дж/см2 для светодиода. В настоящее время используется несколько методик проведения НИЛТ. Если говорить об излучениях в видимом диапазоне спектра, то это в основном чрезкожное или внутривенное облучение (ВЛОК или лазерная гемотерапия) низкоинтенсивным излучением в красном диапазоне спектра [14, 125]. Однако, в последнее время появились методики по использованию НИЛИ и в других областях видимого спектра. Так в рекомендациях для специалистов в области лазерной медицины предлагается проведение ВЛОК не только традиционным способом (длина волны излучения 635 нм, мощность излучения на конце световода - 1,5 - 2 мВт, время облучения для взрослых 10-20 мин. за сеанс) [13]. Авторы предлагают методику ВЛОК-405, где для облучения используется низкоинтенсивное лазерное излучение в синей области спектра. Интересно, что при той же мощности (1,5 - 2 мВт) рекомендуется меньшая продолжительность сеанса - 2 - 5 мин. Применение этой методики облучения привело к успешному лечению пневмонии. Включение в комплексную терапию больных внебольничной пневмонией НИЛТ сопровождалось нормализацией показателей белка острой фазы воспаления - лактоферрина и улучшением клинического течения заболевания [123]. При этом авторы использовали методику внутривенного 60 лазерного облучения крови низкоинтенсивным излучением в синем диапазоне спектра (405 нм). Мощность излучения составляла 1,5 мВт, время облучения от 2 до 5 минут. Sutalangka C. с соавт. также исследовали действие НИЛИ в синем диапазоне спектра (длина волны 405 нм) [135]. Авторы обнаружили положительную динамику когнитивных свойств у пациентов с болезнью Альцгеймера. Интересно, что было зарегистрировано существенное увеличение активности антиоксидантных ферментов - каталазы и супероксиддисмутазы в гиппокампе на фоне неизменного уровня продуктов окисления липидов (измеряли количество малонового диальдегида). Как уже отмечалось, выбор условий облучения при проведении НИЛТ эмпирический. При этом возможен выбор не только разных длин волн излучения, но и выбор дозы, времени облучения, мощности источника облучения, количества процедур, режима работы лазера (постоянного свечения или импульсного) и др. [11, 13, 14, 38, 136] Существует несколько экспериментальных работ по этой теме, но они не связаны с механизмом действия низкоинтенсивных видимых излучений и потому опять же являются эмпирическими. Так, Guerra Fda R. с соавт. исследовали влияние разных режимов НИЛТ на заживление ахиллова сухожилия у крыс [137]. При этом применяли НИЛИ в разных режимах работы: постоянный и импульсный, а также варьировали диапазон частот в импульсном режиме в разных группах. Авторы обнаружили наибольшее сокращение сроков заживления и ускорение синтеза коллагена в группе, получавшей НИЛТ в импульсном режиме с частотой 20 Гц. Pinfildi C.E. с соавт. исследовали скорость заживления при пересадке ткани (кожно-мышечный абдоминальный слой) у крыс в разных режимах облучения НИЛИ [138]. Облучение проводилось в одной точке приложения или в 24 точках. Кроме того, использовались разные дозы облучения: 3, 72 и 114 Дж/см2. НИЛТ проводили в течении трех дней. В облученных группах авторы наблюдали больший процент приживления тканей, чем в контрольной группе, а также ускорение ангиогенеза и активацию микроциркуляции. При этом 61 наиболее эффективной процедурой оказалось облучение животных в одной точке при дозе облучения 6 Дж/см2. Очень важным является тот факт, что после проведения НИЛТ возможны не только терапевтические, но и побочные эффекты, а так же отсутствие каких-либо эффектов на уровне организма в целом [11-13, 15, 57, 139]. Так, например, при проведении НИЛТ с помощью гелий-неонового лазера у больных с ишемической болезнью сердца [139] проводили исследование изменения процессов перекисного окисления липидов и параметров антиоксидантной защиты крови. В результате было определено три группы пациентов: с положительным эффектом лечения, с отрицательным эффектом и с отсутствием эффектов НИЛТ. Аналогичные изменения наблюдали и при проведении лазерной терапии светом ГНЛ у пациентов с ревматоидным артритом [140]. Именно для решения этой проблемы и необходимо понимание механизма действия низкоинтенсивных видимых излучений и разработка индивидуального способа выбора параметров излучения для достижения терапевтического эффекта. Одной стороной данного вопроса являются противопоказания к НИЛТ, эмпирически определенные практикующими врачами. Так не рекомендуется лазерная терапия пациентам, применяющим антикоагулянты, а также при порфириях, фотодерматозах, гипогликемии, почечной недостаточности, артериальной гипотонии, злокачественные новообразования и др. [13, 14]. Кроме того эмпирически установлено снижение времени облучения (и, соответственно, дозы облучения) для разных возрастных категорий [13, 14, 136]. Другой стороной данной проблемы является низкая эффективность НИЛТ или появление после нее осложнений, что может быть следствием несоблюдения эмпирически подобранных врачами методов низкоинтенсивной лазерной терапии [12, 14]. Необходимо отметить, что даже при соблюдении протокола - возможно получение отрицательного эффекта или отсутствие эффекта вследствие непонимания механизмов действия излучения и, соответственно, в условиях отсутствия индивидуального подхода к выбору параметров облучения. Так, 62 например, лазерная акупунктура является одним из распространенных методов НИЛТ, при котором показана хорошая терапевтическая эффективность [135, 141, 142]. Однако, есть и противоположные примеры. Так, применение НИЛИ методом акупунктуры у пациентов с возрастом более 50-ти лет с хронической болью в коленях терапевтического эффекта не обнаружено [143]. При этом He W. с соавт. отмечают различную эффективность лазерной акупунктуры, проведенной у крыс под контролем электроэнцефалографии и электрокардиографии [144]. Эффект зависел от дозы облучения, акупунктура проводилась интерстициально. Использовалось низкоинтенсивное лазерное излучение в красном диапазоне спектра (длина волны излучения 658 нм, мощность 50 мВт). 2.5.2. Эндотоксический шок как модель для исследования системных эффектов на уровне организма Шок - это сформировавшаяся в ходе эволюции неспецифическая пассивнооборонительная реакция организма на агрессию, которая характеризуется минимизацией жизнедеятельности и угнетением механизмов специфической резистентности в сочетании со стимуляцией систем, обеспечивающих неспецифическую резистентность [145]. При шоке наблюдаются гиповолемия и гипотермия, ведущие в к развитию гипоксии, интенсификации катаболизма углеводов и уменьшением запасов гликогена [145]. В результате активируются другие виды обмена, например, усиливается липолиз. Выброс в активную циркуляцию стрессорных гормонов способствует увеличению активности липаз и фосфолипаз. В результате интенсифицируется перекисное окисление липидов, продукция активных форм кислорода и азота [146, 147]. Повреждаются клеточные мембраны, разобщаются процессы окисления и фосфорилирования. Клетками иммунной системы вырабатываются цитокины и другие медиаторы, инициирующие 63 генерализованную воспалительную реакцию. В результате развивается так называемый синдром полиорганной недостаточности [145]. Наиболее выраженные изменения на клеточном уровне наблюдаются для лейкоцитов, макрофагов и эндотелиальных клеток [148-150]. Их активация и адгезия соответственно приводит к нарушению микроциркуляции и дистрофическим изменениям в тканях (Рис. 1). Из активных форм кислорода и азота наиболее важную роль при шоке выполняет оксид азота [150-154]. Его умеренная продукция в ответ на гипоксию направлена на восстановление кровоснабжения. Однако длительная гипоксия с последующей реоксигенацией тканей приводит к чрезмерной продукции оксида азота. В результате, с одной стороны, происходит накопление пероксинитрита, который вызывает повреждение белков и липидов клеточных мембран, повреждает сосудистый эндотелий, увеличивает агрегацию тромбоцитов и др. [152]. С другой стороны, образуются нитрозильные комплексы ферментов цикла Кребса и дыхательной цепи, что еще больше усугубляет положение. Повышенное образование оксида азота, в частности, вызвано его образованием индуцибельной NO- синтазой в лейкоцитах, предстимулированных в результате развития ПОЛ. Данное предположение подтверждается ингибированием активации данного фермента при использовании антиоксиданта [150, 155]. Известно несколько видов шока в зависимости от особенностей патогенеза: травматический, геморрагический, ожоговый, кардиогенный, анафилактический, эндотоксический и другие [145]. Эндотоксический (или эндотоксиновый) шок чаще всего развивается при инфекции грамотрицательными бактериями (coli, proteus и др.), повреждающими клетки и индуцирующими секрецию биологически активных веществ фагоцитами [145, 156]. При этом наблюдают т.н. дисфункцию фагоцитов крови: первичная активация сменяется угнетением функций этих клеток. В патогенезе эндотоксического шока наблюдается две фазы развития. В первой фазе нарушается микроциркуляция в рамках компенсации основного кровотока. 64 Последующее развитие гипоксии в тканях, увеличение проницаемости сосудов микроциркуляторного русла приводят к гиповолемии, дальнейшему нарушению кровообращения на всех уровнях и развитию полиорганной недостаточности [145, 156]. В терминальной стадии эндотоксический шок приводит к кращ-синдрому и сепсису [145]. В лечении интоксикации при эндотоксическом шоке проводят антибактериальную терапию. Так же для вывода токсинов из крови и лимфы различными методами проводят форсированный диурез. В последнее время все большее распространение получают методы экстракорпоральной детоксикации гемосорбции и плазмафереза [157-160]. Для снижения свободнорадикальных процессов и перекисного окисления липидов - проводят антиоксидантную терапию [145]. Необходимо отметить, что существуют схожие с эндотоксическим шоком состояния - интоксикации (эндотоксемии), строго говоря эндотоксическим шоком не являющиеся, так как зачастую вызываются не бактериальными токсинами. тем ни менее патогенез таких состояний аналогичен эндотоксическому шоку [161]. Например, алкогольная интоксикация (острая или хроническая) при которой панкреонекроз и эндотоксический шок служат основными причинами полиорганной недостаточности и внезапной смерти [162]. Хроническую интоксикацию эндотоксинами наблюдали при карциноме слепой кишки [163]. При этом бактерии кишечника и бактериальные токсины в первую очередь накапливались в лимфатических узлах мезентерия. Liu, A.H. с соавт. считают, что эндотоксинами становятся различные частицы в загрязненном воздухе, например, пыль [164]. В результате у человека развивается хроническая эндотоксиновая интоксикация приводящая к развитию атопических аллергических заболеваний. Также эндотоксиновый шок может быть следствием антибиотикотерапии, при которой бактериальные клетки гибнут и, в результате, высвобождаются компоненты их клеточных стенок [165]. Кроме того, интоксикация эндотоксинами является одним из наиболее опасных факторов в педиатрии [166]. Dholakia, S. с соавт. отмечают, что эндотоксиновая воспалительная реакция 65 развивается у детей с инфекционными и неинфекционными патологиями в тяжелом состоянии. При этом зачастую источник эндотоксина находится в желудочно-кишечном тракте или в легких. Авторы предлагают методику ранней диагностики развития эндотоксического шока, основанную на регистрации функциональной активности клеток лейкоцитарной фракции крови, предстимулированных эндотоксином [166]. Так как эндотоксический шок может быть разной степени выраженности в зависимости от количества бактерий или их компонентов, попавших в организм, подходы к фармакологическому лечению и профилактике такого шока могут несколько варьировать. Так для профилактики развития эндотоксического шока применяют антибиотики, глюкокортикоиды, антикоагулянты и антиагреганты, вазопрессоры (сосудосуживающие средства) и плазмазаменители. В случае же развития эндотоксического шока к этой терапии добавляются кардиотонические и кардиостимулирующие средства, антиоксиданты, противогипоксические средства и др. [145]. Модель экспериментального шока является удобным и перспективным приемом для изучения генерализованных процессов и исследований на уровне целого биологического организма и часто используется в научной практике [149, 154, 155, 167]. При этом становится возможным изучать воздействие различных факторов на микроциркуляцию, функционирование клеток крови, процессы перекисного окисления липидов и изменения антиоксидантного статуса и др. С этой целью в экспериментальных исследованиях используют модель эндотоксического шока, липополисахарида (ЛПС) инициированного - основного введением компонента в внешней организм оболочки грамотрицательных бактерий [146, 149, 168]. Молекула ЛПС большинства грамотрицательных бактерий состоит из иммуногенной полисахаридной части и липидной (липид А). Гидрофобный липид А является основным структурным компонентом и отвечает за биологические свойства ЛПС [169]. 66 Эндотоксин, попавший в кровоток из просвета кишечника или из легких или высвободившийся в процессе инвазивной грамотрицательной инфекции, транспортируется в комплексе со специфическим белком-переносчиком липополисахарид-связывающим белком (LBP) [161, 170]. Кроме того, в транспорте и связывании ЛПС участвуют гликопротеины СD14 - растворимая форма, локализованная в плазме и обеспечивающая взаимодействие ЛПС с эндотелиальными и эпителиальными клетками, и мембраносвязанная, функционирующая в качестве рецептора ЛПС на этих клетках [171]. LBP способствует связыванию эндотоксина с гликопротеинами CD14. Комплекс LBPэндотоксин в присутствии СD14 и других вспомогательных белков взаимодействует с толл-подобным рецептором TLR4 (Рис. 1). В результате образуется сигнальный комплекс, который, в частности, ведет к активации фактора транскрипции NF-kB [147, 161]. Результатом транскрипции становится продукция провоспалительных цитокинов. Фактор некроза опухоли и интерлейкин ИЛ-1 считаются инициаторами цитокинового каскада [161, 169]. Так, моделирование шока введением липополисахарида вызывает значительное увеличение продукции ряда цитокинов в макрофагах: интерлейкина 1α, интерлейкина 1β, интерлейкина 6, интерлейкина 10 и фактора некроза опухолей, а также увеличение продукции белков теплового шока [94, 172]. Воспалительный ответ при эндотоксическом шоке неспецифичен. Так, известно, что воздействие эндотоксина in vivo сопровождается активацией или подавлением экспрессии более, чем 3700 генов [161]. Основным органом, обеспечивающим ответ организма на эндотоксин, является печень. Напрямую гепатоциты с ним не взаимодействуют из-за отсутствия соответствующих рецепторов. Передача сигнала осуществляется посредством действия цитокинов, генерируемых активированными эндотоксином клетками (макрофаги, нейтрофилы, эндотелиоциты, лимфоциты) [173, 174]. Так, Altavilla, D. с соавт., изучая развитие эндотоксического шока у крыс, индуцированного введением ЛПС, наблюдали накопление продуктов окисления 67 липидов (малонового диальдегида) и продукцию фактора некроза опухоли альфа в плазме и сыворотке крови. Кроме того, в гепатоцитах происходило увеличение мРНК фактора некроза опухоли альфа и возрастание активности транскрипционного фактора NF-kB [147]. При этом антиоксидант, аналогичный витамину E, отменял наблюдаемые эффекты. Рис. 1. Возможные пути развития эндотоксического шока в организме. Источник: http://prosepsis.squarespace.com/endotoxin/. (Дата обращения: 31.10.2015 г.) Одним из следствий работы цитокинового каскада при действии ЛПС на клетку является увеличение содержания в ней различных видов белков, приводящих к ферментативному синтезу оксида азота (NO) - NO-синтаз (NOS), приводящим к производству высокого уровня NO [175]. В настоящее время известны три изоформы NOS: нейрональная (nNOS), эндотелиальная (eNOS) и индуцибельная (iNOS) [154, 175]. Образующийся NO играют одну из ведущих ролей в подавлении активности бактериальных и опухолевых клеток путем блокирования некоторых их ферментов, в развитии артериальной гипертензии, нарушении процессов перекисного окисления липидов, нарушении нормальной 68 работы митохондрий клетки, в развитии и поддержании других патологических процессов [176-178]. Характерной особенностью NO является его способность быстро диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и также легко проникать в клетки-мишени. Внутри клетки он активирует одни энзимы и ингибирует другие. Одной из важных мишеней NO является внутриклеточная растворимая гуанилатциклаза [179]. Активация этого энзима сопровождается образованием цГМФ, под влиянием которого происходит релаксация гладкомышечных волокон сосудистой стенки [180, 181]. Продуцируемый в результате активации NOS оксид азота прежде всего предназначен для защиты организма хозяина, он способствует снижению активности пограничных воспалительных клеток, гибели микроорганизмов и внутриклеточных паразитов, тормозя агрегацию тромбоцитов и улучшая местное кровообращение. В то же время, в очаге воспаления накапливается продукт частичного восстановления кислорода – супероксид-анион радикал [179, 182]. Оксид азота и супероксид-анион взаимодействию радикал с подвергаются образованием быстрому медиатора радикал-радикальному окислительного клеточного повреждения - пероксинитрита [152, 183, 184]. С другой стороны, известно, что оксид азота может приводить к увеличению уровня супероксид-анион радикалов за счет инактивации супероксиддисмутазной активности, что показано на перитонеальных макрофагах крыс, стимулированных ЛПС [185]. Соотношение активных форм кислорода и азота, продуцируемых при эндотоксическом шоке во многом определяет характер развития процесса. Так, например, показано, что применение при эндотоксемии препаратов, содержащих супероксиддисмутазу, повышает выживаемость лабораторных животных [186]. 69 2.5.3. Эндотоксический шок и действие низкоинтенсивных лазерного или светодиодного излучений Известно что, НИЛИ способно оказывать защитный эффект в условиях эндотоксического шока, оказывая, в первую очередь противовоспалительный эффект [187, 188]. Так, Новоселова Е.Г. с соавт исследовали влияние предварительного облучения зоны тимуса у мышей светом гелий-неонового лазера (632,8 нм, 0,2 мВт/см2) на активность клеток иммунной системы в условиях эндотоксического шока, моделированного введением ЛПС [172]. В результате происходило значительное увеличение продукции ряда цитокинов в макрофагах: интерлейкина 1 альфа, интерлейкина 1 бета, интерлейкина 6, интерлейкина 10 и фактора некроза опухолей альфа. Однократное воздействие НИЛИ на здоровых мышей не приводило к существенному изменению продукции цитокинов и оксида азота в клетках, но вызывало повышение продукции белков теплового шока. Тем не менее, если мышей облучали низкоинтенсивным красным светом перед введением ЛПС, то происходила заметная нормализация продукции почти всех исследованных цитокинов и оксида азота. Кроме того, при этом наблюдали нормализацию уровня продукции исследованных белков теплового шока. Таким образом, предварительное облучение лазерным светом небольшого участка поверхности кожи животных заметно снижало токсический эффект липополисахарида. Эта же группа авторов исследовала действие НИЛИ (632,8 нм, 0,2 мВт/см2) на функциональную активность изолированных перитонеальных макрофагов и лимфоцитов селезенки мышей [94]. При этом дозу излучения варьировали, меняя время облучения от 5 до 180 с. Было обнаружено, что влияние на синтез цитокинов и оксида азота зависит от дозы облучения. НИЛИ в малых дозах было способно вызывало стимуляцию клеток. Увеличение дозы приводило к отмене или, даже,к ингибирующему эффекту. 70 Buravlev, E. A. с соавт. изучали эффекты низкоинтенсивного лазерного и светодиодного излучений на митохондриальное дыхание при экспериментальном эндотоксическом шоке (инициировали введением липополисахарида B) [189]. Были использованы низкоинтенсивные лазеры, излучающие в синей (442 нм) и зеленой (532 нм) областях и светодиод, излучающий в красной (650 ± 5 нм) области спектра. Авторы обнаружили увеличение дыхательного индекса митохондрий крыс в группах животных с шоком и без после облучения в синей области при дозе облучения (максимальный эффект в группе с шоком и при дозе облучения 6 Дж/см2). Интересно, что для низкоинтенсивных излучений в зеленой и красной областях спектра достоверно значимых эффектов не обнаружено. Такие результаты свидетельствуют о возможном участии в реализации эффектов НИЛИ механизма фотолиза нитрозильных комплексов гемопротеинов [175, 190]. Данный механизм описан в соответствующем разделе, где отмечено, что он сейчас активно исследуется и очень вероятно является одним из механизмов, реализующих эффекты низкоинтенсивных излучений в видимом диапазоне спектра (наиболее вероятно именно в синей области). Кожура В.Л. с сотр. изучали влияние НИЛИ в красном диапазоне спектра на крыс при геморрагическом шоке [191-194]. Геморрагический шок имеет отличную этиологию от эндотоксического, но имеет с ним общие звенья патогенеза, в частности гиповолемию и снижение тканевого дыхания [145]. Кожура В.Л. с соавт. исследовали пути фотоиндуцированной коррекции антиокислительной активности и процессов ПОЛ, которые совместно изменялись при развитии шока в случае кровопотери. Также показаны положительные эффекты НИЛТ на поддержание гемодинамики, системы гемостаза, потребление кислорода миокардом у пациентов с геморрагическим шоком [191-194]. Wu J.Y. с соавт. исследовали влияние низкоинтенсивного лазерного излучения в красном диапазоне спектра (длина волны излучения 660 нм) на воспалительную реакцию культуры стволовых клеток, обработанной ЛПС [195]. Авторы показали, что НИЛИ значительно уменьшает ЛПС-индуцированный 71 воспалительный ответ клеток. Это выразилось в ингибировании синтеза провоспалительных цитокинов (ИЛ-1β, ИЛ-6 и ИЛ-8), циклооксигеназы-2 (фермента, катализирующего образование простагландинов и тромбоксанов) и модулировании активности транскрипционного фактора NF-κB, участвующего в развитии воспалительной реакции. Также авторы наблюдали увеличение концентрации вторичного мессенджера - цАМФ, участвующего в регуляции пролиферации, дифференциации апоптоза и воспаления [195]. При этом известно, что цАМФ может влиять на активность фактора NF-κB [196]. Наиболее эффективной оказалась доза облучения - 8 Дж/см2. Авторы объясняют тем самым противовоспалительное действие НИЛТ. Wang Y. с соавт. исследовали влияние НИЛИ в красном диапазоне спектра (650 нм, 30 мВт/см2) на развитие воспалительных реакций у крыс с экспериментальным маститом, вызванным введением ЛПС [197]. Авторы обнаружили ЛПС-индуцированное увеличение провоспалительных цитокинов (ИЛ-1β и ИЛ-8), экспрессию рецепторов, ответственных за хемотаксис клеток лейкоцитарной фракции в очаг воспаления и адгезию на эндотелиоциты, так же происходило увеличение активности фермента клеток лейкоцитарной фракции миелопероксидазы Все обнаруженные эффекты полностью или частично снимались после низкоинтенсивного лазерного облучения. 72 2.6. Научные теории действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты Механизмы действия излучений в оптическом диапазоне спектра электромагнитных волн - актуальный вопрос низкоинтенсивной лазерной терапии. Эффективность и безопасность действия низкоинтенсивных лазерного и светодиодного излучений в медицине определяется именно молекулярноклеточными, а впоследствии и в целом физиологическими механизмами. Именно эти механизмы до сих пор не установлены окончательно и не связаны с эмпирически подобранными характеристиками НИЛИ для проведения лечения [9, 42]. Такими характеристиками являются длина волны излучения, доза излучения, мощность и режим работы источника излучения, длительность терапевтического сеанса.... Не говоря уже об индивидуальном подходе - учете возраста и пола пациента, сопутствующих заболеваний. В настоящее время предложено несколько теорий о механизмах действия видимого излучения на биологические объекты. 2.6.1. Основные группы теорий действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты Необходимо отметить, что существует несколько теорий о механизмах действия низкоинтенсивного и светодиодного излучений на биологические объекты. Часть из них выдвинуты теоретически, часть - основана на экспериментальных данных. Все теории можно разделить на две большие группы [18]: а) гипотезы, основанные на особых свойствах лазерного излучения (когерентность, поляризованность); б) гипотезы о фотохимическом действии света. 73 В первом случае объектами воздействия предполагаются молекулы воды или крупные Предполагаемые биомолекулы с третичной фотоиндуцированные и четвертичной изменения структурами. чаще являются конформационными. Авторами таких теорий являются Ромоданова Э.А. с соавт. [198], Ho M.W. [199], Корпан М.И. с соавт. [200], Liebert A.D. с соавт. [17] и другие. Так, например, Корпан М.И. с соавт. считают, что первичный механизм действия НИЛИ связан с фотоиндуцированным изменением конформации сывороточного альбумина [200]. Однако в первой группе нет ни одной, учитывающей и описывающей весь комплекс фотоиндуцированных процессов: от молекулы к организму. Так же эта группа теорий не имеет достаточного экспериментального обоснования. В настоящее время предпочтение отдается гипотезам о фотохимическом действии света [18]. Авторами таких гипотез являются Владимиров Ю.А. [18-20], Кару Т.Й. [23, 24, 201], Haas A.F. [202] и другие. Более подробно некоторые из этих гипотез будут рассмотрены в следующем разделе. Важно, что взаимодействие света с веществом является сложным фотобиологическим процессом. Основные этапы такого процесса можно представить следующим образом. [18, 203]: 1) поглощение кванта света; 2) внутримолекулярные процессы обмена энергией (фотофизические процессы); 3) межмолекулярные процессы переноса энергии возбужденного состояния; 4) первичный фотохимический акт; 5) темновые реакции, заканчивающиеся образованием стабильных продуктов; 6) биохимические реакции с участием фотопродуктов; 7) биологический ответ на действие света. 74 Несмотря на то, что НИЛТ широко используется более полувека, до сих пор нет полной теории, описывающей все перечисленные выше этапы. Это и является причиной того, что в некоторых странах НИЛИ применяется в ограниченных областях или не применяется вовсе. В настоящее время накоплено множество разрозненных данных об эффектах НИЛИ на каждом из этапов. Выдвинуто несколько, заслуживающих внимания теорий о механизмах НИЛТ. Но нет общепризнанной, теоретически и экспериментально подтвержденной теории о молекулярно-клеточном механизме действия НИЛИ, учитывающей и охватывающей все процессы - от поглощения кванта света до биологического ответа. В данной работе представлена такая теория - фотодинамическая теория действие низкоинтенсивного лазерного излучения. В следующих разделах будут рассмотрена данная теория и другие современные теории о механизмах действия низкоинтенсивного и светодиодного излучений на биологические объекты. 2.6.2. Современные теории действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты Гипотезы о механизмах действия низкоэнергетического видимого излучения на живые организмы выдвигались практически сразу после начала использования НИЛИ в медицине. Тем ни менее в настоящее время накоплено достаточно данных о различных эффектах НИЛИ на биологические объекты. Это позволило нескольким группам авторов предложить свои теории о механизмах НИЛТ. Отметим сразу - действие низкоинтенсивных излучений видимого диапазона спектра может определяться не единственным молекулярно-клеточным механизмом, а несколькими и соответственно несколькими первичными фотоакцепторами. Можно предположить, что роль того или иного фотоакцептора зависит от параметров излучения и исходного состояния биологического объекта. В данном разделе мы рассмотрим наиболее известные и требующие внимания гипотезы. 75 Одним из наиболее известных исследователей в этой области является представитель российской науки - профессор Кару Т.Й. Так, Кару Т.Й. считает, что первичным фотоакцептором при НИЛТ является цитохром c оксидаза [23, 201, 204], которая имеет пики поглощения в синей, красной и инфракрасной областях оптического диапазона спектра электромагнитных волн [204-206]. При этом в красной и инфракрасной областях наблюдаются пики поглощения при 760 нм (инфракрасная область) для восстановленной формы фермента и при 665 нм для окисленной формы [204]. Известно, что цитохром с оксидаза является важнейшим ферментом, катализирующим восстановление кислорода в цепи окислительного фосфорилирования [207]. Кару Т.И. предполагает лазер-индуцированную реактивацию этого фермента после восстановления его в условиях гипоксии. В результате увеличивается трансмембранный потенциал митохондрий, увеличивается продукция АТФ в клетках и транспорт кальция. Все это ведет к стимуляции внутриклеточных процессов. Согласно этой теории и, учитывая пики поглощения этого фермента, может быть объяснимо действие НИЛИ в инфракрасном диапазоне спектра, но непонятен механизм влияния на цитохром c оксидазу при облучении в красной области спектра. Кроме того, основным экспериментальным доказательством данной теории является совпадение спектров действия НИЛИ в красном и инфракрасном диапазонах спектра на синтез ДНК и РНК, пролиферацию культур клеток, бактериальных клеток и дрожжей со спектром поглощения цитохром с оксидазы [22, 201, 204]. Однако измеренный спектр действия НИЛИ по синтезу нуклеиновых кислот и по пролиферации клеток может не иметь прямого отношения к лазер- индуцированной конформационной перестройке цитохром с оксидазы и нормализации функционирования митохондрий. Утверждать это можно только после прямого цитохромоксидазы экспериментального с, как первичного доказательства фотоакцептора роли при именно действии низкоинтенсивных излучений видимого диапазона спектра. К сожалению, механизм фотореактивации цитохром с оксидазы митохондрий остается малоизученным. 76 Кроме того, наблюдаемые процессы могут быть вторичными, а первичные процессы возможно связаны с любым другим вероятным первичным фотоакцептором. С другой стороны, существует и другая возможность регуляции уровня активности дыхательной цепи митохондрий, основанная на взаимодействии оксида азота с цитохромами. Эта гипотеза, называемая гипотезой фотолиза нитрозильных комплексов гемопротеинов, будет рассмотрена в этом разделе далее. Так же с помощью гипотезы о фотоиндуцированной конформационной перестройке цитохромоксидазы с трудно объяснить дистанционность и пролонгированность эффектов НИЛИ, отмечаемых в клинике [16]. Данная гипотеза очевидно требует экспериментальных подтверждений на тканевом и организменном уровнях исследования, а также необходимы прямые эксперименты с доказательством роли именно цитохром с оксидазы. тем ни менее гипотеза представляет большой интерес и перспективу развития. Авторы другой гипотезы - Haas A.F. [202] и авторы некоторых других исследований [54, 195, 208] предполагают ключевую роль NF-κB фактора при действии НИЛИ. Хотя сам этот фактор не предполагается в качестве первичного фотоакцептора, тем ни менее он представляется, с точки зрения авторов, ключевым фактором в механизмах НИЛТ. Транскрипционный (ядерный) фактор NF-κB - универсальный фактор транскрипции, контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла. NF-kB активируется целым рядом стимулов, включая цитокины, бактериальные и вирусные продукты (например, липополисахарид), активные формы кислорода. В цитоплазме клетки NF-kB находится в неактивном состоянии. Стимулирующий агент приводит к высвобождению NF-kB от ингибирующего комплекса, транслокации в ядро и активации транскрипции контролируемых генов [209]. Haas A.F. c сотр. показали, что NF-κB активируется в кератиноцитах человека как при раневом процессе, так и при облучении гелий-неоновым лазером, так и при сочетанном воздействии [202]. Авторы сделали вывод, в частности, что при облучении образуются 77 продукты окисления, аналогичные тем, что появляются в ране. И эти продукты (вероятно, активные формы кислорода) уже активируют транскрипционный фактор. Wu J.Y. с соавт. показали, что НИЛИ значительно уменьшает эффект липополисахарида на роль NF-κB в развитии воспалительной реакции в культуре стволовых клеток [195]. При этом использовался полупроводниковый лазер (660 нм), наиболее эффективная доза составляла 8 Дж/см2 (эксперименты in vitro). Авторы объясняют тем самым противовоспалительное действие НИЛТ. Аналогичные результаты получил Lim W. с сотр. на фибробластах человека при использовании НИЛИ с длиной волны 635 нм (доза составляла 18 Дж/см2, эксперименты in vitro). При этом изучалась роль и низкомолекулярного белка теплового шока HSP 27. Было показано координированное изменение активности этого белка и NF-kB при облучении светом. Авторы предполагают, что фотоиндуцированное действие на транскрипционный фактор происходит опосредованно через HSP 27. Известно, что данный белок активируется при действии множества стрессовых факторов, в частности при увеличении уровня АФК [210]. Гипотеза, рассматривающая роль ядерного фактора NF-kB, заслуживает большого внимания, так как теоретически и экспериментально обоснована. Однако, главный недостаток данной теории - отсутствие первичного фотоакцептора. Тем ни менее, вероятно, она составляет один из вторичных механизмов действия НИЛИ. Так Agrawal T. с соавт. по сути объединяют теории реактивации цитохромоксидазы и последующей цепи процессов активации NF-kB [10]. При этом авторы отмечают, что данный механизм возможен только для дальней красной и инфракрасной областей оптического спектра (длина волны более 650 нм). В конце данного раздела рассмотрим три гипотезы о механизмах действия НИЛИ на биологические объекты, предложенные в 1994 г. академиком РАН, д.б.н. профессором Владимировым Ю.А. [20]. Академик Владимиров Ю.А. широко известен своими работами в фотобиологии. 78 Рис. 2. Три гипотезы о механизмах действия НИЛИ на биологические объекты, предложенные Владимировым Ю.А. Итак, гипотезы, предложенные Владимировым Ю.А., предполагают: фотолиз нитрозильных комплексов, реактивацию СОД и фотодинамическое действие (Рис. 2). Рассмотрим данные гипотезы более подробно. Одна из трех гипотез предполагает фотолиз нитрозильных комплексов гемопротеинов и негемовых соединений. Известно, что нитрозильные комплексы различных гемопротеинов поглощают в видимой и инфракрасной областях спектра [175, 211]. Осипов А.Н. с соавт. показал светочувствительность комплексов NO с гемоглобином и цитохромом с, при этом высвобождается окись азота [19, 190, 212]. Окись азота, как известно, обладает сосудорасширяющим действием. А фотолиз комплексов цитохромов и цитохром с оксидазы с NO приводит к восстановлению дыхания митохондрий и синтеза АТФ [18, 19]. В настоящее время данный механизм активно изучается и обсуждается в научной литературе, как один из перспективных. Однако требуется проведение дальнейших экспериментов по изучению данного механизма в условиях облучения в красной области спектра, которая получила наибольшее распространение в клинической практике. Так достаточно много данных по исследованию механизма фотолиза нитрозильных комплексов гемопротеинов при облучении в синей и зеленой [189, 212-214], а также в инфракрасной областях спектра. При этом практически нет данных по реализации данного механизма после облучения в красной области спектра, а имеющиеся данные противоречивы. 79 Так Buravlev E.A. с соавт. не обнаружили восстановления митохондриального дыхания в митохондриях печени крысы при облучении митохондрий светодиодом с длиной волны облучения 650 нм [189, 214]. Однако облучение митохондрий синим лазером (длина волны излучения 442 нм) приводило к восстановлению данного процесса. Авторы определили, что это происходит за счет восстановления транспорта электронов в комплексе IV дыхательной цепи, где основную роль играет цитохром с оксидаза. С другой стороны, Кару Т.Й. получила спектр действия роста и пролиферации культуры клеток при облучении в красной области спектра, коррелирующий со спектром поглощения цитохром с оксидазы [201]. Следовательно, гипотеза фотолиза нитрозильных комплексов представляет большой интерес, но требует дальнейших исследований. Суть другой гипотезы - реактивации СОД лежит в механизме инактивации и фотореактивации Cu-Mn-супероксиддисмутазы (СОД) в кислой среде [215]. Считается, что кислотность среды, а следовательно, и активность СОД уменьшаются в очагах нарушения нормальной жизнедеятельности клеток [18, 19]. Облучение в красной области спектра приводит к восстановлению активного центра фермента и его активности. При этом восстанавливается способность СОД уменьшать концентрацию супероксидного радикала, который постоянно образуется в условиях патологии. Супероксидный радикал восстанавливает железо до свободного двухвалентного иона, ведущего впоследствии к образованию новых свободных радикалов [216]. Кроме того, супероксидный радикал, взаимодействуя с окисью азота, приводит к образованию пероксинитрита, обладающего цитотоксическим и сосудосуживающим действием [19]. В настоящее время известно три основных вида фермента СОД в биологических объектах - цитозольная, митохондриальная и внеклеточная [217]. Кроме того, важно учитывать утилизацию супероксид-анион радикала в различных свободнорадикальных реакциях, например, в реакции образования пероксинитрита. 80 Необходимо отметить, что гипотеза реактивации СОД, как и исследования фотоиндуцированного изменения СОД-активности, вполне могут рассматриваться среди прочих, однако она не получила широкой теоретической и экспериментальной поддержки. Тем ни менее все три механизма вполне могут опосредовать световое воздействие на биологические объекты, дополняя друг друга и проявляясь больше или меньше в различных условиях (например, при использовании оптических источников с различными длинами волн) [18]. Фотодинамический механизм подробно будет рассмотрен в следующем разделе. 2.6.3. Фотодинамическая теория действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты Данная работа посвящена исследованию именно фотодинамического механизма действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты. Как уже было отмечено выше, фотодинамическая теория была одной из трех, предложенных Владимировым Ю.А. в 1994 году [20]. Согласно данной гипотезе низкоинтенсивное лазерное излучение оказывает фотодинамическое действие, в частности, на мембраны фагоцитов, что сопровождается увеличением её проницаемости и, как результат, возрастанием концентрации внутриклеточного кальция, что в итоге и приводит к активации этих клеток [20, 218]. Первичными акцепторами лазерного излучения в этом случае могут выступать эндогенные порфирины [90, 218, 219]. Эндогенные порфирины присутствуют в биологических тканях и жидкостях, их количество возрастает при различных патологических состояниях [203], в том числе при воспалении [126, 220]. 81 Фотодинамическое действие заключается в инициировании свободнорадикальных реакций фотосенсибилизатором в присутствии кислорода в среде. Это приводит к инициированию последующих механизмов на молекулярно-клеточном, тканевом и организменном уровнях. Такими реакциями могут быть инициация синтеза белков и цитокинов, увеличение бактерицидности, активация пролиферации клеток [19]. В результате мы можем наблюдать такие клинические эффекты, как заживление ран, улучшение микроциркуляции, иммуномодуляция и другие [19]. Преимущества рассматриваемой гипотезы - это возможность: • учесть все уровни организации биологических объектов: от клеточного до организменного (Рис. 3), • понять взаимосвязь первичных и финальных этапов терапевтического воздействия, • объяснить причину развития как положительных, так и отрицательных эффектов лечения, • определить природу первичного акцептора кванта излучения, • разработать методику, позволяющую перейти от эмпирического подбора доз при лазерной и светодиодной терапии - к научно обоснованному. Рис. 3. Гипотеза фотодинамического механизма НИЛИ позволяет учесть все уровни организации биологических объектов: от клеточного до организменного 82 Итак, суть гипотезы о фотодинамическом механизме действия низкоинтенсивных лазерного и светодиодного излучений на биологические объекты заключается в том, что в результате поглощения кванта излучения эндогенным хромофором (фотосенсибилизатором) в присутствии кислорода инициируется образование свободных радикалов, индуцирующих перекисное окисление липидов (ПОЛ) клеточных мембран [20, 221]. Перекисная модификация липидной фазы может приводить, в частности, к увеличению ионной проницаемости мембраны, в том числе для ионов Cа2+ [18, 20, 86-88]. Последующие за увеличением концентрации внутриклеточного кальция экспрессия ряда генов и активация различных ферментов лежит в основе стимулируемого излучением лазера процесса активации, трансформации и пролиферации различных клеток [20, 83]. Чрезмерный же приток Са2+ в клетку, что может происходить при больших концентрациях ФС, приводит к подавлению функциональной активности клеток [27, 83, 84, 88]. Фотосенсибилизированные реакции подробно описаны в классических фотохимических исследованиях ХХ века. Признанными авторами являются Foot C.S. [222, 223], отечественные ученые Теренин А.Н. и Красновский А.А. [224-228], а также Красновский А.А. мл. [229-231]. При фотодинамическом процессе фотосенсибилизированные реакции происходят в присутствии кислорода (О2) и, чаще всего, с участием триплетного возбужденного состояния фотосенсибилизатора (3S*) В этом случае биологическое действие света называется фотодинамическим [18, 88]. Фотодинамический эффект описан еще в начале прошлого века [232]. Немецкий ученый O. Raab, работая в лаборатории Мюнхенского фармакологического института под руководством директора H. von Tappeiner, облучал инфузорий дневным светом в присутствии различных веществ (в частности красителей акридина и эозина). Результатом эксперимента была гибель инфузорий. При этом их облучение без красителя или инкубация в темноте с красителем - к гибели не приводили. H. von Tappeiner предложил использовать 83 термин "фотодинамическая реакция" при описании фотохимической реакции, в которой пигмент, поглощая излучение в присутствии кислорода, приводит к гибели биологического объекта [40]. В настоящее время известно, фотосенсибилизированные что эндогенными свободнорадикальные или реакции, экзогенными фотосенсибилизаторами, в присутствии кислорода могут инициироваться двумя путями, называемыми реакциями первого и второго типов [18, 88, 233]. Кроме этих реакций, после поглощение кванта света и перехода в возбужденное состояние - ФС может претерпевать внутреннюю тепловую конверсию или излучать квант люминесценции [234]. Рассмотрим подробнее фотосенсибилизированные реакции 1-го и 2-го типов. 1) Реакции 1-го типа - через стадию образования радикалов, без первоначального взаимодействия с молекулярным кислородом: S + hv → 1S* → 3S* + RH → R•+ SH• → S− • + H+ 2, где S - фотосенсибилизатор, 1S*и 3S* - синглетное триплетное возбужденное состояние соответственно, RH - субстрат (молекулы клетки, с которыми сталкивается фотосенсибилизатор). Реакции 1-го типа приводят, в частности, к образованию супероксидного анион-радикала (O2.-): S− • + O2 → O2− • + S 3. В основе патогенного действия O2.- лежат, по-видимому, две реакции: образование ионов двухвалентного железа (из трехвалентного) и связывание оксида азота (NO.) [19, 20, 86, 88, 216]. Ионы Fe2+, вступая в реакции с перекисью водорода, гипохлоритом и гидроперекисями липидов - инициируют образование высокореактивного гидроксильного радикала (HO.) и свободнорадикальное 84 цепное окисление липидов. HO., взаимодействуя с белками, приводит к их денатурации, а с нуклеиновыми кислотами - к мутагенным и летальным эффектам. 2) Реакции 2-го типа - через стадию образования синглетного кислорода (1О2), т.е. после первоначального взаимодействия с молекулярным кислородом: S + hv → 1S*→ 3S*→ 3S* + 3O2 → S + 1O2. 1 4. О2 образуется вследствие столкновения ФС в триплетном состоянии с молекулой кислорода и передачи ей энергии электронного возбуждения [18, 233]. В случае реакций 2-го типа, образовавшийся 1О2 затем окисляет органические соединения [216, 233], взаимодействуя с сильно замещенными углеродными атомами при двойных связях или с функциональными группами, характеризующимися высокой электронной плотностью [235]. Так 1О2 реагирует с основными остатками белков, полиненасыщенными жирными кислотами и холестерином, приводит к инактивации различных ферментов и повреждает ДНК, инициирует ПОЛ (например, липидов клеточных мембран) [18, 39, 216, 236]. Так, например, процесс фотосенсибилизаторами фотосенсибилизированного (например, производными экзогенными порфиринов и фталоцианинов) ПОЛ широко описан в литературе [221, 236-240]. Так еще в 1974 г. Пеленицын А.Б. с соавт описали процесс фотосенсибилизированного порфиринами ПОЛ мембран эритроцитов при фотоиндуцированном гемолизе [221]. Считается, что при облучении биологического объекта одновременно протекают реакции и 1-го, и 2-го типов [234]. Какой из них превалирует в биологической ткани - определить очень сложно т.к. свободные радикалы и синглетный кислород обладают малым временем жизни. Тем ни менее Красновскому А.А. мл. с соавт удалось в разных системах доказать генерацию синглетного кислорода в реакциях, фотосенсибилизированных порфиринами [241, 242]. 85 Если вернуться к НИЛИ, то согласно фотодинамической теории механизма действия низкоинтенсивного лазерного или светодиодного излучения такие же процессы происходят в организме, но при участии эндогенных фотосенсибилизаторов. Так, в результате поглощения эндогенным ФС кванта лазерного или светодиодного излучения может образовываться, например, синглетный кислород и инициироваться, в частности, перекисное окисление липидов мембран клеток, сопровождающееся дальнейшим повышением концентрации кальция в цитоплазме и изменением активности фагоцитов. В рамках рассматриваемой гипотезы фотодинамического действия низкоинтенсивного излучения видимого диапазона остается неизвестной природа акцептора лазерного излучения. В данной работе в качестве первичных хромофоров предложены эндогенные порфирины. Так, например, представляют интерес работы Fraikin G. Y., Strakhovskaya M. G., Rubin A. B. с соавт. [243-245]. Авторы исследовали воздействие видимого света (400 - 600 нм) на два вида дрожжей (Candida guilliermondii и Saccharomyces cerevisiae). Было обнаружено, что облучение микроорганизмов без экзогенного ФС приводило к снижению выживаемости и последующей гибели колоний клеток [245]. Летальный эффект строго зависел от присутствия кислорода в среде, что авторы связывают с тем, фотосенсибилизированные что в основе эндогенными поражения ФС реакции. дрожжей лежали Гибель клеток коррелировала с накоплением ТБК-активных продуктов окисления липидов плазматической мембраны дрожжей. Методом спектрофлуориметрии в мембранах исследуемых клеток определили достаточно высокое содержание эндогенных порфиринов (0,1 ∗ 10-9 моль порфиринов/1 мг белка плазматической мембраны теней дрожжей), которые авторы и считают эндогенными ФС. Искусственное увеличение количества эндогенных порфиринов с помощью 2,2'дипиридила приводило к усилению обнаруженных эффектов [243, 244]. Необходимо отметить, что в нашей лаборатории уже экспериментально доказаны некоторые этапы гипотезы фотодинамического механизма действия 86 низкоинтенсивного когерентного лазерного излучения на биологические объекты и модели (эритроциты, лейкоциты, липосомы). Нами показаны этапы, начиная от запуска процессов окисления липидов (за исключением собственно мембранных липидов фагоцитов), фотоиндуцированного изменения концентрации внутриклеточного кальция в лейкоцитах и заканчивая последующей активацией лейкоцитов [25, 27, 32, 90]. Также мы учли, что мишенью фотосенсибилизированного ПОЛ может быть не только мембрана клеток, но и, например, липопротеины плазмы крови. Кроме того, долгоживущие продукты окисления липидов (это могут быть, например, продукты окисления липидов липопротеинов) способны инициировать ПОЛ в мембранах клеток [77, 89]. Участие липопротеинов плазмы крови в индуцированном НИЛИ увеличении активности фагоцитов нами также было показано ранее [25, 28]. Кроме исследований нашей лаборатории, существуют и другие теоретические предположения и экспериментальные доказательства основных этапов реализации фотодинамического механизма действия низкоинтенсивных излучений видимого диапазона. Так, Lubart R. и Friedmann H. поддерживают гипотезу о фотодинамическом механизме действия света, утверждая, что НИЛТ и ФДТ взаимосвязаны единым фотосенсибилизированным механизмом, который приводит к разным эффектам (от стимуляции к ингибированию) при разных дозах облучения и в зависимости от содержания эндогенных ФС [246]. В качестве эндогенных фотосенсибилизаторов авторы предлагают обсуждаемые в литературе цитохромы, флавины, порфирины и НАДН. Kushibiki T с соавт., проведя анализ литературы, делают вывод о единых механизмах действия низкоинтенсивных излучений и излучений с большей интенсивностью, которые используются для проведения фотодинамической терапии с фотосенсибилизаторами [247]. Авторы считают, что ключевым механизмом является воздействие на митохондриальную РНК. При этом излучения с низкой интенсивностью ведут к активации митохондриального 87 дыхания, а с высокой - к угнетению и последующему апоптозу. Интересно, что авторы отмечают исчезновение терапевтических эффектов НИЛИ при увеличении дозы облучения. Кроме того, имеются экспериментальные доказательства, подтверждающие влияние видимых излучений на процессы перекисного окисления липидов [110, 221, 245], продукцию АФК [1, 66, 109, 248], изменения концентрации кальция [64, 65, 249] и функциональной активности фагоцитов [63, 94, 188, 250-252]. Так, Lavi R. с соавт методом ЭПР исследовали фотоиндуцированную продукцию АФК в мембранах изолированных сперматозоидов [109]. Исследователи показали важную роль клеточной мембраны в эффектах низкоинтенсивного облучения. В качестве источника излучения использовали широкополосную лампу с длинами волн от 400 до 700 нм, Длины волн излучения при этом варьировали с помощью системы оптических фильтров. Мощность излучения составляла от 40 до 130 мВт/см2. Авторы показали фотоиндуцированное накопление АФК в мембранах клеток. Интересно, что синий свет оказался более эффективным, чем красный при облучении неденатурированных мембран. В денатурированных образцах мембран действие низкоинтенсивного видимого излучения разных диапазонов не отличалось и приводило примерно к одинаковому возрастанию уровня АФК. Кроме того, авторы показали эффективность немонохроматического низкоинтенсивного видимого излучения. При проведении лазерной терапии с помощью гелий-неонового лазера у больных с ишемической болезнью сердца [139] проводили исследование изменения процессов перекисного окисления липидов в крови. Обнаружили, что в группе пациентов с положительным эффектом НИЛТ происходило снижение концентрации диеновых коньюгатов в плазме, однако при этом повышалась антиокислительная активность плазмы крови. У пациентов на которых в клинических проявлениях лазерная терапия не повлияла - наблюдали увеличение как концентрации диеновых коньюгатов, так и антиокислительной активности 88 плазмы крови. В группе же больных на состояние которых НИЛТ повлияла отрицательно (увеличилось число приступов стенокардии, уменьшилась толерантность к физической нагрузке и т. п.) наблюдали возрастание концентрации диеновых коньюгатов и снижение антиокислительной активности плазмы крови. Аналогичные изменения наблюдали и при проведении лазерной терапии светом ГНЛ у пациентов с ревматоидным артритом [140]. Хорошо доказанным фактом является возрастание уровня внутриклеточного кальция после ЛО различных клеток в присутствии и без экзогенных ФС, применяемых для проведения фотодинамический терапии [249, 253-256]. Так облучение культур клеток яичника китайского хомячка и карциномы мочевого пузыря человека красным светом в присутствии экзогенных ФС: фталоцианина алюминия и производного гематопорфирина приводило к увеличению концентрации кальция в цитоплазме исследуемых клеток [256]. Результаты экспериментов с бескальциевым буфером и хелаторами кальция позволили авторам заключить, что вход Са2+ в клетки происходил из внешней cреды. Облучение каудальной артерии и аорты крысы НИЛИ в красном диапазоне спектра в присутствии производного гематопорфирина и внеклеточного кальция приводило к длительному сокращению гладких мышц сосудов. В бескальциевой среде или в присутствии блокаторов кальциевых каналов (верапамила и нифедипина) такого эффекта не наблюдали. Лазер-индуцированное сокращение миоцитов зависело от содержания кислорода и сопровождалось накоплением ТБК-активных продуктов окисления липидов [254, 257]. При облучении клеток глиомы белым светом в присутствии производного гематопорфирина наблюдали увеличение Са2+ в цитоплазме. Вход кальция зависел от дозы облучения, концентрации ФС и концентрации внеклеточного кальция [255]. 89 Lubart R. с соавт. [249] показали, что облучение светом ГНЛ сперматозоидов быка приводит к увеличению содержания Са2+ в цитоплазме клеток, при этом не использовались экзогенные ФС. Изменение концентрации кальция в клетке ведет к изменению ее активности. Как уже отмечалось выше, в рамках гипотезы о фотодинамическом действии лазерного и светодиодного излучений особенная роль выделяется таким клеткам, как лейкоциты и макрофаги. Мы рассмотрели работы, посвященные исследованию фотоиндуцированного изменения активности этих клеток в соответствующем разделе. Однако, с точки зрения роли фотосенсибилизаторов в изменении активности лейкоцитов и макрофагов после облучения лазером или светодиодом, представляют интерес работы, посвященные этой теме. Ранее в нашей лаборатории под руководством профессора Клебанова Г.И. изучено влияние фотосенсибилизаторов на изменение активности клеток лейкоцитарной фракции крови человека при действии низкоинтенсивного лазерного излучения в красном диапазоне оптического спектра [25, 28, 32, 90]. Было обнаружено изменение функциональной активности клеток лейкоцитарной фракции крови человека в ответ на облучение гелий-неоновым лазером [32, 258]. Функциональную активность клеток оценивали методом люминол-зависимой хемилюминесценции при стимулировании зимозаном. Облучение проводили в интервале доз от 0,025 до 0,5 Дж/см2. При этом использовали клетки лейкоцитарной фракции, выделенные из крови пациентов с бронхолегочными заболеваниями. Оказалось, что в случае острой пневмонии происходит увеличение активности клеток, с достижением максимума в интервале доз 0,05 - 0,1 Дж/см2. При этом в случае бронхита эффект не наблюдали. Однако облучение суспензии клеток в присутствии экзогенного фотосенсибилизатора - "Фотосенса" (8,65 нМ) приводило к модифицированному ответу. Так, в случае острой пневмонии заметного увеличения активности клеток 90 уже не происходило, а при дозе 0,125 Дж/см2 наблюдалось даже снижение активности клеток лейкоцитарной фракции. Тогда как в случае бронхита при малых дозах облучения (0,05 Дж/см2 -0,075 Дж/см2) происходило увеличение функциональной активности клеток, а при возрастании дозы облучения (0,125 и 0,25 Дж/см2) - активность клеток угнеталась. Авторы предполагают, что различные эффекты низкоинтенсивного лазерного излучения на один и тот же тип клеток обусловлен различным содержанием эндогенных хромофоров в них. Кроме того, существует большое количество работ, посвященных механизмам фотодинамической терапии, в которых большое внимание уделяется лейкоцитам и макрофагам, как одним из определяющих клеток в фотосенсибилизированных реакциях [259-263]. Необходимо отметить, что при обсуждении механизмов поражения патологических очагов при ФДТ обсуждается три основных направления: 1) некроз и апоптоз клеток-мишеней в результате действия АФК, образовавшихся в фотосенсибилизированных реакциях; 2) разрушение сосудов микроциркуляторного русла по той же причине; 3) развитие воспалительной реакции, вследствии активации лейкоцитов и макрофагов [260, 261, 264, 265]. Reeves K.J. с соавт., Castano A.P с соавт. [259-261] полагают, что именно изменение активности лейкоцитов в процессе фотодинамической терапии определяет уровень окислительного стресса, продукции активных форм кислорода и азота, факторов воспаления и др. Mitra S. с соавт., при изучении механизмов поражения тканей при ФДТ, показали хемотаксис, активацию лейкоцитов в опухоли и выброс эластазы, определяющей ее разрушение [263]. Debefve E. с соавт. показали ведущую роль лейкоцитов в нарушении проницаемости сосудов при проведении ФДТ в результате взаимодействия с эндотелием[262]. 91 2.7. Порфирины, как возможные первичные фотоакцепторы при действии низкоинтенсивного излучения в видимом диапазоне Данный раздел посвящен порфиринам, как возможным эндогенным фотосенсибилизаторам, участвующим в процессах, реализующих терапевтические эффекты лазерного и светодиодного излучений. 2.7.1. Порфирины в организме человека Выше уже указывалось, что вопрос о природе акцептора низкоинтенсивного лазерного или светодиодного излучений остается открытым. В данном исследовании в качестве первичных фотоакцепторов предлагаются эндогенные порфирины. Порфирины - соединения из группы тетрапирролов. Основу их молекулы составляет кольцо порфина, включающее 4 пиррольных кольца, соединенных друг с другом метиновыми группами (Рис. 4). Рис. 4. Структурная формула протопорфирина IX Порфирины являются промежуточными продуктами на пути биосинтеза важных биологических субстратов. В различных соединениях с железом, магнием, кобальтом и с другими металлами они широко распространены в животном и растительном мире [266, 267]. 92 СУКЦИНИЛ-СоА + ГЛИЦИН Синтетаза АЛА АМИНОЛЕВУЛИНОВАЯ КИСЛОТА Дегидраза АЛА ПОРФОБИЛИНОГЕН Декарбоксилаза порфобилиногена Косинтетаза УРОПОРФИРИНOГЕН III УРОПОРФИРИН III Уропорфириногендекарбоксилаза КОПРОПОРФИРИНОГЕН III КОПРОПОРФИРИН III Декарбоксилаза копропорфириногена Целостность ПРОТОПОРФИРИНОГЕН IX Оксидаза протопорфириногена О2 Целостность ПРОТОПОРФИРИН IX + ЖЕЛЕЗО рН 7.4 Целостность митохондрий Феррохелатаза ГЕМ Нормальное протекание окислительного Рис. 5. Основные этапы синтеза гема. На схеме обозначены условия для нормального протекания тех реакций в цепи синтеза гема, блокирование которых в условиях патологии может приводить к накоплению различных порфиринов в организме 93 Синтез порфиринов происходит в каждой клетке живого организма, где они могут быть в свободном и связанном состоянии [266]. Образуя комплексы с ионами железа, порфирины входят в состав простетических групп хромопротеинов (гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов и др.) [267, 268]. Кроме того, существуют комплексы порфиринов с медью, ванадием, цинком, марганцем, кобальтом, никелем, оловом, алюминием, серебром, натрием, калием [126, 266]. Наиболее важной функцией, выполняемой порфириновыми комплексами, является их участие в таких процессах метаболизма, как биологическое окисление и транспорт кислорода. В процессе биологического распада порфириновых белковых пигментов высвобождаемый протопорфирин превращается в желчные пигменты. Некоторые порфирины (уро- и копропорфирины) выводятся из организма с мочой и калом [269]. Все соединения из группы порфиринов характеризуются интенсивной полосой поглощения с максимумом около 400 нм. Так же в видимой области спектра чаще всего наблюдаются менее интенсивные четыре полосы, расположенные между 480 и 700 нм. В водных растворах многие порфирины могут агрегироваться, образуя ди- и олигомеры [266, 267]. Все порфирины флуоресцируют в области от 580 до 700 нм [270, 271]. Фотохимия и спектральные свойства порфиринов довольно хорошо изучены. Одними из первых работ, посвященных флуоресценции хлорофилла (являющегося производным протопорфирина) были исследования Kautsky H. в 40 - 60-е года XX века [272, 273]. Большой вклад в исследование фотохимии и спектральных свойств порфиринов и соединений порфиринового происхождения внесли российские ученые Красновский А.А. [274-276] и Красновский А.А. мл. [230], Гуринович Г.П. [277]. Биосинтез порфиринов необходим для каждой клетки живого организма. Основные этапы синтеза гема демонстрируют некоторые пути образования эндогенных порфиринов (Рис. 5). Исходными метаболитами для синтеза 94 протопорфиринов являются сукцинил СоА и глицин. В ходе реакции образуется аминолевулиновая кислота (АЛА) [266, 267]. Cинтез АЛА осуществляется в митохондриях и катализируется синтетазой АЛА. Аминолевулиновая кислота используется для индукции синтеза фотодинамической терапии [278, порфиринов 279]. in vivo, Структурная например, формула в 5- аминолевулиновой кислоты представлена на Рис. 33. Вторым этапом синтеза порфиринов является образование порфобилиногена, катализируемое дегидразой АЛА, которая находится в цитоплазме. Далее происходит ряд превращений порфобилиногена под действием ферментов, локализованных в цитоплазме на внутренней мембране что приводит к образованию протопорфириногена IX [267]. Протопорфириноген IX, в свою очередь, под действием оксидазы протопорфириногена - фермента, локализованного на внутренней мембране превращается в протопорфирин IX. Для нормального протекания этой реакции необходим кислород. Соли в высокой концентрации подавляют образование протопорфирина IX. Последняя реакция в биосинтезе гема - включение железа в протопорфирин - катализируется ферментом феррохелатазой (гемсинтетазой), локализованной в митохондриях на внутренней поверхности внутренней мембраны [266, 268]. Активность фермента зависит от состояния липидов внутренней мембраны, а также от состояния окислительного фосфорилирования, благодаря которому ионы железа и кальция проникают в митохондрии [266]. Фиксация готового гема на молекулах соответствующих апобелков завершает синтез гемопротеинов: гемоглобина, миоглобина, различных цитохромов и ряда ферментов, включая каталазу и пероксидазу [269]. До стадии образования протопорфирина IX биосинтез во всех клетках одинаков. Затем в различных клетках в зависимости от их специализации 95 образуются различные производные, которые, соединяясь с белками, формируют функционально активные молекулы ферментов [267]. При гибели и старении клетки порфирины и их предшественники попадают в плазму крови [266]. Анализируя условия синтеза гема в здоровом организме, можно предположить, что различные патологические состояния могут нарушать нормальное образование гема и приводить к накоплению промежуточных метаболитов синтеза - различных порфиринов. И действительно, в литературе имеются данные об увеличении содержания тех или иных порфиринов при многих заболеваниях и патологических состояниях человека: различного рода порфириях, когда блокируется какая-либо реакция из цепи синтеза гема, злокачественных и доброкачественных опухолях, лихорадочных состояниях, интоксикациях лекарственными препаратами, алкоголем и тяжелыми металлами, железодефицитных анемиях, гипертонической болезни, инфаркте миокарда, гиперфункции щитовидной железы и гипофиза, циррозе печени и гепатите, сахарном диабете, нефрозе, нервном возбуждении и переутомлении, беременности и др. [266, 267, 280-282]. При этом количество порфиринов увеличивается как в клетках, так и в биологических жидкостях (кровь, желчь, моча). В некоторых случаях содержание эндогенных порфиринов наоборот снижено [281], что может быть обусловлено повышенным использованием порфиринов в метаболизме или также нарушением их синтеза. Причины разного содержания эндогенных порфиринов в норме и патологии обсуждаются в научной литературе. При этом обозначено три основных фактора, приводящих к возрастанию концентрации порфиринов в условиях патологии: усиленный синтез порфиринов в клетках, обладающих повышенной пролиферативной активностью, нарушение синтеза гема, гемолиз с различной этиологией и жизнедеятельность анаэробной микрофлоры в тканях [220, 269]. 96 Необходимо отметить, что в здоровом организме эндогенные порфирины также обнаруживаются [266, 267, 280, 282]. Однако их содержание варьирует в индивидуальных случаях, а также в зависимости от возраста и пола [280-282]. 2.7.2. Порфирины как фотосенсибилизаторы Как уже указывалось выше, в современной медицине лазерное излучение применяется не только при НИЛТ, но и при фотодинамической терапии (ФДТ). ФДТ - метод, который широко используется в клинической практике для лечения поверхностно локализованных и солидных злокачественных опухолей, а также для лечения неопухолевых (в частности, инфекционных) заболеваний [39, 233, 264, 283-287]. В основе метода лежит способность экзогенных фотосенсибилизаторов, которые вводятся в организм различными способами, специфически аккумулироваться в патологических очагах (например, в опухолевых клетках или нежелательных микроорганизмах) или в необходимых мишенях (например, в кровеносных сосудах опухоли) [18, 233, 265, 288]. Экзогенные ФС, поглощая квант ЛИ, индуцируют свободнорадикальные реакции ПОЛ, денатурации белков и нуклеиновых кислот клеток [233, 289]. Перекисная модификация мембранных липидов вызывает нарушение проницаемости мембран, падение ионных градиентов, уменьшение трансмембранного потенциала, инактивацию мембраносвязанных ферментов, что, по-видимому, и является одним из первичных механизмов поражения биологических мишеней при ФДТ [18, 233]. О фотосенсибилизирующих свойствах порфиринов стало известно еще в начале прошлого века. Так Hausmann W. уже в 1911 г. сообщил о фотосенсибилизирующих свойствах гематопорфирина [290]. В современной фотодинамической терапии первым клинически использованным порфириновым фотосенсибилизатором стала водорастворимая смесь порфиринов, названная производным гематопорфирина - hematoporphyrin derivative (HPD), использованная в 60-х годах прошлого века Lipson R.L. с соавт. [291]. Позже стали 97 использовать очищенную и модифицированную форму HPD - Фотофрин [39]. В настоящее время для проведения ФДТ в качестве ФС используют различные производные порфиринов, фталоцианина, феофорбиды, хлорины и другие фотосенсибилизаторы порфиринового происхождения. [39, 233, 283, 286, 292-297]. Кроме того, в последние несколько лет одним из перспективных методов считается ФДТ с использованием аминолевулиновой кислоты как индуктора синтеза эндогенных порфиринов [264, 298, 299]. В данном случае накопленные в результате усиленного синтеза эндогенные порфирины служат при проведении фотодинамической терапии в качестве ФС. Необходимо отметить, порфирины известны как фотосенсибилизаторы давно. Широко известны работы основателей российской фотобиохимии Красновского А.А. и Теренина А.Н, посвященные фотосинтезу и фотохимическим реакциям [224-228]. Так в 40-x годах XX в. ими были опубликованы работы, посвященные фотосинтезу и фотосенсибилизированным процессам с участием соединений порфириновой природы (хлорофилла и фталоцианина) [226-228]. Большой вклад в понимание механизмов фотосенсибилизированных реакций в целом и участия порфиринов в таких процессах в частности внес Красновский А.А. мл. [229-231]. Как уже указывалось выше, в присутствие кислорода фотосенсибилизированные свободнорадикальные реакции могут инициироваться двумя путями [18, 88, 233]: реакции 1-го типа - через стадию образования радикалов и реакции 2-го типа - через стадию образования синглетного кислорода. При этом, реакции 1-го типа приводят, в частности, к образованию O2.- и HO., которые участвуют в инициировании свободнорадикального цепного окисления липидов. HO., взаимодействуя с белками, приводит к их денатурации, а с нуклеиновыми кислотами - к мутагенным и летальным эффектам [18, 88, 233]. 1О2, образующийся в реакциях 2-го типа, реагирует с основными остатками белков, полиненасыщенными жирными кислотами и холестерином, приводит к инактивации различных ферментов и повреждает ДНК, инициирует ПОЛ 98 (например, липидов клеточных мембран) [18, 233, 236, 264]. Преимущественная реализация того или иного механизма фотосенсибилизированных реакций зависит от многих обстоятельств [18, 88]: химической природы ФС и субстрата окисления, концентрации ФС, субстрата окисления (например, липида) и кислорода, наличия других соединений, способных взаимодействовать с молекулами ФС и О2, физических свойств среды (например, полярности) и др. Кроме того, около 40 лет назад появились работы, свидетельствующие о фотосенсибилизированном порфиринами окислении липидов. Так Пеленицын А.Б., Рощупкин Д.И. и Владимиров Ю.А. в 1974 г. обнаружили совпадение спектра действия ускорения гемолиза и спектра поглощения порфиринов. Сопоставив полученные зависимости со спектром действия при накоплении ТБКактивных продуктов окисления мембранных липидов эритроцитов, авторы сделали вывод о разрушении эритроцитов вследствие фотосенсибилизированного протопорфирином ПОЛ [221]. При этом, важным вопросом является способность порфиринов связываться с мембраной, и, следовательно, вклад связанного и несвязанного с мембраной ФС в инициацию фотосенсибилизированных реакций [300-303]. Riccheli F. с соавт. [301, 302], используя феномен тушения собственной флуоресценции производного гематопорфирина метиловым фиолетовым, продемонстрировали зависимость связывания ФС с липосомами от состава мембран (использовались фосфолипиды, холестерин и кардиолипин) и от концентрации производного гематопорфирина. Ведущую роль при фотосенсибилизированном ПОЛ играют реакции, вызванные связанным с мембраной ФС или с ФС, проникшим в интрацеллюлярное пространство [236, 304, 305]. Рядом с мембраной в зависимости от свойств ФС, концентрации О2 и субстратов окисления могут протекать реакции как по 1-му, так и по 2-му типам. Это определяется временем жизни АФК и следовательно способностью достичь мембрану. В последнее время 99 много исследований направлено на облегчение встраивания ФС в мембраны клеток, для чего синтезируют и используют различные наноструктуры [288] или липосомы [287, 306] являющиеся переносчиками фотосенсибилизаторов in vivo. Необходимо отметить, что часть авторов считает не менее важным, чем ПОЛ механизмом, поражающим мембраны клеток при их ЛО в присутствии ПГП - модификацию мембранных белков [236, 307, 308]. Так, Riccheli F. с соавт. считают, что одним из фотодинамических механизмов действия на клетку может быть изменение в ней транспорта кальция за счет связывания ФС с мембранными транспортными белками или опосредованного воздействия фотоиндуцированных АФК на эти белки [307]. Авторы исследовали транспорт кальция в микросомах эндоплазматического ретикулума и в митохондриях, выделенных из печени крыс. В качестве ФС использовали гематопорфирин и протопорфирин. Представляет Исследователи интерес облучали исследование клетки Miyamoto культуры HeLa Y. в с соавт. присутствии [309]. ФС порфиринового происхождения ("Фотофрина"), используемого в ФДТ, но при дозах облучения, применяемых в НИЛТ (1, 3 и 5 Дж/см2, длина волны излучения 630 нм). Авторы обнаружили ослабление цитотоксического эффекта после облучения в присутствии ФС с уменьшением дозы облучения. Miyamoto Y. с соавт. сделали вывод о единстве и фотосенсибилизированной природе механизмов НИЛТ и ФДТ. Что касается эндогенных порфиринов, то наибольшей гидрофобностью и фотодинамической активностью обладает протопорфирин IX [302]. Другие наиболее распространенные в биологических тканях и жидкостях человека порфирины - уро- и копропорфирин менее эффективны в развитии фотосенсибилизированных реакций и хуже связываются с мембранами клеток [266, 267]. Lubart R. с соавт. методом спиновых ловушек обнаружили, что опухолевые клетки (культуры FELC) способны продуцировать 1 О2 после облучения ГНЛ, как в присутствии, так и без экзогенных протопорфиринов [310]. 100 Авторы предполагают, что в последнем случае генерация 1 О2 обусловлена наличием эндогенных протопорфиринов. Таким образом, можно предположить, что эндогенные порфирины, накапливаясь в организме при патологии, могут выступать в роли фотосенсибилизатора, и, поглощая квант излучения, за счет продукции 1О2 или других радикалов - инициаторов могут запускать свободнорадикальные реакции ПОЛ. Окисление липидов клеточных мембран приводит к увеличению транспорта Са2+, который запускает реакции, приводящие к праймингу фагоцитирующих клеток (Рис. 6). Предстимулированные фагоциты, в результате, продуцируют повышенное количество активных форм кислорода (в первую очередь супероксид анион радикал) при контакте с различными вторичными стимулами. При этом надо учитывать, что количество порфиринов отличается индивидуально и в зависимости от патологии. Как уже было сказано выше, в разных ситуациях содержание порфиринов, может быть как повышено, так и понижено. Мы можем предположить, что различное содержание порфиринов определяет различную индивидуальную чувствительность пациентов к терапии низкоинтенсивным лазерным или светодиодным излучением. Итак, опираясь на гипотезу о фотодинамическом механизме действия низкоинтенсивных излучений в видимом диапазоне спектра и на данные литературы, можно предположить возможную схему событий (Рис. 6). Квант излучения, реагируя с эндогенным хромофором (возможно, порфирином), вызывает свободнорадикальные реакции. Это может приводить к модификации липидов клеточных мембран с увеличением их проницаемости для ионов кальция. В результате возможно, например, повышение функционального потенциала клеток лейкоцитарной фракции и макрофагов. Это может сопровождаться повышенной продукцией биологически активных веществ (оксид азота, простагландины, интерлейкины, гистамин, лизосомальные ферменты), влияющих на тонус и проницаемость сосудов. Некоторые из этих веществ (например, оксид азота) приводят, в частности, к вазодилатации сосудов микроциркуляторного 101 русла. Кроме того активация клеток лейкоцитарной фракции может приводить к повышенной продукции веществ, обладающих бактерицидным действием (гипохлорит-ион, супероксид-анион радикал, оксид азота и др.). Рис. 6. Фотодинамический механизм действия низкоинтенсивных излучений в видимом диапазоне спектра: результаты предыдущих экспериментов и вопросы, требующие исследования (схема автора). Вопросы: • "Лазер или светодиод?" - необходимо экспериментальное подтверждение или опровержение того, что особые свойства лазерного излучения (например, монохроматичность) являются определяющими в эффектах НИЛТ; • "Время?" - кратковременные или пролонгированные эффекты участвуют в реализации данного механизма? • "?" - вопросы, требующие дальнейшего изучения: • природа эндогенного фотоакцептора; • роль активных форм кислорода, продуцируемых фагоцитами, в обеспечении взаимосвязи эффектов низкоинтенсивных видимых излучений - от клетки к организму; 102 3. МАТЕРИАЛЫ И МЕТОДЫ 3.1. Реактивы В экспериментах использовали следующие реактивы и препараты: бидистиллированная деионизованная вода (18,2 Мом/см); KH2PO4 (Sigma); NaH2PO4 (Sigma-Aldrich); Na2HPO4 (Sigma); K2HPO4 (Sigma-Aldriсh); KOH (SigmaAldrich); гепарин (Sigma-Aldrich), Hepes (Sigma); трис-HCl (Reanal); KCl (Sigma); азид натрия NaN3 (Sigma); диметилсульфоксид (ДМСО, Fluka); NaCl (SigmaAldrich); люминол (5-амино-2,3-дигидро-1,4-фталозиндион, Sigma); тритон X-100 (Sigma-Aldrich); L-аскорбиновая кислота (Aldrich, 99%); протопорфирин IX (Sigma-Aldrich); Фотосенс и 5-Аминолевулиновой кислоты гидрохлорид (НИОПИК ГНЦ ФГУП, Россия), феофорбид а и додециламид хлорина e6 (МГАТХТ им. М.В. Ломоносова), хлороформ (Sigma-Aldriсh); метанол (SigmaAldrich); липополисахарид из E.Coli (Sigma, очищенный фенольной экстракцией); цис-паринариевая кислота (Invitrogen), восстановленный β-никотинамидаденин динуклеотид (NADH), 5-метил-феназинметасульфат (ФМС) (Fluka); нитросиний тетразолий (НСТ) (Диа-М); эфир для наркоза (Химмед); зимозан А (Serva); азодиизобутирамидина гидрохлорид (АДБА) (Sigma), стандартный раствор Хенкса (институт полиомиелита и вирусного энцефалита), 2-тиобарбитуровая кислота (Serva, Германия); зимозан (Sigma); бутанол (ХИММЕД); α-токоферол (Sigma); ионол (2,6 дитретбутил-4-метилфенол), (Aldrich). Остальные реактивы, а также жидкий азот были отечественного производства, квалификации «хч». . 3.2. Животные В работе использовали самцов белых крыс Wistar (Филиал «Андреевка» НЦБМТ РАМН, Россия) в возрасте 2 - 4 месяца и массой 140 - 300 г. с разницей в массе не более 50 г внутри одной экспериментальной серии, включая 103 контрольные эксперименты. Животные содержались в стандартных условиях вивария, по 1 особи в клетке, получали комплексный гранулированный корм и имели свободный доступ к воде. 104 3.3. Методы исследования 3.3.1. Процедуры получения крови В работе использовали свежую кровь человека и/или лабораторных животных (крыс). 3.3.1.1. Процедура получения крови человека В экспериментах использовалась кровь здоровых доноров или, в отдельных случаях, пациентов с патологиями (что указано в соответствующих разделах). Взятие крови осуществлялось утром натощак путем пункции локтевой вены. Забор крови в количестве 5 мл осуществляли в пластиковые пробирки. Кровь стабилизировали гепарином, который разводили физиологическим раствором и вносили в пробирки из расчета 20 ед. на 1,0 мл крови. 3.3.1.2. Процедура получения крови крыс У крыс из ретробульбарных синусов с помощью пастеровских пипеток забирали 1 мл крови в пластиковые пробирки Vacuette (Greiner Bio-One, Австрия) для клинических исследований с Li-гепарином, дополнительно добавляя в них раствор гепарина в физиологическом растворе в расчете 100 ед. гепарина на 1 мл крови. Забор крови производился 2 раза для каждого животного с интервалом 4 часа. Первый раз (0 часов от начала эксперимента) кровь собирали у крыс из правого ретробульбарного синуса до введения веществ (раствора липополисахарида или в контрольных группах – физиологического раствора) и до облучения. Второй раз кровь получали через 4 часа из левого ретробульбарного синуса. При обработке данных использовали отношение значений исследуемых параметров крови второго забора крови (в 4 часа) к первому (0 часов). 105 3.3.2. Модель экспериментальной кожной раны у крыс Исследования на "тканевом уровне" проводили с помощью модели экспериментальной кожной раны у крыс. 3.3.2.1. Процедура создания экспериментальной кожной раны у крыс Все эксперименты с экспериментальными кожными ранами были проведены на модели полнослойной плоскостной раны, разработанной Л.И. Слуцким [311]. Для создания экспериментальной кожной раны у животного, находящегося под наркозом, производили депиляцию шерсти в области холки, после чего хирургическими ножницами иссекали лоскут кожи округлой формы примерно 10 мм в диаметре. В области раны удалялась жировая клетчатка. Рана растягивалась тупым пинцетом, и под кожу вводилось тефлоновое кольцо с внутренним диаметром 2 см и высотой 10 мм (Таблица 1)м. В нижней части кольцо имело бортик, препятствовавший выпадению кольца из раны. Сверху на кольце фиксировалась стерильная пленка, предотвращающая высыхание и загрязнение раны. Пленку на ране заменяли ежедневно после проведения всех манипуляций. Кольцо снимали на пятый день после последнего облучения крыс. 3.3.2.2. Планиметрия и фотографирование экспериментальных кожных ран Фотографирование ран производилось на 5, 6, 8, 10, 12, 15, 17, 19 и 22 день. Раны фотографировались при искусственном освещении с одинакового расстояния с линейкой (для примерной оценки размеров раны) и без линейки (для презентации результатов). Для этого использовался цифровой аппарат Nikon CoolPix 5600 (Япония). Площадь ран измеряли, обводя их контуры на плотном прозрачном материале. 106 Муфтообразное тефлоновое кольцо Тефлоновое кольцо фиксируют на коже крысы Забор раневого экссудата Облучение раны Рана у крысы после снятия кольца Полное заживление раны Таблица 1. Процедура работы с животными при использовании модели экспериментальной раны 107 Далее контуры ран переносили на белую бумагу одинаковой плотности. Затем эти контуры вырезали. Вычисление площади ран проводили весовым методом [312]. 3.3.2.3. Патоморфологические исследования экспериментальных кожных ран Патоморфологические исследования выполняли после снятия колец на 5-е, 7-е и 11-е сутки от момента нанесения раны. Для этих целей после эвтаназии животного иссекали ткани раны на всю ее глубину и фиксировали отобранный материал в нейтральном формалине. Далее образцы ткани заливали в парафин. Парафиновые срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизону, толуидиновым синим на кислые гликозаминогликаны. 3.3.3. Модель экспериментального эндотоксического шока В экспериментах использовали стандартную модель экспериментального эндотоксического шока [156, 313, 314]. Для этого крысам внутрибрюшинно вводили раствор липополисахарида В (ЛПС) в физиологическом растворе из расчета 25 мг/кг. В контрольных группах животным вводили эквивалентное количество физиологического раствора. Все инъекции делали внутрибрюшинно сразу после первого забора крови. 108 3.3.4. Процедуры получения плазмы крови, клеток лейкоцитарной фракции крови и раневого экссудата, эритроцитов крови и перитонеальных макрофагов крыс В разных сериях экспериментов были использованы: плазма крови, клетки лейкоцитарной фракции крови и раневого экссудата, эритроциты крови и перитонеальные макрофаги крыс. 3.3.4.1. Процедура выделения клеток лейкоцитарной фракции крови человека Клетки выделяли по методу Boyum A. [315] с некоторыми модификациями. Для выделения полиморфноядерных клеток лейкоцитарной фракции крови человека образцы крови центрифугировали на центрифуге ОПН-3 при 900g в течение 10 мин. Верхнюю фракцию - плазму крови - отбирали в отдельную пробирку и наслаивали 1 мл 0,83% раствора хлористого аммония (NH4Cl). Далее верхнюю фазу, содержащую клетки лейкоцитарной фракции и NH4Cl, осторожно отбирали в две пластиковые пробирки и добавляли по 10 мл NH4Cl. Содержимое пробирок осторожно ресуспензировали и инкубировали 5 мин. при комнатной температуре. Далее центрифугировали при 900g 7 мин. К осадку добавляли 10 мл р-ра Хенкса и центрифугировали при 900g 5 мин. (процедуру повторяли 3 раза). Конечный клеточный осадок ресуспензировали в необходимом количестве р-ра ТРИС-НСl так, чтобы в 0,1 мл суспензии содержался 1 млн. клеток. Выход полиморфноядерных клеток лейкоцитарной фракции составлял 85-95%. Жизнеспособность клеток, определяемая в тесте с трипановым синим, составляла не менее 97%. Пробирки с клетками хранили при температуре 4°С. Клетки использовали в течение 5 часов. 109 3.3.4.2. Процедура выделения перитонеальных макрофагов крыс Для выделения перитонеальных макрофагов крыс применяли методику, описанную Фримелем Г. [316] и модифицированную Клебановым Г.И. с сотр. [317]. Для получения клеток перитонеального экссудата использовали 3 - 4 недельных самцов крыс весом 150 - 180 г, которым за 3 - 4 дня до эксперимента вводили в перитонеальную полость 10 мл 2%-ного раствора пептона. Непосредственно перед забором экссудата животному давали эфирный наркоз, затем фиксировали его в горизонтальном положении на спине с предельно разогнутыми конечностями и протирали шерсть 70% этанолом. Захватывая пинцетом шкуру на животе, делали надрез ножницами с таким расчетом, чтобы разрез раздвигался в краниально-каудальном направлении. Далее животному вводили в брюшную полость 15 мл фосфатного буфера, содержащего 15 ед./мл гепарина. В течение 1-2 минут массировали животному живот. После этого медленно извлекали Перитонеальную перитонеальную жидкость собирали жидкость в с помощью предварительно шприца. охлаждённые и силиконизированные пробирки и центрифугировали дважды при 200g 10 мин. В итоге, осадок, содержащий клетки, ресуспендировали в 1 мл раствора Хенкса. Клеточная суспензия, как правило, содержала 65–80% макрофагов. Количество клеток определяли с помощью камеры Горяева. Жизнеспособность клеток, определяемая в тесте с трипановым синим, составляла не менее 97%. 3.3.4.3. Культивирование макрофагов перитонеального экссудата крыс Культивирование клеток перитонеального экссудата проводили в CO2 инкубаторе при 37°С в 96-луночных планшетах (200 тыс. клеток на лунку) или пластиковых центрифужных пробирках (1 млн/мл). Клетки помещали в раствор, который готовили на основе среды RPMI 1640 с добавлением 1%-ной эмбриональной телячей сыворотки (ЭТС), 10 мМ Hepes и гентамицинсульфата 0,04 мг/мл. При необходимости ингибитор NO-синтазы (L-NMMA), аскорбат и 110 азид натрия добавляли непосредственно в среду инкубации. Все растворы, а также среду инкубации готовили непосредственно перед проведением эксперимента. 3.3.4.4. Процедура получения раневого экссудата и выделения полиморфноядерных клеток лейкоцитарной фракции раневого экссудата крыс Раневой экссудат собирался автоматическими пипетками в пластиковые пробирки в течение четырех дней после операции (со второго по пятый дни включительно). Сбор экссудата производился в начале экспериментального дня до облучения крыс лазером в пластиковые пробирки. Выделение клеток производилось по модифицированной нами методике, описанной Boyum А. [315]. Отобранный материал центрифугировали при 400g 10 мин. Надосадочную жидкость отбрасывали. К осадку добавляли 10 мл р-ра Хенкса, осторожно его ресуспендировали и центрифугировали при 400g 5 мин. (процедуру повторяли 2 раза). Клеточный осадок ресуспендировали в 1 мл раствора Хенкса (рН 7.45). Подсчет количества клеток в суспензии проводили под световым микроскопом, используя камеру Горяева, которую заполняли взвесью фиксированных 3% уксусной кислотой клеток. Выход клеток лейкоцитарной фракции составлял 85 95%. Жизнеспособность клеток, определяемая в тесте с трипановым синим, составляла не менее 97%. Все клетки хранили на холоде и использовали в течении 4 часов после забора экссудата. При необходимости, экссудат, не использованный для выделения клеток, применяли для определения антиоксидантной активности, супероксиддисмутазной активности, регистрации продуктов окисления липидов или уровня порфиринов. 111 3.3.4.5. Процедура выделения плазмы крови, полиморфноядерных клеток лейкоцитарной фракции и эритроцитов крови крыс Пробирку со свежей кровью животных центрифугировали 7 минут при 400g на центрифуге СМ-6 (Россия). После центрифугирования самый верхний слой (плазма крови) отбирался в пластиковые пробирки по 0,5 мл и замораживался. Из среднего слоя (лейкоцитарной пленки) выделяли полиморфноядерные клетки лейкоцитарной фракции (ПМЛ) по методу Boyum A. [315] с некоторыми модификациями. Для этого собирали лейкоцитарную пленку, переносили ее в пластиковую пробирку, добавляли до 10 мл 0,83% NH4Cl и выдерживали 5 минут для проведения щадящего гемолиза, попавших в пробу эритроцитов. Далее клетки дважды отмывали в стандартном растворе Хенкса (рН 7,45). К конечному клеточному осадку добавляли стандартный раствор Хенкса с таким расчетом, чтобы количество клеток составляло 1,5 × 105 в 150 мкл. Выход клеток составлял 85 – 95%. Жизнеспособность клеток, определяемая в тесте с трипановым синим, составляла не менее 97%. Пробирки с клетками хранили в темноте в воде со льдом. Клетки использовали в течение 5 часов. В некоторых разделах при описании результатов клетки называли лейкоцитами (в стилистических целях), подразумевая клетки лейкоцитарной фракции. Для выделения эритроцитов использовалась самая нижняя фракция после центрифугирования пробирки с кровью 7 мин при 400g на центрифуге СМ-6 (Россия) и отбора плазмы крови и лейкоцитарной пленки. Эритроциты отмывались в растворе Хенкса дважды (900g, 10 мин.). К конечному клеточному осадку добавляли 4 мл раствора стандартного Хенкса (рН 7,45). После подсчета клетки замораживали в пластиковых пробирках по 1,5 мл в количестве 1×109 клеток в пробирке. Расчет количества клеток проводили с помощью камеры Горяева. 112 3.3.5. Процедура экстракции липидов из эритроцитов крови крыс Для измерения флуоресценции цис-паринариевой кислоты в липидах мембран эритроцитов образцы эритроцитов размораживали и центрифугировали при 4оС и 1800 g 30 мин. На центрифуге «Rotina 38R» (Hettich zentrifugen, Германия). Далее надосадочную жидкость отбрасывали (в осадке оставались тени эритроцитов). Для разделения липидной и белковой фракций применяли экстракцию в системе хлороформ : метанол : вода (5:1:4). Использовали воду с омическим сопротивлением не меньше 17 МОм. Экстракцию проводили на вортексе (Yellow line TTS2, США) в пластиковых пробирках объемом 1 мл при максимальных оборотах (2500 об/мин.) в течение 30 секунд, затем на ультразвуковой бане («Сапфир», ЗАО ПКФ, Россия) и снова на вортексе до полного растворения осадка. После экстракции суспензию снова центрифугировали при 4оС и 1800 g 30 мин. Осторожно отбирали нижний слой хлороформа, содержащий тени эритроцитов. 3.3.6. Измерение люминол-зависимой хемилюминесценции Измерение хемилюминесценции (ХЛ) исследуемых объектов осуществляли на хемилюминометре ХЛМ-3 («Бикап», Россия), содержащего в качестве регистрирующего элемента ФЭУ-100. Операции по калибровке хемилюминометра и подбору необходимой чувствительности выполняли с помощью вторичного эталона СФХМ-1 N1, представляющего собой радиолюминесцентный источник света, изготовленный из стекла ЖС-19 (ГОСТ 9411-81) и имеющий максимальную интенсивность излучения в диапазоне 500 550 нм. Все эксперименты проводили при температуре 37°С и постоянном перемешивании в стеклянной силиконизированной кювете. Для измерения ХЛ использовали стандартную методику регистрации люминол-зависимой хемилюминесценции [25, 26, 218, 219, 318-320] с 113 модификациями в различных сериях экспериментов, что указано в соответствующих разделах. При регистрации хемилюминесценции в кювету помещали суспензию клеток и добавляли раствор люминола. Далее в течение 2 - 3 минут проводили запись спонтанной люминол-зависимой хемилюминесценции. После этого добавляли стимул - опсонизированный зимозан и регистрировали стимулированную ХЛ. Концентрации люминола и зимозана были определены предварительно на основе данных литературы и подготовительных экспериментов (в каждой серии) по исследованию зависимостей интенсивностей хемилюминесценции от концентрации указанных веществ. На первом этапе хемилюминесцентный ответ оценивали как разность между максимальной интенсивностью стимулированной и спонтанной хемилюминесценции в условных единицах, что показано на примере типичной кривой хемилюминесценции клеток лейкоцитарной фракции крови крыс (Рис. 7). Дальнейшее представление результатов отличалось в разных сериях эксперимента IХЛ, усл. ед. и описано в соответствующих разделах. Люминол Зимозан I Время, мин. Рис. 7. Типичная кривая хемилюминесценции клеток лейкоцитарной фракции крови крыс. Стрелками указаны моменты добавления раствора люминола и зимозана. IХЛ – амплитуда хемилюминесценции, используемая для расчетов 114 3.3.6.1. Получение сыворотки крови и опсонизация зимозана Опсонизированный зимозан использовали как стимулятор клеток для регистрации активированной хемилюминесценции. Опсонизацию проводили с помощью нативной сыворотки крови человека или животного в соответствующих экспериментах. Для получения сыворотки кровь собирали в пробирку без антикоагулянта и инкубировали ее 40 мин. в термостате при температуре 37°С. Затем образцы крови центрифугировали на центрифуге ОС-6М (Россия) при 1800 g в течение 20 мин. Полученную сыворотку крови осторожно отбирали в отдельные флаконы и хранили при 4°С в течение суток, либо в замороженном состоянии при -20°С в течение недели. 200 мг зимозана, суспензированного в 2 мл фосфатно-cолевого буфера (2,7 мМ КСl, 136,7 мМ NaCl, 1,5 мМ KH2PO4, 8,1 мM Na2HPO4, pH 7,4), смешивали с 4 мл сыворотки крови и инкубировали 30 мин. при 37оС [67]. Затем смесь центрифугировали при 4000g в течение 10 мин. на центрифуге ОС-6М (Россия). Осадок дважды отмывали в фосфатно-солевом буфере, используя тот же режим центрифугирования. Полученный опсонизированный зимозан ресуспендировали в 10 мл фосфатно-солевого буфера, разливали по 0,5 мл в пластиковые флаконы и замораживали до использования. Перед работой суспензию зимозана доводили до концентрации 4 мг/мл. 3.3.6.2. Измерение люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции крови человека Для измерения люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции крови человека в кювету помещали 2,0 × 105 клеток и 2,5 115 × 10-5 М раствора люминола (исходная концентрация 10-3 М), объем пробы доводили до 1,9 мл раствором Хенкса (рН 7,45). Проводили запись спонтанной люминол-зависимой хемилюминесценции (ЛХЛ). После этого добавляли стимул опсонизированный зимозан (0,2 мг/мл) и регистрировали стимулированную ЛХЛ. Конечный объем пробы составлял 2 мл. Разность между максимальным уровнем стимулированной ХЛ и уровнем спонтанной ХЛ и обозначали как I (отн. ед.) - для клеток опытных образцов (например, подвергнутых облучению) и I0 для контрольных образцов (например, необлученных). Изменение функциональной активности клеток лейкоцитарной фракции (прайминг) выражали в виде показателя - индекса прайминга - I/I0, %. 3.3.6.3. Измерение люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции раневого экссудата крыс Для измерения люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции раневого экссудата крыс в кювету добавляли 1,5 × 105 клеток и 4 × 10-5 М люминола. Регистрировали спонтанную хемилюминесценцию. После этого добавляли стимул - опсонизированный зимозан (0,4 мг/мл) и регистрировали стимулированную ЛХЛ. Конечный объем пробы составлял 1 мл. Интенсивность ХЛ выражали в отн. ед., характеризующих разность между максимальным уровнем активированной ХЛ и уровнем спонтанной ХЛ (Рис. 7). За функциональную активность клеток принимали отношение интенсивности ХЛ на 3, 4 или 5 дни к интенсивности ХЛ на 2 день после операции. 116 3.3.6.4. Измерение люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции крови крыс Для измерения люминол-зависимой хемилюминесценции клеток лейкоцитарной фракции крови крыс в кювету помещали 1,5 × 105 клеток и 3 × 10-5 М раствора люминола. После этого добавляли стимул - опсонизированный зимозан (0,13 мг/мл) и регистрировали стимулированную ХЛ. Конечный объем пробы составлял 3 мл. Интенсивность ХЛ выражали в отн. ед., характеризующих разность между максимальным уровнем активированной ХЛ и уровнем спонтанной ХЛ (без зимозана). Функциональную активность оценивали по хемилюминесцентому ответу в виде отношения III/II, где II - интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови в начале эксперимента (0 часов, до введения препаратов и облучения), III - интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови через 4 часа после начала эксперимента. 3.3.7. Определение внутриклеточной продукции активных форм кислорода перитонеальными макрофагами крыс Определение продукции активных форм кислорода (АФК) перитонеальными макрофагами проводили методом флуоресценции, используя внутриклеточный зонд 2′,7′-дихлорфлуоресциндиацетат (DCFH-DA) [321, 322]. Суспензию клеток или их лизаты получали обработкой суспензии ультразвуком. Непосредственно перед ЛО клетки инкубировали 15 мин с 5 мкМ DCFH-DA для насыщения флуорофором. Время предварительной инкубации и концентрация флуорофора были выбраны на основании данных литературы [323325]. В экспериментах с клеточными лизатами DCFH-DA добавляли в образец непосредственно перед облучением. 117 Регистрацию флуоресценции образца проводили на спектрофлуориметре MPF-4 (“Hitachi”, Япония) при длине волны возбуждения λвозб - 501 нм, и длине волны испускания λфл - 521 нм сразу после экспозиции НИЛИ. Типичные спектры возбуждения и испускания (эмиссии) представлены на Рис. 8. Результаты измерения флуоресценции представляли как отношение интенсивности флуоресценции облученного образца к необлученному контролю (I/I0 × 100%). 3.3.8. Определение содержания ионов нитрита (NO2¯ ) по методу Грисса Продукцию оксида азота оценивали по содержанию в среде инкубации клеток ионов NO2- методом Грисса, описанным в работах Шебзухова Ю.Б. с соавт. [326] и Ding A.H. с соавт. [327]. В пробе содержалось до 1 мл дистиллированной воды, 150 мкл культуральной среды, 75 мкл реактива А (1.5% сульфаниламид в 1м HCl) и 75 мкл реактива Б (0,15%-ный раствор нафтилэтилендиаминхлорида в дистиллированной воде). Все растворы, а также среду инкубации готовили непосредственно перед проведением эксперимента. Оптическую плотность пробы измеряли при 548 нм на спектрофотометре «СФ-46» («ЛОМО», Россия). Содержание NO2¯ определяли по калибровочному графику, который был построен при использовании различных концентраций NaNO2 (Рис. 9). Спонтанная продукция нитрит-ионов варьировала у различных животных и составляла в среднем 30 мкМ на пробу (2 × 105 клеток). Однако наблюдалась как более низкая спонтанная продукция NO2- у некоторых животных — около 10 мкМ, так и достаточно большая продукция NO2- по сравнению со средним значением — около 50 мкМ. 118 Интенсивность, усл.ед. 0,5 0,4 2 0,3 1 0,2 0,1 0 450 490 530 Длина волны, нм 570 Рис. 8. Спектры возбуждения и флуоресценции суспензии макрофагов перитонеального экссудата крыс нагруженных DCFH-DA. Через 15 мин инкубации в присутствии 5 мкМ DCFH-DA при 370С, макрофаги (1 млн/мл) подвергали ЛО и записывали спектр возбуждения (λфл = 521 нм, кривая 1) и Оптическая плотность флуоресценции (λвозб = 501 нм, кривая 2) клеточной суспензии 0,32 0,24 0,16 0,08 0 0 10 20 30 40 50 Концентрация нитрита, мкМ Рис. 9. Калибровочная прямая для определения содержания нитритов в образце 119 3.3.8.1. Определение содержания ионов нитрита в среде культивирования перитонеальных макрофагов крыс Культивирование клеток перитонеального экссудата проводили в CO2 инкубаторе (5% СО2) при 37°С в 96-луночных планшетах (200 тыс. клеток на лунку) в течение 24 часов. Клетки помещали в раствор, который готовили на основе среды RPMI 1640 с добавлением 1%-ной эмбриональной телячей сыворотки (ЭТС), 10 мМ Hepes и гентамицинсульфата 0,04 мг/мл. После инкубации содержимое лунок собирали и центрифугировали при 400g 10 мин. Надосадочную жидкость (культуральную среду) отбирали и в ней определяли содержание NO2¯ по методу Грисса (см. 3.3.8.). Относительное содержание NO2¯ в экспериментальных пробах выражено в процентах по отношению к содержанию его в образцах клеток, не подвергнутых облучению (контрольных образцах). 3.3.8.2. Определение содержания ионов нитрита в исследованиях на модели экспериментальной раны Клетки раневого экссудата инкубировали в CO2 инкубаторе (5% СО2) при 37°С в 96-луночных планшетах (250 тыс. клеток на лунку) в течение 24 часов. Инкубация проводилась в растворе, приготовленном на основе среды RPMI 1640 с добавлением 1% эмбриональной телячьей сыворотки (ЭТС), 10 мМ Hepes и гентамицин сульфата 0.04 мг/мл. После инкубации содержимое лунок собирали и центрифугировали при 400g 10 мин. Надосадочную жидкость (культуральную среду) отбирали и в ней определяли содержание NO2¯ по методу Грисса (см. 3.3.8.). Относительное содержание NO2¯ в экспериментальных пробах (С/С0) выражали в процентах, где С0 – концентрация ионов нитрита на второй день после нанесения раны, С – концентрация ионов нитрита на 3, 4 или 5 дни. 120 3.3.9. Определение продукции пероксинитрита перитонеальными макрофагами крыс Определение продукции пероксинитрита (ONOO¯ ) перитонеальными макрофагами крыс проводили методом регистрации пероксинитритзависимого окисления дигидрородамина 123 (DHR 123), согласно [328]. Для определения продукции пероксинитрита после облучения (или темновой инкубации в контроле) клетки (3 × 106) инкубировали в пластиковых центрифужных пробирках (1 млн/мл) в течение 24 ч. По окончании инкубации пробирки с культивируемыми клетками центрифугировали при 200g в течение 15 мин. Полученный осадок ресуспендировали в 3 мл фосфатного буфера, содержащего 5 мкМ DHR 123. Через 1 ч инкубации при 37˚C измеряли флуоресценцию образца на спектрофлуориметре MPF-4 (“Hitachi”). Длина волны возбуждения (λвозб) 500 нм, длина волны испускания (λфл) 536 нм. Расчет продукции пероксинитрита проводили по калибровочному графику, построенному с использованием растворов с известной концентрацией реагента (Рис. 10). Получение пероксинитрита проводили по методике [321, 329] посредством быстрого смешивания растворов 0,6М NaNO2 и 0,6М H2O2 (3%) в 0,7М HCl с последующей стабилизацией в 0,9М NaOH. Концентрацию пероксинитрита определяли по характерной полосе поглощения при 302 нм (ε = 1670 М-1⋅см-1). Относительное содержание пероксинитрита в экспериментальных пробах выражено в процентах по отношению к содержанию его в образцах клеток, не подвергнутых лазерному облучению. 121 IФЛ, усл.ед. 50 25 0 0 Рис. 10. 10 20 30 40 Концентрация пероксинитрита, мкМ Калибровочный график для пероксинитрита. IФЛ - интенсивность флуоресценции определения концентрации 122 3.3.10. Регистрация продуктов окисления липидов В наших исследованиях было использовано несколько методов оценки концентрации продуктов окисления липидов в разных системах. 3.3.10.1. Определение накопления ТБК-активных продуктов Оценку накопления ТБК-активных продуктов проводили в суспензии клеток лейкоцитарной фракции человека и в раневых экссудатах крыс. 3.3.10.1.1. Определение накопления ТБК-активных продуктов в суспензии клеток лейкоцитарной фракции крови человека Для определение содержания ТБК-активных продуктов (ТБКАП) окисления липидов в суспензии клеток лейкоцитарной фракции крови человека использовали модифицированный спектрофлуориметрический метод [330]. В пробирку с исследуемым образцом (1 млн. клеток в 0,1 мл растворе Хенкса) вносили раствор двухвалентного железа (3 мкМ) до конечной концентрации 75 мкМ. Далее образцы инкубировали в течение 15 минут при 370С при постоянном перемешивании. Потом в каждую пробирку добавляли 1,5 мл 1% ортофосфорной кислоты (pH = 2,0) и 0,5 мл 0,67% тиобарбитуровой кислоты. Пробирку встряхивали в течение 1 минуты. В контрольную пробирку вместо суспензии клеток или сыворотки вносили раствор ТРИС-НСl (рН = 7,4). Далее образцы инкубировали в течении 45 мин. в кипящей водяной бане и охлаждали пробирки в токе холодной воды до комнатной температуры, добавляли в каждую из них по 2 мл бутанола и содержимое пробирок интенсивно перемешивали под углом 45о в течение 3 мин. Разделение фаз осуществляли центрифугированием при 1500g в течение 1015 минут. 123 Для исследования брали верхнюю бутанольную фазу. Для определения концентрации ТБК-активных продуктов записывали спектр флуоресценции бутанольного экстракта на спектрофлуориметре ”Hitachi, MPF - 4’’ (Япония) при длине волны возбуждения 515 нм и длине волны флуоресценции - 553 нм. Для приготовления стандартной пробы в реакционную смесь добавляли 0,1 мл 5х106 М раствора 1,1,3,3-тетраметоксипропана, что соответствовало содержанию 0,1 нмоль МДА в 0,1 мл пробы. Далее все этапы проводились так же, как с образцами. Концентрацию МДА рассчитывали по формуле: C= Fe − Fk 1 × Fst − Fk V 5 где Fe – интенсивность флуоресценции опытной пробы, Fk – интенсивность флуоресценции растворителя, Fst – интенсивность флуоресценции стандартной пробы, V – объем используемой пробы (лейкомассы). Для оценки полученных результатов использовали ∆МДА, равное изменению МДА до и после облучения. 3.3.10.1.2. Определение накопления ТБК-активных продуктов в раневом экссудате Концентрацию ТБК-активных продуктов в раневом экссудате регистрировали с помощью метода, предложенного Гавриловым В.Б. с соавт. [331]. 124 В реакционную смесь, содержащую 3,0 мл 2% р-ра Н3РО4, 1,0 мл 0,8% водного раствора тиобарбитуровой кислоты (ТБК) и 0,1 мл раствора ионола (10-2 М) вносили 0,3 мл раневого экссудата. Далее пробы перемешивали и инкубировали на кипящей бане в течении 45 минут, затем охлаждали их в токе холодной воды и экстрагировали окрашенный продукт н-бутаноле. Для этого в пробы вносили 4,0 мл н-бутанола, тщательно их перемешивали, закрывали пробирки для предотвращения испарения и центрифугировали при 400g в течении 15 минут. Оптическую плотность бутанольного экстракта измеряли на спектрофотометре СФ-46 (Россия) при длинах волн 535 и 580 нм. Концентрацию ТБКАП рассчитывали по формуле: СТБКАП = D535− D580 V 0 ×l = ε V (нмоль/мл) 6 где D535 и D580 - оптическая плотность бутанольного экстракта при 535 и 580 нм, соответственно, ε535 = 156000 M-1см–1; V - объём исследуемого экссудата; V0 общий объём реакционной среды; – длина оптического пути (в нашем случае l = 1 см). 3.3.10.2. Определение диеновых коньюгатов в суспензии клеток лейкоцитарной фракции крови человека Для определения содержания диеновых коньюгатов (ДК) в суспензии клеток лейкоцитарной фракции использовали модифицированный спектрофотометрический метод [332]. С этой целью к 1 мл суспензии, содержащему 1 млн. клеток, добавляли 2 мл хлороформа, 1 мл метанола и 1 мл дистиллированной воды. Полученную пробу инкубировали в течение 10 мин. при 125 комнатной температуре и постоянном интенсивном перемешивании. Далее смесь центрифугировали 10 мин. при 900g. Верхнюю - водно-метанольную фазу тщательно удаляли. Нижнюю фазу, представляющую собой раствор липидов в хлороформе, выпаривали с помощью вакуумного роторного испарителя. К сухой липидной пленке добавляли 2 мл циклогексана. Оптическую плотность определяли при длине волны λ = 232 нм (образец сравнения содержал только циклогексан). Количество ДК выражали в единицах оптической плотности в пересчете на 10 млн. клеток и представляли как ДК усл. ед./10 млн.кл. 3.3.10.3. Регистрация флуоресценции цис-паринариевой кислоты для измерения окисления липидов мембран эритроцитов крови крыс Для регистрации флуоресценции цис-паринариевой кислоты в присутствии липидов, экстрагированных из эритроцитов крови крыс использовали стандартную методику [333-337] и флуориметр «Fluorescence spectrophotometer МPF-4» (Hitachi, Япония). В кювету для измерения флуоресценции добавляли 250 мкл хлороформенного экстракта, содержащего липиды от 1 миллиарда эритроцитов, 10 мкл 260 мкМ раствора цис-паринариевой кислоты в этаноле и измеряли флуоресценцию цис-паринариевой кислоты в диапазоне 350–500 нм при длине волны возбуждения λex = 310 нм (Конечная концентрация цисПК в пробе - 10 мкМ). Далее исследуемая проба выдерживалась в термостате при 37°С 60 мин. Затем измерение флуоресценции повторялось. При совместном инкубировании липидов теней эритроцитов и цис-паринариевой кислоты при 37°С происходило окисление цис-паринариевой кислоты, что наблюдали по уменьшению интенсивности в спектре ее флуоресценции (Рис. 55). Для контроля проводили инкубирование в тех же условиях только циспаринариевой кислоты без теней эритроцитов. При этом снижения свечения 126 кислоты не происходило, что свидетельствует об отсутствии процесса ее автоокисления в течении проведения эксперимента (Рис. 56). При обработке результатов рассчитывали процент падения флуоресценции (ПФ): ПФ = % ሺࡵ ି ࡵ ሻ ࡵ , 7 где I1 и I2 – максимальные интенсивности флуоресценции в 0 мин. и через 60 мин. инкубации пробы при 37°С соответственно. Результаты представляли в виде отношения процентов падения флуоресценции в начале эксперимента ПФI (0 часов) и через 4 часа после начала эксперимента ПФII: ПФII / ПФI. 3.3.10.4. Оценка уровня липопероксильных радикалов в раневых экссудатах крыс методом хемилюминесценции, активированной кумарином С-525 в присутствии ионов двухвалентного железа Определение уровня липопероксильных радикалов методом хемилюминесценции, активированной сенсибилизатором хемилюминесценции изохинолизиновым двухвалентного кумарином железа С-525 проводили (Рис. по 11) методике, в присутствии ионов предложенной Ю.А. Владимировым и разработанной на кафедре биофизики РНИМУ им. Н.И. Пирогова [18, 338, 339]. Кумарин С-525 является высокоэффективным физическим активатором свечения, усиливающим хемилюминесценцию, сопровождающую цепное окисление липидов [340]. Для измерения хемилюминесценции, сопровождающей окисление липидов раневого экссудата, в кювету хемилюминометра последовательно добавляли фосфатный буфер (рН 7.45) до конечного объема 5 мл; 30 мкл раневого экссудата и 10 мкл кумарина С-525 (конечная концентрация 0,5 мкМ). 127 Рис. 11. Структурная формула кумарина С-525 [338] Инициирование окисления липидов раневого экссудата осуществляли введением 200 мкл раствора FeSO4 (конечная концентрация 1 мМ). Все эксперименты проводили при температуре 370С и постоянном перемешивании. 1,6 Iхл, усл. ед. Экссудат 1,2 С-525 I 0,8 Fe2+ 0,4 t 0,0 0 5 10 15 20 25 Время, мин. Рис. 12. Типичная кривая хемилюминесценции, активированной кумарином С525 в присутствии ионов двухвалентного железа (Fe2+) при оценке уровня липопероксильных радикалов в раневых экссудатах крыс. IХЛ - максимум интенсивности медленной вспышки, t - время достижения интенсивности хемилюминесценции (условный латентный период) максимума 128 Кинетику ХЛ регистрировали до момента наступления максимума интенсивности (I) медленной вспышки. При этом данные представляли в виде отношения In/I2, где In - интенсивность медленной вспышки хемилюминесценции раневого экссудата на 3 или 4 дни после операции, I2 - на второй день после операции. Типичная кинетика представлена на Рис. 12. IХЛ, усл. ед. 1,6 1 1,2 0,5 0,8 20 0,4 0,25 0 0 300 600 Время, с 900 Рис. 13. Кривые хемилюминесценции раневого экссудата крыс при разных концентрациях двухвалентного железа: 00,25; 0,5; 1 и 20 мМ. Активатор хемилюминесценции - кумарин С-525 (0,5 мкМ). IХЛ - интенсивность хемилюминесценции, t - время Время достижения максимума интенсивности хемилюминесценции обозначали как условный латентный период (t), определяя время от момента введения железа до достижения максимума интенсивности хемилюминесценции ( Рис. 12). При этом данные представляли в виде отношения tn/t2, где tn - условный латентный период наступления медленной вспышки хемилюминесценции раневого экссудата на 3 или 4 дни после операции, t2 - на второй день после операции. 129 Необходимо отметить, что условия эксперимента были предварительно подобраны следующим образом: так концентрация железа была выбрана 1 мМ для достижения максимального значения интенсивности хемилюминесценции и удобной для измерения длительности условного латентного периода (Рис. 13). 3.3.11. Определение супероксиддисмутазной активности Для определения активности супероксиддисмутазной активности (СОДактивности) использовали метод с нитросиним тетразолием, описанный в работе Клебанова с соавт. [341]. В качестве системы генерации супероксидных радикалов применяли реакцию окисления восстановленного β- никотинамидадениндинуклеотида 5-метил-феназинметасульфатом. В качестве перехватчика радикалов использовали нитросиний тетразолий (НСТ). К исследуемому образцу (1 мл) добавляли 0.5 мл 0.1% р-ра НСТ, 0.2 мл 0.02% р-ра ФМС и 0.4 мл 0.1% р-ра NADH. Все растворы готовили непосредственно перед началом эксперимента на калий-натриевом фосфатном буфере с pH 7.8. Пробы инкубировали 30 мин при 37˚С при постоянном перемешивании. Реакцию останавливали добавлением 1 мл 1М HCl. После этого проводили осаждение образовавшихся гидрофобных частиц формазана путем центрифугирования 15 мин при 400g. К осадку добавляли 1 мл диметилсульфоксида (ДМСО). Для более полного растворения частиц формазана в ДМСО пробы выдерживали 20 мин. в кипящей бане. Измерение оптической плотности раствора формазана проводили при λ=610 нм на спектрофотометре СФ-46. Для расчета активности фермента использовали коммерческий препарат СОД. Супероксиддисмутазную активность рассчитывали по калибровочной прямой (Рис. 14). 130 3.3.11.1. Определение супероксиддисмутазной активности перитонеальных макрофагов крыс Сразу после облучения (или темновой инкубации в контрольных экспериментах) клетки перитонеального экссудата (5⋅106) инкубировали в пластиковых центрифужных пробирках (1 млн/мл) в течение 24 ч. Активность СОД, Ед. 10000 1000 100 10 1 0 0,2 0,4 0,6 0,8 Оптическая плотность 1 Рис. 14. Калибровочный график для определения СОД-активности По окончании инкубации пробирки с клетками центрифугировали 15 мин при 200g. Осадок ресуспендировали в 1 мл фосфатного буфера, и затем лизировали клетки, добавляя в пробу 1 мл хлороформа. После интенсивного перемешивания пробы центрифугировали 15 мин при 400g для разделения фаз. Для дальнейшего анализа (см. п. 3.3.11) использовали водную фазу, содержащую лизат клеток. Результаты выражали в виде единиц активности СОД (ед. акт. на 1 млн клеток, Ед.). 131 3.3.11.2. Определение супероксиддисмутазной активности раневого экссудата крыс Для анализа СОД-активности в 1 мл фосфатного буфера растворяли 5 мкл надосадочной жидкости, полученной из раневого экссудата после центрифугирования. К полученному раствору добавляли реактивы и проводили исследование согласно п. 3.3.11. Результаты выражали в виде относительной активности супероксиддисмутазы, рассчитанной как отношение активности на 3, 4 или 5 дни к активности на 2 день. 3.3.11.3. Определение супероксиддисмутазной активности плазмы крови крыс Для анализа СОД-активности в 1 мл фосфатного буфера растворяли 5 мкл плазмы крови. Результаты выражали в виде относительной супероксиддисмутазной активности (СОД-активность, АСОД) плазмы крови, рассчитанной как отношение АСОД II/АСОД I, где АСОД I – СОД активность плазмы крови, выделенной из крови в начале эксперимента (0 часов), АСОД II – СОД активность плазмы крови через 4 часа после начала эксперимента. 3.3.12. Определение антиоксидантной активности раневого экссудата в системе на основе азодиизобутирамидина гидрохлорида (АДБА) Свойства раневого экссудата изучали с помощью водно-гомогенной модельной системы на основе азодиизобутирамидина гидрохлорида (АДБА), которая является аналогом системы, предложенной Lissi E. [342] с соавт., 132 содержащей азобисамидинопропан гидрохлорид (ABAP). Продукцию RO2• в модельной системе определяли с помощью измерения люминол-зависимой I, усл. ед. хемилюминесценции (ХЛ). АДБА t Время, с Рис. 15. Типичная кривая хемилюминесценции в модельной системы на основе азодиизобутирамидина гидрохлорида (АДБА). Схема определения латентного периода (t). I - интенсивность хемилюминесценции. Принцип метода на основе азосоединений для определения АОА состоит в том, что АДБА в водной среде при 370С подвергается распаду и каждая молекула АДБА разлагается на 2 алкильных радикала, которые в присутствии кислорода превращаются в пероксильные радикалы (RO2•). Эти радикалы в присутствии люминола способны к хемилюминесценции. В пробу добавляли люминол 10 мкМ, 30 мкл экссудата. Объем пробы доводился до 4,95 мл ФБ рН=7,45. После регистрации темнового тока в среду вводилось 100 мкл АДБА (конечная концентрация 5мМ). Кинетику ХЛ регистрировали до выхода интенсивности на стационарный уровень. 133 Латентный период (t) определяли как время от момента введения АДБА до начала развития свечения (Рис. 15). В некоторых экспериментах для сравнения антиоксидантной активности различных образцов экссудата полученный латентный период переводили в эквивалентную концентрацию тролокса, как эффективно работающего в данной системе антиоксиданта. Для определения эквивалентной концентрации тролокса использовали калибровочный график (Рис. 43). Антиоксидантная активность раневого экссудата определялась как отношение эквивалентной концентрации тролокса на 3, 4 или 5 дни после нанесения ран к эквивалентной концентрации тролокса на 2 день. 3.3.13. Измерение антиоксидантной активности раневого экссудата в модельной системе при окислении суспензии фосфолипидных липосом, индуцированном ионами двухвалентного железа Для получения липосом выделяли фосфолипиды из желтков куриных яиц по методу Folch J. с соавт. [343] с последующей очисткой от нейтральных липидов и пигментов в охлажденном обезвоженном ацетоне. Исходную суспензию липосом готовили по методу Bangham A.D. с соавт. [344] с модификациями, описанными Васильевой О.В. с соавт. [345]. Антиокислительную активность раневого экссудата оценивали при Fe2+индуцированном перекисном окислении липидов в трис-буферной системе липосом. При этом регистрировались латентный период и интенсивность медленной вспышки ХЛ (Рис. 53). Данный метод был описан Дреминой Е.С. и сотр. [346] для оценки АОА плазмы крови и подробно изучен Васильевой О.В. и сотр. [345]. 134 3.3.13.1. Получение общей фракции фосфолипидов из желтков куриных яиц Экстракцию общих липидов из желтков куриных яиц проводили по методу Folch J. и соавт. [343]. С этой целью один объем желтка гомогенизировали в течение 30 мин в 20 объемах хлороформ-метанольной смеси (2 : 1 по объему). Далее гомогенат фильтровали через обезжиренный бумажный фильтр для отделения агрегировавшего белка. Промывку полученного липидного экстракта осуществляли путем добавления к нему 1/3 общего объема 0,74% водного раствора KСl и интенсивного перемешивания. После отстаивания в течение 12 часов при 0 - 40С система разделялась на две фазы. Верхнюю - воднометанольную фазу тщательно удаляли. Нижнюю фазу, представляющую собой хлороформный раствор липидов, использовали для получения общей фракции фосфолипидов желтка. Для этого ее переливали в круглодонную колбу и выпаривали с помощью вакуумного роторного испарителя. Сухую липидную пленку смывали 3 - 4 мл гексана и 20-кратным количеством охлажденного ацетона. При этом фосфолипиды выпадали в осадок в виде белых хлопьев. После удаления надосадочной жидкости фосфолипиды высушивали с помощью вакуумного роторного испарителя. Преципитацию фосфолипидов эфиром и ацетоном проводили три раза. Полученные фосфолипиды растворяли в хлороформ-метанольной смеси, в которой они хранились при температуре -200С в течение месяца. Концентрацию фосфолипидов в липидных экстрактах определяли гравиометрически. 3.3.13.2. Приготовление многослойных фосфолипидных липосом Процедуру приготовления многослойных фосфолипидных липосом (ЛС) выполняли по Bangham A.D. с соавт. [344]. Для этого необходимое количество раствора фосфолипидов в хлороформ-метаноле помещали в круглодонную колбу. Метанольный экстракт фосфолипидов упаривали на вакуумном роторном испарителе. Далее сухую липидную пленку смывали со стенок колбы 135 определенным объемом фосфатного буфера (рН 7,45). С целью формирования ЛС более однородных по своему размеру, полученную липосомальную суспензию подвергали криолитической обработке, сначала охлаждая колбу с суспензией ЛС погружением в жидкий азот до полного замораживания ее содержимого, а потом нагревая под струей теплой воды до исчезновения в ней льда. Цикл замораживания-оттаивания повторяли до 5 раз. Перед использованием липосомальные суспензии выдерживали при комнатной температуре не менее 1 ч. В работе использовали суспензию ЛС, содержащую 1 мг фосфолипидов в 1 мл буфера. 3.3.13.3. Измерение антиоксидантной активности раневого экссудата в модельной системе при окислении суспензии фосфолипидных липосом, индуцированном ионами двухвалентного железа Данное исследование проводили в группах крыс, подвергнутых облучению на 2, 3 и 4 дни после нанесения раны. Забор экссудата проводили перед облучением. Для измерения фосфолипидных хемилюминесценции, липосом, в кювету сопровождающей хемилюминометра окисление последовательно добавляли трис-HCl-буфер (20 мМ трис, рН 7.4) до конечного объема 5 мл; 50 мкл исходной суспензии липосом (конечная концентрация фосфолипидов в кювете составляла 0,4 мг/мл), 10 мкл кумарина С-525 (конечная концентрация 0,5 мкМ) и раневой экссудат (40 мкл). Инициирование окисления фосфолипидных липосом осуществляли введением раствора 200 мкл FeSO4 (конечная концентрация 12 мкМ). Все эксперименты проводили при температуре 370С и постоянном перемешивании. Кинетику ХЛ регистрировали до момента наступления максимума интенсивности (I) медленной вспышки. При этом данные представляли в виде отношения I/I0, где I - интенсивность медленной вспышки хемилюминесценции суспензии липосом в присутствии экссудата, I0 - без экссудата. Типичная кинетика представлена на Рис. 53. 136 Латентный период (tm) определяли как время от момента введения железа до максимума свечения (Рис. 53). При этом данные представляли в виде отношения t/t0, где t - латентный период наступления медленной вспышки хемилюминесценции суспензии липосом в присутствии экссудата, t0 - без экссудата. 3.3.14. Измерение флуоресценции эндогенных порфиринов в раневых экссудатах и плазме крови крыс Для регистрации уровня эндогенных порфиринов в биологических образцах (раневых экссудатах и плазме крови крыс) использовали флуориметрический метод. 3.3.14.1. Измерение флуоресценции эндогенных порфиринов в раневых экссудатах крыс с помощью флуориметра Hitachi MPF-4 В работе использовали флуориметр Hitachi MPF-4 (Япония). Длины волн поглощения и флуоресценции были выбраны на основе данных литературы [126, 277]. Длина волны возбуждения - 405 нм, длина волны флуоресценции – 630 нм. Флуоресценцию эндогенных порфиринов регистрировали в раневых экссудатах в день проведения эксперимента. Для этого стеклянную кювету, содержащую 120 мкл нативного раневого экссудата помещали в светонепроницаемое кюветное отделение. Полученные спектры флуоресценции обрабатывали математическими методами для устранения шумов и более точного определения количества порфиринов. Для устранения шумов сначала проводилось накопление спектров, а потом их сглаживание. При накоплении проводилось 9 измерений и для каждой длины волны бралось среднее значение. Затем осуществлялось сглаживание. При этом для каждых соседних трех длин волн находилось среднее значение интенсивности флуоресценции, которое и откладывалось на сглаженном спектре. 137 Содержание эндогенных порфиринов определяли по площади под кривой пика флуоресценции в интервале длин волн от 600 до 660 нм. Была построена калибровочная прямая зависимости площади под кривой флуоресценции от количества протопорфирина IX (Рис. 75). Эта зависимость впоследствии использовалась для определения концентрации эндогенных порфиринов в раневых экссудатах. При регистрации спектра экзогенного протопорфирина IX готовили его раствор в фосфатном буфере с 0,5% тритоном X-100 согласно рекомендациям производителя. 3.3.14.2. Измерение флуоресценции эндогенных порфиринов в раневых экссудатах и плазме крови крыс с помощью оптического спектрометра FS-003V В работе для использовали оптический спектрометр FS-003V (ООО «Кластер», Россия). Схема установки, использованной для измерения флуоресценции эндогенных порфиринов в раневых экссудатах и плазме крови крыс представлена Рис. 16. Измерения флуоресценции проводили с помощью оптического спектрометра FS-003V (ООО «Кластер», Россия), позволяющего проводить дистанционные измерения оптических спектров с поверхности или из объема различных материалов, включая спектры отражения и флуоресценции биологических объектов. В состав спектрометра входят решеточный полихроматор с многоканальным фотоприемником, интегрированные в единый модуль с лазерными источники возбуждения. Для доставки возбуждающего лазерного излучения к исследуемому образцу и регистрируемого излучения флуоресценции 138 к фотоприемнику применялся Y-образный кольцевой волоконно-оптический катетер (7 волокон диаметром 100 мкм с числовой апертурой 0,22). Рабочий диапазон длин волн спектрометра составляет 410-1000 нм, спектральное разрешение при использовании волоконно-оптического катетера – 3 нм. Рис. 16. Установка для измерения флуоресценции эндогенных порфиринов в раневых экссудатах и плазме крови крыс. 1 - светонепроницаемое кюветное отделение, в которое помещалась пластиковая пробирка с плазмой крови крысы. 2 - Y-образный кольцевой волоконно-оптический катетер (7 волоконно-оптический катетер (7 волокон диаметром 100 мкм с числовой апертурой 0.22). 3 - оптический спектрометр FS-003V (ООО «Кластер», Россия). 4 - системный компьютерный блок. В данной работе для возбуждения флуоресценции эндогенных порфиринов использовали излучение диодного лазера с длиной волны 407 нм, которое попадает в полосу Соре в спектре поглощения порфиринов [126]. Длительность 139 импульса составляла 10 мс. Мощность возбуждающего лазерного излучения с конца волоконно-оптического катетера составляла 3 мВт. Флуоресценцию эндогенных порфиринов регистрировали в раневых экссудатах или плазме крови крыс в день проведения эксперимента. Для этого пластиковую пробирку, содержащую 120 мкл нативного раневого экссудата или 200 мкл нативной плазмы крови и волоконно-оптический катетер помещали в светонепроницаемое кюветное отделение и проводили измерения с боковой поверхности пробирки. При измерении флуоресценции в присутствии экзогенного фотосенсибилизатора – к соответствующему образцу добавляли протопорфирин IX (в виде раствора в фосфатном буфере с 0,5% тритоном X-100) так, чтобы добавляемый объем составлял не более 10% от общего объема пробы. Общий объем пробы составлял 120 мкл при исследовании раневого экссудата или 200 мкл при использовании плазмы крови крыс. 140 3.4. Источники и процедура облучения 3.4.1. Источники излучения Для облучения образцов клеток или животных в разных экспериментах использовали лазерные и светодиодные источники монохроматического и широкополосного излучений соответственно. Лазерные источники. Гелий-кадмиевый (He-Cd) лазер (Plasma, Россия) с длиной волны излучения 442 нм и мощностью излучения 20 ± 2 мВт. Твердотельный лазер (LaserCompact, Россия) с длиной волны излучения 532 нм и мощностью излучения 20 ± 2 мВт. Гелий-неоновый (He-Ne) лазер УЛФ-01 (Россия) с длиной волны излучения 632,8 нм и мощностью излучения 13 ± 3 мВт или ЛА-2 (Россия) с длиной волны излучения 632,8 нм и мощностью излучения 7 ± 2 мВт. Лазерный диод (полупроводниковый лазер, НПЦ "ОПТЭЛ", Россия) с широкой полосой излучения 650 ± 5 нм и мощностью излучения 40 ± 5 мВт. Светодиодные источники. В работе использованы светодиодные излучатели производства НПЦ "ОПТЭЛ" (Москва, Россия): У-118БФ с длиной волны излучения 640 ± 5 нм и мощностью излучения 30 ± 5 мВт; У-118Б с длиной волны излучения 630 ± 5 нм и мощностью излучения 1,6 ± 0,2 мВт. В некоторых экспериментах использовали светодиод У-332Б с длиной волны излучения 630 ± 5 нм и мощностью излучения 200 ± 20 мВт. Также были использованы фототерапевтические аппараты на основе полупроводниковых светодиодных матриц производства ФГУП НИИ "Полюс" (Москва, Россия): АСТП-4-1 с длиной волны излучения 655 ± 20 нм и мощностью излучения 60 ± 5 мВт; АСТП-4-2 с длиной волны излучения 520 ± 20 нм и мощностью излучения 12 ± 2 мВт; АСТП-4-3 с длиной волны излучения 450 ± 20 нм и мощностью излучения 12 ± 2 мВт. Вид источника излучения, применяемого в каждой серии экспериментов, указан в соответствующих разделах. 141 3.4.2. Расчет дозы облучения Расчет дозы облучения проводили согласно формуле: D= P ×t S 8 где D – доза облучения, Р (Вт) - мощность излучения на поверхности раны, S (см2) -площадь облучения раны, t (с) - время облучения. Дозу облучения варьировали за счет изменения времени облучения с учетом мощности излучения на уровне облучаемой поверхности. Площадь облучаемого пятна оставалась постоянной в каждой серии экспериментов и указана в соответствующих этим сериям разделах. Мощность излучения определяли, используя дозиметр ИМI-2 (Россия) и РБК 7101 (Россия). 3.4.3. Процедура облучения В экспериментах in vitro каждый образец облучали один раз. В экспериментах in vivo каждое животное облучали один раз в день. 3.4.3.1. Процедура облучения суспензии полиморфноядерных клеток лейкоцитарной фракции крови человека Облучение суспензии полиморфноядерных клеток лейкоцитарной фракции крови человека проводили светоизолированной в силиконированной термостатируемой (37˚C) стеклянной камере при кювете в постоянном перемешивании. Схема проведения эксперимента представлена на Рис. 17. Контрольную пробу инкубировали при тех же условиях, но без облучения. 142 Облучение проводили He-Ne лазером ЛА-2 (Россия). Для этого 0,5 мл опытной или контрольной пробы помещали в термостатируемую кювету и облучали расфокусированным пучком He-Ne лазера с диаметром светового пучка 13 мм. Мощность излучения, которую определяли, используя дозиметр ИМ1-2 (Россия), составляла 7 мВт. Объем облучаемой пробы составлял 0,5 мл раствора ТРИС-НСL (рН=7,4), в которую вносили 5 × 106 клеток. Облучение проводили в течение определенного времени без предварительной инкубации клеток. 3.4.3.2. Процедура облучения суспензии перитонеальных макрофагов крыс Облучение суспензии перитонеальных макрофагов крыс (106 клеток) проводили в силиконированной стеклянной кювете в светоизолированной термостатируемой (37˚C) камере при постоянном перемешивании. Контрольную пробу инкубировали при тех же условиях, но без облучения. В экспериментах с лазерным излучением в качестве источника лазерного излучения в работе использовали He-Ne лазер УЛФ-01 (Россия) (λ = 632,8 нм). Пучок излучения направляли на образец через световод. При этом средняя мощность лазерного излучения, измеренная с помощью дозиметра РБК 7101 (Россия), составляла на уровне образца 11 мВт. Диаметр светового пучка составлял 1 см. В некоторых экспериментах для снижения мощности излучения и, соответственно, более плавного контроля за временем экспозиции, использовали светофильтр НС8, установленный непосредственно над образцом. Так же использовали светодиодные излучатели марки У-118БФ, У-332Б и У-118Б производства НПЦ "ОПТЭЛ" (Москва, Россия). При облучении клеток мощность подавалась такая же как и при облучении лазером. Диаметр пучка на верхней поверхности суспензии клеток был 1см. 143 3.4.3.3. Процедура облучения крыс 3.4.3.3.1. Процедура облучения крыс при использовании модели экспериментальной раны Облучение производили на 2, 3, 4 и 5 дни после создания раны. Крысы контрольной группы подвергались тем же манипуляциям, что и крысы опытных групп, но облучения ран у них не проводилось. Облучение ран у опытных крыс производилось таким образом, чтобы диаметр пучка лазера, падающего на рану совпадал с внутренним диаметром кольца, т.е. площадь пятна была равна 3.14 см2. В качестве источников излучения в разных сериях экспериментов были использованы лазерные и светодиодные источники. Лазеры: He-Cd лазер, He-Ne лазер (УЛФ-01) и твердотельный лазер. Светодиоды: фототерапевтические аппараты производства ФГУП НИИ "Полюс": АСТП-4-1, АСТП-4-2 и АСТП-4-3. Так же применяли светодиодные излучатели производства НПЦ "ОПТЭЛ": У118БФ; У-118Б. В некоторых экспериментах с воздействием больших доз излучения использовали светодиод У-332Б (НПЦ "ОПТЭЛ"). Мощность лазерного излучения измерялась дозиметром ИМI-2 (Россия) на уровне раны и составляла для He-Cd лазера 20 мВт, а для He-Ne лазера, твердотельного лазера и светодиодных источников - 9 мВт. 3.4.3.3.2. Процедура облучения крыс при использовании модели эндотоксического шока Облучение проводили через 3 часа после первого забора крови (Таблица 2). Животным давали наркоз, после чего облучали внутреннюю поверхность уха таким образом, чтобы центр пучка лазера попадал на центр облучаемой зоны (диаметр зоны – 0,7 см). Ушная раковина обладает разветвленной капиллярнососудистой сетью, близко расположенной к поверхности ушной раковины. 144 Первый забор крови, 0 часов (без воздействий) Введение ЛПС животным из соответствующих групп (в других группах животным вводили только физиологический раствор) Облучение животных (уха) из соответствующих групп, 3 часа после начала эксперимента, (в других группах животных подвергали темновой инкубации) Второй забор крови, 4 часа Таблица 2. Схема проведения эксперимента при использовании модели эндотоксического шока Поэтому, облучая поверхность уха, мы имели возможность достичь эффективного проникновения излучений видимого диапазона спектра до капилляров дермы. Группы крыс без облучения подвергались тем же манипуляциям, но не облучались. 145 В качестве источников излучения в разных сериях экспериментов были использованы лазерные и светодиодные источники. Лазеры: He-Cd лазер, He-Ne лазер (УЛФ-01) и твердотельный лазер. Светодиоды: фототерапевтические аппараты производства ФГУП НИИ "Полюс": АСТП-4-1, АСТП-4-2 и АСТП-4-3. В работе использованы светодиодные излучатели производства НПЦ "ОПТЭЛ": У-118БФ; У-118Б. В некоторых экспериментах использовали светодиод У-332Б с длиной волны излучения 630 ± 5 нм и мощностью излучения 200 ± 20 мВт. Мощность лазерного излучения измерялась дозиметром ИМI-2 (Россия) на уровне внутреннtq поверхностb уха и составляла для He-Cd лазера 20 мВт, а для He-Ne лазера, твердотельного лазера и светодиодных источников - 13 мВт. 146 4. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 4.1. Инициирование низкоинтенсивным лазерным излучением перекисного окисления липидов мембран лейкоцитов при облучении in vitro Ранее в нашей лаборатории уже проводилось изучение некоторых этапов фотодинамического механизма действия низкоинтенсивного лазерного излучения (НИЛИ). Так, было показано, что после облучения в красном диапазоне спектра (длина волны излучения 632,8 нм) происходит прайминг и последующее изменение функциональной активности лейкоцитов крови человека [25, 26, 32, 90]. Напомню, что именно таким клеткам уделяется особое внимание в рамках гипотезы фотодинамического действия НИЛИ. Согласно этой гипотезы, к праймингу приводит фотоиндуцированное перекисное окисление липидов (ПОЛ) мембран клеток (и, в меньшей степени, липопротеинов плазмы крови), которое инициирует изменение концентрации цитозольного кальция. При этом ПОЛ вызывается синглетным кислородом и свободными радикалами, образовавшимися в результате взаимодействия эндогенного фотосенсибилизатора с квантом излучения. В "Обзоре литературы" обсуждались работы, посвященные фотоиндуцированному ПОЛ при действии НИЛИ. В частности, нами ранее показано инициирование перекисного окисления липидов при лазерном облучении липосом и липопротеинов плазмы крови человека без и в присутствии экзогенных фотосенсибилизаторов [25, 29]. Влияние таких процессов на функции биологических мембран мы оценивали по индуцированному НИЛИ гемолизу эритроцитов крови [25, 29-31]. Однако остался экспериментально неподтвержденным важный вопрос происходит ли перекисное окисление липидов собственно мембран лейкоцитов и, если происходит, то зависит ли это процесс от дозы облучения. 147 Схема проведения экспериментов данного раздела представлена на Рис. 17. Проводили облучение in vitro суспензии клеток лейкоцитарной фракции человека гелий-неоновым присутствии лазером. экзогенного При необходимости фотосенсибилизатора облучение (ФС). Все проводили в исследования проводили сразу после облучения. Темновая инкубация Облучение Облучение + фотосенсибилизатор Рис. 17. Схема проведения экспериментов с клетками лейкоцитарной фракции крови человека при облучении in vitro. Контрольные образцы подвергались темновой инкубации время, равное времени облучения в опытных образцах 148 4.1.1. Инициирование низкоинтенсивным лазерным излучением перекисного окисления липидов мембран клеток лейкоцитарной фракции крови и зависимость этого эффекта от дозы облучения Ранее нами обнаружено накопление ТБК-активных продуктов в липопротеинах плазмы крови человека [25]. Однако, не было измерено накопление продуктов перекисного окисления липидов в мембранах клеток лейкоцитарной фракции при их облучении in vitro. Для исследования этого вопроса в данной серии экспериментов был использован гелий-неоновый лазер ЛА-2, излучающий в красной области спектра. Именно красное излучение часто используют в медицине в силу большей глубины проникновения в биологические ткани (по сравнению с синим и зеленым диапазонами видимого спектра). Рис. 18. Накопление ТБК-активных продуктов в суспензии клеток лейкоцитарной фракции крови человека в зависимости от дозы облучения He-Ne лазером. Количество клеток в опытных образцах составляло 1 млн. 149 Нами обнаружено, что низкоинтенсивное лазерное облучение (в дозе 0,3 1,6 Дж/см2) клеток лейкоцитарной фракции крови человека приводит к увеличению содержания продуктов перекисного окисления липидов, таких как ТБК-активные продукты (Рис. 18). При этом количество ТБК-активных продуктов монотонно возрастало с увеличением дозы облучения. При дозах 1 и 1,6 Дж/см2 концентрация ТБК-активных продуктов окисления липидов составляла от 0,277 до 1,292 нмоль/10 млн. клеток. В следующей серии экспериментов мы оценили количество диеновых коньюгатов (ДК), образующихся в мембранах клеток лейкоцитарной фракции при облучении светом He-Ne лазера. Рис. 19. Накопление диеновых коньюгатов в суспензии клеток лейкоцитарной фракции крови человека в зависимости от дозы облучения He-Ne лазером. Количество клеток в опытных образцах составляло 1 млн. 150 При этом были выбраны меньшие дозы облучения (до 1 Дж/см2), так как диеновые коньюгаты относят к первичным продуктам ПОЛ и мы предполагали, что такие дозы облучения будут достаточными в данных экспериментах. И действительно, мы обнаружили, что количество диеновых коньюгатов в мембранах клеток лейкоцитарной фракции увеличивается пропорционально дозе облучения (Рис. 19). Так при дозе облучения 0,5 Дж/см2 количество ДК составило 1,38 усл. ед./10 млн. клеток, а при дозе 1,0 Дж/см2 - 1,52 усл. ед./10 млн. клеток. Таким образом, можно заключить, что при облучении клеток лейкоцитарной фракции крови человека in vitro НИЛИ в красной области спектра действительно происходит процесс перекисного окисления липидов мембран клеток. 4.1.2. Инициирование низкоинтенсивным лазерным излучением перекисного окисления липидов мембран клеток лейкоцитарной фракции крови в присутствии экзогенного фотосенсибилизатора протопорфирина IX Как уже отмечалось, фотодинамическая теория о механизме действия света предполагает, что в качестве первичных фотоакцепторов выступают фотосенсибилизаторы, которыми могут быть, например, эндогенные порфирины. Именно в результате фотосенсибилизированных реакций образуются активные формы кислорода (АФК), инициирующие ПОЛ мембран клеток. В связи с этим представляло интерес исследовать процесс накопления продуктов окисления липидов мембран лейкоцитов после их совместного облучения в присутствии экзогенного фотосенсибилизатора порфириновой природы. Поэтому мы провели эксперимент, облучая суспензию лейкоцитов in vitro красным НИЛИ в присутствии протопорфирина IX (ПП IX). В результате мы наблюдали накопление продуктов пероксидации липидов при облучении клеток в присутствии ПП IX, добавленного извне. Мы обнаружили, что в присутствии ФС - с увеличением дозы облучения от 0,1 до 1,0 151 Дж/см2 количество продуктов перекисного окисления липидов (диеновых коньюгатов) возрастало (Рис. 20). Рис. 20. Накопление диеновых коньюгатов в суспензии клеток лейкоцитарной фракции крови человека в зависимости от дозы облучения He-Ne лазером, после облучения клеток в присутствии протопорфирина IX (2 нМ). Количество клеток в опытных образцах составляло 1 млн. Принципиальный характер дозовой зависимости не изменился, по сравнению с экспериментами без применения фотосенсибилизатора (Рис. 19). Однако, необходимо отметить, что при сравнении накопления диеновых коньюгатов в образцах без и в присутствии фотосенсибилизатора, - в последнем случае количество данных продуктов окисления липидов было меньше. Можно предположить, что, являясь первичными продуктами ПОЛ, диеновые коньюгаты при облучении клеток в присутствии ФС быстрее превращаются в другие промежуточные продукты окисления липидов. Таким образом, можно заключить, что при лазерном облучении in vitro клеток лейкоцитарной фракции происходит накопление продуктов окисления 152 липидов мембран клеток. Облучение проводилось в красной области спектра без и в присутствии экзогенного фотосенсибилизатора протопорфирина IX. Присутствие экзогенного порфирина в суспензии клеток при облучении принципиально не меняло характер изменения уровня продуктов ПОЛ, но, вероятно, ускоряло процесс окисления мембранных липидов. 153 4.2. Влияние низкоинтенсивного лазерного излучения на продукцию активных форм кислорода и азота лейкоцитами и макрофагами при облучении in vitro. В "Обзоре литературы" обсуждалась важная роль лейкоцитов и макрофагов, которая выделяется этим клеткам в рамках гипотезы фотодинамического действия НИЛИ. Особенности таких клеток, а именно способность к праймингу и огромные возможности по выработке широкого круга мессенджеров, а также их представленность практически во всех биологических структурах (тканях и органах) позволяют предположить то, что именно эти клетки могут быть ответственны за системные эффекты НИЛИ при облучении in vivo. Тем ни менее остались нерешенными некоторые вопросы, связанные с реализацией фотодинамического механизма и при облучении клеток in vitro. Так, ранее нами показано изменение функциональной активности лейкоцитов после их облучения красным светом лазера in vitro без и в присутствии экзогенных фотосенсибилизаторов порфириновой природы. Однако, не было проведено экспериментов по изучению взаимосвязи процессов ПОЛ в мембранах лейкоцитов и последующего изменения их функциональной активности. Кроме того, несмотря на то, что макрофаги являются клетками, способными к праймингу, - не было проведено экспериментов по изучению лазериндуцированного изменения их активности в рамках фотодинамической гипотезы действия НИЛИ. Также необходимо отметить, что, все предыдущие эксперименты проводились сразу после облучения лейкоцитов. При этом мы изучали "быстрые" эффекты НИЛИ. Однако, в медицинской практике наблюдаются так называемые "отложенные во времени" или "отсроченные" эффекты НИЛТ, проявляющиеся не раньше, чем через сутки после лазерной терапии. В связи с этим в данном разделе мы провели эксперименты по изучению фотоиндуцированного изменения активности макрофагов через 24 часа после облучения. 154 4.2.1. Изменение продукции активных форм кислорода клетками лейкоцитарной фракции крови при увеличении продуктов окисления липидов мембран под действием лазерного излучения Согласно фотодинамической гипотезы действия НИЛИ именно окисление мембранных липидов клеток ведет к изменению концентрации кальция в них и последующему изменению клеточной активности. Как уже отмечалось, ранее нами было показано дозо-зависимое изменение содержания цитозольного кальция в лейкоцитах при облучении НИЛИ в красном диапазоне спектра. Однако представляло интерес исследовать взаимосвязь процессов ПОЛ и изменения активности лейкоцитов после облучения. Если эти три процесса, а именно ПОЛ мембран, изменение концентрации внутриклеточного кальция и последующее изменение активности клеток последовательно происходят после облучения, значит все они должны проявить взаимозависимость. Одновременного исследования накопления продуктов ПОЛ и изменения функциональной активности лейкоцитов ранее нами проведено не было. Для оценки функциональной активности лейкоцитов мы использовали метод люминол-зависимой хемилюминесценции (ХЛ) при стимулировании клеток зимозаном. Хемилюминесцентный ответ (или индекс прайминга) клеток представляли как отношение интенсивности ХЛ после облучения к таковой до облучения. (Подробности см. в соответствующих разделах "Обзора литературы" и "Материалов и методов"). Данным методом в основном исследуется изменение продукции супероксид-анион радикала клетками лейкоцитарной фракции, что является одним из самых мощных проявлений активации лейкоцитов. Эксперименты были проведены с клетками тех же доноров, что и на Рис. 18 и Рис. 19. Схема проведения экспериментов данного раздела представлена на Рис. 17. Проводили облучение in vitro суспензии клеток лейкоцитарной фракции человека гелий-неоновым лазером. Все исследования проводили сразу после облучения, оценивая тем самым так называемые "быстрые" эффекты НИЛИ. 155 Рис. 21. Накопление ТБК-активных продуктов в суспензии клеток лейкоцитарной фракции крови человека (А или Рис. 18) и изменение хемилюминесцентного ответа (I/I0) клеток лейкоцитарной фракции крови человека (Б) в зависимости от дозы облучения He-Ne лазером. Для оценки индекса прайминга здесь и далее использовали интенсивности метод люминол-зависимой хемилюминесценции хемилюминесценции. контрольного и опытного I0 и I - образцов соответственно. В обоих случаях (А и Б) исследования проводили на клетках, выделенных из крови одного и того же донора. Представлены типичные зависимости. Количество клеток в опытных образцах составляло 1 млн. (А) и 0,2 млн. (Б) Нами было обнаружено, что увеличение концентрации ТБК-активных продуктов ПОЛ мембран лейкоцитов сопровождалось изменением их функциональной активности (Рис. 21). Так, при облучении суспензии клеток лейкоцитарной фракции в диапазоне доз 0,32 - 1,6 Дж/см2 на фоне возрастания концентрации продуктов ПОЛ (Рис. 21 А) происходило колоколообразное изменение функциональной активности клеток 156 лейкоцитарной фракции (Рис. 21БРис. 18). При дозах облучения 1 и 1,6 Дж/см2 происходило увеличение количества продуктов окисления липидов от 0,277 до 1,292 нмоль/10 млн. клеток (Рис. 21 А), но уменьшение активности клеток (Рис. 21 Б) - индекс прайминга составил 278,2 и 89,3% при дозах 1 и 1,6 Дж/см2, соответственно. При небольших дозах облучения (менее 1 Дж/см2) как количество продуктов пероксидации липидов, так и активность клеток возрастали. Рис. 22. Накопление диеновых коньюгатов в суспензии клеток лейкоцитарной фракции крови человека (А или Рис. 19) и изменение хемилюминесцентного ответа (I/I0) клеток лейкоцитарной фракции крови человека в зависимости от дозы облучения He-Ne лазером (Б). Представлены типичные зависимости. В обоих случаях (А и Б) исследования проводили на клетках, выделенных из крови одного и того же донора. Количество клеток в опытных образцах составляло 1 млн. (А) и 0,2 млн. (Б) В следующей серии экспериментов мы сопоставили изменение функциональной активности лейкоцитов и накопление диеновых коньюгатов, 157 образующихся в мембранах клеток одного и того же донора при облучении суспензии клеток in vitro светом He-Ne лазера. Мы обнаружили, что при лазер-индуцированном накоплении диеновых коньюгатов в мембранах лейкоцитов (Рис. 22, А) происходит изменение активности клеток лейкоцитарной фракций (Рис. 22 Б). Индекс прайминга достигал 200% при дозе облучения 0,5 Дж/см2. При большей дозе облучения (1,0 Дж/см2) активность клеток снижалась и индекс прайминга составил 150%. По результатам данной серии экспериментов показано, что ПОЛ мембранных липидов при малых дозах облучения приводит к активации клеток. Увеличение дозы облучения снижает активирующий эффект НИЛИ. Мы можем предположить, что причина этого кроется в разном количестве кальция, поступающего в цитоплазму при этих процессах. И действительно, ранее нами показано, что концентрация цитозольного кальция растет с увеличением дозы облучения [25, 27]. Известно, что кальций может приводить к запуску различных процессов в клетке, которые при небольшом увеличении содержания кальция приводят к активации клетки, а при повышенном уровне кальция - к снижению ее активности [347]. 4.2.2. Влияние антиоксидантов на индуцированное лазерным облучением изменение продукции активных форм кислорода клетками лейкоцитарной фракции крови По результатам предыдущей серии экспериментов можно заключить, что при облучении клеток лейкоцитарной фракции светом гелий-неонового лазера низкой интенсивности действительно происходит процесс перекисного окисления липидов, который сопровождается изменением функциональной активности клеток. Это, однако, не означает, что вызванная облучением пероксидация липидов была причиной активации клеток. 158 Чтобы уточнить взаимосвязь между фотоиндуцированным ПОЛ мембранных липидов и изменения функциональной активности лейкоцитов мы исследовали влияние антиоксидантов (α-токоферола и ионола) на лазериндуцированное изменение продукции супероксид-анион радикала клетками лейкоцитарной фракции крови человека. В случае прямой взаимосвязи процессов ПОЛ и изменения ХЛ-ответа лейкоцитов после облучения антиоксиданты должны снижать или полностью отменять эффекты НИЛИ. И действительно, было обнаружено, что применение антиоксидантов (αтокоферола и ионола) снимало эффекты, вызываемые действием лазера, а именно - изменение ХЛ -ответа. Рис. 23. Влияние ионола на хемилюминесцентный ответ (I/I0) клеток лейкоцитарной фракции крови человека без и при облучении He-Ne лазером в зависимости от концентрации антиоксиданта. Доза облучения 1,9 Дж/см2 Как видно из Рис. 23 лазерное облучение (в отсутствие антиоксиданта ионола) в дозе 1,9 Дж/см2 приводило к увеличению индекса прайминга клеток 159 лейкоцитарной фракции в среднем на 10% (Рис. 23, красный столбец 0). Без облучения индекс прайминга мы считали равным 100% (Рис. 23, белый столбец 0), что было проверено при соответствующей темновой инкубации клеток. Если облучение проводили в присутствии 0,5 мкМ ионола, который в данной концентрации без облучения не влиял на активность клеток (Рис. 23, белый столбец 0,5), то после облучения влияние ионола снижало индекс прайминга до, примерно, 104% (Рис. 23, красный столбец 0,5). Увеличение концентрации антиоксиданта до 1 мкМ (Рис. 23, белый столбец 1) вызывало угнетение хемилюминесцентного ответа клеток более, чем в 2 раза. Облучение таких клеток приводило к полному исчезновению их активации в ответ на лазерное излучение (Рис. 23, красный столбец 1). Результаты, полученные в присутствии другого антиоксиданта - αтокоферола, показаны на Рис. 24. В отсутствие токоферола лазерное облучение увеличивало активность клеток примерно на 33% (Рис. 24, синий столбец). В присутствии 1 мкМ токоферола степень активации при облучении снизилась до 10% (Рис. 24, сине-зеленый столбец). В отсутствие облучения α-токоферол на активацию клеток лейкоцитарной фракции не влиял (Рис. 24, зеленый столбец). Полученные результаты можно объяснить тем, что под действием лазерного излучения в мембранах клеток лейкоцитарной фракции происходит активация перекисного окисления липидов (Рис. 19, Рис. 20), что в свою очередь приводит к увеличению ответов клеток на стимул (праймингу). Итак, можно утверждать, что продукты ПОЛ играют важную роль в фотодинамическом механизме действия низкоинтенсивного лазерного излучения на клетки лейкоцитарной фракции крови человека. Облучение суспензии клеток лейкоцитарной фракции светом He-Ne лазера интенсифицирует процессы перекисного окисления липидов, регистрируемые как в виде ТБК-реактивных продуктов, так и диеновых конъюгатов. 160 Рис. 24. Влияние α-токоферола на активность клеток лейкоцитарной фракции крови человека при облучении He-Ne лазером. Доза облучения 1,9 Дж/см2. Концентрация токоферола 1 мкМ Биостимулирующее действие лазера усиливались в присутствии экзогенного фотосенсибилизатора облучения (протопорфирина IX). Введение антиоксидантов полностью снимало активацию клеток, вызванную лазерным излучением. Можно полагать, что активирующее действие лазерного излучения на клетки лейкоцитарной фракции обусловлено изменением проницаемости мембран последних для ионов Ca2+ в результате вызванного облучением ПОЛ. Необходимо напомнить, что индуцированное НИЛИ увеличение концентрации внутриклеточного кальция было показано нами ранее [27]. 161 4.2.3. Увеличение продуктов окисления липидов и повышенное изменение хемилюминесцентного ответа лейкоцитов при лазерном облучении в присутствии протопорфирина IX Накопление продуктов пероксидации липидов и активация клеток лейкоцитарной фракции наблюдаются также при облучении клеток в присутствии фотосенсибилизатора (ФС), добавленного извне. В нашей работе в качестве ФС был использован протопорфирин IX и исследования данной серии экспериментов были проведены на клетках одного и того же донора (тоже, что на Рис. 19 и Рис. 20). Рис. 25. Накопление диеновых коньюгатов в суспензии клеток лейкоцитарной фракции крови человека (А или Рис. 20) и изменение хемилюминесцентного ответа (I/I0) клеток лейкоцитарной фракции крови человека (Б) в зависимости от дозы облучения He-Ne лазером. Представлены типичные зависимости. В обоих случаях (А и Б) исследования проводили на клетках, выделенных из крови одного и того же донора. Количество клеток в опытных образцах составляло 1 млн. (А) и 0,2 млн. (Б). Концентрация протопорфирина IX составляла 2 нМ, облучение проводили in vitro в его присутствии в суспензии клеток 162 Необходимо отметить, что темновая инкубация клеток с ПП IX (2 нМ) приводила к небольшому увеличению ХЛ-ответа (примерно на 10%), однако это увеличение было недостоверно (Рис. 25 Б, доза облучения 0 Дж/см2). При небольшой дозе облучения (0,1 Дж/см2) нам не удалось обнаружить достоверного изменения ХЛ-ответа клеток. Однако мы обнаружили, что после облучения суспензии клеток дозами 0,5 и 1 Дж/см2 в присутствии ФС на фоне возрастания концентрации ДК (Рис. 25 А) происходило изменение функциональной активности клеток лейкоцитарной фракции крови человека (Рис. 25 Б). В сравнении с результатами экспериментов без применения протопорфирина IX (Рис. 22) принципиальный характер дозовой зависимости не изменился. Однако, необходимо отметить, что при облучении клеток in vitro в присутствии фотосенсибилизатора происходило существенное увеличение ХЛответа лейкоцитов при дозах облучения 0,5 и 1 Дж/см2 - на 160% и 150% соответственно (Рис. 25 Б). В то время, как после облучения без ФС при этих же дозах ХЛ-ответ увеличивался на 100% и на 50% соответственно. Механизмы такого возрастания активности клеток при добавлении экзогенного ФС и увеличении дозы облучения (а также отсутствие эффекта при малой дозе облучения) могут быть связаны с подключением защитных механизмов самой клетки, например активацией ее антиоксидантных ферментов. Вероятно баланс про- и антиоксидантных факторов определяет итоговый результат воздействия НИЛИ. Фотоиндуцированное изменения в антиоксидантной системе будут изучены нами в следующих разделах. 163 4.2.4. Влияние низкоинтенсивного лазерного излучения на продукцию активных форм кислорода и азота перитонеальными макрофагами крыс В данном разделе было исследовано действие низкоинтенсивного лазерного излучения на другие клетки, способные к праймингу, - перитонеальные макрофаги. При этом облучение проводили in vitro без и в присутствии экзогенных фотосенсибилизаторов порфириновой природы. Сначала. были исследованы эффекты НИЛИ сразу после воздействия, а потом "отсроченные" во времени эффекты излучений. 4.2.4.1. Влияние низкоинтенсивного лазерного излучения на внутриклеточную продукцию активных форм кислорода перитонеальными макрофагами крыс сразу после облучения Результаты данного раздела получены совместно с Полтановым Е. А. и Ильиной С. Е. (РНИМУ им. Н.И. Пирогова) В этой серии экспериментов было исследовано влияние излучения гелийнеонового лазера (УЛФ-01) на внутриклеточную продукцию активных форм кислорода (АФК) перитонеальными макрофагами крыс. Общая схема проведения экспериментов такая же, как на Рис. 17. Для регистрации внутриклеточную продукции АФК был использован флуоресцентный зонд дихлорфлуоресцеиндиацетат DCFH-DA [321, 348-351]. Принцип метода состоит в том, что DCFH-DA, будучи незаряженным и обладая гидрофобными свойствами, легко проникает через клеточную мембрану и в цитоплазме подвергается воздействию цитоплазматических эстераз. В результате этого происходит гидролиз DCFH-DA с высвобождением полярного дихлорфлуоресцеина (DCFH), неспособного диффундировать через мембрану клетки. 164 Под действием АФК (перекиси водорода, пероксинитрита и др.) от DCFH отщепляется водород, результатом чего является образование окисленного дихлорфлуоресцеина – соединения, обладающего флуоресценцией (длина волны возбуждения 501 нм, длина волны испускания флуоресценции 521 нм) [322]. Согласно данным литературы, использование DCFH-DA позволяет зарегистрировать увеличение образования внутриклеточных АФК под действием различных стимулов [348, 350-352]. I/I0, % Доза облучения, Дж/см2 Суспензия Лизат 0 100 ± 15 100 ± 15 4,7 88,6 ± 13,3 103,3 ± 15,5 14,3 102,3 ± 15,3 112,2 ± 16,8 28,6 102,9 ± 15,4 174 ± 26,1 Таблица 3. Влияние низкоинтенсивного лазерного излучения на флуоресценцию суспензии и лизата макрофагов нагруженных 2',7'-дихлорфлуоресциндиацетатом. Примечание. Суспензию макрофагов инкубировали 15 мин в присутствии 5 мкМ DCFH-DA, облучали и измеряли интенсивность флуоресценции зонда в опытных и контрольных (без облучения) образцах. Результаты представлены как отношение интенсивности флуоресценции облученного образца к необлученному контролю (I/I0) Для обнаружения внутриклеточных АФК суспензию макрофагов инкубировали в присутствии DCFH-DA. После этого суспензию макрофагов 165 (опытный образец) облучали и измеряли интенсивность флуоресценции зонда в опытных и контрольных (без облучения) образцах (более подробно см. "Материалы и методы"). Было обнаружено, что лазерное облучение суспензии макрофагов в дозах до 28,6 Дж/см2 в присутствии зонда DCFH практически не сопровождалось изменением интенсивности его флуоресценции (Таблица 3, столбец «суспензия»). 600 I/I0 , % 1 400 2 200 0 0 10 20 30 Доза облучения, Дж/см2 Рис. 26. Влияние низкоинтенсивного лазерного излучения на флуоресценцию лизата (1) и суспензии (2) макрофагов, нагруженных 2′,7′-дихлорфлуоресциндиацетатом, в присутствии «Фотосенса» (1 мкМ). Условия проведения эксперимента такие же, как в Таблица 3. Результаты представлены как отношение интенсивности флуоресценции облученного образца к интенсивности флуоресценции необлученного контроля (I/I0). Образцы содержали "Фотосенс" (1 мкМ). Интенсивность флуоресценции других контрольных образцов (без ФС, без облучения) учтена при расчете опытных значений Мы предполагаем, что низкое содержание эндогенных фотосенсибилизаторов в суспензии перитонеальных макрофагов, по-видимому, и привело к тому, что флуоресцентный зонд дихлорфлуоресцеиндиацетат оказался нечувствительным к действию низкоинтенсивного лазерного излучения в 166 суспензии этих клеток. Однако возможно и то, что макрофаги реагируют на фотовоздействие не сразу непосредственно после облучения. Можно предположить, что в случае макрофагов возможны и "отложенные во времени эффекты" низкоинтенсивных излучений видимого диапазона. Для увеличения флуоресценции зонда мы использовали лизат клеток (Таблица 3, столбец «лизат»). В этом случае было зарегистрировано дозозависимое увеличение свечения зонда. При наибольшей использованной дозе облучения 28,6 Дж/см2 флуоресценция возрастала на 74%. Вероятно это связано с фотоиндуцированным ПОЛ мембран лизированных клеток, которое сопровождается образованием, в том числе и АФК. Тем ни менее для доказательства фотосенсибилизированного характера изучаемых процессов мы использовали в работе экзогенный фотосенсибилизатор - «Фотосенс». И, действительно, облучение суспензии макрофагов в присутствии "Фотосенса" (1 мкМ) привело к появлению более выраженных эффектов (Рис. 26). Так, было обнаружено, что лазерное облучение в присутствии экзогенного ФС приводит к зависящему от дозы возрастанию флуоресценции DCF, которое достигало максимума при дозе 14,3 Дж/см2 (Рис. 26, кривая 2). Эксперимент с лизатом клеток дал аналогичные результаты (Рис. 26, кривая 1), однако эффект был выше. Так, при дозе 28,6 Дж/см2 флуоресценция зонда в лизате возросла на 347%, в то время как в суспензии – на 174%. Необходимо отметить, что в дозе облучения 5 Дж/см2 изменение флуоресценции DCF при облучении суспензии клеток было несколько больше, чем в образце с лизатом. Возможно это связано с тем, что при такой дозе облучения клетки еще сохраняли жизнеспособность и реагировали на облучением повышенной продукцией АФК. Дальнейшее увеличение дозы облучения вело к критическому поражению плазматической мембраны и снижению активности макрофагов. 167 Для уточнения полученных результатов нами было изучено влияние ингибиторов реакций образования активных форм кислорода. В качестве ингибиторов были использованы азид натрия и аскорбат. Мы изучили влияние данных веществ на флуоресценцию лизата перитонеальных макрофагов, инкубированных с DCFH-DA и облученных лазером в присутствии экзогенного фотосенсибилизатора "Фотосенса" (Таблица 4). Было обнаружено, что азид натрия (30 мМ) уменьшал продукцию АФК в образцах в 1,4 раза, а аскорбат (0,5 мМ) – в 1,8 раза. Таким образом, можно заключить, что НИЛИ вызывает образование активных форм кислорода внутри клеток, и этот эффект значительно усиливается в присутствии фотосенсибилизатора «Фотосенса». Азид натрия, мМ I/I0, % Аскорбат, мМ I/I0, % 0 226,6 ± 23 0 412,6 ± 41 30 161,7 ± 16 0,5 232,7 ± 23 Таблица 4. Влияние низкоинтенсивного лазерного излучения на флуоресценцию лизата макрофагов нагруженных DCFH-DA в присутствии 1 мкМ фотосенсибилизатора «Фотосенса» и азида натрия или аскорбата. Примечание. Доза облучения 28,6 Дж/см2. Условия проведения эксперимента и обозначения такие же, как в Таблица 3 Итак, по результатам данной серии экспериментов нами показано увеличение продукции АФК перитонеальными макрофагами крыс сразу после облучения суспензии этих клеток in vitro. Однако для достижения этих результатов нам пришлось использовать довольно большие дозы облучения или применять экзогенный фотосенсибилизатор для усиления процессов. В этом фотоиндуцированные изменения активности макрофагов отличаются от 168 лейкоцитов, которые реагировали на лазерное облучение сразу после облучения в небольших дозах и, зачастую, без добавления фотосенсибилизаторов извне. Однако, можно предположить, что макрофаги ответственны за отсроченные эффекты НИЛИ, что и было исследовано в следующей серии экспериментов. 4.2.4.2. Изменения супероксиддисмутазной активности, а также продукции оксида азота и пероксинитрита перитонеальными макрофагами крыс через 24 часа после лазерного облучения Результаты данного раздела получены совместно с Полтановым Е. А. (РНИМУ им. Н.И.Пирогова). Все предыдущие эксперименты проводились сразу после облучения. При этом мы изучали "быстрые" эффекты НИЛИ на клетки. Однако, в медицинской практике наблюдаются так называемые "отложенные во времени" или "отсроченные" эффекты НИЛТ, проявляющиеся не раньше, чем через сутки после лазерной терапии. В связи с этим в данном разделе мы провели эксперименты по изучению фотоиндуцированного изменения активности макрофагов и через 24 часа после облучения in vitro. Для действия более полного НИЛИ на понимания клетки мы молекулярно-клеточных исследовали изменение механизмов активности супероксиддисмутазы (СОД) и содержания оксида азота и пероксинитрита в перитонеальных макрофагах, подвергнутых облучению He-Ne лазером. Исследования проводили на клетках перитонеального экссудата, полученных из одного и того же животного, одновременно изучали влияние излучения лазера пероксинитрита. на Эти активность СОД, продукцию измерения проводили в нитрита (NO2¯ ) клеточных и суспензиях, инкубированных 24 ч после НИЛИ (или без облучения в случае контрольных образцов). При этом представлены типичные результаты исследований. 169 Схема проведения экспериментов представлена на Рис. 27. Сначала мы исследовали влияние низкоинтенсивного излучения гелийнеонового лазера на активность супероксиддисмутазы макрофагов и продукцию оксида азота (Рис. 28). Последний определяли по методу Грисса и судили о содержании оксида азота по концентрации ионов NO2¯ . Рис. 27. Схема проведения экспериментов по определению продукции активных форм кислорода и азота перитонеальными макрофагами крыс после облучения in vitro и инкубации клеток в течении 24 часов 170 Начальная точка на всех графиках соответствует контрольным образцам (без НИЛИ). Относительное содержание NO2¯ (с/cо) в экспериментальных пробах выражено в процентах по отношению к его содержанию в образцах клеток, не подвергнутых НИЛИ (Рис. 28 А). СОД-активность (Рис. 28 Б) выражена в виде единиц активности на 1 млн клеток (Ед.). Рис. 28. Влияние излучения гелий-неонового лазера на продукцию ионов NO2¯ (А) и СОД-активность (Б) макрофагов. 1 - продукция ионов NO2¯ клетками (с/с0); 2 - то же при инкубации с циклогексимидом (30 мкМ); с0 и с концентрация нитритов в экспериментах без и с облучением клеток соответственно. 3 - СОДактивность клеток (СОД); 4 - то же, что 3, но при инкубации с циклогексимидом (30 мкМ) 171 В результате проведенных экспериментов было установлено, что облучение в диапазоне доз от 0,36 до 14,1 Дж/см2 изменяет концентрацию нитритов (Рис. 28, кривая 1) и СОД-активность в суспензии макрофагов перитонеального экссудата крыс (Рис. 28, кривая 3). Так, при облучении в интервале доз от 0,36 до 0,94 Дж/см2 происходило увеличение СОД-активности, которое с возрастанием дозы до 14,1 Дж/см2 сменялось ее ингибированием. Следует отметить, что увеличение СОД-активности при дозе 0,94 Дж/см2 достигало величины 170,23 ± 34,04 (Ед.), в то время как без облучения активность фермента была 1,23 ± 0,25 Ед. (так как начальные точки на графиках соответствуют контрольным образцам без облучения). Обращает на себя внимание тот факт, что во всех экспериментах изменение СОД-активности (Рис. 28 Б, кривая 3) в ответ на лазерное облучение имело положительную корреляцию с изменением продукции оксида азота (Рис. 28 А, кривая 1). Изменение продукции нитритов макрофагами происходило аналогично сначала возрастая и потом снижаясь с увеличением дозы облучения (Рис. 28, кривая 1). Т.е. в ходе эксперимента (проведенного на одной и той же популяции клеток), результаты которого приведены на Рис. 28, было обнаружено возрастание продукции как ионов NO2¯ , так и СОД-активности в интервале доз лазерного облучения от 0,36 до 0,94 Дж/см2, достигая максимума при дозе 0,36 Дж/см2 для ионов NO2¯ (Рис. 28 А, кривая 1) и 0,94 Дж/см2 для СОД-активности (Рис. 28 Б, кривая 3). Дальнейшее снижение СОД-активности сопровождалось снижением концентрации ионов нитрита в суспензии макрофагов. Важно отметить, что инкубация этих же клеток в присутствии циклогексимида (ингибитора синтеза белка) (30 мкМ) отменяла лазериндуцированное увеличение продукции NO2¯ и СОД-активности (Рис. 28, кривые 2 и 4 соответственно). Следовательно, можно предположить, что НИЛИ макрофагов в данном примере индуцировало синтез белков (индуцибельной NOсинтазы – iNOS и СОД) de novo, что выражалось в лазер-индуцированном увеличении продукции оксида азота и активности СОД (Рис. 28, кривые 1 и 3). 172 Так как уровень оксида азота может быть связан с продукцией пероксинитрита, было исследовано изменение содержания последнего при действии НИЛИ. перитонеальными Определение макрофагами продукции крыс пероксинитрита проводили методом (ONOO¯ ) регистрации пероксинитритзависимого окисления дигидрородамина 123 (DHR 123, более подробно см. "Материалы и методы"). В ходе экспериментов низкоинтенсивного лазерного было обнаружено, излучения происходит что под действием заметное изменение продукции пероксинитрита клетками (Рис. 29, кривая 1). Необходимо напомнить, что при этом основное увеличение продукции ионов нитрита наблюдалось в диапазоне доз от 0,36 до 0,94 Дж/см2 с максимумом продукции при дозе 0,36 Дж/см2 (Рис. 29, кривая 3 или (Рис. 28 А, кривая 1). Дальнейшее возрастание дозы НИЛИ приводило к снижению уровня нитрита. В то же время заметное увеличение продукции пероксинитрита можно было обнаружить только при дозе НИЛИ, равной или выше 0,94 Дж/см2 (Рис. 29, кривая 1). Дальнейшее возрастание дозы облучения приводило к увеличению образования пероксинитрита, которое при дозе 14,1 Дж/см2 составляло 333 ± 15%. Очевидно, что возрастание уровня ONOO¯ приводит к уменьшению продукции NO2¯ (Рис. 29, кривые 1 и 3 соответственно). Этот процесс развивается на фоне снижения активности СОД (Рис. 28, кривая 3), что, вероятно, ведет к увеличению количества супероксид-анион радикалов. Последние, вступая в реакцию с монооксидом азота, приводят к наработке пероксинитрита в суспензии клеток. Для подтверждения того факта, что увеличение люминесценции DHR 123 являлось именно следствием образования пероксинитрита, клетки инкубировали в присутствии 100 мкМ конкурентного ингибитора NO-синтазы – N-монометил-Lаргинина (L-NMMA) (Рис. 29, кривая 2). Обнаружено, что в присутствии ингибитора происходило частичное снижение лазер-индуцированного образования ONOO¯ . 173 Так, если при дозе излучения 14,1 Дж/см2 продукция пероксинитрита составляла 333 ± 15%, то продукция пероксинитрита этими же клетками при той же дозе в присутствии L-NMMA соответствовала только 199 ± 12,6%. Важно отметить, что данные на графике представлены в относительных единицах и абсолютный уровень продукции пероксинитрита в присутствии L-NMMA исходно был ниже, чем в контрольном эксперименте. Обнаруженное снижение интенсивности флуоресценции DHR 123 в присутствии L-NMMA подтверждает участие пероксинитрита в этих реакциях. Рис. 29. Влияния дозы лазерного излучения на образование пероксинитрита и нитритов макрофагами. 1 — образование пероксинитрита интактными клетками, 2 - образование пероксинитрита клетками, проинкубированными в присутствии LNMMA (100 мкМ) (ингибитора NO-синтазы), 3 - образование нитритов. Начальные точки на графиках соответствуют контрольным образцам (без лазерного облучения). Относительное содержание ONOO- и NO2- (c/c0) в экспериментальных пробах выражено в процентах по отношению к содержанию пероксинитрита или нитрита в образцах клеток, не подвергнутых облучению 174 Рассматривая результаты экспериментов по определению СОД-активности и продукции пероксинитрита (Рис. 28 и Рис. 29), можно видеть, что НИЛИ приводит к увеличению продукции оксида азота в интервале доз до 0,94 Дж/см2, активности супероксиддисмутазы – до 0,94 Дж/см2 и продукции пероксинитрита в интервале доз от 0,94 Дж/см2. При этом наиболее значительный прирост образования пероксинитрита наблюдается после снижения продукции NO ниже контрольного уровня и падения СОД-активности. Можно предположить, что в диапазоне низких доз до 1 Дж/см2 пониженное образование пероксинитрита связано с усиленной продукцией СОД (или увеличением ее активности), которая, удаляя супероксид, способствует сохранению оксида азота. 175 4.3. Влияние низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами при облучении in vivo. Итак, нами показано изменение продукции активных форм кислорода и азота клетками, способными к праймингу, - лейкоцитами и макрофагами после лазерного облучения in vitro. Как уже отмечалось выше, этим клеткам отводится важная роль в рамках гипотезы фотодинамического действия НИЛИ. Напомню, что особенности таких клеток, а именно способность к праймингу и огромные возможности по выработке широкого круга мессенджеров, а также их представленность практически во всех биологических структурах (тканях и органах) позволяют предположить то, что именно эти клетки могут быть ответственны за системные эффекты НИЛИ при облучении in vivo. В связи с этим представляло интерес изучить изменение активности лейкоцитов после облучения in vivo. Для этого мы проводили исследования с лабораторными животными (крысами) на двух экспериментальных моделях: экспериментальной кожной раны и экспериментального эндотоксического шока. При этом проводили облучение поверхности кожной раны у крыс в первом случае и облучение ушной раковины при моделировании эндотоксического шока. В последнем случае мы имели возможность оценить эффекты НИЛИ как в норме (не инициируя шок), так и в патологии. 4.3.1. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата при облучении поверхности экспериментальной кожной раны Известно широкое применение низкоинтенсивных излучений видимого диапазона в терапии различных ран, что обсуждалось в разделе "Обзор литературы". Применение света в лечении ран в основном обусловлено двумя терапевтическими эффектами: воздействие на скорость заживления и 176 купирование болевого синдрома, которые в основном определяются характером развития воспалительной стадии при заживлении раны. Как уже отмечалось в "Обзоре литературы", данная стадия во многом связана со свободнорадикальными реакциями и миграцией лейкоцитов в область раны. Клетки лейкоцитарной фракции играют важную роль в заживлении раны, активно участвуя в воспалительной фазе раневого процесса [16, 113, 114, 353]. Кроме того, для исследования роли первичных фотоакцепторов в эффектах НИЛИ и для оптимизации применения различных лазерных источников в медицине - немаловажным является факт выбора длины волны излучения. В данном и последующих разделах в качестве источников излучения были использованы три низкоэнергетических лазера - He-Cd лазер, твердотельный лазер, He-Ne лазер (УЛФ-01) с длинами волн излучения в "синей" (442 нм), "зеленой" (532 нм), "красной" (632,8 нм) областях спектра соответственно. При описании результатов источников, как будут "синий использованы лазер", "зеленый условные обозначения лазер" "красный" и этих лазер" соответственно. 4.3.1.1. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата при облучении in vivo и их зависимость от дозы и длины волны излучения Схема проведения экспериментов описана в разделе "Материалы и методы" и представлена в Таблица 1. Для проведения этой серии экспериментов мы проводили сбор раневого экссудата с поверхности раны со второго по пятый день после операции. Затем выделяли клетки лейкоцитарной фракции из собранного раневого экссудата, определяли их количество и функциональную активность. Последний параметр исследовали методом зимозан-активированной люминолзависимой хемилюминесценции. Результаты представляли в виде отношения 177 интенсивностей ХЛ на 3, 4 или 5 дни после операции (и после облучения) к интенсивности ХЛ на второй день (до облучения). На Рис. 30 представлено изменение функциональной активности клеток лейкоцитарной фракции раневого экссудата в динамике раневого процесса. Рис. 30. Изменение функциональной активности клеток лейкоцитарной фракции раневого экссудата при облучении низкоинтенсивным лазером 0,75 Дж/см2 (А) и 1,5 Дж/см2 (Б) со 2 по 5 день после операции. In – интенсивность ХЛ на 3, 4 или 5 дни (т.е. n = 3; 4 или 5); I2 – интенсивность ХЛ на 2 день. Кривая 1 – контрольная группа (без облучения), 2 – облучение "синим" лазером, 3 – облучение "зеленым" лазером, 4 – облучение "красным" лазером. 178 Видно, что в контрольной группе к пятому дню эксперимента наблюдается уменьшение функциональной активности клеток лейкоцитарной фракции на 70% по сравнению со вторым днем (Рис. 30 А, Б; кривая 1). Аналогичная картина наблюдается и при облучении в "красном" диапазоне в дозе 0,75 Дж/см2 (Рис. 30А, кривая 4), что отражает отсутствие эффекта низкоинтенсивного лазерного излучения в при данных условиях (сочетание длины волны и дозы облучения). Однако в опытных группах с облучением в "зеленом" и "синем" диапазонах при той же дозе облучения выявлено увеличение функциональной активности клеток лейкоцитарной фракции раневого экссудата (Рис. 30А, кривые 2 и 3). Так, при облучении раны синим и зеленым лазерами в дозе 0,75 Дж/см2 функциональная активность клеток раневого экссудата увеличивается на 17% и 51% соответственно. Интересно, что при увеличении дозы облучения ситуация изменилась. Теперь облучение низкоинтенсивным красным лазером с дозой 1,5 Дж/см2 (Рис. 30 Б, кривая 4) вызывает увеличение функциональной активности клеток на 150% по сравнению со вторым днем. Во всех остальных опытных группах функциональная активность клеток достоверно не отличалась от контроля. Итак, можно видеть, что красный лазер оказывает активирующее действие при больших дозах облучения, тогда как синий и зеленый - при вдвое меньших. Мы это связываем с природой первичного фотоакцептора - эндогенного порфирина, экстинкция которого постепенно снижается от синей к зеленой и красным областям спектра (Рис. 31). Вероятно в связи с этим необходима большая доза облучения для достижения терапевтического эффекта в длинноволновой (красной) области. В то время как в коротковолновой (синей) области достаточно небольшой дозы облучения для активации клеток, дальнейшее же увеличение дозы в этом случае приводит к смене активирующего действия НИЛИ на ингибирующее. Было также отмечено, что хотя низкоинтенсивное лазерное излучение в "красном" диапазоне в дозе 1,5 Дж/см2 и увеличивает функциональную 179 активность каждого из клеток лейкоцитарной фракции раневого экссудата, однако какого либо выраженного влияния облучения на их количество в ране не наблюдалось. Рис. 31. Спектр поглощения протопорфирина IX. Цветными линиями указаны длины волн используемых в работе синего, зеленого и красного лазеров На Рис. 32 представлена динамика изменения количества клеток в раневом экссудате в зависимости от дня после операции для контрольной и опытной групп. Достоверных отличий не выявлено. Это может говорить о том, что терапевтический эффект лазерного излучения на раневой процесс, который в той или иной степени может быть опосредован клетками лейкоцитарной фракции раневого экссудата, обусловлен именно увеличением средней активности клеток, но не увеличением количества клеток. Тем ни менее, в случае облучения в "красном" диапазоне в дозе облучения 1,5 Дж/см2 наблюдается тенденция к более раннему уменьшению количества клеток лейкоцитарной фракции раневого экссудата (Рис. 32, кривая 4). Это может свидетельствовать о тенденции к сокращению длительности 180 воспалительной фазы и, следовательно, к раннему исчезновению болевого синдрома. Рис. 32. Изменение количества клеток лейкоцитарной фракции в раневом экссудате крыс при облучении лазером со 2 по 5 день после операции. Nn – количество клеток лейкоцитарной фракции на 3, 4 или 5 дни; N2 – количество клеток лейкоцитарной фракции на 2 день. Кривая 1 – контрольная группа, 2 – облучение "синим" лазером, 3 – облучение "зеленым" лазером, 4 – облучение "красным" лазером. Доза облучения 1,5 Дж/см2 Также представляло интерес выяснить - влияет ли мощность и время облучения на характер фотоиндуцированных эффектов на клетки лейкоцитарной фракции. Например, возможно ли получить активацию клеток лейкоцитарной фракции при низкой дозе НИЛИ, которая, однако, достигнута большим временем облучения. Для изучения этого вопроса был проведен следующий эксперимент. Животных облучали He-Ne лазером (ЛА-2, Россия). Ежедневная доза облучения на 2 и 3 дни после операции была 0,18 Дж/см2. При этом первую экспериментальную группу облучали 77с для достижения данной дозы. 181 Мощность лазера в данной группе была 7,5 мВт. Для облучения второй экспериментальной группы добились снижения мощности лазерного источника в 25 раз за счет удаления его от облучаемой мишени и применения светофильтра НС8 - тем самым время облучения для достижения той же дозы составило 30 мин. Функциональную активность клеток (а именно продукцию супероксиданион радикала) оценивали по хемилюминесцентному ответу (ХЛ-ответу) - I4/I2, где I4 – интенсивность ХЛ 4 день после операции; I2 – интенсивность ХЛ на 2 день. Результаты данной серии экспериментов представлены в Таблица 5. № группы ХЛ-ответ клеток лейкоцитарной фракции раневого экссудата (I4/I2) Группы 1 Контроль (n = 4) 1 0,365 2 77 с (n = 4) 1 0,966* 3 30 мин. (n = 4) 1 0,839** 2 день 4 день Таблица 5. Хемилюминесцентный ответ клеток лейкоцитарной фракции раневого экссудата крыс в зависимости от времени облучения гелий-неоновым лазером. Контроль - группа без облучения. 77с и 30 мин. - группы с облучением, время облучения 77с и 30 мин. соответственно. В обеих экспериментальных группах ежедневная доза облучения (на 2-й и 3-й дни после операции) составляла 0,18 Дж/см2. I4/I2 - хемилюминесцентный ответ, где I4 – интенсивность ХЛ 4 день после операции; I2 – интенсивность ХЛ на 2 день. Отличие от группы "Контроль": * p = 0,05; ** p = 0,01. Достоверного отличия значений между группами, получавшими облучение, не обнаружено Как и в предыдущих экспериментах в контрольной группе наблюдалось снижение активности клеток лейкоцитарной фракции в динамике раневого процесса. Так к четвертому дню после операции ХЛ-ответ клеток составил 36,5% относительно второго дня, т.е. уменьшился почти в три раза (Таблица 5, строка 1). 182 В опытных группах снижение функциональной активности клеток лейкоцитарной фракции раневого экссудата было не столь выраженным - 97 и 84% для двух экспериментальных групп (Таблица 5, строки 2 и 3). При этом выявленное снижение ХЛ-ответов после облучения достоверно отличалось от контроля (проверено с помощью критерия Манна-Уитни). Кроме того, очевидно отсутствие достоверных различий между группами с одной и той же дозой, но разным временем облучения. В результате данных экспериментов показано, что при одинаковой дозе - варьирование времени облучения не приводит к изменению фотобиологического ответа. Это прямое подтверждение того, что наблюдаемые процессы являются результатом однофотонных превращений [203]. Следовательно, пространственная когерентность НИЛИ не должна играть роли в исследуемых процессах (что нами будет показано в соответствующих сериях экспериментов), а сами процессы с большой вероятностью могут быть следствием однофотонного поглощения кванта излучения эндогенным фотосенсибилизатором. 4.3.1.2. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата после введения индуктора синтеза эндогенных порфиринов и облучения in vivo Результаты данного раздела получены совместно с Николаевым А. Е. (МГУ им. М.В. Ломоносова). Как уже отмечалось ранее - одним из самых актуальных вопросов в исследовании терапевтических эффектов НИЛИ является природа первичного акцептора кванта излучения. В нашей лаборатории изучается роль эндогенных порфиринов в этих процессах. В связи с этим представляло интерес исследовать изменение активности лейкоцитов раневого экссудата при введении животным индуктора синтеза эндогенных порфиринов аминолевулиновой кислоты. Для 183 обеспечения одинакового объема вводимого крысам вещества здесь и далее использовали животных с примерно одинаковыми массами - 300 ± 5 г. В экспериментальных группах вещества вводили субфасциально в область раны. В контрольных группах животным вводили эквивалентное количество раствора Хенкса. Как указывалось в "Обзоре литературы" 5-аминолевулиновая кислота (АЛА) является необходимым соединением в цепи синтеза порфиринов (Рис. 5) и используется для индукции их синтеза in vivo, например, в фотодинамической терапии [298, 299, 354]. Структурная формула 5-аминолевулиновой кислоты представлена на Рис. 33. Рис. 33. Структурная формула 5-аминолевулиновой кислоты [355] Для введения в область раны готовили раствор 5-аминолевулиновой кислоты в растворе Хенкса.(2 мг/мл) и вводили субфасциально из расчета 6 мг/кг веса (объем вводимого раствора составлял 0,9 мл). Количество вводимой АЛА было подобрано на основе данных литературы [286, 298, 356, 357] и на основе собственных предварительных экспериментов. Для этого с целью изучения динамики количества эндогенных порфиринов в области раны мы проанализировали научную литературу по применению указанных веществ в ФДТ [39, 264, 284-286, 358] и использовали флуориметрический метод, разработанный нами и описанный в разделе, посвященном эндогенным порфиринам. Было показано, что при введении АЛА повышенный уровень эндогенных порфиринов наблюдался в течении 3-48 часов после инъекции, через 184 48 часов уровень эндогенных порфиринов полностью возвращался к исходному. Поэтому АЛА вводили в день операции, а облучение проводили в следующие два дня, т.е. на второй и третий дни после операции. В качестве источника излучения использовали гелий-неоновый лазер, излучающий в красной области спектра, так как именно для этой области были выявлены наиболее яркие эффекты в предыдущих экспериментах (Рис. 30 Б) и именно излучения в красном диапазоне спектра наиболее часто используют в практической медицине. Максимальные эффекты наблюдали при облучении в красной области спектра при дозе облучения 1,5 Дж/см2. Однако, мы учли, что при введении АЛА увеличится уровень эндогенных порфиринов. Следовательно, можно предположить, что доза для воздействия потребуется меньшая. Поэтому мы остановили выбор на дозе облучения красным лазером 0,75 Дж/см2. Кроме того, была выбрана еще доза 2,2 Дж/см2 для получения более полной картины возможных механизмов действия лазерного излучения в присутствии повышенного содержания эндогенных порфиринов и при действии больших доз облучения. Выполнено шесть групп экспериментов (по 4 - 8 животных в каждой) по индивидуальному и совместному действию лазерного излучения и АЛА на заживление кожных ран: 1 группа – без облучения лазером и введения АЛА; 2 группа – с АЛА, без облучения; 3 группа – только облучение в дозе 0,75 Дж/см2 (без АЛА); 4 группа – с АЛА и последующим облучением в дозе 0,75 Дж/см2; 5 группа – только облучение в дозе 2,2 Дж/см2 (без АЛА); 6 группа – с АЛА и последующим облучением в дозе 2,2 Дж/см2. Облучение проводили гелий-неоновым лазером (УЛФ-01) на 2 и 3 день после операции и введения АЛА. Необходимо отметить, что группа "АЛА" сначала была разделена на 2 подгруппы, каждая из которых выдерживалась в тех же условиях, что и облучаемые крысы в течение времени, соответствующего дозам 0,75 и 2,2 Дж/см2. 185 Однако предварительные эксперименты не показали существенных различий и подгруппы были объединены в одну. В Таблица 6 представлены данные изменения ХЛ-ответа клеток лейкоцитарной фракции раневого экссудата. Достоверные эффекты были обнаружены в двух группах (Таблица 6, выделение жирным шрифтом): с введением аминолевулиновой кислоты и облучением низкоинтенсивным лазером в дозе 0,75 Дж/см2 и с облучением в дозе 2,2 Дж/см2 без введения АЛА. ХЛ клеток лейкоцитарной фракции, In/I2 2 3 день 4 день день Группа 1 0,80 ± 0,21 0,55 ± 0,17 1 0,62 ± 0,23 0,49 ± 0,13 Лазер 0,75 Дж/см2 (N = 9) 1 0,57 ± 0,15 0,91 ± 0,29 ALA+Лазер 0,75 Дж/см2 (N = 5) 1 0,14* ± 0,05 (P = 0.011) 0,29 ± 0,33 1 4,77* ± 1,46 (P = 0.017) 5,31* ± 2,12 (P = 0.043) 1 0,58 ± 0,18 0,55 ± 0,17 Контроль (N = 8) ALA (N = 6) 2 Лазер 2,2 Дж/см (N = 8) ALA+Лазер 2,2 Дж/см2 (N = 4) Таблица 6. Изменение интенсивности хемилюминесценции клеток лейкоцитарной фракции раневого экссудата крыс. I2 – интенсивность ХЛ на 2 день после операции. In – интенсивность ХЛ на 3 или 4 дни после операции. N – объем выборки Во-первых, из представленных данных можно видеть, что в группе, подвергавшейся лазерному облучению в дозе 2,2 Дж/см2 без введения АЛА, активность фагоцитов значительно увеличена (достоверность отличий определена 186 относительно группы "Контроль"). Активность клеток выросла в 5,3 раза к 4-му дню после операции по сравнению с контролем. (Таблица 6). Ранее нами было обнаружено возрастание активности клеток лейкоцитарной фракции раневого экссудата при облучении в красном диапазоне при дозе 1,5 Дж/см2 в 1,9 раза к 4-му дню (Рис. 30 Б, кривая 4). Очевидно, что увеличение дозы облучения до 2,2 Дж/см2 приводит к еще большему возрастанию активности клеток (в 5,3 раза к 4 дню после операции). Группа Количество клеток в ране, млн. 2 день 3 день 1,06 ± 0,44 1,17 ± 0,79 1,58 ± 0,55 1,32 ± 0,56 Лазер 0,75 Дж/см2 (N = 9) 1,35 ± 0,88 1,25 ± 0,65 ALA+Лазер 0,75 Дж/см2 (N = 5) 1,63 ± 0,74 1,22 ± 0,31 Лазер 2,2 Дж/см2 (N = 8) 0,41 ± 0,07 0,83 ± 0,25 ALA+Лазер 2,2 Дж/см2 (N = 4) 1,93 ± 0,62 1,94 ± 0,10 Контроль (N = 8) ALA (N = 6) Таблица 7. Динамика изменения абсолютного числа клеток в ране. 2 день, 3 день, 4 день - дни после операции. N – объем выборки. Количество клеток определяли в раневом экссудате крыс Также достоверные отличия от группы "ALA" наблюдали в группе подвергавшейся лазерному облучению в дозе 0,75 Дж/см2 после введения АЛА, т.е. в условиях повышенного уровня эндогенных порфиринов. При этом, активность фагоцитов на 3-й день, наоборот, снизилась в 4,4 раза по сравнению с группой, получавшей только АЛА без облучения (Таблица 6). 187 Ранее нами было обнаружено отсутствие эффекта на активность клеток лейкоцитарной фракции раневого экссудата при облучении в красном диапазоне при дозе 0,75 Дж/см2 (Рис. 30 А, кривая 4), однако при этом не было индуцировано повышенное содержание эндогенных порфиринов у животных. В данной серии экспериментов при облучении в дозе 0,75 Дж/см2 без введения АЛА также не обнаружено достоверных эффектов (Таблица 6). Очевидно, что увеличение уровня ФС приводит к снижению активности клеток уже на 3 день после операции. Тоже самое мы получаем в группе, получавшей АЛА и облучение в дозе 2,2 Дж/см2. Несмотря на впечатляющий эффект облучения в данной дозе без введения АЛА (Группа "Лазер 2,2 Дж/см2") увеличение уровня эндогенных порфиринов полностью отменяло эффект облучения (Группа "ALA+Лазер 2,2 Дж/см2"). Уменьшение активности клеток лейкоцитарной фракции раневого экссудата может быть отражением ускорения воспалительной стадии за счет интенсификации фотосенсибилизированных реакций в условиях повышенного содержания эндогенных порфиринов. Результатом этих процессов может быть снижение и раннее исчезновение болевого синдрома. С другой стороны, снижение активности клеток может быть результатом смены активирующего влияния излучения на ингибирующее в условиях повышенного содержания фотосенсибилизаторов. Далее было исследовано изменение количества клеток лейкоцитарной фракции в раневых экссудатах крыс. Ранее нами не было показано достоверного изменения этого параметра при облучении красным лазером в дозе 1,5 Дж/см2 по сравнению с контролем (Рис. 32, кривые 1 и 4). В данной части работы достоверных изменений количества клеток так же не обнаружили. Использование АЛА не привело к изменению ситуации. В Таблица 7 представлены данные изменения количества клеток от 2-го на 3-ий день после операции для исследуемых в данном разделе экспериментальных групп. 188 4.3.1.3. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами раневого экссудата после введения экзогенных фотосенсибилизаторов и облучения in vivo Результаты данного раздела получены совместно с Ляпиной Е.А., Ларкиной Е.А., Ткачевской Е.П. (Московская государственная академия тонкой химической технологии имени М.В.Ломоносова). В данной серии экспериментов в качестве экзогенных фотосенсибилизаторов использовали феофорбид а, выделенный из биомассы микроводоросли Spirulina platensis по методу [358, 359], и динатриевую соль протопорфирина IX (Sigma-Aldrich). Структурные формулы феофорбида а и протопорфирина IX представлены на Рис. 34. Протопорфирин IX широко известен своими фотодинамическими свойствами [360]. Феофорбид а по сути является продуктом распада хлорофилла и имеет в своей структуре порфириновое кольцо. Он известен своими фотосенсибилизирующими свойствами, имеет высокий коэффициент экстинкции в красной области спектра (где излучение максимально проникает в ткани) и применяется в фотодинамической терапии [361]. Использование фотосенсибилизаторов, являющихся продуктами распада хлорофилла, широко распространено в связи с доступностью, безвредностью биологического материала и простотой его химической обработки [292, 359]. При определении количества феофорбида а или протопорфирина IX, необходимого для введения крысам, были использованы условия, применяемые в подобных фотобиологических исследованиях на животных. Так, для ФДТ доза ФС, приводящая к некрозу клеток опухоли, составляла 3-10 мг/кг [286, 358]. В нашей работе присутствие ФС было необходимо только для общей стимуляции процессов в организме, поэтому был выбран нижний порог дозы – 3 мг/кг веса 189 тела животного. ФС вводили субфасциально в виде растворов (растворитель: физиологический раствор с 20% ДМСО). Объем раствора для инъекций составлял 2,0 мл. Рис. 34. Структурные формулы протопорфирина IX (А) и феофорбида а (Б) [293] Для изучения динамики содержания ФС в области раны мы проанализировали научную литературу по применению указанных веществ в ФДТ [39, 264, 284-286, 358] и также использовали флуориметрический метод, разработанный и описанный в разделе посвященном эндогенным порфиринам. При этом для протопорфирина IX длина волны возбуждения составляла 405 нм, длина волны флуоресценции – 630 нм, а для феофорбила а - 512 нм и 680 нм [361] соответственно. Было показано, что оптимальный интервал времени между введением феофорбида а или протопорфирина IX и облучением составляло 2 часа, так как к этому времени наблюдалось максимальное накопление ФС в раневых экссудатах крыс. В данной серии экспериментов было исследовано влияние экзогенных фотосенсибилизаторов на активность клеток лейкоцитарной фракции раневого экссудата при облучении гелий-неоновым лазером в дозе 2,2 Дж/см2. 190 На Рис. 35 представлено изменение интенсивности люминол-зависимой хемилюминесценции в динамике заживления ран. Как и в других экспериментах (Рис. 30) в контрольной группе наблюдалась тенденция к постепенному снижению активности клеток в процессе заживления раны (Рис. 35, кривая 1). Рис. 35. Изменение функциональной активности клеток лейкоцитарной фракции раневого экссудата крыс в динамике раневого процесса без (1) и при облучении (2, 3, 4) гелий-неоновым лазером в дозе 2, 2 Дж/см2. Облучение проводили без ФС (2) и с субфасциальным введением ФС: феофорбида а (3) или протопорфирина IX (4). Результаты по группам с фотосенсибилизаторами, без облучения не представлены, так как не отличались от контроля. I2 – интенсивность ХЛ на 2 день, In – интенсивность ХЛ на 3, 4 или 5 дни. При этом введение экзогенных ФС без облучения (данные не представлены) и в облучением (Рис. 35, кривые 3 и 4) не приводили к отличиям от контроля. Тогда как облучение красным лазером в дозе 2,2 Дж/см2 без введения экзогенных ФС вело к существенной активации клеток лейкоцитарной фракции на 3-й и 4-й дни после операции. В данной серии экспериментов интенсивность ХЛ при 191 облучении красным лазером в дозе 2,2 Дж/см2 возросла в 6 и 3 раза к 3-му и 4-му дням после операции соответственно (Рис. 35, кривая 2). Необходимо отметить, что и ранее в такой экспериментальной группе мы наблюдали возрастание активности клеток раневого экссудата на третьи и четвертые сутки в результате облучения гелий-неоновым лазером в такой же дозе (Таблица 6). Различия в степени эффектов в разных сериях экспериментов обусловлены, вероятно, набором индивидуальных особенностей крыс внутри каждой экспериментальной группы. Отмена лазер-индуцированного увеличения ХЛ-ответа лейкоцитов при введении экзогенных ФС вероятно является результатом смены активирующего эффекта излучения на ингибирующий в виду повышенной концентрации фотосенсибилизаторов в области раны. Это является косвенным подтверждением фотосенсибилизированного характера увеличения ХЛ-ответа клеток в ответ на лазерное облучение. Также в ходе эксперимента измеряли количество клеток лейкоцитарной фракции в раневом экссудате крыс в динамике заживления раны. Как и в предыдущих экспериментах никаких достоверных различий между группами обнаружено не было (поэтому результаты не представлены). 192 4.3.2. Системные эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами крови крыс при облучении ушной раковины крыс Известно, что при проведении НИЛТ зачастую проводят облучение точек тела, не связанных напрямую с очагом патологии. Как тогда объяснить терапевтические и побочные эффекты данного лечения при чрезкожном или внутривенном облучении пациентов с различными внутренними болезнями (гипертоническая болезнь, хронический бронхит и другие)? Гипотеза фотодинамического механизма действия НИЛИ позволяет объяснить такие системные эффекты лазерного излучения благодаря тому, что ключевыми клетками здесь являются клетки лейкоцитарной фракции крови. Лазерное облучение вызывает прайминг клеток, которые разносятся с током крови и в патологических очагах реализуют свой потенциал. В данной серии экспериментов проводили облучение ушной раковины, т.к. у нее разветвленная капиллярно-сосудистая сеть расположенная близко к поверхности. 4.3.2.1. Эффекты воздействия низкоинтенсивного лазерного излучения на активность лейкоцитов крови при облучении in vivo и их зависимость от дозы и длины волны излучения Целью исследований данного раздела было изучение влияния низкоинтенсивного лазерного излучения синего (441.2 нм), зеленого (532.5 нм) и красного (632.8 нм) диапазонов разных доз излучения на активность лейкоцитов крови крыс при облучении in vivo. Схема проведения экспериментов представлена в Таблица 8. В начале эксперимента (0 часов) у животных забирали кровь. Через 3 193 часа проводили облучение ушной раковины (т.к. у нее разветвленная капиллярнососудистая сеть, расположенная близко к поверхности). Через 4 часа после начала эксперимента проводили второй забор крови. Такая схема эксперимента связана с тем, чтобы обеспечить единый подход и сравнение данных из этой группы и данных животных, которым инициировали эндотоксический шок (см. следующий раздел и Таблица 2). Первый забор крови, 0 часов (без воздействий) Облучение животных (уха) из соответствующих групп, 3 часа после начала эксперимента, (в других группах животных подвергали темновой инкубации) Второй забор крови, 4 часа Таблица 8. Схема проведения эксперимента по исследованию влияния лазерного излучения на крыс при облучении ушной раковины животных. Исследования проводили на группах крыс без облучения ("Контрольная", № 1) и с облучением ("Облучение", №№ 3 - 8). В группах №№ 3 -8 проводили лазерную терапию в синем, зеленом или красном диапазонах видимого спектра в двух дозах - 0.75 Дж/см2 и 1.5 Дж/см2. Подробное описание экспериментальных групп представлено в Таблица 9. 194 ЛПС, мг/кг Доза облучения Дж/см2 Длина волны излучения нм 10 0 0 — 3 5 0 0.75 441.2 4 6 0 0.75 532.5 5 0 0.75 632.8 6 4 0 1.5 441.2 7 4 0 1.5 532.5 8 10 0 1.5 632.8 № группы Количество крыс в группе Воздействие Группы крыс 1 Контрольная 5 Облучение Облучение (уха) Таблица 9. Экспериментальные группы животных, которым облучали ушную раковину. Функциональную активность клеток лейкоцитарной фракции крови оценивали по интенсивности люминол-зависимой хемилюминесценции в ответ на добавление зимозана. Типичные кинетические кривые хемилюминесценции лейкоцитарной фракции животных, подвергшихся клеток действию ЛПС и/или излучения He-Ne лазера, представлены на Рис. 36. Можно видеть, что в контрольной группе активность клеток лейкоцитарной фракции несколько увеличивалась через 4 часа после начала эксперимента (Рис. 36 А II). Облучение животных светом He-Ne лазера приводило к возрастанию хемилюминесцентного ответа примерно в 2 раза (Рис. 36 Б II) Результаты экспериментов по исследованию изменений ХЛ-ответа клеток при действии разных доз и длин волн излучения представлены на Рис. 37. 195 Рис. 36. Типичные кривые хемилюминесценции клеток лейкоцитарной фракции крови крыс в экспериментах без (А) и с облучением (Б) гелий-неоновым лазером (632.8 нм) в дозе 1.5 Дж/см2. По оси ординат IХЛ - интенсивность хемилюминесценции клеток лейкоцитарной фракции. I (на всех графиках) - без облучения, начало эксперимента, первый забор крови, 0 часов. II (на всех графиках) - второй забор крови, 4 часа после первого забора крови. II интенсивность хемилюминесцентного ответа в 0 часов, III - в 4 часа. Так, в контрольной группе животных активность белых клеток крови практически не изменялась (наблюдалось возрастание в 1.11 ± 0.02 раз) (Рис. 37 А, Б, столбцы 1). При лазерном облучении в дозе 0.75 Дж/см2 синим и красным лазерами (Рис. 37 А, столбцы 2 и 4) нами не обнаружено достоверного изменения функциональной активности клеток лейкоцитарной фракции. Необходимо отметить, что для оценки достоверности различий между экспериментальными группами животных мы использовали непараметрический критерий Манна-Уитни, так как количество особей в выборках было недостаточное (от 4 до 10 – см. Таблица 9) для точной параметрической оценки. 196 Рис. 37. Влияние лазерного излучения на функциональную активность клеток лейкоцитарной фракции крови крыс.. Дозы облучения: 0.75 Дж/см2 (А) и 1.5 Дж/см2 (Б). 1 - без облучения, 2 - облучение лазером в синем (441.2 нм), 3 - в зеленом (532.5 нм), 4 - в красном (632.8 нм) диапазонах спектра. По оси ординат: III/II, где III - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови через 4 часа после начала эксперимента (второй забор крови), II - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови вначале эксперимента (первый забор крови, 0 часов) Однако облучение зеленым лазером приводило к небольшому увеличению ХЛ-ответа клеток (Рис. 37 А, столбец 3)- примерно в 1,2 раза относительно контроля (p = 0,05). При увеличении дозы лазерного облучения до 1.5 Дж/см2 (Рис. 37 Б, столбцы 2 - 4) более эффективным оказалось облучение красным лазером. Возрастание хемилюминесцентного ответа клеток лейкоцитарной фракции составило в 1.81 ± 0.07 (p = 0.0001) раза (Рис. 37 Б, столбец 4). Облучение синим (Рис. 37 Б, столбец 2) и зеленым (Рис. 37 Б, столбец 3) лазером приводило к небольшому снижению ХЛ-ответа клеток в 0.93 ± 0.05 (p = 197 0.01) и 0.95 ± 0.06 (p = 0.02) раз соответственно относительно контроля (1.11 ± 0.02). 4.3.2.2. Эффекты воздействия низкоинтенсивного лазерного излучения на активность лейкоцитов крови при ведении липополисахарида B и облучении in vivo Целью данного раздела было исследование влияния НИЛИ разных доз и длин волн излучения на ХЛ-ответ лейкоцитов крови в условиях генерализованной патологии - эндотоксического шока. Для этого животным соответствующих групп вводили липополисахарид B (25 мг/кг). (подробности см. раздел "Материалы и методы") и проводили облучение ушной раковины. Схема проведения эксперимента представлена в Таблица 2. Описание экспериментальных групп представлено в Таблица 10 и Таблица 9. Результаты экспериментов прошлого раздела использовали в данной серии, как контрольные (Рис. 45). Исследования проводили на группах крыс без введения ЛПС (две группы: "Контрольная" - без ЛПС, без облучения и "Облучение" - без ЛПС с облучением; Таблица 9и Таблица 10) и с введением ЛПС (две группы:" +ЛПС, без облучения" и "облучение + ЛПС"; Таблица 10). Следовательно контрольные группы ("Контрольная" и "+ЛПС") не подвергались облучению лазером. В опытных же группах ("Облучение" и "Облучение+ЛПС") проводили лазерную терапию в синем, зеленом или красном диапазонах видимого спектра в двух дозах - 0.75 Дж/см2 и 1.5 Дж/см2. Эндотоксический шок (сепсис, синдром системного воспаления) и последующий синдром полиорганной недостаточности (СПН) являются одними из наиболее опасных генерализованных патологических состояний. Механизм развития эндотоксического шока в ответ на попадание бактериальных липополисахаридов (ЛПС) в организм включает в себя, в частности, изменение активности лейкоцитов, выброс оксида азота и активных форм кислорода [145, 362]. Так, например, взаимодействие оксида азота с супероксидными радикалами, 198 продуцируемыми фагоцитами, может приводить к образованию пероксинитрита, сильного окислителя и индуктора перекисного окисления липидов. Все это может инициировать изменение свободнорадикального статуса организма. № группы Группы крыс Количество крыс в группе Воздействие ЛПС, мг/кг 1 Контрольная 10 0 0 — 2 + ЛПС 10 25 0 — 9 5 25 0.75 441.2 10 5 25 0.75 532.5 4 25 0.75 632.8 4 25 1.5 441.2 13 4 25 1.5 532.5 14 5 25 1.5 632.8 11 12 Таблица 10. Облучение + ЛПС Экспериментальные Облучение (уха) группы Доза облучения Дж/см2 Длина волны излучения нм животных, которым ввели липополисахарид B (ЛПС) и облучали ушную раковину. Группа "Облучение" (без введения ЛПС) представлена в Таблица 9 Представляло интерес оценить эффекты лазерного излучения в условиях такого генерализованного патологического процесса. С этой целью, в частности, мы исследовали изменения продукции супероксид-анион радикала клетками лейкоцитарной фракции крови. Функциональную активность клеток оценивали по интенсивности люминол-зависимой хемилюминесценции в ответ на добавление зимозана. 199 Рис. 38. Типичные кривые хемилюминесценции клеток лейкоцитарной фракции крови крыс без (А, В) и с введением (Б, Г) липополисахарида. А, Б - без облучения. В, Г - с облучением гелий-неоновым лазером (632.8 нм) в дозе 1.5 Дж/см2. По оси ординат: IХЛ - интенсивность хемилюминесценции клеток лейкоцитарной фракции. I (на всех графиках) - без облучения, без липополисахарида, начало эксперимента, первый забор крови, 0 часов. II (на всех графиках) - второй забор крови, 4 часа после первого забора крови. II А - без облучения, без липополисахарида. II Б - без облучения, с липополисахаридом (25 мг/кг). II В - с облучением, без липополисахарида. II Г - с облучением, с липополисахаридом. II - интенсивность хемилюминесцентного ответа в 0 часов, III - в 4 часа 200 Типичные кинетические кривые хемилюминесценции клеток лейкоцитарной фракции крови животных без (А, В) и с введением (Б, Г) ЛПС и без (А, Б) или с облучением (В, Г) He-Ne лазером, представлены на Рис. 38. Можно видеть, что введение ЛПС вызывает незначительное снижение хемилюминесценции клеток лейкоцитарной фракции через 4 часа (Рис. 38 Б). С другой стороны, облучение животных светом He-Ne лазера само по себе или в сочетании с введением липополисахарида приводило к возрастанию хемилюминесцентного ответа в 2-3 раза (Рис. 38 В и Г соответственно). Представляло интерес сравнить действие лазерного излучения разных длин волн и различной интенсивности. Данные всех экспериментов представлены на Рис. 39. У крыс, которым вводили липополисахарид немного, но статистически достоверно (р = 0.002) активность клеток уменьшалась до 0.85 ± 0.09 раз (Рис. 39 Б, Г, столбец 1). Полученные результаты согласуются с данными литературы [363] и свидетельствуют о снижении продукции клетками лейкоцитарной фракции активных форм кислорода, продуцируемых НАДФН и миелопероксидазой, а также об угнетении их способности к хемотаксису и агрегации при эндотоксиновом шоке [145, 173, 363]. Такое угнетение функций клеток лейкоцитарной фракции при введении ЛПС является следствием чрезмерной активации этих клеток по причине прямого контакта рецепторов с ЛПС, что в конечном итоге приводит к полной дисфункции этих лейкоцитов [314, 363]. Как отмечалось в предыдущем разделе эффекты ЛО на лейкоциты крови без введения ЛПС были выражены очень слабо и заметное увеличение ХЛ-ответа лейкоцитов мы наблюдали только при облучении красным светом в дозе 1.5 Дж/см2 (Рис. 39 В). 201 Рис. 39. Влияние лазерного излучения на функциональную активность клеток лейкоцитарной фракции крови крыс без (А, В) и с введением (Б, Г) липополисахарида. Дозы облучения: 0.75 Дж/см2 (А, Б) и 1.5 Дж/см2 (В, Г). 1 - без облучения, 2 - облучение лазером в синем (441.2 нм), 3 - в зеленом (532.5 нм), 4 в красном (632.8 нм) диапазонах спектра. По оси ординат: III/II, где III максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови через 4 часа после начала эксперимента (второй забор крови), II - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови вначале эксперимента (первый забор крови, 0 часов) 202 Однако в группах животных, получавших ЛПС (Рис. 39 Б и Г) мы наблюдали увеличение активности клеток лейкоцитарной фракции после облучения во всех группах. Можно видеть, что при облучении лазером в зеленом (Рис. 39 Б, столбец 3) и красном (Рис. 39 Б, столбец 4) диапазонах спектра в дозе облучения 0.75 Дж/см2 происходило возрастание хемилюминесценции клеток в 2.31 ± 0.32 (р = 0.003) и 1.93 ± 0.19 (р = 0.007) раза соответственно. После облучения синим лазером также происходил рост хемилюминесцентного ответа клеток лейкоцитарной фракции (Рис. 39 Б, столбец 2), но менее выраженный, он составил 1.11 ± 0.07 (р = 0.03) раз. При увеличении дозы лазерного облучения до 1.5 Дж/см2 (Рис. 39 Г) наблюдалось возрастание активности клеток при облучении любым лазером. Клетки лейкоцитарной фракции активировались – в 1.44 ± 0.18 (р = 0.01) и 2.23 ± 0.34 (р = 0.01) раз для синего (Рис. 39 Г, столбец 2) и зеленого (Рис. 39 Г, столбец 3) диапазонов соответственно. При облучении красным лазером ХЛ-ответ возрастал в 2.17 ± 0.73 раз, однако это увеличение не было статистически достоверным (р = 0.5). Результаты данного раздела экспериментов согласуются с данными полученными после облучения лейкоцитов раневого экссудата (Рис. 30). Опять мы наблюдаем наиболее эффективное действие коротковолновых видимых излучений при меньших дозах облучения, а длинноволновых - при больших. Мы это связываем с природой эндогенных порфиринов, как первичных фотоакцепторов, т.к. у них экстинкция от синей к красной области спектра снижается (Рис. 31). 203 4.3.2.3. Эффекты воздействия низкоинтенсивного лазерного излучения на продукцию активных форм кислорода лейкоцитами крови после введения экзогенных фотосенсибилизаторов протопорфирина IX и додециламида хлорина e6 и облучения in vivo Результаты данного раздела получены совместно с Лохматовым А.В, Шевцовой И.С., Ларкиной Е.А, Ткачевской Е.П. (Московская государственная академия тонкой химической технологии имени М.В.Ломоносова ). В связи с изучаемой нами ролью эндогенных порфиринов в эффектах НИЛТ представляло интерес исследовать рассматриваемые процессы в присутствии экзогенных фотосенсибилизаторов порфиринового ряда. Поэтому целью данного раздела было исследование роли тетрапиррольных фотосенсибилизаторов: протопорфирина IX и додециламида хлорина e6 при низкоинтенсивном лазерном облучении зеленого и красного диапазонов (532.5 нм и 632.8 нм) на характеристики оксидативного стресса в крови крыс в условиях эндотоксического шока. В качестве экзогенных фотосенсибилизаторов (ФС) использовали додециламид хлорина е6, выделенный из биомассы микроводоросли Spirulina platensis по методу [358] и динатриевую соль протопорфирина IX. Хлорин е6 был выбран как новый фотосенсибилизатор, перспективный для применения в фотодинамической терапии [295-297]. Данный ФС имеет в основе порфириновое кольцо. Протопорфирин IX был выбран в качестве препарата сравнения. Структурные формулы и спектры поглощения указанных фотосенсибилизаторов приведены на Рис. 40. Необходимо отметить, что хлорины - ФС порфиринового происхождения широко используются для проведения ФДТ, так как обладают сильной полосой поглощения в красной области [265]. Учитывая большое проникновение красного излучения в биологические ткани (по сравнению с синим и зеленым излучениями), 204 хлорины активно используются и получают их химическим синтезом или модификацией хлорофилла а [265]. Рис. 40. Структурные формулы и спектры поглощения протопорфирина IX (А) и хлорина е6 (Б) Используемый в данной работе хлорин е6, обладает также полосой поглощения в зеленой области. Для данного раздела исследований был выбран зеленый лазер, позволивший получить сравнимые данные для экспериментов по применению хлорина е6, и протопорфирина IX, также имеющего полосу поглощения в зеленой области. Оба фотосенсибилизатора имеют примерно сходную экстинкцию в зеленой области спектра (Рис. 40), поэтому в данной серии экспериментов для облучения животных был применен лазер с длиной волны в этой области (532.5 нм). ФС в количестве 1 мг растворяли в ДМСО, а затем постепенно добавляли физиологический раствор, в котором содержалось 10% ДМСО, доводя общий 205 объем раствора до 1 мл. Опытным группам крыс вводили приготовленные растворы ФС из расчета 3 мг/кг [295, 297, 364], а контрольным вводили смесь ДМСО и физиологического раствора, но без ФС в таком же соотношении, как и для опытных крыс. Доза вводимых ФС (3 мг/кг интраперитонеально) была выбрана сравнимой с дозой, применяемой для флуоресцентной диагностики у пациентов [295, 297, 364]. Облучение, как и в предыдущей серии экспериментов проводили через 2 часа после введения ФС. В первой серии экспериментов было изучено влияние фотосенсибилизаторов (протопорфирина IX или хлорина е6) и лазерного излучения в зеленом диапазоне спектра видимого излучения на функциональную активность клеток лейкоцитарной фракции крови крыс без и при введении липополисахарида B (Рис. 41). Схема проведения эксперимента такая же, как и в предыдущем разделе. Проводили облучение ушной раковины крыс. Изучение воздействия ФС на активность клеток лейкоцитарной фракции в отсутствие облучения (Рис. 41 А, столбцы слева – сплошная заливка) показало, что внутрибрюшинное введение и протопорфирина IX, и хлорина e6, практически не оказывает влияния на интенсивность хемилюминесценции клеток лейкоцитарной фракции у контрольных крыс. Введение же липополисахарида (Рис. 41 А, столбцы справа – градиентная заливка), вызывало достоверное снижение хемилюминесцентного ответа клеток (р = 0.002) в отсутствии ФС (Рис. 41 А-1, столбец справа – градиентная заливка) и выявляло тенденцию к восстановлению активности клеток лейкоцитарной фракции (Рис. 41 А-2,3, столбцы справа – градиентная заливка) после введения фотосенсибилизаторов, хотя этот эффект достоверно не отличался от контроля. Для оценки достоверности различий между экспериментальными группами животных мы использовали непараметрический критерий Манна-Уитни, так как количество особей в выборках было мало (от 3 до 10 – см. Таблица 11) для точной параметрической оценки. 206 Рис. 41. Влияние фотосенсибилизаторов (протопорфирина IX и хлорина е6) и лазерного излучения в зеленом диапазоне спектра на ХЛ-ответ клеток лейкоцитарной фракции крови крыс при введении липополисахарида. А - без облучения. Б - с облучением (длина волны излучения 532,5 нм, доза облучения: 0,75 Дж/см2). 1 - без фотосенсибилизаторов, 2 - с протопорфирином IX (3 мг/кг), 3 - с хлорином e6 (3 мг/кг). Столбцы слева (сплошная заливка) - без введения липополисахарида, столбцы справа (градиентная заливка) - с введением липополисахарида (25 мг/кг). По оси ординат III/II, где III - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови через 4 часа после начала эксперимента (второй забор крови), II максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови вначале эксперимента (первый забор крови, 0 часов) Лазерное облучение ушной раковины животных привело к более существенным эффектам (Рис. 41 Б). В отсутствие фотосенсибилизаторов наиболее выраженный эффект наблюдался при лазерном облучении животных с эндотоксическим шоком (Рис. 41 А-1, столбец справа – градиентная заливка) – активность клеток лейкоцитарной фракции возросла в 1.5 раза по сравнению с контролем (Рис. 41 А-1, столбец справа – сплошная заливка). 1 2 11 11.1 11.2 11.3 12 12.1 12.2 12.3 3 4 5 6 Контрольная Шок Облучение 10 10 6 5 10 крыс в группе Группы крыс Количество № группы 207 Воздействие ЛПС мг/кг — 25 — Облучение(уха) Длина Доза, волны, Дж/см2 нм — — — — 532 632,8 632,8 0.75 0.75 1.5 532 632,8 632,8 0.75 0.75 1.5 — — 532 532 0.75 0.75 ФС, мг/кг — — — Облучение – шок 5 4 5 Протопорфирин IX 4 Протопорфирин IX 3 Протопорфирин IX – шок 3 Протопорфирин IX – облучение 3 Протопорфирин IX – шок – облучение 25 — 25 — 25 Додециламид хлорина е6 4 Додециламид хлорина е6 — 3 Додециламид хлорина е6 – шок 25 Додециламид хлорина е6 – облучение 3 — 3 3 7 8 9 9.1 9.2 9.3 10 Додециламид хлорина е6 – шок – облучение 3 10.1 3 10.2 3 10.3 25 — 3 — — 532 632,8 632,8 0.75 0.75 1.5 532 632,8 632,8 0.75 0.75 1.5 3 Таблица 11. Экспериментальные группы животных У контрольных крыс эффект облучения составил около 20%, при этом хемилюминесцентный ответ возрос с 1,11 ± 0,02 до 1,27 ± 0,08. Такое изменение 208 активности клеток при облучении в отсутствие введения протопорфирина или хлорина, вероятно, связано с наличием эндогенных фотосенсибилизаторов. Введение экзогенных фотосенсибилизаторов (Рис. 41 Б-2,3) крысам без и при введении липополисахаридов приводило к разнонаправленным эффектам. В условиях эндотоксического шока эффект лазерного излучения снижался (Рис. 41 Б-2,3, столбцы справа – градиентная заливка). Это может быть связано с тем, что фотобиологическим процессам свойственна «колоколообразная» зависимость и добавление экзогенного ФС приводило к увеличению поглощенной дозы и смене активации стадией ингибирования. Наиболее выраженный эффект продемонстрировал протопорфирин IX, активность клеток после облучения снизилась с 2.31 ± 0.32 без ФС (Рис. 41 Б-1, столбец справа – градиентная заливка) до 1.14 ± 0.09 с ФС (Рис. 41 Б-2, столбец справа – градиентная заливка). Введение хлорина e6 (Рис. 41 Б-3, столбец справа – градиентная заливка) приводило к снижению эффектов лазерного излучения, однако эти различия были малы. Однако, в группах животных, которым не вводили липополисахарид (Рис. 41 Б, столбцы слева – сплошная заливка), наблюдали обратный эффект. Использование протопорфирина IX (Рис. 41 Б-2, столбец слева – сплошная заливка) практически не оказывало влияния на хемилюминесцентный ответ клеток лейкоцитарной фракции. При этом введение хлорина е6 (Рис. 41 Б-3, столбец слева – сплошная заливка) усиливало эффект лазерного излучения, активность клеток возрастала с 1.27 ± 0.08 (Рис. 41 Б-1, столбец слева – сплошная заливка) до 1.77 ± 0.16. На основании полученных результатов мы можем заключить, что введение протопорфирина IX при данных условиях эксперимента не оказывало влияния на активность клеток лейкоцитарной фракции здоровых крыс (без и после облучения, Рис. 41 А-2) и крыс с экспериментальным эндотоксическим шоком (без облучения, Рис. 41 Б-2 столбец слева – сплошная заливка). Однако, использование этого ФС совместно с лазерным облучением у крыс с эндотоксическим шоком приводило практически к нивелированию эффекта облучения. 209 В то же время, хлорин е6 у контрольных крыс усиливал эффект излучения в зеленом диапазоне (Рис. 41 Б-3 столбец слева – сплошная заливка), а у крыс с экспериментальным эндотоксическим шоком практически не оказывал эффекта (Рис. 41 Б-3 столбец справа – градиентная заливка). То есть хлорин е6 показал эффективность при облучении здоровых животных, а протопорфирин IX животных с патологией. Следовательно, при проведении фотодинамической терапии с данными ФС можно ожидать побочных эффектов с их стороны на клетки лейкоцитарной фракции крови. Однако, протопорфирин IX проявляет себя в такой роли только в условиях воспаления и применения лазерного излучения, а хлорин е6 – при использовании видимого излучения в зеленом диапазоне в условиях отсутствия воспалительной реакции. Кроме того необходимо учитывать уровень эндогенных ФС, т.к. вероятно эффекты эндо- и экзогенных хромофоров суммируются. Ранее нами было показано, что и в отсутствие экзогенных фотосенсибилизаторов лазерное излучение эффективно действует на активность клеток лейкоцитарной фракции, при этом в малых дозах (0.75 Дж/см2) наиболее эффективно облучение в зеленом диапазоне спектра. Увеличение дозы до 1.5 Дж/см2 приводит к усилению вклада излучения в красной области. Представляло интерес исследовать сохранится ли такая закономерность в случае присутствия экзогенных ФС. Для этого мы сравнили эффективность излучения в зеленой и красной областях при дозе облучения 0.75 Дж/см2 и оценили эффективность излучения в красной области при дозе 1.5 Дж/см2 (Рис. 42). В качестве фотосенсибилизатора в данной серии экспериментов был использован хлорин е6 (Рис. 42 Б). Сначала было изучено действие лазерного излучения на клетки лейкоцитарной фракции без экзогенного ФС в данных условиях эксперимента (Рис. 42 А). 210 Рис. 42. Влияние лазерного излучения в зеленом и красном диапазонах на ХЛответ клеток лейкоцитарной фракции крови крыс при введении липополисахарида в отсутствие (А) или в присутствии (Б) фотосенсибилизатора - хлорина е6. А - без фотосенсибилизатора. Б - с хлорином е6 (3 мг/кг). 1 - без облучения. 2 - с облучением в зеленом диапазоне (длина волны излучения 532.5 нм, доза облучения: 0.75 Дж/см2). 3 - с облучением в красном диапазоне (длина волны излучения 632.8 нм, доза облучения: 0.75 Дж/см2). 4 - с облучением в красном диапазоне (длина волны излучения 632.8 нм, доза облучения: 1.5 Дж/см2). Столбцы слева (сплошная заливка) - без введения липополисахарида, столбцы справа (градиентная заливка) - с введением липополисахарида (25 мг/кг). По оси ординат III/II, где III - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови через 4 часа после начала эксперимента (второй забор крови), II - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови в начале эксперимента (первый забор крови, 0 часов) 211 В контрольной группе животных (не подвергавшихся ни действию лазерного излучения, ни ЛПС) активность лейкоцитов крови практически не изменялась (наблюдалось возрастание в 1.11 ± 0.02 раз) (Рис. 42 А-1 и Рис. 41 А-1, столбец слева – сплошная заливка), а у крыс, которым вводили липополисахарид немного, но статистически достоверно (р = 0.002) уменьшалась до 0.85 ± 0.09 раз (Рис. 42 А-1 и Рис. 41 А-1, столбец справа – градиентная заливка). При лазерном облучении в дозе 0.75 Дж/см2 в группах животных без введения ЛПС (Рис. 42 А-2,3, столбцы слева – сплошная заливка) нами не обнаружено достоверного изменения активности клеток лейкоцитарной фракции. Это может быть связано с большим разбросом уровня эндогенных ФС в крови крыс данной группы и недостаточным объемом выборки. Однако в группах животных, получавших ЛПС (Рис. 42 А-2,3, столбцы справа – градиентная заливка) мы наблюдали статистически достоверное увеличение активности клеток лейкоцитарной фракции в обеих группах. Можно видеть, что при облучении лазером в зеленом (Рис. 42 А-2) и красном (Рис. 42 А3) диапазонах спектра происходило возрастание хемилюминесценции клеток в 2.31 ± 0.32 (р = 0.003) и 1.93 ± 0.19 (р = 0.007) раза соответственно. При увеличении дозы лазерного облучения в красной области спектра до 1.5 Дж/см2 (Рис. 42 А-3) обнаружено увеличение хемилюминесцентного ответа клеток лейкоцитарной фракции в 1.81 ± 0.07 (p = 0.0001) раза в группе животных, не получавших инъекцию ЛПС (столбец слева – сплошная заливка) и в 2.17 ± 0.73 раз в группе с ЛПС (столбец справа – градиентная заливка) (р = 0.05). Таким образом, как было показано ранее в наших работах, в малой дозе более эффективно излучение в зеленой области спектра, чем в красной. Однако при возрастании дозы облучения красный свет становится более эффективным при действии на клетки лейкоцитарной фракции. Было интересно выяснить, как повлияет на эту ситуацию введение экзогенных ФС (Рис. 42 Б). Было обнаружено, что при введении хлорина е6 резко возрастала эффективность излучения в красной 212 области спектра (Рис. 42 Б-3,4). Так при дозе облучения 1.5 Дж/см2 у здоровых крыс (в отсутствие ЛПС) активность клеток лейкоцитарной фракции возрастала с 1.01 ± 0.13 (Рис. 42 Б-1, столбец слева – сплошная заливка) до 4.50 ± 0.04 (Рис. 42 Б-4, столбец слева – сплошная заливка). Инъекция ЛПС (столбцы справа – градиентная заливка) привела к существенному усилению эффекта красного света на белые клетки крови как при дозе 0.75 Дж/см2 (Рис. 42 Б-3), так и при 1.5 Дж/см2 (Рис. 42 Б-4). При этом активность клеток лейкоцитарной фракции возрастала с 1.28 ± 0.16 до 3.37 ± 0.31 и 5.03 ± 0.07 соответственно. Очевидно, что подобные эффекты лазерного облучения в присутствии экзогенного ФС необходимо учитывать в клинике при проведении фотодинамической терапии. Чрезмерная активация клеток лейкоцитарной фракции крови, в частности может приводить к раннему исчерпанию ресурсов самих лейкоцитов, а также к повышенной продукции активных форм кислорода, которые могут повреждать здоровые клетки и ткани. Так они могут инициировать окисление мембран клеток крови, например, эритроцитов.. 213 4.4. Влияние низкоинтенсивного лазерного облучения in vivo на антиокислительную активность раневого экссудата и плазмы крови крыс Далее представляло интерес исследовать, что происходит с системой антиоксидантной защиты в условиях индуцированного лазерным облучением in vivo изменения функциональной активности клеток лейкоцитарной фракции, сопровождающейся, как известно, изменением продукции активных форм кислорода. 4.4.1. Эффекты воздействия низкоинтенсивного лазерного излучения на антиокислительную активность раневого экссудата крыс при облучении поверхности экспериментальной кожной раны Для оценки изменения антиокислительной активности (АОА) раневого экссудата использовали два метода: оценка АОА в системе на основе азодиизобутирамидина гидрохлорида (АДБА) и определение супероксиддисмутазной активности (СОД-активности) раневого экссудата. Схема проведения эксперимента представлена в Таблица 1. Проводили облучение поверхности экспериментальной кожной раны у крыс. 4.4.1.1. Эффекты воздействия низкоинтенсивного лазерного излучения на антиокислительную активность раневого экссудата в системе на основе азодиизобутирамидина гидрохлорида (АДБА) и их зависимость от дозы и длины волны излучения В данной серии экспериментов свойства раневого экссудата изучали с помощью модельной системы на основе азодиизобутирамидина гидрохлорида (АДБА), которая является аналогом системы, предложеннной Lissi E. [342] с соавт., содержащей азобисамидинопропан гидрохлорид (ABAP). 214 Принцип метода на основе азосоединений для определения АОА состоит в том, что АДБА в водной среде при 370С подвергается самопроизвольному распаду и каждая молекула АДБА разлагается на 2 алкильных радикала, которые в присутствии кислорода превращаются в пероксильные радикалы (RO2•). Эти радикалы в присутствии люминола способны вызывать хемилюминесценцию люминола. Рис. 43. Калибровочный график для определения эквивалентной концентрации гидрохлорида. с, мкМ тролокса в системе на основе азодиизобутирамидина гидрохлорида эквивалентная концентрация тролокса, мкМ. t, с - длительность латентного периода При введении в систему систему, содержащую АДБА, раневого экссудата мы наблюдали увеличение длительности латентного периода (t). Длительность латентного периода определяется способностью перехватчиков свободных радикалов, находящихся в экссудате ран, взаимодействовать со свободными радикалами. К моменту, когда соединения, находящиеся в экссудате и способные эффективно взаимодействовать с радикалами АДБА расходуются расходуются, - латентный период хемилюминограммы свечения. заканчивается и происходит восстановление 215 Итак, продукцию RO2• в модельной системе определяли с помощью измерения люминол-зависимой хемилюминесценции. Кинетику ХЛ регистрировали до выхода интенсивности на стационарный уровень. Латентный период (t) определяли как время от момента введения АДБА до начала развития свечения (Рис. 15). Для сравнения антиоксидантной активности различных образцов экссудата полученный латентный период переводили с помощью калибровочной прямой (Рис. 43) в эквивалентную концентрацию тролокса, как эффективно работающего в данной системе антиоксиданта. Антиоксидантная активность раневого экссудата определялась как отношение эквивалентной концентрации тролокса на 3, 4 или 5 дни после нанесения ран к эквивалентной концентрации тролокса на 2 день (Рис. 44). На рис. Рис. 44 представлено изменение антиоксидантной активности раневого экссудата со 2 по 5 день после операции. Видно, что в контрольной группе (без облучения) к пятому дню антиоксидантная активность экссудата снижается незначительно (Рис. 44 А,Б; кривая 1). Что же касается опытных групп, то в этом случае наблюдается та же тенденция, что и при фотоиндуцированных изменениях функциональной активности клеток лейкоцитарной фракции раневого экссудата (Рис. 30) и крови (Рис. 39) крыс. Так при большей дозе облучения (1,5 Дж/см2) наиболее эффективным оказался красный лазер. Низкоинтенсивное лазерное излучение в красном диапазоне при этой дозе в увеличивало антиокислительную активность раневого экссудата к пятому дню после операции на 150% по сравнению со вторым днем (Рис. 44 Б, кривая 4). Тогда как эффекты синего и зеленого низкоинтенсивных лазеров при данной дозе облучения не отличались от контроля (Рис. 44 Б, кривые 2 и 3). 216 Рис. 44. Изменение антиоксидантной активности раневого экссудата при облучении лазером в дозе 0,75 Дж/см2 (А) и 1,5 Дж/см2 (Б) со 2 по 5 день. cn – эквивалентная концентрация тролокса на 3, 4 или 5 день (т.е. n = 3; 4 или 5) после нанесения ран; c2 – эквивалентная концентрация тролокса на второй день после операции. Кривая 1 – контрольная группа, 2 – облучение синим лазером, 3 – облучение зеленым лазером, 4 – облучение красным лазером Однако, при дозе 0,75 Дж/см2 (Рис. 44 А, кривые 2 и 3) облучение в синем и зеленом диапазонах спектра повышало АОА раневого экссудата на 22 и 39% 217 соответственно. Необходимо отметить, что при этой дозе облучения было заметно и действие красного лазера (Рис. 44 А, кривая 4). В данной группе антиоксидантная активность увеличивалась на 39% по сравнению со вторым днем. Однако все же эффект красного лазера при дозе 0,75 Дж/см2 был выражен гораздо меньше, чем при дозе 1,5 Дж/см2. 4.4.1.2. Эффекты воздействия низкоинтенсивного лазерного излучения на супероксиддисмутазную активность раневого экссудата крыс и их зависимость от дозы и длины волны излучения Из "Обзора литературы" и результатов экспериментов с перитонеальными макрофагами очевидно, что в реализации молекулярно-клеточных механизмов НИЛТ большое значение имеет такое звено антиоксидантной защиты - как супероксиддисмутазная активность. Поэтому в данной серии экспериментов было изучено фотоиндуцированное изменение СОД-активности раневого экссудата при разных длинах волн и дозах излучения. Влияние низкоинтенсивного лазерного излучения различных длин волн на изменение величины супероксиддисмутазной активности раневого экссудата оказалось впечатляющим. При постепенном снижении СОД-активности раневых экссудатов в контрольной группе - во всех группах, получавших облучение мы наблюдали возрастание СОД-активности. Максимальное действие оказал красный лазер при дозе облучения в 1,5 Дж/см2 (Рис. 45 Б, кривая 4). К пятому дню после операции супероксиддисмутазная активность увеличилась в 8,5 раз по сравнению со вторым днем. Синий и зеленый лазеры (Рис. 45 Б, кривые 2 и 3) увеличивали к такому же сроку СОД – активность в 2 и 2,6 раза соответственно. При дозе облучения 0,75 Дж/см2 синий и зеленый лазеры (Рис. 45 А, кривые 2 и 3) увеличивали к 5-му дню супероксиддисмутазную активность в 4,4 218 и 5,3 раза по сравнению со вторым днем после операции, тогда как красный лазер (Рис. 45 А, кривая 4) всего в 2,2 раза. Рис. 45. Изменение супероксиддисмутазной активности в раневом экссудате в группах крыс с дозами облучения 0,75 Дж/см2 (А) и 1,5 Дж/см2 (Б) со 2 по 5 день. An – супероксиддисмутазная активность на 3, 4 или 5 дни (т.е. n = 3; 4 или 5); A2 – супероксиддисмутазная активность на 2 день после операции. Кривая 1 – контрольная группа, 2 – облучение синим лазером, 3 – облучение зеленым лазером, 4 – облучение красным лазером 219 Однако, эффект и синего, и зеленого, и красного лазера при дозах облучения 0,75 и 1,5 Дж/см2 к пятому дню эксперимента существенно отличался от контроля. Для изучения механизмов изменения СОД-активности раневого экссудата при воздействии низкоинтенсивного лазерного излучения было проведено исследование с препаратом сравнения. В качестве такого препарата была выбрана аскорбиновая кислота. Аскорбат (по 10 мл 5% раствора аскорбиновой кислоты для инъекций) вводили (субфасциально под раневую поверхность) дважды - на первые и третьи сутки после операции, облучение лазером у таких животных не проводили. Дозировка вводимого препарата была выбрана на основе клинических данных по применению аскорбата в эндоскопическом лечении язв [365]. СОД-активность, Аn/А2 Группы № группы 2 день 3 день 4 день 1 Контроль 1 0,79 ± 0,02 0,49 ± 0,09 2 Лазер 1 4,97 ± 0,32 5,11 ± 0,26 3 Аскорбат 1 6,23 ± 3,7 46,90 ± 10,3 Таблица 12. Изменение супероксиддисмутазной активности в раневом экссудате в группах крыс: "Контроль" (N = 8; без облучения, без аскорбата), "Лазер" (N = 4; с облучением He-Ne лазером, доза облучения 1,5 Дж/см2; без аскорбата), "Аскорбат" (N = 6; с введением аскорбата, без облучения). An – супероксиддисмутазная активность на 3 и 4 дни (т.е. n = 3 или 4); A2 – супероксиддисмутазная активность на 2 день после операции. Условия облучения и введения аскорбата см. в тексте В другой экспериментальной группе аскорбат не вводили, но проводили облучение He-Ne лазером (1,5 Дж/см2) на вторые и третьи сутки после операции. 220 Животным из контрольных групп облучение не проводили. Первой контрольной группе вводили эквивалентные (10 количества мл) физиологического раствора в соответствующие дни. Животных второй контрольной группы выдерживали в тех же условиях, что и облучаемых животных, но при выключенном лазере. Необходимо отметить, что результаты в двух контрольных группах не отличались и были объединены в одну. В контрольной группе наблюдали постепенное снижением СОД-активности раневого экссудата к 4-му дню после операции (Таблица 12, строка 1). В экспериментальных же группах наблюдали возрастание исследуемого параметра к 3-им и 4-ым суткам после операции. Для группы, облучаемой лазером, и группы, которой вводили аскорбат, увеличение СОД-активности к третьему дню было сравнимо (в 4,97 и 6, 27 раз соответственно) и существенно отличалось от контроля. № группы Группы 1 ХЛ-ответ, In/I2 2 день 3 день 4 день Контроль 1 0,47 ± 0,11 0,38 ± 0,04 2 Лазер 1 1,57 ± 0,27 2,01 ± 0,25 3 Аскорбат 1 0,78 ± 0,21 1,93 ± 0,13 Таблица 13. Изменение функциональной активности клеток лейкоцитарной фракции раневого экссудата в группах крыс: "Контроль" (N = 10; без облучения, без аскорбата), "Лазер" (N = 4; с облучением He-Ne лазером, доза облучения 1,5 Дж/см2; без аскорбата), "Аскорбат" (N = 6; с введением аскорбата, без облучения). In – интенсивность ХЛ на 3 и 4 дни (т.е. n = 3 или 4); I2 – интенсивность ХЛ на 2 день после операции. Условия облучения и введения аскорбата см. в тексте. К четвертому дню после операции СОД-активность еще более возросла, особенно в группе, которой вводили аскорбиновую кислоту (в 46,9 раз). 221 Необходимо отметить, что количественное сравнение эффектов в данном случае неуместно, так как довольно сложно разработать алгоритм выбора соответствующих друг другу доз аскорбата и облучения в разных группах. Однако качественно сравнение обнаруженных эффектов позволяет оценить данные зависимости, как отражающие сходные механизмы увеличения СОДактивности раневого экссудата в динамике раневого процесса. Представляло интерес сопоставить полученные данные с изменением ХЛответа клеток лейкоцитарной фракции раневого экссудата у крыс из исследованных групп. Нами уже было показано постепенное снижение функциональной активности клеток лейкоцитарной фракции раневого экссудата в динамике раневого процесса без облучения. В данной серии экспериментов получили аналогичный результат в контрольной группе (Таблица 13, строка 1). При облучении ран в "красном" диапазоне спектра функциональная активность клеток наоборот постепенно возрастает (Таблица 13, строка 2). В случае использования аскорбиновой кислоты достоверное увеличение активности клеток произошло на 4-ый день после операции (Таблица 13, строка 3). 4.4.1.3. Влияние низкоинтенсивного лазерного облучения ран на супероксиддисмутазную активность раневого экссудата крыс при введении экзогенных фотосенсибилизаторов - феофорбида а или протопорфирина IX Итак, нами бБыло показано увеличение супероксиддисмутазной активности на 3 -5 -й дни после операции при облучении красным лазером в дозах 0,75 и 1,5 Дж/см2 (Рис. 45, кривые 4). В последнем случае эффект был более сильным (Рис. 45 Б, кривая 4). Представляло интерес исследовать этот параметр в условиях присутствия экзогенных ФС в момент облучения животных. Результаты экспериментов представлены на Рис. 46. Проведено исследованием изменения супероксиддисмутазной активности раневого экссудата крыс в динамике раневого процесса без (Рис. 46, кривая 1) и с облучением (Рис. 46, кривые 2, 3, 4) гелий-неоновым лазером в дозе 2,2 Дж/см2. 222 Облучение проводили без ФС (Рис. 46, кривая 2) и с субфасциальным введением ФС: феофорбида а (Рис. 46, кривая 3) или протопорфирина IX (Рис. 46, кривая 4). Результаты групп с фотосенсибилизаторами, без облучения не представлены, так как не отличались от контроля. Рис. 46. Изменение супероксиддисмутазной активности раневого экссудата крыс в динамике раневого процесса без (1) и при облучении (2, 3, 4) гелий-неоновым лазером в дозе 2,2 Дж/см2. Облучение проводили без ФС (2) и с субфасциальным введением ФС: феофорбида а (3) или протопорфирина IX (4). Результаты по группам с фотосенсибилизаторами, без облучения не представлены, так как не отличались от контроля.. А2 – супероксиддисмутазная активность на 2 день, Аn – супероксиддисмутазная активность на 3, 4 или 5 дни после операции. В данной серии экспериментов мы, как и в предыдущих экспериментах, обнаружили увеличение СОД-активности раневого экссудата при облучении лазером без ФС в дозе 2,2 Дж/см2. При этом возрастание исследуемого параметра было велико - в 34 - 37 раз на 4-й и 5-й дни после операции по сравнению с 223 контролем (Рис. 63, кривая 2). В контрольной же группе и в группах с ФС СОДактивность постепенно и умеренно снижалась в динамике раневого процесса (Рис. 63, кривые 1, 3, 4). Следовательно, мы опять наблюдаем исчезновение эффекта лазерного излучения при облучении ран в присутствии экзогенных ФС. Вероятно, при большой дозе облучения и в условиях повышенного содержания фотосенсибилизаторов происходит смена активирующего действия ЛО на ингибирующее. 224 4.4.2. Системные эффекты воздействия низкоинтенсивного лазерного излучения на антиокислительную активность плазмы крови крыс при облучении ушной раковины крыс В предыдущем разделе результатов после облучения поверхности ран мы наблюдали существенные изменения такого показателя антиокислительной активности раневого экссудата, как супероксиддисмутазная активность. Поэтому представляло интерес исследовать изменения СОД-активности плазмы крови крыс после облучения ушной раковины крыс. Схема проведения эксперимента представлена в Таблица 8 (без введения ЛПС) и Таблица 2 (при введении ЛПС). Для доказательства роли фотосенсибилизированных реакций эксперименты были проведены без и при введении животным экзогенных ФС. 4.4.2.1. Эффекты воздействия низкоинтенсивного лазерного облучения in vivo на супероксиддисмутазную активность плазмы крови крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения Было исследовано изменение супероксиддисмутазной активности (в этом разделе: СОД-активность или АСОД) плазмы крови при действии лазерного облучения на крыс в норме и патологии (без и при введении ЛПС, Рис. 47). Мы обнаружили, что в контрольной группе животных (без ЛПС и без облучения) (Рис. 47 А,В, столбец 1) за 4 часа эксперимента АСОД практически не изменялась, соотношение АСОД II /АСОД I составляло 1.05 ± 0.03. В группе животных, которым вводили ЛПС (Рис. 47 Б,Г, столбец 1), прирост СОД активности: АСОД II / АСОД I = 1.17 ± 0.12 был статистически недостоверен. При дозе облучения 0.75 Дж/см2 в группах животных, которым не вводили ЛПС и облучали зеленым (Рис. 47 А, столбец 3) и красным (Рис. 47 А, столбец 4) 225 лазерами, происходило увеличение СОД активности плазмы крови в 1.78 ± 0.19 (р < 0.001) и 1.57 ± 0.06 (р < 0.01) раза соответственно. Рис. 47. Влияние лазерного излучения на супероксиддисмутазную активность плазмы крови крыс без (А, В) и с введением (Б, Г) липополисахарида. Дозы облучения: 0.75 Дж/см2 (А, Б) и 1.5 Дж/см2 (В, Г). 1 - без облучения, 2 - облучение лазером в синем (441.2 нм), 3 - в зеленом (532.5 нм), 4 - в красном (632.8 нм) диапазонах спектра. По оси ординат А СОД II/А СОД I, где А СОД II иА СОД I - СОД активность плазмы крови крыс, выделенной вначале эксперимента (первый забор крови, 0 часов, А СОД I ) и через 4 часа после начала эксперимента (второй забор крови, А СОД II ) соответственно. 226 А в группе крыс, облученных синим лазером (Рис. 47 А, столбец 2), мы обнаружили падение АСОД в 0.68 ± 0.16 (р < 0.003) раз. В группах животных, которым вводили ЛПС мы наблюдали увеличение АСОД после облучения зеленым лазером (Рис. 47 Б, столбец 3) в 2.56 ± 0.27 (р < 0.003) раз и красным лазером (Рис. 47 Б, столбец 4) – в 1.97 ± 0,17 (р < 0,03) раза. Увеличение дозы лазерного облучения до 1.5 Дж/см2 (Рис. 47 В,Г) почти во всех группах привело к росту СОД активности плазмы крови. Так, в группах животных, которые не получали ЛПС и подвергались облучению красным (Рис. 47 В, столбец 4) и зеленым (Рис. 47 В, столбец 3) лазером произошло увеличение АСОД в 2.24 ± 0.14 (р < 0.0001) и в 1.63 ± 0.27 (р < 0.02) раза соответственно. А в группах животных, которым вводили ЛПС (Рис. 47 Г) при облучении всеми тремя типами лазеров было обнаружено выраженное возрастание СОД активности плазмы. При этом облучение синим лазером (Рис. 47 Г, столбец 2) увеличивало СОД активность в 2.18 ± 0.09 (р < 0.01) раза, зеленым – в 2.47 ± 0.22 (р < 0.01) раза, а красным – в 2.17% ± 0.32 (р < 0.08) раза (Рис. 47 Г, столбцы 3 и 4 соответственно). Следовательно, мы снова наблюдали зависимость эффектов НИЛИ от дозы и длины волны и усиление действия излучений в условиях генерализованной патологии (при введении ЛПС). 4.4.2.2. Эффекты воздействия низкоинтенсивного лазерного облучения in vivo в присутствии экзогенных фотосенсибилизаторов на супероксиддисмутазную активность плазмы крови крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения В данной серии экспериментов мы исследовали изменение супероксиддисмутазной активности (АСОД) плазмы крови крыс при действии 227 лазерного облучения в присутствии и в отсутствие экзогенных ФС протопорфирина IX и хлорина е6 (Рис. 48, Рис. 49). При оценке влияния протопорфирина IX и хлорина е6 на АСОД плазмы крови крыс в отсутствие облучения мы не обнаружили достоверных изменений СОД активности плазмы крови (Рис. 48 А). Облучение в зеленой области спектра в отсутствие экзогенных ФС привело к росту СОД активности (Рис. 48 Б-1). И снова наиболее выраженное действие излучения произошло в группах животных, которым вводили ЛПС (правые столбцы – градиентная заливка). Рис. 48. Влияние фотосенсибилизаторов супероксиддисмутазную активность плазмы и лазерного крови крыс излучения при на введении липополисахарида. А - без облучения. Б - с облучением (длина волны излучения 532.5 нм, доза облучения: 0.75 Дж/см2). 1 - без фотосенсибилизаторов, 2 - с протопорфирином IX (3 мг/кг), 3 - с хлорином e6 (3 мг/кг). Столбцы слева (сплошная заливка) - без введения липополисахарида, столбцы справа (градиентная заливка) - с введением липополисахарида (25 мг/кг). По оси ординат А СОД II/А СОД I, где А СОД II и А СОД I - СОД активность плазмы крови крыс, выделенной вначале эксперимента (первый забор крови, 0 часов, А СОД I ) и через 4 часа после начала эксперимента (второй забор крови, А СОД II ) соответственно. 228 Увеличение исследуемого параметра произошло в 1.7 раз (р = 0.001) в группах животных без эндотоксического шока (Рис. 48 А,Б – 1, левые столбцы – сплошная заливка) и в 2.2 раза (р = 0.03) в группах животных, которым вводили ЛПС (Рис. 48 А,Б – 1, правые столбцы – градиентная заливка). Введение протопорфирина IX (Рис. 48 Б-2) или хлорина е6 (Рис. 48 Б-3) и последующее облучение не привело к существенным изменениям по сравнению с влиянием собственно лазерного излучения без ФС (Рис. 59 Б-1). При сравнении действия излучения в красной и зеленой областях спектра без использования экзогенных ФС (Рис. 49 А) было обнаружено возрастание СОД-активности плазмы крови во всех экспериментальных группах. При этом действие красного лазера было эффективней при большей дозе – 1.5 Дж/см2, что согласуется с результатами других экспериментов. В группах, где животным не вводили ЛПС (левые столбцы – сплошная заливка) максимальное возрастание активности СОД наблюдали после облучения красным лазером в дозе 1.5 Дж/см2 (Рис. 49 А-4). Увеличение АСОД за время проведения эксперимента (4 часа) возросло в 2.1 раза (р = 0.0001) с 1.05 ± 0.03 (Рис. 49 А-1, левый столбец – сплошная заливка) до 2.24 ± 0.14 (Рис. 49 А-4, левый столбец – сплошная заливка). В группах с экспериментальным эндотоксическим шоком наиболее эффективным оказалось излучение зеленого лазера (Рис. 49 А-3), что может быть связано с повышенным уровнем эндогенных порфиринов в условиях воспаления. Произошел рост АСОД в 2.2 раза (р = 0.03) с 1.17 ± 0.12 (Рис. 49 А-1, столбец справа – градиентная заливка) до 2.56 ± 0.27 (Рис. 49 А-2, столбец справа – градиентная заливка). Использование хлорина е6 и последующее облучение в зеленой области спектра (Рис. 49 Б-2) не привело к изменениям в величине активности СОД (Рис. 49 А-2). В то же время, облучение красным лазером совместно с введением хлорина е6 (Рис. 49 Б-3,4) привело к снижению СОД-активности плазмы крови по сравнению с эффектами лазерного излучения в этом диапазоне без данного ФС (Рис. 49 А-3,4). В группах без экспериментального эндотоксического шока наибольшее снижение произошло при дозе 1.5 Дж/см2 – в 1.7 раза (р = 0.032), с 229 2.24 ± 0.14 (Рис. 49 А-4, столбец слева – сплошная заливка) до 1.33 ± 0.07 (Рис. 49 Б-4, столбец слева – сплошная заливка). В группах с эндотоксическим шоком – при дозе 0.75 Дж/см2 – в 1.6 раза (р = 0.05) с 1.97 ± 0.17 (рис. 7А-3, столбец справа – градиентная заливка) до 1.22 ± 0.06 (Рис. 49 Б-3, столбец справа – градиентная заливка). Рис. 49. Влияние лазерного излучения в зеленом и красном диапазонах на супероксиддисмутазную активность плазмы крови крыс при введении липополисахарида в отсутствии (А) или присутствии (Б) фотосенсибилизатора хлорина е6. А - без фотосенсибилизатора. Б - с хлорином е6 (3 мг/кг). 1 - без облучения. 2 - с облучением в зеленом диапазоне (длина волны излучения 532.5 нм, доза облучения: 0.75 Дж/см2). 3 - с облучением в красном диапазоне (длина волны излучения 632.8 нм, доза облучения: 0.75 Дж/см2). 4 - с облучением в красном диапазоне (длина волны излучения 632.8 нм, доза облучения: 1.5 Дж/см2). Столбцы слева (сплошная заливка) - без введения липополисахарида, столбцы справа (градиентная заливка) - с введением липополисахарида (25 мг/кг). По оси ординат А СОД II/А СОД I, где А СОД II и АСОД I - СОД активность плазмы крови крыс, выделенной вначале эксперимента (первый забор крови, 0 часов, А СОД I ) и через 4 часа после начала эксперимента (второй забор крови, А СОД II ) соответственно. 230 По результатам экспериментов с применением хлорина е6 у крыс без эндотоксического шока и при облучении красным лазером в дозе 0.75 Дж/см2 оказалось, что достоверного влияния данный ФС на исследуемые процессы не оказывает (Рис. 42, Рис. 49 – А,Б – 3 – левые столбцы – сплошная заливка). Аналогичные результаты получены при использовании излучения в зеленом диапазоне спектра. Однако, в остальных случаях – при облучении в красном диапазоне в дозе 1.5 Дж/см2 (Рис. 42, Рис. 49 – А, Б – 4) и крыс с экспериментальным эндотоксическим шоком в дозе 0.75 Дж/см2 (Рис. 42, Рис. 49 – А, Б – 3 – правые столбцы – градиентная заливка) наблюдали иную картину. А именно происходило увеличение активности клеток лейкоцитарной фракции (Рис. 42) на фоне снижения АСОД (Рис. 49). Вероятно, в данной ситуации уменьшение СОД-активности свидетельствует о функциональном снижении данного ресурса, который был потрачен на сдерживание фотоиндуцированного перекисного окисления липидов и которого, возможно, «не хватило» на борьбу с гиперпродукцией супероксид анион радикала клетками лейкоцитарной фракции. Итак, необходимо отметить, что наиболее выраженные эффекты на изменение АОА мы наблюдали в условиях воспаления – у крыс с экспериментальным эндотоксическим шоком. Кроме того при дозе облучения (0.75 Дж/см2) наиболее эффективным оказалось излучение в зеленом диапазоне спектра. При дозе 1.5 Дж/см2 сильное влияние оказывало излучение, как в зеленой, так и в красной областях спектра Внутрибрюшинное введение экзогенного ФС – протопорфирина IX – не привело к достоверным эффектам в изменении СОД-активности плазмы крови. Это может быть связано с его метаболизмом на ранней стадии распространения в организме и небольшим количеством животных в выборке. С другой стороны это может быть результатом смены активирующего эффекта НИЛИ на 231 ингибирующий. И этот вопрос - тема будущих исследований. Тем ни менее протопорфирин IX эффективно изменял активность клеток лейкоцитарной фракции крови при облучении крыс с шоком светом в зеленом диапазоне (Рис. 41 Б-2). Это, вероятно, связано с тем, что в условиях воспаления повышен уровень эндогенных порфиринов и добавление экзогенного аналогичного вещества ведет к снижению эффективной дозы лазерного излучения. По результатам всех экспериментов с применением хлорина е6 у крыс без эндотоксического шока и при последующем облучении красным лазером в дозе 0.75 Дж/см2 было очевидно, что достоверного влияния данный ФС на исследуемые процессы не оказывает (Рис. 42, Рис. 49 – А, Б – 3 – левые столбцы – сплошная заливка). Аналогичные результаты получены и при использовании излучения в зеленом диапазоне спектра. Однако в остальных случаях – при облучении в красном диапазоне в дозе 1.5 Дж/см2 (Рис. 42, Рис. 49– А, Б – 4) и крыс с эндотоксическим шоком в дозе 0.75 Дж/см2 (Рис. 42, Рис. 49 – А, Б – 3 – правые столбцы – градиентная заливка) наблюдали иную картину. А именно происходило увеличение активности клеток лейкоцитарной фракции (Рис. 42) на фоне снижения АСОД (Рис. 49). Вероятно, в данной ситуации уменьшение СОДактивности свидетельствует о функциональном снижении данного ресурса, который был потрачен на сдерживание фотоиндуцированного перекисного окисления липидов и которого, возможно, «не хватило» на борьбу с гиперпродукцией супероксид анион радикалов клетками лейкоцитарной фракции. . 232 4.5. Влияние низкоинтенсивного лазерного облучения in vivo на процессы перекисного окисления липидов в раневом экссудате и в плазме крови крыс Было исследовано влияние лазерного облучения in vivo на продукцию активных форм кислорода лейкоцитами и изменения антиокислительной активности раневых экссудатов и плазмы крови крыс. Модификация этих параметров может повлиять и на процесс перекисного окисления липидов в исследуемых объектах. Понимание взаимосвязи фотоиндуцированных изменений продукции АФК лейкоцитами, процессов АОА и ПОЛ и их зависимости от условий облучения (дины волны и дозы) и от состояния пациента (вид патологии) позволит повысить эффективность НИЛТ за счет снижения риска развития побочных эффектов. В связи с этим был исследован процесс перекисного окисления липидов в раневых экссудатах и плазме крови крыс после облучения in vivo. 4.5.1. Эффекты низкоинтенсивного лазерного излучения на процессы перекисного окисления липидов в раневом экссудате при облучении поверхности экспериментальной кожной раны В предыдущих разделах были исследованы изменения антиокислительной активности раневого экссудата после облучения поверхности экспериментальной кожной раны у крыс. Эти изменения зависели от дозы и длины волны излучения. Для оценки того, как изменения АОА повлияли на процесс перекисного окисления липидов в раневом экссудате мы исследовали накопление продуктов ПОЛ. При этом использовали метод регистрации ТБК-активных продуктов и хемилюминесцентные методы с кумарином С-525 в присутствии ионов двухвалентного железа. 233 4.5.1.1. Снижение концентрации ТБК-активных продуктов в раневых экссудатах крыс под действием низкоинтенсивного лазерного излучения В первой серии экспериментов мы исследовали влияние лазерного облучения поверхности раны на концентрацию продуктов перекисного окисления липидов в раневом экссудате. Уровень перекисного окисления липидов оценивали по накоплению ТБК-активных продуктов (ТБКАП). В опытных группах ежедневная доза облучения составила 1,5 Дж/см2. Облучение проводили на 2, 3 и 4 дни после операции гелий-неоновым лазером (УЛФ-01) в красном диапазоне спектра. Условия облучения были выбраны на основе результатов предыдущих экспериментов. Животных контрольной группы подвергали тем же процедурам, что и опытной группы, но без облучения. Забор раневого экссудата проводили перед облучением. Было выявлено, что во всех группах исследуемых животных происходило постепенное накопление продуктов окисления липидов в раневом экссудате к 4му и 5-му дням после операции (Рис. 50). Однако было обнаружено снижение уровня ТБКАП у крыс, подвергнутых облучению, по сравнению с контрольной группой. В группе без облучения (контрольной) к пятому дню после операции концентрация ТБКАП возросла на 284% (Рис. 50, кривая 1). В то время, как излучение лазера к этому же дню приводило к увеличению продуктов окисления на 184% (Рис. 50, кривая 2). Таким образом, при общем накоплении продуктов ПОЛ в динамике раневого процесса - лазерное облучение поверхности кожной раны приводит к снижению уровня накопления продуктов окисления липидов в раневом экссудате крыс по сравнению с контрольной группой. Такой эффект может быть обусловлен обнаруженным нами в предыдущих экспериментах увеличением АОА раневого экссудата при облучении в красном диапазоне спектра в дозе 1,5 Дж/см2 (Рис. 44 и Рис. 45). 234 Сn/С2 ТБКАП, % 350 250 1 * 2 150 50 2 3 4 День после операции 5 Рис. 50. Влияние излучения на концентрацию ТБК-активных продуктов в раневом экссудате крыс. ТБКАП - ТБК-активные продукты. C2 - концентрация ТБКАП в раневом экссудате на 2-й день после нанесения раны. Сn - на 3, 4 или 5 дни. 1. Контрольная группа (без облучения). 2. Группа, облучаемая лазером. Ежедневная доза облучения: 1,5 Дж/см2. Облучение проводили на 2, 3, и 4 дни после операции. Забор экссудата проводили перед облучением. Стрелками указаны моменты облучения ран. Объемы выборок N = 5. * р = 0,05 4.5.1.2. Влияние низкоинтенсивного лазерного излучения на уровень липопероксильных радикалов в раневых экссудатах крыс при регистрации хемилюминесценции раневого экссудата, активированной кумарином С-525 в присутствии ионов двухвалентного железа Для получения более полной картины влияния низкоинтенсивного излучения в красном диапазоне спектра на процесс ПОЛ в раневых экссудатах была проведена оценка уровня липопероксильных радикалов методом хемилюминесценции, активированной кумарином С-525 в присутствии ионов двухвалентного железа. Типичная кинетика хемилюминесценции раневого экссудата, индуцированной двухвалентным железом и активированной кумарином С-525 235 представлена на Рис. 12. В исследовании использовали два параметра (Рис. 12) максимум интенсивности (I) медленной вспышки и латентный период (t). В качестве источника излучения использовали He-Ne лазер (УЛФ-01). Проводили облучение поверхности экспериментальной кожной раны у крыс на 2 и 3 дни после операции. Было исследовано 4 группы животных: 1 - контрольная группа (без облучения), 2, 3 и 4 - экспериментальные группы, получавшие облучение на 2 и 3 дни после операции после забора раневого экссудата на исследование. Доза излучения во второй группе - 2 Дж/см2, в третьей - 0,7 Дж/см2, в четвертой - 0,18 Дж/см2. Результаты экспериментов представлены на Рис. 51 и Рис. 52. В контрольной группе (без облучения) выявили постепенное увеличение интенсивности хемилюминесценции раневых экссудатов к четвертому дню после операции примерно в 2,4 раза (Рис. 51, кривая 1). Однако в группах, получавших облучение, в дозах 0,7 Дж/см2 и 0,18 Дж/см2 такого увеличения не происходило (Рис. 51, кривые 3 и 4 соответственно). При облучении в дозе 0,7 Дж/см2 наоборот мы наблюдали достоверное снижение интенсивности хемилюминесценции раневых экссудатов почти на 30% относительно второго дня после операции (Рис. 51, кривая 3). При исследовании латентного периода в данной серии экспериментов (Рис. 52) достоверных различий между группами и в динамике раневого процесса не обнаружили, за одним исключением. Исключение составила группа "2" - с большой дозой облучения (2 Дж/см2). На третий день после операции латентный период в этой группе достоверно отличался от такого показателя в контрольной группе (Рис. 52, 3 день после операции). Снижение латентного периода в группе "2" и отсутствие достоверного отличия от контрольной группы в интенсивности ХЛ позволяет предполагать, что при большой дозе облучения НИЛИ оказывает прооксидантный эффект. 236 3 1 In/I2 2 2 1 * 4 3 0 2 3 День после операции 4 Рис. 51. Изменение интенсивности хемилюминесценции раневого экссудата в присутствии кумарина С-525 и двухвалентного железа. По оси ординат: In/I2, где In - интенсивность медленной вспышки хемилюминесценции раневого экссудата на 3 или 4 дни после операции, I2 - на второй день после операции. 1 контрольная группа (без облучения, n = 8). 2, 3 и 4 - экспериментальные группы, облучаемые He-Ne лазером в дозах 2; 0,7 и 0,18 Дж/см2 соответственно. В каждой экспериментальной группе n = 4. Уровни значимости (сравнение контрольной и экспериментальных выборок с помощью критерия Манна-Уитни): *р = 0,038 Лазер-индуцированное уменьшение интенсивности медленной вспышки в группах с меньшими дозами облучения (Рис. 51, кривые 3 и 4) может происходить в результате увеличения АОА раневого экссудата за счет эндогенного пула некоторых жиро- (например, токоферол) и водорастворимых (например, церулоплазмин) антиоксидантов [127, 128, 160] и активации/синтеза некоторых антиоксидантных ферментов (например, супероксиддисмутазы) [161]. Установить роль конкретного антиоксиданта в довольно трудно для такого сложного по составу объекта, как раневой экссудат. Тем ни менее нами показано увеличение АОА и СОД-активности раневого экссудата после облучения поверхности раны (Рис. 44 и Рис. 45). 237 2,5 1 2 2 3 tn/t2 4 1,5 * 1 0,5 2 3 День после операции 4 Рис. 52. Изменение латентного периода хемилюминесценции раневого экссудата в присутствии кумарина С-525 и двухвалентного железа. По оси ординат: tn/t2, где tn - интенсивность медленной вспышки хемилюминесценции раневого экссудата на 3 или 4 дни после операции, t2 - на второй день после операции. 1 контрольная группа (без облучения, n = 8). 2, 3 и 4 - экспериментальные группы, облучаемые He-Ne лазером в дозах 2; 0,7 и 0,18 Дж/см2 соответственно. В каждой экспериментальной группе n = 4. Уровень значимости (критерий Манна-Уитни): * p = 0,027 Для понимания природы первичных процессов представляло интерес выяснить - не влияет ли длительность облучения на исследуемые эффекты. Подобное исследование фотоиндуцированного нами изменения было уже проведено функциональной при активности изучении клеток лейкоцитарной фракции раневого экссудата (Таблица 5). При этом достоверных различий не выявлено. Мы провели исследование с такими же условиями эксперимента, что и в Таблица 5, то есть облучали животных He-Ne лазером в дозе 0,18 Дж/см2. При этом дозу облучения достигали в одной группе за 77 с, в другой - за 30 мин. 1 2 3 Интенсивность ХЛ (I4/I2) ы № групп 238 Группы Контроль (n = 8) 77 с (n = 4) 30 мин. (n = 4) 2 день 4 день 1 1 1 2,39 1,17* 0,97* Таблица 14. Влияние времени облучения на изменение интенсивности хемилюминесценции раневого экссудата в присутствии кумарина С-525 и двухвалентного железа. Интенсивность: I4/I2, где I4 - интенсивность медленной вспышки хемилюминесценции раневого экссудата на 4 день после операции, I2 на второй день после операции. 1 - контрольная группа (без облучения, n = 8). 2 и 3 - экспериментальные группы, облучаемые He-Ne лазером в дозе 0.18 Дж/см2. При этом время облучения разное и составляет в группах 2 и 3 - 77 секунд и 30 минут соответственно. * p = 0,01 (отличие от группы "Контроль"). Достоверного отличия значений между группами, получавшими облучение, не обнаружено При определении интенсивности свечения, как и на Рис. 51 мы наблюдали снижение уровня медленной вспышки по сравнению с контролем к четвертому дню после операции (Таблица 14). Однако достоверных различий между опытными группами (Таблица 14, строки 2 и 3) обнаружено не было. При исследовании латентного периода, как и на Рис. 52 достоверных отличий между контрольной и опытными группами к четвертому дню после операции обнаружено не было (Таблица 15). Также не выявлено достоверных различий между опытными группами (Таблица 15, строки 2 и 3). Необходимо отметить, что и на третьи сутки после операции достоверных различий между двумя опытными группами не наблюдалось (данные не представлены). Очевидно, что в случае малых доз облучения - время облучения не играет роли в формировании фотоиндуцированных эффектов. Это еще раз 239 подтверждает то, что наблюдаемые процессы являются результатом № групп ы однофотонных процессов, как и было нами показано ранее. Латентный период (t4/t2) Группы 2 день 4 день 1 1 1 1,58 1,19* 1,17* Контроль (n = 8) 77 с (n = 4) 30 мин. (n = 4) 1 2 3 Таблица 15. Влияние времени облучения на изменение латентного периода хемилюминесценции раневого экссудата в присутствии кумарина С-525 и двухвалентного железа. Латентный период: t4/t2, где t4 - латентный период на 4 день после операции, t2 - на второй день после операции. 1 - контрольная группа (без облучения, n = 8). 2 и 3 - экспериментальные группы, облучаемые He-Ne лазером в дозе 0.18 Дж/см2. При этом время облучения разное и составляет в группах 2 и 3 - 77 секунд и 30 минут соответственно. * p = 0,05 (отличие от группы "Контроль"). Достоверного отличия значений между группами, получавшими облучение, не обнаружено 4.5.1.3. Влияние низкоинтенсивного лазерного излучения на изменения антиокислительной активности и окисленности раневого экссудата при Fe2+индуцированном перекисном окислении липидов в липосомах Для дальнейшего изучения изменений АОА и ПОЛ в раневых экссудатах мы исследовали влияние низкоинтенсивного лазерного излучения на антиокислительную активность и окисленность раневого экссудата в другой модельной системе - при Fe2+-индуцированном перекисном окислении липидов в трис-буферной системе в присутствии липосом. При этом регистрировались латентный период и интенсивность медленной вспышки ХЛ (Рис. 53). Данный 240 метод был описан Дреминой Е.С. и сотр. [346] для оценки АОА плазмы крови и подробно изучен Васильевой О.В. и сотр. [345]. Результаты исследований изменений антиоксидантной активности раневого экссудата в зависимости от дозы лазерного облучения представлены на Рис. 54 и Таблица 16. Fe2+ I, усл. ед. 2 1 I t 0 0 4 8 Время, мин. 12 Рис. 53. Типичная кинетика хемилюминесценции, сопровождающей окисление суспензии фосфолипидных липосом, индуцированное ионами Fe2+. Стрелками показаны: Fe2+ - момент введения двухвалентного железа, I - амплитуда медленной вспышки хемилюминесценции, t - латентный период При исследовании изменений латентного периода (Рис. 54) данные представлены в виде отношения латентного периода в пробе, содержащей раневой экссудат, (t) к аналогичному параметру в пробе без экссудата (t0). Было обнаружено (Рис. 54), что происходит снижение латентного периода при добавлении раневого экссудата в пробу (все значения меньше единицы). Аналогично, в работе Дреминой Е.С. с соавт. [346] наблюдали уменьшение латентного периода при добавлении к липосомам плазмы крови. Авторы определили, что это может быть связано с железо-хелатирующим действием 241 некоторых антиоксидантов сыворотки крови, таких как трансферин, церулоплазмин и карбонаты. Вероятно, в этом случае действие раневого экссудата подобно действию плазмы крови. Рис. 54. Влияние низкоинтенсивного лазерного излучения на латентный период хемилюминесценции фосфолипидных липосом, индуцированной ионами Fe2+. t - латентный период наступления медленной вспышки хемилюминесценции суспензии липосом в присутствии экссудата, t0 - без экссудата. Данное исследование проводили в группах крыс, подвергнутых облучению лазером на 2, 3 и 4 дни после нанесения раны. Забор экссудата проводили перед облучением. Объемы выборок: контрольная группа (без облучения), n = 8; опытные группы (с облучением), в каждой группе n = 4 Однако в контрольной группе (доза 0 Дж/см2) снижение латентного периода продолжалось на протяжении 4 дней: с t/t0 = 0,87 на вторые сутки после нанесения раны до 0,61 к четвертым суткам (Рис. 54). При этом лазерное облучение в исследованном интервале доз не вызывало значимых изменений латентного периода на четвертый день по сравнению со вторым днем. Следовательно, облучение ран приводило к увеличению t относительно контрольной группы. 242 Результаты исследования влияния НИЛИ на интенсивность медленной вспышки представлены в Таблица 16. В контрольной группе (без облучения) величина I/I0 постепенно увеличивалась к 4 дню: от 0,69 (на 2 день) до 0,82 (на 4 день). I/I0 Ежедневная доза Дни после операции облучения (Дж/см2) 2 3 4 0 (n = 8) 0,69 ± 0,02 0,71 ± 0,02 0,82 ± 0 0,12 (n = 4) 0,65 ± 0,02 0,73 ± 0,04 0,74 ± 0,02 1,4 (n = 4) 0,64 ± 0,03 0,7 ± 0,02 0,7 ± 0,03 2,2 (n = 4) 0,61 ± 0,02 0,67 ± 0,02 0,7 ± 0,09 2,8 (n = 4) 0,78 ± 0,03 0,75 ± 0,04 0,74 ± 0,02 Таблица 16. Влияние низкоинтенсивного лазерного излучения на интенсивность медленной вспышки индуцированной ионами хемилюминесценции Fe2+. I - фосфолипидных интенсивность медленной липосом, вспышки хемилюминесценции суспензии липосом в присутствии экссудата, I0 - без экссудата. n – объем выборки. Данное исследование проводили в группах крыс, подвергнутых облучению лазером на 2, 3 и 4 дни после операции. Забор экссудата проводили перед облучением При облучении малой дозой излучения (0,12 Дж/см2) тенденция увеличения интенсивности медленной вспышки еще сохранялась, однако дальнейшее возрастание дозы облучение приводило к тому, что интенсивность практически не менялась. Следовательно, облучение ран приводило к уменьшению I относительно контрольной группы. Лазер-индуцированное возрастание латентного периода и уменьшение интенсивности медленной вспышки может происходить в результате увеличения 243 АОА раневого экссудата за счет эндогенного пула некоторых жиро- (например, токоферол) и водорастворимых (например, церулоплазмин) антиоксидантов [345, 346] и активации/синтеза некоторых антиоксидантных ферментов (например, супероксиддисмутазы) [366]. Установить роль конкретного антиоксиданта в данной модельной системе довольно трудно для такого сложного по составу объекта, как раневой экссудат. Однако, напомню, что нами показано увеличение АОА и СОД-активности раневого экссудата после ЛО ран (Рис. 44 и Рис. 45). 244 4.5.2. Системные эффекты воздействия низкоинтенсивного лазерного излучения на процессы перекисного окисления липидов в плазме крови крыс при облучении ушной раковины крыс В предыдущих разделах исследования мы показали изменения антиокислительной активности плазмы крови крыс после облучения поверхности ушной раковины у животных. Эти изменения зависели от дозы и длины волны излучения. Для оценки того, повлияли ли изменения АОА на процесс перекисного окисления липидов мы исследовали накопление продуктов ПОЛ в мембранах эритроцитов крови. При этом использовали метод, основанный на измерении флуоресценции цис-паринариевой кислоты (цисПК) [334-337]. Необходимо отметить, что в данном случае мы исследуем системные эффекты НИЛИ. Это обусловлено тем, что при облучении ушной раковины крыс мы оцениваем влияние излучения на процессы перекисного окисления липидов в компонентах крови животных. Известно, что флуоресценция цисПК снижается при ее окислении свободными радикалами. На Рис. 55 I и II приведены спектры флуоресценции цисПК полученные при ее инкубации с липидами в течение 60 минут. Уровень снижения свечения цисПК свидетельствует о количестве быстро окисляемых липидов в образце. Для сравнения изменений в липидах мы рассчитывали процент падения флуоресценции: ПФ = 100% (I1 - I2) / I1. Результаты представляли в виде отношения процентов падения через 4 часа (ПФII) к соответствующей величине в начале эксперимента (ПФI). Необходимо отметить, что инкубация цисПК в отсутствии липидов мембран эритроцитов не приводила к снижению ее флуоресценции, следовательно автоокисления мы не наблюдали (Рис. 56). 245 Рис. 55. Типичные кривые флуоресценции цис-паринариевой кислоты в липидах, экстрагированных из эритроцитов крови крыс. Представлены кривые, полученные для крысы, которой вводили липополисахарид (25 мг/кг) и облучали лазером (532.5 нм, 0.75 Дж/см2). I - 0 часов после начала эксперимента (первый забор крови). II - 4 часа после начала эксперимента (второй забор крови). Липополисахарид вводили сразу после первого забора крови. Облучение проводили через три часа после начала эксперимента. 1 (на всех графиках) - 0 минут инкубации липидов эритроцитов с цис-паринариевой кислотой. 2 (на всех графиках) - 60 минут инкубации липидов эритроцитов с цис-панинариевой кислотой при 37оС в темноте. По оси ординат Iфл - интенсивность флуоресценции цис-паринариевой кислоты в липидах эритроцитов. Длина волны возбуждения 310 нм, флуоресценции - 416 нм. По результатам данного исследования рассчитывали процент падения флуоресценции: ПФ = 100% (I1 - I2) / I1 246 Рис. 56. Типичные кривые флуоресценции цис-паринариевой кислоты (10 мкМ) в отсутствии липидов. Iфл - интенсивность флуоресценции. Длина волны возбуждения - 310 нм. Время инкубации пробы в темноте при 37оС: 1 - 0 мин, 2 30 мин., 3 - 60 мин. 4.5.2.1. Эффекты воздействия низкоинтенсивного лазерного излучения на окисление липидов мембран эритроцитов крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения На Рис. 57 приведены результаты исследования окисления липидов эритроцитарных мембран животных в норме - без введения ЛПС и в условиях генерализованной патологии (с ЛПС) после лазерного облучения ушной раковины. Мы обнаружили, что при инкубации цисПК с липидами эритроцитов животных, которым не вводили ЛПС (Рис. 57 А и В, столбец 1) происходило снижение флуоресценции цисПК за 4 часа после начала эксперимента (0.68 ± 0.06). Мы это связываем с защитной реакцией организма в ответ на первый забор крови и выбросом молодых эритроцитов в кровяное русло. 247 Также было обнаружено, что при инкубации цисПК с липидами эритроцитов животных, которым вводили ЛПС (Рис. 57 Б и Г, столбец 1), не происходит сильных изменений (в сравнении с контрольной группой) во флуоресценции цисПК (0.58 ± 0.05). При облучении в дозе 0.75 Дж/см2 животных, которым не вводили ЛПС, в синем и зеленом диапазонах спектра, достоверного отличия от контроля также обнаружено не было (Рис. 57 А, столбцы 2,3). Облучение красным лазером (Рис. 57 А, столбец 4). вызывало статистически достоверный рост изменений в интенсивности флуоресценции, который составил 1.05 ± 0.20 (р = 0.03). Тем ни менее и зеленое излучение показывало тенденцию к усилению ПОЛ (Рис. 57 А, столбец 3). Однако, в группах крыс, которым вводили ЛПС и кроме того облучали зеленым лазером в дозе 0.75 Дж/см2 (Рис. 57 Б, столбец 3), происходило заметное увеличение окисления липидов в 1.69 ± 0.12% (р = 0.001) раза. При облучении красным лазером (Рис. 57 Б, столбец 4), изменения составляли 1.14 ± 0.15 (р = 0.03) раза. Облучение же синим лазером (Рис. 57 Б, столбец 2) практически не дало никакого эффекта. При дозе 1.5 Дж/см2 действие лазерного излучения оказалось более выраженным (Рис. 57 В и Г). Так в группах животных, которым не вводили ЛПС (Рис. 57 В), наблюдалось увеличение уровня окисления липидов после облучения красным лазером (Рис. 57 В, столбец 4) в 1.37 ± 0.05 (р = 0.0002) раза, и зеленым лазером (Рис. 57В, столбец 3) – в 0.96 ± 0.06 (р = 0.02) раза. После облучения синим лазером (Рис. 57 В, столбец 2) достоверного эффекта выявлено не было. В группах крыс, которые получали инъекцию ЛПС (Рис. 57 Г), облучение красным лазером (Рис. 57 Г, столбец 4) способствовало усилению окисления липидов в 2.19 ± 0.19 (р < 0.001) раза), а облучение зеленым лазером (Рис. 57 Г, столбец 3) – в 2.09 ± 0.37 (р < 0.01) раза и синим лазером (Рис. 57 Г, столбец 2) – в 1.47 ± 0.22 (р < 0.01) раза. 248 Рис. 57. Влияние лазерного излучения на флуоресценцию цис-паринариевой кислоты в липидах, экстрагированных из мембран эритроцитов крыс без (А, В) и с введением (Б, Г) липополисахарида. Дозы облучения: 0.75 Дж/см2 (А, Б) и 1.5 Дж/см2 (В, Г). 1 - без облучения, 2 - облучение лазером в синем (441.2 нм), 3 - в зеленом (532.5 нм), 4 - в красном (632.8 нм) диапазонах спектра. По оси ординат: ПФII/ПФI, где ПФI и ПФII - % падения флуоресценции цис-паринариевой кислоты в липидах эритроцитов, выделенных из крови в начале эксперимента (первый забор крови, 0 часов, ПФI) и через 4 часа после начала эксперимента (второй забор крови, ПФII) соответственно 249 4.5.2.2. Эффекты воздействия низкоинтенсивного лазерного излучения в присутствии экзогенных фотосенсибилизаторов на окисление липидов мембран эритроцитов крыс без и в условиях генерализованной патологии (без и при введении липополисахарида B) и их зависимость от дозы и длины волны излучения В следующей серии экспериментов мы проводили изучение процессов перекисного окисления липидов в эритроцитах крови после облучения ушной раковины животных, которым вводили экзогенный фотосенсибилизатор порфиринового ряда (Рис. 58, Рис. 59). Сначала мы оценили уровень окисления липидов мембран эритроцитов при облучении в зеленом диапазоне без и в присутствии экзогенных ФС – протопорфирина IX и хлорина е6 (Рис. 58). Затем было изучено воздействие в зеленом и красном диапазонах без и в присутствии одного из ФС – хлорина е6 (Рис. 59). При исследовании влияния ФС на окисление липидов в отсутствии лазерного облучения (Рис. 58 А) достоверный эффект обнаружили только в случае введения протопорфирина IX крысам, у которых инициировали эндотоксический шок. За 4 часа проведения эксперимента падение флуоресценции цисПК возросло в 1.6 раза (р = 0.025) с 0.58 ± 0.05 (Рис. 58 А-1, правый столбец – градиентная заливка) до 0.92 ± 0.13 (Рис. 58 А-2, правый столбец – градиентная заливка). Вероятно, такое воздействие ФС связано с воздействием естественного освещения, которому животные вынужденно подвергались во время эксперимента. При облучении животных зеленым лазером без экзогенных ФС (Рис. 58 Б-1) мы обнаружили рост количества окисленных липидов в образцах как без (столбцы слева – сплошная заливка), так и после введения ЛПС (столбцы справа – градиентная заливка). Наиболее выраженные изменения флуоресценции цисПК произошли в группе с экспериментальным эндотоксическим шоком. 250 Рис. 58. Влияние фотосенсибилизаторов и лазерного излучения на флуоресценцию цис-паринариевой кислоты в липидах, экстрагированных из мембран эритроцитов крови крыс при введении липополисахарида. А - без облучения. Б - с облучением (длина волны излучения 532.5 нм, доза облучения: 0.75 Дж/см2). 1 - без фотосенсибилизаторов, 2 - с протопорфирином IX (3 мг/кг), 3 - с хлорином e6 (3 мг/кг). Столбцы слева (сплошная заливка) - без введения липополисахарида, столбцы справа (градиентная заливка) - с введением липополисахарида (25 мг/кг). По оси ординат: ПФII/ПФI, где ПФI и ПФII - % падения флуоресценции цис-паринариевой кислоты в липидах эритроцитов, выделенных из крови в начале эксперимента (первый забор крови, 0 часов, ПФI) и через 4 часа после начала эксперимента (второй забор крови, ПФII) соответственно Так падение свечения цис-паринариевой кислоты возросло в 2,9 раз (р = 0.014) с 0.58 ± 0.05 (Рис. 58 А-1, столбец справа – градиентная заливка) до 1.69 ± 0.12 (Рис. 58 Б-1, столбец справа – градиентная заливка). Введение протопорфирина IX (Рис. 58 Б-2) и хлорина е6 (Рис. 58 Б-3) не дало достоверного отличия от эффектов собственно лазерного излучения (Рис. 58 Б-1). 251 Рис. 59. Влияние лазерного излучения в зеленом и красном диапазонах на флуоресценцию цис-паринариевой кислоты в липидах, экстрагированных из мембран эритроцитов крови крыс при введении липополисахарида в отсутствие (А) или в присутствии (Б) фотосенсибилизатора - хлорина е6. А - без фотосенсибилизатора. Б - с хлорином е6 (3 мг/кг). 1 - без облучения. 2 - с облучением в зеленом диапазоне (длина волны излучения 532.5 нм, доза облучения: 0.75 Дж/см2). 3 - с облучением в красном диапазоне (длина волны излучения 632.8 нм, доза облучения: 0.75 Дж/см2). 4 - с облучением в красном диапазоне (длина волны излучения 632.8 нм, доза облучения: 1.5 Дж/см2). Столбцы слева (сплошная заливка) - без введения липополисахарида, столбцы справа (градиентная заливка) - с введением липополисахарида (25 мг/кг). По оси ординат: ПФII/ПФI, где ПФI и ПФII - % падения флуоресценции цис- паринариевой кислоты в липидах эритроцитов, выделенных из крови в начале эксперимента (первый забор крови, 0 часов, ПФI) и через 4 часа после начала эксперимента (второй забор крови, ПФII) соответственно Сравнение воздействия облучения в зеленой и красной областях видимого спектра показало, что без экзогенного ФС при малой дозе облучения (0.75 Дж/см2) наиболее эффективно облучение в зеленой области спектра (Рис. 59 А-2), 252 а при большой (1.5 Дж/см2) – в красной (Рис. 59 А-4). Наиболее выраженные эффекты облучения мы наблюдали на модели эндотоксического шока (правые столбцы – градиентная заливка). Так облучение в зеленом диапазоне при дозе 0.75 Дж/см2 (Рис. 59 А-2, правый столбец – градиентная заливка) увеличивало падение флуоресценции цисПК в 2.9 раз (р = 0.014), а в красном диапазоне при дозе 1.5 Дж/см2 (Рис. 59 А-4, правый столбец – градиентная заливка) – в 4.1 раз (р = 0.014). Интересно, что инъекция хлорина е6 (Рис. 59 Б) практически не изменяла эту картину. Достоверные изменения обнаружены только при облучении в красном диапазоне (0.75 Дж/см2) крыс с эндотоксическим шоком (Рис. 59 Б-3, правый столбец – градиентная заливка). Так исследуемый параметр возрос в 1.7 раза (р = 0.05) с 1.14 ± 0.15 (Рис. 59 А-3, правый столбец – градиентная заливка) до 1.97 ± 0.07 (Рис. 59 Б-3, правый столбец – градиентная заливка). Итак, лазерное облучение, как в зеленом, так и в красном диапазонах спектра инициирует окисление липидов мембран эритроцитов. В отсутствии экзогенных ФС при малой дозе наиболее эффективно облучение в зеленой области, а при большой дозе – в красной. Вероятно, это результат фотодинамических реакций, вызванных поглощением квантов света эндогенными ФС, которыми, по нашему предположению, могут быть эндогенные порфирины. Они обладают меньшей экстинкцией в красном диапазоне спектра, что и вызывает увеличение дозы облучения в данных условиях. Использование хлорина е6 не привело к результатам существенно отличающимся от протопорфирина IX. Однако это свидетельствует в пользу данного ФС, как безопасного для терапевтического использования, так как он не инициирует существенное окисление липидов мембран клеток крови. Обнаруженное ранее изменение активности лейкоцитов крови после введения хлорина е6 и облучения в красной области спектра (Рис. 42) на фоне отсутствия возрастания окисления липидов (Рис. 59) может быть связано с изменением антиоксидантной защиты. Так при исследовании изменений СОД- 253 активности плазмы крови (Рис. 49) после облучения ушной раковины крыс, которым вводили е6 обнаружили следующие закономерности. У животных без введения ЛПС и облучении в красном диапазоне спектра в дозе 1.5 Дж/см2 (Рис. 42, Рис. 49 – А, Б – 4) и у крыс с эндотоксическим шоком при облучении в дозе 0.75 Дж/см2 (Рис. 42, Рис. 49 – А, Б – 3 – правые столбцы – градиентная заливка) мы наблюдали увеличение активности лейкоцитов крови (Рис. 42) на фоне снижения СОД-активности плазмы крови (Рис. 49). Вероятно, в данной ситуации уменьшение СОД-активности свидетельствует о функциональном снижении данного ресурса, который был потрачен на сдерживание фотоиндуцированного перекисного окисления липидов и которого, возможно, «не хватило» на борьбу с гиперпродукцией супероксид анион радикалов клетками лейкоцитарной фракции 254 4.6. Влияние низкоинтенсивного лазерного излучения на скорость заживления экспериментальных кожных ран у крыс Результаты местных и системных эффектов, оказываемых НИЛИ можно оценить по их влиянию на различные патологические процессы, что, в частности, рассматривалось в "Обзоре литературы". Одной из наиболее обсуждаемых тем является влияние низкоинтенсивных видимых излучений на заживление ран. В данной работе нами уже показаны лазер-индуцированное изменение свободнорадикального статуса в области раны, а именно антиокислительной активности и уровня продуктов ПОЛ, а также продукции супероксид-анион радикала лейкоцитами раневого экссудата. Указанные параметры зависели от дозы и длины волны излучения. Результатом таких изменений может быть влияние на скорость заживления ран, что и будет исследовано в данном разделе. 4.6.1. Ускорение заживления экспериментальных кожных ран у крыс под действием низкоинтенсивного лазерного облучения и зависимость этого эффекта от дозы и длины волны излучения В данной серии экспериментов, как и в предыдущих соответствующих разделах мы использовали модель экспериментальной кожной раны у крыс. В области раны под кожу вводилось тефлоновое кольцо (Таблица 1) для обеспечения возможности сбора раневого экссудата, как одного из объектов для исследования. Сверху на кольце фиксировалась стерильная пленка, предотвращающая высыхание и загрязнение раны. Кольцо снимали на пятый день после операции и далее наблюдали за динамикой заживления раны, так как скорость закрытия раневого дефекта является одним из основных факторов оценки лечебного воздействия. 255 С этой целью проводили фотографирование ран и измерение площади раневых поверхностей. Площадь ран измеряли, обводя их контуры на плотном прозрачном материале. Далее контуры ран переносили на белую бумагу одинаковой плотности. Затем эти контуры вырезали. Вычисление площади ран проводили весовым методом [312]. Результаты экспериментов представлены в Таблица 17 и Таблица 18. По мере заживления раны (после снятия кольца) ее площадь сокращалась. Можно видеть, что в контрольной группе полное заживление ран происходило к 22 дню после операции. Наибольшее сокращение сроков заживления, до 17 дней, обнаружили при облучении ран красным лазером в дозе 1,5 Дж/см2. Облучение зеленым лазером в этой дозе так же сказывалось на скорости заживления, однако было менее эффективным (сроки заживления ран уменьшались до 19 дней). Синий лазер при этой дозе не оказывал воздействия. Противоположная картина наблюдалась при меньшей дозе облучения. Красный лазер не оказывал заметного эффекта, в то время как синий и зеленый лазеры сокращали сроки заживления до 19 дней. Помимо указанного выше ускорения заживления ран в группах крыс, облучавшихся синим и зеленым лазерами в дозе 0,75 Дж/см2 и красным лазером в дозе 1,5 Дж/см2, следует отметить, что практически во всех опытных группах, начиная с 15 дня, площадь ран существенно сократилась (Таблица 17). Так, например, в контрольной группе площадь ран уменьшалась почти в 8 раз, а в группе, облучаемой красным лазером в дозе 1,5 Дж/см2 - почти в 33 раза (Таблица 18). Исключением стала только группа, получавшая облучение зеленым лазером в дозе 1,5 Дж/см2. В этой группе различия в площади ран относительно контрольной группы были недостоверны. При этом к 15-му дню во всех опытных группах площадь ран была минимум в 1,5 – 2 раза меньше, чем в контрольной группе. 256 0,75 Дж/см2 0 Контроль 442 нм 532 нм 1,5 Дж/см2 633 нм 442 нм 532 нм 633 нм 22 день 19 день 17 день 15 день 12 день 10 день 5 день День после операции Группы Полное заживление Полное Полное заживление заживление Полное Полное заживление заживление Таблица 17. Заживление ран у крыс после снятия кольца. Типичные эксперименты. Контроль - группа без облучения. 0,75 Дж/см2 и 1,5 Дж/см2- дозы облучения. Для облучения поверхности ран использовали лазеры - He-Cd лазер, твердотельный лазер, He-Ne лазер (УЛФ-01) с длинами волн излучения в синей (442 нм), зеленой (532 нм) и красной (633 нм) областях спектра соответственно 257 Так, например, на 15 день при дозе облучении 0,75 Дж/см2 синим лазером площадь ран на 53% меньше контроля, зеленым лазером на 33% и красным лазером на 39% меньше контроля. А при дозе облучения 1,5 Дж/см2 к 15 дню синий лазер уменьшает площадь ран на 39%, зеленый на 20%, красный лазер уменьшает площадь ран на 75% по сравнению с контролем. Таким образом, даже в группах, где сроки заживления ран не отличались от контроля, начиная с 15 дня (после отслоения струпа), площадь ран была все же меньше, чем в контрольной группе (Таблица 18). Это является положительным влиянием НИЛИ на процесс заживления, например может приводить к более раннему (чем в контрольной группе - без облучения) снижению болевого синдрома. Группы Синий лазер Зеленый лазер Красный лазер Синий лазер 0,048 ± 0,004* 0,084 ± 0,018** 0,076 ± 0,03** 0,076 ± 0,009** Зеленый Красный лазер лазер 0,03 ± 0,006* Контроль 0,126 ± 0,002 S15/S5 1,5 Дж/см2 0,1 ± 0,021 0,75 Дж/см2 0 Таблица 18. Относительная площадь ран во всех группах на 15 день. S5 и S15 площадь ран на 5 и 15 дни после операции соответственно. Все результаты представлены в виде среднего значения ± стандартная ошибка средней, рассчитанная по данным четырех экспериментов. В сравнении с контрольной группой: * p = 0,001; ** p = 0,01. Необходимо отметить, что при исследовании сроков заживления (Таблица 17) и площади ран (Таблица 18), как и в других экспериментах, мы наблюдали 258 наибольшую эффективность коротковолновых (синего и зеленого) излучений при меньшей дозе облучения (0,75 Дж/см2), а длинноволновых (красного) при большей - 1,5 Дж/см2. Как обсуждалось ранее, мы связываем это с природой первичных фотоакцепторов - эндогенных порфиринов, которые в синей области спектра имеют большую экстинкцию чем в красной (Рис. 31). В результате для достижения терапевтического эффекта после облучения в красной области необходимо использовать большую дозу облучения, чем в синей. 259 4.6.2. Влияние низкоинтенсивного лазерного излучения на скорость заживления экспериментальных кожных ран у крыс при введении аминолевулиновой кислоты Представляло интерес исследовать эффективность низкоинтенсивной лазерной терапии в условиях повышенного уровня эндогенных фотосенсибилизаторов - порфиринов. В данном разделе мы исследовали совместные эффекты лазерного излучения и введения индуктора синтеза порфиринов - аминолевулиновой кислоты на заживление экспериментальных кожных ран у крыс. При выборе условий облучения мы опирались на результаты предыдущих исследований, которые показали эффективность НИЛИ в красной области спектра при дозе облучения 1,5 Дж/см2. Однако, мы учли, что при введении АЛА увеличится уровень эндогенных порфиринов. Следовательно, можно предположить, что доза для воздействия потребуется меньшая. Поэтому мы остановили выбор на дозе облучения красным лазером 0,75 Дж/см2. Кроме того, была выбрана еще доза 2,2 Дж/см2 для получения более полной картины возможных механизмов действия лазерного излучения в присутствии повышенного содержания эндогенных порфиринов и при действии больших доз облучения. Выполнено шесть групп экспериментов (по 4 - 8 животных в каждой) по индивидуальному и совместному действию лазерного излучения и АЛА на заживление кожных ран: 1 группа – без облучения лазером и введения АЛА; 2 группа – с АЛА, без облучения; 3 группа – только облучение в дозе 0,75 Дж/см2 (без АЛА); 4 группа – с АЛА и последующим облучением в дозе 0,75 Дж/см2; 5 группа – только облучение в дозе 2,2 Дж/см2 (без АЛА); 6 группа – с АЛА и последующим облучением в дозе 2,2 Дж/см2. Облучение проводили гелий-неоновым лазером (УЛФ-01) на 2 и 3 день после операции и введения АЛА. 260 Необходимо отметить, что группа "АЛА" сначала была разделена на 2 подгруппы, каждая из которых выдерживалась в тех же условиях, что и облучаемые крысы в течение времени, соответствующего дозам 0,75 и 2,2 Дж/см2. Однако предварительные эксперименты не показали существенных различий и подгруппы были объединены в одну. Кроме того, важно, что исследования раневого экссудата в соответствующих (с введением АЛА) предыдущих разделах проводились на животных из групп данной серии экспериментов. Следовательно при обсуждении результатов мы можем сопоставлять эти данные. Одним из основных факторов заживления раны является ее площадь. По мере заживления площадь раны сокращалась после снятия кольца. Если на 7-й день раневая поверхность еще оставалась достаточно большой во всех группах крыс, то к 14-му и 21-му дням стали очевидны различия. Результаты фотографирования ран на 7, 14 и 21 дни после операции представлены в Таблица 19. Результаты, полученные для контрольной группы (группа 1) и групп с облучением, но без введения АЛА (группы 3 и 5) сравнимы с данными, представленными в Таблица 17. Самые большие сроки заживления ожидаемо наблюдали в контрольной группе (без АЛА и без облучения). Из Таблица 19 видно, что практически во всех группах, кроме контрольной, к 21-му дню рана почти полностью зажила. В то время, как в группе "Контроль" раневая поверхность оставалась еще достаточно большой. Кроме того, в группах без АЛА облучение в дозах 0,75 и 2,2 Дж/см2 было сравнимо (группы 3 и 5). Мы уже наблюдали максимальный эффект излучения He-Ne лазера на заживление ран при дозе 1,5 Дж/см2 (Таблица 17 и Таблица 18). В нашем случае обе дозы - 0,75 Дж/см2 и 2,2 Дж/см2 симметрично отличаются от дозы 1,5 Дж/см2 - примерно на 0,7 Дж/см2 меньше и больше нее соответственно. При этом они оказались менее эффективны. Тем ни менее, как уже отмечалось и при этих дозах происходило ускорение заживления ран по сравнению с контролем (без АЛА и без облучения). 261 Очевидно, что к 14-му дню после операции раневые поверхности в группах с АЛА оказались меньше, чем в группах без индукции синтеза эндогенных порфиринов (Таблица 19). Группы животных, которым вводили АЛА (группы 2, 4 и 6), показали ускорение заживления ран по сравнению с контролем. День 1 Контроль 2 АЛА Группы животных 3 4 5 Лазер 0,75 Лазер 0,75 Лазер 2,2 Дж/см2 Дж/см2 Дж/см2 АЛА 6 Лазер 2,2 Дж/см2 АЛА 7 14 21 Таблица 19. Заживление ран у крыс после снятия кольца на 7, 14 и 21 дни после операции. Типичные эксперименты. 1 группа (контроль) – без облучения лазером и введения АЛА; 2 группа (АЛА) – с АЛА, без облучения; 3 группа – только облучение в дозе 0,75 Дж/см2 (без АЛА); 4 группа – с АЛА и последующим облучением в дозе 0,75 Дж/см2; 5 группа – только облучение в дозе 2,2 Дж/см2 (без АЛА); 6 группа – с АЛА и последующим облучением в дозе 2,2 Дж/см2. Облучение проводили гелий-неоновым лазером (УЛФ-01) на 2 и 3 день после операции и введения АЛА 262 Для проведения более полного анализа скорости заживления ран была определена площадь раневых поверхностей на 21 день после операции (Рис. 60). Во всех группах, кроме контрольной группы (Рис. 60, столбец 1), площадь ран составляла менее 0,3 см2. Рис. 60. Площадь ран на 21 день после операции. Средние значения. 1 контрольная группа, без облучения лазером и введения АЛА; 2 - группа с АЛА, без облучения; 3 - группа с облучением в дозе 0,75 Дж/см2 (без АЛА); 4 - группа с АЛА и последующим облучением в дозе 0,75 Дж/см2; 5 - группа с облучением в дозе 2,2 Дж/см2 (без АЛА); 6 - группа с АЛА и последующим облучением в дозе 2,2 Дж/см2. Облучение проводили гелий-неоновым лазером (УЛФ-01) на 2 и 3 день после операции и введения АЛА Группы крыс, получавших АЛА в комбинации с лазером в дозах 0,75 Дж/см2 и 2,2 Дж/см2, показали наилучший результат в динамике изменения площади ран (Рис. 60, столбцы 4 и 6 соответственно). 263 Само по себе введение АЛА также ускоряет скорость заживления экспериментальных кожных ран у крыс (Рис. 60, столбец 2). Вероятно, этот эффект связан с побочным влиянием дневного освещения, от которого животных невозможно было полностью изолировать в наших экспериментальных условиях. 4.6.3. Влияние низкоинтенсивного лазерного излучения на скорость заживления экспериментальных кожных ран у крыс при введении экзогенных фотосенсибилизаторов - феофорбида а или протопорфирина IX В следующей серии экспериментов представляло интерес исследовать влияние низкоинтенсивного лазерного излучения в присутствии экзогенных фотосенсибилизаторов - протопорфирина IX и феофорбида а - на общую продолжительность заживления ран. Для облучения раневых поверхностей в данном разделе также применили гелий-неоновый лазер УЛФ-01. Была выбрана доза облучения 2,2 Дж/см2, как эффективно проявившая себя в предыдущих исследованиях. Общая динамика заживления ран осталась прежней - полное заживление у разных крыс происходило примерно на 20 - 25 дни после операции. Результаты измерений площади ран на 20-й день после операции представлены на Рис. 61. Наименьшие сроки заживления наблюдали для группы с облучением лазером без ФС (Рис. 61, столбец 2). Существенных и достоверных отличий в сроках полного заживления ран в других группах не наблюдалось. Можно предположить, что в условиях повышенного уровня фотосенсибилизаторов - доза облучения оказалась большой для оказания стимулирующего эффекта лазерного излучения в присутствии экзогенных ФС. Также необходимо отметить, что собственно введение экзогенных ФС без последующего облучения не приводило к отличиям от контроля (без облучения и 264 без ФС). Поэтому результаты по группам с фотосенсибилизаторами, без облучения не представлены. Рис. 61. Площадь ран у крыс на 20 день после операции в контрольной группе без фотосенсибилизаторов и облучения (1); в группе с облучением, без фотосенсибилизаторов (2); в группе с облучением после введения протопорфирина IX (3); в группе с облучением после введения феофорбида а (4). Результаты по группам с фотосенсибилизаторами, без облучения не представлены, так как не отличались от контроля. В опытных группах доза облучения гелийнеоновым лазером составляла 2,2 Дж/см2 265 4.7. Сравнение биологических эффектов низкоинтенсивного лазерного и светодиодного излучения Результаты данного раздела получены совместно с Шураевой Н.Ю. (РНИМУ им. Н.И. Пирогова). В "Обзоре литературы" мы обсуждали применение в современной физиотерапии не только лазерных, но и светодиодных источников излучения. Преимущества последних - невысокая цена, компактность и возможность изготовления источников излучения любой формы и площади. Однако светодиоды являются источниками некогерентного излучения и это является предметом споров в научной литературе об эффективности их терапевтического действия. Как отмечалось в "Обзоре литературы" обсуждаются даже гипотезы механизмов НИЛИ, основанные на его особых свойствах: когерентности и поляризованности. Тем ни менее в клинической практике светодиоды используются на основе эмпирического подхода. С целью перехода от эмпирического выбора светодиодных источников к научно обоснованному и была проведена данная серия экспериментов. Было проведено сравнение биологических эффектов низкоинтенсивного лазерного и светодиодного излучения при облучении in vitro (облучали суспензию перитонеальных макрофагов крыс) и in vivo (облучали поверхность экспериментальной кожной раны у крыс). Так как наиболее существенные эффекты были обнаружены при действии НИЛИ в красном диапазоне спектра, а также основываясь на широком использовании излучения этого диапазона в практической медицине - исследование было проведено с применением источников излучений именно в красной области видимого спектра электромагнитных волн. 266 4.7.1. Влияние лазерного или светодиодного облучения in vitro на продукцию оксида азота и супероксиддисмутазную активность перитонеальных макрофагов крыс В этой серии экспериментов мы исследовали эффекты лазерного и светодиодного излучений в красном диапазоне спектра на продукцию оксида азота и СОД-активность в суспензии перитонеальных макрофагов крыс при облучении суспензии клеток in vitro. В каждой серии экспериментов использовали клетки, выделенные из одного и того же животного. В общем случае количество клеток делили на 4 части. Одну часть использовали для лазерного облучения. Вторую часть - для облучения светодиодом. Третью и четвертую части - для соответствующих контролей (инкубация в тех же условиях, но без излучения). Данные контрольных групп практически совпадали, поэтому ниже представлены данные только одной контрольной группы ("светодиодной"). В особых случаях групп клеток могло быть больше (например, при исследованиях с ингибитором синтеза белка). Использование клеток разных животных в отдельных сериях экспериментов приводит к тому, что исходные значения (например, СОД-активности) могут отличаться в силу индивидуальных особенностей каждого лабораторного животного. Эксперименты были воспроизведены на нескольких животных и в работе представлены типичные примеры. В качестве источников излучения применили гелий-неоновый лазер УЛФ01 и светодиод У-332Б. Для достижения одинаковой мощности излучения (11 мВт) у облучаемой поверхности - при использовании светодиода применяли светофильтр НС8, установленный непосредственно над образцом. Сначала проводили облучение опытных образцов или соответствующую темновую инкубацию контрольных образцов. После клетки инкубировали 24 часа и потом определяли содержание нитрит-ионов (более подробно см. "Материалы и методы"). Тем самым исследовали "отсроченные" эффекты низкоинтенсивных 267 лазерного и светодиодных излучений. Схема проведения эксперимента представлена на Рис. 27. В первой серии экспериментов исследовали влияние лазерного или светодиодного облучения суспензии перитонеальных макрофагов на продукцию ионов NO2¯ . Результаты данных экспериментов на примере одной из крыс представлены в Таблица 20. Необходимо отметить, что эксперименты данного и других соответствующих разделов были проведены на перитонеальных макрофагах разных крыс, поэтому пик фотоиндуцированного увеличения концентрации нитритов нельзя сравнивать с предыдущими данными. В контрольных экспериментах доза облучения составила 0 Дж/см2 и клетки инкубировались в темноте, в течение времени, равного времени облучения (0, 7, 10 и 21 мин. для каждой дозы облучения соответственно). При этом достоверных различий в содержании ионов NO2¯ во всех контрольных образцах не обнаружено. Однако при облучении образцов лазером или светодиодом ситуация изменилась. Обнаружено дозозависимое изменение продукции ионов NO2¯ перитонеальными макрофагами крыс как при лазерном, так и при светодиодном облучении. Обнаруженные зависимости имели колоколообразный характер и существенно не отличались для когерентного и некогерентного излучений (Таблица 20). В обоих случаях максимальный эффект наблюдался при дозе облучения 8,6 Дж/см2. При этом продукция ионов NO2¯ возросла в 3,2 раза при лазерном облучении, и в 2,9 раз - при светодиодном. Увеличение дозы облучения до 17,6 Дж/см2 сопровождалось относительным снижением ионов NO2¯ , что может быть связано с чрезмерным развитием фотодинамического окисления липидов в мембранах макрофагов и функциональной активности. гибелью части клеток или снижением их 268 Продукция ионов NO2¯ , мкМ Продукция ионов NO2¯ , мкМ Продукция ионов NO2¯ , мкМ Темновая инкубация за время, равное времени облучения ЛАЗЕР СВЕТОДИОД 0 16,3 ± 0,9 - - 6,0 17,3 ± 1,2 42,1 ± 0,7 40,7 ± 1,1 8,6 16,5 ± 0,6 52, 0 ± 1,6 47,3 ± 1,2 17,6 15,2 ± 0,9 24,5 ± 1,5 22,5 ± 1,6 Доза, Дж/см2 Таблица 20. Влияние низкоинтенсивных лазерного и светодиодного излучений на продукцию ионов NO2¯ перитонеальными макрофагами крыс. (Методику проведения эксперимента - см. "Материалы и методы") Ранее нами было обнаружено, что "отсроченное" действие низкоинтенсивного лазерного излучения может быть связано с изменением не только функциональной, но и синтетической активности клеток (Рис. 28, Рис. 29). Представляло интерес выяснить, сохраняется ли данная закономерность для эффектов некогерентного светодиодного излучения. Поэтому в следующей серии экспериментов использовали транскрипционный ингибитор синтеза белков циклогексемид и субстратный ингибитор NO-синтазы - L-N-монометиларгенин при облучении суспензии макрофагов светодиодом. При этом исследование проводили с клетками той же крысы. Необходимо отметить, что в данной серии экспериментов были дополнительные контрольные группы - клетки, инкубированные с эквивалентными количествами циклогексемида или L-N-монометиларгенина, но без облучения и клетки, с эквивалентными количествами растворов, но без действующих веществ. Первые две группы учтены и результаты представлены, как разность концентрации ионов 269 NO2¯ в опытной и контрольной группах. Во второй паре контрольных групп, указанных выше, не выявлено каких-либо отличий. В результате было обнаружено исчезновение эффектов низкоинтенсивного светодиодного излучения на продукцию нитрит-ионов как при применении циклогексемида, так и в случае использования ингибитора NO-синтазы (Таблица 21). Напомним, что аналогичные результаты получены и при использовании низкоинтенсивного лазерного излучения (Рис. 28, Рис. 29). Продукция ионов NO2¯ , мкМ Продукция Циклогексемид, L-NMMA, ионов 0,5 мкМ 100 мкМ NO2¯ , мкМ Доза, Дж/см2 Темновая инкубация за время, равное времени облучения 0 16,3 ± 0,9 16,3 ± 0,9 8,7 ± 0,9 9,5 ± 0,9 6,0 17,3 ± 1,2 40,7 ± 1,1 13,6 ± 1,2 14,6 ± 1,2 8,6 16,5 ± 0,6 47,3 ± 1,2 14,7 ± 1,1 15,8 ± 0,8 17,6 15,2 ± 0,9 22,5 ± 1,6 9,2 ± 0,8 10,2 ± 0,7 Таблица 21. Продукция ионов NO2¯ перитонеальными макрофагами крыс при облучении светодиодом циклогексемида и в присутствии субстратного ингибитора ингибитора синтеза NO-синтазы белков - - L-N- монометиларгенина (L-NMMA). (Типичный эксперимент) Данные результаты демонстрируют единство механизмов действия на клетки как когерентного лазерного, так и некогерентного светодиодного излучений в одном диапазоне спектра. 270 В следующей серии экспериментов изучали влияние низкоинтенсивных лазерного или светодиодного облучения суспензии перитонеальных макрофагов крыс на их СОД-активность (Таблица 22). Необходимо отметить, что данные эксперименты были проведены на перитонеальных макрофагах другой крысы, поэтому пик сравнивать с фотоиндуцированного предыдущими увеличения данными. В СОД-активности данной серии нельзя экспериментов фотоиндуцированные изменения СОД-активности наблюдали в диапазоне доз излучения 0,9 - 2,9 Дж/см2. При этом в контрольной группе клетки инкубировались в темноте время, равное времени облучения (от 1 до 3,5 мин.). СОД-активность, Ед. СОД-активность, Ед. СОД-активность, Ед. Темновая инкубация за время, равное времени облучения ЛАЗЕР СВЕТОДИОД 0 21,0 ± 0,8 - - 0,9 21,8 ± 1,2 22,9 ± 2,3 29,3 ± 1,3 1,2 20,05 ± 0,6 28,6 ± 2,0 38,5 ± 2,7 1,5 21,0 ± 0,6 36,5 ± 5,6 51,9 ± 2,8 1,8 20,1 ± 0,4 47,0 ± 3,3 58,3 ± 1,6 2 20,8 ± 0,7 28,2 ± 1,6 22,9 ± 3,9 2,9 20,6 ± 1,8 11,7 ± 2,5 16,9 ± 1,8 Доза, Дж/см2 Таблица 22. Влияние низкоинтенсивных лазерного и светодиодного облучений суспензии перитонеальных макрофагов крыс на СОД-активность клеток. (Типичный эксперимент) Было обнаружено дозозависимое изменение СОД-активности перитонеальных макрофагов крыс, как при лазерном, так и при светодиодном облучении (Таблица 22). 271 В обоих случаях максимальный эффект наблюдался при дозе облучения 1,8 Дж/см2 и составил увеличение в 2,3 раза для лазерного и в 3 раза для светодиодного излучений. Увеличение дозы облучения до 2,9 Дж/см2 привело к угнетению СОД-активности как при лазерном, так и при светодиодном облучении. Интересно, что в данном эксперименте светодиодное излучение было несколько более действенным, чем лазерное. Однако общий характер и порядок эффектов лазерного и светодиодного излучений были аналогичны. Представляло интерес выяснить механизм фотоиндуцированного изменения СОД-активности перитонеальных макрофагов крыс. Основными механизмами могут быть два - снижение СОД-активности элементов антиоксидантной защиты или ингибирование синтеза фермента - супероксиддисмутазы. В случае действия низкоинтенсивного фотоиндуцированных лазерного излучения "отсроченных" нами эффектов была на показана отмена СОД-активность при использовании ингибиторов синтеза белка (Рис. 28). Для изучения данного вопроса в случае применения светодиодного излучения был проведен следующий эксперимент. Было исследовано влияние светодиодного излучения на суспензию перитонеальных макрофагов крыс в присутствии ингибитора синтеза белков- циклогексемида на СОД-активность клеток (Рис. 62). Необходимо отметить, что в разных сериях экспериментов использовали перитонеальные макрофаги разных крыс. Например на Рис. 62 представлены результаты исследований на клетках, выделенных из одной крысы, а в Таблица 22 - из другой крысы. В связи с этим абсолютные значения СОД-активности в разных сериях экспериментов отличаются в силу индивидуальных особенностей животных. Как и в случае применения низкоинтенсивного лазерного излучения (Рис. 28 Б, кривая 4) - в данной серии экспериментов было обнаружено исчезновение фотоиндуцированных изменений СОД-активности перитонеальных макрофагов при облучении светодиодом в присутствии циклогексемида (Рис. 62, кривая 2). 272 Это подтверждает аналогичные механизмы воздействия низкоинтенсивных лазерного и светодиодного излучений. СОД-активность, Ед. 160 80 0 0 1 2 Доза облучения, Дж/см2 3 Рис. 62. Влияние облучения светодиодом суспензии перитонеальных макрофагов крыс без (1) и в присутствии (2) ингибитора синтеза белков- циклогексемида на СОД-активность клеток 273 4.7.2. Влияние лазерного или светодиодного облучения поверхности ран на изменения функциональной активности лейкоцитов раневого экссудата Итак, нами показано аналогичное действие когерентного лазерного и некогерентного светодиодного излучений на синтетическую активность перитонеальных макрофагов крыс при облучении суспензии клеток in vitro. Представляло интерес сравнить биологические эффекты когерентного и некогерентного излучений при облучении in vivo. Из данных литературы, а также из приведенных выше результатов, очевидно, что в лазер-индуцированном заживлении ран активную роль играют клетки лейкоцитарной фракции. Представляло интерес исследовать изменения активности клеток лейкоцитарной фракции в раневом экссудате при использовании когерентного лазерного и некогерентного светодиодного источника излучений. В данной серии экспериментов животные были разделены на несколько групп (Рис. 63): контрольная группа - без облучения (А). Группа, облучаемая лазером (Б). Группа, облучаемая светодиодом (В). Ежедневная доза облучения в опытных группах составляла: 1 - 0.03 Дж/см2; 2 - 0.9 Дж/см2, 3 - 1.5 Дж/см2; 4 - 4.4 Дж/см2. Количество животных в экспериментальных группах: контрольная группа (n = 6); группа, облучаемая лазером (1 - 0.03 Дж/см2, n = 7; 2 - 0.9 Дж/см2, n = 7; 3 - 1.5 Дж/см2, n = 9; 4 - 4.4 Дж/см2, n = 6); группа, облучаемая светодиодом (1 0.03 Дж/см2, n = 7; 2 - 0.9 Дж/см2, n = 6; 3 - 1.5 Дж/см2, n = 6; 4 - 4.4 Дж/см2, n = 6). Общая схема проведения экспериментов представлена в Таблица 1. В контрольной группе активность клеток с течением времени уменьшалась почти вдвое со 100 до 48,7 ± 6% (Рис. 63, А). При облучении клеток лейкоцитарной фракции лазером и светодиодом наблюдали одинаковую тенденцию (Рис. 63, Б и В). С увеличением дозы облучения хемилюминесцентный ответ клеток сначала возрастал, а затем уменьшался. Небольшая доза - 0.03 Дж/см2 ежедневно (Рис. 63 Б и В, кривые 1) мало изменяла ХЛ-ответ клеток 274 лейкоцитарной фракции при сравнении с контрольной группой при облучении лазером и увеличивала его при облучении диодом. Так в лазерной группе активность клеток падала от 100 до 44 ± 10% (Рис. 63 Б, кривая 1), светодиодом – до 87 ± 22% (Рис. 63 В, кривая 1). Облучение ран дозами 0.9 (Рис. 63 Б и В, кривые 2) и 1.5 Дж/см2 (Рис. 63 Б и В, кривые 3) приводило к аналогичным ответам в опытных группах – функциональная активность клеток с течением времени возрастала. Максимальный эффект был достигнут при дозе 1.5 Дж/см2. Так при облучении лазером индекс прайминга увеличился от 100 до 233 ± 32% (Рис. 63 Б, кривая 3), светодиодом – до 371 ± 71% (Рис. 63 В, кривая 3). Последующее увеличение ежедневной дозы облучения до 4.4 Дж/см2 приводило к ингибированию активности клеток в опытных группах. В лазерной группе индекс прайминга уменьшился от 100 до 30 ± 6% (Рис. 63 Б, кривая 4), при воздействии излучения светодиода – до 16 ± 5% (Рис. 63 В, кривая 4). Таким образом, можно видеть, что действие излучения лазера и светодиода на изменение функциональной активности клеток лейкоцитарной фракции раневого экссудата крыс во многом аналогично. Интересно отметить, что при схожей направленности действия лазерного и светодиодного излучений – количественные характеристики эффектов несколько отличаются друг от друга, что необходимо учитывать при выборе параметров излучений при проведении лечения. 275 Рис. 63. Изменение функциональной активности клеток лейкоцитарной фракции раневого экссудата без облучения (А), при облучении лазером (Б) или светодиодом (В) со 2 по 5 день после операции. In – интенсивность ХЛ на 3, 4 или 5 дни; I2 – интенсивность ХЛ на 2 день. Ежедневная доза облучения: 1 - 0.03 Дж/см2; 2 - 0.9 Дж/см2; 3 - 1.5 Дж/см2; 4 - 4.4 Дж/см2 276 4.7.3. Влияние низкоинтенсивного лазерного и светодиодного облучения ран на концентрацию оксида азота в раневом экссудате крыс Ранее уже отмечалось, что помимо разнообразия эффектов самого оксида азота, важным этапом является возможность его взаимодействия с О2¯ [184, 367]. В результате этой реакции может образовываться пероксинитрит (ONOO¯ ), обладающий противоположным действием на сосуды по сравнению с оксидом азота (NO). ONOO¯ приводит к вазоконстрикции кровеносных сосудов, в то время как NO – мощный сосудорасширяющий агент [183, 367]. Стационарная концентрация активных форм азота частично может контролироваться супероксиддисмутазой, которая элиминирует О2¯ из системы, предотвращая избыточное образование пероксинитрита. В этой связи важно было исследовать изменение продукции оксида азота раневого экссудата после облучения ран лазером или светодиодом. Мы исследовали влияние излучения лазера и светодиода на продукцию нитрита (NO2¯ ) клетками лейкоцитарной фракции, выделенными из раневого экссудата крыс. Было обнаружено, что в течение четырех суток после нанесения раны происходит изменение концентрации NO2¯ (Рис. 64). В контрольной группе (без облучения) наблюдали постепенное снижение содержания нитрит-ионов,47% от исходного уровня к 4 дню до (Рис. 64 А). В опытных группах изменение продукции нитрит ионов клетками лейкоцитарной фракции зависело от дозы облучения (Рис. 64 Б и В). Небольшая доза облучения (0.03 Дж/см2) приводила к тому, что концентрация ионов NO2¯ оставалась практически постоянной на протяжении четырех суток, как после облучения лазером (Рис. 64 Б, кривая 1), так и при действии излучения светодиода (Рис. 64 В, кривая 1). Облучение ран более высокими дозами также не выявило принципиальных различий в действии света лазера и светодиода (Рис. 64 Б и В, кривые 2 - 4). При этом характер изменения продукции нитритов зависел только от дозы облучения. 277 Рис. 64. Динамика продукции ионов NO2¯ в раневом экссудате крыс после нанесения раны. Измерения проводились на 1, 2, 3 и 4 сутки после нанесения раны. Сn – концентрация ионов NO2¯ на 2, 3 или 4 сутки, С2 – концентрация ионов NO2¯ на вторые сутки после нанесения раны. А. Контрольная группа (без облучения) N = 9. Б. Группа, облучаемая лазером. Ежедневная доза облучения: 1 0.03 Дж/см2 , N = 7; 2 – 0.9 Дж/см2, N = 6; 3 – 1.5 Дж/см2, N = 8; 4 – 4.4 Дж/см2, N = 6. В. Группа, облучаемая светодиодом. Ежедневная доза облучения: 1 - 0.03 Дж/см2, N = 6; 2 – 0.9 Дж/см2, N = 8; 3 – 1.5 Дж/см2, N = 8; 4 – 4.4 Дж/см2, N = 6 278 Так облучение дозой 1.5 Дж/см2 приводило к значительному увеличению концентрации NO2¯ ионов и в той, и в другой группах. Облучение лазером вызывало увеличение нитрита до 319,4% к четвертым суткам (Рис. 64 Б, кривая 3), а светодиодом до – 272,5% (Рис. 64 В, кривая 3). Очевидно, что изменения начали развиваться уже на второй день после нанесения раны, когда воздействие лазером привело к увеличению нитритов до 236,8%, а светодиодом – до 144,75%. Интересно, что воздействие большей дозой (4.4 Дж/см2) приводило к снижению уровня нитритов (Рис. 64 Б и В, кривые 4). Так при облучении лазером концентрация ионов снизилась на 4 сутки до 14,5% (Рис. 64 Б, кривая 4), а светодиодом – до 18.8% (Рис. 64 В, кривая 4), что существенно ниже значений в контрольной группе – 47% от исходного значения (Рис. 64 А). Таким образом, в данной серии экспериментов нами показано, что излучение лазера и светодиода способно оказывать влияние на продукцию нитрит ионов клетками лейкоцитарной фракции раневого экссудата крыс. И опять мы не наблюдали принципиальных отличий в действии когерентного лазерного и некогерентного светодиодного излучений, хотя количественные различия имеются. При этом характер влияния в основном определяется дозой облучения, а не типом источника (лазер или светодиод). Можно предположить, что обнаруженные эффекты обусловлены фотоиндуцированным образованием индуцибельной NO синтазы и/или снижением вероятности взаимодействия оксида азота с другими активными соединениями, в частности с супероксид-анион радикалом. 279 4.7.4. Влияние низкоинтенсивного лазерного и светодиодного облучения ран на перекисное окисление липидов и антиокислительную активность раневого экссудата крыс Целью данной серии экспериментов было исследование действия низкоинтенсивных лазерного и светодиодного излучений на перекисное окисление липидов и антиокислительную активность раневого экссудата крыс. Таким образом мы предполагали расширить границы нашего сравнительного исследования эффективности действия низкоинтенсивных когерентного и некогерентного излучений на процессы, происходящие при заживлении экспериментальных кожных ран у крыс. 4.7.4.1. Влияние низкоинтенсивного лазерного и светодиодного излучения на накопление ТБК-активных продуктов в раневом экссудате крыс В первой серии экспериментов мы исследовали влияние излучения лазера и светодиода на концентрацию продуктов перекисного окисления липидов в раневом экссудате. Уровень перекисного окисления липидов оценивали по накоплению ТБК-активных продуктов (ТБКАП). В данной серии экспериментов использовали три группы животных: 1 контрольная группа (без облучения); 2 и 3 - опытные группы, облучаемые лазером и светодиодом соответственно. У облучаемых групп ежедневная доза облучения составила 1,5 Дж/см2. В опытных группах (2 и 3) облучение проводили на 2, 3 и 4 дни после операции. Забор экссудата проводили перед облучением. Ранее нами уже было выявлено, что в первые пять дней после операции происходит постепенное накопление продуктов окисления липидов в раневом экссудате (Рис. 50). Однако было обнаружено снижение уровня ТБКАП у крыс, подвергнутых лазерному облучению, по сравнению с контрольной группой. В группе без облучения (контрольной) к пятому дню после нанесения раны 280 концентрация ТБКАП возросла на 284% (Рис. 50 или Рис. 65, кривая 1). В то время, как излучение лазера к этому же дню приводило к увеличению продуктов окисления на 184% (Рис. 50 или Рис. 65, кривая 2). Интересно, что при облучении поверхности раны светодиодом, как и при облучением лазером – количество продуктов ПОЛ возрастало, но было меньше контроля и составило 152% к пятому дню после операции (Рис. 65, кривая 3). То есть когерентное лазерное и некогерентное светодиодное излучения показали схожий эффект. Таким образом, мы обнаружили, что наблюдается сходство в действии когерентного (лазер) и некогерентного (светодиод) излучений. Сn/С2 ТБКАП, % 350 250 1 * 2 150 3 50 2 3 4 День после операции 5 Рис. 65. Влияние излучения на концентрацию ТБК-активных продуктов в раневом экссудате крыс. ТБКАП - ТБК-активные продукты. C2 - концентрация ТБКАП в раневом экссудате на 2-й день после нанесения раны. Сn - на 3, 4 или 5 дни. 1. Контрольная группа (без облучения). 2. Группа, облучаемая лазером. 3. Группа, облучаемая светодиодом. Ежедневная доза облучения: 1,5 Дж/см2. В опытных группах (2 и 3) облучение проводили на 2, 3, и 4 дни после операции. Забор экссудата проводили перед облучением. Стрелками указаны моменты облучения ран. Объемы выборок N = 5 281 4.7.4.2. Влияние низкоинтенсивного лазерного и светодиодного излучения на изменения антиокислительной раневого экссудата в системе на основе азодиизобутирамидина гидрохлорида (АДБА) Итак, мы обнаружили накопление продуктов окисления липидов в раневом экссудате в динамике раневого процесса (Рис. 65). При этом излучения в красном диапазоне видимого спектра снижали уровень накопленных ТБК-активных продуктов. На этом фоне представляло интерес исследовать механизм антиоксидантного действия светового излучения. Поэтому в следующих экспериментах были исследованы изменения антиокислительной активности (АОА) раневого экссудата при облучении. С этой целью мы применили два метода измерения АОА, основанных на хемилюминесценции (ХЛ). Рис. 66. Типичные кинетики хемилюминесценции модельной системы на основе азосоединения АДБА при добавлении раневого экссудата. Получены на 5 день после операции. АДБА добавлен в начале измерения зависимости. 1. Контрольная группа (без облучения). 2. Группа, облучаемая светодиодом. 3. Группа, облучаемая лазером. Ежедневная доза облучения: 1,5 Дж/см2. В опытных группах (2 и 3) облучение проводили на 2, 3, и 4 дни после операции. Забор экссудата проводили перед облучением 282 В первую очередь мы использовали гомогенную систему на основе азодиизобутирамидина гидрохлорида (АДБА). Данный метод уже был использован нами ранее (Рис. 44). Типичные кинетики хемилюминесценции при добавлении раневого экссудата представлены на Рис. 66. Облучение ран низкоинтенсивным излучением в красном диапазоне в дозе 1,5 Дж/см2 приводило к увеличению латентного периода (Рис. 66, кривые 2 и 3). Для лазерного излучения аналогичные результаты были получены нами и ранее (Рис. 44). Результаты экспериментов по исследованию изменений латентного периода представлены на Рис. 67. Так в контрольной группе (без облучения) латентный период существенно не менялся и к пятому дню составил 118% по сравнению со вторым днем после нанесения раны (Рис. 67, кривая 1). Однако облучение светодиодом приводило к увеличению исследуемого параметра до 208% (Рис. 67, кривая 3), а лазером – до 272% (Рис. 67, кривая 2). Возрастание латентного периода после облучения ран свидетельствует об усилении способности раневого экссудата перехватывать RO•2 радикал АДБА. Иными словами, происходит увеличение антиокислительной активности раневого экссудата в результате светового воздействия на раны. Длительность латентного периода в системе АДБА с биологическими жидкостями в значительной степени определяется присутствием в нем мочевой кислоты [368]. Не исключено, что в нашем случае облучение приводит к увеличению ее концентрации в области раны, по сравнению с контрольной группой. Причиной этого может быть, например, активация системы ксантин-ксантиоксидаза, где ксантин окисляется до мочевой кислоты. Необходимо отметить, что и лазер и светодиод приводили примерно к одинаковым результатам (Рис. 67, кривые 2 и 3). Следовательно действие когерентного и некогерентного излучений оказалось аналогичным. Тем ни менее необходимо отметить количественные отличия в эффектах излучений, что 283 необходимо учитывать в практической медицине при авборе доз облучения для разных источников. Рис. 67. Влияние излучения на латентный период в системе АДБА. 1. Контрольная группа (без облучения). 2. Группа, облучаемая лазером. Ежедневная доза облучения: 1,5 Дж/см2. 3. Группа, облучаемая светодиодом. tn – латентный период на 3, 4 или 5 дни; t2 – латентный период на 2 день. Ежедневная доза облучения: 1,5 Дж/см2. Облучение проводили на 2, 3 и 4 дни после операции. Забор экссудата проводили перед облучением. Объемы выборок N = 6 4.7.4.3. Влияние низкоинтенсивного лазерного и светодиодного облучения ран на изменения супероксиддисмутазной активности раневого экссудата В этой серии экспериментов мы исследовали изменение активности супероксиддисмутазы в раневом экссудате крыс в течение четырех суток после нанесения раны (Рис. 68). В контрольной группе животных (Рис. 68 А) мы наблюдали снижение активности СОД до 24% от исходного значения к пятому дню. Однако облучение ран вызывало существенное возрастание активности фермента (Рис. 68 Б и В). 284 Рис. 68. Динамика изменения супероксиддисмутазной активности в раневом экссудате крыс после нанесения раны. Аn –активность СОД на 3, 4 или 5 сутки, А2 –активность СОД на 2 сутки после нанесения раны. А. Контрольная группа (без облучения), N = 6. Б. Группа, облучаемая лазером. Ежедневная доза облучения: 1 0.03 Дж/см2, N = 7; 2 – 1.5 Дж/см2, N = 9; 3 – 4.4 Дж/см2, N = 8. В. Группа, облучаемая светодиодом. Ежедневная доза облучения: 1 - 0.03 Дж/см2, N = 6; 2 – 1.5 Дж/см2, N = 8; 3 – 4.4 Дж/см2, N = 7 285 При этом принципиальных различий в эффектах излучения лазера и светодиода опять не обнаружилось. Так воздействие малой дозой излучения (0.03 Дж/см2) приводило к увеличению активности СОД до 247% при облучении лазером (Рис. 68 Б, кривая 1) и до 270% при облучении светодиодом (Рис. 68 В, кривая 1). Доза излучения 1.5 Дж/см2 (Рис. 68 Б и В, кривые 2) вызывала значительный прирост активности фермента – до 654% (лазер) и до 726% (светодиод). Дальнейшее увеличение дозы облучения сопровождалось тенденцией к снижению эффекта. Так при дозе 4.4 Дж/см2 – активность СОД возросла до 562% при действии лазера (Рис. 68 Б, кривая 3) и до 495% при облучении светодиодом (Рис. 68 Б, кривая 3). Итак, мы обнаружили изменение активности супероксиддисмутазы раневого экссудата. Характер обнаруженных эффектов был принципиально одинаков как после облучения ран лазером, так и светодиодом. При этом активность фермента менялась преимущественно в зависимости от дозы облучения. Обнаруженное действие излучения в красном диапазоне спектра может быть обусловлено двумя причинами: активацией синтеза СОД, как это было показано для гелий-неонового лазера [366] и/или реактивацией фермента, как это было показано ранее [215]. Итак, в результате проведенных экспериментов нами было обнаружено снижение количества продуктов перекисного окисления в раневом экссудате крыс при облучении ран видимым излучением как лазера, так и светодиода в красном диапазоне спектра. Обнаруженные эффекты сопровождались свето- индуцированным возрастанием антиокислительной активности экссудата. При этом когерентное излучение лазера и некогерентное излучение светодиода приводили к приблизительно одинаковым эффектам. 286 4.7.5. Влияние низкоинтенсивного лазерного и светодиодного излучения на скорость заживления и гистологическую картину экспериментальных кожных ран у крыс Нами было показано схожее действие низкоинтенсивных лазерного и светодиодного излучений на функциональную активность лейкоцитов, АОА и накопление продуктов ПОЛ в раневых экссудатах после облучения поверхности раны. Все эти параметры тесно связаны с течением раневого процесса и должны влиять на его динамику. Поэтому представляло интерес провести сравнительное исследование влияния когерентного лазерного и некогерентного светодиодного излучений на скорость заживления и морфологические параметры заживления модельных ран у крыс. Для выполнения этого исследования животные были поделены на три группы: А - контрольная (n = 6), Б – опытная с облучением ран когерентным излучением He-Ne лазера (632 нм; n = 9), В – опытная с облучением ран некогерентным излучением светодиода У-332Б (630 нм; n = 6). За процессом заживления ран следили, проводя их регулярную фотосъемку. Патоморфологические исследования проводили методом микроскопии после иссечения раневого материала и его окраски. При визуальном наблюдении за заживлением ран мы обнаружили существенные различия между контрольной и опытными группами животных (Таблица 23). В Таблица 23 приведены изображения ран крыс, принадлежащие животным из трех разных экспериментальных групп (контроль – животные не подвергавшиеся облучению и опытные группы – подвергшиеся действию лазерного и светодиодного излучений). Очевидно, что сразу после снятия колец (5 день после операции) диаметр ран был примерно одинаковый во всех трех группах. Однако на седьмой день появились различия в степени заживления ран между контрольной (Таблица 23, столбец А, 7 день) и опытными группами (Таблица 23, столбцы Б и В, 7 день). У 287 крыс из контрольной группы размеры ран были больше, чем у животных в опытных группах. Подобное соотношение стало более выраженным на 11 и 14 дни после операции. К 14-му дню в опытных группах процесс заживления ран практически завершился (Таблица 23, столбцы Б и В, 14 день), тогда как в операции День после контрольной группе он продолжался еще на протяжении 3 – 4 дней. А Б В (контроль) (лазер) (светодиод) 5 7 11 14 Таблица 23. Заживление ран у крыс на 5, 7, 11 и 14 дни после операции. Группы крыс: А - контрольная (без облучения), Б и В - с облучением лазером и светодиодом. У облученных групп (Б и В) ежедневная доза облучения составляла 1,5 Дж/см2 288 Важно отметить, что значимых отличий, между скоростью заживления ран у крыс, облученных когерентным светом лазера и некогерентным излучением светодиода не наблюдалось. Представляло интерес исследовать, какие различия между группами при этом наблюдаются на гистологическом уровне. С этой целью была проведена серия экспериментов по патоморфологическому исследованию раневого материала в ходе заживления (Таблица 24). Сравнение динамики раневого процесса по данным гистологического и гистохимического анализа свидетельствует о стимуляции заживления ран при облучении как гелий-неоновым лазером, так и светодиодом. В контрольной группе (Таблица 24, столбец А) на 5-й день после операции грануляционная ткань на дне раны была развита слабо и отличалась незрелостью своей структуры, воспалительной (нейтрофильной) инфильтрацией и признаками нарушения микроциркуляции. Фибринозный экссудат, покрывающий раневую поверхность, содержал тканевой и клеточный детрит и у части животных - колонии кокковой микрофлоры. К седьмым суткам грануляционная ткань увеличивалась в объеме и становилась более зрелой, воспалительные проявления снижались. Тем не менее, экссудат еще не полностью очищался от микрофлоры и детрита. Через 11 дней после операции грануляционная ткань еще более созревала и претерпевала рубцовую трансформацию. Отмечалась краевая эпителизация раневого дефекта и контракция раны. В группе с лазерным облучением (Таблица 24, столбец Б) уже на 5-й день по сравнению с контролем снижался отек, воспалительная инфильтрация тканей раны и признаки нарушения микроциркуляции. В экссудате отсутствовали микроорганизмы и было уменьшено содержание клеточного детрита. Грануляционная ткань имела более зрелый характер, чем в контроле: образовались вертикальные капиллярные петли, усилилась пролиферация фибробластов и неоангиогенез. 289 Таблица 24. Морфологические исследования раневого материала крыс на 5, 7 и 11 дни после операции. Окраска гематоксилином и эозином. Группы крыс: А контрольная (без облучения), Б и В - опытные с облучением лазером и светодиодом. У облученных групп (Б и В) ежедневная доза облучения составляла 1.5 Дж/см2. А. Контрольная группа. 5 сутки после нанесения раны: очаг незрелой грануляционной ткани в жировой клетчатке. Выраженная воспалительная инфильтрация, макрофагальная реакция, начинающаяся пролиферация фибробластов и новообразование капилляров. Увел. 400. 7 сутки: созревающая грануляционная ткань с участками грануляционной ткани. Воспалительная инфильтрация остается. Увел. 200. 11 сутки: фиброзная трансформация грануляционной ткани. Остаточная воспалительная инфильтрация. Краевая регенерация эпителия. Увел. 200. Б. Группа крыс, облученная лазером. 5 сутки: относительно зрелая грануляционная ткань с вертикальными сосудистыми петлями и горизонтальным 290 расположением фибробластов, уменьшение воспалительной инфильтрации. Увел. 200. 7 сутки: краевая регенерация эпителия: рост эпидермиса на грануляционную ткань под струп. Увел. 200. 11 сутки: фиброзно-рубцовая трансформация грануляционной ткани, поверхность которой выстлана эпидермисом. Воспалительная инфильтрация минимальна. Увел. 400. В. Группа крыс, облученная светодиодом. 5 сутки: участок созревающей грануляционной ткани с умеренной воспалительной инфильтрацией. Над грануляционной тканью - фибринозный экссудат. Увел. 200. 7 сутки: зрелая грануляционная ткань. Активный фибриллогенез коллагеновых волокон. Увел. 200. 11 сутки: рубцовое замещение грануляционной ткани. Резкое сокращение и выраженная эпителизация раны. Увел. 100. Была увеличилось отмечена содержание активация зрелых макрофагальной активно реакции, фагоцитирующих особенно макрофагов. Увеличилось число тучных клеток, регулирующих микроциркуляцию. К 7-му дню в этой группе по сравнению с контролем происходило более значительное очищение экссудата от детрита за счет интенсификации фагоцитарной активности. Грануляционная ткань созрела быстрее и уже в этот срок началась её фиброзная трансформация, т.е. усиление синтеза и фибриллогенеза коллагена. Уже в этот период отмечалась краевая регенерация эпителия. Воспалительные проявления в тканях раны практически исчезли. Через 11 дней резко сократились раны у животных этой группы за счет более интенсивной, чем в контроле, регенерации эпителия и контракции. Последняя была обусловлена формированием фиброзно-рубцовой ткани на месте грануляционной и активной сократительной функцией миофибробластов. Все это свидетельствует о том, что облучение гелий-неоновым лазером стимулирует переход воспалительной фазы раневого процесса в репаративную (пролиферативную) фазу, а затем в фазу рубцевания. Ключевым моментом является индукция макрофагального звена раневого процесса. В группе, где раны облучали некогерентным излучением светодиода (Таблица 24, столбец В), на 5-й день процессы раневой репарации по степени 291 развития и зрелости грануляционной ткани, уровню макрофагальной реакции, пролиферации фибробластов и неоангиогенеза, а также степени снижения воспалительных проявлений несколько уступали группе с лазерным облучением, но заметно превосходили контроль. Через 7 и 11 дней по всем показателям репаративного процесса (созревание и фиброзно-рубцовая трансформация грануляционной ткани, макрофагальная и фибробластическая реакция, контракция раны и регенерация эпителия) раны животных этой группы практически не уступали группе с лазерным воздействием. В завершении данной серии экспериментов были измерены площади ран в динамике их заживления. Результаты исследований представлены на Рис. 69. Рис. 69. Динамика изменения площади ран у крыс без облучения (1), с облучением лазером (2) или светодиодом (3). Доза облучения 1,5 Дж/см2 В контрольной группе средний срок заживления раны составил 22 дня после проведения операции (Рис. 69, прямая 1). В то время как в экспериментальных группах он составил 18 дней при облучении лазером (Рис. 69, прямая 2) и 17 дней при облучении светодиодом (Рис. 69, прямая 3). Необходимо отметить, что площади ран на 6-ые сутки существенно не отличались друг от 292 друга и определялись диаметром стандартного тефлонового кольца, использованного для создания экспериментальной раны. Очевидно сокращение сроков заживления ран в группах, подвергавшихся облучению. При этом существенной разницы при использовании лазерного и светодиодного источников не обнаружено. Итак, в результате экспериментов данного и соответствующих предыдущих разделов исследования мы можем заключить то, что облучение экспериментальных кожных ран у крыс низкоинтенсивным светом лазера и светодиода влияло на репаративные процессы в ране. Так изменялись скорость и характер заживления ран. Кроме того, менялась функциональная активность лейкоцитов раневого экссудата, АОА и уровень ПОЛ и эти изменения зависели от дозы облучения. Зависимость от дозы облучения определяет ускорение или замедление репаративных процессов в ране как при лазерном, так и при светодиодном облучении. Так наибольшая активация клеток лейкоцитарной фракции наблюдалась при дозе облучения 1.5 Дж/см2 (Рис. 63 Б и В, кривые 3). В этой же группе животных (при данной ежедневной дозе) проводилось фотографирование ран после снятия колец (Таблица 23) и было обнаружено ускорение заживления ран по сравнению с контролем. Кроме того, по данным морфологического исследования (Таблица 24) облучение ран когерентным или некогерентным красным светом дозой приводило к качественному изменению процессов заживления ран в лучшую сторону по сравнению с контрольной группой крыс. Таким образом, можно видеть, что существенных отличий в действии когерентного и некогерентного излучений на процесс заживления ран не обнаружено и когерентность лазерного излучения не является свойством, необходимым для проявления его лечебного действия. При этом для каждой длины волны излучения конечный эффект облучения определяется дозой облучения. 293 4.8. Роль эндогенных порфиринов в биологических эффектах низкоинтенсивного лазерного излучения Результаты данного раздела частично (в части экспериментов с оптическим спектрометром FS-003V) получены совместно с Булгаковой Н.Н. (Институт общей физики им. А.М.Прохорова РАН) Как отмечалось выше, главным звеном в фотодинамическом механизме действия света является первичный фотоакцептор. В данной работе в качестве таких фотоакцепторов рассматриваются эндогенные порфирины. Оказываемые НИЛИ биологические эффекты, которые развиваются вследствие реализации фотодинамического механизма, должны зависеть от содержания эндогенных фотосенсибилизаторов в биологических тканях и жидкостях. В связи с этим представляло оценить роль эндогенных порфиринов в биологических эффектах лазерного и светодиодного излучений. В предыдущем разделе нами было установлено, что когерентность не играет значения в этом вопросе, поэтому мы провели данные серии экспериментов только с НИЛИ. Однако известно, что концентрация эндогенных порфиринов в биологических образцах очень мала [126, 220], так как порфирины являются составляющими многих биологически важных веществ и поэтому активно используются в синтетических реакциях организма. А свободные порфирины утилизируются путем превращения в компоненты желчных пигментов или выводятся с калом и мочой [269]. В связи с этим сначала нам необходимо было разработать методику определения следовых количеств эндогенных порфиринов в биологических жидкостях (раневых экссудатах и плазме крови), используемых в наших экспериментах. 294 4.8.1. Регистрация эндогенных порфиринов: разработка методики, определение количества и динамики содержания эндогенных порфиринов в раневых экссудатах крыс Сначала представляло интерес оценить роль эндогенных порфиринов в действии света на раневой процесс. Для этого необходимо было разработать методику определения концентрации порфиринов в раневых экссудатах крыс. Однако этот вопрос является непростым, так как количество эндогенных порфиринов в биологических жидкостях и тканях мало [126, 220] и, следовательно, зарегистрировать уровень этих фотосенсибилизаторов довольно сложно. Наиболее чувствительным и доступным методом регистрации порфиринов является флуоресцентный метод [126, 277], который и был применен в настоящем исследовании. Данных научной литературы по определению количества эндогенных порфиринов в раневых экссудатах нет. Поэтому необходимо было разработать собственную методику флуоресцентного определения эндогенных порфиринов в раневых экссудатах. Для этого сначала были подобраны экспериментальные условия для такого флуоресцентного анализа. В работе использовали флуориметр Hitachi MPF-4 (Япония). В первую очередь были зарегистрированы стандартные спектры поглощения и флуоресценции протопорфирина IX (Рис. 70). Необходимо отметить, что раствор протопорфирина IX готовился в фосфатном буфере с 0,5% тритоном X-100 согласно рекомендациям производителя. Длины волн поглощения и флуоресценции были выбраны на основе данных литературы [126, 277]. Используя протопорфирин IX в концентрации 5 мкМ, мы получили стабильные спектры с высокими интенсивностями свечения (Рис. 70). 295 Рис. 70. Стандартные спектры возбуждения (А) и флуоресценции (Б) протопорфирина IX. Длина волны возбуждения - 405 нм, длина волны флуоресценции – 630 нм. Концентрация фотосенсибилизатора составляла 5 мкМ Однако, в биологических жидкостях и тканях уровень порфиринов меньше [126, 220]. В связи с этим необходимо было зарегистрировать подобные спектры с меньшим содержанием протопорфирина IX. Регистрация аналогичных спектров для низкой концентрации протопорфирина IX выявила существенное снижение интенсивности флуоресценции и появление шумов (Рис. 71). Необходимо было проверить - каков уровень флуоресценции эндогенных порфиринов в раневых экссудатах крыс и станет ли актуальным вопрос с низкой интенсивностью и шумами при регистрации таких спектров. И, действительно, мы увидели схожую картину в биологических образцах (Рис. 72). При этом флуоресценцию эндогенных порфиринов регистрировали в раневом экссудате крыс в день проведения эксперимента. Объем пробы для измерения флуоресценции составлял 120 мкл нативного раневого экссудата. Так же из Рис. 72 очевидно различное содержание эндогенных фотосенсибилизаторов для разных животных. 296 Рис. 71. Спектры возбуждения (А) и флуоресценции (Б) протопорфирина IX. Концентрация фотосенсибилизатора составляла 0,1 мкМ. Длина волны возбуждения - 405 нм (Б), длина волны флуоресценции – 630 нм (А) Перед тем, как решать вопросы по обработке спектров с такими шумами и низкими интенсивностями, положении пика необходимо флуоресценции и было удостовериться соответствии его в точном свечению именно порфиринов. Для этого был проведен следующий эксперимент. Были получены спектры флуоресценции эндогенных порфиринов в раневом экссудате крысы в присутствии протопорфирина IX. Для этого сначала регистрировался спектр флуоресценции нативного раневого экссудата крысы. Потом регистрировались спектры флуоресценции раневых экссудатов этой же крысы, к которым in vitro был добавлен протопорфирин IX. 297 Рис. 72. Типичные спектры флуоресценции эндогенных порфиринов в раневых экссудатах крыс. Использованы раневые экссудаты двух крыс (1 и 2). Длина волны возбуждения - 405 нм Фотосенсибилизатор добавляли в виде раствора в фосфатном буфере с 0,5% тритоном X-100 так, чтобы добавляемый объем составлял не более 10% от общего объема пробы. Общий объем пробы составлял 120 мкл Добавление экзогенного протопорфирина IX приводило к усилению соответствующего пика в раневом экссудате крысы, что доказывает люминесценцию именно эндогенных порфиринов (Рис. 73). Следующим этапом было устранение шумов на получаемых спектрах флуоресценции. Для устранения шумов сначала проводилось накопление спектров, а потом их сглаживание. При накоплении проводилось 9 измерений и для каждой длины волны бралось среднее значение. Затем осуществлялось сглаживание. При этом для каждых соседних трех длин волн находилось среднее значение интенсивности флуоресценции, которое и откладывалось на сглаженном спектре. 298 Рис. 73. Спектры флуоресценции нативного раневого экссудата крысы (1), а также растворов протопорфирина IX в конечной концентрации 150 нМ (2) и 300 нМ (3). Длина волны возбуждения - 405 нм Пример спектра флуоресценции раневого экссудата экссудата, полученный в результате накопления и сглаживания представлен на Рис. 74. .В результате были крыс, пригодные для получены спектры флуоресценции раневых экссудатов крыс определения содержания эндогенных порфиринов в образцах образцах. Как уже упоминалось выше, второй проблемой при регистрации спектров флуоресценции нативного экссудата крыс была невысокая интенсивность свечения. Кроме того, пики флуоресценции эндогенных порфиринов в раневых экссудатах были широкими широкими. 299 Для решения указанных вопросов содержание эндогенных порфиринов определяли не по величине пика флуоресценции, а по площади под этим пиком в интервале длин волн от 600 до 660 нм. Iфл, усл.ед. 0,3 0,0 600 630 Длина волны, нм 660 Рис. 74. Спектр флуоресценции эндогенных порфиринов нативного раневого экссудата крысы. Спектр усредненный и сглаженный. Длина волны возбуждения 405 нм. Была построена калибровочная прямая зависимости площади под кривой флуоресценции от количества протопорфирина IX в фосфатном буфере с тритоном X-100 (Рис. 75). Эта зависимость впоследствии использовалась для определения концентрации эндогенных порфиринов в раневых экссудатах. В результате были подобраны условия для успешной регистрации уровня эндогенных порфиринов в раневых экссудатах крыс. В результате нами было определено содержание данных фотосенсибилизаторов у разных крыс на второй день после операции (Таблица 25). При этом максимальная концентрация эндогенных порфиринов в раневых 300 экссудатах в данной серии экспериментов составляла 264 ± 26 нМ, а минимальная - 33 ± 7 нМ. Рис. 75. Калибровочная прямая для определения содержания эндогенных порфиринов. S - площадь под кривой спектра флуоресценции в интервале длин волн от 600 до 660 нм. [ПП IX], мкМ - концентрация протопорфирина IX, мкМ Очевидно, что количество порфиринов отличается у разных животных и этот показатель может стать решающим при индивидуальном подходе при низкоинтенсивной лазерной терапии. № крысы 1 [ПП IX] 264 нМ ± 26 2 3 4 5 253 ± 24 188 ± 17 156 ± 11 100 ± 15 6 7 8 9 10 11 92 ± 80 ± 64 ± 45 ± 40 ± 33 ± 12 11 14 6 9 7 Таблица 25. Содержание эндогенных порфиринов в раневых экссудатах крыс на второй день после операции операции. Измерения проведены на флуориметре Hitachi MPF4 (Япония) 301 Однако представляло интерес изучить вопрос возможного изменения уровня эндогенных порфиринов в зависимости от времени, прошедшего после операции. Для этого было определено содержание эндогенных порфиринов в раневых экссудатах крыс в течении четырех дней после операции - со 2-го по 5ый дни. Начиная 6-го с дня количество раневого экссудата существенно уменьшалось или он исчезал вовсе, что не предоставляло возможности проводить дальнейшие исследования. На Рис. 76 представлены результаты типичного эксперимента. Оказалось, что в указанном временном интервале максимальное количество эндогенных порфиринов в раневом экссудате наблюдается на второй день после операции, а минимальное - на четвертый. Так, например, по представленным для одной из крыс данным - на второй день после операции уровень эндогенных порфиринов составлял 156 ± 11 нм, а на четвертый день 36 ± 11 нм, что почти в 4 раза меньше (Рис. 76). Результаты данных исследований могут стать основой для изучения вопроса планирования сроков проведения низкоинтенсивной лазерной терапии в лечении раневых процессов. Итак, была разработана методика определения содержания эндогенных порфиринов в раневых экссудатах крыс, были определены концентрации этих фотосенсибилизаторов в образцах, а также была исследована динамика изменения количества порфиринов в раневых экссудатах с течением раневого процесса. Разработанный нами метод определения содержания эндогенных порфиринов в раневых экссудатах крыс является доступным для любой медикобиологической лаборатории, однако довольно трудоемким вследствие недостаточной чувствительности используемого флуориметра. В связи с этим, представляло интерес провести подобные исследования на высокочувствительном приборе, позволяющим оценить содержание эндогенных фотоакцепторов более точно и менее трудоемко. 302 Рис. 76. Изменение содержания эндогенных порфиринов в раневом экссудате крыс в динамике течения раневого процесса. Типичный эксперимент. [ПП IX], мкМ - концентрация протопорфирина IX, мкМ С этой целью в сотрудничестве с институтом общей физики им. А.М. Прохорова РАН проводили измерения флуоресценции порфиринов с помощью оптического спектрометра FS-003V (ООО «Кластер», Россия), позволяющего регистрировать спектры флуоресценции малых интенсивностей с высокой чувствительностью (Рис. 77). Для регистрации флуоресценции пластиковую пробирку, содержащую 120 мкл нативного раневого экссудата и волоконно-оптический катетер помещали в светонепроницаемое кюветное отделение и проводили измерения с боковой поверхности пробирки. Схема установки изображена на Рис. 16. С помощью высокочувствительного спектрометра FS-003V были получены спектры флуоресценции эндогенных порфиринов в раневых Типичные спектры для двух крыс представлены на Рис. 78. экссудатах. 303 Рис. 77. Спектр флуоресценции протопорфирина IX, измеренный с помощью оптического спектрометра FS-003V (ООО «Кластер», Россия). Концентрация фотосенсибилизатора составляла 2,5 мкМ (А, кривая 1) и 50 нМ (А, кривая 2 и Б). Длина волны возбуждения - 407 нм. Расчет содержания эндогенных порфиринов в раневых экссудатах проводили по предварительно разработанной и описанной выше методике, что и в предыдущем разделе (калибровочная прямая строилась для данных условий эксперимента). В исследуемых группах количество порфиринов оказалось невелико (Таблица 26). Важно заметить, что с применением более чувствительного прибора (спектрометра FS-003V) стала возможным регистрация спектров флуоресценции эндогенных порфиринов с низкой интенсивностью, которая была недоступна при использовании флуориметра Hitachi MPF-4 (именно по этой причине несколько образцов раневых экссудатов было исключено для исследования в предыдущем разделе). Итак, в раневых экссудатах крыс, используемых в данной серии экспериментов содержание эндогенных порфиринов варьировало от 7,3 до 43,2 нМ (Таблица 26). 304 Рис. 78. Типичные спектры флуоресценции эндогенных порфиринов в раневых экссудатах двух разных крыс (1 и 2), измеренные с помощью оптического спектрометра FS-003V (ООО «Кластер», Россия). Длина волны возбуждения - 407 нм Группы Опыт Контроль № крысы 1 2 3 4 5 6 [ПП], нМ 8,0 16,2 16,9 18,2 18,7 23,9 7 8 25,2 43,2 9 10 11 7,3 18,4 20,2 Таблица 26. Содержание эндогенных порфиринов в раневых экссудатах крыс на второй день после операции. Измерения проведены на оптическом спектрометре FS-003V (Россия). Контроль - контрольная группа - без облучения. Опыт опытная группа- с облучением. (Однако регистрация порфиринов проведена на второй день после операции, т.е. до облучения). [ПП], мкМ - концентрация эндогенных порфиринов, мкМ 305 Необходимо отметить, что исследования в данной части экспериментов оказались очень трудоемкими в связи с тем, что у животных из этих же групп необходимо было получить биологический материал для оценки параметров сравнения с концентрацией порфиринов. Количество раневого экссудата, требуемого одновременно и для определения эндогенных порфиринов, и для дальнейшего изучения фотоиндуцированных свободнорадикальных процессов, зачастую было недостаточно. В результате удалось определить содержание эндогенных порфиринов у 11 крыс, из них 3 крысы из контрольной группы (без облучения). (С этим же будет связано в дальнейшем различие в количестве крыс в группах). Итак, мы разработали методику определения эндогенных порфиринов в раневых экссудатах крыс. Следующим этапом было изучение роли эндогенных порфиринов в обнаруженных фотоиндуцированных изменениях свободнорадикальных процессов в экспериментальной кожной ране у крыс. 4.8.2. Роль эндогенных порфиринов в эффектах низкоинтенсивного лазерного излучения при облучении поверхности экспериментальных кожных ран у крыс Для исследования роли эндогенных порфиринов в эффектах НИЛИ были выбраны изменения функциональной активности клеток лейкоцитарной фракции и СОД-активности раневого экссудата, так как по результатам предыдущих исследований (Рис. 30, Рис. 45) эти параметры показали наибольшие изменения. Функциональную активность клеток оценивали по продукции супероксид-анион радикала методом люминол-зависимой хемилюминесценции. В данной серии экспериментов использовали гелий-неоновый лазер (УЛФ01), излучающий в красном диапазоне спектра и дозу облучения 1,5 Дж/см2 (эти условия также были выбраны, как наиболее эффективные по результатам прошлых экспериментов). Эксперименты повторили с учетом того, чтобы в 306 раневых экссудатах крыс определить концентрацию эндогенных порфиринов и провести индивидуальное сравнение изменений ХЛ-ответа, СОД-активности и содержания порфиринов у животных. Как и в предыдущих экспериментах (Рис. 30, Рис. 45) мы наблюдали резкое увеличение функциональной активности клеток лейкоцитарной фракции и СОДактивности раневого экссудата в опытной группе (с облучением), при этом эффекты существенно возрастали к 5-му дню после проведения операции. В то время, как в контрольной группе (без облучения) изучаемые параметры снижались (Рис. 79). Так к пятому дню после операции функциональная активность клеток возросла в 2,6 раза в опытной группе (Рис. 79, А2) и уменьшилась в 2,1 раза (Рис. 79, А1) в контрольной группе. Аналогичные изменения к пятому дню после операции произошли с СОДактивностью экссудата: увеличение в опытной группе в 5 раз (Рис. 79, Б2) и уменьшение в контрольной группе в 2,5 раза (Рис. 79, Б1). Как уже отмечалось выше, количество раневого экссудата, требуемого одновременно и для определения эндогенных порфиринов, и для определения СОД-активности и выделения клеток лейкоцитарной фракции раневого экссудата, зачастую было недостаточно. В данной ситуации трудно анализировать результаты контрольной группы, так как в этой группе для проведения полного исследования хватило биологического материала только от трех крыс. Тем ни менее, сравнение фотоиндуцированных изменений активности клеток и СОД-активности экссудата в опытной группе и этих же параметров у крыс контрольной группы с близкими значениями количества эндогенных порфиринов - показательны Рис. 80. Очевидно различие исследуемых значений в контрольной и опытной группах при сходных уровнях эндогенных порфиринов. 307 2 In/I2 А 2 1 1 0 2 3 4 День после операции 5 6 An/A2 Б 2 3 1 0 2 3 4 День после операции 5 Рис. 79. Изменение функциональной активности клеток лейкоцитарной фракции (А) и супероскиддисмутазной активности (Б) раневого экссудата крыс в контрольной группе - без облучения (1, n = 4) и опытной группе - с облучением (2, n = 8) со 2 по 5 дни после операции. In – интенсивность хемилюминесценции на 3, 4 или 5 дни; I2 – интенсивность хемилюминесценции на 2 день. An – супероксиддисмутазная активность на 3, 4 или 5 дни; A2 – супероксиддисмутазная активность на 2 день после операции. Доза облучения гелий-неоновым лазером в опытной группе - 1,5 Дж/см2 308 В случае изучения функциональной активности клеток лейкоцитарной фракции наибольшие отличия наблюдаются для крыс с содержанием порфиринов в интервале 18 - 20 нМ (Рис. 80, А). Рис. 80. Изменение функциональной активности клеток лейкоцитарной фракции (А) и СОД-активности (Б) раневого экссудата у крыс контрольной группы (без облучения) и опытной группы (с облучением гелий-неонового лазера, 1.5 Дж/см2) в зависимости от содержания эндогенных порфиринов в раневых экссудатах (концентрация порфиринов в "нМ" указана у соответствующих столбцов) Очевидно фотоиндуцированное увеличение функциональной активности клеток, возрастающее с концентрацией эндогенных порфиринов в раневом экссудате. При исследовании СОД-активности мы также обнаружили существенное увеличение этого параметра у крыс, подвергнувшихся облучению (Рис. 80, Б). Интересно, что при минимальной концентрации эндогенных порфиринов (7 - 8 нМ) наблюдалось максимальное отличие в СОД-активности раневого экссудата крыс. Увеличение содержания эндогенных ФС приводило к снижению фотоиндуцированного роста СОД-активности, но не к его отмене. 309 Эта же тенденция просматривается при анализе результатов только в опытных группах (Таблица 27). Так, в случае фотоиндуцированного изменения активности клеток лейкоцитарной фракции, - происходит ее снижение при содержании порфиринов в интервале 8 - 16,2 нМ. А в интервале 16,9 - 43,2 нМ активность клеток увеличивается. При этом возрастание уровня эндогенных ФС приводит к увеличению активности, степень которого снижается с увеличением содержания порфиринов. [ПП], нМ 8,0 16,2 16,9 18,2 18,7 25,2 43,2 ХЛ-ответ, I5/I2 0,3 0,5 1,5 2,3 3,1 2,9 1,1 Таблица 27. Индуцированные низкоинтенсивным гелий-неоновым лазером изменения хемилюминесцентного ответа клеток лейкоцитарной фракции раневого экссудата крыс. [ПП], мкМ - концентрация порфиринов, мкМ. I5 – интенсивность хемилюминесценции на 5 день; I2 – интенсивность хемилюминесценции на 2 день после операции. Данные по опытной группе (n = 7). Облучение проводили гелийнеоновым лазером, доза облучения 1,5 Дж/см2 При анализе результатов по фотоиндуцированному изменению СОДактивности раневого экссудата опытной группы очевидно увеличение данного параметра у всех крыс, подвергнутых облучению. При этом интересно, что эффективность воздействия НИЛИ снижается с ростом содержания эндогенных порфиринов в раневом экссудате крыс (Таблица 28). Итак, в результате проведенных экспериментов стало очевидно различное индивидуальное содержание эндогенных порфиринов в раневых экссудатах крыс, изменение их содержания в процессе развития раневого процесса и их возможная 310 роль в развитии фотоиндуцированных свободнорадикальных реакций в области раны. [ПП], нМ 8,0 16,2 16,9 18,7 23,9 25,2 43,2 СОД, A5/A2 7,3 6,3 8,5 4,5 3,9 4,6 2,6 Таблица 28. Индуцированные низкоинтенсивным гелий-неоновым лазером изменения СОД-активности раневого экссудата крыс. [ПП], мкМ - концентрация порфиринов, мкМ. А5 – СОД-активность (СОД) на 5 день; А2 - СОД-активность на 2 день после операции. Данные по опытной группе (n = 7). Облучение проводили гелий-неоновым лазером, доза облучения 1,5 Дж/см2 Также необходимо отметить, что существенное увеличение СОД- активности раневого экссудата крыс при исследовании на тканевом уровне может быть обусловлено как конкретными параметрами облучения (доза и длина волны излучения), так и тем, что в отличии от исследований на клеточном уровне (где объектами исследования были изолированные клетки лейкоцитарной фракции или макрофаги) – вклад в СОД-активность раневого экссудата могут вносить не только указанные клетки, но и другие клетки раневого содержимого, а также внеклеточная СОД. Необходимо отметить, что изучение этого вопроса на тканевом уровне с помощью модели экспериментальной кожной раны весьма ограничено, так как связано с небольшим количеством раневого экссудата, которого зачастую не хватает на проведение полного исследования. В связи с этим представляет интерес исследовать роль эндогенных порфиринов в системных эффектах низкоинтенсивного лазерного излучения при облучении ушной раковины крыс и регистрации изменений параметров крови. 311 4.8.3. Флуоресцентное измерение количества эндогенных порфиринов в плазме крови крыс Результаты данного раздела получены совместно с Буравлевым Е.А. (РНИМУ им. Н.И. Пирогова) и Булгаковой Н.Н. (Институт общей физики им. А.М.Прохорова РАН) Для исследования роли эндогенных порфиринов в системных эффектах низкоинтенсивного лазерного излучения сначала необходимо было подобрать условия регистрации флуоресценции эндогенных порфиринов (ЭП) в плазме крови крыс, т.к. ранее мы работали с раневыми экссудатами. Для измерения флуоресценции эндогенных порфиринов использовали высокочувствительный оптический спектрометр FS-003V (ООО «Кластер», Россия), представленный на Рис. 16 и использованный нами в предыдущем разделе при исследовании эффектов лазерного излучения на раневой процесс. Типичные спектры флуоресценции эндогенных порфиринов в плазме крови крыс представлены на Рис. 81 (кривые 1 и 2). Как видно из представленных спектров, в них присутствуют пики флуоресценции в красной области с максимумами в районе 632 нм, которые можно приписать ЭП (а именно протопорфирину IX). Для подтверждения этого предположения при аналогичных условиях возбуждения были измерены спектры флуоресценции экзогенного протопорфирина IX (ПП IX), который добавляли в плазму крови крыс в различных концентрациях. На Рис. 81 (кривая 3) представлен один из спектров, полученных таким образом. Можно видеть, что расположение максимумов флуоресценции экзогенного ПП IX и эндогенных порфиринов очень близки. Это подтверждает предположение о флуоресценции именно эндогенного ПП IX при данных условиях эксперимента. 312 300 3 100 2 IФЛ, усл. ед. 200 1 0 600 650 Длина волны, нм 700 Рис. 81. Типичные спектры флуоресценции эндогенных порфиринов плазмы крови крыс в отсутствии (1,2) и присутствии (3) экзогенного протопорфирина IX. Спектры измерены с помощью оптического спектрометра FS-003V (ООО «Кластер», Россия). Длина волны возбуждения - 407 нм. 1 - плазма крови крысы № 19 (см. Таблица 29). 2 - плазма крови крысы № 16. 3 - плазма крови крысы № 19, к которой добавлен экзогенный протопорфирин IX (210 нМ) Кроме того, из Рис. 81 очевидно, что интенсивности пиков флуоресценции в районе 632 нм отличалась у разных крыс (кривые 1 и 2), что свидетельствует о разном содержании ЭП. Для выбора оптимального метода количественного определения содержания эндогенных порфиринов в плазме крови мы получили зависимости интенсивности флуоресценции экзогенного протопорфирина IX от его концентрации в нативной плазме крови (Рис. 82 В), в фосфатном буфере с 0,5% тритоном X-100 (Рис. 82 Б) и в плазме крови, разведенной таким буфером в соотношении 1:1 (Рис. 82 А, пунктирная линия). 313 Рис. 82. Зависимость интенсивности флуоресценции протопорфирина IX от его концентрации. Длина волны возбуждения - 407 нм, длина волны флуоресценции – 632 нм. По осям ординат: Iфл - интенсивность флуоресценции. По осям абсцисс: сПП IX - концентрация экзогенного протопорфирина IX, нМ. А - экзогенный протопорфирин IX добавляли в плазму крови крысы № 19, разведенную фосфатным буфером с 0,5% тритоном X-100 в соотношении 1:1 (пунктирная линия). Сплошная линия - такая же зависимость, но с вычетом пика флуоресценции в отсутствии экзогенного протопорфирина (при cПП IX = 0). Б - экзогенный протопорфирин IX добавляли в фосфатный буфер с 0,5% тритоном X100. В - экзогенный протопорфирин IX добавляли в нативную плазму крысы № 19 314 № крысы сЭП ± σ, нМ 1 1 29.3 ± 2.5 (контрольная: 2 113.5 ± 3.0 без шока, 3 142.9 ± 2.3 без облучения) 4 214.3 ± 2.1 5 51.0 ± 2.2 6 57.4 ± 0.9 7 66.3 ± 3.7 8 75.3 ± 2.4 9 84.2 ± 1.1 10 89.3 ± 2.8 11 91.8 ± 1.2 12 105.9 ± 2.4 13 80.4 ± 1.5 14 90.6 ± 2.8 15 109.7 ± 3.8 16 113.5 ± 2.4 17 44.6 ± 2.3 18 52.0 ± 1.3 19 57.4 ± 2.4 20 63.8 ± 2.4 21 67.6 ± 2.3 22 85.5 ± 1.5 23 90.6 ± 1.7 24 109.7 ± 3.9 Группа 2 (с облучением, без шока) 3 (с шоком, без облучения) 4 (с облучением, с шоком) Таблица 29. Концентрация эндогенных порфиринов (ЭП) в плазме крови крыс в начале эксперимента (0 часов) 315 В результате мы остановили свой выбор на последнем варианте (Рис. 82 А), так как, с одной стороны, разведение плазмы фосфатным буфером с небольшим содержанием детергента приводило к существенному снижению светорассеяния, отличавшегося в образцах плазмы крови разных крыс. С другой стороны зависимость получена в исследуемом образце с учетом его биологического состава. В данной серии экспериментов (Рис. 82 А и В) использована плазма крови крысы № 19 (см. Таблица 29). При изучении флуоресценции порфиринов в плазме крови (Рис. 82 А и В) получили зависимости, в которых в отсутствии экзогенного протопорфирина IX (сПП IX = 0) наблюдали пик флуоресценции. Очевидно, что он связан с наличием в исследуемых образцах эндогенных порфиринов. Для дальнейшего количественного определения содержания ЭП у разных крыс произвели вычет вклада флуоресценции эндогенных порфиринов плазмы крови крысы № 19 (Рис. 82 А, сплошная линия). Для расчета концентрации ЭП в плазме крови крыс использовали уравнение полученной прямой у = 0,784 x (Рис. 82 А, сплошная линия), где y – высота пика флуоресценции ЭП в плазме при 632 нм, x – концентрация ЭП. Необходимо отметить, что при проведении таких же экспериментов с использованием плазмы крови других крыс - угол наклона прямой не отличался, что позволило нам получить единое уравнение для всех исследуемых животных. Итак, с помощью высокочувствительного спектрометра FS-003V были получены спектры флуоресценции эндогенных порфиринов в плазме крови различных крыс. В результате проведенных измерений в плазме крови всех исследуемых животных были определены концентрации эндогенных порфиринов (Таблица 29). У разных крыс эти значения варьировали от 29 до 214 нМ. 316 4.8.4. Зависимость эффектов низкоинтенсивного лазерного облучения in vivo на индекс прайминга лейкоцитов крови и супероксиддисмутазную активность плазмы крови от количества эндогенных порфиринов в плазме крови крыс Представляло интерес выяснить, как влияют обнаруженные различия в содержании эндогенных порфиринов у исследуемых животных на чувствительность свободнорадикальных процессов к лазерному облучению в норме и в условиях генерализованной патологии (эндотоксического шока). В группах без введения липополисахарида B (без шока) мы имели возможность исследовать действие собственно лазерного облучения на исследуемые параметры и оценить при этом роль эндогенных порфиринов. В группах с введением ЛПС, помимо этого, важно было оценить эффективность низкоинтенсивного видимого излучения в коррекции шоковых состояний и значение при этом уровня ЭП. В результате были проведены исследования зависимости изменений свободнорадикального статуса в крови животных от содержания эндогенных порфиринов проводили на группах крыс без (Рис. 83, 1 и 2) и с введением ЛПС (Рис. 83, 3 и 4). В обоих случаях контрольные группы (Рис. 83, 1 и 3) не подвергались облучению лазером. В опытных же группах (Рис. 83, 2 и 4) проводили лазерную терапию в красном диапазоне видимого спектра в дозе 1,5 Дж/см2. При этом проводили облучение ушной раковины крыс . Общая схема проведения эксперимента представлена в Таблица 2. Как и в наших предыдущих экспериментах (Рис. 45, Рис. 46, Рис. 47, Рис. 68) наиболее чувствительным параметром к воздействию света оказалась супероксиддисмутазная активность (А) плазмы крови (Рис. 83, кривые А). В контрольной группе животных без шока и без облучения (Рис. 83 1, кривая А) активность СОД практически не изменялась при любом количестве ЭП 317 в плазме крови. В группе с шоком без облучения наблюдали некоторое увеличение супероксиддисмутазной активности (в среднем на 26%), которое, однако, тоже не зависело от содержания эндогенных порфиринов (Рис. 83, 2, кривая А). Такое увеличение исследуемого параметра вероятно является проявлением защитных механизмов организма в ответ на бактериальную инфекцию, например, это может являться компенсацией снижения активности ПМЛ при инициировании шока (Рис. 83, 3, кривая Б). Облучение животных низкоинтенсивным лазерном светом в красном диапазоне существенно влияло на активность СОД (Рис. 83, 2 и 4, кривые А) и эффекты зависели от количества ЭП. Собственно видимое излучение (Рис. 83, 2, кривая А) приводило в большинстве случаев (содержание ЭП: от 57,4 до 91,8 нМ) к увеличению СОД активности плазмы (в среднем на 153%). Однако при минимальном (51 нМ) и максимальном (105,9 нМ) количестве эндогенных порфиринов существенного влияния света на исследуемый параметр не наблюдали. Данные результаты демонстрируют возможную роль ЭП как первичных акцепторов квантов излучения в цепи лазер-индуцированного изменения активности СОД плазмы крови. Это еще более подтверждается при изучении эффектов видимого света в красном диапазоне на СОД активность в условиях шока (Рис. 83, 4, кривая А). Воздействие лазерного излучения было более выражено и существенно зависело от содержания ЭП. При минимальных (44,6 и 52,0 нМ) и максимальной (109,7 нМ) концентрациях эндогенных порфиринов наблюдали угнетение СОД активности плазмы (в среднем на 29%). А в интервале содержания ЭП от 57,4 до 90,6 нМ лазерное излучение увеличивало исследуемый параметр (в среднем на 138%). 318 Рис. 83. Зависимости супероксиддисмутазной активности плазмы крови крыс (А), хемилюминесцентного ответа клеток лейкоцитарной фракции крови крыс (Б) и флуоресценции цис-паринариевой кислоты в липидах мембран эритроцитов крови крыс (В) от концентрации эндогенного порфирина (сЭП) в плазме крови крыс. Содержание эндогенных порфиринов измеряли после первого забора крови. 1 контрольная группа крыс – без облучения лазером и без введения ЛПС; 2 - группа крыс с облучением лазером уха крыс, без ЛПС; 3 - группа крыс с введением животным ЛПС, без облучения лазером; 4 – группа крыс с ЛПС и с облучением лазером уха крыс. По оси ординат: (А) X/X0 = АСОД II/АСОД I, где АСОД II и АСОД I - СОД активность плазмы крови крыс, выделенной вначале эксперимента (0 часов, АСОД I) и через 4 часа после начала эксперимента (АСОД II) соответственно; (Б) X/X0 = III/II, где III - максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови через 4 часа после начала эксперимента, II максимальная интенсивность хемилюминесценции клеток лейкоцитарной фракции, выделенных из крови в начале эксперимента (0 часов); (В) X/X0 = ПФII/ПФI, где ПФI и ПФII - % падения флуоресценции цис-паринариевой кислоты в липидах эритроцитов, выделенных из крови в начале эксперимента (0 часов, ПФI) и через 4 часа после начала эксперимента (ПФII) соответственно. Остальное см. в тексте. 319 В предыдущих экспериментах нами было показано, что еще одним чувствительным звеном в биологическом действии света являются клетки лейкоцитарной фракции крови (Рис. 30, Рис. 35, Рис. 37, Рис. 63, Рис. 79, Рис. 80). Для оценки активности этих клеток использовали хемилюминесцентный метод и определяли индекс прайминга. При исследовании лазер-индуцированных изменений функциональной активности полиморфноядерных клеток лейкоцитарной фракции крови крыс (Рис. 83, 2 и 4, кривые Б) мы обнаружили аналогичные зависимости, которые, были более выражены в условиях эндотоксического шока. Необходимо отметить, что в контрольных группах (Рис. 83, 1 и 3, кривые Б) существенного изменения активности лейкоцитов не происходило вне зависимости от содержания ЭП. В группе животных, которым вводили липополисахарид B наблюдали небольшое снижение данного показателя, что соответствует данным литературы и говорит об угнетении активности ПМЛ в первые часы развития шоковой реакции [173, 363]. Лазерное излучение, как и в случае СОД активности, приводило к активации ПМЛ в среднем диапазоне содержания ЭП и к угнетению исследуемого показателя при минимальных или максимальных значениях концентрации эндогенных порфиринов. Так в группе без введения ЛПС (Рис. 83, 2, кривая Б) в интервале ЭП от 57,4 до 91,8 нМ активность клеток лейкоцитарной фракции в ответ на облучение возрастала в среднем на 82%, а в в группе с шоком (Рис. 83, 4, кривая Б) в интервале ЭП от 57,4 до 90,6 нМ – на 221%! При минимальных и максимальных концентрациях ЭП хемилюминесцентный ответ изменялся несущественно или снижался. Нетрудно видеть, что зависимости от содержания порфиринов лазериндуцированных изменений СОД активности плазмы крови и функциональной активности клеток лейкоцитарной фракции - весьма сходны. Это может свидетельствовать о взаимосвязи этих процессов и о том, что при воздействии 320 красного света на эти параметры именно эндогенные порфирины являются первичными фотоакцепторами. В следующей серии экспериментов мы проводили измерение процессов перекисного окисления в липидах мембран эритроцитов крыс. Для этого мы использовали метод, основанный на измерении флуоресценции цис-паринариевой кислоты (цисПК), использованный и описанный в разделе 4.6.2. и в разделе "Материалы и методы". Как уже отмечалось, уровень снижения свечения цисПК свидетельствует о количестве быстро окисляемых липидов в образце. Как и в предыдущих экспериментах для сравнения изменений в липидах мы рассчитывали процент падения флуоресценции (ПФ) цисПК за 60 мин ее инкубации с липидами эритроцитов при 37ОС (см. раздел «Материалы и методы»). Результаты были представлены в виде отношения процентов падения через 4 часа (ПФII) к соответствующей величине в начале эксперимента (ПФI). Заметим, что инкубация цисПК в отсутствии липидов мембран эритроцитов не приводила к снижению ее флуоресценции (данные не указаны). Кривые В на Рис. 83 показывают, что в контрольных группах через 4 часа после начала эксперимента наблюдается снижение уровня окисленных липидов в эритроцитах крови крыс в среднем на 25% в группе без шока (Рис. 83, 1, кривая В) и на 40% в группе с шоком (Рис. 83, 3, кривая В). Это может быть связано с реакцией организма на забор крови и увеличением количества молодых эритроцитов. Лазерное облучение приводило к возрастанию уровня окисленных липидов в мембранах эритроцитов, при этом эффект был боле выражен условиях эндотоксического шока и не зависел от содержания ЭП. Так в группе без шока процент падения флуоресценции цисПК после облучения в среднем возрос на 46% (Рис. 83, 2, кривая В), а в группе с шоком – на 132% (Рис. 83, 4, кривая В)! Такое возрастание количества окисленных липидов может быть, в частности, вызвано активацией клеток лейкоцитарной фракции (Рис. 83, 2 и 4, кривые Б) в 321 среднем интервале концентраций ЭП и снижением антиоксидантной защиты (например, СОД активности) при минимальных и максимальных уровнях ЭП. Сами эндогенные порфирины в данном случае не рассматриваются, как первичные акцепторы, т.к. окисление липидов мембран эритроцитов – проявление системных взаимосвязанных и во многом вторичных процессов. Согласно фотодинамической гипотезе о терапевтических механизмах действия лазерного излучения, ЭП важны как первичные фотоакцепторы для инициирования окисления липидов в мембранах клеток лейкоцитарной фракции [20], что запускает каскад реакций по их активации, что и было нами ранее показано [2628]. Можно видеть, что два из трех исследованных нами параметров (супероксиддисмутазная активность плазмы крови и функциональная активность клеток лейкоцитарной фракции) являются наиболее чувствительными показателями при изучении терапевтических эффектов низкоинтенсивного лазерного излучения без (эндотоксического шока) и при в условиях облучении in генерализованной патологии vivo. Лазер-индуцированные изменения обоих этих параметров зависят от содержания эндогенных порфиринов в плазме крови. Следовательно, мы можем предположить, что ЭП являются первичными фоторецепторами лазерного излучения. Полученные результаты могут быть использованы для индивидуального подбора доз при проведении лечебного светового воздействия, поскольку для пациентов с пониженным или повышенным содержанием ЭП лазерная терапия будет неэффективна или даже может оказать отрицательное воздействие. Эффекты красного излучения в условиях эндотоксического шока были весьма существенными. Дальнейшие исследования в этой области могут привести к использованию щадящей поддерживающей фототерапии пациентов с такой тяжелой патологией. 322 5. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В работе исследованы различные этапы фотодинамического механизма действия лазерного и светодиодного излучений. Как уже отмечалось в "Обзоре литературы", к началу данного исследования (Рис. 6) был экспериментально подтвержден только один этап фотодинамической гипотезы - изменение концентрации цитозольного кальция в цитоплазме лейкоцитов крови при действии НИЛИ [25, 27]. Было показано изменение концентрации цитозольного кальция в зависимости от дозы облучения гелийнеоновым лазером. Кроме того, до начала данного исследования было обнаружено фотоиндуцированное изменение функциональной активности лейкоцитов [25], т.к. именно фагоцитирующим клеткам придается особое внимание в рамках данной гипотезы. Именно такие клетки могут опосредовать системные эффекты видимых излучений за счет циркуляции в организме и хемотаксиса, синтеза широкого круга биологически активных веществ и способности к праймингу. Однако ни эти, ни более поздние работы не исследовали роль и природу эндогенных фотосенсибилизаторов в лазер-индуцированных процессах изменения активности лейкоцитов. Кроме того, не были исследованы такие ключевые этапы фотодинамического механизма, как перекисное окисление липидов мембран фагоцитирующих клеток, продукция ими активных форм кислорода и азота в зависимости от параметров облучения и содержания эндогенных ФС. Не было исследовано механизма развития системных, а также отсроченных эффектов НИЛИ и не было проведено полномасштабного, по нескольким параметрам, сравнительного исследования действия когерентного лазерного и некогерентного светодиодного излучений. В данной работе, было зарегистрировано накопление продуктов окисления липидов мембран лейкоцитов при действии НИЛИ (Рис. 18, Рис. 19). Процессы 323 зависели от дозы облучения и усиливались в присутствии экзогенного ФС протопорфирина IX (Рис. 20), что доказывает участие фотосенсибилизированных реакций в запуске биологических эффектов лазерного излучения. Важно, что ПОЛ мембран лейкоцитов супероксид-анион сопровождалось радикала (один из изменением важных продукции признаков ими изменения функциональной активности фагоцитирующих клеток) (Рис. 21, Рис. 22, Рис. 25). Взаимосвязь изменения активности лейкоцитов и окисления их мембранных липидов подтверждена в присутствии антиоксидантов (ионола и токоферола), которые отменяли эффект НИЛИ (Рис. 23, Рис. 24). Результаты концентрации экспериментов продуктов ПОЛ по лазер-индуцированному мембран лейкоцитов и изменению сопутствующему изменению индекса предстимуляции этих клеток, а также ранее полученные нами данные по фотоиндуцированному изменению концентрации кальция доказывают основные этапы фотодинамического механизма при лазерном облучении in vitro. Следовательно, можно утверждать, что лазерное излучение инициирует ПОЛ мембран лейкоцитов, это ведет к изменению концентрации кальция в цитоплазме и это служит сигналом к модификации клеточной активности. Все изученные процессы зависят от дозы облучения, которая и определяет, каким будет итоговое влияние НИЛИ на клетку - ингибирующим или активирующим. Так, например, продукция супероксид-анион радикала клетками лейкоцитарной фракции крови с возрастанием дозы облучения сначала увеличивается, а потом - снижается (Рис. 21, Рис. 22). При этом постепенно повышается уровень продуктов ПОЛ, а, следовательно, и концентрация цитозольного кальция. В результате, мы наблюдаем колоколообразный характер в изменении ХЛ-ответа клеток лейкомассы. Усиление указанных параметров при ЛО в присутствии протопорфирина IX подтверждает возможную роль фотосенсибилизированных реакций с участием эндогенных порфиринов в инициировании развития изученных эффектов НИЛИ. 324 Напомню, что в данных сериях экспериментов исследования проводились сразу после облучения. Следовательно, лейкоциты крови ответственны за "быстрые" эффекты НИЛТ сразу после облучения. Тем ни менее в клинической практике известны случаи отложенного во времени эффекта ЛО. В данной работе было показано, что реализация отсроченных эффектов НИЛИ осуществляется с помощью других фагоцитирующих клеток - макрофагов. Облучение этих клеток in vitro приводило к изменению продукции активных форм кислорода и азота и к изменению СОД-активности. Однако для получения таких эффектов сразу после облучения требовались большие дозы ЛО или присутствие экзогенного ФС порфиринового ряда (Фотосенса) (Рис. 26, Таблица 3, Таблица 4). Тем не менее, при облучении суспензии макрофагов малыми дозами лазерного излучения изменения соответствующих параметров происходило через сутки после ЛО (Рис. 28, Рис. 29), что подтверждает участие данных клеток в реализации отсроченных эффектов НИЛИ. В экспериментах с облучением суспензии макрофагов при небольших дозах ЛО наблюдалась активация СОД, сопровождавшаяся повышением уровня оксида азота, при этом уровень пероксинитрита значительно не менялся (Рис. 28, Рис. 29). Однако увеличение дозы приводило к ингибированию фермента, сопровождающемуся накоплением пероксинитрита. Интересно отметить, что лазер-индуцированное увеличение продукции пероксинитрита происходило на фоне пониженного образования клетками NO2¯ . Известно, что в физиологических условиях пероксинитрит быстро восстанавливается в пероксинитриловую кислоту (ONOOH), которая менее устойчива и либо изомеризуется до нитрата (NO3¯ ), либо дисмутирует с образованием двуокиси азота (NO· 2), нитрозодиоксильного радикала (ONOO⋅) или нитрита и кислорода [183]. Вклад образования каждого из этих продуктов неизвестен и, вероятно, зависит от конкретных условий эксперимента. Тем не менее, некоторые авторы склонны полагать, что нитрат является основным продуктом распада пероксинитрита. Кроме этого, пероксинитрит, являясь 325 высокореакционным соединением, может взаимодействовать с целым рядом биологически важных соединений клетки. Так, например, пероксинитрит может участвовать в гидроксилировании фенилаланина, взаимодействии с CO2 (c константой скорости 5,88⋅10-4 М-1с-1) и с тиоловыми группами белков, может вызывать модификацию тирозиновых остатков белков и др. [183]. Таким образом, можно предположить, что с ростом образования в клетке пероксинитрита изменяется соотношение образования NO и NO2 ¯, а образующийся пероксинитрит преимущественно распадется до нитрата и вступает во взаимодействие с компонентами инкубационной среды и клетки. Итак, нами показано, что лазерное излучение в определенных диапазонах доз способно оказывать влияние не только на синтез iNOS макрофагами, но и на активность (и синтез de novo) супероксиддисмутазы, а также на образование пероксинитрита. Известно, что активация СОД in vivo может обусловливать антирадикальное действие НИЛИ, например, за счет таких процессов как: а) снижение восстановления супероксид-анионом комплексов трехвалентного железа до двухвалентного состояния (Fe2+ образует радикалы в реакции Фентона и реакции разветвления цепей окисления липидов), б) снижение стационарной концентрации супероксида может приводить к увеличению выхода фактора расслабления эндотелия (EDRF), что способствует расслаблению стенок кровеносных сосудов, в) усиления образования перекиси водорода и гипохлорит-ионов может приводить к бактерицидному действию. С другой стороны, данные экспериментов показывают, что благотворное действие НИЛИ лежит в узком интервале доз и при определенных условиях может сменяться нежелательными эффектами. Так при дозах более 1 Дж/см2 мы наблюдали снижение продукции СОД и увеличение образования пероксинитрита. 326 Пероксинитрит, являясь антагонистом оксида азота, способствует спазму сосудов и окислительному повреждению клетки. Указанные явления при передозировке НИЛИ могут лежать в основе эффектов вторичного обострения патологических состояний, часто наблюдаемых в клинической практике [11-13, 15, 57, 139]. Таким образом, мы показали реализацию основных этапов фотодинамического механизма действия НИЛИ при облучении in vitro. Однако представляло интерес изучить развитие обнаруженных эффектов при облучении in vivo на разных уровнях организации биологических объектов - тканевом и организменном, изучив тем самым системные эффекты видимых низкоинтенсивных излучений. Согласно фотодинамической гипотезы такие эффекты реализуются в первую очередь благодаря лейкоцитам. В связи с этим мы исследовали изменения активности этих клеток при облучении in vivo: поверхности экспериментальной кожной раны или ушной раковины у крыс. В результате мы наблюдали лазер-индуцированные изменения продукции активных форм кислорода и азота лейкоцитами раневого экссудата (Рис. 30, Рис. 63, Рис. 64) и крови (Рис. 37) после облучения поверхности ран или ушной раковины соответственно. Изменения зависели не только от дозы, но и от длины волны излучения. Интересно, что при меньшей дозе облучения более эффективно действовали коротковолновые излучения (в синем и зеленом диапазонах спектра), а при большей дозе - длинноволновые (в красном диапазоне). Мы это связываем с природой эндогенных акцепторов - эндогенных порфиринов, экстинкция которых снижается от синей к красной области видимого спектра (Рис. 31). Использование экзогенных ФС порфиринового ряда (протопорфирина IX, феофорбида а и хлорина е6) (Рис. 35, Рис. 41, Рис. 42) или индуктора синтеза эндогенных порфиринов (5-аминолевулиновой кислоты) (Таблица 6) приводило к смене активирующего влияния НИЛИ на ингибирующее, т.е. усиливало наблюдаемые процессы, что подтверждает участие фотосенсибилизированных реакций в реализации эффектов лазерного излучения. 327 При облучении ушной раковины у крыс мы проводили исследования не только у здоровых животных, но и у животных с экспериментальной патологией (экспериментальный эндотоксический шок). Оказалось, что в условиях генерализованной патологии при введении ЛПС влияние НИЛИ на лейкоциты крови существенно возрастает (Рис. 39). Это необходимо учитывать при разработке методик НИЛТ для различных заболеваний. В связи с тем, что клетки лейкоцитарной фракции способны к продукции активных форм кислорода и азота, представляло интерес изучить, как это повлияет на процессы ПОЛ и антиокислительную активность биологических жидкостей (раневых экссудатов, крови и ее компонентов). В результате было обнаружено, что ЛО in увеличивает vivo антиокислительную активность раневого экссудата (Рис. 44, Рис. 45, Рис. 52, Рис. 54) и плазмы крови (Рис. 47) после облучения in vivo (поверхности экспериментальной кожной раны и ушной раковины соответственно). Изменения зависели от дозы и длины волны излучения, что, вероятно, также определяет характер итогового эффекта НИЛИ - терапевтический или побочный. Применение экзогенных ФС порфиринового ряда (протопорфирина IX, феофорбида а и хлорина е6) (Рис. 46, Рис. 48, Рис. 49) снова приводило к смене активирующего влияния ЛО на ингибирующий, что доказывало роль фотосенсибилизированных реакции в инициировании развития подобных изменений после облучения. Кроме того, мы опять наблюдали усиление эффектов НИЛИ в условиях генерализованной патологии при введении ЛПС. Учитывая тесную взаимосвязь процессов изменения АОА и ПОЛ, мы также изучили изменение концентрации продуктов окисления липидов в раневых экссудатах и мембранах эритроцитов крови после облучения in vivo (поверхности экспериментальной кожной раны и ушной раковины соответственно). Выяснилось, что при развитии местных процессов (раневой процесс) во всех группах животных происходило возрастание продуктов перекисного 328 окисления липидов. При этом ресурса активированной лазерным облучением раны АОА было достаточно для снижения уровня ПОЛ в раневом экссудате (Рис. 50, Рис. 51, Таблица 16). Однако после облучения ушной раковины мы наблюдали умеренное увеличение продуктов ПОЛ в мембранах эритроцитов (Рис. 57), которое возрастало в условиях генерализованной патологии эндотоксического шока и усиливалось в присутствии экзогенных ФС порфиринового ряда (протопорфирина IX, феофорбида а и хлорина е6) (Рис. 58, Рис. 59). Следовательно, при реализации системных эффектов НИЛИ лазер-индуцированного увеличения АОА недостаточно для снижения уровня ПОЛ. Таким образом, мы наблюдали прооксидантный эффект НИЛИ при облучении in vivo, условия компенсации которого определялись патологией и параметрами облучения. Необходимо отметить, что при облучении in vivo мы изучали вторичные процессы ПОЛ, развивающиеся в результате изменений функциональной активности лейкоцитов и антиокислительной активности биологических жидкостей. В то время как при облучении in vitro (в первом разделе результатов) мы изучали первичное перекисное окисление липидов мембран клеток, инициированное фотосенсибилизированными реакциями в результате взаимодействия кванта света с ФС. Необходимо отметить, что изменение мощности и времени излучения при неизменной дозе облучения не приводило к достоверному изменению величины оказываемого НИЛИ эффекта в случае влияния на функциональную активность лейкоцитов раневого экссудата (Таблица 5) и уровень липопероксильных радикалов в раневых экссудатах (Таблица 14, Таблица 15). Тем самым нами было показано, что наблюдаемые эффекты НИЛИ являются результатом первичных однофотонных фотосенсибилизированных процессов. 329 Представляло интерес исследовать - как изменения активности лейкоцитов, ПОЛ и АОА могут повлиять на развитие патологического процесса. С этой целью мы изучили процесс заживления экспериментальных кожных ран у крыс. В результате - при действии НИЛИ мы наблюдали сокращение площади ран (Таблица 18) и сроков заживления (Таблица 17), ускорение изменения гистологической картины при сменен фаз раневого процесса (Таблица 24). Экзогенные ФС порфиринового ряда (протопорфирин IX и феофорбид а) и индуктор синтеза эндогенных порфиринов (5-аминолевулиновая кислота) усиливали данные эффекты, сменяя активирующее влияние ЛО на ингибирующее (Таблица 19, Рис. 60, Рис. 61). Эффекты зависели от дозы и длины волны излучения. При этом наблюдались соответствия с изменениями функциональной активности лейкоцитов и АОА раневого экссудата: для достижения терапевтического эффект при малой дозе облучения необходимо было применять коротковолновые (в синем и зеленом диапазонах спектра) излучения, а при большой дозе - длинноволновые (в красном диапазоне). Необходимо отметить, что все исследования были проведены с применением источников когерентного лазерного излучения. Однако в "Обзоре литературы" отмечалось, что в современной медицине эмпирически используются и светодиодные источники некогерентного излучения. Для перехода от эмпирического к научно обоснованному выбору последних мы провели сравнительное исследование биологических эффектов когерентного и некогерентного излучений. Было показано аналогичное действие когерентного и некогерентного излучений как при облучении как in vitro (Таблица 20, Таблица 22), так и in vivo (Рис. 63, Рис. 64, Рис. 65, Рис. 67, Рис. 68, Рис. 69, Таблица 23, Таблица 24). Принципиальных различий в действии этих излучений не наблюдалось. Следовательно, экспериментально было установлено, что когерентность не играет роли в реализации эффектов низкоинтенсивных излучений видимого диапазона 330 спектра. Тем не менее отличия в количественном выражении эффектов были. Это необходимо учитывать при разработке методик низкоинтенсивной световой терапии с применением светодиодов как источников излучений. Итак, при проведении данного исследования мы доказали реализацию основных этапов фотодинамического механизма при действии низкоинтенсивных лазерного и светодиодного излучений как in vitro, так и in vivo. Однако оставался неизученным один из главных вопросов - природа эндогенного фотоакцептора. В качестве такового мы рассматривали эндогенные порфирины, хорошо известные своими фотосенсибилизирующими свойствами и широко представленные в организме. Для поиска взаимосвязей обнаруженных лазер-индуцированных эффектов и количества порфиринов сначала необходимо было определить содержание последних в биологических жидкостях (раневых экссудатах и плазме крови). Для этого была разработана флуоресцентная методика регистрации следовых количеств ЭП (Разделы 4.8.1 и 4.8.3). В результате стало возможным определение концентрации эндогенных порфиринов в раневых экссудатах (Таблица 25, Таблица 26, Рис. 76) и в плазме крови крыс (Таблица 29). Сопоставляя обнаруженные ранее эффекты НИЛТ и содержание эндогенных ФС, удалось выявить зависимости лазер-индуцированных изменений активности лейкоцитов (Таблица 27, Рис. 80, Рис. 83) и СОД-активности (Таблица 28, Рис. 80, Рис. 83) от количества эндогенных порфиринов. Эти результаты являются прямым доказательством участия ЭП в реализации эффектов НИЛИ в качестве первичных фотоакцепторов. ингибирующие Показано, эффекты что или не лазерное вызывает облучение эффектов in вызывает vivo вовсе в случаях минимального или, наоборот, максимального граничных содержаний эндогенных порфиринов в биологических жидкостях. Итак, в данной работе подтверждены все основные этапы реализации фотодинамического механизма действия лазерного и светодиодного излучений. 331 Возможную схему событий мы можем представить следующим образом (Рис. 84): квант излучения, поглощаясь эндогенными акцепторами (порфиринами), инициирует запуск свободнорадикальных фотосенсибилизированных реакций. Это приводит к перекисному окислению липидов клеточных мембран фагоцитов, сопровождающемуся увеличением их проницаемости для ионов кальция. В результате происходит повышение функционального потенциала клеток лейкоцитарной фракции и макрофагов. Это сопровождается увеличением супероксиддисмутазной активности и повышенной продукцией активных форм кислорода и азота (в частности таких как супероксид-анион радикал, оксид азота и пероксинитрит). Также, опираясь на данные литературы, мы можем предположить образование других продуктов в этой цепи свободнорадикальных реакций. Такими продуктами могут быть гидроксильный радикал, перекиси, гипохлорит-ион, двухвалентное железо и другие [16, 18, 20, 88, 233]. Кроме того, клетки лейкоцитарной фракции и макрофаги способны продуцировать широкий спектр других биологически активных веществ, вовлекающих другие виды клеток и различные ткани в процесс ответа клетки, ткани и организма в целом на воздействие низкоинтенсивного видимого излучения. Так, широко известно, что клетки лейкоцитарной фракции и макрофаги, помимо активных форм кислорода и азота, продуцируют цитокины, простагландины, простациклины, лейкотриены, тромбоксаны, лактоферрин и др. вещества, участвующие в различных процессах, в том числе и в механизмах иммунной защиты организма. Кроме того, не надо забывать о фагоцитарной активности этих клеток. При этом, необходимо отметить, что в реализации фотодинамического механизма наблюдаются эффекты как кратковременного, так и пролонгированного действия, что может объяснить, в частности, "отсроченные" эффекты НИЛТ. Уровень образования всех активных продуктов при облучении in vivo как местно, так и системно, определяет баланс между положительным или отрицательным конечным биологическим эффектом низкоинтенсивного видимого 332 излучения. Таким балансом, например, может быть соотношение интенсивности процессов перекисного окисления липидов и изменения антиоксидантного статуса биологической клетки или ткани, исходное функциональное состояние клеток лейкоцитарной фракции и макрофагов, количество эндогенных порфиринов в биологических жидкостях и тканях. Так, например, повышенный синтез супероксид-анион радикала, оксида азота, пероксинитрита и других активных форм кислорода и азота может приводить к апоптозу и гибели клеток, к последующему поражению, некрозу и гибели биологических тканей. Возрастание уровня оксида азота и последующее снижение сосудистого сопротивления с неизбежным падением артериального давления может привести к шоку Токсичность оксида азота на клеточном уровне также связывают с образованием нитрозильных комплексов гемовых белков и Sнитрозилированием белков [175]. Следствием таких модификаций является обратимое ингибирование ферментов дыхательной цепи, цикла Кребса, синтеза ДНК. Кроме того, развитие окислительного стресса, индуцированного окисью азота, обусловлено продукцией мощного оксиданта ONOO¯ , который необратимо ингибирует ферменты, окисляет липиды и ДНК [152, 183, 369]. Однако оксид азота может играть и антиоксидантную роль. Как радикал, NO легко реагирует с другими свободными радикалами и может обрывать цепь перекисного окисления липидов или предупреждать её инициацию. Как восстановитель, NO ингибирует пероксидазы, окисляющие липиды до радикалов [175]. Кроме того, важную антиоксидантную роль несомненно играет супероксиддисмутаза, которая в наших экспериментах показала наибольшую чувствительность к облучению. Предотвращая поступление супероксид-анион радикалов в реакцию с оксидом азота, СОД опосредует снижение уровня пероксинитрита [370]. Кроме того, снижается риск других свободнорадикальных реакций с участием супероксид-анион радикала, ведущих к повреждению клеток и тканей. Таким образом, активные формы кислорода и азота могут выступать в качестве прооксидантов и антиоксидантов. И, вероятно, в случае действия 333 низкоинтенсивных излучений видимого диапазона это зависит от количества эндогенных порфиринов и/или при величины дозы облучения, характерной для конкретной длины волны излучения. Итак, показано определяющее влияние трех факторов на исход применения низкоинтенсивных излучений видимой части спектра в биологии и медицине: доза (1) и длина волны (2) излучения и концентрация эндогенных порфиринов (3) (Рис. 84). Именно правильное соотношение этих параметров и станет основой будущей клинической методики, позволяющей перейти от эмпирического выбора условий облучения при проведении низкоинтенсивной терапии лазерным или светодиодным излучениями к научно обоснованному и индивидуальному. Рис. 84. Реализация фотодинамического механизма низкоинтенсивных лазерного или светодиодного излучений на различных уровнях - клеточном, тканевом и организменном (схема автора). В работе показано определяющее влияние на исход применения данных излучений в биологии и медицине трех факторов: доза и длина волны излучения и концентрация эндогенных порфиринов. 334 6. ВЫВОДЫ 1. Низкоинтенсивное лазерное облучение in vitro в красном диапазоне спектра инициирует перекисное окисление липидов мембран клеток лейкоцитарной фракции крови и этот эффект зависит от дозы облучения. 2. Накопление продуктов окисления липидов мембран при облучении in vitro в красном диапазоне лазерном спектра сопровождается изменением (увеличением или снижением) продукции активных форм кислорода клетками лейкоцитарной фракции крови и этот эффект: а) зависит от дозы облучения; б) усиливается в присутствии экзогенного фотосенсибилизатора порфиринового ряда; в) отменяется в присутствии антиоксидантов (ионола и токоферола); г) наблюдается сразу после облучения. 3. Низкоинтенсивное лазерное облучение in vitro в красном диапазоне спектра влияет на продукцию активных форм кислорода и азота перитонеальными макрофагами крыс и этот эффект наиболее выражен через сутки после облучения, а также зависит от дозы облучения и усиливается в присутствии экзогенного фотосенсибилизатора порфиринового ряда. 4. Низкоинтенсивное лазерное излучение влияет на продукцию активных форм кислорода лейкоцитами раневого экссудата при облучении in vivo (поверхности экспериментальной кожной раны) и этот эффект зависит от дозы и длины волны излучения и усиливается при введении экзогенных фотосенсибилизаторов порфиринового ряда или индуктора синтеза эндогенных порфиринов. 5. Низкоинтенсивное лазерное излучение влияет на продукцию активных форм кислорода клетками лейкоцитарной фракции крови крыс при облучении in vivo (ушной раковины) и этот эффект зависит от дозы и длины волны излучения и усиливается при введении экзогенных 335 фотосенсибилизаторов порфиринового ряда, а также в условиях экспериментальной патологии (при введении липополисахарида B). 6. Низкоинтенсивное лазерное излучение влияет на антиокислительную активность раневого экссудата и плазмы крови крыс при облучении in vivo (поверхности экспериментальной кожной раны или ушной раковины соответственно) и этот эффект зависит от дозы и длины волны излучения и усиливается при введении экзогенных фотосенсибилизаторов порфиринового ряда. Супероксиддисмутазная активность плазмы крови после облучения ушной раковины крыс еще более усиливается в условиях экспериментальной патологии (при введении липополисахарида B). 7. Низкоинтенсивное лазерное излучение влияет на процесс перекисного окисления липидов в раневом экссудате и в плазме крови крыс при облучении in vivo (поверхности экспериментальной кожной раны или ушной раковины соответственно) и этот эффект зависит от дозы и длины волны излучения и фотосенсибилизаторов. усиливается Перекисное при введении окисление экзогенных липидов мембран эритроцитов крови после облучения ушной раковины крыс еще более усиливается в условиях экспериментальной патологии (при введении липополисахарида B). 8. Низкоинтенсивное лазерное излучение влияет на скорость заживления экспериментальных кожных ран у крыс и этот эффект зависит от дозы, длины волны излучения и от присутствия в раневых тканях экзогенных фотосенсибилизаторов порфиринового ряда или индуктора синтеза эндогенных порфиринов. 9. Низкоинтенсивное лазерное (когерентное) и светодиодное (некогерентное) излучения в красном диапазоне спектра оказывают аналогичные биологические эффекты, которые зависят от дозы облучения. А именно: влияние на продукцию активных форм кислорода и азота макрофагами и лейкоцитами при облучении in vitro, на перекисное окисление липидов и антиокислительную активность при облучении in vivo, на скорость 336 заживления и гистологическую картину экспериментальных кожных ран при облучении in vivo. 10. Эффективность действия низкоинтенсивного лазерного облучения in vivo на продукцию активных форм кислорода лейкоцитами и супероксиддисмутазную активность плазмы крови и раневого экссудата зависит от количества эндогенных порфиринов в плазме крови или в раневом экссудате соответственно (при фиксированной дозе и длине волны облучения). 337 7. ЗАКЛЮЧЕНИЕ В работе исследовался фотодинамический механизм действия низкоинтенсивного видимого излучения на биологические объекты. Установлено участие фотодинамического механизма в реализации биологических и терапевтических эффектов лазерного и светодиодного излучений. Исследование проведено на разных уровнях организации биологических объектов: от клетки к организму. Это позволило объяснить взаимосвязь различных обсуждаемых в научной и научно-практической литературе эффектах воздействия видимого света на клетки, ткани и организмы. Дальнейшее изучение фотодинамического механизма действия низкоинтенсивного излучения в видимом диапазоне спектра на биологические объекты имеет научные и клинические перспективы. Так, выполненная работа позволяет решить ключевой вопрос в исследовании механизмов терапевтического действия лазерного и светодиодного излучений - какова Экспериментально природа доказано, первичного что в акцептора реализации кванта некоторых излучения? эффектов низкоинтенсивных видимых излучений первичными фотоакцепторами являются эндогенные порфирины. Представляет интерес провести в будущем клинические исследования, посвященные изучению корреляции количества эндогенных порфиринов у пациентов, с одной стороны, и величины и направленности клинических эффектов НИЛТ, с другой стороны. Такие исследования позволят разработать методику индивидуального подхода для проведения данной терапии. Тогда для каждого пациента станет возможным индивидуально определять дозу и длину волны излучения для достижения максимального терапевтического эффекта и исключения осложнений. 338 Кроме того, дальнейшее изучение содержания эндогенных порфиринов в биологических жидкостях и тканях в норме и при различных патологических процессах может стать важным диагностическим и прогностическим фактором в лечении различных патологий. Результаты данного исследования могут быть использованы в научных целях для изучения фотосенсибилизированных реакций на разных уровнях организации биологических совершенствованию синтеза объектов. новых Это, в препаратов частности, для поможет проведения фотодинамической терапии не только опухолей, но и других заболеваний. Необходимо также отметить, что в нашем исследовании показана сравнимая эффективность низкоинтенсивных лазерного (когерентного) и светодиодного (некогерентного) излучений. Это позволяет обоснованно использовать в клинике недорогие и компактные светодиодные терапевтические аппараты. 339 8. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. С целью разработки клинического метода индивидуального выбора дозы и длины волны излучения при проведении световой терапии рекомендуется провести клинические исследования уровня эндогенных порфиринов у различных (по полу, возрасту, заболеваниям...) категорий населения в плазме крови, других биологических жидкостях и тканях. Для получения точных значений рекомендуется использовать флуоресцентный метод, описанный в данной работе. 2. Рекомендуется при проведении физиотерапии использовать не только лазерное (когерентное), но и светодиодное (некогерентное) излучения при тех же исходных параметрах процедур (доза облучения, количество процедур и т.п.). 3. Рекомендуется проведение испытаний новых фотосенсибилизаторов для фотодинамической терапии на клеточном, тканевом и организменном уровнях для предсказания возможного риска развития побочных эффектов. На клеточном уровне необходимо оценить воздействие на клетки лейкоцитарной фракции крови и тканевые макрофаги. На тканевом уровне предлагается модель экспериментальной кожной раны, на организменном уровне - модель экспериментального эндотоксического шока. 4. Рекомендуется преподавание материалов данного исследования студентам медицинского и биологического профиля образования в курсах обучения, посвященных фотобиологии и фотомедицине. 340 9. СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ АДБА Азодиизобутирамидина гидрохлорид АОА Антиокислительная активность АФК Активные формы кислорода ГНЛ Гелий-неоновый лазер ДК Диеновые коньюгаты ЛИ Лазерное излучение ЛО Лазерное облучение ЛПС, LPS Липополисахарид НАДФ Никотинамидадениндинуклеотидфосфат НИЛИ Низкоинтенсивное лазерное излучение НИЛТ Низкоинтенсивная лазерная терапия НСТ Нитросиний тетразолий ПОЛ Перекисное окисление липидов ПП IX Протопорфирин IX СОД Супероксиддисмутаза СОД-активность Супероксиддисмутазная активность СПН Синдром полиорганной недостаточности ТБК Тиобарбитуровая кислота ТБКАП ТБК-активные продукты ФС Фотосенсибилизаторы ХЛ Хемилюминесценция цис-ПК ЭП NF-κB Цис-паринариевая кислота Эндогенные порфирины Транскрипционный (ядерный) фактор B 341 10. БЛАГОДАРНОСТИ Работа посвящается светлой памяти профессора кафедры биофизики РГМУ д.б.н. Клебанова Геннадия Иосифовича, благодаря пионерским работам которого сделан большой вклад в понимание молекулярно-клеточных механизмов действия низкоинтенсивного лазерного излучения. В лаборатории Г.И. Клебанова было убедительно показано, что НИЛИ оказывает стимулирующее действие на фагоциты, приводя к коренной перестройке клеточного метаболизма. Данная работа является продолжением исследований профессора Г.И. Клебанова. Также выражаю огромную благодарность автору гипотезы о фотодинамическом механизме действия низкоинтенсивного лазерного излучения - академику РАН, профессору д.б.н. Ю.А. Владимирову. Благодаря работам Ю.А. Владимирова и стало возможным появление настоящего исследования. Кроме того, Ю.А. Владимиров оказал неоценимую всестороннюю помощь при выполнении данной работы. Безмерная благодарность научному консультанту - профессору, д.б.н. А.Н. Осипову, который поддержал теоретическое и экспериментальное развитие данного исследования. А.Н. Осипов оказал высококвалифицированную консультативную и методическую помощь и всестороннюю поддержку. Выражаю огромную благодарность д.м.н. профессору Е.Ф. Странадко, который стоял у истоков данного исследования, оказывал научную и научнопрактическую помощь и во многом способствовал внедрению результатов исследования в практическую медицину. Также благодарю всех сотрудников кафедр биофизики медико- биологического факультета и физики и математики педиатрического факультета, отдела медицинской биофизики Российского научно-исследовательского 342 медицинского университета за всевозможную помощь и внимание при проведении данного исследования. Огромная благодарность коллегам - сотрудникам Московской государственной академии химической технологии им. М.В. Ломоносова, Института общей физики РАН им. А.М. Прохорова, Городского научного центра хирургии РАМН - и многим другим за плодотворное и эффективное сотрудничество. Кроме того, благодарю свою семью за помощь и поддержку. 343 11. СПИСОК ЛИТЕРАТУРЫ 1. Farivar S. Biological effects of low level laser therapy / Farivar S., Malekshahabi T., Shiari R. // J Lasers Med Sci. - 2014. - Т. 5, № 2. - C. 58-62. 2. Hashmi J.T. Role of low-level laser therapy in neurorehabilitation / Hashmi J.T., Huang Y.Y., Osmani B.Z., Sharma S.K., Naeser M.A., Hamblin M.R. // PM R. 2010. - Т. 2, № 12 Suppl 2. - C. S292-305. 3. Ivandic B.T. Low-level laser therapy improves vision in patients with age-related macular degeneration / Ivandic B. T., Ivandic T. // Photomed Laser Surg. - 2008. - Т. 26, № 3. - C. 241-245. 4. Kim W.S. Is light-emitting diode phototherapy (LED-LLLT) really effective? / Kim W.S., Calderhead R.G. // Laser Ther. - 2011. - Т. 20, № 3. - C. 205 - 215. 5. Leal Junior E. C. Effect of cluster multi-diode light emitting diode therapy (LEDT) on exercise-induced skeletal muscle fatigue and skeletal muscle recovery in humans / Leal Junior E.C., Lopes-Martins R.A., Rossi R.P., De Marchi T., Baroni B.M., de Godoi V., Marcos R.L., Ramos L., Bjordal J.M. // Lasers Surg Med. - 2009. - Т. 41, № 8. - C. 572-7. 6. Mester E. Biological effects of laser radiation / Mester E., Jaszsagi-Nagy E. // Radiobiol Radiother (Berl). - 1971. - Т. 12, № 3. - C. 377-85. 7. Mester E. Lasers in clinical practice / Mester E., Juhasz J., Varga P., Karika G. // Acta Chir Acad Sci Hung. - 1968. - Т. 9, № 3. - C. 349-57. 8. U.S. Food and Drug Administration (FDA). Radiation-Emitting Products. Laser Facts [Электронный ресурс] / U.S. Food and Drug Administration (FDA) // Федеральный исполнительный департамент Министерства здравоохранения и социальных служб США - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов [Офиц. сайт]. - 2015. Режим доступа: URL: http://www.fda.gov/Radiation- EmittingProducts/ResourcesforYouRadiationEmittingProducts/ucm252761.htm# 5 (дата обращения: 19.06.2015). 344 9. Rola P. The Use of Low-Level Energy Laser Radiation in Basic and Clinical Research / Rola P., Doroszko A., Derkacz A. // Adv Clin Exp Med. - 2014. - Т. 23, № 5. - C. 835-842. 10. Agrawal T. Pre-conditioning with low-level laser (light) therapy: light before the storm / Agrawal T., Gupta G.K., Rai V., Carroll J.D., Hamblin M.R. // Dose Response. - 2014. - Т. 12, № 4. - C. 619-49. 11. Москвин С.В. Подсчет дозы низкоинтенсивного лазерного излучения: необходимость или вред? / Москвин С.В. // Вопросы курортологии, физиотерапии и лечебной физической культуры. - 2012. - Т. 6. - C. 54-55. 12. Chung H. The nuts and bolts of low-level laser (light) therapy / Chung H., Dai T., Sharma S.K., Huang Y.Y., Carroll J.D., Hamblin M.R. // Ann Biomed Eng. 2012. - Т. 40, № 2. - C. 516-33. 13. Гейниц А.В. Новые технологии внутривенного лазерного облучения крови: "ВЛОК + УФОК" и "ВЛОК-405" / Гейниц А.В., Москвин С.В. - М.: Тверь: ООО «Издательство «Триада», 2010. - 96 c. 14. Малиновский Е.Л. Низкоинтенсивная лазерная и КВЧ терапия с использованием терапевтических аппаратов серии "Милта" / Малиновский Е.Л. - М.: ЗАО "НПО Космического приборостроения", 2012. - 408 c. 15. Пономаренко Г.Н. Биофизические основы физиотерапии: учебное пособие / Пономаренко Г.Н., Турковский И.И. - М.: ОАО "Издательство "Медицина"", 2006. - 176 c. 16. Толстых П.И. Антиоксиданты и лазерное излучение в терапии ран и трофических язв / Толстых П.И., Клебанов Г.И., Шехтер А.Б., Толстых М.П., Тепляшин А.С. - Москва: Издательский дом "Эко", 2002. - 240 c. 17. Liebert A.D. Protein conformational modulation by photons: a mechanism for laser treatment effects / Liebert A.D., Bicknell B.T., Adams R.D. // Med Hypotheses. - 2014. - Т. 82, № 3. - C. 275 - 281. 18. Владимиров Ю.А. Физико-химические основы фотобиологических процессов / Владимиров Ю.А., Потапенко А.Я. - М.: Дрофа, 2006. - 286 c. 345 19. Владимиров Ю.А. Фотобиологические основы терапевтического применения лазерного облучения / Владимиров Ю.А., Осипов А.Н., Клебанов Г.И. // Биохимия. - 2004. - Т. 69, № 1. - C. 103-113. 20. Владимиров Ю.А. Три гипотезы о механизме действия лазерного облучения на клетки и организм человека / Владимиров Ю.А. // "Эфферентная медицина", Вып. - - М.: Институт Биомедицинской Химии РАМН, 1994. - С. 66. 21. Karu T.I. Elementary processes in cells after light absorption do not depend on the degree of polarization: implications for the mechanisms of laser phototherapy / Karu T.I., Pyatibrat L.V., Moskvin S.V., Andreev S., Letokhov V.S. // Photomed Laser Surg. - 2008. - Т. 26, № 2. - C. 77-82. 22. Karu T.I. Exact action spectra for cellular responses relevant to phototherapy / Karu T.I., Kolyakov S.F. // Photomed Laser Surg. - 2005. - Т. 23, № 4. - C. 35561. 23. Karu T.I. Multiple roles of cytochrome c oxidase in mammalian cells under action of red and IR-A radiation / Karu T.I. // IUBMB Life. - 2010. - Т. 62, № 8. - C. 607 - 610. 24. Karu T.I. Mitochondrial signaling in mammalian cells activated by red and nearIR radiation / Karu T.I. // Photochem Photobiol. - 2008. - Т. 84, № 5. - C. 1091-9. 25. Чичук Т.В. Свободнорадикальный механизм действия низкоинтенсивного лазерного излучения на лейкоциты: дис.... канд. мед. наук: 03.00.02 / Чичук Татьяна Вячеславовна. - М., 1997. - 144 c. 26. Клебанов Г.И. Влияние эндогенных фотосенсибилизаторов на лазериндуцированный прайминг лейкоцитов крови. / Клебанов Г.И., Страшкевич И.А., Чичук Т.В., Модестова Т.М., Владимиров Ю.А. // Биологические мембраны. - 1998. - Т. 15, № 3. - C. 273-285. 27. Клебанов Г.И. Влияние низкоинтенсивного лазерного излучения на пероксидацию мембранных липидов и концентрацию ионов кальция в цитозоле фагоцитов / Клебанов Г.И., Чичук Т.В., Владимиров Ю.А. // Биологические мембраны. - 2001. - Т. 18, № 1. - C. 42-50. 346 28. Клебанов Г.И. Роль порфиринов плазмы в стимулирующем действии излучения He-Ne лазера на лейкоциты человека / Клебанов Г.И., Чичук Т.В., Осипов А.Н., Владимиров Ю.А. // Биофизика. - 2005. - Т. 50, № 4. - C. 713 – 718. 29. Klebanov G.I. Interaction of photosensitizers with membranes of liposomes and of erythrocytes / Klebanov G.I., Stranadko E.F., Teselkin Y.O., Babenkova I.V., Chichuk T.V. // Proceedings of SPIE - The International Society for Optical Engineering. - 1996. - Т. 2924. - C. 205-211. 30. Priezzhev A.V. Aggregation and hemolysis of human erythrocytes at photodynamic therapy / Priezzhev A.V., Firsov N.N., Stranadko E.F., Ryaboshapka O.M., Chichuk T.V., Suschinskaya O.V. // Proceedings of SPIE The International Society for Optical Engineering. - 1996. - Т. 2924. - C. 212-218. 31. Klebanov G. I. Hematoporphyrin derivative or phthalocyanine photosensitized hemolysis of erythrocytes under laser irradiation / Klebanov G.I., Chichuk T.V., Shutova L.N., Stranadko E.F., Vladimirov Y.A. // Membr Cell Biol. - 1998. - Т. 11, № 5. - C. 597-607. 32. Klebanov G. I. Low-power laser irradiation induces leukocyte priming / Klebanov G.I., Teselkin Y.O., Babenkova I.V., Bashkujeva T.Y., Chichuk T.V., Vladimirov Y.A. // Gen Physiol Biophys. - 1998. - Т. 17, № 4. - C. 365-76. 33. Кабардин, О.Ф. Физика: справочные материалы. / Кабардин О.Ф. - М.: Просвещение, 1991. - 367 c. 34. Ремизов, А.Н. Учебник по медицинской и биологической физике / Ремизов А.Н., Максина А.Г., Потапенко А.Я. - М: Дрофа, 2003. - 560 c. 35. Савельев И. В. Курс общей физики: Учеб. пособие. В 3-х т. Т. 2. Электричество и магнетизм. Волны. Оптика. - 3-е изд., испр. / Савельев И. В. - М.: Наука. Гл. ред. физ.-мат. лит., 1988. - 496 c. 36. Егоров В.К. Измерение когерентности лазерного излучения: Учебное пособие и описание лабораторной работы / Егоров В.К., Стариков Р.С. - М.: МИФИ, 2008. - 76 c. 347 37. Качмарек Ф. Введение в физику лазеров / Качмарек Ф. - М.: Мир, 1981. 540 c. 38. Москвин С.В. Эффективность лазерной терапии: cерия "Эффективная лазерная терапия" / Москвин С.В. - Т. 2. - М.-Тверь: ООО "Издательство "Триада", 2014. - 896 c. 39. Agostinis P. Photodynamic therapy of cancer: an update / Agostinis P., Berg K., Cengel K.A., Foster T.H., Girotti A.W., Gollnick S.O., Hahn S.M., Hamblin M.R., Juzeniene A., Kessel D., Korbelik M., Moan J., Mroz P., Nowis D., Piette J., Wilson B.C., Golab J. // CA Cancer J Clin. - 2011. - Т. 61, № 4. - C. 250-81. 40. Гейниц А.В. Фотодинамическая терапия. История создания метода и ее механизмы. / Гейниц А.В., Сорокатый А.Е., Ягудаев Д.М., Трухманов Р.С. // Лазерная медицина. - 2007. - Т. 11, № 3. - C. 42 - 46. 41. Илларионов В.Е. Современные методы физиотерапии: Руководство для врачей общей практики (семейных врачей) / Илларионов В.Е., Симоненко В.Б. - М.: ОАО "Издательство "Медицина"", 2007. - 176 c. 42. Posten W. Low-level laser therapy for wound healing: mechanism and efficacy / Posten W., Wrone D.A., Dover J.S., Arndt K.A., Silapunt S., Alam M. // Dermatol Surg. - 2005. - Т. 31, № 3. - C. 334 - 340. 43. Pontinen P.J. Comparative effects of exposure to different light sources (He-Ne laser, InGaAl diode laser, a specific type of noncoherent LED) on skin blood flow for the head / Pontinen P.J., Aaltokallio T., Kolari P.J. // Acupunct Electrother Res. - 1996. - Т. 21, № 2. - C. 105 - 118. 44. Whelan H.T. Effect of NASA light-emitting diode irradiation on wound healing / Whelan H.T., Smits R.L., Jr., Buchman E.V., Whelan N.T., Turner S.G., Margolis D.A., Cevenini V., Stinson H., Ignatius R., Martin T., Cwiklinski J., Philippi A.F., Graf W.R., Hodgson B., Gould L., Kane M., Chen G., Caviness J. // J Clin Laser Med Surg. - 2001. - Т. 19, № 6. - C. 305 - 314. 45. Avci P. Low-level laser (light) therapy (LLLT) in skin: stimulating, healing, restoring / Avci P., Gupta A., Sadasivam M., Vecchio D., Pam Z., Pam N., Hamblin M.R. // Semin Cutan Med Surg. - 2013. - Т. 32, № 1. - C. 41-52. 348 46. Фаустова Е.Е. Что нужно знать косметологу: краткий справочник / Фаустова Е.Е., Федорова В.Н., Бурылина О.М., Шарова Н.М., Фаустов Е.В. М.: Гэотар-Медиа: Литтерра, 2015. - 152 c. 47. Девятков Н.Д. Применение электроники в медицине и биологии / Девятков Н.Д. // Электронная техника. Серия 1. СВЧ-техника. - 1993. - Т. 455, № 1. C. 66-76. 48. Министерство здравоохранения Российской Федерации. Приказ Минздравсоцразвития России №278 от 23 ноября 2004 г. "Об утверждении стандарта санаторно-курортной помощи больным с болезнями пищевода, желудка и двенадцатиперстной кишки, кишечника" [Электронный ресурс] / Министерство здравоохранения Российской Федерации // Министерство здравоохранения Российской [Офиц. сайт] Федерации. - 2004. - Режим URL: доступа: http://www.rosminzdrav.ru/documents/7967-prikaz- minzdravsotsrazvitiya-rossii-278-ot-23-noyabrya-2004-g (дата обращения: 19.06.2015). 49. Министерство здравоохранения Российской Федерации. Приказ Минздравсоцразвития России №277 от 23 ноября 2004 г. "Об утверждении стандарта санаторно-курортной помощи больным с болезнями печени, желчного пузыря, желчевыводящих путей и поджелудочной железы" [Электронный ресурс] / Министерство здравоохранения Российской Федерации // Министерство здравоохранения Российской Федерации [Офиц. сайт]. - 2004. - Режим доступа: URL: http://www.rosminzdrav.ru/documents/7962-prikaz-minzdravsotsrazvitiya-rossii277-ot-23-noyabrya-2004-g (дата обращения: 19.06.2015). 50. Министерство здравоохранения Российской Федерации. Приказ Минздравсоцразвития России №197 от 27 марта 2006 г. "Об организации деятельности родильного дома (отделения)" [Электронный ресурс] / Министерство здравоохранения Российской Федерации // Министерство здравоохранения Российской Федерации [Офиц. сайт]. - 2006. - Режим доступа: URL: http://www.rosminzdrav.ru/documents/7918-prikaz- 349 minzdravsotsrazvitiya-rossii-197-ot-27-marta-2006-g (дата обращения: 19.06.2015). 51. Российский научный центр медицинской реабилитации и курортологии. История Центра [Электронный ресурс] / Российский научный центр медицинской реабилитации и курортологии // Федеральное государственное бюджетное учреждение «Российский научный центр медицинской реабилитации и курортологии» Министерства здравоохранения Российской Федерации (ФГБУ «РНЦ МРиК» Минздрава России) [Офиц. сайт]. - 2015. Режим доступа: URL: http://www.rncvmik.ru/?ni=history&nii=index&niii=0 (дата обращения: 18.06.2015). 52. Российский научный центр лазерной медицины. История [Электронный ресурс] / Российский научный центр лазерной медицины // Федеральноое государственное бюджетное учреждение «Российский научный центр лазерной медицины» Министерства здравоохранения Российской Федерации (ФГБУ «РНЦ лазерной медицины» Минздрава России) [Офиц. сайт]. - 2015. - Режим доступа: URL: http://lasermedicine-ssc.org/history (дата обращения: 19.06.2015). 53. Volpato L.E. Viability of fibroblasts cultured under nutritional stress irradiated with red laser, infrared laser, and red light-emitting diode / Volpato L.E., de Oliveira R.C., Espinosa M.M., Bagnato V.S., Machado M.A. // J Biomed Opt. 2011. - Т. 16, № 7. - C. 075004. 54. Aimbire F. Low-level laser therapy decreases levels of lung neutrophils antiapoptotic factors by a NF-kappaB dependent mechanism / Aimbire F., Santos F.V., Albertini R., Castro-Faria-Neto H.C., Mittmann J., Pacheco-Soares C. // Int Immunopharmacol. - 2008. - Т. 8, № 4. - C. 603-5. 55. AlGhamdi K. M. Low-level laser therapy: a useful technique for enhancing the proliferation of various cultured cells / AlGhamdi K.M., Kumar A., Moussa N.A. // Lasers Med Sci. - 2012. - Т. 27, № 1. - C. 237-49. 56. Anwer A.G. Visible 532 nm laser irradiation of human adipose tissue-derived stem cells: effect on proliferation rates, mitochondria membrane potential and 350 autofluorescence / Anwer A.G., Gosnell M.E., Perinchery S.M., Inglis D.W., Goldys E.M. // Lasers Surg Med. - 2012. - Т. 44, № 9. - C. 769-78. 57. Araujo B.F. Effects of Low-Level Laser Therapy, 660 nm, in Experimental Septic Arthritis / Araujo B.F., Silva L.I., Meireles A., Rosa C.T., Gioppo N.M., Jorge A.S., Kunz R.I., Ribeiro Lde F., Brancalhao R.M., Bertolini G.R. // ISRN Rheumatol. - 2013. - Т. 2013. - C. 341832. 58. Asai T. The long-term effects of red light-emitting diode irradiation on the proliferation and differentiation of osteoblast-like MC3T3-E1 cells / Asai T., Suzuki H., Kitayama M., Matsumoto K., Kimoto A., Shigeoka M., Komori T. // Kobe J Med Sci. - 2014. - Т. 60, № 1. - C. E12-E18. 59. Dube A. Modulation of macrophage structure and function by low level He-Ne laser irradiation / Dube A., Bansal H., Gupta P. K. // Photochem Photobiol Sci. 2003. - Т. 2, № 8. - C. 851-5. 60. Goralczyk K. Effect of LLLT on endothelial cells culture / Goralczyk K., Szymanska J., Lukowicz M., Drela E., Kotzbach R., Dubiel M., Michalska M., Goralczyk B., Zajac A., Rosc D. // Lasers Med Sci. - 2015. - Т. 30, № 1. - C. 273278. 61. Lan C. C. Low-energy helium-neon laser induces melanocyte proliferation via interaction with type IV collagen: visible light as a therapeutic option for vitiligo / Lan C.C., Wu C.S., Chiou M.H., Chiang T.Y., Yu H.S. // Br J Dermatol. - 2009. Т. 161, № 2. - C. 273-80. 62. Liao X. Helium-neon laser irradiation promotes the proliferation and migration of human epidermal stem cells in vitro: proposed mechanism for enhanced wound re-epithelialization / Liao X., Xie G.H., Liu H.W., Cheng B., Li S.H., Xie S., Xiao L.L., Fu X.B. // Photomed Laser Surg. - 2014. - Т. 32, № 4. - C. 219-25. 63. Mafra de Lima F. Low intensity laser therapy (LILT) in vivo acts on the neutrophils recruitment and chemokines/cytokines levels in a model of acute pulmonary inflammation induced by aerosol of lipopolysaccharide from Escherichia coli in rat / Mafra de Lima F., Villaverde A.B., Salgado M.A., 351 Castro-Faria-Neto H.C., Munin E., Albertini R., Aimbire F. // J Photochem Photobiol B. - 2010. - Т. 101, № 3. - C. 271-8. 64. Yang W.Z. Effects of low power laser irradiation on intracellular calcium and histamine release in RBL-2H3 mast cells / Yang W.Z., Chen J.Y., Yu J.T., Zhou L.W. // Photochem Photobiol. - 2007. - Т. 83, № 4. - C. 979-84. 65. Lavi R. Low energy visible light induces reactive oxygen species generation and stimulates an increase of intracellular calcium concentration in cardiac cells / Lavi R., Shainberg A., Friedmann H., Shneyvays V., Rickover O., Eichler M., Kaplan D., Lubart R. // J Biol Chem. - 2003. - Т. 278, № 42. - C. 40917-22. 66. Ankri R. Visible light induces nitric oxide (NO) formation in sperm and endothelial cells / Ankri R., Friedman H., Savion N., Kotev-Emeth S., Breitbart H., Lubart R. // Lasers Surg Med. - 2010. - Т. 42, № 4. - C. 348-52. 67. Клебанов Г.И. Влияние перекисного окисления липидов на структуру и функционирование мембран и липопротеидов: дис.... докт. биол. наук: 03.00.02 / Клебанов Геннадий Иосифович. - М., 1991. - 267 c. 68. Клебанов Г.И. Клеточные механизмы прайминга и активации фагоцитов / Клебанов Г.И., Владимиров Ю.А. // Усп. совр. биол. - 1999. - Т. 119, № 5. - C. 462 - 475. 69. Uhing R.J. Molecular events in the activation of murine macrophages / Uhing R.J., Adams D.O. // Agents Actions. - 1989. - Т. 26, № 1-2. - C. 9-14. 70. Sheppard F.R. Structural organization of the neutrophil NADPH oxidase: phosphorylation and translocation during priming and activation / Sheppard F.R., Kelher M.R., Moore E.E., McLaughlin N.J., Banerjee A., Silliman C.C. // J Leukoc Biol. - 2005. - Т. 78, № 5. - C. 1025-42. 71. Oldham K. T. The role of oxygen radicals in immune complex injury / Oldham K.T., Guice K.S., Ward P.A., Johnson K.J. // Free Radic Biol Med. - 1988. - Т. 4, № 6. - C. 387-97. 72. McPhail L.C. The NADPH oxidase of human polymorphonuclear leukocytes. Evidence for regulation by multiple signals / McPhail L.C., Clayton C.C., Snyderman R. // J Biol Chem. - 1984. - Т. 259, № 9. - C. 5768-75. 352 73. Warren J. S. Macrophage-derived cytokines amplify immune complex-triggered O2-. responses by rat alveolar macrophages / Warren J.S., Kunkel S.L., Cunningham T.W., Johnson K.J., Ward P.A. // Am J Pathol. - 1988. - Т. 130, № 3. - C. 489-95. 74. Charo I. F. Chemotactic peptides modulate adherence of human polymorphonuclear leukocytes to monolayers of cultured endothelial cells / Charo I.F., Yuen C., Perez H.D., Goldstein I.M. // J Immunol. - 1986. - Т. 136, № 9. - C. 3412-9. 75. Woodman R. C. Evidence that de novo protein synthesis participates in a timedependent augmentation of the chemotactic peptide-induced respiratory burst in neutrophils. Effects of recombinant human colony stimulating factors and dihydrocytochalasin B / Woodman R.C., Curnutte J.T., Babior B.M. // Free Radic Biol Med. - 1988. - Т. 5, № 5-6. - C. 355-61. 76. McPhail L.C. Mechanisms of regulating the respiratory burst in leukocytes / McPhail L.C., Snyderman R. // Contemp Top Immunobiol. - 1984. - Т. 14. - C. 247-81. 77. Koval’chuk L. V. Priming of phagocytes by cytokines and water-soluble products of lipid peroxidation / Koval’chuk L.V., Klebanov G.I., Ribarov S.R., Kreinina M.V., Aptsiauri N.E., Gankowskaya L.W., Karaseva M.V., Shuikina E.E., Vladimirov Y.A. // Biomed. Sci. - 1991. - № 2. - C. 221 - 231. 78. Finkel T. H. Priming of neutrophils and macrophages for enhanced release of superoxide anion by the calcium ionophore ionomycin. Implications for regulation of the respiratory burst / Finkel T.H., Pabst M.J., Suzuki H., Guthrie L.A., Forehand J.R., Phillips W.A., Johnston R.B., Jr. // J Biol Chem. - 1987. - Т. 262, № 26. - C. 12589-96. 79. Yao Y. Neutrophil priming occurs in a sequential manner and can be visualized in living animals by monitoring IL-1beta promoter activation / Yao Y., Matsushima H., Ohtola J.A., Geng S., Lu R., Takashima A. // J Immunol. - 2015. - Т. 194, № 3. - C. 1211-24. 353 80. Islam M.A. Alveolar macrophage phagocytic activity is enhanced with LPS priming, and combined stimulation of LPS and lipoteichoic acid synergistically induce pro-inflammatory cytokines in pigs / Islam M.A., Proll M., Holker M., Tholen E., Tesfaye D., Looft C., Schellander K., Cinar M.U. // Innate Immun. 2013. - Т. 19, № 6. - C. 631-43. 81. Liao C. S. Cryptic receptors for chemotactic peptides in rabbit neutrophils / Liao C.S., Freer R.J. // Biochem Biophys Res Commun. - 1980. - Т. 93, № 2. - C. 56671. 82. Melloni E. The calpains / Melloni E., Pontremoli S. // Trends Neurosci. - 1989. Т. 12, № 11. - C. 438-44. 83. Pietrobon D. Structural and functional aspects of calcium homeostasis in eukaryotic cells / Pietrobon D., Di Virgilio F., Pozzan T. // Eur J Biochem. - 1990. - Т. 193, № 3. - C. 599-622. 84. Westwick J. Mechanisms of calcium homeostasis in the polymorphonuclear leucocyte / Westwick J., Poll C. // Agents Actions. - 1986. - Т. 19, № 1-2. - C. 80-6. 85. Makni-Maalej K. TLR8, but not TLR7, induces the priming of the NADPH oxidase activation in human neutrophils / Makni-Maalej K., Marzaioli V., Boussetta T., Belambri S.A., Gougerot-Pocidalo M.A., Hurtado-Nedelec M., Dang P.M., El-Benna J. // J Leukoc Biol. - 2015. - Т. 97, № 6. - C. 1081 - 1087. 86. Владимиров Ю.А. Биофизика / Владимиров Ю.А., Рощупкин Д.И., Потапенко А.Я., Деев А.И. - М.: Медицина, 1983. - 273 c. 87. Шубин М.В. Изучение влияния перекисного окисления липидов на проницаемость мембран липосом для ионов Са++ / Шубин М.В., Поглазов А.Ф., Скоцеляс Ю.А., Владимиров Ю.А. // Биофизика. - 1975. - Т. 20, № 1. C. 161 - 163. 88. Владимиров Ю.А. Свободные радикалы в живых системах / Владимиров Ю.А., Азизова О.А., Деев А.И., Козлов А.В., А.Н. О., Рощупкин Д.И. - Т. 29. - М.: Итоги науки и техники ВИНИТИ АН СССР: Сер. Биофизика, 1991. 252 c. 354 89. Vladimirov Y. A. Effect of oxidized phospholipids on the chemiluminescence of zymosan-activated leukocytes / Vladimirov Y.A., Ribarov S.R., Bochev P.G., Benov L.C., Klebanov G.I. // Gen Physiol Biophys. - 1990. - Т. 9, № 1. - C. 4554. 90. Klebanov G. I. Effects of endogenous photosensitizers on the laser-induced priming of leucocytes / Klebanov G.I., Strashkevich I.A., Chichuk T.V., Modestova T.M., Vladimirov Y.A. // Membr Cell Biol. - 1998. - Т. 12, № 3. - C. 339-354. 91. Kushibiki T. Blue laser irradiation generates intracellular reactive oxygen species in various types of cells / Kushibiki T., Hirasawa T., Okawa S., Ishihara M. // Photomed Laser Surg. - 2013. - Т. 31, № 3. - C. 95-104. 92. Carlos F. P. Protective effect of low-level laser therapy (LLLT) on acute zymosan-induced arthritis / Carlos F.P., de Paula Alves da Silva M., de Lemos Vasconcelos Silva Melo E., Costa M.S., Zamuner S.R. // Lasers Med Sci. - 2014. - Т. 29, № 2. - C. 757-63. 93. Souza N.H.C. Effect of low-level laser therapy on the modulation of the mitochondrial activity of macrophages / Souza N.H.C., Ferrari R.A.M., Silva D.F.T., Nunes F.D., Bussadori S.K., Fernandes K.P.S. // Brazilian Journal of Physical Therapy. - 2014. - Т. 18, № 4. - C. 308-314. 94. Новоселова Е.Г. Действие низкоинтенсивного лазерного излучения (632,8 нм) на изолированные клетки иммунной системы мышей / Новоселова Е.Г., Черенков Д.А., Глушкова О.В., Новоселова Т.В., Чудновский В.М. , Юсупов В.И., Фесенко Е.Е. // Биофизика. - 2006. - Т. 51, № 3. - C. 509 - 518. 95. Alves A.N. Effects of low-level laser therapy on skeletal muscle repair: a systematic review / Alves A.N., Fernandes K.P., Deana A.M., Bussadori S.K., Mesquita-Ferrari R.A. // Am J Phys Med Rehabil. - 2014. - Т. 93, № 12. - C. 1073-85. 96. Kilik R. Effect of equal daily doses achieved by different power densities of lowlevel laser therapy at 635 nm on open skin wound healing in normal and diabetic rats / Kilik R., Lakyova L., Sabo J., Kruzliak P., Lacjakova K., Vasilenko T., 355 Vidova M., Longauer F., Radonak J. // Biomed Res Int. - 2014. - Т. 2014. - C. 269253. 97. Ekizer A. Light-emitting diode photobiomodulation: effect on bone formation in orthopedically expanded suture in rats--early bone changes / Ekizer A., Uysal T., Guray E., Yuksel Y. // Lasers Med Sci. - 2013. - Т. 28, № 5. - C. 1263-70. 98. Adamskaya N. Light therapy by blue LED improves wound healing in an excision model in rats / Adamskaya N., Dungel P., Mittermayr R., Hartinger J., Feichtinger G., Wassermann K., Redl H., van Griensven M. // Injury. - 2011. - Т. 42, № 9. - C. 917-21. 99. Andrade Fdo S. Effects of low-level laser therapy on wound healing / Andrade Fdo S., Clark R.M., Ferreira M.L. // Rev Col Bras Cir. - 2014. - Т. 41, № 2. - C. 129-133. 100. Avni D. Protection of skeletal muscles from ischemic injury: low-level laser therapy increases antioxidant activity / Avni D., Levkovitz S., Maltz L., Oron U. // Photomed laser Surg. - 2005. - Т. 23, № 3. - C. 273-7. 101. Bayat M. Low-level laser therapy improves early healing of medial collateral ligament injuries in rats / Bayat M., Delbari A., Almaseyeh M.A., Sadeghi Y., Bayat M., Reziae F. // Photomed laser Surg. - 2005. - Т. 23, № 6. - C. 556-60. 102. Byrnes K.R. Photobiomodulation improves cutaneous wound healing in an animal model of type II diabetes / Byrnes K. R., Barna L., Chenault V. M., Waynant R. W., Ilev I. K., Longo L., Miracco C., Johnson B., Anders J. J. // Photomed Laser Surg. - 2004. - Т. 22, № 4. - C. 281-90. 103. Chaves M.E. Effects of low-power light therapy on wound healing: LASER x LED / Chaves M.E., Araújo A.R., Piancastelli A.C.C., Pinotti M. // Anais Brasileiros de Dermatologia. - 2014. - Т. 89, № 4. - C. 616-623. 104. de Araujo C. E. Ultrastructural and autoradiographical analysis show a faster skin repair in He-Ne laser-treated wounds / de Araujo C.E., Ribeiro M.S., Favaro R., Zezell D.M., Zorn T.M. // J Photochem Photobiol B. - 2007. - Т. 86, № 2. - C. 87-96. 356 105. Dungel P. Low level light therapy by LED of different wavelength induces angiogenesis and improves ischemic wound healing / Dungel P., Hartinger J., Chaudary S., Slezak P., Hofmann A., Hausner T., Strassl M., Wintner E., Redl H., Mittermayr R. // Lasers Surg Med. - 2014. - Т. 46, № 10. - C. 773-80. 106. Fung D.T. Effects of a therapeutic laser on the ultrastructural morphology of repairing medial collateral ligament in a rat model / Fung D. T., Ng G. Y., Leung M. C., Tay D. K. // Lasers Surg Med. - 2003. - Т. 32, № 4. - C. 286-93. 107. Fushimi T. Green light emitting diodes accelerate wound healing: characterization of the effect and its molecular basis in vitro and in vivo / Fushimi T., Inui S., Nakajima T., Ogasawara M., Hosokawa K., Itami S. // Wound Repair Regen. - 2012. - Т. 20, № 2. - C. 226-35. 108. Guzzardella G.A. Laser stimulation on bone defect healing: an in vitro study / Guzzardella G. A., Fini M., Torricelli P., Giavaresi G., Giardino R. // Lasers Med Sci. - 2002. - Т. 17, № 3. - C. 216-220. 109. Lavi R. The plasma membrane is involved in the visible light-tissue interaction / Lavi R., Ankri R., Sinyakov M., Eichler M., Friedmann H., Shainberg A., Breitbart H., Lubart R. // Photomed Laser Surg. - 2012. - Т. 30, № 1. - C. 14-9. 110. Mileva M. Effect of He-Ne laser treatment on the level of lipid peroxidation products in experimental cataract of rabbit eyes / Mileva M., Zlateva G., Karabasheva S., Hadjimitova V., Antonov I. // Methods Find Exp Clin Pharmacol. - 2000. - Т. 22, № 9. - C. 679-681. 111. Малиновская С.Л. Оценка биологического действия низкоинтенсивного электромагнитного излучения на миокард при экспериментальной ишемии / Малиновская С.Л., Баврина А.П., Соловьева Т.И., Рахчеева М.В., Яковлева Е.И., Монич В.А. // Современные технологии в медицине. - 2015. - Т. 7, № 2. - C. 49 - 54. 112. Глухов А.А. Основы ухода за хирургическими больными / Глухов А.А., Андреев А.А., Болотских В.И., Боев С.Н. - М.: ГЭОТАР-Медиа, 2008. - 288 c. 357 113. Булынин В.И. Лечение ран / Булынин В.И., Глухов А.А., Мошуров И.П. Воронеж: Изд-во Воронежского государственного университета, 1998. 248 c. 114. Кузин М.И. Раны и раневая инфекция / Кузин М.И., Костюченок Б.М. - М.: Медицина, 1990. - 552 c. 115. Чернух А.М. Воспаление (Очерки патологии и экспериментальной терапии) / Чернух А.М. - М.: Медицина, 1979. - 448 c. 116. Shukla A. Depletion of reduced glutathione, ascorbic acid, vitamin E and antioxidant defence enzymes in a healing cutaneous wound / Shukla A., Rasik A.M., Patnaik G.K. // Free Radic Res. - 1997. - Т. 26, № 2. - C. 93-101. 117. Mester E. The biomedical effects of laser application / Mester E., Mester A.F., Mester A. // Lasers Surg Med. - 1985. - Т. 5, № 1. - C. 31-39. 118. Jongsma F.H. Is closure of open skin wounds in rats accelerated by argon laser exposure? / Jongsma F.H., vd Bogaard A.E., van Gemert M.J., Hulsbergen Henning J.P. // Lasers Surg Med. - 1983. - Т. 3, № 1. - C. 75-80. 119. McCaughan J.S. Jr. Effect of low-dose argon irradiation on rate of wound closure / McCaughan J.S., Jr., Bethel B.H., Johnston T., Janssen W. // Lasers Surg Med. 1985. - Т. 5, № 6. - C. 607-614. 120. Pereira M.C. Influence of 670 nm low-level laser therapy on mast cells and vascular response of cutaneous injuries / Pereira M.C., de Pinho C.B., Medrado A.R., Andrade Zde A., Reis S.R. // J Photochem Photobiol B. - 2010. - Т. 98, № 3. - C. 188-92. 121. Silveira P.C. Effects of low-power laser irradiation (LPLI) at different wavelengths and doses on oxidative stress and fibrogenesis parameters in an animal model of wound healing / Silveira P.C., Silva L.A., Freitas T.P., Latini A., Pinho R.A. // Lasers Med Sci. - 2011. - Т. 26, № 1. - C. 125-31. 122. Ribeiro M. S. Effects of low-intensity polarized visible laser radiation on skin burns: a light microscopy study / Ribeiro M. S., Da Silva Dde F., De Araujo C. E., De Oliveira S. F., Pelegrini C. M., Zorn T. M., Zezell D. M. // J Clin Laser Med Surg. - 2004. - Т. 22, № 1. - C. 59-66. 358 123. Габуева А.А. Влияние низкоинтенсивного лазерного облучения крови на уровень лактоферрина у больных внебольничной пневмонией / Габуева А.А., Бурдули Н.М. // Вопросы курортологии, физиотерапии и лечебной физической культуры. - 2015. - Т. 2. - C. 9 - 11. 124. Ferraresi C. Light-emitting diode therapy in exercise-trained mice increases muscle performance, cytochrome c oxidase activity, ATP and cell proliferation / Ferraresi C., Parizotto N.A., Pires de Sousa M.V., Kaippert B., Huang Y.Y., Koiso T., Bagnato V.S., Hamblin M.R. // J Biophotonics. - 2015. - Т. 8, № 9. - C. 740-54. 125. Притыко Д.А. Лазерная терапия в детской хирургии / Притыко Д.А., Бурков И.В. // Детская хирургия. - 2014. - Т. 18, № 2. - C. 39 - 42. 126. Аскаров К.А. Порфирины: спектроскопия, электрохимия, применение / Аскаров К.А., Березин Б.Д., Быстрицкая Е.В., Голубчиков О.А., Койфман О.И., Кузьмицкий В.А., Майрановский В.Г., Пономарев Г.В., Риш М.А., Смирнов Б.Р., Соловьев К.Н., Цвирко М.П., Ярцев Е.И. - М.: Наука, 1987. 384 c. 127. Кулова Л.А. Влияние внутривенной лазерной терапии на функцию эндотелия и состояние микроциркуляции у больных ревматоидным артритом / Кулова Л.А., Бурдули Н.М. // Вопросы курортологии, физиотерапии и лечебной физической культуры. - 2014. - Т. 3. - C. 9 - 12. 128. Шахова А.С. Внутривенное лазерное облучение крови в комплексном лечении псориаза / Шахова А.С., Куликов А.Г., Корсунская И.М. // Вопросы курортологии, физиотерапии и лечебной физической культуры. - 2012. - № 1. - C. 24 - 28. 129. Волотовская А.В. Антиоксидантное действие и терапевтическая эффективность лазерного облучения крови у больных ишемической болезнью сердца / Волотовская А.В., Улащик В.С., Филипович В.Н. // Вопр Курортол Физиотер Леч Физ Культ. - 2003. - № 3. - C. 22-5. 130. Leal Junior E. C. Effect of 655-nm low-level laser therapy on exercise-induced skeletal muscle fatigue in humans / Leal Junior E.C., Lopes-Martins R.A., Dalan 359 F., Ferrari M., Sbabo F.M., Generosi R.A., Baroni B.M., Penna S.C., Iversen V.V., Bjordal J.M. // Photomed Laser Surg. - 2008. - Т. 26, № 5. - C. 419-24. 131. Пономарев И.В. Применение лазерного излучения в косметологии и офтальмологии / Пономарев И.В. - М., 1994. - 57 c. 132. Пальчун В.Т. Применение лазеров в отоларингологии / Пальчун В.Т., Лапченко А.С., Кучеров А.Г. // Лечебное дело. - 2005. - № 2. - C. 20-23. 133. Nadur-Andrade N. Photobiostimulation reduces edema formation induced in mice by Lys-49 phospholipases A2 isolated from Bothrops moojeni venom / NadurAndrade N., Dale C.S., Santos A.S., Soares A.M., de Lima C.J., Zamuner S.R. // Photochem Photobiol Sci. - 2014. - Т. 13, № 11. - C. 1561-7. 134. Nishioka M.A. LED (660 nm) and laser (670 nm) use on skin flap viability: angiogenesis and mast cells on transition line / Nishioka M.A., Pinfildi C.E., Sheliga T.R., Arias V.E., Gomes H.C., Ferreira L.M. // Lasers Med Sci. - 2012. Т. 27, № 5. - C. 1045-50. 135. Sutalangka C. Laser acupuncture improves memory impairment in an animal model of Alzheimer's disease / Sutalangka C., Wattanathorn J., Muchimapura S., Thukham-Mee W., Wannanon P., Tong-un T. // J Acupunct Meridian Stud. 2013. - Т. 6, № 5. - C. 247-51. 136. Патент. RU 2262106, МПК G 01 N 33/52. Способ подбора индивидуального курса лазеротерапии для детей / Воинова В.М., Амбарцумян Р.В., Улас В.Ю., Степина Н.Д., Юрьева Э.А., Новиков П.В. // Московский научноисследовательский институт педиатрии и детской хирургии Министерства здравоохранения Российской Федерации. - Заявл. 27.06.2003. Опубл. 10.10.2005. - Бюл. № 28. 137. Guerra Fda R. LLLT improves tendon healing through increase of MMP activity and collagen synthesis / Guerra Fda R., Vieira C.P., Almeida M.S., Oliveira L.P., de Aro A.A., Pimentel E.R. // Lasers Med Sci. - 2013. - Т. 28, № 5. - C. 1281-8. 138. Pinfildi C.E. What is better in TRAM flap survival: LLLT single or multiirradiation? / Pinfildi C.E., Hochman B.S., Nishioka M.A., Sheliga T.R., Neves 360 M.A., Liebano R.E., Ferreira L.M. // Lasers Med Sci. - 2013. - Т. 28, № 3. - C. 755-61. 139. Барбараш О.Л. Стресс-модулирующие эффекты лазеротерапии у больных ишемической болезнью сердца / Барбараш О.Л., Марцияш А.А., Шейбак Т.В., Чукаева И.И., Корочкин И.М., Сырнев В.В. // Тер. архив. - 1996. - № 12. - C. 50 - 53. 140. Зверева К.В. Отрицательные эффекты низкоинтенсивной лазерной терапии при ревматоидном артрите / Зверева К.В., Грунина Е.А. // Тер. архив. - 1996. - № 5. - C. 22 - 24. 141. Litscher D. Yellow laser acupuncture - A new option for prevention and early intervention of lifestyle-related diseases: A randomized, placebo-controlled trial in volunteers / Litscher D., Wang G., Gaischek I., Wang L., Wallner-Liebmann S., Petek E. // Laser Ther. - 2015. - Т. 24, № 1. - C. 53-61. 142. Quah-Smith I. The Antidepressant Effect of Laser Acupuncture: A Comparison of the Resting Brain's Default Mode Network in Healthy and Depressed Subjects During Functional Magnetic Resonance Imaging / Quah-Smith I., Suo C., Williams M.A., Sachdev P.S. // Med Acupunct. - 2013. - Т. 25, № 2. - C. 124133. 143. Hinman R. S. Acupuncture for chronic knee pain: a randomized clinical trial / Hinman R.S., McCrory P., Pirotta M., Relf I., Forbes A., Crossley K.M., Williamson E., Kyriakides M., Novy K., Metcalf B.R., Harris A., Reddy P., Conaghan P.G., Bennell K.L. // JAMA. - 2014. - Т. 312, № 13. - C. 1313-22. 144. He W. Effectiveness of Interstitial Laser Acupuncture Depends upon Dosage: Experimental Results from Electrocardiographic and Electrocorticographic Recordings [Электронный ресурс] / He W., Litscher G., Jing X.-H., Shi H., Wang X.-Y., Gaischek I., Su Y.-S., Litscher D., Yang Z.-K., Xin J.-J., Ling Hu L. // Evidence-Based Complementary and Alternative Medicine. - 2013. - 4 c.Режим доступа: URL: http://dx.doi.org/10.1155/2013/934783 (дата обращения: 31.10.2015). DOI: 10.1155/2013/934783. 361 145. Мазуркевич Г.С. Шок: теория, клиника, организация противошоковой защиты / Мазуркевич Г.С., Багненко С.Ф. - Санкт-Петербург: Политехника, 2004. - 539 c. 146. Афанасьева Г.А. О патогенетической взаимосвязи недостаточности антирадикальной защиты эритроцитов и нарушений реологических свойств крови при бактериальном эндотоксикозе / Афанасьева Г.А., Чеснокова Н.П., Кутырев В.В. // Проблемы особо опасных инфекций. - 2009. - Т. 2, № 100. C. 53 - 56. 147. Altavilla D. Inhibition of nuclear factor-kappaB activation by IRFI 042, protects against endotoxin-induced shock / Altavilla D., Squadrito G., Minutoli L., Deodato B., Bova A., Sardella A., Seminara P., Passaniti M., Urna G., Venuti S.F., Caputi A.P., Squadrito F. // Cardiovasc Res. - 2002. - Т. 54, № 3. - C. 68493. 148. Z. Qiu. Inhibition of neutrophil collagenase/MMP-8 and gelatinase B/MMP-9 and protection against endotoxin shock / Qiu Z., Chen J., Xu H., Van den Steen P.E., Opdenakker G., Wang M., Hu J. // J Immunol Res. - 2014. - Т. 2014. - C. 747426. 149. Nakamura A. Increased susceptibility to LPS-induced endotoxin shock in secretory leukoprotease inhibitor (SLPI)-deficient mice / Nakamura A., Mori Y., Hagiwara K., Suzuki T., Sakakibara T., Kikuchi T., Igarashi T., Ebina M., Abe T., Miyazaki J., Takai T., Nukiwa T. // J Exp Med. - 2003. - Т. 197, № 5. - C. 669-74. 150. Demarco V.G. Alpha-lipoic acid inhibits endotoxin-stimulated expression of iNOS and nitric oxide independent of the heat shock response in RAW 264.7 cells / Demarco V.G., Scumpia P.O., Bosanquet J.P., Skimming J.W. // Free Radic Res. - 2004. - Т. 38, № 7. - C. 675-82. 151. Middelveld R.J. Endotoxin-induced shock in the pig--limited effects of low and high concentrations of inhaled nitric oxide / Middelveld R.J., Alving K. // Acta Physiol Scand. - 2003. - Т. 179, № 2. - C. 203-11. 152. Cuzzocrea S. A role for nitric oxide-mediated peroxynitrite formation in a model of endotoxin-induced shock / Cuzzocrea S., Mazzon E., Di Paola R., Esposito E., 362 Macarthur H., Matuschak G.M., Salvemini D. // J Pharmacol Exp Ther. - 2006. Т. 319, № 1. - C. 73-81. 153. Suga H. Reinforcement therapy using nitric oxide synthase inhibitors against endotoxin shock in dogs / Suga H., Nakagawa T., Soga Y., Deguchi Y., Suzuki T., Miyoshi N., Imamura Y., Fukuda M. // Surg Today. - 2006. - Т. 36, № 9. - C. 811-7. 154. Doursout M.F. Distribution of NOS isoforms in a porcine endotoxin shock model / Doursout M.F., Oguchi T., Fischer U.M., Liang Y., Chelly B., Hartley C.J., Chelly J.E. // Shock. - 2008. - Т. 29, № 6. - C. 692-702. 155. Liu L.L. Baicalin inhibits macrophage activation by lipopolysaccharide and protects mice from endotoxin shock / Liu L.L., Gong L.K., Wang H., Xiao Y., Wu X.F., Zhang Y.H., Xue X., Qi X.M., Ren J. // Biochem Pharmacol. - 2008. Т. 75, № 4. - C. 914-22. 156. Karima R. The molecular pathogenesis of endotoxic shock and organ failure / Karima R., Matsumoto S., Higashi H., Matsushima K. // Mol Med Today. - 1999. - Т. 5, № 3. - C. 123-32. 157. Kojika M. Endotoxin adsorption therapy for septic shock using polymyxin Bimmobilized fibers (PMX): evaluation by high-sensitivity endotoxin assay and measurement of the cytokine production capacity / Kojika M., Sato N., Yaegashi Y., Suzuki Y., Suzuki K., Nakae H., Endo S. // Ther Apher Dial. - 2006. - Т. 10, № 1. - C. 12-8. 158. Taniguchi T. Effects of post-treatment with direct hemoperfusion using a CTR column on mortality and inflammatory responses to endotoxin-induced shock in rats / Taniguchi T., Takemoto Y., Tsuda K., Inaba H., Yamamoto K. // Blood Purif. - 2006. - Т. 24, № 5-6. - C. 460-4. 159. Tsuda K. Effects of extracorporeal treatment with Lixelle on the mortality and inflammatory responses to endotoxin-induced shock in rats / Tsuda K., Taniguchi T. // Ther Apher Dial. - 2006. - Т. 10, № 1. - C. 49-53. 160. Nakazawa H. Successful management using combination therapy of endotoxin absorption therapy (PMX) and continuous hemodiafiltration (CVVHDF) of a 363 critically ill burn patient suffering from methicillin-resistant Staphylococcus aureus toxic shock syndrome / Nakazawa H., Nozaki M., Shimoda K., Kikuchi Y., Honda T., Isago T. // Burns. - 2008. - Т. 34, № 2. - C. 288-91. 161. Ронко К. Эндотоксемия и эндотоксический шок. Патогенез, диагностика и лечение. (Российское издание книги "Endotoxemia and endotoxin shock: disease, diagnosis, and therapy" Editors: Claudio Ronco, Pasquale Piccinni, Mitchell H. Rosner. Italy 2010). / Ронко К. // "Научный вклад в нефрологию", Вып. 167 - Ред. К. Ронко, П. Пиччинни, and М.Г. Рознер. - М.: Балабанов И.В., 2012. - С. 130. 162. Гальчиков Ю.И. Органная патология у лиц с хронической алкогольной интоксикацией / Гальчиков Ю.И. // Уральский медицинский журнал. - 2008. - № 14. - C. 94 - 98. 163. Schoeffel U. Inflammatory consequences of the translocation of bacteria and endotoxin to mesenteric lymph nodes / Schoeffel U., Pelz K., Haring R.U., Amberg R., Schandl R., Urbaschek R., von Specht B.U., Farthmann E.H. // Am J Surg. - 2000. - Т. 180, № 1. - C. 65-72. 164. Liu A.H. Endotoxin: friend or foe? / Liu A.H., Redmon A.H., Jr. // Allergy Asthma Proc. - 2001. - Т. 22, № 6. - C. 337-40. 165. Lepper P.M. Clinical implications of antibiotic-induced endotoxin release in septic shock / Lepper P.M., Held T.K., Schneider E.M., Bolke E., Gerlach H., Trautmann M. // Intensive Care Med. - 2002. - Т. 28, № 7. - C. 824-33. 166. Dholakia S. Endotoxemia in pediatric critical illness--a pilot study / Dholakia S., Inwald D., Betts H., Nadel S. // Crit Care. - 2011. - Т. 15, № 3. - C. R141. 167. Маркина А.А. Комплексное экспериментальное моделирование шоковых состояний / Маркина А.А. // Иммунология. - 2012. - Т. 33, № 5. - C. 250 - 254. 168. Макарова О.В. Морфофункциональные изменения иммунной системы мышей BALB/c и C57BL/6 при хроническом бактериальном грамотрицательном эндотоксикозе / Макарова О.В., Диатроптов М.Е., Серебряков С.Н., Малайцев В.В., Богданова И.М. // Архив патологии. - 2012. - № 3. - C. 43 - 48. 364 169. Бондаренко В.М. Диагностика, лечение и профилактика эндотоксинемии / Бондаренко В.М., Лиходед В.Г. // Лечение и профилактика. - 2012. - Т. 2, № 3. - C. 70 - 76. 170. Heumann D. CD14 and LBP in endotoxemia and infections caused by Gramnegative bacteria / Heumann D. // Journal of endotoxin research. - 2001. - Т. 7, № 6. - C. 439 - 441. 171. Mathison J.C. The clearance, tissue distribution, and cellular localization of intravenously injected lipopolysaccharide in rabbits.//Journal of immunology (Baltimore, Md. : 1950) / Mathison J.C., Ulevitch R.J. // - 1979. - Т. 123, № 5. C. 2133 - 2143. 172. Новоселова Е.Г. Защитный эффект низкоинтенсивного лазерного излучения в условиях острого токсического стресса / Новоселова Е.Г., Глушкова О.В., Хренов М.О., Черенков Д.А., Лунин С.М., Новоселова Т.В., Чудновский В.М., Юсупов В.И., Фесенко Е.Е. // Биофизика. - 2007. - Т. 52, № 1. - C. 137 140. 173. Barroso-Aranda J. Neutrophil activation, tumor necrosis factor, and survival after endotoxic and hemorrhagic shock / Barroso-Aranda J., Zweifach B.W., Mathison J.C., Schmid-Schonbein G.W. // J Cardiovasc Pharmacol. - 1995. - Т. 25 Suppl 2, №. - C. S23-9. 174. Бондаренко В.М. Молекулярные аспекты повреждающего действия бактериальных липополисахаридов / Бондаренко В.М., Рябиченко Е.В., Веткова Л.Г. // Журн. микробиол. - 2004. - № 3. - C. 98 - 105. 175. Osipov A.N. Biological activity of hemoprotein nitrosyl complexes / Osipov A.N., Borisenko G.G., Vladimirov Y.A. // Biochemistry (Mosc). - 2007. - Т. 72, № 13. - C. 1491-504. 176. Hunley T.E. Nitric oxide and endothelin in pathophysiological settings / Hunley T.E., Iwasaki S., Homma T., Kon V. // Pediatric nephrology (Berlin, Germany). 1995. - Т. 9, № 2. - C. 235-244. 365 177. Thomas D.D. Breathing new life into nitric oxide signaling: A brief overview of the interplay between oxygen and nitric oxide / Thomas D.D. // Redox Biol. 2015. - Т. 5. - C. 225-233. 178. Predonzani A. Spotlights on immunological effects of reactive nitrogen species: When inflammation says nitric oxide / Predonzani A., Cali B., Agnellini A.H., Molon B. // World J Exp Med. - 2015. - Т. 5, № 2. - C. 64-76. 179. Friebe A. Stimulation of soluble guanylate cyclase by superoxide dismutase is mediated by NO / Friebe A., Schultz G., Koesling D. // Biochem. J. - 1998. - Т. 335. - C. 527-531. 180. Lowenstein C.J. Nitric oxide: a physiologic messenger / Lowenstein C.J., Dinerman J.L., Snyder S.H. // Annals of internal medicine. - 1994. - Т. 120, № 3. - C. 227 - 237. 181. Moncada S. Nitric oxide: physiology, pathophysiology, and pharmacology / Moncada S., Palmer R.M., Higgs E.A. // Pharmacological reviews. - 1991. - Т. 43, № 2. - C. 109 - 142. 182. Fridovich I. Superoxide radical and superoxide dismutases / Fridovich I. // Annu Rev Biochem. - 1995. - Т. 64. - C. 97 - 112. 183. Ducrocq C. Peroxynitrite: an endogenous oxidizing and nitrating agent / Ducrocq C., Blanchard B., Pignatelli B., Ohshima H. // Cell. Mol. Life Sci. - 1999. - Т. 55. - C. 1068 - 1077. 184. Jourd'heuil D. Reaction of superoxide and nitric oxide with peroxynitrite. Implications for peroxynitrite-mediated oxidation reactions in vivo / Jourd'heuil D., Jourd'heuil F.L., Kutchukian P.S., Musah R.A., Wink D.A., Grisham M.B. // J Biol Chem. - 2001. - Т. 276, № 31. - C. 28799 - 28805. 185. Joe B. Studies on the inactivation of superoxide dismutase activity by nitric oxide from rat peritoneal macrophages / Joe B., Lokesh B.R. // Mol Cell Biochem. 1997. - Т. 168, № 1-2. - C. 87-93. 186. Максименко А.В. Лечебное и превентивное действие биферментного препарата супероксиддисмутаза-хондроитинсульфат-каталаза при эндотоксическом шоке / Максименко А.В., Ваваева А.В., Абрамов А.А., 366 Ваваев А.В., Лакомкин В.Л. // Технологии живых систем. - 2014. - Т. 11, № 2. - C. 35 - 43. 187. Lin Y.S. Effects of helium-neon laser on levels of stress protein and arthritic histopathology in experimental osteoarthritis.//American journal of physical medicine & rehabilitation / Lin Y.S., Huang M.H., Chai C.Y., Yang R.C. // Association of Academic Physiatrists. - 2004. - Т. 83, № 10. - C. 758 - 765. 188. Novoselova E.G. Effects of low-power laser radiation on mice immunity / Novoselova E.G., Glushkova O.V., Cherenkov D.A., Chudnovsky V.M., Fesenko E.E. // Photodermatol Photoimmunol Photomed. - 2006. - Т. 22, № 1. - C. 33-8. 189. Buravlev E.A. Effects of laser and LED radiation on mitochondrial respiration in experimental endotoxic shock / Buravlev E.A., Zhidkova T.V., Vladimirov Y.A., Osipov A.N. // Lasers Med Sci. - 2013. - Т. 28, № 3. - C. 785-90. 190. Borisenko G.G. Photochemical reactions of nitrosyl hemoglobin during exposure to low-power laser irradiation / Borisenko G.G., Osipov A.N., Kazarinov K.D., Vladimirov Yu A. // Biochemistry (Mosc). - 1997. - Т. 62, № 6. - C. 661-666. 191. Кожура В.Л. Влияние лазерной коррекции на гидратную оболочку биоструктур клеток миокарда и печени при массивной кровопотере / Кожура В.Л., Николаева С.С., Рощина А.А., Кирсанова А.К., Яковлева Л.В., Быков В.А., Новодержкина И.С., Ребров Л.Б., Паршина Е.Ю. // Общая реаниматология. - 2006. - Т. II, № 2. 192. Рощина А.А. Закономерности изменения различных форм воды в миокарде и печени крыс при кровопотере и в раннем постреанимационном периоде / Рощина А.А., Николаева С.С., Кожура В.Л., Быков В.А., Яковлева Л.В., Новодержкина И.С., Королева О.А., Ребров Л.Б., Паршина Е.Ю., Кирсанова А.К. // Биомедицинская химия. - 2003. - Т. 49, № 5. - C. 451 - 455. 193. Рощина А.А. Состояние воды и пол в тканях крыс при массивной кровопотере и облучении He-Ne-лазером / Рощина А.А., Николаева С.С., Кожура В.Л., Теселкин Ю.О., Бабенкова И.В., Яковлева Л.В., Быков В.А., Новодержкина И.С., Бесараб Д.А., Ребров Л.Б., Паршина Е.Ю., Кирсанова А.К. // Бюлл. эксп. биол. и мед. - 2003. - Т. 135, № 2. - C. 158 - 161. 367 194. Кожура В.Л. Механизмы органопротекторного действия низкоинтенсвиного лазерного излучения при массивной кровопотере и клинической смерти / Кожура В.Л., Таланцев К.В., Новодержкина И.С., Кирсанова А.К., Яковлева Л.В., Закс И.О., Теселкин Ю.О., Бабенкова И.В., Бастрикова Н.А., Чхон К.З. // Анестезиология и реаниматология. - 2000. - № 6. - C. 39 - 43. 195. Wu J. Y. Low-power laser irradiation suppresses inflammatory response of human adipose-derived stem cells by modulating intracellular cyclic AMP level and NF-kappaB activity / Wu J.Y., Chen C.H., Wang C.Z., Ho M.L., Yeh M.L., Wang Y.H. // PLoS One. - 2013. - Т. 8, № 1. - C. e54067. 196. Parry G.C. Role of cyclic AMP response element-binding protein in cyclic AMP inhibition of NF-kappaB-mediated transcription / Parry G.C., Mackman N. // J Immunol. - 1997. - Т. 159, № 11. - C. 5450-6. 197. Wang Y. Low-Level Laser Therapy Attenuates LPS-Induced Rats Mastitis by Inhibiting Polymorphonuclear Neutrophil Adhesion / Wang Y., He X., Hao D., Yu D., Liang J., Qu Y., Sun D., Yang B., Yang K., Wu R., Wang J. // Journal of Veterinary Medical Science. - 2014. - Т. 76, № 11. - C. 1443-1450. 198. Ромоданова Э.А. Влияние температуры на изменение спектральных свойств водных растворов триптофана, вызванное предобработкой воды лазерным излучением / Ромоданова Э.А., Дюбко Т.С., Рошаль А.Д., Тиманюк В.А. // Биофизика. - 2006. - Т. 51, № 3. - C. 409 - 412. 199. Ho M.W. Illuminating water and life: Emilio Del Giudice / Ho M.W. // Electromagn Biol Med. - 2015. - Т. 34, № 2. - C. 113 - 122. 200. Корпан М.И. Влияние низкоинтенсивного лазерного излучения на раствор сывороточного альбумина / Корпан М.И., Шуфрид О., Курик М.В., Чекман И.С., Фиалка-Мозер В. // Биомедицинская радиоэлектроника. - 2010. - № 5. C. 52 - 57. 201. Karu T.I. Absorption measurements of cell monolayers relevant to mechanisms of laser phototherapy: reduction or oxidation of cytochrome c oxidase under laser radiation at 632.8 nm / Karu T.I., Pyatibrat L.V., Kolyakov S.F., Afanasyeva N.I. // Photomed Laser Surg. - 2008. - Т. 26, № 6. - C. 593-9. 368 202. Haas A.F. Redox regulation of wound healing? NF-kappaB activation in cultured human keratinocytes upon wounding and the effect of low energy HeNe irradiation / Haas A.F., Wong J.W., Iwahashi C.K., Halliwell B., Cross C.E., Davis P.A. // Free Radic Biol Med. - 1998. - Т. 25, № 9. - C. 998-1005. 203. Рощупкин Д.И. Основы фотобиофизики / Рощупкин Д.И., Артюхов В.Г. Воронеж: ВГУ, 1997. - 116 c. 204. Karu T. I. Absorption measurements of a cell monolayer relevant to phototherapy: reduction of cytochrome c oxidase under near IR radiation / Karu T.I., Pyatibrat L.V., Kolyakov S.F., Afanasyeva N.I. // J Photochem Photobiol B. - 2005. - Т. 81, № 2. - C. 98-106. 205. Dyuba A.V. Reconstruction of Absolute Absorption Spectrum of Reduced Heme a in Cytochrome c Oxidase from Bovine Heart / Dyuba A.V., Vygodina T.V., Konstantinov A.A. // Biochemistry (Mosc). - 2013. - Т. 78, № 12. - C. 1358 1365. 206. Szundi I. Spectral Identification of Intermediates Generated during the Reaction of Dioxygen with the Wild-Type and EQ(I-286) Mutant of Rhodobacter sphaeroides Cytochrome c Oxidase / Szundi I., Funatogawa C., Cassano J., McDonald W., Ray J., Hiser C., Shelagh Ferguson-Miller S., Robert B. Gennis R.B., Einarsdóttir Ó. // Biochemistry. - 2012. - Т. 51, № 46. - C. 9302 - 9311. 207. Филатов И.А. Строение и свойства цитохромоксидазы / Филатов И.А., Кулиш М.А., Миронов А.Ф. // Биоорганическая химия. - 1988. - Т. 14, № 6. C. 725 - 745. 208. Lim W. Modulation of lipopolysaccharide-induced NF-kappaB signaling pathway by 635 nm irradiation via heat shock protein 27 in human gingival fibroblast cells / Lim W., Kim J., Kim S., Karna S., Won J., Jeon S.M., Kim S.Y., Choi Y., Choi H., Kim O. // Photochem Photobiol. - 2013. - Т. 89, № 1. - C. 199207. 209. Hoesel B. The complexity of NF-kappaB signaling in inflammation and cancer / Hoesel B., Schmid J.A. // Mol Cancer. - 2013. - Т. 12. - C. 86. 369 210. Непринцева Н.В. Определение белков теплового шока в моче и ткани почки, значение в оценке активности и прогрессирования хронического гломерулонефрита: дис.... канд. мед. наук: 14.01.29 / Непринцева Наталья Викторовна. - М., 2014. - 104 c. 211. Брусничкин А.В. Термолинзовое определение цитохрома c и его комплекса с NO / Брусничкин А.В., Марикуца А.В., Проскурнин М.А., Проскурнина Е.В., Осипов А.Н., Владимиров Ю.А. // Вестник Московского университета. Серия 2. Химия. - 2008. - Т. 49, № 6. - C. 409 - 414. 212. Buravlev E.A. Effects of low-level laser therapy on mitochondrial respiration and nitrosyl complex content / Buravlev E.A., Zhidkova T.V., Vladimirov Y.A., Osipov A.N. // Lasers Med Sci. - 2014. - Т. 29, № 6. - C. 1861-1866. 213. Mittermayr R. Blue laser light increases perfusion of a skin flap via release of nitric oxide from hemoglobin / Mittermayr R., Osipov A., Piskernik C., Haindl S., Dungel P., Weber C., Vladimirov Y.A., Redl H., Kozlov A.V. // Mol Med. - 2007. - Т. 13, № 1-2. - C. 22-9. 214. Buravlev E.A. Are the mitochondrial respiratory complexes blocked by NO the targets for the laser and LED therapy? / Buravlev E.A., Zhidkova T.V., Osipov A.N., Vladimirov Y.A. // Lasers Med Sci. - 2015. - Т. 30, № 1. - C. 173-80. 215. Горбатенкова Е.А. Красный свет гелий-неонового лазера реактивирует супероксиддисмутазу / Горбатенкова Е.А., Владимиров Ю.А., Парамонов Н.В., А. А.О. // Бюлл. эксп. биол. и мед. - 1989. - Т. 107, № 3. - C. 302-305. 216. Осипов А.Н. Активные формы кислорода и их роль в организме / Осипов А.Н., Азизова О.А., Владимиров Ю.А. // Усп. биол. химии. - 1990. - Т. 31. C. 180 - 208. 217. Jeeva J.S. Enzymatic antioxidants and its role in oral diseases / Jeeva J.S., Sunitha J., Ananthalakshmi R., Rajkumari S., Ramesh M., Krishnan R. // J Pharm Bioallied Sci. - 2015. - Т. 7, № Suppl 2. - C. S331-3. 218. Мачнева Т.В. Роль эндогенных порфиринов в эффектах низкоинтенсивного лазерного излучения красного диапазона на свободно-радикальные процессы в крови крыс при экспериментальном эндотоксическом шоке / 370 Мачнева Т.В., Буравлев Е.А., Булгакова Н.Н., Владимиров Ю.А., Осипов А.Н. // Биофизика. - 2011. - Т. 56, № 4. - C. 705-713. 219. Мачнева Т.В. Роль эндогенных порфиринов в лазерной терапии экспериментальных кожных ран / Мачнева Т.В., Булгакова Н.Н., Владимиров Ю.А., Осипов А.Н. // Биофизика. - 2010. - Т. 55, № 3. - C. 532538. 220. Горенков Р.В. Хроническая гипоксия как один из факторов повышенной флуоресценции эндогенных порфиринов в живых биологических тканях / Горенков Р.В., Карпов В.Н., Рогаткин Д.А., Шумский В.И. // Биофизика. 2007. - Т. 52, № 4. - C. 711-717. 221. Пеленицын А.Б. О механизме фотогемолиза эритроцитов / Пеленицын А.Б., Рощупкин Д.И., Владимиров Ю.А. // Физико-химические основы функционирования надмолекулярных структур клетки. - М-лы Всесоюзного симпозиума, М. 17 - 19 июня, 1974 г. - 1974. - № 2. - C. 59 - 61. 222. Foote C.S. Chemistry of singlet oxygen. X. Carotenoid quenching parallels biological protection / Foote C.S., Chang Y.C., Denny R.W. // J Am Chem Soc. 1970. - Т. 92, № 17. - C. 5216-8. 223. Foote C.S. Mechanisms of photosensitized oxidation. There are several different types of photosensitized oxidation which may be important in biological systems / Foote C.S. // Science. - 1968. - Т. 162, № 3857. - C. 963-70. 224. Непорент Б.С. Из истории физики. Александр Николаевич Теренин / Непорент Б.С. // Успехи физических наук. - 1969. - Т. 98, № 4. - C. 722 - 730. 225. Холмогоров В.Е. Работы теренинской школы в области фотобиофизики / Холмогоров В.Е. // Санкт-Петебургский университет. - 2001. - Т. 17, № 3571. - C. 22 - 25. 226. Красновский А.А. Фотохимические реакции хлорофилла и фталоцианинов / Теренин А.Н., Красновский А.А. // Вестник АН СССР. - 1949. -, № 8. - C. 65. 227. Красновский А.А. Каталитическое и фотосенсибилизированное окисление аскорбиновой кислоты на фталоцианинах / Красновский А.А., Брин Г.П. // Доклады Академии наук СССР. - 1946. - Т. 53, № 5. - C. 447 - 450. 371 228. Красновский А.А. Современные представления о фотосинтезе / Красновский А.А. // Успехи совр. биол. - 1946. - Т. 21, № 2. - C. 153-184. 229. Krasnovsky A. A. Jr. Photosensitization and quenching of singlet oxygen by pigments and lipids of photoreceptor cells of the retina / Krasnovsky A.A., Jr., Kagan V.E. // FEBS Lett. - 1979. - Т. 108, № 1. - C. 152-4. 230. Krasnovsky A. A. Jr. Photophysical studies of pheophorbide a and pheophytin a. Phosphorescence and photosensitized singlet oxygen luminescence / Krasnovsky A.A., Jr., Neverov K.V., Egorov S., Roeder B., Levald T. // J Photochem Photobiol B. - 1990. - Т. 5, № 2. - C. 245-54. 231. Венедиктов Е.А. Эффективность генерации люминесценции синглетного молекулярного кислорода порфиринами / Венедиктов Е.А., Красновский А.А. // Журнал прикладной спектроскопии. - 1982. - Т. 36, № 1. - C. 152 154. 232. Raab O. Über die Wirkung fluorescierender Stoffe auf Infusorien / Raab O. // Biol. - 1900. - № 39. - C. 524 - 529. 233. Bacellar I.O. Photodynamic Efficiency: From Molecular Photochemistry to Cell Death / Bacellar I.O., Tsubone T.M., Pavani C., Baptista M.S. // Int J Mol Sci. 2015. - Т. 16, № 9. - C. 20523-59. 234. Castano A.P. Mechanisms in photodynamic therapy: part one-photosensitizers, photochemistry and cellular localization / Castano A.P., Demidova T.N., Hamblin M.R. // Photodiagnosis Photodyn Ther. - 2004. - Т. 1, № 4. - C. 279 - 293. 235. Фут Х. Фотосенсибилизированное окисление и синглетный кислород. Биологические следствия. / Фут Х. // Свободные радикалы в биологии (в 2-х томах). - 1979. - Т. 2. - C. 96 -143. 236. Girotti A. W. Photosensitized oxidation of membrane lipids: reaction pathways, cytotoxic effects, and cytoprotective mechanisms / Girotti A.W. // J Photochem Photobiol B. - 2001. - Т. 63, № 1-3. - C. 103 - 113. 237. Мачнева Т.В. Изменение низкоинтенcивном лазеpном паpаметpов окcидативного облучении тканей в cтpеccа пpи пpиcутcтвии тетpапиppольныx фотоcенcибилизатоpов в уcловияx эндотокcичеcкого шока 372 / Мачнева Т.В., Лохматов А.В., Шевцова И.С., Ларкина Е.А., Ткачевская Е.П., Миронов А.Ф., Владимиров Ю.А., Осипов А.Н. // Биофизика. - 2012. Т. 57, № 2. - C. 274. 238. Клебанов Г.И. Влияние липофильных антиоксидантов на фотосенсибилизированную производными гематопорфирина пероксидацию липосомальных мембран при облучении гелий-неоновым лазером / Клебанов Г.И., Теселкин Ю.О., Бабенкова И.В., Жамбалова Б.А., Ванданмагсар Б., Нестерова О.А., Странадко Е.Ф. // Биологические мембраны. - 1996. - Т. 13, № 2. - C. 133 - 137. 239. Lopes D. Evaluation of the interplay among the charge of porphyrinic photosensitizers, lipid oxidation and photoinactivation efficiency in Escherichia coli / Lopes D., Melo T., Santos N., Rosa L., Alves E., Clara Gomes M., Cunha A., Neves M.G., Faustino M.A., Domingues M.R., Almeida A. // J Photochem Photobiol B. - 2014. - Т. 141. - C. 145-53. 240. Olchawa M.M. Zeaxanthin and alpha-tocopherol reduce the inhibitory effects of photodynamic stress on phagocytosis by ARPE-19 cells / Olchawa M.M., Herrnreiter A.M., Pilat A.K., Skumatz C.M., Niziolek-Kierecka M., Burke J.M., Sarna T.J. // Free Radic Biol Med. - 2015. - № 89. - C. 873 - 882. 241. Krasnovsky A.A. Photosensitized formation of singlet molecular oxygen in solutions of water-soluble porphyrins. Direct luminescence measurements / Krasnovsky A.A., Egorov S.Y., Nasarova O.V., Yartsev E.I., G.V. P. // Studia biophys. - 1988. - Т. 124, № 2-3. - C. 123 - 142. 242. Красновский А.А. мл. Фотогенерация синглетного кислорода водорастворимыми порфиринами / Красновский А.А.м., Егоров С.Ю., Назарова Н.В., Ярцев Е.И., Пономарев Г.В. // Биофизика. - 1987. - Т. 32, № 6. - C. 982 - 993. 243. Шумарина А.О. Фотодинамическое повреждение субклеточных структур дрожжей с индуцированным накоплением эндогенного протопорфирина IX / Шумарина А.О., Страховская М.Г., Туровецкий В.Б., АФрайкин Г.Я. // Микробиология. - 2003. - Т. 72, № 4. - C. 488 - 492. 373 244. Strakhovskaya M.G. Endogenous porphyrin accumulation and photosensitization in the yeast Saccharomyces cerevisiae in the presence of 2,2'-dipyridyl / Strakhovskaya M.G., Shumarina A.O., Fraikin G., Rubin A.B. // J Photochem Photobiol B. - 1999. - Т. 49, № 1. - C. 18-22. 245. Fraikin G.Ya. The role of membrane-bound porphyrin-type compound as endogenous sensitizer in photodynamic damage to yeast plasma membranes / Fraikin G.Y., Strakhovskaya M.G., Rubin A.B. // J Photochem Photobiol B. 1996. - Т. 34, № 2-3. - C. 129-35. 246. Lubart R. LLLT and PDT / Lubart R., Friedmann H. // Laser Ther. - 2011. - Т. 20, № 3. - C. 233. 247. Kushibiki T. Regulation of miRNA expression by low-level laser therapy (LLLT) and photodynamic therapy (PDT) / Kushibiki T., Hirasawa T., Okawa S., Ishihara M. // Int J Mol Sci. - 2013. - Т. 14, № 7. - C. 13542-58. 248. Freas W. Neurovascular effects of reactive oxygen intermediates produced by photoradiation / Freas W., Llave R., Hart J.L., Kobayashi Y., Nagel J., Muldoon S.M. // Neuropharmacology. - 1992. - Т. 31, № 8. - C. 809-15. 249. Lubart R. Effect of light on calcium transport in bull sperm cells / Lubart R., Friedmann H., Levinshal T., Lavie R., Breitbart H. // J Photochem Photobiol B. 1992. - Т. 15, № 4. - C. 337-41. 250. Lima F.M. Low-level laser therapy (LLLT) acts as cAMP-elevating agent in acute respiratory distress syndrome / de Lima F.M., Moreira L.M., Villaverde A.B., Albertini R., Castro-Faria-Neto H.C., Aimbire F. // Lasers Med Sci. - 2011. - Т. 26, № 3. - C. 389-400. 251. El Batanouny M. Mitogenic potential inducible by He:Ne laser in human lymphocytes in vitro / El Batanouny M., Korraa S., Fekry O. // J Photochem Photobiol B. - 2002. - Т. 68, № 1. - C. 1-7. 252. Sinyakov M.S. Chemiluminescent analysis of light-irradiated leukocytes as a diagnostic tool for fast identification of pathological states / Sinyakov M.S., Shlenskaya T.S., Belotsky S., Zhevelev H.M., Shainberg B., Lubart R., 374 Friedmann H., Avtalion R.R. // Photomed Laser Surg. - 2007. - Т. 25, № 4. - C. 257 - 263. 253. Ben-Hur E. Phthalocyanine-induced photodynamic changes of cytoplasmic free calcium in Chinese hamster cells / Ben-Hur E., Dubbelman T.M., Van Steveninck J. // Photochem Photobiol. - 1991. - Т. 54, № 2. - C. 163-6. 254. Freas W. Vascular interactions of calcium and reactive oxygen intermediates produced following photoradiation / Freas W., Hart J.L., Golightly D., McClure H., Rodgers D.R., Muldoon S.M. // J Cardiovasc Pharmacol. - 1991. - Т. 17, № 1. - C. 27-35. 255. Joshi P.G. Ca2+ influx induced by photodynamic action in human cerebral glioma (U-87 MG) cells: possible involvement of a calcium channel / Joshi P.G., Joshi K., Mishra S., Joshi N.B. // Photochem Photobiol. - 1994. - Т. 60, № 3. - C. 244 - 248. 256. Penning L.C. A role for the transient increase of cytoplasmic free calcium in cell rescue after photodynamic treatment / Penning L.C., Rasch M.H., Ben-Hur E., Dubbelman T.M., Havelaar A.C., Van der Zee J., Van Steveninck J. // Biochim Biophys Acta. - 1992. - Т. 1107, № 2. - C. 255-60. 257. Freas W. Contractile properties of isolated vascular smooth muscle after photoradiation / Freas W., Hart J.L., Golightly D., McClure H., Muldoon S.M. // Am J Physiol. - 1989. - Т. 256, № 3 Pt 2. - C. H655-64. 258. Klebanov G.I. Effect of low-intensity laser radiation on leukocyte function / Klebanov G.I., Teselkin Iu O., Babenkova I.V., Bashkueva T., Modestova T.M., Steklova L.S., Vladimirov Iu A. // Biull Eksp Biol Med. - 1997. - Т. 123, № 4. C. 341-343. 259. Reeves K. J. Is nitric oxide important in photodynamic therapy? / Reeves K.J., Reed M.W., Brown N.J. // J Photochem Photobiol B. - 2009. - Т. 95, № 3. - C. 141 - 147. 260. Castano A. P. Mechanisms in photodynamic therapy: Part three-Photosensitizer pharmacokinetics, biodistribution, tumor localization and modes of tumor 375 destruction / Castano A.P., Demidova T.N., Hamblin M.R. // Photodiagnosis Photodyn Ther. - 2005. - Т. 2, № 2. - C. 91-106. 261. Castano A.P. Photodynamic therapy and anti-tumour immunity / Castano A.P., Mroz P., Hamblin M.R. // Nat Rev Cancer. - 2006. - Т. 6, № 7. - C. 535 - 545. 262. Debefve E. Leukocyte-endothelial cell interaction is necessary for photodynamic therapy induced vascular permeabilization / Debefve E., Mithieux F., Perentes J.Y., Wang Y., Cheng C., Schaefer S.C., Ruffieux C., Ballini J.P., Gonzalez M., van den Bergh H., Ris H.B., Lehr H.A., Krueger T. // Lasers Surg Med. - 2011. Т. 43, № 7. - C. 696-704. 263. Mitra S. Enzyme-activatable imaging probe reveals enhanced neutrophil elastase activity in tumors following photodynamic therapy / Mitra S., Modi K.D., Foster T.H. // J Biomed Opt. - 2013. - Т. 18, № 10. - C. 101314. 264. Rkein A. M. Photodynamic therapy / Rkein A.M., Ozog D.M. // Dermatol Clin. 2014. - Т. 32, № 3. - C. 415 - 425. 265. Гельфонд М.Л. Фотодинамическая терапия в онкологии / Гельфонд М.Л. // Практическая онкология. - 2007. - Т. 8, № 4. - C. 204 - 210. 266. Кузнецова Н.П. Порфирии / Кузнецова Н.П., Панков Б.С., Чубарова А.С., Кривошеев Б.А., Капралов И.К. - М.: Медицина, 1981. - 192 c. 267. Кубатиев А.А. Порфирины, витамин В12 и рак / Кубатиев А.А. - Тула: Приокское кн. изд-во, 1973. - 224 c. 268. Марри Р. Биохимия человека: В 2-х томах. Т. 1. Пер. с англ. / Марри Р., Греннер Д., Мейес П., Родуэлл В. - М.: Мир, 1993. - 384 c. 269. Щербак И.Г. Биологическая химия. Учебник для медицинских вузов. / Щербак И.Г. - Санкт-Петербург: Изд-во СПбГМУ, 2005. - 480 c. 270. Poh-Fitzpatrick M.B. Direct spectrofluorimetry of diluted erythrocytes and plasma, a rapid method in primary and secondary porphyrinemias / PohFitzpatrick M.B., Lamola A.A. // J. Lab and Clin. med. - 1976. - Т. 87, № 2. - C. 362 - 371. 271. Грубина Л.А. Методы измерения количеств порфиринов крови / Грубина Л.А. // Вопросы медицинской химии. - 1988. - Т. 34, № 5. - C. 34 - 37. 376 272. Kautsky H. [Chlorophyll fluorescence and carbon assimilation. Part XIII. The fluorescence and the photochemistry of plants] / Kautsky H., Appel W., Amann H. // Biochem Z. - 1960. - Т. 332. - C. 277 - 292. 273. Kautsky H. Chlorophyllfluorescenz und Kohlensäureassimilation / Kautsky H. // Klin Wochenschr. - 1948. - Т. 26, № 23-24. - C. 383. 274. Shuvalov V.A. The luminescence of zinc-porphyrins in microorganisms and plants: phosphorescence and delayed fluorescence / Shuvalov V.A., Krasnovskii A.A. // Mol Biol. - 1971. - Т. 5, № 5. - C. 557 - 566. 275. Bystrova M.I. Spectral effects of aggregation of protochlorophyll pigments / Bystrova M.I., Lang F., Krasnovskii A.A. // Mol Biol. - 1972. - Т. 6, № 1. - C. 61 - 68. 276. Bystrova M.I. Photochemical properties of various types of aggregated forms of chlorophylla and bacterioviridin / Bystrova M.I., Krasnovskii A.A. // Mol Biol. 1971. - Т. 5, № 2. - C. 232 - 240. 277. Гуринович Г.П. Спектроскопия порфиринов / Гуринович Г.П., Севченко А.Н., Соловьев К.Н. // Успехи физических наук. - 1963. - Т. LXXIX, № 2. - C. 173-234. 278. Nakanishi T. Kinetic Evaluation of Determinant Factors for Cellular Accumulation of Protoporphyrin IX Induced by External 5-Aminolevulinic Acid for Photodynamic Cancer Therapy / Nakanishi T., Ogawa T., Yanagihara C., Tamai I. // J Pharm Sci. - 2015. - Т. 104, № 9. - C. 3092-100. 279. Nissen C.V. Protoporphyrin IX formation after topical application of methyl aminolaevulinate and BF-200 aminolaevulinic acid declines with age / Nissen C.V., Philipsen P.A., Wulf H.C. // Br J Dermatol. - 2015. - Т. 173, № 3. - C. 760766. 280. Грубина Л.А. Содержание копропорфирина в моче здоровых людей и онкологических больных / Грубина Л.А., Гуринович И.Ф. // Вопр. мед. хим. - 1993. - Т. 39, № 4. - C. 38 - 41. 377 281. Грубина Л.А. Определение содержания эндогенных порфиринов у детей и подростков с патологией щитовидной железы / Грубина Л.А. // Журн. прикл. спектр. - 1997. - Т. 64, № 6. - C. 748 - 752. 282. Грубина Л.А. Изучение люминесцентным методом порфиринового обмена у беременных женщин / Грубина Л.А., Литвинович Н.Г. // Журн. прикл. спектр. - 1997. - Т. 64, № 5. - C. 633 - 636. 283. Волгин В.Н. Оптимизация режимов фотодинамической терапии базальноклеточного рака кожи с Фотосенсом / Волгин В.Н., Странадко Е.Ф., Соколова Т.В., Ламоткин И.А., Рябов М.В. // Лазерная медицина. - 2007. - Т. 11, № 1. - C. 50 - 54. 284. Karrer S. Photodynamic therapy for skin rejuvenation: review and summary of the literature--results of a consensus conference of an expert group for aesthetic photodynamic therapy / Karrer S., Kohl E., Feise K., Hiepe-Wegener D., Lischner S., Philipp-Dormston W., Podda M., Prager W., Walker T., Szeimies R.M. // J Dtsch Dermatol Ges. - 2013. - Т. 11, № 2. - C. 137 - 148. 285. Filip A. G. Photodynamic therapy--indications and limits in malignant tumors treatment / Filip A.G., Clichici S., Daicoviciu D., Olteanu D., Muresan A., Dreve S. // Rom J Intern Med. - 2008. - Т. 46, № 4. - C. 285 - 293. 286. Breskey J. D. Photodynamic therapy: occupational hazards and preventative recommendations for clinical administration by healthcare providers / Breskey J.D., Lacey S.E., Vesper B.J., Paradise W.A., Radosevich J.A., Colvard M.D. // Photomed Laser Surg. - 2013. - Т. 31, № 8. - C. 398 - 407. 287. Ferro S. Efficient photoinactivation of methicillin-resistant Staphylococcus aureus by a novel porphyrin incorporated into a poly-cationic liposome / Ferro S., Ricchelli F., Monti D., Mancini G., Jori G. // Int J Biochem Cell Biol. - 2007. - Т. 39, № 5. - C. 1026-34. 288. Timor R. PEG-Phospholipids Coated Quantum Rods as Amplifiers of the Photosensitization Process by FRET / Timor R., Weitman H., Waiskopf N., Banin U., Ehrenberg B. // ACS Appl Mater Interfaces. - 2015. - Т. 7, № 38. - C. 21107-14. 378 289. Spano V. Pyrazolo[3,4-h]quinolines promising photosensitizing agents in the treatment of cancer / Spano V., Parrino B., Carbone A., Montalbano A., Salvador A., Brun P., Vedaldi D., Diana P., Cirrincione G., Barraja P. // Eur J Med Chem. 2015. - Т. 102. - C. 334-51. 290. Hausman W. Die sensibilisierende wirkung des hematoporphyrins / Hausman W. // Biochem Z. - 1911. - № 30. - C. 276. 291. Lipson R.L. The photodynamic properties of a particular hematoporphyrin derivative / Lipson R.L., Baldes E.J. // Arch Dermatol. - 1960. - Т. 82. - C. 508 516. 292. Шляхтин С.В. Возможности и перспективы использования производных хлорофилла для создания эффективных и безопасных фотосенсибилизаторов для фотодинамической терапии. Обзор литературы / Шляхтин С.В., Трухачева Т.В. // Вестник фармации. - 2010. - Т. 48, № 2. - C. 87 - 106. 293. Ляпина Е.А. Влияние фотосенсибилизаторов феофорбида а и протопорфирина IX на заживление кожных ран при низкоинтенсивном лазерном облучении / Ляпина Е.А., Мачнева Т.В., Ларкина Е.А., Ткачевская Е.П., Осипов А.Н., Миронов А.Ф. // Биофизика. - 2010. - Т. 55, № 2. - C. 350355. 294. Radu A. Mucosal ablation with photodynamic therapy in the esophagus: optimization of light dosimetry in the sheep model / Radu A., Conde R., Fontolliet C., Wagnieres G., Van den Bergh H., Monnier P. // Gastrointest Endosc. - 2003. - Т. 57, № 7. - C. 897-905. 295. Pegaz B. Preclinical evaluation of a novel water-soluble chlorin E6 derivative (BLC 1010) as photosensitizer for the closure of the neovessels / Pegaz B., Debefve E., Borle F., Ballini J.P., Wagnieres G., Spaniol S., Albrecht V., Scheglmann D., Nifantiev N.E., van den Bergh H., Konan Y.N. // Photochem Photobiol. - 2005. - Т. 81, № 6. - C. 1505-10. 296. Chin W.W. Improved formulation of photosensitizer chlorin e6 polyvinylpyrrolidone for fluorescence diagnostic imaging and photodynamic 379 therapy of human cancer / Chin W.W., Heng P.W., Thong P.S., Bhuvaneswari R., Hirt W., Kuenzel S., Soo K.C., Olivo M. // Eur J Pharm Biopharm. - 2008. - Т. 69, № 3. - C. 1083-93. 297. Chin W.W. Chlorin e6 - polyvinylpyrrolidone mediated photosensitization is effective against human non-small cell lung carcinoma compared to small cell lung carcinoma xenografts / Chin W.W., Heng P.W., Olivo M. // BMC Pharmacol. - 2007. - Т. 7. - C. 15. 298. Steinbauer J. Phototoxic reactions in healthy volunteers following photodynamic therapy with methylaminolevulinate cream or with cream containing 5aminolevulinic acid: a phase II, randomized study / Steinbauer J., Schreml S., Karrer S., Ackermann G., Babilas P., Landthaler M., Szeimies R.M. // Photodermatol Photoimmunol Photomed. - 2009. - Т. 25, № 5. - C. 270 - 275. 299. Puccioni M. Photodynamic therapy using methyl aminolevulinate acid in eyelid basal cell carcinoma: a 5-year follow-up study / Puccioni M., Santoro N., Giansanti F., Ucci F., Rossi R., Lotti T., Menchini U. // Ophthal Plast Reconstr Surg. - 2009. - Т. 25, № 2. - C. 115 - 118. 300. Ehrenberg B. The effect of liposomes' membrane composition on the binding of the photosensitizers Hpd and photofrin II / Ehrenberg B., Gross E. // Photochem Photobiol. - 1988. - Т. 48, № 4. - C. 461 - 466. 301. Ricchelli F. Liposomes as models to study the distribution of porphyrins in cell membranes / Ricchelli F., Jori G., Gobbo S., Tronchin M. // Biochim Biophys Acta. - 1991. - Т. 1065, № 1. - C. 42-8. 302. Ricchelli F. Photophysical properties of porphyrins in biological membranes / Ricchelli F. // J Photochem Photobiol B. - 1995. - Т. 29, № 2-3. - C. 109-18. 303. Gross E. Singlet oxygen generation by porphyrins and the kinetics of 9,10dimethylanthracene photosensitization in liposomes / Gross E., Ehrenberg B., Johnson F.M. // Photochem Photobiol. - 1993. - Т. 57, № 5. - C. 808-13. 304. Ricchelli F. Meso-substituted tetra-cationic porphyrins photosensitize the death of human fibrosarcoma cells via lysosomal targeting / Ricchelli F., Franchi L., 380 Miotto G., Borsetto L., Gobbo S., Nikolov P., Bommer J.C., Reddi E. // Int J Biochem Cell Biol. - 2005. - Т. 37, № 2. - C. 306-19. 305. Moreno G. The effects of singlet oxygen produced by photodynamic action on the mitochondrial permeability transition differ in accordance with the localization of the sensitizer / Moreno G., Poussin K., Ricchelli F., Salet C. // Arch Biochem Biophys. - 2001. - Т. 386, № 2. - C. 243-50. 306. Bombelli C. New cationic liposomes as vehicles of m-tetrahydroxyphenylchlorin in photodynamic therapy of infectious diseases / Bombelli C., Bordi F., Ferro S., Giansanti L., Jori G., Mancini G., Mazzuca C., Monti D., Ricchelli F., Sennato S., Venanzi M. // Mol Pharm. - 2008. - Т. 5, № 4. - C. 672-9. 307. Riccheli F. Photodynamic action of porphyrin on Ca2+ influx in endoplasmic reticulum: a comparison with mitochondria / Ricchelli F., Barbato P., Milani M., Gobbo S., Salet C., Moreno G. // Biochem J. - 1999. - Т. 338 ( Pt 1), №. - C. 2217. 308. Ehrenberg B. Electric depolarization of photosensitized cells: lipid vs. protein alterations / Ehrenberg B., Gross E., Nitzan Y., Malik Z. // Biochim Biophys Acta. - 1993. - Т. 1151, № 2. - C. 257-64. 309. Miyamoto Y. Effect of 630-NM pulsed laser irradiation on the proliferation of HeLa cells in Photofrin((R))-mediated photodynamic therapy / Miyamoto Y., Nishikiori D., Hagino F., Wakita M., Tanabe I., Toida M. // Laser Ther. - 2011. Т. 20, № 2. - C. 135 - 138. 310. Lubart R. A pоssible mechanism of low level laser - living cell interaction / Lubart R., Malik Z., Rochkind S., Fisher T. // Laser Ther. - 1990. - Т. 2, № 1. - C. 65-68. 311. Слуцкий Л.И. Биохимия нормальной и патологически измененной соединительной ткани / Слуцкий Л.И. - Ленинград: Медицина, 1969. - 376 c. 312. Стручков В.И. Гнойная рана / Стручков В.И., Григорян А.В., Гостищев В.К. - М.: Медицина, 1975. - 311 c. 313. Kozlov A.V. Different effects of endotoxic shock on the respiratory function of liver and heart mitochondria in rats / Kozlov A.V., Staniek K., Haindl S., 381 Piskernik C., Öhlinger W., Gille L., Nohl H., Bahrami S., H. R. // Am J Physiol Gastrointest Liver Physiol . - 2006. - Т. 290. - C. 543-549. 314. Victor V.M. Modulation of murine macrophage function by N-acetylcysteine in a model of endotoxic shock / Victor V.M., Guayerbas N., Garrote D., Del Rio M., De la Fuente M. // Biofactors. - 1999. - Т. 10, № 4. - C. 347-57. 315. Boyum А. Isolation of mononuclear cells and granulocytes from human blood / Boyum А. // Scand. J. Clin. Invest. - 1968. - Т. 21, № 97. - C. 77-89. 316. Фримель Г. Иммунологические методы. Пер. с нем. А. П. Тарасова. / Фримель Г. - М.: Медицина, 1987. - 472 c. 317. Клебанов Г.И. Влияние низкоинтенсивного лазерного излучения на продукцию оксида азота и цитокинов лейкоцитами / Клебанов Г.И., Полтанов Е.А., Долгина Е.Н., Никанкина Л.А., Анохина Е.Б., Ганковская Л.В., Крейнина М.В., Владимиров Ю.А. // Биол. мембраны. - 2002. - Т. 19, № 5. - C. 391 - 402. 318. Мачнева Т.В. Изучение действия низкоинтенсивного лазерного излучения синего, зеленого и красного диапазонов на процесс заживления экспериментальных кожных ран у крыс. / Мачнева Т.В., Протопопов Д.М., Владимиров Ю.А., Осипов А.Н. // Биофизика. - 2008. - Т. 53, № 5. - C. 894901. 319. Мачнева Т.В. Влияние низкоинтенсивного лазерного излучения синего, зеленого и красного диапазонов на свободно-радикальные процессы в крови крыс при экспериментальном эндотоксическом шоке / Мачнева Т.В., Космачева Н.В., Владимиров Ю.А., Осипов А.Н. // Биомедицинская химия. 2013. - Т. 59, № 4. - C. 411-424. 320. Клебанов Г.И. Сравнительное исследование действия лазерного и светодиодного излучения на заживление ран и функциональную активность клеток раневого экссудата / Клебанов Г.И., Шураева Н.Ю., Чичук Т.В., Осипов А.Н., Руденко Т.Г., Шехтер А.Б., Владимиров Ю.А. // Биофизика. 2005. - Т. 50, № 6. - C. 1137-1144. 382 321. Hempel S.L. Dihydrofluorescein diacetate is superior for detecting intracellular oxidants: comparison with 2',7'-dichlorodihydrofluorescein diacetate, 5(and 6)carboxy-2',7'-dichlorodihydrofluorescein diacetate, and dihydrorhodamine 123 / Hempel S.L., Buettner G.R., O'Malley Y.Q., Wessels D.A., Flaherty D.M. // Free Radic Biol Med. - 1999. - Т. 27, № 1-2. - C. 146 - 159. 322. Rota C. Evidence for free radical formation during the oxidation of 2'-7'dichlorofluorescin to the fluorescent dye 2'-7'-dichlorofluorescein by horseradish peroxidase: possible implications for oxidative stress measurements / Rota C., Chignell C.F., Mason R.P. // Free Radic Biol Med. - 1999. - Т. 27, № 7-8. - C. 873 - 881. 323. Bass D.A. Flow cytometric studies of oxidative product formation by neutrophils: a graded response to membrane stimulation / Bass D.A., Parce J. W., Dechatelet L. R., Szejda P., Seeds M. C., Thomas M. // J Immunol. - 1983. - Т. 130, № 4. - C. 1910 - 1917. 324. Burow S. Flow-cytometric characterization of stimulation, free radical formation, peroxidase activity and phagocytosis of human granulocytes with 2,7dichlorofluorescein (DCF) / Burow S., Valet G. // Eur J Cell Biol. - 1987. - Т. 43, № 1. - C. 128 - 133. 325. Zeller J.M. Evaluation of human monocyte oxidative metabolism utilizing a flow cytometric assay / Zeller J.M., Rothberg L., Landay A.L. // Clin Exp Immunol. 1989. - Т. 78, № 1. - C. 91 - 96. 326. Шебзухов Ю.Б. Синтез оксида азота перитонеальными макрофагами мыши под действием С-реактивного протеина / Шебзухов Ю.Б., Вайсбурд М.Ю., Артюшкин К.В., Мысякин Е.Б. // Бюлл. Эксп. Биол. и Мед. - 1988. - Т. 125, № 1. - C. 48-50. 327. Ding A.H. Release of reactive nitrogene intermediates and reactive oxigene intermediates from mouse peritoneal macrophages / Ding A.H., Nathan C.F., Stuehr D.J. // J. Immunol. - 1988. - Т. 141, № 7. - C. 2707 - 2412. 383 328. Kooy N. W. Peroxynitrite-mediated oxidation of dihydrorhodamine 123 / Kooy N. W., Royall J. A., Ischiropoulos H., Beckman J. S. // Free Radic Biol Med. - 1994. - Т. 16, № 2. - C. 149 - 156. 329. Bolzan R.M. Direct and simultaneous ultraviolet second-derivative spectrophotometric determination of nitrite and nitrate in preparations of peroxynitrite / Bolzan R.M., Cueto R., Squadrito G.L., Uppu R.M., Pryor W.A. // Methods Enzymol. - 1999. - Т. 301. - C. 178 - 187. 330. Yagi K. Assay for blood plasma or serum / Yagi K. // Methods Enzymol. - 1984. - Т. 105. - C. 328 - 331. 331. Гаврилов В.Б. Анализ методов определения продуктов перекисного определения липидов в сыворотке крови по тесту с тиобарбитуровой кислотой / Гаврилов В.Б., Гаврилова А.П., Мажуль Л.М. // Вопр. Мед. Химии. - 1987. - Т. 33, № 1. - C. 118-122. 332. Recknagel R.O. Spectrophotometric detection of lipid conjugated dienes / Recknagel R.O., Glende Jr. E.A. // Methods Enzymol. - 1984. - Т. 105. - C. 331 337. 333. Kagan V.E. Sensitive and specific fluorescent probing of oxidative stress in different classes of membrane phospholipids in live cells using metabolically integrated cis-parinaric acid / Kagan V.E., Ritov V.B., Tyurina Y.Y., Tyurin V.A. // Methods Mol Biol. - 1998. - Т. 108. - C. 71-87. 334. McKenna R. Kinetic analysis of the free-radical-induced lipid peroxidation in human erythrocyte membranes: evaluation of potential antioxidants using cisparinaric acid to monitor peroxidation / McKenna R., Kezdy F.J., Epps D.E. // Anal. Biochem. - 1991. - Т. 196, № 2. - C. 443-450. 335. Sklar L.A. The partition of cis-parinaric acid and trans-parinaric acid among aqueous, fluid lipid, and solid lipid phases / Sklar L.A. // Mol. Cell. Biochem. 1980. - Т. 32, № 3. - C. 169-177. 336. Steenbergen R.H. The use of cis-parinaric acid to measure lipid peroxidation in cardiomyocytes during ischemia and reperfusion / Steenbergen R. H., Drummen 384 G. P., Op den Kamp J. A., Post J. A. // Biochim. Biophys. Acta. - 1997. - Т. 1330, № 2. - C. 127-137. 337. Van den Berg J.J. The use of cis-parinaric acid to determine lipid peroxidation in human erythrocyte membranes. Comparison of normal and sickle erythrocyte membranes / Van den Berg J.J., Kuypers F.A., Qju J.H., Chiu D., Lubin B., Roelofsen B., Op den Kamp J.A. // Biochim. Biophys. Acta. - 1988. - Т. 944, № 1. - C. 29-39. 338. Владимиров Ю.А. Активированная хемилюминесценция и биолюминесценция как инструмент в медико-биологических исследованиях / Владимиров Ю.А. // Соросовский образовательный журнал. - 2001. - Т. 7, № 1. - C. 16 - 23. 339. Владимиров Ю.А. Активированная кумарином хемилюминесценция липопротеидов низкой плотности в присутствии двухвалентного железа / Владимиров Ю.А., Шерстнев М.П., Азимбаев Т.К. // Биофизика. - 1995. - Т. 40, № 2. - C. 323 - 327. 340. Владимиров Ю.А. Свободные радикалы и клеточная хемилюминесценция / Владимиров Ю.А., Проскурнина Е.В. // Усп. биол. химии. - 2009. - Т. 49. - C. 341 - 388. 341. Клебанов Г.И. Измерение активности супероксиддисмутазы в процессе стимуляции полиморфноядерных лейкоцитов периферической крови / Клебанов Г.И., Крейнина М.В., Чукаева И.И., Барбараш О.Л., Корочкин И.М., Владимиров Ю.А. // Бюлл. Эксп. Биол. и Мед. - 1990. - Т. 109, № 4. C. 334 - 336. 342. Evalution of total antioxidant potential (TRAP) and total antioxidant reactivity from luminol-enhanced chemiluminescence measurements / Lissi E., SalimHanna M., Pascual C., del Castielo M.D. // Free Rad Biol and Med. - 1995. - Т. 18. - C. 153-158. 343. Folch J. A simple method for the isolation and purification of total lipids from animal tissues / Folch J., Lees M., Stanley G.H.S. // J.Biol. Chem. - 1957. - Т. 226, № 1. - C. 497 - 509. 385 344. Bangham A.D. Diffusion of univalent ions across the lamallae of swollen phospholipids / Bangham A.D., Standish M.M., Watkins J.C. // J. Mol. Biol. 1965. - Т. 13, № 2. - C. 238 - 252. 345. Васильева О.В. Действие антиоксидантов на кинетику цепного окисления липидов в липосомах / Васильева О.В., Любицкий О.Б., Клебанов Г.И., Владимиров Ю.А. // Биологические мембраны. - 1998. - Т. 15, № 2. - C. 177 183. 346. Дремина Е.С. Использование кинетики Fe2+-индуцированной хемилюминесценции в трис-буферной суспензии липосом для исследования антиоксидантной активности плазмы крови / Дремина Е.С., Шаров В.С., Владимиров Ю.А. // Биофизика. - 1993. - Т. 38, № 6. - C. 1047-1051. 347. Авдонин П.В. Рецепторы и внутриклеточный кальций / Авдонин П.В., Ткачук В.А. - М.: Наука, 1994. - 288 c. 348. Bae Y.S. Epidermal growth factor (EGF)-induced generation of hydrogen peroxide. Role in EGF receptor-mediated tyrosine phosphorylation / Bae Y.S., Kang S.W., Seo M.S., Baines I.C., Tekle E., Chock P.B., Rhee S.G. // J Biol Chem. - 1997. - Т. 272, № 1. - C. 217 - 221. 349. Dreiem A. Relationship between lipophilicity of C6-10 hydrocarbon solvents and their ROS-inducing potency in rat cerebellar granule cells / Dreiem A., Myhre O., Fonnum F. // Neurotoxicology. - 2002. - Т. 23, № 6. - C. 701-9. 350. Mills E.M. Nerve growth factor treatment prevents the increase in superoxide produced by epidermal growth factor in PC12 cells / Mills E.M., Takeda K., Yu Z.X., Ferrans V., Katagiri Y., Jiang H., Lavigne M.C., Leto T.L., Guroff G. // J Biol Chem. - 1998. - Т. 273, № 35. - C. 22165-8. 351. Sundaresan M. Requirement for generation of H2O2 for platelet-derived growth factor signal transduction / Sundaresan M., Yu Z.X., Ferrans V.J., Irani K., Finkel T. // Science. - 1995. - Т. 270, № 5234. - C. 296-9. 352. Sekkat C. Oxidative phenomena are implicated in human T-cell stimulation / Sekkat C., Dornand J., Gerber M. // Immunology. - 1988. - Т. 63, № 3. - C. 431-7. 386 353. Росс Р. Заживление ран / Росс Р. // "Молекулы и клетки", Вып. 5 - Ред. Франк Г.М. - М.: Мир, 1970. - С. 134 -152. 354. Hillemanns P. Photodetection of cervical intraepithelial neoplasia using 5aminolevulinic acid-induced porphyrin fluorescence / Hillemanns P., Weingandt H., Baumgartner R., Diebold J., Xiang W., Stepp H. // Cancer. - 2000. - Т. 88, № 10. - C. 2275 - 2282. 355. PubChem Compound Database; CID=137. Aminolevulinic acid [Электронный ресурс] / PubChem Compound Database; CID=137 // U.S. National Library of Medicine. National Center for Biotechnology Information. - 2015. - Режим доступа: URL: http://pubchem.ncbi.nlm.nih.gov/compound/137#section=Top (дата обращения: 30.07.2015). 356. Pinheiro A.L. Polarized light (400-2000 nm) and non-ablative laser (685 nm): a description of the wound healing process using immunohistochemical analysis / Pinheiro A.L., Pozza D.H., Oliveira M.G., Weissmann R., Ramalho L.M. // Photomed laser Surg. - 2005. - Т. 23, № 5. - C. 485-92. 357. Halliwel B. Free Radicals in Biology and Medicine / Halliwel B., Gutteridge J.M.C. -. Third edNational institute of educational library, Singapore: Oxford University Press, 2001. - 936 c. 358. Karmakova T. Tissue distribution and in vivo photosensitizing activity of 13,15[N-(3-hydroxypropyl)]cycloimide chlorin p6 and 13,15-(N-methoxy)cycloimide chlorin p6 methyl ester / Karmakova T., Feofanov A., Pankratov A., Kazachkina N., Nazarova A., Yakubovskaya R., Lebedeva V., Ruziyev R., Mironov A., Maurizot J.C., Vigny P. // J Photochem Photobiol B. - 2006. - Т. 82, № 1. - C. 2836. 359. Миронов А.Ф. Направленная модификация природных хлоринов по пиррольному кольцу D / Миронов А.Ф., Нечаев А.В. // Биоорганическая химия. - 2001. - Т. 27, № 2. - C. 141 -144. 360. Su X. PpIX induces mitochondria-related apoptosis in murine leukemia L1210 cells / Su X., Chen Y., Wang X., Wang Y., Wang P., Li L., Liu Q. // Drug Chem Toxicol. - 2014. - Т. 37, № 3. - C. 348-56. 387 361. Ryazanova O. Fluorescent studies on cooperative binding of cationic pheophorbide-a derivative to polyphosphate / Ryazanova O., Voloshin I., Dubey I., Dubey L., Zozulya V. // Ann N Y Acad Sci. - 2008. - Т. 1130. - C. 293 - 299. 362. Wolkow P.P. Involvement and dual effects of nitric oxide in septic shock / Wolkow P.P. // Inflamm Res. - 1998. - Т. 47, № 4. - C. 152-66. 363. Pascual C. A controlled study of leukocyte activation in septic patients / Pascual C., Karzai W., Meier-Hellmann A., Bredle D.L., Reinhart K. // Intensive Care Med. - 1997. - Т. 23, № 7. - C. 743-8. 364. Chin W.W. Chlorin e6-polyvinylpyrrolidone as a fluorescent marker for fluorescence diagnosis of human bladder cancer implanted on the chick chorioallantoic membrane model / Chin W.W., Lau W.K., Bhuvaneswari R., Heng P.W., Olivo M. // Cancer Lett. - 2007. - Т. 245, № 1-2. - C. 127-33. 365. Тимен Л.Я. Консервативное лечение гигантской язвы желудка / Тимен Л.Я., Шерцингер А.Г., Жигалова С.Б., Трубицына И.Е., Чикунова Б.З., Манукьян В.Г. // Экспериментальная и клиническая гастроэнтерология. - 2010. - Т. 10. - C. 110 - 111. 366. Клебанов Г.И. Влияние красного низкоинтенсивного лазерного излучения на активность супероксиддисмутазы макрофагов / Клебанов Г.И., Полтанов Е.А., Владимиров Ю.А. // Биофизика. - 2003. - Т. 48, № 3. - C. 462-473. 367. Сосунов А.А. Оксид азота как межклеточный посредник / Сосунов А.А. // Соросовский образовательный журнал. - 2000. - Т. 6, № 12. - C. 27-34. 368. Lissi E. Evaluation of total antioxidant potential (TRAP) and total antioxidant reactivity from luminol-enhanced chemiluminescence measurements / Lissi E., Salim-Hanna M., Pascual C., Del Сastielo M.D. // Free Rad Biol and Med. - 1995. - Т. 18, № 2. - C. 153 - 158. 369. Klebanov G. I. Changes in superoxide dismutase activity and peroxynitrite content in rat peritoneal macrophages exposed to He-Ne laser radiation / Klebanov G.I., Poltanov E.A., Chichuk T.V., Osipov A.N., Vladimirov Y.A. // Biochemistry (Mosc). - 2005. - Т. 70, № 12. - C. 1335-40. 388 370. Brockhaus F. Overexpression of CuZn superoxide dismutase protects RAW 264.7 macrophages against nitric oxide cytotoxicity / Brockhaus F., Brune B. // Biochem. J. - 1999. - Т. 338. - C. 295-303.