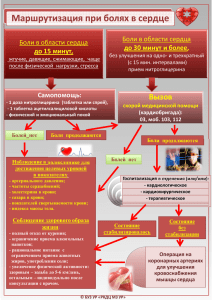
Диссертация Бояркина
advertisement

Крымский государственный медицинский университет имени С.И. Георгиевского Республика Крым, Российская Федерация На правах рукописи Бояркина Анна Викторовна ВЛИЯНИЕ ПСИХОЛОГИЧЕСКИХ И ГЕНЕТИЧЕСКИХ ФАКТОРОВ НА ЭФФЕКТИВНОСТЬ ПОСЛЕОПЕРАЦИОННОЙ АНАЛГЕЗИИ ОПИОИДАМИ 14.01.20 – анестезиология и реаниматология Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель доктор медицинских наук доцент А.Л. Потапов Симферополь – 2014 2 ОГЛАВЛЕНИЕ СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ ………………………………5 ВВЕДЕНИЕ…………………………………………………………………………..7 ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ………………………………………………………...…..13 1.1. Современное состояние проблемы послеоперационного обезболивания…13 1.2. Биопсихосоциальная модель боли…………………………………………..19 1.3. Психологические аспекты послеоперационной боли……………………...24 1.4. Клиническая фармакогенетика и послеоперационная боль…………….....28 ГЛАВА 2 МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ………………………....………...35 2.1. Дизайн исследования и клиническая характеристика пациентов………...35 2.2. Оценка уровня предоперационной тревоги и депрессии…………………...37 2.3. Оценка показателей интенсивности боли и выраженности побочных эффектов опиоидов после операции…………………………………………..…39 2.4. Определение генотипов полиморфизма гена OPRM1 118A>G и COMT 1947 G>A…………………………………………………………………………..40 2.5. Методика расчета прогностической ценности психологических шкал и генотипирования, а также чувствительности и специфичности комбинированного теста………………………………………………………….44 2.6. Статистические методы исследования……………………………………...45 3 ГЛАВА 3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ……………………..………..……………….47 3.1. Эффективность аналгезии после операций на почке и верхней трети мочеточника с помощью µ-агониста тримеперидина….……………………….47 3.2. Влияние уровня предоперационной тревоги и депрессии на интенсивность боли после операции ……..………………………………...………………….…52 3.3. Оценка частот генотипов полиморфизма 118A>G гена OPRM1 и полиморфизма 1947G>A гена COMT среди пациентов и их влияния на интенсивность боли после операции…………………………………………….58 3.4. Исследование взаимосвязи между SNPs 118A>G гена OPRM1 и 1947G>A гена COMT и предоперационным психологическим состоянием пациентов...65 3.5. Оценка влияния предоперационного психологического состояния пациентов, SNP 118A>G гена OPRM1 и SNP 1947G>A гена COMT на частоту возникновения и выраженность побочных эффектов опиоидов………………67 3.6. Прогностическая значимость генотипирования OPRM1 118A>G, COMT 1947G>A и психологического состояния пациентов относительно интенсивной боли после операции и развития побочных эффектов опиоидов……………...74 ГЛАВА 4 ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ……………..……………87 4.1. Оценка послеоперационной аналгезии тримеперидином и влияния психологических и генетических факторов на её эффективность…………….87 4.2. Влияние психологических и генетических особенностей пациентов на развитие побочных эффектов тримеперидина………………………………...101 4 4.3. Прогностическая ценность различных диагностических тестов и их комбинаций относительно развития сильной боли после операции и побочных эффектов опиоидов………………………………………………………………105 ВЫВОДЫ…….…………………………………………………………………....109 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ………………………………………….111 ПЕРСПЕКТИВЫ ДАЛЬНЕЙШЕЙ РАЗРАБОТКИ ТЕМЫ...…………………..112 СПИСОК ЛИТЕРАТУРЫ………………………………………………………...115 5 СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ ДИ – доверительный интервал ИВЛ – искусственная вентиляция легких КПА – контролируемая пациентом аналгезия МА – местные анестетики НА – наркотические анальгетики НПВС – нестероидные противовоспалительные средства ПЦР – полимеразная цепная реакция ПЭ – побочные эффекты ТЭА – торакальная эпидуральная аналгезия ХБС – хронический болевой синдром ЦРШ – цифровая рейтинговая шкала ЧДД – частота дыхательных движений AUC – площадь под ROC-кривой (Area Under Curve) COMT – ген катехол-О-метилтрансферазы (Catechol-O-methyltransferase gene) HADSтревога – госпитальная шкала тревоги (Hospital Anxiety Scale) HADSдепрессия – госпитальная шкала депрессии (Hospital Depression Scale) LR+ – отношение правдоподобия для положительного результата теста NPV – негативная прогностическая значимость OR – отношение шансов (odds ratio) OPRM1 – ген µ1-опиоидного рецептора (µ1-opioid receptor gene) 6 PHQ-9 – шкала оценки самочувствия (Patient Health Questionnaire) POSSUM – шкала оценки периоперационного риска PPV – позитивная прогностическая значимость ROC-кривая – «рабочая характеристика приёмника» (Receiver Operator Characteristic), графическая характеристика качества бинарного классификатора RR – относительный риск (Relative risk) RSS – шкала седации Рамсея (Ramsay Sedation Scale) SE – чувствительность диагностического теста (SEnsitivity) SNP – однонуклеотидный полиморфизм (single nucleotide polymorphism) SP – специфичность диагностического теста (SPecificity) SpO2 – насыщение гемоглобина крови кислородом 7 ВВЕДЕНИЕ Актуальность темы Проблема эффективного лечения послеоперационной боли остается актуальной и далека от своего разрешения. По данным рабочей группы PROSPECT (www.postoppain.org) 70% пациентов после операции испытывают боль от умеренной до сильной, что влияет на комфорт и результаты лечения [111]. В последние годы появился ряд работ, содержащих критическое отношение к применению регионарных методов обезболивания, связанное с неоднозначным влиянием на послеоперационную летальность и частоту осложнений [12-15]. Поэтому повышение эффективности и безопасности применения наркотических анальгетиков (НА) сохраняет свою актуальность и является важной задачей современной анестезиологии. Реакция пациентов на применение НА подвержена сильным индивидуальным колебаниям [11,16], и до настоящего времени надежных факторов прогноза эффективности и безопасности данной группы препаратов не найдено. Определенные фармакогенетическими надежды исследованиями в этом [17-23], отношении но пока связаны трудно с дать конкретные практические рекомендации. Наиболее перспективными генетическими факторами являются однонуклеотидные полиморфизмы (SNP – single nucleotide polymorphism) генов µ1-опиоидного рецептора (OPRM1) 118A>G и катехол-О-метилтрансферазы (СОМТ) 1947G>A. SNP OPRM1 118A>G сопровождается заменой аденина (А) на гуанин (G) в 118 положении и приводит к замене аспарагина на аспартат в позиции 40 аминокислотной последовательности рецептора (Asn40Asp). Последствием замены Asn40Asp является изменение числа µ1-рецепторов и их аффинитета к эндо- и экзогенным опиатам, но сообщения о влиянии данного полиморфизма на эффективность применения НА противоречивы [16,17,21,23]. SNP COMT 1947G>A сопровождается заменой G на A в положении 1947, что 8 приводит к замене валина на метионин в 158 позиции белковой структуры фермента (Val158Met) и 3-4-кратному снижению его активности. В литературе имеются противоположные точки зрения на последствия указанного SNP относительно проведения болевого сигнала и потребления НА [19,21]. Изучение взаимосвязи SNP OPRM1 118A>G, COMT 1947G>A и качества послеоперационной аналгезии опиоидами является обоснованным с точки зрения современной концепции биопсихосоциальной модели боли [3], поскольку они могут влиять на ее интенсивность и эмоциональное состояние пациентов [20,24,25]. В нашем регионе распространенность данных SNP, а также их связь с уровнем предоперационной тревоги, депрессии и эффективностью применения НА ранее не исследовались. Кроме того, в практическую анестезиологию недостаточно широко внедрена предоперационная оценка психологического состояния хирургических пациентов, что может иметь значение для прогнозирования интенсивности боли после операции. Степень разработанности темы исследования Анализ научной прогнозирования информации качества свидетельствует, послеоперационной что аналгезии проблема опиоидами разработана недостаточно. С этой целью целесообразным является изучение психологических и генетических особенностей пациентов, но данные отдельных публикаций противоречивы. Поэтому были сформулированы следующие цель и задачи исследования. Цель исследования Разработка и внедрение нового подхода к прогнозированию эффективности аналгезии наркотическими анальгетиками после объемных операций, основанного на предоперационной оценке психологических и генетических особенностей пациентов. 9 Задачи исследования 1. Провести углубленную оценку индивидуальной реакции пациентов на послеоперационную аналгезию тримеперидином и обосновать целесообразность применения биопсихосоциальной модели боли с целью повышения эффективности обезболивания. 2. Изучить влияние уровня предоперационной тревоги и депрессии на интенсивность боли после операции у пациентов после объемных хирургических вмешательств. 3. Оценить частоты генотипов полиморфизма 118A>G гена µ1- опиоидного рецептора и полиморфизма 1947G>A гена катехол-О- метилтрансферазы в данной группе пациентов и изучить их влияние на эффективность аналгезии опиоидами. 4. Исследовать генетическими возможную особенностями и взаимосвязь между предоперационным изучаемыми психологическим состоянием пациентов. 5. Оценить влияние предоперационного психологического состояния пациентов и полиморфизмов генов OPRM1 118A>G и COMT 1947G>A на частоту возникновения и выраженность побочных эффектов опиоидов. 6. Изучить прогностическую значимость генотипирования OPRM1 118A>G и COMT 1947G>A, а также психологического состояния пациентов с целью раннего выявления группы повышенного риска развития интенсивной боли после операции и побочных эффектов опиоидов. Методология и методы исследования Диссертация выполнена в соответствии с принципами и правилами доказательной медицины. Использовался комплекс клинических, биохимических, молекулярно-генетических, психологических и статистических методов, направленный на изучение эффективности опиоидной аналгезии, оценку предоперационного психологического состояния пациентов, выявление полиморфных вариантов генов OPRM1 118A>G и COMT 1947G>A среди 10 пациентов и их влияния на интенсивность боли после операции, частоту возникновения побочных эффектов НА, а также взаимосвязь с предоперационным уровнем невротических расстройств. Научная новизна полученных результатов Обоснована целесообразность оценки качества послеоперационной аналгезии опиоидами в рамках биопсихосоциальной модели боли. Проведен анализ распространенности SNP генов OPRM1 118A>G и COMT 1947G>A в Республике Крым. Доказано влияние указанных полиморфизмов на эффективность обезболивания наркотическими анальгетиками, частоту и выраженность их побочных эффектов. Установлена связь SNP OPRM1 118A>G с предоперационным психологическим состоянием пациентов. Обосновано применение шкал HADS, PHQ-9, а также генотипирования OPRM1 118A>G и COMT 1947G>A с целью прогнозирования качества послеоперационной аналгезии опиоидами. Теоретическая и практическая значимость Установлено, что различия индивидуальной реакции пациентов на применение наркотических анальгетиков в послеоперационном периоде могут быть связаны с психологическими и генетическими особенностями. Доказано, что уровень тревоги и депрессии по шкалам HADS и PHQ-9, а также SNP генов OPRM1 118A>G и COMT 1947G>A влияют на интенсивность боли, выраженность тошноты, сонливости, головокружения, частоту рвоты и кожного зуда. Выявлена высокая прогностическая значимость применения комбинированных тестов, основанных на оценке показателей шкал HADS, PHQ9 и полиморфизмов OPRM1 118A>G и COMT 1947G>A, а также пола пациента, с целью выявления пациентов группы риска неадекватной аналгезии и развития побочных эффектов опиоидов. 11 Основные положения, выносимые на защиту 1. Одной из причин неудовлетворительной послеоперационной аналгезии с использованием наркотических анальгетиков является значительная вариабельность и непредсказуемость индивидуальной реакции пациентов на применение данной группы препаратов, что заставляет рассматривать боль в рамках биопсихосоциальной модели с учетом психологических и генетических особенностей пациента. 2. Риск развития сильной боли и некоторых побочных эффектов на фоне аналгезии опиоидами после объемных урологических операций существенно выше у пациентов с выраженными предоперационными невротическими расстройствами, а также наличием определенных видов полиморфных вариантов генов OPRM1 118A>G и COMT 1947G>A. 3. Применение комплексной оценки предоперационного психологического состояния и генетических полиморфизмов OPRM1 118A>G, COMT 1947G>A у хирургических пациентов является эффективным методом прогнозирования фармакологических эффектов наркотических анальгетиков и способствует реализации концепции персонализированного лечения боли. Результаты работы внедрены: − В Государственном учреждении «Крымский государственный медицинский университет имени С.И. Георгиевского» г. Симферополя, кафедра медицины неотложных состояний и анестезиологии (акт внедрения от 28.03.2014). − В Крымском республиканском учреждении «КТМО «Университетская клиника» г. Симферополя, отделении анестезиологии с палатами интенсивной терапии (акт внедрения от 01.04.2014). − В учебно-научно-лечебном комплексе ГУ «Крымский государственный медицинский университет имени С.И. Георгиевского» г. Симферополя (акт внедрения от 07.04.2014). 12 − В Городской клинической больнице №7 г. Симферополя, отделении анестезиологии с койками интенсивной терапии (акт внедрения от 28.03.2014). − В КП «Феодосийская городская больница №1» г. Феодосия, отделении анестезиологии с койками интенсивной терапии (акт внедрения от 07.04.2014). Личный вклад соискателя Автором самостоятельно проведен патентно-информационный поиск, анализ научной литературы по выбранной теме, совместно с научным руководителем определены цель и задачи исследования, сформулированы основные выводы работы и практические рекомендации. Автор принимал непосредственное участие в проведении всех анестезиологических пособий, лично выполнил все психологические исследования, провел оценку, систематизацию и статистическую обработку полученных результатов. Апробация результатов диссертации Основные положения работы доложены и представлены на следующих конференциях: VI Национальном конгрессе анестезиологов Украины (18-21 сентября 2013 г., Львов), Восточноевропейском конгрессе по боли (18-20 сентября 2013 г., Ялта), XI Всероссийской научно-методической конференции ''Стандарты и индивидуальные подходы в анестезиологии и реаниматологии'' (18-20 мая 2014 г., Геленджик), конгрессе Европейского общества анестезиологии (31 мая-3 июня 2014 г., Стокгольм). Публикации По материалам диссертации опубликовано 11 научных работ, из них в изданиях, утвержденных ВАК – 5, материалах конференций – 3, зарубежных журналах – 2, других журналах – 1. 13 ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ 1.1. Современное состояние проблемы послеоперационного обезболивания Лечение боли является одной из важнейших задач послеоперационного ведения пациентов и во многом определяет исход лечения [5,26]. Несмотря на то, что в большинстве развитых стран послеоперационное обезболивание осуществляется в соответствии с принятыми национальными и международными стандартами [3,8,27-32], имеется большой выбор мощных препаратов и методик, эффективность действия которых доказана, результаты аналгезии остаются неудовлетворительными [1,8,33,34]. В настоящее время существуют организации, объединяющие ведущих специалистов мира с целью исследования и содействия улучшению терапии болевых синдромов различной этиологии (IASP, EFIC, РОИБ, УАИБ, APS), рекомендации которых также основаны на данных доказательной медицины. Однако, при теоретической разработанности и простоте решения данного вопроса, на практике не всегда удается достичь желаемых результатов. Об этом свидетельствуют данные широкомасштабных исследований, проведенных в различных развитых странах [35-41]. Результаты одноцентрового исследования Sommer M. и соавт. (2008), проведенного в Германии, показали, что из 1490 хирургических пациентов сразу после операции боль от умеренной до сильной испытывали 41% пациентов, в 1 сутки – 30%, 2 сутки – 19%, 3 сутки – 16%, 4 сутки – 14% [35]. C. Maier и соавт. (2010) провели многоцентровое исследование качества послеоперационной аналгезии после различных типов хирургических вмешательств с участием 2252 пациентов, находившихся на лечении в 25 госпиталях Германии. Отсутствие болевых ощущений выявлено всего лишь у 12,4% пациентов. 55% пациентов признали качество послеоперационной 14 аналгезии неудовлетворительным. 29% пациентов в покое и 55% при движении испытывали боль от умеренной до сильной интенсивности. У 45,6% пациентов послеоперационная аналгезия признана неадекватной [39]. Исследование, проведенное в Дании V. Lorentzen и соавт. (2012), также подтверждает недостаточную эффективность послеоперационного обезболивания на фоне применения опиатов. В исследовании участвовало 573 пациента, 45,5% из которых в течение 72 часов после операции сообщали о наличии болевых ощущений от средней до сильной интенсивности [40]. Согласно интернациональному многоцентровому исследованию «Pain Out», в котором участвовало 10 000 пациентов из 13 разных стран, в том числе из Украины, в 1 сутки после операции 70,9% пациентов испытывали боль, превышающую 3 балла, 40,1% – более 6 баллов, что также подтверждает необходимость повышения качества послеоперационного обезболивания [41]. Вопрос адекватной аналгезии недостаточно разработан и при некоторых специфических видах оперативных вмешательств. Известно, что открытые операции на почке и верхней трети мочеточника, выполняемые из люмботомического доступа, относятся к высшей категории травматичности [4]. Однако рекомендации Европейской ассоциации урологов 2013 года по терапии послеоперационного болевого синдрома у урологических пациентов практически полностью основаны на результатах, полученных в других областях хирургии, и, кроме того, содержат большое количество ссылок на исследования, проведенные до 2000 года [28]. Поэтому разработка новых подходов к аналгетической терапии у данной категории пациентов является особо актуальной. Последствия неадекватного обезболивания во время и после операции хорошо известны и достаточно широко описаны в современной литературе. Послеоперационная боль оказывает негативное воздействие на органы и системы организма, вызывая комплекс нейроэндокринных, иммунологических, метаболических и психологических изменений, описанных в рамках стрессовой 15 реакции на повреждение. Результатом недостаточной аналгезии являются увеличение времени реабилитации пациентов после операции, длительности госпитализации, рост частоты осложнений и, в конечном итоге, повышение экономических затрат на лечение [28,37,42,43]. Еще одним возможным последствием послеоперационной боли является развитие хронического болевого синдрома (ХБС), связанное с повреждением периферических нервов и последующими функциональными изменениями путей проведения болевой чувствительности [3]. Развитие ХБС после открытых нефрэктомий может достигать 28,6% [10]. Хронизация боли является серьезной медико-социальной проблемой, поскольку не только существенно снижает качество жизни пациентов после выписки, но и имеет большое экономическое значение. Согласно отчету Института медицины (2011) затраты США на лечение ХБС составляют 635 млрд. долларов ежегодно [44]. Оценка боли и этапный мониторинг эффективности аналгезии являются важным элементом послеоперационного обезболивания. По разным данным 3555% медицинских сестер недооценивает интенсивность боли у пациентов [4547], а более 63% пациентов не получают аналгетическую терапию при таких болезненных манипуляциях, как удаление дренажей или перевязка [48]. Многие пациенты убеждены, что медицинский персонал осведомлен об испытываемой ими боли, однако в 50% случаев подобных данных нет [8]. Учитывая субъективную природу болевого синдрома, для его оценки в клинической практике используются визуальные шкалы. Наиболее распространенными среди них являются: визуально-аналоговая шкала (VAS – visual analogue scale), цифровая рейтинговая шкала (NRS – numeric rating scale), вербальная рейтинговая шкала (VRS – verbal categorical rating scale), вербальная описательная шкала (VDS – verbal descriptive scale), числовая шкала боли (NPS – numeric pain scale), мимическая шкала (FPS – faces pain scale) [49]. При этом необходимо ориентироваться на критерии максимально допустимой интенсивности боли, в частности, по цифровой рейтинговой шкале (ЦРШ) максимально допустимая интенсивность боли в покое – 3 балла, при движениях 16 (кашле) – 4 балла [29,39,50]. ЦРШ также может быть использована для измерения других аспектов качества аналгезии: эмоциональных переживаний, тяжести побочных эффектов, удовлетворенности лечением. [3,50]. Несмотря на легкость выполнения и доказанную эффективность, рутинная оценка уровня болевого синдрома после операции недостаточно внедрена в практическое здравоохранение [3,8,33]. В рекомендациях американской ассоциации по изучению боли показано, что динамическая оценка качества аналгезии является неотъемлемой составляющей успешного лечения послеоперационного болевого синдрома и терапии в целом [51]. Успех обезболивания во многом зависит от степени информированности пациентов и их веры в квалифицированность специалиста. В связи с этим целесообразно предоставить пациентам детальную информацию о послеоперационной боли и способах борьбы с ней [4]. Показано, что проведение подобной разъяснительной беседы накануне операции способствует снижению уровня предоперационной тревоги и страха, боли после операции, а также количества послеоперационных осложнений [3,52]. Современное определение эффективной фармакотерапии боли звучит как «мультимодальная сбалансированная аналгезия», то есть одновременное воздействие как минимум на 2 уровня формирования болевого ощущения [53]. С этой целью возможно использование нестероидных противовоспалительных препаратов (НПВС), опиатов, регионарной анестезии/аналгезии и их комбинаций. Открытые операции на почке и верхней трети мочеточника относятся к высшей категории травматичности, поэтому использование НПВС в качестве средств моноаналгезии у данной категории пациентов не рекомендуется и возможно только при боли низкой интенсивности (ЦРШ<3 баллов). Их применение может сопровождаться рядом нежелательных побочных эффектов, среди которых повышение риска значимых кровотечений и сердечно-сосудистых осложнений [3,33,54-60]. 17 Высоким качеством обезболивания обладают регионарные блокады. Результаты исследований с высоким уровнем доказательности позволяют считать, что при объемных урологических и абдоминальных операциях предпочтение должно отдаваться торакальной эпидуральной аналгезии (ТЭА) с использованием местных анестетиков (МА) [61]. Доказано, что ТЭА обеспечивает лучшее послеоперационное обезболивание в сравнении с парентеральным назначением опиатов, включая контролируемую пациентом аналгезию [61-64]. Эпидуральное введение МА улучшает оксигенацию и снижает частоту восстановлению легочных функции осложнений, кишечника способствует после более абдоминальных раннему операций, позволяет снизить длительность искусственной вентиляции легких (ИВЛ) в послеоперационном периоде, а также уменьшает риск развития ХБС [63-66]. Прямое действие МА на тромбоциты [67,68] и более ранняя активизация пациентов при данном типе обезболивания приводит к достоверному снижению частоты развития венозных тромбозов [69,70]. Несмотря на наличие несомненных преимуществ эпидуральной и нейроаксиальной аналгезии, в последние годы в литературе они все чаще подвергаются критике. В своем обзоре Kettner S.C. и соавт. (2011) провели оценку нескольких мета-анализов и систематических обзоров, в которых исследовались результаты использования регионарных методов обезболивания и их влияние на частоту послеоперационных осложнений [13]. Было обнаружено, что мета-анализ Rodgers А. и соавт. (2000), согласно которому применение регионарных блокад на треть снижает послеоперационную летальность, имеет ряд существенных методических недостатков, ставящих под сомнение полученные выводы [13]. Работа Pratt W.B. и соавт. (2008) показала, что общая частота осложнений и длительность пребывания в стационаре в группе пациентов ТЭА была выше по сравнению с группой, получавшей опиаты внутривенно. У этих пациентов наблюдалась более высокая потребность в переливании препаратов крови, 18 инфузионной терапии, чаще развивались гастроинтестинальные и легочные осложнения. У 31% пациентов ТЭА была прекращена из-за гемодинамической нестабильности и неадекватной аналгезии [15]. Choi D.X. и соавт. (2010) также не выявили преимуществ применения ТЭА по сравнению с системным назначением опиатов при операциях на поджелудочной железе: частота осложнений, сроки госпитализации и летальность в группах пациентов не отличались [14]. По мнению Rawal N. и соавт. (2012) эпидуральная аналгезия не может считаться золотым стандартом лечения боли, что связано с риском осложнений, дополнительными материальными и трудовыми затратами [12]. С появлением новых, менее инвазивных техник, не уступающих эпидуральной аналгезии по эффективности, актуальность данного метода существенно снижается, а вопрос ее рутинного использования ставится под сомнение [12,71]. В этой связи особое значение приобретает повышение эффективности послеоперационной аналгезии наркотическими аналгетиками, которые попрежнему составляют основу лечения боли во многих хирургических стационарах. Для купирования боли в послеоперационном периоде в 60% случаев используют опиоиды, однако эффективность аналгезии при использовании данной группы препаратов в качестве монотерапии не превышает 25-30% [33]. Реакция пациентов на применение наркотических аналгетиков трудно предсказуема и подвержена сильным индивидуальным колебаниям, что не позволяет адекватно купировать боль у каждого конкретного пациента. Это может быть связано с генетическими, психологическими и социальными факторами [11], именно поэтому боль в настоящее время предлагается рассматривать в рамках биопсихосоциальной модели [3]. В литературе подобный подход больше связывают с лечением ХБС, что, безусловно, является патогенетически обоснованным [72-75]. Для терапии острой боли биопсихосоциальная модель не разработана – исследования по данному вопросу низкого уровня доказательности и немногочисленны [3]. Активно изучаемая в последнее время концепция персонализированной 19 медицины в анестезиологии учитывает влияние генетических особенностей пациентов на эффективность фармакотерапии боли [17,18]. Однако в силу нейрофизиологической сложности процессов формирования болевого ощущения повысить эффективность аналгезии, учитывая только генетические факторы, не представляется возможным [75]. В эти процессы вовлечена и эмоциональноя сфера пациента, поэтому форма его реагирования на болевой стимул индивидуальна. Следовательно, изучение биопсихосоциальной модели лечения острой послеоперационной боли, охватывающей более широкий круг факторов, может иметь существенное практическое значение и в настоящее время является особо актуальной [3]. Таким образом, не смотря на большое количество исследований, проблема эффективности послеоперационной аналгезии остается актуальной. Поскольку боль оказывает влияние не только на комфорт пациента, но и результаты лечения в целом, продолжение исследований в данном направлении имеет прямое практическое значение. В этой связи целесообразным является попытка реализации современной концепции биопсихосоциальной модели послеоперационной боли. 1.2. Биопсихосоциальная модель боли Биопсихосоциальная модель боли была впервые предложена Engel G. в 1977 г. и стала следующим этапом развития после существующей многие годы биомедицинской модели [76]. Суть биомедицинского подхода состоит в том, что боль, как правило, является отражением органического заболевания или повреждения, поэтому восстановление функции пораженного органа должно сопровождаться исчезновением болевых ощущений. При этом сопутствующие признаки заболеваний, такие как эмоциональная нестабильность, нарушение сна и депрессивные расстройства рассматриваются как вторичная реакция на патологический процесс, которая утрачивается с выздоровлением [77]. Такой подход в настоящее время подвергается сомнению, поскольку, как показывает 20 клинический опыт, жалобы пациента не всегда соответствуют тяжести повреждения, а психоэмоциональные расстройства могут предшествовать болезни и влиять на ход лечения. Первая попытка связать психологические и физиологические факторы в единую систему боли была предпринята Мелзаком Р. и Уоллом П. в теории воротного контроля (1965) [8]. Ценность данной теории состояла в осознании роли не только периферических механизмов, но и ЦНС в восприятии болевых ощущений. Безусловно, данная модель несовершенна, однако она дала импульс к развитию новых концепций, учитывающих психологические, поведенческие и социальные факторы [77], из которых наиболее изучаемой в настоящее время является биопсихосоциальная модель. Данная концепция основывается на понимании, что боль – это не только сенсорная модальность, но и субъективный опыт. В общей структуре такого индивидуального опыта можно выделить четыре основных компонента: сенсорно-дискриминативный, когнитивный, аффективный и мотивационный. Сенсорно-дискриминативный компонент определяет способность индивида указать на место повреждения или источник болевых ощущений, а также дать им характеристику. Когнитивный компонент обуславливает оценку условий, при которых произошло повреждение, и сравнение текущей боли с предыдущим «болевым опытом». Аффективный компонент отражает эмоциональную реакцию на повреждение, а мотивационный – направлен на устранение повреждающих факторов [78]. Принятие во внимание только одного или двух компонентов в повседневной практике объясняет причину не всегда успешной диагностики и лечения болевого синдрома. Современного человека невозможно выделить из его окружения, поэтому отношение пациента к боли зависит не только от места и характера повреждения, но и условий, при которых оно произошло. На индивидуальное восприятие боли оказывают влияние пол, возраст, психологическое состояние, генетические особенности, социальные факторы, 21 религия [79-83]. Ощущение боли может сохраняться и поддерживаться, в том числе, и за счет ожидаемых неприятных последствий повреждения, которые часто преувеличиваются, а в ряде случаев чрезмерно драматизируются [74,84]. Индивидуальные стратегии пациента по преодолению трудностей и отношение к проводимому лечению также способны влиять на интенсивность послеоперационной боли, эффективность проводимой терапии в целом [3,74,85]. В соответствии с концепцией биопсихосоциальной модели боль рассматривается как результат динамического взаимодействия биологических, психологических и социальных факторов. Доказано, что скорость приспособительных реакций, а также такие физиологические процессы, как выработка гормонов и активность автономной нервной системы способны меняться под влиянием факторов окружающей среды [86]. В тоже время, биологические факторы могут инициировать, поддерживать и модулировать физические нарушения, психологические переменные влияют на оценку и восприятие внутренних физиологических сигналов [77]. В отличии от биомедицинской модели, делающей акцент на заболевании, биопсихосоциальный подход учитывает взаимное влияние физиологических, психологических и социальных факторов, которое обуславливает формирование индивидуального «болевого фенотипа», определяющего форму реагирования пациента на повреждение. Данный подход разрабатывался для лечения хронического болевого синдрома [75], однако нашел применение и в паллиативной медицине – у онкологических пациентов [72,73,87,88]. Согласно работе George S.Z. и соавт. (2014) депрессивные расстройства и полиморфизмы генов катехол-О- метилтрансферазы (COMT), β2-адренорецептора (ADRB2), 1А-рецептора аргинин-вазопрессина (AVPR1A) и потенциалзависимых калиевых каналов (KCNS1) могут обуславливать различные болевые фенотипы при хронической мышечно-скелетной боли [73]. Ряд исследований, посвященных проблеме болевого синдрома при раке, свидетельствует, что эмоциональный статус, 22 социальные факторы и поддержка со стороны родственников оказывают значительное влияние на эффективность лечения боли у данной категории пациентов и подтверждает важность использования мультидисциплинарного подхода [88-90]. Особую актуальность приобретает применение биопсихосоциальной модели для терапии острой послеоперационной боли. Исследованиями показано, что интенсивность болевого синдрома при сравнимых по травматичности операциях и одинаковом подходе к аналгезии значительно отличается среди пациентов, причем часть из них почти не ощущают боли, а некоторые характеризуют свои ощущения как «нестерпимые» [11,91]. Причинами подобной вариабельности могут служить генетические особенности рецепторного аппарата и ферментных систем, вовлеченных в ноцицепцию, эмоциональный окружающей статус среды. послеоперационной пациентов, Очевидно, боли, её социальные для следует факторы успешной рассматривать, и терапии как факторы острой личностное переживание, возникающее под влиянием физической патологии наряду с фиксацией внимания раздражительностью подтверждает и пациента страхом необходимость на повреждении, перед неэффективной и тревожностью, терапией. целесообразность Это внедрения персонализированного подхода к послеоперационной аналгезии с учетом потребностей каждого конкретного пациента. Именно биопсихосоциальная модель учитывает многокомпонентную природу боли и имеет большое количество преимуществ перед традиционным подходом к обезболиванию. Во-первых, данный подход подразумевает проведение дополнительных бесед с пациентами, что способствует повышению их психологического комфорта во время нахождения в стационаре [72]. Снижение тревоги и страха является важной составляющей лечения боли, поскольку невротические расстройства оказывают влияние не только на интенсивность боли после операции, но и развитие ХБС [10,92]. Во-вторых, учет большего количества факторов, оказывающих влияние на эффективность 23 аналгезии, позволяет на раннем этапе выделять пациентов с повышенным риском нестандартной реакции на различные анальгетики и соответствующим образом проводить профилактические и лечебные мероприятия. Наконец, именно такой подход предполагает развитие «периоперационной медицины боли», при которой осуществляется тесное сотрудничество анестезиолога со смежными специалистами (хирургами, психиатрами, психологами и др.). При этом общей целью является выбор оптимального метода обезболивания в индивидуальном порядке на основании анализа соотношения риск/польза, оценка и динамическое наблюдение за пациентом в течении пред-, интра- и послеоперационного периода, обеспечение комфорта пациента [93]. В таких структурных подразделениях зарубежных клиник, как служба острой боли (Acute Pain Service), лечение болевого синдрома проводится с учетом психологических особенностей и предыдущего «болевого опыта» пациента. Первые подобные отделения были открыты в Германии и США еще в 1985 году [94,95] и с тех пор неоднократно подтвердили свою эффективность [93,96]. Перспективным направлением развития подобных структур состоит во внедрении биопсихосоциальной модели лечения боли с учетом не только психологических, но также генетических факторов и факторов окружающей среды [93]. Таким образом, боль является многомерным субъективным ощущением и для эффективной анальгетической терапии необходим индивидуальный мультидисциплинарный подход, основанный на определении физических, психологических и социальных характеристик пациента, его предыдущего «болевого опыта», а также наблюдении за пациентом в течение всего периоперационного периода. Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека. Поэтому разработка и внедрение индивидуального подхода к обезболивающей терапии с учетом потребностей каждого конкретного пациента является целесообразным, практически ориентированным направлением и приобретает все большую актуальность. 24 1.3. Психологические аспекты послеоперационной боли Психологическое состояние играет существенную роль в формировании болевого синдрома. Известно, что помимо сенсорного боль включает и аффективный компонент, поэтому такие расстройства эмоционального фона, как тревога и депрессия, катастрофизация боли, страх и пессимистический настрой могут оказывать влияние на толерантность к послеоперационной боли. По данным Larson S.L. и соавт. (2004), пациенты с более тяжелыми проявлениями депрессии значительно чаще сообщают о наличии болевых ощущений [97]. Некоторые авторы рассматривают боль в форме единого депрессивно-алгического синдрома [98]. Важным психологическим фактором, оказывающим влияние на восприятие болевых ощущений, является болевой опыт после различных оперативных вмешательств. У пациентов формируется болевой стереотип, своего рода условный рефлекс, пусковым механизмом которого становится любая последующая операция. Купирование послеоперационного болевого синдрома у данной категории пациентов представляет значительные трудности [99]. Кроме того, психологический дистресс, нарушение интра- и интерперсональных отношений могут стать источником самоиндуцированной боли [99,100]. Согласно исследованиям тревожные расстройства могут служить предиктором уровня боли и эффективности аналгезии после различных операций [101,102]. Доказано, что уровень предоперационной тревоги связан с более высокими показателями интенсивности боли после оперативных вмешательств в абдоминальной хирургии, кардиохирургии, при урологической и гинекологической патологии [103-106]. Предоперационный дистресс также может служить предиктором уровня боли после артропластики коленного сустава [107,108]. Уровень предоперационной тревоги и ожидаемых болевых ощущений согласно исследованию Pan P.H. и соавт. (2013) является предиктором интенсивности острой боли после операции кесарево сечение [109]. В свою очередь, предоперационная тревога и сильная боль после 25 операции повышают риск развития послеоперационной тревоги [3], что также негативно сказывается на терапии [110]. Депрессивные расстройства влияют на интенсивность боли в покое и при активизации в раннем послеоперационном периоде [111]. Установлено, что предоперационный уровень тревоги и депрессии демонстрирует положительную корреляцию с интенсивностью боли после операции, а также оказывает влияние на время реабилитации и качество жизни хирургических пациентов [99,112,113]. В роли предиктора сильной боли после операции может выступать не только клинически выраженная депрессия, но и субклиническая форма [112], что свидетельствует о важности учета даже незначительных невротических расстройств. Катастрофизация боли, оцениваемая по одноименной шкале (PCS – Pain Catastrophising Scale), является прогностическим фактором уровня болевого синдрома после различных операций [114-117], в том числе по исправлению воронкообразной грудной клетки, артропластики коленного сустава, а также хирургических вмешательств на сердце [104,118-120]. При операциях на поясничном отделе позвоночника катастрофизация и тревога могут служить не только предиктором уровня боли, но и количества потребляемых наркотических анальгетиков [121]. При этом влияние психологического состояния пациентов высокотравматичных на эффективность вмешательств, как аналгезии урологические после таких операции из люмботомического доступа, изучено не достаточно. Работы по данному вопросу немногочисленны и низкого уровня доказательности [10,105], поэтому продолжение исследований в данном направлении является особо актуальным. Прогнозирование выраженности побочных эффектов (ПЭ) опиоидов также является важной проблемой. Их развитие может вызывать дискомфорт у пациентов, а также удлинять время госпитализации и повышать стоимость лечения [122]. Наличие ПЭ часто является причиной ограничения дозы или даже отмены опиоидов, что еще больше снижает эффективность аналгезии. 26 Обзорная статья Becker D.E. (2010) свидетельствует, что тревожные расстройства обладают высокой прогностической ценностью относительно возникновения послеоперационной тошноты и рвоты [123]. Некоторые исследования подтверждают наличие взаимосвязи между психоэмоциональным состоянием пациента и выраженностью не только гастроинтестинальных, но и центральных ПЭ данной группы препаратов [124]. Дальнейшее изучение взаимосвязи между психологическим статусом и выраженностью ПЭ опиоидов будет способствовать более раннему и точному выделению пациентов группы риска и своевременному проведению необходимых профилактических и лечебных мероприятий. Механизмы влияния психологического состояния на уровень послеоперационной боли до конца не ясны и являются предметом дискуссий. Это может быть связано с изменением функционирования эндогенной модулирующей системы на фоне психоэмоциональных расстройств [118]. Вероятно, данная взаимосвязь возможна вследствие участия в процессах модуляции боли тех структур мозга, рецепторов и нейротрасмиттеров, которые ответственны и за эмоциональную неустойчивость, депрессивно-тревожные расстройства, патологическую реакцию на воздействие стрессовых факторов. В исследованиях показано, что психологический дистресс способен снижать супраспинальный ингибиторный контроль антиноцицептивной системы [125128], а дефицит нисходящих ингибирующих адренергических стимулов обуславливает повышение уровня послеоперационной боли и риска развития ХБС [118]. Поэтому дальнейший поиск взаимосвязи между предоперационным психологическим состоянием и интенсивностью боли после операции имеет существенное научно-практическое значение. Нормализация психологического состояния пациентов может открыть новые возможности не только в вопросах эффективного купирования болевого синдрома, но и успешной терапии в целом. Это связано с тем, что психологическая дизадаптация может оказывать существенное влияние на процессы реабилитации хирургических пациентов [112,129]. Учет 27 психологических факторов при планировании лечебных мероприятий должен стать обязательной мерой, поскольку эмоциональная стабильность является составляющей личностного потенциала пациента, который определяет его возможности по преодолению болезни и восстановлению после операции [130]. Психологический дискомфорт и ажитация имеют большое влияние на скорость заживления ран [131]. Кроме того, как болевой синдром, так и психологические расстройства могут способствовать нарушению сна, вызывая частые ночные пробуждения в послеоперационном периоде [132], а также усиливать негативное отношение к проводимой терапии. Доказано, что бессонница способствует снижению болевого порога и существенно снижает качество жизни пациента во время нахождения в стационаре и после выписки [132]. Ряд исследований свидетельствует о том, что депрессивные расстройства способствуют транзиторному угнетению иммунной системы и удлинению сроков госпитализации [116]. В рандомизированном клиническом исследовании Sadati L. и соавт. (2013) показано, что уменьшение выраженности психоэмоциональных расстройств перед операцией способствует снижению количества послеоперационных осложнений [52]. Таким образом, психологический статус пациента влияет на интенсивность послеоперационной боли, количество потребляемых анальгетиков, частоту возникновения осложнений и ПЭ опиоидов, а также качество жизни хирургических пациентов. Несмотря на то, что оценка эмоциональных расстройств с помощью специальных психодиагностических инструментов недостаточно используется в практической анестезиологии и хирургии, проведенные исследования подтверждают её целесообразность и перспективность дальнейшей разработки данного направления с целью повышения эффективности послеоперационного обезболивания. 28 1.4. Клиническая фармакогенетика и послеоперационная боль Клиническая фармакогенетика – раздел клинической фармакологии и клинической генетики, изучающий генетические особенности пациента, влияющие на фармакологический ответ [133]. Индивидуальный фармакологический ответ зависит от различных факторов, таких как пол, возраст, психологический статус, сопутствующие заболевания, однако 50% неблагоприятных эффектов зависят от генетических особенностей пациентов [133,134]. Одним из наиболее представленных в геноме человека является однонуклеотидный полиморфизм (SNP – single nucleotide polymorphism), который возникает в результате вариаций единичных нуклеотидов в определенных областях генома и обуславливает внутривидовую изменчивость признака [135]. Связь некоторых SNP с низкой эффективностью или токсичностью препаратов свидетельствует о возможном изучении генотипа пациентов с целью выбора вида и оптимальных доз лекарственных средств и, таким образом, улучшении результатов лечения. Так, гены, регулирующие фармакокинетику (ферменты биотрансформации, транспортеры) и фармакодинамику (рецепторы, каналы, элементы сигнальной трансдукции) опиоидов обуславливают вариабельность интенсивности боли после операции, количества потребляемых наркотических анальгетиков, а также выраженности ПЭ данной группы препаратов, в связи с чем представляют большой интерес для исследователей [16,17,20,136-138]. Установлено, что на болевую чувствительность могут оказывать влияние ген серотониновых рецепторов (HTR-1A), GTP-циклогидролазы 1 (GCH1), ваннилоидного рецептора 1 (TRPV1), рецептора меланокортина 1 (MC1R), Р-гликопротеина 1 (MDR1) [139144]. Касательно эффективности опиоидной терапии наиболее изучаемыми являются гены цитохрома Р-450 (CYP2D6), катехол-О-метилтрансферазы (COMT) и µ1-рецептора (OPRM1). 29 Цитохром Р-450 биотрансформации, представляет которые собой осуществляют группу метаболизм ферментов около 25% используемых препаратов и других ксенобиотиков [133,145]. Представитель одного из подсемейств цитохрома Р-450, изофермент CYP2D6, участвует в метаболизме многих лекарств, в том числе НА [133]. Ген, кодирующий CYP2D6, имеет около 100 полиморфных вариантов и обуславливает значительные индивидуальные различия в скорости метаболизма опиоидов и эффективности аналгетической терапи [134,146]. Фенотипически выделяют экстенсивных метаболайзеров – с нормальной скоростью метаболизма лекарственных средств, медленных метаболайзеров – со сниженной скоростью и ультрабыстрых – с повышенной скоростью метаболизма препаратов. В европейских популяциях частота встречаемости медленных метаболайзеров составляет от 8 до 10%, ультрабыстрых – от 3 до 5% [3]. Показано, что ультрабыстрым метаболайзерам для достижения адекватной аналгезии после операции требуются меньшие дозы морфина по сравнению с остальными пациентами [147]. Полиморфизм гена CYP2D6 может иметь клиническое значение и при применении кодеина и трамадола, так как их метаболиты — морфин и О-десметилтрамадол обладают высокой анальгетической активностью [148,149]. Более быстрый метаболизм указанных препаратов способствует раннему наступлению аналгезии, однако, наряду с этим, повышает риск развития ПЭ опиоидов. Ассоциация по внедрению фармакогенетических достижений США (CPIC – Clinical Pharmacogenetics Implementation Consortium) в 2012 году выпустила рекомендации по применению кодеина у пациентов с различными видами полиморфизма гена CYP2D6 в связи с возможным развитием токсических эффектов у ультрабыстрых метаболайзеров [150]. Это подтверждает важность учета генетических особенностей пациентов при применении данной группы препаратов. 30 Модуляция боли в центральной нервной системе тесно связана с уровнем адреналина, норадреналина и дофамина. Содержание данных медиаторов в синапсах ЦНС во многом определяется деятельностью ферментов, метаболизирующих катехоламины, в частности, катехол-О-метилтрансферазы. Однонуклеотидный полиморфизм 1947G>A гена (rs4680) COMT сопровождается заменой валина на метионин в 158 позиции белковой структуры фермента и значительным снижением его активности. У носителей генотипа А1947А активность COMT в 3-4 раза ниже по сравнению с носителями генотипов G1947A и G1947G [21]. Данные о влиянии SNP COMT 1947G>A на эффективность послеоперационной аналгезии НА противоречивы, но этот вопрос продолжает интенсивно изучаться [19,21,151,152]. носителям генотипа COMT А1947А В исследованиях для показано, достижения что адекватного обезболивания в послеоперационном периоде требуются меньшие дозы морфина по сравнению с носителями G1947A и G1947G [153]. Аналогичные результаты получены при лечении онкологической боли и хронической боли в спине [152,154]. Указанные эффекты полиморфизма COMT 1947G>A могут иметь следующее объяснение. Низкая активность фермента у носителей генотипа COMT А1947А приводит к высокому содержанию катехоламинов в системах, ответственных за модуляцию боли в ЦНС, их активации и усилению нисходящего ингибирующего влияния на восприятие ноцицептивных сигналов [155]. Кроме того существует мнение, что хроническая гиперактивация адренергической системы сопровождается повышением плотности опиоидных µ1-рецепторов [152], таким образом увеличивая мишень для действия НА. С другой стороны, существуют работы, свидетельствующие о повышенной чувствительности к болевым стимулам у здоровых добровольцев с генотипом COMT А1947А [156], а также большей восприимчивости носителей того же генотипа к боли, вызванной температурным воздействием [157]. Согласно исследованию Loggia M. L. (2011) у пациентов с генотипом COMT А1947А при 31 проведении функциональной МРТ наблюдалась более выраженная активация антиноцицептивных регионов мозга в ответ на повторный болевой раздражитель, что, предположительно, свидетельствует об их повышенной чувствительности к боли [158]. Подобные противоречивые результаты исследований могут объясняться одновременным влиянием на восприятие боли целого ряда генов и полиморфизмов, наследуемых сцеплено с SNP COMT 1947G>A в виде гаплотипа [159]. Кроме того, большую роль могут играть различный дизайн проведенных исследований, используемые шкалы оценки боли, виды НА и неучтенные социокультурные факторы [160]. Уровень катехоламинов в ЦНС может определять и психологическое состояние пациентов, которое, в свою очередь, влияет на восприятие боли [25,80]. Несмотря на то, что однозначные результаты, подтверждающие связь SNP COMT 1947G>A с эмоциональными расстройствами, получены не были, этот вопрос продолжает активно исследоваться. Это может быть связано с участием в процессах метаболизма катехоламинов и других ферментов, например, моноаминооксидазы [161]. Кроме того, мощное воздействие на психологическое состояние оказывают социокультурные факторы [162]. Это еще раз подчеркивает взаимосвязь болевых ощущений, невротических расстройств и генетических факторов, а также необходимость изучения боли в рамках биопсихосоциальной модели, которая учитывает индивидуальные особенности пациента и влияние окружающей среды [3]. Отмечается взаимосвязь SNP COMT 1947G>A c выраженностью ПЭ опиоидов. После абдоминальных гистерэктомий и простатэктомий на фоне аналгезии опиоидами в группе носителей G1947G уровень тошноты был выше по сравнению с носителями G1947A и A1947A [21]. Аналогичное влияние данного полиморфизма на проявление тошноты и рвоты отмечено у онкологических больных, длительно получающих наркотические аналгетики [163]. Влияние SNP COMT 1947G>A как на уровень боли, так и на выраженность ПЭ опиоидов свидетельствует, что данный полиморфизм может 32 играть существенную роль в индивидуальных различиях фармакологических эффектов НА и является перспективным для разработки персонализированного подхода к послеоперационной аналгезии. Различная эффективность НА может быть связана с наличием точечных мутаций в гене, кодирующем структуру опиоидного µ1-рецептора (OPRM1) – основной мишени для действия данной группы препаратов [21]. µ1-опиоидный рецептор относится к родопсиновому семейству ассоциированных с G-белком рецепторов и состоит из экстрацеллюлярной N-терминали, 7 трансмембранных спиралей, трех экстра- и интрацеллюлярных петель и интрацеллюлярной Стерминали [16]. Ген OPRM1 человека находится в локусе шестой хромосомы (6q24-q25) и насчитывает около ста полиморфизмов [16]. Наиболее изучаемым является SNP 118А>G (rs1799971), приводящий к замене аспарагина на аспартат в позиции 40 белковой структуры (Asn40Asp) и утрате Nгликозилированного участка экстрацеллюлярной терминали рецепторов [164]. В данном полиморфизме аллель А является природным (или «диким»), а аллель G – мутантным, и именно с его наличием связано изменение структуры и функции µ 1-рецептора [16]. Показано, что SNP 118А>G может приводить к различным последствиям: снижению экспрессии гена, изменению числа рецепторов [165,166], их аффинитета как к экзо-, так и эндогенным опиатам [167-170] и таким образом оказывать влияние на эффективность аналгезии НА [16]. Через µ1-рецептор реализуется действие не только НА, но и эндогенных опиоидных пептидов, поэтому мутация OPRM1 118A>G имеет более широкое значение, в том числе, может быть связана с изменениями психологического состояния пациента и реакции на стресс [166,171,172]. У гомозиготных носителей OPRM1 G118G, число которых в разных странах составляет от 0,8% до 48 % общей популяции [16], отмечается увеличение потребности в морфине после различных операций [173-175]. В работе отечественных исследователей показано, что у пациентов с генотипом OPRM1 G118G наблюдался повышенный расход НА интраоперационно, позже 33 выполнялась экстубация, чаще регистрировались такие послеоперационные осложнения, как тошнота и рвота, и отмечался более высокий уровень боли в раннем послеоперационном периоде [20]. Согласно результатам мета-анализа Walter C. и Lötsch J. (2009), носителям мутантного аллеля G требуются более высокие дозы опиоидов для эффективного контроля послеоперационной боли [176]. Подобные результаты получены и при лечении хронической боли различной локализации с помощью НА [117,178]. В тоже время, ряд исследований свидетельствует об отсутствии связи SNP OPRM1 118А>G с эффективностью аналгезии после операции и при лечении боли у онкологических пациентов [179,180]. Данные о влиянии SNP OPRM1 118А>G на ПЭ опиоидов неоднозначны. Ряд работ свидетельствует о слабой ассоциации полиморфизма с возникновением тошноты, рвоты в раннем послеоперационном периоде на фоне применения морфина, оксикодона и фентанила, а также при лечении хронической боли с помощью НА [122,173,177,181]. С другой стороны, метаанализ Walter C., Lоtsch J. (2009) показал слабый протективный эффект генотипа OPRM1 G118G относительно возникновения тошноты [176], а некоторые исследования – повышенный риск развития данного ПЭ у пациентов с генотипом OPRM1 А118А [21]. Влияние полиморфизма на уровень респираторной депрессии вследствие приема опиоидов исследованиями не подтвердилось [173,177,182]. Важно отметить, что боль – понятие сложное и многокомпонентное и скорее является результатом взаимодействия нескольких генов и их продуктов, поэтому актуальным в настоящее время является изучение влияния на аналгезию и ПЭ опиоидов различных комбинаций полиморфизмов генов OPRM1 118А>G и COMT 1947G>A [21,183]. Показано, что при лечении онкологической боли у пациентов с генотипом OPRM1 A118A и COMT A1947A потребность в морфине была существенно ниже, по сравнению с другими комбинациями [153,184]. 34 Таким образом, полиморфизмы генов COMT и OPRM1 могут оказывать существенное влияние на эффективность обезболивания опиоидами. Изучение взаимосвязи между генетическими особенностями, психоэмоциональным состоянием пациентов и интенсивностью боли после операции будет способствовать более глубокому пониманию молекулярных механизмов ноцицепции, а также повышению эффективности и безопасности методов аналгезии, основанных на применении опиоидов. Проведенный анализ литературы свидетельствует, что прогнозирование эффективности обезболивания НА с помощью оценки генетических и психологических факторов не разработано в достаточной мере, позволяющей рутинно использовать его в практической работе. Однако, очевидно, что данное направление перспективно и является первым шагом в понимании послеоперационной боли в рамках биопсихосоциальной модели и разработке ее персонализированного лечения. 35 ГЛАВА 2 МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ 2.1. Дизайн исследования и клиническая характеристика пациентов Исследование проводилось с 26.02.2013 по 12.07.2013 гг. на клинической базе кафедры медицины неотложных состояний и анестезиологии (зав.кафедрой доцент Бабанин А.А.) ГУ «КГМУ им. С.И. Георгиевского» (ректор – профессор Бабанин А.А.). В исследование включены пациенты, находившиеся на лечении в урологическом отделении Крымского республиканского учреждения «Крымское территориальное медицинское объединение «Университетская клиника», а также хирургическом отделении учебно-научно-лечебного комплекса ГУ «КГМУ им. С.И. Георгиевского». Дизайн исследования. Открытое обсервационное нерандомизированное когортное клиническое исследование, проверяющее рабочую гипотезу. Проверяемая рабочая гипотеза. На эффективность послеоперационной аналгезии с помощью опиоидов оказывают влияние уровень предоперационной тревоги и депрессии, а также генетические факторы пациентов, в частности однонуклеотидные полиморфизмы генов OPRM1 и COMT. Критерии включения пациентов в исследование. Выполнение планового объемного оперативного вмешательства на почке и верхней трети мочеточника из люмботомического доступа; согласие пациента сотрудничать; понимание смысла предлагаемого опросника для оценки интенсивности боли и выраженности побочных эффектов опиоидов. Критерии исключения пациентов из исследования. Физический статус пациента по ASA IV-V; применение регионарных блокад с целью на Ретроспективно периоперационного обезболивания. Принцип распределения пациентов группы. в зависимости от уровня максимального болевого синдрома в первые сутки после 36 операции – боль <6 баллов и боль ≥6 баллов. Ретроспективно по показателям шкалы HADS – 1 группа – норма (0-7 баллов), 2 группа – субклинически выраженная тревога/депрессия (8-10 баллов), 3 группа – клинически выраженная тревога/депрессия ( ≥11 баллов). По показателям шкалы PHQ-9 – 1 группа – отсутствие симптомов/минимальные проявления депрессии (0-4 балла), 2 группа – мягкая и умеренная депрессия (5-14 баллов) и 3 группа – умеренная и тяжелая депрессия (≥15). Для оценки прогностической значимости указанных психологических шкал пациенты ретроспективно были разделены следующим образом: шкала HADSтревога/депрессия – норма (0-7 баллов) и наличие проявлений (≥ 8 баллов), шкала PHQ-9 – норма (1-4 балла) и наличие проявлений (≥ 5 баллов). Ретроспективно в зависимости от вида генотипа полиморфизма гена OPRM1 – группа A118A, группа A118G+G118G и гена COMT – группа A1947A, группа G1947A и группа G1947G. В исследование включено 100 пациентов. Общая характеристика пациентов представлена в таблице 2.1. Физикальный статус пациентов оценивали по шкале POSSUM (The Physiologic and Operative Severity Score for the enUmeration of Mortality and Morbidity) [185]. Схема анестезиологического пособия была одинаковой у всех пациентов и включала преднаркозную подготовку, которая подразумевала назначение диазепама в дозе 10 мг в/м перед сном накануне операции. Для премедикации за 40 минут до операции пациентам в/м вводился атропин в дозе 0,01 мг/кг, димедрол – 10 мг, промедол – 20 мг. Индукцию проводили внутривенным введением сибазона – 10мг, фентанила 0,1-0,2 мг, атракурия – 5 мг, ступенчатым введением пропофола по 40 мг каждые 10 секунд до появления клинических признаков анестезии (150-200 мг), кетамина 1-2 мг/кг. Интубация трахеи выполнялась через 30-60 секунд после введения сукцинилхолина в дозе 1-1,5 мг/кг. На начальных этапах индукции производилась денитрогенизация с помощью 100% кислорода в течение 4-10 минут. ИВЛ проводилась смесью воздуха, кислорода и севофлюрана методом низкопоточной анестезии с 37 дыхательным объемом 6-7 мл/кг. Величина МАК севофлурана выставлялась в соответствии с возрастом пациента. Интраоперационная аналгезия осуществлялась с помощью фентанила в дозе 0,01-0,015 мг/кг. Миорелаксация поддерживалась введением атракурия в дозе 0,3-0,6 мг/кг. Таблица 2.1 – Общая характеристика пациентов, включенных в исследование [*Me (QI-QIII)] Возраст, годы 59 (52-66)* Пол, М/Ж 47/53 POSSUM, баллы 15 (13,5-16)* Длительность операции, мин 75 (60-90)* Длительность наркоза, мин 100 (85-122,5)* Длительность ИВЛ после операции, мин 15 (10-20)* Общая доза фентанила во время операции, мг 0,6 (0,5-0,8)* Нефрэктомия, нефроуретерэктомия, n 36 Пиелолитотомия, n 45 Уретеролитотомия, n 9 Резекция почки, n 6 Другие, n 4 Послеоперационная аналгезия в течение первых суток после операции выполнялась по стандартной схеме – с помощью дробного внутримышечного введения тримеперидина (промедола) по 20 мг 5 раз в сутки до общей дозы 100 мг. При недостаточном обезболивании дополнительно применялись НПВС (кеторолак по 30 мг). 2.2. Оценка уровня предоперационной тревоги и депрессии Оценка уровня предоперационной тревоги и депрессии осуществлялась при поступлении пациента в стационар с использованием госпитальной шкалы тревоги и депрессии (HADS – Hospital Anxiety Depression Scale), 38 рекомендуемой для скрининга и определения степени тяжести психологического дистресса среди пациентов [186,187]. HADS включает две субшкалы: «тревога» и «депрессия», состоящих из семи утверждений. Каждому из утверждений соответствует 4 варианта ответа, отражающих градацию выраженности признака по нарастанию тяжести симптома от 0 до 3. При интерпретации результатов учитывается суммарный показатель по каждой субшкале: норма (0-7 баллов), субклинически выраженная тревога/депрессия (8-10 баллов), клинически выраженная тревога/депрессия (≥11 баллов). Предоперационной уровень депрессии дополнительно оценивался с помощью шкалы оценки самочувствия (PHQ-9 – Patient Health Questionnaire). Шкала состоит из 9 вопросов, в каждом из которых пациент должен отметить частоту возникновения того или иного симптома – от минимальной (0 баллов) до максимальной (3 балла). Интерпретация результатов осуществляется, исходя из полученной суммы баллов: отсутствие депрессии (0-4 балла), мягкая депрессия (5-9 баллов), , умеренная депрессия (10-14 баллов), умеренно-тяжелая депрессия (15-19 баллов), тяжелая депрессия (20-27 баллов) [188]. Допускается применение упрощенной схемы баллов: ≤4 – отсутствие симптомов, 5-14 баллов – мягкая/умеренная депрессия депрессия, ≥15 баллов – умеренно-тяжелая/тяжелая (www.emoryhealthcare.org/heart-disease-prevention/pdfs/phq-9- form.pdf). Согласно некоторым данным, оценка психологического статуса накануне операции затруднена, поскольку учет всех факторов требует применения объемных шкал и опросников и связан с высокой трудоемкостью диагностического процесса [189]. Используемые в настоящей работе шкалы не только обладают высокими показателями чувствительности и специфичности, но также просты в применении и легко воспринимаются пациентами разных возрастных групп [186,188,190]. 39 2.3 Оценка показателей интенсивности боли и выраженности побочных эффектов опиоидов после операции Оценка интенсивности боли и выраженности побочных эффектов опиоидов проводилась при помощи анкеты, которая была разработана для проведения интернационального многоцентрового исследования «Pain-Out» (www.painout.eu), с разрешения организаторов данного испытания. Каждой анкете присваивался индивидуальный код в качестве гарантии конфиденциальности полученной информации и нераспространении ее врачам и другим медицинским работникам, принимавшим участие в проводимой терапии. В данной анкете пациенту предлагается ответить на следующие вопросы, касающиеся интенсивности боли: максимальная (1) и минимальная боль в первые сутки после операции (2), длительность максимального болевого синдрома в первые сутки после операции (3), в какой мере боль мешала двигаться в постели (4), глубоко дышать или кашлять (5), спать (6), насколько уменьшились послеоперационные боли при аналгетической терапии (7), была ли потребность в большем количестве обезболивающих средств (8), удовлетворенность результатами обезболивания (9), насколько остро в связи с болью пациенты чувствовали тревогу (10), беспомощность (11). Показатели 1,2,4-6,9-11 оценивались с использованием ЦРШ в баллах от 0 до 10; показатели 3,7 выражены в %; показатель 8 оценивался на основании ответа пациента «да»/«нет». Выраженность побочных эффектов опиоидов в данной анкете оценивалась с помощью ЦРШ в баллах от 0 до 10: уровень тошноты, сонливости, зуда и головокружения. Дополнительно пациентом отмечалось наличие/отсутствие рвоты. С целью контроля функций внешнего дыхания в течение первых суток после операции проводилось мониторирование насыщения гемоглобина крови кислородом (SpO2) и частоты дыхательных движений (ЧДД). Через 6-8 часов 40 после операции проводилась оценка степени седации с помощью шкалы Рамсея (RSS – Ramsay Sedation Scale), являющейся наиболее приемлемой и часто используемой в отделениях интенсивной терапии [49]. 2.4. Определение генотипов полиморфизма гена OPRM1 118A>G и COMT 1947 G>A Материалом для исследования служили образцы ДНК, выделенные из ядросодержащих клеток периферической крови пациентов. Венозная кровь в количестве 3 мл помещалась в вакуумные пластиковые пробирки типа «Vacuette» объемом 4,0 мл с добавленным в качестве антикоагулянта 3,2% цитратом натрия. Для выполнения анализа ДНК собранный материал отправлялся в Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины, лабораторию эпигенетики, г. Киев (www.geront.kiev.ua/sba/epigenetic.htm). Исследование осуществлялось с согласия пациентов, соответствовало этическим принципам, предъявляемым Хельсинской декларацией Всемирной Медицинской Ассоциации (WMA – World Medical Assotiation Declaration of Helsinki) [191]. Выделение ДНК из венозной крови проводилось стандартным методом с использованием протеиназы К, фенола и хлороформа. Качество препаратов ДНК определяли по спектральным характеристикам и методом электрофореза в 0,6% агарозном геле и на УФ-транилюминаторе ЕСХ -15L фирмы «Vilber Lourmat» (Франция). Детекция однонуклеотидных замен (SNPs OPRM1 118A>G и COMT 1947G>A) выполнялась методом полимеразной цепной реакции (ПЦР) в реальном времени. С этой целью проводили амплификацию геномных последовательностей в автоматическом режиме на термоциклере "Rotor Gene" Corbett (Австралия). Пробирки с реакционной смесью помещали в амплификатор и в соответствии с видом последовательностей, которые амплифицируются, 41 использовали различные режимы проведения стадий полимеразной цепной реакции: денатурации ампликона и синтеза. После 30 циклов амплификации образцы выдерживали в течение 10 минут при температуре 70 °С и охлаждали при комнатной температуре. Последовательность экзона 1 гена OPRM1 амплифицировалась с использованием специфических фирменных зондов («Applied Biosystems», США) и праймеров: F – 5-GGTCAACTTGTCCCACTTAGATCGC-3, R – 5-AATCACATACATGACCAGGAAGTTT-3. ПЦР проходила 30 циклов в следующем режиме: денатурация ДНК – 30 с при 94 °С, отжиг праймеров – 30 с при 55 °С, элонгация – 30 с при 72 °С. Последовательность экзона 4 гена амплифицировалась COMT с использованием специфических фирменных зондов («Applied Biosystems», США) и праймеров: F – 5-CCCAGCGGCTGGTGGAT-3, R – 5-AACGGGTCAGGCATGCA-3. ПЦР проходила по следующей схеме: дополнительная денатурация – 5 минут при 94 °С, 2 цикла – денатурация ДНК – 30 с при 94 °С, отжиг праймеров – 30 с при 56 °С, элонгация – 30 с при 72 °С, 5 циклов – денатурация ДНК – 30 с при 94 °С, отжиг праймеров – 30 с при 53 °С, элонгация – 30 с при 72 °С, 23 цикла – денатурация ДНК – 30 с при 94 °С, отжиг праймеров – 30 с при 51 °С, элонгация – 30 с при 72 °С, финальная элонгация 7 минут при 72 °С. Продукты амплификации анализировали с помощью детекции флуоресценции в реальном времени (термоциклер "Rotor Gene" Corbett, программа Rotor-Gene Q 6plex Priority Package Plus, Австралия). Успешной считали амплификацию гибридизованного зонда, если кривая амплификации выходила в логарифмическую фазу до 30 цикла амплификации. 42 Для гетерозигот наблюдали одновременный выход в логарифмическую фазу кривых амплификации обоих зондов (рисунок 2.1, 2.2). Рисунок 2.1 – Анализ образцов на определение вида генотипа полиморфизма 118A>G гена OPRM1. На основании полученных данных определяли вид генотипа полиморфизма 118A>G гена OPRM1 у каждого пациента: А118А – норма/«wild-type», A118G – гетерозиготы, G118G – гомозиготы/«mutant type». Аналогичным образом у пациентов определялись виды генотипов полиморфизма 1947G>A гена COMT: АА – гомозиготы/«mutant type», GA – гетерозиготы и GG – норма/гомозиготы. В исследуемой выборке пациентов Республики Крым проведен анализ соотношения полученных частот генотипов изучаемых полиморфизмов (SNP 118A>G гена OPRM1 и 1947G>A гена COMT) и его соответствия идеальной популяции по закону Харди-Вайнберга, используя формулу [21,192]: p2 + 2pq + q2 = 1 (2.3), 43 где p – частота одного аллеля (А), q – частота другого аллеля (G). Также расчеты проводились с применением он-лайн энциклопедии для эпидемиологических генетических исследований (The Online Encyclopedia for Genetic Epidemiology studies, www.oege.org) [192]. Рисунок 2.2 – Анализ образцов на определение вида генотипа полиморфизма 1947G>A гена COMT. 2.5. Методика расчета прогностической ценности психологических шкал и генотипирования, а также чувствительности и специфичности комбинированного теста Чувствительность и специфичность психологических шкал и генотипирования относительно сильной боли после операции и возникновения 44 ПЭ опиоидов рассчитывались по общепринятым формулам [193]. Зависимость количества верно классифицированных положительных примеров (чувствительность) от количества неверно классифицированных отрицательных примеров (100-специфичность) анализировалась с помощью построения ROCкривых (ROC – Receiver Operator Characteristic). Сравнение диагностических методов между собой проводилось на основе расчета площади под каждой ROC-кривой (AUC – Area Under Curve). Пост-тестовая вероятность заболевания (post-test probability) и отношение правдоподобия (Likelihood ratio – LR+) для положительного результата теста вычислялись с помощью стандартных формул [194], а также с использованием электронного ресурса – центра доказательной медицины г. Торонто Канадского института по исследованию здоровья (CIHR – Canadian Institute of Health Research, www.ktclearinghouse.ca). Произведен расчет позитивной прогностической ценности метода (PPV – Positive predictive value) по формуле, основанной на теореме Байеса [194]: PPV = SE × prevalence × 100 % SE × prevalence + (1 − SP ) × (1 − prevalence ) (2.1), где SE – чувствительность метода, prevalence – распространенность заболевания, SP – специфичность метода. Расчет негативной прогностической ценности метода (NPV – Negative predictive value) проводили по формуле, основанной на теореме Байеса [194]: NPV = SP × (1 − prevalence ) × 100 % (1 − SE ) × prevalence + SP × (1 − prevalence ) (2.2), где SE – чувствительность метода, prevalence – распространенность заболевания, SP – специфичность метода. Чувствительность и специфичность для комбинированного теста вычислялись согласно двум правилам: «and rule» и «or rule». В соответствии с первым правилом, вычисления проводятся исходя из следующего принципа: 45 если оба теста положительные, комбинированный тест считается положительным и если один или оба теста отрицательные, комбинированный тест считается отрицательным. Второе правило исходит из другого принципа: если один или оба теста положительные, комбинированный тест считается положительным и если оба теста отрицательные, комбинированный тест является отрицательным. [195, 196]. Оценка влияния различных признаков на интенсивность боли после операции, а также развитие ПЭ опиоидов проводилась с помощью метода логистической регрессии с использованием программы MedCalc 13. 2.6. Статистические методы исследования Статистическую обработку данных проводили при помощи программы STATISTICA 6.0 согласно руководству В. Боровикова (2003) [197], MedStat 4 и MedCalc 13. Проверка распределения на нормальность производилась с помощью критерия Шапиро-Уилка. Поскольку полученные данные не подчинялись нормальному распределению (p<0,05), использовали непараметрические критерии. Для ориентировочной оценки различий между независимыми выборками использовали непараметрический однофакторный дисперсионный анализ (ANOVA Kruskal-Wallis). При сравнении показателей между разными группами (независимые выборки) использовали U-критерий Mann-Whitney. Наличие связи между отдельными величинами оценивали методом ранговой корреляции Spearman. Частоту признаков между группами оценивали при помощи критерия χ2 Pearson. В случае, если частота появления признака была менее 10, использовали поправку Yates. Рассчитывали также относительный риск (RR – Relative risk) возникновения неблагоприятного события, отношение шансов (OR – odds ratio) наступления неблагоприятного события (развитие сильной боли после операции, побочных эффектов опиоидов). Для оценки максимальной боли в первые сутки после операции 46 применялись методы вариационной статистики: определялся размах вариации (R), среднее значение и стандартное отклонение (M±σ), коэффициент вариации (V). Все данные представлены в виде Me – медианы, в скобках даны значения I и III квартилей (QI-QIII), либо в виде M±m – среднего значения и стандартного отклонения. В отдельных случаях даны 95% доверительные интервалы (ДИ). Различия считали статистически значимыми при p<0,05. 47 ГЛАВА 3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Эффективность аналгезии после операций на почке и верхней трети мочеточника с помощью µ-агониста тримеперидина Задачей данного раздела является оценка эффективности действия тримеперидина среди обследуемых пациентов. В его основу положены наблюдения за 100 пациентами, которые поступили для планового оперативного лечения заболеваний почек и верхней трети мочеточника. Изучение показателей послеоперационной боли проводилось с помощью опросника Pain-Out, в котором пациенту предлагается ответить на следующие вопросы: максимальная (1) и минимальная боль в первые сутки после операции (2), длительность максимального болевого синдрома в первые сутки после операции (3), в какой мере боль мешала двигаться в постели (4), глубоко дышать или кашлять (5), спать (6), насколько уменьшились послеоперационные боли при аналгетической терапии (7), была ли потребность в большем количестве обезболивающих средств (8), удовлетворенность результатами обезболивания (9), насколько остро в связи с болью пациенты испытывали тревогу (10) и беспомощность (11). Медианные значения показателей 1-7 и 9-11 приведены в таблице 3.1. Из представленной таблицы видно, что медианное значение максимального уровня боли в первые сутки после операции превышает пороговую величину (3-4 балла). При этом боль >3 баллов испытывали 88% пациентов, >4 баллов – 81% пациентов, ≥6 баллов – 62% пациентов и 15% пациентов оценили интенсивность болевого синдрома в 10 баллов, что равносильно «нестерпимой» боли и является недопустимым с позиции ранней реабилитации пациентов после операции. При сравнении максимального болевого синдрома пациентов с условной средней величиной 4 балла (порог адекватности аналгезии), получены достоверные различия (p<0,0001). 48 Таблица 3.1 – Показатели интенсивности боли (баллы) в первые сутки после операции у обследованных пациентов Вопрос 1 2 3* 4 5 6 7* 9 10 11 Me 7 2 40 7 7 5 70 9 3 4,5 5-9 1-3,5 20-60 4,5-9 3-8 2-7,5 50-100 7-10 0-6 1,5-7 QI-QIII Примечание. * – показатели выражены в %. В ходе настоящего исследования получены результаты, свидетельствующие, что неудовлетворительное качество послеоперационной аналгезии у обследованных пациентов может быть связано с выраженными различиями индивидуальной реакции на данную группу препаратов (рисунок 3.1). Несмотря на интраоперационное обезболивания, одинаковую количество отмечается тяжесть фентанила, разный ответ проведенных схему операций, послеоперационного пациентов на аналгезию тримеперидином. Показатели вариабельности болевого синдрома составили: размах вариации (R) – 10 баллов, среднее значение боли и стандартное отклонение (M±σ) – 6,5±2,6 баллов, коэффициент вариации (V) – 40,3%. Минимальную боль после операции, превышающую 3 балла (пороговая величина адекватной аналгезии в покое), испытывали 25% пациентов, превышающую 4 балла (пороговая величина адекватной аналгезии при движении) – 11% пациентов. 7% пациентов оценили минимальную боль в 6 и более баллов. Наиболее высокая интенсивность минимальной боли составила 9 баллов у 3% пациентов. При этом вариабельность минимальной боли также была высокой, V=88%. 49 Время, в течение которого пациент испытывал сильную боль в первые сутки после операции, составило ≥50% у 39% пациентов. 2% пациентов отметили непрекращающуюся сильную боль в течение первых суток (длительность 100%). 20 18 Число наблюдений 16 14 12 10 8 6 4 2 0 0 1 2 3 4 5 6 7 8 9 10 Максимальная боль в 1 сутки после операции, баллы Рисунок 3.1 – Распределение пациентов по уровню максимальной боли в первые сутки после операции. Показатель, в какой мере боль мешает поворачиваться в постели, у 65% пациентов составил ≥6 баллов. Показатели, в какой мере боль мешает глубоко дышать/кашлять и спать, составили ≥6 баллов у 59% и 44% пациентов соответственно. Все три показателя показали высокую вариабельность среди пациентов, V составил 44%, 52% и 68% соответственно. Интенсивность боли после применяемой терапии снижалась на 90-100% у 36% пациентов. У 55% пациентов боль снижалась на 40-80%, у 9% пациентов на фоне использования тримеперидина болевой синдром уменьшался на 30% и менее, что свидетельствует о недостаточном уровне аналгезии. Потребность в дополнительном обезболивании выразили 22% пациентов. 50 Тревога, связанная с послеоперационной болью, в различной степени выраженности наблюдалась у 69% пациентов. При этом высокий уровень тревоги (≥8 баллов) обнаружен у 15% пациентов, средний (3-7 баллов) – у 37% пациентов и низкий (1-2 балла) – у 17% пациентов. 31% пациентов не отметили наличие тревожных симптомов (0 баллов). Чувство беспомощности, вызванное болевыми ощущениями, в той или иной степени обнаружено у 81% пациентов. Острую беспомощность (8-10 баллов) ощущали 23% пациентов, среднюю (3-7 баллов) – 42% и слабовыраженную (1-2 балла) – 16% пациентов. Результаты проведенного исследования показали, что интенсивность болевого синдрома после операции связана с эмоциональным фоном пациентов в раннем послеоперационном периоде. Так, нами обнаружена прямая умеренная и высокая корреляция между уровнем максимальной и минимальной боли (1,2), длительностью сильной боли (3), показателями, в какой мере боль мешает двигаться в постели (4), глубоко дышать/кашлять (5), спать (6) и уровнем тревоги и беспомощности, испытываемых пациентами в первые сутки после оперативного вмешательства (таблица 3.2). Таблица 3.2 – Корреляция между показателями интенсивности боли и уровнем послеоперационной тревоги и беспомощности Показатель Тревога 1 2 3 R=0,45; R=0,55; p<0,001 p<0,0001 p<0,0001 p<0,003 R=0,56; R=0,43; Беспомощность p<0,0001 p<0,002 R=0,64; 4 R=0,42; R=0,67; R=0,47; p<0,0001 p<0,001 5 R=0,57; 6 R=0,44; p<0,0001 p<0,002 R=0,53; R=0,71; p<0,0001 p<0,0001 51 В целом, большое количество пациентов были удовлетворены результатами послеоперационного обезболивания. Проводимую терапию оценили от 6 до 9 баллов 49% пациентов. Максимальную оценку (10 баллов) дали 39% пациентов. 12% пациентов – в меньшей степени удовлетворены проводимой терапией (оценка ≤5 баллов). Самая низкая удовлетворенность обезболиванием наблюдалась у 4% пациентов (2-3 балла). Таким образом, полученные данные свидетельствуют о том, что внутримышечное введение фиксированных доз опиоидов (тримеперидина) не обеспечивает адекватного послеоперационного обезболивания после операций на почке и верхней трети мочеточника, выполняемых из люмботомического доступа. В раннем послеоперационном периоде среднее значение уровня максимальной боли превышает критический порог – 3 балла в покое и 4 балла при движении. Показатели, в какой мере боль мешает двигаться в постели, глубоко дышать и спать также превышают допустимый уровень. Кроме того, согласно проведенному исследованию, показатели интенсивности болевого синдрома после операции демонстрируют прямую умеренную и высокую корреляцию с такими эмоциональными расстройствами в послеоперационном периоде, как тревога и беспомощность. Несмотря на одинаковую схему интра- и послеоперационного обезболивания, характер и длительность хирургических вмешательств, показатели интенсивности боли после операции подвержены значительной вариабельности среди пациентов (V=40,3-88%). Это вынуждает исследователей искать дополнительные причины подобных индивидуальных различий, в роли которых могут выступать психологические и генетические особенности пациентов. 52 3.2. Влияние уровня предоперационной тревоги и депрессии на интенсивность боли после операции Согласно одной из задач настоящего исследования – оценки влияния предоперационного психологического состояния пациентов на интенсивность боли после операции, мы разделили пациентов на группы с интенсивностью боли ≥6 баллов и <6 баллов (таблица 3.3). Таблица 3.3 – Клиническая характеристика обследованных пациентов Боль ≥6 баллов Боль <6 баллов 62 38 26/36 21/17 Возраст, годы* 58 (48-66) 39 (52-65) POSSUM, баллы* 15 (14-17) 15 (13-16) Длительность операции, мин* 75 (60-95) 80 (55-90) 100 (85-120) 110 (85-125) Нефрэктомии/нефруретерэктомии 21 15 Пиелолитотомии 31 12 Уретеролитотомии 4 5 Другие 6 6 Показатели Всего пациентов, n Пол, М/Ж Длительность наркоза, мин* Выполненные операции (n): Примечание. *Me (QI-QIII) Оказалось, что группы сопоставимы по полу, возрасту, физическому статусу, характеру и длительности оперативных вмешательств, наркоза, но 53 существенно отличаются по уровню предоперационной тревоги и депрессии – в 1,75-3 раза (таблица 3.4). Таблица 3.4 – Выраженность предоперационной тревоги и депрессии (баллы) в группах пациентов [Me (QI-QIII)] Группы HADSтревога HADSдепрессия PHQ-9 Боль ≥ 6 баллов 8 (6-14) 7 (5-11) 9 (5-16) Боль < 6 баллов 4 (2-7) 4 (2-6) 3 (2-6) Примечание. Все различия между группами р < 0,001 Полученные данные делают обоснованным поиск взаимосвязи между психологическим состоянием пациентов и интенсивностью боли. Нами выявлена прямая умеренная корреляция между предоперационной тревогой и депрессией и показателями интенсивности болевого синдрома в первые сутки после операции (вопросы 1,2,3,4,5,6; таблица 3.5). Таблица 3.5 – Корреляция между уровнем предоперационной тревоги и депрессии и показателями интенсивности боли после операции Показатель HADSтревога HADSдепрессия PHQ-9 1 R=0,49; p<0,001 R=0,56; p<0,001 R=0,58; p<0,001 2 R=0,43; p<0,001 R=0,49; p<0,001 R=0,36; p<0,012 3 R=0,51; p<0,001 R=0,52; p<0,001 R=0,56; p<0,001 4 R=0,30; p<0,04 R=0,47; p<0,001 R=0,46; p<0,001 5 R=0,44; p<0,002 R=0,39; p<0,006 R=0,40; p<0,005 6 R=0,49; p<0,001 R=0,60; p<0,001 R=0,54; p<0,001 Не все шкалы продемонстрировали одинаковую силу связи с различными характеристиками боли после операции. Шкала HADSдепрессия наиболее сильно 54 коррелирует с максимальной болью и связанными с ней расстройствами сна (1 и 6), HADSтревога – с максимальной интенсивностью боли и продолжительностью сильной боли (1 и 3). Шкала PHQ-9 показала наибольшую связь с максимальным болевым синдромом, его продолжительностью и расстройствами сна (1,3,6), среднюю связь – со снижением двигательной активности в постели (4), а наименьшую – с минимальной болью в первые сутки после операции (2). Это подчеркивает необходимость комплексного подхода к оценке психологического состояния пациента и целесообразность одновременного использования нескольких шкал. На следующем этапе исследования сравнивали показатели интенсивности боли в группах пациентов в зависимости от выраженности предоперационной тревоги и депрессии. Среди обследованных пациентов у 58% тревожные расстройства по шкале HADS отсутствовали (группа 1), у 18% – выявлена субклинически выраженная тревога (группа 2), у 24% выявлена клинически выраженная тревога (группа 3). Данные группы оказались сопоставимы по возрасту и физическому статусу, но различались по полу. Количество женщин достоверно выше в группе с клинически выраженной тревогой и составило 16 человек (66,7%), в группе без симптомов тревоги – 23 (39,7%) (p=0,026). Оценка взаимосвязи между уровнем предоперационной тревоги и интенсивностью боли после операции показала следующие результаты (таблица 3.6). Показатель максимальной интенсивности боли в группах пациентов с субклинически и клинически выраженной тревогой по шкале HADS в 1,6-1,8 раз выше, чем в группе без тревожных расстройств. Выявлено достоверное отличие не только максимального и минимального болевого синдрома, но также его длительности в первые сутки после операции и показателей – в какой мере боль мешает двигаться в постели, глубоко дышать и спать. 55 Таблица 3.6 – Показатели интенсивности боли (баллы) в первые сутки после операции в группах пациентов в зависимости от выраженности предоперационной тревоги по шкале HADS [Me (QI-QIII)] Группа 1 Группа 2 Группа 3 (n=58) (n=18) (n=24) ANOVA Показатель Kruskal-Wallis 1 5 (4-8) 8 (5-9) 9 (7-10) p<0,001 2 2 (0-3) 3 (2-4) 2,5 (1-4) p<0,05 3 30 (20-40) 50 (40-70) 60 (30-80) p<0,001 4 6 (3-8) 7,5 (6-9) 8,5 (8-10) p<0,001 5 4 (2-8) 8 (6-8) 8 (7-9) p<0,001 6 3 (1-6) 6 (4-8) 8 (5-10) p<0,001 Взаимосвязь между уровнем предоперационной депрессии по шкале HADS и интенсивностью болевого синдрома после операции также обнаружена в ходе нашего исследования. Установлено, что у 67% пациентов симптомов депрессии не наблюдается (группа 1), у 16% – имеется субклинически выраженная депрессия (группа 2), у 17% – клинически выраженная депрессия (группа 3). Группы не отличались по полу, возрасту и физическому статусу. В группах пациентов в зависимости от уровня депрессивных расстройств выявлены достоверные различия большинства исследуемых показателей (таблица 3.7). Потребность в дополнительном обезболивании (вопрос 8) различалась в группах пациентов в зависимости от уровня тревожных и депрессивных расстройств по шкале HADS. В группе пациентов с субклинически и 56 клинически выраженной тревогой (≥8 баллов) количество пациентов, которым требовалась дополнительная аналгезия было достоверно больше, чем в группе без тревожных расстройств – 14 (33,3%) и 8 (13,8%) соответственно (p=0,02). Таблица 3.7 – Показатели интенсивности боли (баллы) в первые сутки после операции в группах пациентов в зависимости от уровня предоперационной депрессии по шкале HADS [Me (QI-QIII)] Показатель Группа 1 Группа 2 Группа 3 ANOVA (n=67) (n=16) (n=17) Kruskal-Wallis 1 6 (5-8) 7 (5-9) 10 (9-10) p<0,001 2 2 (0-3) 3,5 (2-5,5) 3 (2-4) p<0,05 3 30 (20-50) 45 (30-50) 70 (50-80) p<0,001 4 6 (3-8) 8 (6-9.5) 9 (8-10) p<0,001 5 5 (2-8) 8 (5-8) 8 (7-9) p<0,001 6 3 (1-6) 6,5 (4-7.5) 9 (7-10) p<0,001 Аналогично, в группе с субклинически и клинически выраженной депрессией число пациентов, нуждающихся в дополнительном обезболивании, превышало таковое в группе без депрессивных расстройств 13 (39,4%) и 9 (13,4%) соответственно (p=0,003). В зависимости от выраженности депрессии по шкале PHQ-9 нами установлено следующее распределение пациентов: у 37% – симптомы депрессии отсутствовали (группа 1), у 43% – депрессия умеренной степени 57 выраженности (группа 2), у 20% пациентов – умеренно-тяжелая/тяжелая депрессия (группа 3). Данные группы были сопоставимы по полу, возрасту и физическому статусу. В исследуемых группах обнаружены статистически значимые различия по таким параметрам: уровень максимальной и минимальной боли в первые сутки после операции, длительность сильной боли в течение первых суток после операции, показатели, в какой мере боль мешает двигаться в постели, глубоко дышать/кашлять и спать (таблица 3.8). Показатель максимальной интенсивности боли в группах пациентов с субклинически и клинически выраженной депрессией по шкалам HADS и PHQ-9 в 1,2-1,7 раз выше, чем в группе без психологических расстройств. Таблица 3.8 – Показатели интенсивности боли (баллы) в первые сутки после операции в группах пациентов в зависимости от уровня предоперационной депрессии по шкале PHQ-9 [Me (QI-QIII)] Показатель Группа 1 Группа 2 Группа 3 ANOVA (n=37) (n=43) (n=20) Kruskal-Wallis 1 5 (4-7) 8 (5-9) 9 (6,5-10) p<0,001 2 2 (0-2) 3 (2-4) 3 (1-4) p<0,05 3 30 (20-40) 40 (20-50) 70 (50-75) p<0,001 4 5 (2-7) 7 (5-9) 9 (8-10) p<0,001 5 4 (2-7) 8 (3-8) 8 (7,5-9) p<0,001 6 3 (1-6) 5 (2-7) 8 (6-10) p<0,001 58 Взаимосвязь психологического состояния пациентов по шкалам HADS и PHQ9 с мерой их удовлетворенности проводимой терапией (вопрос 9), а также со степенью снижения боли после введения тримеперидина (вопрос 7) не обнаружена. Полученные данные показали, что предоперационное психологическое состояние связано не только с уровнем боли, но также со степенью невротических расстройств после операции. Уровень тревоги и депрессии по шкале HADS и PHQ-9 перед операцией показал прямую умеренную корреляцию со степенью выраженности чувства тревоги (R=0,51; 0,54; 0,49, p<0,0001 соответственно) и беспомощности (R=0,58; 0,58; 0,63, p<0,0001 соответственно) у пациентов в раннем послеоперационном периоде. Таким образом, уровень предоперационной тревоги и депрессии оказывает влияние на интенсивность дополнительной аналгезии. боли после Поэтому, на операции наш и взгляд, потребность в целесообразно продолжение исследований не только в направлении коррекции психологического статуса с целью улучшения лечения боли после операции, но также изучения прогностической ценности уровня эмоциональных расстройств относительно эффективности послеоперационного обезболивания с помощью опиоидов. 3.3. Оценка частот генотипов полиморфизма 118A>G гена OPRM1 и полиморфизма 1947G>A гена COMT среди пациентов и их влияния на интенсивность боли после операции С целью изучения взаимосвязи между полиморфизмами 118A>G гена OPRM1 и 1947G>A гена COMT и интенсивностью боли после операции на фоне применения µ-агониста тримеперидина на первом этапе проводилась оценка частоты встречаемости возможных аллельных вариантов указанных SNPs среди обследованных пациентов. В ходе настоящего исследования нами выявлены следующие частоты генотипов полиморфизма 118A>G гена OPRM1: генотип A118A составил 66%, 59 A118G – 24%, G118G – 10%. Данное распределение не подчиняется закону Харди-Вайнберга (χ2=9,04; p<0,005) [192], что может быть отражением селекции в отношении некоторых аллельных вариантов данного гена [21]. Важно отметить, что в полиморфизме OPRM1 118A>G аллель А является природным (или «диким»), а аллель G – мутантным, и именно с его наличием связано изменение структуры и функции µ 1-рецептора и, как следствие, эффективности аналгезии с помощью опиоидов [16]. Данный факт стал главной причиной объединения групп пациентов с генотипом A118G и G118G для проведения статистического анализа влияния данного на SNP эффективность послеоперационной аналгезии (таблица 3.9). Таблица 3.9 – Клиническая характеристика пациентов [*Me (QI-QIII)] Показатель AA AG+GG Всего пациентов, n 66 34 58 (52-65,5) 61,5 (43-66) Пол, М/Ж 36/30 11/23 POSSUM* 15 (14-16) 15 (13-16) Длительность операции, мин* 75 (60-90) 77,5 (60-90) Длительность наркоза, мин* 100 (80-120) 105 (90-125) Общая доза фентанила во время операции, мг* 0,6 (0,5-0,8) 0,6 (0,5-0,7) Возраст, годы* Выполненные операции (n): Нефрэктомии/нефруретерэктомии 28 8 Пиелолитотомии 24 21 Уретеролитотомии 7 2 Другие 7 3 60 Данные группы пациентов сопоставимы по возрасту, физическому статусу, характеру и длительности оперативного вмешательства, длительности наркоза. Однако группы отличались по половому составу: среди носителей генотипа A118G+G118G количество лиц женского пола было выше, чем среди носителей генотипа A118A (67,6% vs 45,4%; p<0,05). В нашем исследовании не удалось выявить непосредственной связи SNP OPRM1 118A>G с интенсивностью боли после операции, но обнаружено влияние мутантного аллеля G на некоторые другие характеристики послеоперационной аналгезии. В группе носителей мутантного аллеля OPRM1 (A118G+G118G) выявлена лишь незначительная тенденция к повышению интенсивности максимального болевого синдрома, но обнаружено статистически значимое увеличение значения показателя, в какой мере боль мешала спать, и потребности в дополнительном обезболивании (OR=2,3; 95%ДИ 1,12-4,83; p=0,049, таблица 3.10). Таблица 3.10 – Показатели интенсивности боли (баллы) в 1 сутки после операции в группах пациентов в зависимости от генотипа SNP 118A>G гена OPRM1 [Me (QI-QIII)] Показатель А118А (n=66) A118G+G118G (n=34) Значение р 1 6 (5-8) 7,5 (5-9) 0,1 2 2 (0-3) 2 (1-4) 0,49 4 7 (4-8) 8 (6-9) 0,13 6 5 (1-7) 6 (3-9) 0,02 8, n (%)* 10 (15,2) 12 (35,3) 0,02 Примечание. *n – количество положительных ответов на вопрос 8 в группах пациентов 61 Частоты генотипов полиморфизма 1947G>A гена COMT в исследовании составили: А1947А – 21%, G1947A – 51%, G1947G – 28%, что соответствует закону Харди-Вайнберга (χ2=0,06; p>0,05) [192]. Полученные результаты свидетельствуют, что данный SNP оказывает существенное влияние на эффективность послеоперационной аналгезии опиоидами (таблица 3.11). Наличие генотипов G1947А и G1947G связано не только с увеличением максимального и минимального уровня боли в первые сутки после операции, но также показателем, в какой мере боль мешала менять положение в постели. Кроме того, у данной категории пациентов выявлена сильная тенденция к увеличению длительности максимальной боли и связанных с ней расстройств сна. Количество пациентов, требующих дополнительного введения обезболивающих средств, также было выше в группах G1947A и G1947G, чем в А1947А (27%, 33% и 14% соответственно), но данное отличие оказалось статистически не значимо. Таблица 3.11 – Показатели интенсивности боли (баллы) в 1 сутки после операции в группах пациентов в зависимости от генотипа SNP 1947G>A гена COMT [Me (QI-QIII)] Показатель А1947А (n=21) G1947A (n=51) G1947G (n=28) Значение p 1 5 (2-6) 7 (5-9) 8 (5,5-9) 0,001 2 0 (0-2) 2 (2-4) 2 (1-4) 0,02 3 30 (10-40) 40 (30-70) 40 (30-50) 0,06 4 5 (2-8) 8 (5-9) 7 (4-9) 0,03 6 3 (1-6) 5 (3-8) 6 (3-8) 0,06 С различной частотой идентифицированы 9 возможных комбинаций SNP COMT 1947G>A-OPRM1 118A>G (таблица 3.12). Наиболее часто встречалась комбинация G1947A-A118A (34%), наиболее редко – комбинация A1947AG118G (1%). 62 Таблица 3.12 – Идентифицированные комбинации SNP COMT 1947G>A и OPRM1 118A>G GA- GG- GA- GG- GA- АА- GG- AA- AA- GG GG AG AA AA АА AG AG GG Частота, % 3 6 14 15 34 17 7 3 1 Номер* 1 2 3 4 5 6 7 8 9 SNP Примечание. * Далее в рисунках комбинации SNP обозначаются под указанными номерами В группах пациентов с различными комбинациями SNP отмечены статистически значимые различия максимальной интенсивности боли в первые сутки после операции. Наиболее высокий показатель наблюдался у пациентов G1947A-G118G группы – 9 (6-10) баллов, а наименьший был у пациентов групп А1947А-А118А – 5 (2-6) баллов, А1947А-A118G – 5 (5-6) баллов и единственного представителя группы A1947A-G118G – 5 баллов (рисунок 3.2). 10 9 8 Баллы 7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 8 9 Комбинации SNP Рисунок 3.2 – Максимальная интенсивность боли в первые сутки после операции для отдельных комбинации SNP (p=0,036). Выраженность связанного с болью ограничения подвижности пациентов в кровати в течение первых суток после операции также отличалась в группах с 63 различными комбинациями SNP. Наибольшее значение данного показателя наблюдалось у носителей комбинации G1947A-G118G – 10 (9-10) баллов, а наименьшим оно было в группе А1947А-А118А – 3 (2-8) балла. Хотя выявленные отличия не достигли статистической значимости, их можно трактовать как существенную тенденцию (рисунок 3.3). 10 9 8 Баллы 7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 8 9 Комбинации SNP Рисунок 3.3 – Степень связанного с болью ограничения подвижности пациентов с различными комбинациями SNP в первые сутки после операции (p=0,098). Аналогичная тенденция наблюдалась при сравнении выраженности связанных с болью расстройств сна. Величина данного показателя была максимальной у пациентов с комбинацией SNP G1947A-G118G – 10 (5-10) баллов, а наименьшие значения зафиксированы у пациентов группы А1947АА118А – 3 (1-5) балла, и единственного представителя группы A1947A-G118G – 1 балл (рисунок 3.4). Таким образом, проведенное исследование выявило, что SNP OPRM1 118A>G может оказывать влияние на выраженность расстройства сна, связанного с болью в первые сутки после операции, и потребность в 64 дополнительном обезболивании, которые были выше в группе носителей мутантного аллеля A118G+G118G (p<0,05). 10 9 Баллы 8 7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 8 9 Комбинации SNP Рисунок 3.4 – Выраженность связанных с болью расстройств сна в первые сутки после операции в зависимости от комбинации SNP (p=0,075). SNP 1947G>A гена COMT также может оказывать воздействие на эффективность послеоперационной аналгезии опиоидами после объемных урологических вмешательств – интенсивность максимальной боли в первые сутки после операции была на 40-60% выше в группах G1947A и G1947G, по сравнению с А1947А (p<0,001). Кроме того, в группах G1947A и G1947G показатели минимального болевого синдрома и в какой мере боль мешает двигаться в постели статистически значимо превышали таковые в группе А1947А (p<0,05). Полученные результаты свидетельствуют о том, что генотипирование пациентов по данным SNPs может быть полезным при планировании аналгезии в послеоперационном периоде. 65 3.4. Исследование взаимосвязи между SNPs 118A>G гена OPRM1 и 1947G>A гена COMT и предоперационным психологическим состоянием пациентов В ходе настоящего исследования установлено, что SNP OPRM1 118A>G связан с предоперационным психологическим состоянием пациентов. Уровень предоперационной тревоги и депрессии по шкалам HADS и PHQ-9 в группе носителей A118G+G118G оказался на 45,4-72,7% выше, чем у носителей генотипа А118А (таблица 3.13). Таблица 3.13 – Уровень предоперационной тревоги и депрессии (баллы) в группах пациентов в зависимости от генотипа SNP 118A>G гена OPRM1 [Me (QI-QIII)] Шкала А118А (n=66) A118G+G118G (n=34) Значение р HADSтревога 6,5 (3-8) 10 (6-14) <0,001 HADSдепрессия 5,5 (4-7) 8 (5-12) 0,015 PHQ-9 5,5 (2-10) 9,5 (4-16) 0,016 Нам не удалось выявить влияние SNP COMT 1947G>A на психологическое состояние пациентов. Уровень предоперационной тревоги и депрессии статистически значимо не отличался в группах пациентов с генотипами A1947A, G1947A и G1947G (таблица 3.14). Связь различных комбинаций SNP COMT 1947G>A-OPRM1 118A>G со степенью выраженности предоперационной депрессии по шкале HADS и PHQ9 не выявлена. Однако установлено, что уровень предоперационной тревоги по шкале HADS существенно отличается среди носителей различных генотипов COMT 1947G>A-OPRM1 118A>G (рисунок 3.5). 66 Таблица 3.14 – Уровень предоперационной тревоги и депрессии (баллы) в группах пациентов в зависимости от SNP 1947G>A гена COMT [Me (QI-QIII)] Шкала А1947А (n=21) G1947A (n=51) G1947G (n=28) Значение р HADSтревога 7 (3-7) 8 (4-14) 6,5 (4-10) 0,27 HADSдепрессия 5 (2-7) 6 (4-10) 6 (4-8,5) 0,12 PHQ-9 5 (2-10) 8 (3-16) 5 (3-10) 0,11 20 18 16 Баллы 14 12 10 8 6 4 2 0 1 2 3 4 5 6 7 8 9 Комбинации SNP Рисунок 3.5 – Степень выраженности предоперационной тревоги по шкале HADS среди пациентов с различными комбинациями SNP в первые сутки после операции (p=0,0093). Клинически выраженная тревога обнаружена у носителей генотипа G1947A-G118G – 14 (9-20) баллов, A1947A-A118G – 13 (6-14) баллов, G1947GG118G – 12,5 (3-14) баллов и G1947A-A118G – 12 (8-15) баллов. Наиболее низкий уровень тревоги выявлен у носителей генотипов G1947G-A118A, G1947A-A118A и A1947A-A118A, где он составил 6 (3-9), 6,5 (3-8) и 7 (3-7) баллов соответственно. 67 Таким образом, SNP OPRM1 118A>G связан с уровнем предоперационной тревоги и депрессии, что говорит о возможном влиянии эндогенной опиоидной системы не только на ноцицептивные процессы, но и психологическое состояние пациентов, являясь связующим звеном между анальгетической и эмоциональной сферой пациентов. Комбинации SNP COMT 1947G>AOPRM1 118A>G оказывают влияние на уровень предоперационных тревожных расстройств, что свидетельствует об одновременном участии многих генов и их продуктов в формировании эмоционального фона пациента. Это подтверждает важность комплексного обследования пациентов и индивидуального подхода к фармакотерапии. Оценка влияния предоперационного психологического состояния 3.5 пациентов, SNP 118A>G гена OPRM1 и SNP 1947G>A гена COMT на частоту возникновения и выраженность побочных эффектов опиоидов В первые сутки после операции с различной частотой наблюдались следующие ПЭ опиоидов – тошнота, рвота, головокружение, кожный зуд, сонливость (рисунок 3.6). 100 80 80 61 60 56 40 17 20 17 0 Тошнота Рвота Головокружение Зуд Сонливость Рисунок 3.6 – Частота возникновения ПЭ опиоидов (%) у обследованных пациентов. 68 Интересно, что выраженность некоторых ПЭ показала высокую вариабельность среди пациентов: Rтошноты составил 10 баллов, Rсонливости – 10 баллов. Rзуда и Rголовокружения оказались ниже – 3 и 4 балла соответственно. Не было выявлено ни одного случая клинически значимого снижения SpO2 и ЧДД. Оценка влияния предоперационной тревоги по шкале HADS на выраженность ПЭ опиатов в первые сутки после операции показала следующие результаты (таблица 3.15). Среди пациентов отмечены статистически значимые отличия в выраженности центральных ПЭ опиоидов. Показатели сонливости и головокружения в группе 3 были соответственно в 2,75 и 5 раз выше, по сравнению с группой 1. Таблица 3.15 – Выраженность ПЭ опиоидов (баллы) в группах в зависимости от уровня предоперационной тревоги по шкале HADS [Me (QI-QIII)] Группа 1 Группа 2 Группа 3 Показатель ANOVA Kruskal- (n=58) (n=18) (n=24) Тошнота 1 (0-4) 2 (0-7) 3,5 (0-8,5) p=0,13 Сонливость 2 (1-5) 4 (2-8) 5,5 (1-8) p=0,042 Головокружение 1 (0-3) 1 (0-5) 5,0 (2,5-7,5) p<0,001 Wallis Степень тошноты была выше в группе клинически выраженной тревоги, однако статистической значимости выявленные различия не достигли. В группе пациентов без симптомов тревоги рвота наблюдалась у 8,6% пациентов, в группе с наличием проявлений тревоги ее частота была статистически значимо выше и составила 28,6% (OR=3,3; 95% ДИ 1,26-8,70; р=0,021). Статистически значимых различий в частоте возникновения кожного зуда в группах пациентов не обнаружено. 69 Выраженность гастроинтестинальных и центральных ПЭ опиоидов отличалась в группах пациентов в зависимости от уровня предоперационной депрессии по шкале HADS (таблица 3.16). Показатели сонливости и головокружения в 3,5-5 раз выше в группе с клиническими проявлениями депрессии, чем в группе без депрессивных расстройств. Кроме того, в группе 3 выявлена сильная тенденция к увеличению степени тошноты. Частота рвоты и кожного зуда среди пациентов статистически значимо не отличалась. Таблица 3.16 – Выраженность ПЭ опиоидов (баллы) в группах в зависимости от уровня предоперационной депрессии по шкале HADS [Me (QI-QIII)] ANOVA Группа 1 Группа 2 Группа 3 (n=67) (n=16) (n=17) Тошнота 0 (0-4) 4 (0-6,5) 5 (0-8) p=0,06 Сонливость 2 (1-5) 5 (1,5-7,5) 7 (1-9) p<0,05 Головокружение 1 (0-3) 5 (0,5-5,5) 5 (3-8) p<0,01 Показатель KruskalWallis В группах пациентов в зависимости от уровня депрессии по шкале PHQ-9 также существуют статистически значимые различия выраженности центральных ПЭ опиоидов. В группе пациентов с минимально выраженной депрессией уровень сонливости составил 2 (0-4) балла, с умеренной депрессией – 3 (1-7) балла. Выраженность сонливости среди пациентов с умереннотяжелой/тяжелой депрессией в 3,75 раз выше, чем в группе без депрессии – 7,5 (3,5-9) баллов (p=0,0005). Степень головокружения также достоверно отличалась среди пациентов с минимальной, умеренной и тяжелой депрессией по шкале PHQ-9: 0 (0-3), 2 (05) и 5 (0,5-6,5) баллов соответственно (p=0,013). Взаимосвязь уровня депрессии до операции по данной шкале с частотой возникновения рвоты и кожного зуда 70 в послеоперационном периоде не выявлено. Влияние предоперационных эмоциональных расстройств по шкале HADS и PHQ-9 на длительность ИВЛ не обнаружено. Результаты проведенного корреляционного анализа позволили выявить прямую взаимосвязь между предоперационным психологическим состоянием пациентов и выраженностью таких ПЭ опиоидов, как сонливость, головокружение, тошнота (таблица 3.17). Уровень предоперационной тревоги и депрессии демонстрирует положительную слабую корреляцию с гастроинтестинальными ПЭ опиоидов и прямую умеренную – с центральными ПЭ. Таблица 3.17 – Корреляция между уровнем предоперационной тревоги, депрессии и выраженностью ПЭ опиоидов Показатель HADSтревога HADSдепрессия PHQ-9 Тошнота R=0,26; p<0,01 R=0,27; p<0,01 R=0,19; p=0,058 Сонливость R=0,34; p<0,01 R=0,34; p<0,005 R=0,42; p<0,001 Головокружение R=0,41; p<0,001 R=0,47; p<0,001 R=0,38; p<0,001 Анализ полученных результатов свидетельствует о том, что SNP OPRM1 118A>G может оказывать существенное влияние на тяжесть ПЭ опиоидов (таблица 3.18). Наличие аллеля G связано со статистически значимым увеличением проявлений не только гастроинтестинальных ПЭ наркотических анальгетиков (тошнота, рвота), но также ПЭ, связанных с центральной нервной системой (сонливость). Частота возникновения рвоты в группе пациентов с генотипом OPRM1 A118G+G118G составила 29,4% и была статистически значимо выше, чем в группе с генотипом OPRM1 А118А, где данный ПЭ наблюдался у 10,6% пациентов (OR=2,8; 95%ДИ 1,16-6,64; р=0,046). Кроме того, в группе пациентов A118G+G118G головокружения. выявлена сильная тенденция к увеличению степени 71 Таблица 3.18 – Побочные эффекты опиоидов (баллы) в группах пациентов в зависимости от вида SNP OPRM1 118A>G [Me (QI-QIII)] Показатель А118А (n=66) A118G+G118G (n=34) Значение p Тошнота 1 (0-4) 4 (0-8) 0,02 Головокружение 1 (0-4) 3 (0-6) 0,055 Сонливость 2 (1-5) 5,5 (1-8) 0,034 RSS 4 (2-4) 3 (2-4) 0,384 ИВЛ, мин 15 (10-20) 15 (10-20) 0,4 Уровень седации по шкале RSS, а также длительность ИВЛ после операции в группах пациентов статистически значимо не отличались. В ходе настоящего исследования также выявлена взаимосвязь между SNP COMT 1947G>A и ПЭ наркотических анальгетиков (таблица 3.19). Выраженность тошноты статистически значимо выше в группах пациентов G1947A и G1947G. Уровень седации по шкале RSS в группах пациентов A1947A и G1947A практически в два раза превышает таковой в группе G1947G. Таблица 3.19 – Побочные эффекты опиоидов в зависимости от SNP COMT 1947G>A [Me (QI-QIII)] Показатель А1947А G1947A G1947G Значение p (n=21) (n=51) (n=28) Тошнота, баллы 0 (0-2) 2 (0-6) 2 (0-7) 0,04 RSS, баллы 4 (2-4) 4 (3-4) 2 (2-3) 0,04 ИВЛ, мин 10 (10-20) 15 (10-20) 15 (12,5-20) 0,17 72 В ходе исследования установлено, что если в объединенной группе пациентов COMT А1947А+G1947A кожный зуд наблюдался у 11,1% пациентов, то в группе G1947G его частота статистически значимо выше и составила 32,1% (OR=2,9; 95% ДИ 1,24-6,79; р=0,039). Связь данного полиморфизма с другими центральными ПЭ (головокружение, сонливость), а также его влияние на длительность ИВЛ после операции не обнаружены. Результаты работы показали, что различные комбинации SNP COMT 1947G>A-OPRM1118A>G не влияют на выраженность ПЭ опиоидов. Однако обнаружены различия в степени тошноты среди пациентов различных групп, которые можно трактовать, как существенную тенденцию (рисунок 3.7). Наиболее высокий уровень тошноты выявлен у носителей генотипа G1947AG118G – 6,5 (0-10) баллов, а наиболее низкий – у носителей генотипов А1947АА118А – 0 (0-2) балла, A1947A-A118G – 0 (0-0) баллов, а также единственного представителя A1947A-G118G – 0 баллов. Также достаточно низкие показатели уровня тошноты обнаружены у носителей G1947G-A118A и G1947A-A118A – 1 (0-5), 1 (0-4) балла соответственно. 10 9 8 Баллы 7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 8 9 Комбинации SNP Рисунок 3.7 – Степень тошноты у пациентов с различными комбинациями SNP в первые сутки после операции (p=0,061). 73 Итак, уровень предоперационной тревоги оказывает влияние на частоту возникновения гастроинтестинальных и уровень центральных ПЭ опиоидов: выраженность сонливости, головокружения и частота рвоты были в 2,75 (p<0,05), 5 (p<0,001) и 3,3 (p<0,05) раза выше в группе пациентов с клинически выраженной тревогой по сравнению с группой без тревожных расстройств. Уровень предоперационной депрессии также влияет на выраженность центральных ПЭ наркотических аналгетиков: максимальные значения головокружения и сонливости выявлены в группе субклинически и клинически выраженной депрессии по шкале HADS и PHQ-9. Развитие центральных ПЭ опиоидов может быть связано с SNP COMT 1947G>A: выраженность седации была в 2 раза выше у носителей A1947A и G1947A по сравнению с G1947G (p<0,05). Также выявлены достоверное увеличение степени сонливости и сильная тенденция к усилению головокружения у носителей SNP OPRM1 A118G+G118G (p=0,034; р=0,055). Гастроинтестинальные ПЭ могут быть связаны с SNP OPRM1 118A>G и COMT 1947G>A: степень тошноты была выше в группе пациентов OPRM1 A118G+G118G, COMT G1947A и G1947G (p<0,05), частота рвоты была в 2,8 раза выше в группе OPRM1 A118G+G118G, чем в группе OPRM1 A118A (p<0,05). Тяжесть кожных ПЭ опиатов также может зависеть от варианта SNP COMT 1947G>A: в группе пациентов с генотипом G1947G частота кожного зуда в 2,9 раз выше, по сравнению с группой А1947А+G1947A (p<0,05). Предоперационное выявление данных SNP может быть полезным с точки зрения прогнозирования возникновения ПЭ опиоидов, проведения разъяснительной работы среди пациентов, планирования соответствующей терапии и, в итоге, повышения безопасности и эффективности назначения наркотических аналгетиков после объемных хирургических вмешательств. 74 3.6. Прогностическая значимость генотипирования OPRM1 118A>G, COMT 1947G>A и психологического состояния пациентов относительно интенсивной боли после операции и развития побочных эффектов опиоидов Оценка психологических особенностей пациентов до операции показала, что группа пациентов с умеренными и сильными проявлениями тревоги/депрессии по шкале HADS и депрессии по шкале PHQ-9 имеют более высокий риск развития сильной боли после операции по сравнению с группой без психологических расстройств (таблица 3.17). Таблица 3.17 – Риск возникновения сильной боли после операции в зависимости от предоперационного психологического состояния пациентов HADSтревога Показатель RR, % (95% ДИ) OR (95% ДИ) HADSдепрессия PHQ-9 >8 баллов <8 баллов >8 баллов <8 баллов >4 баллов <4 баллов n=42 n=58 n=33 n=67 n=63 n=37 85,7 44,8 81,8 52,2 76,2 37,8 (73,394,7) (32,157,9) (66,493,2) (40,164,2) (64,886,0) (22,654,4) 1,91* 1,57** 2,01* (1,40-2,61) (1,18-2,07) (1,30-3,11) Примечание. * р < 0,001; **p<0,01 Полученные данные делают обоснованным изучение применяемых шкал оценки психологических особенностей в качестве методов прогнозирования сильной послеоперационной боли. 75 Чувствительность и специфичность шкалы HADSтревога относительно сильной боли после операции составили 58 % и 84%, AUC=0,802 (95% ДИ 0,710-0,875), p<0,0001. Шкала HADSдепрессия показала другие результаты: чувствительность – 43,5%, специфичность – 84%, AUC=0,747 (95% ДИ 0,651-0,829), p<0,0001. Аналогичные показатели для шкалы PHQ-9 составили 77,5% и 60,5%, AUC=0,788 (95% ДИ 0,694-0,863), p<0,0001 (рисунок 3.8). Влияние на уровень послеоперационной боли полиморфизма гена COMT 1947G>A делает обоснованным изучение данного SNP также в качестве метода прогнозирования. Чувствительность и специфичность такого теста составляет 88,7% и 36,8%, AUC=0,653 (95% ДИ 0,551-0,745), p<0,004 (рисунок 3.8). 100 HADSтревога HADSдепрессия PHQ-9 COMT Sensitivity 80 60 40 20 0 0 20 40 60 80 100 100-Specificity Рисунок 3.8 – Графики ROC-кривых для различных диагностических тестов. Данные показатели используются для оценки вероятности постановки правильного диагноза при применении того или иного метода диагностики 76 [193,194]. С этой целью нами проведен расчет прогностической ценности каждого теста с учетом распространенности сильной боли после операции среди обследованных пациентов (0,62), соответствующей распространенности интенсивной послеоперационной боли в европейской популяции [35,39,41]. Результаты проведенной работы показали, что PPV PHQ-9 невысокая и составляет 76% (95% ДИ 64,4-85), NPV – 62,2% (95% ДИ 46,1-75,9). PPV HADSдепрессия составила 82% (95% ДИ 65,6-91,5), NPV – 47,7% (95% ДИ 36,359,5). Шкала HADSтревога показала высокую PPV – 85,5% (95% ДИ 72,2-93,3) и относительно низкую NPV – 55,1% (95% ДИ 42,5-67,3). PPV теста на определение генотипа SNP 1947G>A гена COMT составила 69,6% (95% ДИ 58,8-78,7), NPV – 66,6% (95% ДИ 45,4-82,8). LR+ шкал HADSтревога и HADSдепрессия составило соответственно 3,7 (95% ДИ 1,7-7,9) и 2,7 (95% ДИ 1,2-6,05). Для PHQ-9 LR+=1,9 (95% ДИ 1,3-2,9), для генетического теста COMT1947G>A LR+=1,4 (95% ДИ 1,08-1,8). Дополнительным показателем диагностической способности теста является график пост-тестовой вероятности возникновения сильной боли, как функции претестовой вероятности (рисунок 3.9-3.12). Чем шире диапазон между пост-тестовой вероятностью заболевания при позитивном результате теста и пост-тестовой вероятностью при негативном результате, тем выше вероятность того, что данный тест правильно определит наличие/отсутствие заболевания у пациента [198-200]. Анализируя полученные графики, наилучшим предиктором относительно интенсивной боли после операции является уровень предоперационной тревоги по шкале HADS (рисунок 3.9). Показатели чувствительности и специфичности существенно возрастают при одновременном применении двух диагностических тестов (таблица 3.18). 77 Рисунок 3.9 – Пост-тестовая Рисунок 3.10 – Пост-тестовая вероятность возникновения сильной вероятность возникновения сильной боли при позитивном и негативном боли при позитивном и негативном результате тестирования по шкале результате тестирования по шкале HADSтревога. HADSдепрессия. Рисунок 3.11 – Пост-тестовая вероятность возникновения сильной боли при позитивном и негативном результате тестирования по шкале PHQ-9. Рисунок 3.12 – Пост-тестовая вероятность возникновения сильной боли по результатам генотипирования COMT 1947G>A (генотип АА – «отрицательный» тест, генотип GA+GG «положительный» тест). 78 Таблица 3.18 – Чувствительность (SE) и специфичность (SP) комбинированных тестов относительно боли после операции ≥ 6 баллов Комбинированный тест Правило «And rule» Правило «Or rule» HADSтревога+HADSдепрессия* SE=25,2%; SP=97,4% SE =76,3%; SP=70,6% HADSтревога+PHQ-9* SE=44,9%; SP=94,0% SE=90,5%; SP=50,8% HADSтревога+COMT 1947G>A* SE=51,4%; SP=89,9% SE=95,3%; SP=30,9% HADSдепрессия+PHQ-9 SE=33,7%; SP=93,7% SE=87,3%; SP=50,8% HADSдепрессия+COMT 1947G>A SE=38,6%; SP=89,9% SE=93,6%; SP=30,9% PHQ-9+COMT 1947G>A SE=68,7%; SP=75,0% SE=97,5%; SP=22,3% Примечание. * – наиболее удачные комбинации двух диагностических тестов Таким образом, для того, чтобы создать оптимальную диагностическую систему необходимо найти компромисс между показателями чувствительности и специфичности, отражающий баланс между рисками «ложных тревог» и пропуска заболеваний и учитывающий экономическую эффективность применяемого теста. Для наиболее удачных комбинаций тестов проведен расчет PPV, NPV и LR+ (таблица 3.19). Степень влияния различных признаков на интенсивность боли после операции прослеживается при использовании метода логистической регрессии. Данный метод позволяет провести анализ взаимосвязи между интенсивностью 79 боли после операции (≥6 баллов) и не только уровнем предоперационной тревоги, депрессии, различными видами генотипов COMT 1947G>A, но и другими предикторами, такими как пол, возраст. Таблица 3.19 – Прогностическая значимость (PPV, NPV) и LR+ для лучших комбинаций тестов относительно боли после операции ≥ 6 баллов Комбинированный тест Правило «And rule» Правило «Or rule» HADSтревога+HADSдепрессия PPV=94,1%; NPV=44,4%; PPV=80,9%; NPV=64,6%; LR+=9,7 LR+=2,6 PPV=92,4%; NPV=51,1%; PPV=75,0%; NPV=77,0%; LR+=7,5 LR+=1,8 PPV=89,2%; NPV=53,1%; PPV=69,2%; NPV=80,1%; LR+=5,1 LR+=1,4 HADSтревога+PHQ-9 HADSтревога+COMT 1947G>A Еще одним важным преимуществом применения логистической регрессии является возможность комбинации двух и более диагностических тестов для оценки их предикторных свойств. Показатель конкордации модели, учитывающей влияние одновременно шести вышеуказанных признаков на интенсивность боли после операции, составляет 73%, AUC=0,85 (95% ДИ 0,76-0,91). Следовательно, полученное уравнение логистической регрессии адекватно, что также подтверждается с помощью вычисления статистики χ2 методом правдоподобия (χ2=43, df=6, p<0,0001). 80 Дальнейший анализ модели свидетельствует о том, что наиболее значимое влияние на интенсивность боли после операции оказывают такие признаки, как уровень предоперационной тревоги по шкале HADS и наличие генотипа COMT G1947A и G1947G, поскольку обладают наиболее высокими регрессионными коэффициентами, p<0,05 (таблица 3.20). Таблица 3.20 – Регрессионные коэффициенты (Coefficient) и стандартные ошибки (Std. Error) изучаемых предикторов сильной боли после операции Диагностический тест Coefficient Std. Error р 0,24997 0,10460 0,0169 HADSдепрессия 0,058350 0,10568 0,5809 PHQ-9 0,093452 0,069172 0,1767 COMT 1947G>A 0,99767 0,38628 0,0098 пол 0,25293 0,55588 0,6491 -0,00034079 0,019764 0,9862 HADSтревога возраст Менее всего значимы такие предикторы, как пол и возраст. Это также подтверждается величиной площади под ROC-кривой для указанных признаков: AUC для пола составила 0,57 (95% ДИ 0,46-0,66), для возраста – 0,50 (95% ДИ 0,40-0,60). Нами проанализированы различные варианты предикторных моделей относительно возникновения сильной боли после операции (таблица 3.21). Наилучшей предикторной моделью оказалось совместное применение HADSтревога+PHQ-9+COMT 1947G>A, что еще раз подтверждает важность комплексной оценки общего состояния пациента накануне операции. В ходе настоящего исследования установлено влияние психологических и генетических особенностей пациентов на частоту возникновения рвоты в послеоперационном периоде на фоне аналгезии тримеперидином. Согласно 81 результатам исследования, полиморфизм 118A>G гена OPRM1, а также повышенный уровень предоперационной тревоги способствуют увеличению частоты рвоты в послеоперационном периоде. Таблица 3.21 – Показатель конкордации и площадь под ROC-кривой для различных комбинаций диагностических тестов Модель Показатель конкордации, % AUC (95% ДИ) HADSтревога+HADSдепрессия 72 0,82 (0,73-0,89) HADSтревога+PHQ-9 74 0,82 (0,73-0,89) HADSтревога+COMT 1947G>A 71 0,84 (0,75-0,90) HADSдепрессия+PHQ-9 72 0,79 (0,70-0,87) HADSдепрессия+COMT1947G>A 66 0,76 (0,67-0,84) PHQ-9+COMT 1947G>A 71 0,82 (0,73-0,89) HADSтревога+HADSдепрессия+ 72 0,84 (0,75-0,91) 74 0,85 (0,76-0,91) COMT 1947G>A HADSтревога+PHQ-9+COMT 1947G>A В группе пациентов с проявлениями тревоги и генотипом OPRM1 A118G+G118G риск возникновения рвоты соответственно в 3,3 и 2,8 раз выше 82 по сравнению с группой без тревожных расстройств и генотипом OPRM1 A118A (таблица 3.22). Это позволяет рассматривать указанные параметры в качестве методов прогнозирования развития гастроинтестинального ПЭ наркотических анальгетиков – рвоты. Таблица 3.22 – Риск возникновения рвоты в зависимости от уровня предоперационной тревоги и вида генотипа полиморфизма 118A>G гена OPRM1 HADSтревога Показатель RR, % (95% ДИ) OPRM1 >8 баллов <8 баллов AG+GG AA n=42 n=58 n=34 n=66 28,6 8,6 29,4 10,6 (15,7-43,5) (2,7-17,3) (15,1-46,2) (4,3-19,3) OR (95% ДИ) 3,3* (1,26-8,7) 2,8** (1,16-6,64) Примечание. * p=0,021; ** p=0,046 Чувствительность, специфичность генетического теста (определение полиморфизма гена OPRM1 118A>G) составили 58,8%, 71,1%, AUC=0,65 (95% ДИ 0,55-0,74), p<0,024 (рис. 3.13). PPV данного анализа 76,8%, NPV – 51,4%, LR+=2,03 (95%ДИ 1,20-3,43). Чувствительность и специфичность шкалы HADSтревога относительно возникновения рвоты также были невысокие и составили 70,6%, 63,9%, AUC=0,74 (95% ДИ 0,65- 0,83), p<0,0001(рисунок 3.13). 83 PPV HADSтревога несколько ниже и составила 76,1%, NPV – 57,1%, LR+=1,95 (95% ДИ 1,28-2,97). 100 HADSтревога OPRM1 Sensitivity 80 60 40 20 0 0 20 40 60 80 100 100-Specificity Рисунок 3.13 – Графики ROC-кривых для диагностических тестов HADSтревога и SNP OPRM1 118A>G. График пост-тестовой вероятности возникновения рвоты, как функции претестовой вероятности показал следующую диагностическую способность изучаемых тестов – HADSтревога и SNP OPRM1 118A>G (рисунок 3.14,3.15). По рисункам видно, что оба теста не являются идеальным инструментов в прогнозировании ПЭ рвоты, и лишь небольшим преимуществом обладает диагностический тест HADSтревога. 84 Рисунок 3.14 – Пост-тестовая Рисунок 3.15 – Пост-тестовая вероятность возникновения рвоты вероятность возникновения рвоты по результатам генотипирования при позитивном и негативном OPRM1 118A>G (генотип АА – результате тестирования по шкале «отрицательный» тест, генотип HADSтревога. AG+GG – «положительный» тест). Сочетание двух изучаемых диагностических методов приводит к следующим показателям чувствительности и специфичности (таблица 3.23). Сообразно с полученными значениями проведен расчет PPV, NPV и LR+ для комбинированного теста. Таблица 3.23 – Чувствительность (SE) и Специфичность (SP) комбинированного теста относительно рвоты после операции Комбинированный тест Правило «And rule» Правило «Or rule» HADSтревога+OPRM1 118A>G SE=41,5%; SP=89,6% SE=87,9%; SP=45,4% 85 Исходя из правила «And rule», PPV теста HADSтревога+OPRM1 118A>G возрастает до 86,7%, LR+=3,99, а NPV несколько уменьшается и составляет 48,4%. В соответствии HADSтревога+OPRM1 118A>G с правилом снижается «Or до rule» 72,4%, PPV комбинации однако наблюдается увеличение NPV до 69,7%. LR+=1,60. Анализ взаимосвязи различных признаков (уровень предоперационной тревоги, депрессии, полиморфизм 118G>A гена OPRM1) с возникновением рвоты после операции методом логистической регрессии показал, что наибольшее влияние на развитие данного ПЭ оказывает уровень предоперационной тревоги по шкале HADS (регрессионный коэффициент – 0,18, p=0,0488). Наименьшее влияние оказывают такие предикторы, как возраст и пол (регрессионные коэффициенты – 0,018, -0,2; p=0,4, 0,7). Это также подтверждается величиной площади под ROC-кривой для указанных признаков: AUC для пола составила 0,57 (95% ДИ 0,47-0,67), для возраста – 0,55 (95% ДИ 0,45-0,66). Оценка влияния на возникновение рвоты различных комбинаций признаков показала, что удовлетворительными характеристиками обладает модель, учитывающая влияние предоперационной тревоги и генотипа OPRM1 118А>G: процент конкордации составил 83%, AUC=0,75 (95% ДИ 0,660,83). Аналогичные данные выявлены для модели HADSтревога+пол пациента – процент конкордации составил 83%, AUC=0,75 (95% ДИ 0,65-0,83). Наиболее приемлемыми показателями обладает предикторная модель, включающая такие признаки, как уровень тревоги перед операцией по шкале HADS, вид генотипа SNP OPRM1 118A>G и пол пациента. Процент конкордации данной модели составляет 83%, AUC=0,76 (95% ДИ 0,66-0,84). Результаты проведенного исследования показали, что комбинированное применение шкал HADSтревога, PHQ-9 и генотипирования пациентов по гену 86 COMT 1947G>A обладает наилучшими предикторными свойствами в отношении эффективности аналгезии с помощью опиоидов (AUC=0,85; 95% ДИ 0,76-0,91) и может быть использовано для выделения пациентов с повышенным риском возникновения сильной боли после операции. Комплексное использование оценки уровня предоперационной тревоги по шкале HADS, принадлежности генотипирование пациента OPRM1 обладает 118A>G приемлемыми и учет половой прогностическими свойствами [199,200] относительно развития рвоты (AUC=0,76; 95% ДИ 0,660,84) и могут быть использованы в практике для выделения пациентов группы риска. 87 ГЛАВА 4 ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ 4.1. Оценка послеоперационной аналгезии тримеперидином и влияния психологических и генетических факторов на её эффективность Эффективное послеоперационное обезболивание остается актуальной проблемой современной анестезиологии. Сильная послеоперационная боль может приводить к развитию тяжелых послеоперационных осложнений, а у некоторых пациентов к формированию хронического болевого синдрома [3]. В нашей стране центральным звеном в лечении острой боли остаются опиоиды, однако оптимальное обезболивание при применении данного класса препаратов достигается не всегда [4]. Индивидуальная реакция пациентов на наркотические анальгетики подвержена значительным колебаниям, что может быть связано с психологическими, генетическими особенностями и факторами окружающей среды. Поэтому в настоящее время боль предлагается рассматривать в рамках, так называемой, биопсихосоциальной модели [77]. Именно биопсихосоциальная модель учитывает субъективный характер боли и ее многокомпонентную природу, а также подчеркивает важность разработки и внедрения персонализированного подхода к обезболивающей терапии с учетом потребностей каждого конкретного пациента. Целью настоящей работы является разработка и внедрение нового подхода к прогнозированию эффективности аналгезии наркотическими анальгетиками после объемных операций, основанного на предоперационной оценке психологических и определении однонуклеотидных полиморфизмов генов OPRM1 (SNP118A>G) и COMT (SNP1947G>A). Для этого с использованием комплекса клинических, биохимических, психологических и молекулярногенетических методов обследовано 100 пациентов, которым были выполнены операции на почке и верхней трети мочеточника из люмботомического доступа. 88 Одной из задач данного исследования являлась углубленная оценка индивидуальной реакции пациентов на послеоперационную аналгезию с помощью фиксированных доз тримеперидина и обоснование целесообразности применения биопсихосоциальной модели боли с целью повышения эффективности обезболивания. Несмотря на проводимую большую работу по внедрению современных аналгетических технологий в практическое здравоохранение, по-прежнему во многих лечебных учреждениях нашей страны основу обезболивания во время и после операции составляет введение наркотических анальгетиков по требованию пациента или по графику, назначенному лечащим врачом. Оценка аналгезии проводилась на основе данных анкет «Pain Out», заполненных пациентами через сутки после операции. Пороговым уровнем адекватной аналгезии в покое считали интенсивность боли по ЦРШ ≤ 3 баллов, и при активизации (глубокий вдох, кашель) ≤ 4 баллов. Указанные уровни рекомендованы P.E. Macintyre и соавт. в 3 издании клинических рекомендаций по лечению острой боли (2010), в работах Christoph Maier и соавт. (2010), И.И. Лесного и соавт. (2011) [3,5,39]. Получены результаты, в целом, свидетельствующие о неудовлетворительном качестве послеоперационной аналгезии. 62 пациента (62%) испытывали в первые сутки после операции боль интенсивностью 6 баллов и более, 15 пациентов (15%) оценили боль как «нестерпимую» – 10 баллов. О низком качестве аналгезии свидетельствует показатель минимальной боли в первые сутки после операции – у 25% пациентов он составил ≥4 балла. Более половины пациентов не отмечали снижение болевых ощущений на 90100% при применении тримеперидина и 22% сообщали о необходимости дополнительного обезболивания. По классификации Овечкина А.М. (2009) операции, выполняемые из люмботомического доступа, относятся к высшей категории травматичности [4], и соответственно, данная категория пациентов требует пристального внимания к послеоперационному обезболиванию. 89 Действительно, люмботомический доступ предполагает пересечение больших массивов тканей, особенно мышц, с высокой вероятностью повреждения нервных стволов и присоединения нейропатического болевого синдрома. Однако проблема аналгезии после операций на почке и мочеточнике разработана явно недостаточно. Об этом красноречиво свидетельствует тот факт, что рекомендации Европейской ассоциации урологов 2010 года, посвященные проблеме послеоперационного обезболивания у урологических пациентов, практически полностью базируются на данных, полученных в других областях хирургии [28]. Полученные в настоящем исследовании данные о неудовлетворительном состоянии послеоперационной аналгезии совпадают с результатами других авторов, как в нашей стране, так и за рубежом. Согласно интернациональному многоцентровому исследованию «Pain-Out», в котором участвовало 10 000 пациентов из 13 разных стран, в том числе из Украины, в 1 сутки после операции 70,9% пациентов испытывали боль, превышающую 3 балла, 40,1% – более 6 баллов (ЦРШ 0-10) [41]. И.И. Лесной и соавт. (2011) приводят данные литературы и результаты собственных исследований интенсивности болевого синдрома после различных типов оперативных вмешательств. Интенсивную боль в первые трое суток после онкогинекологических операций испытывали 50% пациентов в покое и 68% при движении, после абдоминальных операций боль была интенсивной у 43-49% пациентов в покое и 51-64% при движении, в онкоурологии, торакальной и торакоабдоминальной хирургии это составило 2141% в покое и 29-54% при попытке активизации [5]. Хотя вопрос исследовании хронической предметно не послеоперационной исследовался, боли полученные в настоящем данные дают существенные основания для его обсуждения. Нами установлено, что время, в течение которого пациент испытывает сильную боль, у 39% составило 12 часов и более, 2% отметили непрекращающуюся сильную боль в течении первых суток после операции. Следовательно, такие результаты могут иметь значение с 90 точки зрения хронизации послеоперационного болевого синдрома, поскольку группу риска развития ХБС составляют пациенты с длительной и интенсивной болью. Частота возникновения ХБС колеблется в зависимости от типа операции и достигает 50%. По данным Gerbershagen H.J. и соавт. (2009) через 3 и 6 месяцев после нефрэктомии признаки хронической боли выявляются соответственно у 28,6% и 8,6% пациентов [10]. Данная проблема имеет важный экономический аспект. В работе Gustavsson A. и соавт. (2012) показано, что в Швеции затраты на лечение хронической боли достигают 32 миллиона евро в год [201]. Проведенное нами исследование показало, что 65% пациентов оценили меру, с которой боль мешает поворачиваться в постели, в 6 и более баллов. Еще 59% также высоко оценили степень, с которой боль мешает глубоко дышать/кашлять. Такие показатели могут иметь серьезные негативные последствия, поскольку являются причиной более поздней активизации и неспособности пациента Многочисленными откашливать исследованиями мокроту показано, и глубоко что это дышать. способствует повышению риска развития легочных и тромбоэмболических осложнений [28,37,42,202]. Адекватный контроль боли важен с точки зрения способности оказывать влияние на эмоциональный статус пациента в послеоперационном периоде и вызывать психологическую дизадаптацию. Данные проведенного исследования свидетельствуют, что 69% пациентов испытывают тревогу вследствие болевых ощущений, 81% – чувство беспомощности. В свою очередь, послеоперационный психологический дистресс связан с силой болевых ощущений пациентов в первые сутки после операции. Послеоперационная тревога более всего коррелирует с такими показателями, как длительность максимальной боли и в какой мере боль мешает глубоко дышать/кашлять. Чувство беспомощности в большей мере коррелирует с длительностью максимальной боли и связанной с болью степенью нарушения сна (таблица 91 3.2). Связь пред- и послеоперационного психологического состояния пациентов отмечается в ряде других исследований [3]. Это говорит о необходимости динамического наблюдения за психологическим состоянием пациентов, поиска путей коррекции эмоциональных расстройств с целью улучшения результатов лечения боли. Коррекция послеоперационного психологического состояния важна еще и потому, что депрессивно-тревожные расстройства могут иметь такие негативные последствия, как замедление сроков реабилитации, а также скорости заживления ран [116]. В настоящей работе обнаружены значительные различия индивидуальной реакции на аналгезию тримеперидином, при этом часть пациентов практически не ощущают боли, а некоторые характеризуют свои ощущения как «нестерпимые» (рисунок 3.1), что обуславливает высокую вариабельность показателя максимальной боли после операции внутри исследуемой группы (V=40,3%). Высокий коэффициент вариации обнаружен и для таких показателей: минимальная боль в первые сутки после операции (V=88%), в какой мере боль мешает поворачиваться в постели (V=44%), глубоко дышать/кашлять (V=52%), спать Полученные (V=68%). данные свидетельствуют, что тримеперидин имеет неодинаковую эффективность у разных пациентов, а также обуславливают важность изучения индивидуальных особенностей больных, способных влиять на эффективность аналгезии. В роли таких особенностей могут выступать предоперационный эмоциональный статус пациентов, а также генетические факторы, связанные с особенностями рецепторного аппарата опиоидной системы и ферментных систем, ответственных за метаболизм нейромедиаторов, обеспечивающих модуляцию боли в центральной нервной системе (ЦНС) [91,164]. В ходе настоящего исследования нами обнаружено, что группы пациентов в зависимости от уровня максимального болевого синдрома (<6 баллов и ≥6 баллов) после операции сопоставимы по характеру и длительности оперативных вмешательств, но в 1,75-3 раза отличаются по уровню 92 предоперационной тревоги и депрессии (таблица 3.4). Кроме того, выявлена корреляционная зависимость между предоперационным психологическим состоянием пациентов и интенсивностью боли после операции (таблица 3.5). Шкалы HADSтревога, продемонстрировали HADSдепрессия, связь с PHQ-9 показателями в боли, неравной что степени подтверждает необходимость комплексной оценки эмоционального статуса. Как тревожные расстройства, так и депрессивные могут оказывать влияние на эффективность аналгезии и выступать в роли предикторов послеоперационного болевого синдрома. Оценка данных параметров в повседневной практике нередко затруднена в связи с применением объемных, трудных для понимания, хоть и надежных опросников [189]. Однако для использованных в настоящем исследовании шкал характерна не только высокая валидность, но также простота применения и легкость восприятия пациентом [186,188,190]. По итогам проведенной работы выявлено, что большое количество пациентов имели предоперационные тревожные расстройства по шкале HADS: у 24% – выявлена клинически выраженная тревога, у 18% – субклинически выраженная тревога. Установлено, что группы пациентов в зависимости от уровня тревоги существенно отличаются по большинству показателей интенсивности боли в первые сутки после операции, которые были выше в группе с субклинически и клинически выраженной тревогой (вопрос 1-6, таблица 3.6). Полученные данные совпадают с результатами других авторов. Доказано, что между степенью выраженности тревоги и послеоперационной потребностью в анальгетиках существует прямая умеренная корреляция, а предоперационная психологическая поддержка и дополнительное внимание со стороны врача способствуют снижению дозы НА на 50% [101]. Причины подобной взаимосвязи до конца не ясны и остаются предметом дискуссий. На наш взгляд, психологическое состояние может зависеть от состояния эндогенной опиоидной системы и таким образом быть связано с эффективностью аналгезии НА. Такая теория подтверждается результатами 93 работы Petrovic P. и соавт. (2002), в ходе которой авторы проводили визуализацию регионов мозга методом позитронно-эмиссионной томографии у пациентов с различным эмоциональным статусом. Оказалось, что у пациентов с позитивным настроем и верой в эффективность проводимого лечения более активны нисходящие пути антиноцицептивной системы, а эндогенная опиоидная система более чувствительна к эффектам морфина. И наоборот, у пациентов со слабым самоконтролем, страхом и повышенной тревогой чувствительность к опиоидам снижена (рисунок 4.14) [203]. Рисунок 4.1 – Эффективность применения НА среди двух категорий пациентов (Позитивно настроенный «Placebo responder»/Тревожно настроенный «Anxiebo» resonder») [202]. Подтверждает данную теорию и тот факт, что среди обследуемых нами пациентов потребность в дополнительном обезболивании была достоверно выше в группе с субклинически и клинически выраженной тревогой, чем в группе без тревожных расстройств (p=0,02). Аналогичные результаты приводятся в обзоре Svedman P. и соавт. (2005), согласно которым адаптация тревожного пациента к стрессовой ситуации проявляется повышенной потребностью в дополнительном обезболивании и чрезмерном использовании анальгетиков. Также приводятся данные, свидетельствующие, что в условиях КПА у тревожных пациентов часто нажатие на кнопку доставки НА не связано 94 с болевыми возможный ощущениями механизм [101]. влияния Указанные исследования психологической объясняют дизадаптации на эффективность аналгезии у хирургических пациентов и указывают на существенную роль эндогенной опиоидной системы в этих процессах. Результаты проведенной работы свидетельствуют, что по шкале HADS у 17% имеется клинически выраженная депрессия, у 16% – субклинически выраженная, 67% пациентов – без симптомов депрессии. Несмотря на то, что в процентном соотношении выраженность депрессии среди пациентов по шкалам HADS и PHQ-9 различалась, установлено влияние предоперационной депрессии согласно обеим шкалам на показатели интенсивности боли после операции (вопрос 1-6, таблица 3.7,3.8). Влияние на потребность в дополнительной аналгезии выявлено только при оценке депрессии с помощью шкалы HADS: количество пациентов, нуждающихся в дополнительном обезболивании, достоверно выше в группе с субклинически и клинически выраженной депрессией (p=0,003). Полученные данные согласуются с указанной выше теорией и подтверждаются исследованиями других авторов. В работе Rakel B.A. и соавт. (2012) исследовались возможные предикторы послеоперационной боли в покое и при активизации. Рабочей группой обнаружено, что предоперационные депрессивные расстройства наряду с некоторыми другими факторами существенно влияют на интенсивность боли в раннем послеоперационном периоде, а коррекция подобных расстройств может содействовать более быстрой реабилитации хирургических пациентов [111]. В нашей работе обнаружено, что группы пациентов с болью менее 6 баллов и более 6 баллов не различались по полу. Однако группы в зависимости от выраженности предоперационной тревоги отличались по данному признаку: количество женщин в группе с клинически выраженной тревогой достоверно выше, чем в группе без эмоциональных расстройств (p=0,026). Согласно проведенному исследованию половая принадлежность пациента является важным дополнительным фактором риска развития тревоги, что целесообразно 95 учитывать и при прогнозировании болевого синдрома. Аналогичные данные получены в работе Bornemann-Cimenti H. и соавт. (2014), где говорится, что пол не оказывает статистически послеоперационной боли. значимого Однако влияния отмечается, что на восприятие женщины склонны испытывать интенсивную боль после малоинвазивных вмешательств, а мужчины подвержены интенсивному болевому синдрому после объемных хирургических вмешательств [204]. Проведенное исследование говорит о важности учета даже незначительной психологической дизадаптации, поскольку у пациентов с субклинически выраженной тревогой и депрессией (8-10 баллов) уровень боли достоверно превышал таковой в группе без эмоциональных расстройств. Кроме того, выявлено, что предоперационная тревога и депрессия связаны с послеоперационным чувством тревожности и беспомощности, вызываемые болевым синдромом (p<0,0001). Исследованиями доказано, что невротические расстройства умеренной и сильной выраженности способны влиять как на эффективность аналгезии, так и качество жизни пациента [116,205], что, в итоге, свидетельствует о значительной роли психологического состояния пациентов в процессах выздоровления. Безусловно, результаты анкетирования пациентов во многом зависят от их личного отношения к собственным переживаниям, но боль по определению является ощущением субъективным [206]. Кроме того, биохимические механизмы, ответственные за психологическое состояние пациента и передачу ноцицептивных сигналов имеют много общего. Это может быть связано с наличием общих нейротрансмиттеров, путей их метаболизма и рецепторного аппарата. Известно, эндогенная опиоидная система связана не только с болевыми ощущениями, но также оказывает влияние на поведенческие реакции, устойчивость к стрессу, а также различные виды социальной адаптации [166,171,172]. Вероятно, именно эта система служит связующим звеном между эмоциональной реакцией пациента на боль и ноцицепцией. 96 Реализация фармакологического действия наркотических аналгетиков осуществляется через систему специфических опиоидных рецепторов, которые являются универсальными для эндо- и экзогенных опиатов. Ген OPRM1 обладает рядом послеоперационной полиморфизмов, аналгезии данной связанных группой с эффективностью препаратов, наиболее изучаемым среди которых является однонуклеотидный полиморфизм 118А>G (rs1799971). Другим важным компонентом передачи и восприятия боли является модуляция болевого сигнала в ЦНС, которая реализуется через адренергические системы и связана с уровнем таких медиаторов, как адреналин, норадреналин, дофамин. Их количество в синапсах ЦНС во многом определяется деятельностью фермента COMT, активность которого сильно зависит от полиморфизма соответствующего гена (1947G>A, rs4680) и может различаться в несколько раз [21]. Указанные полиморфизмы могут оказывать влияние на индивидуальное восприятие боли, поэтому изучение данной взаимосвязи может способствовать развитию персонализированного подхода к аналгезии. Среди обследованных пациентов частота генотипа A118A составила 66%, A118G – 24%, G118G – 10%, что не соответствует закону Харди-Вайнберга. Это может быть обусловлено селекцией в отношении некоторых аллельных вариантов данного гена [21], а также многонациональным составом населения полуострова Крым. При этом полученные результаты занимают промежуточное положение между восточными и западными странами. Так, в Японии частота генотипа GG, связанного с изменением эффективности действия НА, существенно выше, чем в Крыму и составляет 21,3% [207], а например, в Норвегии значительно ниже – 4% [177]. Распределение генотипов SNP COMT 1947G>A было следующее: A1947A – 21%, G1947A – 51%, G1947G – 28%, которое соответствует закону ХардиВайнберга. Полученное распределение SNP COMT 1947G>A сходно с распределением в большинстве европейских стран [21,152], но статистически 97 значимо отличается от азиатского региона, в частности, в Филиппинах частота генотипа А1947А составила 1%, G1947A – 32%, G1947G – 67% [208]. Продемонстрированные изменения частоты мутантного аллеля G гена OPRM1 и аллеля А гена COMT среди различных стран свидетельствуют о том, что этнические различия восприятия боли могут иметь генетическую природу. В настоящей работе впервые предпринимается попытка оценить распространенность комбинаций SNP COMT 1947G>A и OPRM1 118A>G в Республике Крым и Российской Федерации. Безусловно, с точки зрения генетики, экстраполяция полученных данных на всю популяцию будет неправомочной, поскольку для этого необходимо оценивать частоты в группе здоровых доноров. Однако наличие обсуждаемых полиморфных вариантов генов OPRM1 и COMT и связанных с ними особенностей применения наркотических аналгетиков имеет значение не столько для популяции в целом, сколько для людей, подвергающихся объемным хирургическим вмешательствам. Поэтому полученные данные все же имеют существенное практическое значение, так как исследование проведено с участием пациентов, которым были выполнены операции, относящиеся к высшей категории травматичности. В ходе исследования оказалось, что группы пациентов в зависимости от вида генотипа OPRM1 SNP 118А>G сопоставимы по возрасту, физическому статусу, но отличаются по полу. Среди носителей генотипа A118G+G118G количество лиц женского пола было выше, чем среди носителей генотипа A118A (p<0,05). Учитывая, что для данного полиморфизма не характерно сцепленное с полом наследование [16], для изучения полученной взаимосвязи и формулировки определенных выводов необходимо проведение дополнительных исследований. Полученные результаты свидетельствуют, что SNP 118А>G гена OPRM1 может оказывать влияние на уровень послеоперационной боли (таблица 3.10). Более высокая потребность в дополнительном обезболивании у носителей 98 генотипа A118G+G118G говорит о том, что определение этого генотипа может иметь значение для разработки индивидуального подхода к назначению опиоидов с целью послеоперационной аналгезии. Полученные данные подтверждаются результатами мета-анализа Walter C. и Lötsch J. (2009), согласно которому носителям мутантного аллеля G требуются более высокие дозы опиоидов для эффективного контроля послеоперационной боли [176]. Связь SNP OPRM1 118A>G с уровнем предоперационной тревоги и депрессии (таблица 3.13) подтверждает влияние эндогенной опиоидной системы на психологическое состояние пациентов. Учитывая, что чувствительность данной системы к НА отличается у тревожных и позитивно настроенных пациентов (рисунок 4.14), можно сказать, что она является связующим звеном между психологическим статусом и индивидуальным восприятием болевых ощущений пациента. Согласно нашему исследованию, у носителей генотипа A118G+G118G повышен уровень предоперационной тревоги и депрессии, а также увеличена потребность в дополнительном обезболивании. Есть вероятность, что SNP OPRM1 118A>G оказывает влияние на эффективность аналгезии опиоидами через эмоциональную сферу, изменяя тревожную реактивность пациента. И, несмотря на то, что данная гипотеза требует тщательной проверки, полученные данные могут служить отправной точкой для дальнейших исследований в этом направлении. В ходе работы установлено, что SNP COMT 1947G>A может оказывать существенное влияние на эффективность послеоперационной аналгезии с помощью опиоидов (таблица 3.11). Подобная связь SNP COMT 1947G>A с интенсивностью боли после операции подтверждается в ряде других исследований. Показано, что носителям генотипа А1947А для достижения адекватного обезболивания в послеоперационном периоде требуются меньшие дозы морфина по сравнению с носителями G1947A и G1947G [153]. Аналогичные результаты получены при лечении онкологической боли и хронической боли в спине [152,154]. Такое влияние может иметь следующее 99 объяснение. Низкая активность фермента у носителей генотипа А1947А приводит к высокому содержанию катехоламинов в системах, ответственных за модуляцию боли в ЦНС, их активации и усилению нисходящего ингибирующего влияния на восприятие ноцицептивных сигналов [155]. Также существует мнение, что хроническая гиперактивация адренергической системы сопровождается увеличением количества опиоидных µ-рецепторов [152]. Именно этим может объясняться тот факт, что на фоне аналгезии промедолом у носителей генотипов G1947A и G1947G интенсивность боли на 40-60% выше, по сравнению с носителями генотипа А1947А. Нам не удалось выявить влияние SNP COMT 1947G>A на уровень предоперационной тревоги и депрессии. С одной стороны, это может быть связано с тем, что в процессах деградации катехоламинов в ЦНС участвуют и другие ферменты, в частности, моноаминооксидаза [161]. С другой – на психологическое состояние пациента оказывают влияние не только особенности метаболизма медиаторов ЦНС, но и социальные факторы. Именно поэтому боль в настоящее время рассматривается в рамках так называемой биопсихосоциальной модели, которая учитывает индивидуальные особенности пациента и влияние окружающей среды [77]. Как уже упоминалось выше, SNP 118A>G гена OPRM1 и SNP 1947G>A гена COMT способны влиять на эффективность аналгезии опиоидами, при этом более низкая потребность в анальгетиках и интенсивность боли наблюдается у гомозигот OPRM1 А118А и COMT А1947А [21,177]. Поэтому вполне логично, что у носителей комбинации SNP COMT-OPRM1 A1947A-A118A наблюдалась самая низкая интенсивность болевого синдрома в первые сутки после операции (рисунок 3.2). С одной стороны, на фоне низкой активности СОМТ у носителей А1947А имеются предпосылки для высокого содержания катехоламинов в синапсах, ответственных за модуляцию боли, с другой – адекватное количество структурно неизмененных µ-рецепторов у носителей A118А . 100 Аналогичные данные получили C.C. Reyes-Gibby и соавт. (2007), которые оценивали влияние SNP COMT 1947G>A и OPRM1 118A>G на потребность в морфине у пациентов с онкологической болью [184]. У носителей SNP COMT A1947A потребность в морфине для достижения адекватной аналгезии была соответственно на 23% и 63% ниже по сравнению с носителями G1947A и G1947G. А у гомозиготных носителей SNP OPRM1 A118A она была на 93% ниже по сравнению с G118G. При оценке влияния комбинации данных SNP на эффективность аналгезии наименьшая потребность в морфине выявлена у носителей комбинации А1947А-А118А. В настоящей работе впервые проводится изучение взаимосвязи комбинаций SNP COMT 1947G>A и OPRM1 118A>G с предоперационным психологическим состоянием пациента. Установлено, что данные полиморфизмы оказывают влияние на уровень предоперационной тревоги по шкале HADS (рисунок 3.5), при этом наиболее низкий уровень тревоги выявлен у носителей генотипа G1947G-A118A, частота встречаемости которого составила 15%. Следовательно, полученные данные могут быть использовании для прогнозирования выраженности тревоги среди пациентов, а значит, и эффективности послеоперационной аналгезии. Дальнейшие исследования относительно комбинаций SNP COMT 1947G>A и OPRM1 118A>G целесообразно проводить минимум в двух направлениях. Во-первых, это увеличение числа пациентов в группах, поскольку частоты некоторых комбинаций (таблица 3.12) были слишком низкими для проведения статистически обоснованных сравнений. Во-вторых, это изучение влияния других генов и их комбинаций на эффективность применения наркотических аналгетиков, в первую очередь, кодирующих ферменты системы цитохрома CYP2D6, ответственных за метаболизм данной группы препаратов в печени [3]. Нами было установлено, что лучший ответ на применение трмепередина наблюдается при наличии комбинации SNP COMT-OPRM1 A1947A-A118A 101 (рисунок 3.12). Поскольку таких пациентов может быть до 17%, полученные данные могут стать персонализированного первым существенным подхода к шагом обезболиванию к разработке после объемных хирургических вмешательств. Полученные нами результаты подтверждают данные современных научных обзоров [16,176] и имеют существенное практическое значение по ряду причин. Понимание возможных причин индивидуальной вариабельности фармакологических эффектов наркотических анальгетиков среди пациентов позволит разработать новые методики оценки предоперационного физического и психологического состояния и проводить обезболивание с учетом потребностей каждого конкретного пациента [209]. Результаты настоящего исследования имеют значение еще и потому, что влияние психологических и генетических особенностей на интенсивность боли после операции продемонстрированы на специфическом контингенте урологических больных, поскольку до этого клинические рекомендации, посвященные проблеме послеоперационного обезболивания в урологии, практически полностью базировались на данных, полученных в других областях хирургии [28]. 4.2. Влияние психологических и генетических особенностей пациентов на развитие побочных эффектов тримеперидина Одной из задач настоящего исследования являлся поиск предикторов развития побочных эффектов опиоидов с учетом предоперационного психологического состояния и генетических особенностей пациентов. В ходе настоящей работы установлена следующая частота основных ПЭ (рисунок 3.6). Аналогичные ПЭ при использовании тримеперидина выявлены в исследовании Еременко А.А. и соавт. (2013), где данный препарат вводился в условиях КПА. Частота тошноты в этой работе составила 30-35%, слабости и сонливости – 3545%, головокружения – 25-35% [210]. В ходе нашего исследования также 102 установлено, что ПЭ опиоидов подвержены значительной вариабельности среди пациентов, что может быть связано с психологическими и генетическими особенностями пациента. У пациентов с клинически выраженной тревогой по шкале HADS отмечается увеличение выраженности головокружения, сонливости и частоты рвоты. Наличие симптомов депрессии по шкалам HADS и PHQ-9 связано с достоверным увеличением степени центральных ПЭ опиоидов и тенденцией к увеличению выраженности тошноты. Корреляционный анализ выявил большее влияние психологической гастроинтестинальные ПЭ дизадаптации на наркотических центральные, аналгетиков. Таким нежели образом, полученные данные свидетельствуют, что уровень предоперационной тревоги и депрессии в разной степени оказывает влияние на формирование гастроинтестинальных и центральных ПЭ опиоидов. Причины найденной взаимосвязи остаются предметом дискуссий. В условиях сильных переживаний у пациентов может наблюдаться так называемая «соматизация тревоги», сопровождающаяся фиксацией пациента на телесном дискомфорте, увеличением выраженности тошноты и головокружения [130]. Вероятно, тревожно-фобические расстройства могут приводить к активации лимбической системы, что, совместно с действием опиоидов, обуславливает ответственных за повышенную возникновение стимуляцию тошноты, рвоты, регионов мозга, головокружения и сонливости у данной категории пациентов. Полученные данные свидетельствуют, что психологический статус пациента может служить предрасполагающим фактором относительно возникновения ПЭ опиоидов. Комплексная оценка уровня предоперационной тревоги и депрессии по шкале HADS и PHQ-9 наряду с другими факторами риска позволит более точно прогнозировать нежелательные ПЭ наркотических аналгетиков и выбирать соответствующую стратегию их профилактики и коррекции. В свою очередь, перспективным направлением дальнейших 103 исследований остается разработка и внедрение методов, направленных на уменьшение психологического дискомфорта в пред- и послеоперационном периоде. В ходе настоящего исследования обнаружена взаимосвязь между изучаемыми полиморфизмами и выраженностью ПЭ опиоидов (таблица 3.18,3.19, рисунок 3.7). В литературе нет единого мнения относительно механизмов влияния SNP OPRM1 118A>G на выраженность ПЭ опиоидов. На наш взгляд, выявленная зависимость может иметь следующее объяснение. Наличие генотипа OPRM1 G118G связано с изменением белковой структуры µ-рецепторов и повышением их аффинитета к эндогенным опиатам, в частности, β-эндорфину [21]. Это может приводить к хронической гиперактивации эндогенной опиоидной системы, в том числе в регионах ЦНС, связанных с тошнотой, рвотой и головокружением – хеморецепторной триггерной зоне, вестибулярном лабиринте внутреннего уха. Поэтому даже небольшие дозы опиоидов могут усиливать стимуляцию указанных областей и вызывать более тяжелые ПЭ у данной категории пациентов. Существуют также исследования, свидетельствующие о возможной связи SNP OPRM1 118A>G с выраженностью эмоциональной реакции на различные события [171,172], а уровень предоперационной тревоги, в свою очередь, является одним из предикторов тяжести ПЭ наркотических анальгетиков [123]. В некоторых других исследованиях не отмечается связи данного SNP с выраженностью ПЭ опиоидов, что авторы связывают с преобладающим влиянием других факторов (вид операции, анестезии, используемые препараты и др.) [16,21]. Поскольку метаболизм катехоламинов в ЦНС определяет течение множества физиологических процессов – преобладания тонуса симпатический нервной системы, модуляции боли, эмоционального фона, влияние SNP COMT 1947G>A на выраженность ПЭ опиоидов является закономерным. Наличие подобной связи подтверждается работами других авторов. Показано, что после абдоминальных гистерэктомий и простатэктомий на фоне аналгезии опиоидами 104 в группе носителей G1947G уровень тошноты был выше по сравнению с носителями G1947A и A1947A [21]. Аналогичное влияние данного полиморфизма на проявление тошноты и рвоты отмечено у онкологических больных, длительно получающих наркотические аналгетики [163]. Кроме того, у носителей генотипов G1947A и G1947G отмечается повышение интенсивности боли после операции [153], что может быть одной из причин различия уровня седации в послеоперационном периоде. Наконец, SNP COMT 1947G>A сопровождается изменением количества µ-рецепторов, что также может влиять на выраженность центральных и кожных ПЭ опиоидов [152]. Оценка взаимосвязи комбинаций SNP COMT 1947G>A-OPRM1118A>G с выраженностью различных ПЭ выявила существенную тенденцию их влияния на выраженность тошноты (рисунок 3.7). Оказалось, что наименьший уровень тошноты наблюдается у носителей генотипа А1947А-А118А, частота встречаемости которого составила 17% среди обследованных пациентов. Таким образом, SNP OPRM1 118A>G и COMT 1947G>A могут влиять на индивидуальные различия в фармакологических эффектах опиатов и должны учитываться при разработке персонализированного подхода к лечению боли. Безусловно, изучение генетических особенностей для прогноза низкой эффективности опиоидов и выраженности ПЭ в большей мере является медициной будущего. Однако, фармакогенетика активно развивается в настоящее время, и ряд передовых стран уже выпустили рекомендации по использованию некоторых НА у пациентов с различными видами полиморфизмов гена CYP2D6 [150]. Принятие во внимание не только генетических, но и психологических особенностей пациентов является первым шагом к разработке биопсихосоциальной модели лечения острой боли, которая подразумевает патогенетически обоснованный, мультидисциплинарный, более эффективный и безопасный подход к терапии болевого синдрома. 105 4.3. Прогностическая ценность различных диагностических тестов и их комбинаций относительно развития сильной боли после операции и побочных эффектов опиоидов Результаты проведенного исследования показали, что у пациентов с субклинически и клинически выраженной тревогой и депрессией по шкалам HADS и PHQ-9 возрастает риск возникновения сильной боли после операции (таблица 3.17). Также нами выявлена взаимосвязь SNP COMT1947G>A с интенсивностью боли после операции (таблица 3.11), что дало основания изучить все указанные параметры в качестве методов прогнозирования сильного болевого синдрома на фоне аналгезии опиоидами у хирургических пациентов. В ходе работы оказалось, что каждый показатель в отдельности обладает недостаточной чувствительностью, специфичностью и прогностической значимостью. Однако, исходя из полученных данных, можно выделить наиболее приемлемые диагностические тесты. На наш взгляд, таковыми являются шкала HADSтревога, у которой выявлен достаточно высокий показатель специфичности – 84% и AUC=0,802, а также генетический тест COMT1947G>A, обладающий более высокой чувствительностью – 88,7%. По совокупности показателей прогностической значимости и LR+, лучшим диагностическим тестом, на наш взгляд, является шкала HADSтревога (PPV – 5,5%; NPV – 55,1%; LR+=3,7). Этот факт также подтверждается графиком посттестовой вероятности возникновения сильной боли после операции (рисунок 3.9). Данные показатели возрастают при комбинированном применении двух диагностических тестов (таблица 3.18). комбинациями, исходя из Мы считаем, что лучшими проведенных расчетов, являются HADSтревога+HADSдепрессия, HADSтревога+PHQ-9, HADSтревога+COMT 1947G>A. 106 Последняя комбинация является оптимальной согласно проведенному расчету PPV, NPV и LR+ (таблица 3.19). Безусловно, в медицинской диагностике оптимален тот метод исследования, который был бы априорно как высокоспецифичен, так и высокочувствителен. Однако в реальности это труднодостижимо, так как повышение чувствительности теста неизбежно будет сопровождаться потерей его специфичности и наоборот, повышение специфичности сопряжено со снижением его чувствительности. Высокочувствительные методы являются идеальными идентификаторами заболеваний, поэтому их рекомендуется применять на ранних этапах диагностического процесса, когда требуется сузить круг предполагаемых диагнозов. Методики диагностики с высокой чувствительностью редко «пропускают» пациентов, у которых имеется болезнь. Наряду с этим высокочувствительный тест дает много «ложных тревог», что требует дополнительных затрат на дальнейшее обследование. Для комбинированного теста повышение чувствительности достигается применением правила «Or rule» (таблица 3.18) [195]. Высокоспецифичные тесты нужны для подтверждения (установления) диагноза, то есть при положительном результате врач должен быть почти уверен в том, что не поставил пациенту несуществующий диагноз. Для комбинированного теста повышение специфичности достигается применением правила «And rule» (таблица 3.18) [195]. Следовательно, можно сделать вывод, что стремиться найти тест со 100% специфичностью или 100% чувствительностью не является целесообразным. Идеальный соотношением диагностический чувствительности тест и должен обладать специфичности, оптимальным которое позволит минимизировать количество ложноположительных и ложноотрицательных результатов. 107 В отношении настоящего исследования, на наш взгляд, для проведения скрининга и выделения пациентов группы риска по развитию сильной боли после операции и низкой эффективности НА, более гуманным является применение высокочувствительного теста. Таким образом, максимальное количество пациентов с возможным развитием сильного болевого синдрома будет под пристальным наблюдением специалистов, а число «пропусков» пациентов группы риска будет минимальным. Методом логистической предикторная модель регрессии относительно была определена наилучшая возникновения сильной послеоперационной боли – HADSтревога+PHQ-9+COMT1947G>A, обладающая самым высоким процентом конкордации и AUC (таблица 3.21). Комбинация HADSтревога+PHQ-9 (таблица 3.21) также обладает приемлемыми показателями и может быть использована в практике для выделения пациентов группы риска. В ходе настоящей работы установлено влияние психологических и генетических особенностей пациентов на частоту возникновения рвоты в послеоперационном периоде на фоне аналгезии опиоидами (таблица 3.22), что позволяет рассматривать данные показатели в качестве методов прогнозирования. Наиболее приемлемыми показателями чувствительности, специфичности и прогностической значимостью относительно рвоты, на наш взгляд, обладает шкала HADSтревога (рисунок 3.13). Это также подтверждается графиком посттестовой вероятности возникновения рвоты (рисунок 3.15). Комбинированное использование HADSтревога+OPRM1118A>G приводит к увеличению данных показателей (таблица 3.23). Методом логистической регрессии выявлена наилучшая предикторная модель относительно возникновения рвоты – HADSтревога+ SNP OPRM1 118A>G +пол пациента. AUC для данной модели составила 0,76 (95% ДИ 0,66-0,84), что соответствует хорошей диагностической способности теста. 108 Указанные методы прогнозирования являются первым шагом к усовершенствованию терапии болевого синдрома, неотъемлемой составляющей которой является снижение выраженности и частоты возникновения побочных эффектов опиатов. Своевременный и достоверный прогноз нежелательных последствий операции и применяемой фармакотерапии может позволить заранее планировать лечебные мероприятия, а значит, и избежать возможных серьезных последствий. Тратить время на тесты, обладающие низкой информативностью, в условиях современной медицины нет смысла, в то время как методы обследования с высокой предсказательной ценностью (≥ 80%) и показателем AUC (≥0,7) могут ускорить и облегчить труд специалистов, а также улучшить результаты послеоперационного обезболивания в целом. 109 ВЫВОДЫ 1. Одной из причин неадекватной послеоперационной аналгезии путем внутримышечного введения фиксированных доз тримеперидина является значительная вариабельность индивидуальной реакции пациентов на применение препаратов данной группы, что обуславливает необходимость ее оценки в рамках современной концепции биопсихосоциальной модели боли. 2. Предоперационное психологическое состояние пациентов оказывает влияние на эффективность послеоперационной аналгезии: показатели интенсивности боли в группах с субклинически и клинически выраженной тревогой и депрессией по шкалам HADS и PHQ-9 выше, по сравнению с группой без психологических расстройств. 3. Частоты генотипов полиморфизма 118A>G гена OPRM1 среди обследованных пациентов составляют: А118А – 66%, A118G – 24%, G118G – 10%; полиморфизма 1947G>A гена COMT: A1947A – 21%, G1947A – 51%, G1947G – 28%. Низкая эффективность аналгезии опиоидами связана с наличием генотипов COMT G1947A и G1947G, OPRM1 A118G и G118G. Наилучший ответ на терапию тримеперидином наблюдается у носителей комбинации COMT A1947A-OPRM1 A118A. 4. Полиморфизм гена OPRM1 118A>G оказывает влияние на предоперационное психологическое состояние пациентов: наличие мутантного аллеля G обуславливает более высокий уровень предоперационной тревоги и депрессии по шкалам HADS и PHQ-9. 5. Предоперационное психологическое состояние пациентов влияет на частоту побочных эффектов опиоидов: в группе с клинически выраженной тревогой и депрессией по шкале HADS и PHQ-9 наблюдается более выраженная сонливость, головокружение и повышенная частота рвоты. 6. Полиморфизмы генов OPRM1 118A>G и COMT 1947G>A влияют на выраженность побочных эффектов опиодиов: более высокий уровень седации наблюдается у носителей генотипов COMT A1947A и G1947A; 110 тошнота и рвота более выражены при наличии SNP COMT G1947A и G1947G, SNP OPRM1 A118G и G118G; кожные проявления чаще наблюдаются у носителей SNP COMT G1947G. 7. Наилучшей прогностической моделью относительно сильной боли после операции является комбинированная оценка PHQ-9 и развития рвоты в HADSтревога, генотипирование COMT 1947G>A. Относительно послеоперационном периоде лучшей прогностической комбинацией является HADSтревога, генотипирование OPRM1 118A>G и пол пациента. 111 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. С целью раннего выявления пациентов с высоким риском низкой эффективности опиоидов показано применение следующей комбинации диагностических тестов: шкалы HADSтревога и PHQ-9. Группу повышенного риска составляют пациенты с субклинически и клинически выраженной тревогой (≥8 баллов) и симптомами депрессии (≥5 баллов). 2. При наличии целесообразно возможности применять выполнения следующую генетического комбинацию исследования тестов: шкалы HADSтревога и PHQ-9, генотипирование SNP COMT 1947G>A. Группу повышенного риска неадекватной аналгезии составляют пациенты с субклинически и клинически выраженной тревогой (≥8 баллов), симптомами депрессии (≥5 баллов), а также полиморфными вариантами SNP COMT G1947A и G1947G. 3. С целью прогнозирования возникновения рвоты в раннем послеоперационном периоде показано применение следующей комбинации тестов: шкала HADSтревога и пол пациента. К предикторам относятся женский пол и наличие тревоги ≥8 баллов. 4. При наличии рекомендуется возможности применять выполнения следующую генетического комбинацию исследования тестов: шкала HADSтревога, генотипирование SNP OPRM1 118G>A и пол пациента. К предикторам развития рвоты относятся женский пол, наличие субклинически и клинически выраженной тревоги (≥8 баллов) и полиморфных вариантов гена OPRM1 A118G и G118G. 112 ПЕРСПЕКТИВЫ ДАЛЬНЕЙШЕЙ РАЗРАБОТКИ ТЕМЫ Перспективным направлением дальнейших исследований может стать разработка и внедрение индивидуального подхода к послеоперационной аналгезии, основанного на предоперационной оценке психологических и генетических факторов пациентов, а также поиск дополнительных параметров, позволяющих повысить точность выявления пациентов с высоким риском интенсивной боли после операции. Поскольку формирование болевого ощущения происходит при участии большого количества генов, дальнейшее изучение роли отдельных полиморфизмов и их комбинаций позволит приблизиться к формированию единого представления о «генетике боли» и разработке персонализированного подхода к ее лечению. ПЕРЕЧЕНЬ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ИССЛЕДОВАНИЯ: 1. Бояркина А.В. Риск возникновения сильной боли после операции зависит от предоперационного психологического состояния пациентов / А.В. Бояркина // Запорожский медицинский журнал. – 2013. – №6. – С.10-12. 2. Бояркина А.В. Влияние предоперационного психологического состояния пациентов на выраженность побочных эффектов опиоидов / А.В. Бояркина // Таврический журнал психиатрии. – 2013. – №3. – С.61-65. 3. Бояркина А.В. Послеоперационная аналгезия: роль полиморфизма 118A>G гена µ 1-опиоидного рецептора / А.В. Бояркина, А.Л. Потапов // Біль, знеболювання і інтенсивна терапія. – 2013. – №4. – С.63-66. Соискатель самостоятельно провел набор материала исследования, математическую обработку и анализ полученных данных. 4. Бояркина А.В. Влияние полиморфизма гена катехол-О-метилтрансферазы на интенсивность боли после объемных урологических операций в условиях аналгезии опиоидами / А.В. Бояркина, А.Л. Потапов, А.А.Бабанин // Український журнал екстремальної медицини імені Г.О.Можаєва. – 2013. – 113 №4. – С.109-112. Соискатель самостоятельно провел набор материала исследования, математическую обработку и анализ полученных данных. 5. Потапов А.Л. Значение однонуклеотидных полиморфизмов генов катехол-Ометилтрансферазы и µ 1-опиоидного рецептора для послеоперационной аналгезии наркотическими аналгетиками / А.Л. Потапов, А.В. Бояркина, А.А. Бабанин // Медицинский журнал Западного Казахстана. – 2013. – №4. – С.29-33. Соискателю принадлежит идея исследования, самостоятельно проведен анализ литературы и статистическая обработка полученных данных. 6. Бояркіна Г.В. Інтенсивність болю після операції пов’язана з рівнем передопераційної тривоги і депресії / Г.В. Бояркіна, О.Л. Потапов // Біль, знеболювання і інтенсивна терапія. – 2013. – №2д. – С.48-50. Соискателем самостоятельно выполнен клинический раздел, совместно с научным руководителем сделаны выводы. 7. Boiarkina A.V. Psychological condition of patients affects the intensity of pain after major urological surgeries / A.V. Boiarkina, A.L. Potapov, A.A. Babanin // Crimea Journal of Experimental and Clinical Medicine. – 2013. – Vol.3, №1-2. – P.1-6. Соискатель самостоятельно провел набор материала исследования и его математическую обработку. 8. Do preoperative psychological condition and µ1-opioid receptor gene polymorphism 118A>G affect opioid analgesia efficacy after major urological surgeries? / A.V. Boiarkina, A.L Potapov., A.A. Babanin [et al.] // Journal of Health Sciences. – 2013. – Vol.3, №10. – P.605-612. Соискателю принадлежит идея и дизайн исследования, самостоятельно выполнен клинический раздел, совместно с научным руководителем проведен анализ материала и сделаны выводы. 9. Бояркина А.В. Влияние генетических факторов на выраженность побочных эффектов опиоидов у пациентов после объемных хирургических вмешательств / А.В. Бояркина, А.Л. Потапов // Клінічна хірургія. – 2014. – №5. – С.52-55. Соискателю принадлежит идея и дизайн исследования, 114 самостоятельно выполнен клинический раздел, совместно с научным руководителем проведен анализ материала и сделаны выводы. 10.Бояркина А.В. Влияние психологических и генетических факторов на интенсивность боли после объемных операций / А.В. Бояркина, А.Л. Потапов, А.А. Бабанин, В.А. Бендерук // Материалы XI Всероссийской научно-методической конференции с международным участием «Стандарты и индивидуальные подходы в анестезиологии и реанитматологии», 18-20 мая 2014 г., Геленджик, Россия. – С.11-12. Соискателю принадлежит идея и дизайн исследования, самостоятельно выполнен клинический раздел, совместно с научным руководителем проведен анализ материала и сделаны выводы. 11.Potapov O. Catechol-O-methyltransferase (COMT) and opioid µ-1 receptor (OPRM1) gene single nucleotide polymorphisms (SNP) and postoperative opioid analgesia // O. Potapov, G. Boiarkina, A. Babanin // European Journal of Anaesthesiology. – 2014. – Vol.31, e-Supplement 52. – P.220. Соискатель самостоятельно выполнил математическую обработку данных и анализ результатов исследования. 115 СПИСОК ЛИТЕРАТУРЫ 1. Pain intensity on the first day after surgery: a prospective cohort study comparing 179 surgical procedures / H.J. Gerbershagen, S. Aduckathil, A.J. Wijck et al. // Anesthesiology. – 2013. – Vol.118, №4. – Р.934-944. 2. Лечение послеоперационной боли у урологических больных / С.А. Матвеев, И.Г. Жданов, В.В. Щуковский и соавт. // Саратовский научно-медицинский журнал. – 2009. – Т.5, №2. – С.177-179. 3. Acute Pain Management: Scientific Evidence (3rd edition) / P.E. Macintyre, S.A. Schug, D.A. Scott еt al. – Melbourne.: ANZCA & FPM, 2010. – 491 p. 4. Овечкин А.М. Послеоперационная боль и обезболивание: современное состояние проблемы / А.М. Овечкин // Избранные лекции по регионарной анестезии и лечению послеоперационной боли. Под ред. А.М. Овечкина, Е.С. Горобца, Е.М. Шифмана. – Петрозаводск, «ИнтелТек», 2009. – С.297326. 5. Лесной И.И. Острая послеоперационная боль, проблемы и пути решения / И.И. Лесной, Е.Ю. Белка, Ю.Л. Кучин // Біль, знеболювання і інтенсивна терапія. – 2011. – №1. – С.22-29. 6. White P.F. Improving postoperative pain management. What are the unresolved issues / P.F. White, H. Kehlet // Anesthesiology. – 2010. – Vol.112, №1. – Р.220225. 7. Boezaart A.P. Acute pain medicine in anesthesiology / A.P. Boezaart, A.P. Munro, P.J. Tighe // F1000Prime Rep. – 2013. – Vol.5. – P.1-6. 8. Послеоперационная боль. Руководство / Под ред. Ф.М. Ферранте, Т.Р. ВейдБопкора; пер. с англ. М.А. Карачунского, Е. В. Мельниковой. – М.: Медицина, 1998. – 640 с. 9. Кобеляцкий Ю.Ю. Современные подходы к периоперационной аналгезии в различных областях хирургии с доказательных позиций / Ю.Ю. Кобеляцкий // Медицина неотложных состояний. – 2011. – №1-2. – С. 41-52. 116 10. Risk factors for acute and chronic postoperative pain in patients with benign and malignant renal disease after nephrectomy / H.J. Gerbershagen, O. Dagtekin, T. Rothe et al. // Eur J Pain. – 2009. – Vol.13, №8. – P.853-860. 11. Потапов А.Л. Сравнительная оценка индивидуальной реакции пациентов на применение различных методов послеоперационной аналгезии / А.Л. Потапов // Медицина неотложных состояний. – 2013. – №6. – С.171-173. 12. Rawal N. Epidural technique for postoperative pain: gold standard no more? / N. Rawal // Reg Anesth Pain Med. – 2012. – Vol.37, №3. – P.310-317. 13. Kettner S.C. Does regional anaesthesia really improve outcome? / S.C. Kettner, H. Willschke, P. Marhofer // Br J Anaesth. – 2011. – Vol.107 (S1). – P.i90-i95. 14. Choi D.X. For patients undergoing pancreatoduodenectomy, epidural anesthesia and analgesia improves pain but increases rates of intensive care unit admissions and alterations in analgesics / D.X. Choi, L.O. Schoeniger // Pancreas. – 2010. – Vol.39, №4. – P.492-497. 15. Pratt W.B. Epidural analgesia for pancreatoduodenectomy: a critical appraisal / W.B. Pratt, R.A. Steinbrook, S.K. Maithel et al. // J Gastrointest Surg. – 2008. – Vol.12, №7. – P.1207-1220. 16. Consequences of the 118A>G polymorphism in the OPRM1 gene: translation from bench to bedside? / E. Mura, S. Govoni, M. Racchi et al. // J Pain Res. – 2013. – Vol.6. – P.331-353. 17. Махарин О.А. Полиморфизм генов системы детоксикации ксенобиотиков и его роль в биотрансформации внутривенных анестетиков / О.А. Махарин, Ю.С. Макляков, В.М. Женило // Биомедицина. – 2012. – №3. – С.98-107. 18. Генетика и медицина критических состояний: от теории к практике / В.В. Мороз, Т.В. Смелая, А.М. Голубев, Л.Е. Сальникова // Общая реаниматология. – 2012. – №4. – С.5-12. 19. Pain modality- and sex-specific effects of COMT genetic functional variants / I. Belfer, S.K. Segall, W.R. Lariviere et al. // Pain. – 2013. – Vol.154, №8. – P.1368-1376. 117 20. Махарин О.А. Фармакодинамический анализ влияния полиморфизма гена м-опиоидного рецептора на течение тотальной внутривенной анестезии / О.А. Махарин, Ю.С. Макляков, В.М. Женило // Медицинский вестник Юга России. – 2014. – №1. – С.65-70. 21. Combined Catechol-O-Methyltransferase and µ-Opioid Receptor Gene Polymorphisms Affect Morphine Postoperative Analgesia and Central Side Effects / Y. Kolesnikov, B. Gabovits, A. Levin et al. // Pain Medicine. – 2011. – Vol.112, №2. – P.448-453. 22. Бурлев А.В. Фармакогенетические аспекты клинической анестезиологии / А.В. Бурлев, Е.М. Шифман // Анестезиология и реаниматология. – 2010. – №6. – С.83-86. 23. Влияние полиморфизма гена OPRM1 118/G на перцепцию боли и фармакодинамику наркотических анальгетиков / В. М. Женило, О. А. Махарин // Общая реаниматология. – 2014. – №1. – С.58-67. 24. Way B.M. Variation in the mu-opioid receptor gene (OPRM1) is associated with dispositional and neural sensitivity to social rejection / B.M. Way, S.E. Taylor, N.I. Eisenberger // Proc Natl Acad Sci U S A. – 2009. – Vol.106, №35. – P.15079-15084. 25. Hopkins S.C. Catechol-O-methyltransferase genotype as modifier of superior responses to venlafaxine treatment in major depressive disorder / S.C. Hopkins, D.S. Reasner, K.S Koblan // Psychiatry Res. – 2013. – Vol.208, №3. – P.285-287. 26. Correlation of postoperative pain to quality of recovery in the immediate postoperative period / C.L. Wu, A.J. Rowlingson, A.W. Partin et al. // Reg Anesth Pain Med. – 2005. – Vol.30, №6. – P.516-522. 27. Postoperative Pain Management – Good Clinical Practice / J.D. Andrés, H.B.J. Fischer, G. Ivani et al. – European society of Regional Anaesthesia and Pain Therapy, 2005. – 57p. Available from: http://esraeurope.org/ Postoperative Pain Management.pdf 118 28. Guidelines on Pain Management and Palliative care / A. Paez Borda, F. CharnaySonnek, V.Fonteyne, E.G. Papaioannou. – European Association of Urology, 2013. – 96p. 29. Kopf A. Guide to Pain Management in Low-Resource Settings / A. Kopf, N.B. Patel // IASP Press, 2010. – 371p. 30. Уваров Д.Н. Протоколы периоперационной анальгезии (методические рекомендации для врачей) / Д.Н. Уваров, Э.Э. Антипин, Ю.В. Суханов. – Архангельск, 2012. – 44с. 31. Al Mejade A.H. Acute Pain Service: Operations Manual / A.H. Al Mejade, F. Jafri. – Kuwait, 2012. – 70p. 32. Clinical Practice Guidelines for the Management of Pain, Agitation, and Delirium in Adult Patients in the Intensive Care Unit / J. Barr, G.L. Fraser, K. Puntillo et al. // Crit Care Med. – 2013. – Vol.41, №1. – P.263-306. 33. Овечкин А.М. Послеоперационная боль и обезболивание: современное состояние проблемы / А.М. Овечкин, С.В. Свиридов // Медицина неотложных состояний. – 2011. – №6. – С.20. 34. White P.F. Improving postoperative pain management: what are the unresolved issues? / P.F. White, H. Kehlet // Anesthesiology. – 2010. – Vol.112, №1. – P.220–225. 35. The prevalence of postoperative pain in a sample of 1490 surgical inpatients / M. Sommer, J.M. de Rijke, M. van Kleef et al. // M Eur J Anaesthesiol. – 2008. – Vol.25, №4. – P.267–274. 36. Postoperative pain experience: results from a national survey suggest postoperative pain continues to be undermanaged / J.L. Apfelbaum, C. Chen , S.S. Mehta, T.J. Gan // Anesth Analg. – 2003. – Vol.97, №2. – P.534-540. 37. Hutchison R.W. Challenges in acute post-operative pain management / R.W. Hutchison // Am J Health Syst Pharm. – 2007. – Vol.64, №6. – P.S2-S5. 38. Qualitätsverbesserung in der postoperativen Schmerztherapie / W. Meissner, S. Mescha, J. Rothaug et al. // Deutsches Ärzteblatt. – 2008. – Vol.105, №50. – P.865-870. 119 39. Qualität der Schmerztherapie in deutschen Krankenhäusern / C. Maier, N. Nestler, H. Richter et al. // Deutsches Ärzteblatt. – 2010. – Vol.107, №36. – P.607-614. 40. Lorentzen V. A prospective analysis of pain experience, beliefs and attitudes, and pain management of a cohort of Danish surgical patients / V. Lorentzen, I.L. Hermansen, M. Botti // Eur J Pain. – 2012. – Vol.16, №2. – P.278-288. 41. Feasibility of International Data Collection and Feedback on Postoperative Pain Data: Proof of Concept / R. Zaslansky, C.R. Chapman, J. Rothaug et al. // Eur J Pain. – 2012. – Vol.16, №3. – P.430-438. 42. The impact of early postoperative pain on health-related quality of life / R.S. Taylor, K. Ullrich, S. Regan et al. // Pain Pract. – 2013. – Vol.13, №7. – P.515523. 43. Boezaart A.P. Acute pain medicine in anesthesiology / A.P. Boezaart, A.P. Munro, P.J Tighe // F1000Prime Rep. – 2013. – Vol.5. – P.1-6. 44. Relieving Pain in America: A Blueprint for Transforming Prevention, Care, Education, and Research / P.A. Pizzo, N.M. Clark, O. Carter-Pokras et al. – IOM (US) Committee on Advancing Pain Research, Care, and Education. – Washington, 2011. – 382p. 45. Hamill-Ruth R.J. Evaluation of pain in the critically ill Patient / R.J. Hamill-Ruth, M.L. Marohn // Crit Care Clin. – 1999. – Vol.15, №1. – P.35-54. 46. Puntillo K.A. Pain experiences of intensive care unit patients / K.A. Puntillo // Heart Lung. – 1990. – Vol.19, №5. – P.526-533. 47. Puntillo K. Stitch, stitch ... creating an effective pain management program for critically ill patients / K. Puntillo // Am J Crit Care. – 1997. – Vol.6, №4. – P.259260. 48. Practices and predictors of analgesic interventions for adults undergoing painful procedures / K.A. Puntillo, L.R. Wild, A.B. Morris et al. // Am J Crit Care. – 2002. – Vol.11, №5. – P.415-429. 120 49. Sessler C.N. Evaluating and monitoring analgesia and sedation in the intensive care unit / C.N. Sessler, M.J. Grap, M.A.E. Ramsay // Crit Care. – 2008. – Vol.12. – P.1-13. 50. Assessment of pain / H. Breivik, P.C. Borchgrevink, S.M. Allen et al. // Br J Anaesth. – 2008. – Vol.101, №1. – P.17-24. 51. American pain society recommendations for improving the quality of acute and cancer pain management: American Pain Society Quality of Care Task Force / D.B. Gordon , J.L. Dahl, C. Miaskowski et al. // Arch Intern Med. – 2005. – Vol.165, №14. – P.1574-1580. 52. Effect of preoperative nursing visit on preoperative anxiety and postoperative complications in candidates for laparoscopic cholecystectomy: a randomized clinical trial / L. Sadati, A. Pazouki, A. Mehdizadeh et al. // Scand J Caring Sci. – 2013. – Vol.27, №4. – P.994-998. 53. Implementation of a standardized pain management in a pediatric surgery unit / B. Messerer, A. Gutmann, A. Weinberg, A. Sandner-Kiesling // Pediatr Surg Int. – 2010. – Vol.26, №9. – P.879–889. 54. Effects of nonsteroidal antiinflammatory drugs on patient-controlled analgesia morphine side effects: meta-analysis of randomized controlled trials / E. Marret, O. Kurdi, P. Zufferey et al. // Anesthesiology. – 2005. – Vol.102, №6. – P.12491260. 55. Effects of postoperative, nonsteroidal, antiinflammatory drugs on bleeding risk after tonsillectomy: meta-analysis of randomized, controlled trials / E. Marret, A. Flahault, C.M. Samama et al. // Anesthesiology. – 2003. – Vol.98, №6. – P.14971502. 56. Elia N. Does multimodal analgesia with acetaminophen, nonsteroidal antiinflammatory drugs, or selective cyclooxygenase-2 inhibitors and patientcontrolled analgesia morphine offer advantages over morphine alone? Metaanalyses of randomized trials / N. Elia, C. Lysakowski, M.R. Tramer // Anesthesiology. – 2005. – Vol.103, №6. – P.1296-1304. 121 57. The risk of upper gastrointestinal bleeding in elderly users of aspirin and other non-steroidal anti-inflammatory drugs: the role of gastroprotective drugs / A. Pilotto, M. Franceschi, G. Leandro et al. // Aging Clin Exp Res. – 2003. – Vol.15, №6. – P. 494–499. 58. Nonsteroidal antiinflammatory drugs and the risk of operative site bleeding after tonsillectomy: a quantitative systematic review / S. Moiniche, J. Romsing, J.B. Dahl et al. // Anesth Analg. – 2003. – Vol.96, №1. – P.68–77. 59. Clinical tolerability of perioperative tenoxicam in 1001patients–a prospective, controlled, double-blind, multi-centre study / A.F. Merry, C.S. Webster, R.L. Holland et al. // Pain. – 2004. – Vol.111, №3. – P. 313–322. 60. McGettigan P. Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2 / P. McGettigan, D. Henry // JAMA. – Vol.296, №13. – P.1633–1644. 61. Manion S.C. Thoracic epidural analgesia and acute pain management / S.C. Manion, T.J. Brennan // Anesthesiology. – 2011. – Vol.115, №1. – P.181-188. 62. Randomized, double-blind comparison of patient-controlled epidural infusion vs nurse-administered epidural infusion for postoperative analgesia in patients undergoing colonic resection / J.J. Nightingale, M.V. Knight, B. Higgins et al. // Br J Anaesth. – 2007. – Vol.98, №3. – P. 380–384. 63. Guay J. The benefits of adding epidural analgesia to general anesthesia: a metaanalysis / J. Guay // J Anesth. – 2006. – Vol.20, №4. – P. 335–340. 64. Nishimori M. Epidural pain relief versus systemic opioid-based pain relief for abdominal aortic surgery / M. Nishimori, J.C. Ballantyne, J.H. Low // Cochrane Database Syst Rev. – 2006. – Issue 3. – 70p. 65. Protective effects of epidural analgesia on pulmonary complications after abdominal and thoracic surgery: a meta-analysis / D.M. Popping, N. Elia, E. Marret et al. // Arch Surg. – 2008. – Vol.143, №10. – P. 990–999. 122 66. Andreae M.H. Regional anaesthesia to prevent chronic pain after surgery: a Cochrane systematic review and meta-analysis / M.H. Andreae, D.A. Andreae // Br J Anaesth. – 2013. – Vol.111, №5. – P.711-720. 67. Davies J. Effect of ropivacaine on platelet function / J. Davies, R. Fernando // Anaesthesia. – 2001. – Vol.56, №7. – P. 709-710. 68. The effects of ropivacaine hydrochloride on platelet function: an assessment using the platelet function analyser (PFA-100) / J. Porter, B. Crowe, M. Cahill, G. Shorten // Anaesthesia. – 2001. – Vol.56, №1. – P.15–18. 69. Parker M.J. Anaesthesia for hip fracture surgery in adults / M.J. Parker, H.H. Handoll, R. Griffiths // Cochrane Database Syst Rev. – 2004. – Issue 4. – 81p. 70. Effects of epidural-and-general anesthesia combined versus general anesthesia alone on the venous hemodynamics of the lower limb. A randomized study / K.T. Delis, A.L. Knaggs, P. Mason, K.G. Macleod // Thromb Haemost. – 2004. – Vol.92, №5. – P.1003–1011. 71. Systematic review and meta-analysis of continuous local anaesthetic wound infiltration versus epidural analgesia for postoperative pain following abdominal surgery / N.T. Ventham, M. Hughes, S. O’Neill et al. // Br J Surg. – 2013. – Vol.100, №10. – P.1280-1289. 72. Adherence Monitoring with Chronic Opioid Therapy for Persistent Pain: A Biopsychosocial-Spiritual Approach to Mitigate Risk / D. Matteliano, St. B.J. Marie, J. Oliver, C. Coggins // Pain Manag Nurs. – 2014. – Vol.15, №1. – P.391405. 73. Biopsychosocial influence on exercise-induced injury: genetic and psychological combinations are predictive of shoulder pain phenotypes / S.Z. George, J.J. Parr, M.R. Wallace et al. // J Pain. – 2014. – Vol.15, №1. – P.68-8 74. Кукушкин М.Л. Хронический болевой синдром: механизмы развития / М.Л. Кукушкин // Боль. Суставы. Позвоночник. – 2011. – №1. – С.34-40. 75. Turk D.C. The biopsychosocial model of pain and pain management / D.C. Turk, H. Wilson, K.S. Swanson // Behavioral and Psychopharmacologic Pain 123 Management. Ed by M.H. Ebert, R.D. Kerns. – Cambridge, Cambridge University Press, 2010. – P.16-43. 76. Engel G. The need for a new medical model: A challenge for biomedicine / G. Engel // Science. – 1977. – Vol.196, №4286. – P.129-136. 77. Данилов А. Управление болью. Биопсихосоциальный подход / А. Данилов, А. Данилов. – М.: «АММ ПРЕСС», 2012. – С.568. 78. Lydic R. Neurochemical Mechanisms Mediating Opioid-Induced REM Sleep Disruption / R. Lydic, H.A. Baghdoyan // Sleep and Pain. Ed by G. Lavigne, B.J. Sessle, M. Choiniere, P.J. Soja. – Seattle, IASP PRESS, 2007. – P.99-122. 79. Bartley E.J. Sex differences in pain: a brief review of clinical and experimental findings / E.J. Bartley, R.B. Fillingim // Br J Anaesth. – 2013. – Vol.111, №1. – P.52-58. 80. Pain modality- and sex-specific effects of COMT genetic functional variants / I. Belfer, S.K. Segall, W.R. Lariviere et al. // Pain. – 2013. – Vol.154, №8. – P.1368-1376. 81. Psychosocial interventions for managing pain in older adults: outcomes and clinical implications / F.J. Keefe, L. Porter, T. Somers et al. // Br J Anaesth. – 2013. – Vol.111, №1. – P.89-94. 82. Dein S. Theodicy and end-of-life care / S. Dein, J. Swinton, S.Q. Abbas // J Soc Work End Life Palliat Care. – 2013. – Vol.9, №2-3. – P.191-208. 83. Comparative effectiveness of a complex Ayurvedic treatment and conventional standard care in osteoarthritis of the knee-study protocol for a randomized controlled trial / C.M. Witt, A. Michalsen, S. Roll et al. // Trials. – 2013. – Vol.14. – P.1-10. 84. The role of presurgical expectancies in predicting pain and function one year following total knee arthroplasty / M. Sullivan, M. Tanzer, G. Reardon et al. // Pain. – 2011. – Vol.152, №10ю – P.2287–2293. 85. Rosenberger P.H. Psychosocial factors and surgical outcomes: an evidence-based literature review / P.H. Rosenberger, P. Jokl, J. Ickovics // J Am Acad Orthop Surg. – 2006. – Vol.14, №7. – P.397-405. 124 86. Flor H. Biopsychosocial models of pain. / H. Flor, C. Hermann // Psychosocial Aspects of Pain: a Handbook for Health Care Providers. Ed by R.H. Dworkin and W.S. Breitbart. – Seattle, IASP Press, 2004. – P.47-75. 87. Basler M.H. Prolonged postoperative pain is a complex biopsychosocial problem / M.H. Basler, C.P. Rae // BMJ. – 2014. – Vol.348. – P.g2162. 88. Novy D.M. The biopsychosocial model in cancer pain / D.M. Novy, C.J. Aigner // Curr Opin Support Palliat Care. – 2014. – Vol.8, №2. – P.117-123. 89. Bard H. Associations between depression, pain behaviors, and partner responses to pain in metastatic breast cancer / H. Bard, K. Milbury // Pain. – 2011. – Vol.152, №11. – P.2596-2604. 90. Tavoli A. Depression and quality of life in cancer patients with and without pain: the role of pain beliefs / A. Tavoli, A. Montazeri, R. Roshan // BMC Cancer. – 2008. – Vol.8. – P.1-6. 91. Landau R. One Size Does Not Fit All / R. Landau // Anesthesiology. – 2006. – Vol.105, №2. – P.235-237. 92. Preoperative anxiety and catastrophizing: a systematic review and meta-analysis of the association with chronic postsurgical pain / M. Theunissen, M.L. Peters, J. Bruce et al. // Clin J Pain. – 2012. – Vol.28, №9. – P.819-841. 93. Upp J. The Evolution and Practice of Acute Pain Medicine / J. Upp, M. Kent, P. J. Tighe // Pain Med. – 2013. – Vol.14, №1. – P.124-144. 94. Postoperative pain therapy a general nursing statins: an analysis of eight years experience at an anesthesiological acute pain service / C. Maier, K. Kibbel, S. Mercker, H. Wulf // Anesthesist. – 1994. – Vol.43, №6. – P.385-397. 95. Development of an anesthesiology-based postoperative pain management service / L.B. Ready, R. Oden, H.S. Chadwick et al. // Anesthesiology. – 1988. – Vol.68, №1. – P.100-106. 96. Лесной И.И. Острая послеоперационная боль, проблемы и пути решения / И.И. Лесной, Е.Ю. Белка, Ю.Л. Кучин // Біль, знеболювання і інтенсивна терапія. – 2011. – №1. – С.22-29. 125 97. Larson S.L. Depressive disorder as a long-term antecedent risk factor for incident back pain: A 13-year follow-up study from the Baltimore Epidemiological Catchment Area sample / S.L. Larson, M.R. Clark, W.W. Eaton // Psychol. Med. – 2004. – Vol.34, №2. – P.211-219. 98. Lindsay P.G. The depression-pain syndrome and its response to antidepressants / P.G. Lindsay, M. Wyckoff // Psychosomatics. – 1981. – Vol.22, №7. – P.576577. 99. Взаимосвязь восприятия психологических боли характеристик в периоперационном пациентов / О.Ю. периоде Щелкова, и Я.В. Степанова, В.А. Мазурок, Ю.Б. Михалева // Вестник ЮУрГУю – 2012. – №45. – С.100-107. 100. Павленко С.С. Лечение хронической боли нестероидными противовоспалительными средствами / С.С. Павленко // Боль и ее лечение. – 1999. – №10. – С.4-8. 101. Svedman P. "Anxiebo", placebo, and postoperative pain / P. Svedman, M. Ingvar, T. Gordh // BMC Anesthesiology. – 2005. – Vol.5. – P.1-6. 102. Rehabilitation following surgery: clinical and psychological predictors of activity limitations / R. Powell, M. Johnston, W.C. Smith et al. // Rehabil Psychol. – 2013. – Vol.58, №4. – P.350-360. 103. The effect of preoperative anxiety on postoperative analgesia and anesthesia recovery in patients undergoing laparascopic cholecystectomy / Ali, D. Altun,B.H. Oguz et al. // J Anesth. – 2014. – Vol.28, №2. – P.222-227. 104. The association between preoperative pain catastrophizing and postoperative pain intensity in cardiac surgery patients / R.S. Khan, P. Skapinakis, K. Ahmed et al. // Pain Med. – 2012. – Vol.13, №6. – P.820-827. 105. Romeo M.M.C. Effects of using an information leaflet in reducing perioperative anxiety and pain in patients undergoing urological surgery / M.M.C. Romeo, S.L. Muniesa // Enferm Clin. – 2014. – Vol.24, №4. – P.233-240. 126 106. Azari L. Optimal pain management in total abdominal hysterectomy / L. Azari, J.T. Santoso , S.E. Osborne // Obstet Gynecol Surv. – 2013. – Vol.68, №3. – P.215-270. 107. Demographic and psychosocial predictors of acute perioperative pain for total knee arthroplasty / M.L. Roth, D.A. Tripp, M.H. Harrison et al. // Pain Res Manag. – 2007. – Vol.12, №3. – P.185–194. 108. Lingard E.A. Impact of psychological distress on pain and function following knee arthroplasty / E.A. Lingard, D.L. Riddle // J Bone Joint Surg Am. – 2007. – Vol.89, №6. – P.1161-1169. 109. Predicting acute pain after cesarean delivery using three simple questions / P. H. Pan, A.M. Tonidandel, C.A. Aschenbrenner et al. // Anesthesiology. – 2013. – Vol.118, №5. – P.1170-1179. 110. Perioperative disorders of mental functions / D. Tonković, V.N. Adam, M. Kovacević et al. // Acta Med Croatica. – 2012. – Vol.66, №1. – P.73-79. 111. Predictors of postoperative movement and resting pain following total knee replacement / B.A. Rakel , N.P. Blodgett , B.M. Zimmerman et al. // Pain. – 2012. – Vol.153, №11. – P.2192-2203. 112. Do psychological variables affect early surgical recovery? / M.N. Mavros, S. Athanasiou, I.D. Gkegkes et al. // PLoS One. – 2011, Vol.6, №5. – P.e20306. 113. The impact of depression and anxiety on self-assessed pain, disability, and quality of life in patients scheduled for rotator cuff repair / C.H. Cho, H.J. Seo, K.C. Bae et al. // J Shoulder Elbow Surg. – 2013. – Vol.22, №9. – P.1160-1166. 114. Granot M. The roles of pain catastrophizing and anxiety in the prediction of postoperative pain intensity: a prospective study / M. Granot, S.G. Ferber // Clin J Pain. – 2005. – Vol.21, №5. – P.439–445. 115. Prediction of postoperative pain: a systematic review of predictive experimental pain studies / M.U. Werner, H.N. Mjobo, P.R. Nielsen, A. Rudin // Anesthesiology. – 2010. – Vol.112, №6. – P.1494–1502. 127 116. Predictors of postoperative pain and analgesic consumption: a qualitative systematic review / H.Y. Ip, A. Abrishami, P.W. Peng et al. // Anesthesiology. – 2009. – Vol.111, №3. – P.657–677. 117. Catastrophizing: a risk factor for postsurgical pain / D.J. Pavlin, M.J. Sullivan, P.R. Freund, K. Roesen // Clin J Pain. – 2005. – Vol.21, №1. – P.83–90. 118. Conditioned pain modulation and situational pain catastrophizing as preoperative predictors of pain following chest wall surgery: a prospective observational cohort study / K. Grosen, L. Vase, H.K. Pilegaard et al. // PLoS One. – 2014. – Vol.9, №2. – P. e90185. 119. Preoperative pain catastrophizing predicts pain outcome after knee arthroplasty / D.L. Riddle, J.B. Wade, W.A. Jiranek, X. Kong // Clin Orthop Relat Res. – 2010. – Vol.468, №3. – P.798-806. 120. Enhanced presurgical pain temporal summation response predicts postthoracotomy pain intensity during the acute postoperative phase / I. Weissman-Fogel, Y. Granovsky, Y. Crispel et al. // J Pain. – 2009. – Vol.10, №6. – P.628–636. 121. The role of catastrophizing in the prediction of postoperative pain / M. Papaioannou, P. Skapinakis, D. Damigos et al. // Pain Med. – 2009. – Vol.10, №8. – P.1452-1459. 122. Study of the OPRM1 A118G genetic polymorphism associated with postoperative nausea and vomiting induced by fentanyl intravenous analgesia / W. Zhang, J.J. Yuan, Q.C. Kan et al. // Minerva Anestesiol. – 2011. – Vol.77, №1. – P.3339. 123. Becker D.E. Nausea, Vomiting, and Hiccups: A Review of Mechanisms and Treatment / D.E. Becker // Anesth Prog. – 2010. – Vol.57, №4. – P.150-157. 124. Aversive and Reinforcing Opioid Effects: A Pharmacogenomic Twin Study / M.S. Angst, L.C. Lazzeroni, N.G. Phillips et al. // Anesthesiology. – 2012. – Vol.117, №1. – P.22–37. 128 125. Martel M.O. Sex Differences in the Stability of Conditioned Pain Modulation (CPM) among Patients with Chronic Pain / M.O. Martel, A.D. Wasan, R.R. Edwards // Pain Med. – 2013. – Vol.14, №11. – P.1757-1768. 126. Associations between catastrophizing and endogenous pain-inhibitory processes: sex differences / B.R. Goodin, L. McGuire, M. Allshouse et al. // J Pain. – 2009. – Vol.10, №2. – P.180-190. 127. Determinants of endogenous analgesia magnitude in a diffuse noxious inhibitory control (DNIC) paradigm: do conditioning stimulus painfulness, gender and personality variables matter? / M. Granot, I. Weissman-Fogel, Y. Crispel et al. // Pain. – 2008. – Vol.136, №1-2. – P.142-149. 128. Decreased pain inhibition in irritable bowel syndrome depends on altered descending modulation and higher-order brain processes / M. Piche, M. Bouin, M. Arsenault et al. // Neuroscience. – 2011. – Vol.195 – P.166-175. 129. High preoperative depression, phobic anxiety, and binge eating scores and low medium-term weight loss in sleeve gastrectomy obese patients: a preliminary cohort study / P. Brunault, D. Jacobi, V. Miknius et al. // Psychosomatics. – 2012. – Vol.53, №4. – P.363-370. 130. Гуреева И.Л. Психологическое состояние пациентов в период ожидания хирургической операции протезирования клапанов сердца в условиях искусственного кровообращения / И.Л. Гуреева, Е.Р. Исаева // Вестник ЮУрГУ, Серия: Психология. – 2012. – Выпуск 19, №45. – С.83-87. 131. Psychological status, real pain and antioxidant capacity of plasma, could make the prediction about the post-trauma wound healing / D. Marcoci, B. Bran, M. Ciurea et al. // Rom J Morphol Embryol. – 2011. – Vol.52, №1. – P.459-463. 132. Lydic R. Neurochemical Mechanisms Mediating Opioid-Induced REM Sleep Disruption / R. Lydic, H.A. Baghdoyan // Sleep and Pain. Ed by G. Lavigne, B.J. Sessle, M. Choiniere, P.J. Soja. – Seattle, IASP PRESS. – 2007. – P.99-122. 133. Клиническая фармакогенетика: Учебное пособие / Под. Ред. В.Г. Кукеса, Н.П. Бочкова. – М.: ГЭОТАР-Медиа, 2007. – 248с. 129 134. Searle R. Pharmacogenomic variability and anaesthesia / R. Searle, P.M. Hopkins // Br J Anaesth. – 2009. – Vol.103, №1. – P.14–25. 135. Баранов В.С. Программа «Геном человека» как научная основа профилактической медицины / В.С. Баранов // Вестн. РАМН. – 2000. – №10. – С. 27-37. 136. Seltzer Z. Nothing in pain makes sense except in the light of genetics / Z. Seltser // Pain. – 2014. – Vol.155, №5. – P.841-842. 137. Mauck M. Epigenetics of chronic pain after thoracic surgery / M. Mauck, T. Van de Ven , A.D. Shaw // Curr Opin Anaesthesiol. – 2014. – Vol.27, №1. – P.1-5. 138. Interpreting patient treatment response in analgesic clinical trials: implications for genotyping, phenotyping, and personalized pain treatment / R.H. Dworkin, M.P. McDermott, J.T. Farrar et al. // Pain. – 2014. – Vol.155, №3. – P.457-460. 139. Chronic stress is linked to 5-HT(1A) receptor changes and functional disintegration of the limbic networks / H. Jovanovic, A. Perski, H. Berglund, I. Savic // Neuroimage. – 2011. – Vol.55, №3. – P.1178-1188. 140. Genetic variation in the serotonin transporter gene (5-HTTLPR, rs25531) influences the analgesic response to the short acting opioid Remifentanil in humans / E. Kosek, K. Jensen, T. Lonsdorf et al. // Mol. Pain. – 2009. – Vol.5. – P.1-7. 141. GTP cyclohydrolase and tetrahydrobiopterin regulate pain sensitivity and persistence / I. Tegeder, M. Costigan, R.S. Griffin et al. // Nat Med. – 2006. – Vol.12, №11. – P.1269-1277. 142. Induction of total insensitivity to capsaicin and hypersensitivity to garlic extract in human by decreased expression of TRPV1 / J.J. Park, J. Lee, M.A. Kim et al. // Neurosci Lett. – 2007. – Vol.411, №2. – P.87-91. 143. Mogil J.S. Animal models of pain: progress and challenges / J.S. Mogil // Nat Rev Neurosci. – 2009. – Vol.10, №4. – P.283-294. 144. Genetic variation and response to morphine in cancer patients: catechol-Omethyltransferase and multidrug resistance-1 gene polymorphisms are associated 130 with central side effects / J.R. Ross , J. Riley , A.B. Taegetmeyer // Cancer. – 2008. – Vol.112, №6. – P.1390-1403. 145. Heller F. Genetics/genomics and drug effects / F. Heller // Acta Clin Belg. – 2013. – Vol.68, №2. – P.77-80. 146. Somogyi A.A. Pharmacogenetics of opioids / A.A. Somogyi, D.T. Barratt, J.K. Coller // Clin Pharmacol Ther. – 2007. – Vol.81, №3. – P.429-444. 147. The impact of CYP2D6 genetic polymorphisms on postoperative morphine consumption / K.A. Candiotti, Z. Yang, Y. Rodriguez et al. // Pain Med. – 2009. – Vol. 10, №5. – P.799805. 148. CYP2D6 polymorphisms and codeine analgesia in postpartum pain management: a pilot study / S. VanderVaart, H. Berger, J. Sistonen et al. // Ther Drug Monit. – 2011. – Vol.33, №4. – P.425-432. 149. Tramadol efficacy in patients with postoperative pain in relation to CYP2D6 and MDR1 polymorphisms / O. Slanar, P. Dupal, O. Matouskova et al. // Bratisl Lek Listy. – 2012. – Vol.113, №3. – P.152-155. 150. Clinical Pharmacogenetics Implementation Consortium guidelines for cytochrome P450 2D6 genotype and codeine therapy: 2014 update / K.R. Crews, A. Gaedigk, H.M. Dunnenberger // Clin Pharmacol Ther. – 2014. – Vol.95, №4. – P.376-382. 151. Kambur O. CatecholOmethyltransferase and pain / O. Kambur, P.T. Männistö // Int. Rev. Neurobiol. – 2010. – Vol. 95. – P.227279. 152. Genetic variation in the catechol-O-methyltransferase (COMT) gene and morphine requirements in cancer patients with pain / T.T. Rakvag, J.R. Ross, H. Sato et al. // Mol Pain. – 2008. – Vol.4, №64. – P.1-12. 153. Genetic variability at COMT but not at OPRM1 and UGT2B7 loci modulates morphine analgesic response in acute postoperative pain / M. De Gregori , G. Garbin , S. De Gregori et al. // Eur J Clin Pharmacol. – 2013. – Vol.69, №9. – P.1651-1658. 131 154. An Opposite-Direction Modulation of the COMT Val158Met Polymorphism on the Clinical Response to Intrathecal Morphine and Triptans / S. Cargnin, F. Magnani, M. Viana et al. // J Pain. – 2013. – Vol.14, №10. – P.1097-1106. 155. Janus molecule I: dichotomous effects of COMT in neuropathic vs nociceptive pain modalities / S.K. Segall, W. Maixner, I. Belfer et al. // CNS Neurol Disord Drug Targets. – 2012. – Vol.11, №3. – P.222-235. 156. COMT val158met genotype affects mu-opioid neurotransmitter responses to a pain stressor / J.K. Zubieta, M.M. Heitzeg, Y.R. Smith et al. // Science. – 2003. – Vol.299, №5610. – P.1240-1243. 157. Increased sensitivity to thermal pain following a single opiate dose is influenced by the COMT val(158)met polymorphism / K.B. Jensen, T.B. Lonsdorf, M. Schalling et al. // PLoS One. – 2009. – Vol.4, №6. – P.e6016. 158. The catechol-O-methyltransferase (COMT) val158met polymorphism affects brain responses to repeated painful stimuli / M.L. Loggia, K. Jensen, R.L. Gollub et al. // PLoS One. – 2011. – Vol.6, №11. – P.e27764. 159. Low enzymatic activity haplotypes of the human catechol-O-methyltransferase gene: enrichment for marker SNPs / A.G. Nackley, S.A. Shabalina, J.E. Lambert et al. // PLoS One. – 2009. – Vol.4, №4. – P.e5237. 160. Aversive and reinforcing opioid effects: a pharmacogenomic twin study / M.S. Angst, L.C. Lazzeroni , N.G. Phillips et al. // Anesthesiology. – 2012. – Vol.117, №1. – P.22-37. 161. Culpepper L. Reducing the Burden of Difficult-to-Treat Major Depressive Disorder: Revisiting Monoamine Oxidase Inhibitor Therapy / L. Culpepper // Prim Care Companion CNS Disord. – 2013. – Vol.15, №5. – P.1-24. 162. Finne L.B. Psychological and social work factors as predictors of mental distress: a prospective study / L.B. Finne, J.O. Christensen, S. Knardahl // PLoS One. – 2014. – Vol.9, №7. – P.e102514. 163. Clinical and genetic factors associated with nausea and vomiting in cancer patients receiving opioids / E.A. Laugsand, T. Fladvad, F. Skorpen et al. // Eur J Cancer. – 2011. – Vol.47, №11. – P.1682-1691. 132 164. Is target opioid therapy within sight? / G. Finco, M. Pintor, D. Sanna et al. // Minerva Anestesiol. – 2012. – Vol.78, №4. – P.462-472. 165. Wang D. Searching for Polymorphisms That Affect Gene Expression and mRNA. Processing: Example ABCB1 (MDR1) / D. Wang, W. Sadée // The AAPS Journal. – 2006. – Vol.8, №3. – P.E515-E520. 166. Mague S.D. OPRM1 SNP (A118G): involvement in disease development, treatment response, and animal models / S.D. Mague, J.A. Blendy // Drug Alcohol Depend. – 2010. – Vol.108, №3. – P.172-182. 167. Effect of the A118G polymorphism on binding affinity, potency and agonistmediated endocytosis, desensitization, and resensitization of the human muopioid receptor / A. Beyer, T. Koch, H. Schröder et al. // J Neurochem. – 2004. – Vol.89, №3. – P.553–560. 168. The single nucleotide polymorphism A118G alters functional properties of the human mu opioid receptor / T. Kroslak, K.S. Laforge, R.J. Gianotti et al. // J Neurochem. – 2007. – Vol.103, №1. – P.77–87. 169. Allelic expression imbalance of human mu opioid receptor (OPRM1) caused by variant A118G / Y. Zhang, D. Wang, A.D. Johnson et al. // J Biol Chem. – 2005. – Vol.280, №38. – P.32618–32624. 170. Human Mu Opioid Receptor (OPRM1 A118G) polymorphism is associated with brain mu-opioid receptor binding potential in smokers / R. Ray, K. Ruparel, A. Newberg et al. // Proc Natl Acad Sci U S A. – 2011. – Vol.108, №22. – P.92689273. 171. Way B.M. Is there a genetic contribution to cultural differences? Collectivism, individualism and genetic markers of social sensitivity / B.M. Way // Soc Cogn Affect Neurosci. – 2010. – Vol.5, №2-3. – P.203-211. 172. Way B.M. Variation in the mu-opioid receptor gene (OPRM1) is associated with dispositional and neural sensitivity to social rejection / B.M. Way, S.E. Taylor, N.I. Eisenberger // Proc Natl Acad Sci U S A. – 2009. – Vol.106, №35. – P.15079-15084. 133 173. Association of mu-opioid receptor gene polymorphism (A118G) with variations in morphine consumption for analgesia after total knee arthroplasty / W.Y. Chou, L.C. Yang, H.F. Lu et al. // Acta Anaesthesiol Scand. – 2006. – Vol.50, №7. – P.787-792. 174. Human opioid receptor A118G polymorphism affects intravenous patientcontrolled analgesia morphine consumption after total abdominal hysterectomy / W.Y. Chou, C.H. Wang, P.H. Liu et al. // Anesthesiology. – 2006. – Vol.105, №2. – P.334-337. 175. A118G single nucleotide polymorphism of human mu-opioid receptor gene influences pain perception and patient-controlled intravenous morphine consumption after intrathecal morphine for postcesarean analgesia / A.T. Sia, Y. Lim, E.C. Lim et al. // Anesthesiology. – 2008. – Vol.109, №3. – P.520-526. 176. Walter C. Meta-analysis of the relevance of the OPRM1 118A . G genetic variant for pain treatment / C. Walter, J. Lötsch // Pain. – 2009. – Vol.146, №3. – P.270– 275. 177. The 118A>G polymorphism in the human mu-opioid receptor gene may increase morphine requirements in patients with pain caused by malignant disease / P. Klepstad, T.T. Rakvag, S. Kaasa et al. // Acta Anaesthesiol Scand. – 2004. – Vol.48, №10. – P.1232-1239. 178. A Genetic Association Study of the Functional A118G Polymorphism of the Human µ-Opioid Receptor Gene in Patients with Acute and Chronic Pain / P.K. Janicki, G. Schuler, D. Francis et al. // Anesthesia and Analgesia. – 2006. – Vol.103, №4. – P.1011-1017. 179. Lack of association of OPRM1 and ABCB1 single-nucleotide polymorphisms to oxycodone response in postoperative pain / S.T. Zwisler, T.P. Enggaard, S. Mikkelsen et al. // J Clin Pharmacol. – 2012. – Vol.52. – P.234-242. 180. Clinical response to morphine in cancer patients and genetic variation in candidate genes / J.R. Ross, D. Rutter, K. Welsh et al. // Pharmacogenomics J. – 2005. – Vol.5, №5. – P.324-336. 134 181. Association of human micro-opioid receptor gene polymorphism A118G with fentanyl analgesia consumption in Chinese gynaecological patients / W. Zhang, Y.Z. Chang, Q.C. Kan et al. // Anaesthesia. – 2010. – Vol.65, №2. – P.130-135. 182. Polymorphism of the micro-opioid receptor gene (OPRM1 118A>G) affects fentanyl-induced analgesia during anesthesia and recovery / W.D. Wu, Y. Wang, Y.M. Fang, H.Y. Zhou // Mol Diagn Ther. – 2009. – Vol.13, №5. – P.331-337. 183. The genetic influence on the cortical processing of experimental pain and the moderating effect of pain status / H. Vossen, G. Kenis, B. Rutten et al. // PLoS One. – 2010. – Vol.5, №10. – P.e13641. 184. Exploring joint effects of genes and the clinical efficacy of morphine for cancer pain: OPRM1 and COMT gene / C.C. Reyes-Gibby, S. Shete, T. Rakvag et al. // Pain. – 2007. – Vol.130, №1-2. – P.25-30. 185. Copeland J.P. POSSUM: a scoring system for surgical audit / J.P. Copeland, D. Jones, M. Walters // Br J Surg. – 1991. – Vol.78, №3. – P.355-360. 186. Emotional sequelae among survivors of critical illness: a long-term retrospective study / M. Kowalczyc, A. Nestorowicz, A. Fijalkowska, M. Kwiatosz-Muc // Eur J Anaesthesiol. – 2013. – Vol.30, №3. – P.111-118. 187. Smarr K.L. Measures of depression and depressive symptoms: Beck Depression Inventory-II (BDI-II), Center for Epidemiologic Studies Depression Scale (CESD), Geriatric Depression Scale (GDS), Hospital Anxiety and Depression Scale (HADS), and Patient Health Questionnaire-9 (PHQ-9) / K.L. Smarr, A.L. Keefer // Arthritis Care Res (Hoboken). – 2011. – Vol.63, №11. – P.S454-S466. 188. Kroenke K. The PHQ-9: validity of a brief depression severity measure / R.L. Spitzer , J.B. Williams // J Gen Intern Med. – 2001. – Vol.16, №9. – P.606-613. 189. Прогнозирование послеоперационной боли на основании психологических характеристик больных и стандартизированных болевых стимулов / Я.В. Степанова, О.Ю. Щелкова, К.М. Лебединский, В.А. Анестезиология и реаниматология. – 2013. – №3. – С.58-62. Мазурок // 135 190. Validation of two depression screening instruments in a sleep disorders clinic / M. Law, M.T. Naughton, A. Dhar et al. // J Clin Sleep Med. – 2014. – Vol.10, №6. – P.683-688. 191. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects / World Medical Association // JAMA. – 2013. – Vol.310, №20. – P.2191-2194. 192. Rodriguez S. Hardy-Weinberg Equilibrium Testing of Biological Ascertainment for Mendelian Randomization Studies / S. Rodriguez, T.R. Gaunt, I.N. Day // American J Epidemiol. – 2009. – Vol.169, №4. – P.505-514. 193. Altman D.G. Diagnostic tests 1: sensitivity and specificity / D.G. Altman, J.M. Bland // BMJ. – 1994. – Vol.308, №6943 – P.1552. 194. Altman D.G. Diagnostic tests 2: predictive values / D.G. Altman, J.M. Bland // BMJ. – 1994. – Vol.309, №6947 – P.102. 195. Weinstein S. Clinical evaluation of diagnostic tests / S. Weinstein, N.A. Obuchowski , M.L. Lieber // AJR Am J Roentgenol. – 2005. – Vol.184, №1. – P.14-19. 196. Understanding and using sensitivity, specificity and predictive values / R. Parikh, A. Mathai, S. Parikh et al. // Indian J Ophthalmol. – 2008. – Vol.56, №1. – P.4550. 197. Боровиков В. STATISTICA. Искусство анализа данных на компьютере: Для профессионалов. 2-е изд. / В. Боровиков. – Сп-б.:«Питер», 2003. – 688с. 198. Zweig M.H. Receiver-operating characteristic (ROC) plots: A fundamental evaluation tool in clinical medicine / M.H. Zweig, G. Campbell // Clin Chem – 1993. Vol.39, №4. – P.561-577. 199. DeLong E.R. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach / E.R. DeLong, D.M. DeLong, D.L. Clarke-Pearson // Biometrics. – 1988. – Vol.44, №3. – P. 837-845. 200. Hanley J.A. The meaning and use of the area under a receiver operating characteristic (ROC) curve / J.A. Hanley, B.J. McNeil // Radiology. – 1982. – Vol.143, №1. – P.29-36. 136 201. Socio-economic burden of patients with a diagnosis related to chronic pain – Register data of 840000 Swedish patients / A. Gustavsson, J. Bjorkmann, C. Ljungcrantz et al. // Eur J Pain. – 2012. – Vol.16, №2. – P.289-297. 202. Значение эпидуральной анестезии и анальгезии в профилактике послеоперационной респираторной дисфункции и осложнений / П.А. Любошевский, М.В. Петрова, А.В. Забусов, А.Н. Фролов // Вестник РНЦРР. – 2012. – № 12. – С.10. 203. Placebo and opioid analgesia – imaging a shared neuronal network / P. Petrovic, E. Kalso, K.M. Petersson, M. Ingvar // Science. – 2002. – Vol.295, №5560. – P.1737-1740. 204. The influence of sexes on postoperative pain / H. Bornemann-Cimenti, S.W. Stöcklegger, I.-S. Szilagyi et al. // Eur J Anaesthesiol. – 2014. – Vol.31. – P.222. 205. Степанова Я.В. Экспресс-метод прогнозирования выраженности болевого синдрома в раннем послеоперационном периоде / Я.В. Степанова, В.А. Мазурок, О.Ю. Щелкова // Вестник интенсивной терапии. – 2014. – №5. – С.104-107. 206. Комкин В.А. Оптимизация послеоперационного обезболивания с позиции контроля воспалительного ответа у пациентов ортопедического профиля / В.А. Комкин, Т.А. Жирова, В.А. Руднов // Фундаментальные исследования. – 2013. – №7. – С.105-108. 207. Diversity of Opioid Requirements for Postoperative Pain Control Following Oral Surgery—Is It Affected by Polymorphism of the m-Opioid Receptor? / K. Fukuda, M. Hayashida, K. Ikeda et al. // Anesth Prog. – 2010. – Vol.57, №4. – P.145-149. 208. Allelic and genotype frequencies of catechol-O-methyltransferase (Val158Met) and CYP2D6*10 (Pro34Ser) single nucleotide polymorphisms in the Philippines / O.B. Michael., R.Z. Predicala., C.A. Mapua et al. // Int J Mol Epidemiol Genet. – 2012. – Vol.3, №2. – P.115-121. 209. Возможности оптимизации послеоперационного обезболивания в зависимости от болевой чувствительности / Д.А. Казанцев, А.В. Экстрем, 137 Д.С. Тириченко, А.С. Попов // Вестник интенсивной терапии. – 2014. – Приложение к №5. – С.25-26. 210. Еременко А.А. Комбинации кетопрофена и нефопама для обеспечения послеоперационного обезболивания с минимальным потреблением анальгетиков у кардиохирургических больных / А.А. Еременко, Л.С. Сорокина, М.В. Павлов // Анестезиология и реаниматология. – 2013. – №5. – С.11-15.