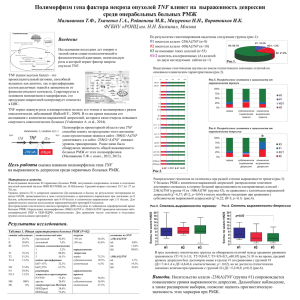
1 003927 2 Область изобретения Антагонисты фактора
advertisement

1 Область изобретения Антагонисты фактора опухолевого некроза (TNF) вводятся в терапевтически эффективных дозах для лечения и/или профилактики эндометриоза. Антагонисты данного изобретения обычно выбраны среди различных классов молекул, но предпочтительно представляют растворимые рецепторы TNF. Антагонисты могут применяться для того, чтобы вызвать обратное развитие эндометриозных поражений и, при комбинации с другими активными ингредиентами, для облегчения течения родственных расстройств, подобных бесплодию. Предшествующий уровень техники Эндометриоз представляет заболевание женских половых органов, характеризующееся наличием желез и стромы эндометрия вне полости эндометрия и маточной мышечной ткани. Наиболее часто поражаемыми анатомическими участками являются яичники, маточнокрестцовые связки, тазовая брюшина, ректовагинальная перегородка, шейка матки, влагалище, фаллопиевы трубы и вульва. В целом, вероятна глубокая инфильтрация эндометриоза из ректовагинальной перегородки в подлежащие ткани, и он может быть не виден на поверхности. Иногда можно встретить очаги эндометриоза во внеяичниковых участках, таких как легкие, мочевой пузырь, кожа, плевра и лимфоузлы. Эндометриозные поражения носят прогрессирующий характер; сначала они имеют вид прозрачных пузырьков, которые затем становятся красными и в течение периода нескольких лет прогрессируют в черные, фибротические поражения (MacSween, 1993). Эндометриоз считается доброкачественным заболеванием, но иногда эндометриозные поражения становятся злокачественными. Как и при других видах злокачественных поражений, развитие новообразований, происходящих из эндометриоза, связано с сопутствующими процессами, вовлекающими изменения факторов роста и/или регуляции онкогенов (Cheung, 1996). Эндометриоз является одним из самых распространенных гинекологических заболеваний с распространенностью среди женщин репродуктивного возраста: это заболевание обнаруживается приблизительно у 5-10% женщин в репродуктивном возрасте (Ваrbieri, 1988). Для продолжающегося роста, включая эктопические участки локализации, эндометриозная ткань полностью зависит от эстрогена. Следовательно, эндометриоз редко встречается перед началом менструаций и после менопаузы, когда у женщин имеется недостаточность эстрогена. Эндометриозная гормональная чувствительность лежит в основе некоторых из более распространенных симптомов, которыми являются боль в области таза и дисменоррея. Эндометриоз происходит из клеток эндометрия, диссеминировавших из матки в другие 003927 2 участки, куда могут внедряться и где могут расти жизнеспособные клетки. Для объяснения исходного распространения клеток было предложено два возможных механизма. Ретроградная менструация, часто встречающийся феномен среди женщин с менструальными циклами, обеспечивает возможность для фрагментов, открепившихся от эндометрия, достичь через менструальную рефлюксную жидкость расположенные поблизости структуры в половом аппарате. Альтернативно, для объяснения встречаемости эндометриоза в участках, отличных от половых структур, клетки эндометрия могут распространяться через маточные вены и доставляться через лимфатическую систему (гематогенная или лимфатическая диссеминация). Этому распространению могут также способствовать гинекологические хирургические вмешательства (MacSween, 1993). Кроме диссеминации клеток эндометрия восприимчивость женщин к эндометриозу могут определять другие факторы, такие как генетическая предрасположенность (Malinak et al.,1980), а также иммунологические изменения (Но et аl., 1997). Поскольку во время менструации у всех женщин клетки эндометрия часто видны в перитонеальной жидкости, у млекопитающих должны быть механизмы, по всей вероятности относящиеся к иммунной системе, во избежание начала эндометриоза. В целом, клетки эндометрия, которые избегают иммунную реакцию хозяина и имеют адекватную эстроген-ную стимуляцию, могут пролиферировать с образованием крупных, макроскопически видимых поражений. Поэтому эндометриоз рассматривается как динамический процесс, при котором постоянно образуются новые поражения, в то время, как существующие поражения могут расти или разрушаться под влиянием иммунной реакции хозяина. Воспалительная реакция, обычно связанная с эндометриозом, изменяет перитонеальную среду, поскольку имеется увеличенный объем перитонеальной жидкости и возрастает и количество, и активность перитонеальных макрофагов. Поэтому моноцитарная/макрофагальная система была предложена как играющая ключевую роль в развитии эндометриоза. Секреторные продукты макрофагов, включая RANTES (Hornung et al.,1997), интерлейкин-6 (Harada et al.,1997), интерлейкин-8 (Arici et al., 1996a), альфа-фактор опухолевого некроза (Overton et al., 1996), моноцитарный хемотаксический белок-1 (Arici et al., 1997), были в более высоких концентрациях обнаружены в перитонеальной жидкости женщин, пораженных этим заболеванием. Было показано, что у женщин с эндометриозом имели место иммунологические изменения, но не было доказано, ответственны ли эти процессы за развитие эндометриоза или являются результатом воспаления, вызванного эндометриозом (Rana et al., 1996). 3 Знания об эндометриозе и его связи с другими расстройствами в настоящее время пока ограничены даже на уровне диагностики. Хотя эндометриоз рассматривается как одна из главных причин бесплодия, исследования патофизиологии заболевания противоречивы и не окончательны. Существует низкая корреляция между степенью болевого синдрома или бесплодием и тяжестью заболевания, поскольку ранние поражения являются более метаболически активными. При уровне бесплодия выше, чем у здоровой популяции, исследованием на кроликах показано, что хирургически вызванный эндометриоз приводит к снижению фертильности с 75 до 25% (Hahn et al., 1986). У пациенток с болями в области таза эндометриоз обнаружен в 71% случаев, в то время как у пациенток с болями в области таза и бесплодием в 84% случаев был диагностирован эндометриоз (Koninckx et al., 1991). В целом, бесплодие может быть выявлено, когда эндометриоз имеет такой распространенный характер, что может нарушить нормальную влагалищную структуру, тогда как при минимальных проявлениях эндометриоза частота беременности нормальная. Эндометриоз может также различным образом повлиять на фертильность. Возрастает содержание всех посредников лейкоцитов, таких как интерлейкин-6, интерферон и фактор опухолевого некроза, неблагоприятно влияя на взаимодействие яйцеклетки и спермы. Было обнаружено, что образцы сыворотки, полученные у женщин с эндометриозом, обладают эмбриотоксическим действием на моделях мышиных эмбрионов и ингибируют подвижность сперматозоидов in vitro (Halme, 1991), причем данный эффект усиливается при добавлении рекомбинантного альфа-фактора опухолевого некроза (Eisermann, 1989). Однако эти исследования не были направлены на проблему воздействия цитокинов на прогрессирование эндометриоза, а лишь показали влияние таких молекул на жизнеспособность клеток зародыша и плода. В настоящее время используются два вида лечения эндометриоза: гормональная терапия и хирургическое лечение. Современная фармакологическая терапия эндометриоза требует гормонального подавления выработки эстрогена с тем, чтобы бедная гормональная среда блокировала рост эктопической ткани. В отношении лечения, связанного с эндометриозом бесплодия, гормональная терапия у пациенток с минимально выраженным заболеванием не имеет доказанного благоприятного эффекта, хотя другие исследования показали увеличение частоты беременности (Arici et al., 1996b). Различные виды гормональной терапии включали высокую дозу прогестогенов, комбинации эстрогена и прогестерона (с использованием пилюль, содержащих высокую дозу оральных контрацептивов, или ОКЦ, по схеме «ложной беременности»), даназол (андро- 003927 4 генное производное этистерона) и, позднее, агонисты гонадотропин-релизинг гормона (ГРГ). Эти виды гормональной терапии эффективно воздействуют на болевой синдром в области таза и вызывают объективное обратное развитие поражений, но при этом необходимо соблюдать несколько предосторожностей. Эстроген может стимулировать и вызвать пролиферацию ткани эндометрия, поскольку он может быть неспособен реагировать на прогестерон даже в высоких дозах, так что ОКЦ может дать частичное облегчение у ограниченного числа пациенток (Dawood, 1993). Способствующие развитию беременности средства могут спровоцировать беспорядочное кровотечение (50%) наряду с депрессией, прибавкой массы тела и задержкой жидкости. Даназол подавляет различные реакции, вызывающие эндометриоз, включая снижение уровня растворимого альфа-фактора опухолевого некроза, бета-интерлейкина-1 и CD8 в сыворотке (Matalliotakis, 1997; Mori, 1990), ингибирование нового стероидогенеза и вытеснение эстрадиола из его рецептора. Даназол может облегчить симптомы приблизительно у 66-100% пациенток, страдающих болевым синдромом, но частота рецидивов в сроки до 4 лет составляет приблизительно 40-50%. Другими недостатками терапии даназолом являются прибавка массы тела и андрогенные побочные эффекты, которые могут вызвать прекращение данной терапии пациентками, количество которых достигает 80% (Barbieri, 1988). Аналоги ГРГ, которые действуют путем устранения эстрогенного стимула к росту всех тканей, чувствительных к эстрогену, являются более мощными и длительно действующими, чем нативный ГРГ. Побочные эффекты аналогов ГРГ, как снижение плотности костной ткани и частота рецидивов через 5 лет до 50%, главным образом вторичны по отношению к глубокой гипоэстрогенемии (Waller and Shaw, 1993). В зависимости от степени заболевания, хирургическое вмешательство может быть консервативным, если желательна фертильность, или может привести к удалению матки, труб и яичников в случае тяжелого заболевания. В любом случае даже ограниченное хирургическое лечение приводит к значительному уменьшению фертильности. Частота беременности после операции в целом находится в диапазоне от 35 до 65%, поэтому пациентки для достижения нормального оплодотворения нуждаются в индукции овуляции и внутриматочном осеменении (Koninckx and Martin, 1994). Клинические сообщения показывают, что после лапоротомии и резекции эндометриоза в пределах 5 лет 40% пациенток требовали повторной операции. Даже после агрессивного хирургического вмешательства рецидив болевого синдрома вследствие эндометриоза продолжает быть существенной проблемой. Некоторые причины несостоятельности хирургического лечения могут включать 5 неполную резекцию с наличием либо не распознанных, либо полностью не выявленных поражений. Многие поражения являются микроскопическими и не могут визуализироваться, несмотря на увеличение, обеспечиваемое лапороскопом. Поэтому нельзя ожидать, что только хирургическое вмешательство излечит это заболевание (Revelli et al., 1995). Вследствие этого так много пациенток с эндометриозом страдают от недостатков традиционных методов лечения (включая последствия гормонального дисбаланса, высокую частоту рецидивов и бесплодие). Поэтому представляет интерес предоставление альтернативных методов лечения эндометриоза. Возможный подход к лечению может быть представлен применением иммуномодулирующих молекул, которые могли бы и смягчить степень эндометриозных поражений и улучшить иммунологическую ситуацию. Такой подход считался оправданным для лечения общих симптомов (Rana et al., 1996), но отсутствуют экспериментальные доказательства, указывающие на то, какой цитокин среди цитокинов с нарушенными уровнями экспрессии после эндометриоза мог бы быть предпочтительной мишенью для лечебных вмешательств. Как было сказано ранее, одним из нескольких продуктов секреции макрофагов, участвующих в эндометриозной воспалительной реакции, является фактор опухолевого некроза (далее сокращенно TNF). TNF, определяемый также как кахектин, является плейотропным цитокином, высвобождаемым активированными Т клетками и макрофагами. TNF является членом цитокиновой сети интерферона, интерлейкина и колониестимулирующего фактора, который играет ключевую роль в сигнальной системе в отношении патогенеза многих инфекционных и воспалительных заболеваний, вызывая ряд провоспалительных изменений, включая продукцию другого цитокина и адгезионной молекулы (Fiers, 1991). Для удобства термин TNF будет по всему тексту настоящей заявки совместно обозначать альфа и бета-фактор опухолевого некроза от животных и людей вместе с естественно встречающимися их аллелями TNF-альфа (Pennica et al., 1984). TNF-бета, именуемый также лимфотоксином, имеет аналогичную активность, но продуцируется различными типами клеток (лимфоцитами и естественными клеткамикиллерами) в ответ на антигенные или митогенные стимулы (Gray et al., 1984). TNF экспрессируется в виде зрелого белка 17 кДа, который активен в качестве тримера. Этот комплекс оказывает свое биологическое действие путем агрегации своих находящихся на поверхности клеток рецепторов, которые опосредуют специфические эффекты в различных органах и тканях. В эндометрии экспрессия TNF зависит от участка и менструального цикла 003927 6 (Hunt et al., 1992) и вызывает апоптоз в эндометрии экспериментальных животных (Shalaby et al., 1989). Прилипание клеток стромы эндометрия к мезотелиальным клеткам значительно увеличивалось предварительной обработкой мезотелиальных клеток TNF (Zhang et al., 1993), подтверждая таким образом положение о том, что TNF может участвовать в инициации и/или развитии эндометриоза. TNF реализует свою активность, которая требуется для нормального развития и функции иммунной системы, связыванием семейства связанных с мембраной рецепторных молекул, включая рецептор р55 TNF, также определяемый в литературе как TNF-RI, и рецептор р75 TNF, также определяемый в литературе как TNF-RII (Bazzoni and Beutler, 1996). О преобладании TNF-RI при передаче сигнала TNF свидетельствует способность агонистических антител, специфичных для этого рецептора, имитировать большинство реакций, вызванных TNF (Shalaby et al., 1990). Путем связывания его рецепторов, связанных с мембраной, TNF запускает сигнальный путь через цитоплазматические медиаторы, подобные TRADD и TRAP-1 (для TNF-RI) или TRAF-1 и TRAF-2 (для TNF-RII), приводя к различной клеточной реакции, подобной пролиферации Т клеток, лизису опухолевых клеток, некрозу дермы, резистентности к инсулину, апоптозу. Внеклеточные части обоих рецепторов TNF могут сбрасываться, и эти растворимые рецепторы сохраняют способность связывать TNF, инактивируя активность TNF путем образования комплексов с высоким сродством, уменьшая таким образом связывание TNF с рецепторами мембран клеток-мишеней (Nophar et al., 1990). В эндометрии мышей на уровни связанных с мембраной рецепторов TNF воздействуют введением эстрадиола и/или прогестерона, приводя ко временной и клеточно-специфичной экспрессии TNF-RI (Roby et al., 1996). Однако данное исследование, как и многие другие исследования, проведенные на различных моделях, относящихся к эндометрию, не дало никаких намеков на действительное влияние TNF и TNF-RI in vivo, связанных с мембраной или растворимых, на развитие эндометриальных очагов, но лишь дало описание связанных с эндометриозом иммунологических отклонений от нормы. Сущность изобретения Настоящая заявка на патент основана на предположении о том, что антагонист TNF способен связыванием циркулирующего TNF блокировать прогрессирование поражений эндометрия. Это предположение подтверждается данными, о которых сообщается в примере, показывающими, что антагонист TNF значительно уменьшает размер очагов, подобных эндометриозным, в экспериментальной модели у крыс. В результате данных, обнаруженных заявите- 7 лем, в настоящей заявке предоставляется способ лечения и/или профилактики эндометриоза у индивидуума, включающий введение терапевтически эффективного количества антагониста TNF. Во втором варианте реализации изобретение относится к способу лечения и/или профилактики связанных с эндометриозом состояний бесплодия у индивидуума, включающему введение терапевтически эффективного количества антагониста TNF в комбинации с другими препаратами. Еще одной задачей настоящего изобретения является применение антагониста TNF вместе с фармацевтически приемлемым носителем при получении фармацевтических композиций для лечения эндометриоза. В настоящем изобретении введение антагониста TNF может быть парентеральным или он может вводиться в виде других эффективных композиций. Может подходить любой вид парентерального введения, включая внутривенное, внутримышечное и подкожное. Кроме фармацевтически приемлемого носителя, композиции изобретения могут также включать небольшие количества добавок, таких как стабилизаторы, наполнители, буферы и консерванты. Антагонисты TNF, которые могут применяться в способе настоящего изобретения, включают растворимые молекулы рецептора TNF, антитела и соединения против TNF, которые предотвращают и/или ингибируют сигнализацию рецепторов TNF. Можно применять один антагонист TNF или в комбинации с другими антагонистами TNF. Возможна также комбинация с одним или несколькими фармацевтически активными продуктами, в частности, для облегчения состояний пациенток, страдающих бесплодием, связанным с эндометриозом. Описание изобретения Описанное в данной заявке изобретение ясно показывает неожиданный результат, состоящий в том, что связывание TNF (который является лишь одним из нескольких цитокинов, уровень экспрессии которых возрастает в перитонеальной жидкости после эндометриоза), посредством антагониста TNF уменьшает подобные эндометриозу очаги на экспериментальной модели у крыс. Эта модель демонстрирует также, что такой эффект получается без существенного влияния на гормональный баланс и активность естественных клеток-киллеров. Уменьшение эндометриозных поражений при использовании антагонистов TNF может также повысить частоту фертильности, поскольку нормализация структуры половых органов оказывает положительное влияние на частоту имплантации. Поэтому главной задачей настоящего изобретения является предоставление способа лечения и/или профилактики эндометриоза у индивидуума, включающего введение терапевти- 003927 8 чески эффективного количества антагониста TNF. Во втором варианте реализации изобретение относится к способу лечения состояний бесплодия, связанных с эндометриозом, у индивидуума, включающему введение терапевтически эффективного количества антагониста TNF в комбинации с другими препаратами. Еще одной задачей настоящего изобретения является применение терапевтически эффективного количества антагониста TNF вместе с фармацевтически приемлемым носителем при получении фармацевтических композиций для лечения и/или профилактики эндометриоза. Полученные таким образом фармацевтические композиции также являются еще одной задачей настоящего изобретения. Активными ингредиентами заявленных в настоящей заявке композиций являются антагонисты TNF. Заявленные антагонисты TNF оказывают свое действие одним или двумя путями. Во-первых, антагонисты могут с достаточным сродством и специфичностью связываться с самой молекулой TNF или секвестировать (блокировать) ее для того, чтобы по существу нейтрализовать эпитоп TNF, ответственный за связывание рецептора TNF (далее именуемые "секвестирующими антагонистами"). Альтернативно, антагонисты TNF могут ингибировать сигнальный путь TNF, активированный рецептором клеточной поверхности после связывания TNF (далее именуемые "антагонистами сигнализации"). В соответствии с настоящим изобретением, обе группы антагонистов могут применяться или отдельно, или вместе, при лечении эндометриоза. Антагонисты TNF легко идентифицируются и ранжируются рутинным скринингом кандидатов по их влиянию на действие нативного TNF по отношению чувствительных клеточных линий in vitro, например, В-клеток человека, в которых TNF вызывает пролиферацию и секрецию Ig. Количественный анализ содержит композицию TNF в различных разведениях перспективного антагониста, например, от 0,1 до 100 молярных количеств TNF, применяемых при анализе и контроле без TNF, или содержащие только антагонист (Tucci et al., 1992). В соответствии с настоящим изобретением, секвестирующие антагонисты являются предпочтительными антагонистами TNF. Среди секвестирующих антагонистов предпочтительными являются те полипептиды, которые с высоким сродством связывают TNF и обладают низкой иммуногенностью. Особенно предпочтительными являются растворимые молекулы рецептора TNF и нейтрализующие антитела к TNF. Например, в настоящем изобретении могут применяться TNF-RI и TNF-RII. В соответствии с настоящим изобретением, особенно предпочтительными антагонистами являются усеченные формы этих рецепторов, включаю- 9 щие внеклеточные домены рецепторов или их усеченные части. Усеченные формы рецепторов TNF являются растворимыми и ингибирующие связывание TNF белки 30 кДа и 40 кДа, которые первоначально были названы соответственно TBPI и TBPII, были выявлены в моче и сыворотке (Engelmann et al., 1990). Производные, фрагменты, области и биологически активные части молекул рецептора функционально напоминают молекулы рецептора, которые могут применяться в настоящем изобретении. Такие биологически активные эквиваленты или производные молекул рецептора относятся к части указанного полипептида, или последовательности, кодирующей молекулу рецептора, которая имеет достаточный размер и способна связывать TNF с таким сродством, что ингибируется или блокируется взаимодействие со связанным с мембраной рецептором TNF. В предпочтительном варианте реализации человеческий растворимый TNF-RI является антагонистом TNF для введения пациенткам. Естественные и рекомбинантные растворимые молекулы рецептора TNF и способы их производства были описаны в европейских патентных заявках ЕР 308378, ЕР 398327 и ЕР 433900. Многомерные молекулы рецептора TNF и слившиеся молекулы иммунорецептора TNF и их производные и части представляют собой дополнительные примеры молекул рецепторов, которые могут применяться в способах настоящего изобретения. Многомерные молекулы рецептора TNF, которые могут применяться в способах настоящего изобретения, включают весь или функциональную часть внеклеточного домена двух или более рецепторов TNF, связанных через один или несколько полипептидных линкеров. Многомерные молекулы могут, кроме того, включать сигнальный пептид секретируемого белка для направления экспрессии многомерной молекулы. Эти многомерные молекулы и способы их получения были описаны в европейской патентной заявке ЕР 526905. Слившиеся молекулы иммунорецептора TNF, которые могут применяться в способах настоящего изобретения, включают, по меньшей мере, одну часть одной или нескольких молекул иммуноглобулина и весь или функциональную часть одного или нескольких рецепторов TNF. Эти слившиеся молекулы иммунорецептора TNF могут собираться в виде мономеров или гетеро- или гомомультимеров. Слившиеся молекулы иммунорецептора TNF могут также быть моновалентными и мультивалентными. Слившиеся молекулы иммунорецептора TNF и способы их получения были описаны в европейской патентной заявке ЕР 620739, соответствующей патентной заявке РСТ WO 94/06476. Другой класс секвестрирующих антагонистов, которые могут применяться в способе настоящего изобретения, представлен антителами 003927 10 против TNF, включая моноклональные, химерные гуманизированные и рекомбинантные антитела и фрагменты, которые характеризуются высоким сродством связывания с TNF in vivo и низкой токсичностью. Антитела, которые могут применяться в изобретении, характеризуются их способностью лечить пациенток в течение периода, достаточного для получения от хорошей до отличной регрессии эндометриозных поражений, облегчения симптомов и низкой токсичности. Нейтрализующие антитела легко вырабатываются у таких животных как кролики или мыши при иммунизации TNF. Иммунизированные мыши особенно подходят для обеспечения источников В-клеток для производства гибридов, которые в свою очередь культивируются для получения больших количеств моноклональных антител против TNF. Химерные антитела представляют собой молекулы иммуноглобулина, характеризуемые двумя или более сегментами или частями, полученными от различных видов животных. В целом, вариабельная область химерного антитела получается из антитела млекопитающего, такого как мышиное моноклональное антитело, а константная область иммуноглобулина получается из молекулы человеческого иммуноглобулина. Предпочтительно, обе области и комбинация имеют низкую иммуногенность, по данным обычного определения (Elliott et al., 1994). Гуманизированные антитела представляют собой молекулы иммуноглобулина, созданные методом генной инженерии, в котором мышиные константные области замещаются человеческими аналогами, в то же самое время сохраняя области связывания мышиного антигена. Полученное в результате мышино-человеческое химерное антитело должно иметь сниженную иммуногенность и улучшенную фармакокинетику у людей (Knight et al., 1993). Предпочтительные примеры высокоаффинных антител и их химерных производных, которые могут применяться в способах настоящего изобретения, описаны в европейской патентной заявке ЕР 186833 и патентной заявке РСТ WO 92/16553. Антагонист TNF может вводиться индивидууму различными способами. Пути введения включают интрадермальный, трансдермальный (например, в композициях пролонгированного высвобождения), внутримышечный, внутрибрюшинный, внутривенный, подкожный, оральный, эпидуральный, местный и интраназальный пути. Может применяться любой другой терапевтически эффективный путь введения, например, всасывание через эпителиальную или эндотелиальную ткани, или геннотерапевтический, при котором пациенту вводится молекула ДНК, кодирующая антагонист TNF (например, посредством вектора), которая вызывает экспрессию и секрецию антагониста TNF in vivo. Кроме того, антагонист TNF может вводиться вместе с другими компонентами биологически активных средств, такими как фармацевтически при- 11 емлемые поверхностно-активные вещества, наполнители, разбавители или любые другие носители. Определение «фармацевтически приемлемый» предназначено охватывать любой носитель, который не препятствует реализации биологической активности активного ингредиента и который не токсичен для организма, в который он введен. Например, для парентерального введения антагонист TNF может быть включен в композиции в дозированную лекарственную форму для инъекции в таких носителях как солевой раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Для парентерального введения (например, внутривенного, подкожного, внутримышечного) композиция с включением антагонистов TNF может быть в виде раствора, суспензии, эмульсии или лиофилизированного порошка в сочетании с фармацевтически приемлемым парентеральным носителем (например, водой, солевым раствором, растворы декстрозы) и добавками, которые поддерживают изотоничность (например, маннитол) или химическую устойчивость (например, консерванты и буферы). Композиция стерилизуется обычно используемыми методиками. Биологическая активность антагониста TNF может быть также повышена использованием процедур конъюгации, которые увеличивают период полувыведения молекулы в организме человека, например, связывание молекулы с полиэтиленгликолем, как описано в патентной заявке РСТ WO 92/13095. Терапевтически эффективные количества антагониста TNF будут зависеть от многих переменных, включая тип антагониста, сродство антагониста с TNF, любую остаточную цитотоксическую активность, проявляемую антагонистами, путь введения, клиническое состояние пациентки (включая желательность поддержания нетоксичного уровня активности эндогенного TNF), присутствие множества участков, комбинирующих TNF, в секвестрирующих средствах, например,антител. «Терапевтически эффективное количество» - это такое, которое при введении антагониста TNF приводит к ингибированию биологической активности TNF. Введенная индивидууму доза в виде однократной дозы или множественных доз будет варьировать в зависимости от множества факторов, включая фармакокинетические свойства антагониста TNF, путь введения, состояния и характеристики пациентов (пол, возраст, масса тела, здоровье, величина), выраженность симптомов, сопутствующие виды лечения, частота лечения и желаемый эффект. Подбор и манипуляции для установления диапазонов доз хорошо известны специалистам в данной области, также как и способы определения ингибирования TNF у индивидуума in vitro и in vivo. 003927 12 Поскольку максимальная переносимая доза TNF в клинических испытаниях у людей достигала приблизительно 25 мкг/м2 поверхности тела/24 ч, нужно, чтобы количество введенного антагониста не превышало дозу, которая рассчитана для нейтрализации данного количества TNF. Соответственно, молярная доза антагониста TNF будет варьировать приблизительно от 0,001 до 10 максимально переносимых молярных доз TNF, хотя, как отмечено выше, это будет в значительной степени определяться соображениями эффективного лечения. Более того, данные, полученные в клинических исследованиях, в которых увеличение концентрации TNF в перитонеальной жидкости у женщин с эндометриозом было продемонстрировано с использованием различных схем (Eisermann et al.,1988; Halme. 1991; Overton et al., 1996), также могут использоваться при определении подлежащей введению эффективной дозы антагониста TNF. Обычно суточная дозировка активного ингредиента может составлять от около 0,01 до 100 мг/кг массы тела. Обычно для получения желаемых результатов эффективны дозы от 1 до 40 мг/кг, вводимые дробными дозами, или в форме с пролонгированным высвобождением. Второе или последующие введения могут выполняться в дозировке, которая равна, меньше или больше, чем начальная или предыдущая доза, введенная индивидууму. Второе или последующие введения могут выполняться во время или перед рецидивом эндометриоза или связанных с ним симптомов. Термины «рецидив» или «повторное возникновение» предназначены охватывать появление одного или нескольких симптомов эндометриоза. Антагонист TNF может вводиться индивидууму профилактически или с целью лечения перед, одновременно или последовательно с другими терапевтическими схемами или средствами (например, в схемах многокомпонентной медикаментозной терапии) в терапевтически эффективном количестве, в частности, для лечения бесплодия. Антагонисты TNF, которые вводятся одновременно с другими лечебными средствами, могут вводиться в тех же или в других композициях. В частности, когда расстройство, подлежащее лечению, представляет собой бесплодие, связанное с эндометриозом, могут вводиться биологически активный человеческий хорионический гонадотропин (чХГ), лютеинизирующий гормон (ЛГ) или фолликулостимулирующий гормон (ФСГ), или в естественной, высоко очищенной, или в рекомбинантной форме. Такие молекулы и способы их получения были описаны в европейских патентных заявках ЕР 160699, ЕР 211894 и ЕР 322438. Настоящее изобретение будет теперь проиллюстрировано примером, который ни в коей мере не предназначен для его ограничения и ссылается на следующие чертежи. 13 Описание фигур На фиг. 1 показаны воздействия антида (2 мг/кг, вводимого подкожно 1 раз в 3 дня), рекомбинантного растворимого TNF-RI (10 мг/кг, вводимого подкожно 2 раза/день в течение периода 1 нед.), на размер имплантатов у крыс с экспериментальным эндометриозом через 2 и 9 дней после последнего лечения. Эти данные, которые были получены с использованием 6 животных на группу для первого значения времени, и 5 животных на группу для второго значения времени, представляют среднее процентное значение ингибирования ± стандартная ошибка средней. На фиг. 2 показаны воздействия рекомбинантного растворимого TNF-RI (10 мг/кг, вводимого 2 раза/д в течение периода 1 нед) и антида (2 мг/кг, вводимого 1 раз в 3 дня) на активность естественных киллеров селезенки крыс против клеток YAC (высвобождение 51Сr) через 2 дня (панель А) и 9 дней (панель В) после последнего лечения. Данные представляют среднее процентное значение лизиса ± стандартная ошибка средней. На фиг. 3 показаны воздействия рекомбинантного растворимого TNF-RI (10 мг/кг, вводимого 2 раза/д в течение периода 1 нед) в сравнении с контролем и антидом (2 мг/кг, вводимого 1 раз в 3 дня) на уровень эстрадиола-17β в сыворотке при экспериментальном эндометриозе у крыс. Данные представляют среднюю концентрацию эстрадиола-17β ± стандартная ошибка средней. Пример Материалы и методы Животные. Самки крыс линии SpragueDawley (250-275 г) были закуплены у Charles River Italia (Calco, Lecco Italy). Животных содержали в следующих условиях окружающей среды: температура 22 ± 2°С, относительная влажность 55 ± 10%, вентиляция 15 ± 3 объемов воздуха за 1 ч, фильтруемого через фильтры НЕРА 99,97% и искусственное освещение с циркадным циклом 12 часового освещения (с 7:00 до 19:00). Перед экспериментами животным давали возможность акклиматизироваться к этим условиям в течение периода, по меньшей мере, 1 недели. Животные без ограничений получали стандартный гранулированный корм. Исследуемые препараты. Антид был произведен и представлен фирмой Bachem (California, USA). Используемая в примере молекула человеческого рекомбинантного растворимого TNF-RI имеет последовательность, соответствующую сегменту 20-180 человеческого TNF-RI (Nophar et al., 1990) и была получена в клетках СНО и предоставлена Interpharm Laboratories Ltd. (Israel) под названием r-hTBP-1. Материал. Общий материал клеточной культуры был закуплен в Gibco BRL, Life Technologies (Paisley, UK). Набор RIA 17β- 003927 14 эстрадиола был закуплен в фирме DPC (Los Angeles, CA, USA). Инокетам был закуплен в фирме Virbac (Carros, FR). [51Cr]-натрий хромат был закуплен у NEN Dupont (Boston, MA, USA). Ромпун был закуплен в фирме Bayer AG (Leverkusen, DE). Шелковая нить была закуплена у компании Ethicon (Pomezia, IT). Экспериментальная модель эндометриоза у крыс. Для исследования воздействий рекомбинантного растворимого TNF-RI при эндометриозе использовали ранее описанную экспериментальную модель (Jones, 1987) с небольшими модификациями. В условиях анестезии инокетамом/ромпуном аутологичный фрагмент ткани эндометрия (длиной 1 см) резецируют из правого рога матки и помещают в раствор с фосфатным буфером при 37°С. Сегмент матки вскрывают продольным разрезом, и отрезок размером 5х5 см без удаления миометрия трансплантируют на внутреннюю поверхность брюшной стенки с использованием прошивания в четырех углах нерассасываемой шелковой нитью. Исследование воздействий изучаемых препаратов при экспериментальной модели эндометриоза. Экспериментальный эндометриоз вызывают хирургическим путем у наркотизированных крыс, как указано выше. Кроме того, аналогичным образом удаляют один рог матки у другой группы, но трансплантируют квадрат размером 5х5 мм жировой ткани, окружающей матку (группа ложнооперированных животных). Еще одну группу крыс, не подвергавшихся никакому хирургическому вмешательству, держат в качестве здоровой контрольной группы. Через 3 недели после индукции эндометриоза животных подвергают второй лапоротомии (лапоротомия перед лечением) для оценки размера и жизнеспособности эктопической ткани эндометрия. Используя измеритель, регистрируют площадь поверхности (длина х ширину). Как показано в табл. 1, животных с признаками жизнеспособных имплантатов включают в группы, предназначенные для лечения, так что в конце эксперимента получают 6 животных на группу для точки времени первого забоя и 5 животных на группу для точки времени второго забоя. Различные виды лечения начинают после периода восстановления длительностью 1 нед. Контрольная группа получает только солевой раствор, другая группа получает 3 подкожных инъекции антида 2 мг/кг 1 раз в 3 дня по схеме, которая, как было показано ранее, подавляет активность яичников и гипоталамуса (Sharpe et al., 1990). Другая группа в течение периода 1 нед. получает 10 мг/кг рекомбинантного растворимого TNF-RI, разделенные на 2 суточные дозы. 15 Трансплантация эндометрия Нет Ложно оперированные Да Да 003927 Дни Лечение лечения(1) Солевой раствор 28-34 Солевой раствор 28-34 Таблица 1 Дни забоя(1) 36, 43 36, 43 Солевой раствор 28-34 36, 43 Антид (2 мг/кг) 28, 31, 34 36, 43 Рекомбинантный растворимый Да TNF-RI (10 28-34 36, 43 мг/кг) в двух суточных дозах (1) Со дня хирургической имплантации (1-ый день). В предназначенные точки времени забоя (2 и 9 дни после последнего лечения, т.е. на 36 и 43 день после хирургической имплантации) животных наркотизируют; из брюшной аорты берут образцы крови, отделяют сыворотку и хранят при -20°С до тех пор, пока не проводят анализ на содержание 17β-эстрадиола. Иссекают селезенки для измерения активности естественных киллеров (NK) . В каждую точку времени забоя измеряют площадь поверхности очагов, подобных эндометриозу, для нормализации данных рассчитывают процент вариации в сравнении с величиной при лапоротомии перед лечением по формуле где Х0 - размер во время лапоротомии перед лечением, а Х - размер во время забоя. Затем рассчитывают среднюю величину вариации в процентах в каждой группе. Определение активности NK. Степень активности NK определяют с использованием анализа высвобождения 51Сr. Клетки мышиной лимфомы YAC-1 собирают во время фазы экспоненциального роста и однократно промывают средой (RPMI 1640, содержащей пенициллин/стрептомицин, L-глутамат и 10% инактивированной нагреванием сыворотки овцы). Клеточный осадок инкубируют со 100 мккюри [51Сr] -натрия хромата при 37°С, 5% СО2 в течение 2 ч. Затем клетки промывают 3 раза 10 мл аналитической среды, ресуспендируют в желаемой концентрации и добавляют в аналитическую планшету в присутствии крысиных спленоцитов. Их ресуспендируют в аналитической среде в желаемой концентрации (2 х 106/мл) и проводят серийные разведения в аналитической среде в тройных U-образных лунках 96-луночной планшеты перед добавлением меченых 51Сr клеток-мишеней. Меченые 51Сr клетки-мишени (5 х 103) добавляют в каждую лунку аналитической планшеты и для каждого образца анализируют три отношения эффекторов к мишеням (200:1, 100:1 и 50:1). Планшету, содержащую клеточную смесь эффекторов и мишеней центрифугируют при 200хg в течение 4 мин, а затем инкубируют при 37°С, в 5% СО2 в течение 4 ч. После дополнительного центрифугирования планшеты при 200хg в течение 4 мин, 20 16 мкл надосадочной жидкости из каждой лунки переносят на стекловолоконный фильтр и βсчетчиком оценивают ассоциированную радиоактивность. Процентную долю лизиса рассчитывают следующим образом: где cpmsample = среднее высвобождение 51Сr в присутствии эффекторных клеток; cpmspont. = среднее высвобождение 51Cr из клеток-мишеней в присутствии культуральной среды; cpmtotal = среднее высвобождение 51Сr из клеток-мишеней в присутствии 1% Triton-X100. Определение содержания 17β-эстрадиола. Концентрацию 17β-эстрадиола в сыворотке определяют с использованием имеющегося в продаже набора для количественного определения эстрадиола в сыворотке без этапа экстракции (DPC, Los Angeles, СА, USA). Вкратце, меченый 125 I эстрадиол конкурирует с эстрадиолом в образце сыворотки за участки антител. После инкубации отделение связанного эстрадиола от свободного достигают декантированием. Затем пробирку для подсчета помещают в гамма счетчик (LKB-Pharmacia Wallak), причем результаты подсчета обратно пропорционально связаны с количеством эстрадиола, присутствующего в образце сыворотки. Количество эстрадиола в образцах определяют сравнением данных подсчета с калибровочной кривой. Антисыворотка высоко специфична для эстрадиола с относительно низкой перекрестной реактивностью по отношению к другим естественно встречающимся стероидам. Образцы из одного экспериментального цикла анализируют в одной иммунной пробе. Статистический анализ. Статистическая значимость различий, наблюдающихся среди групп лечения, оценивают с использованием программы ANOVA, имеющейся в программном обеспечении Statgraphics Plus® (версия 1.4). Применяют мультипараметрический критерий Tukey (P<0.05). Результаты Исследование воздействий рекомбинантного растворимого TNF-RI при экспериментальном эндометриозе Успешный рост и развитие имплантированной хирургическим путем ткани эндометрия у крыс предоставили исследовательскую модель, которую использовали для изучения некоторых аспектов эндометриоза, которые невозможно адекватно исследовать у людей (Dudley et al., 1992). Предыдущие исследования экспериментального эндометриоза у крыс показывают, что антид соответствующим образом действует в качестве положительного контроля (Sharpe et al., 1990). Как показано в итоговой 17 003927 табл. 2, в настоящем примере эффект антида сравнивался с точки зрения размера имплантата до и после лечения с размерами, полученными с использованием рекомбинантного растворимого TNF-RI. Лечение Солевой раствор Растворимый TNF-RI Антид Солевой раствор Растворимый TNF-RI Антид Таблица 2 Доза Время Средняя± Средняя± (мг/кг) наблюде- стандартное стандартное ния после отклонение отклонение последнесредней средней го лечения величины величины (дни) перед лече- после лечения (см2) нием (см2) - 2 1,45±0,41 1,18±0,15 10 2 1,43±0,38 0,77±0,09 2 2 1,43±0,34 0,08±0,02 - 9 1,28±0,24 0,97±0,11 10 9 1,42±0,38 0,54±0,19 2 9 1,41±0,32 0,19±0,09 Результаты выражены на фиг. 1 в виде среднего ингибирования в процентах фрагментов имплантированного эндометрия (рассчитанного, как описано выше). Антид был эффективен в плане уменьшения размера очагов, подобных эндометриозным (фиг. 1), вызывая почти полную (соответственно 94 и 88%, в сравнении с первоначальным размером) ремиссию в обеих точках времени наблюдения после прекращения лечения. Лечение в течение 1 недели человеческим рекомбинантным растворимым TNF-RI (10 мг/кг, в двух ежесуточных дозах) привело к существенному уменьшению размеров (соответственно 33 и 64%, в сравнении с первоначальным размером) очагов, подобных эндометриозным в обеих точках времени наблюдения, но статистически значимому (Р<0.05, ANOVA и тест Tukey) только на 9 день. В любые точки времени имплантаты не наблюдались у ложно оперированных животных. Оценка активности клеток NK Активность клеток NK оценивали в тестах in vitro с использованием клеток селезенки в сравнении с клетками YAC. Никаких различий между группами выявлено не было (фиг. 2), аналогично тому, что наблюдалось у бабуинов, где у животных с эндометриозом и без него не была обнаружена разница цитотоксичности по отношению эндометрия и активности клеток NK (D'Hooghe et al., 1995). Эти данные противоречат данным, полученным у людей, где сообщалось о подавлении активности клеток NK у пациенток с эндометриозом при значимой корреляции между сниженной активностью перитонеальных NK и тяжестью эндометриоза (Oosterlynck et al., 1992). Оценка содержания эстрадиола-17β в сыворотке Концентрацию эстрадиола-17β в сыворотке измеряли радиоиммуноанализом в обеих точках времени наблюдения. Значимое различие 18 наблюдалось в группах леченных антидом, в сравнении с нелеченными контролями во второй точке времени наблюдения. При сравнении с контролями, для рекомбинантного растворимого TNF-RI статистически значимые различия не наблюдались (фиг. 3; (Р<0,05, ANOVA и тест Tukey). Выводы На экспериментальной модели эндометриоза у крыс введение антагониста TNF, растворимой формы TNF-RI, дает впервые отчетливые доказательства потенциальной эффективности не связанного с гормонами лечения, основанного на цитокинах, этого патологического состояния. Таким образом, антагонисты TNF представляют альтернативу существующим методам медикаментозного лечения с точки зрения снижения частоты побочных эффектов. Эти данные оценивают применение антагонистов TNF при лечении бесплодия, связанного с эндометриозом. Специалистам в данной области будут ясны или они смогут понять, используя не более чем обычные эксперименты, многие эквиваленты конкретных вариантов реализации изобретения, описанных в данной заявке. Предполагается, что эти и все другие эквиваленты будут охвачены следующей формулой изобретения. Список библиографических источников Arici, A., Tazuke, S.L, Attar, E., Kliman, H.J., and Olive, D.L, 1996a, Mol. Hum. Reprod. 2, 40-45. Arici, A., Oral, E., Bukulmez, O., Duleba, A., Olive, D.L., and Jones, E.E., 1996b, Fertil. Steril. 65, 603-607. Arici, A., Oral, E., Attar, E., Tazuke, S.I, and Olive, D.J., 1997, Fertil. Steril. 67, 1065-1072. Barbieri, R.L, 1988, N. Engl. J. Med. 318, 512-514. Bazzoni, F. and Bentler, В., 1996, N. Engl. Med. 334, 1717-1725. Cheung, A.N., 1996, Curr. Opin. Obstet. Gynecol 8,46-51. D'Hooghe, TM, Scheerlinck, J.P., Koninckx, P.R, Hill, J.A., and Bambra, CS., 1995, Hum.Reprod. 10, 558-562 Dawood, M.Y., 1993, Int. J. Gynaecol. Obstet. 40 (Suppl), S29-42. Dudley, DJ, Hatasaka, HJL, Branch, D.W., Hammond, E., and Mitchell, M.D, 1992, Am. J. Obstet. Gynecol. 167, 1774-1780. Eisermann. J., Gast, M.J., Pineda, J., Odem, R.R., and Collins J. L., 1988, Fertil. Steril. 50, 573579. Eisermann, J., Register, K.B., Strickler, R.C., and Collins J. L., 1989, J.Androl. 10, 270-274. Elliott. M.J., Maini, R.N., Feldmann, M., Long-Fox, A., Charles, P., Bijl, H, and Woody, J.N, 1994, Lancet 344, 1125-1127. Engelmann, H., Novick, D., and Wallach, D., 1990, J. Biol. Chem. 265,1531-1536. 19 Fiers, W., 1991, FEBS Lett. 285, 199-212. Gray, P.W, Aggarwal, B.B., Benton, C.V., Bringman, T.S., Henzel, W.J., Jarrett, J.A., Leung, D.W., Moffat, В., Ng, P., and Svedersky, L.P., 1984, Nature 312, 721-724. Hahn, D.W, Carraher, R.P., Foldesy, RG, and MeGuire, J.L., 1986, Am. J. Obstet. Gynecol. 155, 1109-1113. Halme, J., 1991, Ann. N. Y. Acad. Sci. 622, 266-274. Harada, Т., Yoshioka, H., Yoshida, S., Iwabe, Т., Qnohara, Y., Tanikawa, M., and Terakawa, N., 1997, Am. J. Obstet. Gynecol. 176 , 593-597. Но, H.N., Wu, M.Y., and Yang, Y.S., 1997, Am.J.Reprod.Immunol. 38, 400-412. Hornung, D., Ryan, LP., Chao, V.A., Vigne, J.L., Schriock, E.D., and Taylor, R.N, 1997, J. Clin. Endocrinol. Metab. 82,1621-1628. Hunt, J.S., Chen, H.L, Hu, XL., and Tabibzadeh, S., 1992, Biol. Reprod. 47,141-147. Jones, R.C, 1987, Acta Endocrinol. (Copenh.) 114, 379-382. Knight, D.M., Trinh, H., Le, J., Siegel, S., Shealy, D., McDonough, M, Scallon, В., Moore, M.A, Vilcek, J., and Daddona, P., 1993, Mol. Immunol. 30,1443-1453. Koninckx, P.R., Meuleman, C., Demeyere, S., Lesaffre, E., and Cormillie, F.J., 1991, Fertil. Steril. 55,759-765. Koninckx, P.R. and Martin, D., 1994, Curr. Opin. Obstet. Gynecol. 6,231-241. MacSween, R.N.M., 1993, Muir's Textbook of pathology, 13th ed. (Whaley K.; ISBN 0-34055145-3), 1024-1025. Malinak, L.R., Buttram, V.C.J., Elias, S., and Simpson, J.L., 1980, Am. J. Obstet. Gynecol. 137, 332-337. Matalliotakis, L, Neonaki, M., Zolindaki, A., Hassan, E., Georgoulias, V., and Koumantakis, E., 1997, Int. J. Fertil. Womens. Med. 42, 211-214. Mori, H., Nakagawa, M., Itoh, N., Wada, K., and Tamaya, Т., 1990, Am. J. Reprod. Immunol. 24, 45-50. Nophar, Y., Kemper, O., Brakebusch, C., Englemann, H., Zwang, R., Aderka, D., Holtmann, H, and Wallach, D., 1990, EMBOJ. 9.3269-3278. Oosterlynck, D.J., Meuleman, C., Waer, M., Vandeputte, M., and Koninckx, P.R, 1992, Fertil. Steril. 58, 290-295. Overton, C., Fernandez-Shaw, S., Hicks, В., Barlow, D., and Starkey, P., 1996, HumReprod. 11, 380-386. Pennica, D., Nedwin, G.E., Hayflick, J.S., Seeburg, P.H., Derynck, R., Palladino, M.A, Kohr, W.J., Aggarwal, B.B., and Goeddel, D.V., 1984, Nature 312, 724-729. Rana, N., Braun, D.P., House, R., Gebel, H., Rotman, C., and Dmowski, W.P., 1996, Fertil. Steril. 65, 925-930. Revelli, A., Modotti, M., Ansaldi, C., and Massobrio, M., 1995, Obstet. Gynecol. Surv, 50, 747-754. 003927 20 Roby, K.F., Laham, N., and Hunt, J.S., 1996, J. Reprod. Fertil. 106, 285-290. Shalaby, M.R., Laegreid, W.W, Ammann, A.J., and Liggitt, H.D., 1989, Lab. Invest. 61, 564570. Shalaby, M.R, Sundan, A., Loetscher, H, Brockhaus, M., Lesslauer, W., and Espevik, Т., 1990, J.Exp.Med. 172, 1517-1520. Sharpe, K.L., Bertero, M.C., and Vernon, M.W., 1990, Prog. Clin. Biol. Res. 323, 449-58. Tucci, A., James, H., Chicheportiche, R., Bonnefoy, J.Y., Dayer, J.M., and Zubler, R.H., 1992, J. Immunol 148, 2778-2784. Waller, K.G. and Shaw, R.W., 1993, Fertil. Steril. 59, 511-515. Zhang, R.J., Wild, R.A., and Ojago, JМ, 1993, Fertil. Steril. 59, 1196-1201. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение антагониста TNF, представляющего собой секвестрирующий антагонист или антагонист сигнализации, в качестве активного вещества фармацевтической композиции для лечения и/или профилактики эндометриоза. 2. Применение антагониста TNF, представляющего собой секвестрирующий антагонист или антагонист сигнализации, в качестве активного вещества фармацевтической композиции для повышения частоты имплантации и фертильности путем уменьшения эндометриозных поражений. 3. Применение по п.1 или 2, где секвестрирующий антагонист представляет его рецепторную молекулу, производное или фрагмент, который связывается с TNF. 4. Применение по п.3, где рецепторная молекула выбрана из группы, состоящей из TNFRI и TNF-RII. 5. Применение по п.3, где рецепторная молекула представляет внеклеточный домен TNFRI. 6. Применение по п.3, где рецепторная молекула представляет человеческий растворимый рекомбинантный TNF-RI. 7. Применение по п.3, где рецепторная молекула представляет многомерную молекулу рецептора TNF или ее функциональную часть. 8. Применение по п.7, где многомерная молекула рецептора TNF включает весь или функциональную часть двух или более внеклеточных доменов рецепторов TNF, связанных посредством одного или нескольких полипептидных линкеров. 9. Применение по п.3, где рецепторная молекула представляет слитую молекулу иммунорецептора или ее функциональную часть. 10. Применение по п.9, где слитая молекула иммунорецептора включает весь или функциональную часть рецептора TNF и цепь иммуноглобулина. 21 003927 11. Применение по п.1 или 2, где секвестрирующий антагонист представляет антитело против TNF или его фрагмент. 12. Применение по п.11, где моноклональное антитело выбрано из группы, состоящей из 22 химерного моноклонального антитела, гуманизированного моноклонального антитела или его фрагмента. Фиг. 2 Фиг. 1 Фиг. 3 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6