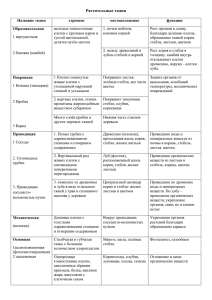
протоколы лабораторных занятий
advertisement

МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ ХАРЬКОВСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ имени В. Н. КАРАЗИНА Ю. Ю. Юхно, О. А. Авксентьева АНАТОМИЯ РАСТЕНИЙ: протоколы практических занятий Учебно-методическое пособие 2-е издание ХАРЬКОВ – 2015 УДК 581.4(075.8) ББК 28.56 я 73 Ю 94 Рецензенты: Колупаев Ю. Е. – доктор биологических наук, зав. кафедры ботаники и физиологии растений Харьковского национального аграрного университета имени В. В. Докучаева; Некрасова А. В. – кандидат биологических наук, доцент кафедры генетики и цитологии Харьковского национального университета имени В. Н. Каразина; Гамуля Ю. Г. – кандидат биологических наук, доцент кафедры ботаники и экологии растений Харьковского национального университета имени В. Н. Каразина. Утверждено к печати решением Научно-методического совета Харьковского национального университета имени В. Н. Каразина (протокол № 5 от 23.05.2014 года) Юхно Ю. Ю. Ю 94 Анатомия растений: протоколы практических занятий : учебнометодическое пособие / Ю. Ю. Юхно, О. А. Авксентьева. – 2-е изд. – Х. : ХНУ имени В. Н. Каразина, 2015. – 104 с. Учебно-методическое пособие включает четыре раздела: «Краткие основы микроскопической техники», «Растительная клетка», «Растительные ткани», «Анатомия вегетативных органов». Структура учебно-методического издания позволяет успешно его использовать и как учебное пособие, и как рабочую тетрадь, в которую студент заносит результаты своей работы на лабораторных занятиях. Для студентов биологических специальностей ВУЗов, изучающих курс «Анатомия растений», а также аспирантов и научных сотрудников, исследующих растительные объекты. УДК 581.4(075.8) ББК 28.56 я 73 ©Харьковский национальный университет имени В. Н. Каразина, 2015 © Юхно Ю. Ю., Авксентьева О. О., 2015 © Дончик И. Н., макет обложки, 2015 Содержание ПРЕДИСЛОВИЕ .................................................................................................. 4 1. КРАТКИЕ ОСНОВЫ МИКРОСКОПИЧЕСКОЙ ТЕХНИКИ ................................ 6 1.1. 1.2. 1.3. 1.4. 1.5. Устройство светового микроскопа .......................................................... 6 Правила работы со световым микроскопом «Биолам» .......................... 11 Техника приготовления микропрепаратов ........................................... 13 Микрохимические (цито- и гистохимичесие) реакции ......................... 16 Измерение размеров клеток и их компонентов .................................... 18 2. РАСТИТЕЛЬНАЯ КЛЕТКА .............................................................................. 21 2.1. Лабораторная работа № 1. «Устройство светового микроскопа и правила работы с ним. Методы анатомии растений. Общий план строения растительной клетки» ................................................. 21 2.2. Лабораторная работа № 2. «Движение цитоплазмы. Пластидная система, клеточная стенка и ее видоизменения» ........... 24 2.3. Лабораторная работа № 3. «Вакуоль. Явление плазмолиза и деплазмолиза. Кристаллические включения» ..................................... 32 2.4. Лабораторная работа № 4. «Запасные вещества растительных клеток» ................................................................................................ 38 2.5. Примеры тестовых и модульных заданий ............................................ 44 3. РАСТИТЕЛЬНЫЕ ТКАНИ ............................................................................... 46 3.1. Лабораторная работа № 5. «Меристематические, покровные и механические ткани» .......................................................................... 46 3.2. Лабораторная работа № 6. «Проводящие ткани, сосудистоволокнистые (проводящие) пучки, поглотительные, выделительные ткани, система проветривания» ................................ 55 3.3. Примеры тестовых и модульных заданий ............................................ 66 4. АНАТОМИЯ ВЕГЕТАТИВНЫХ ОРГАНОВ ...................................................... 68 4.1. Лабораторная работа № 7. «Первичное и вторичное строение стебля. Видоизменения стебля» .......................................................... 68 4.2. Лабораторная работа № 8. «Анатомия листа однодольных и двудольных растений. Экологическая пластичность анатомии листьев к условиям среды .................................................. 79 4.3. Лабораторная работа № 9. «Анатомическое строение корня. Метаморфозы (видоизменения) корней» ............................................ 89 4.4. Примеры тестовых и модульных заданий ............................................ 98 ПРИЛОЖЕНИЯ ............................................................................................... 100 Приложение 1. Правила техники безопасности при работе в биологической лаборатории малого практикума по курсу «Анатомия растений» ........................................................................ 100 Приложение 2. Правила ухода за световым микроскопом ........................ 101 КАРТА УСПЕВАЕМОСТИ ................................................................................ 102 ЛИТЕРАТУРА ................................................................................................... 103 ПРЕДИСЛОВИЕ Анатомия растений – это наука, изучающая внутреннее строение растительного организма: строение растительных клеток, тканей и органов. Курс «Анатомии растений» традиционно является первым из ботанических дисциплин, с которого начинается изучение растительного мира. В рамках курса раскрываются особенности строения и, отчасти, функции растений, рассматриваются некоторые общебиологические понятия, приводится обширная терминология, на основе которой оказывается возможным изучение других дисциплин ботанического цикла. Данное учебно-методическое пособие «Анатомия растений : протоколы практических занятий» разработано на основе многолетней практики преподавания этой дисциплины на кафедре физиологии и биохимии растений и микроорганизмов студентам 1-го курса биологического факультета Харьковского национального университета имени В. Н. Каразина. Учебно-методическое пособие включает четыре раздела: «Краткие основы микроскопической техники», «Растительная клетка», «Растительные ткани», «Анатомия вегетативных органов». Выполнение студентами лабораторных занятий по курсу «Анатомия растений» способствует более эффективному усвоению теоретических знаний курса, а также формированию практических навыков микроскопической техники и компетенций при проведении самостоятельных исследований в данной области науки. Каждая лабораторная работа включает краткие теоретические сведения, описание хода работ: конкретные задания; методические рекомендации к их выполнению; пояснения к препаратам растительных объектов; вопросы, на которые необходимо дать ответы; глоссарий. Значительное место в учебнометодическом пособии отводится иллюстративному материалу, что дает возможность студенту не только правильно понять изучаемый препарат, но и скорректировать свой рисунок в альбоме. Приступая к выполнению лабораторной работы, следует внимательно прочитать соответствующий теоретический материал, задания к теме (обязательные и дополнительные), перечень объектов и методов исследования, продумать последовательность выполнения заданий, при необходимости проконсультироваться с преподавателем и только после этого начать практическое выполнение лабораторной работы. Лабораторные работы выполняются каждым студентом. Полученные результаты в виде рисунков, таблиц и пр. оформляются в альбоме и служат показателем проделанной студентом работы на занятии. В альбоме указываются: а) дата работы, б) точное название темы, в) результаты работы ― в виде рисунков и соответствующих подписей, ответов на вопросы, заполнения таблиц и т. д. Структура учебно-методического издания позволяет успешно его использовать и как учебное пособие, и как рабочую тетрадь, в которую 4 студент заносит результаты своей работы на лабораторных занятиях и делает необходимые рисунки. Кроме того, пособие дает возможность студентам использовать его и для внеаудиторной самостоятельной работы в процессе подготовки к лабораторным и итоговым занятиям по приведенным тестовым и модульным контрольным вопросам по каждой теме. К зачету допускаются студенты, полностью освоившие учебный план лекционных и практических занятий по курсу «Анатомия растений». Оформленный альбом должен быть проверен и подписан преподавателем. Студент должен знать теоретический материал каждого занятия и иметь оценки за контрольные работы по разделам практикума. 5 1. КРАТКИЕ ОСНОВЫ МИКРОСКОПИЧЕСКОЙ ТЕХНИКИ Методы исследования в анатомии растений Единицей строения и жизнедеятельности растений, их тканей и органов является клетка. Размеры растительных клеток очень малы: от 10 до 100 мкм (1 мкм = 0,001 мм), в то время как человеческий глаз различает объекты величиной не менее 0,1 мм. Отсюда понятно, что изучение анатомического строения растений возможно только с помощью оптического прибора – микроскопа. Поэтому основным методом исследования в анатомии растений является микроскопический с использованием световых, флуоресцентных и конфокальных микроскопов, а также различных техник приготовления и исследования микроскопических препаратов. При выполнении лабораторных работ по данному курсу студенты используют световой микроскоп, технику приготовления временных анатомических препаратов, цитохимические и гистохимические методы. 1.1. Устройство светового микроскопа Микроскоп – это оптический прибор, позволяющий получить обратное изображение изучаемого объекта и рассмотреть мелкие детали его строения, размеры которых лежат за пределами разрешающей способности человеческого глаза. В биологических исследованиях и на лабораторных занятиях в настоящее время наиболее часто используются микроскопы серии «БИОЛАМ». Они предназначаются для изучения микроскопических объектов в проходящем свете в светлом поле. Обычно используют световые микроскопы, на которых микропрепараты рассматриваются с использованием естественного или искусственного света. Микроскоп состоит из трех основных систем (частей): осветительной, оптической и механической. Осветительная система обеспечивает наилучшее освещение изучаемого объекта, оптическая позволяет получить его увеличенное изображение, механическая – объединяет две первые и способствует их слаженной работе (рис. 1.1). Осветительная система состоит из конденсора, ирисовой диафрагмы, откидного кольца для светофильтра, дополнительной откидной линзы и зеркала (или осветителя). Конденсор (8) укреплен над зеркалом и состоит из 2–3 линз, вставленных в цилиндрическую оправу. Он собирает параллельные лучи, идущие от источника света (или отраженные зеркалом) в одной точке – фокусе, которая должна находиться в плоскости препарата. В нижнюю часть конденсора встроена ирисовая диафрагма. Она состоит из тонких металлических пластинок («лепестков»), подвижно укрепленных в круглой оправе. С помощью специального рычажка пластинки можно 6 сдвигать и раздвигать, получая в центре диафрагмы отверстие разной величины. При уменьшении отверстия задерживаются боковые лучи света, которые непосредственно не принимают участия в формировании изображения, в результате чего получается более четкая картина объекта. Обычно при использовании в работе малого увеличения и интенсивного освещения, пластинки диафрагмы сдвигают, уменьшая отверстие и, наоборот, при большом увеличении и слабом освещении препарата диафрагму раздвигают полностью. Под конденсором укреплено откидное кольцо, в которое вставляют светофильтр из синего или матового стекла, чтобы уменьшить яркость освещения объекта в случае использования искусственного источника света. Под диафрагмой находится дополнительная откидная линза, которую используют при микроскопировании с малым увеличением. Конденсор вместе со светофильтром может перемещаться вверх и вниз в пределах 20 мм при помощи специального винта. При подъеме или опускании его с помощью этого винта соответственно конденсируется или рассеивается свет, падающий от зеркала на объект. Регулировка высоты положения конденсора производится каждый раз при смене микроскопируемого препарата, чтобы совместить его фокус с плоскостью объекта и улучшить четкость его изображения. Рис. 1.1. Устройство световых микроскопа марки «БИОЛАМ»: 1 – окуляр; 2 – тубус; 3 – тубусодержатель; 4 – винт грубой наводки; 5 – микрометренный винт; 6 – подставка; 7 – зеркало; 8 – конденсор, ирисовая диафрагма и светофильтр; 9 – предметный столик; 10 – револьверное устройство; 11 – объектив 7 Ниже конденсора расположено зеркало (7). Оно подвижно соединяется со штативом микроскопа с помощью тоже подвижной вилки. Зеркало можно вращать во взаимно перпендикулярных плоскостях. Это позволяет направлять лучи, отраженные зеркалом, от источника света через конденсор и отверстие предметного столика на объект. Зеркало двустороннее: одна сторона его плоская, другая – вогнутая. Плоской стороной пользуются при работе с большим увеличением и с применением конденсора. Вогнутое зеркало применяют в тех случаях, когда работают с малым увеличением. В лабораториях с рассеянным светом используют вогнутое зеркало. При работе с зеркалом лучше всего использовать естественное освещение, причем рассеянное, а не прямые солнечные лучи. Если источником освещения служит искусственный свет, удобнее и желательно пользоваться матовыми лампами. Вместо зеркала может использоваться электроосветитель. Он устанавливается под конденсором в гнездо подставки. Оптическая система – наиболее важная часть микроскопа. Она представлена объективами и окуляром. В свою очередь, объектив (11) является важнейшей составляющей оптической системы. Именно объектив дает действительное увеличение и обратное изображение изучаемого объекта. Название свое он получил потому, что при работе с микроскопом обращен к исследуемому предмету. Объектив состоит из нескольких линз, вставленных в металлическую оправу. Он может содержать до 6 и более (10–20) линз. Его оптические свойства в большей мере зависят от количества и качества линз. Самая главная линза – наружная, ее называют фронтальной. Чем больше кривизна этой линзы, тем больше увеличение объектива, меньше его рабочее расстояние и поле зрения. Рабочее расстояние – это расстояние от фронтальной линзы до плоскости препарата при сфокусированном объекте. Линзы, расположенные в объективе выше фронтальной, обеспечивают четкость изображения. Каждый объектив характеризуется своим собственным увеличением, которое обозначено цифрами, выгравированными на его оправе. Например, на лабораторных занятиях по анатомии растений чаще всего используют объективы 8х (малое увеличение) и 40х (большое увеличение). Это значит, что данные объективы увеличивают изображение объекта в 8 и 40 раз соответственно. При микроскопировании следует обращать внимание на рабочее расстояние объектива, о котором говорилось выше. У объектива 8х оно составляет около 9,2 мм, а у объектива 40х – около 0,6 мм. Учитывая малое расстояние при большом увеличении, опускать объектив надо осторожно, чтобы не раздавить препарат. Поскольку объектив малого увеличения дает большое поле зрения, его используют, во-первых, для рассмотрения общего плана строения объекта, и, 8 во-вторых, для поиска участков для более подробного их изучения с помощью большого увеличения. Окуляр (1) имеет более простое строение по сравнению с объективом. Название его связано с тем, что при работе с микроскопом он обращен к глазу. Окуляр состоит из 2–3 линз и диафрагмы, встроенных в металлический цилиндр. Верхнюю линзу называют глазной, а нижнюю – собирательной. Между линзами расположена диафрагма, которая задерживает боковые лучи и ограничивает поле зрения, что обеспечивает более контрастное изображение. Нижняя собирательная линза фокусирует изображение, которое объектив строит в плоскости диафрагмы. На оправе окуляра имеются цифры – показатели его увеличения. Для лабораторных занятий чаще используют окуляры 10х и 15х, которые увеличивают изображение в 10 и 15 раз соответственно. Таким образом, общее увеличение микроскопа равно увеличению объектива, умноженному на увеличение окуляра. Например, 8 х 15 = 120; 40 х 15 = 600. Получается, при увеличении окуляра в 15 раз, используя объектив малого увеличения, объект в сумме увеличивается в 120 раз, а при использовании большого – в 600 раз. В целом изображение, которое получается с помощью микроскопа, оказывается дважды увеличенным и обратным (перевернутым) по отношению к изучаемому объекту. То, что получается мнимое изображение, особого значения не имеет, т. к. изображение все равно можно рассмотреть, зарисовать, измерить, сфотографировать. Некоторым неудобством является только то, что изображение оказывается обратным исходному объекту: его левая сторона будет справа, а верхняя – снизу, и наоборот. Это следует учитывать при интерпретации изображения. Для использования всех возможностей микроскопического метода важно иметь представление о разрешающей способности оптической системы микроскопа. Разрешающая способность микроскопа определяется минимальными расстояниями между двумя точками (или линиями), когда они не сливаются в одну. Чем меньше это расстояние, тем выше разрешающая способность. Причем качество изображения определяется разрешающей способностью объектива, т. к. окуляр, увеличивая изображение, не выявляет в нем новых деталей. Так, разрешающая способность объектива 8х приблизительно равна 1,5 мкм, а объектива 40х – 0,5 мкм. Оптическая и осветительная системы микроскопа строго отцентрированы. Механическая система состоит из основания микроскопа, тубусодержателя, механизмов грубой и тонкой наводки (фокусировки), винта конденсора, тубуса, револьвера (с объективами) и предметного столика. 9 Основание микроскопа (6) – это массивная площадка, на которой расположены все другие части микроскопа. У современных приборов она имеет прямоугольную форму и обеспечивает их устойчивость в процессе работы. (3) К основанию неподвижно прикреплен тубусодержатель прямоугольной формы. В его нижнюю часть вмонтирован механизм, который с помощью макрометрического винта (4) может перемещать тубусодержатель по вертикали на 50 мм. Он предназначен для грубой фокусировки, и его обычно используют при работе с объективом малого увеличения. В основании микроскопа находится механизм тонкой (точной) наводки. Микрометрический винт (5), с помощью которого осуществляется этот процесс, имеет форму диска. При полном обороте винта-диска тубусодержатель передвигается по вертикали на 100 мкм. Микровинт используют при работе с большим увеличением. При вращении каждого из этих винтов по часовой стрелке тубусодержатель опускается, а при вращении против часовой стрелки – поднимается. Механизмы макро- и особенно микрофокусировки изготовлены очень точно и поэтому требуют осторожного обращения. Вращать их следует плавно и осторожно, без рывков и применения силы, в противном случае они легко ломаются. К механической части микроскопа относят также винт конденсора, о котором уже шла речь ранее. Он расположен с правой стороны микроскопа под предметным столиком и обеспечивает перемещение конденсора вверх и вниз. В верхней части тубусодержателя находится головка с двумя гнездами: верхнее гнездо служит для укрепления тубуса, нижнее – револьвера. Тубус (2) представляет собой металлическую трубку, в верхнее отверстие которой вставляется окуляр, а нижнее закрепляется в гнезде тубусодержателя. Револьвер (10) – это специальное приспособление для смены объективов. Он имеет форму диска с несколькими гнездами, в которые ввинчиваются объективы. Поворотом револьвера можно заменить один объектив на другой. При этом о правильной установке объектива свидетельствует легкий щелчок. Сам же револьвер вставляется в нижнее гнездо тубусодержателя. Тубус и револьвер обеспечивают строго центрированное положение окуляра и объектива. Револьвер не следует самостоятельно вынимать из гнезда, так как при повторном его закреплении в гнезде можно нарушить отцентрованное положение объективов. Тубус с объективами перемещается по вертикали вместе с тубусодержателем, движение которого обеспечивается работой макро- и микрометрических механизмов. В результате этого производится грубая и тонкая фокусировка микроскопа. Важной составляющей механической системы микроскопа является предметный столик (9), на который помещают для изучения микропрепарат. 10 В центре столика имеется круглое отверстие, в которое может входить верхняя часть конденсора. В предметном столике есть еще два отверстия, которые используются, во-первых, для укрепления зажимов, удерживающих неподвижно предметное стекло с микропрепаратом, во-вторых, для установки препаратоводителя, который позволяет перемещать исследуемый объект в двух взаимоперпендикулярных направлениях: вправо-влево, вперед-назад. Предметное стекло с исследуемым объектом всегда помещают над центральным отверстием столика, чтобы его освещал пучок лучей света, идущий от зеркала через конденсор. 1.2. Правила работы со световым микроскопом «Биолам» Перед началом микроскопирования необходимо ознакомиться с правилами работы с микроскопом: 1. Микроскоп устанавливают на столе недалеко от края так, чтобы его окуляр, находился против левого плеча исследователя. Справа от микроскопа размещают все необходимое оборудование: предметные и покровные стекла, препаровальные иглы, лезвия, стеклянные палочки, капельницы с реактивами, кусочки фильтровальной бумаги, а также альбом или тетрадь для зарисовки препарата и необходимых записей. 2. Работать с микроскопом надо сидя прямо вплотную к столу. При этом высота стула или табурета должна быть такой, чтобы во время работы не испытывать напряжения. 3. В окуляр рекомендуется смотреть левым глазом, а правый при этом должен оставаться открытым. При длительном микроскопировании во избежание утомления, можно пользоваться по очереди обоими глазами, в каждом случае другой глаз остается открытым. 4. Перед началом работы объектив, окуляр и зеркало протирают кусочком мягкой хлопчатобумажной ткани (или бинтом). 5. В начале работы с микроскопом добиваются равномерного освещения поля зрения. Для этого производят такие операции: - путем вращения макрометрического винта устанавливают объектив малого увеличения на расстоянии не более 1 см от поверхности предметного столика; - полностью открывают ирисовую диафрагму; - поворачивают зеркало вогнутой стороной по направлению к источнику света; - глядя в окуляр, движением зеркала направляют лучи света так, чтобы получить равномерно освещенное поле зрение. Для освещения лучше всего использовать естественный рассеянный свет. В этом случае необходимо предварительно отодвинуть в сторону откидное кольцо со светофильтром, находящееся под конденсором. Прямые солнечные лучи в микроскопах не используются. Они ухудшают микроскопическое 11 изображение и вредят зрению. При работе с искусственным освещением удобнее использовать матовые лампы. В случае работы со специальными осветителями для более равномерного освещения препарата применяют светофильтр или вставляют в откидное кольцо матовое стекло. На протяжении всего занятия удобно поддерживать одинаковые условия освещения поля зрения, поэтому после его установки желательно не сдвигать микроскоп с места. В противном случае все операции надо повторять с начала. 6. Изучение препарата всегда начинают с малого увеличения. Для этого после освещения поля зрения на столик над центральным отверстием помещают предметное стекло с исследуемым объектом. Далее, глядя сбоку, чтобы не раздавить препарат, осторожным вращением макровинта от себя опускают объектив, устанавливая его на расстоянии в 3–4 мм от покровного стекла. Глядя в окуляр, плавно поднимают объектив вращением того же винта к себе для появления в поле зрения четкого изображения объекта. 7. Для перехода на большое увеличение надо найти участок объекта, который следует рассмотреть более подробно, и, перемещая препарат, расположить его в центре поля зрения. После этого производят смену объектива, для чего осторожно поворачивают револьвер до тех пор, пока объектив большого увеличения не займет место малого, на что укажет легкий щелчок. Смена увеличения не требует поднятия тубуса, поскольку длина оправ всех объективов рассчитана так, что при этом каждый из них сразу оказывается на нужном расстоянии от препарата. После замены объектива в микроскопе появляется изображение, часто не очень четкое. Неясное изображение фокусируют (доводят до четкости) с помощью микрометрического винта. Его осторожно вращают в ту или другую сторону не более чем на ½ или ¾ полного оборота, чтобы избежать поломки тонкого механизма. Резкость полученного изображения регулируют с помощью ирисовой диафрагмы. При большом увеличении полностью открытая диафрагма снижает контрастность изображения. 8. Полученное изображение объекта рассматривают и в соответствии с целью занятия и задачей исследования измеряют его структурные компоненты, описывают или зарисовывают их. 9. По окончании изучения объекта при большом увеличении вращением револьвера устанавливают объектив малого увеличения и только после этого убирают препарат с предметного столика. 10. После окончания работы протирают линзы, предметный столик, револьвер устанавливают на пустое гнездо, при помощи макровинта опускают тубус до упора вниз. Далее микроскоп переносят в шкаф или накрывают его чехлом. 12 1.3. Техника приготовления микропрепаратов Для изучения растительных объектов с помощью светового микроскопа необходимо приготовить микропрепарат. Микропрепараты, не предназначенные для длительного хранения, называются временными. Изучаемый объект помещают на предметное стекло в каплю воды, глицерина, раствора, реактива или красителя и накрывают покровным стеклом. Такие препараты можно хранить в течение нескольких дней, поместив во влажную атмосферу. Если объекты помещают в бальзам или глицерин с желатиной, препараты сохраняются годами и называются постоянными. Некоторые растения или их органы (водоросли, споры, пыльца и др.) можно рассматривать под микроскопом целиком, без предварительного изготовления срезов. Такие препараты называются тотальными. Однако число объектов, которые можно изучать на тотальных микропрепаратах невелико. Чаще приходится делать срезы органов, подлежащих изучению. Срезы изготавливают из свежих или фиксированных частей растений. Обычно для фиксации используют растворы спирта или формалина. Сделанные срезы должны быть очень тонкими и прозрачными. Различают следующие виды срезов: поперечный и продольный (радиальный, тангентальный, парадермальный). Поперечный срез проходит перпендикулярно оси органа и позволяет изучить строение органа в поперечном сечении. Продольный радиальный срез проходит по радиусу оси органа и дает возможность изучить строение органа в продольном сечении. Продольный тангентальный срез проходит перпендикулярно радиусу цилиндрической структуры, например, корня или стебля; в случае вторичных ксилемы и флоэмы проходит под прямым углом к сердцевинным лучам. Парадермальный срез (греч. пара + дерма – кожа) – сечение, параллельное поверхности плоской структуры, например, листа (срез эпидермы листа). При изготовлении временных микропрепаратов необходимо соблюдать следующую последовательность операций: 1. Вымыть и тщательно вытереть предметное и покровное стекла. Чтобы не сломать очень хрупкое покровное стекло, надо поместить его в складку салфетки между большим и указательным пальцами правой руки и осторожно вытереть его круговыми движениями пальцев. 2. Нанести на предметное стекло пипеткой каплю жидкости (воды, глицерина, раствора, реактива или красителя). 3. Сделать срез изучаемого органа при помощи лезвия. Лезвие должно быть очень острым. Зажать объект между большим и указательным пальцами 13 левой руки так, чтобы верхний конец кусочка органа оказался на уровне указательного пальца, а большой палец был несколько ниже. Лезвием или острым ножом выровнять верхнюю поверхность объекта. Лезвие смочить жидкостью, в которой хранился материал. Затем сделать тонкий срез, ведя лезвием к себе наискось (вправо) одним плавным и быстрым движением. При этом объект держать строго вертикально, а лезвие – строго горизонтально. Обе руки должны быть совершенно свободны. Не следует ими опираться на стол или прижимать к груди. Сделать сразу несколько срезов. Лезвие и объект все время смачивать. Не следует делать коротких, отрывистых (пилящих) движений, при которых получаются неровные и рваные срезы. 4. Для изготовления срезов с тонких нежных органов (листья, молодые корешки и т. п.), а также с мелких объектов, которые трудно удержать в руке, срезы делают поместив объект между кусочками из сердцевины бузины или пенопласта. 5. Выбрать самый тонкий срез, перенести его с помощью препаровальной иглы или тонкой кисточки в центр предметного стекла в каплю жидкости. 6. Накрыть срез покровным стеклом так, чтобы под него не попал воздух. Для этого покровное стекло взять двумя пальцами за грани и подвести под углом (примерно 45º) нижнюю грань к краю капли жидкости и плавно его опустить. Если жидкости много, и она вытекает из-под покровного стекла, удалить ее при помощи фильтровальной бумаги. Если же под покровным стеклом остались места, заполненные воздухом, то добавить жидкость, поместив ее каплю рядом с краем покровного стекла, а с противоположной стороны фильтровальную бумагу. Покровное стекло сверху должно оставаться совершенно сухим и плотно прилегать к предметному стеклу. Во избежание загрязнения следами жира никогда не следует пальцами касаться плоскости покровного стекла. При необходимости проведения микрохимической реакции для получения окрашивания определенных биологических структур клетки или элементов тканей растительный материал окрашивают различными красителями. Для приготовления постоянных микропрепаратов также необходимо соблюдать определенную последовательность операций. Выделяют следующие этапы: 1. Фиксация растительного материала – сохранение прижизненного состояния клеток и их структур. Для этого необходимо быстро умертвить ткани, что лучше всего достигается с небольшими кусочками живой ткани или органа. Используемое для этого вещество называют фиксатором. Чаще всего фиксатором выступает не одно какое-либо вещество, а смесь из нескольких веществ. Во время фиксации изучаемый объект помещают в раствор фиксатора на определенное время, которое зависит от цели исследования, размеров объекта, его плотности и оводненности. Следует помнить, что фиксатор должен быть свежим, приготовленным 14 непосредственно перед употреблением и его объем должен превышать в 40–100 раз объем фиксируемого объекта. Чаще всего применяют следующие фиксаторы: спирт-формол по Шафферу: 1 часть 40% формалина и 3 части 96% этанола. Продолжительность фиксации 24–48 часов, не требует дальнейшей промывки водой; фиксатор Корнуа: 6 частей 96% этанола, 3 части хлороформа, 1 часть ледяной уксусной кислоты. Продолжительность фиксации от 30 минут до 3 часов; уксусно-кислый алкоголь: 3 части 96% этанола и 1 часть ледяной уксусной кислоты. Продолжительность фиксации от 30 минут до 6 часов; фиксатор Навашина: 100 мл 1% хромовой кислоты, 4 мл 40% формалина, 1 мл ледяной уксусной кислоты. Продолжительность фиксации 12–24 часа, затем промывают в воде 24 часа. 2. Промывка и обезвоживание объектов – осуществляются для удаления остатков фиксаторов и удаления остатков воды из зафиксированного материала (чтобы материал не разрушался микроорганизмами и удачно прошли последующие этапы). После водного фиксатора материал промывают на марле под проточной водой около 1-х суток, в некоторых случаях это время может быть увеличено до 2-х суток. После этого материал быстро переносят в 20% этанол, затем в 40%, 60% и 80%. В каждом растворе выдерживают по 30 минут. После спиртового фиксатора материал промывают в 70% этаноле дважды и один раз в 80% этаноле по 1–2 часа. После промывки материала перед обезвоживанием с фиксированного материала делают анатомические срезы и при необходимости проводят микрохимические реакции. Окончательное удаление воды из зафиксированного материала проводят путем помещения его в четыре спирта: два раза в 96% и два раза в 100% этанол. В каждом растворе материал выдерживают не более 1 часа, а уже готовые срезы от 2–5 минут. Более длительное пребывание материала в 100% спирте придает ему хрупкость, что нежелательно. 3. Пропитывание промежуточной жидкостью и осветление препарата – проводят из-за того, что парафин и канадский бальзам не смешиваются со спиртом или водой, поэтому их постепенно заменяют промежуточной жидкостью (чаще всего ксилолом). Для этого готовят обычно три смеси ксилола с абсолютным спиртом: 1) 1:3, 2) 1:1 и 3) 3:1. Затем материал переносят в чистый ксилол. Материал выдерживают около 1 часа, а готовые срезы – до 10 минут. Такая процедура приводит также к тому, что материал становится прозрачным. 4. Заключение в парафин и канадский бальзам – необходимо для приготовления микротомных срезов, окончательной фиксации и длительного хранения препаратов. 15 Для получения тонких микротомных срезов материал необходимо залить в парафин. Вначале препарат пропитывают расплавленным парафином в термостате при температуре 56–57°С несколько суток, а затем уже материал заливают горячим парафином в специальных формах, которые затем охлаждают и получают парафиновые блоки. Далее с помощью микротома готовят срезы материала, заключенного в парафиновый блок. Эти срезы затем приклеивают к предметному стеклу путем высушивания в термостате при температуре около 40°С в течение 2–3 суток. Срезы пристают к стеклу вследствие капиллярного натяжения. После этого осуществляют освобождение срезов от парафина, помещая предметные стекла с наклеенными препаратами в ксилол, спирты убывающей концентрации (100%, 96%, 80%, 70%) и дистиллированную воду. Время нахождения в каждой среде – 2–3 минуты. Далее можно проводить окрашивание препаратов согласно методикам. После чего заново проводят обезвоживание и пропитывание ксилолом. Для длительного хранения препаратов их необходимо заключить в среду, предохраняющую препарат от окисления воздухом и от поражения микроорганизмами. Для этого пропитанные ксилолом срезы заключают в канадский бальзам (пихтовый бальзам), разведенный ксилолом до консистенции жидкого меда. На покровное стекло по центру наносят каплю или, если стекло длинное, две капли жидкого раствора канадского бальзама. Покровное стекло помещают каплей вниз и слегка прижимают. Пространство между предметным и покровным стеклом заполняется монтирующей средой, которая склеивает покровное и предметное стекла и консервирует объект. 1.4. Микрохимические (цито- и гистохимичесие) реакции С помощью микрохимических реакций, как правило, определяют некоторые части клетки, характер клеточной оболочки, ее химические изменения, состав клеточного сока, химический характер клеточных включений, а также наличие и локализацию вторичных продуктов обмена. Окрашивание проводят, используя стекла с лункой или часовые стекла, или непосредственно на предметном стекле. В лунку или на часовое стекло наливают необходимое количество реактива, помещают срез, стараясь его не подсушить, и выдерживают определенное время. После окрашивания краситель удаляют фильтровальной бумагой, срез промывают 2–3 раза водой, переносят на предметное стекло во включающую жидкость и накрывают покровным стеклом. В некоторых случаях окрашивание можно провести сразу на предметном стекле в капле красителя или после исследования объекта, не снимая покровного стекла. Для этого каплю красителя наносят рядом с краем покровного стекла, а с противоположной его стороны прикладывают полоску 16 фильтровальной бумаги. Бумага впитывает воду, а под стекло проникает краситель. Обнаружение клетчатки (целлюлозы). Чаще всего используют реакцию с реактивом хлор-цинк-йод (по Новопокровскому). Срез помещают в каплю воды, просушивают его фильтровальной бумагой, а затем капают на него реактивом и накрывают покровным стеклом. Хлор-цинк-йод окрашивает клетчатку в синий, фиолетовый или сине-фиолетовый цвет, а одревесневшие оболочки – в желтокоричневые тона. Обнаружение одревесневшей оболочки (лигнина). Наиболее характерной реакцией на лигнин является флороглюциновая реакция. Срез помещается в каплю дистиллированной воды, обсушивают фильтровальной бумагой и выдерживают в течение 1–2 минут в 2–3 каплях 1–5 % спиртового раствора флороглюцина, затем прибавляют 3–4 капли концентрированной соляной кислоты, выдерживают около 30–60 секунд, аккуратно удаляют остатки соляной кислоты фильтровальной бумагой, срез промывают 2–3 раза водой и накрывают покровным стеклом. В зависимости от толщины среза и степени одревеснения, содержащие лигнин оболочки приобретают вишневую, красно-фиолетовую окраску или другие оттенки красного цвета. Окраска не очень стойкая, поэтому препарат следует изучить в течение 10–15 минут. Обнаружение крахмала (крахмальных зерен). Крахмал рекомендуется наблюдать в воде или сильно разбавленном глицерине. Классической является йодная реакция – с реактивом Люголя. Срез или соскоб помещают в 2–3 капли реактива Люголя и накрывают покровным стеклом. При этом крахмальные зерна могут окрашиваться в цвет от голубого, слабо-фиолетового до интенсивного синего, почти черного. Иногда крахмальные зерна под действием йодсодержащих реактивов окрашиваются в красноватый цвет с оттенками от коричневого до фиолетового (за счет преобладания амилопектина в молекуле крахмала). Обнаружение инулина. Из растворов инулин осаждается этиловым спиртом, для этого нужно свежий растительный материал выдержать в 50–70 % этиловом спирте в течение нескольких недель, при этом в клетках выпадают хорошо сформированные округлые, обычно прилегающие к клеточной оболочке, сферокристаллы инулина. Они имеют лучисто-радиальное строение с концентрической слоистостью. Обнаружение запасных белков (алейроновых зерен). Самая простая и доступная реакция на алейроновые зерна – реакция с реактивом Люголя. Под его действием они окрашиваются в желтый цвет. В 17 богатых жирными маслами объектах для лучшего проявления реакции срезы рекомендуется смотреть не в воде, а в безводном глицерине. Обнаружение масел, смол, восков, опробковевших оболочек. Для выявления общих липидов, в том числе и жиров, чаще всего применяется реакция с раствором жирорастворимого красителя – Судан III. Срезы на 10 минут помещают в раствор красителя, после окрашивания заключают в глицерин. Жиры, масла, воск и свободные жирные кислоты под действием реактива окрашиваются в розовый, оранжевый, оранжево-красный цвет. Воска не растворимы в холодной воде, но при кипячении расплавляются и собираются в виде капель. Для обнаружения смол используют реакцию по Цалевскому. Срезы помещают в каплю насыщенного водного раствора оксалата меди и подогревают на водяной бане до 100ºС, при этом расплавляющаяся смола окрашивается в изумрудно-зеленый цвет. Под действием насыщенного раствора Судана III в 50 % спирте в течение 10–15 минут смолы в срезах, подкисленных азотной кислотой, окрашиваются в розовый цвет. 1.5. Измерение размеров клеток и их компонентов Для проведения измерений и подсчета необходимы: объект-микрометр, окуляр-микрометр и препаратоводитель на столике микроскопа. Объект-микрометр представляет собой металлическую или стеклянную пластинку в форме предметного стекла (рис. 1.2, а). Рис. 1.2. Приборы для измерений и подсчета микрообъектов под микроскопом: а – объект-микрометр; б – шкала объект-микрометра; в – линейный окулярмикрометр; г – сетчатый окуляр-микрометр 18 На этой пластинке обозначен круг, в центре которого имеется шкала. Длина всей шкалы составляет 1 мм. Она разделена на 100 частей (рис. 1.2, б). Интервалы между делениями обычно равны 0,01 мм, т. е. 10 микрометрам ‒ это цена одного деления объект-микрометра, которая обозначена в виде маркировки на объект-микрометре. Объект-микрометр нужен для определения цены деления окуляр-микрометра, для определения масштаба изображения на микрофотографиях и рисунках и для определения увеличения микроскопов со сложными оптическими системами. Окуляр-микрометр представляет собой тонкую круглую стеклянную (отдельную или вмонтированную в окуляр) пластинку, с нанесенной на ней линейной шкалой (рис. 1.2, в). Длина всей шкалы может равняться 5 мм. Она разделена на 50 частей, по 0,1 мм каждая, или же на 200 частей – по 0,05 мм каждая. Бывает шкала окуляр-микрометра длиной в 10 мм. Она разделена на 100 частей, по 0,1 мм каждая. Окуляр-микрометр вставляется между линзами окуляра. Такой окуляр-микрометр служит для линейных измерений. Для измерений плоскостей и для подсчета числа клеток в определенной площади используется сетчатый окуляр-микрометр. В нем на стеклянной пластинке нанесен квадрат. Длина сторон квадрата 10 мм. Каждая сторона квадрата разделена на 20 частей. В результате пересечения горизонтальных и вертикальных линий образуется сеточка, с интервалами между делениями 0,5 мм (рис. 1.2, г). Пределы измерения винтовым окуляр-микрометром – от 0 до 8 мм. Изображение объектов под микроскопом измеряется окуляр-микрометром в делениях его шкалы. Поворотом окуляра, в который вложен окулярмикрометр, и перемещением препаратоводителя на столике микроскопа, совмещают шкалу окуляр-микрометра с измеряемым объектом по направлению измерения. Определяют, сколько делений окуляр-микрометра приходится на длину (ширину) объекта. Для вычисления абсолютной величины объекта нужно определить цену деления окуляр-микрометра. Для этого на предметный столик микроскопа, вместо препарата помещают объект-микрометр, находят его шкалу и совмещают ее со шкалой окулярмикрометра. Определяют сколько делений окуляр-микрометра приходится на какое-то определенное число делений объект-микрометра. Рассчитывают цену деления окуляр-микрометра: L= (N × S) , где n L – цена деления окуляр-микрометра; N – число делений объект-микрометра; S – цена одного деления объект-микрометра (см. маркировку); n – число делений окуляр-микрометра, совпадающих с числом делений объект-микрометра. 19 Пример: 40 делений окуляр-микрометра точно совпадают с 9 делениями объект-микрометра. Цена деления объект-микрометра равна 0,01 мм (10 мкм). Рассчитаем цену одного деления окуляр-микрометра: L = (9 х 0,01 мм)/40 = 0,00225 мм = 2 мкм. Таким образом, цена деления окуляр-микрометра при данной комбинации окуляра и объектива равна двум мкм. Цена деления окулярмикрометра зависит от комбинации окуляра и объектива, а также от длины тубуса микроскопа. Поэтому она определяется для каждого сочетания окуляра и объектива, применяемого для измерения, и записывается. При работе на одном микроскопе можно один раз определить цену деления окуляр-микрометра при различных комбинациях окуляров и объективов и использовать полученные величины при последующих измерениях. Контрольные вопросы и задания 1. Назовите основные части светового микроскопа. 2. Какие элементы входят в состав механической и осветительной частей микроскопа, и каково их значение? 3. Назовите значение оптической части микроскопа и ее составляющих. 4. Каков порядок работы с микроскопом? 5. Назовите последовательность этапов приготовления временных препаратов. 20 2. РАСТИТЕЛЬНАЯ КЛЕТКА 2.1. Лабораторная работа № 1. «Устройство светового микроскопа и правила работы с ним. Методы анатомии растений. Общий план строения растительной клетки» Цель работы: ознакомиться с устройством и правилами работы со световым микроскопом, освоить методы приготовления временных микропрепаратов и проведения цитохимического окрашивания, рассмотреть общий план строения растительной клетки. Задание 1. Познакомиться (см. п. 1.1). Заполнить табл. 2.1. с устройством светового микроскопа Таблица 2.1. Устройство светового микроскопа Осветительная система Оптическая система Механическая система 1. 1. 1. 2 2. 2. 3. 3. 4. 4. 5. 6. Рассчитать увеличение микроскопа (см. п. 1.1), если: а) увеличение окуляра × 10, а объектива × 8; Ув. м.= б) увеличение окуляра × 7, а объектива ×40. Ув. м.= Теоретические сведения. Общий план строения растительной клетки Во взрослой полностью сформировавшейся растительной клетке различают три основные части: клеточную оболочку, протопласт (живое содержимое) и вакуоль. Сложная организация процессов жизнедеятельности возможна благодаря специализированным структурным элементам – органеллам, выполняющим различные функции. Это ядро, пластиды, митохондрии, эндоплазматический ретикулум, рибосомы, аппарат Гольджи и др. Клеточная оболочка, вакуоль и включения являются продуктами жизнедеятельности протопласта, и образуются им на определенных этапах развития клетки. Задание 2. Составить схему «Основные компоненты и органеллы растительной клетки» и указать органеллы, характерные только для растительной клетки. 21 Растительная клетка Протопласт Продукты жизнедеятельности протопласта Задание 3. Освоить технику приготовления временных микропрепаратов (см. п. 1.3). Приготовить микропрепарат эпидермиса сочной чешуи лука (Allium cepa). Последовательность работы. Кусочек наружного эпидермиса сочной чешуи лука репчатого размером примерно 1.5 × 2 см поддеть препаровальной иглой и поместить на предметное стекло в каплю воды, накрыть покровным стеклом. На препарате найти участок, где клетки располагаются монослоем и хорошо видны. Препарат рассмотреть при малом (х8) и большом (х40) увеличениях микроскопа. Обратить внимание на то, что цитоплазма прижата к клеточным стенкам. В слое цитоплазмы располагается ядро, в котором при большом увеличении хорошо заметно 1 или 2 ядрышка. Зарисовать микропрепарат эпидермиса сочной чешуи репчатого лука при малом (х 8 –А) и большом (х 40 – Б) увеличении и сделать обозначения. А Б Рис. 2.1. Микропрепарат эпидермиса сочной чешуи лука (Allium cepa) (А – увеличение объектива х 8; Б – увеличение объектива х 40): 1 – клеточная оболочка; 2 – цитоплазма; 3 – ядро; 4 – ядрышко; 5 – вакуоль Задание 4. Провести окрашивание микропрепарата реактивом Люголя. Последовательность работы. Окрашивание можно провести сразу на предметном стекле, не снимая покровного стекла. Для этого каплю реактива Люголя наносят рядом с краем покровного стекла, а с противоположной его стороны прикладывают полоску фильтровальной бумаги. Бумага впитывает воду, а под стекло проникает краситель. 22 Описать, какие изменения наблюдаются в результате окрашивания. Задание 5. Заполнить табл. 2.2 (см. п. 1.4). Таблица 2.2. Цитохимические реакции в растительных тканях. Краситель Окрашиваемое вещество Анатомические структуры Цвет 1. 2. 3. 4. 5. Глоссарий Апопласт – ____________________________________________________________________________ _______________________________________________________________________________________ Клеточная оболочка – __________________________________________________________________ _______________________________________________________________________________________ Плазмодесмы – ________________________________________________________________________ Протопласт – __________________________________________________________________________ Симпласт – ___________________________________________________________________________ _______________________________________________________________________________________ 23 Контрольные вопросы и задания: 1. Назовите основные характерные особенности растительной клетки. 2. Какие органеллы характерны только для растительных клеток и с чем это связано? 3. Опишите последовательность проведения цитохимических реакций (окрашивания) временных микропрепаратов на предметном стекле. 4. Какие красители используют при окраске растительных объектов? 5. В чем заключается различие понятий «цитоплазма» и «протопласт»? 2.2. Лабораторная работа № 2. «Движение цитоплазмы. Пластидная система, клеточная стенка и ее видоизменения» Цель работы: ознакомиться с пластидной системой, рассмотреть хлоропласты, хромопласты, лейкопласты; изучить движение цитоплазмы (циклозис) в растительных клетках; ознакомиться с видоизменениями клеточной стенки. Теоретические сведения. Пластидная система Характерным признаком, отличающим клетки растений от клеток животных, является наличие пластидной системы. Пластиды – это органеллы протопласта, характерные только для растительных клеток. Они выполняют различные функции, связанные, главным образом, с синтезом органических веществ в процессе фотосинтеза. В зависимости от окраски, обусловленной наличием пигментов, различают три основных типа пластид: хлоропласты (зеленые), хромопласты (имеют желтую, оранжевую или красную окраску) и лейкопласты (бесцветные). Задание 1. Приготовить временный микропрепарат листа элодеи (Elodea canadensis) или валлиснерии (Vallisneria spiralis) в капле воды. Рассмотреть хлоропласты в клетках листа. Обратить внимание на их форму, размеры и количество (рис. 2.2). Рис. 2.2. Хлоропласты в клетках листа элодеи (Elodea canadensis) или валлиснерии (Vallisneria spiralis) в капле воды: 1 – клетки листа, 2 – клеточная стенка, 3 – хлоропласты, 4 – цитоплазма 24 Последовательность работы. Приготовить временный микропрепарат листа водного растения. Найти тонкий участок на листе (обычно около центральной жилки или по краям листа), где клетки хорошо видны. При малом увеличении найти хлоропласты, которые в большом количестве содержатся во всех клетках листа. При большом увеличении микроскопа рассмотреть хлоропласты, имеющие форму мелких овальных зеленых телец. Обратить внимание на их количество в клетке. Зарисовать хлоропласты в клетках листа элодеи или валлиснерии (при увеличении × 40). Сделать обозначения: 1 – клеточная стенка, 2 – хлоропласты, 3 – цитоплазма, 4 – ядро (если видно). Рис. 2.3. Хлоропласты в клетках листа ________________ Задание 2. Приготовить и рассмотреть микропрепараты из мякоти зрелых плодов рябины обыкновенной (Sorbus aucuparia), шиповника собачьего (Rosa canina), томата (Lycopersicon esculentum), перца болгарского (Capsicum annuum) в каплях воды (рис. 2.4). Рис. 2.4. Хромопласты в паренхимных клетках мякоти зрелых плодов: А – шиповник (Rosa canina); Б – томат (Lycopersicon esculentum); В – рябина (Sorbus aucuparia); Г – перец болгарский (Capsicum annuum): 1 – хромопласты; 2 – ядро; 3 – клеточная оболочка Последовательность работы. Приготовить 2 препарата из предложенных объектов. Для этого извлечь небольшой кусочек мякоти из зрелого плода, поместить его в центр предметного стекла в каплю воды, осторожно измельчить, разрыхлить с помощью лезвия или препаровальной иглы и 25 накрыть покровным стеклом. При малом увеличении найти участок со свободно лежащими клетками, при большом увеличении исследовать их. Клетки имеют округлую форму. Стенки их очень тонкие. Внутри клеток хорошо видны скопления хромопластов. В плодах рябины хромопласты имеют вытянутую, заостренную, слегка изогнутую форму, в клетках плодов шиповника – овальную, в клетках плода томата более или менее шаровидную, в клетках плодов перца – пластинчатую или веретеновидную форму. Зарисовать хромопласты в клетках мякоти 2-х объектов, которые были выбраны для изучения. Сделать обозначения. Рис. 2.5. Хромопласты в паренхимных клетках _____________________ 1 – клеточная оболочка; 2 – ядро; 3 – хромопласты Задание 3. Приготовить микропрепарат мякоти зрелого плода снежноягодника (Symphoricarpos albus) (рис. 2.6). Найти и рассмотреть лейкоплаты, провести их окрашивание реактивом Люголя, сделать рисунок. Рис. 2.6. Лейкопласты в клетках мякоти зрелых плодов снежноягодника (Symphoricarpos albus): 1 – ядро; 2 – лейкопласты; 3 – цитоплазматические тяжи Последовательность работы. Для приготовления препарата извлечь небольшой кусочек мякоти из зрелого плода, поместить его в центр предметного стекла в каплю воды, осторожно разрыхлить и накрыть покровным стеклом. При малом увеличении найти участок со свободно лежащими клетками и при большом увеличении рассмотреть их. Клетки имеют округлую форму. Стенки их очень тонкие. Обратить внимание на крупное ядро, расположенное в центре клетки, вокруг которого цитоплазмой образован ядерный кармашек, соединенный с ее пристенным слоем тонкими 26 тяжами. Рассмотреть лейкопласты (мелкие шаровидные тельца, сильно преломляющие свет), расположенные в ядерном кармашке и в тяжах цитоплазмы. Провести окрашивание реактивом Люголя, при этом лейкопласты окрашиваются в желтый цвет. Зарисовать клетки мякоти зрелых плодов снежноягодника. Сделать обозначения: 1 – ядро; 2 – лейкопласты; 3 – цитоплазматические тяжи (если видны); 4 – клеточная оболочка Рис. 2.7. Клетки мякоти зрелых плодов снежноягодника Заполнить табл. 2.3. Таблица 2.3. Полифункциональность пластидной системы Название пластид Функции 1. Пропластиды 2. Хлоропласты 3. Хромопласты 4. Лейкопласты: а) амилопласты б) протеинопласты в) олеопласты 27 5. Этиопласты Нарисуйте схему «Взаимные превращения пластид» (укажите все виды пластид и условия, при которых возможны превращения). Теоретические сведения. Движение цитоплазмы Одним из важнейших свойств цитоплазмы живой клетки является ее способность к движению. Движение цитоплазмы (циклозис) играет важную роль в осуществлении обмена и распределении веществ внутри клетки, а также характеризует уровень ее жизнедеятельности. О движении цитоплазмы можно судить по перемещению органелл в крупных клетках с большими вакуолями. В осуществлении движения цитоплазмы принимают участие элементы цитоскелета – микрофиламенты. Источником энергии для движения служит АТФ. Различают виды движения цитоплазмы : спонтанное, постоянное и индуцированное внешними факторами (изменением освещенности, температуры, химическими веществами, механическими воздействиями и т. п.). Основными типами движения цитоплазмы являются круговое (вращательное или ротационное), струйчатое и колебательное. Задание 4. Пронаблюдать и зарисовать круговое движение цитоплазмы по перемещению хлоропластов в листе валлиснерии (Vallisneria spiralis) или элодеи (Elodea canadensis). Последовательность работы. Оторвать лист элодеи или отрезать часть листа валлиснерии и положить его в каплю воды. Объект накрыть покровным стеклом и рассмотреть сначала при малом, а затем при большом увеличении. Обрывание листа вызывает в его клетках движение цитоплазмы, которое легко наблюдать по перемещению хлоропластов в одном направлении вдоль клеточной стенки (круговое движение). Наиболее интенсивное движение можно увидеть в длинных узких клетках средней жилки листа. 28 Зарисовать круговое движение цитоплазмы в клетках листа валлиснерии (или элодеи). Сделать обозначения. Направление движения цитоплазмы показать стрелками. 1 – клеточная оболочка; 2 – пристенный слой цитоплазмы; 3 – пластиды в разном положении Рис. 2.8. Циклозис в клетках листа элодеи Ответьте на вопрос: «В чем отличие вращательного (ротационного) движения цитоплазмы от струйчатого?» Теоретические сведения. Клеточная оболочка и ее видоизменения Клеточная оболочка является продуктом жизнедеятельности протопласта, так как образуется в результате его функционирования. В ее биосинтезе принимает участие Аппарат Гольджи, где синтезируются компоненты матрикса клеточной стенки и целюллозосинтазный ферментативный комплекс, который непосредственно встроен в плазмолемму. Клеточная оболочка в значительной степени определяет форму клеток и текстуру растительных тканей. Она выполняет опорную и защитную функции. Ей принадлежит важная роль в таких процессах жизнедеятельности, как поглощение, передвижение веществ, транспирация и выделение секретируемых веществ. В растительной оболочке различают три части: Срединная пластинка (межклетное вещество) находится между первичными оболочками двух смежных клеток и состоит, главным образом, из пектиновых веществ. Первичная оболочка – это первая собственная оболочка, образующаяся в развивающейся клетке, которая у многих типов клеток остается и единственной на протяжении всей жизни. В ней содержится целлюлоза, гемицеллюлозы и пектины. 29 Вторичная оболочка накладывается на первичную изнутри, т. е. со стороны протопласта. Она состоит, в основном, из целлюлозы, лигнина, суберина и других веществ. Клетки, имеющие вторичные оболочки, в зрелом состоянии часто лишены протопласта. Многие клетки сохраняют целлюлозные оболочки до конца своей жизни. Однако очень часто, в процессе развития клетки, в ее оболочке происходят различные физико-химические видоизменения в результате отложения новых слоев из другого вещества. За счет этого возможны следующие видоизменения клеточной оболочки: одревеснение (лигнификация), опробковение (суберинизация), кутинизация, ослизнение, минерализания. Задание 5. Заполните табл.2.4 Таблица 2.4. Видоизменения клеточной оболочки Название видоизменения 1. Вещество и его свойства Пример тканей Живая или мертвая клетка 2. 3. 4. 5. Задание 6 (дополнительное). Провести качественную реакцию на присутствие лигнина в оболочках клеток. Микропрепарат мякоти плодов груши рассмотреть при малом и большом увеличениях микроскопа. Зарисовать каменистые клетки. 30 Последовательность работы. Приготовить временный микропрепарат мякоти плода груши обыкновенной (Pyrus communis), окрасив его флороглюцином в соляной кислоте. Срез (или соскоб) сделать лучше с твердых участков, под кожицей или ближе к середине плода. При малом увеличении рассмотреть препарат. Среди бесцветных паренхимных клеток, найти разбросанные группы мелких клеток с оболочками, окрашенными в малиновый или розовый цвет. Тонкостенные удлиненные клетки мякоти плода расходятся от них как лучи. Выбрать группу клеток с окрашенными стенками (склереиды) и рассмотреть ее при большом увеличении. В толстой стенке клетки видна слоистость, а также узкие, часто разветвленные поровые каналы. При рассмотрении наружной поверхности клетки видны поры в виде кружочков. Живое содержимое в полостях клеток не сохраняется. Зарисовать каменистые клетки в мякоти плода груши обыкновенной (Pyrus communis). Сделать обозначения. 1 – паренхимные клетки мякоти плода; 2 – каменистые клетки; 3 – оболочка клетки; 4 – полость клетки; 5 – ветвистые поры Рис. 2.9. Каменистые клетки (брахисклереиды) в мякоти плода груши обыкновенной (Pyrus communis) Глоссарий Поры - ________________________________________________________________________________ Пропластиды - ________________________________________________________________________ Срединная пластинка - _________________________________________________________________ _______________________________________________________________________________________ Циклозис - ____________________________________________________________________________ Этиопласты - __________________________________________________________________________ Контрольные вопросы 1. Назвать основные типы пластид. Какое они имеют строение? 2. В каких органах растений чаще всего можно встретить хромопласты? 3. Какие пигменты содержатся в хлоропластах и хромопластах? 4. Какие функции выполняют лейкопласты? 5. С чем связано движение цитоплазмы? Может ли оно происходить в мертвых клетках? 31 2.3. Лабораторная работа № 3. «Вакуоль. Явление плазмолиза и деплазмолиза. Кристаллические включения» Цель работы: изучить осмотические свойства растительной клетки на примере плазмолиза и деплазмолиза; рассмотреть кристаллические включения. Теоретические сведения. Осмотические свойства растительной клетки В поглощении и выделении веществ растительной клеткой большую роль играют процессы диффузии и осмоса. Осмотическими называют явления, происходящие в системе, состоящей из двух растворов разной концентрации, разделенных полупроницаемой мембраной. В растительной клетке роль полупроницаемых мембран выполняют плазмалемма и тонопласт. Плазмалемма – наружная мембрана цитоплазмы, прилегающая к клеточной оболочке. Тонопласт – внутренняя мембрана цитоплазмы, окружающая вакуоль. Центральная вакуоль растительной клетки представляет собой полость в цитоплазме, заполненную клеточным соком – водным раствором различных веществ: углеводов, органических кислот, солей, гидрофильных белков, пигментов и др. Концентрация веществ в клеточном соке и во внешней среде (в почве, водоемах) обычно не одинакова. Чем больше концентрация содержащихся в клеточном соке веществ, тем сильнее сосущая сила – сила, с которой клетка поглощает воду. При увеличении объема клеточного сока, вследствие поступления в клетку воды, увеличивается его давление на цитоплазму, плотно прилегающую к оболочке. Состояние внутреннего напряжения клетки, обусловленное высоким содержанием воды и развивающимся давлением содержимого клетки на ее оболочку носит название тургора (рис. 2.10, А). Если клетка находится в гипертоническом растворе, концентрация которого больше концентрации клеточного сока, то вода из клеточного сока будет диффундировать в окружающий раствор. Вследствие выхода воды из клетки объем клеточного сока сокращается, тургор уменьшается. Уменьшение объема клеточной вакуоли сопровождается отделением цитоплазмы от оболочки – происходит плазмолиз. В ходе плазмолиза форма протопласта меняется. Вначале протопласт отстает от клеточной стенки лишь в отдельных местах, чаще всего в уголках. Плазмолиз такой формы называют уголковым (рис. 2.10, Б). Затем протопласт продолжает отставать от клеточных стенок, сохраняя связь с ними в отдельных местах, поверхность протопласта между этими точками имеет вогнутую форму. На этом этапе плазмолиз называют вогнутым (рис. 2.10, В). Постепенно протопласт отрывается от клеточных стенок по всей поверхности и принимает округлую форму. Это выпуклый плазмолиз (рис. 2.10, Г). Если у протопласта связь с клеточной стенкой в отдельных местах сохраняется, то 32 при дальнейшем уменьшении объема в ходе плазмолиза протопласт приобретает неправильную форму. Протопласт остается связанным с оболочкой многочисленными нитями Гехта. Такой плазмолиз называется судорожным (рис. 2.10, Д). При длительном нахождении клеток в растворе нитрата калия (15 мин и более) цитоплазма набухает и в клетках образуются так называемые колпачки цитоплазмы – колпачковый плазмолиз (рис. 2.10, Е). Если плазмолизированную клетку поместить в гипотонический раствор, концентрация которого меньше концентрации клеточного сока, вода из окружающего раствора будет диффундировать внутрь вакуоли. В результате увеличения объема вакуоли повысится давление клеточного сока на цитоплазму, которая начинает приближаться к стенкам клетки, пока не примет первоначальное положение – произойдет деплазмолиз. Рис. 2.10. Плазмолиз в растительной клетке (А – клетка в состоянии тургора; Б – уголковый; В – вогнутый; Г – выпуклый; Д – судорожный; Е – колпачковый): 1 – клеточная оболочка; 2 – вакуоль; 3 – цитоплазма; 4 – ядро; 5 – нити Гехта. Задание 1. Пронаблюдать явление плазмолиза в клетках эпидермиса сочной чешуи лука репчатого (Allium cepa). Сделать соответствующие рисунки. Последовательность работы. Отделить кусочек наружного эпидермиса с сочной чешуи лука репчатого и положить его на предметное стекло в каплю 6–8% раствора NaCl, накрыть его покровным стеклом. Через 2–3 минуты начать наблюдение, отмечая последовательные стадии плазмолиза. Зарисовать формы плазмолиза в клетках эпидермы сочной чешуи лука репчатого. Сделать обозначения. А Б В Рис. 2.11. Формы плазмолиза в клетках эпидермы сочной чешуи лука репчатого (А – уголковый, Б – вогнутый, В – выпуклый): 1 – клеточная стенка; 2 – протопласт. 33 Задание 2. Пронаблюдать явление деплазмолиза в клетках эпидермиса сочной чешуи лука репчатого (Allium cepa). Последовательность работы. Следует заменить раствор соли на воду, оттянув раствор фильтровальной бумагой (с одной стороны покровного стекла кладется бумага, с другой из капельницы наносится вода). Пронаблюдать постепенное возвращение цитоплазмы к клеточной стенке. Ответить на вопрос: почему при помещении растительной клетки в раствор соли наблюдается явление плазмолиза, при помещении плазмолизированной клетки в воду присходит деплазмолиз? Теоретические сведения. Кристаллические включения Растения, не имеющие развитых органов выделения, вынуждены накапливать различные вещества в тканях. Избыточное накопление веществ, выключаемых из обмена, часто приводит к выпадению их в осадок в аморфном виде или в форме кристаллов, носящих название включений. Кристаллы, содержащиеся в растениях, чаще всего состоят из оксалата кальция и имеют разную форму (рис. 2.12). Рис. 2.12. Кристаллы щавелевокислого кальция в клетках: А – одиночные и крестообразные в клетках сухой чешуи луковицы лука (Allium cepa); Б – одиночный кристалл и друза (черешок щавеля – Rumex crispus); В – пучок рафид в клетке корневища купены (Polygonatum officinale); Г – стилоид в листе эйхгорнии (Eichhornia crassipes); Д – кристаллический песок (картофель – Solanum tuberosum) Друзы – шаровидные образования, состоящие из многих мелких сросшихся кристаллов (в клетках корневищ, коры, корки, черешков и эпидермы многих растений). Рафиды – игольчатые кристаллы, соединенные в 34 пучки (в корневищах купены, стебле винограда). Кристаллический песок – скопление множества мелких одиночных кристаллов (в чешуе лука, стебле бузины). Как правило, друзы встречаются у двудольных растений, а рафиды – у однодольных. Встречаются одиночные кристаллы более простых и сложных форм. Кристаллы, имеющие форму сильно вытянутых призм, называют стилоидами. Стилоиды находятся в клетках по одному. Обычно они покрыты очень тонкой оболочкой. К кристаллическим включениям очень близки цистолиты (греч. китос – пузырь, или мешок, литос - камень). Они чаще всего состоят из карбоната кальция или кремнезема и представляют собой гроздевидные образования внутри клеток, возникшие на выступах клеточной оболочки (рис. 2.16). Рис. 2.16. Цистолит (1) в эпидерме листа фикуса (Ficus elastica) Задание 3. Приготовить временный микропрепарат сухой чешуи лука (Allium cepa) в капле глицерина. Рассмотреть и зарисовать клетки с кристаллами. Последовательность работы. Отрезать лезвием небольшой тонкий кусочек чешуи и поместить в каплю глицерина на предметное стекло, накрыть его покровным стеклом. При малом увеличении найти клетки с одиночными палочковидными и крестообразными кристаллами. Рассмотреть их при большом увеличении. Зарисовать клетки сухой чешуи лука репчатого с кристаллами. Сделать обозначения: 1 – клеточная стенка; 2 – одиночный кристалл; 3 – крестообразный кристалл; 4 – т-образный кристалл (если видно) Рис. 2.13. Одиночные кристаллы в клетках сухой чешуи лука репчатого 35 Задание 4. Приготовить временный микропрепарат продольного среза корневища купены лекарственной (Polygonatum officinale), рассмотреть и зарисовать клетки с рафидами. Последовательность работы. Сделать продольный срез и поместить его в каплю воды на предметное стекло, покрыть срез покровным стеклом. Найти клетки, содержащие рафиды. Они обычно вытянутые и крупнее, чем окружающие их соседние паренхимные клетки. Рассмотреть в клетках игольчатые кристаллы, лежащие группами параллельно друг к другу. Зарисовать пучок рафид в клетке корневища купены. Сделать обозначения: 1 – рафидоносная клетка; 2 – паренхимные клетки; 3 – пачка рафид; 4 – отдельные рафиды Рис. 2.14. Рафиды в клетке корневища купены Задание 5. Рассмотреть и зарисовать друзы на поперечном срезе черешка щавеля (Rumex crispus). Последовательность работы. Сделать тонкий поперечный срез черешка щавеля в капле воды. При малом увеличении микроскопа найти тонкостенные паренхимные клетки. В клеточном соке многих клеток встречаются отложения оксалата кальция либо в виде одиночных кристаллов – ромбоидров, либо в виде сростков многочисленных мелких кристаллов – друз. В некоторых клетках могут встретиться переходные формы, у которых на поверхности крупных одиночных кристаллов видны спаянные с ними более мелкие кристаллы. Найти клетки с разными по форме кристаллами (ромбоидры, друзы, переходные формы). Зарисовать друзы в клетках черешка щавеля. Сделать обозначения: 1 – клетка с друзой; 2 – паренхимные клетки; 3 – друза Рис. 2.15. Друзы в клетках черешка щавеля Ответить на вопрос: Какой биологический смысл кристаллов щавелевокислого кальция в клетках растений? 36 образования Задание 6 (дополнительное). Приготовить временный микропрепарат поперечного среза листа фикуса (Ficus elastica). Найти и зарисовать цистолит. Последовательность работы. Сделать тонкий поперечный срез листа фикуса, поместить в каплю воды. Найти клетки верхней эпидермы. Под ними располагается два слоя бесцветных клеток, называемые гиподермой. В некоторых клетках гиподермы, граничащих с мезофиллом, встречаются гроздевидные образования – цистолиты. Зарисовать цистолит в клетках эпидермы листа фикуса и обозначить: 1 – клетки эпидермы, 2 – цистолит Рис. 2.17. Цистолит в клетках эпидермиса листа фикуса Глоссарий Тургор – _______________________________________________________________________________ _______________________________________________________________________________________ Плазмолиз – ___________________________________________________________________________ _______________________________________________________________________________________ Цистолит – ____________________________________________________________________________ _______________________________________________________________________________________ Друза – _______________________________________________________________________________ Рафида – ______________________________________________________________________________ Контрольные вопросы 1. Объясните явление тургора, плазмолиза и деплазмолиза? 2. Может ли происходить плазмолиз в мертвой клетке? 3. Дать определения понятиям осмос, диффузия и сосущая сила. 4. Какие вещества входят в состав клеточного сока? 5. Что представляют собой включения и цистолиты? 37 2.4. Лабораторная работа № 4. «Запасные вещества растительных клеток» Цель работы: ознакомиться с основными запасными веществами в растительных клетках; рассмотреть различные формы запасания органических веществ: крахмальные зерна, алейроновые зерна, сферокристаллы; провести цитохимические реакции на крахмал, белок и растительные масла. Теоретические сведения. Запасные вещества: крахмальные зерна Вещества живого содержимого растительной клетки - протопласта и продукты его жизнедеятельности очень разнообразны. Условно их объединяют в две группы: 1) конституционные, входящие в состав живой материи, и участвующие в обмене веществ (белки, нуклеиновые кислоты, липиды, углеводы и др.); 2) эргастические включения – это компоненты протопласта, играющие вспомогательную роль в его жизни и являющиеся либо источниками материи и энергии при росте и работе клетки, либо побочными продуктами ее метаболизма. Крахмал образуется в хлоропластах во время фотосинтеза – ассимиляционный или первичный крахмал. Позже он расщепляется, транспортируется в запасающие органы, где вновь синтезируется как запасной или вторичный крахмал в амилопластах. Крахмальные зерна имеют разную форму (рис. 2.18) и образуют слоистость вокруг одной точки, называемой образовательным центром. Рис. 2.18. Крахмальные зерна различных видов растений: А – картофель (Solanum tuberosum); Б – пшеница (Triticum aestivum); В – овес (Avena sativa); Г – рис (Oryza sativa); Д – кукуруза (Zea mays); Е – гречиха (Fagopyrum sagittatum); 1 – простое крахмальное зерно, 2 – сложное, 3 – полусложное 38 Расположение слоев может быть концентрическим, например, у злаков и бобовых, и эксцентрическим, например, у картофеля. В последнем случае, точка, вокруг которой откладываются слои, находится не в центре зерна, а сдвинута вбок. Амилопласт может содержать одно (простое зерно) или несколько крахмальных зерен (полусложное и сложное). Если в лейкопласте имеется одна точка, вокруг которой откладываются слои, то образуется простое зерно, если две и более, то образуется сложное зерно, состоящее как бы из нескольких простых. Полусложное зерно образуется в том случае, если крахмал сначала откладывается вокруг нескольких точек, а затем после соприкосновения простых зерен вокруг них возникают общие слои. Особенности строение крахмальных зерен могут служить систематическим признаком. Задание 1. Приготовить, рассмотреть и зарисовать временный микропрепарат крахмальных зерен клубня картофеля (Solanum tuberosum). Последовательность работы. Отрезать маленький кусочек клубня картофеля и сделать им мазок на предметном стекле в капле воды. Каплю накрыть покровным стеклом и рассмотреть при малом и большом увеличении. При большом увеличении хорошо видны овальные и яйцевидные зерна крахмала. При рассмотрении слоистости следует прикрыть диафрагму конденсора и слегка вращать микровинт. Зарисовать простые (А), сложные (Б) и полусложные (В) крахмальные зерна клубня картофеля. Сделать обозначения. Подписать тип слоистости. А Б В Рис. 2.19. Крахмальные зерна клубня картофеля: простое (А), сложное (Б) и полусложное (В), 1 – образовательный центр, 2 – слои крахмала После рассмотрения и зарисовки крахмальных зерен, провести качественную реакцию на крахмал, используя реактив Люголя. Ответить на вопрос: Почему крахмальные зерна образуют слоистость? 39 Теоретические сведения. Сферокристаллы инулина В клубнях георгина, земляной груши, корнях одуванчика и других растений семейства сложноцветных клеточный сок содержит углевод инулин. При действии спирта инулин кристаллизуется, образует так называемые сферокристаллы (рис. 2.20). Рис. 2.20. Сферокристаллы инулина (1) в клетках клубня георгина (Dahlia Variabilis) Задание 2. Рассмотреть сферокристаллы полисахарида инулина на срезе клубня георгина (Dahlia Variabilis). Последовательность работы. Приготовить временный микропрепарат поперечного среза клубня георгина в капле глицерина (в воде сферокристаллы быстро растворяются). Сферокристаллы состоят из множества игловидных кристаллов. Они быстро разрастаются, захватывая несколько клеток. Стенки этих клеток видны в сферокристалле при работе с микровинтом. Зарисовать сферокристаллы полисахарида инулина на срезе клубня георгина. Сделать обозначения: 1 – паренхимные клетки, 2 – сферокристаллы инулина Рис. 2.21. Сферокристаллы инулина в клубне георгина Теоретические сведения. Алейроновые зерна Запасные белки наиболее часто откладываются в виде зерен округлой или овальной формы, называемых алейроновыми. Это простые белки – протеины. Они откладываются в вакуолях или лейкопластах. Большое количество белков находится в клетках, расположенных под семенной кожурой, в так называемом алейроновом слое. Эти клетки содержат большое количество очень 40 мелких простых алейроновых зерен, представленных аморфной белковой массой (рис. 2.22, А). Сложные алейроновые зерна крупнее и кроме аморфного белка, могут содержать еще кристаллический белок (кристаллоид), глобоиды (фитин, в состав которого входят инозит, фосфор, кальций и магний) и кристаллы оксалата кальция (рис. 2.22, Б). Рис. 2.22. Алейроновые зерна: А – простые зерна в алейроновом слое зерновки пшеницы (Triticum aestivum), Б – сложные алейроновые зерна в клетках семядолей клещевины (Ricinus); 1 – аморфный белок простого зерна, 2 – аморфный белок сложного зерна, 3 – кристаллоид, 4 – глобоид Теоретические сведения. Растительные масла Липиды являются структурными компонентами клетки (входят в состав мембран, образуют липидные капли в цитоплазме) или эргастическими веществами. Запасные масла обычно откладываются в виде мельчайших капелек в цитоплазме, лейкопластах, называемых олеопластами, и сферосомах. Наиболее богаты маслами клетки семян, плодов, сердцевины и коры стеблей, корневища. Задание 3. Рассмотреть крахмальные и алейроновые зерна в клетках семени фасоли (Phaseolus vulgaris) и зарисовать их. Последовательность работы. Приготовить временный микропрепарат поперечного среза семени фасоли в смеси воды и реактива Люголя. Найти при малом увеличении тонкий участок среза. При большом увеличении видно, что семядоля фасоли состоит из крупных паренхимных клеток с небольшими межклетниками. Внутри клеток хорошо заметны большие овальные синие крахмальные зерна и между ними – золотисто-желтые простые алейроновые зерна. Крахмальные зерна фасоли заметно отличаются от зерен картофеля очертаниями, слоями равномерной толщины и наличием трещин на месте образовательного центра. 41 Зарисовать запасные вещества в клетке семени фасоли, отметить: 1 – клеточная оболочка, 2 – крахмальные зерна, 3 – алейроновые зерна Рис. 2.23. Крахмальные и алейроновые зерна в семени фасоли Ответить на вопрос: Почему реактив Люголя окрашивает препарат семени фасоли разными цветами (желтым и синим)? Задание 4. Рассмотреть и зарисовать сложные алейроновые зерна и липидные капли в клетках семени клещевины (Ricinus), окрашенных реактивом судан-III. Последовательность работы. Приготовить временный препарат из семени клещевины (Ricinus), окрасив его реактивом судан-III. Передвигая препарат, найти наиболее тонкое место и рассмотреть содержимое клеток. В мелкозернистое содержимое клеток вкраплены округлые или овальные алейроновые зерна. В каждом зерне различимы тонкая оболочка в виде однородной тонкой плёночки, одно или несколько шарообразных телец (глобоидов) и кристаллик – один, реже несколько (кристаллоид). Зарисовать сложные алейроновые зерна в семенах клещевины, обозначив: 1 – сложное алейроновое зерно; 2 – аморфный белок; 3 – глобоид; 4 – кристаллоид; 5 – капли масла. Рис. 2.24. Сложные алейроновые зерна в семенах клещевины Ответить на вопрос «В чем преимущество жирных масел как запасных веществ в растительных клетках по сравнению с крахмалом и белком?» 42 Задание 5 (дополнительное). Приготовить и рассмотреть временные микропрепараты крахмальных зерен овса (Avena sativa), кукурузы (Zea mays) и риса (Oryza sativa). Сравнить формы крахмальных зерен, определить их размеры у разных видов растений, сделать их рисунки. Последовательность работы. Для приготовления препаратов разрезать и извлечь кончиком иглы небольшие кусочки эндосперма каждого объекта, перенести их в капли воды на предметные стекла, разрыхлить иглой, накрыть покровными стеклами и рассмотреть под микроскопом. Крахмальные зерна овса мелкие, овальные, сложные. При их развитии в лейкопластах возникают многочисленные образовательные центры, которые в сформированном зерне, как правило, не видны. Сложное зерно легко распадается на отдельные составляющие его зернышки. Поэтому на микропрепарате можно наблюдать мелкие угловатые и многочисленные простые зерна. Крахмальные зерна кукурузы простые, многогранные, со сглаженными углами. В центре их видна трещина, по форме напоминающая штрих, галочку или звездочку. С помощью окуляр-микрометра определить размеры объектов (см. п. 1.5). Заполните табл. 2.5. Таблица 2.5. Крахмальные зерна различных видов растений Вид растения Овес Размеры зерна Тип зерна Тип слоистости Рисунок Кукуруза Рис Глоссарий Ассимиляционный крахмал – ___________________________________________________________ _______________________________________________________________________________________ Глобоид – _____________________________________________________________________________ 43 Инулин – ______________________________________________________________________________ Кристаллоид – _________________________________________________________________________ Образовательный центр – ______________________________________________________________ _______________________________________________________________________________________ Контрольные вопросы: 1. Что такое конституционные и эргастические вещества? 2. С помощью каких реактивов можно обнаружить запасные вещества в клетках? 3. В чем отличие первичного и вторичного крахмала? 4. В чем различия между разными типами крахмальных зерен? 5. Из чего состоят и как образуются простые и сложные алейроновый зерна? 2.5. Примеры тестовых и модульных заданий Примеры тестовых заданий 1. В вакуолях содержатся пигменты: а) хлорофиллы; б) каротиноиды; в) антохлоры; г) антоцианы. 2. В олеопластах запасается: а) масло; б) белок; в) крахмал; г) нуклеиновая кислота. 3. Удлиненные отложения оксалата кальция в клетках – это: а) кристаллы; б) друзы; в) рафиды; г) алейроновые зерна. 4. Раствор с повышенной концентрацией относительно внутриклеточной: а) гипертонический; б) изотонический; в) гипотонический; г) изоосмотический. 5. Двойной мембраной окружены: а) ядро и вакуоль; б) митохондрии и лейкопласты; в) пластиды, митохондрии и ядро; г) лизосомы, пероксисомы и ядро. 6. Одревеснение клеточной стенки происходит вследствие пропитки ее: а) лигнином; б) суберином; 44 в) кутином; г) воском. 7. Замкнутые мембранные пузырьки в хлоропластах – это: а) кристы; б) тилакоиды; в) ламеллы; г) граны. 8. Пластиды, не содержащие пигмента: а) лейкопласты; б) хлоропласты; в) хромопласты; г) амилопласты. 9. Процесс выхода воды из вакуоли сопровождается: а) деплазмолизом; б) плазмолизом; в) диализом; г) тургором. Примеры заданий для модульного контроля 1. Перечислите направления современной анатомии растений. 2. В чем отличия прозенхимных и паренхимных клеток растений? 3. Перечислите мембраны, относящиеся к эндомембране растительной клетки. 4. В какой органелле или структуре растительной клетки находится: а) десмотрубочка; б) грана; в) эухроматин; г) тонопласт; д) кольцевая ДНК; е) диктиосома; ж) ламелла; з) микрофибриллы целлюлозы; и) тилакоид; к) глобоид. 5. Какие органоиды растительной клетки называют полуавтономными? Объясните почему? 6. Напишите названия органоидов соответственно следующим функциям: А. Поддержка формы растительной клетки – … Б. Участие в процессе фотодыхания – … В. Компартментализация растительной клетки – … Г. Участие в процессе глюконеогенеза – … Д. Синтез белка – … Е. Гидролиз макромолекул (гидролитическая) –… Ж. Синтез целлюлозы – … З. Движение цитоплазмы – … И. Синтез компонентов матрикса клеточной оболочки – … 7. Нарисуйте схему взаимопревращения пластид – … 8. Перечислите химические вещества, входящие в состав оболочки растительной клетки и укажите их значение. 9. Закончите предложение. Напишите и нарисуйте виды плазмолиза. Плазмолиз - это ___________________________________________________ Происходит, если поместить растительную клетку в __________________ раствор. 10. Охарактеризуйте систему микротелец растительной клетки. 45 3. РАСТИТЕЛЬНЫЕ ТКАНИ 3.1. Лабораторная работа № 5. «Меристематические, покровные и механические ткани» Цель работы: ознакомиться с классификацией меристем, типами и строением покровных и механических тканей. Теоретические сведения. Тканями называют устойчивые, т. е. закономерно повторяющиеся, комплексы клеток, сходные по происхождению, строению и выполняющие одну или несколько сходных функций. По происхождению растительные ткани принято делить на первичные и вторичные. Первичные ткани образуются в точках роста органов растений, а вторичные возникают из клеток, закончивших свое формирование. По степени дифференциации выделяют ткани образовательные и постоянные. Образовательные ткани ‒ эмбриональные, их клетки способны непрерывно делится. Постоянные ткани – это ткани, которые после своего формирования не подвергаются дальнейшим изменениям (дифференцированные); они возникают из образовательных тканей. К постоянным тканям относятся покровные, проводящие, механические, выделительные и основные. Образовательная ткань или меристема - это недифференцированная растительная ткань, клетки которой способны многократно делиться. Возникшие из меристем клетки дифференцируются и дают начало всем тканям и органам растений. Клетки меристемы имеют слабо оформленные мелкие вакуоли и малодифференцированный протопласт, пластиды обычно находятся на стадии пропластид. Отложения запасных веществ в них не происходит. Клетки располагаются близко друг к другу и не имеют межклетников, однако разные меристемы сильно отличаются по форме и размерам составляющих их клеток. По происхождению выделяют: первичные и вторичные меристемы. По положению в растении выделяют меристемы: верхушечные (апикальные), боковые (латеральные), вставочные (интеркалярные), раневые. Задание 1. Заполнить табл. 3.1. Таблица 3.1. Меристемы растительного организма Название Локализация По происхождению 1. 46 Функция 2. По расположению 3. 4. 5. 6. Теоретические сведения. Покровные ткани Это комплекс клеток, расположенных снаружи органа растения. Ее функция заключается в предохранении растений от высыхания, действия низких и высоких температур, механических повреждений и других неблагоприятных факторов внешней среды. При изменениях возраста органов и их функций, покровные ткани закономерно сменяют одна другую. По происхождению различают первичные (эпидермис), вторичные (перидерма) и третичные (корка или ритидом) покровные ткани. Первичная покровная ткань. Эпидермис образуется из поверхностного слоя апикальной меристемы – протодермы. Он покрывает листья, плоды, части цветка и молодые стебли. Кроме защитной функции, эпидермис регулирует процессы транспирации и газообмена, принимает участие в синтезе различных веществ и др. В состав эпидермиса входит несколько морфологически различных клеток: основные клетки, замыкающие и побочные клетки устьиц, трихомы (выросты эпидермиса). Клетки живые, имеют ядра, лейкопласты, вакуоли, хлоропласты (только в замыкающих клетках устьиц). Эпидермис у большинства растений однослойный, реже многослойный. Клетки первичной покровной ткани плотно примыкают друг к другу, и не 47 имеют межклетников. С наружной стороны эпидермис покрыт сплошным слоем кутикулы. (прерывается только над устьичными щелями). Задание 2. Изучить строение эпидермиса двудольного растения (например, листа сеткреазии – Setcreasea). Последовательность работы. Приготовить временный микропрепарат парадермального среза эпидермиса нижней стороны листа сеткреазии в воде. Изучить препарат при малом увеличении, а затем при большом. Найти разные клетки эпидермы: основные клетки, или собственно эпидермальные; замыкающие клетки устьиц. Изучить строение устьица. Обратить внимание на неравномерность утолщения оболочки у замыкающих клеток: она более толстая на стороне обращенной к устьичной щели. Используя микровинт, при большом увеличении убедиться, что устьице погружено вовнутрь листа, а окружающие клетки «нависают» над ним. При рассмотрении внутреннего содержимого клеток обратить внимание на пластиды, находящиеся в побочных клетках (лейкопласты) и замыкающих клетках устьиц (хлоропласты). Рассмотреть побочные клетки. Зарисовать фрагмент эпидермиса (А) и устьице (Б) листа сеткреазии и сделать обозначения. А Б Рис. 3.1. Эпидермис (А) и устьице (Б) листа сеткреазии: 1 ‒ основные клетки, 2 ‒ устьичный аппарат, 3 ‒ замыкающие клетки, 4 – побочные клетки, 5 – устьичная щель, 6 – трихома (если видно) Задание 3. Изучить строение эпидермиса однодольного растения на примере листа кукурузы (Zea mays). Последовательность работы. Приготовить временный микропрепарат парадермального среза эпидермиса нижней стороны листа кукурузы. Изучить строение эпидермы. Клетки эпидермы сильно вытянуты по длине листа и имеют волнистые стенки. Между этими клетками найти ромбовидный устьичный аппарат. Замыкающие клетки имеют вид двух палочек, расширенных на концах, а к каждой замыкающей клетке прилегает более или менее треугольная побочная клетка. Замыкающие клетки имеют 48 толстостенную среднюю часть и тонкостенные концы, образующие как бы головки, содержащие хлоропласты. При увеличении тургора концы замыкающих клеток вздуваются, клетки при этом принимают форму гантелей, а средние их части отодвигаются друг от друга, открывая устьичную щель. Зарисовать клетки эпидермиса (А) и устьице (Б) листа кукурузы. Сделать обозначения А Б Рис. 3.2. Клетки эпидермиса (А) и устьице (Б) листа кукурузы: 1 – замыкающие клетки, 2 – побочные клетки, 3 – устьичная щель, 4 – устьичный аппарат, 5 ― основные клетки эпидермы Сравнить форму и строение основных, побочных и замыкающих клеток устьиц в эпидермисе листа однодольного и двудольного растений, рассмотренных в заданиях 2 и 3. Заполнить табл.3.2. Табл. 3.2 Строение устьиц одно- и двудольных растений Клетки Однодольные растения Основные эпидермальные Замыкающие (устьичные) 49 Двудольные растения Побочные Задание 4. Рассмотреть и зарисовать волоски (трихомы) эпидермиса листьев лоха серебристого (Elaeagnus commutata), яблони домашней (Malus domestica) и обыкновенного (Verbáscum thápsus). Последовательность работы. Сделать соскоб с опушенной поверхности листьев предложенных объектов в воду. Рассмотреть строение и форму волосков. Зарисовать препараты, отметив одноклеточное или многоклеточное строение волоска каждого из объектов. Зарисовать трихомы – выросты эпидермиса листьев лоха (А), яблони (Б) и коровяка (В). А Б В Рис. 3.3. Трихомы – выросты эпидермиса листьев лоха (А), яблони (Б) и коровяка (В) Ответить на вопрос: «Какие функции выполняют трихомы?» Вторичная покровная ткань. Перидерма возникает при заложении феллогена в эпидерме, субэпидермальном слое (под эпидермой) или в более глубоких слоях первичной коры. Она замещает эпидерму в тех стеблях и корнях, которые разрастаются в толщину путем вторичного роста. Перидерма состоит из трех основных компонентов: феллогена (пробковый камбий), за счет которого перидерма нарастает в толщину, производя к поверхности феллему 50 (пробку), выполняющую защитную функцию, а внутрь феллодерму. Живые ткани, расположенные под пробкой, испытывают потребность в газообмене. Для этого в перидерме формируются чечевички. Третичная покровная ткань. Корка (ритидом) приходит на смену перидермы. У большинства древесных растений она образуется в результате многократного заложения новых прослоек перидермы во все более глубокие ткани первичной коры. Живые клетки, заключенные между этими прослойками отмирают. Таким образом, корка состоит из чередующихся слоев пробки и заключенных между ними отмерших прочих тканей первичной коры. Задание 5. Рассмотреть строение перидермы и чечевички на поперечном срезе ветки бузины (Sambucus sibirica). Сделать рисунки строения перидермы и чечевички. Последовательность работы. Приготовить поперечный срез ветки бузины в воде. При малом увеличении на поверхности стебля обычно видны полуразрушенные плоские клетки эпидермы, за ними следуют правильные радиальные ряды пробки. Протопласты клеток отмерли. Под пробкой лежит слой плоских тонкостенных клеток с живым содержимым. Это вторичная меристема ― феллоген (пробковый камбий). Внутрь от него находится слой хлорофиллоносной паренхимной ткани – феллодерма. Три рассмотренных слоя (пробка, пробковый камбий и феллодерма) вместе составляют перидерму. Найти и рассмотреть строение чечевички. Она имеет двояковыпуклое очертание. Большая часть чечевички заполнена рыхло расположенными, имеющими большие межклетники, более или менее округлившимися клетками, которые чередуются с более плотными слоями клеток. Это клетки выполняющей ткани. Пробковый камбий под чечевичкой усиленно делится, образуя сплошной слой, соединяясь с феллогеном под феллемой. Зарисовать перидерму (А) и строение чечевички (Б) на поперечном срезе ветки бузины. Сделать обозначения. А Б Рис. 3.4. Перидерма (А) и строение чечевички (Б) на поперечном срезе ветки бузины: 1 – остатки эпидермы, 2 – феллема, 3 – феллоген, 4 – феллодерма, 5 – чечевичка, 6 – выполняющая ткань 51 Ответить на вопрос: «По какому принципу покровные ткани делят на первичные, вторичные и третичные?» Теоретические сведения. Механические ткани С развитием растений в их органах образуются специализированные механические ткани, обладающие высокой прочностью. Эти ткани усиливают противодействие всего растения или его органов, прежде всего излому или разрыву. Механические ткани в связи с выполняемыми функциями называют также опорными или арматурными. Высокая прочность этих тканей достигается утолщением клеточных оболочек. К механическим тканям относятся колленхима и склеренхима. Колленхима состоит из живых толстостенных клеток, содержащих протопласт со всеми органеллами. Первичные клеточные стенки, кроме целлюлозы, содержат большое количество пектина и гемицеллюлозы, но в них нет лигнина. Поскольку пектиновые вещества гидрофильны, оболочки клеток колленхимы богаты водой, за счет чего выглядят блестящими. Утолщения оболочек колленхимы распределены неравномерно. По форме утолщения оболочек выделяют три типа колленхимы (рис. 3.5): 1) уголковая – утолщения локализуются в углах клеток; 2) пластинчатая – утолщены тангентальные стенки клеток; 3) рыхлая – утолщены стенки, обращенные к межклетникам (сочетаются функции опоры и газообмена). Рис. 3.5. Типы колленхимы (А – рыхлая, Б – пластинчатая, В – уголковая): 1 – первичная оболочка, 2 – утолщенная оболочка, 3 – межклетник, 4 – протопласт Склеренхима состоит из клеток с равномерно утолщенными и одревесневшими вторичными оболочками вследствие пропитки ее лигнином, а содержимое клеток отмирает после окончательного формирования 52 оболочек. Обычно склеренхима размещается в органах глубже колленхимы среди паренхимных или проводящих тканей. По форме клеток различают два основных типа склеренхимы – волокна и склереиды. Волокна встречаются в различных частях растения. Они имеют форму сильно вытянутых в длину (прозенхимных) клеток, заостренных на концах. Обычно они имеют толстые стенки и узкую полость. Различают древесинные волокна (волокна либриформа) и лубяные волокна. Древесинные волокна входят в состав древесины (ксилемы), лубяные в состав луба (флоэмы). Склереидами называют склеренхимные клетки, не обладающие формой волокон. Обычно эти клетки имеют толстостенные вторичные оболочки, сильно одревесневшие и снабженные многочисленными, чаще всего простыми порами. Склереиды могут быть изодиаметрическими или слегка удлиненными – брахисклереиды (каменистые клетки); палочковидные – макросклереиды; звездчатые – астросклереиды и др. Задание 6. Изучить колленхиму и склеренхиму на поперечном срезе стебля тыквы (Cucurbita pepo). Последовательность работы. Приготовить временный микропрепарат поперечного среза стебля тыквы, для выявления склеренхимы провести окрашивание флороглюцином с соляной кислотой. На малом увеличении найти расположенные под эпидермой клетки колленхимы с блестящими толстостенными (неравномерно утолщенными) клеточными стенками. Определить тип утолщения оболочек клеток колленхимы. Немного передвинуть микропрепарат к центру и рассмотреть несколько рядов, расположенных кольцом плотно сомкнутых многоугольных клеток с равномерно утолщенными оболочками склеренхимы, окрашенных в розовато-малиновый цвет. Зарисовать участок поперечного среза стебля тыквы. Сделать обозначения: 1 – эпидерма, 2 – колленхима, 3 – склеренхима Рис. 3.6. Поперечный срез стебля тыквы Сравнить между собой механические ткани (колленхиму и склеренхиму), указав особенности строения клеток и расположение тканей, заполнив табл. 3.3. 53 Таблица 3.3. Сравнительная характеристика механических тканей Характеристика Колленхима Склеренхима Клеточная стенка Протопласт Локализация в органах растений Для каких систематических групп растений характерна Задание 7 (дополнительное). Изучить строение эпидермиса на поперечном срезе листа ириса (Iris germanica). Сделать рисунок. Последовательность работы. Приготовить временный микропрепарат поперечного среза листа ириса. На препарате найти устьичный аппарат и рассмотреть его при большом увеличении. Среди относительно крупных клеток эпидермы расположены углубления с двумя маленькими яйцевидными замыкающими клетками, направленными острыми концами друг к другу. Между ними есть щель, а под ними всегда находится крупная воздушная полость. На поперечном разрезе хорошо видно, что наружная и внутренняя стенки замыкающих клеток, образующие в сторону щели острый угол, сильно утолщены. Это утолщение постепенно уменьшается в сторону, противоположную от щели. На наружной поверхности клеток эпидермы хорошо видна кутикула в виде блестящей прозрачной полоски. На замыкающих клетках она образует острую складку, которая на поперечном разрезе кажется клювовидным выростом. Обратить внимание на то, что наружная стенка клеток эпидермы гораздо толще боковых и внутренних. Зарисовать участок нижнего эпидермиса и устьице на поперечном срезе листа ириса, отметить: 54 1 – замыкающие клетки, 2 – устьичная щель, 3 – воздушная полость, 4 – побочная клетка, 5 – кутикула, 6 – основные клетки эпидермы, 7 – клетки мезофилла Рис. 3.7. Нижний эпидермис и устьице на поперечном срезе листа ириса Глоссарий Астросклереиды – _____________________________________________________________________ Брахисклереиды – _____________________________________________________________________ Либриформ – _________________________________________________________________________ Трихома – _____________________________________________________________________________ Устьице – _____________________________________________________________________________ _______________________________________________________________________________________ Контрольные вопросы: 1. Назвать строение и функции эпидермы. Какие органы она покрывает? 2. Какой механизм работы устьичного аппарата? 3. Как через пробку происходит газообмен и транспирация? 4. Какие меристемы обеспечивают рост органов в длину, а какие – в ширину? 5. Какие механические ткани встречаются у однодольных и двудольных растений? 3.2. Лабораторная работа № 6. «Проводящие ткани, сосудисто-волокнистые (проводящие) пучки, поглотительные, выделительные ткани, система проветривания» Цель работы: ознакомиться со строением проводящих, поглотительных, выделительных тканей, типами и строением сосудисто-волокнистых пучков и особенностями организации системы проветривания. Теоретические сведения. СВП (сосудисто-волокнистые пучки) Проводящая система растений состоит из ксилемы, осуществляющей восходящий ток воды и растворенных в ней минеральных веществ от корней к листьям, и флоэмы – ткани, проводящей органические, синтезированные в ходе фотосинтеза вещества (нисходящий ток) от листьев к корням. Это сложные ткани, т. к. включают различные по структуре и функциональному значению анатомические элементы. Проводящие ткани по происхождению 55 могут быть первичными и вторичными. Первичные образуются в результате деятельности прокамбия, а вторичные – камбия. Ксилему составляет три типа элементов: 1) собственно проводящие (трахеиды и трахеи (сосуды)); 2) механические (древесинные волокна или либриформ); 3) паренхимные. Основными проводящими элементами ксилемы являются трахеиды и трахеи (сосуды). В зрелом состоянии оба типа элементов представляют собой более или менее вытянутые клетки, лишенные протопластов и имеющие одревесневшие вторичные оболочки. Трахеиды – это прозенхимные клетки со скошенными концами. Они отличаются от сосудов тем, что не имеют перфораций. В трахеидах передвижение воды из клетки в клетку осуществляется, главным образом, через поровые мембраны, которые отличаются высокой проницаемостью для воды и растворенных веществ. Трахеи (сосуды) – это длинные (до многих метров) полые трубки, состоящие из члеников. Они образуются из вертикального ряда прозенхимных меристематических клеток прокамбия. Их боковые стенки с возрастом одревесневают и неравномерно утолщаются, а поперечные – образуют сквозные отверстия (перфорации). Флоэма, как и ксилема, состоит из трех типов тканей: 1) собственно проводящей (ситовидные трубки с клетками-спутницами и ситовидные клетки); 2) механической (лубяные волокна); 3) паренхимной. Ситовидная трубка представляет собой вертикальный ряд клеток, соединенных между собой концами посредством ситовидных пластинок. Каждая отдельная клетка, входящая в состав ситовидной трубки называется члеником. Оболочки их первичные целлюлозные. Органические вещества движутся сверху вниз из клетки в клетку по дезорганизованным протопластам (смесь клеточного сока с цитоплазмой). Рядом с ситовидной трубкой обычно расположены сопровождающие клетки (клетки-спутницы). Они тесно связаны с члениками ситовидной трубки своим происхождением и функцией, заключающейся в регуляции передвижения веществ по флоэме. Ситовидные клетки лишены специализированных сопровождающих клеток и в зрелом состоянии содержат ядра. Их ситовидные поля рассеяны на боковых стенках. Ксилема и флоэма обычно расположены рядом, образуя так называемые проводящие пучки, представленные в растениях несколькими типами (рис. 3.8). Их можно классифицировать: I . По элементарному составу: 1. Простые пучки – наиболее примитивные по структуре и состоят из одних гистологических элементов: а) из одних трахеид (в листьях, ближе к их краям); б) из одних ситовидных трубок (в цветочных стрелках лука). 56 2. Общие пучки – трахеиды, сосуды и ситовидные трубки расположены рядом. 3. Сложные пучки – содержат проводящие и паренхимные элементы. 4. Сосудисто-волокнистые пучки – включают все элементы ксилемы и флоэмы, механические ткани и паренхимные элементы. II. По наличию или отсутствию камбия: 1. Открытые – между ксилемой и флоэмой находится камбий. 2. Закрытые – камбия отсутствует. III. По взаимному расположению ксилемы и флоэмы: 1. Коллатеральные – ксилема и флоэма располагаются бок о бок, т. е. на одном радиусе. 2. Биколлатеральные – флоэма прилегает к ксилеме с обеих сторон. Наружный участок флоэмы более мощный. 3. Концентрические: а) амфивазальные – ксилема замкнутым кольцом окружает флоэму; б) амфикрибральные – флоэма окружает ксилему. 4. Радиальные – ксилема расходится лучами от центра, а флоэма располагается между лучами. Рис. 3.8. Типы проводящих пучков: А – открытый коллатеральный, Б – открытый биколлатеральный, В – закрытый коллатеральный, Г – концентрический амфивазальный , Д – концентрический амфикрибральный, Е – радиальный: 1 – флоэма, 2 – камбий, 3 – ксилема Задание 1. Рассмотреть и зарисовать закрытый коллатеральный проводящий пучок на поперечном срезе стебля кукурузы (Zea mays). Последовательность работы. Сделать несколько поперечных срезов стебля кукурузы, окрасить их флороглюцином в соляной кислоте. Найти закрытый коллатеральный проводящий пучок и рассмотреть его при малом увеличении. Найти ксилему: сосуды расположены в центре среза, между ними крупные клетки древесинной паренхимы с одревесневшими стенками и древесинные волокна; а затем флоэму: ситовидные трубки (шестиугольные 57 ситовидные пластинки), клетки-спутники (четырехугольные мелкие клетки с зернистой цитоплазмой). Между ксилемой и флоэмой нет слоя камбия (закрытый проводящий пучок). Зарисовать закрытый коллатеральный проводящий пучок стебля кукурузы, отметив: 1 – склеренхимное влагалище, 2 – флоэма, 3 – ситовидные трубки, 4 – клетки-спутницы, 5 – ксилема, 6 – паренхима пучка, 7 – воздушная полость Рис. 3.9. Закрытый коллатеральный проводящий пучок стебля кукурузы Задание 2. Рассмотреть и зарисовать концентрический амфивазальный проводящий пучок на поперечном срезе корневища ландыша (Convallaria majalis). Последовательность работы. Сделать несколько поперечных срезов корневища ландыша, окрасить их флороглюцином в соляной кислоте. При малом увеличении видно, что все проводящие пучки собраны в центре органа. Концентрические пучки лежат в самом центре и окружены со всех сторон основной паренхимой. Рассмотреть такой пучок при малом увеличении. Ксилема, состоящая из крупных паренхимных клеток с толстыми стенками, окрашенными реактивом в малиновый цвет, расположена кольцом на периферии пучка. Ткань, заключенная в середине пучка, – флоэма. В ней можно различить более крупные клетки – ситовидные трубки, а между ними мелкие клетки с густым содержимым – клетки-спутницы. Зарисовать концентрический амфивазальный проводящий пучок корневища ландыша. Сделать обозначения: 1 – ксилема, 2 – флоэма, 3 – паренхима центрального цилиндра Рис. 3.10. Концентрический амфивазальный проводящий пучок корневища ландыш 58 Задание 3. Рассмотреть радиальный проводящий пучок на постоянном микропрепарате поперечного среза корня ириса (Iris germanica). Последовательность работы. Рассмотреть постоянный микропрепарат корня ириса. Найти на нем ксилему и флоэму, обратить внимание на их взаимное расположение. Ксилема расходится лучами от центра, а флоэма располагается между лучами. В корне ириса полиархный (многолучевой) проводящий пучок. Зарисовать радиальный проводящий пучок корня ириса. Сделать обозначения: 1 – лучи ксилемы 2 – участок флоэмы Рис. 3.11. Радиальный проводящий пучок корня ириса Заполнить табл. 3.4. Таблица 3.4. пучков Название СВП Характеристика сосудисто-волокнистых (проводящих) Ткани, входящие в состав СВП, их расположение Локализация в растительном организме По наличию камбия По расположению ксилемы и флоэмы 59 Теоретические сведения. Поглотительные ткани Ризодерма (эпиблема) образована апикальной меристемой корня. Она покрывает молодые корешки и именно через ризодерму происходит поглощение воды и минеральных солей из почвы. Кроме того, взаимодействует с микроорганизмами почвы, через ризодерму из корня в почву выделяются вещества, способствующие минеральному питанию. Клетки ризодермы имеют очень тонкие оболочки, отсутствует кутикула, вследствие чего эти клетки имеют оболочки легко проницаемые для воды. На небольшом расстоянии от кончика корня образуются корневые волоски – выросты ризодермы, которые осуществляют всасывание и многократно увеличивают поверхность поглощения корневой системы. Веламен, как и ризодерма, происходит из поверхностного слоя апикальной меристемы корня. Эта своеобразная ткань покрывает корни эпифитов, приспособленных к поглощению влаги и минеральных веществ из окружающего воздуха (монстера, орхидные, бромеллиевые и др.). Веламен от ризодермы отличается многослойностью. Протопласт клеток отмирает и поэтому веламен всасывает воду не осмотическим, а капиллярным путем через многочисленные капилляры клеточной оболочки. Задание 4. Рассмотреть и зарисовать строение веламена воздушных корней монстеры (Monstera deliciosa). Последовательность работы. Сделать несколько поперечных срезов корня монстеры и поместить их в воду на предметное стекло, покрыть покровным. Рассмотреть строение веламена. Снаружи расположено несколько рядов более крупных клеток. Под ними находится многорядный слой более мелких клеток. Изнутри веламен граничит с экзодермой. В нижнем слое веламена выделяются клетки треугольной формы – кроющие клетки. Они расположены 60 над пропускными клетками экзодермы. Через пропускные клетки экзодермы вода транспортируется вглубь корня. Зарисовать веламен воздушных корней монстеры. Сделать обозначения: 1 – веламен, 2 – экзодерма, 3 – пропускная клетка в экзодерме. Рис. 3.12. Веламен воздушных корней монстеры Теоретические сведения. Выделительные (или секреторные) ткани Секреторные ткани весьма разнообразны по морфологии и топографии в растении. Различают два типа элементов выделительной ткани – системы внешней (экзогенной) и внутренней (эндогенной) секреции. Выделительные ткани внешней (экзогенной) секреции. Железистые волоски представляют собой трихомы, т. е. производные эпидермы, образованные без участия ниже лежащих тканей. Железистые волоски могут быть сидячими, иметь многоклеточную головку и т. д. Железки отличаются от волосков тем, что в их формировании участвует не только клетки эпидермы, но и более глубоко лежащие ткани. Они часто более многоклеточны и к ним подходят окончания проводящих пучков. Железки выполняют разнообразные функции: выделение эфирных масел (черная смородина); избытка солей (галофиты); липкой слизи для улавливания насекомых и пищеварительных ферментов для их переваривания («хищные» растения); веществ, склеивающих почечные чешуи, для защиты точки роста (почки древесных растений) и др. Гидатоды (водяные устьица) – это комплекс клеток в листьях, обеспечивающих выделение из растений капельно-жидкой воды и солей. Этот процесс называется гуттацией. Нектарники представляют собой разнообразные железистые образования для выделений сахаристой жидкости (нектара). Нектар служит средством привлечения животных, чаще всего насекомых, производящих перекрестное опыление растений. Выделительные ткани внутренней (эндогенной) секреции. Вместилища очень разнообразны по форме, величине и происхождению. Различают схизогенные и лизигенные вместилища. Первые возникают в виде межклетников, заполненных выделенными веществами и окруженных 61 живыми клетками эпителия. Вторые возникают на месте группы клеток, которые распадаются после накопления веществ. Каналообразные вместилища обычно называются по их содержимому масляными, смоляными, слизевыми и камедевыми ходами. Выделительные клетки (идиобласты) накапливают различные вещества: кристаллы оксалата кальция (одиночные кристаллы, друзы, рафиды и т. д.), слизи, таннины, эфирные масла. Они встречаются среди клеток разных тканей, могут иметь разнообразную форму и химический состав. Млечники (млечные трубки) – это живые клетки с цитоплазмой, многими ядрами и вакуолью, заполненной млечным соком (латексом). Выполняют разнообразные функции: проводящую, запасающую, выделительную. Различают два вида млечников: членистые и нечленистые. Членистые образуются в результате разрушения поперечных стенок у вертикального ряда клеток. Нечленистые млечники возникают в результате разрастания специальных клеток зародыша. Это гигантские цилиндрические или разветвленные клетки. Млечники располагаются или только во флоэме, или пронизывают весь орган (стебель, корень, лист). Задание 5. Рассмотреть и зарисовать схизогенные смоляные ходы на временном микропрепарате поперечного среза хвои сосны обыкновенной (Pinus sylvestris). Последовательность работы. Приготовить поперечный срез хвои сосны в воде. При малом увеличении найти среди хлоренхимы резко выделяющиеся округлые группы неокрашенных клеток с межклеточным пространством в центре. При большом увеличении видно, что межклетник окружен живыми клетками эпителия. Клетки эпителия заполнены густой цитоплазмой с ясно заметными ядрами. Вокруг клеток эпителия находятся толстостенные мертвые клетки, которые выполняют опорную функцию, препятствуя сплющиванию полости смоляного хода. Зарисовать схизогенный смоляной ход на поперечном срезе хвои сосны обыкновенной. Сделать обозначения: 1 – полость, 2 – эпителий, 3 – клетки хлоренхимы, 4 – толстостенные мертвые клетки Рис. 3.13. Схизогенный смоляной ход на поперечном срезе хвои сосны обыкновенной Ответить на вопрос: «В чем сходство и различие в строении и образовании схизогенного и лизигенного вместилищ?» 62 Теоретические сведения. Система проветривания Система проветривания включает устьица, чечевички, межклетники и специализированную воздухоносную ткань аэренхиму. Аэренхима (воздухоносная ткань) – ткань, с преобладающей функцией газообмена (вентиляции), имеющая крупные межклетники. Аэренхима развита у растений, произрастающих в условиях недостатка (гипоксии) или аноксии (отсутствия) воздуха. Задание 6. Рассмотреть аэренхиму на временном препарате поперечного среза стебля растения-гидрофита: рдеста плавающего (Potamogeton natans), камыша озерного (Schoenoplēctus lacūstris), кубышки желтой (Núphar lútea), кувшинки белой (Nymphaéa álba). Последовательность работы. Приготовить поперечный срез стебля рдеста или камыша в воде. При малом увеличении на срезе сразу под эпидермой видна необычного вида ткань с крупными полостями, отделенными друг от друга одним рядом относительно мелких паренхимных клеток. Межклетники, тянущиеся вдоль стебля, называют воздухоносными ходами, которые служат для накопления воздуха и его циркуляции по всему растению. Провести окрашивание препарата флороглюцином с соляной кислотой. Рассмотреть препарат и найти окрашенные астросклереиды – элементы механической ткани, придающие прочность аэренхиме. Зарисовать аэренхиму на поперечном срезе стебля рдеста или стебля камыша. Сделать обозначения: 1 – паренхимные клетки, 2 – межклетники, 3 – астросклереида Рис. 3.14. Аэренхима на поперечном срезе водного растения 63 Задание 7_а (дополнительное). Рассмотреть и зарисовать открытый коллатеральный проводящий пучок на поперечном срезе стебля подсолнечника (Helianthus annuus). Последовательность работы. Сделать несколько поперечных срезов стебля подсолнечника, окрасить их флороглюцином в соляной кислоте. Найти склеренхиму. Она укрепляет флоэму снаружи. Под склеренхимой расположена флоэма (ситовидные трубки, клетки-спутники, лубяная паренхима). Обратить внимание на присутствие лубяной паренхимы (в стебле кукурузы ее нет), поэтому сопровождающие клетки расположены уже не в таком строгом порядке, как это было у кукурузы. Между флоэмой и ксилемой находится камбий – слой клеток с густой цитоплазмой, расположенный радиальными рядами. Внутрь от камбия правильными радиальными рядами располагаются сосуды ксилемы. Причем в центре они мелкие и образованы прокамбием (первичная ксилема), а крупные – камбием (вторичная ксилема). Между сосудами ксилемы находится древесинная паренхима (более мелкие клетки с живым содержанием). Зарисовать открытый коллатеральный проводящий пучок стебля подсолнечника. Сделать обозначения: 1 – склеренхима, 2 – флоэма, 3 – камбий, 4 – ксилема, 5 – основная паренхима стебля Рис. 3.15. Открытый коллатеральный проводящий пучок стебля подсолнечника Задание 7_б (дополнительное). Рассмотреть и зарисовать открытый биколлатеральный проводящий пучок на поперечном срезе стебля тыквы (Cucurbita pepo). Последовательность работы. Сделать несколько поперечных срезов стебля тыквы, окрасить их флороглюцином в соляной кислоте. При малом увеличении проводящие пучки, расположенные в один круг на разном уровне, за счет образования полости внутри стебля. Найти ксилему (вторичная ксилема – крупные сосуды; первичная ксилема – мелкие сосуды в центре). С обеих сторон ксилемы расположены ткани флоэмы. Между ксилемой и наружным слоем флоэмы находится камбий, а между первичной ксилемой и внутренней флоэмой – паренхимные клетки. 64 Зарисовать открытый биколлатеральный проводящий пучок стебля тыквы. Сделать обозначения. 1 – основная паренхима стебля, 2 – наружная флоэма, 3 – камбий, 4 – вторичная ксилема, 5 – первичная ксилема, 6 – внутренняя флоэма, 7 – ситовидная трубка, 8 – клетка-спутница Рис. 3.16. Открытый биколлатеральный проводящий пучок стебля тыквы Задание 7_в (дополнительное). Рассмотреть лизигенные вместилища на поперечном среза околоплодника мандарина или апельсина (Citrus). Последовательность работы. Близко к поверхности виден ряд больших округлых полостей. Клетки, выстилающие их изнутри, имеют очень тонкую стенку и крупные вакуоли. Самый внутренний слой клеток обычно полуразрушен, видны остатки клеточных стенок. Здесь происходит постепенное растворение выделительных клеток. Оно начинается с небольшой центральной группы клеток и распространяется вокруг, захватывая новые концентрические слои клеток и увеличивая, таким образом, полость вместилища. Зарисовать лизигенные вместилища в околоплоднике мандарина или апельсина. Сделать обозначения: 1 – разрушающиеся клетки, 2 – полость Рис. 3.17. Лизигенные вместилища в околоплоднике мандарина или апельсина Глоссарий: Веламен – _____________________________________________________________________________ Гидатоды – ____________________________________________________________________________ Идиобласты – _________________________________________________________________________ 65 _______________________________________________________________________________________ Млечники – ___________________________________________________________________________ Сосудисто-волокнистый пучок – ________________________________________________________ _______________________________________________________________________________________ Контрольные вопросы: 1. В чем принципиальное отличие между открытым и закрытым типом проводящих пучков? 2. Как классифицируют пучки по расположению флоэмы и ксилемы? 3. Какие пучки характерны для стебля однодольного растения, для стебля двудольного растения? 4. Какие проводящие пучки называют простыми, общими, сложными и сосудисто-волокнистыми? 5. Что такое аэренхима? В каких органах и каких растений она встречается? 3.3. Примеры тестовых и модульных заданий Примеры тестовых заданий 1. Мертвая механическая ткань — это: а) колленхима; б) склеренхима; в) паренхима; г) хлоренхима. 2. Раневые меристемы относятся к: а) первичным; б) верхушечным; в) вторичным; г) интеркалярным. 3. Трихомами называют: а) эпидермальные волоски; б) корневые волоски; в) кристаллы щавелевокислого кальция; г) устьичные клетки. 4. Клетки эпидермы содержат хлоропласты у: а) растений засушливых мест обитания; б) высокогорных растений; в) влаголюбивых растений; г) водных растений. 5. Трахеиды являются единственными проводящими элементами ксилемы у: а) водорослей; б) мохообразных; в) голосеменных; г) покрытосеменных. 66 6. Загрузка флоэмы является основной функцией: а) ситовидных трубок; б) трахеид; в) клеток-спутниц; г) идиобластов. 7. Пучок, в котором одна проводящая ткань окружает другую, называется: а) коллатеральным; б) биколлатеральным; в) радиальным; г) концентрическим. 8. Гидатоды обеспечивают функцию: а) гуттации; б) транспирации; в) секреции; г) дыхания. 9. Одиночные клетки называют: а) устьичными; б) спутницами; в) идиобластами; г) трахеидами. 10. Тиллы представляют собой ткань: а) проводящую; б) покровную; в) механическую; г) ложную. Примеры заданий для модульного контроля 1. Перечислите особенности растительных тканей. Приведите примеры полифункциональных тканей. 2. Какие критерии (признаки) могут лежать в основе классификации растительных тканей. Приведите примеры живых и мертвых тканей. 3. Меристемы разделяют на ______________________________________________. 4. Нарисуйте устьице. Сделайте соответствующие обозначения. 5. Перечислите вещества, входящие в состав ксилемного и флоэмного сока. 6. Охарактеризуйте элементы флоэмы. 7. Охарактеризуйте элементы ксилемы. 8. Какие типы СВП Вы знаете? 9. К какому типу тканей относится: а) эпиблема; б) феллема; в) колленхима; г) млечники; д) астросклереиды; е) феллоген; ж) трихомы; з) веламен; и) трахеиды; к) аэренхима. 10. Сравните особенности строения тканей одно- и двудольных растений. 67 4. АНАТОМИЯ ВЕГЕТАТИВНЫХ ОРГАНОВ 4.1. Лабораторная работа № 7. «Первичное и вторичное строение стебля. Видоизменения стебля» Цель работы: ознакомиться с первичным и вторичным строением стебля покрытосеменных растений; изучить закономерности разных способов заложения камбия и образования различных типов стел у двудольных растений; рассмотреть видоизменения стебля на примере строения корневища. Теоретические сведения. Первичное строение стебля Стебель представляет собой осевой вегетативный орган растения, несущий листья и почки. Основные функции стебля – опорная и проводящая. Стебель осуществляет связь между корнями, листьями и генеративными органами. Кроме того, в стебле нередко откладываются запасные питательные вещества. Иногда стебель выступает как ассимилирующий орган. На начальных этапах развития формируется первичная анатомическая структура стебля, сохраняющаяся у однодольных в течение всей жизни. У двудольных покрытосеменных и голосеменных растений первичная структура стебля в ходе онтогенеза преобразуется и в итоге формируется так называемое вторичное строение стебля. В результате деятельности прокамбия и остальной первичной меристемы конуса нарастания формируется первичное строение стебля. В первичном строении обычно различают эпидерму, первичную кору и стелу (центральный цилиндр). Первичная кора располагается сразу под эпидермой и представляет собой комплекс тканей, в состав которого могут входить хлоренхима (ассимиляционная паренхима), паренхима, выделительные, механические (чаще колленхима), а также некоторые другие ткани. Совокупность тканей стебля, расположенных внутрь от первичной коры, называется центральным цилиндром (стелой). Он занимает центральную часть стебля внутрь от эндодермы, с которой граничит самый наружный слой центрального цилиндра – перицикл. Под ним располагаются проводящие ткани в виде сосудисто-волокнистых пучков или сплошного кольца. Сердцевина расположена в центре стебля и представлена преимущественно паренхимой. Сердцевина многих растений частично разрушается, и тогда стебель становится полым. Такой тип строения стебля называется соломиной. Сердцевина сообщается с первичной корой при помощи паренхимной ткани, расположенной радиальными рядами и получившей название сердцевинных лучей. У большинства однодольных растений первичная кора и сердцевина четко не выражены, так как проводящие пучки располагаются по всему поперечному сечению стебля. 68 У голосеменных и большинства двудольных покрытосеменных рост стебля в толщину осуществляется за счет работы камбия, образующего вторичные ткани. Существует несколько способов заложения и деятельности камбия: Непучковый тип – камбий закладывается в виде непрерывного кольца, откладывая сплошные слои вторичных проводящих тканей (стебель липы – Tilia cordata). Пучковый тип: а) закладывается пучковый и межпучковый камбий. Последний дифференцируется в лучевую паренхиму или механические элементы (стебель кирказона – Aristolochia clematitis); б) закладывается только пучковый камбий. Пучки разделены паренхимой, которая даже в наиболее старых участках стебля не одревесневает (стебель тыквы – Cucurbita pepo). Переходный тип – закладывается как пучковый, так и межпучковый камбий. Межпучковый камбий образуется из паренхимы. Из него дифференцируются новые проводящие (добавочные) пучки, которые расположены между более крупными пучками (стебель подсолнечника – Helianthus annuus). Задание 1. Приготовить и рассмотреть временный микропрепарат поперечного среза стебля подсолнечника (Helianthus annuиs) с переходным типом строения. Последовательность работы. Сделать поперечный срез стебля подсолнечника, окрасить флороглюцином в соляной кислоте. Рассмотреть ткани стебля вначале при малом, затем при большом увеличении. Снаружи стебель покрыт эпидермой, на которой образуются крупные многоклеточные волоски. Под эпидермой расположена механическая ткань – колленхима. Обратить внимание на то, что клетки колленхимы имеют живое содержимое, в том числе ядра и хлоропласты. Под колленхимой лежит небольшой слой паренхимы первичной коры, заканчивающийся извилистым слоем из цепочки клеток, прилегающих к участкам склеренхимы. Это эндодерма. В основной паренхиме изредка встречаются схизогенные смоляные ходы. Таким образом, первичная кора состоит из колленхимы, основной паренхимы, эндодермы. К центру стебля, сразу же за первичной корой, расположен центральный цилиндр. Он начинается хорошо обособленными группами толстостенных клеток склеренхимы с одревесневшими стенками. Тяжи склеренхимы расположены не произвольно, а в комплексе с коллатеральными сосудистоволокнистыми пучками, всегда прилегают к флоэмной части пучка. Пучки открытые, расположены равномерно по окружности стебля. Несколько изогнутая зона пучкового камбия, выходя за пределы пучка, формирует выпуклую дугу межпучкового камбия. В результате его деятельности в нижней 69 части стебля формируются новые добавочные более мелкие СВП. Снаружи от камбия располагается слой флоэмы. Внутрь от пучков лежит крупноклеточная паренхима сердцевины, составляющая основную массу стебля. Зарисовать сектор поперечного среза стебля подсолнечника с переходным типом строения и сделать обозначения. Рис. 4.1. Поперечный срез стебля подсолнечника с переходным типом строения: 1 – эпидерма, 2 – колленхима, 3 – паренхима коры, 4 – смоляной ход, 5 ‒ первичная кора, 6 – склеренхима, 7 – открытый коллатеральный основной пучок, 8 – флоэма, 9 – пучковый камбий, 10 – ксилема, 11 – межпучковый камбий, 12 – добавочный СВП, 13 – паренхима сердцевины, 14 ‒ центральный цилиндр Задание 2. Познакомиться с строением стебля ржи (Secale cereale) или пшеницы с плохо выраженной первичной корой, беспорядочным расположением проводящих пучков и большой полостью в центре стебля – соломиной. Сделать рисунок и соответствующие обозначения. Последовательность работы. Сделать поперечный срез стебля, окрасить его флороглюцином в соляной кислоте. При малом увеличении рассмотреть мощный слой склеренхимы, выступы которого доходят до эпидермы. Между выступами склеренхимы лежат участки хлоренхимы, над ними можно заметить устьица. В более старых стеблях хлорофиллоносную паренхиму заметить почти невозможно, так как стенки ее клеток постепенно одревесневают. В каждом выступе склеренхимы, между участками хлорофиллоносной паренхимы лежит небольшой проводящий пучок. Ближе к центру расположены более крупные закрытые коллатеральные проводящие 70 пучки. Они окружены крупноклеточной паренхимой. В центре находится сердцевина. При росте стебля злаковых в длину клетки сердцевины могут разрываться и образуется полость, свойственная стеблям большинства злаков. Схематично зарисовать первичное строение стебля ржи и сделать обозначения. Рис. 4.2. Поперечный срез стебля ржи: 1 – эпидерма, 2 – склеренхима, 3 – хлоренхима (если есть), 4 – закрытый коллатеральный пучок, 5 – основная паренхима, 6 – полость Задание 3. Ознакомиться с первичной структурой стебля с пучковым типом строения с хорошо выраженной первичной корой на временном микропрепарате поперечного среза стебля тыквы (Cucurbita pepo). Последовательность работы. Сделать поперечный срез стебля тыквы, окрасить его флороглюцином в соляной кислоте. Междоузлия стебля тыквы полые и, как снаружи, так и изнутри, ребристые. В ребрах залегают сосудисто-волокнистые пучки, из них более крупные находятся во внутренних ребрах, а более мелкие – в наружных. Под эпидермисом с волосками располагается тонкий слой колленхимы, за которой идут тонкостенная паренхима, а за нею – сплошным слоем проходит склеренхима. Далее за склеренхимой залегает основная ткань центрального цилиндра, в которой размещаются проводящие сосудисто-волокнистые пучки. Пучки расположены в два круга, наружный состоит из более мелких пучков, а внутренний – из более крупных. Пучок тыквы открытый биколлатеральный. Схематично зарисовать первичное строение стебля тыквы с пучковым типом и сделать обозначения. 71 Рис. 4.3. Поперечный срез стебля тыквы с пучковым типом строения: 1 – эпидерма, 2 – колленхима, 3 – паренхима, 4 ‒ первичная кора (2-3), 5 – склеренхима (если есть), 6 ‒ основная паренхима, 7 ‒ открытый биколлатеральный пучок, 8 – ксилема, 9 – флоэма, 10 ‒ камбий, 11 – полость, 12 – центральный цилиндр (5–11) Сравните первичное строение стебля однодольного и двудольного растения (сравнение проведите в виде таблицы). Таблица 4.1. Первичное строения стебля одно- и двудольного растения Особенности строения стебля Двудольные растения Эпидермис Первичная кора 72 Однодольные растения Центральный цилиндр (стела) Теоретические сведения. Вторичное строение стебля Вторичное строение стебля формируется в результате деятельности камбия и феллогена (пробкового камбия), за счет чего образуется четыре основные части: покровная ткань, кора, древесина и сердцевина. Покровная ткань при вторичном строении чаще всего представлена перидермой, однако у ряда древесных растений с возрастом на смену перидерме формируется корка (ретидом). Кора многолетнего стебля древесного растения включает остатки первичной коры, группы механических элементов различного происхождения, располагающихся на границе остатков первичной коры и флоэмы, и всю массу флоэмы (вторичную флоэму – луб и остатки первичной). Луб дифференцирован на мягкий луб, состоящий из проводящих и паренхимных элементов. Совокупность механических элементов вторичной 73 флоэмы получила название твердого луба. Граница коры и древесины проходит по камбию. Вторичную ксилему с несколькими кольцами прироста называют древесиной. Она расположена внутрь от камбия и занимает большую часть стебля. Слой древесины, отложенный камбием за один вегетационный период, называется годичным кольцом. Как правило, в годичном кольце выделяют весеннюю и летне-осеннюю древесину. Сердцевина представлена паренхимными клетками. В радиальном направлении стебель пронизан лубодревесинными (сердцевинными) лучами, первичными и вторичными, осуществляющими связь между всеми зонами стебля. Задание 4. Рассмотреть и зарисовать временный микропрепарат поперечного среза стебля липы (Tilia cordata) с непучковым типом заложения камбия и вторичным строением стебля. Последовательность работы. Приготовить поперечный срез стебля липы (Tilia cordata), окрасить его флороглюцином в соляной кислоте. Подробно рассмотреть препарат последовательно от периферии к центру сначала при малом, затем при большом увеличении. Покровная ткань. Самая наружная часть среза наиболее пигментирована – это перидерма (вторичная покровная ткань). Иногда на поверхности пробки все еще сохраняются остатки отмершей первичной покровной ткани эпидермы. Кора. Первичная кора. К нижней стороне пробки примыкает слой мелких клеток с блестящими белыми стенками. Это живые клетки механической ткани – колленхимы. Под колленхимой лежит хорошо обособленный и легко наблюдаемый слой крупных клеток паренхимы первичной коры. Эти клетки имеют живое содержимое, а в некоторых есть друзы. Вторичная кора. Это хорошо обособленная морфологически и постоянно функционирующая часть стебля. В толще вторичной коры хорошо заметны участки луба (вторичной флоэмы) На поперечном срезе стебля они имеют форму трапеций, расширяющихся в сторону камбия и древесины и суженных к периферии. При большом увеличении видно, что горизонтальные слои слабо одревесневшей ткани состоят из плотно расположенных клеток склеренхимы – лубяных волокон. Стенки этих клеток настолько утолщены, что полость клетки видна в виде точки. Между слоями лубяных волокон, называемых твердым или толстостенным лубом, расположены остальные элементы флоэмы, называемые все вместе мягким или тонкостенным лубом. К мягкому лубу относят и паренхиму сердцевинных лучей. Камбий. Пограничной зоной луба и древесины служит камбий ‒ латеральная меристема. Она состоит из типичных мелких тонкостенных клеток, заполненных цитоплазмой, не имеющих крупных вакуолей. Клетки камбия расположены правильными радиальными рядами. 74 Древесина представлена годичными кольцами вторичной ксилемы. Они образуются в результате неоднородного строения древесины. Весенняя древесина состоит преимущественно из больших по диаметру сосудов. Причем наибольшие по диаметру сосуды сосредоточены у границы предыдущего годичного кольца. Летне-осенняя древесина состоит из сосудов малого диаметра с преобладанием трахеид и либриформа, которые как бы сплюснуты. За мелкими элементами осенней древесины на следующий год опять образуются сосуды большого диаметра. Этот резкий переход и создает видимые простым глазом границы слоев годичного прироста древесины. На границе с сердцевиной заметны небольшие выступы – участки первичной древесины. Сердцевина. В центре стебля расположена тонкостенная паренхимная ткань ‒ сердцевина. Некоторые клетки ее более крупные, не имеют живого содержимого, стенки их одревесневают и формируют так называемое ядро. Вокруг располагаются еще живые клетки, но обычно с темным содержимым, богатым дубильными веществами – заболонь. Схематично зарисовать сектор поперечного среза стебля липы и сделать обозначения. Рис. 4.4. Поперечный срез стебля липы: 1 ‒ перидерма, 2 ‒ первичная кора, 3 ‒ колленхима, 4 ‒ паренхима коры, 5 ‒ вторичная кора, 6 ‒ твердый луб, 7 – мягкий луб, 8 – первичный сердцевинный луч, 9 ‒ центральный цилиндр, 10 ‒ камбий, 11 ‒ вторична древесина, 12 – первичная древесина, 13 ‒ годичное кольцо древесины, 14 – вторичный сердцевинный луч 75 Заполнить табл. 4.2. Таблица 4.2. Первичное и вторичное строения стебля двудольных растений Система тканей Первичное строение Вторичное строение Покровная ткань Первичная кора Центральный цилиндр Задание 5. Рассмотреть видоизменение стебля на временном микропрепарате поперечного среза корневища ландыша (Convallaria majalis). Последовательность работы. Сделать поперечный срез корневища ландыша, окрасить флороглюцином в соляной кислоте. При изучении препарата поперечного среза корневища ландыша видно, что снаружи он покрыт перидермой, под которой располагается первичная кора. Первичная кора дифференцирована. Внутренний ее слой образован эндодермой. Все 76 проводящие пучки собраны в центре органа. Вполне концентрические лишь немногие из них, лежащие в самом центре и окруженные со всех сторон основной паренхимой. Ксилема, состоящая из крупных паренхимных клеток с толстыми стенками, окрашенными в малиновый цвет, расположена кольцом на периферии пучка. Ткань, заключенная в середине пучка, – флоэма. В ней можно различить более крупные клетки – ситовидные трубки, а между ними мелкие клетки с густым содержимым – клетки-спутницы. Схематично зарисовать сектор поперечного среза корневища ландыша и сделать обозначения. Рис. 4.5. Поперечный срез корневища ландыша: 1 – перидерма, 2 – первичная кора, 3 – эндодерма, 4 – амфивазальный концентрический проводящий пучок, 5 – флоэма, 6 – ксилема, 7 – коллатеральный проводящий пучок, 8 – основная паренхима стебля Задание 6 (дополнительное). Рассмотреть и зарисовать вторичное строение стебля голосеменного растения на примере поперечного среза ветки сосны (Pinus sylvestris). Последовательность работы. Сделать поперечный срез стебля сосны, окрасить флороглюцином в соляной кислоте. В центре стебля найти небольшой участок тонкостенных паренхимных клеток сердцевины. К периферии от нее концентрическими слоями располагаются годичные кольца древесины, состоящие из трахеид. Древесина сосны имеет весьма примитивную организацию, т. к. ни сосудов (трахей), ни специализированных механических элементов (либриформа) у хвойных нет. А древесинная 77 паренхима представлена только клетками сердцевинных лучей и выстилающими клетками смоляных ходов. Сердцевинные лучи образованы живыми удлиненными паренхимными клетками, расположенными в один ряд. Одни из них идут от сердцевины до коры (первичные лучи), другие начинаются от какого-либо годичного кольца древесины и иногда не достигают коры (вторичные лучи). Границей между древесиной и вторичной корой является камбий. Вторичная кора состоит из вторичной и первичной. Ситовидные трубки флоэмы сосны не имеют клеток-спутниц и в периферической части флоэмы смяты. Между слоями мелких ситовидных трубок находятся более крупные округлые клетки лубяной паренхимы. Сердцевинные лучи во флоэме состоят из одного ряда клеток, однако более крупных, чем в ксилеме. Снаружи от флоэмы располагаются крупные клетки паренхимы первичной коры, среди которых заметны большие смоляные ходы. Покровная ткань состоит из слоев клеток с тонкими опробковевшими стенками, чередующихся со слоями клеток с толстыми одревесневшими стенками. Схематично зарисовать сектор поперечного среза ветки сосны с вторичным строением и сделать обозначения. Рис. 4.6. Поперечный срез ветки сосны: 1 – пробка, 2 – паренхима первичной коры, 3 – флоэма, 4 – камбий, 5 – древесина, 6 – смоляной ход, 7 – сердцевина, 8 – сердцевинный луч, 9 – лубяная паренхима 78 Глоссарий Годичное кольцо – _____________________________________________________________________ _______________________________________________________________________________________ Мягкий луб – __________________________________________________________________________ Первичная кора – ______________________________________________________________________ Сердцевинный луч – ___________________________________________________________________ _______________________________________________________________________________________ Стела – _______________________________________________________________________________ _______________________________________________________________________________________ Контрольные вопросы 1. Каковы особенности строение флоэмы и ксилемы у хвойных? 2. Каковы особенности строения стебля у однодольных растений? 3. Каковы особенности вторичного строения стеблей покрытосеменных растений? 4. Из каких гистологических элементов состоят сердцевинные лучи? Какую роль они выполняют? 5. С чем связано образование годичных колец в древесине? 4.2. Лабораторная работа № 8. «Анатомия листа однодольных и двудольных растений. Экологическая пластичность анатомии листьев к условиям среды» Цель работы: изучить различные типы морфо-анатомического строения листьев; ознакомиться с экологической пластичностью анатомии листьев к условиям среды. Теоретические сведения. Анатомия листа Лист – боковой вегетативный орган с детерминированным типом роста и сохранением первичного строения на протяжении онтогенеза, выполняющий функции фотосинтеза, транспирации и газообмена. Эпидермис покрывает лист сплошным слоем, регулирует газообмен и транспирацию. Система разветвленных проводящих пучков снабжает лист водой, поддерживает в клетках мезофилла степень оводненности необходимую для нормального хода фотосинтеза и осуществляет отток ассимилятов. Главной тканью листа является мезофилл (хлоренхима), в котором сосредоточены хлоропласты и происходит процесс фотосинтеза. Он занимает все пространство между верхней и нижней эпидермой листа, исключая проводящие пучки и механические ткани. Клетки мезофилла довольно однородны по форме и строению (округлые, слегка вытянутые, с отростками). Протопласт состоит из пристенного слоя цитоплазмы с ядром и многочисленными хлоропластами. Иногда стенки клеток образуют складки, 79 вдающиеся внутрь (складчатый мезофилл), что увеличивает поверхность и позволяет разместить большое число хлоропластов в пристенном слое цитоплазмы. Мезофилл, чаще всего, дифференцирован на два типа – палисадный (столбчатый) и губчатый (рыхлый). В палисадном мезофилле клетки вытянуты перпендикулярно поверхности листа, расположены в один или несколько слоев. Клетки губчатого мезофилла соединены более рыхло, и межклетные пространства в этой ткани могут быть большими по сравнению с объемом самих клеток. Выделяют несколько типов мезофилла: Дорсовентральный – палисадная хлоренхима одно- или многорядная и расположена на верхней стороне листа, а губчатая – на нижней стороне. Изолатерально-палисадный – состоит из одного или нескольких рядов палисадных клеток, расположенных с обеих сторон губчатой хлоренхимы. Изогубчатый – состоит только из губчатой ткани. Изопалисадный – образован только палисадной хлоренхимой. Центрический (радиальный) – образован палисадной паренхимой с радиальной симметрией и с центральной позицией главной жилки. Проводящие пучки в листьях образуют непрерывную систему, связанную с проводящей системой стебля. В листьях обычно пучки закрытые и коллатеральные, размещенные в одной плоскости. Характерным признаком листа является то, что ксилема в нем повернута к морфологически верхней стороне, а флоэма – к морфологически нижней. Мелкие проводящие пучки имеют упрощенное строение. Ксилема обычно включает один – два трахеальных элемента, а флоэма одну ситовидную трубку с клеткойспутницей. Проводящие элементы листа ограничены от клеток мезофилла плотно сомкнутыми обкладочными клетками. Проводящие пучки с окружающими их тканями называют жилками. Механическими тканями листа являются склеренхимные волокна, отдельные склереиды и тяжи колленхимы. Волокна чаще всего сопровождают крупные проводящие пучки. Они окружают проводящие ткани со всех сторон или только сверху и снизу. Колленхима часто присутствует в крупных жилках или по краю листа, предохраняя его от разрыва. Задание 1. Изучить строение листа с дорсовентральным типом мезофилла с использованием постоянного микропрепарата «Лист камелии (Camelia japonica)». Последовательность работы. При малом увеличении микроскопа рассмотреть срез листовой пластинки листа камелии. Снаружи лист покрыт эпидермисом. Между верхним и нижним эпидермисом находится ткань, которая состоит из клеток, содержащих хлорофилл. Это ассимиляционная паренхима ‒ мезофилл или хлоренхима. Между клетками мезофилла на 80 некотором расстоянии друг от друга расположены сосудисто-волокнистые пучки. Обратить внимание на то, что сверху листа располагаются клетки вытянутой формы, плотно сомкнутые, без межклетников, расположены в два слоя. Это столбчатая (палисадная) хлоренхима. Под ней расположены более округлые клетки с крупными межклетниками ‒ губчатая хлоренхима. Листья, у которых мезофилл дифференцирован на столбчатую и губчатую хлоренхиму, называют дорсовентральными. Главная функция нижней стороны листа – газообмен и транспирация. Строение сосудисто-волокнистого пучка рассмотреть на главной жилке, которая занимает почти всю толщу листа от верхней до нижней эпидермы. При малом увеличении хорошо видна мощная ксилема, состоящая из правильных рядов проводящих элементов, которые чередуются с древесинной паренхимой. К ксилеме примыкает флоэма. Отметить, что ксилема обращена к верхней стороне листа, а флоэма – к нижней. Пучок окружен склеренхимой. Выше и ниже пучка расположена колленхима, примыкающая к эпидерме. Это закрытый коллатеральный сосудисто-волокнистый пучок. Схематично зарисовать лист камелии с дорсовентральным типом мезофилла и сделать обозначения. Рис. 4.7. Лист камелии с дорсовентральным типом мезофилла: 1 – верхняя эпидерма, 2 – столбчатая хлоренхима, 3 – губчатая хлоренхима, 4 – клетка с друзой, 5 – склереида, 6 – проводящий пучок, 7 – ксилема, 8 – флоэма, 9 – склеренхима, 10 – нижняя эпидерма, 11 – устьице Задание 2. Изучить строение листа с изолатерально-палисадным дифференцированным типом мезофилла на временном препарате поперечного среза листа фикуса (Ficus elastica). Последовательность работы. Приготовить поперечный срез листа фикуса (поперек прохождения жилки). Вначале рассмотреть в воде. Лист фикуса 81 имеет эпидерму, состоящий из трех слоев клеток. Клетки второго и третьего слоев крупнее клеток наружного слоя, их стенки тонкие, содержимое бесцветное, хлоропластов нет. Они задерживают тепловые лучи и предохраняют ассимиляционную ткань от перегрева, а также накапливают воду. В некоторых клетках внутренних слоев эпидермы, граничащих с мезофиллом верхней стороны листа, встречают гроздевидные образования – цистолиты. На поверхности эпидермы заметен достаточно толстый слой кутикулы. Другое важное отличие структуры листа фикуса – слои клеток столбчатой паренхимы и у верхней, и у нижней эпидермы (изолатеральнопалисадный тип). Окрасить препарат флороглюцином в соляной кислоте и рассмотреть строение проводящего пучка. Обратить внимание на расположение проводящих тканей. Схематично зарисовать участок поперечного среза листа фикуса с изолатерально-палисадным дифференцированным мезофиллом и сделать обозначения. Рис. 4.8. Лист фикуса с изолатерально-палисадным дифференцированным мезофиллом: 1 – верхняя эпидерма, 2 – цистолит (если видно), 3 – столбчатая хлоренхима, 4 – губчатая хлоренхима, 5 – ксилема, 6 – флоэма, 7 – склеренхима, 8 – коллатеральный пучок, 9 – нижняя эпидерма, 10 – устьичный аппарат (если видно) Ответить на вопрос: «В чем отличие столбчатой и губчатой хлоренхимы листа? Чем обусловлено различное расположение этих тканей в мякоти листа?» 82 Задание 3. На временном микропрепарате поперечного среза листа кукурузы (Zea mays) рассмотреть изолатеральный недифференцированный тип мезофилла, отметить особенности строение листа ксерофитов. Последовательность работы. Приготовить поперечный срез листа кукурузы (поперек прохождения жилки). Окрасить флороглюцином в соляной кислоте. При большом увеличении видно, что эпидерма покрыта кутикулой, особенно толстой с нижней стороны. На верхней эпидерме расположены устьица, а среди обычных мелких клеток видны группы из 3–5 и более крупных клеток. Боковые и внутренние стенки этих клеток тонкие, а наружная утолщена и покрыта кутикулой. Это двигательные (моторные, шарнирные) клетки. При уменьшении тургора они спадаются, что способствует свертыванию листа в трубку. Мезофилл состоит из однородных паренхимных клеток (изолатеральный). Проводящие пучки коллатеральные, закрытые и окружены обкладочными клетками. Схематично зарисовать участок поперечного среза листа кукурузы с изолатеральным недифференцированным мезофиллом и сделать обозначения. Рис. 4.9. Лист кукурузы с изолатеральным недифференцированным мезофиллом: 1 – верхняя эпидерма, 2 – моторные клетки, 3 – рыхлый мезофилл, 4 – коллатеральный проводящий пучок. 5 – ксилема, 6 – флоэма, 7 – обкладочные клетки, 8 – нижняя эпидерма Задание 4. На временном препарате поперечного среза хвои сосны обыкновенной (Pinus sylvestris) изучить строение листа с центрическим 83 недифференцированным (складчатым) типом мезофилла, рассмотреть особенности строение листа голосеменных. Последовательность работы. Приготовить поперечный срез хвои сосны. Окрасить флороглюцином в соляной кислоте. Снаружи хвоя покрыта 2-мя слоями клеток – клетки эпидермы и гиподермы. Эпидерма покрыта толстым слоем кутикулы. Клетки эпидермы почти квадратной формы, стенки их сильно утолщены, в углах имеются поровые каналы. Клетки гиподермы состоят из одного, а в углах – из двух–трех слоев клеток, с утолщенными одревесневшими стенками. В углублениях на уровне гиподермы расположены устьица, под которыми имеется большая воздушная полость. Под гиподермой находится мезофилл, состоящий из однородных клеток. Обратить внимание на то, что стенки клеток местами врастают в полость клетки, образуя складки (складчатая хлоренхима). Это значительно увеличивает площадь прилегающего к стенке слоя цитоплазмы с хлоропластами, а следовательно, и ассимилирующую поверхность. Среди мезофилла, ближе к гиподерме располагаются смоляные ходы. На радиальных стенках клеток эндодермы имеются одревесневающие утолщения – пояски Каспари. Проводящие пучки коллатерального типа. Ксилемная часть обращена к плоской стороне листа, флоэмная – к выпуклой. Следовательно, плоская сторона хвои является морфологически верхней, а выпуклая – нижней. Между проводящими пучками расположена механическая ткань – склеренхима. Остальное пространство центральной части занято толстостенными паренхимными клетками – трансфузионная ткань. Зарисовать схематический рисунок поперечного среза хвои сосны и сделать обозначения. Рис. 4.10. Поперечный срез хвои сосны: 1 – эпидерма, 2 – устьичный аппарат, 3 – гиподерма, 4 – складчатый мезофилл, 5 – смоляной ход, 6 – эндодерма, 7 – ксилема, 8 – флоэма, 9 – проводящий пучок, 10 – склеренхима, 11 – трансфузионная ткань 84 Заполнить табл. 4.3. Таблица 4.3. Экологическая пластичность анатомического строения листа Экологическая группа растений Адаптации анатомоморфологического строения По отношению к влаге Ксерофиты Суккуленты Мезофиты Гигрофиты Гидрофиты 85 Тип строения мезофилла По отношению к интенсивности света Светолюбивые Теневыносливые Тенелюбивые Задание 5а (дополнительное). На временном микропрепарате поперечного среза листа кувшинки желтой (Nymphaea luteum) рассмотреть особенности строение листа водного растения. Последовательность работы. Приготовить поперечный срез листа кувшинки желтой. Окрасить флороглюцином в соляной кислоте. Верхняя эпидерма листа, как правило, толстостенная, покрыта хорошо развитой кутикулой. На нижней стороне листа кутикула тонкая или отсутствует. Устьица расположены только в верхней эпидерме. Под эпидермой лежит дифференцированный мезофилл, особенностью которого является наличие многослойной столбчатой хлоренхимы с мелкими клетками и губчатой хлоренхимы с большими межклетниками, образующими воздушные полости (аэренхиму). В мезофилле можно увидеть достаточно крупные механические клетки – астросклереиды. Жилки развиты слабо, особенно мало в них элементов ксилемы. В нижней эпидерме расположены специальные образования – гидропоты. Это многоклеточные образования с извилистыми клеточными стенками и мелкими хлоропластами, которые могут поглощать воду или выделять ее избыток. 86 Схематично зарисовать участок поперечного среза листа кувшинки желтой и сделать обозначения: 1 – верхняя эпидерма, 2 – устьица, 3 – столбчатая хлоренхима, 4 – губчатая хлоренхима, 5 – воздушные полости, 6 – проводящий пучок, 7 – астросклереида, 8 – нижняя эпидерма, 9 – гидропот Рис. 4.11. Поперечный срез листа кувшинки желтой Задание 5б (дополнительное). На временном микропрепарате поперечного среза листа алоэ (Аloe vera) рассмотреть особенности строение листа суккулентов. Последовательность работы. Приготовить поперечный срез листа алоэ. Окрасить флороглюцином в соляной кислоте. На большом увеличении заметно, что клетки эпидермы кутинизированы и покрыты мощным восковым налетом. Углубления, в которых расположены устьица, также засыпаны воском. Под верхней эпидермой расположен очень тонкий слой недифференцированной хлоренхимы, который окружает бесцветную, слизистую сердцевинную ткань – водоносную ткань. На границе обеих тканей лежат расположенные вдоль мелкие проводящие пучки. Снаружи от них находится кажущаяся на поперечном разрезе полулунной и состоящая из нескольких рядов цепочка призматических тонкостенных клеток, которые наполнены очень горьким соком, окрашенным различно (от ярко-желтого, золотисто-желтого до буро-желтого цвета). Это секреторные клетки – алоиновые клетки, находящиеся чуть выше флоэмы. Проводящие элементы развиты слабо, в ксилеме всего несколько трахеид, а во флоэме несколько ситовидных трубок с немногочисленными клетками-спутницами. Среди клеток водоносной ткани можно обнаружить отложения оксалата кальция в виде стилоидов. Зачастую стилоиды разрывают оболочку клетки и создаётся впечатление, что стилоиды находятся в межклетниках. Схематично зарисовать участок поперечного среза листа алоэ с развитой водоносной тканью и сделать обозначения. 87 Рис. 4.12. Поперечный срез листа алоэ: 1 – эпидерма, 2 – восковой налет, 3 – устьице, 4 – хлоренхима, 5 – алоиновые клетки, 6 – проводящий пучок, 7 – водоносная ткань, 8 – стилоид (если видно) Глоссарий Гиподерма – __________________________________________________________________________ Дорсовентральный мезофилл – _________________________________________________________ _______________________________________________________________________________________ Моторные клетки – ____________________________________________________________________ _______________________________________________________________________________________ Палисадная хлоренхима – ______________________________________________________________ Трансфузионная ткань – _______________________________________________________________ _______________________________________________________________________________________ Контрольные вопросы 1. Почему у большинства растений в верхнем эпидермисе листа устьица или отсутствуют или их мало? 2. Каково строение проводящих пучков листа? В чем отличие крупных пучков от мелких? 3. Какова функция двигательных моторных клеток в листе ксерофитов? 4. В чем особенность строения мезофилла хвои? 5. Какие признаки анатомического строения листа свидетельствуют о ксероморфности растения? 88 4.3. Лабораторная работа № 9. «Анатомическое строение корня. Метаморфозы (видоизменения) корней» Цель работы: изучить особенности первичного и вторичного строения корня покрытосеменных растений; рассмотреть различные типы строения метаморфозов корней – корнеплодов. Теоретические сведения Корень представляет собой подземный орган, который служит для закрепления растения в субстрате, поглощения из почвы воды с растворенными в ней солями, часто отложения запасных веществ, синтеза органических веществ, для вегетативного размножения. Корень никогда не несет на себе листьев, поэтому по сравнению с внутренней структурой стебля у корня она относительно проста. Корень по длине можно разделить на несколько участков, имеющих различное строение и выполняющих различные функции. Эти участки называют зонами корня. Выделяют корневой чехлик и следующие зоны: деления, растяжения, всасывания и проведения. Задание 1. Приготовить и рассмотреть временный микропрепарат кончика корня пшеницы (Triticum aestivum) или лука репчатого (Allium cepa), используя технику «давленного» препарата, изучить зоны молодого корня. Последовательность работы. Аккуратно лезвием отрезать кончик от молодого корня пшеницы или лука, длиной около 1 см. Поместить его в смесь воды и реактива Люголя, накрыть покровным стеклом и сверху кусочком фильтровальной бумаги, а затем аккуратно «раздавить» препарат. При малом увеличении микроскопа рассмотреть зоны корня. Корневой чехлик располагается на самом кончике корня и имеет вид колпачка. Он состоит из паренхимных живых клеток, содержащих цитоплазму, ядро, амилопласты с крахмальными зернами (окрасятся реактивом Люголя) и тонкие ослизняющиеся оболочки. Считают, что крахмальные зерна выполняют роль статолитов, определяющих рост корня вниз (положительный геотропизм). Клетки зоны деления, которую прикрывает корневой чехлик, мелкие, изодиаметрические, с тонкими оболочками, густой цитоплазмой и крупными ядрами. В зоне растяжения клетки обычно прекращают делиться и увеличиваются в размерах. Корень в этой зоне прозрачен, что определяется, прежде всего, образованием крупных вакуолей. Наряду с ростом клеток наблюдается их дифференциация. Зона всасывания четко заметна благодаря наличию корневых волосков. Здесь большинство клеток уже полностью дифференцированы. По периферии расположены клетки ризодермы. У некоторых растений не все 89 клетки ризодермы способны образовывать волоски. В этом случае выделяют два типа клеток: трихобласты, образующие волоски, и атрихобласты – клетки, выполняющие защитную функцию. Место, где происходит отмирание корневых волосков, является началом зоны проведения. Она тянется вплоть до корневой шейки и составляет большую часть протяженности корня. На этом участке корня происходит ветвление. Зарисовать кончик корня и сделать обозначения. Рис. 4.13. Зоны роста корня (давленный препарат кончика корня пшеницы): 1 – зона проведения, 2 – зона всасывания, 3 – зона растяжения, 4 – зона деления, 5 – корневой волосок, 6 – корневой чехлик Охарактеризуйте особенности строения и функции корневого чехлика. Теоретические сведения. Первичное строение корня Дифференциация тканей корня происходит в зоне всасывания. По происхождению это первичные ткани, так как они образуются из первичной 90 меристемы конуса нарастания. Поэтому анатомическое строение корня в зоне всасывания называют первичным. У однодольных растений первичное строение сохраняется и в зоне проведения. Здесь лишь отсутствует самый поверхностный слой с корневыми волосками – ризодерма (эпиблема). Защитную функцию выполняет ниже лежащая ткань – экзодерма. В первичном строении корня выделяют три части: ризодерму, первичную кору и осевой (центральный) цилиндр. На первичную кору приходится основная масса первичных тканей корня. Ее клетки накапливают крахмал и другие вещества. Эта ткань содержит многочисленные межклетники, имеющие значение для аэрации клеток корня. Наружные клетки первичной коры, лежащие непосредственно под ризодермой, называются экзодермой. Основная масса коры (мезодерма) образована паренхимными клетками. Самый внутренний слой носит название эндодермы. Это ряд плотно сомкнутых клеток (без межклетников) с утолщенными клеточными стенками – пояски Каспари. Центральный или осевой цилиндр (стела) состоит из проводящих тканей, окруженных одним или несколькими слоями клеток – перициклом. Внутренняя часть центрального цилиндра у большинства растений представлена сложным радиальным сосудисто-волокнистым пучком. Задание 2. Изучить первичное строение корня на временном микропрепарате поперечного среза корня ландыша (Convallaria majalis) или ириса (Iris germanica). Последовательность работы. Сделать поперечный срез корня ландыша или ириса. Окрасить флороглюцином в соляной кислоте. На срезе уже при малом увеличении ясно различаются небольшая внутренняя часть – центральный цилиндр, и наружная первичная кора, покрытая одним слоем клеток с корневыми волосками – ризодермой (эпиблемой). Наружный слой первичной коры – экзодерма, состоит из плотно сомкнутых многоугольных клеток, стенки которых впоследствии опробковевают и выполняют защитную функцию. Затем расположена основная паренхима (мезодерма), составляющая главную массу первичной коры. Внутренний слой первичной коры – эндодерма состоит из одного ряда клеток, с утолщенными радиальными и внутренними стенками – поясками Каспари. Среди этих клеток имеются тонкостенные живые клетки, называемые пропускными. Наружный слой центрального цилиндра – перицикл, состоит из одного ряда паренхимных клеток. Внутренняя часть центрального цилиндра занята полиархным радиальным пучком. Зарисовать первичное строение корня ландыша (или ириса) и сделать обозначения. 91 1 – ризодерма, 2 – экзодерма, 3 – мезодерма, 4 – эндодерма, 5 – пропускная клетка эндодермы, 6 – перицикл, 7 – луч первичной ксилемы, 8 – участок первичной флоэмы, 9 – первичная кора (2–5), 10 – центральный цилиндр (6–8) Рис. 4.14. Поперечный срез корня ландыша (ириса) Теоретические сведения. Вторичное строение корня У двудольных и голосеменных растений уже в раннем возрасте в центральном цилиндре корня между ксилемой и флоэмой появляется камбий, деятельность которого приводит к вторичным изменениям и в конечном итоге формируется вторичная структура корня (рис. 4.15). К центру камбий откладывает клетки вторичной ксилемы, а к периферии – клетки вторичной флоэмы. В результате деятельности камбия первичная флоэма оттесняется кнаружи, а первичная ксилема остается в центре корня. Вслед за изменениями в центральном цилиндре корня происходят изменения в коровой части. Клетки перицикла начинают делиться по всей окружности, в результате чего возникает слой клеток вторичной меристемы – феллогена (пробкового камбия). Феллоген, в свою очередь, делясь, откладывает наружу феллему, а внутрь – феллодерму. Образуется перидерма, пробковый слой которой изолирует первичную кору от центрального цилиндра. В результате вся первичная кора отмирает и постепенно сбрасывается; наружным слоем корня становится перидерма. Клетки феллодермы и остатки перицикла в дальнейшем разрастаются и составляют паренхимную зону, которую называют вторичной корой корня. 92 Рис. 4.15. Переход от первичного строения корня к вторичному: 1 – первичная флоэма, 2 – первичная ксилема, 3 – камбий, 4 – перицикл, 5 – эндодерма, 6 – мезодерма, 7 – ризодерма, 8 – экзодерма, 9 – вторичная ксилема, 10 – вторичная флоэма, 11 – вторичная кора, 12 – феллоген, 13 – феллема Задание 3. Изучить вторичное строение на постоянном микропрепарате поперечного среза корня тыквы (Cucurbita pepo). Последовательность работы. При малом увеличении найти центральный цилиндр с четырьмя лучами первичной ксилемы (тетрархный пучок). Между ними расположены основания четырех крупных открытых коллатеральных проводящих пучков. Эндодерма заметна плохо, так как у ее клеток утолщены лишь радиальные стенки. При большом увеличении видно, что клетки тонкостенной паренхимы, лежащей между ксилемой и флоэмой, разделены тангентальными перегородками, а в некоторых местах внутрь от этого слоя заметны только что образовавшиеся и еще не одревесневшие сосуды. Между ксилемой и флоэмой расположена широкая камбиальная зона, имеющая неровные очертания и состоящая из нескольких рядов довольно мелких клеток таблитчатой формы. Вторичное утолщение связано с заложением и деятельностью камбия. Вторичная ксилема значительно превышает по площади флоэму и лежит ближе к центру. Она представлена крупными сосудами, волокнами и мелкими клетками паренхимы. Вторичная флоэма, находящаяся по периферии камбиальной зоны, представлена ситовидными трубками с простыми горизонтальными ситовидными пластинками, клетками-спутницами и паренхимой. Первичная флоэма 93 расположена на самой периферии пучка, ее ситовидные трубки деформированы. Между проводящими пучками находятся широкие первичные лубодревесные лучи, образованные межпучковым камбием. Крупные паренхимные клетки, образующие лучи, несколько вытянуты в радиальном направлении. С поверхности корень тыквы покрыт перидермой. При малом увеличении схематически зарисовать строение корня, обозначив первичную и вторичную ксилему, первичную и вторичную флоэму, камбий, вторичную кору, перидерму. Зарисовать схематический рисунок вторичного строения корня тыквы и сделать обозначения Рис. 4.16. Поперечный срез корня тыквы: 1 – первичная ксилема (если видна), 2 – вторичная ксилема, 3 – камбий, 4 – первичная и вторичная флоэма, 5 – основная паренхима вторичной коры, 6 – перидерма Сравните первичное и вторичное строение корня, заполнив табл. 4.4. Таблица 4.4. Особенности первичного и вторичного строения корня Система тканей Первичное строение Покровная ткань 94 Вторичное строение Первичная кора Центральный цилиндр Теоретические сведения. Видоизменение корней – корнеплоды При развитии запасающей паренхимы главного корня происходит формирование запасающих корней или корнеплодов. Различают корнеплоды: 1. Монокамбиальные (редька, морковь) – закладывается только один слой камбия, а запасные вещества могут накапливаться либо в паренхиме ксилемы (ксилемный тип – редька), либо в паренхиме флоэмы (флоэмный тип – морковь). В первом случае у таких растений диаметр луба велик и превышает вторичную древесину. Во втором случае, наоборот, луб представлен лишь тонким слоем, а основной диаметр корнеплода занят древесиной. 2. Поликамбиальные – через определенные промежутки времени происходит заложение нового слоя камбия (свекла). Задание 4. Заполнить табл. 4.5 и провести сравнение анатомического строения корнеплодов. 95 Таблица 4.5. Анатомическое строение различных корнеплодов Система тканей Корнеплод моркови Корнеплод редьки Корнеплод свеклы Покровная ткань Особенности проводящих тканей Расположение и особенности запасающей ткани Задание 5 (дополнительное). Приготовить и рассмотреть временный микропрепарат корнеплода с определённым типом заложения камбия и отложением запасных веществ: 1) монокамбиальный: а) флоэмный (поперечный срез корнеплода моркови – Daucus sativus); б) ксилемный (поперечный срез корнеплода редьки – Raphanus sativus); 2) поликамбиальный (поперечный срез корнеплода свеклы – Beta vulgaris). Последовательность работы. Сделать поперечный срез одного из корнеплодов, окрасить их флороглюцином в соляной кислоте. Изучить его строение и отметить особенности заложения камбия и отложения запасных веществ. На поперечном срезе корнеплода моркови под перидермой найти большое кольцо флоэмы. Основная ее масса представлена запасающей паренхимой, а ситовидные трубки образуют небольшие группы. Камбиальная зона хорошо выражена и представлена довольно мелкими клетками. Площадь сечения ксилемы значительно меньше площади флоэмы. В центре расположена диархная первичная ксилема. Немногочисленные сосуды 96 вторичной ксилемы расположены в виде прерывистых радиальных цепочек в запасающей паренхиме. На поперечном срезе корнеплода редьки найти ксилему, занимающую наибольшую часть. В центре расположены мелкие сосуды диархной первичной ксилемы. Вторичная ксилема представлена, главным образом, запасающей паренхимой. Небольшие группы сосудов образуют радиальные цепочки. По периферии камбиальной зоны расположено узкое кольцо вторичной флоэмы. Корень покрыт перидермой. На поперечном срезе корнеплода свеклы найти хорошо выраженные концентрические кольца тканей. Возникновение колец связано с наличием добавочных камбиев, образующихся из перицикла и его производных. Затем рассмотреть в центре корня свеклы диархную первичную ксилему. Между двумя лубодревесными лучами расположены два небольших открытых коллатеральных пучка. Основную массу корня занимает запасающая паренхима, образованная в результате деятельности добавочных камбиев. Многочисленные открытые коллатеральные пучки, представленные небольшим числом сосудов и ситовидных трубок с клетками-спутницами, расположены в виде концентрических колец. Корень покрыт перидермой. Зарисовать схематический рисунок поперечного среза рассмотренного корнеплода и обозначить: 1 – перидерма, 2 – вторичная флоэма, 3 – камбий, 4 – вторичная ксилема, 5 – первичная ксилема Рис. 4.17. Поперечный срез корнеплода ________________ Глоссарий Корневой чехлик – _____________________________________________________________________ Клубенек – ____________________________________________________________________________ Пояски Каспари – ______________________________________________________________________ Трихобласты – _________________________________________________________________________ Эндодерма – ___________________________________________________________________________ 97 Контрольные вопросы 1. В какой зоне корня можно наблюдать первичное строение корня и почему его называют первичным? 2. Какие комплексы тканей можно выделить при первичном строении корня? 3. Каково строение зоны проведения? 4. С чем связан переход корня от первичного ко вторичному строению? 5. Из каких комплексов тканей состоит корень со вторичным строением? 4.4. Примеры тестовых и модульных заданий Примеры тестовых заданий 1. Согласно теории гистогенов, периблема дает начало: а) эпидерме; б) центральному цилиндру; в) первичной коре; г) сердцевине. 2. Корень ветвится: а) эндогенно; б) мезогенно; в) экзогенно; г) по-разному. 3. Вторичное утолщение у лиан достигается за счет: а) разрастания древесины; б) разрастания луба; в) рассечения луба паренхимой; г) рассечения древесины паренхимой. 4. Корни растений, выращенных в водной среде, отличаются: а) отсутствием корневых волосков; б) более ранним развитием корневых волосков; в) наличием корневых волосков на всем протяжении корня; г) формой корневых волосков. 5. Отложение запасных питательных веществ в корнеплодах моркови происходит: а) за счет добавочных камбиальных колец; б) в центральном цилиндре; в) в лубе; г) в перидерме. 6. Лист хвойных содержит: а) столбчатый мезофилл; б) губчатый мезофилл; в) водоносную ткань; г) недифференцированный мезофилл. 7. Крахмалоносное влагалище стеблей некоторых растений — это видоизменение: 98 а) эпидермы; б) эндодермы; в) экзодермы; г) перидермы. 8. Листья водных растений имеют: а) толстую кутикулу; б) фотосинтезирующую эпидерму; в) развитую аэренхиму; г) развитую водозапасающую ткань. 9. Непучковый тип строения стебля возникает вследствие отложения проводящих тканей: а) одним кольцом камбия; б) пучковым и межпучковым камбием; в) только пучковым камбием; г) пучковым и межпучковым камбием, но при условии, что межпучковый камбий формирует мелкие пучки в широких сердцевинных лучах. Примеры заданий для модульного контроля 1. Перечислите особенности строения вегетативных органов: стебля, листа, корня. 2. Укажите функции вегетативных органов: стебля, листа, корня. 3. Схематично нарисуйте непучковый, пучковый и переходной тип строения стебля двудольных растений. 4. Охарактеризуйте сезонные и возрастные изменения вторичной древесины двудольных растений. 5. Что такое «кранц-анатомия»? 6. Проведите сравнение анатомического строения светового и теневого листа. 7. Перечислите функции корневого чехлика. 8. Охарактеризуйте метаморфозы (видоизменения) корней. 9. Дайте определение следующим понятиям: либриформ; гиподерма; пояски Каспари; гидропоты; статолиты; микориза; твердый и мягкий луб; заболонь и ядро; дерматоген (дерматокалиптроген); гетерофиллия. 10. Сравните первичное строение стебля и корня. 99 ПРИЛОЖЕНИЯ Приложение 1. Правила техники безопасности при работе в биологической лаборатории малого практикума по курсу «Анатомия растений» Находясь в лаборатории, необходимо выполнять следующие общие требования и меры предосторожности: 1. Запрещается входить в лабораторию в верхней одежде. 2. Работать в лаборатории только в специальном халате. 3. На каждом лабораторном занятии назначается дежурный, который отвечает за чистоту и порядок в лаборатории во время занятия. 4. Открывать окна можно только по разрешению преподавателя. 5. Запрещается приносить и употреблять в пищу напитки и продукты. 6. Включать и выключать тумблеры на электрическом щитке можно только с разрешения преподавателя. 7. При работе с оборудованием и оптическими приборами в случае обнаружения неисправности приборов, электропроводки или розеток нужно сообщить об этом преподавателю. Запрещается самому производить ремонт. 8. При изготовлении временных препаратов необходимо осторожно обращаться с режущими инструментами и стеклами. В случае нанесения порезов необходимо сообщить об этом преподавателю (для оказания медицинской помощи). 9. Запрещается выбрасывать сломанные предметные и покровные стекла в мусоросборник, осколки необходимо складывать в специальный контейнер. 10. Для работы с фиксированными в спирте объектами необходимо использовать пинцет. 11. По окончании работы следует сдать инструменты и отработанные препараты преподавателю; микроскопы перенести на стол преподавателя; навести порядок на рабочем месте, сдать рабочее место дежурному. При работе с химическими реактивами необходимо соблюдать следующие правила: работу с концентрированными кислотами, щелочами и ядовитыми веществами можно проводить только в вытяжном шкафу; наливать или насыпать реактивы следует только над столом; не следует оставлять открытыми банки с реактивами; пролитые или рассыпанные реактивы нужно немедленно удалить со стола с помощью тряпки и промыть поверхность водой. 100 Приложение 2. Правила ухода за световым микроскопом Микроскоп – сложный и точный прибор. Для того чтобы он хорошо работал долгое время, за ним требуется тщательный уход. 1. Микроскопы защищают от пыли, поэтому их хранят в закрытых шкафах или в чехлах. 2. Переносят микроскоп на рабочее место двумя руками. Одной рукой его берут за тубусодержатель, другой – поддерживают основание. Прибор нельзя резко двигать, трясти и с силой ставить на стол. 3. При затруднении в работе механических частей микроскопа (револьвера, винтов и т. д.) нельзя применять силу. Запрещается также снимать револьвер и раскручивать объективы. В подобных случаях следует воспользоваться помощью специалиста. 4. Особого тщательного ухода требует оптическая система. Линзы объективов и окуляра предохраняют от механических повреждений (ударов, царапин), пыли, от соприкосновения с химическими веществами – кислотами, щелочами, растворителями, красителями, которые применяют для приготовления препаратов. 5. Недопустимо прикасаться к линзам пальцами, протирать их бумагой, так как даже мельчайшие пятна и царапины сильно ухудшают оптические свойства микроскопа. Оптические стекла следует протирать без всякого нажима кусочками мягкой хлопчатобумажной ткани (или бинтом), которые должны храниться в закрытой от пыли банке. При сильном загрязнении оптики ткань слегка смачивают бензином или смесью спирта с эфиром. 6. Оптику и предметный столик особенно тщательно протирают после работы перед тем, как поставить прибор в шкаф. 101 КАРТА УСПЕВАЕМОСТИ студента 1-го курса биологического факультета по курсу «Анатомия растений» уч. год 20__/20__ Фамилия, имя группа № Баллы получе max нный Раздел 1. Растительная клетка 25 1.1 Выполнение лабораторных работ 15 1.2 Контрольная работа (тесты) 10 2. Растительные ткани 15 2.1 Выполнение лабораторных работ 5 2.2 Контрольная работа (таблица) 10 3. Вегетативные органы растений 30 3.1 Выполнение лабораторных работ 20 3.2 4. 5. Контрольная работа («немые рисунки») Самостоятельная работа (выполняется по желанию) - ИНИЗ Дата Подпись преподавате ля 10 10 Итоговая контрольная работа 20 Всего: 100 Шкала оценивания: Сумма баллов за все виды деятельности на протяжении семестра Оценка по национально й шкале (для зачета) 90 – 100 Дата 80-89 70-79 Итоговая оценка Подпись преподавателя зачет 60-69 Внимание! За несвоевременную сдачу и выполнение теоретической и практической частей по неуважительным причинам предполагается снятие 50 % от максимального количества баллов. 50-59 1-49 не зачет 102 ЛИТЕРАТУРА 1. Атлас по анатомии растений. Растительная клетка, ткани, органы / А. Г. Сербин, Л. С. Картмазова, В. П. Руденко, Т. Н. Гонтовая. – Харьков : Колорит, 2006. – 86 с. 2. Барыкина Н. П. Справочник по ботанической микротехнике. Основы и методы / Н. П. Барыкина, Т. Д. Веселова, А. Г. Девятов и др. – М. : МГУ, 2004. – 312 с. 3. Брайон О. В. Анатомія рослин / О. В. Брайон, В. Г. Чикаленко. – К. : Вища школа, 1992. – 272 с. 4. Бетехтина А. А. Микротехнические исследования на базе современного оборудования. Руководство к практическим занятиям [Электронный ресурс] / А. А. Бетехтина, И. А. Уткина. – Екатеринбург : Из-во УГУ, 2008. – 110 с. – Режим доступа : elar.usu.ru/bitstream/1234.56789/1570/5/1334882_guide.pdf 5. Гончаренко І. В. Будова рослинного організму / І. В. Гончаренко. – Суми: ВТД «Університетська книга», 2004. – 200 с. 6. Красільнікова Л. О. Анатомія рослин. Рослинна клітина, тканини, вегетативні органи : підручник / Л. О. Красільнікова, О. О. Авксентьєва, Ю. О. Садовніченко. – Х. : ХНУ імені В. Н. Каразіна, 2013. – 260 с. 7. Лотова Л. И. Словарь фитоанатомических терминов / Л. И. Лотова, М. В. Нилова, А. И. Рудько. – М. : Издательство ЛКИ, 2007. – 112 с. 8. Лотова Л. И. Ботаника: Морфология и анатомия высших растений / Л. И. Лотова. – М. : Книжный дом «ЛИБРОКОМ», 2010. – 512 с. 9. Лотова Л. И. Сравнительная анатомия высших растений / Л. И. Лотова, А. К. Тимонин. – М. : Изд-во Моск. ун-та, 1989. – 80с. 10. Панюта О. О. Анатомія рослин / О. О. Панюта, О. П. Ольхович. – К. : Рода, 2009. – 272 с. 11. Панюта О. О. Анатомія рослин: зошит для лабораторних занять / О. О. Панюта, О. П. Ольхович, А. В. Капустян. – Київ : Фітосоціоцентр, 2008. – 147 с. 12. Curtis J. D. Photographic. Atlas of Plant anatomy [Electronic Resource] / J. D. Curtis, N. R., Lersten M. D. Nowak. – Way of access: botweb.uwsp.edu/anatomy. 103 Навчальне видання Юхно Юлія Юріївна Авксентьєва Ольга Олександрівна Анатомія рослин: протоколи практичних занять 2-ге видання (Рос. мовою) Коректор Л. Є. Стешенко Відповідальний за випуск О. А. Авксентьева Комп'ютерний набір та верстка Ю. Ю. Юхно Макет обкладинки І. М. Дончик Формат 60×84/16. Умов. друк. арк. 5,12 Тираж 100 пр. Зам. № Видавництво ХНУ імені В. Н. Каразіна 61022, Харків, майдан Свободи, 4 Харківський національний університет імені В. Н. Каразіна Свідоцтво суб’єкта видавничої справи ДК №3367 від 13.01.2009 р. Тел. 705-24-32 Надруковано з готових оригінал-макетів у друкарні ФО-П Коротчаєва І. О. 61103, м. Харків, вул. Двадцять третього серпня, 63, кв. 33 Свідоцтво про реєстрацію АВ №505751 від 09.07.2013 104