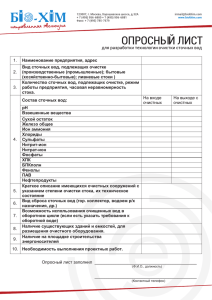
Практическая работа №1.
advertisement

БИОЛОГИЯ С ОСНОВАМИ ЭКОЛОГИИ Номер варианта выбирается исходя из номера зачетной книжки. Последняя цифра номера книжки должна соответствовать номеру варианта. Цифра 0 соответствует варианту 10. Практическая работа №1. Осмос Цель работы: решить задачи. Все процессы жизнедеятельности любого организма представляют собой совокупность химических реакций, протекающих в водном растворе. А для водных растворов, разделенных полупроницаемой оболочкой, характерно такое явление как осмос. Физиологические процессы, в основе которых лежат осмотические явления, имеют большое значение в жизни любого организма. В частности, эти процессы обуславливают поступление воды в клетки и передвижение воды между ними, определяют упругость тканей, рост клеток на фазе растяжения. С явлением осмоса связано открывание и закрывание устьиц листьев растений, и более того, благодаря явлению осмоса вообще возможна жизнь растения, поскольку осмос является главной движущей силой, обеспечивающей поступление воды в корневые волоски, и передвижение воды и питательных веществ по растению. Сила, обуславливающая осмос, называется осмотическим давлением раствора. Величина осмотического давления зависит от ряда условий и подчиняется связям, которые выражаются формулой: P = RTCI, где P - осмотическое давление, атм; R – газовая постоянная, равная 0,082 л·атм/град·моль; T - температура, °К; C – концентрация, моль; I – изотонический коэффициент, величина которого зависит от концентрации вещества и степени его диссоциации (таблица). Для недиссоциирующих веществ в разбавленных растворах он равен 1. Таблица Концентрация солей, моль 0.00 0.01 0.02 0.03 0.05 0.1 0.2 0.3 0.4 0.5 0.6 5 Хлористый натрий – NaCl 1.96 1.94 1.92 1.92 1.88 1.85 1.81 1.79 1.77 1.75 1.74 Хлористый калий – KCl 1.96 1.95 1.93 1.92 1.90 1.87 1.84 1.82 1.81 1.79 1.78 Азотнокислый калий – KNO3 1.96 1.94 1.92 1.92 1.88 1.83 1.79 1.76 1.74 1.71 1.70 Хлористый кальций – CaCl2 2.86 2.80 2.76 2.72 2.62 2.54 2.48 2.42 2.36 2.30 2.28 Азотнокислый кальций – Ca(NO3)2 2.84 2.76 2.72 2.68 2.58 2.48 2.40 2.34 2.26 2.18 2.14 Сернокислый магний – MgSO4 1.77 1.69 1.65 1.61 1.52 1.45 1.42 1.39 1.35 1.32 1.31 0.7 0.8 0.9 1.0 1.73 1.71 1.70 1.69 1.78 1.77 1.77 1.67 1.68 1.67 1.65 1.64 2.26 2.22 2.20 2.18 2.10 2.08 2.04 2.00 1.30 1.27 1.26 1.26 Осмотическое давление при неизменном объеме и постоянной температуре зависит только от числа молекул растворенного вещества, но не зависит ни от природы растворенного вещества, ни от природы растворителя, отсюда следует, что осмотическое давление раствора, содержащего несколько веществ, равно сумме осмотических давлений, создаваемых каждым веществом в отдельности. Благодаря зависимости между молярной концентрацией раствора и его осмотическим давлением можно по величине осмотического давления вычислить молекулярные массы многих веществ. Непосредственное измерение осмотического давления представляет довольно большие трудности, но в этом и нет настоятельной необходимости. Осмотическое давление тесно связано с некоторыми другими свойствами разбавленных растворов, сравнительно легко поддающимися измерению, а именно: с понижением давления пара, понижением температуры замерзания, повышением температуры кипения. Определив любую из этих величин, можно по ней рассчитать и осмотическое давление раствора. Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если взять два раствора с разной концентрацией, то раствор с большей концентрацией по отношению к раствору с меньшей концентрацией будет являться гипертоническим, а раствор с меньшей концентрацией по отношению к раствору с большей концентрацией – гипотоническим. При погружении клетки в гипертонический раствор из нее отсасывается вода, клетка снимается, а при погружении в гипотонический раствор клетка увеличивается в размерах, и при отсутствии достаточно прочной оболочки может лопнуть. Таким образом, при помещении клетки в гипотонический раствор, последняя как бы проявляет “сосущую силу” с помощью которой она извлекает из окружающей среды воду. Величина сосущей силы клеток определяется по соотношению: S = P – T, где S - сосущая сила, а T – противодавление оболочки клетки (тургорное давление). При потери тургора противодавление оболочки равно нулю и сосущая сила равна осмотическому давлению. При полном тургоре, когда клетка насыщена водой полностью, сосущая сила равна нулю. При помещении растительной клетки в гипертонический раствор происходит отток воды из клетки, что сначала приводит к снижению тургора, а затем и к отслоению эластичной протоплазмы от клеточной стенки. Это явление называется плазмолизом. Методом плазмолиза можно определить концентрацию клеточного сока и его осмотическое давление. Явление плазмолиза можно наблюдать в микроскоп. 1. Имеется раствор глюкозы с концентрацией 25г в 300 мл. Температура в помещении 23°С. Какова величина осмотического давления раствора? 2. В колбе находится раствор хлористого кальция с концентрацией 0,15 моль. Температура в помещении повысилась с 17 до 21°С. На сколько процентов изменилось осмотическое давление в растворе? 3. Клеточный сок корневых волосков представляет собой раствор глюкозы с концентрацией 0,24 моль. В каких пределах меняется величина осмотического давления сока в течение суток при колебаниях температуры от 9 до 22°С? 4. В колбе налито 105 мл раствора, в котором содержится 0,37 г сахарозы и 0,27 г NaCl. В раствор добавили 0,23 г CaCl2. Температура в лаборатории 24°С. На сколько процентов изменилось осмотическое давление раствора по отношению к начальному? 5. Осмотическое давление в корневых волосках равно 7,3 атм. Концентрация почвенного раствора имеет 0,18 моль. Будет ли вода поступать в корни? 6. В колбу налили раствор сахарозы с концентрацией 0,2 моль. Затем с помощью фермента инвертазы было гидролизовано 16% сахара. Каким было и стало осмотическое давление раствора в колбе? Температура в лаборатории 23°С. 7. Осмотическое давление клеточного сока в листьях кукурузы составляет 0,1 атм. Сколько граммов крахмала потребуется гидролизовать до глюкозы, чтобы при понижении температуры с 25 до 5°С величина осмотического давления в клетках не изменилась? Осмотическое давление растительной клетки определяется осмотическим давлением в вакуоли. Объем вакуоли в клетках листьев кукурузы равен 0,002 мм3. 8. В 1 мл воды растворили 80 мг белка. Осмотическое давление составило при 25°С 12 мм рт. ст. Каков молекулярный вес белка? 9. Почему глюкоза запасается в виде гликогена, а не мономера? 10. Какова причина сходства первичной структуры белка у разных организмов? Варианты Варианты Номера задач 1 1, 10 2 2, 9 3 3, 8 4 4, 7 5 5, 6 6 6, 1 7 7, 2 8 8, 3 9 9, 4 10 10, 4 Практическая работа №2. Живая клетка Цель работы: изучить структурные особенности, провести сравнительный анализ эукариотных и прокариотных клеток. Все, что занимает пространство и обладает массой, называют веществом. Различают косное вещество и «живое вещество». Любое вещество состоит из одного или нескольких химических элементов. Четыре элемента – углерод, водород, азот и кислород – составляют более 95% массы живой клетки. Клетка – структурно-функциональная единица организма. Клетки различаются по форме, строению, функциям. Имеются клетки плоские, шарообразные, кубические, пирамидальные, звездчатые. Размеры их самые разные: от нескольких микрометров (малый лимфоцит) до 200 микрометров (яйцеклетка). В состав любой клетки входит оболочка, цитоплазма и наследственный аппарат, снова которого ДНК. Последняя расположена либо в обособленном от цитоплазмы клеточном ядре, либо непосредственно в цитоплазме. В связи с этим различают два основных типа клеток: содержащие ядро — эукариотные клетки и безъядерные — прокариотные клетки. Почти все прокариоты и часть эукариот — это одноклеточные организмы. Например, амебы состоят всего из одной клетки, выполняющей все основные характерные для целого организма функции. Абсолютное большинство видов эукариот — многоклеточные организмы, представляющие собой ассоциации разнообразных клеток, формирующих ткани. По морфофункциональным признакам у животных выделяют четыре основных типа тканей: эпителиальную, соединительные, мышечные и нервные. Ткани растений – покровная, образовательная, основная, механическая и проводящая. В биохимии принято массы атомов и молекул выражать в единицах массы изотопа углерода 12С, атомный вес которого принят равным 12. Масса одного атома 12С равна в точности 12 дальтонам, а 1 дальтон равен 1,661 ·10-24 г. Массы молекул выражают в дальтонах, и численно они равны молекулярной массе. Дальтоны удобно использовать в случае таких структур, как хромосомы, рибосомы, митохондрии, вирусы и целые клетки, к которым не применим термин “молекулярная масса”. Эукариотные клетки Средние размеры эукариотных клеток в три раза больше размеров клеток прокариот. Диаметр большинства клеток от 1 до 10мкм. - Клеточная оболочка (плазматическая мембрана) непосредственно взаимодействует с внешней средой или с соседними клетками. Основная часть клеточной оболочки – плазматическая мембрана, ее толщина 9-10 нм. - Цитоплазма представляет собой вязкоупругий гель, содержащий соли, белки, другие органические соединения и структурные компоненты. Обязательные компоненты цитоплазмы – клеточные органеллы. Отсутствие цитоскелета, нет движений цитоплазмы, эндоцитоза и экзоцитоза. Каждый тип органелл имеет определенное строение и выполняет специфические функции. Цитоплазма разделена клеточными мембранами на относительно автономные отсеки, что создает возможность одновременного осуществления разнонаправленных биохимических процессов. Кроме этого, в ограниченном объеме процессы обмена веществ идут более интенсивно. Временные компоненты цитоплазмы — включения — могут накапливаться в больших количествах или полностью исчезать. Митохондрии — органеллы эукариотной клетки, синтезирующие АТФ, имеют палочковидную, нитевидную или округлую форму, их длина 0,3—5,0, ширина 0,2—1,0 мкм. Митохондрии живут 5—10 сут., размножаются поперечным делением. Их количество в клетке колеблется от нескольких штук до нескольких тысяч. Например, в клетках печени содержится до 2500 митохондрий. Рисунок 1 - Схематическое изображение животной клетки, цифрами отмечены некоторые субклеточные компоненты: (1) ядрышко, (2) клеточное ядро, (3) рибосома, (4) везикула, (5) шероховатый эндоплазматический ретикулум (ЭР), (6) аппарат Гольджи, (7) цитоскелет, (8) гладкий ЭР, (9) митохондрия, (10) вакуоль, (11) цитоплазма, (12) лизосома, (13) центриоль Рибосомы и эндоплазматическая сеть. Рибосомы на электронограммах имеют вид плотных гранул, на них происходит заключительный этап синтеза белка — его сборка из аминокислот. Основные компоненты рибосом — рибосомная РНК и белки. Каждая рибосома состоит из двух субъединиц — большой и малой. Отдельные рибосомы функционально неактивны и работают лишь в комплексе из нескольких рибосом, называемом полисомой. Полисомы могут свободно лежать в цитоплазме и быть связаны с мембранами эндоплазматической сети. На свободно лежащих полисомах синтезируется основная масса белков, используемых в самой клетке. На полисомах, связанных с эндоплазматической сетью, синтезируются белки, предназначенные для выведения за пределы клетки. Эндоплазматическая сеть (эндоплазматическии ретикулум, ЭР) представляет собой систему взаимосвязанных мембранных полостей в виде канальцев, пузырьков или более крупных полостей — цистерн. К наружной поверхности мембраны могут быть прикреплены рибосомы, этот отдел ЭР называют гранулярным. В ЭР происходят синтез липидов, стероидов, реакции углеводного обмена. Еще одна важная функция ЭР заключается в транспорте веществ из одного участка клетки в другой. Пластинчатый комплекс Гольджи — система полостей в виде уплощенных мешочков (цистерн), образующихся из агранулярного ЭР, ограниченных мембранами и расположенных группами вокруг ядра. От полостей отходят трубочки, на их концах располагаются крупные и мелкие пузырьки. Сюда по ЭР поступают белки, скапливаясь в пузырьках, которые затем отрываются от трубочек. Белки используются клеткой или выводятся наружу. Участие комплекса Гольджи в процессах секреции — одна из важных его функций. Поступив туда, секретируемые продукты уплотняются, приобретая вид гранул, и окружаются мембранами, накапливаются, а затем перемещаются к плазмалемме, и их содержимое выделяется за пределы клетки. Лизосомы — мембранные органеллы округлой или овальной формы различного размера содержат набор гидролитических ферментов — гидролаз, действующих при кислых значениях рН. Лизосомные гидролазы способны расщеплять все основные соединения клетки — белки, нуклеиновые кислоты, углеводы, липиды и др. В норме мембраны лизосом препятствуют проникновению гидролаз в цитоплазму, предохраняя клетку от саморазрушения. Микротрубочки присутствуют во всех клетках, однако их размеры обнаруживаются лишь при помощи электронного микроскопа. Стенка каждой трубочки состоит из спиралеобразно закрученных фибрилл. Фибрилла — ряд бусообразно соединенных белковых глобул. Микротрубочки представляют собой крайне динамичную структуру: они могут распадаться на составляющие их комплексы и вновь собираться. Микротрубочки участвуют в перемещении и запасании различных веществ в полостях трубчатых образований, выполняют опорные функции, формируют цитоскелет. Микроворсинки – тонкие выросты клеточной поверхности. Микроворсинки существенно увеличивают площадь поверхности клетки и ускоряют связанные с этим процессы, например, всасывание. Ядро клетки выполняет функции хранения, воспроизведения и передачи закодированной в ДНК наследственной информации. Различают два состояния ядра: ядро неделящейся клетки — интерфазное и делящееся ядро. Интерфазное ядро обеспечивает процессы синтеза белков, делящееся — увеличение количества клеток и равное распределение в них наследственной информации. Геном представляет из себя, как правило, одну кольцевую ДНК. Хроматин и хромосомы. Нитевидные структуры в ядрах эукариотных клеток, названные хромосомами (от греч. chroma — цвет, окраска, soma — тело), открыты в 80-х годах XIX в. Этим термином подчеркнуто сильное сродство хромосом к клеточным красителям. В течение последующих десятилетий было показано, что именно хромосомы служат материальными носителями наследственности.Хромосомы четко видны во время деления клетки, однако факт непрерывности их существования и в неделящихся ядрах сомнений не вызывает. Ядрышки. В ядре находятся мелкие округлые образования — ядрышки, в них происходит биогенез рибосом. Ядрышко окружено хроматином, часть которого заходит в глубь ядрышка. Размер ядрышек зависит от их активности — интенсивности синтеза рРНК, скорости транспорта субъединиц рибосом в цитоплазму. Ядерная оболочка — единственная мембранная структура ядра. Основные функции ядерной оболочки состоят в разграничении ядерного и цитоплазматического пространства, выработке энергии, фиксации хромосом, участии в транспорте веществ. Прокариотные клетки Средние размеры прокариот 0,5—3 мкм, а самых мелких форм (микоплазмы) — 0,10— 0,15 мкм. Гигантские клетки некоторых серобактерий достигают 100 мкм в длину, клетки спирохет — 250 мкм. - Генетический материал (генофор) прокариот представлен единственной кольцевой молекулой двухцепочечной ДНК, закрепленной на цитоплазматической мембране, одевающей клетку. - Цитоплазма и клеточная оболочка. У прокариот нет эндоплазматического ретикулума (иногда имеются впячивания поверхностной мембраны — мезосомы), митохондрий, пластид и других цитоплазматических органелл, свойственных эукариотам. В прокариотных клетках функции митохондрий выполняет плазматическая мембрана. Цитоскелет из белковых волокон; эндоцитоз и экзоцитоз. Микротрубочки у прокариот отсутствуют, поэтому у них нет веретена деления, центриолей и жгутиков, построенных из микротрубочек. Жгутик прокариот (флагелла) — это особое образование, лишенное микротрубочек и состоящее из специального, свойственного лишь прокариотам белка — флагеллина. Строение типичной клетки прокариот: капсула, клеточная стенка, плазмалемма, цитоплазма, рибосомы, плазмида, пили, жгутик, нуклеоид. Таблица 1 - Сравнение прокариотных и эукариотных клеток Структура клетки Размер клеток Цитоплазма Ядро Клеточная оболочка (мембрана) Геном Рибосомы Эндоплазматическая сеть Митохондрии Комплекс Гольджи Микротрубочки Лизосомы Пластиды Центриоли Прокариоты: бактерии и цианобактерии Эукариоты: протисты, грибы, растения, животные Вакуоли Клеточная стенка Клеточная организация (одноклеточные, многоклеточные) Практическая работа №3. Дыхание Цель работы: решить задачи. Превращение веществ при дыхании обычно характеризуется схемой: С6Н12О6 + 6О2 = 6СО2 + 686 ккал (2822 кДж) + 6Н2О. Интенсивность дыхания характеризуется несколькими величинами: а) количеством углекислого газа, выделяемого за единицу времени на единицу массы организма, например, мг СО2 /ч/г; б) количеством кислорода, поглощенного за единицу времени на единицу массы, например, мг О2/ч/г; в) количеством органического вещества, израсходованного на дыхание за единицу времени на единицу массы, например, г сухого вещества/ч/г; г) величиной потери массы дышащего материала за единицу времени на единицу массы. 1. В процессе дыхания прорастающие семена пшеницы выделили 780 мг углекислоты. Сколько было окислено глюкозы, сколько кислорода было потреблено и сколько кал энергии выделено? 2. 195 г зерен кукурузы влажностью 14,7% поставили на проращивание в темноте для определения интенсивности дыхания. Через некоторое время семена и проростки высушили и взвесили. Их сухая масса оказалась равной 154,9 г. Сколько кал энергии было выделено в процессе дыхания, если считать, что все потери в массе произошли за счет распада крахмала в глюкозу? Сколько при этом было поглощено кислорода? 3. На хранение заложено 1250 кг клубней картофеля. За 250 ч они выделили в процессе дыхания 950 мг углекислоты. На сколько процентов уменьшилась масса клубней за 35 сут хранения? 4. Сколько граммов АТФ будет образовано при гликолизе 96 г глюкозы до пировиноградной кислоты, и сколько при полном окислении в процессе дыхания? 5. Известно, что на образование 1 моля АТФ тратиться 30,5 кДж энергии. Молекулярная масса АТФ равна 507. Взрослый человек с массой 70 кг в среднем содержит одновременно 50 г АТФ и расходует на поддержание своей жизни в сутки в среднем 10000 кДж энергии. Рассчитайте, сколько раз в сутки успевает обернуться одна молекула АТФ? 6. С подвергаемых дыхательному расщеплению молекул на кислород каждую минуту переходит во всех митохондриях тела человека количество электронов равное току в 76 А. Оцените общую энергетическую мощность тела человека, если перепад значения окислительно-восстановительного потенциала в дыхательной цепи равен 1,13 в. Варианты Варианты 1 2 3 4 5 Номера задач 1, 2 2, 3 3, 4 4, 5 5, 6 6 7 8 9 10 6, 1 1, 3 2, 4 3, 5 4, 6 Практическая работа №4. Фотосинтез Цель работы: решить задачи. Фотосинтез — это превращение зелеными растениями и фотосин-тезирующими микроорганизмами лучистой энергии Солнца в энергию химических связей органических веществ. От фотосинтеза зависит вся жизнь на Земле. В процессе фотосинтеза растение вырабатывает из неорганических веществ необходимые для всего живого органические вещества. Фотосинтез — единственный биологический процесс, который идет с увеличением свободной энергии и прямо или косвенно обеспечивает доступной химической энергией все земные организмы (кроме хемосинтезирующих). Ежегодно в результате фотосинтеза на Земле образуется около 150 млрд. т органического вещества, усваивается 300 млрд. т СО2 и выделяется около 200 млрд. т свободного О2. Благодаря фотосинтетической деятельности первых зеленых организмов в первичной атмосфере Земли появился кислород, возник озоновый экран, создались условия для биологической эволюции. Фотосинтез является единственным источником атмосферного кислорода. Процесс фотосинтеза является основой питания всех живых существ, а также снабжает человечество топливом (древесина, уголь, нефть), волокнами (целлюлоза) и бесчисленными полезными химическими соединениями. Из диоксида углерода и воды, связанных из воздуха в ходе фотосинтеза, образуется около 90-95% сухого веса урожая. Остальные 5-10% приходятся на минеральные соли и азот, полученные из почвы. Человек использует около 7% продуктов фотосинтеза в пищу, в качестве корма для животных и в виде топлива и строительных материалов. Фотосинтез происходит с участием поглощающих свет пигментов (хлорофилл и др.). В процессе фотосинтеза из диоксида углерода (СО2) и воды (Н2О) образуется органическое вещество — глюкоза (С6Н12О6), являющаяся не только важным источником энергии, но и строительным материалом многих органических веществ. Ее углеводородные компоненты входят во все молекулярные структуры живого: углеводы, липиды, белки и нуклеиновые кислоты. В их создании могут принимать участие и другие элементы — О, N, S, Р, но основой являются С—С- и С—Н-связи. Возможное разнообразие органических молекул бесконечно, этим определяется и разнообразие живых организмов. Диоксид углерода, содержащийся в воздухе, проникает в лист через устьица — особые отверстия в эпидермисе листа; вода и минеральные вещества поступают из почвы в корни и отсюда транспортируются к листьям по проводящей системе растения. Световая энергия, необходимая для синтеза органических веществ из неорганических, поглощается хлорофиллом. В клетке синтез органических веществ протекает в хлоропластах, содержащих хлорофилл. Свободный кислород, образующийся в процессе фотосинтеза, выделяется в атмосферу. Энергия химических связей пищевых веществ первично образуется в процессе фотосинтеза и сопряженных с ним реакциях. Таким образом, кинетическая энергия солнечного излучения преобразуется в потенциальную энергию, запасенную глюкозой. Из глюкозы вместе с получаемыми из почвы минеральными элементами питания — биогенами — образуются все органические компоненты растений—белки, углеводы, жиры, липиды, ДНК, РНК. Продуцировать органическое вещество могут также некоторые бактерии за счет энергии, образующейся при окислении неорганических соединений, например аммиака, железа или серы (в глубоких океанических впадинах, куда не проникает солнечный свет, но скапливается сероводород). Эти организмы называют хемосинтетиками. Фото- и хемосинтетики, создающие органические вещества из неорганических с помощью энергии окружающей среды, называют автотрофами. Запасенная ими потенциальная энергия обеспечивает существование остальных видов (гетеротрофов). Фотосинтез зеленых растений протекает в две стадии: первая из них объединяет световые реакции, идущие только тогда, когда растение освещено, а вторая - темновые реакции, которые могут происходить как в темноте, так и на свету. Кислород, образующийся при фотолизе воды, является побочным продуктом фотосинтеза. Он может использоваться дальше растительными клетками для дыхания или выделяться в биосферу. Накопленная в ходе световой фазы фотосинтеза энергия в форме АТФ используется клеткой для синтеза углеводов в темновых реакциях фотосинтеза из СО2 и Н2О. Темновые реакции начинаются в хлоропласте и продолжаются в цитозоле. Хотя эти реакции зависят от продуктов световых реакций, их называют темновыми, поскольку они не требуют прямого участия света. Расход энергии продуктов световых реакций фотосинтеза (АТФ) в цепи темновых реакций, получивших название цикл Кальвина, приводит к образованию из СО2трехатомного сахара – глицеральдегид-3-фосфата. Из последнего могут образоваться жирные кислоты, аминокислоты, крахмал, в цитоплазме он быстро превращается в результате обратного протекания некоторых реакций гликолиза в производные глюкозы и фруктозы, из которых образуется сахароза. Если объединить реакции световой и темновой фазы, исключив промежуточные этапы, то получим всем хорошо известное суммарное уравнение процесса, фотосинтеза: 6СО2 + 6Н2О + 686 ккал (2822 кДж) = С6Н12О6 + 6О2. При сравнении объемов газов, участвующих в фотосинтезе, их необходимо приводить к нормальным условиям давления и температуры (0°С и 760 мм рт.ст.), используя уравнение Менделеева-Клапейрона: PV = RT. Для решения задач этого раздела нужно вспомнить следующие понятия: 1. Уравнение фотосинтеза. 2. Уравнение Менделеева-Клапейрона . Задачи 1. В течение года в процессе фотосинтеза все растения на земном шаре связывают 1,75·1011 т, а растения суши –2·1010 т углерода. Какие растения и сколько выделяют кислорода и сколько Дж солнечной энергии они связывают? 2. Интенсивность фотосинтеза составляет 2,4 мг СО2/дм2/ч. Сколько органических веществ в пересчете на глюкозу будет синтезировано за 5 ч листьями площадью 1600 см2. 3. Почему глубоководные растения имеют окраску, отличную от зеленой? 4. Для определения влияния на фотосинтез возраста растения был поставлен следующий опыт. В один из дней было определено, что в единицу времени на единицу массы листа растения было усвоено 9,03 г углекислого газа при температуре16°С и давлении 782 мм рт.ст. В следующее измерение, проведенное через несколько дней было установлено, что в единицу времени с единицы массы листа растение выделило 4,07 л кислорода при температуре 21°С и давлении 743 мм рт.ст. Изменилась ли с возрастом интенсивность фотосинтеза? 5. Каковы механизмы и связь между световой и темновой стадией фотосинтеза? Варианты Варианты 1 2 3 4 5 6 7 8 9 10 Номера задач 1, 2 2, 3 3, 4 4, 5 1,5 2,4 3,1 2,5 3,5 4,1 Практическая работа №5. Молекулярные основы жизни Цель работы: решить задачи. Генетический код ДНК Первое основание А мРНК У Г Ц Т А Ц Г А У УУУ-фен УУЦ-фен УУА-лей УУГ-лей ЦУУ-лей ЦУЦ-лей ЦУА-лей ЦУГ-лей АУУ-илей АУЦ-илей АУА-илей АУГ-мет ГУУ-вал ГУЦ-вал ГУА-вал ГУГ-вал Второе основание Г Т Ц А УЦУ-сер УАУ-тир УЦЦ-сер УАЦ-тир УЦА-сер УАА-стоп УЦГ-сер УАГ-стоп ЦЦУ-про ЦАУ-гис ЦЦЦ-про ЦАЦ-гис ЦЦА-про ЦАА-глутн ЦЦГ-про ЦАГ-глутн АЦУ-тре ААУ-аспн АЦЦ-тре ААЦ-аспн АЦА-тре ААА-лиз АЦГ-тре ААГ-лиз ГЦУ-ала ГАУ-асп ГЦЦ-ала ГАЦ-асп ГЦА-ала ГАА-глу ГЦГ-ала ГАГ-глу Ц Г УГУ-цис УГЦ-цис УГА-стоп УГГ-трип ЦГУ-арг ЦГЦ-арг ЦГА-арг ЦГГ-арг АГУ-сер АГЦ-сер АГА-арг АГГ-арг ГГУ-гли ГГЦ-гли ГГА-гли ГГГ-гли 1. Участок гена состоит из следующих нуклеотидов: ТТТ ТАЦ АЦА ТГГ ЦАГ. Расшифровать последовательность аминокислот в белковой молекуле, кодируемой данным участком гена. 2. В составе белка имеется такая последовательность аминокислот: валин – лейцин – гистидин – серин – изолейцин. Какова последовательность нуклеотидов в составе гена, кодирующего данный белок? 3. В состав белка входит 400 аминокислот. Определить, какую суммарную длину имеют экзоны, контролирующие синтез этого белка, если расстояние между двумя нуклеотидами в молекуле ДНК составляет 0,34 нм. 4. Определить состав ДНК и мРНК, кодирующие аминокислоты в белке в следующей последовательности: валин – пролин – изолейуин – метионин; аргинин – фенилаланин – аланин – аспарагиновая кислота; лизин – треонин – валин – триптофан – гистидин. 5. Определить массу гена, контролирующего образование белка, состоящего из 450 аминокислот, если известно, что средняя масса одного нуклеотида 300 дальтон. Оценить количество энергии, необходимой для синтеза этого гена и белка, кодируемого им. 6. Может ли участок ДНК не кодировать белок? Может ли один и тот же участок ДНК кодировать два и более белков? 7. В некоторых книгах утверждается, что пчелы могут путем изменений в диете направленно изменять генотип своего потомства. В качестве довода приводится факт содержания в маточном молочке ДНК и РНК. Убедителен ли этот аргумент? 8. Среди мутаций выделяются делеции – утраты разного количества нуклеотидов в ДНК. Могут ли быть случаи, когда делеции не вредны, а безразличны или даже полезны? 9. В результате мутаций часто в белке происходит замена одной аминокислоты другой. Но частота замен для разных аминокислот разная, а некоторые очень редки. Объясните причину этого. 10. У человека, свиньи и кролика инсулин различается лишь по одной аминокислоте. У кролика в положении 30 в цепи имеется серин, у свиньи – аланин, у человека – треонин. Установите, какие точечные мутации привели к возникновению вариантов инсулина? 11. Всякое ли изменение последовательности нуклеотидов в ДНК сказывается на структуре и функции белка? 12. На планете Х открыли живые существа, белок которых состоит из 40 аминокислот. Нашли ДНК, содержащую 3 типа нуклеотидов. Что можно сказать о генетическом коде этих организмов? 13. Утверждают, что все клетки многоклеточного организма идентичны. Так ли это, и как это проверить? 14. В организме произошла мутация, полипептидные цепи обрываются в том месте, где должна быть включена одна и та же аминокислота. Что это может быть за мутация? 15. Какое биологическое значение имеет повторение некоторых идентичных генов в одной хромосоме? Как такое повторение может возникнуть? Варианты Варианты Номера задач 1 1, 2 2 2, 3 3 3, 4 4 4, 5 5 5,6 6 6,15 7 7,14 8 8,13 9 10,11 10 11,12 Практическая работа №6. Основные понятия генетики Цель работы: решить задачи. Для изображения сочетаемости разных классов гамет и получения на этой основе разных генотипических классов потомства удобно пользоваться решеткой Пеннета, которая для моногибридного расщепления имеет вид: Гаметы родителей А а А АА Аа а Аа аа 1. У фасоли черная окраска семян А доминирует над белой а. Определить окраску семян в потомстве каждого из следующих скрещиваний: а) Аа Аа; б) АА Аа; в) аа АА; г) Аа аа. Растение, гомозиготное по черной окраске, скрещено с белосемянным растением. Определить фенотипы: а) F1; б) F2; в) потомства от возвратного скрещивания растения F1 с белосемянным растением родительской формы;г) потомства от возвратного скрещивания растения F1 с черносеменным растением родительской формы. При опылении растения, выросшего из черного семени, пыльцой белосеменного растения получили половину черных и половину белых семян. Определить генотип материнского растения. Скрещивание двух растений, полученных от черных семян, дало около ¾ черных и около ¼ белых семян. Определить генотипы обеих родительских растений. При скрещивании растения, имеющего черные семена, с белосеменным получены только черные семена. Какую окраску семян будет иметь потомство от скрещивания двух таких черносеменных растений F1 между собой? При самоопылении растения, выросшего из черного семени, получили 3/4 черных и 1/4 белых семян. Определить генотип исходного растения. При скрещивании двух черносеменных растений получили черные семена. Можно ли определить генотип родительских форм? При скрещивании растения, выросшего из черного семени, с белосеменным получены черные семена. Можно ли определить генотип материнского растения? 2. У кукурузы окрашенный эндосперм и гладкий алейроновый слой контролируются доминантными генамиC и S, а неокрашенный эндосперм и морщинистый алейроновый слой – их рецессивными аллелями с и s. Эти гены находятся в одной паре гомологичных хромосом, т.е. они сцеплены. Поэтому в результате сочетания указанных генов образуется неодинаковое количество гамет: некроссоверных гамет бывает значительно больше, чем кроссоверных. Установлено, что расстояние между генами С и S составляет 3,6 морганиды. Определить, какие типы гамет и в каком процентном отношении образуют особи генотипа CcSs? 3. Определить расстояние между генами А и В, если при скрещивании гетерозиготной по этим генам особи с гомозиготным рецессивом получено 6,4% рекомбинантов. 4. Существовала гипотеза, согласно которой – хромосома – это временное образование, собирающееся из отдельных генов для обеспечения митоза и мейоза а потом вновь распадающаяся. Приведите факты, которые прямо или косвенно отвергают ее? 5. Группа крови АВО у человека по принципу множественного аллелизма, т.е. ген может быть в трех аллельных формах: IО, IА, IВ. IО – 1 группа, IА – 11 группа, IВ – 111 группа, IАIВ – 1V группа. У мальчика 1 группа крови, у его сестры 1V. Определите группу крови и генотип их родителей? 6. Мужчина гомозиготен по гену В (111) группы крови, женщина – по гену О (1). Каков генотип детей? 7. У человека присутствие резус-фактора Rh обусловлено доминантным геном D. Женщина с генотипом Rh-А(1), у которой отец имеет генотип Rh-O(1), вышла замуж за мужчину Rh-O(1). Какова вероятность того, что ребенок наследует оба признака отца? 8. Перед судебно-медицинской экспертизой поставлена задача, выяснить: является ли ребенок, имеющейся в семье супругов, родным или приемным. Исследование групп крови показало следующее: мать – Rh- AB M, отец – Rh- O N, ребенок – Rh+ O M. Какое заключение должна сделать экспертиза и на каком основании? 9. Аня и Ася – идентичные близнецы. Ваня и Вася - идентичные близнецы. Ваня женился на Ане, Вася женился на Асе. В обеих семьях родились сыновья. Будут ли эти мальчики похожи друг на друга как однояйцовые близнецы? 10. В семье у кареглазых родителей четверо детей. Двое голубоглазых имеют 1 и 111 группу крови, двое кареглазых – 11 и 111 группы. Определите вероятность рождения следующего ребенка кареглазым с 1 группой крови? Карий цвет доминирует над голубым и обусловлен аутосомным геном. 11. У человека доминантный ген Д, обуславливающий дефект ногтей, и ген, определяющий группу крови, находятся в одной аутосоме на расстояние 10 морганид. Женщина с дефектом ногтей, отец которой был гомозиготен по группе А и имел нормальные ногти, а мать О группы с дефектными ногтями, вышла замуж за мужчину с нормальными ногтями и группой крови О. Какова вероятность, что ребенок будет по обоим признакам похож на: а) отца; б) бабушку? Варианты Варианты Номера задач 1 1, 11 2 2, 3 3 3, 5 4 4, 7 5 5, 9 6 6, 2 7 7, 4 8 8, 6 9 9, 4 10 10, 11 Практическая работа №7. Вид и популяция Цель работы: решить задачи. Частота генов в популяции выражается формулой p + q = 1. Если, например, концентрация доминантного аллеля A = p = 0,8, то концентрация рецессивного аллеля a = q = 0,2. В свободно скрещивающихся популяциях устанавливается равновесие генных частот, подчиняющееся закону Харди-Вайнберга: p2AA + 2pqAa + q2aa. 1. Докажите этот закон. 2. В выборке, состоящей из 84000 растений ржи, 210 растений оказались альбиносами, так как у них рецессивные гены находятся в гомозиготном состоянии. Необходимо определить частоты аллелей R и r и частоту гетерозиготных растений, несущих признак альбинизма. 3. Дальтонизм – заболевание, определяемое сцепленным с полом рецессивным геном. Частота дальтонизма у мужчин 0,08. Какова частота в популяции людей гомо- и гетерозиготных женщин по этому гену? 4. У человека существует группа крови MN (M и N – два кодоминантных аллеля одного гена). Частота группы крови NN 16%. Найти частоты встречаемости групп крови MM и MN. 5. На Амазонке открыто большое изолированное племя. Исследование крови у 100 человек на MN группу. Получены следующие результаты: MM – 80, MN – 20 человек. На основании этих данных сделан вывод, что в условиях Амазонки люди с кровью группы NN не выживают. Правильно ли это? 6. Единственное проявление аллеля заключается в том, что гомозиготы по нему бесплодны. Опишите его судьбу в популяции. 7. Князь Задунайский – последний в своем некогда знаменитом роде. Князья всегда женятся и имеют 2 детей. Дочери меняют фамилию. Какова вероятность того, что фамилия сохранится в последующих поколениях? 8. Почему полиплоидия чаще встречается у растений, чем у животных? 9. Какие преимущества имеют га-, ди- и полиплоидные организмы? 10. Как оценить численность популяции, если в нее выпустить некоторое количество меченых животных? Варианты Варианты Номера задач 1 1, 2 2 2, 3 3 3, 4 4 4, 5 5 5, 6 6 6, 7 7 7, 8 8 8, 9 9 9, 10 10 10, 1 Практическая работа №8. Эволюция и многообразие органического мира Цель работы: ответить на вопросы. 1. В процессе эмбрионального развития происходит трата энергии и вещества на формирование таких, казалось бы, бесполезных органов, как жабры у зародышей млекопитающих. Почему формирование таких органов не было устранено естественным отбором в ходе эволюции? 2. У лягушки 3-х камерное сердце. Объясните, чем такое сердце для лягушки лучше, чем 2-х или 4-х камерное? 3. Почему избыток витаминов приводит к болезни? Почему симптомы таких болезней совпадают с симптомами гиповитаминоза? 4. В чем особенности кровеносной системы птиц по сравнению с кровеносной системой млекопитающих? Чем обусловлены эти особенности? 5. Рыба, вытащенная из воды, задыхается (засыпает). Почему это происходит, ведь кислорода в воздухе больше? 6. Каковы особенности строения и жизнедеятельности водорослей в связи с преимущественно водным образом жизни? 7. Каковы особенности анатомического строения листа в связи с выполняемыми функциями? 8. Как происходит газообмен в легких человека? 9. Что такое СПИД? 10. Что представляют собой неклеточные формы жизни? 11. Близкородственные виды живут бок о бок, хотя, согласно Дарвину, между ними существует наиболее сильная конкуренция. Почему один вид не вытесняет другой? 12. Области распространения двух близкородственных видов пересекаются. В каких частях ареала животные этих видов будут более похожи – там, где живут вместе, или там, где раздельно? 13. Почему уничтожение малярии оказалось более простым делом, чем уничтожение клещевого энцефалита? 14. Как Вы думаете, продолжается ли в настоящее время эволюция человека? 15. Казалось бы, в природной популяции должен закрепляться аллель, дающий своему носителю наибольшее преимущество в борьбе за существование. Почему же в природных популяциях часто одновременно встречаются разные аллели одного и того же гена? 16. Почему даже длительное воздействие стабилизирующего отбора не приводит к полному фенотическому единообразию особей в популяции? 17. Гусеницы одного из видов бабочек встречаются на листьях двух видов – яркозеленого и сероватого цветов. На зеленых листьях намного чаще встречаются зеленые гусеницы, а на сероватых – серые. Предложите возможные объяснения этого факта и опыты по их проверке. 18. Почему некоторые близкие виды животных, способные давать потомство в неволе, в природе существуют, не смешиваясь? 19. Сорта культурных растений обычно удается успешно использовать лишь в течение нескольких лет после введения их в практику. С чем это может быть связано? 20. Щенкам спаниелей и фокстерьеров в раннем возрасте подрезают хвосты, чего не делают со щенками сеттеров и овчарок. У спаниелей и фокстерьеров щенки с укороченными хвостами рождаются гораздо чаще, чем у сеттеров и овчарок. Как это можно объяснить? Вариант 1 2 3 4 5 6 7 8 9 10 Вопросы 1, 11 2, 12 3, 13 4,14 5,15 6,16 7,17 8,18 9,19 10,20 Практическая работа №9. Некоторые биотические факторы среды и человек Цель работы: решить задачи. Задание 1. Исследованы готовые к употреблению лекарственные растения (продукция заводовизготовителей) на содержание в них тяжелых металлов. Используя результаты этих исследований (таблица 1), рассчитайте для каждого элемента, сколько химического элемента-загрязнителя попадает в организм больного, если он за день употребит 200 мл водного настоя травы (1:20). Запишите полученные результаты в виде таблицы (см. табл. 2). Сравните полученные величины с ПДК для соков и напитков, приведенных в таблице 1. Сделайте выводы. Таблица 1- Содержание тяжелых металлов в растительном сырье (продукция фармацевтических заводов), p.p.m.* Растение Химический элемент Mn Cr Cu Zn Ni Pb Cd Sb Sn Побеги багульника 1013, 1 1,64 6,04 25,17 0,129 1,29 0,005 - - Кора дуба 744,0 4,6 4,5 9,76 1,77 0,77 0,055 - 0,065 Трава череды 178,8 579,6 13,5 45,0 10,6 0,35 1,28 1,21 0,75 Почечный 157,8 242,0 31,0 19,4 16,1 0,76 - 0,01 0,03 чай Березовые почки 401,9 30,0 21,6 92,5 10,6 4,47 0,31 0,26 0,193 Корневище валерианы 102,3 150,0 2,0 19,4 16,6 0,71 0,33 0,01 0,168 Цветы ромашки 125,7 311,1 5,01 30,0 21,17 12,9 0,1 0,01 0,4 Семена тыквы 47,8 12,5 18,5 52,4 8,6 2,3 - - 0,25 Ламинария сахаристая 3,18 7,11 1,54 21,8 3,53 1,41 2,86 - - ПДК для соков и напитков, мг/л 0,1 0,1 5,0 10,0 0,3 0,4 0,03 0,2 200 *p.p.m. – 1-миллионная часть, или 1 мг/кг, или 1 мкг/г. Приведенные величины рассчитаны для сухой травы. Таблица 2. Растение Химическ ий элемент Содержан ие в сырье, мг/кг Содержан ие в 200 мл настоя, мг Содержан ие в 1 л настоя, мг/л ПДК для соков и напитков, мг/л Побеги багульника Mn Кора дуба Mn Трава череды Cr Почечный чай Cu Березовые почки Zn Корневище валерианы Ni Цветы ромашки Pb Задание 2. Нефть – один из самых опасных загрязнителей воды. Только 1 т нефти способна покрыть тонкой пленкой площадь в 12 км2. Скорость микробного окисления нефтяной пленки – 240 мг/м2 за вегетационный сезон. Нефть отрицательно влияет на жизнь живущих в воде и прибрежной зоне организмов: нефтяная пленка не пропускает солнечные лучи, замедляет образование кислорода в воде. Это приводит к гибели рыб, планктона, личинок насекомых и других обитателей водного бассейна. Птицы гибнут от того, что их оперение пропитывается нефтью. Снижение концентрации кислорода в воде нарушает равновесие между живущими в ней организмами и вызывает “цветение” воды – размножение анаэробных форм водорослей и простейших. Продукты переработки нефти содержат много токсичных веществ, обладающих многопрофильным мутагенным и канцерогенным действием. Площадь акватории Новосибирского водохранилища 1070 км2. В районе поселка Ордынское допущен аварийный сброс нефти в водохранилище в количестве 5 т. Рассчитайте, какая часть площади акватории водохранилища оказалась под нефтяной пленкой и сколько потребуется времени для микробного окисления этой пленки? В дыме одной сигареты содержится 20-50 мг бензола, 1,3-1,6 мг хлористого винила, 5-100 мг формальдегида,10-500 нг бенз(а)пирена, 120-3700 нг N’-нитрозонорникотин (соответственно ПДК для воздуха на 1 м3 – 1,5 мг, 30 мг, 0,035 мг, 1 нг, не установлен) – веществ, обладающих сильным канцерогенным действием и вызывающих опухоли легких. При вдыхании воздуха с перечисленными веществами около 30% их количества сорбируется легкими. Отец и мать грудного ребенка курят, не выходя из комнаты. Они выкуривают за день по 1 пачки сигарет (20 шт.). Объем комнаты – 40 м3. Через легкие взрослого человека за сутки проходит 1,5 м 3 воздуха, через легкие грудного ребенка – 3 м3. В 1 л молока курящей женщины содержится 2 мг никотина, 1/10 его составляет N-нитрозонорникотин (канцерогенное производное). Рассчитайте, сколько канцерогенных веществ попадает за сутки в воздух комнаты (в расчете на 1 м3), сравните с ПДК. Сколько канцерогенных веществ вдыхается матерью ребенка и сколько ребенком в сутки? Сколько никотина и N-нитрозонорникотина попадает в организм матери? Сколько никотина и его канцерогенного производного поглощает с молоком грудной ребенок, если он получает 6 кормлений по 200 мл молока в сутки? Задание 3. В окрестностях города Н. собраны лекарственные растения. Результаты химического анализа этих растений на содержание тяжелых металлов приведены в таблице. Рассчитайте возможное содержание этих химических элементов в водных настоях трав (1:20) так же, как при выполнении предыдущего задания, запишите в виде аналогичной таблицы, сравните с ПДК. Сделайте вывод о степени экологической чистоты лекарственного сырья. Растение Химический элемент Fe Mn Cu Pb Sn Трава череды 400 800 200 30 - Корни одуванчика 300 700 500 10 10 500 100 60 10 - Трава крапива 600 700 50 10 10 Трава пустырника 800 60 200 10 - Трава тысячелистника ПДК для соков и напитков, мг/л 15 0,1 5 0,4 200 Задание 4. Одним из активнейших мутагенов и канцерогенов является бенз(а)пирен. Среди загрязнителей воздуха его доля достигает 50%. Основным источником его поступления в атмосферу – выхлопные газы автомобилей, которые содержат его в количестве 20 мкг/м3. Бенз(а)пирен входит также в состав любого дыма и любой сажи, нефтепродуктов, присутствует в копченой рыбе, овощах, злаках, жареном кофе. В почву бенз(а)пирен попадает: а) в результате оседания и вымывания загрязнений и выбросов промышленных предприятий; б) с осадками из атмосферы; в) с потерями топливных продуктов (нефтепродуктов, каменноугольных, сланцевых смол и др.). Бенз(а)пирен обладает высокой стабильностью. При попадании в почву снижение его содержания до фоновых значений происходит очень медленно; в дерновоподзолистых почвах – за 5-6 лет;в черноземных – за 2-3,5 года. В организм человека бенз(а)пирен попадает из воздуха, с водой и пищевыми продуктами. ПДК бенз(а)пирена в атмосферном воздухе населенных пунктов – 0,001 мкг/м3. Если учесть, что 1 м3 отработавших газов автомобилей содержит 20 мкг бенз(а)пирена, а сжигание 1,5 кг бензина дает 1 м3 отработавших газов и что автотранспортом в городе Н. сжигается за год 480000 т бензина, то сколько бенз(а)пирена выделяется транспортом города Н. Дым одной выкуренной сигареты содержит 0,2 мкг бенз(а)пирена, курящие жители города Н. выкуривают все вместе 2,4 млрд сигарет в год. Сколько бенз(а)пирена выделяется с дымом сигарет? Повышенное содержание в воздухе оксида углерода (СО) приводит к переходу гемоглобина крови человека в необратимое состояние – карбоксигемоглобин и вызывает развитие гипоксии. Насыщение крови оксидом углерода обуславливает развитие состояния утомления и снижения трудоспособности. Степень развития гипоксии и ее последствий зависит от концентрации СО в воздухе и времени ее действия. Насыщение крови карбоксигемоглобином всего на 4% уже приводит к увеличению кислородного дефицита в организме, снижению парциального давления кислорода в артериальной крови, в коронарных артериях и венах, изменению физиологического состояния организма. Такая степень насыщения (4%) устанавливается при следующих условиях: Концентрация СО в воздухе, мг/м3 Время воздействия, ч 23 24 35 8 117 1 ПДК оксида углерода в атмосфере населенного пункта 5 мг/м3. В городе Н. в безветренную погоду на одном из самых оживленных перекрестков в течение светового дня содержание СО в воздухе – 40 мг/м3. Оцените, опасна ли такая концентрация СО в воздухе: - для милиционера-регулировщика, простоявшего на перекрестке в течение 8 часов; - для пассажира, простоявшего на автобусной остановке в течение 15 минут; - для жителей микрорайона и их потомства. Практическая работа №10. Природные воды Цель работы: освоение принципов описания природных вод. Природная вода представляет собой слабый раствор. Суммарное содержание в воде растворенных неорганических веществ (концентрация солей) выражают либо в виде минерализации M (мг/л, г/л), либо в виде солености S (г/кг, ‰). Промилле (‰) – единица измерения, равная 1 части на 1000 частей. В случае солености 1 промилле численно равен 1 грамму соли в 1 кг (1000 г) природной воды. По содержанию солей природные воды подразделяют на четыре группы: пресные – менее 1 ‰, солоноватые – 1-25‰, соленые – 25-50‰, высокосоленые (рассолы) – свыше 50‰. Определение минерализации или солености проводят по плотному остатку. Плотный остаток определяют путем выпаривания определенного количества профильтрованной воды и высушивания остатка при 110°С до постоянного веса. Вес остатка измеряют в граммах и определяют с точностью до четвертого знака после запятой. Количество взятой для выпаривания воды измеряют либо в миллилитрах, либо в граммах. Если количество воды выражено в мл, то концентрацию солей в воде называют минерализацией и определяют по формуле: М (г/л) = 1000·вес остатка/объем воды. Если количество воды выражено в граммах, то концентрацию солей в воде называют соленостью и определяют по формуле: S (г/кг, ‰) = 1000·вес остатка/вес воды. Минерализацию можно определить и по химическому составу природной воды. В этом случае минерализацию определяют как сумму всех ионов в одном литре воды. Для обычных расчетов можно пренебречь различием между минерализацией и соленостью пресных, солоноватых и соленых природных вод, однако для высокосоленых вод, из-за возникновения достаточно большой ошибки, этого делать уже нельзя. Сумма концентрации двухвалентных катионов кальция и магния называется общей жесткостью воды. Кальций и магний присутствуют в воде в виде растворимых углекислых, двууглекислых, хлоридных и сернокислых солей. Различают: мягкая вода – общая жесткость менее 3,5 мг-экв/л; средняя жесткость – 3,5-7 мг-экв/л; жесткая вода – 7-14 мг-экв/л; очень жесткая вода – более 14 мг-экв/л. Водородный показатель (pH) определяют на приборе, называемом pH-метр. По водородному показателю все природные воды делятся на: - нейтральные (6,5<рН<7,5); - слабощелочные (7,5<рН<8,5); - щелочные (8,5<рН<9,5); - сильнощелочные (рН>9,5); - слабокислые (5,5<рН<6,5); - кислые (4,5<рН<5,5); - очень кислые (рН<4,5). Питьевая вода имеет нейтральную или слабощелочную реакцию. К числу главных ионов солей, находящихся в природных водах, относятся анионы: НСО3- -гидрокарбонат, SO42- - сульфат, Cl-- хлорид и катионы: Ca2+, Mg2+, Na+ и К+. Наряду с указанными ионами вода может содержать и другие ионы. Все природные воды делятся: - по преобладающему аниону на три класса: гидрокарбонатный, сульфатный и хлоридный; - по преобладающему катиону на три группы: кальциевую, магниевую и натриевую. Для определения степени преобладания того или иного иона содержание всех ионов должно быть сначала выражено в мг-эквивалентах на литр воды, а затем преобразовано в процентное содержание от суммы всех катионов или анионов в зависимости от того, какой ион рассматривается. В случае выражения химического состава в мг/л для его перевода в мгэкв/л необходимо количество мг/л иона разделить на его эквивалентную массу. Эквивалентная масса катионов: Ca2+ - 20,0; Mg2+ - 12,15; Na+ - 23,0. Эквивалентная масса анионов: CO32- - 30,00; НСО3- - 61,0; SO42- - 48,0; Cl- - 35,5. Сумма всех мг-эквивалентов катионов должна быть равна сумме всех мг-эквивалентов анионов. Различие в этих суммах может быть либо следствием неполного химического анализа, либо результатом ошибки. Наиболее распространенные газы, растворенные в природных водах, - это кислород, азот, углекислый газ, сероводород. Природные воды содержат биогенные вещества, к числу которых относятся соединения азота, фосфора, кремния. Содержатся в воде и различные растворенные органические вещества: углеводы, белки и продукты из разложения. Природные воды содержат микроэлементы (микроэлементами называют вещества, содержание которых в воде не превышает 1 мг/л). К числу наиболее распространенных микроэлементов относятся бром, йод, фтор, литий, барий, железо, никель, цинк и др. Для наглядного изображения химического состава природных вод удобно применять формулу Курлова. В этой формуле, выражаемой в виде псевдодроби, в числителе в убывающем порядке пишут долю (%) мг-экв аниона с его символом, в знаменателе, – аналогичным способом катионы. Впереди дроби указывают минерализацию в г/л, рН, общую жесткость в мг-экв/л и, при необходимости, компоненты, придающие воде специфические свойства (содержание газов, микроэлементов, биогенных и органических веществ, радиоактивность и т.д.). Для подземных вод сзади дроби указывают температуру (°С) и дебит (D) воды (м3/сутки). После составления формулы воды дают ей название из названий анионов и катионов, содержание которых более 25%. Задание: Опишите природную воду Таблица - Химический состав воды, мг/л Вари рН Mg2+ Na+ Ca2+ ант 1 6.92 79 37 35 2 7.26 93 10 6 3 7.5 76 143 37 4 7.5 2.5 2.15 11.9 5 7.7 2.76 7.67 4.12 6 7.4 88.2 29.1 21.4 7 7.5 152.3 121.2 630.0 8 10.48 0.2 2.8 180.8 9 7.29 3.4 3.0 3.017 10 6.92 79.0 37.0 35.0 Cl- SO42- CO32- НСО3- 12 6 17 5.6 3.2 14.2 553.0 89.6 1.9 12.0 66 83 25 5.69 2.5 79.0 915.6 3.76 1.11 66.0 0.34 136.5 - 418 238 890 30.31 48.45 346.0 629.7 90.5 26.56 418.0 11 12 13 14 7.45 7.9 9.2 8.85 2.5 381.0 0.5 44.0 2.15 122 1.5 32.7 11.91 1402 103.9 221.5 0.56 815 5.0 17.0 5.69 1637 0.98 64.6 40.0 86.4 40.31 2245 160.0 683.4 Практическая работа №11. Рациональное питание Цель: дать понятие студентам о культуре питания, ознакомить с основами рационального питания. Задача: Рассчитать лист питания на день, на неделю. Определить необходимое количество пищи, учитывая ее разнообразие, рассчитывается баланс белков, жиров и углеводов. Задание выполняется с использованием приведенных таблиц и образца "листа питания". Содержание белков, жиров, углеводов в продуктах питания и их энергетическая ценность (на 100г. продукта) Продукт Белки Жиры ккал 3 0,7 2,6 5,8 1,6 0,9 1,0 5,0 0,9 0 следы 0,1 35,7 17,5 39,5 0,1 следы следы 29,9 Углеводы 4 73,3 68,0 65,4 67,7 75,2 40,1 56,4 49,7 99,8 79,6 92,1 52,4 27,9 51,3 77,7 80,4 77,3 50,6 1 Крупа: манная гречневая овсяная Горох лущеный Макаронные изделия Хлеб ржаной сдоба пшеничный Сахар-песок Крахмал картофельный Карамель фруктовая Шоколад молочный Какао порошок Конфеты шоколадно-кремовые Мармелад Пастила Зефир Халва Кондитерские изделия: печенье сахарное галеты вафли фруктовые пряники пирожное с кремом Молоко, молочные продукты: молоко пастеризованное сливки 10% жирности сметана 20% жирности творог полужирный сырки творожистые кефир нежирный простокваша молоко сухое молоко сгущенное с сахаром Масло сливочное Масло топленое Сыр российский Брынза их коровьего молока Плавленый сыр 40% жирности Мороженое молочное 2 11,3 12,6 11,9 23,0 10,4 6,5 7,6 7,6 0 0,1 0,1 6,9 24,2 4,0 следы 0,5 0,8 12,7 7,5 9,7 3,2 4,8 5,4 11,8 10,2 2,8 2,8 38,6 74,4 68,4 80,1 77,7 46,4 417 393 342 336 544 2,8 3,0 2,8 16,7 7,1 3,0 2,8 25,6 7,2 0,6 0,3 23,4 17,6 23,0 3,2 3,2 10,0 20,0 9,0 23,0 0,05 3,2 25,0 8,5 82,5 98,0 30,0 20,1 19,0 3,5 4,7 4,0 3,2 1,3 27,5 3,8 4,1 39,4 56,0 0,9 0,6 21,3 58 118 206 156 340 30 58 475 315 748 887 371 260 270 125 5 326 329 345 323 332 190 288 226 37,7 129 348 547 373 566 296 305 299 510 Эскимо ленинградское Маргарин Жир кулинарный Сало растительное Растительное масло Овощи, плоды: горошек зеленый кабачки капуста картофель ананас бананы персики яблоки апельсины лимон виноград земляника садовая грибы свежие белые сушеные капуста квашеная томаты соленые чай зеленый байховый Мясо: баранина 2 категории говядина 1 категории говядина 2 категории кролик свинина мясная печень почки Колбасные изделия: Докторская Сардельки 1 сорта Сосиски свиные Копченая краковская Грудинка сырокопченая Консервы мясные: Говядина тушеная Завтрак туриста Птица: Бройлеры (цыплята) 1 категории Гуси 1 категории Индейки 1 категории Куры 1 категории 2 категории Утки 1 категории Яйца куриные Рыба: Горбуша Камбала Треска Хек Щука Язь Краб Паста "Океан" Сельдь соленая Икра кеты зернистая Минтая Томат-паста Консервы фруктовые компоты: Абрикосы 3,5 0,3 0 0 0 20,0 82,3 99,7 99,7 99,9 19,6 1,0 0 0 0 268 746 897 897 899 5,0 0,6 1,8 2,0 0,4 1,5 0,9 0,4 0,9 0,9 0,9 1,8 3,2 27,6 0,8 1,7 20,0 0,2 0,3 0,1 0,7 6,8 - 13,3 5,7 5,4 19,7 11,8 22,4 10,4 11,3 8,4 3,6 17,5 8,1 1,6 10,0 1,8 1,8 6,9 72 27 28 83 48 91 44 46 38 31 69 41 25 209 14 19 109 20,8 18,9 20,2 20,7 14,6 17,4 12,5 9,0 12,4 7,0 12,9 33,0 3,1 1,8 - 164 187 144 199 355 98 66 13,7 9,5 11,8 16,2 7,6 22,8 17,0 30,8 44,6 66,8 1,9 - 260 198 324 466 632 16,8 20,5 18,3 10,4 - 232 176 17,6 15,2 19,5 18,2 20,8 15,8 12,7 12,3 39,0 22,0 18,4 8,8 38,0 11,5 0,4 0,7 0,6 0,7 183 412 276 241 165 105 157 21,0 15,7 17,5 16,6 18,8 19,0 16,0 18,9 17,0 31,6 28,4 4,8 7,0 3,0 0,6 2,2 0,7 4,5 0,5 6,8 8,5 13,8 1,9 0 18,9 147 90 75 86 82 117 69 137 145 251 131 96 0,5 0 21,4 85 Персики Фруктовые соки: Вишневый Яблочный Варенье из малины Фрукты сушеные: Урюк Изюм Воздушная кукуруза Кукурузные хлопья Хрустящий картофель Мука высшего сорта 0,3 0 22,3 86 0,7 0,5 0,6 0 0 0 12,2 11,7 71,2 53 47 271 5,0 1,8 9,4 15,1 3,4 10,3 0 0 3,3 1,3 38,8 0,9 67,5 70,9 76,5 73,3 48,1 74,2 278 276 354 347 534 327 Пример: "Лист питания" Вес (студента) - 75 кг. Предварительное меню на сутки: Коррекция Завтрак: творог Молоко Хлеб Масло слив. 100г 200г 100г 10г Обед: свекла Масло растит. Картофель Мясо говяд. Хлеб Варенье 50г 20г 200г 100г 100г 50г Полдник: Мука Масло раст. Сок яблочн. 100г 10г 200г пастила 50г Куры 2 кат. 100г Капуста 200г Молоко сгущ. 20г Пряники 50г Хлеб 50г воздуш. кукуруза 100г Ужин: изюм 100г шоколад 20г Таблица 1. Расчет питания по белкам, жирам, углеводам, ккал на сутки Продукты Кол-во, г Белки, г Жиры, г Молоко Творог Масло словочн. Растит. Хлеб Пряники Мясо говяд. Куры 2 кат. Молоко сгущен. Свекла Картофель Капуста Мука Сок яблочн. варенье 200 100 10 30 250 50 100 100 20 50 200 200 100 200 50 5,6 16,7 0,06 0 19 2,4 18,9 20,8 1,4 0,8 4,0 3,6 10,0 1,0 0,3 6,4 9,0 8,2 30 2,2 1,4 12,4 8,8 1,7 0,2 0,9 0 0 Углеводы, г 9,4 1,3 0,09 0 124,2 38,8 0,6 11,2 5,4 39,4 10,8 74,2 23,4 35,6 Ккал 116 156 75 270 565 168 187 165 63 24 186 58 327 94 136 Итого. г 1660 104,86 81,2 373,39 2588 Потребность на 1 кг веса 1,5 1,5 8 50 Потребность на весть вес 112,5 112,5 600 3750 Отклонение от нормы на весь вес -7,6 -31,3 -226,6 -1162 Коррекция: Шоколад 50 3,4 17,8 26,2 274 Изюм 100 1,8 70 280 Воздушная 100 9,4 3,3 76,5 354 кукуруза пастила 50 0,2 40,2 152 Итого: 300 14,8 21,1 212,7 1060 Всего: 1960 119,7 102,3 586,1 3648 Отклонение на вес % +7,3 (6,5%) -10,4 (9,2%) -13,8 (2,3%) -102 (2,7%) Таблица 2. Рекомендуемый баланс белков, жиров, углеводов для взрослого человека Белки Жиры Углеводы Весовое 1 1,2 4,6 соотношение Процентное 11-13% 30-33% 56% соотношение энергетической потребности Качественное Животные Животные 50% соотношение 55% Растит. 30% Растит. Маргарин 20% 45% Таблица 3. Распределение пищевого рациона при 4-х разовом и 3-х разовом питании. 4-х разовое 3-х разовое Завтрак 25% 30-35% Обед 35% 40-45% Полдник 15% Ужин 25% 20-30% Практическая работа №12. Определение предельно допустимых сбросов веществ и условий спуска сточных вод в водотоки Цель работы: Изучить приемы определения ПДС и необходимой степени очистки сточных вод перед их спуском в водоток. Порядок выполнения 1. Ознакомиться и законспектировать общие сведения о сточных водах. 2. Пользуясь исходными данными по химическому составу сточных вод и вод реки установить: а) необходимую степень разбавления сточных вод в водоеме в заданном створе; б) степень очистки сточных вод от взвешенных частиц; в) степень очистки от загрязнителей, определяющих БПК; г) необходимость мероприятий по снижению уровня теплового загрязнения; д) степень очистки стоков от растворенных в них тяжелых металлов; е) величины ПДС по всем видам загрязняющих веществ. Предварительное пояснение Производственная и бытовая деятельность человека тесно связана с использованием воды. Большая часть использованной воды возвращается в водоемы в виде насыщенных загрязнителями сточных вод. Сточные воды по характеру загрязнений разделяются на содержащие минеральные вещества, органические вещества или одновременно и те и другие. К минеральным веществам относятся частицы грунта, руды, шлака, металлов, минеральные соли, кислоты, щелочи и другие неорганические вещества. Органические примеси весьма разнообразны и образуются за счет поступления в сточную воду остатков сырья, реагентов и продуктов производства, отходов жизнедеятельности человека и животных, веществ растительного происхождения и др. органические вещества характеризуются присутствием в их составе углерода, водорода, во многих случаях кислорода и азота, а также серы, фосфора, хлора, металлов. Загрязняющие вещества могут находится в воде в виде пены, эмульсии, в грубодисперсном состоянии, в коллоидном состоянии или в виде истинного раствора. Сточные воды могут быть разного происхождения, однако в большинстве случаев преобладают сточные воды промышленного происхождения. Промышленные стоки бывают трех видов: бытовые, поверхностные и производственные. Бытовые сточные воды образуются при работе душевых, туалетов, прачечных и столовых. Поверхностные сточные воды образуются в результате смывания талой, дождевой или поливочной водой веществ и материалов, скапливающихся на территории, крышах и стенах производственных зданий. Производственные сточные воды образуются в результате использования воды в технологических процессах. Промышленные стоки содержат растворенные и взвешенные вещества, нефтепродукты и плавающий мусор, иногда вода в них может иметь повышенную температуру. Преобладание тех и иных загрязнителей в сточных водах зависит от их происхождения. Так, в бытовых сточных водах преобладают органические вещества, в т.ч. синтетические моющие средства, в поверхностных сточных водах много мусора, взвешенных веществ, нефтепродуктов. Состав производственных сточных вод зависит от профиля производства, часто в них можно в большом количестве обнаружить тяжелые металлы. Любые загрязнители, попадая со сточными водами в поверхностные водоемы, ухудшают качество воды в них. Если это вещества органической природы, то в приемном водоеме они начинают окисляться либо самостоятельно, либо при участии микроорганизмов, однако в любом случае на их окисление расходуется кислород. Возникает, так называемая, биохимическая потребность в кислороде (БПК) – количество кислорода, необходимое для полной минерализации микроорганизмами-деструкторами органических веществ, содержащихся в 1 л воды Следовательно, БПК является показателем содержания в воде органических веществ. Чем больше БПК, тем сильнее вода загрязнена органическими веществами, тем выше интенсивность расходования кислорода воды на окисление этих веществ и тем меньше кислорода остается в воде для живых организмов – рыб, ракообразных, моллюсков, растений и водорослей. Ухудшение условий жизни перечисленных групп живых организмов снижает скорость самоочищение водоема, иногда самоочищение может полностью прекратиться и тогда вода становиться совсем непригодной для человека и животных. Биогенные вещества (соединения азота, фосфора), попадающие в водоем, способствуют ухудшению условий его самоочищения. В этом случае имеет место усиленное размножение в водоеме синезеленых водорослей, которые своей жизнедеятельностью подавляют все остальные группы живых организмов. Снижению скорости самоочищения воды в ряде случаев способствует сброс в водоемы нагретой воды. Растворимость кислорода в воде невысока, а с повышением температуры она еще более снижается, что, естественно, не улучшает условия жизнедеятельности водных организмов и не способствует самоочищению воды. Биогенные и ряд органических веществ и тепло становятся помехой для пресноводных экосистем только тогда, когда их количество превышает некий предел. В малых же объемах эти компоненты иногда могут быть даже полезны для этих экосистем. Однако существуют и другие загрязнители, которые по своей природе чужды природным экосистемам – это тяжелые металлы и многие синтетические вещества. С такими загрязнителями природные экосистемы могут справиться лишь при незначительной их концентрации. Для того, чтобы природные водные экосистемы успевали обезвредить загрязнители, необходимо ограничить их поступление в водоемы, т.е. необходимо уменьшить сброс в водоемы неочищенных сточных вод предприятий. Предварительная очистка сточных вод, т.е. значительное снижение БПК стоков, уменьшение содержания биогенных веществ, тяжелых металлов, взвешенных веществ, уменьшение температуры до необходимой величины достигается на очистных сооружениях, которые должны иметь большинство предприятий. Необходимая степень очистки сточных вод перед их сбросом в водоемы зависит не только от состава и расхода сточных вод, но и от многих других факторов: расхода воды в реке, ее химического состава, температуры, места сброса стоков (у берега или на стрежне), строения берегов, извилистости реки, хозяйственного назначения водоема, удаленности места сброса стоков от мест водопотребления и т.п. Нормы качества воды в водных объектах достигаются путем реализации комплекса водоохранных мероприятий. Одним из которых является предельно-допустимый сброс. Предельно допустимый сброс (ПДС) вещества в водный объект – масса вещества в сточных водах, максимально допустимая к отведению с установленным режимом в данном пункте водного объекта в единицу времени с целью обеспечения качества воды в контрольном пункте. ПДС устанавливаются для каждого вещества отдельно. Норматив разрабатывается для условий нормальной работы технологического оборудования при условии его полной загрузки. ПДС используются для контроля режима сброса сточных вод в водные объекты, а также служит основным целевым показателям при разработке планов и программ развития водоохранных комплексов. Нормирование качества воды состоит в установлении совокупности допустимых значений показателей состава и свойств воды водных объектов, в пределах которых надежно обеспечивается здоровье населения, благоприятные условия водопользования и экологическое благополучие водного объекта. Нормы качества поверхностных вод устанавливаются для условий хозяйственно-питьевого, коммунально-бытового и рыбохозяйственного водопользования. К хозяйственно-питьевому водопользованию относится использование водных объектов или их участков в качестве источника хозяйственно-питьевого водоснабжения, а также для водоснабжения предприятий пищевой промышленности. К коммунально-бытовому водопользованию относится использование водных объектов для купания, спорта и отдыха населения, а также иное использование водных объектов, находящееся в черте населенных пунктов. Рыбохозяйственные водные объекты, используемые для воспроизводства, промысла и миграции рыб, беспозвоночных и водных млекопитающих, подразделяются на три категории. К высшей категории относятся места расположения нерестилищ, массового нагула и зимовальных ям особо ценных видов рыб и других промысловых водных организмов, а также охранные зоны хозяйств любого типа для искусственного разведения и выращивания рыб, других водных животных и растений. К первой категории относятся водные объекты, используемые для сохранения и воспроизводства ценных видов рыб, обладающих высокой чувствительностью к содержанию кислорода. Ко второй категории относятся водные объекты, используемые для других рыбохозяйственных целей. Виды использования водного объекта в пределах субъекта Федерации определяются его природоохранными органами. Нормы качества вод водных объектов включают общие требования к составу и свойствам поверхностных вод для различных видов водопользования, а также перечень ПДК вредных веществ. Предельно допустимая концентрация (ПДК) загрязняющего вещества в воде – максимальная концентрация загрязняющего воду вещества, отнесенная к определенному времени усреднения, которая при периодическом воздействии или же на протяжении всей жизни человека не вызывает негативного прямого или косвенного влияния на природную среду и здоровье человека. При сбросе сточных вод в водные объекты, используемые для хозяйственно-питьевых и коммунально-бытовых целей, нормы качества вод этих объектов или их природный состав и свойства должны выдерживаться на водотоках, начиная со створа, расположенного на 1 км выше ближайшего по течению пункта водопользования (водозабор для хозяйственнопитьевого водоснабжения, места купания, организованного отдыха, территория населенного пункта и т.п.). При сбросе сточных вод в рыбохозяйственные водотоки, нормы качества воды или ее природные свойства (в случае природного превышения этих норм) должны соблюдаться на протяжении всего участка водопользования, начиная с контрольного створа, определяемого в каждом конкретном случае природоохранными органами, но не далее чем 500 м от места сброса сточных вод или расположения других источников загрязнения поверхностных вод (мест добычи полезных ископаемых, производства работ на водном объекте и т.п.). Внимание! Приведенные ниже формулы расчета ПДС и необходимой степени очистки сочных вод пригодны лишь для случая сброса стоков отдельным выпуском в водотоки, т.е. в реки. Во всех остальных случаях необходимо пользоваться другими расчетами. Расчет степени очистки сточных вод от загрязнителей не участвующих в формировании БПК (взвешенные вещества, ионы тяжелых металлов, соли и т.п.) Этот расчет проводят по каждому веществу отдельно по формуле: Эi i i Сст С ПДС i Сст 100%, (1) i где Эi – степень очистки сточных вод от i-того загрязняющего вещества, %; С ст - i концентрация i-того загрязняющего вещества в сточных водах, мг/л; С ПДС - допустимая концентрация i-того загрязняющего вещества в сточных водах перед их сбросом в воду реки (мг/л), обеспечивающая нормативное качество воды в контрольном створе, которая, в свою очередь, определяется по формуле: i i i С ПДС С ПДК n(С ПДК С iр ), (2) i где С ПДК - предельно-допустимая концентрация i-того загрязняющего вещества в воде водных объектов, мг/л; С iр - концентрация i-того загрязняющего вещества в реке (до спуска в нее сточных вод), мг/л; n – степень разбавления сточных вод в расчетном створе. Степень разбавления сточных вод в расчетном створе, определяется по формуле: n q Q , q (3) где q – расход сточных вод, м3/с; Q – расход воды в реке, м3/с; - коэффициент смешения, показывающий, какая часть речного расхода, смешивается со сточной жидкостью в максимально загрязненной струе расчетного створа. Величина коэффициента смешения зависит от расстояния от выпуска сточных вод до расчетного створа по фарватеру, от турбулентной диффузии и гидравлических условий в реке, извилистости последней, от места выпуска сточных вод (у берега, на стрежне и т.п.), времени года. Фактически формула 2 применяется достаточно редко, поскольку при ее выводе предполагалось, что в воде водотока отсутствуют другие загрязняющие вещества, обладающие тем же лимитирующим показателем вредности (ЛПВ). Если это правило не соблюдается (либо в воде водотока уже содержатся такие вещества, либо они поступают в i i водоток со сточными водами), то вместо С ПДК в формуле 2 применяют С норм . (нормализованная концентрация i-того загрязняющего вещества). i Значение С норм . каждого из загрязняющих веществ с одинаковым ЛПВ определяется по уравнению 1 С норм . ПДК1 ... n С норм . ПДК n 1. (4) Это уравнение для случая поступления в водоток сточной воды, содержащей несколько веществ с одинаковым ЛПВ, не имеет однозначного решения. В таких случаях при его решении учитываются его экономические последствия. Однако в любом случае значение i i С норм . в уравнении 2 не может быть меньше С р . Если концентрация какого-либо загрязняющего вещества в сточных водах окажется меньше допустимой концентрации этого загрязняющего вещества в сточных водах перед их сбросом в воду реки, то рассчитывать необходимую степень очистки от этого вещества не нужно. Расчет степени очистки от загрязнителей, определяющих полное биохимическое потребление кислорода (БПКполн) смеси речной воды и сточных вод При поступлении стоков в реку снижение концентрации органических веществ, выраженное в БПК, происходит не только вследствие разбавления, но и из-за самоочищения воды. Концентрация сточных вод ( Lo ), при которой БПК воды реки в ближайшем пункте водопользования ниже спуска сточных вод будет не больше принятых нормативов, находят по формуле: L0 n LПДК Lсм 10kt Lр Lр , (4) где n – степень разбавления, LПДК - предельно-допустимое значение БПК (полное при о 20 С) в воде водных объектов; Lсм - БПК, обусловленная метаболитами и органическими веществами, смываемыми в водоток атмосферными осадками с площади водосбора на последнем участке пути перед контрольным створом длиной 0,5 суточного пробега; k – константа неконсервативности органических веществ, обуславливающих БПК (вводится для учета изменения концентрации этих веществ во времени под действием процесса, обуславливающего самоочищение воды и зависит о температуры речной воды); t – время протекания воды от места сброса сточных вод до расчетного створа, сут; L р - БПК (полное при 20 оС) речной воды до сброса сточных вод, мг/л. Значение Lсм принимается равным; для горных рек – 0,6-0,8 г/м3; для равнинных рек, протекающих по территории, почва которой не слишком богата органическими веществами – 1,7-2 г/м3; для рек болотного питания или протекающих по территории, с которой смывается повышенное количество органических веществ – 2,3-2,5 г/м3. Если расстояние от выпуска сточных вод до контрольного створа меньше 0,5 суточного пробега, то Lсм принимается равным нулю. Величина коэффициента неконсервативности определяется по формуле: k 0,375[1,12(T 1) 0,022 ]T 20 , (5) где T – температура речной воды, оС. Если Lo меньше БПК сточных вод, то перед их спуском в водоем обязательна их очистка до расчетного значения Lo . Необходимая степень очистки сточных вод ( ЭБПК ) в этом случае определяется по формуле: ЭБПК Lст Lo 100%, Lст где Lст - полная биохимическая потребность (БПК) сточной воды в кислороде, мг/л. Расчет необходимой степени охлаждения сточных вод перед сбросом их в водоем (6) Сточные воды перед их сбросом в водоем должны иметь температуру, определяемую по формуле: р Т ст nТ доп Т рmax , (7) где Т доп - допустимое повышение температуры в реке, оС; Т рmax - максимальная температура речной воды (до спуска сточных вод) в наиболее теплый месяц года, оС; n – степень разбавления. Если температура сточных вод больше расчетной температуры ( Т стр ), то перед спуском в водоем сточные воды должны быть охлаждены до расчетной величины. Расчет ПДС загрязняющих веществ Величины ПДС определяются для каждого загрязняющего вещества для всех категорий водопользователей как произведение максимального часового расхода сточных вод (м3/ч) на допустимую концентрацию загрязняющего вещества (г/м3). Для расчета применяют следующие формулы: i ПДС = q С ПДС ; (8) ПДС = q Lo . (9) Формула 8 применяется для веществ не участвующих в формировании БПК, а формула 9 – для веществ, формирующих БПК. Подчеркиваем обязательность требования увязки сброса массы вещества, соответствующей ПДС, с расходом сточной воды. Например, уменьшение расхода сточных вод при сохранении величины ПДС будет приводить к концентрации вещества в водном объекте, превышающей ПДК. Исходные данные для выполнения лабораторной работы Сточные воды Показатели Вариант Расход сточных вод, м3/с 1 2 3 2,5 250 3 4 5 6 7 8 9 3,5 4 4,5 10 15 20 18 210 375 321 Концентрация взвешенных частиц, мг/л 180 165 195 570 350 Время протекания воды от места сброса до места водопотреблени я, час 1 2 1,.5 2,5 3 4 4 3,5 6 БПК,мг/л 89 105 220 176 240 890 570 240 145 Температура сточных вод, о С 38 30 45 28 40 41 32 26 28 Содержание тяжелых металлов, мг/л: мышьяк, 0,07 0.09 0,02 0,04 0,14 0,36 0,01 0,08 0,23 ртуть, 0,01 0,02 0,03 0,04 0,001 0,01 0,06 0,01 0,1 свинец 0,02 0,6 0,3 0,05 0,09 0,4 0,8 0,3 0,02 *Биохимическая потребность в кислороде (полная при 20 оС) Речная вода Показатели Вариант 1 2 3 4 5 6 7 8 9 26 36 40 83 129 210 312 465 369 0,15 0,2 0,4 0,14 0,19 0,21 0,17 0,35 0,18 91 45 24 156 87 231 167 98 310 1,1 0,7 2,1 0,9 0,7 1,4 1,6 0,1 0,4 21 23 19 25 21 24 26 19 22 Содержание тяжелых металлов, мг/л: мышьяк, 0,01 0,005 0,02 0,01 0,003 0,01 0,03 0,01 0,01 ртуть, отс 0,001 отс отс 0,001 0,002 отс отс 0,003 свинец 0,01 0,04 0,01 0,04 0,007 0,006 0,01 0,05 0,03 Расход воды, м3/с Коэффициент смешения Концентрация взвешенных частиц, мг/л БПК*, мг/л Максимальная летняя температура, оС *Биохимическая потребность в кислороде (полная при 20 оС) Хозяйственное назначение водоема № варианта Цель водопользования 1 хозяйственно-питьевое 2 коммунально-бытовое 3 хозяйственно-питьевое 4 хозяйственно-питьевое 5 коммунально-бытовое 6 хозяйственно-питьевое 7 рыбохозяйственное (11 категория)* 8 рыбохозяйственное (1 категория)* 9 коммунально-бытовое Приложение 1 - ПДК некоторых веществ в воде водных объектов, мг/л Цель водопользования Показатель хозяйственн о-питьевое коммунальнобытовое Рыбохозяйственное, высшая и Рыбохозяйственное 11 категории 1 категории Взвешенные вещества +0,25* +0,75* +0,25* +0.75* БПК** 3 6 3 3 Свинец 0,1 0,1 0,1 0,1 Ртуть 0,005 0,005 0 0,005 Мышьяк 0,05 0,05 0,05 0,05 Температура воды Допускается повышение не более чем на 3о по отношению к среднемесячной температуре самого жаркого месяца Допускается повышение не более чем на 5о по отношению к естественной температуре воды, но общая температура воды не должна превышать 28 о летом и 8 о зимой * добавление к естественному содержанию в водоем, ** биохимическое потребление кислорода (полное при 20 оС) Практическая работа №13. Техногенное загрязнение атмосферы Цель работы: познакомиться с понятием предельно допустимой концентрации вредных веществ в атмосферном воздухе; научиться выполнять расчет рассеивания в атмосфере вредных веществ, составлять схемы загрязнений и делать выводы о степени загрязненности промышленной и жилой зоны. Понятие предельно допустимой концентрации (ПДК) вредных веществ в атмосферном воздухе, санитарно-защитная зона предприятий Защита воздушного бассейна от загрязнения регламентируется ПДК вредных веществ в атмосферном воздухе населенных пунктов, ПДК выбросов вредных веществ и временно согласованными выбросами вредных веществ от источников загрязнений. ПДК загрязняющих веществ в атмосферном воздухе населенных пунктов регламентированы списком Министерства здравоохранения. ПДК – это максимальная концентрация (мг/м3) вредных веществ в атмосфере, которая при воздействии на протяжении всей жизни человека не оказывает ни на него, ни на окружающую среду в целом вредного действия, включая отдаленные последствия. ПДК вредных веществ в воздухе рабочей зоны являются также концентрации, которые при ежедневной работе в пределах 8 часов в течение всего рабочего стажа не могут вызывать у работающих заболеваний или отклонений в состоянии здоровья, обнаруживаемые современными методами исследований, непосредственно в процессе работы или в отдаленные сроки. Максимальная разовая ПДК макс - основная характеристика опасности вредного вещества. Она устанавливается при кратковременном воздействии атмосферных загрязнений. Среднесуточная ПДКСС устанавливается для предупреждения общетоксического и другого влияния вещества на организм человека при круглосуточном воздействии. Наибольшая концентрация «С» каждого вредного вещества в приземном слое атмосферы не должна превышать: ПДК макс при действии не более 20 минут; ПДК СС при длительном воздействии. При совместном присутствии в атмосфере нескольких вредных веществ, обладающих однонаправленным (усиление эффекта при одновременном воздействии) действием, их безразмерная суммарная концентрация не должна превышать 1: С 1/ ПДК 1 + С2/ ПДК 2 + ∙ ∙ ∙ + С n / ПДК n ≤ 1 , (1) где С1, С2 –фактические концентрации вредных веществ в атмосфере, мг/м3; ПДК1, ПДК2 – предельно допустимые концентрации вредных веществ в атмосфере, мг/м3. Эффектом однонаправленного действия обладают такие вредные вещества, как диоксиды серы и азота, сильные минеральные кислоты – серная, соляная, азотная и др. Значения ПДК и список вредных веществ однонаправленного действия приведены в справочнике ПДК, который периодически изменяется и исправляется. Приземные максимальные концентрации в местах крупных санаториев, зоны отдыха городов не должны превышать 0,8 ПДК. Для каждого проектируемого и действующего предприятия устанавливается предельно допустимый выброс (ПДВ) вредных веществ в атмосферу. Необходимо учитывать концентрацию вредных веществ в атмосфере от других источников, чтобы соблюдалось условие: Сi +Сф ≤ ПДК, (2) где Сi – концентрация вещества в приземном слое от расчетного источника выброса; Сф – фоновая концентрация. Особое внимание следует уделять выбору площадки для промышленного предприятия и взаимному расположению производственных зданий и жилых массивов. Промышленный объект должен быть расположен на возвышенном месте, хорошо продуваемом ветрами. Площадка жилой застройки не должна быть выше предприятия, иначе теряется преимущество высоких труб для рассеивания выбросов. Строительство предприятия со значительными выбросами вредных веществ не рекомендуется на площадках, где может происходить длительный застой примеси при сочетании слабых ветров с температурными инверсиями: в глубоких котловинах, в районах частого образования туманов, ниже плотин ГЭС, в районах возникновения смога. Взаимное расположение предприятий и населенных пунктов определяется по средней розе ветров теплого периода года. Промышленные объекты, являющиеся источниками выделения вредных веществ, располагаются с подветренной стороны от жилых массивов и отделяются от жилой застройки санитарно-защитными зонами. Это территория, за пределами которой загрязнения атмосферы не должны превышать допустимое значение. На границе санитарно-защитной зоны должно выполняться условие: ПДК = 1. В соответствии с санитарной классификацией предприятий устанавливаются размеры санитарно-защитной зоны от 50 м до 1 км. Санитарно-защитная зона может быть увеличена при необходимости и надлежащем технико-экономическом и гигиеническом обосновании, но не более, чем в 3 раза при отсутствии способов очистки выбросов в зависимости от розы ветров. Санитарно-защитная зона или какая-либо часть ее не могут быть резервной частью территории предприятия и использоваться для расширения промышленной площадки. Территория санитарно-защитной зоны должна быть благоустроена и озеленена по проекту благоустройства. В ней допускается размещать предприятия с производствами меньшего класса вредности, при условии аналогичного характера вредности, а также здания управления, магазины и др. Нельзя размещать жилые здания и детские учреждения. Размеры санитарно-защитных зон Х, м, установленные в «Санитарных нормах проектирования промышленных предприятий», должны подтверждаться расчетом. Полученный по расчету размер зоны должен уточняться в зависимости от розы ветров района расположения предприятия по формуле: Xi′ = Xi ∙ Рi /Р0 , (3) где Xi – расчетное расстояние, м, от источника загрязнения до границы санитарнозащитной зоны без учета поправки на розу ветров; Xi′ – то же, с учетом поправки на розу ветров; Pi - среднегодовая повторяемость направлений ветров рассматриваемого румба, %; P0 - повторяемость направлений ветров одного румба при круговой розе ветров, %, при 8 румбовой розе P0 = 100/8 =12,5 %. Если размер санитарно-защитной зоны для предприятия больше установленного, то необходимо пересмотреть проект предприятия и обеспечить снижение выбросов вредных веществ или увеличить высоту выбросов, чтобы обеспечить требования норм по чистоте воздушного бассейна в зоне жилой застройки. Расчет рассеивания в атмосфере вредных веществ Степень опасности загрязнения приземного слоя атмосферного воздуха выбросами вредных веществ определяется по наибольшей рассчитываемой величине приземной концентрации вредных веществ См, мг/м3, которая может устанавливаться на некотором расстоянии от места выброса Хм. Величина наибольшей концентрации каждого вредного вещества См в приземном слое атмосферы не должна превышать величины максимальной разовой предельно допустимой концентрации данного вредного вещества в атмосферном воздухе. Разовые концентрации вредного вещества определяются по пробам, отобранным в течение 20 минут. Величина максимальной приземной концентрации вредного вещества С м для выброса нагретой газовоздушной смеси из одиночного источника с круглым устьем при неблагоприятных метеорологических условиях на расстоянии Хм, м, от источника определяется по формуле: (4) СМ A M F m n , H2 3 v T где А – коэффициент, зависящий от распределения температуры воздуха в атмосфере и определяющий условия вертикального и горизонтального рассеивания вредных веществ в атмосфере воздуха; для Сибири А = 200; М – количество вредного вещества, выбрасываемого в атмосферу, г/сек.; F – безразмерный коэффициент, учитывающий скорость оседания вредных веществ в атмосферном воздухе: для газов F = 1, для золы F = 2 при степени улавливания более 90 %; m, n – безразмерные коэффициенты, учитывающие условия выхода газовоздушной смеси из устья источника выбросов; H – высота выброса над землей, м; Т – разность между температурой выбрасываемой газовоздушной смеси и температурой окружающего атмосферного воздуха, градусов; Т = Тг – Тв; V – объем газовоздушной смеси, м3/с, определяемой по формуле: V , Д2 W0 4 (5) где Д – диаметр устья источника выброса, м; W0 - средняя скорость выхода газовоздушной смеси из устья источника выброса, м/с. Величины M, V определяются расчетом в технологической части проекта или применяются в соответствии с действующими для данного производства (процесса) нормативами. Величину Т, град., следует определять, принимая температуру окружающего воздуха Тв за среднюю температуру наружного воздуха в 13 часов наиболее жаркого месяца года, а температуру выбрасываемой в атмосферу газовоздушной смеси Тг по действующим для данного производства нормативам. Коэффициент m определяется по формуле (6) в зависимости от величины параметра f, м/с2 ∙ град., вычисляемого по формуле (7). m 1 0,67 0,1 f 0,343 f , (6) w2 Д . (7) f 10 2 Н Т Значение безразмерного коэффициента n определяется следующим образом: n = 3 при υ = 0,3; 2 при 0,3 < υ ≤ 2; (8) n 3 0,3 4,36 3 n=1 при υ > 2; здесь 0,65 3 VT , H2 где υ - скорость оседания вредных веществ. Величина максимальной приземной концентрации вредных веществ См при неблагоприятных метеоусловиях достигается на оси факела выброса по направлению среднего ветра за рассматриваемый период на расстоянии Хм , м, от источника выброса. Величина Хм определяется по формуле: Хм = d ∙ H, (9) где d – безразмерная величина, определяемая по формулам: при υ≤2 d 4,95 1 0,28 3 f ; (10) d 7 (1 0,28 3 f ) при υ > 2 ; когда F ≥ 2 , (11) Хм 5F dH . 4 (12) Рис. 1. Рассеивание вредных веществ по оси факела Величины приземных концентраций вредных веществ в атмосфере по оси факела выброса на различных расстояниях от источника выброса определяются по формуле: Ci = S i∙ Cм , (13) Si = 3(Xi/Xм)4 – 8(Xi/Xм)3 + 6(Xi/Xм)2; (14) где при Xi/Xм ≤ 1 при 1< Xi/Xм≤ 8 Si (15) 1,13 ; 0,13(X i / X м ) 2 1 при Xi/Xм > 8 F=1 Xi / Хм Si 2 3,58(X i / X м ) 35,2(X i / X м ) 120 ; (16) при Si = Xi/Xм > 8 и F = 2; 2,5; 3 Si 1 0,1(X i / X м ) 2,47(X i / X м 17,8 . 2 (17) Приземная концентрация вредных веществ в любой точке местности при наличии N источников определяется как сумма концентраций вредных веществ в этой точке от отдельных источников: С м = С1 + С2 + ∙ ∙ ∙ + СN . (18) Если по какому-либо вредному веществу сумма максимальных приведенных концентраций См от всех источников окажется меньшей или равной ПДК, то дальнейший расчет рассеивания этого вещества в атмосфере производить необязательно. Начальные или фоновые концентрации вредных веществ, содержащихся в атмосфере, 3 мг/м , должны учитываться при проектировании вновь строящихся предприятий в районах, где атмосферный воздух уже загрязнен от других предприятий. Данные для расчета рассеивания вредных веществ в атмосферном воздухе по формулам (7.4 – 7.12) выписываются из «Экологического паспорта промышленного предприятия», введенного с 1.07.90., ГОСТ 17.0.0.04-90. Содержание задания 1) по данным экологического паспорта промышленного предприятия вычислить по формулам (4 – 8) значения См и по формуле (1) определить суммарную концентрацию при однонаправленном действии вредных веществ, приведенных в таблице 2. Пример расчета приведен в табл. 3; 2) определить расстояние Хм, на котором находится от источника максимальная приземная концентрация См, по формулам (9 – 12); 3) определить величины приземных концентраций С i вредного вещества в атмосфере по оси факела выброса на различных расстояниях Xi от источника по формулам (13 –17). Шаг по оси Х взять равным 1 – 2 см в масштабе карты. Значения Ci получены в долях ПДК согласно формуле (1). Вычислить расстояния Xi с учетом поправки на розу ветров по формуле (3). Вычисления выполнить для всех 8 румбов розы ветров. Характеристика розы ветров приведена ниже. Вычисления рекомендуется оформить таблицей (табл. 1). Таблица 1 Вычисление величин приземных концентраций вредных веществ в атмосфере и их расстояний от источника выброса Xi, м Si Ci Xi ′ по румбам С СВ В ЮВ Ю ЮЗ З СЗ 4) на листе бумаги или кальки нанести линии румбов, отложить соответствующие им расстояния Xi в масштабе карты (по заданию преподавателя) и подписать значения Ci. По полученным точкам построить изолинии загрязнений путем интерполяции через 0.5 ПДК. 5) совместить полученную схему с источником загрязнений на карте. Нарисовать изолинии на карте, подписав их значения. Сделать выводы о степени загрязнения промышленной и жилой зоны. Материалы для сдачи зачета: - пояснительная записка; - вычисления значений См, Хм и таблица вычисления значений Ci, Xi′; - схема изолиний загрязнения; - фрагмент экологической карты загрязнения от одиночного источника выброса промышленного предприятия. Таблица 2 ПДК (мг/м3) загрязняющих веществ в атмосферном воздухе населенных пунктов Вредные вещества Серный ангидрид Диоксид азота Двуокись серы Оксид углерода Фенол Пыль Зола Бензол Фенол ПДКмакс 0,5 0,085 0,5 5,0 0,003 3,0 0,3 1,5 0,003 ПДКсс 0,05 0,04 0,05 3,0 0,003 3,0 0,1 0,8 0,003 Характеристика розы ветров Распределение вредных веществ в атмосфере определяется в зависимости от розы ветров района расположения предприятия. Роза ветров – это векторная диаграмма, характеризующая режим ветра в данном месте по многолетним наблюдениям. Частота ветров (Pi дней): С -31; СВ – 32,5; В – 26,1; ЮВ – 35,0; Ю – 47,2; ЮЗ – 53,4; З – 39,3; СЗ – 31,5. Рис. 2. Роза ветров района расположения предприятия Повторяемость направлений ветров одного румба P0 = Pi/8. Расстояние Xi с учетом поправки на розу ветров определяется по формуле (3). Таблица 3 Пример расчета концентрации вредных веществ в атмосфере. Объект: котельная в г. Новосибирске. Характеристика обозначения, расчет 1 1. Число дымовых труб, N 2. Высота, H 3. Диаметр устья трубы, Д 4. Скорость выхода газовоздушной смеси, W0 5. Температура газовоздушной смеси, Тг 6. Температура окружающего воздуха, Тв 7. Выброс двуокиси серы, Mсеры 8. Выброс золы (мелкодисперсной аэрозоли), Мз 9. Выброс диоксида азота, Мазота 10. Коэффициенты в формуле (7.4): А F 11. Среднесуточные ПДКСС: двуокиси серы золы диоксида азота 12. Объем газовоздушной смеси (формула 7.5) 13. Перегрев газ.смеси Т = Тг - Тв 14. Параметр f по формуле (7.7) 15. Параметр υ по формуле (7.8) 16. Параметр m по формуле (7.6) 17. Параметр n по формуле (7.8) при υ > 2 18. Параметр d по формуле (7.11) 19. Значение Хм по формуле (7.9) 20. Значение См для двуокиси серы 21. Значение См для золы 22. Значение Смυ для диоксида азота 23. Безразмерная суммарная концентрация по формуле (7.1) Един. изм. 2 штук м м м/с град. С град. С г/с г/с г/с Значение 3 1 35 1,4 7 125 25 12 2,6 0,2 - 200 1 мг/м3 мг/м3 мг/м3 м3/с град. С м/с м мг/м3 мг/м3 мг/м3 - 0,05 0,1 0,04 10,8 100 0,56 2,04 0.08 1 12,3 430,5 0,19 0,12 0.002 5,05 Вычисления Si, Ci, Xi выполнить в таблице 1 по указанным формулам. Таблица 4 Исходные данные к заданию Вредные вещества, их код и величина выбросов (№) Вредные вещества Код Выбросы Мi, г/с № 1 2 3 4 5 Серный ангидрид Диоксид азота Двуокись серы Оксид углерода Фенол Пыль Зола Бензол а б в г д е ж з 12 7 5 26 6 6 10 2 6 5 4 18 8 12 11 3 8 11 8 20 4 14 13 2 Таблица 5 Исходные данные к заданию. Вредные вещества даны по коду и № (табл.4) вар. Н, м Д, м W0,м/с Тг, ˚ С Тв, ˚ С М1 М2 1 36 1,0 6 130 20 а3 г3 2 40 1,2 7 125 20 б2 д2 3 70 1,5 8 120 25 б1 ж4 4 120 2,6 7,5 130 20 а4 б2 5 80 2,0 6,8 140 25 г3 д3 6 100 2,7 7,0 125 25 а2 б5 7 110 3,5 5,9 130 20 а4 б2 8 85 2,7 8,0 140 15 г1 д2 9 93 2,9 7,5 140 18 г4 д1 10 100 3,0 6,8 120 17 б3 ж5 11 110 2,1 8,0 125 25 в4 д3 12 65 1,7 7,1 120 20 а 2 д1 13 70 2,0 6,5 132 19 б5 г5 14 80 1,8 8,6 130 15 д3 е2 15 95 2,1 7,5 130 23 в2 ж5 16 45 1,3 7,0 118 25 а1 г4 17 30 1,0 6,5 120 25 в3 д3 18 60 1,5 6,8 125 20 б4 д1 19 50 1,4 7,0 129 20 д1 е3 20 45 1,2 7,1 130 18 в3 ж5 21 35 1,5 6,5 140 20 а3 б4 22 40 1,3 7,3 135 15 а1 б1 23 50 1,4 7,0 138 28 г3 д3 24 70 2,3 7,3 126 25 г2 д1 25 65 2,3 7,6 118 20 б1 ж4 10 16 6 17 3 8 15 5 4 6 10 18 5 20 8 4 М3 е4 ж3 з2 е5 ж4 е1 ж2 ж5 е4 з2 ж4 е5 е2 з5 з1 е3 ж2 ж4 з 1 з 2 е2 ж1 ж5 е4 з 1 Контрольные вопросы (ответить письменно) 1. Что такое ПДК? 2. Как определяется загрязнение атмосферы при одновременном действии нескольких вредных веществ? 3. Что называется санитарно-защитной зоной предприятия? 4. Каковы требования к санитарно-защитной зоне предприятия? 5. Как определяется размер санитарно-защитной зоны? 6. Как выполняется расчет рассеивания в атмосфере вредных веществ?