Лабораторная работа N3.22
advertisement
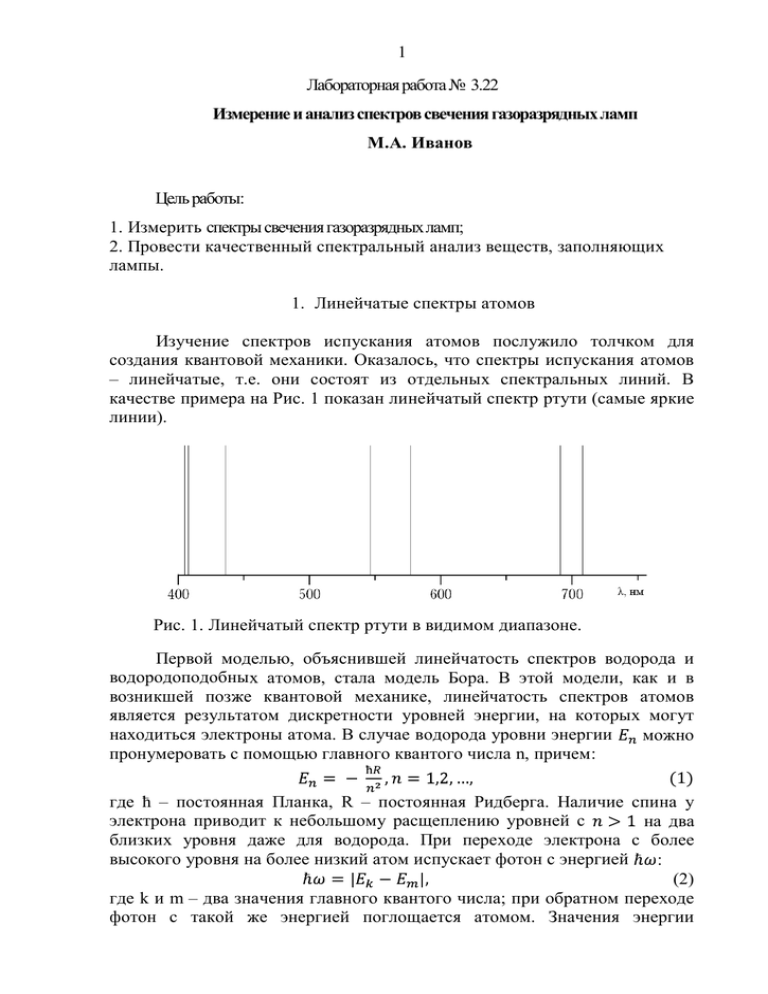
1 Лабораторная работа № 3.22 Измерение и анализ спектров свечения газоразрядных ламп М.А. Иванов Цель работы: 1. Измерить спектры свечения газоразрядных ламп; 2. Провести качественный спектральный анализ веществ, заполняющих лампы. 1. Линейчатые спектры атомов Изучение спектров испускания атомов послужило толчком для создания квантовой механики. Оказалось, что спектры испускания атомов – линейчатые, т.е. они состоят из отдельных спектральных линий. В качестве примера на Рис. 1 показан линейчатый спектр ртути (самые яркие линии). Рис. 1. Линейчатый спектр ртути в видимом диапазоне. Первой моделью, объяснившей линейчатость спектров водорода и водородоподобных атомов, стала модель Бора. В этой модели, как и в возникшей позже квантовой механике, линейчатость спектров атомов является результатом дискретности уровней энергии, на которых могут находиться электроны атома. В случае водорода уровни энергии можно пронумеровать с помощью главного квантого числа n, причем: (1) где ћ – постоянная Планка, R – постоянная Ридберга. Наличие спина у электрона приводит к небольшому расщеплению уровней с на два близких уровня даже для водорода. При переходе электрона с более высокого уровня на более низкий атом испускает фотон с энергией : (2) где k и m – два значения главного квантого числа; при обратном переходе фотон с такой же энергией поглощается атомом. Значения энергии 2 одиночного фотона запрещены, но возможно одновременное поглощение нескольких фотонов с суммарной энергией, равной (многофотонный процесс). В многоэлектронных атомах помимо кулоновского взаимодействия каждого электрона с ядром имеются также взаимодействия электронов друг с другом и обменное взаимодействие, связанное с неразличимостью электронов при их квантовомеханическом описании. Движение каждого из электронов можно рассматривать происходящим в некотором усредненном поле, создаваемом ядром и всеми другими электронами. Для многоэлектронных атомов уровни энергии электрона зависят, кроме n, еще от трех квантовых чисел: азимутального числа l, магнитного числа и , причем от n и l сильнее, чем от последних спинового магнитного числа двух чисел. Главное квантовое число n описывает взаимодействие электрона с усредненным электрическим полем ядра и внутренних электронов атома. Азимутальное число характеризует момент импульса электрона при его движении вокруг ядра. Электрон имеет электрический заряд, поэтому такое движение приводит к возникновению магнитного момента, проекция которого на выделенное направление характеризуется магнитным квантовым числом Спин электрона также приводит к наличию спинового магнитного момента электрона, проекция которого на выделенное направление характеризуется спиновым магнитным квантовым числом Электроны являются фермионами (частицами с полуцелым спином), и подчиняются принципу Паули: в замкнутой системе (например, в атоме) не может существовать двух фермионов с одинаковым набором квантовых чисел. Кроме того, как и всякая физическая система, атом стремится занять состояние с наименьшей энергией, которое наиболее устойчиво. Принцип Паули и требование наименьшей энергии новых состояний определяют строение периодической таблицы Менделеева. Взаимодействие магнитных орбитальных и спиновых моментов между собой приводит к тому, что энергия валентных электронов атома зависит от четырех квантовых чисел: главного квантого числа n самого электрона, квантого числа L суммарного орбитального момента атома, квантого числа S суммарного спинового момента атома и квантого числа J полного момента атома. Квантовое число L всегда целое; число S целое при четном числе электронов атома и полуцелое при нечетном числе электронов. При данных L и S число J должно иметь одно из следующих значений: Совокупность квантовых чисел L, S, J состояния атома называют термом атома. Терм принято записывать как: (3) где (L) – латинская буква, которую принято сопоставлять данному значению числа L (см. табличку), 2S+1 дает мультиплетность терма, 3 т.е. количество подуровней, отличающихся значениями числа J. L (L) 0 S 1 P 2 D 3 F … … Например, термы имеют и значения При испускании или поглощении фотона атом переходит с одного уровня на другой, причем для квантовых чисел атома выполняются правила отбора: обусловленные значением спина фотона, равного 1. На Рис. 2 в качестве примера показана схема уровней энергии атома натрия; интервал энергий (-1 эВ – 0 эВ) дополнительно растянут. Уровни с разными значениями L сгрупированы в столбцы и помечены буквами S, P, D для L = 1, 2, 3. Возможные серии переходов с (переходы показаны наклонными линиями) имеют названия; первые буквы S, P, D этих названий на английском как раз и используются для обозначения термов атомов. Рис. 2. Схема уровней энергии атома натрия. 2. Спектральный анализ Спектральным анализом называется физический метод определения химического состава вещества, основанный на изучении спектра излучения или поглощения электромагнитных волн этим веществом. Различают качественный и количественный анализ. Задачей качественного спектрального анализа является установление всех химических элементов, из которых состоит исследуемый образец. Она решается путем измерения длин волн спектральных линий излучения вещества и отождествления их по таблицам спектральных линий с линиями определенных химических элементов. В задачу количественного спектрального анализа входит определение концентраций химических элементов, содержащихся в веществе -- источнике излучения. Этот анализ производится путем 4 измерения интенсивностей спектральных линий данного элемента и последующего сравнения их с интенсивностями тех же линий в образцах с известной концентрацией того же элемента. Спектральный анализ в подавляющем большинстве случаев точнее, быстрее и чувствительнее химических методов и поэтому широко применяется в современном производстве и в научных исследованиях. По положению линий в спектре, т.е. по их длинам волн, можно судить об уровнях энергии и внутреннем строении атомов и молекул, а по интенсивности линий – о вероятностях переходов между отдельными уровнями. Интенсивность спектральных линий определяется также числом излучающих атомов и молекул, что дает возможность определить содержание отдельных элементов и молекулярных соединений в исследуемом веществе. Различают атомный и молекулярный спектральный анализ. В обоих случаях анализ может проводиться по спектрам излучения и тогда он называется эмиссионным. Анализ по спектрам поглощения называется абсорбционным. Линии излучения и поглощения данного элемента имеют одинаковые длины волн. Интересный факт из истории: в 1868 году Парижская академия наук организовала экспедицию в Индию, где предстояло полное солнечное затмение. Там учёные обнаружили: все тёмные линии в спектре солнца (линии Фраунгофера) в момент затмения, когда спектр излучения сменил спектр поглощения солнечной короны, стали, как и было предсказано, яркими на тёмном фоне. Спектр солнца, снятый с очень высоким разрешением, со множеством линий Фраунгофера можно увидеть на плакате в лаборатории 503-4. Спектры излучения атомов обычно получают при высокой температуре источника света, при которой происходит испарение вещества, расщепление его молекул на отдельные атомы и возбуждение атомов. Спектры молекул можно изучать и в излучении, и в поглощении (например, в лабораторной работе 3.9 изучается спектр поглощения молекул йода). Спектры сложных молекул легче изучать в поглощении, так как при этом они не распадаются. При абсорбционном анализе свет от источника со сплошным спектром пропускают через исследуемое вещество. При этом часть световой энергии будет избирательно поглощаться атомами или молекулами вещества. В результате на фоне сплошного спектра появятся темные линии и полосы поглощения. По положению, структуре и коэффициенту поглощения этих линий можно узнать состав и строение исследуемого вещества. Спектральные переходы возможны только между определенными уровнями энергии. Никаких промежуточных переходов в атоме быть не может. Следовательно, не может быть и квантов света с промежуточными значениями энергии, а значит и частоты. Атомы каждого химического 5 элемента имеют присущий только им набор возможных стационарных энергетических состояний. Переходы между этими состояниями и образуют спектр частот излучения (или поглощения), характерный только для данного элемента. Именно поэтому оказывается возможным отождествление химического элемента по его спектру испускания или поглощения, т.е. качественный спектральный анализ. Число спектральных линий одинаковых атомов может быть очень велико. Например, спектр железа только в видимой и ультрафиолетовой областях содержит около 60 тысяч линий с различной интенсивностью. У других многоэлектронных атомов число линий того же порядка. Следовательно, не исключено случайное совпадение некоторых длин волн в спектре различных атомов, что в спектроскопии называется “наложением” линий. Поэтому качественный спектральный анализ следует проводить по нескольким наиболее интенсивным линиям атомов или молекул в исследуемом спектре. Совпадение измеренных длин волн этих линий с табличными данными надежно показывает присутствие определенных атомов или молекул в источнике излучения. На Рис. 3 приведены спектры поглощения атомов Ca, H, Fe и Mg, а внизу – спектр некой звезды, снятый тем же спектральным прибором. Попробуйте для тренировки установить, какие из этих четырех элементов содержатся в атмосфере звезды. Рис. 3. Спектры поглощения атомов Ca, H, Fe и Mg, внизу – спектр некой звезды, снятый тем же спектральным прибором. Наиболее полной и удобной базой данных по атомным спектрам является база американского Национального института стандартов и технологий -- the NIST Atomic Spectra Database. Она доступна через интернет, имеет хороший интерфейс пользователя. Приведенные ниже таблицы спектральных линий составлены по данным из этой базы. Для разложения света на монохроматические компоненты и их изучения используют спектроскопы и спектрометры. В качестве их 6 диспергирующих элементов чаще всего используются призмы и дифракционные решетки. Спектроскопы дают возможность изучать спектр визуально или фотографировать его – результат будет таким как на Рис. 3. Спектрометры позволяют измерять длины волн спектральных линий, а их разновидность -- спектрофотометры – еще и измерять интенсивность света как функцию длины волны (пример такого измерения показан ниже на Рис.4). Доступным спектральным прибором является компакт-диск. Расстояние между его дорожками с записями около 1,5 микрометров, и на отражение он работает как дифракционная решетка с 700 штрихами на миллиметр. При освещении диска солнечным светом вы видите все цвета непрерывного спектра, а при освещении люминесцентной лампой вы увидите отдельные линии с темными провалами между ними. Если ламп много или лампа близко расположена, перед диском нужно поместить картонку с узкой прорезью – щель. 3. Газоразрядные лампы Удобными для учебной лаборатории источниками света с линейчатым спектром являются газоразрядные лампы. В них светится газ, через который течет ток. Протекание тока через газ принято называть газовым разрядом. Одна из разновидностей таких ламп – это лампы с холодным катодом, которые используются, в частности, в рекламном освещении, еще их называют неоновыми, хотя их заполняют разными инертными газами (неоном, криптоном, аргоном и другими) и их смесями при низком давлении, а также водородом, парами ртути. Цвет свечения зависит от состава газа. В смеси аргона с парами ртути аргон служит буферным газом, его собственное свечение имеет малую интенсивность. При протекании тока в такой смеси, кроме прямой ионизации атомов газа электронами, происходит также образование метастабильных состояний атомов аргона с последующей ионизацией атомов ртути при столкновениях с ними. Это приводит к существенному снижению напряжения пробоя межэлектродного промежутка, т.е. напряжения зажигания разряда. Цвет свечения такой смеси – оттенок синего, цвет лаванды. Это изменение цвета обусловлено изменением относительной интенсивности линий ртути при новом характере возбуждения ее атомов. На такие лампы подают высокое напряжение – от нескольких киловольт, желательно высокой частоты, чтобы лампы не мигали. Другая разновидность – это люминесцентные лампы, трубки которых изнутри покрывают люминофором. Люминофор под действием ультрафиолетового излучения газа испускает свет видимого диапазона за счет люминесценции, что приводит к повышению эффективности лампы как источника видимого света. Такую разновидность люминесценции называют фотолюминесценцией. Люминесцентные лампы используют для 7 освещения. Это лампы с подогреваемым катодом, включаемые в сеть переменного тока и имеющие специальную схему запуска и ограничения тока – балласт. Состав люминофора подбирают так, чтобы глазу свет лампы казался белым или желтоватым. В последние годы компактные люминесцентные лампы с обычным цоколем, в котором смонтирован электронный балласт (их называют еще экономичными), начали вытеснять лампы накаливания в быту. Люминесцентные лампы используют также для многих других целей, например подсвечивания жидкокристаллических дисплеев (лампы с холодным катодом). В настоящее время используются два различных ряда люминофоров. Галофосфаты, в основе которых лежат хлор-фтор-фосфат кальция или стронция, это более старые люминофоры, нашедшие широкое применение в начале 1950-х годов. Второй ряд люминофоров включает люминофоры на основе редкоземельных металлов, таких как иттрий, лантан и другие. Эти редкоземельные люминофоры имеют узкий спектр излучения, и обычно используется их смесь. Спектр люминесцентной лампы включает как линии свечения газа -часто паров ртути и натрия, так и сложный спектр свечения люминофора, который содержит и непрерывную часть и дискретные линии. На Рис. 4 показан спектр люминесцентной лампы в видимом диапазоне, измеренный с помощью спектрометра Ocean Optics HR2000. Спектральные линии на фоне непрерывного спектра принадлежат атомам ртути, пары которой заполняют лампу, и некоторым ионам люминофора. Сдвоенный пик в центре через монохроматор был бы виден как две ярких зеленых линии на зеленом фоне. Рис. 4. Спектр люминесцентной лампы в видимом диапазоне, измеренный с помощью спектрометра Ocean Optics HR2000 (материал из Википедии). 4. Экспериментальная установка. 8 Приборы и оборудование: монохроматор МУМ, две лампы с холодным катодом №1 и №2 и независимыми преобразователями напряжения, компактная люминесцентная лампа №3. Экспериментальная установка собрана на базе монохроматора МУМ. Основным элементом этого монохроматора является дифракционная решётка с переменным шагом нарезки и криволинейными штрихами, что обеспечивает абсолютную калибровку (т.е. пропускаемая монохроматором длина волны в нанометрах равна показанию механического счетчика) и даёт возможность скомпенсировать расфокусировку по мере изменения длины волны и другие аберрации. Схема установки изображена на Рис. 5. Кроме монохроматора, установка содержит три лампы, которые смонтированы на передней панели поворотной конструкции (расположение ламп слева направо: №2, №1, №3) и прикрыты решеткой. Каждая лампа включается в сеть независимо от других своим шнуром с вилкой; вилки помечены номерами ламп. Конструкцию с лампами можно слегка повернуть вокруг вертикальной оси, чтобы включенная лампа оказалась перед входной щелью монохроматора. Лампы нужно включать по одной. Рис. 5. Схема экспериментальной установки. Перед входной щелью монохроматора 2 устанавливается одна из исследуемых ламп (1). Излучение от лампы 1 попадает на входную щель 2 и зеркалом 3 направляется на дифракционную решетку 4. Разложенное на монохроматические компоненты излучение, отразившись от зеркала 5, попадает через выходное окно и выходную щель 6 в окуляр 7. Сканирование спектра осуществляется поворотом решётки с помощью рукоятки редуктора 8. Длина волны излучения, попадающего в центр поля зрения окуляра и на визир (указатель) – тонкую проволочку внизу поля 9 зрения окуляра, определяется в нанометрах непосредственно по цифровому механическому счётчику 9 с точностью до 0,1 нм (десятые доли отсчитываются по цилиндрической шкале, цена деления 0,2 нм). Ниже выходного окна 6 имеется стержень 10, с помощью которого производится поворот зеркала 5 при настройке монохроматора перед началом измерений. 5. Порядок выполнения работы и анализа результатов измерений 1. Включите в сеть лампу №1 (синюю). Установите окуляр в патрубок выходного окна. Осуществите фокусировку окуляра, двигая его вдоль оси и добиваясь чёткой видимости указателя и какой-нибудь линии спектра. 2. Установите на счетчике монохроматора 435,8 нм. Задвиньте стержень 10 от себя до упора; с помощью этого стержня, двигая его от себя или на себя, установите яркую синюю линию спектра лампы №1 напротив указателя. Теперь шкала монохроматора привязана к этой спектральной линии; стержень 10 должен оставаться в таком положении при выполнении всех измерений. 3. Просматривая видимый диапазон 400 – 750 нм, измерьте длины волн всех спектральных линий лампы №1. Для этого рукоятку 8 вращают до тех пор, пока центр линии не окажется напротив указателя, показания счетчика считывают с точностью до 0,1 нм. 4. Измеренные длины волн линий занесите в Таблицу 1. 5. Выключите лампу №1, включите лампу №2 (красную), повторите пункты 3 и 4 для нее; проделайте те же операции с лампой №3 (белой). Таблица 1. Измеренные длины волн спектральных линий Лампа №1 Лампа №2 Лампа №3 элемент элемент элемент 6. Осталось самое интересное: используя данные о длинах волн спектральных линий атомов некоторых элементов из Таблицы 2, отождествите измеренные длины волн линий каждой лампы с табличными, если это возможно. Разница не должна превышать 0,5 нм. Те линии, которые удалось отождествить, пометьте в соседнем столбце Табл. 1 символом соответствующего элемента. 7. Сформулируйте результаты анализа: сколько линий в спектре каждой лампы, какие химические элементы удалось обнаружить по спектрам ламп, сколько их линий удалось отождествить. He 447.1480 501.5678 587.5621 587.5621 587.5621 587.5621 667.8151 706.5190 Ne 453.77545 470.43949 470.88594 471.00650 471.20633 471.5344 478.89258 482.7338 488.49170 495.70335 534.10938 540.05616 585.24878 588.18950 602.99968 607.43376 614.30627 616.35937 621.72812 626.64952 633.44276 638.29914 640.2248 650.65277 659.89528 692.94672 702.40500 703.24128 705.91079 717.39380 724.51665 743.88981 748.88712 10 Таблица 2. Длины волн спектральных линий атомов, нм Ar Kr Na 696.5431 427.39694 418.55 706.7218 431.95795 443.23 714.7042 437.61216 507.12 727.2936 446.36900 588.99509 738.3980 557.02894 589.59242 587.09159 Hg 404.6565 407.7837 410.8054 433.92232 434.74945 435.8335 491.6068 496.01 510.2705 512.0637 513.7940 529.0740 535.4034 538.4626 546.0750 554.9634 567.581 576.9610 578.969 579.0670 N 496.398 575.250 646.844 648.270 648.375 648.480 742.364 744.229 746.831 Eu+3 (как примесь в решетке Y2O3) 587.6 593.4 599.7 611.6 631.1 650.8 662.6 687.7 693.7 707 709 712.3 11 1. 2. 3. 4. 6. Задание Изучите экспериментальную установку. Проведите привязку шкалы монохроматора к известной спектральной линии. Измерьте спектры всех трех ламп. Проведите качественный спектральный анализ для каждой лампы. 8. Контрольные вопросы 1. С чем связана линейчатость спектров атомов? 2. Как найти энергию испускаемого/поглощаемого атомом фотона? 3. В чем состоит принцип Паули? 4. Что характеризуют квантовые числа атома L, S, J? 5. Как обозначают термы атома? Приведите пример. 6. Как проводят качественный спектральный анализ вещества? 7. Что светится в газоразрядных лампах? Почему? 8. Зачем трубки ламп изнутри покрывают люминофором? 9. Как устроен монохроматор МУМ? 10. В составе двух ламп этой установки имеется одно и то же вещество. Почему у них разный цвет свечения? 7. Техника безопасности На лампы №1 и №2 подается высокое напряжение 4,5 кВ, будьте осторожны. Нельзя лезть руками под защитную решетку или стенки поворотной конструкции, за которыми установлены преобразователи напряжения, вставлять туда любые предметы – ручки, карандаши, трясти установку или наваливаться на нее телом, толкаться возле установки. 9. Литература 1. И. В. Савельев. Курс общей физики. Том 3. - М.: Наука, 1987. 2. 3. Э. В. Шпольский. Атомная физика, т.1. М., Наука, 1963. 3. Качественный спектральный анализ с помощью монохроматора УМ2. Саратовский госуниверситет, кафедра оптики и биофотоники. Практикум по курсу общей физики: Оптика. Выпуск 3: Спектроскопия, Лабораторная работа № 2. optics.sgu.ru/_media/library/education/opt3lab2.pdf. 4. Г. Н. Рохлин. Газоразрядные источники света. М.: Энергоатомиздат, 1991. 5. NIST Atomic Spectra Database. http://www.nist.gov/pml/data/asd.cfm. 12 Краткая инструкция по выполнению работы № 3.22 Рис. 5. Схема экспериментальной установки. 1. Включите в сеть лампу №1 (синюю). Установите окуляр в патрубок выходного окна. Осуществите фокусировку окуляра, двигая его вдоль оси и добиваясь чёткой видимости указателя и какой-нибудь линии спектра. 2. Установите на счетчике монохроматора 435,8 нм. Задвиньте стержень 10 от себя до упора; с помощью этого стержня, двигая его от себя или на себя, установите яркую синюю линию спектра лампы №1 напротив указателя. Теперь шкала монохроматора привязана к этой спектральной линии; стержень 10 должен оставаться в таком положении при выполнении всех измерений. 3. Просматривая видимый диапазон 400 – 750 нм, измерьте длины волн всех спектральных линий лампы №1. Для этого рукоятку 8 вращайте до тех пор, пока центр линии не окажется напротив указателя, показания счетчика считывают с точностью до 0,1 нм. 4. Измеренные длины волн линий занесите в Таблицу 1. 5. Выключите лампу №1, включите лампу №2 (красную), повторите пункты 3 и 4 для нее; проделайте те же операции с лампой №3 (белой). 6. Используя данные из Таблицы 2, отождествите измеренные длины волн линий каждой лампы с табличными, если это возможно. Разница не должна превышать 0,5 нм. Те линии, которые удалось отождествить, пометьте в соседнем столбце Табл. 1 символом соответствующего элемента. 7. Сформулируйте результаты анализа: сколько линий в спектре каждой лампы, какие химические элементы удалось обнаружить по спектрам ламп, сколько их линий удалось отождествить. 13 Рис. 3 -- Цветная версия.
