Химические свойства Fe
advertisement
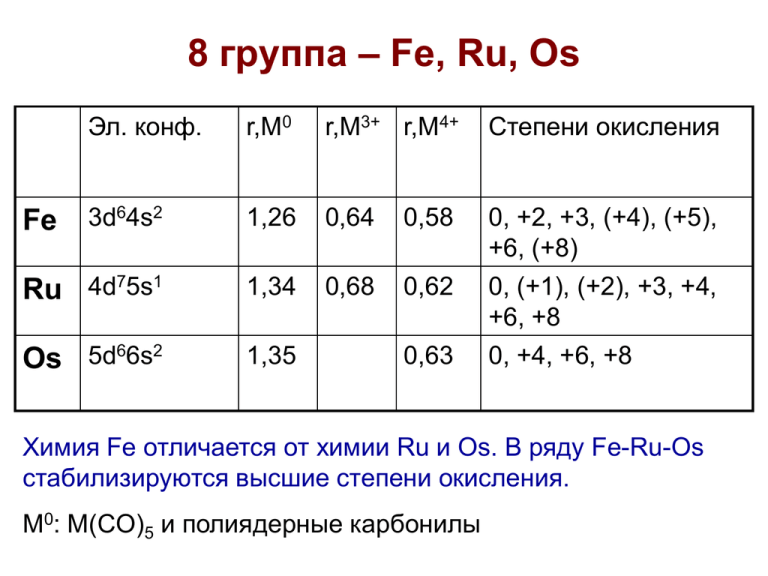
8 группа – Fe, Ru, Os
Эл. конф.
r,M0
r,M3+ r,M4+
Степени окисления
3d64s2
1,26
0,64
0,58
Ru 4d75s1
1,34
0,68
0,62
Os 5d66s2
1,35
0, +2, +3, (+4), (+5),
+6, (+8)
0, (+1), (+2), +3, +4,
+6, +8
0, +4, +6, +8
Fe
0,63
Химия Fe отличается от химии Ru и Os. В ряду Fe-Ru-Os
стабилизируются высшие степени окисления.
M0: M(CO)5 и полиядерные карбонилы
Содержание в земной коре и
минералы
• Fe – 4 место, FeS2 – пирит (слева); Fe2O3 - гематит;
Fe3O4 – магнетит (в центре); FeCO3 – сидерит
(справа) и др.
• Ru – 73 место, редкий
• Os – 74 место, редкий
Трудно оценить запасы платиновых металлов.
Открытие элементов
• Fe – известен с глубокой древности; лат. Ferreus твердый
• Ru – 1844 г. Проф. Казанского университета К.К.
Клаус; лат. Ruthenia - Русь
• Os – 1804 г. Англ. С. Пеннант; греч. Osmë - запах
Химические свойства Fe
3Fe + 2O2 = Fe3O4 горение на воздухе
4Fe + 3O2 = 2Fe2O3 горение в чистом кислороде
Во влажном воздухе подвергается коррозии с
образованием Fe2O3.xH2O.
Fe не реагирует с растворами щелочей, пассивируется
конц. HNO3 и H2SO4.
Минеральные кислоты растворяют металл с образ. солей
Fe(II) (или Fe(III) – конц. HNO3, H2SO4 при Т):
Fe + 2H+ = Fe2+ + H2
2Fe + 3X2 = 2FeX3 (X = F, Cl, Br; но с I2 образуется FeI2)
Fe + S = FeS (при нагревании)
3Fe + С = Fe3С (при нагревании)
Высшая степень окисления Fe(VI)
Высшие степени окисления стабилизируются кислородом.
Феррат(VI):
Fe2O3 + 3OCl- +4OH- = 2FeO42- + 3Cl- + 2H2O
Щелочные растворы стабильны, нейтральные нет:
4FeO42- + 6H2O = FeO(OH) + 8OH- +3O2
Сильный окислитель:
FeO42- + 8H+ +3e = Fe3+ + 4H2O Eo = +2,20 В
Соли: Na2FeO4, K2FeO4 – темно-красно-фиолетовые,
растворимы в воде, в структуре тетраэдры FeO42-
Степени окисления Fe(V), Fe(IV)
K2FeO4 +KOH = K3FeO4 + H2O +1/2O2 (1000oC) – очень
редкий пример Fe(V).
Ферраты(IV): Na4FeO4, Sr2FeO4, Ba2FeO4 – получают
сплавлением с пероксидами:
FeSO4 + 3BaO2 = Ba2FeO4 + BaSO4 + O2
Только Na4FeO4 содержит дискретные анионы FeO44-,
диспропорционирует в воде:
3Na4FeO4 + 5H2O = Na2FeO4 + Fe2O3 + 10NaOH
Мало примеров фторидов: Cs2[FeF6]
Галогениды Fe(III)
2Fe(CO)4I2 + I2 = 2FeI3 + 8CO (hν, в растворе)
2FeI3 = 2FeI2 +I2 (легко при нагревании)
FeF3 – структура ReO3
FeCl3 – темно-зеленый/черный, структура BiI3
FeBr3 – красно-коричневый, структура BiI3
В газе равновесие: (FeX3)2 = 2FeX3 (X = Cl, Br)
FeCl3 + 6H2O = FeCl3.6H2O – оранжевокоричневый trans-[FeCl2(H2O)4]Cl.2H2O
Кислородсодержащие соединения
Fe(III)
,,,ε-Fe2O3 имеют различное строение и свойства,
нерастворимы в воде, (трудно) растворимы в минеральных
кислотах (с образованием [Fe(H2O)6]3+) и крепких щелочах
– [Fe(OH)6]3-.
При 1400оС Fe2O3 разлагается с образованием черного
Fe3O4=FeIIFeIII2O4 (ферромагнитные свойства).
Fe3+ + OH- = аморфный красно-коричневый осадок.
Нет гидрокида Fe(OH)3 – записывают Fe2O3.xH2O или
FeO(OH); амфотерные свойства.
Комплексы Fe(III) –d5
Наиболее типична октаэдрическая координация.
Высокоспиновые комплексы: [Fe(H2O)6]3+, [FeF6]3-,
[Fe(ox)3]3-
Низкоспиновые: [Fe(CN)6]3-, [Fe(en)3]3+, [Fe(phen)3]3+
↑
d5
↑↓ ↑↓ ↑
↑↓ ↑
↑
Комплексы Fe(III) –d5
[Fe(H2O)6]3+ +H2O = [Fe(H2O)5(OH)]2+ + H3O+ pKa = 2,0
[(H2O)5Fe-O-Fe(H2O)5]4+ линейное строение
[Fe(NH3)6]3+ - только в жидком NH3
[Fe(CN)6]3- + e = [Fe(CN)6]4- E0 = + 0,36 В
[Fe(H2O)6]3+ + e = [Fe(H2O)6]2+ E0 = +0,77 В
[Fe(phen)3]3+ + e = [Fe(phen)3]2+ E0 = +1,12 В
Fe3+ + H2O + 5SCN- = [Fe(NCS)5(H2O)]2- - кроваво-красный
[Fe(NCS)6]3- - лучше получать в неводной среде.
КЧ = 7: [Fe(edta)(H2O)]-
Соединения Fe(II)
Fe + I2 = FeI2
Fe + 2HX = FeX2 + H2 (X = F, Cl, Br)
FeO – черный, нерастворим в воде, структура NaCl
Fe(C2O4) = FeO + CO2 + CO (разложение в вакууме)
Диспропорционирование при нагревании:
4FeO = Fe3O4 + Fe
Fe(OH)2 – нерастворим в воде, бесцветный, быстро
окисляется (зеленый, потом коричневый).
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Fe(OH)2 + 4NaOH(конц) = Na4[Fe(OH)6] – сине-зеленый р-р
Комплексы Fe(II) –d5
Аквакомплекс – Fe(H2O)6]2+ - высокоспиновый d6
Низкоспиновые диамагнитные: [Fe(phen)3]2+, [Fe(CN)6]4-
FeX2 + 6NH3(газ) = [Fe(NH3)6]2+ - разлагается в воде
FeCl2.4H2O содержит [FeCl2(H2O)4]
Редкий пример тетраэдрического комплекса:
2MCl + FeCl2 = M2[FeCl4] (в этаноле)
d6
↑↓ ↑↓ ↑↓
↑ ↑
↑↓ ↑ ↑
Цианидные комплексы Fe
K4[Fe(CN)6] – желтая кровяная соль (диамагнитный d6)
K3[Fe(CN)6] – красная кровяная соль (низкоспиновый d5)
2K4[Fe(CN)6] + Cl2 = 2 K3[Fe(CN)6] + 2KCl (или электролиз)
CN лиганд более лабилен в гексацианоферрате(III)?????
[Fe(CN)6]3- более слабый окислитель, чем аквакомплекс.
Цианидные комплексы Fe
Fe2+
Fe3+
[Fe(CN)6]4- K2FeII[FeII(CN)6] – FeIII4[FeII(CN)6]3 –
белый осадок
синий осадок
(берлинская лазурь)
[Fe(CN)6]3- FeII3[FeIII(CN)6]2
FeIII[FeIII(CN)6] –
(?!) – турнбулева зелено-коричневое
синь
окрашивание
KFe[Fe(CN)6]
Нитропруссид натрия
K4[Fe(CN)6] + 6 HNO3 → H2[Fe(CN)5(NO)] + CO2 + NH4NO3 + 4 KNO3
H2[Fe(CN)5NO] + Na2CO3 → Na2[Fe(CN)5(NO)] + CO2 + H2O
[Fe(CN)6]4- + H2O + NO2- → [Fe(CN)5(NO)]2- + CN- + 2 OH-
Угол Fe-N-O равен 1760, это комплекс Fe(II) с NO+.
Диамагнитный низкоспиновый комплекс d6
Быстро и кратковременно понижает кровяное
давление.
Ферроцен
2(C5H5)-Na+ + FeCl2 = [(5-C5H5)2Fe] + 2NaCl
[(5-C5H5)]2Fe – e = [(5-C5H5)2] Fe+
Ru, Os
Благородные/платиновые металлы, низкая реакционная
способность.
Не растворимы даже в царской водке (компактный М).
Os + 2O2 = OsO4 (порошок металла, 20оС – медленно)
Ru + O2 = RuO2 (600oС, при комн. Т пассивируется).
M + 3KNO3 + 2KOH = K2MO4 + 3KNO2 + H2O (сплавление)
M + 3Na2O2 = Na2MO4 + 2Na2O (сплавление)
Ru, Os – степени окисления +8, +7
Токсичные, летучие желтого цвета OsO4, RuO4
8 Ru3+ + 5 IO4− + 12 H2O → 8 RuO4 + 5 I− + 24 H+
МO4 → O2 + МO2
2RuO4 + 16HCl(разб.) = 2RuCl3 + 5Cl2 + 8H2O
OsO4 + 8HCl(конц.) = OsCl4 + 2Cl2 + 4H2O
Фториды неизвестны.
Известны оксофториды OsO3F2,OsO2F4
Ru, Os – степени окисления +6, +5, +4
Os + 3F2 = OsF6 – желтый, летучий, молекулярная структура
2Ru + 5F2 = 2RuF5 – тетрамер, строение (NbF5)4
2RuF5 + F2 = 2RuF6 – получают под давлением, нестабилен
Известны: MF4, OsCl4, OsBr4
RuO4 = RuO2 + O2 (100oC)
RuO2 = Ru + O2 (1300oC)
5RuO2 + 4MnO4- + 12H+ = 5RuO4 + 4Mn2+ + 6H2O
Ru, Os – степени окисления +3, +2
RuX3 (X = F, Cl, Br, I), OsX3 (X = Cl, I)
RuX2 (X = Cl, Br, I), OsI2 (X = Cl, Br, I)
2Ru + 3Br2 = 2RuBr3 (450oC)
Оксиды M(III) и M(II) неизвестны.
Доминирует химия октаэдрических комплексов. В отличие от
Fe – стабильные комплексы с NH3.
Химическая фиксация азота:
2[Ru(NH3)5Cl]2+ +Zn+N2 =[(NH3)5Ru-N≡N-Ru(NH3)5]4+ +Zn2++2Cl(dN-N = 1,12Å)
Биологическая роль железа
ФЕРРИТИН – хранение железа в клетках в нетоксичной
форме.
М. вес – 444000 (24 единицы), в организме взрослого –
2.4 г (0.5 г железа).
До 4500 атомов железа (III).
(FeOOH)8FeO(H2PO4)
ТРАНСФЕРРИН – транспорт железа через плазму.
М. вес – 76000 (2 единицы), в организме взрослого –20 г
(0.007 г железа). 2 атома железа (III)
Транспорт и хранение дикислорода
Гемоглобин – транспорт кислорода в плазме.
М. вес – 64500 (4 единицы), в организме взрослого –750
г (2,6 г железа).
Меоглобин – хранение кислорода в мускулах.
М. вес – 17000 (1 единица), в организме взрослого –40 г
(0.13 г железа).
Железосодержащие белки
Перенос и «хранение» электронов.
Цитохром Р-450
R-H + 1/2O2 = R-O-H
9 группа – Co, Rh, Ir
Эл. конф.
r,M0
Степени
окисления
Co
3d74s2
1,25 Å
0, +2, +3, (+4)
Rh
4d85s1
1,34 Å
0, (+1), (+2), +3,
(+4), (+5), (+6)
Ir
5d76s2
1,35 Å
0, (+1), (+2), +3,
+4, (+5), (+6)
Содержание в земной коре, минералы
Co – 32 место; CoAsS – кобальтин, CoS – кобальтит, CoAs –
смальтит
Rh – 75 место
Ir – 76 место
Открытие элементов и названия
Co – швед Г. Брандт в 1735 г., нем. «кобольд» - подземный
гном.
Rh – англ. Волластон в1804 г., Rhodon – греч., роза.
Ir – англ. С. Пеннант в 1804 г. Iris – греч., радуга.
Co
Менее реакционноспособен, чем Fe.
M2+ + 2e = M (Eo(Fe)= -0,44 B; Eo(Co)= -0,28 B; Eo(Ni)= -0,25 B)
Co + H2SO4 = CoSO4 + H2
Конц. HNO3 пассивирует Fe, Co, Ni.
Co +4HNO3 = Co(NO3)2 + 2NO2 + 2H2O (конц. кислота, при Т)
6Co(порошок) + 4O2 = 2Co3O4
2Co + 3F2 = 2CoF3 (при Т)
Co + X2 = CoX2 (при Т; X = Cl, Br, I)
Повышение стабильности в ряду Co(IV)-Co(III)-Co(II).
Примеры соединений Co(IV): Cs2[CoF6], коричневый CoO2
(плохо охарактеризован), Ba2CoO4, M2CoO3 (M = K, Rb, Cs).
Соединения Co(III)
Мало примеров бинарных соединений: CoF3, Co2O3
(плохо охарактеризован).
Коричнево-черный Co(OH)3 получается при окислении
суспензии розово-красного Co(OH)2:
2Co(OH)2 + Br2 + 2NaOH = 2Co(OH)3 + 2NaBr
6Co(OH)3 = 2Co3O4 + 1/2O2 + 9H2O (выше 150оС)
Темно-зеленый Co3O4 = CoIICoIII2O4
Окисид и гидроксид являютcя окислителями:
2Co3O4 + 12HNO3 = 6Co(NO3)2 + O2 + 6H2O
Co3O4 + 8HCl = 3CoCl2 + Cl2 + 4H2O
Кобальтаты (III): LiCoO2 широко используется в Li-ионных
батареях.
Комплексы Co(III) – d6
Октаэдрические, низкоспиновые, кинетически инертные.
Редкий пример высокоспинового комплекса - [CoF6]3-
d6
↑↓ ↑↓ ↑↓
↑ ↑
↑↓ ↑ ↑
Комплексы Co(III) – d6
Часто получают окислением (O2, Br2, H2O2, PbO2) комплексов
Co(II):
Co2+(aq) + 2H+ + 3 C2O42- + PbO2 = [Co(ox)3]3- + PbO + H2O
4Co2+(aq) + 24NH3 +4H+ + O2 = 4[Co(NH3)6]3+ + 2H2O (C – кат.)
Аквакомплекс [Co(H2O)6]3+ сильный окислитель, окисляет
воду:
[Co(H2O)6]3+ + e = [Co(H2O)6]2+ Eo = +1,92 B
[Co(NH3)6]3+ + e = [Co(NH3)6]2+ Eo = +0,31 B
[Co(en)3]3+ + e = [Co(en)3]2+ Eo = -0,26 B
Комплексы с кислородом
2[CoII(CN)5]3- + O2 = [(NC)5CoIII-O-O-CoIII(CN)5]6диамагнитный пероксокомплекс O22[(NC)5CoIII-O-O-CoIII(CN)5]5- - парамагнитный
супероксокомплекс O2-
Соединения Co(II)
Известны все галогениды CoX2
CoCl2 + 2HF = CoF2 + 2HCl – розовый, структура TiO2
Co + Cl2 = CoCl2 – голубой, структура CdCl2
Co + Br2 = CoBr2 - голубой, структура CdCl2 и CdI2
Co + 2HI = CoI2 +H2 - темно-синий
CoCO3 = CoO + CO2 – оливково-зеленый пигмент, структура
NaCl
3CoO + 1/2O2 = Co3O4 (500oC)
Co2+ + 2OH- = Co(OH)2 – розовый, свежеосажденный
амфотерен
Co(OH)2 + 2OH- = [Co(OH)4]2- тетраэдр
Комплексы Co(II) – d7
Большинство комплексов – высокоспиновые.
↑
d7
↑↓ ↑↓ ↑↓
↑ ↑
↑↓ ↑↓ ↑
Комплексы Co(II) – d7
Широкий набор координационный полиэдров, КЧ от 2 до 8.
Тетраэдр: [Co(OH)4]2-, [CoX4]2- (X = Cl, Br, I)
Квадрат: [Co(CN)4]2Квадратная пирамида: [Co(CN)5]3Октаэдр: [Co(H2O)6]2+ (устойчив на воздухе), [Co(NH3)6]2+
(легко окисляется на воздухе, получают в аргоне).
Co2+aq + 4Cl- = [CoCl4]2розовый
голубой
Соли Co(II)
CoCl2.6H2O – темно-розовый, содержит trans-[CoCl2(H2O)4]
CoCl2.4H2O – содержит cis-[CoCl2(H2O)4]
CoCl2.2H2O – полимер с мостиковыми атомами Cl
При растворении в воде содержат различные формы
(равновесие) – основные [Co(H2O)6]2+, [CoCl(H2O)5]+,
[CoCl4]2[Co(H2O)6]2+ = [Co(H2O)4]2+ + 2H2O (равновесие в растворе)
CoBr2.6H2O, CoI2.6H2O, CoSO4.6H2O, Co(NO3)2.6H2O,
Co(ClO4)2.6H2O – все содержат [Co(H2O)6]2+
M(VI), M(V) (M= Rh, Ir)
M + 3F2 = MF6 – мономеры, летучи, получаются под
давлением F2
M + 5/2F2 = MF5 – тетрамеры, структура (NbF5)4
Известны соли [MF6]-
IrF5 + H2O = IrO2.nH2O + HF + O2
Неизвестны для Cl, Br, I
Соединения M(IV) (M= Rh, Ir)
Галогениды только MF4.
Rh + O2 = RhO2 (Т, давление; без давления - Rh2O3)
Ir + O2 = IrO2 (MO2 – строение TiO2)
[RhCl6]3- + Cl2 = [RhCl6]2- + 2Cl- (в расплаве CsCl)
2MCl + Ir + 2Cl2 = M2[IrCl6]
Гексахлориридиевая кислота H2[IrCl6] – продажный препарат.
[IrCl6]2- во многих реакциях восстанавливается до Ir(III).
Соединения M(III) (M= Rh, Ir)
2M + 3X2 = 2MX3 (при Т; X = Cl (рис.), Br, I)
Rh + 6NaCl + 3Cl2 = 2Na3[RhCl6] (при Т)
2RhCl3 + 3F2 = 2RhF3 + 3Cl2 (при Т)
Ir +IrF6 = 2IrF3 (при Т)
Продажные препараты – RhCl3.3H2O (темно-красный) и
IrCl3.3H2O (темно-зеленый).
IrCl3.3H2O + 3Cl- = [IrCl6]3- + 3H2O
[IrCl6]3- + 3ox2- = [Ir(ox)3]3- +6Cl[IrCl6]2- + e = [IrCl6]3-
Соединения M(III) (M= Rh, Ir)
Ir2O3 – в чистом виде не получен.
Rh2O3 – хорошо охарактеризован.
4Rh + 3O2 = 2Rh2O3 (при Т)
4Rh(NO3)3.6H2O = 2Rh2O3 + 24H2O + 12NO2 +3O2
Аквакомплексы [M(H2O)6]3+ кинетически инертные и
хорошо получаются в HClO4.
Получены все [M(H2O)6-nCln](3-n)+
Rh(II), Ir(II)
Ir(II) – очень мало примеров
Rh(II) – доминирует химия биядерных карбоксилатов
Кипячение RhCl3.3H2O в метаноле с уксусной кислотой и
ацетатом натрия приводит к образованию
[Rh2(O2CCH3)4(CH3OH)2]
d(Rh-Rh) = 2,38 Å, одинарная связь Rh-Rh: 24224
[Rh2(O2CCH3)4(H2O)2]
M(0)
Комплекс Васка обратимо связывает
дикислород, side-on bonding.
Co2(CO)8 + H2 → 2 HCo(CO)4
Co2(CO)8 + 2 Na → 2 NaCo(CO)4
Металлоцены
19е комплекс
2Co(C5H5)2
19e−
+ I2
→
2[Co(C5H5)2]+
18e−
+ 2I−
Гидрирование алкенов
Соединение Rh(I): [RhCl(PPh3)3] –
катализатор Вилкинсона
Синтез уксусной кислоты
(процесс Monsanto)
CH3OH + CO = CH3COOH
Coenzyme В12
Dorothy Hodgkin,
1964
10 группа – Ni, Pd, Pt
Эл. конф.
r,M0
Степени
окисления
Ni
3s23p63d84s2
1,24 Å
0, +2, +3, (+4)
Pd
4s24p64d104s0 1,37 Å
Pt
5s25p65d96s1
0, +2, (+3), +4,
(+5), (+6)
0, +2, (+3), +4,
(+5), (+6)
1,38 Å
Увеличение стабильности ст.
окисления +4.
M0: [Ni(CO)4], [Pt(PR3)4]
Содержание в земной коре, минералы
Ni – 23 место; (Fe,Ni)9S8 – пендландит, NiAs – никелин, NiS –
миллерит. .
Pd – 71 место; (Pd,Pt) – палладистая платина.
Pt – 72 место; самородная платина,PtAs2 – сперрелит.
Открытие элементов и названия
Ni – швед А. Кронштедт; «купферникель» - дьявольская руда.
Pd – англ. У. Волластон в 1803 г. Астероид Паллада.
Pt – известна давно. Plata – исп., серебро.
Никель
Растворим в разб. минеральных кислотах, пассивируется
конц HNO3, устойчив к щелочам.
Никель Ренея (пирофорный) получают растворением в
щелочи сплава Ni-Al или разложением Ni(C2О4).
Ni + F2 = NiF2
Ni и сплав Монель – аппараты для работы с F2 и XeF2.
Ni + X2 = NiX2 (X = Cl, Br, I)
Наиболее типичная степень окисления +2.
Степень окисления 0: [Ni(CO)4], [Ni(PF3)4], [Ni(CN)4]4-.
Ni +4CO = Ni(CO)4 - ядовит
Ni(IV), Ni(III)
Мало примеров, стабилизируются F и О.
K2[NiF6] – фторирование NiCl2 в KCl. Сильный окислитель,
октаэдр, низкоспиновый d6.
K3[NiF6] – нагревание K2[NiF6]
NiF4 = NiF3 + 1/2F2 (-60оС)
NiF3 = NiF2 +1/2F2 (сильный фторирующий агент)
Оксиды неизвестны.
2Ni2+ + OCl- + 4OH- = 2NiO(OH) + Cl- + H2O
Черный NiO(OH) используют в NiCd батареях.
Ni(II)
NiF2 получают фторированием NiCl2, а не Ni
NiCl2.6H2O в кристалле содержит [Ni(H2O)6]2+
NiCl2.2H2O – полимерное строение с мостиковыми Cl
NiCO3 = NiO + CO2 (или разложение нитрата; зеленый,
строение NaCl)
NiO + H2SO4 = NiSO4 + H2O – основной оксид
Ni2+ + 2OH- = Ni(OH)2 – осадок, зеленый, структура CdI2
Ni(OH)2 + 2OH- = [Ni(OH)4]2- -растворение в конц. щелочах
Ni(OH)2 + 6NH3 = [Ni(NH3)6]2+ + 2OH- - фиолетовый р-р
Соли Ni2+ + Na2CO3 дают зеленый основной карбонат
2NiCO3.3Ni(OH)2.4H2O
Комплексы Ni(II)
Тетраэдр: [NiCl4]2-, [NiBr4]2Квадрат: [Ni(CN)4]2Тригональная бипирамида:[Ni(CN)5]3-
Квадратная пирамида: [Ni(CN)5]3- (зависит от катиона)
Октаэдр: [Ni(H2O)6]2+, [Ni(NH3)6]2+, [Ni(en)3]2+, [NiF6]4В воде равновесие:[Ni(NH3)6]2++2H2O=[Ni(NH3)4(H2O)2]2++2NH3
Характерны переходы тетраэдр/квадрат и квадратная
пирамида/тригональная бипирамида.
NiX2L2 – квадрат (L = R3P, R – алкил), (L = R3As, R– арил)
Сложное поведение магнитных свойств.
Реактив Чугаева
Гравиметрическое определение Ni в виде [Ni(Hdmg)2] (мешает
Pd).
Осаждение за счет низкой растворимости, а не большой К
образования.
Pd, Pt – платиновые металлы
Pd более реакционноспособный , чем Pt
Pd + 1/2O2 = PdO (при Т)
Pd + X2 = PdX2 (при Т)
Pd + 4HNO3 = Pd(NO3)2 + 2NO2 + 2H2O (в конц.H2SO4 при Т)
Pd и Pt растворимы в царской водке.
3Pt + 18HCl + 4HNO3 = 3H2[PtCl6] + 4NO + 8H2O
Pd растворяет водород: 1 об. губч. Pd – 900 об. H2 (возможно,
в атомарном виде) - водородные мембраны,
катализаторы топливных элементов.
Основные степени окисления +2 и +4. У платины
большая стабильность +4.
Карбонилы (гомолигандные) неизвестны.
M(VI), M(V)
Pt + 3F2 = PtF6 – при 600оС; молекулярная структура,
сильнейший окислитель
O2 + PtF6 = [O2]+[PtF6]Фторирование PtCl2 при Т дает неустойчивый PtF5 (тетрамер)
2PtF5 = PtF4 + PtF6
PdF6 и PdF5 не получены, но получен [O2]+[PdF6]-
Pd(IV), Pt(IV)
Все соединения диамагнитные, соединений Pd(IV) меньше,
чем Pt(IV).
Галогениды Pd: PdF4 и PdF3=PdII[PdIVF6]
Pd + 2 F2 = PdF4 (при Т)
Галогениды Pt: PtX4 (X = F, Cl, Br, I)
Pt + X2 = PtX4 (X = Cl, Br)
Оксид – только PtO2 (черный) и PtO2.xH2O
PtO2.xH2O + 6HCl = H2[PtCl6] + (x+2)H2O
PtO2.xH2O + 2NaOH +2H2O = Na2[Pt(OH)6] + xH2O
[PtCl6]2- + Na2CO3 = PtO2.xH2O
PtO2 = Pt + O2 (при Т)
Комплексы Pd(IV), Pt(IV)
Множество термодинамически стабильных и кинетически
инертных комплексов, диамагнитные, октаэдрические.
Комплексы Pt встречаются чаще.
[PtCl6]2- +6NH3 = [Pt(NH3)6]2+ + 6Cl- (в жидком NH3)
[Pt(NH3)4]2+ + Cl2 = trans-[PtCl2(NH3)4]2+
Окислительное присоединение часто используют для
получения комплексов M(IV).
Pd(III), Pt(III) и смешанновалентные
соединения
[Pd2(-O2CCH3)4(H2O)2]2+, [Pd2(-O2SO2)4(H2O)2]2-
Платиновые сини получаются при
гидролизе cis-[PtCl2(NH3)2] или
[PtCl2(en)] в присутствии AgNO3.
{Pt4}9+ = (PtIII)(PtII)3
Противораковая активность
Pd(II), Pt(II)
Pd + Cl2 = -PdCl2 (выше 550оС -форма)
Pd + Br2 = PdBr2
PdCl2 + 2HI = PdI2 + 2HCl
Pt + X2 = PtX2 (X = Cl, Br, I)
Pd + 1/2O2 = PdO (единственный оксид Pd; для Pt - PtO2)
PdCl2 + CO + H2O → Pd + CO2 + 2HCl качественная реакция на СО
PdO + 2HClO4 +3H2O = [Pd(H2O)4](ClO4)2
[PtCl4]2- + 4H2O + 4Ag+ = [Pt(H2O)4]2+ + 4AgCl
Комплексы Pd(II), Pt(II)
Доминируют квадратные комплексы.
[MX4]2- (X = Cl, Br, I, SCN, CN)
[MX2L2] (L = NH3, NR3, Py, PR3, SR2)
[ML4]2+ (L = NH3, PR3, CH3CN)
Зеленая соль Магнуса: [Pt(NH3)4][PtCl4]
Бесцветный [Pt(NH3)4]2+ и розовый [PtCl4]2PdCl2 + 2 PPh3 → PdCl2(PPh3)2
PdCl2(PPh3)2 + 2 PPh3 + 2.5 N2H4 → Pd(PPh3)4 + 0.5 N2 + 2 N2H5+Cl−
Олефиновые комплексы
[PtCl3(C2H4)]-
Противораковые препараты
H3N
O
Cl
H3N
Pt
Cl
H3N
O
Pt
O
H3N
O
cisplatin
H3N
H3N
O
Pt
O
nedaplatin
carboplatin
H2N
O
*
*
O
O
O
O
Pt
H2N
oxaliplatin
Взаимодействие цисплатина с ДНК
Pd(0) как катализатор
Реакция Сузуки
Реакция Хека
Реакция Соногашира
Нобелевская премия по химии 2010 года (Сузуки, Хек, Нигиши)


