Ключи к олимпиадным заданиям отборочного этапа
advertisement
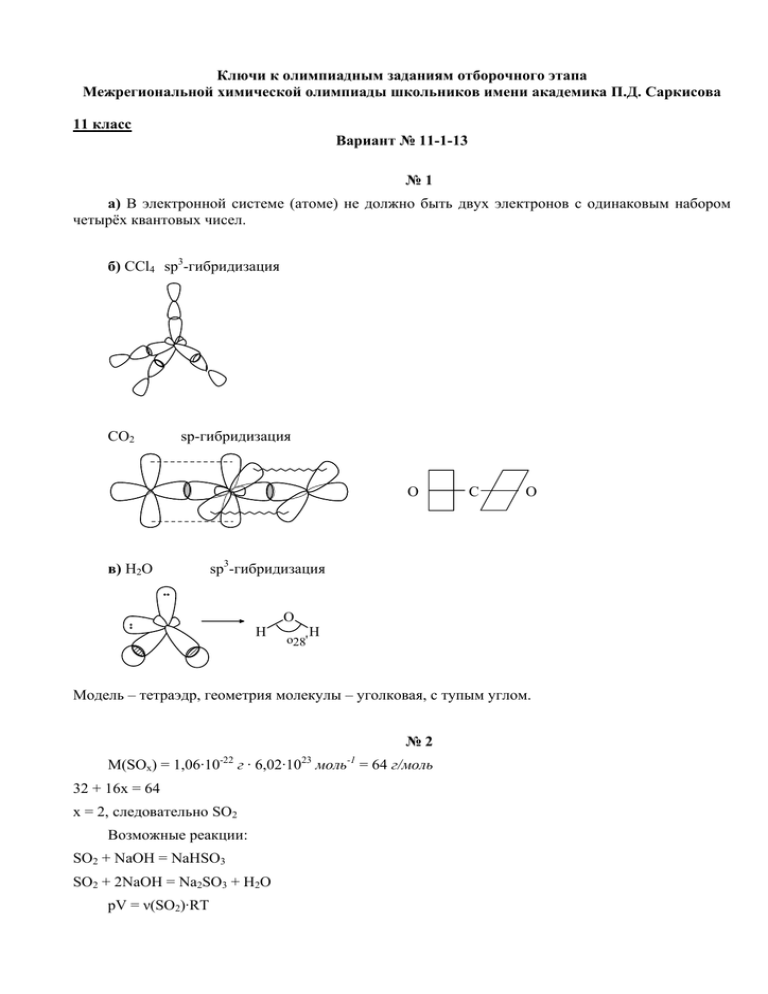
Ключи к олимпиадным заданиям отборочного этапа Межрегиональной химической олимпиады школьников имени академика П.Д. Саркисова 11 класс Вариант № 11-1-13 №1 а) В электронной системе (атоме) не должно быть двух электронов с одинаковым набором четырёх квантовых чисел. б) ССl4 sp3-гибридизация CO2 sp-гибридизация O в) Н2О C O sp3-гибридизация H O o28' H Модель – тетраэдр, геометрия молекулы – уголковая, с тупым углом. №2 -22 M(SОx) = 1,06·10 -1 г · 6,02·10 моль = 64 г/моль 32 + 16х = 64 х = 2, следовательно SO2 Возможные реакции: SO2 + NaOH = NaHSO3 SO2 + 2NaOH = Na2SO3 + H2O pV = ν(SO2)·RT 23 ν ( SO2 ) = pV 33,5·50,0 = = 0,624 моль RT 8,31·(273 + 50) ν ( NaOH ) = 714·1,05·0,05 = 0,937 моль 40 Из мольного соотношения NaOH : SO2 следует, что образуются обе соли. Пусть получено х моль NaHSO3 и у моль Na2SO3. По уравнениям: ⎧ х = 0,311 ⎨ ⎩ у = 0,313 ⎧ х + у = ν ( SO2 ) = 0,624 ⎨ x + 2 y = 0,937 ⎩ Во второй реакции получено 0,313 моль воды. ν ( H 2O ) = 714 ⋅ 1,05 ⋅ 0,95 + 0,313 = 39,9 моль 18 В полученном растворе находятся: 0,311 моль NaHSO3, 0,313 моль Na2SO3 и 39,9 моль Н2О. №3 100 г вещества содержат: 52,2 г С 13,0 г Н 34,8 г О : 12 :1 : 16 4,35 С 13 Н 2,175 О Переходим на 1 (О): 4,35/2,175 = 2 С 13/2,175 = 6 Н Î С2Н6О 1 О Реагирует со щелочными металлами, следовательно это C2H5OH. Синтез этанола из СаСО3: 800 С СаСО3 ⎯⎯ ⎯⎯→ СaO + CO2 ; o 1000 С ⎯⎯ ⎯⎯→ CO2 + 2Mg t ⎯ ⎯→ C + 2MgO o CaO + 3C CaC2 + CO CaC2 + 2H2O → C2H2 + Ca(OH)2 t, Ni C2H2 + 2H2 ⎯⎯⎯→ C2H6 hν ⎯→ C H Br + HBr C2H6 + Br2 ⎯⎯ 2 5 H 2O ⎯→ C H OH + KBr C2H5Br + KOH ⎯⎯ ⎯ 2 5 или O HgSO4, H + ⎯→ CH3 C С2Н2 + H2O ⎯⎯ ⎯ ⎯ ⎯ ⎯ H + → восстановление альдегида до спирта №4 а) 2P + 3Mg t ⎯ ⎯→ Mg3P2 Mg3P2 + 6HCl → 3MgCl2 + 2PH3 2PH3 + 4O2 → P2O5 + 3H2O P2O5 + Ca(OH)2 + H2O → Ca(H2PO4)2 б) Fe2O3 + Fe + 6HCl → 3FeCl2 + 3H2O без _ доступа _ кислорода FeCl2 + 2NaOH ⎯⎯ ⎯ ⎯ ⎯ ⎯ ⎯ ⎯ ⎯ ⎯ ⎯⎯→ Fe(OH)2 + 2NaCl 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 или 2Fe(OH)2 + H2O2 → 2Fe(OH)3 сплавление Fe(OH)3 + KOH ⎯⎯ ⎯ ⎯ ⎯⎯→ KFeO2 + 2H2O №5 300 С, Pd ⎯⎯ ⎯ ⎯ ⎯→ o н-гептан -3 С6H5-CH3 + 4H2 +7 +3 +4 Н 2О ⎯→ C6H5COOK + 2MnO2 + KOH + H2O C6H5-CH3 + 2KMnO4 ⎯⎯ ⎯ t C6H5COOK(к.) + КОН(к.) ⎯⎯→ С6Н6 + K2CO3 t , FeCl3 ⎯→ C H Cl + HCl C6H6 + Cl2 ⎯⎯ ⎯ ⎯ 6 5 p, t C6H5Cl + 2KOH ⎯⎯⎯→ C6H5OK + KCl + H2O C6H5OK + HCl → C6H5OH + KCl или кумольный метод получения фенола: OH С6H5OH + 3Br2 Н 2О ⎯⎯ ⎯ ⎯→ Br Br + 3HBr Br №6 RCOOCH3 + NaOH Н 2О ⎯⎯ ⎯ ⎯→ RCOONa 1 моль + CH3OH 0,85 моль RCOONa + H+ → RCOOH + Na+ 0,85 моль 0,85·0,65 = = 0,5525 моль Н+ RCOOH + C2H5OH ⎯⎯⎯→ RCOOC2H5 + H2O 0,5525 моль 0,5525·0,76 = = 0,420 моль R = CnH2n+1 M(RCOOCH3) = 14n + 1 + 44 + 15 = 14n + 60 г/моль M(RCOOC2H5) = 14n + 74 г/моль 14n + 60 = 2,094 (14n + 74) ⋅ 0,420 14n + 60 = 12,3n + 65,1 1,7n = 5,1 n = 3. Эфиры образованы бутановой кислотой. №7 K2CO3 + 2HCl → 2KCl + CO2↑ + H2O х моль 2х моль 2х моль х моль Mg + 2HCl → MgCl2 + H2↑ y моль 2y моль y моль y моль M(CO2) = 44 г/моль M(K2CO3) = 138 г/моль M(MgCl2) = 95 г/моль M(KCl) = 74,5 г/моль ν(HCl) = 250·1,05·0,100/36,5 = 0,719 моль ⎧2 х + 2 у = ν ( HCl ) = 0,719 ⎨ 44 x + 2 y = 15,0 ⎩ 22х + у = 7,50 2х + 2(7,50 – 22х) = 0,719 2х + 15,0 – 44х = 0,719 42х = 14,281 х = 0,340; у = 0,02. m(полученного раствора) = 250·1,05 + 138·0,34 + 0,02·24 – 15,0 = 294,9 г ω ( KCl ) = 2 ⋅ 0,34 ⋅ 74,5 ⋅100% = 17,18% 294,9 ω ( MgCl 2 ) = 0,02 ⋅ 95 ⋅ 100% = 0,64% 294,9 Вариант № 11-2-13 №1 а) Электронный слой – совокупность электронов, имеющих одно и то же главное квантовое число n. Емкость электронного слоя равна 2n2. б) NH3 sp3-гибридизация CH2=CH2 sp2-гибридизация в) Наиболее полярная связь среди молекул, содержащих атомы магния и неметаллов, в той, где имеется атом с наибольшей электроотрицательностью. Такой является молекула MgF2. Следует отметить, что речь идет о возможных молекулах в газовой фазе, в кристаллическом состоянии упомянутых молекул нет. №2 СОх; PV = νRT = m RT ; M m PM =ρ= M RT Для газов, имеющих одинаковую плотность при одинаковой температуре: P1M 1 P2 M 2 = RT RT или P1M 1 = P2 M 2 92,1 * M CO x = 101,3 * M C3 H 4 = 101,3 * 40 M CO x = 44 12 + 16 x = 44 x = 2 → CO2 2,80 = 0,125 моль 22,4 735 * 1,02 * 0,0200 ν NaOH = = 0,375 моль 40 Образуется средняя соль и NaOH частично остается в растворе: СO2 + 2NaOH = Na2CO3 + H2O 0,125 моль 0,250 моль 0,125 моль 0,125 моль ν CO = 2 В окончательном растворе: 0,125 моль Na2CO3; 0,375-0,250=0,125 моль NaOH 735 *1,02 * 0,980 и ν H 2O = + 0,125 = 40,9 моль 18 №3 100 г вещества содержат: 53,3 г С 15,6 г Н 31,1 г N : 12 :1 : 14 4,44 С 15,6 Н 2,22 N Переходим на 1 (N): 4,44/2,22 = 2 С 15,6/2,22 = 7 Н 1 N Î С2Н7N Реагирует с галогенводородами в мольном отношении 1:1, следовательно это C2H5NH2. 3C + CaO 1000 0 C = CaC2 + CO CaC2 + 2 H 2O = Ca (OH ) 2 + C2 H 2 t C2 H 2 + 2 H 2 = C2 H 6 Ni или Al H+ Cl 2 Na С → Al4C3 → CH 4 → CH 3Cl → C2 H 6 hν t hν C2 H 6 + Br2 = C2 H 5 Br + HBr + C2 H 5 Br + NH 3 = C2 H 5 NH 3 Br − C2 H 5 NH 3+ Br − + KOH = C2 H 5 Br + KBr + H 2 №4 а) 2 Na + O2 = Na2O2 Na2O2 + 2 H 2O = 2 NaOH + H 2O2 NaOH + CO2 = NaHCO3 NaHCO3 + HNO3 = NaNO3 + H 2O + CO2 б) эл .ток = 2 KOH + Cl + H 3Cl + 6 KOH = 5 KCl + KClO + 3H O 2 KClO = 2 KCl + 3O 2 KCl + 2 H 2O 2 2 t 2 3 2 t 3 2 MnO2 KCl( к ) + H 2 SO4 ( конц ) = HCl ↑ + KHSO4 №5 Дрожжи C6 H12O6 = 2C2 H 5OH + 2CO2 5C2 H 5OH + 4 KMnO4 + 6 H 2 SO4 = 5CH 3COOH + 4 MnSO4 + 2 K 2 SO4 + 11H 2O УФ CH 3COOH + Cl2 = ClCH 2COOH + HCl ClCH 2COOH + 2 NH 3 = NH 2CH 2COOH + NH 4Cl t NH 2CH 2COOH = CO2 + CH 3 NH 2 C 6 H 5OH + NaOH = C6 H 5ONa + H 2O №6 x моль x моль C n H 2 n +1COOH + NaOH = Cn H 2 n +1COONa + H 2O y моль y моль 234 * 1,07 * 0,060 = 0,376 моль x + y = ν NaOH = 40 2O ⎯ → не реагирует C n H 2 n +1COOH + Br2 ⎯H⎯ С6 H 5OH + 3Br2 = C6 H 2 Br3OH + 3HBr x моль x моль 41,8 ν C 6 H 5OH = ν C6 H 2 Br3OH = x = = 0,126 моль 331 y = 0,376 - 0,126 = 0,250 моль M C 6 H 5 OH = 94 г/моль M C n H 2 n+1COOH = 12n + 2n + 1 + 45 = 14n + 46 mC n H 2 n+1COOH = 26,75 − 0,126 * 94 = 14,91 г M C n H 2 n+1COOH = 14,91 = 60 г/моль 0,250 14n + 46 = 60 n =1 CH 3COOH №7 mSO3 в олеуме = 25,0 *1,90 * 0,200 = 9,50 г m H 2 SO4 в олеуме = 25,0 *1,90 * 0,800 = 38,0 г SO3 + H 2O = H 2 SO4 80 98 9,5 x x = 11,6 г m100% H 2 SO4 из олеума = 38,0 + 11,6 = 49,6 г 132,5 * 0,960 * 0,100 = 0,748 моль 17 49,6 ν H 2 SO4 = = 0,506 моль 98 NH 3 + H 2 SO4 = NH 4 HSO4 ν NH = 3 x моль x моль x моль 2NH 3 + H 2 SO4 = ( NH 4 ) 2 SO4 2 y моль y моль y моль ⎧⎪x + y = ν H 2 SO4 = 0,506 ⎨ ⎪⎩ x + 2 y = ν NH 3 = 0,748 x = 0,264 y = 0,242 M NH 4 HSO4 = 115 г/моль M ( NH 4 ) 2 SO4 = 132 г/моль mполученного раствора = m олеума + m р - ра NH 3 = 25,0 *1,90 + 132,5 * 0,960 = 47,5 + 127,2 = 174,7 г ωNH 4 HSO 4 ω( NH 4 )2 115 * 0,264 *100 = 17,4% 174,7 132 * 0,242 = *100 = 18,3% 174,7 = SO4 Вариант № 11-3-13 №1 а) Электронная орбиталь – совокупность электронов, обладающих одним и тем же магнитным квантовым числом. На орбитали может быть максимум два электрона и обязательно с противоположными спинами. б) СHCl3 sp3-гибридизация HC ≡ C - CH 3 sp sp sp 3 − гибридизация в) Фторацетатный анион сильнее гидратирован, чем ацетатный, поэтому равновесие диссоциации FCH2COOH более смещено вправо, чем равновесие диссоциации CH3COOH. То есть фторуксусная кислота сильнее уксусной. Другой вариант объяснения связан с сильным отрицательным индуктивным эффектом атома F. №2 SO x ; 32 = 0,400 32 + 16x x = 3 → SO 3 M = 32 + 16x; ω S= 32 = 6,4x + 12,8; 100 * 35,5 = 1,30 моль 8,31 * (273 + 55) 867 * 1,05 * 0,050 = = 1,14 моль 40 NaOH NaHSO 4 + = PV = ν SO 3 RT; ν SO 3 = ν NaOH SO3 1,14 моль SO3 1,14 моль + 1,14 моль H 2O (1,30 − 1,14) = 0,16 моль = 0,16 моль В полученном растворе : 1,14 моль NaHSO 4 ; 0,16 моль H 2 SO 4 и H 2 SO4 0,16 моль νH 2O 867 * 1,05 * 0,95 − 0,16 = 47,9 моль 18 = №3 o н - C7 H16 300 C = C6 H 5CH 3 + 4 H 2 Pd толуол Синтез: t 4Al + 3C = Al4C3 Al4C3 + 12 HCl = 3CH 4 + 4 AlCl3 hν CH 4 + Br2 = CH 3 Br + HBr 3C + CaO 1000 o C = CaC2 + CO CaC2 + 2 H 2O = Ca (OH ) 2 + C2 H 2 600 o C 3C2 H 2 = C6 H 6 C ( акт ) CH 3 Br + C6 H 6 t = C H CH 6 5 3 + HBr FeBr3 №4 а) CaCO3 800 o C = CaO + CO2 o 1000 C = 2CO 2CO + O = 2CO CO + 2 Mg = C + 2 MgO CO2 + C t 2 2 t 2 б) FeO + 2 HCl без доступа O 2 = FeCl2 + H 2O 2 FeCl2 + Cl2 = 2 FeCl3 H+ 2 FeCl3 + Fe = 3FeCl2 FeCl2 + 2 KOH без доступа O 2 = Fe(OH ) 2 ↓ +2 KCl №5 С2 H 4 + HBr = C2 H 5 Br C2 H 5 Br + KOH H 2O = C H OH + KBr 2 5 −1 +3 3CH 3 C H 2OH + 2 K 2Cr2O7 + 8H 2SO4 = 3CH 3 C OOH + 2Cr2 ( SO4 )3 + 2 K 2 SO4 + 11H 2O УФ CH 3COOH + Cl2 = ClCH 2COOH + HCl H+ ClCH 2COOH + CH 3OH = ClCH 2COOCH 3 + H 2O №6 СH3COOH х моль CnH2n+1OH y моль СH3COOH + Na = CH3COONa + 1/2H2 x моль x/2 моль CnH2n+1OH + Na = CnH2n+1ONa + 1/2H2 y моль y/2 моль x y 3,64 + =ν H2 = = 0,1625 моль 2 2 22,4 С n H 2 n +1OH + NaHCO3 → не реагирует СH 3COOH + NaHCO3 = CH 3COONa + H 2O + CO2 x моль 2 x 0,1625 = = 0,065 2 2,5 x = 0,130 моль x моль 2 x + y = 0,325; y = 0,195 моль m C n H 2 n+1OH = 19,5 − 0,130 * 60 = 11,7 г 11,7 = 60 г/моль 0,195 14n + 18 = 60; n = 3 → С3H 7OH M C n H 2 n+1OH = мол.%CH 3COOH = 0,130 * 100 = 40% 0,130 + 0,195 №7 CH 4 + x моль СO y моль 2O2 t = 2x моль + CO2 + 2 H 2O x моль 1 O2 = 2 y/2 моль t CO 2 y моль H2 z моль + 1 O2 2 z/2 моль = H 2O ⎧x + y + z = 2,0 ⎪ ⎨2x + y/2 + z/2 = 2,2 ⎪x + y = 1,2 ⎩ z = 0,8; 2(1,2 - y) + y/2 + 0,4 = 2,2 2,4 - 2y + y/2 = 1,8 1,5y = 0,6 y = 0,4 0,8 * 100 = 40% Об. доля H 2 = Об. доля СH 4 = 2,0 M газовой смеси = 0,2 * 28 + 0,4 * 16 + 0,4 * 2 = 12,8 г/моль D смеси по азоту = M смеси 12,8 = = 0,457 28 28 Вариант № 11-4-13 №1 а) Fe3+; 23 электрона; 1s22s22p63s23p63d5; S2-; 18 электронов; 1s22s22p63s23p6; б) N2 CH 3 − O - H sp 3 sp 3 − гибридизация в) H-COOH и C2H5-COOH +I эффект этильной группы выше, чем у атома водорода, поэтому связь ОН труднее рвется у пропионовой кислоты и она слабее. Другое объяснение связано с тем, что пропионат ион менее гидратирован чем формиат-ион. M ЭН 3 = 2,83 * 10 −23 №2 * 6,02 * 10 = 17 г/моль → NH 3 23 53,5 * 55,0 = 1,25 моль 8,31 * (273 + 10) 1486 * 1,03 * 0,06 ν H 3 PO4 = = 0,937 моль 98 H 3 PO4 + NH 3 = NH 4H 2 PO 4 PV = ν NH 3 RT ; ν NH 3 = x моль x моль x моль H 3 PO4 + 2 NH 3 = ( NH 4 ) 2 HPO4 y моль 2y моль y моль ⎧⎪x + y = ν H 3 PO4 = 0,937 ⎨ ⎪⎩ x + 2 y = ν NH 3 = 1,25 x = 0,624; y = 0,313 В полученном растворе: 0,624 моль NH4H2PO4; 0,313 моль (NH4)2HPO4 1486 * 1,03 * 0,94 и ν H 2O = = 79,9 моль 18 №3 3С + CaO 1000 o C = CaC2 + CO CaC2 + 2 H 2O = C2 H 2 + Ca (OH ) 2 3C2 H 2 600 o C = C6 H 6 C ( акт ) С6 H 6 + Cl2 t = C H Cl + HCl 6 5 FeCl 3 P ,t C6 H 5Cl + 2 NaOH ( изб ) = C6 H 5ONa + NaCl C6 H 5ONa + H + = C6 H 5OH ↓ + Na + №4 а) 2P + 3Cl 2 ( недостаток) = 2PCl3 PCl3 + Cl2 = PCl5 PCl5 + 4 H 2O = 5 HCl + H 3 PO4 H 3 PO4 + Ca (OH ) 2 = CaHPO4 + 2 H 2O б) 4 Fe(OH ) 2 + O2 + 2 H 2O = 4 Fe(OH )3 или 2Fe(OH)2 + H 2O2 = 2 Fe(OH )3 Fe(OH )3 + KOH сплав = KFeO 2 + 2 H 2O KFeO2 + 4 HCl = KCl + FeCl3 + 2 H 2O H+ 2 FeCl3 + Fe = 3FeCl2 №5 CH 3CH 2CH 2Cl + KOH CH 3CH 2CH 2OH H 2O = CH CH CH OH + KCl 3 H 2 SO4 ( конц ) = 170 o C 2 2 CH 3 − CH = CH 2 + H 2O H+ CH 3 − CH = CH 2 + H 2O = CH 3−CHOH − CH 3 CH 3 − CHOH − CH 3 (абс) + HCl(гг = CH 3 − CHCl − CH 3 + H 2O 2CH 3 − CHCl − CH 3 + 2 Na = CH (CH 3 ) 2 − CH (CH 3 ) 2 + 2 NaCl №6 (Cn H 2 n +1 ) 2 NH Сn H 2 n +1 NH 2 0,125 моль x моль + − C n H 2 n +1 NH 2 + HCl = Cn H 2 n +1 NH 3 Cl 0,125 моль 0,125 моль (Cn H 2n +1 ) 2 NH + HCl = + − (Cn H 2n +1 ) 2 N H 2 Cl x моль x моль x моль 5,60 = 0,25 моль = 0,125 + x ν аминов = ν HCl = 22,4 x = 0,125 моль 0,125 *100 мол.% С n H 2 n +1 NH 2 = = 50,0% 0,125 + 0,125 Cn H 2 n +1 NH 2 + O2 → nCO2 + ... 0,125 моль 0,125n моль (Cn H 2 n +1 ) 2 NH + O2 → 2nCO2 + ... 0,125 моль 0,25n моль СO 2 + Ca (OH ) 2 = CaCO3 ↓ + H 2O ν CO = ν CaCO = 2 3 75,0 = 0,75 моль = 0,125n + 0,25n 100 0,375n = 0,75 n=2 C 2 H 5 NH 2 и (С 2 H 5 ) 2 NH №7 Na 2 SO3 + H 2 SO4 = Na2 SO4 + SO2 ↑ + H 2O x моль x моль x моль Zn + H 2 SO4 = y моль y моль M SO 2 = 64 г/моль x моль ZnSO4 y моль M H 2 = 2 г/моль 250 *1,06 * 0,09 = 0,243 моль 98 ⎧64x + 2y = 14,43 ⎨ ⎩x + y = ν H 2 SO4 = 0,243 νH 2 SO 4 = 64 x + 2(0,243 − x) = 14,43 62 x = 13,944 x = 0,225 y = 0,018 + H2 ↑ y моль m полученного раствора = 250 *1,06 − 14,43 + 28,35 + 1,17 = 280,1 г M Na 2 SO4 = 142 г/моль M ZnSO 4 = 161 г/моль ωNa 2 SO 4 ωZnSO 4 0,225 * 142 *100 = 11,4% 280,1 0,018 *161 *100 = = 1,04% 280,1 = 10 класс Вариант № 10-1-13 0 +1 №1 -3 а) 4Р + 3КОН + 3Н2О → 3KH2PO2 + PH3 или t 2P + 3Ca ⎯ ⎯→ Ca3P2 Сa3P2 + 6HCl → 3CaCl2 + 2PH3 -3 +7 +5 +2 б) 5PH3 + 8KMnO4 + 12H2SO4 → 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O Mn+7 + 5e- → Mn+2 8 P-3 – 8e- → P+5 5 №2 a) Al2O3 + 6HCl → 2AlCl3 + 3H2O AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl или 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 6NaCl б) Al(OH)3 + KOH ⎯сплавление ⎯⎯⎯⎯ ⎯→ KAlO2 + 2H2O №3 a) CaC2 + 2H2O → C2H2 + Ca(OH)2 С ,Сакт. C H 3C2H2 ⎯600 ⎯⎯⎯⎯⎯ ⎯→ 6 6 О , AlCl 3 C H C H + HCl C6H6 + C2H5Cl ⎯t⎯ ⎯ ⎯→ 6 5 2 5 -2 -3 +4 +3 б) C6H5-CH2-CH3 + 12KMnO4 + 18H2SO4 → 5CO2 + 6K2SO4 + 5C6H5COOH + 12MnSO4 + + 28H2O C-3 – 7e- → C+4 C-2 – 5e- → C+3 5 Mn+7 + 5e- → Mn+2 12 COOH H 2 SO 4( конц.) C6H5COOH + HNO3(конц.) ⎯⎯ ⎯ ⎯ ⎯ ⎯⎯→ + H2O NO2 №4 pV = νRT ν= pV 75,0 ⋅ 100 = = 3,01моль RT 8,31 ⋅ 300 m(раствора) = 460·1 + 3,01·17 = 511,2 г ω(NH3) = 51,2·100%/511,2 = 10,0% m(1 л раствора) = 1000·0,960 = 960 г m(NH3 в 1 л раствора) = 0,100·960 = 96 г Концентрация = 96/17 = 5,65 моль/л №5 СхНу М(CxHy) = 12x + y г/моль y ⎧ = 0,143 ⎪ ⎨ 12 x + y ⎪⎩12 x + y = 4 ⋅14 = 56 56 − 12 x = 0,143 12 x + 56 − 12 x 56 – 12х = 8,01 х = 4; у = 8. СH2=CH–CH2–CH3 бутен-1 СH3–CH=CH–CH3 бутен-2 метилпропен 0 5 CH3 +4 C +2 -2 +7 +2 CH2 + 8KMnO4 + 12H2SO4 → 5 CH3 C CH3 + CH3 O + 5CO2 + 8MnSO4 + 4K2SO4 + 17H2O C0 – 2e- → C+2 C-2 – 6e- → C+4 5 Mn+7 + 5e- → Mn+2 8 №6 BaCO3 + 2HCl → BaCl2 + CO2↑ х моль M(BaCO3) = 197 г/моль х моль MgCO3 + 2HCl → MgCl2 + CO2↑ у моль M(MgCO3) = 84 г/моль у моль 197 x + 84 y = 37,4 ⎧ ⎪ ⎨ x + y = ν (CO ) = 5,96 = 0,266 2 ⎪⎩ 22,4 197(0,266 – у) + 84y = 37,4 52,4 – 197y + 84y = 37,4 113у = 15,0 у = 0,133; х = 0,133 мольн .доля ( MgCO3 ) = x⋅100 = 50,0% x+ y №7 NH2–CH2–CH2–COOH CH3 CH COOH β-аминопропановая кислота α-аминопропановая кислота NH2 NH2–CH2–COOCH3 метиловый эфир аминоуксусной кислоты СН3–СН2–СН2NO2 1-нитропропан CH3 CH CH3 2-нитропропан NO2 HCOOCH2–CH2–NH2 эфир муравьиной кислоты и аминоэтанола Вариант № 10-2-13 №1 t а) Si + 2Mg ⎯ ⎯→ Mg2Si Mg2Si + 2H2SO4 → 2MgSO4 + SiH4 б) SiH4 + 2KOH + H2O → K2SiO3 + 4H2 №2 С a) BaCO3 ⎯1000 ⎯ ⎯ ⎯→ BaO + CO2 О BaO + H2O → Ba(OH)2 б) Ba(OH)2 + 2CO2 → Ba(CO3)2 №3 ROOR a) CH2=CH–CH3 + HBr ⎯⎯ ⎯⎯→ CH3–CH2–CH2Br эфир б) 2CH3–CH2–CH2Br + 2Na ⎯⎯ ⎯ ⎯→ н-C6H14 + 2NaBr C , Pd н-C6H14 ⎯300 ⎯ ⎯ ⎯ ⎯→ C6H6 + 4H2 H 2SO 4(конц.) C H NO + H O в) C6H6 + HNO3(конц.) ⎯⎯ 2 ⎯ ⎯ ⎯ ⎯⎯→ 6 5 2 O C6H5NO2 + 3Zn + 6KOH → C6H5NH2 + 3K2ZnO2 + 2H2O №4 pV = ν(SO2)RT ν ( SO2 ) = pV 40,3 ⋅ 120 = = 1,95 моль RT 8,31 ⋅ 298 m(раствора) = 1300·1 + 1,95·64 = 1424,8 г ω(SO2) = 1,95·64·100%/1424,8 = 8,76% V(раствора) = 1424,8/1,06 = 1344 мл Концентрация = 1,95/1,344 = 1,45 моль/л Концентрация = 96/17 = 5,65 моль/л №5 C6H5–СnН2n+1 М = 77 + 14n + 1 г/моль 2n + 6 = 0,0943 14n + 78 2n + 6 = 1,32n + 7,36 n = 2. C6H5–С2Н5 Есть 3 изомера – диметилбензолы. -2 -3 +7 +3 +4 +4 , H 2O C H COOK + 4MnO + KOH + K CO + 2H O C6H5–СH2–СН3 + 4KMnO4 ⎯t⎯ 2 2 3 2 ⎯⎯→ 6 5 C-3 – 7e- → C+4 C-2 – 5e- → C+3 3 1 Mn+7 + 3e- → Mn+4 12 4 №6 Zn + 2KOH → K2ZnO2 + H2 х моль K2[Zn(OH)4] х моль Al + 3KOH → K2AlO3 + 1,5H2 у моль K3[Al(OH)6] 1,5у моль 65 x + 27 y = 12,0 ⎧ ⎪ ⎨ x + 1,5 y = ν ( H ) = 7,28 = 0,325 2 ⎪⎩ 22,4 65(0,325 – 1,5у) + 27y = 12,0 21,1 – 97,5y + 27y = 12,0 70,5у = 9,1 у = 0,129; мольн.доля( Al ) = х = 0,132 0,129 ⋅100% = 49,4% 0,129 + 0,132 №7 СН3–СН2–СН2–СН2OH бутанол-1 CH CH2 бутанол-2 CH3 CH3 OH CH3 CH3 C CH3 метилпропанол-2 OH CH3 CH CH2 OH метилпропанол-1 C H3 С2Н5–О–С2Н5 диэтиловый эфир СН3–СН2–СН2–О–СН3 метил-н-пропиловый эфир CH3 метил-изо-пропиловый эфир O CH CH3 CH3 9 класс Вариант № 9-1-13 №1 O 8е– 1s22s22p4 Co 27е– 1s22s22p63s23p63d74s2 Cl– 18е– 1s22s22p63s23p6 №2 Наиболее полярной (наименее ковалентной) связью в группе однотипных соединений НГ будет характеризоваться то соединение, где содержится наиболее электроотрицательный атом. Таким соединением будет HF. В водных растворах указанные в задании соединения являются кислотами: HF – слабой, HBr и HAt – сильными. В ряду HF – HBr – HАt сила кислот возрастает. г 20 моль = 3,32 ⋅ 10 − 23 г Масса молекулы фтороводорода = 1 6,02 ⋅ 10 23 моль №3 CuSO4·xH2O t ⎯ ⎯→ M = 160 + 18x CuSO4 + xH2O↑ M = 160 Потеря массы (в %) = 1800x = 5760 + 648x 18 х ⋅100% = 36% 160 + 18 х 1152x = 5760 х=5 m (CuSO4 в 25,0 г CuSO4·5H2O) = 25,0 ⋅ 160 = 16,0 г 250 m (раствора) = 200·1 + 25,0 = 225,0 г ω (СuSO4 ) = 16,0 ⋅100% = 7,11% 225,0 №4 Al2O3 + 6KOH + H2O → 2K3[Al(OH)6] сплавление Al2O3 + 2NaOH ⎯⎯ ⎯ ⎯ ⎯⎯→ 2NaAlO2 + H2O Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O Al2O3 + 3SO3 → Al2(SO4)3 t ⎯→ Ca(AlO ) Al2O3 + CaO ⎯ 2 2 №5 2KMnO4 + 10KI + 8H2SO4 → 2MnSO4 + 5I2 + 6K2SO4 + 8H2O Mn+7 + 5e– → Mn+2 2 2I– – 2e– → I2 5 №6 Al3+ + H2O AlOH2+ + H+ Al2(SO4)3 + 2H2O (первая основная стадия) 2Al(OH)SO4 + H2SO4 №7 ν (SO3) = 8,00/80,0 = 0,100 моль ν (NaOH) = 6,00/40 = 0,150 моль Протекают 2 реакции: SO3 + NaOH → NaHSO4 SO3 + 2NaOH → Na2SO4 + H2O Пусть образовалось х моль NaHSO4 и у моль Na2SO4: ⎧ x + y = ν ( SO3 ) = 0,100 ⎨ ⎩ x + 2 y = ν ( NaOH ) = 0,150 х = у = 0,0500 моль В окончательном растворе находятся 0,0500 моль NaНSO4 и 0,0500 моль Na2SO4. Вариант № 9-2-13 №1 19е – 1s 2s 2p 3s 3p 4s Mn 25е – 1s22s22p63s23p63d54s2 Cr2+ 22е– К 2 2 6 2 6 1 1s22s22p63s23p63d4 №2 Наиболее полярной (наименее ковалентной) связью в группе однотипных соединений Н2Э будет характеризоваться то соединение, где содержится наиболее электроотрицательный атом. Таким соединением будет H2S. В водных растворах указанные в задании соединения являются кислотами. В ряду H2S – H2Se – H2Te сила кислот возрастает. г 81 моль Масса молекулы селеноводорода = = 1,35 ⋅ 10 − 22 г 1 6,02 ⋅ 10 23 моль №3 Na2SO4·xH2O M = 142 + 18x t ⎯ ⎯→ Na2SO4 + xH2O↑ M = 142 Потеря массы (в %) = 1800x = 7937,8 + 1006,2x 18 х ⋅100% = 55,9% 142 + 18 х 793,8x = 7937,8 х = 100 m (Na2SO4 в 32,2 г Na2SO4·100H2O) = 32,2 ⋅ m (раствора) = 150·1 + 32,2 = 182,2 г ω ( Na2 SO4 ) = 142 = 14,2г 322 14,2 ⋅ 100% = 7,79% 182,2 №4 Al(OH)3 + 3KOH(изб.) → K3[Al(OH)6] сплавление Al(OH)3 + NaOH ⎯⎯ ⎯ ⎯ ⎯⎯→ NaAlO2 + 2H2O сплавление Al(OH)3 + 3NaOH ⎯⎯ ⎯ ⎯ ⎯⎯→ Na3AlO3 + 3H2O 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O 2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3Н2О №5 2KMnO4 + 5Zn + 8H2SO4 → 2MnSO4 + 5ZnSO4 + K2SO4 + 8H2O Mn+7 + 5e– → Mn+2 Zn0 – 2e– → Zn2+ №6 Fe2+ + H2O AlOH+ + H+ 2FeSO4 + 2H2O (первая основная стадия) [Fe(OH)]2SO4 + H2SO4 №7 ν (P2O5) = 14,2/142 = 0,100 моль ν (KOH) = 16,8/56 = 0,300 моль Протекают 2 реакции: P2O5 + 2KOH + H2O → 2KH2PO4 P2O5 + 4KOH → 2K2HPO4 + H2O Пусть образовалось х моль KH2PO4 и у моль K2HPO4: ⎧ x + y = 2ν ( P2O5 ) = 0,200 ⎨ ⎩ x + 2 y = ν ( KOH ) = 0,300 х = у = 0,100 моль В окончательном растворе находятся 0,100 моль KH2PO4 и 0,100 моль K2HPO4.



