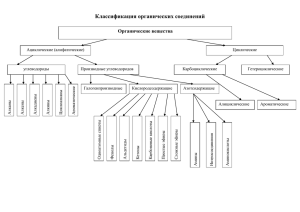
Влияние строения органических соединений на свойства и
advertisement
Электронные эффекты заместителей Понятия «заместитель» и «реакционный центр» молекулы R заместитель реакционный центр R R= H, Alk, Hal, NO2, SO3H etc. Cl OH OH Cl2/catalysis OH + kOH Cl NO2 Cl Cl2/catalysis kNO2 kOH >> kNO2 NaOH CH3-H CH3-NO2 NaOH Na CH2-NO2 + H2O NO2 Заместитель может повышать или понижать электронную плотность на реакционном центре электронная плотность - R заместитель - реакционный центр электронодонор! электронная плотность + + реакционный центр E электрофил R1 заместитель - электроноакцептор! Nu: нуклеофил Такие влияния заместителей названы "электронными эффектами заместителей". Эти эффекты могут осуществляться по двум механизмам - индукционному и мезомерному (резонансному) Индукционный эффект Индукционный эффект связан с различием в электроотрицательности функциональной группы и реакционного центра Индукционный эффект на схемах демонстрируется с помощью стрелки: Индукционный эффект обозначается «I», бывает положительным (+I) и отрицательным (-I) Индукционный эффект атома водорода принято считать равным «0» X CR3 -I-эффект H CR3 стандарт, I = 0 Y CR3 +I-эффект Индукционный эффект заместителей (-I-Эффект) (+I-Эффект) Галогены: -F, -Cl, -Br, -I -OH, OR, -NH2, NR2, -NO2, -CN, -C(R)=O, -COOH, -SH, -SR, -SO3H, -CH2Cl, -CHCl2, -CCl3, -CH=CH2 > -C6H5 > -CCH Металлы: -Na, -Li, MgX и т.п., -CH3, C2H5 и др. алкилы -O-, -NH-, -C-R2 Особенности проявлений индукционных эффектов 1. Сила индукционного эффекта быстро убывает с расстоянием: + H3C + - CH2 Cl H3C - 2. Все ненасыщенные углеводородные группировки проявляют -I-эффект. - + CH2 Li До сих пор дискуссионным остается вопрос о механизмах передачи индуктивного эффекта от заместителя к реакционному центру молекулы. Согласно одной из теорий, индуктивный эффект передается по связям. По другой теории этот эффект имеет электростатическую природу и передается через пространство (поле), поэтому в литературе он иногда определяется как "полевой эффект". Последняя точка зрения в настоящее время становится преобладающей. Мезомерный эффект Мезомерные или резонансные эффекты заместителей проявляются только в тех молекулах, где есть возможность сопряжения заместителя R с оставшейся частью молекулы R-X. 1 CH2 2 CH 4 CH2 3 CH 1,3-бутадиен сопряжение CH2=CH-F винилфторид n-сопряжение C C F 1 2 3 4 Мезомерный эффект Мезомерный эффект обозначается «М» может быть положительным (+М) и отрицательным (-М) На схемах мезомерный эффект изображается двумя способами: изогнутыми стрелками и резонансными структурами + H2C - C H C H + O H2N -M +M O H2C C H O CH3 H2C C H CH3 Мезомерный эффект Мезомерный эффект обозначается «М» может быть положительным (+М) и отрицательным (-М) На схемах мезомерный эффект изображается двумя способами: изогнутыми стрелками и резонансными структурами + H2C - C H C H + O H2N -M +M O H2C NH2 NH2 C H O CH3 NH2 H2C NH2 C H CH3 Мезомерный эффект. Правила написания резонансных структур: 1. в результате сопряжения происходит толко смещение n- и pэлектронов, но не перемещение атомов; 2. атом углерода во всех резонансных структурах остается четырехвалентным • Все резонансные структуры являются условностью, реальная электронная структура представляет собой некое среднее состояние между резонансными структурами (гибрид резонансных структур): +NH2 + - H2C O C H + CH3 H2C C H C H - O - - Мезомерный эффект Мезомерный эффект считается положительным (+М), если заместитель, в результате сопряжения, повышает электронную плотность на реакционном центре. Эффект считается отрицательным (-М), если заместитель понижает электронную плотность на реакционном центре. Отрицательный мезомерный эффект можно ожидать лишь у таких заместителей,которые могут расширить или перегруппировать свою октетную оболочку O O R-CH CH R-CH=CH-C OH C OH Мезомерный эффект (-М) (+М) -NO2, -C(R)=O, -COOH, -CN, -SO3H, -C+R2 (карбокатионы) F,Cl,Br,I (-I-эффекты) -OH, -OR, -NH2, NR2, -SH, -SR (-I- эффекты) • Важно отметить, что мезомерный и индукционный эффекты заместителя в одной молекуле действуют независимо друг от друга! Гиперконьюгация, или сверхсопряжение В символике теории резонанса гиперконьюгацию изображают как наложение классических неполярных структур и возбужденных сверхсопряженных, в которых водород представляют ионизованным. H H H H C C C H C H H H H H C H H H H H H CHCH3 H C CH3CH3 H Концепцию сверхсопряжения часто привлекают для объяснения стабилизации карбониевых ионов, что согласуется с результатами расчетов по методу МО. Стабильность интермедиатов Из двух состояний системы наиболее стабильным является то, при котором внутренняя энергия системы минимальна Стабильность заряженной частицы определяется возможностью делокализации заряда 1 2 1 Энергия акт. * A+ B интермедиат C+D Координата реакции Стабильность интермедиатов H H H CH3 +I C C C C H H H3C H CH3 +I +I H H3C H3C +I CH3 +I +I H H H CH3 +I C C C C H H3C +I H H3C +I CH3 +I H3C +I CH3 +I Какое из двух соединений бензиловый спирт или этанол быстрее вступает во взаимодействие с ZnCl2 с образованием соответствующего хлорпроизводного? Реакция идет через образование карбокатиона. Стабильность интермедиатов CH2OH CH2 CH3-CH2-OH CH2 CH2 CH2 +M-эффект бензольного кольца CH3 CH2 +I-эффект метильной группы CH2 CH3 CH2 Стабильность интермедиатов Почему под действием оснований водород в нитрометане может замещаться на другой атом, а метан в подобные превращения не вступает? CH2 H CH2 NO2 NO2 CH3 CH3 H O O CH2 N O CH2 N -М-эффект нитрогруппы O Литература 1. Сайкс П. Механизмы реакций в органической химии.М.:Химия. 1973 (1991) 2. Матье Ж., Панико Р. Курс теоретических основ органической химии. М.:Мир.-1975 3. Беккер Г. Введение в электронную теорию органических реакций. М.: Мир.-1977