Отчет по лабораторной работе № 12
advertisement

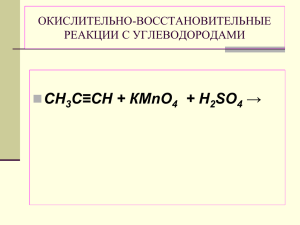
Московский государственный университет путей сообщения (МИИТ) Кафедра «Химия и инженерная экология» Группа________________ Студент _________________________________________ (ФИО студента, дата выполнения) Преподаватель______________________ Отчёт принят_______________________ (ФИО преподавателя) (Подпись преподавателя, дата) ОТЧЁТ ПО ЛАБОРАТОРНОЙ РАБОТЕ № 12 Окислительно-восстановительные процессы Цель работы: Изучение окислительно-восстановительных реакций. Необходимые средства: Посуда, оборудование: пробирки, штативы, спички. Реактивы: Растворы: I2, H2S, H2SO3, Br2, K2CrO4, Na2SO3, H2SO4. Кристаллическая соль: (NH4)2Cr2O7. Основные теоретические положения. Степень окисления (с.о.) −____________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Определите степени окисления всех элементов в следующих соединениях: H2SO4, K2CrO4, HNO2, О2, NH4Cl, K2Cr2O7, Fe, HNO3, KMnO4. Окислительно-восстановительные реакции − __________________________________ _________________________________________________________________________ Окислитель –_____________________________________________________________ Какая степень окисления должна быть у типичного окислителя (максимальная, минимальная, промежуточная)? ______________________________Как меняется с.о. окислителя в реакции?_______________________________________________________ Примеры типичных окислителей: _____________________________________________ 2 Восстановитель − _________________________________________________________ Какая степень окисления должна быть у типичного восстановителя (максимальная, минимальная, промежуточная)? ___________________________ Как меняется с.о. окислителя в реакции?_______________________________________________________ Примеры типичных восстановителей:__________________________________________ Элемент в промежуточной степень окисления проявляет свойства __________________ ___________________________________________________________________________ Заполните таблицу по образцу Уравнение полуреакции Окислитель/восстановитель Cl2 + 2e- → 2Cl- Cl2 – окислитель S+4 + 4e- → S0 S+4 – 2I- - 2e- → ……….. I- – Cr6+ + 3e- → ……….. Cr6+ – S6+ …………… → S4+ S6+ – N3+ …………… → N5+ N3+ – Процесс восстановление Экспериментальная часть. Выполните опыты, запишите наблюдения и составьте уравнения реакций с электронным балансом. Номер опыта 1 Уравнение реакции, электронный баланс I2 + H2S → Наблюдения 3 2 Br2 + H2SO3 + H2O → 3 K2CrO4 + Na2SO3 + H2SO4 → 4 (NH4)2Cr2O7 → Закончите уравнения реакций и составьте электронный баланс 1. K2Cr2O7 + H2S + H2SO4 → S + ……. 2. K2Cr2O7 + HI + H2SO4 → I2 + ……. 3. Cr(OH)3 + Br2 + KOH → K2CrO4 + KBr + …….. 4 4. FeS + HNO3 → Fe(NO3)3 + NO2 + S + H2O 5. Mo(NO3)3 + Na2O2 + NaOH → Na2MoO4 + NaNO3 + H2O Подпись студента_________________