Электроэкстракция цинка - Томский политехнический университет
advertisement

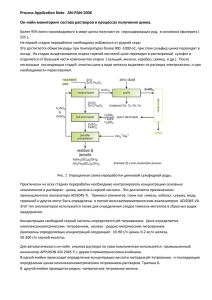
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Национальный исследовательский Томский политехнический университет» Физико-технический институт Кафедра химической технологии редких, рассеянных и радиоактивных элементов Направление: «Химическая технология материалов современной энергетики» Специальность: 240501 «Химическая технология материалов современной энергетики» «УТВЕРЖДАЮ» Зав. кафедрой ХТРЭ ______________ Дьяченко А.Н. «_____» ______________ 2013 г. Электроэкстракция цинка Методические указания к выполнению лабораторной работы по курсу « Электрохимические методы в технологии редких, рассеянных и радиоактивных элементов» Томск 2013 1 УДК 66.02.(076.1) Электроэкстракция цинка. Методические указания к выполнению лабораторной работы по курсу «Электрохимические методы в технологии редких, рассеянных и радиоактивных элементов» для студентов специальности 240501 «Химическая технология материалов современной энергетики» Составитель к.х.н., доц. В.П. Дмитриенко Рецензент к.х.н., доц. О.И. Налесник 2 1. 2. 3. 4. 5. Содержание Введение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Гидрометаллургическая схема производства . . . . . . . . Теория электроэкстракции цинка . . . . . . . . . . . . . . . . . . Организация процесса электролиза . . . . . . . . . . . . . . . . Экспериментальная часть . . . . . . . . . . . . . . . . . . . . . . . . 4.1. Схема установки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.2. Порядок выполнения работы. . . . . . . . . . . . . . . . . . Оформление отчета. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Литература. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 5 7 9 10 10 10 12 13 3 Введение Цинк имеет масштабное использование в составе латуней, применяемых в различных отраслях машиностроения и в теплообменной аппаратуре. Цинковые покрытия – основные для защиты стальных деталей и конструкций от коррозии в атмосфере, воде и грунте. Цинк применяется в качестве активного материала отрицательных электродов (анодов) в различных химических источниках тока. В природе цинк встречается в составе полиметаллических руд вместе с медью, никелем, кобальтом, кадмием, свинцом и другими цветными металлами. Основной вид химического соединения цинка в природе ZnS (сульфид цинка или цинковая обманка). Реже встречается карбонат цинка ZnCО3. Содержание цинка в полиметаллических рудах не превышает 30-40 %, поэтому требуется обогащение руды. Значительное количество цинка содержится в вельц-оксидах, побочных продуктах производства свинца. Основной способ производства цинка – гидрометаллургический. Гораздо реже применяется пирометаллургический способ, заключающийся в восстановительной плавке концентрата, отгонке и конденсации паров металлического цинка. Пирометаллургический цинк – порошковый продукт с высокой степенью окисления и существенным содержанием примесей применяется в производстве сплавов. 4 1. Гидрометаллургическая схема производства Схема представлена на рис. 1. Концентрат Обжиг “Нейтральное” выщелачивание Отстаивание Осветленный раствор Очистка от примесей Отработанный электролит Электролиз Кек H2SO4 Кислый раствор “Кислое” выщелачивание Фильтрация Плавка катодного цинка Кек Вода Промывная вода Промывка Zn Фильтрация Вельц-кек На получение свинца Рис. 1. Принципиальная гидрометаллургическая схема производства цинка Обжиг сульфидного концентрата необходим для перевода в легкорастворимую форму – ZnO по реакции: ZnS + 3/2О2 = ZnO + SО2. (1) Обжиг осуществляется в печах кипящего слоя при 800900 С. Одновременно часть сульфида каталитически окисляется до сульфата: 5 ZnS + 2О2 = ZnSО4. (2) Присутствующие примеси из сульфидной формы также превращается в оксиды. Часть оксида цинка сплавляется с оксидами железа, образуя феррит цинка (ZnO·Fe2О3). Перевод окисленного цинка в раствор происходит легко при малой концентрации серной кислоты: ZnO + H2SО4 = ZnSО4 +H2О, (3) а растворения феррита цинка проводят концентрированной кислотой, т.к. оплавленные частицы феррита химически стойки к ее действию. Поэтому после выщелачивания основного количества цинка в слабом растворе кислоты (нейтральное выщелачивание), твердая фаза подвергается «кислому» выщелачиванию. Осветленный раствор после нейтрального выщелачивания содержит кроме ZnSО4 сульфаты примесей меди, никеля, кадмия и подвергается ступенчатой очистке от них разными методами. Электролизному извлечению цинка из сульфатного раствора может подвергаться только чистый раствор, т.к. все названные примеси имеют более положительный потенциал, чем цинк (см. табл. 1), и будут в первую очередь осаждаться на катоде. Поэтому чистый цинк может электролитически осаждаться только из чистого раствора. Таблица 1. Стандартные потенциалы выделения цинка и металлов-примесей Металл Стандартный потенциал, В Cu/Cu2+ Ni/Ni2+ Со/Со2+ +0,34 -0,26 – Fe/Fe2+ Cd/Cd2+ Zn/Zn2+ -0,44 – -0,76 Отфильтрованный раствор после «кислого» выщелачивания содержит значительное количество кислоты и используется как реагент для «нейтрального» выщелачивания. Свинец после обжига при выщелачивании концентрата превращается в нерастворимый сульфат свинца, в результате чего хвостовой кек после промывки и фильтрации используется как сырье для производства свинца. 6 2. Теория электроэкстракции цинка Очищенный раствор сульфата цинка подвергается электролизу после электропроводной добавки серной кислоты. Оптимальный состав электролита: ZnSО4 – 100 г/л, H2SО4 – 5060 г/л. На катоде разряжаются не только ионы Zn (см. рис. 2). Рис. 2. Схема анодной электроэкстракции цинка и катодной реакций Zn2+ + 2e– = Zn, 0 Zn2 / Zn E (4) = –0,76 В. 0 EZnp 2 / Zn = EZn 2 / Zn RT RT ln aZn2 (5) ln aZn2 = 0,76 2F 2F Ионы Н+ (H3О+) также могут разряжаться на катоде: 2Н+ + 2e– = H2 E 0 Н / Н2 (6) = 0,0 В. При потенциалах, лежащих между точками 1 и 2, на катоде происходит только выделение водорода. После точки 2 начинает выделяться цинк, при потенциале точки 3, цинк и водород 7 выделяются в равных количествах. Лишь при более отрицательных потенциалах происходит преимущественное выделение цинка. Выход цинка по току на производстве составляет 88-94 %. На аноде происходит только выделение кислорода по реакции: Н2О – 2е– = 1 2 О2 + 2Н+, (7) EН0 / О = 1,23 В. 2 RT RT ln( pO0,25 aH2 ) aH 2O = 1,23 ln aH . (8) 2 zF zF Суммарная реакция: ZnSО4 + Н2О = Zn + 1 2 О2 + H2SО4. (9) Напряжение разложения сульфата цинка EНр / О = EН0 / О 2 0 p 0 0 0 E разл = E E = EН / О EZn2 / Zn =1,23–(–0,76) = 1,99 В. 2 Eразл = 1,99 RT ln( a 2 H (10) ) a H 2O . zF aZn 2 Практическое напряжение электролиза достигает 3,0-3,2 В. 8 3. Организация процесса электролиза Наилучшим материалом анода в условиях серной кислоты является свинец с добавкой 1 % серебра. Катодом служит полированный алюминиевый сплав, с которым осаждаемый цинк имеет слабое сцепление. Цинк наращивается до толщины 2-3 мм, а затем сдирается с катодной алюминиевой основы и после мойки, сушки поступает на переплавку. На производстве применяют железобетонные монолитные ванны, футерованные изнутри полимерными материалами. В цех электролиза поступает нейтральный раствор с концентрацией примерно 100 г/дм3 цинка. После электролиза отработанный электролит состава 50 г/дм3 цинка и примерно 100 г/дм3 серной кислоты поступает на охлаждение, а после охлаждения смешивается с исходным нейтральным раствором в соотношении 1:10 и вновь поступает на электролиз (см. схему на рис. 3). Рис. 3. Схема циркуляции электролита в электролизном цехе 9 4. Экспериментальная часть Цель работы: Ознакомление в лабораторных условиях с процессом электроэкстракции цинка и изучение влияния плотности тока на напряжение электролиза, выход продукта по току и на удельные затраты электроэнергии. 4.1. Схема установки 1 A 2 V 3 Графит Сталь 6 5 4 Рис. 4. Схема лабораторной установки: 1 – блок питания;2 – амперметр; 3 – вольтметр; 4 – ячейка с электролитом; 5 – графитовый анод; 6 – стальной катод 4.2. Применяемые реактивы и растворы Для приготовления раствора электролита используют: • кристаллогидрат ZnSO4·7H2O, • сульфат натрия Na2SO4·10H2O, • сульфат алюминия Al2(SO4)3·18H2O. Количества реагентов, необходимые для приготовления 1 000 мл электролита: кристаллогидрат ZnSO4·7H2O – 200 г/л, сульфат натрия Na2SO4·10H2O – 50 г/л, сульфат алюминия Al2(SO4)3·18H2O – 30 г/л. Для приготовления электролита большего объема количества реагентов кратно умножаются. 10 4.3. Приготовление электролита Каждый из компонентов электролита взвешивают в количестве, соответствующем составу электролита и объему электролизера, растворяют в отдельных емкостях в горячей дистиллированной воде, после чего все растворы декантируют или фильтруют. • раствор электролита, содержащий раствор сульфата цинка 100 г/л и серную кислоту с концентрацией 50 г/л. Объем раствора – 1000 мл. Для приготовления электролита используют кристаллогидрат ZnSO4·7H2O. Для приготовления 1000 мл раствора электролита берут навеску ZnSO4·7H2O, равную 178 г и растворяют ее в 200 мл дистиллированной воды. Затем к полученному раствору добавляют 85 мл концентрированной H2SO4. После остывания объем раствора доводят до 1000 мл. 4.4. Порядок выполнения работы В стаканы 1 наливают раствор, содержащий ZnSО4 ( сZnSO 100 г/л ) и H2SO4 ( сH SO 50 100 г/л ), и устанавливают предварительно взвешенные катодные основы из нержавеющей стали так, чтобы уровень электролита был ниже точки токоподвода на 8-10 мм. Катодные основы различаются шириной в 2 раза. Это позволяет за один опыт провести электролиз при двух плотностях тока. Расчет силы тока электролиза в опытах проводят для интервала плотности тока от 400 до 800 А/м2. Для проведения расчета предварительно измеряют площадь поверхности каждого анода, c учетом того, что только часть анода будет опущена в электролит. Проводят электролиз при плотности тока 400 А/м2. Электроды взвешивают через каждые 30 мин проведения электролиза. Определяют скорость электролиза (по увеличению массы катода) в зависимости от времени. 4 2 4 11 Затем приготавливают новый электролит и проводят электролиз при плотности тока 800 А/м2. Также, как и в 1-мм эксперименте определяют скорость электролиза. Перед взвешиванием катоды с осажденным цинком промывают, обсушивают фильтровальной бумагой, а затем досушивают в тепле (в сушильном шкафу при t = 50 °С). Выход по току металла рассчитывают по уравнению: BT mZn I , qZn (11) где mZn – масса осадившегося цинка, г; mZn = m2-m1, (12) m2 – масса катода после опыта, г; m1 – масса катода до опыта, г; I – сила тока, А; τ – время электролиза, ч; qZn – электрохимический эквивалент цинка, г/А·ч; Результаты эксперимента заносят в табл. 2. Таблица 2. Результаты эксперимента Wэ, выход № I, А i, А/м2 Uэл., В τ, час по энергии, Вт, % п/п Вт·ч/кг 1 2 12 5. Оформление отчета Отчет по электроэкстракции цинка должен содержать: а) цель работы; б) краткое описание основных процессов, протекающих в ходе выполнения работы; в) схему установки; г) порядок выполнения работы; д) электродные и суммарные реакции; е) поляризационные кривые выделения Zn, H2 и О2; ж) таблицу экспериментальных результатов; з) результаты эксперимента, представляются таблицей и зависимостями Uэл = f(ik), BT = f(ik), Wуд = f(ik); и) краткий вывод по результатам эксперимента. 13 Литература 1. Прикладная электрохимия. Под ред. Томилова А.П. – М.: Химия, 1984. – 520 с. 2. Антропов Л.И. Теоретическая электрохимия./ Учеб. Для хим. и хим.-технол. Спец. ВУЗов. – М.: Высш. Шк., 1984. –519 с. 3. Дамаскин Б. Б. Электрохимия: учеб. по направлению 510500 "Химия" и специальности 011000 "Химия" / Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина. – М.: КолосС, 2006. – 670 с. 4. Дамаскин Б. Б. Введение в электротехническую кинетику: учеб. пособие для химич. спец. ун-тов / Б.Б. Дамаскин; Под ред А.Н. Фрумкина. – М.: Высш. шк., 1975.–416 с. 5. Кузьмина М.Ю. Электрохимия расплавленных солей. Учеб. Пособие для студентов специальности 150102 "Металлургия цветных металлов" / М.Ю. Кузьмина. – Иркутск: Изд-во ИрГТУ, 2008. – 84 с. 6. Кузьмина М.Ю. Электрохимия расплавленных солей. Избранные вопросы высокотемпературной электрохимии: конспект лекций по специальности 150102 "Металлургия цв. металлов" дневной и заоч. форм обучения /М.Ю. Кузьмина. – Иркутск: Изд-во ИрГТУ, 2008. – 30 с. 7. Кузьмина М.Ю. Электрохимия расплавленных солей. Кинетика электродных процессов в расплавленных солях: конспект, лекций для студентов специальности 150102 "Металлургия цв. металлов" дневной и заоч. форм обучения / М.Ю. Кузьмина. – Иркутск: Изд-во ИрГТУ, 2008. – 23 с. 8. Методические указания к решению задач по электрохимии / Иркут. Политехн. ин-т. – Иркутск: ИПИ, 1979. – 33 с. 9. Михайлов Б.Н. Приборы и методы исследования электрохимических процессов: учеб. пособие / Б.Н. Михайлов, С.И. Половиева, Л.А. Минаева. – Иркутск: Изд-во ИрГТУ, 2007. – 107 с. 10. Прикладная электрохимия: учеб. пособие для хим.технол. спец. ВУЗов / Под ред. Н.Т. Кудрявцева. – 2-е изд., перераб. и доп. – М.: Химия, 1975. – 551 с. 11. Сборник задач по теоретической электрохимии: учеб. пособие для ВУЗов по специальности "Технология электрохим. пр-ва" / Ф.И. Куков, И.Д. Куджрявцева, В.И. Гончаров. – М.: Высш. шк., l982. – 160 c. 14