s-Элементы I группы
advertisement
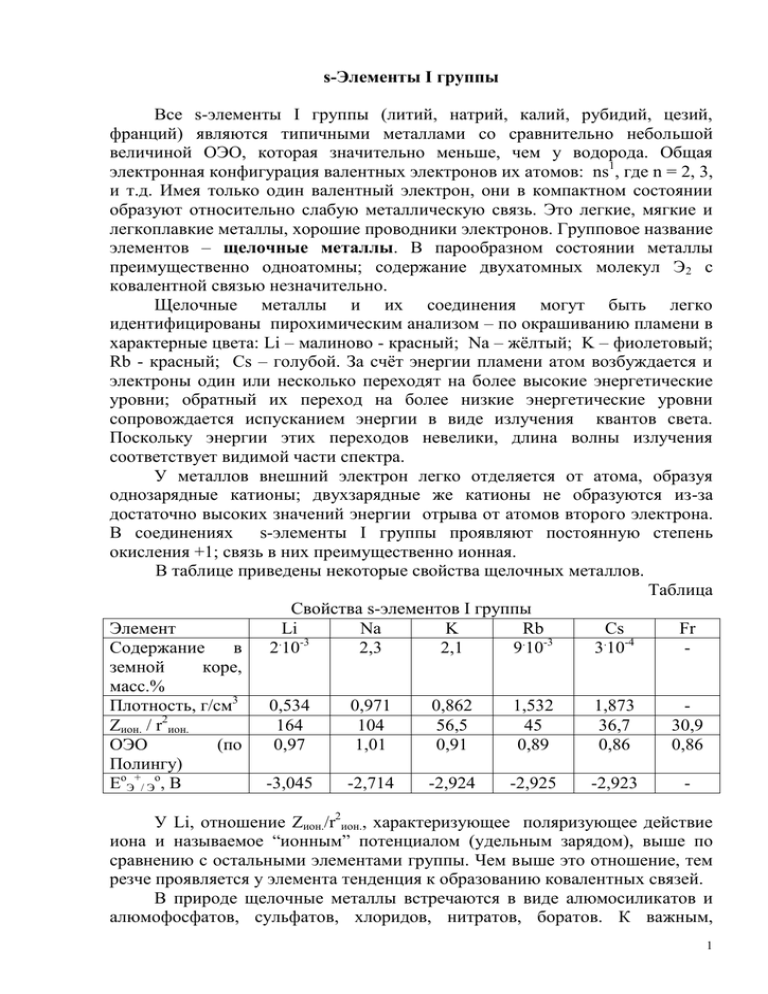
s-Элементы I группы Все s-элементы I группы (литий, натрий, калий, рубидий, цезий, франций) являются типичными металлами со сравнительно небольшой величиной ОЭО, которая значительно меньше, чем у водорода. Общая электронная конфигурация валентных электронов их атомов: ns1, где n = 2, 3, и т.д. Имея только один валентный электрон, они в компактном состоянии образуют относительно слабую металлическую связь. Это легкие, мягкие и легкоплавкие металлы, хорошие проводники электронов. Групповое название элементов – щелочные металлы. В парообразном состоянии металлы преимущественно одноатомны; содержание двухатомных молекул Э2 с ковалентной связью незначительно. Щелочные металлы и их соединения могут быть легко идентифицированы пирохимическим анализом – по окрашиванию пламени в характерные цвета: Li – малиново - красный; Na – жёлтый; K – фиолетовый; Rb - красный; Cs – голубой. За счёт энергии пламени атом возбуждается и электроны один или несколько переходят на более высокие энергетические уровни; обратный их переход на более низкие энергетические уровни сопровождается испусканием энергии в виде излучения квантов света. Поскольку энергии этих переходов невелики, длина волны излучения соответствует видимой части спектра. У металлов внешний электрон легко отделяется от атома, образуя однозарядные катионы; двухзарядные же катионы не образуются из-за достаточно высоких значений энергии отрыва от атомов второго электрона. В соединениях s-элементы I группы проявляют постоянную степень окисления +1; связь в них преимущественно ионная. В таблице приведены некоторые свойства щелочных металлов. Таблица Свойства s-элементов I группы Элемент Li Na K Rb Cs Fr . -3 . -3 . -4 Содержание в 2 10 2,3 2,1 9 10 3 10 земной коре, масс.% Плотность, г/см3 0,534 0,971 0,862 1,532 1,873 2 Zион. / r ион. 164 104 56,5 45 36,7 30,9 ОЭО (по 0,97 1,01 0,91 0,89 0,86 0,86 Полингу) EoЭ+/ Эо, В -3,045 -2,714 -2,924 -2,925 -2,923 У Li, отношение Zион./r2ион., характеризующее поляризующее действие иона и называемое “ионным” потенциалом (удельным зарядом), выше по сравнению с остальными элементами группы. Чем выше это отношение, тем резче проявляется у элемента тенденция к образованию ковалентных связей. В природе щелочные металлы встречаются в виде алюмосиликатов и алюмофосфатов, сульфатов, хлоридов, нитратов, боратов. К важным, 1 имеющим промышленное значение, минералам относятся: лития - сподумен LiAl[Si2O6], липодолит KLi1,5[Si3AlO10](OH, F)2; натрия – каменная соль, галит NaCl, глауберова соль, мирабилит Na2SO4 10H2O, чилийская селитра NaNO3, криолит Na3[AlF6], бура, тинкал Na2B4O7∙10H2O; калия – сильвин KCl, сильвинит KCl∙NaCl, карналит KCl∙MgCl2∙6H2O, индийская селитра KNO3; рубидий является рассеянным, а цезий – редким элементами, встречаются в минералах лития, калия, бериллия и др. К собственным минералам цезия можно отнести редкие минералы авогадрит (K, Cs)[BF4] и поллуцит (Cs, Na)[Al Si2O6]∙nH2O. Получение щелочных металлов основано либо на электролизе расплава их соединений (в основном Li и Na), либо вакуум-термическом их восстановлении (в основном K, Rb и Cs) из солей, оксидов или гидроксидов. При электролизе обычно используют (для снижения температуры) эвтектические смеси хлоридов выделяемого металла с другими галогенидами (LiВr, KCl, NaF, CaF2 и др.). В качестве восстановителей в вакуумтермических методах (обычно при температурах 1000-1200оС) применяются Na, Mg, Ca, Al, Si, Zr и др. Например: 4KCl + Si + 4CaO ═ 4K + 2CaO SiO2 + 2CaCl2; 4Cs2CrO4 + 5Zr ═ 8Cs + 5ZrO2 + 2Cr2O3 Очищают получаемые металлы вакуумной перегонкой. Литий, натрий и калий используют в качестве восстановителей в органическом синтезе и в металлотермии, а также в атомной промышленности в качестве теплоносителя. Рубидий и цезий – важнейший материал электронной техники. По химическим свойствам s-элементы I первой группы являются весьма активными металлами; у лития она выражена меньше, поскольку его внешний электрон более прочно связан с ядром (менее экранирован). Литий по многим физико-химическим свойствам похож на магний (диагональная периодичность свойств). s-Металлы непосредственно реагируют с большинством простых и сложных веществ – окислителей. Отношение к простым окислителям С водородом при нагревании металлы образуют ионные гидриды, анионом в которых выступает гидрид-ион Н-: при электролизе, например, расплавленного LiH, на аноде выделяется водород. Устойчивость гидридов уменьшается в ряду Li – Na – K – Rb – Cs; так, если LiH плавится при 680оС без разложения, то уже NaH при нагревании до 400оС разлагается на элементы, а гидриды рубидия и цезия во влажном воздухе воспламеняются. Гидриды легко окисляются кислородом и разлагаются водой, например: ЭH + H2O ═ ЭOH + H2. Гидрид лития используется в лабораторной практике как реагент для получения водорода. Гидриды - сильные восстановители; они энергично восстанавливают ряд простых и сложных веществ, например: 4NaH + TiCl4 ═ Ti + 4NaCl + 2H2; 2CsH + Cl2 ═ 2CsCl + H2. 2 Достаточно легко щелочные металлы окисляются галогенами: они горят в атмосфере фтора и хлора, а при нагревании реагируют с бромом и йодом, особенно металлы подгруппы калия, образуя ионные галогениды. Последние, кроме галогенида лития, хорошо растворяются в воде и образуют кристаллогидраты LiCl∙H2O, NaBr∙2H2O, KF∙4H2O, RbF∙3H2O и др. Металлы непосредственно взаимодействуют с серой, селеном и теллуром с образованием сульфидов, селенидов и теллуридов. Известны их кристаллогидраты Э2S nH2O, где «n» = 4 – 9. Сульфиды хорошо растворяются в воде, одновременно подвергаясь гидролизу, поэтому образующиеся растворы имеют щелочную среду: S- + H2O OH- + HS-; Э2S + H2O ЭOH + ЭHS. Селениды и теллуриды, в отличие от сульфидов, разлагаются по схеме: Na2Se + 2H2O ═ 2NaOH + Se + H2. В присутствии кислорода влажного воздуха сульфиды окисляются до тиосульфата: 2Na2S + 2O2 + H2O ═ Na2S2O3 + 2NaOH. Все металлы, кроме лития, образуют полисульфиды (персульфиды), образующиеся при растворении серы в концентрированных водных растворах сульфидов щелочных металлов: Э2S + (x-1)S ═ Э2Sx, где «x» может принимать значения 1 – 9. Полисульфидные ионы [Sx]2- имеют цепочечное строение – S – S – . Сульфид состава Na2S2 по химическому строению аналогичен пероксиду водорода. С азотом только литий реагирует при обычных условиях; другие щелочные металлы только при действии тлеющего электрического разряда на пары металлов в атмосфере азота образуют нитриды, которые при действии воды подвергаются гидролизу: Э3N + 3H2O NH3 + 3ЭOH. С фосфором прямым синтезом могут быть получены фосфиды лития, натрия и калия состава Э3Р, легко разлагающиеся водой: Э3Р + 3H2O ЭОН + РН3. Известны карбиды состава Э2С2. Это кристаллические, химически активные вещества (сильные восстановители), легко разлагающиеся на элементы при нагревании. Карбиды Li2C2 и Na2C2 можно получить при 800900оС непосредственно взаимодействием простых веществ с древесным углем; при действии воды карбиды полностью разлагаются: Li2C2 + 2H2O = 2LiOH + C2H2. C кремнием щелочные металлы при температуре 600-700оС под вакуумом взаимодействуют с получением силицидов переменного состава, например Li4Si, Li2Si. Кислородом воздуха при обычных условиях натрий и калий окисляются до нормальных оксидов Э2О, а рубидий и цезий образуют пероксиды – Э2О2. Литий же на воздухе покрывается плёнкой смеси Li2O и Li3N. 3 При сгорании же в кислороде только литий образует нормальный оксид Li2O, остальные металлы: натрий – пероксид Na2O2, а калий, рубидий и цезий – надпероксиды (супероксиды) ЭО2 (Э2О4). Нормальные оксиды получают косвенным путём – взаимодействием стехиометрических количеств соответствующих металла и пероксида: 2Э + Э2О2 ═ 2Э2О; оксид натрия может быть получен также из азида по реакции (в вакууме): 5NaN3 + NaNO3 ═ 3Na2O + 8N2. Известны и озониды щелочных металлов ЭО3 (Э – K, Rb, Cs). Получение их возможно, например, по реакции: 4КОН + 4О3 ═ 4КО3 + О2 + 2Н2О. Озониды щелочных металлов легко разлагаются: 2ЭО3 ═ 2ЭО2 + О2 Устойчивость озонидов повышается в ряду K – Rb – Cs. Пероксиды щелочных металлов проявляют как окислительные, так и восстановительные свойства, например: Cr2O3 + 3Na2O2 + H2O ═ 2Na2CrO4 + 2NaOH, 3Na2O2 + 2AuCl3 ═ 3O2 + 2Au + 6NaCl. Надпероксиды и озониды являются сильными окислителями; из озонидов наиболее изучен КО3. Оксиды содержат анион О2-, пероксиды – О22-, супероксиды – О2-, и озониды – О-3. Сродство к электрону молекулы O2 составляет 0,8 эВ, а энергия ионизации – 12,08 эВ. Поэтому, при химических превращениях O2 легко присоединяет электроны с образованием O2-, O22- и значительно труднее отдает, превращаясь в O2+. Молекулярные орбитали разр. р разр. разр. р р св. св. р р св. р разр. s св. s Порядок связи Межядерные расстояния, нм. O2+ 2,5 0,112 O2- O2 2 0,1207 O22 1,5 0,132 1 0,149 Эти ионы в изолированном виде присутствуют в ионных кристаллах. Реакции кислородсодержащих соединений с водой могут быть схематично представлены уравнениями: О2-(т) + Н2О(ж) ═ 2ОН-; 2О3-(т) + 2Н2О(ж) ═ 4ОН-(р) + 2О2(г); 2О2- (т) + 2Н2О(ж) ═ 2ОН-(р) + Н2О2(р) + О2(г); О22-(т) + 2Н2О(ж) ═ 2ОН-(р) + Н2О2(р). 4 Широкое применение получили Na2O2, NaO2 и KO2, в частности, в процессах отбеливания тканей и древесины; поглощения СО2 и получения кислорода (регенерация кислорода в изолирующих приборах, подводных лодках и др.): 2КО2 + 2Н2О ═ 2КОН + Н2О2 + О2; 2Н2О2 ═ 2Н2О + О2; 2Na2O2 + 2CO2 ═ 2Na2CO3 + O2; 4ЭО2 + 2СО2 ═ 2Э2СО3 + 3О2. Гидроксиды ЭОН являются сильными основаниями; в кристаллическом состоянии – это очень гигроскопичные, легкоплавкие вещества. По основным свойствам LiOH занимает промежуточное положение между гидросидами щелочных и щелочно-земельных металлов. Он менее гигроскопичен, чем NaOH и KOH; на воздухе легко поглощает СО2. Как и NaOH и KOH, LiOH в твердом состоянии и концентрированных растворах легко разрушает стекло и фарфор. Гидроксиды натрия и калия называют едким натром и едким кали; в технике NaOH часто называют каустической содой. Расплавы гидроксидов, кроме LiOH, устойчивы при высоких температурах; гидроксид же лития при нагревании разлагается на Li2O и Н2О: 2LiOH = Li2O + H2O. С образованием оксида лития разлагаются и кислородсодержащие соли лития, например: Li2CO3 ═ Li2O + CO2; 4LiNO3 ═ 2Li2O + 4NO2 + O2. Получают гидроксиды: а) обычно электролизом концентрированных водных растворов хлоридов металлов; одновременно на катоде получается газообразный хлор. Из других известных методов следует отметить известковый и ферритный методы получения гидроксида натрия: б) известковый: Na2CO3 + Ca(OH)2 ═ 2NaOH + CaCO3 в) ферритный: Fe2O3 + Na2CO3 ═ 2NaFeO2 + CO2 NaFeO2 + 2H2O ═ NaOH + Fe(OH)3 Одним из важнейших соединений основной химии является карбонат натрия – кальцинированная сода Na2CO3. Из водных растворов она кристаллизуется в виде кристаллогидрата Na2CO3 10H2O. Потребителями кальцинированной соды являются стекольная, целлюлозно-бумажная, текстильная и ряд других отраслей промышленности; используется она и в составах моющих средств. Промышленным методом получения Na2CO3 является аммиачно – хлоридный. Сначала при взаимодействии в водном растворе аммиака и диоксида углерода получают гидрокарбонат аммония: NН3 + СО2 + H2O = NН4НCO3. Затем обменным взаимодействием хлорида натрия и гидрокарбоната аммония получают малорастворимый гидрокарбонат натрия: NН4НCO3 + NaСl NаНCO3 + NН4Сl. 5 Гидрокарбонат натрия, на последнем этапе, подвергается термической обработке (кальцинации) с получением кальцинированной соды: t 2NаНCO3 Nа2CO3 + CO2 + H2O. Часть гидрокарбоната натрия выпускается в виде питьевой или двууглекислой соды. Карбонат калия или поташ К2СО3 из-за большой растворимости гидрокарбоната калия (KHCO3) не получают аммиачно–хлоридным методом; в основе его получения лежит реакция: 2КОН + CO2 = К2СО3 + Н2О. Большое значение имеют и широко используются такие важнейшие соединения щелочных металлов, как галогениды, сульфаты, фосфаты, нитраты и др. За исключением некоторых солей (LiF, Li2CO3, Li3PO4, Na2[Sb(OH)6], KСlO4, K2[PtCl6], K3[Co(NO2)6], RbClO4, CsClO4), все они хорошо растворимы в воде. Вместе с соединениями азота и фосфора соли калия применяются в качестве удобрений. 6



