Дефекты кристаллической структуры (точечные дефекты, линейные дефекты) Дефект по Френкелю
advertisement
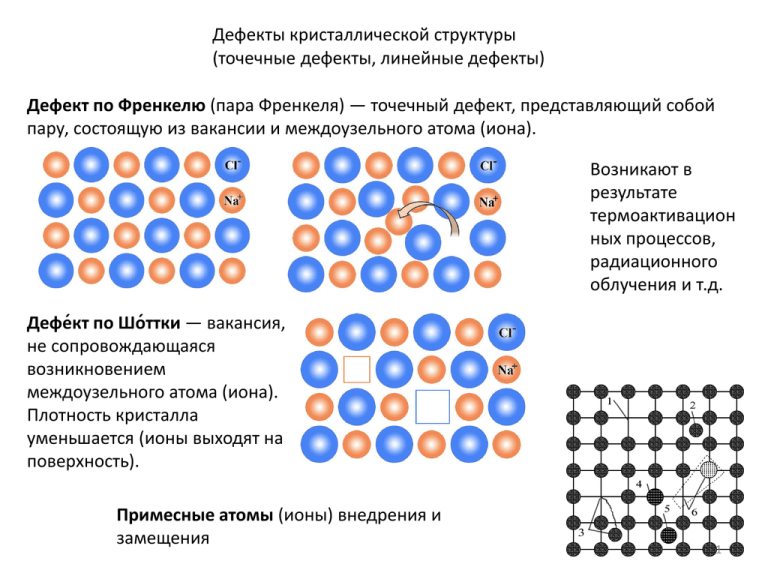
Дефекты кристаллической структуры (точечные дефекты, линейные дефекты) Дефект по Френкелю (пара Френкеля) — точечный дефект, представляющий собой пару, состоящую из вакансии и междоузельного атома (иона). Возникают в результате термоактивацион ных процессов, радиационного облучения и т.д. Дефе́кт по Шо́ттки — вакансия, не сопровождающаяся возникновением междоузельного атома (иона). Плотность кристалла уменьшается (ионы выходят на поверхность). Примесные атомы (ионы) внедрения и замещения 1 Линейные дефекты - дислокации Краевая дислокация ОО/, возникшая в результате сдвига Пластическая деформация как результат движения краевой дислокации Винтовая дислокация 2 Дифракция рентгеновских лучей – определение структуры кристаллов Межатомные расстояния имеют порядок нескольких ангстрем (1 nm = 10 Å) Брэгговское отражение q q q0 B B q0 3 Экспериментальные методы 1. Метод Лауэ (для монокристаллов) Применяется, в основном, для ориентирования кристаллов 2. Метод вращения образца (для монокристаллов) 3. Метод порошковой дифракции (порошки, композиты) 4 Дифрактограмма порошка NaCl Формула Дебая-Шеррера для определения размеров нанокристаллов: Уширение линий для наночастиц хрома по сравнению с металлическим хромом 5 Классификация твердых тел по проводимости Состояние электронов в изолированном атоме. главное квантовое число n орбитальное квантовое число l (характеризует форму орбиталей и принимает значения от 0 до n – 1) l = 0 1 2 3 4 … l = s p d f g … магнитное квантовое число m (принимает целые значения от –l до + l через единицу, всего 2l + 1 значений) спиновое квантовое число ms имеет два значения ms = ±1/2 В многоэлектронных атомах энергия атомных орбиталей возрастает согласно ряду 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p 6 Энергетические зоны Be Na Металлы, полупроводники, диэлектрики Условность разделения, широкозонные полупроводники 7 Типы связи в кристаллах Ковалентная связь, ионная связь, металлическая связь, молекулярная связь (Ван-дер-Вааальса), водородная связь Ионная связь. Реализуется в ионных кристаллах, где притяжение обусловлено, главным образом, кулоновским взаимодействием между разноименно заряженными ионами. LiF, NaCl, KBr, CsCl и т.д. Один из атомов отдает электрон и становится катионом, другой атом принимает электрон и становится анионом. Вклады в энергию связи ионного кристалла по мере их значимости: 1. кулоновское притяжение ионов разного знака; 2. кулоновское отталкивание ионов одного знака; 3. квантово-механическое отталкивание при перекрывании электронных оболочек; 4. ван-дер-ваальсово притяжение между ионами. Ионная связь не направленная и не насыщенная 8 Оценка для NaCl V e 2 R0 4 . 8 10 10 2 . 8 10 2 8 8 10 12 erg 5 eV 1erg 6 . 2 10 eV 11 из эксперимента 8 eV Для атома в кристалле с 2 сортами атомов А - постоянная Маделунга, зависит от типа кристаллической структуры. Для структуры NaCl A = 1.748, сфалерита – А = 1.638 Для NaCl n=9.4 Ковалентная связь. Реализуется во многих диэлектриках и полупроводниках. Примеры: алмаз, германий, кремний. Валентные электроны обобществляются. Направленная и насыщенная, бывает полярной и неполярной Обобществляется пара электронов, но может быть и один электрон, как в молекуле 9 Потенциал взаимодействия в ковалентных кристаллах U(r ) a r Часто применяется 4 B r n n=6-9 где a, c и a – подгоночные параметры Энергия связи на один атом С60 связи одинарные (двухэлектронная двухцентровая) и двойные (четырёхэлектронная двухцентровая) 10 Гибридизация орбиталей На примере CH4 уровни энергии электронов в атоме углерода sp3 - гибридизация 11 Схема гибридизации атомных орбиталей атома углерода d Аналогично гибридизация 3s и 3p электронов для Si и 4s и 4p электронов для Ge 12 Графен Связи одинарные, sp2 – гибридизация: три гибридные орбитали в одной плоскости, направленные под углом 120 градусов. 2pz-состояние отвечает в графите за образование межплоскостных связей Углеродные нанотрубки —структуры диаметром от одного до нескольких десятков nm и длиной до нескольких cm, состоящие из одной или нескольких свёрнутых в трубку графеновых плоскостей и заканчивающиеся обычно полусферой 13 Металлическая связь. Металлы и интерметаллические соединения (интерметаллики) Большинство металлов образует одну из решёток с плотной упаковкой атомов: кубическую объемноцентрированную, кубическую гранецентрированную и гексагональную. Металлическая связь не направленная и не насыщенная, достаточно сильная (4…5 eV). 14 Связь Ван-дер-Ваальса Обусловлена диполь-дипольным взаимодействием атомов и молекул, реализуется в молекулярных кристаллах и кристаллах инертных газов, обусловливают возможность существования агрегатных состояний инертных газов Слабая: 0.02 – 0.15 eV на атом. Три типа (электромагнитное взаимодействие): Ориентационные силы - между молекулами, являющимися постоянными диполями. (HCl в жидком и твердом состоянии). Энергия взаимодействия обратно пропорциональна кубу расстояния между диполями. Дисперсионное притяжение (лондоновские силы) - между мгновенным и наведенным диполем. Силы Ван-дер-Ваальса возникают, например, когда в результате флуктуационного разделения зарядов в каком-либо одном атоме кристалла возникает ненулевой электрический дипольный момент p1. Соседние атомы также поляризуются, их индуцированные дипольные моменты пропорциональны p1. Такие атомы будут притягиваться друг к другу. Притяжение из-за поля E и Индукционное притяжение - между постоянным диполем и наведенным (индуцированным). Энергия взаимодействия аналогична. 15 потенциал Ван дер Ваальса VW A r 6 B r m потенциал Леннарда-Джонса V LJ A 6 B r r Обуславливает сцепление частиц малых астероидов и т.п. 12 16 Водородная связь Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными. Слабые – 0.1 eV. Самые сильные водородные связи — F-H…F Внутримолекулярная водородная связь проявляется в образовании пептидных цепей Водные комплексы сеть молекул , соединённых водородными связями с пустотами - лед 17


