Карбоновые кислоты 1 МОДУЛЬ 4
advertisement
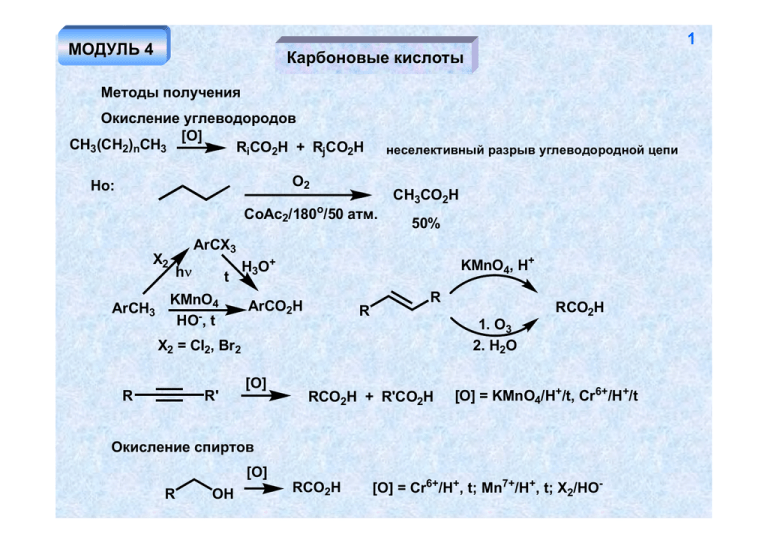
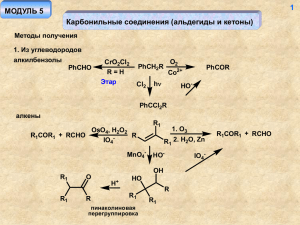
1 МОДУЛЬ 4 Карбоновые кислоты Методы получения Окисление углеводородов [O] CH3 (CH2)nCH3 RiCO2H + RjCO2H неселективный разрыв углеводородной цепи O2 Но: CoAc2/180o/50 атм. 50% ArCX3 X2 ArCH3 CH3CO2H hν t KMnO4 HO-, t KMnO4, H+ H3O+ R ArCO2H 1. O3 2. H2O X2 = Cl2, Br2 R R' RCO2H R [O] RCO2H + R'CO2H [O] = KMnO4/H+/t, Cr6+/H+/t Окисление спиртов [O] R OH RCO2H [O] = Cr6+/H+, t; Mn7+/H+, t; X2/HO- 2 Из алкилгалогенидов RMgX 1. CO2 RCO2H Mg Li 2. H3O+ RLi CN RX SN2 RCN H3O+ RCO2H Окисление альдегидов [O] RCHO RCO2H [O] = Cr6+/H+, t; Mn7+/H+, t; X2/HO-, O2 (воздух); Ag+ (реактив Толленса, реакция "серебряного зеркала"); R'CO3H (реакция Байера-Виллигера) Реакции диспропорционирования альдегидов реакция Канницаро (R - не содержит протонов у α-углеродного атома RCHO 1. HO- RCH2OH + RCO2H 2. H+ реакция Тищенко O RCHO H3O+ Al(OR')3 R O R RCH2OH + RCO2H 3 Из кетонов Окисление происходит с разрушением скелета O MnO4-, H+ R1H2 C CH2R2 t R1CH2CO2H + R1CO2H + R2CH2CO2H + R2CO2H R'CO3H O R1 H2C O RCOCH3 CH2R2 X2 HO- H3O+ RCO2- R1CH2 CO2H + R2CH2OH + CX3H галоформный распад X = Cl, Br Перегруппировка Фаворского O R R H+ O O Br2 R R HO- R R -H2O Br -BrBr 4 O O- HO HO R CO2- CO2H - R R R R R R R Реакция Вильгеродта S Ar N Ar O NH H3O+ OH Ar S O Гидролиз производных карбоновых кислот RCN H3O+ RCO2Et RCO2H RCONH2 CO/Ni(CO)4 Синтез Реппе R R CO2H CO CO/Ni(CO)4 R R CO2H CH3OH 3+ o [Rh ], 180 , 30 атм. CH3CO2H 99% OH2 CO HCO2H HCO2H H+ - H2O O - H2O H + - H+ CO -H OH2 + OH HCO2H H2SO4 H+ - H2O CO2H 1. CO 2. H2O - (CH3)CH Синтез муравьиной кислоты (в промышленности) NaOH CO p, t HCO2Na CO2H H2O CO H2SO4 OH 5 + H3O+ HCO2H 6 Удлинение цепи. Метод Арнта-Айстерта RCO2H O- O SOCl2 R H2C N N R Cl Cl O O N N O N N N N R - H+ N N R R α-диазокетон Перегруппировка Вольфа O N N R Ag2O ТГФ/H2O C R кетен O H2O R CO2H 7 Свойства карбоновых кислот Тривиальные названия некоторых кислот RCO2H: R = Н (муравьиная), CH3 (уксусная), C2H5 (пропионовая), C3H7 (масляная), C4H9 (валериановая), C5H11 (капроновая), C15H31 (пальмитиновая), C16H33 (маргариновая), C17H35 (стеариновая) Номенклатурное название кислот – «алкановая» (метановая, этановая, пропановая) Высокая растворимость в воде, высокая температура кипения H O O R R O Кислотность R ± O O O O H+ R OH H R O O делокализация заряда Акцепторные заместители R повышают устойчивость аниона (и кислотность соответствующей кислоты), доноры - снижают RCO2H R рК CH3 C6H5 CF3 H 3.75 4.75 4.2 0.2 8 Сила кислоты Х-C6 H2CO2H 2-CO2 H 2-OH 4-NO2 4-CO2 H 3-CO2H 2-CH3 H 3 (4)-CH3 4-OCH3 4-NH2 3.62 3.9 4.49 3.54 4.2 4.3 2.98 3.4 4.92 pK 2.95 X Отсутствие прямого сопряжения заряженных атомов кислорода с заместителем в ароматическом кольце R R O O- O- O "Косвенное" влияние мезомерных заместителей X X донор CO2- CO2- CO2- CO2O O2N акцептор N O 9 Влияние орто-заместителя O O O -H+ O O OCH3 H O H O H нарушение планарности (сопряжения) более устойчивая ВМВС Производные карбоновых кислот Образование солей PhOH NaOH O R OH NaHCO3 PhONa RCO2Na 10 Образование сложных эфиров (реакция этерификации) RCO2H R'OH H+ RCO2R' + H2O Фишер R R OH R OH R O R' OH O R OH2 ± H+ O R' O OH H2O R O OH R O O R' R' OH H+ R' OH ± OH R R'OH H ± R OH OH OH H+ ± O H+ R' OH Все стадии процесса обратимы. Положение равновесия определяется количеством воды - при проведении этерификации воду необходимо удалять. В избытке воды в кислой среде происходит гидролиз эфира по той же самой схеме. Образование эфиров при взаимодействии карбоновых кислот со спиртами в условиях щелочного катализа невозможно вследствие того, что первая стадия процесса – депротонирование карбоксильной группы, а образующийся карбоксилат-анион является очень слабым электрофилом. O O HO- R' R R O R' - HO- O OH реакция необратима H O H - R'OH HORCO2H -H2O 11 RCO2 - Другие механизмы гидролиза O SN1 R' O + R - R'CO2- R H2O - H+ ROH возможно только в случае образования устойчивых катионов аллильного, бензильного, трет-бутильного! скорость реакции не зависит от рН среды O I SN2 R' O LiI R'CO2- + RCH2I R DMSO реакция очень чувствительна к характеру заместителя и позволяет гидролизовать метиловые эфиры (R =H) в присутствие этиловых (R = CH3) 12 Другие способы получения сложных эфиров Переэтерификация в кислой среде O R OR' H OH HO R"OH + R OH OR' OH R R R + -H R OR" _ + +H R' OH OR" - R'OH O R OR" OR" OR' + OH H+ OR" Все стадии реакции обратимы. Положение равновесия определяется избытком спирта основный катализ O O R"OH R R OR' R"OR'O- + R"OH O OR' OR" R - R'O - OR" R"O- + R'OH Положение равновесия определяется избытком спирта OCOR1 OCOR2 OCOR3 OH EtOH + OH - H (EtO ) OH + Σ 13 RiCO2Et 1. "биодизель" 2. анализ растительных жиров в виде эфиров Взаимодействие с диазометаном RCO2H + H2C RCO2H Nu N R - NuH O- Nu- O - RCO2- + H3C N R O- O- слабый электрофил O R X Nu- OR Nu X R N SN2 - N2 RCO2CH3 нет приемлемой уходящей группы кроме Nu- - карбоновые кислоты и их соли очень Nu малореакционноспособны по отношению к нуклеофилам! O - X- N если группа Х не способна к депротонированию и является хорошей уходящей, то реакции с нуклеофилами происходят Nu легко! 14 Синтез эфиров из хлорангидридов RCO2H SOCl2 R (PCl5, PCl3) R R'OH Cl O R O O Cl OH + -H R' O O R' Cl R' -Cl- R O Cl- - хорошая уходящай группа! Синтез эфиров из ангидридов R' O O O R R'OH R O O R R O RCO2- H - RCO2- H+ RCO2R' O - хорошая уходящая группа! 15 Активация карбоксильной группы при этерификации (конденсация в присутствие дициклогексилкарбодиимида – ДЦК) H O O R + N δ C N RCO2 H R' O N O R O R'OH N H N N H хорошая уходящая группа ДЦК RCO2R' H N H N + (RCO)2O O ДЦК RCO2H O R'NH2 ДЦК R NHR' 16 Синтез эфиров из солей карбоновых кислот O R'X S N2 RCO2- R' R O Амиды карбоновых кислот R'NH2 RCO2 H RCO2- R'NH3 t RCONHR' реакция происходит в жестких условиях нет хорошей уходящей группы! аммонийная соль O R X O R'NH2 -H+ R NHR' X RCONHR' -X- если Х - - хорошая уходящая группа (галогенид-, карбоксилат-, в некоторой степени OR), реакция происходит легко O N COCl 2 N N H N RCO2H N N N N H O N R'NH2 N R N N H RCONHR' 17 Гидролиз нитрилов в кислой среде RCN H3O+ R C OH NH H2O -H+ R NH2 R OH R NH NH OH OH OH R C RCONH2 C R H2O NH2 -H+ R OH OH H+ R NH2 OH NH3 OH OH в щелочной среде δ+ HOR C N H2O R H+ OH -H+ OH RCO2H OH N H2O -HO- RCONH2 NH HO- - NH3 18 O R OH NH2 H RCN H2O2 HO - H O - NH3 -HO- HORCO2H H2O RCO2- селективный гидролиз нитрилов в амиды (происходит в более мягких условиях, поскольку в качестве нуклеофила выступает более сильный, чем гидроксид-анион - супероксид анион НО2- RCONH2 Обратная реакция (дегидратация амидов) SOCl2 RCONH2 RCN или P2O5 t Амиды могут быть получены из кетонов (оксимов) перегруппировкой Курциуса (Бекмана) O R N3NHR H2 SO4 R Курциус O O 1. NH2 OH R 2. H+ R NHR Бекман 19 Риттер R H RCN N R N H2SO4 NH + H2O O - H+ R Некоторые свойства амидов O O R R NH NH ± O H + повышенная NH-кислотность (струтура изоэлектронна карбоксилат-аниону) O R R NH2 NH2 пониженная основность O R'X (SN2) R'X (SN2) R'COCl O HN N O NaH R R + R-H R R' R N R R'COCl O R N O R' R нитрозирование O NaNO2 R' R N H3O+ H 20 O R' R N-нитрозоамиды - канцерогены N NO O O NaNO2 R NH2 H2O R H3O+ N -N2, N -H+ RCO2H очень хорошая уходящая группа легко протекающий гидролиз O O R RMgX H N H H3O+ N O H R H N RCHO нет хорошей уходящей группы Например: OCH3 OCH3 OCH3 BuLi Li 1. HCON(CH3)2 CHO 2. H3O+ OCH3 OCH3 OCH3 21 «Секстетные» перегруппировки O X N R N - -X C O R изоцианат X- - Хорошая уходящая группа O R O Br2 NH2 HO- Гофман Br R N O RCOCl N NaN3 N R N O HNO2 R Курциус O R O 1. Ac2O/NEt3 NHOH 2. HO- R N OCOCH3 Лоссен NHNH2 22 Галогенангидриды O R'COCl F- RCO2H RCOCl - R'CO2H R SOCl2, PCl3, PCl5, PBr3 X = Cl, Br RCOF X Ангидриды карбоновых кислот RCO2Na RCO2H RCOCl SOCl2 (0.5 моль) O P2 O5 R RCO2H не всегда возможно O PCl5 R RCO2Na O Другие производные карбоновых кислот RX R CNSN2 RCONH2 NH SOCl2 HCl R C Cl имидоилхлорид N R'OH/H+ (R'O-) R NH OR' иминоэфир NH R NH4Cl R C N NH3 NH2 амидин NH2OH.HCl 23 NH H3O+ R OR' RCO2R' NH NOH NH2OH R R Cl NH2 амидоксим O O R NH R NH O RCO2Et N2H4 R (RCOCl) NHNH2 RCO2Et NH2OH R ацилгидразид гидроксамовая кислота O N,N'-диацилгидразид O 2. R'COCl 1. NaH RCOCl N O R NH2OH R NH2 O R' N,N-диацилгидразид NHOH O NH2 24 Свойства карбоновых кислот и их производных Пиролиз солей CO2CO2- t Ca2+ O Электрохимическое окисление (синтез Кольбе) _ _ + e RCO2R R Реакция Бородина-Хунсдиккера RCO2Ag Br2 RBr Pb(OAc)4 RCO2H (RCO2)Pb(OAc)3 R + R+ Pb(OAc)3 - PbOAc2 - AcO- - CO2 Например: O CO2H Cl Pb(OAc)2 Pb(OAc)2 O LiCl O пиридин 25 Восстановление производных карбоновых кислот RCO2H RCO2R' [H] [H] [H] = LiAlH4, B2H6, H2/катализатор - в жестких условиях RCH2OH NaBH4 - нет RCH2 OH + R'OH [H] = LiAlH4, Na/EtOH H2/катализатор - в жестких условиях NaBH4 - нет RCONH2 LiAlH4 RCOCl RCH2NH2 [H] RCHO [H] = LiAlH(OR')3, H2 / Pd/BaSO4 1. LiAlH4 (1 экв.) [H] RCH2NH2 RCN RCHO 2. H2O [H] = LiAlH4, H2/cat, B2H6, NaBH4/Ni Взаимодействие производных карбоновых кислот с нуклеофильными реагентами O - Nu ? R O- O- O Nu- Nu- R - NuH (X = OH) O R X 26 Nu R -X- Nu X Реакция происходит тем легче, чем лучше уходящая группа (вторая стадия - лимитирующая. Ряд активности производных карбоновых кислот: галогенангидриды (X = I, Br, Cl) > ангидриды (X = OCOR) > эфиры (X = OR') >> амиды (X = RNHR') >> кислоты (X = OH, депротонирование!) Взаимодействие производных карбоновых кислот с металлоорганическими соединениями O R'MgX RCO2H RCO2- 1. R'MgX -R'H 2. H3O+ R R' O 1. R'MgX RCN 2. H3O+ O R R 1. R'2CuLi R' 2. H3O+ R' RCOCl RCONH2 1. R'MgX 2. H3O+ R'MgX -R'H - RCONH O /Cd2+ R R' R'MgX RCOCl R'MgX/FeCl3 RCOR' -78 RCO2R" -O R'MgX «обратный порядок прибавления» o O R' OR" - R"O R 27 R R'MgX R' R R' O R' реакцию практически невозможно остановить на стадии образования кетона более активного, чем сложный эфир, нуклеофила (алкоксигруппа - донор по мезомерному эффекту, снижающий частичный положительный заряд на атоме углерода) HCO2Et MgCl - 20o CHO «обратный порядок прибавления» Реакции по α-углеродному атому Производные карбоновых кислот OH O H+ Карбонильные соединения O OH H+ X X нехарактерно, кроме Х = галоген R R O R O O HO- B- + X -H R O O X X резонансная стабилизация малозначима (мезомерное влияние гетероатома) 28 Реакция Геля-Фольгарда-Зелинского RCH2CO2H Br2 RCHBrCOBr или RCHBrCO2H P Br2 + P PBr3 PBr3 RCH2CO2H -P(OH)3 HO HO Br Br Br O + Br R -H Br RCH2COBr R Br Br R RCH2CO2H RCHBrCO2H -RCH2COBr При использовании 1/3 моля красного фосфора продуктом реакции является галогензамещенный галогенангидрид, в случае каталитических количеств фосфора – галогензамещённая кислота. Для получения бромангидрида монобромзамещенной кислоты необходимо 2 моля брома. Другие способы галогенирования: RCH2 CO2 H SO2Cl2 RCHXCO2 H (Br2/пиридин, Br2/RCOBr, CuBr2) -Br- X = Cl, Br 29 Конденсация Кляйзена Более низкая СН-кислотность сложных эфиров по сравнению с карбонильными соединениями требует применения более сильного основания - EtO- (NaNH2, NaH, Na) - O O O EtO O OEt RCH2CO2Et EtO R R метиленовая компонента O -EtO- EtO EtO R R карбонильная компонента O O O O O EtOEtO -EtOH R R EtO EtO R R R R все стадии процесса обратимы, равновесие сдвигается в сторону образования продукта за счёт солеобразования на последней стадии 30 Перекрестная конденсация эфир + эфир = β-кетоэфир O возможно при отсутствии в молекуле карбонильной компоненты атомов водорода у α-углеродного атома в составе R - RCO2Et + R'CH2CO2Et EtO CO2Et R R' O ArCO2Et + CH3CO2Et EtOAr CO2Et HCO2Et, (CH3)3CCO2 Et, CF3CO2Et, (EtO)2CO, (CO2Et)2 Эфир + карбонат = малоновый эфир O + CH3CO2Et EtO OEt NaH O EtO CO2Et OEt CO2Et - EtO- CO2Et малоновый эфир 31 Эфир + формиат = β-альдегидоэфир R'CH2CO2Et + HCO2Et CO2Et NaH O R' б) эфир + кетон = β-дикетон O O R + R'CH2CO2Et EtO O R' R метиленовая карбонильная компонента компонента СН-кислотность кетона заметно выше, чем у сложного эфира (резонансная стабилизация). Поэтому, применение достаточно сильного основания позволяет проводить реакцию таким образом, чтобы кетон преимущественно выступал в качестве метиленовой компоненты. в) эфир + альдегид Такую перекрестную конденсацию осуществить, как правило, не удается – альдегид и более сильная СН-кислота, и значительно более активная карбонильная компонента, чем сложный эфир. Будет происходить конденсация альдегида самого с собой. 32 а если у альдегида нет протонов у α-углеродного атома? EtO- EtOPhCO2Et + PhCH2OH PhCHO + CH3CO2Et конденсация Канницаро а если сложный эфир сильная СН-кислота? CO2Et RCHO + CO2Et NEt3 Кневенагель CO2Et CH3CO2Et R 1. LDA 2. PhCHO Ph CO2Et CO2Et такая конденсация в принципе возможна, поскольку альдегид не может быть метиленовой компонентой, а очень сильное основание (и очень слабый нуклеофил!) может создать большую концентрацию аниона из сложного эфира. CH2CO2Et + CH3CH2O CH3CO2Et + CH2CHO самоконденсация альдегида При наличие протона у α -углеродного атома альдегида реакция сильно затрудняется (осуществима с трудом) вследствие переноса этого протона на анион сложного эфира) Конденсация Перкина Ac2O R RCHO AcONa t CO2H R не должен содержать протонов у α-углеродного атома O O O O O AcONa R O O OAc R CO2 OAc Ac2O - AcO- R OH O O O O R O O E2 R O H O O O O - R O - AcOH O 33 O - AcOH - AcO- R O -OAc R = Ph - коричная кислота Конденсация Дикмана - разновидность конденсации Кляйзена, приводящая к образованию циклических продуктов O OEt CO2Et O EtO CO2Et CO2Et O OEt CO2Et CO2Et реакция подходит для синтеза 5- и 6-членных циклов H3 O+ 34 межмолекулярная конденсация Дикмана O CO2Et - EtO2C OEt EtO 2 CO2Et EtO2C EtO2C O OEt EtO2C O OEt EtO2C CO2Et CO2Et O EtO2C O CO2Et O CO2Et EtO Реакции дианионов CO2R CO2 R CO2H O OEt O EtO EtO2C NaNH2 (LDA) R CO2- R'X CO2- - 78 oC SN2 R CO2- CO2Et 35 Ацилоиновая конденсация O CO2Et n(H2C) CO2Et OEt Na эфир O OEt n(H2C) n(H2C) OEt OEt O O O O Na n(H2C) O -2OEt- OH H2O n(H2C) O n(H2C) ацилоин реакция пригодна для получения макроциклов O 36 Дикарбоновые кислоты Производные угольной кислоты C COCl2 CO + Cl2 t фосген ROH O CCl4 + SO3 RNH2 O O O ROH RO RNH2 Cl OR карбонат OR Cl NHR хлорформиат RHN NHR мочевина ROH O RONa O CO2 t NaO H3O+ OR ROH - CO2 Мочевина (карбамид) O CO2 + NH3 t P H2 N H2O (медленно) NH2 RO NHR уретан 37 O CaC2 NH4 CNS N2 H2NCN H2N NH4 CNO Велер O NH H2O NH2 NH2 NH3 CO2 S H2 N H2N t t H2S t H2O CN2Ca O t H2N NH2 N H NH2 биурет гуанидин Свойства мочевины H2 N - H+ H2 N NH сравнительно высокая кислотность N2 + CO2 + H2O O O O H2O H2N NH2 низкая основность и нуклеофильность O HNO2 H2 N NH2 NH3CH3 Cl NH2 t - HO H2N O NHCH3 NH3 - NH3 H2N N H 38 O H2N O NaNO2 N H H2N H3O+ N нитрозометилмочевина - канцероген. Реакция происходит по этому атому азота вследствие донорного влияния метильной группы NO O O HOH2N OH H2O H3C N H2N NO N N _ O N O N - HOO- H2N O- - H OH - H2O H2C N N - HO - H2C HON NO N H2C N N диазометан OH ArO2S N CH2N2 раствор диазометана в эфире концентрированный водный раствор KOH NNH2 RCO2H CH2N2 N2 RCO2CH3 39 O 2CH2N2 HgO N2 RCOCl - CH3Cl - N2 ROH CH2N2 R ROCH3 BF3 CO2H H N O N H NH2 t O N H O O O CH2O NH2 H2N N H O N H N H N O OH N H N H мочевино-формальдегидные смолы n N O барбитуровая кислота парабановая кислота H2N NH CO2H H2N t O O CO2H O O CO2H n n Изоцианаты, изотиоцианаты Синтез O COCl2 ArNH2 Ar N Cl t 40 N C O Ar O H OH ArNH CH3NH2 COCl2 t N C O N H O "севин" - гербицид Бхопальская катастрофа — последствия аварии на химическом заводе Union Carbide в индийском городе Бхопал (штат Мадхья-Прадеш) ранним утром 3 декабря 1984 года, повлёкшей смерть, по крайней мере, 18 тысяч человек, из них 3 тысячи человек погибли непосредственно в день трагедии, и 15 тысяч — в последующие годы. По различным данным, общее количество пострадавших оценивается в 150—600 тысяч человек. Эти цифры дают основание считать бхопальскую трагедию крупнейшей в мире техногенной катастрофой по числу жертв CSCl2 ArNH2 N 41 изотиоцианаты S Ar 1. NaNO2/H3O+, 0 oC CS2 2. NaN3 PPh3 ArN3 N Ar - N2 t O R C RNCO бензол N3 PPh3 Курциус Взаимодействие с нуклеофильными реагентами Nu C N R N C H Nu- X R C HN R C N O X X = O, S X C HN R OR' R'OH N O R Nu + Nu R HN X C NHR' R'NH2 R C O H2O O HN R C OH - CO2 RNH2 Промышленно-важные диизоцианаты – мономеры для полимеров (полиуретанов) OCN NCO (H2C)6 NCO NCO OH NCO + O OH H N O NCO O N H n O OCN N O NCO N N O NCO OH OH сетчатый полиуретан 42 43 Производные тиоугольной кислоты S - RNH2 С+S CS2 S R'X R S HO- N H R'S S S RX R -S N H дитиокарбаматы H+ RONa R SN2 O R R'S SN2 O ксантогенаты S R N R R S - S Cl2 S R N N R S S R тиурамдисульфиды (R = Et - "эспераль", "торпеда") RMgX 1. CS2 2. H2O S R SH Синтез меркаптанов с использованием тиомочевины S S NH2 SN2 NH NH3 RX H2 N 44 RSH + H2 N NH2 H3 N X- NH2 «Настоящие» дикарбоновые кислоты CO2H Щавелевая CO2H CO2H CO2H CO2H CO2H Малоновая янтарная CO2H CO2H CO2H CO2H глутаровая Адипиновая Методы синтеза HCO2Na CH3CO2H Cl2 P ClCH2CO2H 1. NaOH 2. NaCN t + CO2Na H3O CO2Na CN CO2H CO2H + H3 O CO2Na CO2H CO2H _ +e OH OH O EtO- + CH3CO2Et EtO CO2Et OEt RCH2CO2H CO2H + H3O CO2H CO2Et CO2H 1. LDA R 2. CO2 CO2H 3. H2O Br CN H3O NaCN Br CN CO2H O O O2 V2O5 O OH O или n(H2C) CO2H + n(H2C) H2 Pd/C O O или n(H2C) O [O] HO2C CO2H (CH2)n 45 CO2 - CO2 Et _e + CO2Et CO2Et (CH2)n N N COCl + CO2Et Кольбе (CH2)2n+2 (CH2)n 46 O NEt3 CO2Et (CH2)n 1. H3O+ 2. HO HO2C HO2C (CH2 )5 O (CH2)5 1. N2H4 (CH2)n (CH2)n 2. HO 3. H+ HO2C HO2C - Свойства дикарбоновых кислот Кислотность кислота рК1 рК2 щавелевая 1.27 4.23 малоновая 2.87 5.70 янтарная 4.16 5.61 глутаровая 4.34 5.27 Причины: •Индуктивный эффект карбоксильной группы. •Внутримолекулярная водородная связь, стабилизирующая анион. H O O H OO оксалат-анион O O OO малонат-анион 46 легкость окисление щавелевой кислоты CO2H KMnO4 CO2H CO2Et CO2Et CO2 + H2O диэтилоксалат - сложный эфир, не имеющий атомов водорода у α -углеродного атома - активная карбонильная компонента в перекрестных конденсациях Кляйзена H2O Дегидратация O C C C P2O5 t O CO2H CO2H H O CH3CO2H OH O Декарбоксилирование HO ~ 100o -CO2 O -CO2 CH3CO2H HO Синтетические применения малонового (натрмалонового) эфира CO2H CO2H EtOH H+ CO2Et CO2Et EtONa EtO2C Na+ EtO2C устойчивый анион индуктивное влияние двух акцепторных групп CO2H t R 47 R CO2H CO2H H3O+ CO2Et CO2Et CO2Et RX R SN2 CO2Et 1. EtO2. R'X CO2Et R R' + H3O t CO2Et R CO2H R' R, R' = алкил CO2Et ClCH2CO2Et EtO2C CO2Et CO2Et + CO2H H3O t CO2Et CO2H Br CO2Et 0.5 M CO2Et Br CO2Et Br 0.5 M Br EtONa (2 M) CO2H H3O+ CO2Et t EtO2C CO2H CO2Et CO2Et CO2Et H3 O+ t CO2H 49 Нуклеофильное присоединение к акцептороно-замещенному алкену (Михаэль) + X CO2Et EtO- (cat) CO2Et EtOH X = CO2Et, COR, NO2, C EtOH CO2Et X CO2Et CO2Et CO2Et EtO- t X X H3O+ CO2H N Например: CO2Et EtO2C + O EtO2C CO2Et EtO- (cat) H3O+ CO2Et CO2Et EtOH O CO2Et CO2Et CO2H O CO2H CO2Et CO2Et I2 EtO2C CO2Et EtO2C CO2Et CO2Et + H3O t CO2H CO2H t 50 CO2Et R I2 CO2Et EtO2C CO2Et R R EtO2C CO2Et Янтарная кислота CO2H R CO2H H3O+ t O O CO2H P2O5 t R CO2H O P2O5 t CO2H CO2H O O O O CO2H P O 2 5 t CO2H n(H2C) O (CH2)nO Некоторые свойства ангидридов дикарбоновых кислот O O RO RO- O CO2- O CO2CH3 O O моноэфир дикислоты CH3OH H+ CO2CH3 CO2CH3 O NBr NH3 Br2/HO- NH 0 oC O NBS Br2/HO- CONH2 O a - гидролиз b - расщепление Гофмана t a CO2- b CONH2 NH2 Применение конденсации Дикмана в синтезе O EtO- CO2Et CO2Et CO2 H NH3 O t O CO2 - CO2Et 51 O O O O CO2Et H3O+ RX/EtO- R SN2 β-кетоэфир HO- t CO2- -O 2C R t R 52 реакция конденсации обратима! O EtO R O EtOCO2Et R CO2Et t CO2Et CO2Et CO2Et CO2Et R R более устойчивый анион R R R OEt -EtO 1. EtO- - O O CO2Et O CO2Et H3O+ t O 2.R'X EtO2C R R' R' HOt R' R CO2H CO2H O 53 R O CO2 Et O EtO2C EtO2C EtO- 1. EtOCO2Et CO2 Et H3O+ t O R R 2. RX O O CO2Et CO2H CO2H O2 Co2+ CO2H 2+ Co фталевые кислоты толуиловые кислоты Br CO2H CONEt2 1. Mg / эфир 2. CO2 3. H3O+ HOt R Ароматические кислоты O2 R ДЭТА CO2H CO2H 54 O CO2H O2 H3O+ O V2O5 CO2H фталевая кислота: диэтилфталат (репеллент) O CO2H CO2H KOH/400o CO2H 1. 2. H3O+ HO2C терефталевая кислота O HO2C H2O2 CaO t AcOH CO2H дифеновая кислота флуоренон 55 CO2H графит HO2C HNO3 CO2H HO2C CO2H t HO2C CO2H CO2H CO2H меллитовая кислота графит пиромеллитовая кислота Свойства O CO2H CH3O- O NH3 O NaOBr NH t CO2H t NH2 CO2CH3 O O фталимид антраниловая кислота HO Ph 56 O O OH PhH PhOH CO2H O ZnCl2 AlCl3 O O O Zn HO- O O фенолфталеин фталид Ph Ph COCl PhH COCl O AlCl3 O HO2C H2N O CO2H HO NH2 O OH O O O HN NH кевлар n n O лавсан Галоидкарбоновые кислоты МОДУЛЬ 5 (Часть 1) Синтез – галоидировние карбоновых кислот: Br2/P (Гель-Фольгардт-Зелинский) Br2/пиридин Br2/RCOBr Br2/hν NBS SO2Cl2 SOCl2/hν Br [Br2] R CO2H Cl R CO2H OH HNO3 57 ClCH2CO2H H2SO4 Cl Cl t Cl F-/HF (CH3CO)2O _e + CF3COF H2O CF3CO2H OH Cl2 OH HO- HNO3 Cl3 C OH Cl3CCO2H 58 Производные ϖ-галоидкарбоновых кислот O COCl SOCl2 O HBr ZnCl2 Cl CO2Et EtOH Br β-Галоидкарбоновые кислоты CO2H HX H+ CO2H CO2H H+ CO2H X = Cl, Br X X- оба катиона неустойчивы! OH OH OH OH Свойства α-галоидкарбоновых кислот Повышение кислотности по мере накопления атомов галогена у α-углеродного атома. Ка CF3CO2H 5.9.10-1 (в 10000 раз более сильная кислота, чем уксусная!) 59 Использование реакций нуклеофильного замещения CN CN Br CH2N2 CNR HO- R CO2H NH3 H2O α-гидроксикислоты H Ag+ Br H3O+ R CO2H CO2H O (S)-бромпропионат - AgBr LiAlH4 NH2 CO2H R α-аминокислоты O- CO2CH3 циануксусный эфир NH2 OH R R CO2H H SN2 CO2H R γ-аминоспирты малоновые кислоты O - H+ O SN2 H2O OH O- H HO O (R)-лактат 60 Реакция Дарзана O O- O ClCH2CO2Et CO2Et - Cl NaNH2 (EtO-) CO2Et Cl Реакция Реформатского O OClCH2CO2Et OH CO2Et Zn H2O CO2Et Br HBr - CO2 H EtO CO2 H Br CO2 H активный электрофил в реакции присоединения CO2 Et по Михаэлю! 61 Гидроксикислоты HO HO HO2C CO2H CO2H гликолевая (свекла, виноград) HO CO2H CO2H яблочная (клюква) OH HO молочная (брожение) HO HO2C CO2H винная (виноградная) CO2H HO CO2H CO2H лимонная (махорка) CO2H (CHOH)n Ph миндальная CO2H (CHOH)n CH2OH CO2H гликоновые кислоты гликаровые (сахарные) кислоты 62 Методы получения α-гидроксикислоты OH Br R CO2H H2O Штреккер HCN RCHO R N2+ H2O HOCO2H OH R CN R CO2H R OH O2 CO2H β-гидроксикислоты OH OH CHO R Ag2O CO2H R R альдоль R CO2H CO2 H R = Ph - миндальная кислота OH Cat H3O+ OH H3O+ циангидрин OH NH2 NaNO2 R 63 HO CO2H LiAlH4 H3O+ HO RCO3H O CO2H CO2H CO2H H3O+ OH HO CO2H O OClCH2CO2Et OH CO2Et Zn H2O CO2Et Реформатский γ-гидроксикислоты Cl 1. Mg/эфир O CO2H O 2. CO2 CN- γ-бутиролактон H3O NaBH4 CN O O O H3O t + OH CO2H ω−гидроксикислоты 64 O O RCO3H O (CH2)n (CH2)n Реакция Байера-Виллигера Cl O t (CH2)n+3 HO2C лактон 1. HCN Cl HO H3O+ 1. KCN 2. H3O+ Cl Cl HO CO2H HO2C 2. H3O+ CO2H HO CO2H лимонная кислота O G CO2H NaBH4 OH G (LiAlH4) CO2H G = (CH2)n, где n = 0,1,2... CHO OH (CHOH)4 CH2OH углевода CO2 H молочнокислое брожение 65 OH HO OH 1. B2H6 (CH2)n 2. H3O+ RCO3H H2O2/HO- HO2C (CH2)n HO2C смесь региоизомеров O (CH2)n HO2C (CH2)n HO2C LiAlH4 OH (CH2)n HO2C смесь региоизомеров Свойства гидроксикислот H H O O OH - H+ O O O Повышенная кислотность в результате образования внутримолекулярной водородной связи, стабилизирующей анион 66 свойства спиртов + свойства кислот OH OH 1. Na2CO3 EtOH 2. CH3I CO2CH3 CO2H H+ SOCl2 NaH RCOCl Cl OH CO2Et CH3I OCH3 OCOR COCl + H3O CO2CH3 CO2H O CrO3 CO2H пиридин OH HI CO2H LiAlH4 t CO2H t OH OH OCH3 CO2H 67 Реакция декарбонилирования OH R OH + OH H t CO2H OH2 R -H2O R - CO O O OH OH R R RCHO + -H Термические процессы α-гидроксикислоты OH R R O O O O R лактид t CO2H β-гидроксикислоты R t O O R CO2H OH t R CO2H 68 γ,δ-гидроксикислоты HO HO O (CH2)3 CO2H (CH2)n CO2H O t O t O HO (CH2)4 CO2H O t O (CH2)n O n>4 n Ароматические гидроксикислоты Синтез Кольбе-Шмидт ONa OH CO2 OH > t,p CO2H салициловая кислота OH CO2К OH OH CO2 230o HO2C KO2C NaO2 C OH CO2 280o CO2Na 69 OH OK OH CO2 t > 125o > KO2C OH OH NH4HCO3 OH HO H2O, 100o ONa CO2H OH CO2Na CO2 120o OH OH CO2K CO2 240o CO2K CO2K 70 OM CO2/260 OM o OH CO2/200o M = Na M=K CO2Na KO2C CO2/240o CO2/260o CO2M M = Na M=K OH KO2C CO2K 400 CO2K o KO2C Другие методы HO OH PhONa CCl4 HO-, Cu+ + CO2Na CO2Na PhONa CCl4 - 71 HO OH + + HO , Cu CO2Na CO2Na 25% 35% OH OH OH PhCO2Cu(OH) t I2 CO2H CO2H пиридин CO2H CO2H HNO3 H2SO4 PhCO2H SO3 H2SO4 SO3H O2N Fe HO- t H3O+ CO2H CO2H 1. NaNO2 / H3O+ NH2 2. H3O+, t OH COCH3 OH 72 OH [O] CO2 H t [O] = CuO/NaOH; MnO2/KOH; KClO3 Свойства Повышенная кислотность салициловой кислоты Свойства кислот + свойства фенолов CO2H CO2H OCOCH3 (CH3CO)2 O CO2CH3 OH OH CH3OH H+ ацетилсалициловая кислота (аспирин) PhOH SOCl2 CO2CH3 CO2Ph OH салол 1. HO2. CH3I OCH3 CO2H H3O + OCH3 OH Br Br Br2 73 OH OH CO2H O2N HNO3 Br NO2 NO2 HO2C OH PhN2+ N Ph OH N OH OCH3 CO2H H3CO H3CO HO2C анисовая кислота OH OH ванилиновая кислота галловая кислота OCH3 OH OCH3 OH HO2C протокатеховая кислота OH HO2C вератровая кислота 74 Непредельные кислоты и их производные α,β-Ненасыщенные кислоты Синтез O HCN HO CN HCN + H3O H3O+ t CO2H акриловая кислота OH KCN t Cu+ CN NH3 O2 Cl COCl2 Cl COCl AlCl3 O HCN HO CN H3O+ t метакриловая CO2H кислота CH3OH + H3O CO2CH3 метилметакрилат Br 75 EtOCO2H t Br2 CO2H P CO2H CO2H CO2H t RCHO + CO2H CO2H R H+ CO2H R NH [O] R CO2H R O R R Свойства (нуклеофильное присоединение) O O HO X X O Nu Nu- + X Nu X 1,2-присоединение + O O O Nu X X Nu X 1,4-присоединение Присоединению по Михаэлю – 76 взаимодействие акцепторно-замещенных алкенов с карбанионами происходит как 1,4-присоединение! HCN CN- CO2 H (NaHSO3 ) CO2H HX CO2H CO2H CN CO2 H X 1. R2CuLi R CO2Et 2. H2O R 1. RMgX R CO2Et 2. H2O OH Реакции с карбанионами EtO2C CO2Et CN CN CO2Et CO2Et CO2Et CO2Et EtO2 C CO2Et H3O+ t CO2H CO2H Реакция полимеризация (радикальная или анионная) CO2CH3 полиметилметакрилат (оргстекло) n CO2CH3 n полиакрилонитрил (орлон, нитрон) CN CN n CO2H полиакриловая кислота n CONH2 полиакриламид 77 78 β,γ-Ненасыщенные кислоы Br 1. CN2. H3O+ CO2H O H+ O 1. Mg (эфир) Cl CO2H 2. CO2 3. H3O+ _ + +H CO2- Легкость декарбоксилирования H O t O - CO2 CO2- + _ H+ CO2H 79 Природные ненасыщенные карбоновые кислота стеарин OCOR маргарин H2 OCOR' Ni H3O H2O HO- RCO2- + R'CO2 - + R"CO2- + OH Na-соли - мыло OH OCOR" олифа (Co, Pb, Mn) OH глицериды эфиры насыщенных и ненасыщенных кислот кислоты насыщенные CH3(CH2)14CO2H пальмитиновая CH3(CH2)15CO2H маргариновая CH3(CH2)16CO2H стеариновая кислоты ненасыщенные H3C(H2C)7 (CH2)7CO2H олеиновая (CH2)7CO2H H3C(H2C)7 элаидиновая CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2H линолевая CH3(CH2CH=CH)3(CH2)7CO2H линоленовая 80 ClCH2(CH2)nCO2H PPh3 Ph3PCH2(CH2)nCO2H LiI/ДМФА Cl- OCOR - O P O R n(H2C) CO2H преимущественно цис-изомер OCOR OCOR' O RCHO OCOR' O NH3 O кефалины (биологические мембраны, нервная ткань) - O P O N O лецитины (биологические мембраны) 81 Олифа натуральная («высыхающие жиры») изомеризация + Варка O2 O O OH OH O O полимеризация ("высыхание") 82 Оксокислоты Синтез α-Оксокислоты OH O [O] CO2- + _e CO2H OH глиоксиловая кислота O R CO2- CN O - Cl R H3O R CN t CO2H CO2H виноградная кислота RCOCH2Br пировиноградная кислота ДМСО RCOCHO NOH RCH2CO2Et 1. NaH (LDA) 2. R'ONO CO2H O OH OH HO2C O + R CO2Et [O] RCOCO2H O H3O+ (CH2O/H+) R CO2H 83 β-Оксокислоты Конденсация Кляйзена AcOEt O EtO- CO2Et CO2Et O O CO(OEt)2 CO2H N N H 1.ClCO2Et/NEt3 H+ NaH O 2. H3 O+ γ-Оксокислоты O O CO2Et 1. EtO H3O+, t - CO2Et 2. ClCH2CO2Et CO2Et O H3O+, t фруктоза (крахмал) CO2Et левулиновая кислота 84 CO2H N 1.ClCH2CO2Et/NEt3 O 2. H3O+ R OH + O H3O O Cr R 6+ CO2H R H3O+ O + BrCH2CO2Et Na R Hg2+ R CO2H δ-Оксокислоты O CO2H O 1. EtOCO2Et CO2Et 2. CO2Et CO2Et H3O+, t O CO2H CO2Et O 1. EtO- H3O+, t CO2Et CO2 Et 2. CO2Et CO2H CO2Et O CO2Et 85 O O 1. EtO- CO2Et 2. Cl CO2Et O O [O] (CH2)n N O 1. RCOCl/NEt3 2. H3O+ HO2C O (CH2)n O OH O O HOR t R R - O2C 86 Свойства оксокислот α-Оксокислоты Декарбоксилирование O HO HCN HO CN O O CO2- R CN R CN - CO2 R - RCHO - CN R O Декарбонилирование O OH R O O + H O OH2 R O O - CO R - H2O R H2O RCO2H - H+ O Реакции с нуклеофильными реагентами OH R O NaBH4 NH2OH CO2H - R'H CO2H R N2H4 NOH R 1. R'MgX R'MgX R CO2H O NNH2 R CO2H CO2- R OH CO2H 2. H2O R' 87 β-Оксокислоты Значительная енолизация карбонильной группы (значительно в большей степени, чем для обычных кетонов, но в меньшей степени, чем в случае β-дикарбонильных соединений. Стабилизация енольной формы образованием сопряженной системы и внутримолекулярной водородной связи. Енолизация сложноэфирной (карбоксильной) группы не происходит вследствие донорного (по мезомерному эффекту) влияния алкокси- (гидрокси-) группы. H H O O O O O O OEt OEt O O OEt менее значимая резонансная структура (донорное влияние алкоксигруппы) + H+ - H+ O O OEt O OEt O OEt Высокая СН-кислотность – результат резонансной стабилизации карбонильной группой и индуктивным акцепторным влиянием сложноэфирной группы. Более слабые, чем β-дикетоны СН-кислоты. 88 Применение β-кетоэфиров в синтезе CH2CO2Et LDA RX RCH2CO2Et - 78o CH3CO2Et осуществить реакцию алкилирвания невозможно вследствие низкой СН-кислотности сложного эфира RX EtO- O CO2Et ацетоуксусный эфир сильная СН-кислота O O EtO-EtOH CO2Et CO2Et RX SN2 резонансная + индуктивная стабилизация карбаниона O O - CO2Et 1. EtO 2. R'X R кетонное расщепление CO2Et R R' кетон O H O O CO2Et O OH H3 O+ t O R R, R' - алкил, Х - I, Br, Cl R' R R' R' R' -CO2 R R кислотное расщепление CO2Et HOt R' CO2 HO- R - HO R' CO2H -AcOH R R R O R' CO2R R' Таким образом: O кислота O O O R 89 CO2H CH3CO2Et R R CO2H R' R' O O O 1. EtOCO2Et 2. I2 (O.5 M) O + CO2Et H3O t EtO2C O HOt - O2C CO2- 90 аналогично R O R O CO2Et O или O2C R R X' R CO2- X' O CO2- или X' - O2C X' O O O O 1. EtOCO2Et CO2Et 2. CO2Et или X X = акцептор (реакция Михаэля) X X X' 91 R O H3O+ O H3O+ t O CO2Et CO2Et t R O CO2Et 1. R EtO- CO2Et 2.RX HO- CO2H t CO2H EtO-, t O O CO2Et CO2Et EtO2C EtO2C O EtO2C CO2- CO2CO2- 92 Генерирование и применение дианионов ацетоуксусного эфира O CO2 Et O LDA Li Li O O RX (NaH, LiN(SiMe3)2 Li H2C OEt R кинетический контроль O R'X R CO2 Et H3O+ t R' OEt H2O R O O R O LDA CO2Et H2C CO2 Et R' O O O O Br(CH2)3Br CO2Et CO2Et Br CO2Et 93 Реакции с другими электрофильными реагентами O CO2Et CO2Et CO2Et O CHR RCHO NEt3 O CO2Et Br2 CO2Et CO2Et O N N O NNHAr Ar NO2+ CO2Et O CO2Et O NOH NO+ ArN2+ AcOH O NO NO2 Все указанные продукты можно вводить в "кетонное" или "кислотное" расщепление Br O OCH3 R CH2N2 TsN3 O CO2Et R CO2Et HO-, ТЭБАХ CH2Cl2-H2O CO2Et R N2 O CO2Et O 94 COR O RCO2Et CO2Et O RCOCl CO2Et R "мягкий" электрофил (сложный эфир) взаимодействует с "мягким" нуклеофилом - атомом углерода; "жесткий" (хлорангидрид) - с "жестким" нуклеофилом - атомом кислорода енолят-аниона Реакции с нуклеофильными реагентами Cl O CO2Et RMgX O O R H2O CO2Et O HO R R PCl5 OH NaBH4 RMgX R - RH O CO2Et CO2Et NH2OH NOH N CO2Et N2H4 N NNH2 CO2Et NH O O O