АТОМНО АБСОРБЦИОННОЕ ОПРЕДЕЛЕНИЕ ЦИНКА В
advertisement

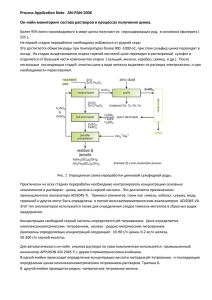
14 «Заводская лаборатория. Диагностика материалов» № 5. 2006. Том 72 Таблица 2. Характеристика методов определения Се (ІV) Реагент Тропеолин 00 ПАР Метиловый оранжевый Метиловый красный Используемый раствор реагента λmax Минимальная определяемая концентрация, мкг/мл Литература Водный " В 60 % H2SO4 В 80 % H2SO4 530 415 или 453 533 533 0,04 0,5 4 4 — [6] [5] [5] высокой точностью определять до 0,001 % Се (ІV) в водо- и кислоторастворимых объектах. По селективности предложенный метод не отличается от известных аналогичных методов, но по чувствительности (минимальная определяемая концентрация церия — 0,04 мкг/мл) значительно их превосходит (табл. 2). ЛИТЕРАТУРА 1. Харламова Л.И., Борчева Т.А., Соломатин В.Т. / Заводская лаборатория. 1974. Т. 40. № 10. С. 1169 – 1177. 2. Blazejak-Ditges D. / Z. Anal. Chem. 1970. V. 251. № 1. P. 11 – 15. 3. Gayduk O.V., Pantaler R.P., Blank A.B. / Function materials. 2005. V. 12. № 1. Р. 69 – 71. 4. Iordanov N., Antonova N., Daiev C. / Talanta. 1966. V. 13. № 10. P. 1459 – 1462. 5. Черкесов А.И., Жигалкина Т.С. / ЖАХ. 1961. Т. 41. № 3. С. 364 – 365. 6. Basavaiah K., Chandrashekar U., Nagegowda P. / Bulg. Chem. Commun. 2003. V. 35. № 3. P. 174 – 182. 7. А. с. 1201740 (СССР). Способ определения Се / В. М. Иванов, В. Н. Фигуровская // Открытия. Изобретения. 1985. № 48. УДК 546.47: 543.422 АТОМНОАБСОРБЦИОННОЕ ОПРЕДЕЛЕНИЕ ЦИНКА В МЕДНЫХ СПЛАВАХ © А. М. Пашаджанов, Н. Х. Рустамов1 Статья поступила 23 октября 2005 г. Исследовано комплексообразование цинка с 2-гидрокси-5-третбутилбензол-<1-азо-1′>-2′метилбензолом (HR). Найдены оптимальные условия комплексообразования и установлен состав комплекса Zn. Изучено влияние посторонних ионов на образование и экстракцию комплекса. Разработана методика экстракционно-атомно-абсорбционного определения цинка в медных сплавах. Широкое применение цинка требует разработки методики его определения в самых разных объектах. Для определения микроколичеств цинка используют фотометрические, атомно-абсорбционные и атомноэмиссионные методы [1]. Ион цинка не обладает хромофорными свойствами, и фотометрические методы его определения основаны на применении органических реагентов. 1 Институт химических проблем НАН Азербайджана, г. Баку, Азербайджан. Для фотометрического определения цинка используются многие хелатообразующие реагенты, содержащие донорные атомы N, O или S [2]. Открытые новые аналитические возможности хелатообразующих реагентов, в том числе и азосоединений, вызывают большой практический интерес. В качестве реагентов на цинк предложены многочисленные гетероазосоединения. Среди них наибольшей чувствительностью отличается 5-(2хинолилазо)-2′-моноэтиламино-п-крезол (2-ХААК) «Заводская лаборатория. Диагностика материалов» № 5. 2006. Том 72 [3]. Все реагенты этого класса малоселективны. Для определения цинка широко применяемым остается экстракционно-фотометрический метод с использованием дитизона [1, 2]. Реакция цинка с дитизоном высокочувствительна, но не избирательна. Определению цинка атомно-абсорбционным методом с предварительным экстракционным концентрированием посвящены работы [4, 5]. Цель настоящего исследования — изучение экстракционных возможностей 2-гидрокси-5третбутилбензол-<1-азо-1′>-2′-метилазобензола по отношению к ионам Zn и разработка методики экстракционно-атомно-абсорбционного определения микроколичеств цинка в медных сплавах. 2-Гидрокси-5-третбутилбензол-<1-азо-1′>-2′метилбензол синтезировали по реакции диазотирования производных анилина и азосочетанием паратретбутилфенола с диазосоединениями [6]. Его состав и строение устанавливали элементным анализом, методами ИК- и УФ-спектроскопии. Структурная формула реагента H9C4 N OH N CHСН 3 3 Стандартный 1,5·10–5 М раствор цинка готовили растворением металла марки ЦО (ГОСТ 3640–65) в HCl (1:1) с последующим выпариванием раствора досуха и растворением сухого осадка в воде. Рабочие растворы цинка получали разбавлением исходных. Необходимую кислотность создавали 0,1 M HCl и NaOH, а также боратными буферными растворами (Na2B4O7 + NaOH) [7]. Для создания ионной силы раствора использовали 1 M KNO3. Применяли 0,1 %-ный этанольный раствор 2-гидрокси-5-третбутилбензол-<1-азо-1′>-2′метилбензола (HR). В качестве органических растворителей использовали бензол, толуол, хлороформ, четыреххлористый углерод и бутанол. Величину рН растворов контролировали с помощью универсального иономера ЭВ-74. Спектрофотометрическое исследование окрашенных растворов проводили на приборах СФ-46 и КФК-2 в кювете с толщиной поглощающего света слоя l = 0,5 см. Атомное поглощение измеряли на атомно-абсорбционном спектрофотометре ААS-IN, резонансная линия 213,9 нм. Источник резонансного излучения — лампа с полым катодом из цинка. Пламя — ацетилен – воздух. При взаимодействии цинка с реагентом образуется окрашенное комплексное соединение с 15 максимальным светопоглощением при λ = 400 нм, а сам реагент поглощает при λ = 370 нм. Оптимальная величина рН комплексообразования — рН 10. Изучена экстракция комплексов цинка рядом неполярных и малополярных органических растворителей. При выборе экстрагента, удовлетворяющего требованиям атомно-абсорбционного анализа (не изменяющего режима горения пламени), испытаны спирты (бутиловый, изобутиловый), углеводороды (толуол, бензол, ксилол) и хлорорганические соединения (дихлорэтан, четыреххлористый углерод и хлороформ). Наибольшее извлечение цинка (90 – 98 %) получено при экстракции толуолом, бутанолом и смесью бутилового спирта с хлороформом (4:1). Бутанол оказался наиболее пригодным для атомно-абсорбционного анализа. Он не изменяет режим горения пламени при расходе экстракта до 10 л/мин. При изучении влияния времени и температуры на комплексообразование установлено, что оптическая плотность достигает максимума через 2 – 4 мин после смешения растворов и остается постоянной в течение 24 ч. При повышении температуры оптическая плотность увеличивается, затем при понижении температуры до комнатной опять принимает первоначальное значение. Молярный коэффициент светопоглощения комплекса, рассчитанный по методу насыщения, равен 32000. Соотношение компонентов в комплексе изучали методами прямой линии Асмуса и сдвига равновесия: оно составляет 1:2 [8]. Влияние посторонних элементов на реакцию комплексообразования характеризовали фактором селективности. Установлено, что определению цинка с HR не мешают 1000-кратные количества щелочных, щелочноземельных металлов; 100-кратные — W (VI), Mo (VI), Pb (II), Cr (III), V (V); 50-кратные — Mn (II), Cd (II), Al (III). Сравнительные характеристики известных фотометрических, экстракционно-фотометрических методик определения цинка и предлагаемой авторами приведены в табл. 1. Определение цинка в медных сплавах. Навеску образца 0,5 г растворяют при нагревании в 15 мл азотной кислоты (1:1) и упаривают до влажных солей. Далее остаток растворяют при нагревании в бидистилляте, раствор переливают в мерную колбу вместимостью 50 мл, разбавляют до метки водой и перемешивают. Аликвотную часть раствора (0,2 – 10 мкг цинка) переносят в делительную воронку емкостью 25 мл, добавляют 0,5 мл 0,1 %-ного раствора HR и 5 мл буферного раствора (рН 10; Na2B4O7 + NaOH), прибавляют 5 мл бутанола и встряхивают в течение 16 «Заводская лаборатория. Диагностика материалов» № 5. 2006. Том 72 Таблица 1. Основные спектрофотометрические характеристики методик определения цинка Органические реагенты Диапазон определяемых концентраций Zn, мкг/мл λmax, нм ε pH среды Дитизон (дифенилтиокарбазон) 530 8·104 6 – 8,3 5 – 10 2 ХААК [5-(2-хинолилазо)-2-моноэтиламино-п-крезол] 530 9,6·104 8–9 0,6 – 10 2-гидрокси-5-третбутилбензол-<1-азо1′>-2′-метилбензол 400 3,2·104 9 – 10 0,2 – 10 Мешающие элементы (кратные количества) Литература Cu (II); Co (II); Fe (III); Ni (II); Pb (II); Cd (II); Hg (II); Sn (II); Ag (I) (50 – 100) Mg (II) (500); Al (III) (100); Mn (II) (5); Pb (II) (90); Fe (III) (60); Ni (II); Cu (II) (0,5); Cd (II) (50); Cd (II) (100) W (VI); Mo (VI) (100); Mn (II) (50); Pb (II) (100); V (V) (100); Cr (III) (100); Al (III) (50); Cd (II) (50) [1] [9] Таблица 2. Результаты экстракционно-атомно-абсорбционного определения цинка в медных сплавах (n = 5; p = 0,95) Марка образца Аттестованное содержание элементов, % Найдено Zn, % sr М 183-2 0,008 Zn; 5,88 Sn; 0,26 P; 0,046 Fe; 0,69 Pb; 0,011 Sb; 0,002 Bi; 0,005 Al; 0,001 Si; 0,003 Mg; Cuост 0,7 Zn; 16,3 Pb; 5,2 Mn; 0,65 Ni; 1,1 Sn; 0,3 Fe; 0,0045 Si; 0,4 P; Cuост 0,2 Zn; 20,0 Pb; 4,5 Mn; 1,2 Ni; 0,5 Sn; 0,2 Fe; 0,1 Si; 0,1 Sb; 0,1 P; Cuост 0,0081 0,031 0,699 0,21 0,040 0,050 М 141-1 М 141-6х минуты. После расслоения отделяют органическую фазу от водной, измеряют атомное поглощение Zn на атомно-абсорбционном спектрофотометре при оптимальных условиях. Содержание цинка определяют по градуировочному графику, который строят аналогично по стандартным растворам соли цинка. Полученные данные приведены в табл. 2. Таким образом, исследовано комплексообразование цинка с 2-гидрокси-5-третбутилбензол<1-азо-1′>-2′-метилбензолом и разработана методика экстракционно-атомно-абсорбционного определения цинка в медных сплавах. ЛИТЕРАТУРЫ 1. Живописцев В.П., Селезнева Е.А. Аналитическая химия цинка. — М.: Наука, 1975. — 200 с. 2. Умланд Ф., Янсен А., Тиринг Д., Вьюнш Г. — В кн.: Комплексные соединения в аналитической химии. — М.: Мир, 1975. С. 531. 3. Гусев С.И., Николаева Э.М., Пирожкова З.А. / ЖАХ. 1975. Т. 30. № 2. С. 376. 4. Прайс В. Аналитическая атомно-абсорбционная спектроскопия / Пер. с англ. — М.: Мир, 1976. — 356 с. 5. Симонова В.И. Атомно-абсорбционные определения элементов в породах и минералах. — Новосибирск: Наука, 1980. — 210 с. 6. Касумов В.Т., Меджидов А.А. / Координационная химия. 1990. Т. 16. Вып. 10. С. 1355 – 1359. 7. Лурье Ю.Ю. Справочник по аналитической химии. — М.: Химия, 1971. — 235 с. 8. Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. — М. – Л.: Химия, 1972. — 190 с. 9. Гусев С.И., Николаева Э.М., Пирожкова Э.А. / ЖАХ. 1975. Т. 30. № 2. С. 376 – 378.