Московская химическая олимпиада РЕШЕНИЯ 10 класс 2007/08
advertisement
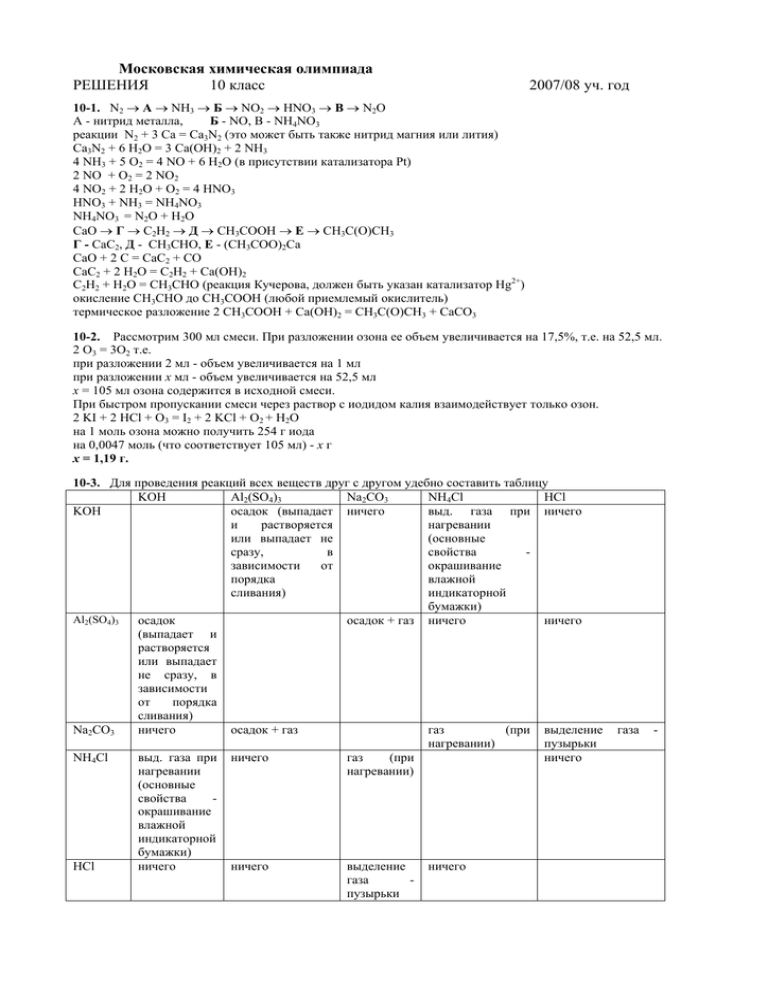
Московская химическая олимпиада РЕШЕНИЯ 10 класс 2007/08 уч. год 10-1. N2 → А → NH3 → Б → NO2 → HNO3 → В → N2O А - нитрид металла, Б - NO, В - NH4NO3 реакции N2 + 3 Ca = Ca3N2 (это может быть также нитрид магния или лития) Сa3N2 + 6 H2O = 3 Ca(OH)2 + 2 NH3 4 NH3 + 5 O2 = 4 NO + 6 H2О (в присутствии катализатора Pt) 2 NO + O2 = 2 NO2 4 NO2 + 2 H2O + O2 = 4 HNO3 HNO3 + NH3 = NH4NO3 NH4NO3 = N2O + H2O CaO → Г → C2H2 → Д → CH3COOH → Е → CH3C(O)CH3 Г - CaC2, Д - CH3CHO, Е - (CH3COO)2Ca CaO + 2 C = CaC2 + CO CaC2 + 2 H2O = C2H2 + Ca(OH)2 C2H2 + H2O = CH3CHO (реакция Кучерова, должен быть указан катализатор Hg2+) окисление CH3CHO до CH3COOH (любой приемлемый окислитель) термическое разложение 2 CH3COOH + Сa(OH)2 = CH3C(O)CH3 + CaCO3 10-2. Рассмотрим 300 мл смеси. При разложении озона ее объем увеличивается на 17,5%, т.е. на 52,5 мл. 2 O3 = 3O2 т.е. при разложении 2 мл - объем увеличивается на 1 мл при разложении x мл - объем увеличивается на 52,5 мл x = 105 мл озона содержится в исходной смеси. При быстром пропускании смеси через раствор с иодидом калия взаимодействует только озон. 2 KI + 2 HCl + O3 = I2 + 2 KCl + O2 + H2O на 1 моль озона можно получить 254 г иода на 0,0047 моль (что соответствует 105 мл) - х г х = 1,19 г. 10-3. Для проведения реакций всех веществ друг с другом удебно составить таблицу KOH Al2(SO4)3 Na2CO3 NH4Cl HCl KOH осадок (выпадает ничего выд. газа при ничего и растворяется нагревании или выпадает не (основные сразу, в свойства зависимости от окрашивание порядка влажной сливания) индикаторной бумажки) Al2(SO4)3 осадок осадок + газ ничего ничего (выпадает и растворяется или выпадает не сразу, в зависимости от порядка сливания) Na2CO3 ничего осадок + газ газ (при выделение нагревании) пузырьки NH4Cl выд. газа при ничего газ (при ничего нагревании нагревании) (основные свойства окрашивание влажной индикаторной бумажки) HCl ничего ничего выделение ничего газа пузырьки газа - Из таблицы видно, что каждое из веществ дает свой уникальный набор реакций, т.е. вещества различаются. Реакции Al2(SO4)3 + KOH = Al(OH)3 + K2SO4, Al(OH)3 + KOH = K[Al(OH)4] KOH + NH4Cl = KCl + NH3 + H2O Al2(SO4)3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 3 Na2SO4 Na2CO3 + 2 HCl = 2 NaCl + CO2 Na2CO3 + 2 NH4Cl = 2 NH3 + CO2 + 2 NaCl + H2O 10-4. 1) Судя по свойствам, углеводород А является ароматическим и не содержит двойных связей (помимо тех, что в бензольном кольце) 2) один моль С6H6 образует 6 CO2 + 3 H2O т.е. 9 моль продуктов, газообразных при 300° один моль А образует таким образом 15 моль (т.к. отношение 5 : 3). Так как углеводород ароматический и не содержит дополнительных двойных связей это соответствует C9H12 (9 CO2 + 6 H2O) 3) Такую суммарную формулу может иметь пропилбензол, метилэтилбензол и триметилбензол. Чтобы выбрать правильный вариант, нужно определить формулу кислоты. Содержание элементов в кислоте соответсвует бензойной C6H5COOH 4) Так как при окислении А получается бензойная кислота, значит А имеет один заместитель в кольце, т.е. это н-пропилбензол или изопропилбензол. 10-5. Предположим, что углеводород В - бензол (что соответствует его молярной массе). Вещество С - метанол Вещество А — метилбензоат при нагревании: C6H5COOCH3 + NaOH = C6H5COONa + CH3OH (гидролиз сложного эфира) при прокаливании C6H5COONa + NaOH = C6H6 + Na2CO3 Na2CO3 + 2HCl = 2NaCl + CO2 + H2O Количество СO2 — 0,1 моль, значит должно быть по 0,1 моль метанола и бензола, что составляет 7,8 + 3,2 = 11 г, это соответствует условию 10-6. 1) Соль представляет собой сульфат, так как с нитратом бария образует осадок, не растворимый в кислотах 2) При действии щелочи получен гидроксид, который затем окисляется, а при прокаливании образуется оксид. Если оксид M2On содержит 30% кислорода, то молекулярная масса металла: при n = 1 составляет 18,67 (такого нет), при n = 2 — 37,3 (такого тоже нет) и при n = 3 — 56. Такой есть, это железо. 3) 0,4 г Fe2O3 соответствуют 0,0025 моль. Тогда исходного сульфата железа(II) было взято 0,005 моль, т.е. 0,76 г. Однако по условию задачи его взято 2,78 : 2 = 1,39 г. Остается предположить, что был взят кристаллогидрат 4) Определим состав кристаллогидрата 1,39 - 0,76 = 0,63. Так как вещества 0,005 моль, то 1 моль содержит 126 г воды, что соответствует 7 молям воды. Формула кристаллогидрата — FeSO4 7 H2O 5) Реакции FeSO4 + Ba(NO3)2 = BaSO4 + Fe(NO3)2 FeSO4 + 2 NaOH = Fe(OH)2 + Na2SO4 Fe(OH)2 + O2 + H2O = Fe(OH)3 Fe(OH)3 = Fe2O3 + H2O 10 FeSO4 + 2 KMnO4 + 8 H2SO4 = 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8 H2O 6) 50 см3 указанного раствора KMnO4 содержат 0,02 х 0,05 = 0,001 моль пермангагата. По уравнению реакции он взаимодействует с 0,005 моль FeSO4, что соответсвует расчету для первой порции соли.




