КИСЛОТЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА.
advertisement
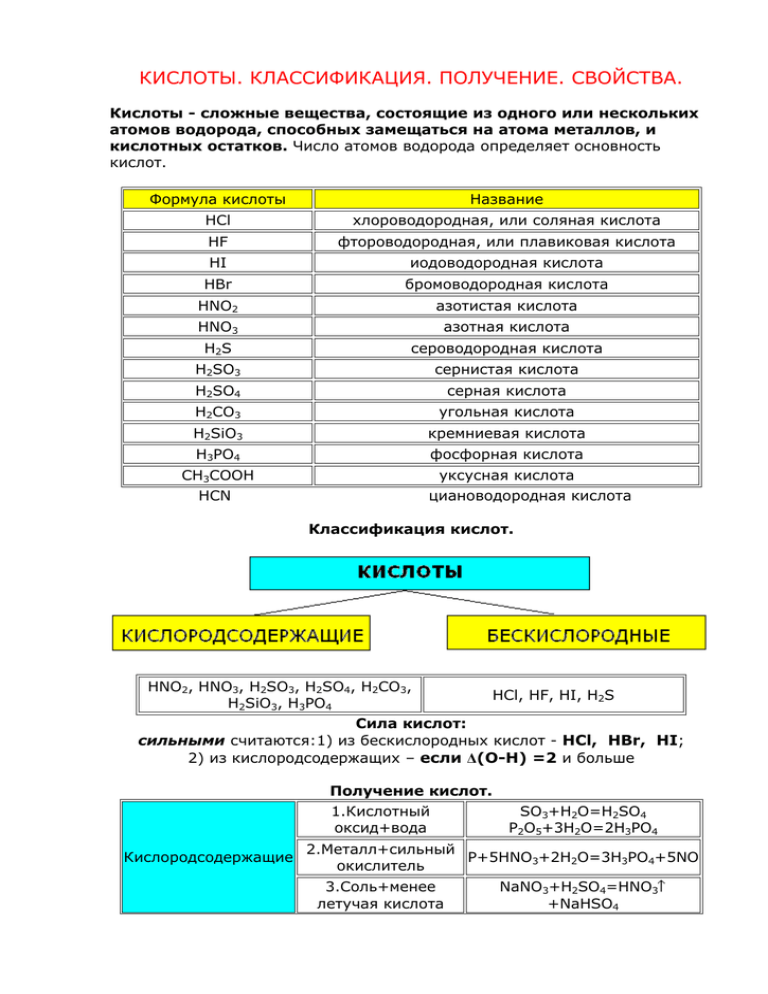
КИСЛОТЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА. Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Число атомов водорода определяет основность кислот. Формула кислоты Название HCl хлороводородная, или соляная кислота HF фтороводородная, или плавиковая кислота HI иодоводородная кислота HBr бромоводородная кислота HNO2 азотистая кислота HNO3 азотная кислота H2S сероводородная кислота H2SO3 сернистая кислота H2SO4 серная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота H3PO4 фосфорная кислота CH3COOH HCN уксусная кислота циановодородная кислота Классификация кислот. HNO2, HNO3, H2SO3, H2SO4, H2CO3, HCl, HF, HI, H2S H2SiO3, H3PO4 Сила кислот: сильными считаются:1) из бескислородных кислот - HCl, HBr, HI; 2) из кислородсодержащих – если Δ(О-Н) =2 и больше Получение кислот. 1.Кислотный оксид+вода Кислородсодержащие SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 2.Металл+сильный P+5HNO3+2H2O=3H3PO4+5NO окислитель 3.Cоль+менее летучая кислота NaNO3+H2SO4=HNO3 +NaHSO4 Бескислородные 1.Водород+неметалл H2+Cl2=2HCl 2.Cоль+менее летучая кислота NaCl+H2SO4=2HCl +NaHSO4 Химические свойства. Кислородсодержащие Бескислородные 1.Изменяют окраску индикаторов лакмус-красный, метилоранж-красный (только для растворимых кислот) 2.Взаимодействие с металлами, стоящими до водорода H2SO4+Ca=CaSO4+H2 2HCl+Ca=CaCl2+H2 2.Взаимодействие с основными оксидами H2SO4+CaO=CaSO4+H2O 2HCl+CaO=CaCl2+H2O 3.Взаимодействие с основаниями H2SO4+Ca(OH)2=CaSO4+2H2O 2HCl+Ca(OH)2=CaCl2+2H2O 4.Взаимодействие с амфотерными оксидами H2SO4+ZnO=ZnSO4+H2O 2HCl+ZnO=ZnCl2+H2O 5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество H2SO4+BaCl2=BaSO4+2HCl 2HCl+Na2CO3=2NaCl+H2O+CO2 6.При нагревании Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 H2S=H2+S Номенклатура кислот: приставка корень суффикс окончание ди(би, дву…) н (ев, ов) (н) ист (н) оват новатист ая в названии кислот, полученных сложением кислоты и её же оксида , например: Н2CrO4 + CrO3 = H2Cr2O7 по русскому названию центрального атома в высшей кислоте, если ст. ок.(Э) =№ группы в низшей кислоте, если ст. ок.(Э) =№ группы-2 в низшей кислоте, если ст. ок.(Э) =№ группы-4 в низшей кислоте, если ст. ок.(Э) =№ группы-6 +слово «кислота»