69 Глава III РАСТВОРЫ Логическая схема главы.
advertisement
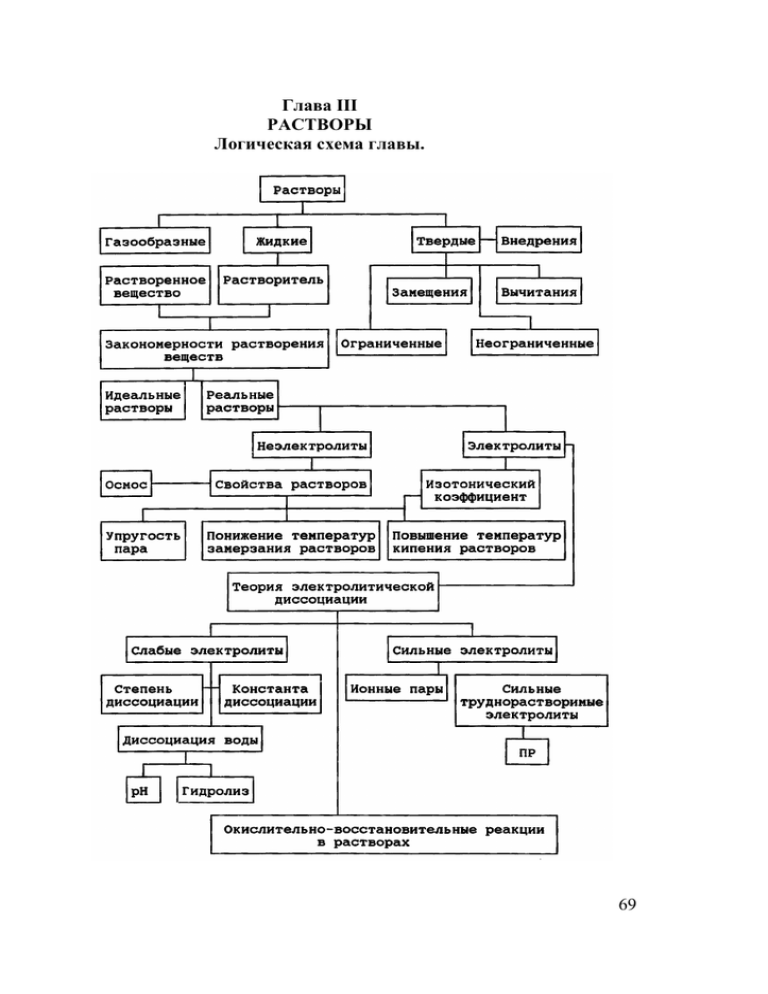
Глава III РАСТВОРЫ Логическая схема главы. 69 Большая часть химических реакций осуществима лишь при растворении веществ в каком-либо растворителе. Процессы в растворах имеют ряд преимуществ: их протекание достаточно легко регулируется, замена одного растворителя другим позволяет получить материалы с новыми свойствами, жидкие растворы легко транспортировать, растворитель можно очистить и возвратить в производство, реакции в растворах чаще всего идут с большой скоростью. Раствором называется многокомпонентная однофазная система переменного состава. Различают растворы газообразные, жидкие и твердые. Газообразные растворы возникают в случае слабого взаимодействия молекул газов. Для таких систем характерно хаотическое движение молекул и отсутствие определенной структуры. Поэтому при обычных давлениях газовый раствор представляет собой физическую смесь, в которой каждый компонент проявляет свои индивидуальные свойства. Пример: Воздух содержит: 78% N2, 21% O2, 1% CO2, пары воды, инертные газы. Общее давление, оказываемое газовой смесью, представляет собой сумму давлений составляющих его газовых частей, которые называются парциальными. Пример: Атмосферное давление при нормальных условиях равно 760 мм. рт. ст. (1 атм.). На долю азота (78% по объему) приходится 760.78/100 = 540 мм. рт. ст.(парциальное давление азота), парциальное давление кислорода – 760.21/100 =159,6 мм. рт. ст. При высоких давлениях, особенно когда плотность газа становится сравнима с плотностью жидкости, образование газовых растворов сопровождается изменением объема и тепловым эффектом. В сжатых газах растворение веществ достигает значительных величин. Твердые растворы – это растворы, образуемые веществами в твердом состоянии. Они играют большую роль в технике. Твердые растворы бывают различных типов: твердые растворы внедрения, замещения и вычитания. Кроме того, различают непрерывные твердые растворы (компоненты растворяются друг в друге во всём интервале концентрации) и ограниченные твердые растворы (компоненты растворяются в узком интервале концентраций). Наиболее распространены растворы различных веществ в жидкостях. Раствор состоит из растворителя и растворенного вещества. Компонент, агрегатное состояние которого не изменяется при образовании раствора, принято считать растворителем (например, вода). 70 В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твердого вещества с твердым, под растворителем понимают компонент, содержание которого в растворе преобладает. Растворы можно различать по типу растворителя, например, растворы в протонных и апротонных растворителях. Растворитель является протонным, если его молекулы способны отщеплять ион Н+ (H2O, HCN). В общем случае такие вещества называют протогенными (рождающими протон). Протогенные вещества вступают в реакции с любыми веществами, присоединяющими протон и называемыми протофильными (любящими протон). Протонные растворители, как правило, являются сильно ассоциированными жидкостями за счет водородных связей между молекулами. К апротонным (не образующим ион Н+) растворителям относятся бензол, ацетон, хлороформ, диоксан и др. Наиболее сильно на свойствах растворов отражается такая характеристика, как диэлектрическая проницаемость. В средах растворителя с высокой диэлектрической проницаемостью идет электростатическая работа по разделению противоположно заряженных ионов растворяемого вещества. Поэтому растворители, состоящие из полярных молекул (HCl, NH3, H2O и др.) и характеризующиеся высокой диэлектрической проницаемостью, способствуют гетеролитическому разрыву связи между атомами растворенного вещества. Гетеролитический разрыв связи – это такой разрыв, при котором электронная пара полностью переходит к одному из атомов – более электроотрицательному, и образуются ионы: А : В ↔ А+ + :В–. В растворах с низкой диэлектрической проницаемостью в основном протекают реакции с гомолитическим разрывом связи. В этом случае электроны отталкиваются по одному к каждому из атомов и образуются свободные радикалы: А : В ↔ А. + В.. В качестве чисто ионных растворителей можно использовать такие высокотемпературные системы, как расплавы солей. По исходному фазовому состоянию растворяемого вещества –газообразного, жидкого или твердого – жидкие растворы делят на три группы: а) жидкость + газ; 71 б) жидкость + жидкость; в) жидкость + твердое вещество. Это самая большая группа растворов. Сюда относятся растворы большинства солей, щелочей и т.д. Все растворы относятся к дисперсным (раздробленным) системам. Раствор может оставаться гомогенной системой, если частицы растворенного вещества не существуют в виде достаточно крупных ассоциатов, отделенных от растворителя поверхностью раздела, т.е. не образуют отдельной фазы. Считается, что раствор остается истинным, если размер частиц растворенного вещества не превышает 10 оА. Если в растворе присутствуют частицы от 10 до 1000 оА, то такие растворы грубодисперсны и неустойчивы. К ним относятся пены (газ в жидкости), эмульсии (жидкость в жидкости), суспензии (твердое вещество в жидкости). Современные представления о растворах Раствор – однородная, внутри себя взаимодействующая равновесная система переменного состава. Образование раствора сопровождается как физическими, так и химическими явлениями. Простейшим физическим взаимодействием является механическое диспергирование частиц растворенного вещества среди молекул растворителя. К физическим взаимодействиям более сложного типа относятся все взаимодействия за счет сил электрической природы. Это взаимодействие между ионами и диполями молекул (ион-дипольное взаимодействие), между диполем одной молекулы и диполем другой (диполь-дипольное взаимодействие), взаимодействие между ионами и т.п. Физические силы действуют на дальних расстояниях и предшествуют силам химической природы. Химические силы действуют на близких расстояниях (порядка диаметра молекулы). Образование химической связи сопровождается деформацией электронных облаков атомов взаимодействующих частиц. Процесс образования продуктов взаимодействия между молекулами растворителя и растворенного вещества за счет физических сил называется физической гидратацией (для неводных растворов – сольватацией), процесс образования продуктов за счет химических сил – химической гидратацией (сольватацией). Примером химической сольватации является образованиe гидратов CuSO4.5H2O, сольватов SO2.BCl3 (в жидком SO2), ионов типа [CoOH(H2O)5]2+, H3O+ (в растворителе H2O). К продуктам физической 72 сольватации следует отнести гидратированные ионы, такие как Cs+.8H2O, Cl-.8H2O, ассоциаты серы S8 в сероуглероде и т.п. Растворы – сложные взаимодействующие системы. В подтверждение этому укажем важнейшие взаимодействия в насыщенном водном растворе сульфида кадмия: nH2O ) (H2О)n 2H2O ) H3O+ + OH CdS ) S2– + Cd2+ Cd2+ + H2O ) CdOH+ + H+ (процесс ассоциации); (процесс самоионизации растворителя); (процесс ионизации растворенного вещества); (гидролиз) и др. Чем больше компонентов в растворе и чем он концентрированнее, тем сложнее и разнообразнее протекающие в нем процессы. Между всеми равновесиями в растворе происходит обмен веществом. Рассмотрение какого-либо одного взаимодействия без учета других нельзя считать вполне оправданным. Растворы многолики. Они образуются не только между компонентами, находящимися в том же агрегатном состоянии: газами (г), твердыми веществами (т), но и между компонентами разных агрегатных состояний: г – ж, т – ж и др. Образование растворов – термодинамически выгодный процесс. Предельно чистые вещества в природе практически не реализуются. Об этом, в частности, свидетельствуют трудности, связанные с очисткой веществ. Движущей силой образования раствора является стремление исходной системы понизить за счет взаимодействия свою свободную энергию ∆GP,T (индекс означает: при постоянных температуре и давлении): ∆Gр-ра = Σ(∆GP,T)прод – Σ(∆GP,T)исх < 0. На рисунке 3.1 дано геометрическое изображение понижения свободной энергии исходных компонентов в процессе образования раствора. На абсциссе изображен состав исходной смеси. Точки А и Б отрезка символизируют чистые вещества. Все точки между А и Б представляют собой смеси исходных веществ. Точка Q, например, означает, что 100%-я смесь составлена из 45% Б и 55% А: чем ближе к концу А отрезка АБ, тем больше в смеси содержится компонента А, и наоборот. 73 Рис. 3.1. Геометрическое изображение понижения свободной энергии компонентов в процессе образования растворов Известно, что все вещества характеризуются запасом внутренней энергии ∆UT,V (энтальпией ∆НT,P) и степенью беспорядка –энтропией S. Чем больше беспорядка в системе, тем больше энтропия. Изменение изобарно-изотермического потенциала при образовании раствора связано с изменением энтальпии и энтропии вещества и описывается уравнением ∆G = ∆H – T∆S. Изменение энтальпии количественно оценивается тепловым эффектом процесса ∆H = –QP,T. Если процесс растворения сопровождается поглощением тепла, то это означает, что Σ∆Hпрод – Σ∆Hисх > 0, и наоборот, если процесс растворения идет с выделением тепла, то Σ∆Hпрод – Σ∆Hисх < 0. 74 Как правило, процесс растворения сопровождается выделением тепла (∆H < 0), и только около 8% веществ растворяются с поглощением тепла. Их, в частности, используют для приготовления охлаждающих смесей (табл. 3.1). Таблица 3.1 Охлаждающие смеси Смесь соль и вода Соль CH3COONa.H2O NH4Cl NaNO3 Na2S2.5H2O Весов. часть Т,°С CaCl2.6H2O 250 -12.4 -5.1 NH4NO3 60 -13.6 75 -5.3 KCNS 150 -23.7 110 -8.0 Весов. часть Т,°С 85 -4.7 30 Соль Смесь соль и снег Весов. часть Т,°С Соль Весов. часть Т,°С CaCl2.6H2O 41 -9.0 NaNO3 59 -18.5 CaCl2 30 -11.0 (NH4)2SO4 62 -19 NH4Cl 25 -15.8 33 -21 NH4NO3 60 -17.3 125 -40.3 Соль NaCl CaCl2.6H2O Примечание: Весовая часть – число весовых частей соли на100 весовых частей воды или снега; Т – максимально низкая температура, которую можно получить для данной смеси. С термодинамической точки зрения вещество может растворяться в жидкости самопроизвольно при P = const и T = const, если в результате этого процесса свободная энергия системы уменьшается: ∆G = ∆H – T∆S < 0. Если вещество переходит из упорядоченного жидкого, а тем более твердого состояния в раствор, в котором термодинамическая вероятность состояния его частиц становится значительно больше, то энтропия 75 системы увеличивается, т.е. ∆S > 0. Это способствует процессу растворения, и вклад энтропийного фактора особенно ощутим при высоких температурах. Поэтому растворимость твердых и жидких веществ при нагревании, как правило, увеличивается. При переходе из газообразного состояния в растворенное вероятность состояния его молекул из-за сольватации или просто помех, оказываемых растворителем, уменьшается, и ∆S < 0. Влияние энтропийного фактора на ∆G является минимальным при низких температурах, поэтому растворимость газов увеличивается при охлаждении. В процессе растворения энтальпия системы также может увеличиваться или уменьшаться. Если пренебречь изменением объема раствора, происходящим при растворении, то ∆H ≡ ∆U, т.е. ∆H будет зависеть в основном от изменения внутренней энергии системы. Тогда ∆Hраств. будет представлять собой разность энергий: энергии, затрачиваемой на разрушение исходной структуры вещества, и энергии, выделяющейся в результате сольватации растворенного вещества. ∆Hраств. = Еструкт. – Есольв. или ∆Hраств. = ∆Hструкт. + ∆Hсольв., так как ∆Hструкт. = Еструкт., а ∆Hсольв. = –Есольв. При растворении газов ∆Hструкт.= 0 и ∆Hраств.= ∆Hсольв., т.е. ∆Hраств.<0, поэтому растворение газов всегда является экзотермическим процессом. Чем больше энергия связи между частицами в веществе, тем выше Ест. Для молекулярных кристаллов и жидкостей ван-дер-ваальсовы силы рукт. взаимодействия и даже водородные связи недостаточно прочны. Поэтому Еструкт. остается меньше Есольв., и растворение таких веществ как сахар, спирт, глицерин является также экзотермическим процессом (∆Hраств. < 0). Если при растворении молекулярных веществ не происходит заметной сольватации их молекул (Есольв. → 0), а сами молекулы неполярны (Еструкт.→ 0), то растворение практически не сопровождается тепловым эффектом (например, растворение I2 в CCl4). В этом случае на растворение оказывает влияние энтропийный фактор. ∆Hраств. = 0 и Еструкт.= Есольв. 76 При растворении ионных кристаллов и других веществ, в которых под действием растворителя происходит разрыв химических связей, величина Еструкт. настолько велика, что не всегда компенсируется энергией взаимодействия растворителя с ионами. В этом случае Еструкт.> Есольв. и ∆Hраств.> 0, и процесс растворения является эндотермическим. При более точных расчетах необходимо учитывать изменение энтальпии в процессах растворения, а также затраты энергии на разрушение структуры растворителя молекулами растворенного вещества. Пример: Рассчитайте тепловой эффект растворения хлорида натрия в воде. Укажите, какое влияние на растворение данной соли оказывает повышение температуры. Екрист.NaCl = 764 кДж/моль; Есольв.Na+ = –410 кДж/моль; Есольв.Cl- = –350 кДж/моль; Егидр.(Na+ + Cl-) = –760 кДж/моль; ∆Hраств. = 764 – 760 = 4 кДж/моль > 0. Процесс растворения хлорида натрия является эндотермическим, а следовательно, повышение температуры приведёт к увеличению растворимости. С термодинамической точки зрения растворение вещества рассматривается как обратимый процесс: Растворение ) выделение вещества. Особенно хорошо это наблюдается для твердых веществ. Для твердых веществ обратимым процессом является кристаллизация вещества из раствора. По мере растворения вещества его концентрация в растворе увеличивается, и его частицы АВ(раствор) чаще сталкиваются с поверхностью осадка АВ(тв). Это приводит к кристаллизации вещества из раствора, скорость которой возрастает. Если скорость при кристаллизации вещества станет равной скорости растворения, вещество прекратит растворяться. Если Vраст. – скорость растворения вещества; Vкрист.– скорость кристаллизации, то конец растворения наблюдается при Vраст.= Vкрист.. 77 Так как концентрация твердой фазы, из которой частица АВ поступает в раствор, не меняется, то, не учитывая взаимодействия с ней растворителя, можно записать Vраст.= Краст. Vкрист.= Ккрист.⋅ САВ. Откуда САВ = Краст./Ккрист., т.е. при выравнивании скоростей растворения и кристаллизации концентрация раствора над осадком остается величиной постоянной. При данных условиях такой раствор называется насыщенным, и, при сохранении условий неизменными, его концентрацию невозможно изменить. Если растворимость вещества при повышении температуры увеличивается (Краст. > Ккрист.), то равновесие сдвигается в сторону растворения, и концентрация насыщенного раствора повышается. При охлаждении раствора идет обратный процесс, т.е. растворимость уменьшается, и концентрация раствора тоже уменьшается. Таким образом, насыщенный раствор – это такой раствор, в котором твердая фаза находится в равновесии с растворённым веществом. Известны некоторые вещества (CH3COONa, Na2S2O3, Na2SO4.10H2O и другие), которые образуют насыщенные растворы, сохраняющие свою избыточную концентрацию при осторожном охлаждении в отсутствии осадка. Такие растворы называются пересыщенными. Явление образования пересыщенных растворов было открыто в XVIII в. Т. Ловицем. Пересыщенные растворы являются метастабильными (неустойчивыми) системами и легко разрушаются при попадании затравки (пыли, кристаллика вещества и т.п.). Растворители Важнейшим растворителем является вода. Около 60% всего живого и неживого на нашей планете состоит из воды. В химической практике широко используются спирты, эфиры, ацетон, уксусная, муравьиная, серная и другие кислоты, четыреххлористый углерод, сероуглерод, жидкий диоксид серы, пиридин. В настоящее время находят важное применение в качестве растворителей плавиковая кислота, галогениды (окси- 78 галогениды) фосфора и мышьяка, синильная кислота, жидкий сероводород, гидразин. Растворяющая способность растворителя определяется, главным образом, его диэлектрической проницаемостью ξ и способностью сольватировать растворенное вещество – образовывать с молекулами растворенного вещества связи физической и химической природы. Чем выше сольватирующая активность растворителя, тем лучше растворимость. Вода обладает хорошей растворяющей способностью именно потому, что она характеризуется большой величиной ξ (81), легко образует с растворенным веществом водородные и донорноакцепторные связи. Диэлектрическая проницаемость ξ показывает, во сколько раз уменьшается сила взаимодействия электрических зарядов (ионов или диполей) при переносе их из вакуума в данный растворитель. Она играет существенную роль в процессе растворения, ионизации и ассоциации. В разбавленных растворах структура растворителя определяет структуру раствора. Некоторые растворители диссоциируют на ионы (подвергаются самоионизации): 2CH3COOH ↔ СΗ3COOH2+ + CH3COO-; 2NH3 ↔ NH4+ + NH2-; 2H2O ↔ H3O+ + OH-. Количественной характеристикой самоионизации растворителей является константа автопротолиза Кs. В случае воды эта величина называется ионным произведением воды Кw. Среди других важных свойств следует указать на структурированность растворителя. Структурированность зависит от способности однородных молекул растворителя взаимодействовать между собой с образованием в ультрамикрообъемах структур, свойственных твердому телу (ближний порядок). Чем выше структурированность, тем менее компактен растворитель. Ниже приведен ряд возрастания компактности (убывание структурированности) растворителей: H2O > CH3OH > C2H5OH > C6H5Cl ≥ (CH3)2CO > CCl4 > C6H6. Активность. Коэффициент активности 79 В реальных растворах наблюдаемая на опыте (кажущаяся) концентрация компонентов, как правило, меньше аналитической. Для количественного описания свойств растворов реальных концентраций Дж. Льюисом (1907) был разработан метод активности. В основе метода лежит понятие активности компонентов раствора. Активностью растворителя называют условную мольную долю, при подстановке которой в уравнение Рауля вместо концентрации можно получить давление пара растворителя, наблюдаемого на опыте, а отклонение этой величины от концентрации – коэффициент активности растворителя. Так, для растворителя А PA = PA • αA; γA = αA/CA, где α – активность растворителя; γ – коэффициент активности; CA – моль/л. Для растворенного вещества Б PБ = PБ . αБ; γБ = αБ/CБ. Активность компонента А не имеет физического смысла. Она рассчитывается из произведения концентрации компонента на его коэффициент. Коэффициенты активности компонентов выражаются в следующих единицах: α = γm – в единицах моляльности; α = γ’m – в мольных долях; α = fC – в единицах молярности. Мы будем использовать коэффициент в единицах молярности. Для разбавленных растворов этими различиями можно пренебречь. В дальнейшем для простоты мы обозначаем коэффициенты активности компонентов символом γ. Коэффициенты активности находятся экспериментально (из криоскопии, метода электродвижущих сил, электропроводности и т.п.). Они учитывают суммарный вклад всех сопутствующих, не фиксируемых в опыте, процессов, как бы снижающих аналитическую концентрацию компонентов в растворе. В качестве примера использования метода активности Льюиса для количественного описания давления пара растворителя по закону Рауля и давления растворенного вещества по закону Генри приведены в таблицах 3.2. и 3.3, давления насыщенного пара сахара и пара ацетона в сероуглероде. Таблица 3.2 Давление насыщенного пара сахара 80 NA (мольн. доля А) 0,9969 0,9919 0,9830 αА 0,9968 0,9910 0,9802 РА= РА0 ⋅ αА 4,584 4,563 4,521 РА (раствора) = РА 0 ⋅ NА 4,586 4,558 4,510 Таблица 3.3 Давление пара ацетона NБ (мольн. доля Б) 0,900 0,800 0,700 αБ 0,126 0,166 0,110 РБ= КБ0 ⋅ αБ 315 290 275 РБ (раствора) = КБ ⋅ NБ 225 200 176 С целью сопоставления активности компонентов растворов различной концентрации выбирают стандартное состояние – уровень отсчета. В растворах неэлектролитов стандартным считают состояние с активностью компонентов, равной 1. αA = 1, если РAст = РAo (т.к. РAст = РAoαA = РAo.1). Для растворенного вещества Б αБ = 1, если РБст = КБ (т.к. РБст = КБαБ = КБ.1). Таким образом, за стандартное состояние растворителя принимается состояние чистой жидкости, а за стандартное состояние растворенного вещества – состояние, в котором его давление пара равно константе Генри. Особенности растворимости вещества 1. Растворимость газов в воде В 1 литре воды при давлении 1 атм (1013 ГПа) растворяется: O2 - 0.049 л; CO2 - 1.713 л; Cl2 -4.61 л; 81 NH3 - 1305 л. Как известно, процесс растворения газов – процесс экзотермический, и поэтому с повышением температуры растворимость газов в воде понижается. При растворении газа в воде выполняется закон Генри: Масса газа, растворенного при данных условиях в данном объеме раствора, прямо пропорциональна его парциальному давлению С = К . Р, где К – коэффициент пропорциональности, зависящий от вида газа, растворителя и температуры. С увеличением Р увеличивается и С. Отсюда следует, что объем растворенного газа не зависит от давления. Растворимость газа чаще всего выражается числом объемов растворенного газа на объем растворителя. Пример: Рассмотрим растворение воздуха в воде (21% O2 и 78% N2). Растворимость O2 (при 0 оС и Р = 1 атм) в 1 л воды равна 49 мл. Растворимость N2 (при 0 оС и Р = 1 атм) в 1 л воды равна 23,5 мл. Смесь их (воздух) при 0 оС имеет давление 1 атм, но на долю O2 приходится только 0.2 атм, а на долю N2 – 0.8 атм. Это парциальные давления азота и кислорода. Отсюда, в воде растворяется: 49 ⋅. 0.2 = 9.8 мл O2; 23.5 ⋅. 0.8 = 18.8 мл N2. 2. Растворимость жидкостей При растворении жидкостей друг в друге наблюдают три случая: а) жидкости, смешиваемые в неограниченных количествах (спирт – спирт, спирт – вода); б) полностью нерастворимые друг в друге жидкости (бензин –вода); в) ограниченно растворимые жидкости (эфир – вода, фенол – вода). При увеличении температуры в последнем случае растворимость возрастает. Температура, при которой ограниченно растворимые жидкости полностью растворяются, называется критической (рис. 3.2). Ниже Ткр, в зависимости от состава, растворимость изменяется. 82 Рис 3.2. Изменение растворимости ограниченнорастворимых жидкостей с температурой 3. Растворимость твердых веществ По растворимости твердые вещества делятся на хорошо растворимые, если растворимость больше 10 г на 100 г растворителя, малорастворимые, если растворимость меньше 10 г и больше 1 г на 100 г растворителя, и практически нерастворимые, если в 100 г растворителя растворяется меньше 1 г вещества. Растворимость выражается количеством граммов вещества на 100 г растворителя. Часто растворимость выражают с помощью массовой концентрации или молярной концентрации. С изменением температуры растворимость твердых веществ изменяется в зависимости от соотношения ∆Hраств. и ∆Hсольв.. Способы выражения концентрации растворов Существуют различные способы выражения концентраций раствора. Такие способы выражения концентраций растворов как насыщенный, пересыщенный и ненасыщенный являются приближёнными и достаточно грубыми. К более точным способам выражения концентраций относятся: 83 а) массовая доля выражается отношением массы данного компонента в растворе к общей массе раствора. Обычно массовая доля выражается в долях единицы или в процентах; б) наиболее часто используемые способы выражения концентраций растворов в химии – это молярная концентрация и нормальная концентрация. Молярной концентрацией называют отношение количества вещества в системе к объёму этой системы: n(X) = n(X)/V = m/VM(X), где n(X) – число молей вещества X; m – масса вещества Х; М – молекулярная масса вещества Х; V – объём системы. Молярную концентрацию выражают в моль/л или в моль/дм3. Нормальной концентрацией или молярной концентрацией эквивалента называют отношение количества вещества эквивалента в системе (растворе) к объёму этой системы. Нормальную концентрацию обычно выражают в моль/л или моль/дм3; в) молярная и нормальная концентрации зависят от температуры раствора, так как при изменении температуры изменяется и объём раствора. Поэтому при применении раствора в неизотермических условиях целесообразнее использовать для обозначения его концентрации моляльность. Моляльностью называют отношение количества вещества (в молях) к массе растворителя: a(X) = n(X)/m(Y). Измеряют моляльность в моль/кг; г) oчень часто в аналитической химии используют такой способ выражения концентраций раствора как титр: определяется числом граммов растворённого вещества в 1 мл раствора. Титрованные, или стандартные растворы – это растворы с точно известным содержанием вещества. Без таких растворов просто невозможно представить проведение химического анализа; д) молярная доля – это отношение количества компонента, содержащегося в данной системе ( в молях), к общему количеству веществ в системе ( в молях). Выражают в долях единицы или процентах. 84 mA mA MA MA + mB = мольная доля. MB Первые научные теории о растворах Жидкие растворы имеют молекулярную раздробленность частиц. Основными признаками раствора являются однородность и переменность состава. Из-за однородности растворы долго причисляли к химическим соединениям, и только после знаменитого спора К.Л. Бертолле и Ж.Л. Пруста (1808), в котором одержал победу Пруст, понятия раствора как сложного объекта и химического соединения как индивида, были разделены. Во времена Д.И. Менделеева господствовало мнение, согласно которому считалось, что процесс образования раствора – чисто физический процесс. При образовании раствора молекулы растворенного вещества распределяются среди молекул растворителя путем механического диспергирования за счет сил диффузии. Наблюдаемый на практике химизм в растворах относили к аномальным явлениям. Представители школы физиков ставили своей целью количественно описать свойства разбавленных растворов и в этом отношении добивались значительных успехов. Были открыты законы Вант-Гоффа, Рауля, Генри, закон разбавления Оствальда. Творцом физической теории растворов был Я.Г. Вант-Гофф. Среди его знаменитых последователей можно назвать С.А. Аррениуса, предложившего теорию электролитической диссоциации. На иных позициях стояли представители школы химиков во главе с Д.И. Менделеевым, работы которых долгое время не признавались. Менделеев исходил из того, что процесс образования раствора невозможен без взаимодействия растворителя и растворенного вещества. Химики ставили своей целью изучить природу явлений при образовании раствора. Для формирования и утверждения химического направления очень важное значение имели работы Д.И. Менделеева, И.А. Каблукова, Н.С. Курнакова. Д.И. Менделеев создал гидратную (химическую) теорию растворов, И.А. Каблуков много работал в области химии неводных растворов и, будучи приверженцем гидратной теории, первым ввел понятие ионной 85 гидратации (сольватации); Н.С. Курнаков разработал метод исследования сложных систем – физико-химический анализ (ФХА). По мере накопления экспериментальных фактов, особенно в области химии неводных растворов, химическая теория растворов Д.И. Менделеева прокладывала путь к признанию. В начале ХХ в. физическая и химическая теории слились в единую физико-химическую теорию растворов. Свойства растворов Законы Рауля, Генри, Вант-Гоффа Важнейшими свойствами растворов являются: давление пара Р, осмотическое давление Росм, температура замерзания и температура кипения растворов. В основе количественного описания свойств реальных растворов лежат закономерности, полученные для идеальных растворов. Идеальным называется раствор, в котором энергия взаимодействия между молекулами растворенного вещества и молекулами растворителя одинакова. В среде идеального раствора молекулы растворенного вещества распространяются подобно идеальному газу. Идеальный раствор образуется без теплового эффекта (∆Н = 0) и без изменения объема (∆V = 0) смешиваемых компонентов. Движущей силой образования такого раствора является возрастание энтропии (∆S > 0). Парциальное давление пара любого летучего компонента идеального раствора прямо пропорционально его мольной доле Pi = Pio ⋅ Ni, (1) где Pio – давление насыщенного чистого компонента; Ni – мольная доля i-го компонента; Pi – парциальное давление пара i-го компонента. Соотношение (1) не зависит ни от природы растворителя, ни от природы и концентрации других компонентов. Оно зависит только от его собственной концентрации в растворе. Если раствор состоит из летучих компонентов А и Б, то PA = PAо ⋅. NA, PБ = PБо ⋅ NБ. (1') Общее давление идеального раствора равно сумме парциальных давлений (закон Дальтона): P = PA + PБ = PAо.NA + PБ NБ. 86 (2) В соответствии с уравнением (2) NA = nA/(nA + nБ); NБ = -nБ/(nA + nБ) заменим NБ на (1 – NA), тогда P = PAо.NA + (1-NA).NБ = =PAо.NA + PБо -PБо.NA = PБо + (PAо -PБо).NA. (2') Графическое изображение закономерностей (1) и (1') для идеального раствора из летучих компонентов А и Б дано на рисунке 3.3. Рис. 3.3. Графическое представление закона Рауля На длине отрезка АБ, условно принимаемого за единицу (или за 100%), откладывается от его левого конца мольная доля (или содержание в процентах) компонента Б и NБ. В любой точке длины отрезка содержание компонента А будет определяться из соотношения NA = 1 – NБ. Концы отрезка символизируют содержание чистых компонентов: в точке А мольная доля компонентов А, NA = 1, в точке Б мольная доля компонента Б, NБ = 1. Соответственно перпендикуляры к точкам А и Б представляют собой давление пара чистых компонентов (PAо и PБо). Левая (тонкая) линия (рис. 3.3) иллюстрирует изменение парциального давления компонента А в зависимости от его мольной доли в растворе, правая (тонкая) линия – изменение парциального давления компонента Б в зависимости от его содержания в растворе. Прямая Робщ 87 иллюстрирует изменение общего давления Р, равного сумме парциальных давлений компонентов А и Б, в зависимости от состава раствора. К ординате PAо примыкают растворы, богатые компонентом А и бедные компонентом Б. К ординате PБо, наоборот, примыкают растворы, богатые компонентом Б и бедные компонентом А. Реальные растворы В природе не существуют идеальные растворы, за исключением растворов изотопов, оптических изомеров; близка к идеальному раствору смесь бензол – толуол. Свойства реальных растворов отклоняются от идеальных. На рисунке 3.4 приведены кривые зависимости давления пара от состава раствора, отражающие поведение реальных растворов с положительным (3.4а) и отрицательным (3.4 б) отклонениями от идеальности. Положительное отклонение от идеальности имеет место тогда, когда энергия между одноименными молекулами (А-А, Б-Б, В-В) больше, чем между молекулами (А-Б, А-В...). а) б) Рис 3.4. Кривые давления насыщенного пара компонентов в растворах: а) с положительным отклонением от идеального; б) с отрицательным отклонением от идеального; n – линия Рауля Каждая молекула старается окружить себя подобными молекулами и вытолкнуть из сферы своего влияния чужеродные молекулы, повышая тем самым давление раствора. Растворы с положительным отклонением образуются с трудом, энтальпия образования такого раствора больше нуля. Растворы с отрицательным отклонением от идеальности образуются в тех случаях, когда энергия взаимодействия разнородных молекул 88 больше, чем однородных, их смешение сопровождается выделением тепла (∆H < 0). Ф. Раулем (1887) и У. Генри (1803) было установлено, что если реальный раствор разбавлен (мольная доля растворенного вещества ниже 0.01), то концентрационная зависимость давления пара растворителя и растворенного вещества подчиняются количественным соотношениям идеальных растворов. Закон Рауля гласит: Относительное понижение давления пара растворителя над раствором равно мольной доле нелетучего растворенного вещества. (РAо - РA)/РAо = NБ или ∆Р/РAо = NБ, (3) где РAо – давление пара чистого растворителя; РA – давление пара растворителя над раствором (давление раствора). Соотношение Рауля принимает вид соотношения идеальности, если его левую и правую части вычесть из единицы: 1 -((РAо - РA)/РAо) = 1 -NБ. После простого преобразования получим РA = РAо.NA, где NA ∀ 0.99 (NБ ∀ 0.01). На рисунке 3.3 закон Рауля выполняется на концах кривых, совпадающих с пунктирной прямой (линией Рауля – линией идеальности). Закон Генри: В разбавленном растворе неэлектролита при данной температуре давление пара растворенного вещества прямо пропорционально его мольной доле РБ = КБ.NБ. (4) Закон Генри имеет то же значение для описания зависимости давления насыщенного пара растворенного вещества в реальном растворе от его мольной доли, что и закон Рауля для растворителя. По форме математические выражения этих законов отличаются. В законе Рауля коэффициент пропорциональности численно равен давлению насыщенного пара чистого компонента (РAо для А и РБо для Б), о чем свидетельствует совпадение концов кривых, характеризующих давление пара растворителя над раствором с пунктирной прямой (рис. 3.2). В законе Генри КA ≠ РA и КБ ≠ РБ. Различие в поведении растворенного вещества и раство89 рителя, которые нашли отражение в законах Генри и Рауля, объясняются неравноценностью взаимного влияния компонентов раствора. В разбавленном растворе влияние растворенного вещества на межмолекулярное поле сил растворителя ничтожно мало, в то время как влияние межмолекулярного поля сил растворителя, составляющего практически весь объем раствора, велико. Следует отметить, что чем полнее сходство молекул вещества и растворителя, тем ближе КБ и РБ, и тогда, когда их межмолекулярные силовые поля равны друг другу, раствор становится идеальным. Закон Генри является частным случаем закона распределения. Понижение температуры замерзания Растворы нелетучего растворенного вещества замерзают при более низкой температуре, чем чистый растворитель. Кристаллизация растворителя из раствора начинается тогда, когда его давление в растворе (жидкой фазе) станет равным давлению пара твердой (закристаллизованной) фазы. Рж = Рт. На рисунке 3.4 кривая ОО иллюстрирует зависимость “Р-Т” чистого растворителя в твердой фазе (лед). В точке О пересечения кривых ОО”и ОА (Т = 100 оС, Р = 1 атм) лед находится в равновесии с чистой водой. Для растворов с концентрациями m1 и m2 эти точки лежат при более низких температурах. Примером, приведенным выше, можно доказать, что ∆Тзам = K.m. (5) Понижение температуры замерзания раствора прямо пропорционально моляльности раствора и не зависит от природы растворенного вещества. Коэффициент пропорциональности К называется криоскопической константой: K = RTпл2/1000 λпл, (6) где λпл – молекулярная теплота плавления растворителя. В учебной литературе соотношение (5) называют вторым законом Рауля. Второй закон, как и первый закон Рауля, справедлив лишь для разбавленных растворов. 90 Следствие из второго закона Рауля: эквимоляльные растворы кипят и замерзают при одной и той же температуре. В таблице 3.4 приведены константы К и Е некоторых растворителей. Таблица 3.4 Криоскопические и эбулиоскопические константы некоторых растворителей Формула растворителя Е K H 2O 0.52 1.86 C 6H 6 2.57 5.10 C 6H 5N H 2 3.69 5.87 CCl4 5.30 29.80 Закономерности Рауля (5) и (6) находят широкое применение для определения молекулярных масс нелетучих растворимых веществ. Для удобства они записываются в виде: ∆Тзам = Кg1000/MА (криоскопический метод); ∆Ткип = Eg1000/MА (эбулиоскопический метод), (7) (8) где g и А – соответственно масса растворенного вещества и растворителя в граммах; М – молекулярная масса растворенного вещества. Пример: Раствор, содержащий 27 г. растворенного вещества в 750 г. бензола, замерзает при 3,5 °С. Чистый бензол замерзает при 5,5 °С. Криоскопическая константа бензола –5,2. Определите молекулярную массу М вещества, растворенного в бензоле. ∆Тзам = 5.5 – 3.5 = 2; ∆Тзам = К.g.1000/M.А; M = K.g.1000/∆Тзам.А = 5.2.2.7.1000/2.750 = 93.6. Повышение температуры кипения Растворы растворенного нелетучего вещества кипят при более высокой температуре. В таком растворе не вся поверхность занята молекулами летучего растворителя, часть этой поверхности молекулы растворен91 ного вещества. Процесс испарения затруднен, давление пара раствора ниже, чем давление пара чистого растворителя. Вместе с тем и чистый растворитель, и раствор начинают кипеть, когда их давление достигает внешнего (атмосферного) давления. Поэтому, чтобы раствор закипел, его надо нагреть до более высокой температуры, чем чистый растворитель. С повышением концентрации температура кипения раствора возрастает. Покажем, что справедлива зависимость ∆Ткип = Е.m, где ∆Ткип – повышение температуры кипения раствора; Е – коэффициент пропорциональности; m – моляльность раствора. С этой целью на рисунке 3.5 для системы “вода – раствор соли” приведена диаграмма в координатах Р – Т. Внешнее давление системы Р = 1 атм; температура кипения и замерзания воды равны соответственно 100 о С и 0 оС. Кривая аА демонстрирует зависимость Ро от Т чистого растворителя (воды) в жидкой фазе. Кривые а’А и а”А” – аналогичные кривые растворов с моляльностью m1 и m2 соответственно. Раствор с моляльностью m1, для которого давление пара на величину отрезка АС’ (∆Р1) меньше по сравнению с чистым растворителем, кипит при температуре 100 оС + ∆Т2; его давление пара меньше давления пара чистого растворителя на величину отрезка АС”(∆Р2). Рис. 3.5. Диаграмма, иллюстрирующая повышение температуры кипения водных растворов 92 Доказательство: Пусть концентрации взятых растворов отличаются друг от друга и от чистого растворителя на бесконечно малые величины. Тогда отрезки АА’ (∆Т1) и АА”(∆Т2), равно как отрезки АС’ (∆Р1) и АС”(∆Р2), будут бесконечно малыми первого порядка. Это означает, что кривые линии a’А’ и a”А”на участках С’А’ и С”А”можно заменить прямыми и считать треугольники САА’ и С”АА”подобными (тем более, что их гипотенузы a’А’ и a”А”являются бесконечно малыми второго порядка). Из подобия треугольников следует: АА’/АА”= АС’/АС”. Поскольку АС’ = ∆Р1 = Ро – Р1, АА’ = ∆Т1. АС”= ∆Р2 = Ро – Р2, АА”= ∆Т2, то ∆Т1/∆Т2 = (Ро – Р1)/Ро = Ро/(Ро – Р2) = N1/N2. Умножив числитель и знаменатель на Ро, получим ∆Т1/∆Т2 = (Ро-Р1)/Ро = Ро/(Ро-Р2) = N1/N2. В соответствии с (1) ∆Т1/∆Т2 = m1/m2 или ∆Т1 = m1.Е, ∆Т2 = m2.Е (при условии, что Е – постоянная, не зависимая от моляльности раствора). Опуская индексы, получим: ∆Т = m.Е, (5) что и требовалось доказать. Постоянную Е называют эбулиоскопической константой. Она зависит от природы растворителя. Можно показать, что Е = R.Tисп2/1000 λисп, где λисп – молекулярная теплота испарения растворителя. Соотношение (5) формулируется следующим образом: Повышение температуры кипения раствора прямо пропорционально моляльности раствора и не зависит от природы растворенного вещества. 93 Осмотическое давление Раствор – однородная система. Это означает, что концентрация растворенного вещества в любом мысленно выделенном объеме такая же, как и во всем объеме раствора, и она остается неизменной во времени. Неизменность концентрации обусловлена тем, что число молекул, входящих в этот объем растворителя и растворенного вещества, одинаково. Выделенный объем находится в динамическом равновесии с окружающей средой. Если же взять растворенное вещество, CuSO4.5H2O например, и привести его в соприкосновение с водой, то на поверхности раздела фаз (твердой – медного купороса и жидкой – воды) динамического равновесия не будет. Молекулы растворенного вещества будут проникать в растворитель, а молекулы растворителя – в объем раствора в направлении от состояния с большей концентрацией каждого из компонентов к его меньшей концентрации. Результатом такой двухсторонней диффузии будет выравнивание концентраций растворенного вещества во всем объеме раствора. Возьмем сосуд со стенками, сделанными из полупроницаемого материала, который будет пропускать только молекулы растворителя и не будет пропускать молекулы растворенного вещества, и посмотрим, что произойдет, если поместить в него сахар и опустить в стакан с водой (рис. 3.6). Молекулы растворителя из объема с их большей концентрацией (из чистой воды) будут диффундировать через проницаемую только для них перегородку в водный раствор сахара, где их концентрация меньше. Явление односторонней диффузии растворителя через полупроницаемую перегородку называется осмосом. Сила на единицу поверхности, препятствующая молекулам растворителя проникать через полупроницаемую перегородку, получила название осмотического давления. Вследствие осмоса уровень в сосуде с раствором сахара повысится, при этом создается дополнительное (гидростатическое) давление, препятствующее диффузии. При некоторой высоте h это дополнительное давление достигает такой величины, что осмос прекратится совсем. 94 Рис. 3.6. Схема простейшего прибора для измерения осмотического давления: 1 – внутренний сосуд, 2 – внешний сосуд Гидростатическое давление, равное высоте h, заставляющее прекратить одностороннюю диффузию растворителя, численно равно осмотическому давлению Росм. В 1887 г. Пфеффером экспериментально были найдены две закономерности, которым подчиняется осмотическое давление растворов неэлектролитов: а) в разбавленных растворах неэлектролитов при данной температуре осмотическое давление прямо пропорционально концентрации С (моль/л). Росм = К1.С; (а) б) при одной и той же концентрации осмотическое давление разбавленного раствора неэлектролита прямо пропорционально абсолютной температуре Росм = К2.Т. (б) Я.Г. Вант-Гофф обратил внимание на аналогию между законами Пфеффера и газовыми законами Гей-Люссака и Бойля-Мариотта. Анализируя числовые данные, полученные при измерениях осмотического давления Пфеффером, он показал, что величина осмотического давления для разбавленных растворов неэлектролитов может быть выражена уравнением Росм.V = RT, (в) 95 где V – объем раствора, содержащего 1 моль растворенного вещества; R – постоянная, численно равная величине газовой постоянной в уравнении состояния Клапейрона-Клаузиуса. Уравнению (в) можно придать следующий вид: Росм = СRТ, (г) где 1/V заменена величиной С, представляющей молярную концентрацию растворенного вещества. Формулировка закона Вант-Гоффа: Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора. На практике широко используется понятие изотонических растворов. Изотоническими называются растворы с одинаковым осмотическим давлением. Осмотическое давление на границе “раствор – полупроницаемая перегородка – растворитель”весьма важно в жизнедеятельности организмов и растений. Оно лежит в основе регулирования водного баланса клеток. В медицине им руководствуются при приготовлении изотонических растворов с кровью (физиологический раствор), с раствором желудочного сока и тому подобное. Осмос лежит в основе многих явлений, протекающих в природе. Закономерность, установленная Вант-Гоффом, так же как и законы Рауля, используется для определения молекулярных масс растворенных веществ. Осмотический метод оказался применимым также для определения молекулярных масс растворов высокомолекулярных соединений. Соотношения Рауля для этой цели неприменимы из-за невозможности приготовления разбавленных растворов и трудности, связанной с достижением равновесия. Зависимость осмотического давления растворенного высокомолекулярного вещества от его концентрации описывается соотношением Росм = g.R.T/M + A.g2 или Росм/g = R.T/M + A.g, где g – масса в г. Член (A.g2) учитывает специфику строения и кинетики полимерных молекул. 96 Опытным путем находят зависимость величины Росм/g от массовой концентрации соединения. Экспериментальные данные наносят на график (см. рис. 3.7). Экстраполируя величины Росм/g к нулевой концентрации, определяют длину отрезка на оси ординат, которая равна величине RT/M, и таким образом определяют молекулярную массу высокомолекулярных соединений. Рис. 3.7. Графическое предствавление зависимости Росм/g = R.T/M + A.g Отклонение свойств разбавленных растворов электролитов от законов Рауля и Вант-Гоффа Рассмотренные выше закономерности (1, 4-б) оказались неприемлемыми для количественного описания коллигативных свойств кислот, солей и оснований, проводящих ток (растворов электролитов). Например: растворение 0.5 г KCl в 20 мл воды вызывает понижение температуры замерзания на 1,2 °С, тогда как теоретическая величина, рассчитанная по закону Рауля, ∆Tтеор = 1.68⋅0.5 ⋅ 1000/58⋅20 = 0,63. Аналогично для водных растворов 1М CH3COOH и CuSO4 вместо ∆Tтеор = 1.86 получены значения ∆Tоп = 1.96 и 2.57 соответственно, или найдено на опыте понижение давления пара 2.5%-го водного раствора NaCl ∆Роп = 0.30 мм. рт. ст. вместо ∆Ртеор = 0.17 мм. рт. ст. Для того чтобы можно было использовать законы идеальности для количественного описания свойств разбавленных растворов 97 электролитов (1,4-6,8), Я.Г. Вант-Гоффом был введен в соотношение множитель (изотонический коэффициент Вант-Гоффа) i = ∆Tоп/∆Tтеор = ∆Росм(оп)/∆Росм(теор) = ∆Роп/∆Ртеор. Следовательно, для электролитов ∆Tзам = iКm; Росм = iCRT; ∆Р = i∆Ртеор В том числе для приведенных выше примеров: для раствора KCl: iKCl = ∆Tоп/∆Tтеор = 1.2/Кm = 1.2/0.63 = 1.9; для раствора CuSO4: iCuSO4 = 2.57/1.86 = 1.4; и для раствора CH3COOH: iCH3COOH = 1.05. Во всех случаях i – величина дробная и больше единицы, т.е. можно предположить, что в растворах электролитов действующая частичная концентрация больше исходной концентрации электролита. Я.Г. Вант-Гофф не пытался раскрыть причины отклонений, наблюдаемых в растворах электролитов. Это было сделано С.А. Аррениусом в его гипотезе электролитической диссоциации. Растворы электролитов. Теория электролитической диссоциации Сванте Аррениус в 1887 г. предложил теорию электролитической диссоциации, согласно которой: Вещества, растворы которых являются электролитами, при растворении распадаются на частицы (ионы), несущие положительные и отрицательные заряды. Растворы являются проводниками электрического тока тогда, когда они содержат ионы. Чем больше растворенных частиц, тем лучше они проводят электрический ток. По мере распада электролитов на ионы растет число частиц, находящихся в растворе, так как из одной частицы образуется две или более. Следовательно, законы Рауля и Вант-Гоффа 98 верны и для растворов электролитов, если учитывать как недиссоциированные, так и диссоциированные частицы. Ионы, заряженные положительно, называются катионами, а отрицательно заряженные ионы – анионами. Катионами являются положительно заряженные ионы металлов, ион водорода, NH4+, анионы – водные и кислотные остатки. Величина заряда иона совпадает с валентностью атома или кислотного остатка, а количество положительных зарядов равно количеству отрицательных. Поэтому раствор в целом электронейтрален. Процесс электролитической диссоциация изображается следующим образом: NaCl ↔ Na+ + Cl– H2SO4 ↔ 2H+ + SO42-. Теория Аррениуса объяснила многие явления, связанные со свойствами растворов электролитов, но не ответила на вопрос: почему одни вещества являются электролитами, а другие – нет, а также какую роль в образовании ионов играет растворитель. Механизм диссоциации Теорию процесса диссоциации разработал И.А.Каблуков (1891). Представим себе, что ионный кристалл, например, NaCl, внесен в воду. Каждый ион, находящийся на поверхности кристалла, образует вокруг себя электрическое– поле. Вблизи от Na+ создается поле положительного знака, вблизи Cl дается электростатическое поле отрицательного знака. Влияние этих полей распространяется на некоторое расстояние от кристалла. В растворе кристалл со всех сторон окружают беспорядочно движущиеся молекулы воды. Попадая в поле действия электрических заряженных ионов, они изменяют свое движение: в непосредственной близости от кристалла они ориентируются таким образом, что к отрицательно заряженному иону Cl- диполи воды оказываются направленными положительно заряженным полюсом, а к положительно заряженному Na+ – отрицательно заряженным полюсом. Такое явление называется ориентацией полярных молекул в электростатическом поле. Между ионами и диполями воды действуют кулоновские силы притяжения. В результате ион-дипольного взаимодействия выделяется энергия, которая способствует разрыву ионных связей в кристалле и переведению иона из кристалла в раствор. Отделенные друг от друга ионы тотчас же после разрыва связи между ними вплотную окружаются полярными молекулами воды и становятся полностью гидратированными. Явление взаимодействия ионов с молекулами воды, в результате чего происходит образование гидратной оболочки, называется гидратацией ионов. Теп99 лота, выделяющаяся при гидратации ионов, называется теплотой гидратации и выражается в Дж/моль или кал/моль. Пример: При гидратации 1 моля ионов Na+ выделяется 422.2 – кДж/моль тепла, а при гидратации 1 моля ионов Cl 351.1 кДж/моль. Гидратированные ионы, имеющие противоположные заряды, могут взаимодействовать друг с другом. Но так как ионы движутся в растворе вместе с гидратными оболочками, то сила их взаимодействия значительно уменьшена, и они способны к самостоятельному существованию. Сила взаимодействия гидратированных ионов зависит от свойств растворителя, одним из которых является диэлектрическая проницаемость. Диэлектрическая проницаемость показывает, во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в вакууме. При растворении полярных соединений происходит ориентация диполей воды вокруг растворенных молекул, вызывая еще большую поляризацию их. Полярная ковалентная связь между атомами переходит в ионную. Общая электронная пара сдвигается к одному из атомов. Например, в HCl электронная пара сдвигается к атому хлора, который превращается в гидратированный ион хлора, и протон с молекулой воды образует сложную положительно заряженную частицу H3O+ – ион гидроксония. HCl + xH2O ↔ H3O+ + Cl-yH2O. Таким образом, электролитами могут быть соединения только с ионной или полярной ковалентной связью. Электролиты могут диссоциировать только в полярных растворителях (бензол ξ = 23, диметиловый эфир – ξ = 21, этанол – ξ = 27, вода – ξ = 81, HCN – ξ = 95). В хлороформе (ξ = 5.1) диссоциации не происходит. По своим свойствам ионы отличаются от атомов и молекул. Так, водород – горит, плохо растворим в воде, H+ – не горит, существует в растворах в виде H3O+ и т.д. Степень электролитической диссоциации Разноименно заряженные гидратированные ионы, находящиеся в растворе, могут взаимодействовать друг с другом, хотя это взаимодействие незначительно и зависит от природы растворителя. Поэтому электролитическая диссоциация – процесс обратимый. HF ↔ H+ + F– NH4OH ↔ NH4+ + OH-. 100 Таким образом, в каждый данный момент в одном растворе электролитов присутствуют как ионы, так и молекулы. Между ними практически мгновенно устанавливается подвижное химическое равновесие, т.е. такое равновесие, когда скорость прямой реакции (диссоциации) равна скорости обратной. Аррениус ввел понятие степени электролитической диссоциации α: Число молекул, распавшихся на ионы α = Общее число молекул растворенного вещества Если N – общее число молекул в растворе, n – число молекул, распавшихся на ионы, то α = n/N; при n = N α = 1. В этом случае все молекулы растворенного вещества распались на ионы. Если n = 0, то вещество совсем не распадается на ионы, т.е. является неэлектролитом. Степень диссоциации лежит в пределах от 0 до 1 и может быть выражена в долях или процентах. Пример: Степень электролитической диссоциации 0.01 Н раствора CH3COOH при 18 С равна 4.3⋅10–2, или 4.3%. Это означает, что при равновесии CH3COOH ) H+ + CH3COO– из каждых 100 молекул CH3COOH 96 остаются в молекулярном виде. Кроме того, в растворе находятся 4 иона H+ и 4 иона CH3COO–. Применительно к сильным электролитам (α ≈ 1) понятия степени электролитической диссоциации и недиссоциированной части электролита носят условный характер. Определяемая на опыте a для сильных электролитов не отражает картины распада электролита на ионы и называется кажущейся степенью диссоциации. Она всегда ниже истинной степени диссоциации. Сильные электролиты в растворе диссоциируют полностью, так как их кристаллические решетки состоят из ионов. Но с увеличением концентрации сильного электролита в растворе увеличивается взаимное притяжение разноименных ионов, которое при достаточном приближении их друг к другу приводит к образованию ионных пар. Они ведут себя подобно молекулам, хотя и не являются ими. Отличие от молекул у них в том, что ионы в них непосредственно друг с другом не соприкасаются, а разделены одним или несколькими слоями молекул воды. Образование ионных пар воспринимается на опыте как отсутствие полной диссоциации сильного электролита. В результате химическая активность сильного электролита в растворе падает. Понятие “ионная пара” ввели Бьеррум 101 и Семенченко. Для каждого электролита существует параметр Бьеррума g, представляющий собой расстояние, на которое подходят друг к другу ионы в процессе образования ионной пары. Его определяют из соотношения [z+ ⋅ z –]e2 g = , 2ξKT где z+ и z – – заряды катиона и аниона; e – заряд электрона (4.8.10–10 эл.ст.ед.); К – постоянная Больцмана (1.38.10–16 эрг/град = 1.38.10–23 Дж/К); Т – абсолютная температура; ξ – диэлектрическая проницаемость растворителя. При увеличении заряда иона увеличивается g, т.е. увеличивается расстояние, на котором взаимодействуют ионы. При увеличении ξ уменьшается электростатическая сила взаимодействия ионов. Поэтому полярные растворители, характеризующиеся большими значениями диэлектрической постоянной, способствуют образованию растворов, являющихся сильными электролитами, т.е. с малой способностью к образованию ионных пар. При увеличении температуры g падает, и взаимодействие между ионами ослабевает. Параметр Бьеррума имеет вполне определенное значение для каждого растворителя при заданных значениях температуры и зарядов ионов. Так, для одновалентных ионов в воде (z+⋅ z – = 1) при Т = 298 К (4.8 ⋅ 10-10)2 g = = 3.57 ⋅ 10-8= 3.57°A. 2.1.38 ⋅ 10-16 ⋅ 298 ⋅ 81 Тогда при g<3.57°A молекула считается недиссоциированной, при g > 3.57°A ионы можно считать изолированными. Для оценки состояния ионов сильных электролитов в растворе пользуются величиной, называемой активностью. Под активностью иона понимают ту эффективную условную концентрацию его, соответственно которой он действует в химических реакциях. a = f ⋅ c, где f – коэффициент активности. Коэффициенты активности различных ионов различны. Кроме того, они изменяются при изменении концентрации раствора. В концентриро102 ванных растворах f обычно меньше единицы, а с разбавлением раствора он приближается к единице. Значение f < 1 указывает на взаимодействие между ионами, приводящее к их связыванию. В очень разбавленных растворах расстояние между ионами достаточно велико, действие межионных сил мало, и f ≈ 1. В разбавленных растворах природа иона мало влияет на значение f. Поэтому считают, что коэффициент активности данного иона зависит только от его заряда и от ионной силы раствора I. Ионная сила раствора – это мера интенсивности электрического поля, создаваемого ионами в растворе. Ионная сила – это полусумма произведений концентраций всех ионов, находящихся в растворе, на квадрат их заряда: I = 1/2(C1Z12 + C2Z22 + ... + CnZn2). Пример: Вычислить ионную силу раствора 0.1M NaCl и 0.1M BaCl2. C1 = [Na+] = 0.1 моль ионов/л, Z1 = 1; C2 = [Ba2+] = 0.1 моль ионов/л, Z2 = 2; C3 = [Cl ] = 0.1 + 0.1.2 = 0.3 моль ионов/л. I = 1/2[0.1.12 + 0.1.22 + 0.3.(-1)2] = 0.4. Если пользоваться значениями активности, то законы химического равновесия можно применить и к сильным электролитам, только надо вместо концентраций ионов ставить их активность. Тогда, например, выражение для константы равновесия запишется так: АВ ↔ А+ + В– Kp = (aA+ aA–)/aAB. Степень диссоциации зависит от следующих факторов 1. Природа электролита Природа электролита – главный фактор, определяющий степень диссоциации. Чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости препятствует электростатическому взаимодействию ионов противоположного знака в растворе, тем больше степень диссоциации. В том случае, если вещество содержит только ковалентные связи между атомами или группами атомов, то оно не диссоциирует в растворе. Но не всегда вещества с большей ионностью связи сильнее диссоциируют в растворах. Так, для гало103 геноводородов ионность связи уменьшается от HF к HI, тем не менее степень диссоциации иодоводородной кислоты значительно больше степени диссоциации фтористоводородной кислоты (см. табл. 3.5). Это можно объяснить тем, что в водном растворе вследствие процесса гидратации меняется характер химической связи между частицами вещества. Протон в воде сильно гидратируется и образует достаточно объёмные ионы гидроксония Н3О+, которые оказывают гораздо меньшее поляризующее действие на ион галогена, чем не гидратированный. В ряду F , Cl , Br , I радиус иона увеличивается, а это приводит к тому, что связь в молекуле HI становится более ионной, чем в HF. Таблица 3.5 Характеристики галогеноводородов и степень диссоциации их в растворах Свойство (полярность), D HF 1.91 HCl 1.30 HBr 0.79 HI 0.42 ∆Hобр, кДж/моль –268.61 –92.30 –35.98 +25.94. α (степень дисс.) 0.10 0.92 0.95 0.98 2. Природа растворителя Природа растворителя оказывает существенное влияние на степень диссоциации растворённого вещества. Степень диссоциации в значительной мере зависит от диэлектрической проницаемости растворителя. Чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации. Это хорошо видно на примере иодида тетраметиламмония, степень диссоциации которого растёт с увеличением диэлектрической проницаемости растворителя (табл. 3.6). Таблица 3.6 Значения степени диссоциации 0,01 М раствора N(CH3) 4 I в различных растворителях Растворитель ξ α ацетон 20.75 0.50 нитробензол 34.7 0.71 вода 81 0.91 Замена воды, имеющей диэлектрическую проницаемость 81, на растворитель с меньшей диэлектрической проницаемостью, например, 104 на этиловый спирт (ξ=25), сильно понижает степень диcсоциации. Сильные электролиты в спирте становятся электролитами средней силы, а слабые – практически не диссоциируют. Вследствие высокой диэлектрической проницаемости воды в ней даже при больших концентрациях растворённого вещества маловероятно образование ионных пар. В средах с малой диэлектрической проницаемостью ионные пары образуются легко. 3. Температура Для многих электролитов существует достаточно широкий температурный интервал, в котором наблюдается простая зависимость между тепловым эффектом, степенью диссоциации и температурой. Если процесс диссоциации экзотермичен, то с повышением температуры степень диссоциации падает. При эндотермическом процессе – повышение температуры ведёт к увеличению степени диссоциации. Так, степень диссоциации воды растёт с увеличением температуры. При 18 °С степень диссоциации воды равна 1,5⋅10–9, а при 100 °С – 1,5⋅10–8. Но в общем случае степень электролитической диссоциации сложным образом зависит от температуры. Для каждого электролита существуют температурные условия, в которых он диcсоциирует в большей степени. Так, степень диссоциации уксусной кислоты максимальна при 25 °С (Кд = 1,75⋅10–5). Выше и ниже этой температуры степень диссоциации уксусной кислоты меньше ( при 0 °С Кд = 1,6510–5 0, при 50 °С Кд = 1,62⋅10–5). Отсутствие чёткой зависимости степени диссоциации от температуры объясняется неравномерным изменением энтальпии гидратации, состава ионов, свойств растворителя и других с изменением температуры. 4. Концентрации растворов С увеличением концентрации растворов α уменьшается, так как ионы чаще сталкиваются друг с другом с образованием молекул или ионных пар. Пример: Рассмотрим влияние концентрации растворенного вещества на степень диссоциации на примере раствора CH3COOH при 18 °С. С, моль/л α Kg 10-5 105 2.8⋅10-5 1.11⋅10-4 1.03⋅10-3 5⋅10-2 0.1 0.539 0.328 0.124 0.019 0.0135 1.75 1.75 1.76 1.75 1.69 5. Влияние одноимённых ионов При прибавлении в раствор слабой кислоты или основания соли, содержащей одноимённый анион или катион для кислоты или основания соответственно, то, согласно принципу Ле-Шателье, следует ожидать смещения равновесия диссоциации влево, т.е. в сторону уменьшения степени диссоциации. Так, если к раствору уксусной кислоты добавить немного ацетата натрия, то добавленные ацетат-ионы смещают равновесие диссоциации кислоты СН3СООН <=> CH3COO– + H+ влево и степень диссоциации уксусной кислоты уменьшается. Об этом свидетельствуют данные, приведённые в таблице 3.7. Подавление диссоциации под влиянием одноимённого иона называется “репрессией ионизации”. С репрессией ионизации связаны многие процессы, имеющие практическое значение. Так, её используют для уменьшения растворимости тех или иных соединений. Таблица 3.7 Влияние ацетата натрия на степень диссоциации уксусной кислоты Концентрация ацетата натрия, моль/л 0,0 0,001 0,002 0,005 0,010 0,020 Степень диссоциации уксусной кислоты, % 4,1 1,5 0,84 0,35 0,18 0,09 Методы определения степени электролитической диссоциации 106 Степень диссоциации определяют экспериментально из измерений электропроводности растворов, изучения спектров комбинационного рассеяния или через расчётные методы с использованием изотонического коэффициента. Но и в этом случае применяют экспериментальные данные по температурам кипения или замерзания, осмотическому давлению, упругости пара растворов. 1. По электропроводности раствора α = λ/λ∼ ⋅ λ∞ – электропроводность при бесконечном разбавлении, λ – электропроводность изучаемого раствора. 2. Через изотонический коэффициент Сисх. N + AB ↔ A + B` , N – αN αN αN, Сравн. где N – общее число молекул; n – число ионов, на которые распались молекулы; N – aN – число молекул, оставшихся недиссоциированными; α – степень диссоциации. Тогда i = Pэксп /Pтеор = [(N – αN) + nαN]/N = 1 – α + nα. Отсюда α = (i – 1)/(n – 1). Пример: Вычислить осмотическое давление при Т = 27 °С раствора, в одном литре которого содержится 87.1 г K2SO4, α = 0.53. P = iCRT α = (i – 1)/(n – 1); i = 1 – a + na n = 3 K2SO4 ) 2K+ + SO42- i = 2.06 P = 2.06 ⋅ 87.1 ⋅ 0.082 ⋅ 300/174.2 = 25.35 атм. Константа диссоциации Пользоваться величиной степени электролитической диссоциации не всегда удобно, так как α зависит от концентрации раствора. Поэтому для характеристики диссоциации в растворах вводят понятие “константа диссоциации”. В растворе слабых электролитов (α < 1) можно говорить о равновесии между ионами и реально существующими недиссоциированными молекулами. Значит, в общем виде это равновесие можно записать так: KA ↔ K+ + A-, 107 где K+ – катион, A– – анион. По закону действующих масс скорость диссоциации при постоянной температуре равна V1 = K1[KA], а скорость обратной реакции (ассоциации) равна V = K [K+][A– ]. Так как процесс диссоциации – это об2 2 ратимый процесс, то в состоянии равновесия V1 = V2, или K1[KA] = K2[K+][A– ]. Отсюда K1/K2 = [K+][A– ]/[KA] = KД. Величина KД называется константой диссоциации электроли-та и показывает отношение произведения концентраций ионов в растворе слабого электролита к концентрации недиссоцииро-ванных молекул. Величина Kд для слабого электролита при данной температуре есть величина постоянная, которая зависит от концентрации. Для сильных электролитов в разбавленных растворах не существует недиссоциированных молекул, для них понятие константы диссоциации не имеет смысла. С учетом кажущейся степени диссоциации для сильного электролита формально можно вычислить константу диссоциации. Однако с изменением концентрации данного электролита она не остается постоянной. Таким образом, константа диссоциации может служить критерием деления электролитов на сильные и слабые. Слабые электролиты характеризуются константой диссоциации, а у сильных электролитов такая характеристика отсутствует. Чем больше константа диссоциации, тем значительнее электролит диссоциирует на ионы, тем он сильнее. Если Kд > 10-1, то электролит относится к сильным, при Kд < 10-3 – к слабым, а при 10-3 < Kд < 10-1 – к электролитам средней силы. Для большинства слабых электролитов значения Kд сведены в таблицы и приведены в справочниках. Слабые многоосновные кислоты и основания при растворении в воде диссоциируют на ионы ступенчато, последовательно отдавая в раствор один, два и более ионов водорода или гидроксида. Рассмотрим примеры ступенчатой диссоциации многоосновных кислот: а) H2S диссоциирует на ионы в две ступени: 1. H S ↔ H+ + HS– ; 2 2. HS– ↔ H+ + S2–; K1 = [H+][HS– ] /[H2S] = 8.9 ⋅ 10–8; 108 K2 = [H+][S2–]/[HS–] = 1.0 ⋅ 10–13; б) H3PO4 как трехосновная кислота диссоциирует на ионы в три ступени: 1. H3PO4 ) H+ + H2PO4; 2. H2PO4 ) H+ + HPO4; 3. HPO42– ) H+ + PO43–; K1 = [H+][H2PO4– ]/[H3PO4] = 7.5 ⋅ 10–3; K = [H+][HPO 2–]/[H PO – ] = 6.2 ⋅ 10–8; 2 4 2 4 K3 = [H+][PO43–]/[HPO42–] = 2.2 ⋅ 10–13. Ступенчатой диссоциации может подвергнуться основание, содержащее несколько гидроксидных групп 1. Mg(OH)2 ) MgOH+ + OH–; 2. MgOH– ) Mg2+ + OH–; K1 = [MgOH+][OH–]/[Mg(OH)2]; K = [Mg2+][OH–]/[MgOH+]. 2 Константа полной диссоциации электролита равна произведению констант его диссоциации по ступеням. Пример: для H2CO3 для Pb(OH)2 Kд = K1K2 = 2.2⋅10-17; Kд = K1K2 = 2.86⋅10-11. Часто при рассмотрении равновесий в растворах кислот и оснований используют не константы диссоциации, а их отрицательные логарифмы, по аналогии с рН. Так, для фосфорной кислоты рК1 = 2,12, рК2 = 7,21, рК3 = 12,67. Таким образом, в растворах многоосновных кислот содержатся различные частицы, и нейтральные, и заряженные. Так, в растворе фосфорной кислоты содержатся частицы семи видов: H PO , H PO –, 3 4 2 4 HPO42–, PO43–, H2O, OH–, H+. Это могло бы сильно усложнить рассмотрение равновесий. Поэтому необходимо допустить некоторые приближения. Известно, что при равенстве рН раствора и рК диссоциации в нем кислоты концентрации диссоциированной и недиссоциированной форм равны друг другу. Тогда, для второй ступени диссоциации фос109 форной кислоты рК2 = 7,21, константа диссоциации определяется выражением [H+][HPO42–] К2 = . [H PO –] 2 Отсюда 4 [HPO42–] lg = pH – pK2. [H2PO4–] При рН = рК должно выполняться соотношение [HPO42–] = 1,00. [H PO –] 2 4 Следовательно, в нейтральном растворе ионы H2PO4– и HPO42– присутствуют примерно в одинаковой концентрации. В таком растворе концентрация недиссоциированных молекул фосфорной кислоты будет очень мала, поскольку из выражения для константы диссоциации по первой ступени [H+][H2PO42–] К1 = [H3PO4] следует, что [H2PO4–] lg = pH – pK1 = 7,00 – 2,12 = 4,88, [H3PO4] [H PO –] 2 4 = 104,88 = 7,6 ⋅ 104 = 76000. [H3PO4] В таком растворе присутствует очень незначительное количество ионов РО43– а значит 110 [PO43–] lg = pH – pK3 = 7,00 – 12,67 = -5,67 [HPO42–] [PO43–] и = 2,1 ⋅ 10–6 = 1/480000. [HPO42–] Таким образом, при рН = 7 в фосфатном растворе следует учитывать только ионы Н РО – и НРО 2–. Аналогично в кислых растворах при 2 4 4 рН около 3 присутствуют лишь ионы Н2РО4– и молекулы Н3РО4. Величины констант диссоциации некоторых кислот приведены в таблице 3.8. Таблица 3.8 Константы диссоциации некоторых слабых кислот при 25 °С Кислота Трихлоруксусная Щавелевая К1 К2 Сернистая K1 K2 Ортофосфорная K1 K2 K3 Азотистая Фтористоводородная Муравьиная Уксусная Угольная К1 К2 Сероводородная K1 Формула ССl3COOH НООС-СООН Кд 2⋅10-1 рК 0,70 5,9⋅10-3 6,4⋅10-5 1,23 4,19 1,54⋅10-2 1,02⋅10-7 1,81 6,37 7,52⋅10-3 6,23⋅10-8 2,2⋅10-13 4,6⋅10-4 2,12 7,21 12,67 3,34 3,53⋅10-4 1,77⋅10-4 1,75⋅10-5 3,45 3,75 4,75 4,3⋅10-7 5,61⋅10-11 6,37 9,1⋅10-8 7,O4 H2SO3 H3PO4 HNO2 HF HCOOH СН3СООН Н2СО3 H2S 111 K2 Цианистоводородная HCN Пероксид водорода H2O2 Вода H2O 1,1⋅10-12 11,96 4,93⋅10-10 9,31 2,4⋅10-12 1,8⋅10-16 11,62 15,76 Закон разбавления Степень, константа диссоциации и концентрация раствора связаны между собой законом разбавления Оствальда. Сисх, моль/л HA ↔ H+ + A– C- aC aC aC, Cравн. α – степень диссоциации. [H+] = αC; при диссоциации [A–] = [H+] = αC, а недиссоциированными остались C – αC молей. Тогда Kд = (aC Ч aC)/(C - aC) = Ca2/(1 - a). Если α << 1, то Kд = C α2 или α= –1 KD C . –3 Если Kд ≈ 10 – 10 , т.е. электролит относится к более сильным, то Cα2 + αКд – Kд = 0. Современные взгляды на процессы электролитической диссоциации Вода – не единственный ионизирующий агент. Электропроводность имеет место в многих неводных растворителях: спиртах, жидких CS2, H2S, H2F2 и даже в углеводородах. Процесс электролитической диссоциации невозможен без взаимодействия растворенного вещества с растворителем (сольватации). Ионизирующая активность определяется природой и свойствами растворителя. Важнейшими характеристиками растворителя как ионизирующего агента являются: – способность его молекул вступать во взаимодействие с растворенным веществом, или способность сольватировать растворенные вещества; 112 – диэлектрическая проницаемость растворителя ξ; – способность к собственной ионизации, характеризующаяся константой автопротолиза KS. Ионы в растворе образуются за счет: – диссоциации растворенного вещества (NaCl, KCl); – самоионизации растворителя + 2H2O ↔ H3O + OH–; 2NH3 ↔ NH4+ + NH2–; – взаимодействия растворителя и растворенного вещества NH3 + H2O ↔ NH3 ⋅ H2O ↔ NH4+ + OH–; Cl2 + H2O ↔ HCl + HClO ↔ H+ + Cl–+ ClO–; SO2 + H2O ↔ SO2 ⋅ H2O ↔ HSO3– + H+. Образование ионов в растворе за счет растворенного вещества связывается с двумя процессами: электролитической диссоциацией и электролитической ионизацией. Под электролитической диссоциацией понимают процесс разрушения ионной молекулы на ионы под действием сил сольватации. Например: NaCl + nH2O ↔ Na+ ⋅ mH2O + Cl– ⋅ kH2O ↔ Na+ + Cl–, где Na+ , Cl– – гидратированные катион и анион соответственно. Под электролитической ионизацией понимают процесс трансформации полярной молекулы в ионную: HCl ⋅ nH2O → (H+Cl–)⋅ nH2O → H3O+ + Cl– ⋅ mH2O. ионизация диссоциация Сила электролита в ряде случаев полностью определяется природой растворителя. В воде хлористый водород – сильный электролит, а в бензоле он не проводит электрического тока совсем. Напротив, углеводороды в воде – типичные непроводники, а в жидкой H2F2 для них характерна определенная электропроводность. По Аррениусу, растворенные вещества разделяются на два класса: непроводники и проводники, а также на сильные, слабые и электролиты средней силы. Такое разделение нельзя считать строгим. Оно имеет смысл только применительно к данному растворителю. Механизм процесса электролитической диссоциации полностью не 113 установлен. Н.А. Измайлов, основываясь на аналогии в химии водных и неводных растворов, предложил следующую единую схему электролитической диссоциации (М – растворитель, АВ – растворенное вещество): AB + (n+m)M ) ABMn + mM ) A+сольв. + Bсольв. + yM a b d↑↓ ↑↓c Aсольв. ⋅ Bсольв. + xM, где m = x + y. В этой схеме процесс (a) – реакция присоединения растворителя. Продукт присоединения АВМ под влиянием дополнительной сольватации (b) ионизируется с образованием сольватных ионов A+сольв. и Bсольв.. Сольватированные ионы по реакции (с) могут образовывать ассоциаты, частично теряя растворитель (десольватируясь). В водных растворах в основном идут процессы а и b. В неводных растворителях, характеризующихся более слабой, чем вода, сольватирующей способностью и меньшими значениями диэлектрических постоянных, преобладающими являются процессы а, d. По этой причине неводные растворы обладают слабой электропроводностью. Кислоты и основания Уже на рубеже ХХ в. теория кислот и оснований Аррениуса не находила объяснений большому кругу явлений. Было установлено, что ион H+ не существует в растворе, он гидратируется (сольватируется) с образованием иона гидроксония H3O+. Были известны случаи кислотноосновного взаимодействия водородосодержащих веществ в недиссоциированном состоянии. Например, HCl (типичный непроводник в среде бензола) изменяет окраску индикатора при добавлении пиридина. Был известен большой круг веществ, не содержащих водорода, которые вступают в кислотно-основное взаимодействие (Na2CO3, AlCl3 и т.д.). Было также установлено, что кислотно-основная функция зависит от партнера: мочевина в воде проявляет кислотные свойства, а в уксусной кислоте – основные. Это побуждало исследователей к созданию теории кислот и оснований. В 1905 г. В. Франклином была предложена теория, получившая название теории cольвосистем. Теория cольвосистем была применима к водоподобным самоионизирующимся растворителям и по существу не отличалась от теории кислот и оснований системы Аррениуса. Согласно теории cольвосистем, кислота – это вещество, образующее катион, 114 идентичный с катионом растворителя. Основание – это вещество, образующее анион, идентичный с анионом растворителя. Так, в случае аммосистем растворитель – NH3, самоионизирующийся по реакции 2NH3 ↔ NH4+ + NH2– KNH ↔ K+ + NH –, 2 2 является основанием, а NH4Cl – кислотой: NH4Cl ↔ NH4+ + Cl–. Реакция нейтрализации, как и по теории Аррениуса, сводится к образованию растворителя и соли: KNH2 + NH4Cl ↔ 2NH3 + KCl. Образование соли в результате кислотно-основного взаимодействия послужило поводом к названию этих систем – cольвосистемы. Каждая сольвосистема имеет свой круг кислот и оснований, свою шкалу кислотности, определяемую константой автопротолиза KS растворителя, свою реакцию нейтрализации и т.д. Исторически теория cольвосистем сыграла важную роль в накоплении опытных данных по химии неводных самоионизирующихся растворителей. В настоящее время эта теория утратила свое значение. Среди других теорий, разрабатываемых в начале ХХ в., следует указать протонную теорию Бренстеда-Лоури и электронную теорию Льюиса. Теория Бренстеда и Лоури (1923) заслуживает особого внимания, поскольку она получила в настоящее время наибольшее признание и широко используется на практике. Теория Бренстеда-Лоури относится к химической теории кислот и оснований, на первое место она выдвигает взаимодействие растворителя и растворенного вещества. Согласно протонной теории, кислота – любое вещество, способное отдавать протон (донор протона). Основание – любое вещество, способное принять протон (акцептор протона). Сила кислоты HA ↔ H+ + A–, (а) (где A – частица, получившая название сопряженного с кислотой HA основания) определяется константой кислотности (аналогичной константе ионизации Аррениуса) 115 K1 = [H+][A–]/[HA]. Сам по себе процесс ионизации (а) невозможен, необходимо присутствие основания, которое удерживало бы протон сильнее, чем сопряженное с кислотой основание A–. Пусть таким основанием будет Э–, тогда HA + Э– ↔ HЭ + A–; K1 ⋅ осн.1 = К2 ⋅ осн.2. (б) В процессе кислотно-основного взаимодействия (б) вместо одной кислотно-основной пары образуется другая пара кислоты и основания. Кислота HЭ слабее, чем HA, т.е. сопряженное с ней основание Э удерживает протон сильнее, чем A . Следовательно, константа кислотности HЭ K2 = [H+][Э–]/[HЭ] < K1 = [H+][A–]/[HA]. Реакции в растворах, сопровождающиеся переносом протона (б), получили название протолитических реакций. К протолитическому кислотно-основному равновесию (б) применим закон действующих масс Kn = [HЭ][A–]/[HA][Э–] = K1 / K2. Чем больше константа кислотности продукта протолиза K2, тем больше константа протолиза Kn. Кислотами Бренстеда могут быть: 1) нейтральные частицы типа HCl ↔ H+ + Cl–; 2) aнионные кислоты типа H2SO4 ↔ H+ + HSO4–; 3) катионные кислоты [Al(H2O)6]3+ ↔ [Al(OH2)5OH]2+ + H+ NH4+ ↔ NH3 + H+, H3O+ ↔ H2O + H+. Аналогично для оснований: 1) нейтральные Аl(OH)3, Cd(OH)2 и др; 2) aнионные Cl–, Br–, NO3–, SO42– и др; 116 3) катионные [Al(H2O)5OH]2+ и др. Растворитель в протолитической реакции участвует либо как кислота, либо как основание. Если сродство к протону у растворителя больше, чем у растворенного вещества, то он выполняет функцию основания, а растворенное вещество – функцию кислоты. И наоборот, если сродство к протону у растворителя меньше, чем у растворенного вещества, первый выполняет роль кислоты, а второй – основания. Сродство к протону оценивается значением ∆Н реакции взаимодействия протона с молекулой растворителя в газовой фазе (джоуль в расчете на моль растворителя). Н+ + H2O ↔ H3O+ + 790 Дж; H+ + NH3 ↔ NH4+ + 880 Дж. Зависимость ионизации растворенного вещества от природы растворителя можно иллюстрировать примером ионизации в жидких средах: CH3COOH + H2O ↔ H3O+ + CH3COO–; сл. к-та осн. CH3COOH + NH3 ↔ NH4+ + CH3COO–; сильн.к-та CH3COOH + H2F2 ↔ CH3COOH2+ + HF2–. Важнейшим достоинством теории Бренстеда является то, что она позволяет процессы ионизации, нейтрализации, гидролиза количественно описывать с единой позиции кислотно-основных равновесий. Количественное описание кислотно-основных равновесий в неводных растворителях получило дальнейшее развитие в работах Н.А. Измайлова. Протонная теория Бренстеда-Лоури не применяется к кислотам, не содержащим водорода, типа AlBr3, AlCl3, SnCl4. Кислотно-основное взаимодействие таких веществ находит объяснение в рамках теории кислот и оснований Льюиса (1923). По Льюису, кислота – это вещество, способное принять недостающую для октета пару электронов (акцептор электронов). Например, SO3, AlCl3. O Cl .. .. O:S .. O Al:Cl .. Cl 117 Основание – вещество, способное отдать неподеленную электронную пару (донор электронов). Например, H2O, NH3. По Льюису, кислотно-основное взаимодействие сводится к образованию донорно-акцепторной связи. Br .. Br : Al + :NH3 ↔ .. Br Br .. Br : Al : NH3. .. Br Водородный показатель (рН) Если в цепь для определения проводимости воды включить чувствительный гальванометр, то он покажет наличие электрического тока. Это значит, что молекулы воды в небольшой степени диссоциируют на ионы: 2H2O ↔ H3O+ + OH– или H2O ↔ H+ + OH– . Применим к этому равновесию закон действующих масс. V1 = K1[H2O] V2 = K2[H+][OH–] V1 = V2; – – K1[H2O] = K2[H+][OH ] K1/K2 = [H+][OH ]/[H2O]. Так как вода является слабым электролитом, то [H2O] = const, Kp Ч [H2O] = [H+][OH ] = Kw. – KW – показывает, чему равно произведение концентраций ионов водорода и гидроксид-ионов в воде, и называется ионным произведением воды. При 22 °C Kw = 10 –14 [H+][OH–] = 10–14; [H+] = [OH–], откуда [H+]2 = 10–14, и [H+] = [OH–] = (10–14)1/2 = 10–7. Тогда [H+] = 10–14/[OH–], [OH–] = 10–14/[H+]. Концентрации ионов водорода и гидроксила можно выражать в граммах на 1 литр раствора. Для этого нужно умножить значение концентрации (в молях ионов на литр) на соответствующую массу ионов ( 118 для H+ – на 1, для OH – на 17). Изменение концентрации ионов водорода, а отсюда, естественно, и концентрации ионов гидроксила, приводит к увеличению кислотности (щелочности) среды. [H+]: [OH–] -1 -2 -3 -4 -5 -6 -7 -8 -9 -10 -11 -12 -13 10 10 10 10 10 10 10 10 10 10 10 10 10 10-14 увеличение кислотности увеличение щелочности нейтр. Концентрации ионов водорода, а также и гидроксила, выраженные в молях ионов на литр, обычно составляют малые доли единицы. Пользоваться ими неудобно. Поэтому введены особые единицы измерения концентраций ионов водорода, называемые водородным показателем, и обозначаемые pH. Водородным показателем называется отрицательный десятичный логарифм концентрации ионов водорода. Пример: [H+] = 1 ⋅ 10–7 lg[H+] = –7 [H+] = 1 ⋅ 10–9 lg[H+] = –9 [H+] = 5 ⋅ 10–3 lg[H+] = 0,7 – 3 = –2.3 [H+] = 3 ⋅ 10–7 lg[H+] = 0,48 – 7 = –6.52 [H+] = 2.0 lg[H+] = 0,3 pH = 7,0 pH = 9,0 pH = 2,3 pH = 6,52 pH = –0,3 Аналогично отрицательный десятичный логарифм OH– называется гидроксильным показателем и обозначается pOH. Характер среды, выраженный через pH и pOH, можно показать следующим образом: pH = 7 – среда нейтральная; pOH = 7 -среда нейтральная; pH < 7 – среда кислая; pOH > 7 – среда кислая; pH > 7 – среда щелочная; pOH < 7 – среда щелочная. Зная pH, можно установить pOH, так как pH + pOH = 14. Приближённые значения рН некоторых растворов приведены в таблице 3.9. Таблица 3.9 рН некоторых растворов 119 Раствор рН Концентрированная Раствор рН Дождевая вода 6,5 о Соляная кислота –1,1 Чистая вода при 25 С 7,0 1М раствор HСl 0,0 Раствор пищевой соды 8,5 Желудочный сок 1,4 Раствор буры 9,2 Лимонный сок 2,1 Известковая вода 10,5 Апельсиновый сок 2,8 Кровь 7,4 Томатный сок 4,1 1М раствор NaOH 14,0 Молоко 6,9 Насыщенный раствор NaOH ~15,0 Для измерения pH существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, индикаторов, окраска которых меняется в зависимости от концентрации ионов водорода. Кислотно-основной индикатор представляет собой слабую кислоту или основание, которые обладают резко отличающейся окраской в диссоциированном и недиссоциированном состояниях. Чаще всего это сложные органические соединения. На рисунке 3.5 приведена графическая формула индикатора метилового оранжевого Н CH3 120 CH3 CH3 CH3 N N+ C C C C C C C C C C C C N N +H+ N N C C C C C C C C C C C C S S O O O O O O Рис. 3.5. Графическая формула метилового оранжевого индикатора в основной (а) и кислотной (б) формах. Добавление в раствор кислоты смещает равновесие индикатора влево, а добавление щелочи – вправо. Следовательно, метиловый оранжевый имеет красную окраску в кислых растворах и жёлтую в – щелочных. Интенсивность окраски таких индикаторов достаточно велика и хорошо заметна даже при введении небольшого количества индикатора, не способного существенно повлиять на рН раствора. Отношение концентраций диссоциированной и недиссоциированной форм индикатора зависит от концентрации ионов водорода в растворе 121 [H ][Ind ] + КД = − [HInd ] [Ind ] = − Отсюда [HInd ] а, следовательно, . KD , H+ [ ] [Ind ] = pH - pK − lg [HInd ] Для метилового оранжевого КД = 1,6 5 ⋅ 10-4 и рК = 3,8. Это означает, что при рН = 3,8 нейтральная и диссоциированные формы находятся в равновесии в приблизительно равных концентрациях. Наиболее употребительными индикаторами являются: метиловый оранжевый, лакмус, фенолфталеин и другие. Характеристики некоторых индикаторов приведены в таблице 3.10. Таблица 3.10 Характеристики индикаторов Название Фенолфталеин Лакмус Метиловый оранжевый Метиловый фиолетовый Бромкрезоловый зелёный Бромтимоловый Тимоловый синий 122 Цвет индикатора в различных средах бесцветный бледнорН < 8 малиновый 8.0 < pH < 9.8 красный фиолетовый рН < 5 5 < рН < 8 красный оранжевый рН < 3.1 3.1 < рН < 4.4 жёлтый фиолетовый рН = 0 рН> 3 жёлтый синий рН < 3,8 рН > 5,6 жёлтый синий рН < 6 pH > 7,7 красный жёлтый Рн < 0,5 2,5 < pH < 7,9 малиновый pH > 9.8 синий рН > 8 желтый рН > 4.4 синий pH > 7,9 Для многих процессов величина pH имеет большое значение. pH крови человека и животных имеет строго постоянное значение. Растения могут развиваться в определенном интервале pH, характерном для данного вида растений. Например, pH крови 7.34 (артериальная) и 7.4 (венозная). Повышение pH крови хотя бы на 0.1 ведет к тяжёлому заболеванию. Растения развиваются при определенных значениях pH. Микроорганизмы также развиваются при определенных pH. Так, актиномицеты, ацидофилы, грибковые бактерии растут при pH = 4-6. Все болезнетворные микробы развиваются при pH 7.3-8.0. Даже для деления микробов используют различия в pH их жизнедеятельности. Произведение растворимости Закон действующих масс можно применить и к гетерогенным системам – насыщенному раствору труднорастворимого сильного электролита (насыщенный раствор находится в равновесии с твердой фазой). Так, например, в насыщенном растворе хлорида серебра существует равновесие Kравн AgCl ↔ Ag+ + Cl– = [Ag+][Cl–]/[AgCl], [AgCl] = const, Kравн[AgCl] = [Ag+][Cl–] = ПР. В общем случае для труднорастворимого электролита сосотава AnBm в растворе наблюдается равновесие: Тогда AnBm = nA+ + mB–. ПР = [A+]n[В–]m. Величина ПР означает, что в насыщенном растворе труднорастворимого электролита произведение концентраций его ионов есть величина постоянная (при данной температуре). Произведение растворимости характеризует растворимость вещества. Чем больше ПР, тем больше растворимость. AgCl AgBr ПР при 25 °С 1.78 ⋅ 10–10 3 ⋅ 10–13 123 AgI 8.3 ⋅ 10–17 Из величины ПР вытекает условие образования и растворения осадка: n m 1. Если [A+] [В–] = ПР, то осадок находится в равновесии с раствором; 2. Если [A+]n[В–]m > ПР, то осадок выпадает; 3. Если [A+]n[В–]m < ПР, то осадок растворяется. Пример: Выпадут ли в осадок CaSO4 и CaCO3, если смешать равные объемы 0.001 М растворов Na2SO4 и CaCl2, Na2CO3 и CaCl2? [Ca2+] = [SO42–] = [CO32–] = 10–3 моль/л – концентрация ионов в исходных растворах. При смешении растворов происходит их разбавление в два раза, и концентрации ионов становятся равными [Ca2+] = [SO42–] = [CO32–] = 10–3/2 = 5 ⋅ 10–4 моль/л; ПРCaSO4 = 9,1 ⋅ 10–6. Тогда [Ca2+][SO42–] = 5,4 ⋅ 10–4 ⋅ 5 ⋅ 10–4 = 2,5 ⋅ 10–7. Следовательно, [Ca2+][SO42–] < ПРCaSO4 – осадок не образуется. ПРСaCO3 = 4,8 ⋅ 10–9. Тогда [Ca2+][CO32–] = 2,5 ⋅ 10–7 > ПР – осадок выпадает. Величина ПР позволяет вычислить растворимость малорастворимого соединения. Пример: Вычислить растворимость иодида серебра AgI ↔ Ag+ + I–. ПРAgI = 8,3 ⋅ 10–17; [Ag+] = [I–]; [Ag+][I–] = 8,3 ⋅ 10–17; [Ag+]2 = 8,3 ⋅ 10–17; [Ag+] = (8,3 Ч 10–17)1/2 = 9 ⋅ 10–8= S. С помощью ПР можно более полно осадить вещество. Зная растворимость соли, можно определить ПР. Пример: Вычислить величину произведения растворимости Ag2CrO4, если растворимость этой соли равна 0.025 г/л. Ag2CrO4 ↔ 2Ag+ + CrO42–; ПР = [Ag+]2 [CrO42–] [CrO42–] =S; [Ag+] = 2S; S = 0,025/331,8 = 7,53 ⋅10–5 моль/л; ПР = (2 ⋅ 7,53 ⋅ 10–5)2(7,53 ⋅ 10–5) = 1,69 ⋅ 10–12. Зная ПР, можно объяснить, почему одни вещества растворяются, а 124 другие – нет. И наоборот, легко объяснить, почему одни вещества выпадают в осадок, а другие – нет. Пример: Почему FeS растворяется в соляной кислоте, а СuS – нет? FeS + 2HCl = FeCl2 + H2S, CuS + HCl ≠. Величины значений ПРFeS = 3,7⋅105–19, ПРCuS = 8,5⋅10–45.Отсюда следует, что в случае сульфида меди в насыщенном растворе находится очень мало ионов S2–, и молекулы H2S не будут образовываться, а, следовательно, равновесие в насыщенном растворе сульфида меди не будет нарушаться. Осадок не будет растворяться. В случае же сульфида железа сульфид-ионов достаточно для образования молекул H2S, и равновесие сдвигается вправо. Осадок сульфида железа растворяется. Пример: Почему FeS не осаждается из раствора с помощью H2S и осаждается раствором (NH4)2S? FeCl2 + H2S ≠ FeCl2 + (NH4)2S = FeS + 2NH4Cl. Сероводородная кислота является слабой (К2 = 1 ⋅ 10–14). Отсюда ионов S2- недостаточно для выполнения условия [Fe2+][S2–] > ПР, и осадок не выпадает. Сульфид аммония – сильный электролит, и сульфид-ионов достаточно для выполнения вышеуказанного условия. А это приводит к выпадению осадка. Произведение растворимости можно использовать для селективного разделения ионов осаждением из растворов. Пример: Можно ли осадить отдельно ионы Ba2+ и Sr2+ из раствора, содержащего 0,010 моль/л BaCl2 и 0,020 моль/л SrCl2, используя концентрированный раствор Na2SO4? Какой ион будет осаждаться первым? ПР сульфатов бария и стронция определяется соотношениями ПР = [Ba2+][SO42–] = 1,5 ⋅ 10–9; ПР = [Sr2+][SO42–] = 7,6 ⋅ 10–7. Следовательно, осаждение сульфата бария при наличии 0,010 моль/л ионов Ва2+ не будет происходить до тех пор, пока концентрация иона SO42- не достигнет величины 125 1,5 ⋅ 10–9 [SO42–] = = 1,5 ⋅ 10–7 моль/л. 0,010 Осаждение сульфата стронция начнётся при концентрации сульфатиона, равной 7,6 ⋅ 10–7 2– [SO4 ] = = 3,8 ⋅ 10–5 моль/л. 0,020 Следовательно, ионы бария начнут осаждаться первыми. При достижении концентрации сульфат-ионов величины 3,8⋅10–5 моль/л начнётся осаждение сульфата стронция. К тому времени в растворе останется 1,5 ⋅ 10–9 [Ba ] = = 3,9 Ч 10–5 моль/л. 3,8 ⋅ 10–5 2+ Это составит только 0,39% от исходного количества ионов бария. Остальные 99,6% ионов бария будут осаждены до начала выпадения осадка сульфата стронция. Произведения растворимости некоторых веществ приведены в таблице 3.11. Таблица 3.11 Произведения растворимости некоторых веществ при 25°С Вещество BaF2 MgF2 PbF2 PbCl2 PbBr2 PbI2 AgCl AgBr AgI SrCrO4 BaCrO4 Hg2CrO4 Ag2CrO4 126 ПР 2,4.10-4 8.10-8 4.10-8 1,6.10-5 4,6.10-6 8,3.10-9 1,7.10-10 5,0.10-13 8,5.10-17 3,6.10-5 8,5.10-11 2,0.10-9 1,9.10-12 Вещество CaF2 SrF2 Hg2Cl2 Hg2Br2 Hg2I2 CaSO4 SrSO4 BaSO4 Ag2SO4 PbSO4 Ca(OH)2 Sr(OH)2 Ba(OH)2 ПР 3,9.10-11 7,9.10-10 1,1.10-18 1,3.10-22 4,5.10-29 2,4.10-5 7,6.10-7 1,5.10-9 1,2.10-5 1,3.10-8 1,3.10-6 3,2.10-4 5,0.10-3 PbCrO4 Ag2CO3 2,0.10-16 8,2.10-12 Hg2CO3 MgCO3 CaCO3 SrCO3 BaCO3 NiCO3 FeCO3 CuCO3 ZnCO3 CdCO3 MnCO3 PbCO3 Ag2S Bi2S3 MnS FeS NiS CoS ZnS CuS HgS 9,0.10-15 1,0.10-16 4,7.10-9 7,0.10-10 1,6.10-9 1,4.10-7 2,1.10-11 2,5.10-10 2,0.10-10 5,2.10-12 8,8.10-11 1,5.10-15 5,5.10-51 1,6.10-72 7,0.10-16 4,0.10-19 3,0.10-21 5,0.10-22 2,5.10-22 8,0.10-37 1,6.10-54 Mg(OH)2 8,9.10-12 AgOH 2,0.10-8 продолжение таблицы 3.11 Cu(OH)2 1,6.10-19 Fe(OH)2 1,8.10-15 Co(OH)2 2,5.10-16 Ni(OH)2 1,6.10-16 Mn(OH)2 2,0.10-13 Fe(OH)3 6,0.10-38 Co(OH)3 2,5.10-43 Cr(OH)3 6,7.10-31 Al(OH)3 5,0.10-33 Zn(OH)2 4,5.10-17 Cd(OH)2 2,0.10-14 Hg(OH)2 3.10-26 Pb(OH)2 4,2.10-15 Sn(OH)2 3,0.10-27 SnS 1,0.10-26 CdS 1,0.10-28 PbS 7,0.10-29 Ag3PO4 1,8.10-18 Ca3(PO4)2 1,3.10-32 Sr3(PO4)2 1,0.10-31 Ba3(PO4)2 6,0.10-39 Pb3(PO4)2 1,0.10-54 Гидролиз При растворении большинства солей в воде происходит разложение их с нарушением равновесия диссоциации воды за счет связывания ионов H+ или OH– воды, т.е. вода способна разлагать растворенные вещества, действуя на них как кислота или основание. PCl3 + 3H2O = H3PO3 + 3HCl; Al2S3 + 6H2O ↔ 2Al(OH)3 + 3H2S. При этом изменяется кислотность растворов по сравнению с кислотностью растворителя. Это явление получило название гидролиз. В общем случае гидролиз – это разложение веществ водой. Вода – одно из самых активных веществ. Она действует на самые различные классы соединений. Но мы не будем рассматривать влияние воды на все вещества, а изучим только действие воды на соли. Ионы соли, попав в воду, 127 гидратируются, и многие из них активно взаимодействуют с молекулами воды. При этом взаимодействии нарушается ионное равновесие воды и изменяется кислотность раствора. Соль гидролизуется. Гидролизом соли называется обратимое взаимодействие ионов соли с ионами воды, приводящее к изменению равновесия между ионами водорода и гидроксида в растворе. Гидролиз солей идет лишь в тех случаях, когда в результате реакции образуются малодиссоциирующие соединения. Гидролиз – процесс обратимый, поэтому к нему применим закон действующих масс. Количественными характеристиками гидролиза являются степень гидролиза и константа гидролиза. число гидролизованных молекул Степень гидролиза = . общее число молекул Чем слабее кислота или основание, образующие соль, тем больше степень гидролиза. Известно несколько случаев гидролиза солей. 1. Соль образована сильным основанием и слабой кислотой. Na2CO3 + H2O ↔ NaOH + NaHCO3, CO 2– + H O ↔ HCO – + OH–. 3 2 3 Реакция среды стала щелочной. Вода, хоть и в малой степени, диссоциирует по уравнению H2O ↔ H+ + OH–. Карбонат-ионы, связывая ионы водорода, сдвигают равновесие диссоциации воды вправо. Диссоциация слабых электролитов, образованных многоосновными кислотами, идет ступенчато: H2CO3 ↔ H+ + HCO3–; НCO ` ↔ H+ + CO 2–; 3 3 Kд = 4,2 ⋅ 10–7; Kд = 4,7 ⋅ 10–11. Отсюда видно, что второй ион водорода удерживается кислотным остатком гораздо прочнее, чем первый. Поэтому присоединение ионов водорода по первой ступени гидролиза выражено сильнее, чем по второй: NaHCO3 + H2O ↔ OH–+ H2CO3; 128 HCO3– + H2O ↔ OH– + H2CO3, т. е. гидролиз для Na2CO3, а также для других солей многоосновных кислот чаще всего идет по первой ступени, реже по второй, и в обычных условиях не идет по третьей. Кроме того, при гидролизе образуются ионы OH–, накопление которых, в соответствии с принципом Ле Шателье, препятствует гидролизу. Поэтому гидролиз солей, образованных сильным основанием и слабой кислотой, подавляется прибавлением щелочи. Выведем выражение для константы гидролиза соли слабой кислоты и сильного основания: NaCN + H2O ↔ NaOH + HCN; + Na + CN– +H2O ↔ Na+ + OH– + HCN; CN– + H2O ↔ HCN + OH– ; Kравн = [HCN][OH– ]/[CN– ][H2O]. [H2O] имеет наибольшую величину, которая в ходе реакции практически не изменяется, поэтому ее можно условно считать постоянной. Тогда Kравн [H2O] = [HCN][OH–]/[CN–] = Kгидр. Обозначим [OH–] = Kw/[H+], тогда Kгидр = [HCN]H2O/[H+][CN–] = Kw/Kд.кисл, так как [HCN]/[H+][CN–] = 1/Kд.кисл. 2. Соль образована слабым основанием и сильной кислотой. NH4Cl + H2O ↔ NH4OH + HCl; NH4+ + H2O ↔ NH4OH + H+. Гидролизу подвергается катион, среда становится кислой. Следовательно, добавление H+ сдвигает равновесие влево. Соли многоосновных кислот или многовалентных металлов гидролизуются ступенчато: а) ZnCl2 + H2O ↔ ZnOHCl + HCl; 129 Zn2+ + 2Cl– + H2O ↔ ZnOH+ + Cl–+ H+ + Cl–; Zn2+ + H2O ↔ ZnOH+ + H+; б) ZnOHCl + H2O ↔ Zn(OH)2 + HCl; ZnOH+ + Cl–+ H2O ↔ Zn(OH)2 + H+ + Cl-; ZnOH+ + H2O ↔ Zn(OH)2 + H+. Уравнение для константы гидролиза соли слабого основания и сильной кислоты можно вывести на cледующем примере: NH4Cl + H2O ↔ NH4OH + HCl; NH4+ + H2O ↔ H4OH + H+; Kравн = [NH4OH][H+]/[NH4+][H2O]; Kравн[H2O] = [NH4OH][H+]/[NH4+] = Kгидр. Так как то [H+] = Kw/[OH-] Kгидр = [NH4OH]Kw/[NH4+][OH–] = Kw/Kд.осн. 3. Соль образована слабой кислотой и слабым основанием. В данном случае возможны два варианта: а) соль образована слабой кислотой и слабым основанием одинаковой силы Так как NH4CH3COO + H2O ↔ NH4OH + CH3OOH. Kд.осн.= 1.8 ⋅ 10–5 и Kд.кисл.= 1.8 ⋅ 10–5, то среда остается нейтральной; б) соль образована слабой кислотой и слабым основанием разной силы NH4CN + H2O ↔ NH4OH + HCN, Kд.кисл. 0= 5 ⋅ 10–10. Kд.осн. = 1,8 ⋅ 10–5 Так как гидролизу подвергаются и катион, и анион, то реакция идет до конца. Гидролизу катиона способствует гидролиз аниона и наоборот. Ионы H+ связываются прочнее в HCN, чем ионы OH в NH4OH, поэтому ионов OH в растворе будет больше, чем ионов H+, и среда будет сла130 бощелочной. Если же кислота будет сильнее, чем основание, то среда будет слабокислой. Выведем выражение для константы гидролиза соли слабой кислоты и слабого основания. NH4CN + H2O ↔ NH4OH + HCN; NH4+ + CN` + H2O ) NH4OH + HCN; [NH4OH][HCN] Кравн. = . [NH4+][CN-][H2O] [NH4OH][HCN] Кгидр. = . [NH4+][CN-] Умножим числитель на Kw, а знаменатель – на [OH ][H+], тогда [NH4OH][HCN] Kw K w Кгидр. = = . [NH4+][CN ][OH ][H+] Kд.оснKд.кисл. Отсюда Константа гидролиза, степень гидролиза и концентрация соли связаны между собой. Если в общем случае исходную концентрацию аниона слабой кислоты обозначить через С (моль/л), то Ch (моль/л) – концентрация той части аниона A–, которая подверглась гидролизу и образовалось Ch (моль/л) слабой кислоты HA и Ch (моль/л) гидроксидных групп. С [A–] + H2O ↔ HA + OH–, C-Ch Ch Ch тогда Kгидр = [HA][OH–]/[A–] = Ch ⋅ Ch/(C-Ch) = Ch2/1-h. h = (Kгидр/C)1/2. При h ≤ 1 Kгидр = Ch2 Можно рассчитать pH раствора, если известны C и h. Учитывая, что [HA] = [OH ] = Ch, получим: Kгидр = Ch ⋅ Ch/C = [OH–]2/C, откуда [OH–] = (Kгидр ⋅ C)1/2. Для раствора соли слабого основания и сильной кислоты [H+] = (Kгидр ⋅ C)1/2. 131 Если же нельзя пренебречь h, то следует пользоваться формулой h = (Kгидр + (K2гидр + 4KгидрC)1/2)/2C. Тогда [H+] = (-Kгидр + (K2гидр + 4KгидрC)1/2)/2; [OH–] = (-Kгидр + (K2гидр +4KгидрC)1/2)/2. Пример 1. Какова степень гидролиза ацетата натрия в 0.1 М растворе? Каков рН такого раствора? Kгидр = [CH3COOH][OH–]/[CH3COO–] = Kw/Kд.кисл = = 10–14/10–5 = 10–10 [CH3COOH] = [OH–], и каждая из этих величин равна той части моля соли, которая поверглась гидролизу. Отсюда [CH3COO–] = 0.1 моль/л hгидр = (Kгидр/C)1/2 = (5,5 ⋅ 10–10/0,1)1/2 = 10–5; Kгидр = [OH–]2/C; – [OH ] = (5,5 ⋅ 10–10 ⋅ 0,1)1/2 = 7,4 ⋅ 10–6. pOH = 6 – lg7.4 = 5.1 и pH = 14 – 5.1 = 8.9. Пример 2. Вычислить KГИДР, pH и h 0.01 М раствора CH3COONH4. Kгидр = Kw/Kд.кислKд.осн = 10–14/1,8 ⋅ 10–5 ⋅ 1,8 ⋅ 10–5 = 10–5; CH3COO– + NH4+ + H2O ) NH4OH + CH3COOH; h = (Kгидр/C)1/2 = (3,7 Ч 10–7/0,01)1/2 = 3,1 ⋅ 10–3; [H+] = (KwKосн/Kкисл)1/2 = 10–7 pH = 7. 132 Контрольные вопросы 1. Какие процессы сопровождают растворение твёрдых веществ в жидкостях? 2. Почему вода является одним из самых лучших растворителей? 3. Почему в воде лучше растворяются органические спирты, чем предельные углеводороды? 4. Как зависит растворимость газов в воде от давления и температуры? 5. Как влияет природа растворителя на процесс растворения веществ? 6. Каким образом гидратация влияет на растворение солей? 7. Как влияет температура на растворимость твёрдых веществ в воде? 8. Какие способы выражения концентраций растворов известны? 9. Какие растворы называют изотоническими? 10. Как связано осмотическое давление раствора с температурой и концентрацией? 11. Почему растворы кипят при более высокой, а замерзают при более низкой температуре, чем чистый растворитель? 12. Какие растворы называют идеальными? 13. Чем определяется интенсивность и направление осмоса? 14. Зависят ли криоскопическая и эбулиоскопическая константы от природы растворённого вещества? 15. Чем отличаются свойства растворов электролитов от растворов неэлектролитов? 16. Почему для сильных электролитов используют понятие "кажущаяся" степень диссоциации? 17. Какое влияние оказывает на диссоциацию диэлектрическая проницаемость растворителя? 18. Почему хлорид натрия является сильным электролитом в водных растворах и слабым в спиртовых? 19. Чем отличается ионная пара от молекулы и иона? 20. Каким образом по величине константы диссоциации отнести электролиты к средним, слабым и сильным? 21. Какой процесс называется высаливанием? 22. Что называется ионным произведением воды? 133 23. Что представляет собой шкала рН? 24. Какие значения рН имеют кислоты, щелочи? 25. Возможно ли полное отсутствие ионов Н+ или ОН в концентрированных растворах кислот или щелочей? 26. Каким образом рассматривается понятие "кислота" в теории Аррениуса и в теории Бренстеда-Лоури? А в теории Льюиса? 27. Какими способами можно определить рН раствора? 28. Какие вещества используют в качестве индикаторов при кислотно-основном титровании? 29. Почему при титровании сильной кислоты сильным основанием выбор индикатора не имеет большого значения, а при титровании слабой кислоты выбор индикатора имеет существенное значение? 30. Почему возможно применение закона действующих масс к описанию равновесия в насыщенном растворе труднорастворимого электролита? 31. Какие проблемы позволяет решить знание ПР труднорастворимого вещества? 32. Что называется гидролизом соли? 33. Чем отличается гидролиз соли от гидролиза хлорангидрида? 34. Как связаны константы гидролиза с константами диссоциации кислот и оснований, образующих соль? 35. Как связаны константа гидролиза с концентрацией раствора и степенью гидролиза? 36. Почему соли сильных кислот и оснований не подвергаются гидролизу? 37. Каково соотношение между растворимостью и ПР для СаСО3? Задачи 1. Какова молярность 32% раствора КОН ( ρ = 1,31 г/мл)? 2. Сколько миллилитров 0,4 М раствора HCl надо прилить к раствору нитрата серебра для получения 0,2866 г AgCl? 3. Вычислите осмотическое давление 4% раствора сахарозы при 20°С. Плотность раствора равна 1,014 г/мл. 4. Вычислить давление пара 10% водного раствора мочевины при 100 °С. 5. При какой температуре будет замерзать 20% раствор этилового спирта в воде? 6. Найти температуру кипения раствора хлорида аммония, если в 134 200 г воды растворить 1,07 г NH4Cl. Кажущаяся степень диссоциации равна 80% (Еэбул.=0,52). 7. Вычислить степень диссоциации и концентрацию ионов водорода в 0,03 М растворе HF (КД = 3,53 ⋅ 10-4). 8. Для нейтрализации 30 мл 0,1 М раствора щелочи потребовалось 12 мл кислоты. Определить молярность кислоты. 9. Во сколько раз изменится концентрация гидроксид-ионов при изменении рН на две единицы? 1О. Определите рН 0,025% раствора HCl. Плотность раствора примите равной единице. 11. В каком направлении изменится рН чистой воды при прибавлении к ней следующих веществ: a) HCN; б) NaCN; в) NaCl? 12. Константа диссоциации мышьяковой кислоты равна 6,0 ⋅ 10-10. Определите рН и рОН 0,01 М раствора этой кислоты. 13. Написать уравнения гидролиза солей K2CO3, Cu(NO3)2. Укажите рН в растворах этих солей. 14. Не производя расчётов, указать, в каком из растворов двух солей равной концентрации рН больше или меньше: a) Na2CO3 и NaHCO3; б) NaClO и NaClO3. 15. Вычислить константу гидролиза, степень гидролиза и рН 0,05 М раствора хлорида аммония (КД = 1,8 ⋅ 10–5). 16. Как изменяется сила кислот в ряду HClO – HClO2 – HClO3 – HClO4? Почему? 17. Какой из анионов Cl , Br , I наиболее чувствителен для обнаружения ионов серебра в растворе? 18. Останется ли прозрачным фильтрат из-под осадка PbCl2, если к нему добавить раствор иодида калия? 19. Какова растворимость CoS ( в моль/л) в чистой воде? Чему будет равна растворимость CoS в 0,1 М растворе Na2S? 20. Растворимость фосфата серебра Ag3PO4 при 20 °С в воде равна 0,0067 г/л. Определите произведение растворимости этой соли. Дополнительная литература 1. Ахметов Н.С. Общая и неорганическая химия. М.: Высш. школа, 1987. 364 с. 2. Дикерсон К., Селбин Д. Теоретическая неорганическая химия. М.: Химия, 1979. 289 с. 135 3. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.: Мир, 1982. Т.1. С. 206 – 266. Т. 2. С. 119 – 155. 4. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия. 1981. 563 с. 5. Крестов Г.А. Теоретические основы неорганической химии. М.: Высш. школа, 1982. 275 с. 6. Крестов Г.А., Березин Б.Д. Основные понятия современной химии. Л.: Химия, 1986. 306 с. 7. Мартыненко Л.И., Спицын В.И. Методические аспекты курса неорганической химии. М.: Изд-во МГУ, 1983. 187 с. 8. Угай Я.А. Общая химия. М.: Высш. школа. 1977. С. 206-247. 9. Спицын В.И., Мартыненко Л.И. Неорганическая химия. М.: Издво МГУ, 1991. Ч. 1. С. 424-459. 136 Окислительно-восстановительные реакции Реакции, сопровождающиеся изменением степеней окисления элементов, называются окислительно-восстановительными. Название сложилось исторически с давних пор, когда стали известны реакции окисления металлов кислородом и их восстановления из оксидов. В настоящее время к реакциям восстановления и окисления относят не только реакции с кислородом, но и все реакции, сопровождающиеся передачей электронов. Окислителем называется вещество, в составе которого есть элемент, принимающий электроны. Восстановителем называется вещество, в составе которого есть элемент, отдающий электроны. Типичными окислителями являются вещества, в составе которых есть элементы в высшей степени окисления. Например: KMnO4, NaNO3, KClO4. Типичными восстановителями являются вещества, содержащие элементы в низшей степени окисления. Например: NH3, H2S, KI и другие галогениды. Вещества, содержащие элементы в промежуточных степенях окисления, проявляют окислительно-восстановительную двойственность, т.е. могут быть и окислителями и восстановителями в зависимости от реагента. Например: NaNO2, Na2SO3, NaClO и т.д. Каждая окислительно-восстановительная реакция состоит из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые составляют единый процесс. Восстановитель в результате реакции окисляется, а окислитель – восстанавливается. Если цинковую пластинку поместить в раствор сульфата меди, то через некоторое время будет заметно растворение цинка и выделение меди на поверхности цинковой пластинки, т.е. будет протекать следующая реакция: Zn + CuSO4 = ZnSO4 + Cu, или в ионном виде: Zn + Cu2+ = Zn2+ + Cu. Конечно, мы привели схему процесса. В реальном процессе ионы окружены гидратными оболочками, т.е. являются гидратированными. Расчет термодинамических характеристик данной реакции показывает, что ∆H°298 = –216,8 кДж/моль, ∆S°298 = –16,1 э.е. Отсюда ∆G = –21680 + 137 16,1T. При стандартных условиях константа равновесия этой реакции равна K= C Zn 2 + C Cu 2+ = 10 37. Такое высокое значение константы равновесия указывает на практическую необратимость данной реакции. Если разделить реакцию цинка с раствором сульфата меди на две полуреакции и провести их раздельно в приборе, изображенном на рисунке 3.8, то можно получать полезную работу. Соляной мостик Zn Cu 2+ Zn 2SO4 Рис. 3.8. Схема гальванического элемента Если растворы, содержащие цинковую и медную пластинки, не соединены солевым мостиком, то в каждом из них протекают следующие процессы: полуреакция растворения цинка Zn = Zn2+ + 2e; DG0 = -152420 + 48,1T; полуреакция растворения меди Сu = Cu2+ + 2e; DG0 = 64390 + 132T. Оба эти процесса являются строго равновесными. Константа равновесия цинка в растворе достаточно велика, при стандартных условиях К = 1019. Так как водные растворы не обладают электронной проводимостью, то освобождающиеся электроны накапливаются на поверхности цинка, создавая строго определенную равновесную концентрацию. На 138 поверхности цинка создается отрицательный заряд или потенциал Е1. Вследствие электростатического притяжения электронов в металле и ионов в растворе на границе двух сред возникает двойной электрический слой. Медная пластинка тоже равновесна в водном растворе СuSO4, но константа этого равновесия при тех же условиях очень мала: К = 1018 . Поэтому концентрация электронов на медной поверхности намного меньше, чем на цинковой. Это приводит к тому, что потенциал медной пластинки Е2 должен быть более положительным по сравнению с потенциалом цинковой пластинки. Если эти две полуреакции соединить солевым мостиком, а цинковую и медную пластинки металлическим проводником, то электроны будут перемещаться от того элементa, где их избыток, к тому элементу, где их недостаток. Возникнет электрический ток. Замкнутая неравновесная система называется гальваническим элементом. Для восстановления равновесного потенциала цинкового электрода цинк переходит в раствор, медь для восстановления своего равновесного потенциала должна выделяться из раствора. Разность потенциалов между электродами (цинком и медью) ∆Е = Е2 – E1 называется электродвижущей силой, а величины Е1 и Е2 – электродными потенциалами. В элементах, подобных изображенному на рисунке 3.8, можно использовать и другие комбинации металлов. Если в качестве пары металлов взять никель и медь, то никель окисляется на аноде, а ионы меди восстанавливаются на катоде. Элемент в этом случае имеет эдс Е = 0,57 В. Если же используются цинк и никель, то цинк окисляется, а ионы никеля восстанавливаются, и эдс этой системы равен 0,53 В (при концентрации ионов в растворе, равной 1 моль/л). Электродвижущие силы гальванических элементов обладают таким же свойством аддитивности, как и реакции Ni + Cu2+ = Ni2+ + Cu Zn + Ni2+ = Zn2+ + Ni Zn + Cu2+ = Zn2+ + Cu E0 = +0,57 B E0 = +0,53 B E0 = +1,10 B. Положительный знак эдс означает, что электрохимическая реакция самопроизвольно протекает слева направо. Символ Е0 означает стандартный потенциал, соответствующий 1 М концентрации реагирующих ионов и температуре 298 К. 139 Водородный электрод Электродные реакции не обязательно должны протекать на металлах. На рисунке 3.9 изображен гальванический элемент, в котором катодная реакция представляет процесс восстановления водорода 2H+ + 2e = H2 e _ H2 (г) Zn (анод) Zn 2+ 2_ SO4 2 H _ 2 SO4 Платиновый электрод (катод) Рис. 3.9. Гальванический элемент с водородным электродом В гальваническом элементе с водородным электродом протекают следующие реакции: На аноде: Zn(тв.) → Zn2+ + 2e На катоде: 2H+ + 2e → H2(г.) Полная реакция: Zn(тв.) + 2H+ → Zn2+ + H2 (г.) Такая же полная реакция протекает при погружении полоски металлического цинка в раствор серной кислоты. Металл растворяется в кислоте, а газообразный водород выделяется на катоде. Водородный электрод используется в электрохимии в качестве стандартного, его электродный потенциал при стандартных условиях принимается равным нулю. Основой водородного электрода служит пластинка черненой платины, погруженной в 1 М раствор серной кислоты. Через раствор непрерывно пропускают газообразный водород под давлением 1013 гПа (1 атм). Мелкодисперсная платина хорошо адсорбирует водород на своей поверхности. В растворе устанавливается равновесие: 140 H+ + e → 1/2H2. Относительно такого электрода, который является международным электродом сравнения, определяют потенциалы других электродов. Электродные потенциалы, определенные относительно стандартного водородного электрода при стандартных условиях (температура 298 К и давление 1013 гПа), называются стандартными электродными потенциалами. В таблице 3.15 приведены стандартные электродные потенциалы некоторых электродных реакций. Таблица 3.15 Стандартные электродные потенциалы в водных растворах некоторых веществ при 298 К Полуреакция Кислая среда F2 + 2e → 2FAg2+ + e → Ag+ H2O2 + 2H+ + 2e → 2H2O PbO2 + 4H+ + SO42- + 2e → PbSO4 + 2H2O MnO4– + 4H+ + 3e → MnO2 + 2H2O MnO4– + 8H+ + 5e → Mn2+ + 4H2O PbO2 + 4H+ + 2e → Pb2+ + 2H2O Cl2 + 2e → 2ClCr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O O2 + 4H+ + 4e → 2H2O MnO2 + 4H+ + 2e →Mn2+ + 2H2O Br (ж) + 2e → 2Br2 AuCl4– + 3e → Au + 4Cl– NO3– + 4H+ + 3e → NO + 2H2O 2Hg2+ + 2e → Hg22+ Ag+ + e → Ag Hg22+ + 2e → 2Hg Fe3+ + e → Fe2+ O2 + 2H+ + 2e → H2O2 MnO4– + e → MnO42– I2 + 2e → 2I– Cu+ + e → Cu Е0298, В 2,87 1,99 1,78 1,69 1,68 1,49 1,46 1,36 1,33 1,23 1,21 1,09 0,99 0,91 0,80 0,80 0,77 0,68 0,68 0,56 0,54 0,52 0,34 141 Cu2+ + 2e → Cu Hg2Cl2 + 2e → 2Hg + 2Cl– AgCl + e → Ag + Cl– SO42- + 4H+ + 2e → H2SO3 + H2O Cu2+ + e → Cu+ 2H+ + 2e → H2 Pb2+ + 2e → Pb Sn2+ + 2e → Sn Ni2+ + 2e → Ni PbSO4 + 2e → Pb2+ + SO42– Cd2+ + 2e →Cd Cr3+ + e → Cr2+ Fe2+ + 2e → Fe Zn2+ + 2e → Zn Mn2+ + 2e → Mn Al3+ + 3e → Al H2 + 2e → 2HMg2+ + 2e → Mg La3+ + 3e → La Na+ + e → Na Ca2+ + 2e → Ca Ba2+ + 2e → Ba K+ + e → K Li+ + e → Li Щелочная среда H2O2 + 2e → 2OHMnO4– + 2H2O + 3e → MnO2 + 4OH– O2 + 2H2O + 4e → 4OH– HgO + H2O + 2e → Hg + 2OH– MnO2 + H2O + 2e → Mn(OH)2 + 2OH– S + 2e → S– Pb(OH)2 + 2e → Pb + 2OH– Cd(OH)2 + 2e → Cd + 2OH– SO42– + H2O + 2e → SO32– + 2OH– Zn(NH3)42+ + 2e → Zn + 4NH3 Zn(OH)42– + 2e → Zn + 4OH– Mg(OH)2 + 2e → Mg + 2OH– 142 0,34 0,27 0,22 0,20 0,16 0,00 –0,13 –0,14 –0,23 –0,35 –0,40 –0,41 –0,41 –0,76 –1,03 –1,71 –2,23 –2,37 –0,37 –2,71 –2,76 –2,90 –2,92 –3,04 0,87 0,59 0,40 –0,098 –0,60 –0,54 –0,76 –0,92 –1,03 –1,04 –1,25 –2,67 –3,02 Ca(OH)2 + 2e → Ca + 2OH– Когда электрический заряд величиной q самопроизвольно перемещается между точками с разностью потенциалов Е вольт, он выполняет внешнюю электрическую работу WВНЕШН. = qE. Поэтому изменение изобарно-изотермического потенциала системы, в которой происходит перемещение электрического заряда, равно ∆G = WВНЕШН = –qE. Так как электрон имеет отрицательный заряд, он должен самопроизвольно перемещаться из области с низким потенциалом в область с высоким потенциалом. Для электрона, перемещаемого между точками с разностью потенциалов Е в направлении повышения потенциала, изменение свободной энергии равно Для моля электронов ∆G = -eE. ∆G = -NeE = -FE, где N – число Авогадро, F = Ne – заряд одного моля электронов, равный 96485 Кл, или 1 фарадею. Если на моль реакции приходится n электронов ( т.е. заряд nF фарадеев на моль), изменение свободной энергии составляет ∆G = – nFE. Отсюда Е = – ∆G/nF. Реакция в гальваническом элементе (его называют элементом Даниэля) Zn(тв.) + Сu2+ → Zn2+ + Cu(тв.) создает стандартное напряжение элемента 1,10 В. Следовательно, эта реакция должна иметь стандартный изобарно-изотермический потенциал, равный ∆G = –2(96500)(+1,10) = –212300 Дж/моль, n – число электронов, перемещающихся в реакции на каждый ион. Аналогично можно рассчитать изменение изобарно-изотермического потенциала для других окислительно-восстановительных реакций. 143 Международный союз по чистой и прикладной химии (ИЮПАК) принял решение, что электродные потенциалы следует записывать как потенциалы восстановления. Термином "электродный потенциал" следует обозначать величины, имеющие знак, соответствующий направлению протекания реакции восстановления. Так, реакцию на цинковом электроде следует записать следующим образом: Zn2+(ГИДР.) + 2e = Zn(тв.), Е0 = –0,763 В. Тогда говорят, что цинк имеет электродный потенциал минус 0,763 В. Если два электродных потенциала объединяют и получают гальванический элемент, который используют в качестве электрической батареи, то электрод, имеющий более отрицательный потенциал, считают отрицательным электродом, так как он является источником электронов. Для подсчета эдс элемента на основании стандартных электродных потенциалов следует от из величины потенциала более положительного электрода вычесть значение электродного потенциала менее положительного электрода. Например, гальванический элемент, составленный из натриевого и цинкового электродов, имеет эдс. E0Na-Zn = E0Zn - E0Na = -0,763 B - (-2,71 B) = + 1,95 B, т.е. натрий выступает в качестве анода, а цинк – в качестве катода. Величины электродных потенциалов существенно зависят от температуры и концентрации окислителя и восстановителя. Зта зависимость хорошо описывается уравнением Нернста: E = E0 + RT C ln ок . , nF С восст . где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная; Т – абсолютная температура; n – число электронов, участвующих в электродном процессе; F – число Фарадея; CОК. – концентрация окислителя; CВОССТ. – концентрация восстановителя. Если гальванический элемент составлен из одинаковых электродов, помещенных в раствор собственной соли различной концентрации, то такой элемент называется концентрационным. Электродвижущая сила такого элемента определяется соотношением концентраций растворов, так как величина Е° для обоих электродов будет одинаковой: 144 E = E0 + RT C ln . nF С о В стандартных условиях при С = С0 = 1 моль/л Е = Е0. Типы окислительно-восстановительных реакций Окислительно-восстановительные реакции очень распространены. Можно сказать, что большинство химических реакций относится к этому виду. Среди всех окислительно-восстановительных реакций различают три типа: 1. Внутримолекулярные окислительно-восстановительные реакции. К ним относятся реакции, в которых внутри одной молекулы атомы одного элемента являются восстановителями, а атомы другого элемента – окислителями. Например, реакция разложения бихромата аммония: (NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O. В молекуле бихромата аммония атомы хрома в степени окисления, равной шести, являются окислителями, а атомы азота в степени окисления минус три – восстановителями. 2. Реакции самовосстановления – самоокисления. Их часто называют реакциями диспропорционирования. В таких реакциях атомы одного и того же элемента являются и окислителями и восстановителями. Такие реакции достаточно характерны для элементов, образующих соединения в различных степенях окисления. Например, реакция хлора с водой: Cl2 + H2O → HClO + HCl. 3. Межмолекулярные окислительно-восстановительные реакции. В этих реакциях одна из молекул является восстановителем, а другая – окислителем. Например, 2KMnO4 + 10KI + 8H2SO4 → 2MnSO4 + 5I2 + 6K2SO4 + 8H2O Методы уравнивания окислительновосстановительных реакций Определение коэффициентов в уравнениях окислительновосстановительных реакций обычно проводят двумя методами: методом электронного баланса и ионно-электронным методом (метод полуреакций). Метод электронного баланса основан на подсчете числа электро145 нов, теряемых или приобретаемых элементами в окислительновосстановительной реакции, с учетом изменения степеней окисления. Рассмотрим этот метод на примере реакции K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O. Сначала определим элементы, изменяющие степени окисления в ходе реакции. К ним относятся хром и иод. Степень окисления хрома была +6, а стала +3. У иода была степень окисления, равная –1, стала 0. Изменение степеней окисления изобразим в виде схемы: Cr+6 + 3e → Cr+3 2I-1 – 2e → I20 2 3 Вследствие электронейтральности химической реакции число отданных окислителем электронов должно быть равно числу электронов, принятых восстановителем. Поэтому вводятся дополнительные множители, изображаемые справа от схемы перехода электронов за вертикальной чертой. Эти множители и представляют собой коэффициенты при молекулах окислителя и восстановителя. Далее уравнивают число атомов, не принимающих участия в окислительно-восстановительной реакции, т.е. атомов, не изменивших степени окисления. Затем уравнивают ионы кислотных остатков, не изменивших свои заряды. В нашем случае это сульфат-ионы. Следующим действием является уравнивание количества ионов водорода. С целью проверки правильности подбора коэффициентов производят подсчет числа атомов кислорода в левой и правой частях уравнения реакции. Метод электронного баланса основан на учете изменения степеней окисления элементов. Но степень окисления – это условная формальная величина. Она показывает условный заряд, который приобрел бы атом, если бы электронная пара полностью перешла к более электроотрицательному атому. В действительности же даже в ионных соединениях не происходит полного перехода электронной пары к более электроотрицательному атому. Так, в NaCl ионность связи составляет около 80%, а не 100%. В нашем случае атом хрома находится в степени окисления +6. В настоящее время установлено, что связи хром – кислород в хроматах, а также в других подобных соединениях, преимущественно ковалентные, сложные по природе, включающие б-связи и π-связи. Эффективный заряд на атоме хрома в таких соединениях не превышает 2+. В растворах ионы с зарядом более 3+ не могут существовать вследствие большой 146 величины ионного потенциала и сильнейшего поляризующего действия, приводящего к перераспределению электронной плотности между атомами и понижению заряда. Тем не менее термин "степень окисления" широко используется в химии и является удобным при написании уравнений окислительновосстановительных реакции, особенно при сплавлении. Ионно-электронный метод, или метод полуреакций, используется для составления уравнений окислительно-восстановительных реакции в растворах и основан на составлении частных уравнений восстановления окислителя и окисления восстановителя. Затем эти частные уравнения суммируются в общее уравнение. Общий принцип, лежащий в основе метода полуреакций, аналогичен методу электронного баланса. Он также основан на подсчете числа электронов, теряемых восстановителем и приобретаемых окислителем в реакции. Отличие в том, что окислители и восстановители берутся в их действительном виде, в котором они существуют в растворах (ионы, молекулы и т.д.). Кроме того, обязательно учитывается среда, так как проявление окислительных или восстановительных свойств веществами сильно зависит от среды, в которой протекает та или иная реакция. Например, большое влияние оказывает кислотность среды, присутствие комплексообразователя и т.д. Частные уравнения полуреакции составляют, основываясь на общих правилах написания ионных уравнений. Сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные и труднорастворимые вещества записывают в молекулярном виде. В качестве примера рассмотрим взаимодействие перманганата калия с сульфатом железа (II) в кислой среде: 2KMnO4 + 10FeSO4 + 8H2SO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O. Окислителем в этой реакции является ион MnО4–, восстановителем ион Fe2+. Уравнения полуреакций окисления и восстановления имеют следующий вид: MnO4– + 8H+ + 5e → Mn2+ + 4H2O 2Fe2+ – 2e → 2Fe3+ 2 5 Так как реакция электронейтральна, то число отданных электронов равно числу принятых. Поэтому умножим верхнее уравнение на 2, а нижнее – на 5. Затем просуммируем обе полуреакции с учетом коэффициентов: 147 2MnO4– + 16H+ + 10Fe2+ + 10e – 10e → 2Mn2+ + 10Fe3+ + 8H2O или 2MnO4– + 16H+ + 10Fe2+ → 2Mn2+ + 10Fe3+ + 8H2O Затем поставим полученные коэффициенты в исходное уравнение с учетом молекулы K2SO4, ионы которой не участвуют в реакции. Метод полуреакций удобен при подборе коэффициентов реакций с участием органических веществ или веществ, в молекулах которых несколько атомов изменяют свои степени окисления: 3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + 28NO 3 As2S3 +20H2O – 28e → 2AsO43– + 3SO42– + 4OH+ 28 NO3- + 4H+ + 3e → NO + 2H2O 3As2S3 + 60H2O + 28NO3- + 112H+ → 6AsO43– + 9SO42– + 120H+ + 28NO + 56H2O После приведения подобных членов с учетом того, что часть ионов водорода идет на связывание нитрат-ионов и образовавшихся арсенат и сульфат-ионов, получим: 3As2S3 + 28NO3– + 4H2O + 28H+ → 6AsO43– + 9SO42– + 36H+ + 28NO Полученные коэффициенты поставим в исходное уравнение. Метод полуреакций удобен тем, что можно определить коэффициенты для практически всех участников окислительно-восстано-вительной реакции. Кроме того, в этом методе не надо прибегать к понятию "степень окисления". В отличие от метода электронного баланса в методе полуреакций четко показывается роль среды в протекании реакции. Так, перманганат-ион восстанавливается в кислой среде до иона Mn2+, в нейтральной – до MnO2, а в щелочной – до MnO42-. Механизмы окислительно-восстановительных реакций изучены недостаточно полно. Электронный баланс и метод полуреакций имеют много недостатков при описании механизма протекания окислительновосстановительных реакции. И некоторые данные позволяют по-иному описывать механизм окислительно-восстановительных реакций в растворах. Рассмотрим взаимодействие нитрит-иона с хлорноватистой кислотой: NO2– + HClO → NO3– + HCl. 148 Согласно методу электронного баланса запишем: Ν3+ – 2e → N5+ Cl+ + 2e → Cl– Ν3+ + Cl+ → N5+ + Cl– Используя метод полуреакций, получим: ΝO2– + H2O – 2e → NO3– + 2H+ HOCl + H+ + 2e → Cl– + H2O NO2– + HOCl + H2O + H+ → NO3– + Cl– +2H+ + H2O или NO2– + HOCl → NO3– + Cl– + H+ Оба этих метода подбора коэффициентов, несмотря на разницу в подходе, предполагают, что изменение степени окисления азота и хлора в этом процессе происходит в результате передачи электронов от азота к хлору. Но тонкие исследования с помощью меченых атомов показали, что в этой реакции окисление и восстановление связаны с переносом не электронов, а атомов. Аналогичное явление обнаружено и для других окислительно-восстановительных процессов. Установлено также, что перенос положительно заряженной группы атомов или отдельного атома эквивалентен переносу электронов, а перенос отрицательно заряженной группы атомов или атома – присоединению электронов. Так, для реакции нитрит-иона с хлорноватистой кислотой был доказан следующий механизм: – – – H 2O O O N 18O – – Cl → N 18O + HCl. N – –18O Cl → O O O H H Ο Как показывает схема, в результате реакции тяжелый кислород от хлорноватистой кислоты через промежуточный комплекс перешел к азоту, а связь хлора с кислородом заменилась на связь хлора с водородом. Видно, что процесс окисления азота не связан с переносом электронов от азота к хлору. Изменение степени окисления связано с переносом нейтрального атома кислорода с молекулы хлорноватистой 149 кислоты на нитрит-ион. Подобное явление установлено для окисления сульфит-ионов до сульфат-ионов анионами гипохлорита, хлорита, хлората и бромата. Тем не менее, число электронов, переходящих от восстановителя к окислителю, и в методе электронного баланса, и в методе полуреакций точно соответствует числу электронов, которое в действительности затрачивается в электрохимической реакции (например, при электролизе раствора или расплава). Это соответствие вроде бы убеждает в реальности процесса переноса электронов в окислительно-восстановительной реакции. Как же устранить это противоречие между условностью понятия "степень окисления" и постоянным соответствием между изменяющейся степенью окисления и числом электронов, участвующих в окислительно-восстановительных процессах? Рассмотрим полуреакцию ClO3– + 2OH– – 2e → ClO4– + H2O. Из неё видно, что при получении моля перхлорат-иона на анод переходят два электрона. Степень окисления хлора также изменяется на две единицы: (Cl(V) → Cl(VII). Аналогичное явление происходит при окислении манганата в перманганат: MnO4– – e → MnO4– или Mn6+ – e → Mn7+, т.е. Mn(VI) → Mn(VII). Складывается впечатление, что для повышения степени окисления марганца от VI до VII необходимо электрохимически лишить марганец(VI) одного электрона. Но, учитывая ковалентный характер связей ЭО в оксоанионах ClO3– , MnO4– и им подобных, с этим нельзя согласиться. В анионах MnO4–, MnO42–, ClO4–, ClO3– и других потери электронов не происходит. Электронная система этих ионов включает все электроны нейтральных атомов элементов, образующих оксоанионы, и еще несколько электронов, полученных со стороны атомов, соединенных с этим оксоанионом. Например, электрон атома калия в KMnO4. Какова же тогда природа электронов, переходящих из раствора на анод при анодном окислении: ClO3– + 2OH– – 2e → ClO4– + H2O? 150 Видимо, более правильно рассматривать процесс превращения ClO3– → ClO4– как процесс вхождения нейтрального атома кислорода в координационную сферу атома хлора в хлорат-ионе. Этому процессу предшествует переход электронов с кислорода молекулы воды или гидроксид-иона на анод с высвобождением нейтрального атома кислорода: H2O – 2e → [O] + 2H+. Освободившийся атом кислорода координируется с атомом хлора в хлорат-ионе. превращая его в перхлорат-ион. При этом переносе атома кислорода от гидроксид-иона или воды к хлорат-иону и превращении его в в перхлорат и происходит повышение степени окисления атома хлора на две единицы. Контрольные вопросы 1. На каком из электродов – аноде или катоде – происходит окисление в гальваническом элементе? 2. Каково происхождение движущей силы, создающей напряжение в концентрационном элементе? 3. Как связано напряжение концентрационного элемента с концентрациями веществ у электродов? 4. Каким образом эдс гальванического элемента связано с величиной изобарно-изотермического потенциала протекающей в нем реакции? 5. Что называется стандартным потенциалом? 6. Как вычислить эдс гальванического элемента, если известны протекающие в нем электродные полуреакции и их потенциалы? 7. Что можно сказать о реакции, протекающей в гальваническом элементе, если эдс этого элемента оказывается положительным? 8. Что представляет собой уравнение Нернста и как оно связывает эдс гальванического элемента с концентрациями реагентов? 9. Почему для концентрационного элемента первый член уравнения Нернста равен нулю? 1О. Каким образом на основании измерения потенциалов окислительно-восстановительной реакции можно судить о растворимости вещества, которое присутствует в растворе в очень маленьких концентрациях, трудно установимых обычными аналитическими методами? Задачи 151 1. В какую сторону пойдет реакция между диоксидом свинца (PbO2) и иодидом калия (KI) в кислой среде, если концентрации веществ равны – 1 моль/л? 2. Будет ли металлическое серебро растворяться в разбавленной серной кислоте? 3. Установить, что произойдет, если раствор нитрата железа (II) перемешивать алюминиевой ложкой? 4. Укажите, какие из реакций способны протекать самопроизвольно: a) Zn + Mg2+ → Zn2+ + Mg; б) Fe + Cl2 → Fe2+ + 2Cl; в) 4Ag + O2 + 4H+ → 4Ag+ + 2H2O? 5. Используя справочные данные, установите, в какой среде (кислотной или щелочной) полнее протекают следующие окислительновосстановительные реакции: a) MnO4 + H2O → .....; б) Pb(IV) + Cr(III) → Pb(II) + Cr(VI); в) MnO4 + SO32- → ...... 6. Установите, можно ли приготовить раствор, содержащий одновременно следующие вещества: а) перманганат калия и сульфит калия; б) перманганат калия и сульфат калия; в) азотную кислоту и сероводород. Подтвердите ваш ответ соответствующими уравнениями. 7. Используя справочные данные, установите, какой оксид – жидкий Mn2O7 или твердый Tc2O7 – является более сильным окислителем при стандартных условиях? 8. Найдите стандартные потенциалы Е° для следующих электродов: a) S2+ CuS(тв.) Cu(тв.); б) NH3(водн.) Zn(NH3)42+ Zn(тв.). 9. Какая из указанных ниже реакций относится к окислительновосстановительным: a) Zn + H2SO4(разб) → ZnSO4 + H2; б) Zn + 2H2SO4(конц) → ZnSO4 + SO2 + 2H2O; в) Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O? 10. Какие из перечисленных ниже веществ проявляют только окислительные свойства, только восстановительные свойства, окислительновосстановительную двойственность: 152 a) KMnO4, MnO2, V2O5, KI; б) PbO2, NH3, HNO2, Na2S; в) Na2SO3, HNO3, K2Cr2O7, PH3? 11. Подберите коэффициенты в следующих окислительновосстановительных реакциях: a) As2O3 + HNO3 + H2O → H3AsO4 + NO; б) Fe2(SO4)3 + AsH3 → As + FeSO4 + H2SO4; в) Bi + HNO3 → Bi(NO3)3 + NO + H2O; г) Bi2O3 + Cl2 + KOH → KBiO3 + KCl + H2O; д) K2Cr2O7 + C2H5OH + H2SO4 → Cr2(SO4)3 + CH3CHO + K2SO4 + H2O; е) CrCl3 + H2O2 + NaOH → Na2CrO4 + NaCl + H2O; ж) KIO3KI + H2SO4 → I2 + K2SO4 + H2O; з) Ca(OH)2 + Cl2 → Ca(ClO)2 + CaCl2 + H2O. 12. Закончить уравнения и подобрать коэффициенты в следующих реакциях: а) KMnO4 + Zn + H2SO4 → б) K2Cr2O7 + NaNO2 + H2SO4 → в) SnCl2 + K2CrO4 + KOH → г) KNO3 + Zn + KOH → NH3 + д) Cr2(SO4)3 + Br2 + NaOH → Bi + е) H3AsO3 + H2O2 → ж) Bi2S3 + HNO3 → Bi2(SO4)3 + з) Na4V6O17 + KI + H2SO4 → и) KMnO4 + Zn + KOH → Дополнительная литература 1. Угай Я.А. Общая химия. М.: Высш. школа, 1977. С. 248-268. 2. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.: Мир, 1982. С. 156-203. 3. Новиков Г.И. Основы общей химии. М.: Высш. школа, 1988. С. 140 -163. 4. Мартыненко Л.И., Спицын В.И. Методические аспекты курса неорганической химии. М.: Изд-во МГУ, 1983. С. 18-25. 44 5. Басоло Ф., Пирсон Р. Механизмы неорганических реакций. М.: Мир, 1971. С. 397-407. 153 6. Карапетьянц М.Х. Введение в теорию химических процессов. М.: Высш. школа, 1975. С. 87-103. 7 Ахметов Н.С. Неорганическая химия. М.: Высшая школа, 1978. С. 78. 8. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1981. С. 202-212. 154

