Ванадий, ниобий, тантал
advertisement

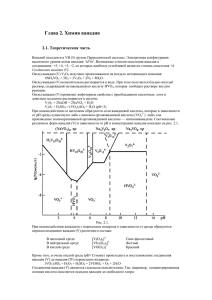
Ванадий, ниобий, тантал Ванадий, ниобий, тантал находятся в VВ (5) группе Периодической системы. Электронная конфигурация валентного уровня этих элементов (n-1)d3ns2. Наиболее устойчивая степень окисления ниобия и тантала +5. Электронная конфигурация валентного уровня атома ванадия: 3d34s2. Возможные степени окисления ванадия в соединениях: +5, +4, +3, +2, из которых наиболее устойчивой является степень окисления +4. При прокаливании в кислороде все элементы дают оксид Э2О5. Ниобий и тантал при реакции со всеми галогенами образуют ЭГ5; ванадий дает со фтором VF5, с хлором VCl4, с бромом VBr3, с иодом VI2. Металлы устойчивы к действию кислот-неокислителей, кроме плавиковой: 2 V + 12 HF = 2 H[VF6] + 5 H2 С ниобием и танталом дополнительно получаются, благодаря их бОльшим радиусам, H2[NbF7] и H3[TaF8] . Реакции с кислотами-окислителями. Все металлы (V, Nb, Ta) растворяются в смеси азотной и плавиковой кислот: 3 M + 5 HNO3 + 18 HF = 3 H[MF6] + 5 NO + 10 H2O С ниобием и танталом дополнительно получаются H2[NbF7] и H3[TaF8] . С концентрированной серной и азотной кислотами, а также с царской водкой реагирует только ванадий: 2 V + 6 H2SO4 = (VO2)2SO4 + 5 SO2 + 6 H2O 3 V + 8 HNO3 = 3 VO2NO3 + 5 NO + 4 H2O 3 V + 5 HNO3 + 3 HCl = 3 VO2Cl + 5 NO + 4 H2O Ванадий, ниобий, тантал реагируют с расплавами щелочей в присутствии кислорода: 4 М + 12 KOH + 5 O2 = 4 K3МO4 + 6 H2O Соединения ванадия (V) Оксид ванадия (V) V2O5 получают прокаливанием на воздухе метаванадата аммония: 4NH4VO3 + 3O2 = 2V2O5 + 2N2 + 8H2O Оксид ванадия (V) незначительно растворяется в воде. При этом получается бледно-желтый раствор, содержащий ортованадиевую кислоту H3VO4, которая сообщает раствору кислую реакцию. Оксид ванадия (V) проявляет амфотерные свойства с преобладанием кислотных, он довольно медленно растворяется в щелочи. V2O5 + 2NaOH = 2NaVO3 + H2O V2O5 + H2SO4 = (VO2)2SO4 + H2O (рН<3) С Nb2O5 идет аналогичная реакция, а высший оксид тантала дает сульфат: Ta2O5 + 5 H2SO4 = Ta2(SO4)5 + 5 H2O При взаимодействии со щелочами образуются соли ванадиевой кислоты, которые в зависимости от рН среды существуют либо с анионом ортованадиевой кислоты (VO43–) либо, как производные полимеризованной ортованадиевой кислоты — изополиванадаты. Соотношение различных форм ванадия (V) в зависимости от рН и концентрации ванадия показано на рисунке: 1 Формы существования ванадия (V) в зависимости от его концентрации и рН среды При взаимодействии ванадатов с пероксидом водорода в зависимости от среды образуются пероксосоединения ванадия (V) различного состава: В щелочной среде: [V(O2)4]3– Сине-фиолетовый В нейтральной среде: [VO2(O2)2]3– Желтый В кислой среде [VO(O2)]+ Красный Кроме того, в очень кислой среде (pH<1) может происходить и восстановление соединения ванадия (V) до ванадия (IV) пероксидом водорода: (VO2)2SO4 + H2O2 + H2SO4 = 2VOSO4 + O2 + 2H2O Соединения ванадия (V) являются сильными окислителями. Так, например, концентрированная соляная кислота окисляется оксидом ванадия до свободного хлора: V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O; V2O5 может быть восстановлен водородом: при слабом нагревании до VO2 , при 7000С до V2O3, при 17000С до VO. Соединения ванадия (IV). Степень окисления +4 — наиболее устойчивая степень окисления ванадия. Водные растворы соединений ванадий (IV) синего цвета, который придает им гидратированный ион [VO(H2O)5]2+ (ион ванадила или оксованадий (IV)). Соединения ванадия (IV) могут быть получены восстановлением солей ванадия (V), например, щавелевой кислотой: 2NaVO3 + H2C2O4 + 3H2SO4 = 2VOSO4 + 2CO2 + Na2SO4+ 4H2O Ванадил-ион (VO2+), образующийся в результате этой реакции, очень устойчив и сохраняется не только в водных растворах солей, но и в составе гидроксида ванадия (IV) VO(OH)2. Оксид и гидроксид ванадия (IV) обладают амфотерными свойствами, т. е. растворяются и в кислотах и в основаниях. При растворении в кислотах образуются производные ванадил-иона (VO2+), а при растворении в щелочах — ванадаты (IV) различного состава, например V4O92–. VO(OH)2 + H2SO4 = VOSO4 + 2H2O 4VO(OH)2 + 2KOH = K2[V4O9] + 5H2O 2 Соединения ванадия (III). Получить соединения ванадия (III) можно восстановлением солей ванадия (V) в кислой среде, например, нитритом натрия: 2NaVO3 + 2NaNO2 + 4H2SO4 = V2(SO4)3 + 2NaNO3 + Na2SO4 + 4H2O Водные растворы соединений ванадия (III) окрашены в зеленый цвет, который им придают гидратированные ионы [V(H2O)6]3+. Оксид и гидроксид ванадия (III) обладают ярко выраженными основными свойствами и растворяются только в кислотах: 2V(OH)3 + 3H2SO4 = V2(SO4)3 + 6H2O Соединения ванадия (III) являются восстановителями, они окисляются на воздухе: 4 V(OH)3 + O2 = 4 VO(OH)2 + 2 H2O Соединения ванадия (II). Переход ванадия от высшей степени окисления + 5 к низшей +2, через все промежуточные степени окисления, можно наблюдать при взаимодействии раствора метаванадата натрия в кислой среде с цинком: VO3– → VO2+ → VO2+ → V3+ → V2+. Водные растворы соединений ванадия (II) имеют фиолетовый цвет, за счет гидратированных ионов [V(H2O)6]2+. Для оксида и гидроксида ванадия (II) характерны основные свойства: V(OH)2 + H2SO4 = VSO4 + 2H2O Соединения ванадия (II) – сильные восстановители. Сразу после получения V(OH)2 восстанавливает воду: 2 V(OH)2 + 2 H2O = 2 V(OH)3 + H2 ↑ 3