Водород (Н2) традиционно очень востре
advertisement
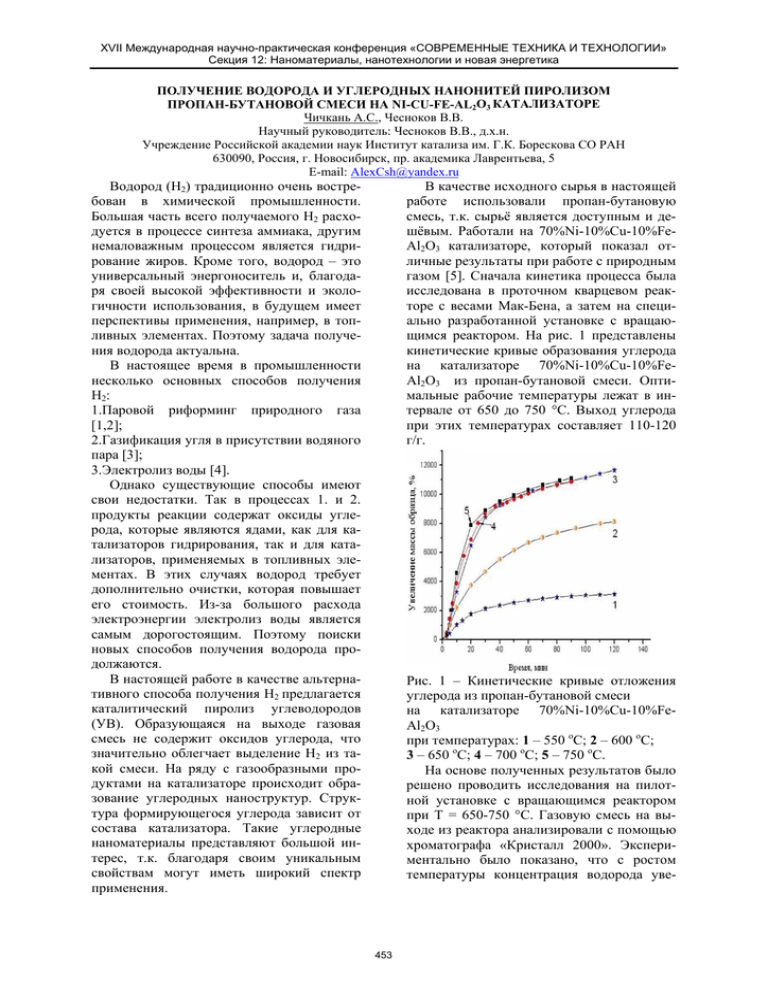
XVII Международная научно-практическая конференция «СОВРЕМЕННЫЕ ТЕХНИКА И ТЕХНОЛОГИИ» Секция 12: Наноматериалы, нанотехнологии и новая энергетика ПОЛУЧЕНИЕ ВОДОРОДА И УГЛЕРОДНЫХ НАНОНИТЕЙ ПИРОЛИЗОМ ПРОПАН-БУТАНОВОЙ СМЕСИ НА NI-CU-FE-AL2O3 КАТАЛИЗАТОРЕ Чичкань А.С., Чесноков В.В. Научный руководитель: Чесноков В.В., д.х.н. Учреждение Российской академии наук Институт катализа им. Г.К. Борескова СО РАН 630090, Россия, г. Новосибирск, пр. академика Лаврентьева, 5 E-mail: AlexCsh@yandex.ru В качестве исходного сырья в настоящей работе использовали пропан-бутановую смесь, т.к. сырьё является доступным и дешёвым. Работали на 70%Ni-10%Cu-10%FeAl2O3 катализаторе, который показал отличные результаты при работе с природным газом [5]. Сначала кинетика процесса была исследована в проточном кварцевом реакторе с весами Мак-Бена, а затем на специально разработанной установке с вращающимся реактором. На рис. 1 представлены кинетические кривые образования углерода на катализаторе 70%Ni-10%Cu-10%FeAl2O3 из пропан-бутановой смеси. Оптимальные рабочие температуры лежат в интервале от 650 до 750 °С. Выход углерода при этих температурах составляет 110-120 г/г. Водород (Н2) традиционно очень востребован в химической промышленности. Большая часть всего получаемого Н2 расходуется в процессе синтеза аммиака, другим немаловажным процессом является гидрирование жиров. Кроме того, водород – это универсальный энергоноситель и, благодаря своей высокой эффективности и экологичности использования, в будущем имеет перспективы применения, например, в топливных элементах. Поэтому задача получения водорода актуальна. В настоящее время в промышленности несколько основных способов получения Н2: 1.Паровой риформинг природного газа [1,2]; 2.Газификация угля в присутствии водяного пара [3]; 3.Электролиз воды [4]. Однако существующие способы имеют свои недостатки. Так в процессах 1. и 2. продукты реакции содержат оксиды углерода, которые являются ядами, как для катализаторов гидрирования, так и для катализаторов, применяемых в топливных элементах. В этих случаях водород требует дополнительно очистки, которая повышает его стоимость. Из-за большого расхода электроэнергии электролиз воды является самым дорогостоящим. Поэтому поиски новых способов получения водорода продолжаются. В настоящей работе в качестве альтернативного способа получения Н2 предлагается каталитический пиролиз углеводородов (УВ). Образующаяся на выходе газовая смесь не содержит оксидов углерода, что значительно облегчает выделение Н2 из такой смеси. На ряду с газообразными продуктами на катализаторе происходит образование углеродных наноструктур. Структура формирующегося углерода зависит от состава катализатора. Такие углеродные наноматериалы представляют большой интерес, т.к. благодаря своим уникальным свойствам могут иметь широкий спектр применения. Рис. 1 – Кинетические кривые отложения углерода из пропан-бутановой смеси на катализаторе 70%Ni-10%Cu-10%FeAl2O3 при температурах: 1 – 550 оС; 2 – 600 оС; 3 – 650 оС; 4 – 700 оС; 5 – 750 оС. На основе полученных результатов было решено проводить исследования на пилотной установке с вращающимся реактором при Т = 650-750 °С. Газовую смесь на выходе из реактора анализировали с помощью хроматографа «Кристалл 2000». Экспериментально было показано, что с ростом температуры концентрация водорода уве- 453 XVII Международная научно-практическая конференция «СОВРЕМЕННЫЕ ТЕХНИКА И ТЕХНОЛОГИИ» Секция 12: Наноматериалы, нанотехнологии и новая энергетика личивается, а концентрация метана снижается (рис.2). Рис. 4 – Зависимость времени стабильной работы катализатора (ч) от температуры (°С) реакции. В результате проведенных исследований было показано, что 70%Ni-10%Cu-10%FeAl2O3 катализатор эффективно работает в реакции разложения пропан-бутановой смеси. Оптимальные температуры работы катализатора составляют 700-725 °С. В этих условиях катализатор 70%Ni-10%Cu-10%FeAl2O3 стабильно работает в течение 13 часов с выходом углеродных нанонитей до 350 г/г. Список использованных источников 1.Sandset T., Sogge J., Starm T. Evaluation of natural gas based synthesis gas production technologies // Catalysis Today, 1994, v.21, Р.269. 2.Aasberg-Petersen K., Bak Hausen Y.-H., Christensen T.S., Dybkjaer I., Seier Christensen P., Stub Nielsen C., Winter Madsen S.E.L., Rostrup-Nielsen J.R. Technologies for largescale gas conversion // Applied Catalysis A: General, 2001, v. 221, Р.379-387. 3.Ионе К.Г. Проблемы промышленного производства водорода в сопоставлении с проблемами добычи природного водорода как полезного ископаемого // Химия в интересах устойчивого развития, 2003, т. 11, № 6, С.907-917. 4.Коровин Н.В. и др. Электрохимия, 1984, т. 20, С._258. Vladimir V. Chesnokov, Alexandra S. Chichkan Production of hydrogen by methane catalytic decomposition over Ni–Cu– Fe/Al2O3 catalyst International Journal of Hydrogen Energy, Volume 34, Issue 7, April 2009 – P. 2979-2985. Рис. 2 – Зависимости концентраций газов от температуры реакции (°С). При увеличении температуры от 650 °С до 725 °С выход углеродных нанонитей увеличивается с 220 г/г до 350 г/г (рис. 3), а время стабильно работы снижается незначительно (рис. 4). Однако при дальнейшем повышении температуры до 750 °С происходит резкое снижение, как выхода углерода, так и времени стабильной работы. Рис. 3 – Зависимость выхода углерода (г/гкат) от температуры (°С) реакции. 454



