ЗФ ОНиФХ задачи
advertisement
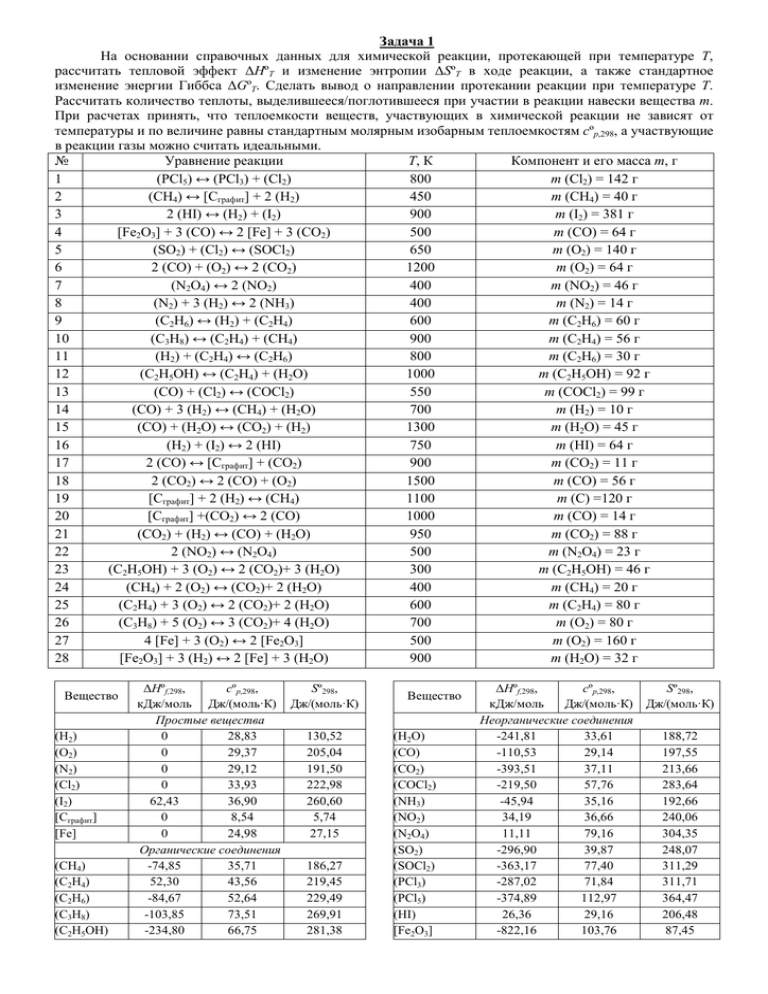
Задача 1 На основании справочных данных для химической реакции, протекающей при температуре T, рассчитать тепловой эффект ∆HºT и изменение энтропии ∆SºT в ходе реакции, а также стандартное изменение энергии Гиббса ∆GºT. Сделать вывод о направлении протекании реакции при температуре T. Рассчитать количество теплоты, выделившееся/поглотившееся при участии в реакции навески вещества m. При расчетах принять, что теплоемкости веществ, участвующих в химической реакции не зависят от температуры и по величине равны стандартным молярным изобарным теплоемкостям cºp,298, а участвующие в реакции газы можно считать идеальными. № Уравнение реакции T, К Компонент и его масса m, г 1 (PCl5) ↔ (PCl3) + (Cl2) 800 m (Cl2) = 142 г 2 (CH4) ↔ [Cграфит] + 2 (H2) 450 m (CH4) = 40 г 3 2 (HI) ↔ (H2) + (I2) 900 m (I2) = 381 г 4 [Fe2O3] + 3 (CO) ↔ 2 [Fe] + 3 (CO2) 500 m (CO) = 64 г 5 (SO2) + (Cl2) ↔ (SOCl2) 650 m (O2) = 140 г 6 2 (CO) + (O2) ↔ 2 (CO2) 1200 m (O2) = 64 г 7 (N2O4) ↔ 2 (NO2) 400 m (NO2) = 46 г 8 (N2) + 3 (H2) ↔ 2 (NH3) 400 m (N2) = 14 г 9 (C2H6) ↔ (H2) + (C2H4) 600 m (C2H6) = 60 г 10 (C3H8) ↔ (C2H4) + (CH4) 900 m (C2H4) = 56 г 11 (H2) + (C2H4) ↔ (C2H6) 800 m (C2H6) = 30 г 12 (C2H5OH) ↔ (C2H4) + (H2O) 1000 m (C2H5OH) = 92 г 13 (CO) + (Cl2) ↔ (COCl2) 550 m (COCl2) = 99 г 14 (CO) + 3 (H2) ↔ (CH4) + (H2O) 700 m (H2) = 10 г 15 (CO) + (H2O) ↔ (CO2) + (H2) 1300 m (H2O) = 45 г 16 (H2) + (I2) ↔ 2 (HI) 750 m (HI) = 64 г 17 2 (CO) ↔ [Cграфит] + (CO2) 900 m (CO2) = 11 г 18 2 (CO2) ↔ 2 (CO) + (O2) 1500 m (CO) = 56 г 19 [Cграфит] + 2 (H2) ↔ (CH4) 1100 m (C) =120 г 20 [Cграфит] +(CO2) ↔ 2 (CO) 1000 m (CO) = 14 г 21 (CO2) + (H2) ↔ (CO) + (H2O) 950 m (CO2) = 88 г 22 2 (NO2) ↔ (N2O4) 500 m (N2O4) = 23 г 23 (C2H5OH) + 3 (O2) ↔ 2 (CO2)+ 3 (H2O) 300 m (C2H5OH) = 46 г 24 (CH4) + 2 (O2) ↔ (CO2)+ 2 (H2O) 400 m (CH4) = 20 г 25 (C2H4) + 3 (O2) ↔ 2 (CO2)+ 2 (H2O) 600 m (C2H4) = 80 г 26 (C3H8) + 5 (O2) ↔ 3 (CO2)+ 4 (H2O) 700 m (O2) = 80 г 27 4 [Fe] + 3 (O2) ↔ 2 [Fe2O3] 500 m (O2) = 160 г 28 [Fe2O3] + 3 (H2) ↔ 2 [Fe] + 3 (H2O) 900 m (H2O) = 32 г Вещество (H2) (O2) (N2) (Cl2) (I2) [Cграфит] [Fe] (CH4) (C2H4) (C2H6) (C3H8) (C2H5OH) ∆Hºf,298, cºp,298, Sº298, кДж/моль Дж/(моль·К) Дж/(моль·К) Простые вещества 0 28,83 130,52 0 29,37 205,04 0 29,12 191,50 0 33,93 222,98 62,43 36,90 260,60 0 8,54 5,74 0 24,98 27,15 Органические соединения -74,85 35,71 186,27 52,30 43,56 219,45 -84,67 52,64 229,49 -103,85 73,51 269,91 -234,80 66,75 281,38 Вещество (H2O) (CO) (CO2) (COCl2) (NH3) (NO2) (N2O4) (SO2) (SOCl2) (PCl3) (PCl5) (HI) [Fe2O3] ∆Hºf,298, cºp,298, кДж/моль Дж/(моль·К) Неорганические соединения -241,81 33,61 -110,53 29,14 -393,51 37,11 -219,50 57,76 -45,94 35,16 34,19 36,66 11,11 79,16 -296,90 39,87 -363,17 77,40 -287,02 71,84 -374,89 112,97 26,36 29,16 -822,16 103,76 Sº298, Дж/(моль·К) 188,72 197,55 213,66 283,64 192,66 240,06 304,35 248,07 311,29 311,71 364,47 206,48 87,45 Задача 2 На основании справочных данных для химической реакции, протекающей при температуре 298 К, рассчитать стандартный тепловой эффект ∆Hº298. Записать выражение для константы равновесия Кр через равновесные парциальные давления участников реакции. Как будет влиять на равновесный выход основного продукта а) уменьшение общего давления в системе; б) повышение температуры; в) введение в систему инертного газа при постоянном общем давлении; г) увеличение парциального давления участника реакции А. № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Уравнение реакции (PCl5) ↔ (PCl3) + (Cl2) (CH4) ↔ [Cграфит] + 2 (H2) 2 (HI) ↔ (H2) + (I2) [Fe2O3] + 3 (CO) ↔ 2 [Fe] + 3 (CO2) (SO2) + (Cl2) ↔ (SOCl2) 2 (CO) + (O2) ↔ 2 (CO2) (N2O4) ↔ 2 (NO2) (N2) + 3 (H2) ↔ 2 (NH3) (C2H6) ↔ (H2) + (C2H4) (C3H8) ↔ (C2H4) + (CH4) (H2) + (C2H4) ↔ (C2H6) (C2H5OH) ↔ (C2H4) + (H2O) (CO) + (Cl2) ↔ (COCl2) (CO) + 3 (H2) ↔ (CH4) + (H2O) (CO) + (H2O) ↔ (CO2) + (H2) (H2) + (I2) ↔ 2 (HI) 2 (CO) ↔ [Cграфит] + (CO2) 2 (CO2) ↔ 2 (CO) + (O2) [Cграфит] + 2 (H2) ↔ (CH4) [Cграфит] +(CO2) ↔ 2 (CO) (CO2) + (H2) ↔ (CO) + (H2O) 2 (NO2) ↔ (N2O4) (C2H5OH) + 3 (O2) ↔ 2 (CO2)+ 3 (H2O) (CH4) + 2 (O2) ↔ (CO2)+ 2 (H2O) (C2H4) + 3 (O2) ↔ 2 (CO2)+ 2 (H2O) (C3H8) + 5 (O2) ↔ 3 (CO2)+ 4 (H2O) 4 [Fe] + 3 (O2) ↔ 2 [Fe2O3] [Fe2O3] + 3 (H2) ↔ 2 [Fe] + 3 (H2O) Вещество ∆Hºf,298, кДж/моль Вещество Простые вещества (H2) (O2) (N2) (Cl2) (I2) [Cграфит] [Fe] (CH4) (C2H4) (C2H6) (C3H8) (C2H5OH) 0 0 0 0 62,43 0 0 Органические соединения -74,85 52,30 -84,67 -103,85 -234,80 А Cl2 CH4) I2 CO O2 O2 NO2 N2 C2H6 C2H4 C2H6 C2H5OH COCl2 H2 H2O HI CO2 CO C CO CO2 N2O4 C2H5OH CH4 C2H4 O2 O2 H2O (H2O) (CO) (CO2) (COCl2) (NH3) (NO2) (N2O4) (SO2) (SOCl2) (PCl3) (PCl5) (HI) [Fe2O3] ∆Hºf,298, кДж/моль Неорганические соединения -241,81 -110,53 -393,51 -219,50 -45,94 34,19 11,11 -296,90 -363,17 -287,02 -374,89 26,36 -822,16 Задача 3 При температуре T константа равновесия приведенной в таблице химической реакции равна Kр. Рассчитать равновесную степень превращения β исходного вещества А, если начальные парциальные давления исходных реагентов А и В равны р0А и р0В соответственно, а начальные парциальные давления продуктов реакции равны нулю. № Уравнение реакции Kр 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 2 (H2) + (O2) ↔ 2 (H2O) (SOCl2) ↔ (SO2) + (Cl2) (C2H6) ↔ (H2) + (C2H4) (H2) + (Br2) ↔ 2 (HBr) (PCl5) ↔ (PCl3) + (Cl2) (CH4) + (I2) ↔ (CH3I) + (HI) 2 (CO) + (O2) ↔ 2 (CO2) (C3H8) ↔ (C2H4) + (CH4) (C2H5OH) ↔ (C2H4) + (H2O) (CH3I) + (I2) ↔ (CI4) + (HI) (N2O4) ↔ 2 (NO2) (CH3Br) + (Br2) ↔ (CBr4) + (HBr) 3 (CO) + [Fe2O3] ↔ 2 [Fe] + 3 (CO2) (CH4) + 2 (O2) ↔ (CO2)+ 2 (H2O) 2 (CO) ↔ [Cграфит] + (CO2) (H2) + (I2) ↔ 2 (HI) (C3H8) ↔ (C2H4) + (CH4) 2 (NO2) ↔ (N2O4) (N2) + 3 (H2) ↔ 2 (NH3) (CH4) + (Cl2) ↔ (CH3Cl) + (HCl) 3 (H2) + [Fe2O3] ↔ 2 [Fe] + 3 (H2O) 2 (H2) + [Cграфит] ↔ (CH4) (N2H4) ↔ (N2) + 2 (H2) 2 (NO2) ↔ 2 (NO) + (O2) (H2) + (C2H4) ↔ (C2H6) (H2) + (Cl2) ↔ 2 (HCl) (CH3Cl) + (Cl2) ↔ (CCl4) + (HCl) (CO2) + [Cграфит] ↔ 2 (CO) 32 0,42 0,25 14 0,025 0,84 0,98 0,24 0,73 7,6 9,8 13 1,8 22 0,28 5,4 3,9 0,35 2,9 2,5 0,91 0,32 2,6 18 35 0,65 11 1,9 Начальное давление, атм р0А р0В 8,0 0,7 1,2 – 0,9 – 0,5 1,8 – 0,5 0,6 1,0 0,4 1,5 – 1,0 0,9 0,8 2,0 – – – 0,5 – 0,3 0,6 1,0 – 0,4 0,5 0,5 – 0,2 – 0,3 1,0 0,6 0,5 1,2 – 1,6 – 0,8 – 1,2 – 0,5 0,5 1,0 1,0 0,4 0,4 1,8 – Задача 4 В таблице для некоторой необратимой гомогенной реакции νА А→ продукты приведены значения константы скорости k1 и k2 при двух различных значениях температуры T1 и T2 соответственно. Рассчитать энергию активации химической реакции EA, значение константы скорости реакции при температуре T3 (k3), период полупревращения t½ и степень превращения β исходного вещества к моменту времени t от начала реакции. Начальная концентрация вещества 0,5 моль/л. Порядок реакции равен n. № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 T1, К 300 350 400 450 500 550 600 650 700 750 800 850 900 950 650 500 870 700 650 960 600 980 550 800 800 750 550 800 k1, (моль/л)1-n · мин-1 4,12 · 10-3 2,56 · 10-4 1,24 · 10-4 7,68 · 10-3 3,45 · 10-3 2,46 · 10-4 0,234 0,869 1,08 3,45 · 10-3 0,268 8,76 · 10-3 7,54 · 10-4 3,08 · 10-3 5,64 · 10-3 23,6 0,0135 2,66 12,2 4,52 · 10-3 0,258 3,12 · 10-4 1,12 0,0112 8,64 12,4 0,0456 8,64 T2, К 500 650 600 550 550 650 700 750 800 800 850 870 980 960 550 300 850 600 350 950 400 900 450 750 700 650 500 700 k2, (моль/л)1-n · мин-1 23,6 12,2 0,258 1,12 0,0456 5,64 · 10-3 2,66 12,4 8,64 0,0112 0,765 0,0135 3,12 · 10-4 4,52 · 10-3 2,46 · 10-4 4,12 · 10-3 8,76 · 10-3 0,234 2,56 · 10-4 3,08 · 10-3 1,24 · 10-4 7,54 · 10-4 7,68 · 10-3 3,45 · 10-3 1,08 0,869 3,45 · 10-3 1,08 T3, К 400 500 500 500 525 750 800 700 750 770 820 890 1100 1000 600 400 800 650 450 940 500 950 500 700 750 700 450 600 n 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 t, мин 60 55 50 45 40 35 30 25 20 15 10 5 10 15 20 25 30 35 40 45 50 55 60 55 50 45 40 35 Список литературы по дисциплине 1. Болвако, А.К. Физическая химия. Лабораторный практикум : учеб.-метод. пособие для студентов химико-технологичексих специальностей заочной формы обучения / А.К. Болвако, И.А. Великанова, А.А. Затюпо. Минск: БГТУ, 2015. 82 с. 2. Клындюк А.И., Петров Г.С. Физическая химия: учеб. пособие для студентов специальностей 1-36 07 01 «МиАХПиПСМ», 1-53 01 01 «АТПиП», 1-43 01 06 «ЭТЭМ». – Мн: БГТУ, 2010. 3. Краткий справочник физико-химических величин. / под ред. А.А. Равделя, А.М. Пономаревой. – Л.: Химия, 1974 (1983, 1999).


