Номер варианта – две последние цифры номера зачетной книжки.
advertisement
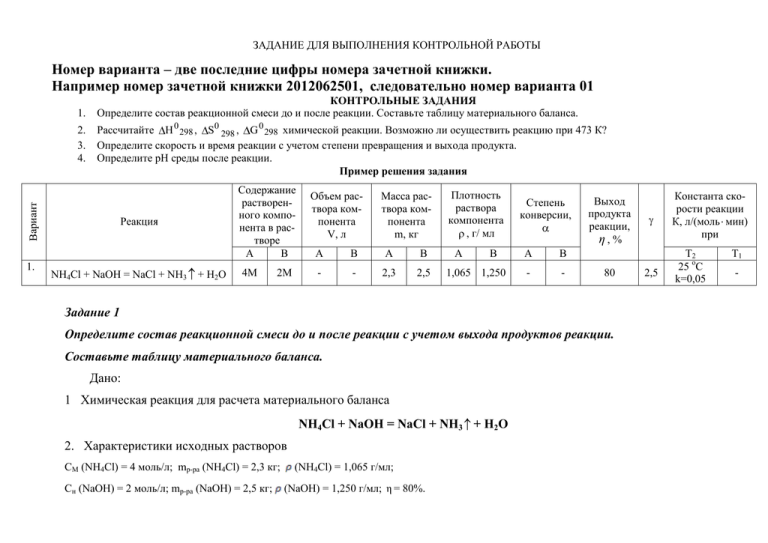
ЗАДАНИЕ ДЛЯ ВЫПОЛНЕНИЯ КОНТРОЛЬНОЙ РАБОТЫ Номер варианта – две последние цифры номера зачетной книжки. Например номер зачетной книжки 2012062501, следовательно номер варианта 01 1. Рассчитайте H 0 298 , S0 298 , G 0 298 химической реакции. Возможно ли осуществить реакцию при 473 К? Определите скорость и время реакции с учетом степени превращения и выхода продукта. Определите рН среды после реакции. Пример решения задания Вариант 2. 3. 4. КОНТРОЛЬНЫЕ ЗАДАНИЯ Определите состав реакционной смеси до и после реакции. Составьте таблицу материального баланса. 1. Содержание растворенного компонента в растворе А В Реакция NH4Cl + NaOH = NaCl + NH3 + H2O 4M 2М Объем раствора компонента V, л Масса раствора компонента m, кг А В А В - - 2,3 2,5 Плотность раствора компонента , г/ мл А В 1,065 1,250 Степень конверсии, А В - - 80 Задание 1 Определите состав реакционной смеси до и после реакции с учетом выхода продуктов реакции. Составьте таблицу материального баланса. Дано: 1 Химическая реакция для расчета материального баланса NH4Cl + NaOH = NaCl + NH3 + H2O 2. Характеристики исходных растворов СМ (NH4Cl) = 4 моль/л; mр-ра (NH4Cl) = 2,3 кг; Сн (NaOH) = 2 моль/л; mр-ра (NaOH) = 2,5 кг; (NH4Cl) = 1,065 г/мл; (NaOH) = 1,250 г/мл; η = 80%. Константа скорости реакции К, л/(моль мин) при Выход продукта реакции, η,% 2,5 Т2 25 оС k=0,05 Т1 - Проведем расчет веществ приходящих в реакцию Приход: (Исходные вещества) 1) Объем приходящего раствора NH4Cl: m р ра 2300 V 2159,6 мл. 1,065 2) Количество NH4Cl в приходящем растворе: C M V 4 2,1596 8,64 моль. 3) Масса NH4Cl в приходящем растворе: m( NH 4 Cl) M 8,64 53,5 462,24 г. 4) Масса воды в приходящем растворе хлорида аммония NH4Cl: m(H 2 O) 2300 462,24 1837,76 г. 5) Объем приходящего раствора щелочи (NaOH): m р ра 2500 V 2000 мл. 1,25 6) Масса вещества NaOH в приходящем растворе: m( NaOH ) C н M Э V 2 40 2 160 г. 7) Количество NaOH в приходящем растворе: m 160 V 4 моль. M 40 8) Масса воды в растворе щелочи: m(H 2 O) 2500 160 2340 г. 9) Количество прореагировавшего NaOH с учетом выхода продуктов реакции: ( NaOH ) прор 4 0,8 3,2 моль. исх 10) Количество непрореагировавшего NaOH: ( NaOH ) непр 4 3,2 0,8 моль. 11) Масса непрореагировавшего NaOH: m( NaOH) 0,8 40 32 г. 12) Количество непрореагировавшего NH4Cl: ( NH 4 Cl) непр 8,64 3,2 5,44 моль. 13) Масса непрореагировавшего NH4Cl: m( NH 4 Cl) 5,44 53,5 291,04 г. Проведем расчет веществ образовавшихся в реакции (Продукты реакции) 1) Масса образовавшегося NaCl: m( NaCl ) 3,2 58,5 187,3 г. 2) Масса образовавшейся воды: m(H 2 O) 3,2 18 57,6 г. 3) Масса образовавшегося аммиака: m( NH 3 ) 3,2 17 54,4 г. Расход: Состав реакционной смеси 1. 2. 3. NH4Cl NaOH H2O, в том числе: с раствором NH4Cl с раствором NaOH m, г 462,24 160 4177,76 1837,34 2340,0 Материальные баланс Приход Состав реакционной смеси моль ,% 8,64 9,63 1. NH4Cl 4 3,33 2. NaOH 229,85 87,04 3. NH3 4. NaCl 5. H2O, в том числе: реакционной из исходных раств. Итого: Итого (сумма п.п. 1+2+3): 4800 242,49* 100 * - количество молей приходной и расходной частей могут быть неравными. m, г 291,04 32 54,4 187,2 4235,36 57,6 4177,76 4800 Расход моль 5,44 0,8 3,2 3,2 233,05 ,% 6,06 0,67 1,13 3,9 88,24 3,2 229,85 245,69* 100 Задание 2. Рассчитайте энергию Гиббса, энтальпию, энтропию данного процесса при температуре 298 К. Возможна ли данная реакция при температуре 473 К? 1) Определяем энтальпию данной реакции при Т=298 К: H реакции j fH j прод. реакцтт i fH j исх. веществ Н реакции 411,12 45,94 285,3 314,22 426,35 2) Определяем энтропию данной реакции при Т=298 К: Sреакции Sреакции jS j прод. реакции 1,79 кДж/моль. jS j исх. веществ 72,13 192,66 69,95 95,81 64,43 174,5 Дж/(моль К). Стандартные значения энтальпии и энтропии соответствующих веществ определяют по таблице термодинамических характеристик веществ. 3) Определяем энергию Гиббса при Т = 298 К: G 0 298 G 0 298 H 0 298 1,79 (298 0,1745) G 0 <0, то данная реакция возможна при температуре Т=298 К. G 473 1,79 (473 0,1745) При Т=473 К данная реакция также возможна. T S0 298 53,791 кДж/ моль. Так как 84,328 кДж/моль. Задание 3. Определите скорость и время реакции с учетом выхода продукта. Константа скорости реакции К=0,2 л/(моль с). 1) Масса раствора после реакции: m р ра m р ра ( NH 4 Cl) m р ра ( NaOH ) m( NH 3 ) 2300 2500 54,4 4745,6 г. Так как концентрации веществ в растворе незначительны, то плотность раствора принимаем за 1 г/мл, отсюда: Vр ра 4745,6 мл 4,7456 л. Время реакции: C (C XA ) 2,303 1 lg B A , К СА СВ C A (C B X B ) где К – константа скорости реакции; СА, СВ – начальные концентрации реагирующих веществ, моль/л; ХА, ХВ – количество молей реагирующих веществ, вступивших в реакцию к моменту времени . 2) Концентрация веществ до реакции: 8,64 C( NH 4 Cl) 1,82 моль/л, V 4,7456 4 C( NaOH ) 0,84 моль/л. V 4,7456 3) Концентрация веществ после реакции: 5,44 C( NH 4 Cl) 1,15 моль/л, V 4,7456 0,8 C( NaOH ) 0,168 моль/л. V 4,7456 Время реакции: 2,303 1 0,84 1,15 lg 5,9 с. 0,2 1,82 0,84 1,82 0,168 4) Скорость реакции по NH4Cl: С 1,82 1,15 0,114 моль/(л с ) 5,9 Задание 4. Определите рН среды после реакции. После завершения реакции в растворе присутствуют вещества: NH4Cl, NaOH, NaCl, частично растворенный аммиак. На реакцию среды могут влиять NaOH и гидролизируемый NH4Cl. NH 4 Cl H 2 O NH 3 H 2 O HCl / C М (HCl) C M ( NH 4 Cl) 1,15 моль/л. C M ( NaOH ) 0,168 моль/л, так как (NaOH) 100% , то C(OH ) C M n 0,168 1 1 0,168 моль/л. Концентрацию ионов водорода, образующихся при гидролизе NH4Cl, вычислим через константу и степень гидролиза: Кг где С – концентрация соли, моль/л; С 1 2 - степень гидролиза соли. Так как степень гидролиза значительно меньше единицы, то выражение принимает вид: К г С Константа гидролиза соли слабого основания и сильной кислоты рассчитываются по формуле: К Н 2О 10 14 Кг 5,65 10 10 , К осн 1,77 10 5 Кг 5,65 10 10 2,2 10 5 . С 1,15 Так как C(HCl)=C(NH4Cl), то Кг C( H ) 2,2 10 5 моль/л. С соли С(ОН ) значительно больше C(H ) ; С(ОН ) =0,186 моль/л. Следовательно, рН раствора считаем по концентрации щелочи: Н 10 14 0,168 рН lg H рН lg(5.376 10 14 ) 13,23 . 5,376 10 14 моль/л. 2 . Вариант 00 01 02 03 04 05 06 07 08 09 10 11 12 13 14 Реакция ВАРИАНТЫ СЕМЕСТРОВЫХ ЗАДАНИЙ ДЛЯ II СЕМЕСТРА Содержание Плотность Объем расМасса расрастворенСтепень раствора твора комтвора комного компокомпонента конверсии, понента понента нента в рас, г/ мл V, л m, кг творе А В А В А В А В А В Константа скорости реакции К, л/(моль мин) при Выход продукта реакции η,% FeCl3+NaOH Fe(OH)3+NaCl 1н 3М 2,0 3,0 - - 1,08 1,11 - 0,6 - 2,5 H2SO4+NaOH Na2SO4+H2O 4н 5М 2,0 3,0 - - 1,115 1,12 1,0 - - 3,2 30% 2н 0,8 1,5 - - 1,32 1,03 - 0,9 - 3,5 FeI2+NaF NaI+FeF2 NH4Cl+NaOH NaCl+H2O+H3 4М 2н - - 2,0 2,2 1,08 1,13 - - NaCl 0,8 3,0 AgNO3+Na2S Ag2S+Na2NO3 25% 2М 1,5 2 - - 1,23 1,15 0,85 - - 2,5 - BaCl2+Na2CO3 KOH+HCl KCl+H2O NaOH+HNO3 KOH+HI BaCO3+NaCl NaNO3+H2O KI+H2O KOH+H2SO3 KHSO3+H2O Pb(NO3)2+(NH4)2S Na2SO3+H2SO4 NH4NO3+PbS Na2SO4+SO2+H2O KOH+Cl2 KClO+KCl+H2O KI+H3PO4 KH2PO4+HI HCl+AgNO3 HNO3+AgCl Т2 25 оС k=0,05 25 оС k =1,5 25 оС k =0,008 25 оС k =0,2 25 оС k =0,8 25 оС k =1,1 25 оС k =2,0 35 оС k =1,8 45 оС k =2,3 25 оС k =0,5 25 оС k =0,01 35 оС k =1,5 4н 3М 0,8 1,2 - - 1,28 1,19 - - NaCl 0,9 5н 25% - - 1,5 1,5 1,26 1,125 1,0 - - 3,6 4М 3н - 2,0 2,0 - 1,18 1,11 - 1,0 - 3,0 7н 40% 3,0 5,0 - - 1,42 1,18 - 1,0 - 3,5 2М 3М 1,0 1,5 - - 1,15 1,22 - 0,8 - 2,5 2М 3н - 1,0 0,8 - 1,33 1,15 - - (NH4)2SO4 0,8 2,8 20% 2,5М 1,0 1,5 - - 1,23 1,21 0,75 - - 2,0 3н - 1,2 25 - - 1,35 - - 0,8 - 2,5 - 1,5М 20% 1,5 2,0 - - 1,23 1,18 0,85 - - 3,8 25 оС K=0,02 3М 2М 2,0 1,6 - - 1,06 1,12 - 0,9 - 2,3 - Т1 45 оС k =5,9 45 оС k =5,0 45 оС k=2,0 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 CuSO4+NaOH NH4S+H2SO4 Cu(OH)2+Na2SO4 (NH4)2So4+H2S NaOH+H2S Na2S+H2O H3PO4+NaOH KOH+CO2 H2NaPO4+H2O K2CO3+H2O H3BO3+NaOH Na2B4O7+H2O Al2(SO4)3+NaOH NH3+HCl Na2SO4+Al(OH)3 NH4Cl (NH4)2SO4+BaCl2 BaSO4+NH4Cl Na2GrO4+AgNO3 Ag2GrO4+NaNO3 NH4Cl+Ca(OH)2 Na2S+HCl NH3+CaCl2+H2O H2S+NaCl 2н 2,5М - - 1,2 1,2 1,31 1,11 - 0,85 - 2,5 10% 10% 1,3 1,5 - - 1,016 1,07 0,75 - - 3,6 4н 1,5М - - 3,0 2,2 1,12 1,115 - 0,7 - - 4н 4М 1,5 - - 1,6 1,23 1,21 0,80 - - 3,0 1М - 1,2 25 - - 1,05 - - - K2CO3 0,9 2,2 25% 2н 2,0 - - 2,0 1,16 1,09 - 0,8 - 2,3 6н 25% - 1,2 1,2 - 1,10 1,28 0,83 - - 2,5 3М 2н 1,2 - 1,0 - 0,81 1,04 - 0,65 - 2,0 3н 2М 1,5 1,5 - - 1,12 1,16 - 0,75 - 2,5 20% 2М 2,0 2,2 - - 1,31 1,35 0,70 - - 3,1 2н 0,3М 1,6 5,0 - - 1,21 1,17 0,85 - - 2,8 15% 15% 2,5 3,0 - - 1,14 1,08 - - NaCl 0,88 3,3 CuSO4+Na2S CuS+Na2SO4 2М 3н - - 1,4 1,5 1,107 1,20 0,80 - - 3,8 FeCl3+NaOH Fe(OH)3+NaCl 1н 3М 2,0 3,0 - - 1,08 1,11 - 0,6 - 2,5 H2SO4+NaOH Na2SO4+H2O 4н 5М 2,0 3,0 - - 1,115 1,12 1,0 - - 3,2 30% 2н 0,8 1,5 - - 1,32 1,03 - 0,9 - 3,5 FeI2+NaF NaI+FeF2 NH4Cl+NaOH NaCl+H2O+H3 4М 2н - - 2,0 2,2 1,08 1,13 - - NaCl 0,8 3,0 AgNO3+Na2S Ag2S+Na2NO3 25% 2М 1,5 2 - - 1,23 1,15 0,85 - - 2,5 25 оС k =0,8 55 оС k =7,5 25 оС k =1,2 25 оС k =0,7 35 оС k =0,03 25 оС k =0,8 25 оС k =0,03 25 оС k =0,003 35 оС k =0,1 25 оС k=0,0005 25 оС k=0,05 25 оС k =1,5 25 оС k =0,008 25 оС k =0,2 25 оС k =0,8 45 оС k=6,2 45 оС k =2,0 45 оС k =2,0 45 оС k =2,05 - 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 BaCl2+Na2CO3 KOH+HCl KCl+H2O NaOH+HNO3 KOH+HI BaCO3+NaCl NaNO3+H2O KI+H2O KOH+H2SO3 KHSO3+H2O Pb(NO3)2+(NH4)2S Na2SO3+H2SO4 NH4NO3+PbS Na2SO4+SO2+H2O KOH+Cl2 KClO+KCl+H2O KI+H3PO4 KH2PO4+HI HCl+AgNO3 HNO3+AgCl CuSO4+NaOH NH4S+H2SO4 (NH4)2So4+H2S NaOH+H2S Na2S+H2O H3PO4+NaOH KOH+CO2 Cu(OH)2+Na2SO4 H2NaPO4+H2O K2CO3+H2O H3BO3+NaOH Na2B4O7+H2O Al2(SO4)3+NaOH NH3+HCl NH4Cl Na2SO4+Al(OH)3 25 оС k =1,1 25 оС k =2,0 35 оС k =1,8 45 оС k =2,3 25 оС k =0,5 25 оС k =0,01 35 оС k =1,5 4н 3М 0,8 1,2 - - 1,28 1,19 - - NaCl 0,9 - 5н 25% - - 1,5 1,5 1,26 1,125 1,0 - - 3,6 4М 3н - 2,0 2,0 - 1,18 1,11 - 1,0 - 3,0 7н 40% 3,0 5,0 - - 1,42 1,18 - 1,0 - 3,5 2М 3М 1,0 1,5 - - 1,15 1,22 - 0,8 - 2,5 2М 3н - 1,0 0,8 - 1,33 1,15 - - (NH4)2SO4 0,8 2,8 20% 2,5М 1,0 1,5 - - 1,23 1,21 0,75 - - 2,0 3н - 1,2 25 - - 1,35 - - 0,8 - 2,5 - 1,5М 20% 1,5 2,0 - - 1,23 1,18 0,85 - - 3,8 25 оС K=0,02 3М 2М 2,0 1,6 - - 1,06 1,12 - 0,9 - 2,3 - 2н 2,5М - - 1,2 1,2 1,31 1,11 - 0,85 - 2,5 10% 10% 1,3 1,5 - - 1,016 1,07 0,75 - - 3,6 4н 1,5М - - 3,0 2,2 1,12 1,115 - 0,7 - - 4н 4М 1,5 - - 1,6 1,23 1,21 0,80 - - 3,0 1М - 1,2 25 - - 1,05 - - - K2CO3 0,9 2,2 25% 2н 2,0 - - 2,0 1,16 1,09 - 0,8 - 2,3 6н 25% - 1,2 1,2 - 1,10 1,28 0,83 - - 2,5 3М 2н 1,2 - 1,0 - 0,81 1,04 - 0,65 - 2,0 25 оС k =0,8 55 оС k =7,5 25 оС k =1,2 25 оС k =0,7 35 оС k =0,03 25 оС k =0,8 25 оС k =0,03 45 оС k =5,9 45 оС k =5,0 45 оС k=2,0 45 оС k=6,2 45 оС k =2,0 - 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 (NH4)2SO4+BaCl2 BaSO4+NH4Cl Na2GrO4+AgNO3 Ag2GrO4+NaNO3 NH4Cl+Ca(OH)2 Na2S+HCl NH3+CaCl2+H2O H2S+NaCl 3н 2М 1,5 1,5 - - 1,12 1,16 - 0,75 - 2,5 20% 2М 2,0 2,2 - - 1,31 1,35 0,70 - - 3,1 2н 0,3М 1,6 5,0 - - 1,21 1,17 0,85 - - 2,8 15% 15% 2,5 3,0 - - 1,14 1,08 - - NaCl 0,88 3,3 CuSO4+Na2S CuS+Na2SO4 2М 3н - - 1,4 1,5 1,107 1,20 0,80 - - 3,8 FeCl3+NaOH Fe(OH)3+NaCl 1н 3М 2,0 3,0 - - 1,08 1,11 - 0,6 - 2,5 H2SO4+NaOH Na2SO4+H2O 4н 5М 2,0 3,0 - - 1,115 1,12 1,0 - - 3,2 30% 2н 0,8 1,5 - - 1,32 1,03 - 0,9 - 3,5 FeI2+NaF NaI+FeF2 NH4Cl+NaOH NaCl+H2O+H3 4М 2н - - 2,0 2,2 1,08 1,13 - - NaCl 0,8 3,0 AgNO3+Na2S Ag2S+Na2NO3 25% 2М 1,5 2 - - 1,23 1,15 0,85 - - 2,5 4н 3М 0,8 1,2 - - 1,28 1,19 - - NaCl 0,9 - 5н 25% - - 1,5 1,5 1,26 1,125 1,0 - - 3,6 4М 3н - 2,0 2,0 - 1,18 1,11 - 1,0 - 3,0 7н 40% 3,0 5,0 - - 1,42 1,18 - 1,0 - 3,5 2М 3М 1,0 1,5 - - 1,15 1,22 - 0,8 - 2,5 2М 3н - 1,0 0,8 - 1,33 1,15 - - (NH4)2SO4 0,8 2,8 20% 2,5М 1,0 1,5 - - 1,23 1,21 0,75 - - 2,0 3н - 1,2 25 - - 1,35 - - 0,8 - 2,5 BaCl2+Na2CO3 KOH+HCl KCl+H2O NaOH+HNO3 KOH+HI BaCO3+NaCl NaNO3+H2O KI+H2O KOH+H2SO3 KHSO3+H2O Pb(NO3)2+(NH4)2S Na2SO3+H2SO4 KOH+Cl2 NH4NO3+PbS Na2SO4+SO2+H2O KClO+KCl+H2O 25 оС k =0,003 35 оС k =0,1 25 оС k=0,0005 25 оС k=0,05 25 оС k =1,5 25 оС k =0,008 25 оС k =0,2 25 оС k =0,8 25 оС k =1,1 25 оС k =2,0 35 оС k =1,8 45 оС k =2,3 25 оС k =0,5 25 оС k =0,01 35 оС k =1,5 - 45 оС k =2,0 45 оС k =2,05 45 оС k =5,9 45 оС k =5,0 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 KI+H3PO4 KH2PO4+HI HCl+AgNO3 HNO3+AgCl CuSO4+NaOH NH4S+H2SO4 Cu(OH)2+Na2SO4 (NH4)2So4+H2S NaOH+H2S Na2S+H2O H3PO4+NaOH KOH+CO2 H2NaPO4+H2O K2CO3+H2O H3BO3+NaOH Na2B4O7+H2O Al2(SO4)3+NaOH NH3+HCl Na2SO4+Al(OH)3 NH4Cl (NH4)2SO4+BaCl2 BaSO4+NH4Cl Na2GrO4+AgNO3 Ag2GrO4+NaNO3 NH4Cl+Ca(OH)2 Na2S+HCl NH3+CaCl2+H2O H2S+NaCl 1,5М 3М 20% 2М 1,5 2,0 2,0 1,6 - - 1,23 1,06 1,18 1,12 0,85 - 0,9 - 3,8 2,3 2н 2,5М - - 1,2 1,2 1,31 1,11 - 0,85 - 2,5 10% 10% 1,3 1,5 - - 1,016 1,07 0,75 - - 3,6 4н 1,5М - - 3,0 2,2 1,12 1,115 - 0,7 - - 4н 4М 1,5 - - 1,6 1,23 1,21 0,80 - - 3,0 1М - 1,2 25 - - 1,05 - - - K2CO3 0,9 2,2 25% 2н 2,0 - - 2,0 1,16 1,09 - 0,8 - 2,3 6н 25% - 1,2 1,2 - 1,10 1,28 0,83 - - 2,5 3М 2н 1,2 - 1,0 - 0,81 1,04 - 0,65 - 2,0 3н 2М 1,5 1,5 - - 1,12 1,16 - 0,75 - 2,5 20% 2М 2,0 2,2 - - 1,31 1,35 0,70 - - 3,1 2н 0,3М 1,6 5,0 - - 1,21 1,17 0,85 - - 2,8 15% 15% 2,5 3,0 - - 1,14 1,08 - - NaCl 0,88 3,3 CuSO4+Na2S CuS+Na2SO4 2М 3н - - 1,4 1,5 1,107 1,20 0,80 - - 3,8 FeCl3+NaOH Fe(OH)3+NaCl 1н 3М 2,0 3,0 - - 1,08 1,11 - 0,6 - 2,5 H2SO4+NaOH Na2SO4+H2O 4н 5М 2,0 3,0 - - 1,115 1,12 1,0 - - 3,2 25 оС K=0,02 25 оС k =0,8 55 оС k =7,5 25 оС k =1,2 25 оС k =0,7 35 оС k =0,03 25 оС k =0,8 25 оС k =0,03 25 оС k =0,003 35 оС k =0,1 25 оС k=0,0005 25 оС k=0,05 25 оС k =1,5 45 оС k=2,0 45 оС k=6,2 45 оС k =2,0 45 оС k =2,0 45 оС k =2,05 - 86 87 88 89 90 91 92 93 94 95 96 97 98 99 FeI2+NaF NaI+FeF2 30% 2н 0,8 1,5 - - 1,32 1,03 - 0,9 - 3,5 25 оС k =0,008 25 оС k =0,2 25 оС k =0,8 25 оС k =1,1 25 оС k =2,0 35 оС k =1,8 45 оС k =2,3 25 оС k =0,5 25 оС k =0,01 35 оС k =1,5 NH4Cl+NaOH NaCl+H2O+H3 4М 2н - - 2,0 2,2 1,08 1,13 - - NaCl 0,8 3,0 AgNO3+Na2S Ag2S+Na2NO3 25% 2М 1,5 2 - - 1,23 1,15 0,85 - - 2,5 4н 3М 0,8 1,2 - - 1,28 1,19 - - NaCl 0,9 - 5н 25% - - 1,5 1,5 1,26 1,125 1,0 - - 3,6 4М 3н - 2,0 2,0 - 1,18 1,11 - 1,0 - 3,0 7н 40% 3,0 5,0 - - 1,42 1,18 - 1,0 - 3,5 2М 3М 1,0 1,5 - - 1,15 1,22 - 0,8 - 2,5 2М 3н - 1,0 0,8 - 1,33 1,15 - - (NH4)2SO4 0,8 2,8 20% 2,5М 1,0 1,5 - - 1,23 1,21 0,75 - - 2,0 3н - 1,2 25 - - 1,35 - - 0,8 - 2,5 - 1,5М 20% 1,5 2,0 - - 1,23 1,18 0,85 - - 3,8 25 оС K=0,02 3М 2М 2,0 1,6 - - 1,06 1,12 - 0,9 - 2,3 - 2н 2,5М - - 1,2 1,2 1,31 1,11 - 0,85 - 2,5 25 оС k =0,8 BaCl2+Na2CO3 KOH+HCl KCl+H2O NaOH+HNO3 KOH+HI BaCO3+NaCl NaNO3+H2O KI+H2O KOH+H2SO3 KHSO3+H2O Pb(NO3)2+(NH4)2S Na2SO3+H2SO4 NH4NO3+PbS Na2SO4+SO2+H2O KOH+Cl2 KClO+KCl+H2O KI+H3PO4 KH2PO4+HI HCl+AgNO3 CuSO4+NaOH HNO3+AgCl Cu(OH)2+Na2SO4 45 оС k =5,9 45 оС k =5,0 45 оС k=2,0 -