Л6. Кислородные соединения азота. Табл.1. Свойства оксидов
advertisement
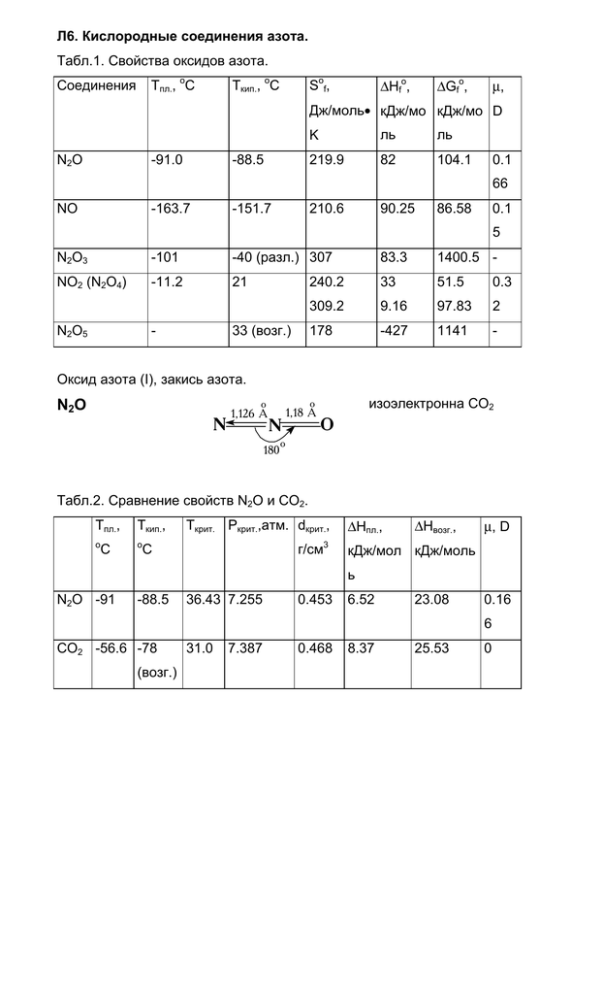
Л6. Кислородные соединения азота.
Табл.1. Свойства оксидов азота.
Тпл., оС
Соединения
Ткип., оС
Sof,
∆Hfo,
∆Gfo,
µ,
Дж/моль• кДж/мо кДж/мо D
N2O
-91.0
-88.5
K
ль
ль
219.9
82
104.1
0.1
66
NO
-163.7
-151.7
210.6
90.25
86.58
0.1
5
N2O3
-101
-40 (разл.) 307
83.3
1400.5 -
NO2 (N2O4)
-11.2
21
240.2
33
51.5
0.3
309.2
9.16
97.83
2
178
-427
1141
-
N2O5
-
33 (возг.)
Оксид азота (I), закись азота.
N2O
N
o
1,126 A
N
180
o
1,18 A
изоэлектронна CO2
O
o
Табл.2. Сравнение свойств N2O и CO2.
Тпл.,
Ткип.,
о
о
С
Ткрит. Ркрит.,атм. dкрит.,
г/см3
С
∆Hпл.,
∆Hвозг.,
µ, D
кДж/мол кДж/моль
ь
N2O -91
-88.5
36.43 7.255
0.453
6.52
23.08
0.16
6
CO2 -56.6 -78
(возг.)
31.0
7.387
0.468
8.37
25.53
0
NH4NO3 → N2O + 2 H2O ( 200 - 220 oC)
HNO2 + HN3→ N2O + N2 + H2O
HNO2 + NH2OH → N2O + 2 H2O
NaNH2 + N2O → NaN3 + H2O
[Ru(NH3)5(H2O)]2+ + N2O → [Ru(NH3)5(N2O)]2+ + H2O
Оксид азота (II), окись азота.
N
lN-O = 1,15 A
O
Заселенность
Молекула
N2
3,000
1,00
NO
2,417
0,9820,9660,469
NO+
2,929
0,9770,9760,976
CO
2,760
0,9080,9260,926
I1 NO
9,26 эв (890,6 кДж/моль)
I1 N (ат.)
14,534 эв
I1 O (ат.)
13,618 эв
N
O
2 NO
o
2,18 A
1,,00
πy
1,00
πy∗ - 1 e
Димер NO - (NO)2
N
o
2,62 A
O
N2O2 - лимитирующая стадия
N2O2 + O2 → N2O4 - быстро
N2O4
πx
σсв.
кратность
2 NO2 - быстро
Нитрозильные комплексы.
[Fe(H2O)5(NO)]2+ - коричневое окрашивание
Na2[Fe(CN)5(NO)] - нитропруссид натрия
(Еа < 0)
O
1,16
N
Cl
o
124
1,97
2,34
P 2,41
P
Cl
2,41
Ir
1,56 C
1,178
O
N
o
138
1,80
Ir
2,37
P2,43
1,16
1,74
O
[Ir(CO)Cl(NO)(PPh3)2]+
M
N
sp 180o
M
N
O
oN
180
1,16 O
[IrCl(NO)2(PPH3)2]+
O
N
M
P
2,43
O (äîíîð ýëåêòðîíîâ)
O
N
sp2 120o M
Cr(CO)6
M
Cr(NO)4
Оксид азота (III), азотистый ангидрид. N2O3.
O
1,142 105,1
N
o
1,864
112,7
o
N
117,5 o
O
1,202
o
129,8
1,217
N2O3⇔ NO(г) + NO2 (г) ∆So298= 139
Дж/моль К; ∆Ho298= 40,5 кДж/моль;
∆Go298= -1,59 кДж/моль; Kp 298= 1,93
O
2 HNO3 + H2O + As2O3 → N2O3 + 2 H3AsO4
2 HNO3 + 2 SO2 → 2 NOHSO4 + 2 H2O → N2O3 + H2SO4
N2O3 + H2O ⇔ 2 HNO2
N2O3 + 3 H2SO4 → 2 NO+ + H3O+ + 3 HSO4N2O3 + 2 NaOH → 2 NaNO2 + H2O
Оксид азота (IV), двуокись азота. NO2, N2O4/
N2O4
2 NO2
∆So298 = 175,7 Дж/моль К
∆Ho298 = 57,20 кДж/моль
∆Go298 = 4,77 кДж/моль
O
N
O
134
1,197
o
N
O
N2O4
1,21
O
1,75
N
135
o
O
O
NO+ + NO3- (+ 2H+) → NO+ + H2NO3+ ( + H+) → NO+ + NO2+
+ H3O+
ρ (0 oC) 1,3•10-13 ом-1см-1 ; ξ = 2,42
“Нейтрализация”.
NOCl + AgNO3 → AgCl + N2O4
2 NIOCl + Sn → SnCl2 + 2 NO
2 [EtNH3]NO3 + N2O4 + Zn → [EtNH3]2[Zn(NO3)4] + 2 NO
CaO + 2 N2O4 → Ca(NO3)2 + N2O3
ZnCl2 + 2 N2O4 → Zn(NO3)2 + 2 NOCl
TiI4 + 4 N2O4 → Ti(NO3)4 + 4 NO + 2 I2
[Mn2(CO)10] + N2O4 → [Mn(CO)5(NO3)] + [Mn(CO)x(NO)y] (x≥1, y=5-x/2)
Fe(CO)5 + 4 N2O4 → [Fe(NO3)3•N2O4] + 5 CO + 3 NO
Cu + 3 N2O4 → (NO)[Cu(NO3)3] + 2 NO
4 SO2 + 3 N2O4 → 2 (NO)2S2O7 + 2 NO
Оксид азота (V), азотный ангидрид.
N2O5 (г)
[NO2+] [NO3-] (тв.)
∆Hfo 298,
Sfo298, Дж/мольК
кДж/моль
∆Gfo298,
кДж/моль
N2O5 (крист.)
-43,1
178,2
113,8
N2O5 (газ)
11,3
355,6
115.1
o
180
O
O
N
O
O
o
180
N
O1,154 N
O
O
O
o
120
N
1,24
O
растворы в CCl4, POCl3.
N2O5 + H2O → 2 HNO3
N2O5 + H2O2 → HONO2 + HOONO2
N2O5 + Na → NaNO3 + NO2
NaF + N2O5 → NaNO3 + NO2F
N2O5 + I2 → I2O5 + N2
N2O5 + 2 SO3 → [NO2]2[S2O7]
Гипонитриты.
HONNOH → {HONNO-] → N2O + OH2 NaNO3 + 8 Na/Hg + 4 H2O → Na2N2O2 + 8 NaOH + 8 Hg
NH2OH + RONO + 2 NaOEt (EtOH) → Na2N2O2 + ROH + 2 EtOH
H2N2O2
O
изомер - нитроамид H2N-NO2
HO-N=N-OH
1,18
1,00
H
N 1,43 N
115 o
H
O
o
130
O
Na2oNNO2 ( Na2N2O3) нитрогиддроксомат натрия
NH2OH + CH3NO3 + CH3ONa (CH3OH) → Na2N2O3 + CH3OH
( H2NO2) Na2NO2 - (гидроазотистая кислота) соль Энгля
NaNO2 (NH3 жидк. электролиз) → Na2NO2
NaNO2 + Na (жидкий NH3) → Na2NO2
Нитриты, азоотистая кислота.
H
0,959
102,1
o
O1,433 N
110,7o
1,177
N
O
O
2HNO2 (газ)
o
115,4
1,236
O
H2O (газ) + NO (газ) + NO2 (газ)
Кр = 8•103
∆H = 38 кДж/моль
Координация нитрит-ионаю
M
O
M
O
N
O
O
M
O
N
O
нитро-
N
нитрито-
хелатная бидентатная
O
O
N
N
O
M
M
O
M
асимметрическая
M
µ2-О бидентатная
бидентатная
Азотная кислота. Нитраты.
H
0,96
102
O
o
o
116
N
1,406
o
114
O
o
130
1,21
O
ρ (20oC) = 3,72•10-2 ом-1см-1
ξ(14oC) = 50 ± 10
Типы координации нитрат-иона.
O
M
O
N
O
монодентатная
O
107-o
M
109
O-o
110
M
118
O
o
120
N
O
бидентатная островная
O
N
O
N
O
O
M
асимметричная бидентатная
O
M
µ2-О,О’ - бидентатная мостиковая
островная
Литература.
1. Ахметов Н.С. “Общая и нерганическая химия”, М.”Высшая школа”, 1988,
стр.337-347.
2. Некрасов Б.В., “Основы общей химии”, М., “Мир”, 1973, т.1, стр.382 - 436.
3. Коттон Ф.А., Уилкинсон Дж., “Современная неорганическая химия”, М.,
”Мир”, 1969, т.2, стр.175-188.
Дополнительная литература.
1.Уэллс А. “Сруктурная неорганическая химия”, М., “Мир”, 1987, т.2, стр.
566-589.


