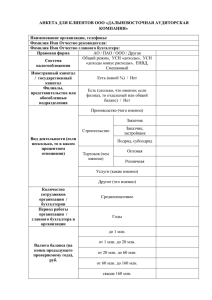
012599 - 1 - Эта заявка претендует на все преимущества
advertisement

012599 Эта заявка претендует на все преимущества предварительных заявок США под номерами 60/462457 и 60/462040 (обе поданы 10 апреля 2003) и 60/499062 (подана 29 августа 2003). Содержание этих заявок включено сюда путем отсылки во всей своей полноте для всех целей. Область техники, к которой относится изобретение Настоящее изобретение обеспечивает композиции и способы уменьшения плотности сенсорных нервных волокон в тканях и улучшения капсаицин-чувствительных состояний и находит применение в области медицины. Уровень техники Канал с транзиторным рецепторным потенциалом (Transient Receptor Potential, TRP) 1 типа (TRPV1), связывающийся с ванилоидами, представляет собой капсаицин-чувствительный лигандзависимый катионный канал, избирательно экспрессируемый на малых немиелинизированных периферических нервных волокнах (кожные ноцицепторы). См. Caterina and Julius, 2001, "The vanilloid receptor: a molecular gateway to the pain pathway," Annu Rev Neurosci. 24:487-517 и Montell et al., 2002, "A unified nomenclature for the superfamily of TRP cation channels," Mol. Cell. 9:229-31. Когда TRPV1 активируется агонистами, такими как капсаицин, и другими факторами, такими как нагревание и ацидоз, кальций входит в клетку и инициируются болевые сигналы. В результате болезни или повреждения кожные ноцицепторы становятся устойчиво гиперактивными, спонтанно передающими избыточные болевые сигналы в спинной мозг в отсутствие болевых стимулов, что приводит к различным типам хронической боли. Когда TRPV1 постоянно активируется посредством продолжительного воздействия агониста (например, капсаицина), избыточный кальций входит в нервное волокно, инициируя процесс, который приводит к долгосрочному, но еще обратимому повреждению функции ноцицептора. Полагают, что это механизм, с помощью которого применение капсаицина обеспечивает снятие боли. Капсаицин также может быть эффективен для улучшения состояния или заболеваний, отличных от боли. Например, капсаицин действует как противовоспалительное средство, отвлекающее средство, средство, уменьшающее жжение и зуд, и противопсориазное средство (в качестве обзора см. Szallasi and Blumberg, 1999, "Vanilloid (Capsaicin) Receptors and Mechanisms," Pharm Revs, 51:159-211). Кроме того, показано, что капсаицин вызывает апоптоз и/или ингибирует пролиферацию злокачественных раковых клеток (в качестве обзора см. Surh, 2002, "More Than Spice: Capsaicin in Hot Chili Peppers Makes Tumor Cells Commit Suicide," J Nat Cancer Inst, 94:1263-65) и уменьшает синоназальные полипы (Baudoin et al., 2000, "Capsaicin significantly reduces sinonasal polyps," Acta Otolaryngol 120:307-11). Кремы с низкой концентрацией капсаицина использовались в течение многих лет для лечения болезненных невропатий и скелетно-мышечной боли, но их использование было ограничено из-за того, что они были болезненными и неудобными в употреблении, обычно требующими многократного применения в течение дня для довольно скромного ослабления боли. Недавно был разработан пластырь с высокой концентрацией капсаицина (NGX-4010; NeurogesX, Inc.), который, как полагают, обеспечивает эффективное и продолжительное освобождение от боли. Настоящее изобретение обеспечивает дополнительные способы и композиции для введения капсаицина и других агонистов TRPV1. Раскрытие изобретения Настоящее изобретение имеет отношение к способам, композициям и устройствам для введения агонистов TRPV1, таких как капсаицин, лицам, нуждающимся в лечении. В одном аспекте изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном участке тела субъекта путем контактирования этого участка с композицией, которая включает агонист TRPV1 и растворяющую систему с одним или более усилителей проницаемости, где указанная композиция доставляет в кожу по меньшей мере около 3 нмоль агониста, как было измерено с помощью способа анализа абсорбции кожей мыши. В одном из воплощений изобретения композиция представляет собой композицию с немедленным высвобождением. В другом воплощении изобретения контактирование происходит в неокклюзионных условиях. В еще одном воплощении контактироване осуществляется в неадгезивных условиях. В одном из воплощений изобретения по меньшей мере около 5 мкл композиции доставляют на каждый см2 участка в течение приблизительно 15 мин. В одном из воплощений изобретения 15-минутное нанесение композиции на кожу млекопитающего приводит к уменьшению плотности функциональных ноцицептивных нервных волокон по меньшей мере приблизительно на 20%. В другом воплощении изобретения плотность функциональных ноцицептивных нервных волокон уменьшается по меньшей мере приблизительно на 50%. Еще в одном воплощении изобретения млекопитающее является мышью. В другом воплощении изобретения млекопитающим является человек. В одном из воплощений изобретение обеспечивает способ лечения капсаицин-чувствительного состояния у субъекта с помощью введения композиции, которая включает агонист TRPV1 и по меньшей мере один усилитель проницаемости, где указанная композиция доставляет в кожу по меньшей мере около 3 нмоль агониста при измерении способом анализа абсорбции кожей мыши. В одном из воплощений изобретения композиция представляет собой композицию с немедленным высвобождением. В другом воплощении введение является неокклюзивным и/или неадгезивным. В одном из воплощений изо-1- 012599 бретения капсаицин-чувствительное состояние представляет собой невропатическую боль, боль, вызываемую смешанными ноцицептивными и невропатическими этиологиями, воспалительную гипералгезию, вульводинию, интерстициальный цистит, гиперактивный мочевой пузырь, гиперплазию простаты, ринит, гиперчувствительность прямой кишки, синдром обожженного рта, ротовой мукозит, герпес, гипертрофию простаты, дерматит, прурит, зуд кожи, шум в ушах, псориаз, бородавки, рак кожи, головные боли или морщины. В родственном аспекте изобретение предоставляет способ лечения капсаицин-чувствительного состояния у субъекта путем введения композиции, которая включает агонист TRPV1 и по меньшей мере два усилителя проницаемости, где указанная композиция доставляет в кожу по меньшей мере около 3 нмоль агониста при измерении способом анализа абсорбции кожей мыши. В различных воплощениях изобретения композиция доставляет в кожу по меньшей мере около 6 нмоль агониста, по меньшей мере около 16 нмоль агониста, по меньшей мере около 32 нмоль агониста, по меньшей мере около 49 нмоль агониста или по меньшей мере около 65 нмоль агониста, как было измерено способом анализа абсорбции кожей мыши. В одном из воплощений изобретения композиция обладает эффектом накопления, который меньше чем приблизительно 0,25, как было измерено способом анализа абсорбции кожей мыши. В некоторых воплощениях изобретения эффект накопления меньше чем приблизительно 0,1, меньше чем приблизительно 0,02 или меньше чем приблизительно 0,001. В одном из воплощений изобретения композиция включает агонист TRPV1 и растворяющую систему, в которой усилитель (усилители) проницаемости составляют по меньшей мере 20% (об./об.) растворяющей системы. В другом воплощении изобретения усилитель (усилители) проницаемости составляют по меньшей мере 50% (об./об.) растворяющей системы, по меньшей мере 90%, по меньшей мере 95% или, по существу, всю растворяющую систему. В одном из воплощений изобретения композиция включает агонист TRPV1 (например, ваниллоид, такой как капсаицин) в концентрации от 0,05% (мас./об.) до 60% (мас./об.). В одном из воплощений изобретения растворяющая система включает усилитель проницаемости, выбранный из простого эфира, сложного эфира, спирта, жирной кислоты, сложного эфира жирной кислоты, жирного спирта, полиола, терпена или амина. В одном из воплощений изобретения растворяющая система включает усилитель проницаемости, выбранный из 1-ментона, диметилизосорбида, каприлового спирта, лаурилового спирта, олеилового спирта, этиленгликоля, диэтиленгликоля, пропиленгликоля, триэтиленгликоля, бутиленгликоля, валериановой кислоты, пеларгоновой кислоты, капроновой кислоты, каприловой кислоты, лауриновой кислоты, олеиновой кислоты, изовалериановой кислоты, изопропилбутирата, изопропилгексаноата, бутилацетата, метилацетата, метилвалерата, этилолеата, полоксамера, dпиперитона, метилноненовой кислоты, метилноненилового спирта и d-пулегона. Изобретение обеспечивает фармацевтическую композицию, включающую терапевтически эффективное количество агониста TRPV1 и один или несколько усилителей проницаемости, и, при необходимости, один или несколько дополнительных терапевтически активных агентов, где указанная композиция доставляет в кожу по меньшей мере около 3 нмоль агониста, как было измерено с помощью способа анализа абсорбции кожей мыши. В одном из воплощений изобретения фармацевтическая композиция находится в форме, пригодной для введения субъекту. В одном из воплощений изобретения концентрация капсаицина больше чем 0,05% и меньше чем 20%. В одном из воплощений изобретения композиция включает агонист TRPV1 и, при необходимости, один или несколько дополнительных терапевтически активных агентов в растворяющей системе, включающей один или несколько усилителей проницаемости, где указанные один или несколько усилителей проницаемости, взятые вместе, составляют по меньшей мере около 50% (об./об.) и до 100% от всей растворяющей системы. В одном из воплощений изобретения композиция включает другой терапевтически активный агент, такой как локальный анестетик. В другом аспекте изобретение обеспечивает систему лечения капсаицин-чувствительного состояния, включающую композицию агониста TRPV1 или микроэмульсию и неокклюзивное, неадгезивное аппликаторное устройство для нанесения композиции на поверхность кожи или слизистой. Альтернативно, композицию помещают в контейнер, отделенный от устройства. В соответствующем воплощении предоставляется набор, включающий композицию или систему и очищающую композицию для удаления агониста. В другом аспекте изобретение обеспечивает микроэмульсию, включающую агонист TRPV1, такой как капсаицин, а также способы лечения с использованием микроэмульсии. В другом аспекте изобретение обеспечивает способ ранжирования двух или более композиций в соответствии с их полезностью для терапевтической доставки агониста TRPV1 субъекту путем определения для каждой композиции эффекта накопления раствора, состоящего из композиции и агониста TRPV1 или отличающегося агониста TRPV1, сравнения значений, полученных для каждой композиции, и ранжирования композиций в соответствии с этими значениями, где композиция с более низким значением оценивается как более подходящая для терапевтической доставки агониста TRPV1. В другом аспекте изобретение обеспечивает способ увеличения количества наносимой местно мо-2- 012599 лекулы, которая проникает в эпидермальный и дермальный слои, путем местного нанесения молекулы в композиции, включающей метилнонениловый спирт или метиноненовую кислоту. В другом родственном аспекте изобретение обеспечивает фармацевтическую композицию, включающую капсаицин и метилнонениловый спирт или метилноненовую кислоту. В другом воплощении изобретение обеспечивает способ доставки агониста TRPV1 в эпидермис и дерму, расположенные под 1 см2 площади поверхности кожи или слизистой оболочки, путем контактирования площади с композицией, включающей агонист TRPV1, и по меньшей мере один усилитель проницаемости, где через 15 или 30 мин после контакта по меньшей мере около 3 нмоль агониста TRPV1 задерживается в эпидермисе или дерме. В некоторых воплощениях изобретения плотность функциональных ноцицептивных нервных волокон в эпидермисе и дерме уменьшается по меньшей мере приблизительно на 20% при измерении после стадии контактирования. Краткое описание фигур Фиг. 1 демонстрирует уменьшение плотности нервных волокон кожи («голая» мышь) после введения агониста TRPV1. Фиг. 2 демонстрирует уменьшение плотности нервных волокон в вульве (крыса) после введения агонистов TRPV1. Transcutol® представляет собой моноэтиловый эфир диэтиленгликоля (DGME). Фиг. 3 демонстрирует болевое поведение после нанесения агониста TRPV1 на вульву (крыса). Фиг. 4 демонстрирует болевое поведение после нанесения агониста TRPV1 на кожу (тыльная часть лапы крысы). Осуществление изобретения 1. Введение. Настоящие изобретения отчасти имеют отношение к открытию того, что введение агониста TRPV1 в условиях, в которых значительное количество агониста быстро и эффективно доставляется и остается в коже, обеспечивает поразительные преимущества. В частности, такая доставка приводит к значительному снижению плотности функциональных ноцицептивных нервных волокон кожи и слизистых на обрабатываемой поверхности после краткого контакта с агонистом (см. ниже примеры 1, 2 и 3). Более того, полагают, что дискомфорт, который обычно возникает после контакта с агонистом TRPV1, таким как капсаицин, уменьшается, если агонист быстро и эффективно проникает и остается в коже или слизистых (см. ниже примеры 4 и 5). В родственном аспекте изобретение обеспечивает способ лечения капсаицин-чувствительного состояния у субъекта с помощью введения композиции, включающей капсаицин или другой агонист TRPV1, в условиях, в которых значительное количество агониста быстро и эффективно доставляется и остается в коже или слизистых. В одном из аспектов настоящего изобретения композицию, включающую агонист TRPV1, включающую, при необходимости, дополнительный терапевтически активный агент (агенты), включающую растворяющую систему, в состав которой входит по меньшей мере один усилитель проницаемости, и включающую, при необходимости, другие компоненты, как описано ниже, приводят в контакт с намеченным участком тела субъекта, (например, кожей или слизистыми). Для большей ясности композицию иногда обозначают как «вводимую композицию». В некоторых воплощениях растворяющая система характеризуется тем, что один или несколько усилителей проницаемости составляют в ней большую долю. 2. Определения и условные обозначения. Чтобы облегчить читателю понимание изобретения, приведены следующие определения. Если специально не оговорено, подразумевается, что все используемые здесь термины, относящиеся к области техники, обозначения и другие научные или медицинские термины или терминология имеют общепринятое для специалистов в области химии и медицины толкование. Иногда для большей ясности и/или для быстрого ознакомления термины с общепринятыми значениями разъясняются дополнительно, и включение сюда таких разъяснений не следует воспринимать как попытку продемонстрировать существенное отличие используемого термина от его обычного употребляемого смысла в этой области техники. Термин «терапевтически эффективное количество» или «терапевтически эффективная доза» относится к количеству или дозе средства, необходимым для получения клинически желательных результатов, таким как биологический или химический ответ (например, уменьшение плотности функциональных ноцицептивных нервных волокон кожи и слизистых у субъекта, нуждающегося в таком уменьшении), облегчение или улучшение одного или нескольких симптомов заболевания или состояния, уменьшение степени выраженности заболевания или стабилизированное состояние заболевания. Термин «лечение» состояния или пациента относится к предприниманию шагов для получения полезных или желаемых результатов, включая клинические результаты. Для достижения целей настоящего изобретения полезные или желаемые клинические результаты включают, но не ограничиваются только ими, облегчение или улучшение одного или нескольких симптомов, характеризующие уменьшение степени выраженности заболевания, задержку или замедление прогрессирования заболевания, улучшение, временное облегчение или стабилизацию состояния болезни и другие полезные результаты, описанные ниже. Термин «фармацевтически приемлемая соль» относится к соли с кислотой или основанием, которая -3- 012599 является токсикологически безопасной для введения субъекту, и которая без каких-либо ограничений включает фосфат, сульфат, лактат, напсилат, мезилат, гидрохлорид, натриевую, калиевую, nметилглюкаминовую и трометаминовую соли. Термины «локальное введение», «местное введение», «местно» и их грамматические эквиваленты относятся к введению биологически активного соединения на предварительно выбранный или определенный участок тела, такой как определенный или ограниченный участок поверхности кожи, слизистой мембраны, определенного органа, определенного отростка или участка (например, ступни). Термины «локальное» или «местное введение», используемые в этом тексте, не включают введение с помощью подкожной инъекции. Термины «совершенно растворимый», или «полностью растворенный», или «полностью в растворе» относятся к визуально прозрачному гомогенному раствору, в котором практически полностью отсутствуют суспендированные или нерастворенные частицы терапевтически активных агентов. Количественное определение прозрачности раствора можно произвести с помощью турбидиметрических измерений, например уменьшения прозрачности жидкости, вызванного присутствием нерастворенного вещества (см. Lawler, 1995, Turbidimetry and Nephelometry Encyclopedia of Analytical Science, ed. P. Worsfold, Academic Press Ltd., UK). Можно использовать такие приборы, как турбидиметр Model 2100AN или 2100N (Hach Co., Loveland, CO). Обычно мутность композиции, включающей терапевтически активный агент, меньше чем приблизительно 10 NTU (нефелометрическая единица мутности), более часто эта величина меньше приблизительно 5 NTU или меньше приблизительно 3 NTU. Термин «роговой слой» относится к внешнему слою кожи, который является основным барьерным слоем. Роговой слой создает скорость-лимитирующий барьер для диффузии активного агента через кожу. Термин «усилитель проницаемости» относится к агентам, которые повышают скорость транспорта активного агента через кожу в подкожный слой и которые применяют для доставки активных агентов таким организмам, как млекопитающие. Термины «индивидуум» или «субъект» относятся к позвоночному животному, предпочтительно млекопитающему и часто человеку. Млекопитающие включают, но не ограничиваются только ими, людей, отличных от человека приматов, экспериментальных модельных животных (например, мышей и крыс), важных для сельского хозяйства животных и домашних животных. Употребляемый в этом тексте термин «произведенная или рецептированная по стандартам GMP», относящийся к фармацевтической композиции, означает композицию, произведенную в полном соответствии со всеми правилами качественной производственной практики (ОМР) Управления по продуктам питания и лекарственным средствам США (U.S. Food and Drug Administration). Термин «функциональность нервного волокна (NFF)» является критерием функциональной или структурной инактивации ноцицептивных (экспрессирующих TRPV1) сенсорных нервных волокон. Изменение NFF можно выразить как изменение плотности функциональных нервных волокон, определенной с помощью иммуноокрашивания или морфологии, как описано ниже. Альтернативно, изменение NFF можно выразить как изменение чувствительности нервного волокна (например, к изменениям температуры). Употребляемые в этом тексте термины «доставлять», «доставка» и грамматические эквиваленты (например, «доставка агониста в эпидермис и дерму») относятся к выполнению действия, результатом которого является перенос агента (например, агониста TRPV1) в ткань-мишень (например, эпидермис и дерму). Например, капсаицин можно доставить в дерму, нанося капсаицинсодержащую композицию настоящего изобретения на ненарушенную поверхность кожи, покрывающей дерму. Употребляемый в этом тексте термин «задерживаемый» (например, как «агонист, задерживаемый в коже») относится к количеству средства, обнаруживаемого в определенной ткани (например, эпидермисе и дерме) в определенный момент времени (например, через 15 мин после нанесения агонистсодержащей композиции). Для описания, приведенного ниже, используют следующие условные обозначения и сокращения: если специально не указано, температура выражена в градусах стоградусной шкалы, и все измерения проводят при 1 атм и температуре от 23 до 32°С. Сокращения, применяемые в этом раскрытии изобретения, включают «мкл» (микролитр); «мл» (миллилитр); «нмоль» (наномоль), «РЕ» (усилитель проницаемости), «ТАА» (терапевтически активный агент); масса/объем (мас./об.), объем/объем (об./об.). Ссылки на определенное время после введения композиции, включающей агонист TRPV1 (например, «15 мин»), относятся к времени, которое прошло после первого начального контакта, композиции с субъектом (например, времени нанесения). Если специально не указано или не очевидно из контекста, измерения могут проводиться 15 или 30 мин после введения композиции, и полученные значения нормируют на введение на 1 см площади. 3. Агонисты TRPV1. Агонисты TRPV1, полезные в настоящем изобретении, включают капсаицин, аналоги и производные капсаицина и другие низкомолекулярные соединения (например, с мол. массой < 1000), которые являются агонистами TRPV1. Капсаицин можно рассматривать как прототипичный агонист TRPV1. Кап-4- 012599 саицин (также называемый 8-метил-N-ванилил-транс-6-ноненамид; (6Е)-N-[(4-гидрокси-3-метоксифенил)метил]-8-метилнон-6-енамид; N-[(4-гидрокси-3-метоксифенил)метил]-8-метил-(6Е)-6-ноненамид; N-(3-метокси-4-гидроксибензил)-8-метилнон-транс-6-енамид; (Е)-N-[(4-гидрокси-3-метоксифенил)метил]-8-метил-6-ноненамид) имеет следующую химическую структуру: Кроме капсаицина можно вводить множество аналогов и производных капсаицина и другие агонисты TRPV1. Ваниллоиды, такие как капсаициноиды, являются примерами полезных агонистов TRPV1. Примеры ваниллоидов, полезных в настоящем изобретении, включают N-ванилил-алкандиенамиды, Nванилил-алкандиенилы, N-ванилил-цис-мононенасыщенные алкенамиды, капсаицин, дигидрокапсаицин, норгидрокапсаицин, нордигидрокапсаицин, гомокапсаицин и гомодигидрокапсаицин. В другом воплощении изобретения агонист TRPV1 является веществом, не обладающим ванилильной функциональной группой, таким как пиперин или диальдегид сесквитерпена (например, варбурганаль, полигодиаль или изовеллераль). В другом воплощении изобретения агонист TRPV1 является трипренилфенолом, таким как скутигераль. Другие агонисты TRPV1 описаны в американских патентах под номерами 4599342; 5962532; 5762963; 5221692; 4313958; 4532139; 4544668; 4564633; 4544669; 4493848; 4532139 и в РСТ-публикации WO 00/50387. Другие полезные агонисты TRPV1 включают фармакологически активные гингеролы, пиперины, шогаолы и, в особенности, гваякол, евгенол, цингерон, цивамид, нонивамид, нуванил, олванил, NE-19550, NE-21510 и NE-28345 (см. Dray et al.,1990, Eur. J. Pharmacol 181:289-93 и Brand et al., 1990, Agents Actions 31:329-40), резинифератоксин, аналоги резинифератоксина и производные резинифератоксина (например, тиниатоксин). Можно использовать любые активные геометрические изомеры или стереоизомеры упомянутых выше агонистов. Другие агонисты TRPV1 представляют собой ваниллоиды, которые имеют участки связывания с рецептором TRPV1, такие как монофенольный монозамещенный бензиламин, амидированный с помощью алифатического циклизованного, обычного или разветвленного заместителя. Еще одни полезные агонисты TRPV1 для практического использования изобретения можно легко идентифицировать, используя стандартную методологию, описанную в американской патентной публикации US 20030104085. Полезные способы анализа идентификации агонистов TRPV1 включают, но не ограничиваются только ими, анализ связывания с рецептором, функциональную оценку стимуляции входа кальция или мембранного потенциала в клетках, экспрессирующих рецептор TRPV1, анализ способности индуцировать клеточную смерть в таких клетках (например, селективное удаление нейронов С-волокон) и другие способы анализа, известные в этой области техники. Также можно использовать смеси агонистов и фармацевтически приемлемых солей любых вышеперечисленных соединений. См. публикацию Szallasi and Blumberg, 1999, Pharmacological Reviews 51:159-211, U.S. Pat. No. 5879696 и ссылки в ней. 4. Быстрая доставка агонистов TRPV1 в высоком количестве. Настоящее изобретение частично имеет отношение к открытию того, что введение агониста TRPV1 в условиях, в которых значительное количество агониста быстро и эффективно доставляется и преимущественно остается в коже, обеспечивает поразительные преимущества. В одном из аспектов изобретение обеспечивает способ для лечения капсаицин-чувствительного состояния с помощью введения композиции, которая включает агонист TRPV1 и один или несколько усилителей проницаемости. В воплощении изобретения композиция осуществляет доставку в кожу по меньшей мере около 3 нмоль агониста, как было измерено способом анализа абсорбции кожей мыши. Анализ абсорбции кожей мыши кожи детально описан ниже. Как обсуждено ниже, при анализе абсорбции кожей мыши доставка определенного молярного количества агониста в кожу мыши относится к количеству средства, доставленного на 1 см2 (как было пронормировано для данных для 0,8 см2 поверхности кожи, использованной в анализе) в течение 15 мин в условиях измерения. В родственном аспекте изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном типе ткани субъекта с помощью контактирования ткани с композицией, которая включает агонист TRPV1 и один или несколько усилителей проницаемости. В воплощении изобретения композиция осуществляет доставку в кожу по меньшей мере около 3 нмоль агониста, как было измерено способом анализа абсорбции кожей мыши. В родственном аспекте изобретение обеспечивает фармацевтическую композицию, включающую агонист TRPV1 и один или несколько усилителей проницаемости, где композиция осуществляет доставку в кожу по меньшей мере около 3 нмоль агониста, как было измерено способом анализа абсорбции кожей мыши. В одном из воплощений изобретения агонист TRPV1 представляет собой капсаицин и количество доставленного агониста составляет по меньшей мере около 3 нмоль, по меньшей мере около 6 нмоль, по -5- 012599 меньшей мере около 9 нмоль, по меньшей мере около 16 нмоль, по меньшей мере около 32 нмоль, по меньшей мере около 49 нмоль или по меньшей мере около 65 нмоль, как было измерено способом анализа абсорбции кожей мыши. В воплощении изобретения агонист TRPV1 представляет собой капсаицин, и количество доставленного агониста находится в диапазоне от приблизительно 3 до приблизительно 290 нмоль, например в области с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль, где верхний предел выше, чем нижний предел. В родственном аспекте изобретения агонист TRPV1 представляет собой агонист, отличный от капсаицина, и количество доставленного агониста, как было измерено способом анализа абсорбции кожей мыши, составляет по меньшей мере около 3 нмоль, по меньшей мере около 6 нмоль, по меньшей мере около 9 нмоль, по меньшей мере около 16 нмоль, по меньшей мере около 32 нмоль, по меньшей мере около 49 нмоль или по меньшей мере около 65 нмоль, или находится в диапазоне от приблизительно 3 до приблизительно 290 нмоль, например в области с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль, где верхний предел выше, чем нижний предел. В родственном аспекте изобретения агонист TRPV1 представляет собой агонист, отличный от капсаицина, и количество доставленного агониста, как было измерено способом анализа абсорбции кожей мыши, эквивалентно по меньшей мере приблизительно 3 нмоль капсаицина, по меньшей мере приблизительно 6 нмоль капсаицина, по меньшей мере приблизительно 9 нмоль капсаицина, по меньшей мере приблизительно 16 нмоль капсаицина, по меньшей мере приблизительно 32 нмоль капсаицина, по меньшей мере приблизительно 49 нмоль капсаицина или по меньшей мере приблизительно 65 нмоль капсаицина, или эквивалентно диапазону от приблизительно 3 до приблизительно 290 нмоль капсаицина, например в области с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль капсаицина и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль капсаицина, где верхний предел выше, чем нижний предел. Молярное количество агониста TRPV1, которое эквивалентно в том смысле, как термин используется в этом контексте, молярному количеству (например, 3 нмоль) капсаицина, можно определить, используя стандартную методологию. Так как активность и эффективность агонистов TRPV1 могут различаться, в некоторых случаях после определения оптимальной доставляемой дозы капсаицина полезно подобрать концентрацию или дозировку агониста TRPV1, не являющегося капсаицином. Количество молей некапсаицинового агониста TRPV1, которое будет давать тот же самый уровень выраженности биологического эффекта (например, сниженную функцию ноцицептивного нервного волокна), который производится 1 моль капсаицина, обозначают как один капсаициновый эквивалент («СЕ»). Понятие СЕ является аналогом «морфиновых эквивалентов», используемых для прогнозирования уровней эквивалентной аналгезирующей дозы различных опиоидных анальгетиков (см., например, Kaiko, 1986, "Controversy in the management of chronic cancer pain: therapeutic equivalents of IM and PO morphine" J Pain Symptom Manage. 1:42-5; Hoskin et al., 1991, "Opioid agonist-antagonist drugs in acute and chronic pain states" Drugs 41:326-44). Значения СЕ устанавливают как из активности, так и эффективности агониста TRPV1, которые сравнивали с капсаицином в идентичных условиях анализа. Один из способов определения относительной активности и эффективности агонистов TRPV1 состоит в использовании стандартизованного анализа in vitro, например основанного на технологии флуориметрического ридера для пластин для визиографии (FLIPR) (Sullivan et al., 1999, "Measurement of [Ca2+] using the Fluorimetric Imaging Plate Reader (FLIPR)" Methods Mol Biol. 114:125-33). Анализы с помощью FLIPR широко использовались для характеристики и сравнения большого числа агонистов TRPV1 (см., например, Smart et al., 2001, "Characterisation using FLIPR of human vanilloid VR1 receptor pharmacology" Eur J Pharmacol. 417:51-8; Witte et al., 2002, "Use of a fluorescent imaging plate reader-based calcium assay to assess pharmacological differences between the human and rat vanilloid receptor" J biomol Screen. 7:466-475 и Behrendt et al., 2004, "Characterization of the mouse cold-menthol receptor TRPM8 and vanilloid receptor type-1 VR1 using a fluorimetric imaging plate reader (FLIPR) assay" Br J Pharmacol. 141:737-45). В одном из способов определения значения СЕ для некапсаицинового агониста TRPV1 складывают активность и эффективность соединения, считая, что значения, измеряемые для капсаицина в анализе FLIPR, равны 0,5 как для активности, так и для эффективности (что дает суммарное значение, равное 1,0). Затем определяют значения активности и эффективности другого агониста TRPV1 и нормируют на значение 0,5, принятое для капсаицина. Суммарное нормированное значение для другого агониста TRPV1 сравнивают с 1,0 для капсаицина, чтобы получить приблизительное количество нмолей некапсаицинового агониста TRPV1, который, как предполагается, при нанесении будет оказывать такой же эффект, например, на функциональность нервных волокон (NFF), что и капсаицин. В следующем аспекте изобретения композиция осуществляет доставку агониста TRPV1 с существенным эффектом накопления. Используемый здесь термин «эффект накопления» относится к задержке агониста в коже при анализе на коже мыши, и представляет собой отношение количество агониста, покинувшего кожу, к количеству, задержавшемуся в коже при анализе абсорбции кожей мыши. Таким образом, в одном из аспектов изобретение обеспечивает способ лечения капсаицин-6- 012599 чувствительного состояния путем введения композиции, которая включает агонист TRPV1 и один или несколько усилителей проницаемости, в котором композиция осуществляет доставку в кожу 3 нмоль или больше чем 3 нмоль агониста, как было измерено способом анализа абсорбции кожей мыши, и в котором значительная доля агониста задерживается в коже. В родственном аспекте изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном типе тканей субъекта путем контактирования ткани с композицией, которая включает агонист TRPV1 и один или несколько усилителей проницаемости, в котором композиция осуществляет доставку в кожу 3 нмоль или больше чем 3 нмоль агониста, как было измерено способом анализа абсорбции кожей мыши, и в котором значительная доля агониста задерживается в коже. В некоторых воплощениях изобретения, например, отношение количества агониста, который входит в рецепторную камеру при анализе абсорбции кожей мыши, к количеству, задержавшемуся в коже, меньше чем приблизительно 0,25, меньше чем приблизительно 0,2, меньше чем приблизительно 0,15, меньше чем приблизительно 0,1, меньше чем приблизительно 0,04, меньше чем приблизительно 0,02, меньше чем приблизительно 0,01, меньше чем приблизительно 0,004, меньше чем приблизительно 0,002, меньше чем приблизительно 0,0015 или меньше чем приблизительно 0,001. В некоторых воплощениях изобретения отношение количества агониста, который входит в рецепторную камеру при анализе абсорбции кожей мыши, к количеству, задержавшемуся в коже в определенный момент времени, находится между приблизительно 0,0001 и приблизительно 0,25, часто между приблизительно 0,0001 и приблизительно 0,2, иногда между приблизительно 0,0001 и приблизительно 0,1 и иногда между приблизительно 0,0001 и приблизительно 0,04. В некоторых воплощениях изобретения отношение количества агониста, который входит в рецепторную камеру при анализе абсорбции кожей мыши, к количеству, задержавшемуся в коже, находится между приблизительно 0,001 и приблизительно 0,25, часто между приблизительно 0,01 и приблизительно 0,2, иногда между приблизительно 0,1 и приблизительно 0,25. В одном из воплощений изобретения отношение количества агониста в дерме к количеству в эпидермисе находится в диапазоне от 0,5 до 2, как измерено способом анализа абсорбции кожей мыши. В некоторых воплощениях изобретения отношение находится в диапазоне от 0,75 до 1,5. В родственном воплощении изобретение обеспечивает способ лечения капсаицин-чувствительного состояния путем введения композиции, которая включает агонист TRPV1, в условиях, в которых значительное количество агониста быстро доставляется и преимущественно задерживается в ткани-мишени, такой как кожа, слизистая оболочка и эндотелий, не ограничиваясь только ими. В другом соответствующем воплощении изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон в определенном типе ткани субъекта путем контактирования ткани с композицией, которая включает агонист TRPV1 в условиях, в которых значительное количество агониста быстро доставляется и преимущественно задерживается в ткани-мишени. В воплощении изобретения «условия, в которых значительное количество агониста быстро доставляется в ткань-мишень» относятся к введению агониста TRPV1 в условиях, которые приводят к доставке по меньшей мере 3 нмоль агониста на см2 площади поверхности нанесения (например, площади поверхности кожи или слизистой оболочки) в пределах 30 мин, более часто в пределах 15 мин и иногда в пределах 5 мин. В одном из воплощений изобретения «условия, в которых значительное количество агониста быстро доставляется в кожу», определяются как условия, измеренные у субъекта-человека. В одном из аспектов изобретения субъект-человек представляет собой субъекта с нормальным здоровьем. В одном из аспектов изобретения субъект-человек представляет собой субъекта, нуждающегося в лечении капсаицинчувствительного заболевания или состояния. Таким образом, в одном из аспектов изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном участке ткани субъекта с помощью местного введения значительного количества агониста в участок в течение менее чем приблизительно 30 мин, при необходимости в течение менее чем приблизительно 15 мин и при необходимости в течение менее чем приблизительно 10 мин. Значительное количество может быть по меньшей мере 3 нмоль, при необходимости по меньшей мере 6 нмоль, по меньшей мере приблизительно 9 нмоль, по меньшей мере приблизительно 16 нмоль, по меньшей мере приблизительно 32 нмоль, по меньшей мере приблизительно 49 нмоль или по меньшей мере приблизительно 65 нмоль, или находится в диапазоне от приблизительно 3 нмоль до приблизительно 290 нмоль, например в диапазоне с нижним пределом от 3, 6, 9, 16, 32 или 49 нмоль и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль на см2 поверхности участка (например, кожи, слизистой оболочки и эндотелия, например, мочевого пузыря), где верхний предел выше, чем нижний предел. В альтернативном воплощении изобретения условия, в которых значительное количество агониста быстро доставляется в кожу, определяются как условия, измеренные в анализе на коже мыши. В одном из воплощений изобретения агонист TRPV1 представляет собой капсаицин, и количество доставленного агониста составляет по меньшей мере около 3 нмоль, по меньшей мере около 6 нмоль, по меньшей мере около 9 нмоль, по меньшей мере около 16 нмоль, по меньшей мере около 32 нмоль, по меньшей мере около 49 нмоль или по меньшей мере около 65 нмоль. В воплощении изобретения агонист TRPV1 представляет собой капсаицин, и количество доставленного агониста находится в диапазоне от -7- 012599 около 3 нмоль до приблизительно 290 нмоль, например в диапазоне с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль, где верхний предел выше, чем нижний предел. В родственном аспекте изобретения агонист TRPV1 представляет собой агонист, отличный от капсаицина, и количество доставленного агониста составляет по меньшей мере около 3 нмоль, по меньшей мере около 6 нмоль, по меньшей мере около 9 нмоль, по меньшей мере около 16 нмоль, по меньшей мере около 32 нмоль, по меньшей мере около 49 нмоль или по меньшей мере около 65 нмоль, или находится в диапазоне от около 3 до приблизительно 290 нмоль, например в диапазоне с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль, где верхний предел выше, чем нижний предел. В родственном аспекте изобретения агонист TRPV1 представляет собой агонист, отличный от капсаицина, и количество доставленного агониста эквивалентно по меньшей мере приблизительно 3 нмоль капсаицина, по меньшей мере приблизительно 6 нмоль капсаицина, по меньшей мере приблизительно 9 нмоль капсаицина, по меньшей мере приблизительно 16 нмоль капсаицина, по меньшей мере приблизительно 32 нмоль капсаицина, по меньшей мере приблизительно 49 нмоль капсаицина или по меньшей мере приблизительно 65 нмоль капсаицина, или эквивалентно диапазону от приблизительно 3 до приблизительно 290 нмоль капсаицина, например диапазону с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль капсаицина и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль капсаицина, где верхний предел выше, чем нижний предел. В одном из аспектов изобретение обеспечивает способ лечения капсаицин-чувствительного состояния путем введения композиции, которая включает агонист TRPV1, в условиях, в которых значительное количество агониста быстро доставляется и преимущественно задерживается в ткани. В другом родственном воплощении изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон в определенном типе ткани субъекта путем контактирования ткани с композицией, которая включает агонист TRPV1 в условиях, в которых значительное количество агониста быстро доставляется и преимущественно задерживается в коже. Систематический контакт с болюсными дозами агонистов TRPV1 создает угрозу безопасности пациентов. Это происходит потому, что эти рецепторы экспрессируются в нервных волокнах, которые регулируют сердечно-сосудистую систему (и другие системы органов), поэтому ожидается, что быстрая активация этих нервов вызовет быстрые изменения в частоте сокращений сердца и кровяном давлении (Zahner et al., "Cardiac vanilloid receptor 1expressing afferent nerves and their role in the cardiogenic sympathetic reflex in rats" J Physiol. 551:515-23). Такие изменения проблематичны для пожилых пациентов и для пациентов с уже существовавшим сердечно-сосудистым заболеванием. Таким образом, неожиданное открытие того, что усиленное и быстрое экспонирование кожи, слизистых мембран и других типов ткани агонистам TRPV1, как описано здесь, можно осуществить без значительной системной доставки лекарственного средства, делает возможным местное применение композиций, включающих агонист TRPV1, с относительно высоким запасом безопасности. В одном из аспектов настоящее изобретение обеспечивает способ доставки агониста TRPV1 в эпидермис и дерму, расположенные под 1 см2 площади поверхности кожи или слизистой оболочки млекопитающего, путем контактирования площади с композицией, включающей агонист TRPV1 и по меньшей мере один усилитель проницаемости, причем в этом способе через 30 мин после контактирования по меньшей мере около 3 нмоль агониста TRPV1 задерживается в эпидермисе и дерме. В родственном аспекте настоящее изобретение обеспечивает способ доставки агониста TRPV1 в эпидермис или дерму, расположенные под 1 см2 площади поверхности кожи или слизистой оболочки млекопитающего, путем контактирования площади с композицией, включающей агонист TRPV1 и по меньшей мере один усилитель проницаемости, причем через 15 мин после контактирования по меньшей мере около 3 нмоль агониста TRPV1 задерживается в эпидермисе или дерме. В различных воплощениях изобретения количество агониста TRPV1, удерживаемого в эпидермисе и дерме, составляет по меньшей мере около 3 нмоль, по меньшей мере около 6 нмоль, по меньшей мере около 9 нмоль, по меньшей мере около 16 нмоль, по меньшей мере около 32 нмоль, по меньшей мере около 49 нмоль или по меньшей мере около 65 нмоль. В одном из воплощений изобретения агонист TRPV1 представляет собой капсаицин, и количество доставленного агониста находится в диапазоне от около 3 до приблизительно 290 нмоль, например в диапазоне с нижним пределом в 3, 6, 9, 16, 32 или 49 нмоль и независимо выбранным верхним пределом в 6, 9, 16, 32, 49, 65, 75, 90, 120, 200 и 290 нмоль, где верхний предел выше, чем нижний предел. Будет понятно, что при измерении содержания агониста в эпидермисе или дерме, расположенными под 1 см2 площади, действительное поперечное сечение анализированной ткани может быть меньше (например, 0,8 см2) или больше чем 1 см2, и измеренное содержание агониста может быть нормировано к количеству на 1 см2. В одном из воплощений изобретения агонист приводят в контакт с кожей, поверхностью слизистой оболочки или мочевого пузыря in vitro (например, при использовании способа анализа абсорбции кожей мыши или сходного способа анализа). В другом воплощении изобретения агонист приводят в контакт с кожей, поверхностью слизистой оболочки или мочевого пузыря in vivo (например, с помощью нанесения композиции на кожу человека или животного, например мыши), и образец ткани выделяют (например, -8- 012599 поверхность кожи и лежащие под ней дерму и эпидермис) и определяют в нем содержание агониста. Используя рутинные методы, например перфорирующую биопсию или иссечение, можно выделить образцы ткани. Содержание агониста можно определить, используя количественные методы, например ВЭЖК-МС (см. примеры), в зависимости от индивидуального применяемого агониста. При необходимости можно провести независимые определения для дермального и эпидермального слоев и объединить результаты. В одном из воплощений изобретения агонист TRPV1 является капсаицином. В одном из воплощений изобретения млекопитающее представляет собой субъекта-человека. Субъект-человек может быть здоров или может страдать от капсаицин-чувствительного состояния. В следующем аспекте количество агониста, доставляемого в нижерасположенную ткань (дерма или эпидермис), достаточно для уменьшения плотности функциональных ноцицептивных нервных волокон в эпидермисе и дерме (т.е. для сниженной функции нервного волокна) по меньшей мере приблизительно на 20% при измерении через 1, 2, 3, 4, 5, 6 или 7 дней после указанной стадии контактирования. В альтернативных воплощениях изобретения уменьшение плотности составляет по меньшей мере около 30%, по меньшей мере около 40%, по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70% или по меньшей мере около 80% по сравнению с необработанным участком. Будет ясно, что, если концентрацию агониста и NFF определяют для одного и того же субъекта, измерения проводят, используя различные области тканей. Более часто, однако, анализы можно проводить у различных субъектов, чтобы установить, что предусмотренные условия контактирования (применение агониста TRPV1 в комбинации с композициями изобретения) приводят к предусмотренной доставке агониста и/или уменьшению NFF. 4.1. Способ анализа абсорбции кожей мыши. «Способ анализа абсорбции кожей мыши» представляет собой способ анализа in vitro, основанный на использовании ячейки Франца, в котором применяют кожу мышей Nu/Nu («голых» мышей) для определения (1) количества агониста, который проникает в кожу через 15 мин после введения агониста на поверхность кожи площадью 0,8 см2; (2) соотношения агониста в коже, найденного в эпидермальном и дермальном слоях и (3) количества агониста, которое прошло сквозь кожу (например, вошло в рецепторную камеру ячейки Франца). Этот способ анализа, подробно описанный ниже в примере 1, измеряет количество агониста, которое задерживается в дерме и эпидермисе через пятнадцать минут после контакта кожи с композицией, включающей агонист. В соответствии с сообщениями, в которых исследования in vitro кожи «голых» мышей прогнозируют результаты, получаемые для живых животных (Venter et al., 2001, "А comparative study of an in situ adapted diffusion cell and an in vitro Franz diffusion cell method for transdermal absorption of doxylamine" Eur J Pharm Sci. 13:169-77), доставка агониста TRPV1 в кожу по модели кожи мыши коррелирует с уменьшением функциональности нервных волокон in vivo после введения агониста (см. примеры, иллюстрирующие взаимосвязь между доставкой агониста TRPV1 в кожу «голой» мыши in vitro и фармакологическими эффектами на нервные волокна кожи, иммуноокрашенные при анализе in vivo). У млекопитающих физические процессы, например диффузия, распределение и физическое связывание, различаются предсказуемым образом (Franz et al., 1992, In: Treatise on Controlled Drug Delivery. Edited by A. Kydonieus. Marcel Dekker, Inc. New York), и исследования кожи «голой» мыши in vitro рассматриваются как прогноз скоростей проникновения лекарственного вещества и растворителей в кожу человека (Durrheim et al., 1980, "Permeation of hairless mouse skin I: Experimental methods and comparison with human epidermal permeation by alkanols" J. Pharm. Sci. 69:781-6; см. также Tojo, 1987, "Mathematical modeling of skin permeation of drugs" J. Chem. Eng. Jpn. 20:300-308; и Tojo, 1988, "Concentration profile in plasma after transdermal drug delivery" Int. J. Pharm. 43:201-205). Примечательно, что плотность волосяных фолликулов у безволосых животных, таких как «голая» мышь, сближает эти мембраны с кожей человека (Katz, 1993, "Rationale and Approaches to Skin Permeation" In: Skin Permeation, Fundamentals and Application, Edited by JL. Zatz. Allured Publishing Corp. Wheaton, IL). С помощью способа анализа абсорбции кожей мыши можно измерить несколько значений. Можно измерить количества агониста, которые проникают в эпидермис («Е») и дерму («D»). (В значениях, приведенных в примерах, количество, которое проникает в поперечное сечение кожи площадью 0,8 см2, нормируют на 1 см2, умножая его на 1,25). Соотношение этих двух значений («E/D»), рассматриваемое как «эффект распределения», представляет собой измерение относительного распределения агониста в двух слоях кожи, при равномерном распределении (рассчитывается, как указано, или на основании молярности, или массы), дающем соотношение, равное 1. Сумма этих двух значений (Е+D) является общим количеством агониста, доставленного в кожу («S») в условиях анализа. Также может быть измерено количество агониста, которое проходит через кожу и входит в рецепторную камеру ячейки Франца («Р»). Соотношение количества агониста, которое прошло через кожу, к количеству, которое задержалось в коже («P/S») приписывают «эффекту накопления». Единицы Е, D, В и S могут быть молярными (например, нмоль агониста) и весовыми (например, микрограмм агониста). Величины E/D и P/S являются безразмерными. 5. Вводимая композиция. В одном из аспектов изобретения агонист TRPV1 вводится в виде композиции («вводимая компо-9- 012599 зиция»), включающей по меньшей мере один усилитель проницаемости. Применяемую композицию настоящего изобретения можно описать как трехкомпонентную систему: 1. Растворяющая система, в которой растворим агонист TRPV1, включающая по меньшей мере один усилитель проницаемости. 2. Агонист (агонисты) TRPV1 и/или один или несколько дополнительных терапевтически активных средств. 3. Дополнительные компоненты, которые, если присутствуют, составляют не более чем 5% (мас./об.) от всей композиции. В некоторых воплощениях изобретения растворяющая система характеризуется наличием высокой концентрации усилителя (усилителей) проницаемости. 5.1. Растворяющая система. 5.1.1. Усилители проницаемости. Растворяющая система настоящего изобретения может включать усилитель проницаемости или набор усилителей проницаемости. Усилители проницаемости хорошо известны в этой области техники и представляют собой композиции, которые обеспечивают заметную внутридермальную или подкожную доставку средства (см. Smith and Maibach, in Percutaneous Penetration Enhancers; CRC Press: Florids 1995; pp.1-8, например, табл. 1; см. также Barry, B.W. "Vehicle Effect: What Is an Enhancer?" Topical Drug Bioavailability, Bioequivalence, and Penetration, Shah&Maibach. Eds. PlenumPress: New York, 1993; pp.26176). Без намерения быть связанными рамками определенного механизма, полагают, что усилители проницаемости функционируют по нескольким механизмам, которые включают «шунтирование» перемещения лекарственного средства через поры, потовые железы и волосяные фолликулы и открытие межклеточных промежутков в роговом слое (Asbill et al., 2000, "Enhancement of transdermal drug delivery: chemical and physical approaches," Crit Rev Ther Drug Carrier Syst. 17:621-58). Что касается последнего механизма, белковый внутриклеточный матрикс рогового слоя вместе с многообразной биохимической окружающей средой внутриклеточных компартментов в роговом слое представляют собой трудно преодолимый барьер для лекарственных средств, после которого они смогут достичь более глубокие части эпидермиса (например, мальпигиев слой) и дермы. После абсорбции в роговом слое эффекты усилителя проницаемости могут включать изменение потенциала растворителя в биохимической окружающей среде рогового слоя (например, возможность рогового слоя задерживать лекарственные средства в некристаллической форме) и нарушение упорядоченной структуры участка внутриклеточных липидов (например, из-за включения молекулы усилителя между параллельными углеводородными цепями жирных кислот). Ниже в качестве иллюстрации перечислены примеры усилителей проницаемости, которые, однако, не ограничиваются этим списком (см., например, табл. 1-3). С помощью рутинных способов анализа можно идентифицировать другие усилители проницаемости, например используя результаты исследования проницаемости кожи in vitro на коже крысы, свиньи или человека с применением диффузионных ячеек Франца (см. Franz et al., "Transdermal Delivery" In: Treatise on Controlled Drug Delivery. A. Kydonieus. Ed. Marcell Dekker: New York, 1992; pp.341-421). В этой области техники известны многие другие методы оценки усилителей, включающие высокопроизводительные методы Karande and Mitragotri, 2002, "High throughput screening of transdermal formulations" Pharm Res 19:655-60 и Karande and Mitragotri, 2004, "Discovery of transdermal penetration enhanxers by high-throughput screening". Усилители проницаемости, подходящие для использования в настоящем изобретении, являются фармакологически приемлемыми усилителями проницаемости. Фармакологически приемлемый усилитель проницаемости можно наносить на кожу пациента-человека без нежелательных эффектов (например, усилитель обладает низкой или приемлемой токсичностью при применяемых концентрациях). Усилители проницаемости, подходящие для применения в настоящем изобретении, включают, но не ограничиваются только ими, усилители из любого из следующих классов: жирные спирты, жирные кислоты (линейные или разветвленные); терпены (например, моно-, ди- и сесквитерпены; углеводороды, спирты, кетоны); сложные эфиры жирных кислот, органические кислоты, эфиры, амиды, амины, углеводороды, спирты, фенолы, полиолы, поверхностно-активные вещества (анионные, катионные, неионные, соли желчных кислот). Усилители проницаемости могут быть охарактеризованы с помощью множества физических, а также структурных свойств. Например, в некоторых воплощениях настоящего изобретения компонент растворяющей системы, усиливающий проницаемость, имеет молекулярную массу не более 400, при комнатной температуре представляет собой жидкость и имеет упругость пара менее 10 мм рт.ст. при 32°С. Примеры, иллюстрирующие, но не ограничивающие список таких соединений, приведены в табл. 1 (табл. 1-5 приведены в конце описания). В некоторых воплощениях настоящего изобретения компонент растворяющей системы, усиливающий проницаемость, имеет молекулярную массу не более 400, при комнатной температуре представляет собой жидкость и имеет упругость пара более 10 мм рт.ст. Усилители проницаемости этого типа обычно составляют менее 100% (об./об.) от растворяющей системы, чаще не более 95% от растворяющей системы, еще чаще не более 75% от растворяющей системы, еще чаще не более 50% от растворяющей систе- 10 - 012599 мы и наиболее часто эти усилители проницаемости составляют не более приблизительно 30% (об./об.) от растворяющей системы. Примеры, иллюстрирующие, но не ограничивающие такие соединения, приведены в табл. 2. В некоторых воплощениях настоящего изобретения компонент растворяющей системы, усиливающий проницаемость, нерастворим при комнатной температуре (например, миристиловый спирт). Такие «твердые усилители проницаемости» обычно не используются в виде единственного компонента растворяющей системы. Однако растворяющая система, которая включает смесь компонентов, может включать твердый усилитель (усилители) проницаемости, до тех пор, пока собственно твердый усилитель проницаемости находится в растворе. Например, можно использовать растворяющую систему, включающую 95%-ный моноэтиловый эфир диэтиленгликоля и 5%-ный миристиловый спирт (где миристиловый спирт находится в растворе). Усилители проницаемости этого типа обычно составляют менее 100% (об./об.) от растворяющей системы, чаще не более 95% от растворяющей системы, еще чаще не более 75% от растворяющей системы, еще чаще не более 50% от растворяющей системы и наиболее часто эти усилители проницаемости составляют не более приблизительно 30% (об./об.) от растворяющей системы. Примеры, иллюстрирующие, но не ограничивающие такие соединения, приведены в табл. 3. В некоторых воплощениях настоящего изобретения компонент растворяющей системы, усиливающий проницаемость, имеет молекулярную массу менее 50. Усилители проницаемости этого типа обычно составляют менее 100% (об./об.) от растворяющей системы, чаще не более 95% от растворяющей системы, еще чаще не более 75% от растворяющей системы, еще чаще не более 50% от растворяющей системы и наиболее часто эти усилители проницаемости составляют не более приблизительно 30% (об./об.) от растворяющей системы. В некоторых воплощениях настоящего изобретения компонент растворяющей системы, усиливающий проницаемость, является поверхностно-активным веществом. В некоторых воплощениях доля в растворяющей системе, включающей поверхностно-активное вещество, составляет не более 5% (об./об.). В некоторых воплощениях настоящего изобретения компонент растворяющей системы, усиливающий проницаемость, является мочевиной. В некоторых воплощениях пропорция в растворяющей системе, включающей мочевину, составляет не более 10% (об./об.) или альтернативно не более 5% (об./об.). В одном из воплощений изобретения растворяющая система содержит только один усилитель проницаемости. В родственном воплощении такого же типа растворяющая система содержит два усилителя проницаемости, три усилителя проницаемости, четыре усилителя проницаемости, пять усилителей проницаемости и более чем пять усилителей проницаемости. Обычно растворяющая система содержит от одного до четырех усилителей проницаемости. Усилители проницаемости, особенно те, которые подходят для применения в настоящем изобретении, включают жирные спирты и терпены. Примеры жирных спиртов, полезных в качестве усилителей проницаемости, включают олеиловый спирт, элаидиловый спирт, линолеиловый спирт, элаидолинолеиловый спирт, линолеиловый спирт, элаидолинолеиловый спирт, цетилстеариловый спирт, лаурилмиристиловый спирт, октилдециловый спирт, октиловый спирт, дециловый спирт, миристиловый спирт, цетиловый спирт, стеариловый спирт, лауриловый спирт, 2-лауриловый спирт, рициноловый спирт, талловый спирт и каприловый спирт. Терпены имеют молекулярную формулу (CnH2n-4) и классифицируются в соответствии с количеством изопреновых звеньев. Теоретически терпены могут находиться в следующих четырех конфигурациях: (1) три двойные связи и отсутствие цикла (например, оцимен и мирецен), (2) две двойные связи и один цикл (например, лимонен и карвеол), одна двойная связь и два цикла (например, α-пинен или βпинен и оксид лимонена). Сесквитерпены имеют формулу (CnH2n-6) и теоретически существуют во множестве конфигураций. Из-за определенного многообразия в природе терпенов и отсутствия строгой классификации терпенов упомянутое выше описание терпенов и сесквитерпенов не ставит перед собой цели ограничить изобретение в его объеме. Другие примеры включают монотерпены (2 изопреновые единицы), сесквитерпены (3 изопреновые единицы), дитерпены (4 изопреновые единицы), тритерпены (6 изопреновых единиц) и тетратерпены (8 изопреновых единиц). Примеры монотерпенов включают: нерол, цитраль, камфару, ментол. Примеры сесквитерпенов включают: неролидол, фарнезол. Примеры дитерпенов включают: фитол, витамин А1. Сквален является примером тритерпена, а каротин (провитамин А1) является тетратерпеном. Примеры терпенов, полезных в качестве усилителей проницаемости, приведенные для иллюстрации, но не для ограничения объема изобретения, включают метилноненовую кислоту и метилнонениловый спирт, оксид, циклопентеноксид D-лимонена, β-карен, α-терпинеол, терпинен-4-ол, карвон, пулегон, пиперитон, ментон и 1,8-цинеол. В одном из воплощений изобретения терпены, применяемые на практике, имеют молекулярную массу менее 600. В одном из воплощений изобретения терпены, применяемые на практике, имеют молекулярную массу более 100. В одном из аспектов настоящее изобретение предоставляет способ увеличения количества локально нанесенного агониста TRPV1, который проникает в эпидермальный и дермальный слои, путем местного нанесения молекулы в композиции, включающей терпен. В одном из воплощений изобретение обеспечивает фармацевтическую композицию, включающую терпен - 11 - 012599 и агонист TRPV1. В одном из воплощений изобретения агонист TRPV1 является капсаицином. В одном из воплощений изобретения терпен является метилноненовой кислотой или метилнонениловым спиртом. В другом воплощении изобретения терпен выбирают из группы, включающей оксид α-пинена, оксид лимонена, циклопентеноксид D-лимонена, α-пинен, β-карен, α-терпинеол, терпинен-4-ол, карвол, карвон, пулегон, пиперитон, ментон и 1,8-цинеол. Один из полезных усилителей проницаемости растворяющей системы является ментоном. В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 50% (об./об.), по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95% или по меньшей мере около 100% ментона. Другим полезным усилителем проницаемости растворяющей системы является метилноненовая кислота. В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 50% (об./об.), по меньшей мере около 70%, по меньшей мере около 80% или по меньшей мере около 90% метилноненовой кислоты. В одном из аспектов изобретение обеспечивает фармацевтическую композицию, включающую агонист TRPV1 (например, капсаицин) и метилноненовую кислоту. Другим полезным усилителем проницаемости растворяющей системы является метилнонениловый спирт. В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 50% (об./об.), по меньшей мере около 70%, по меньшей мере около 80% или по меньшей мере около 90% метилноненилового спирта. В одном из аспектов изобретение обеспечивает фармацевтическую композицию, включающую агонист TRPV1 (например, капсаицин) и метилнонениловый спирт. В другом аспекте изобретение обеспечивает способ увеличения доставки агониста TRPV1 в ткань (например, эпидермис и/или дерму) с помощью введения композиции, включающей агонист и метилнонениловый спирт. Применение метилноненилового спирта и метилноненовой кислоты для усиления проницаемости кожи для терапевтически активных соединений, таких как капсаицин, ранее описано не было. В одном из аспектов настоящее изобретение обеспечивает способ увеличения количества локально наносимых молекул, которые проникают в эпидермальный и дермальный слои, с помощью местного нанесения молекулы в композиции, включающей метилнонениловый спирт или метилноненовую кислоту. В одном из воплощений изобретения молекула является терапевтически активным средством. В одном из воплощений изобретения молекула является агонистом TRPV1. Другим полезным усилителем проницаемости растворяющей системы является цетиловый спирт. В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 10% (об./об.), по меньшей мере около 20%, по меньшей мере около 30% или по меньшей мере около 40% цетилового спирта. Другим полезным усилителем проницаемости растворяющей системы является олеиловый спирт. В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 50% (об./об.), по меньшей мере около 70%, по меньшей мере около 80% или по меньшей мере около 90% олеилового спирта. Другим полезным усилителем проницаемости растворяющей системы является пропиленгликоль. В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 50% (об./об.), по меньшей мере около 70%, по меньшей мере около 80% или по меньшей мере около 90% пропиленгликоля. Другим полезным усилителем проницаемости растворяющей системы является моноэтиловый эфир диэтиленгликоля (DGME), имеющийся в продаже под названием Transcutol® (Gattefossé Corp., Paramus, NJ). В некоторых модификациях изобретения растворяющая система включает по меньшей мере около 70% (об./об.), по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95% или по меньшей мере около 99% моноэтилового эфира диэтиленгликоля. В некоторых воплощениях изобретения растворяющая система не включает DGME или DGME составляет не более чем 95% от растворяющей системы, альтернативно не более чем 75% от растворяющей системы, альтернативно не более чем 50% от растворяющей системы и альтернативно не более чем 30% (об./об.) от растворяющей системы. В некоторых воплощениях изобретения растворяющая система включает один, или два, или более следующих усилителей проницаемости: ментон, метилнонениловый спирт, метилноненовую кислоту, олеиловый спирт, изопропилмиристат, диметилизосорбид и пропиленгликоль. Примеры растворяющих систем включают следующие комбинации усилителей проницаемости, не содержащих дополнительные усилители проницаемости, или, при необходимости, с одним, двумя, тремя или более чем тремя дополнительными усилителями проницаемости: d-пиперитон и олеиновую кислоту; 1-ментон и олеиновую кислоту; 1- ментон и этилолеат; 1-ментон и бензиловый спирт; этиленгликоль и 1ментон; бензиловый спирт и олеиловый спирт; 1-ментон и цетиловый спирт; 1,3-бутандиол и олеиновую кислоту; моноэтиловый эфир диэтиленгликоля и 1-ментон; этиленгликоль и олеиновую кислоту; изопропилмиристат; олеиловый спирт и 1,3-бутандиол; 1-ментон и изопропилбутират; 1-ментон и 1,3бутандиол; н-гексан и олеиновую кислоту; ментон и метанол; метилноненовую кислоту и н-гексан; олеиловый спирт и пропиленгликоль; метилнонениловый спирт и диметилацетамид и Brij. - 12 - 012599 Примеры растворяющих систем включают (i) ментон 90% (об./об.) плюс метанол 10% (об./об.); (ii) метилноненовую кислоту 95% плюс н-гексан 5%; (iii) олеиловый спирт 20% плюс пропиленгликоль 80%; (iv) метилнонениловый спирт 94% плюс диметилацетамид 5% плюс Brij-35 1%. Ожидается, что капсаицин остается стабильным в течение продолжительного периода времени в этих композициях, которые являются чрезвычайно липофильными и абсорбируют небольшое количество воды. Дополнительные примеры растворяющих систем, приводимые в качестве иллюстрации и не ограничивающие объем изобретения, приведены в табл. 6. Если растворяющая система включает более чем один усилитель проницаемости, иногда бывают случаи, когда в смеси преобладает один из усилителей проницаемости. Например, в воплощениях изобретения соотношение доминирующего усилителя проницаемости к сумме других усилителей проницаемости в растворяющей системе составляет по меньшей мере около 2:1, по меньшей мере около 3:1, по меньшей мере около 5:1, по меньшей мере около 8:1, по меньшей мере около 9:1 (об./об.) или по меньшей мере около 20:1. В одном из воплощений изобретения преобладающим усилителем проницаемости является моноэтиловый эфир диэтиленгликоля. В одном из воплощений изобретения доминирующим усилителем проницаемости является ментон. Примеры усилителей проницаемости включают стеариловый спирт, олеиловый спирт, линолеиловый спирт, линолениловый спирт, каприловый спирт, дециловый спирт, лауриловый спирт, пропиленгликоль, полиэтиленгликоль, этиленгликоль, диэтиленгликоль, триэтиленгликоль, этоксидиэтиленгликоль, дипропиленгликоль, глицерин, пропандиол, бутандиол, пентандиол, гексантриол 2-лауриловый спирт, миристиловый спирт, цетиловый спирт, каприновую кислоту, лауриновую кислоту, миристиновую кислоту, стеариновую кислоту, олеиновую кислоту, каприловую кислоту, валериановую кислоту, гептановую кислоту, пеларгоновую кислоту, капроновую кислоту, изовалериановую кислоту, неопентановую кислоту, триметилгексановую кислоту, неодекановую кислоту, изостеариновую кислоту, неогептановую кислоту, неононановую кислоту, изопропиловый эфир н-декановой кислоты, изопропилпальмитат, октилдодецилмиристат, этилацетат, бутилацетат, метилацетат, изопропиловый эфир н-масляной кислоты, этилвалерат, метилпропионат, диэтилсебацинат, этилолеат, изопропиловый эфир н-гексановой кислоты, изопропилмиристат, мочевину, диметилацетамид, диэтилтолуамид, диметилформамид, диметилоктамид, диметилдекамид, 1-гексил-4-метоксикарбонил-2-пирролидон, 1-лаурил-4-карбокси-2пирролидон, 1-метил-4-карбокси-2-пирролидон, 1-алкил-4-имидазолин-2-он, 1-метил-2-пирролидон, 2пирролидон, 1-лаурил-2-пирролидон, 1-гексил-4-карбокси-2-пирролидон, 1-метил-4-метоксикарбонил-2пирролидон, 1-лаурил-4-метоксикарбонил-2-пирролидон, диметилсульфоксид, децилметилсульфоксид, N-алкилпирролидоновое производное кокосового масла, N-диметиламинопропилпирролидон, Nалкилпирролидоновое производное твердого животного жира, N-циклогексилпирролидон, 1фарнезилазациклогептан-2-он, 1-геранилгеранилазациклогептан-2-он, эфиры жирных кислот и 2гидроксиэтил-2-пирролидона, 1-геранилазациклогептан-2-он, 1-додецилазациклогептан-2-он (Azone®), 1-(3,7-диметилоктил)азациклогептан-2-он, 1-геранилазациклогексан-2-он, 1-(3,7,11-триметилдодецил)азациклогептан-2-он, 1-геранилазациклопентан-2,5-дион, 1-фарнезилазациклопентан-2-он, бензиловый спирт, бутанол, пентанол, гексанол, октанол, нонанол, деканол, этанол, 2-бутанол, 2-пентанол, пропанол, диэтаноламин, триэтаноламин, гексаметиленлаурамид и его производные, хлорид бензалькония, лаурат натрия, лаурилсульфат натрия, хлорид цетилпиридина, лимонную кислоту, янтарную кислоту, салициловую кислоту, салицилат бромида цетилтриметиламмония, бромид тетрадецилтриметиламмония, хлорид октадецилтриметиламмония, хлорид додецилтриметиламмония, хлорид гексадецилтриметиламмония, Span 20, Span 40, Span 60, Span 80, Span 85, Poloxamer 231, Poloxamer 182, Poloxamer 184, Brij 30, Brij 35, Brij 93, Brij 96, Span 99, Myrj 45, Myrj 51, Myrj 52, Myglyol 840, гликолевую кислоту, натриевые соли таурохолевой кислоты, лецитин, холат натрия, дезоксихолевую кислоту, D-лимонен, α-пинен, β-карен, αтерпинеол, терпинен-4-ол, карвол, карвон, пулегон, пиперитон, иланг-иланг, ментон, анис, хеноподий, эвкалипт, оксид лимонена, оксид α-пинена, оксид циклопентена, 1,8-цинеол, оксид циклогексена, нгептан, н-октан, н-нонан, н-декан, н-ундекан, н-додекан, н-тридекан, н-тетрадекан, н-гексадекан и эфирные масла (например, масла чайного дерева). Как обсуждается ниже, в некоторых воплощениях изобретения растворяющая система может включать элементы, отличные от усилителей проницаемости, например воду или другой наполнитель. В некоторых воплощениях изобретения усилитель проницаемости (если растворяющая система включает только один усилитель проницаемости) или усилители проницаемости вместе (если растворяющая система включает больше одного усилителя проницаемости) составляют по меньшей мере около 20% от объема растворяющей системы. Часто усилитель (усилители) проницаемости составляет по меньшей мере около 40% от объема растворяющей системы, часто по меньшей мере около 50% от объема растворяющей системы, часто по меньшей мере около 75% от объема растворяющей системы, часто по меньшей мере около 80% от объема растворяющей системы, часто по меньшей мере около 90% от объема растворяющей системы, часто по меньшей мере около 95% от объема растворяющей системы, часто по меньшей мере около 98% от объема растворяющей системы, иногда по меньшей мере около 99% от объема растворяющей системы, иногда по меньшей мере около 99,5% от объема растворяющей системы и иногда 100% от - 13 - 012599 объема растворяющей системы. 5.1.2 Другие компоненты растворяющей системы. В некоторых воплощениях изобретения в дополнение к усилителю проницаемости или комбинации усилителей проницаемости растворяющая система включает жидкие компоненты (воду, солевой раствор и т.д.). В некоторых воплощениях изобретения растворяющая система является двухфазной, и агонист TRPV1 растворим по меньшей мере в одной фазе. В одном из воплощений изобретения растворяющая система является монофазной. 5.2. Агонист TRPV1 и/или другие терапевтически активные агенты. 5.2.1. Введение агонистов TRPV1. Примеры агонистов TRPV1 описаны выше (раздел 3). В некоторых воплощениях изобретения вводимая композиция также включает один или более дополнительных терапевтически активных агентов, которые вводят вместе с агонистом (агонистами) TRPV1. Используя способы и композиции, подробно описанные здесь, терапевтически эффективные количества агонистов TRPV1, например капсаицина, можно вводить (например, местно) субъекту намного быстрее, чем это возможно при использовании общепринятых композиций. Терапевтические преимущества применения капсаицина (включающие уменьшение плотности ноцицепторов кожи и слизистых оболочек) могут достигаться с помощью введения капсаицина в низкой концентрации и/или в более короткое время по сравнению с тем, что предполагалось и демонстрировалось ранее. Для некоторых применений желательно использовать относительно высокую концентрацию в более короткое время, тогда как в других случаях было бы выгодно использовать низкую концентрацию. Концентрация агониста TRPV1 в композиции может находиться в диапазоне от 0,05 до 60% (мас./об.) в зависимости от конкретного агониста TRPV1, используемой растворяющей системы и желаемого результата. В некоторых воплощениях изобретения концентрация агониста TRPV1 в композиции настоящего изобретения находится в диапазоне от приблизительно 1% (мас./об.) до приблизительно 40%, от приблизительно 5 до приблизительно 25%, от приблизительно 10 до приблизительно 20% или около 15%. В одном из воплощений изобретения концентрация агониста TRPV1 меньше чем приблизительно 3% (мас./об.). В некоторых воплощениях изобретения концентрация агониста TRPV1 в композиции настоящего изобретения находится в диапазоне от приблизительно 0,001 до приблизительно 20%, от приблизительно 0,05 до приблизительно 20%, от приблизительно 0,1 до приблизительно 10% или от приблизительно 0,1 до приблизительно 5%. В одном из воплощений изобретения концентрация агониста TRPV1 меньше чем приблизительно 3%. Другие примерные диапазоны составляют от приблизительно 0,001 до приблизительно 0,09%, от приблизительно 0,001 до приблизительно 0,05%, от приблизительно 0,001 до приблизительно 0,5%, от приблизительно 0,01 до приблизительно 1%, от приблизительно 1 до приблизительно 5%, от приблизительно 1 до приблизительно 10%, от приблизительно 2 до приблизительно 7% и от приблизительно 2 до приблизительно 5%. В различных воплощениях изобретения агонист TRPV1 присутствует в концентрации в диапазоне, ограниченном нижним пределом в 0,001, 0,010, 0,05, 0,1, 0,5, 0,75%, 1, 2, 3, 4, 5, 6, 7, 7,5 или 10%, и независимо выбранным верхним пределом в 0,010, 0,05, 0,5, 1, 2, 3, 4, 5, 6, 7, 7,5, 10, 20, 30, 40, 50 или 60% (где верхний предел выше, чем нижний предел). В одном из воплощений изобретения капсаицин (или аналог капсаицина) применяется в концентрации меньше чем 5% (мас./об.), меньше чем приблизительно 3%, меньше чем приблизительно 2%, меньше чем приблизительно 1% или меньше чем приблизительно 0,5%. Обычно концентрация агониста TRPV1 такова, что терапевтически эффективную дозу агониста TRPV1 можно доставлять в объеме, который удобно наносить на кожу субъекта (например, обычный объем от приблизительно 5 до 50 мкл на 1 см2, часто объем приблизительно 50 мкл на 1 см2, часто приблизительно 25 мкл на 1 см2, часто приблизительно 10 мкл на 1 см2, часто между приблизительно 5 и 25 мкл на 1 см2 или между приблизительно 5 и 10 мкл на 1 см2). В одном из воплощений композиция настоящего изобретения включает более одного агониста TRPV1 (например, два, три, четыре или более агонистов TRPV1). В одном из воплощений изобретения композиция включает капсаицин и другой агонист TRPV1. Обычно суммарная концентрация агонистов TRPV1 в композиции составляет от 0,05 до 60 мас./об.%, чаще от 0,05 до 10%, часто от 0,1 до 15%, от 0,1 до 10% или от 1 до 10%. В одном из воплощений композиция настоящего изобретения включает только агонист TRPV1. В одном из воплощений агонист TRPV1 является капсаицином. 5.3. Терапевтически активные агенты, отличные от агонистов TRPV1. В некоторых воплощениях изобретения вводимая композиция включает одно или несколько дополнительных терапевтически активных агентов («ТАА»), которые вводят совместно с агонистом (агонистами) TRPV1. Употребляемый здесь термин «терапевтически активный агент» относится к агенту, отличному от агониста TRPV1, которое обладает биологически требуемой активностью и которое можно вводить субъекту с помощью местного нанесения на кожу, глаза или слизистую оболочку рта или носа. Обычно ТАА имеет молекулярную массу меньше чем 1000, часто меньше чем 500. Понятно, что усилители проницаемости, основа, растворители и т.п. не являются примерами ТАА. В одном из воплощений дополнительное терапевтически активное средство, вводимое совместно с агонистом (агонистами) TRPV1, является локальным анестетиком. Примеры локальных анестетиков - 14 - 012599 включают, не ограничивая объем изобретения, ацетамидоевгенол, ацетат альфадолона, альфаксалон, амукаин, амоланон, амилокаин, беноксинат, бензокаин, бетоксикаин, бифенамин, бупивакаин, буретамин, бутакаин, бутабен, бутаниликаин, буталитал, бутоксикаин, картикаин, 2-хлорпрокаин, кокаэтилен, кокаин, циклометилкаин, дибукаин, диметизоквин, диметокаин, диперадон, диклонин, экгонидин, экгонин, этиламинобензоат, этилхлорид, этидокаин, этоксадрол, β-эукаин, эупроцин, феналкомин, фомокаин, гексобарбитал, гексилкаин, гидроксидион, гидроксипрокаин, гидрокситетракаин, изобутил-nаминобензоат, кетамин, мезилат лейцинокаина, левоксадрол, лидокаин, мепивакаин, меприлкаин, метабутоксикаин, метогекситал, метилхлорид, мидазолам, миртекаин, наепаин, октакаин, ортокаин, оксетазаин, парэтоксикаин, фенакаин, фенциклидин, фенол, пиперокаин, пиридокаин, полидоканол, прамоксин, прилокаин, прокаин, пропанидид, пропанокаин, пропаракаин, пропипокаин, пропофол, пропоксикаин, псевдококаин, пиррокаин, ризокаин, салициловый спирт, тетракаин, тиалбарбитал, тимилал, тиобутабарбитал, тиопентал, толикаин, тримекаин и золамин и их комбинации. В других воплощениях изобретения дополнительный терапевтически активный агент (агенты), вводимый совместно с агонистом (агонистами) TRPV1, является веществом, отличным от местного анестетика. В качестве примера, но не для ограничения объема изобретения, ТАА может быть стероидным, нестероидным противовоспалительным лечебным средством (например, ибупрофеном, кетопрофеном, фторбипрофеном, напроксеном, кеторолаком и диклофенаком), опиоидным анальгетиком (например, фентанилом и бупренорфином), противоопухолевым средством (например, 5-фторурацилом) или одним из многих других лекарственных средств. Обычно ТАА является агентом, для которого предпочтительно локальное (например, дермальное) нанесение. Концентрация ТАА в композиции может находиться в диапазоне от 0,05 до 60% (мас./об.) в зависимости от конкретного ТАА и используемой растворяющей системы. Концентрация ТАА в композиции обычно находится в диапазоне от приблизительно 0,05% до приблизительно 10%, часто в диапазоне от приблизительно 0,1% до приблизительно 10% и наиболее часто в диапазоне от приблизительно 0,1% до приблизительно 5%. Обычно концентрация такова, что терапевтически эффективную дозу ТАА можно доставлять в объеме, который удобно наносить на кожу субъекта (например, обычно объем между 0,05 и 10 мл, чаще между приблизительно 0,1 и 5 мл, еще чаще между 0,25 и 1 мл). В различных воплощениях изобретения агонист TRPV1 присутствует в концентрации в диапазоне, ограниченном нижним пределом в 0,001% (мас./об.), 0,010, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 7,5 или 10%, и независимо выбранным верхним пределом в 0,001, 0,010, 0,05, 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 7,5, 10, 20, 30, 40, 50 или 60% (где верхний предел выше, чем нижний предел) и локальный анестетик присутствует в концентрации в диапазоне, ограниченном нижним пределом в 0,1, 0,5, 1 или 2% и независимо выбранным верхним пределом в 0,5, 1, 2, 5 или 10% (где верхний предел выше, чем нижний предел). В одном из воплощений локальный анестетик является тетракаином. Обычно суммарная концентрация агониста TRPV1 и другого (других) ТАА составляет диапазон от 0,05 до 60 мас./об.%, чаще от 0,05 до 10% и часто от 0,1 до 10%. 5.4. Введение терапевтически активных агентов, отличных от агонистов TRPV1. В родственном аспекте изобретения терапевтически активный агент, отличный от агониста TRPV1, вводится в виде композиции, которая включает растворяющую систему, как уже было описано относительно вводимых внутрь композиций настоящего изобретения. Таким образом, композиции ТАА включают следующие компоненты: 1. Растворяющую систему, в которой растворим ТАА, включающую по меньшей мере один усилитель проницаемости. 2. Один или более ТАА. 3. Дополнительные компоненты, которые, если присутствуют, составляют не более чем 5% (мас./об.) от всей композиции. В предпочтительных воплощениях изобретения растворяющая система характеризуется высокой концентрацией усилителя (усилителей) проницаемости, например концентрация может составлять по меньшей мере около 50%, по меньшей мере около 75%, по меньшей мере около 85%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 99%, по меньшей мере около 99,5% или 100%. Примеры ТАА, которые могут быть введены с помощью композиции, включают те, которые приведены выше в разделе 5.2, и обычно представляют собой средства, для которых предпочтительным является локальное введение (например, дермальное), они часто являются лекарственными средствами, которые действуют в непосредственной близости к месту введения (например, локальные анестетики). 5.5. Другие компоненты вводимой композиции. Композиция может также включать стабилизаторы, рН-модификаторы, красители и ароматизаторы или другие соединения. Эти компоненты составляют менее чем 5% (мас./об.) от всей композиции, чаще менее чем приблизительно 2% и чаще менее чем приблизительно 1% или даже около 0,5% от всей композиции. Стабилизаторы, полезные в композициях, включают материалы, которые обеспечивают стабилизацию композиции (например, сохранение вязкости в течение всего времени, поддержание рН в течение - 15 - 012599 всего времени или сохранение чистоты, внешнего вида, гомогенности и/или цвета в течение всего времени) и/или предупреждают рост бактерий или других микроорганизмов и/или поддерживают химическую стабильность агониста или другого терапевтически активного агента, защищая их от гидролиза, окисления, термического или фотолитического разрушения. Примеры стабилизаторов включают антиоксиданты, хелаторы, консерванты (например, динатриевую соль ЭДТА, β-каротин, токоферолы, октилгаллат, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол), противомикробные средства (которые включают любые вещества, эффективные для снижения или предупреждения накопления микробной массы в композиции, например парабены, метилпарабен, пропилпарабен, бутилпарабен, метилсалицилат, фенэтиловый спирт и резорцин) и другие средства (см., например, U.S. Pat. № 6013270 и 6390291). 5.6. Дополнительные средства, которые обычно не являются обязательными и иногда не включаются в композицию или присутствуют в очень малых количествах. Местно вводимые средства часто вводятся в виде форм, обладающих от средней до высокой вязкостью (например, в виде геля, лосьона или крема), или с помощью местного или трансдермального пластыря. В некоторых воплощениях изобретения композиция изобретения представляет собой композицию с «немедленным высвобождением», в которой все терапевтическое средство или его большая часть (например, полная доза) доступны в месте введения средства (например, в коже, на поверхности слизистой оболочки или эпидермиса), и которая более предпочтительна, чем композиция, вводимая в течение продолжительного периода. В некоторых воплощениях изобретения композиция представляет собой композицию с низкой вязкостью (т.е. агонисты TRPV1 доставляются в композиции с низкой вязкостью). Употребляемый в этом контексте термин «композиция с низкой вязкостью» относится к композиции, имеющей вязкость менее чем приблизительно 5000 сантипуазов (сПз), иногда менее чем приблизительно 1000 сПз, менее чем приблизительно 500 сПз, менее чем приблизительно 100 сПз, менее чем приблизительно 50 сПз, менее чем приблизительно 40 сПз, менее чем приблизительно 20 сПз или менее чем приблизительно 10 сПз при измерении до нанесения на кожу или, альтернативно, при измерении при 32°С (температура кожи). Вязкость можно измерить, используя стандартные методы, например, с помощью плоскоконического вискозиметра или ротационного вискозиметра. Трансдермальные пластыри (например, резервуарные, матриксные и микрорезервуарные пластыри) широко используются для доставки лекарства и обычно являются окклюзионными и/или адгезивными устройствами. Кроме того, композиции, доставляемые с помощью пластырей, по своей сути являются композициями с «замедленным высвобождением». Введение терапевтического средства без применения окклюзивного пластыря относится к «неокклюзивному» введению или контактированию. Введение терапевтического средства без применения приспособления, наклеивающегося на кожу, относится к «неадгезивному» введению или контактированию. Терапевтическое средство, вводимое без применения механизма с замедленным высвобождением, относится к композиции с «немедленным высвобождением». В некоторых воплощениях настоящего изобретения агонисты TRPV1 доставляются без применения устройства в виде трансдермального пластыря и/или без использования любого из окклюзивных средств, и/или без применения адгезивных средств, и/или в виде композиций с немедленным высвобождением. В одном из воплощений изобретения агонист TRPV1 вводимой композиции проникает в ткань пассивно (например, без применения окклюзивного материала, увеличивающего скорость проникновения). Таким образом, в некоторых воплощениях изобретения вводимая композиция не содержит веществ, которые обычно добавляют к композициям, применяемым для местного нанесения, для того, чтобы увеличить вязкость, или иным способом, чтобы сохранить контакт средства, местно нанесенного на поверхность кожи, в течение длительного периода времени, и/или которые добавляют, чтобы модифицировать текучесть для облегчения нанесения на определенную поверхность, или, в случае присутствия таких веществ, они содержатся в очень низких количествах (например, менее чем приблизительно 3% (мас./об.), менее чем приблизительно 1%, обычно менее чем приблизительно 0,5% и наиболее часто менее чем приблизительно 0,1%). Например, в некоторых воплощениях можно включить этилцеллюлозу в концентрации менее чем 1%, более обычно в концентрации меньше чем 0,5% и в большинстве случаев менее чем 0,1% или менее чем 0,05%. Таким образом, в некоторых воплощениях изобретения вводимая композиция имеет очень низкую вязкость и не содержит или, по существу, не содержит (что в этом контексте означает содержание меньше чем 0,1% мас./об.) загустителей и гелеобразующих веществ, таких как сополимеры алкенов (например, бутилен-этилен-стироловый сополимер или этилен-пропилен-стироловый сополимер), поперечносшитые полиакрилатные полимеры, полимеры карбоновых кислот, полиакриламидные полимеры, сополимеры акриловой кислоты/этилакрилатов, карбоксивиниловые полимеры, смолы Carbopol™ (коллоидный водорастворимый полиалкенированный полиэфирный поперечно-сшитый полимер акриловой кислоты, поперечно-сшитой с помощью поперечно-сшивающих агентов, таких как полиаллилсахароза или полиаллилпентаэритрит), гуммиарабик, агар, альгиновую кислоту, моностеарат алюминия, аттапульгит (активированный или коллоидный активированный), бентонит, очищенный бентонит, густую суспензию бентонита, кальциевую соль карбоксиметилцеллюлозы, натриевую соль карбоксиметилцеллюлозы, на- 16 - 012599 триевую соль карбоксиметилцеллюлозы 12, каррагинан, микрокристаллическую целлюлозу, декстрин, желатин, гуаровую смолу, гиалуроновую кислоту, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, силикат магния алюминия, метилцеллюлозу, пектин, полиэтиленоксид, поливиниловый спирт, повидон, альгинат пропиленгликоля, двуокись кремния, коллоидную двуокись кремния, вязкое силиконовое масло (> 5000 сПз), гели на силиконовой основе, альгинат натрия, трагакант, ксантановую смолу и силикаты алюминия. 5.7 Форма вводимой композиции. В некоторых воплощениях изобретения вводимая композиция представляет собой форму, пригодную для введения субъекту (например, пациенту-человеку). В одном из воплощений композиция предоставляется в виде единичной дозированной формы или в виде мультиформы, содержащей несколько единичных дозировок. Употребляемый здесь термин «единичная дозированная форма» означает количество вводимой композиции, пригодной для однократного введения единственному пациенту, нуждающемуся в лечении, а термин «мультиформа, содержащая несколько единичных дозировок», означает количество вводимой композиции, пригодной для многократного приема средства (например, обычно от 2 до 10 приемов, чаще от 2 до 5 приемов, еще чаще от 2 до 4 приемов и наиболее часто для 2 или 3 приемов). Единичная дозированная форма и мультиформа, содержащая несколько единичных дозировок, могут быть в виде жидкого раствора в одном или нескольких пузырьках или сходных контейнерах. Обычно содержание каждого пузырька составляет от 0,1 до 100 мл, чаще от 0,5 до 50 мл, более часто от 1 до 10 мл. В некоторых воплощениях единичная дозировка или мультидозировка содержатся в шприце, капельнице, пипетке или другом устройстве для доставки жидкости. В некоторых воплощениях единичная дозировка или мультиформа, содержащая несколько единичных дозировок, содержатся в устройстве для доставки спрея или аэрозоля. В некоторых воплощениях единичная дозировка или мультидозировка содержатся в шприце. В некоторых воплощениях единичная дозировка или мультиформа, содержащая несколько единичных дозировок, находятся в форме полотенца или другого впитывающего материала, пропитанного вводимой композицией. В одном из воплощений каждая единичная дозировка или мультиформа, содержащая несколько единичных дозировок, индивидуально упакованы в упаковку, пригодную для хранения и/или перевозки. 6. Свойства вводимой композиции и растворяющей системы. Этот раздел описывает дополнительные свойства некоторых вводимых композиций, которые могут применяться в практике изобретения. Эти свойства могут быть использованы при выборе комбинаций усилителей проницаемости и других компонентов композиции для оптимизированного применения с конкретным типом и концентрацией агониста. Однако полезные композиции изобретения не ограничиваются композициями, обладающими всеми свойствами, проиллюстрированными ниже. 6.1. Вводимая композиция и растворяющая система могут быть жидкими растворами, в которых агонист (агонисты) TRPV1 растворимы. Как было указано выше, агонист TRPV1 растворен в растворяющей системе в количестве и концентрации, которые будут различаться в зависимости от конкретно применяемого агониста, присутствия других ТАА, цели композиции и желаемой дозы. В предпочтительном воплощении настоящего изобретения, однако, наиболее ценным будет вариант, когда агонист TRPV1 полностью растворен в растворяющей системе (например, присутствует в количестве, которое меньше чем предел насыщения агониста TRPV1 в растворяющей системе). Для перевода агониста в раствор могут быть использованы перемешивание, нагревание, ультразвуковая обработка и т.п., до тех пор, пока агонист после приготовления остается в растворе при комнатной температуре или при температуре кожи. Композиции настоящего изобретения могут быть гомогенными растворами, в которых агонист TRPV1 практически полностью растворен в композиции (и часто растворен в компоненте растворяющей системы композиции) и в которых, по существу, отсутствуют суспендированные или нерастворенные частицы агониста. Хотя настоящее изобретение не ограничивается композициями, демонстрирующими только конкретный максимальный уровень мутности, специалисты в этой области техники понимают, что в основном мутность является минимальной. 6.2. Композицию можно наносить в виде тонкой пленки. Некоторые композиции изобретения можно наносить в виде тонкой гомогенной пленки, которая не требует окклюзивных, биоадгезивных или других добавок или устройств для получения фармакологического эффекта. Композицию можно наносить с помощью физического механизма, включающего тампон, аппликаторную прокладку, намазочный шприц или похожие устройства, предназначенные для нанесения жидкостей в виде тонкой пленки. Поскольку вводимые композиции изобретения обычно наносятся на кожу в дозе около 10 мкл на см2, иногда в диапазоне до 20 или 30 мкл на см2, такие нанесения приводят к толщине пленки композиции около 100-300 мкм. Обычно композиции изобретения наносят в жидкости объемом по меньшей мере около 5 мкл/см2 наносимой площади (например, поверхности кожи или слизистой оболочки), часто по меньшей мере около 7,5 мкл/см2 наносимой площади, по меньшей мере около 10 мкл/см2 нанесения. Нанесение композиций приводит к созданию тонкого слоя гомогенной жидкости с низкой вязко- 17 - 012599 стью, адсорбированного на неровностях микроповерхности кожи и принимающего форму тела. Покрытие, увлажнение и присущее придание формы по контуру, происходящие в результате местного нанесения, позволяют обеспечить контакт с максимальной поверхностью благодаря реологическим и термодинамическим свойствам жидкости с низкой вязкостью. Композиции демонстрируют ожидаемое поведение, например присутствие начальной влажной жировой пленки, которая затем постепенно исчезает. Нанесение в виде тонкой пленки может вносить вклад в способность композиций накапливаться в коже за очень короткие по продолжительности периоды нанесения. 6.3. Композиция может исчезнуть сразу же после нанесения. Некоторые композиции изобретения характеризуются быстрым и, по существу, полным исчезновением с поверхности кожи сразу после нанесения. В одном из воплощений, например, композиция, по существу, исчезает (например, адсорбируется и/или испаряется) в течение около 30 мин (и чаще в течение 15, 10 мин, часто в течение приблизительно 5 мин, часто в течение приблизительно 2 мин и иногда даже в течение 1 мин) после нанесения около 5 или 10 мкл на кожу (например, на предплечье) на см2 кожной поверхности (например, 250 мкл на 25 см2). Под термином «по существу, исчезает» понимают событие, когда большая часть (обычно по меньшей мере около 75%, по меньшей мере около 90% или по меньшей мере около 95%) композиции, нанесенной местно, исчезает в результате впитывания через роговой слой в эпидермис или дерму кожи и/или в результате процессов испарения (например, как было оценено по исчезновению композиции с поверхности места нанесения, например когда поверхность кожи становится сухой на ощупь, или как было оценено с помощью других количественных или качественных методов). В одном из воплощений исчезновение, главным образом, или практически полностью происходит в результате впитывания (например, основная часть или по меньшей мере около 75% композиции, нанесенной местно, исчезало путем впитывания). В другом воплощении исчезновение, главным образом, или практически полностью происходит в результате испарения. В одном из воплощений по меньшей мере около 5 мкл композиции доставляется (впитывается) в каждый см2 кожи или другой обрабатываемой поверхности в течение приблизительно 15 мин. 6.4. Скорость проникновения композиции может быть выше, чем скорость испарения. Некоторые композиции изобретения характеризуются тем, что скорость их проникновения выше, чем скорость их испарения. Употребляемый здесь термин «скорость проникновения» относится к скорости, с которой композиция проникает через барьер рогового слоя и впитывается в кожу. Употребляемый здесь термин «скорость испарения» относится к скорости, с которой компоненты композиции подвергаются изменению фазового состояния из жидкой в газообразную форму. Если скорость испарения композиции выше, чем скорость проникновения, особенно вероятно, что значительная часть агониста будет оставаться на поверхности кожи. Различным образом установлено, что если упругость пара композиции высока и таким образом скорость его испарения превышает проникновение под кожу, значительный остаток терапевтического агента может оставаться в виде остаточного отложения на поверхности кожи. Относительные скорости проникновения и испарения композиции могут быть определены с помощью множества методов, включающих те, которые описаны B.W. Kemppainen and W.G. Reifeinrath in Methods For Skin Absorbtion, CRC Publication 1990. Системы анализа испарения/проникновения доступны от фирмы Laboratory Glass Apparatus, Inc. Berkeley, CA. 7. Способы создания композиций. Композиции изобретения можно сделать, применяя общепринятые технические приемы. Материалы можно комбинировать в любом порядке. Иллюстративные способы приготовления для некоторых форм композиции описаны ниже. В одном из воплощений при использовании материалов, подходящих для введения субъектамлюдям, производятся компоненты или составляется рецептура в полном соответствии со стандартами Качественной производственной практики (GMP) Управления пищевых продуктов и лекарственных средств США. 8. Нанесение с высокой скоростью потока. В другом аспекте изобретение обеспечивает способ лечения капсаицин-чувствительного состояния у субъекта с помощью местного введения композиции, включающей агонист TRPV1 в условиях, в которых агонист проникает через роговой слой с высокой скоростью потока. При введении с большой скоростью потока быстрый контакт нервных волокон с капсаицином и/или быстрая аккумуляция капсаицина в эпидермисе или дерме приводят к значительному уменьшению плотности функциональных кожных ноцицепторов. Скорость потока относится к перемещению вещества (например, агониста TRPV1) через барьер (например, роговой слой) и характеризуется единицами вес/площадь/единица времени (например, мкг/см2/10 мин). Используемый в этом контексте термин «высокая скорость потока» означает скорость потока, по меньшей мере, равную приблизительно 10 мкг/см2/15 мин, предпочтительно по меньшей мере приблизительно 10 мкг/см2/10 мин, еще более предпочтительно по меньшей мере приблизительно 20 мкг/см2/15 мин, или даже по меньшей мере приблизительно 35 мкг/см2/15 мин, или по меньшей мере приблизительно 35 мкг/см2/10 мин, иногда даже по меньшей мере приблизительно 50 мкг/см2/15 мин, по меньшей мере - 18 - 012599 приблизительно 75 мкг/см2/15 мин или по меньшей мере приблизительно 100 мкг/см2/15 мин. Термин «высокая скорость потока» также означает скорость потока, по меньшей мере, равную приблизительно 1 мкг/см /мин, предпочтительно по меньшей мере приблизительно 2 мкг/см2/мин, по меньшей мере приблизительно 3,5 мкг/см2/мин, по меньшей мере приблизительно 5 мкг/см2/мин, или по меньшей мере приблизительно 7,5 мкг/см2/мин, или по меньшей мере приблизительно 10 мкг/см2/мин. В одном из воплощений изобретение обеспечивает способ лечения капсаицин-чувствительного состояния у субъекта с помощью местного введения композиции, включающей агонист TRPV1 в концентрации меньше чем 5% (мас./об.), обычно меньше чем приблизительно 3%, часто не более чем около 1%, часто меньше чем около 1%, часто меньше чем около 0,5% и иногда меньше чем около 0,1 или 0,05%, в условиях, в которых агонист проникает через роговой слой с высокой скоростью потока. В одном из воплощений изобретение обеспечивает способ лечения капсаицин-чувствительного состояния у субъекта с помощью местного введения композиции, включающей агонист TRPV1, с высокой скоростью потока, где указанное введение составляет менее чем приблизительно 45 мин, предпочтительно менее чем приблизительно 30 мин, часто менее чем приблизительно 15 мин, иногда около 10 мин или меньше или даже менее чем приблизительно 5 мин. В одном из воплощений вводимая композиция включает капсаицин в концентрации, которая меньше 5% (мас./об.), обычно меньше чем приблизительно 3%, часто не больше чем приблизительно 1%, часто меньше чем приблизительно 1%, часто меньше чем приблизительно 0,5% и иногда меньше чем приблизительно 0,1 или 0,05%. В одном из воплощений изобретение обеспечивает способ существенного уменьшения плотности функциональных кожных ноцицепторов в локальной области у субъекта с помощью местного введения композиции, включающей агонист TRPV1, с высокой скоростью потока, где указанное введение составляет менее чем приблизительно 45 мин, предпочтительно менее чем приблизительно 30 мин, часто менее чем приблизительно 15 мин, иногда около 10 мин или меньше или даже менее чем приблизительно 5 мин. В одном из воплощений вводимая композиция включает капсаицин в концентрации, которая меньше 5% (мас./об.), обычно меньше чем приблизительно 3%, часто не больше чем приблизительно 1%, часто меньше чем приблизительно 1%, часто меньше чем приблизительно 0,5% и иногда меньше чем приблизительно 0,1, и иногда меньше чем приблизительно 0,05%. 9. Введение композиции. 9.1. Продолжительность введения. В зависимости от целей введения и/или воздействуемого состояния, введение композиции может принести различные полезные эффекты, включающие уменьшение функциональности нервного волокна, изменение в чувствительности кожи, ослабление боли и другие полезные эффекты. Неожиданно оказалось, что эти эффекты обычно могут быть достигнуты с помощью относительно кратковременного контакта с композицией. Например, продолжительность введения, достаточного для достижения благотворного эффекта, составляет менее чем один час, чаще менее чем 30 мин, иногда менее чем приблизительно 15 мин и иногда менее чем приблизительно 10 мин, иногда около 5 мин или меньше и иногда менее чем приблизительно 2 мин. Используя способы и композиции, подробно описанные здесь, терапевтически эффективные количества агонистов TRPV1, например капсаицина, можно локально вводить субъекту намного быстрее, и эти количества выше, чем это возможно при применении общепринятых композиций. В одном из воплощений изобретение обеспечивает способ уменьшения хронической боли у субъекта путем местного введения композиции, включающей агонист TRPV1, в течение времени меньшего чем приблизительно 45 мин, обычно менее чем приблизительно 30 мин, часто менее чем приблизительно 15 мин, иногда около 10 мин или меньше, или даже менее чем приблизительно 5 мин. Обычно одного или двух введений достаточно, чтобы обеспечить стойкое купирование. Употребляемый здесь термин «продолжительность введения» может быть отнесен к времени, прошедшему между первым нанесением композиции субъекту (например, путем распыления на кожу, путем погружения или аналогичным образом) и любым из следующего: (1) окончание контакта (например, путем извлечения из ванны погруженной части тела, удаления аппликатора с кожи и т.п.); (2) очистка участка, контактировавшего с композицией, для удаления всех остатков агониста (например, используя очищающий раствор, как описано в разделе 10) или (3) момент, в который композиция полностью исчезла с места нанесения (например, путем впитывания в кожу, испарения или их комбинации). 9.2. Введение в кожу. Композиции изобретения могут быть нанесены на кожу (или, альтернативно, на слизистую мембрану), используя широкий спектр способов и устройств. Например, композиции могут быть введены с помощью губки, аэрозоля, пульверизатора, щетки, тампона и другого аппликатора. В одном из воплощений аппликатор обеспечивает как фиксированное, так и регулируемое отмеренное нанесение дозы, например, как в случае дозировочного аэрозоля, дозировочного насоса с запасенной энергией или ручного дозировочного насоса. В одном из воплощений аппликаторное устройство имеет калибровочные метки, чтобы помочь пользователю определять количество композиции в аппликаторном устройстве. В одном из воплощений аппликатор не является окклюзивным. В одном из воплощений аппликатор не приклеивается к коже и/или не является адгезивным. В одном из воплощений аппликатор не является - 19 - 012599 устройством в виде пластыря. В одном из воплощений аппликатор является устройством в виде пластыря и не включает усилитель проницаемости, выбранный из группы, включающей бутандиолы, дипропиленгликоль, тетрагидрофурфуриловый спирт, диметиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля, монобутиловый эфир диэтиленгликоля, пропиленгликоль, дипропиленгликоль, сложные эфиры карбоновых кислот и три- и диэтиленгликоля, полиэтоксилированные жирные спирты с 6-18 углеродными атомами, 2,2-диметил-4-гидроксиметил-1,3-диоксолан, дипропиленгликоль, 1,3-бутандиол, моноэтиловый эфир диэтиленгликоля или 2,2-диметил-4-гидроксиметил-1,3-диоксолан. В одном из аспектов изобретение обеспечивает систему лечения капсаицин-чувствительного состояния, содержащую (1) вводимую композицию, как описано в тексте; (2) аппликаторное устройство для нанесения состава на кожу или поверхность слизистой. В одном из воплощений аппликаторное устройство предварительно заполнено композицией. В одном из воплощений вводимая композиция помещается в контейнер, отделенный от устройства. 9.3. Закапывание. В одном из воплощений применяемую композицию вводят с помощью закапывания. Употребляемый в этом контексте термин «закапывание» означает введение композиции в некоторую часть тела, отличную от кожи, с помощью способа, не являющегося инъекцией. Примерами закапывания являются введение в мочевой пузырь с помощью катетера, введение в носовую полость с помощью аэрозоля, закапывание в уретру и закапывание в хирургические раны (например, для лечения или предупреждения боли). 9.4. Введение с помощью инъекции. В некоторых воплощениях изобретения описанные здесь составы вводят с помощью инъекции. Например, инъекционные способы могут применяться для доставки агониста TRPV1 в специфические нервные пути, ткани или другие части тела субъекта. Выгодно, чтобы вводимые композиции настоящего изобретения доставляли большое количество агониста TRPV1 в дозе небольшого объема; дозы небольшого объема вызывают уменьшенную боль и повреждение ткани и удобны для сотрудников службы здравоохранения. Кроме того, принимая во внимание выраженный эффект накопления, наблюдаемый в коже для некоторых вводимых композиций изобретения, ожидается, что композиции после инъекции будут накапливаться в зоне инъекции, что приведет к низкому уровню системного экспонирования, обеспечивая высокую локальную концентрацию агониста TRPV1. Инъекцию агонистов TRPV1 в нервные пути можно применять для блокирования входящих афферентных болевых сигналов от дистальных ноцицептивных нервных волокон, обеспечивая, таким образом, пользу для пациентов с невропатическими болевыми синдромами (см. Pertovaara, 1988 "Collateral sprouting of nociceptive C-fibers after cut or capsaicin treatment of the sciatic nerve in adult rats" Neurosci Lett. 90:248-53). В другом примере инъекцию агониста TRPV1 в ткань простаты можно применять для контроля за раком предстательной железы путем селективного уничтожения клеток раковой опухоли простатического происхождения (см., например, Morre et al., 1997, "NADH oxidase activity from sera altered by capsaicin is widely disturbed among cancer patients" Arch Biochem Biophys 342:224-30; Szallasi et al., 2001, "Vanilloid receptor ligands: hopes and realities for the future" Drugs Aging. 18:561-73; Surh, 2002, "Anti-tumor promoting potential of selected spice ingredients with antioxidative and anti-inflammatory activities: a short review" Food Chem Toxicol. 40:1091-7; Van der Aa et al., 2003, "Intersticial cells in the human prostate: a new therapeutic target?" Prostate 56:250-5). 9.5 Введение в виде микроэмульсии. В одном из воплощений изобретения вводимая композиция наносится или закапывается в виде микроэмульсии. В одном из воплощений изобретения микроэмульсия вводится в мочевой пузырь. 9.6 Другие формы введения. Специалистам в этой области техники очевидно, что известны другие способы введения средства. Все подходящие способы предусматриваются и охватываются изобретением. Другие формы введения средства включают его введение с помощью заполненных жидкостью микросфер (см., например, U.S. Pat. Nos. US 5716643; US 6264988), липосом, других полых везикул, циклодекстринов, мицеллярных или биоразрушаемых гелей. 10. Удаление остатка агониста TRPV1. В одном из аспектов изобретение обеспечивает способ контактирования поверхности (например, кожи) с агонистом TRPV1 для уменьшения функциональности нервных волокон и/или лечения капсаицин-чувствительного состояния с последующим удалением любых остатков агониста с поверхности. В одном из воплощений изобретения остатки агониста удаляют промыванием. В другом воплощении изобретения остатки агониста удаляют с помощью очищающей композиции, в которой растворим агонист, после чего очищающую композицию удаляют. В качестве иллюстрации, но не для ограничения объема изобретения, подходящим соединением может быть композиция, в основе которой применяется полиэтиленгликоль (PEG), такая как водный гель, содержащий от 60 до примерно 99 мас./мас.% полиэтиленгликоля. В воплощении изобретения очищающее средство включает PEG-300 (89,08%), загущающий агент на основе полиакрилата, такой как Carbopol 1382™ (1,0%) бутилированный гидроксианизол (0,02%), динатриевую соль ЭДТА (0,1%), остальное - вода; гель имеет рН около 6,5. См., например, публикацию РСТ WO04021990A2 "Compositions and kits for the removal of irritating compounds from bodily - 20 - 012599 surfaces." При желании, количество агониста, оставшееся на поверхности кожи, можно определить с помощью любого из многочисленных способов анализа. Например, остаток на коже можно удалить промыванием с помощью растворителя, в котором растворим агонист TRPV1, или протиранием тампоном места нанесения средства, при этом можно установить вес, концентрацию и биологическую активность агониста TRPV1 в растворителе или на тампоне. Подходящие процедуры для этого определения будут очевидны для специалистов в этой области техники и со ссылкой на научную литературу. См., например, Wang et al., 2001, Int J Pharm 14:18-104. В большинстве исследований проводили сбор образцов остаточных количеств лекарственного средства с поверхности кожи. Один из способов сбора образцов представляет собой протирание места нанесения средства марлевой губкой хирургического качества, слегка пропитанной растворителем, подходящим для определенного лекарственного вещества. При протирании каждая поверхность губки используется только один раз в процессе одного мазка в продольном направлении. Марлевую губку затем помещают на воронку из пористого стекла и промывают достаточно известным количеством растворителя (такое же известное количество применяют для первоначального намачивания марли). Полученные промывные воды анализируют с помощью метода (хроматография, УФили масс-спектроскопия), подходящего для количественного определения данного лекарственного средства. См., например, M.J. Shifflet and M. Shapiro Development of Analytical Methods to Accurately and Precisely Determine Residual Active Pharmaceutical Ingredients and Cleaning Agents on Pharmaceutical Surfaces, American Pharmaceutical Review; Summer 2002. Альтернативный способ сбора образцов описан в статье Nanji A. et. al. 1987, JToxicol. Clin Toxicol. 25:501-15 (описано применение зонда-отсоса для сбора образцов, которые затем загружают прямо в масс-спектрометр для термодесорбции). 11. Наборы и устройства. В одном из аспектов настоящее изобретение обеспечивает набор, включающий (1) вводимую композицию изобретения и материалы для удаления остатков агониста с поверхности нанесения (например, поверхности кожи). В воплощении изобретения набор включает чистящий гель на основе PEG, такой как описан в публикации РСТ WO04021990A2. Кроме того, набор изобретения может включать анестезирующее средство, химически устойчивые одноразовые пакеты, аппликаторы для нанесения очищающей композиции, полотенца или салфетки для удаления чистящего геля, перчатки, средство защиты глаз, ножницы, маркеры и дополнительные очищающие поверхность тела средства, такие как смоченные спиртом тампоны. В одном из воплощений изобретения анестезирующее средство является лидокаином. В одном из аспектов изобретение обеспечивает набор, включающий (1) вводимую композицию изобретения и (2) материал или устройство для доставки композиции. В одном из воплощений изобретения композиция содержится в контейнере отдельно от устройства. В одном из воплощений изобретения в качестве аппликаторного устройства используют губку, щетку или тампон. 12. Примеры эффектов. Применение агонистов TRPV1 по изобретению приводит к множеству полезных физиологических и/или терапевтических эффектов, некоторые из примеров которых описаны ниже. 12.1. Уменьшение плотности функциональных ноцицептивных нервных волокон. Как отмечено выше, в одном из аспектов изобретение обеспечивает способ уменьшения плотности функциональных ноцицептивных нервных волокон (то есть понижение функциональности нервного волокна, NFF) в выбранном участке тела субъекта путем контактирования этого участка с композицией, которая включает агонист TRPV1 и растворяющую систему, включающую один или более усилителей проницаемости, то есть с вводимой композицией, описанной в тексте. В некоторых воплощениях изобретения в результате контактирования участка с вводимой композицией в течение определенного периода времени происходит значительное уменьшение плотности. «Значительное уменьшение» плотности или числа функциональных ноцицептивных нервных волокон означает снижение по меньшей мере примерно на 20%, по меньшей мере примерно на 25%, по меньшей мере примерно на 28%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 75% и иногда по меньшей мере примерно на 80% по сравнению с необработанным (контроль) участком тела субъекта. Смотри ниже примеры 2 и 3. В некоторых воплощениях изобретения определенный период времени составляет не больше чем около 10, 15, 20, 30 или 45 мин. Плотность или число функциональных ноцицептивных нервных волокон можно определить многими способами. Особо полезным способом является иммуноокрашивание белкового продукта гена 9.5 («PGP 9.5»), как описано в статье Nolano et.al., 1999, J Neuroscience 81:135-45. Также см. Kennedly et al., 1996, «Quantitation of epidermal nerves in diabetic neuropathy» Neurology 47:1042-48. Уменьшение окрашивания PGP 9.5 указывает на понижение NFF. Другие способы измерения функциональной или структурной инактивации нервных волокон включают иммуноокращивание субстанции Р, иммуноокрашивание продукта гена, родственного кальцитонину, иммуноокрашивание S100, иммуноокрашивание белков нейрофиламентов и иммуноокрашивание рецепторов TRPV1, например, используя антитела к рецептору TRPV1. Анализ иммуноокращивания обычно проводят между 2 и 7 днем после введения агониста - 21 - 012599 TRPV1. В различных воплощениях изобретения плотность нервных волокон измеряют 2, 3, 4, 5, 6 или 7 дней спустя после введения композиции. В одном из воплощений изобретения плотность функциональных ноцицептивных нервных волокон измеряют 7 дней спустя после введения агониста TRPV1. Альтернативно, кроме иммуноокрашивания могут быть использованы другие способы оценки плотности кожных ноцицепторов. Примеры 2 и 3 иллюстрируют анализ NFF после местного нанесения капсаицина или резинифератоксина. Воздействие агониста TRPV1 может привести или к явному уменьшению количества поддающихся подсчету нервных волокон в эпидермисе и дерме, или к изменениям внешнего вида этих нервных волокон. Когда для наблюдения за NFF используют иммуноанализы PGP 9.5, считают только PGP 9.5позитивные нервные волокна с нормальной морфологией. Области кожи, пораженные периферийными невропатиями, характеризуются атипичным опуханием, варикозами или сегментацией нервных волокон малого диаметра (ноцицепторов) (см., например, McArthur et al., 1998, «Epidermal nerve fiber density: normative reference range and diagnostic efficiency» Arch Neurol. 55:1513-20; Herrmann et al., 2004, «Epidermal nerve fiber density, axonal swelling and QST as predictor of HIV distal sensory neuropathy» Muscle Nerve. 29:420-7) и полагают, что похожие изменения в морфологии ноцицепторов происходят после местного воздействия капсаицина на кожу. При определении числа нервных волокон на миллиметр кожи учитывают только нервные волокна с нормальным морфологическим видом. В дальнейшем, если существенное количество нервных волокон в любом срезе кожи находится в припухшем состоянии или имеет варикозы, так что невозможно посчитать волокна нормального вида, тогда этому срезу приписывают нулевое количество нервных волокон. 12.2. Длительное ослабление невропатической боли. В одном из воплощений изобретение обеспечивает способ, в котором применение вводимой композиции субъекту с невропатической болью приводит к продолжительному или устойчивому исчезновению симптомов (например, боли). В некоторых случаях, чтобы обеспечить устойчивое облегчение (например, облегчение симптомов по меньшей мере приблизительно на четыре недели, предпочтительно по меньшей мере приблизительно на восемь недель), достаточно одного или двух введений. 12.3. Снижение чувствительности кожи после введения агонистов TRPV1 (анализ QST). В норме ноцицептивные нервные волокна отвечают на тепловые или холодовые температурные стимулы. Поэтому изменения пороговых значений температуры служат указанием на снижение функции ноцицепторов и могут быть использованы для измерения NFF. «Значительное снижение» NFF может быть обнаружено в виде изменения порогового значения температуры. Для обнаружения изменений порогового значения температуры, происходящих как из-за болезней, так и в результате контакта с агонистами TRPV1, можно использовать количественное сенсорное тестирование (QST) (Bjerring et al., 1989, "Use of a new argon laser technique to evaluate changes in sensory and pain thresholds in human skin following topical capsaicin treatment" Skin Pharmacol. 2:162-67). Методы QST хорошо известны в научной литературе и среди специалистов в этой области техники (Siao et al., 2003, "Quantitative sensory testing" Phys Med Rehabil Clin N Am. 14:261-86). Например, можно измерить сниженную способность испытывать чувство холода, производимого металлическим валиком (Therrell device, Somedic Production AB, Sollentuna, Sweden), предварительно охлажденным до 12°С. В различных воплощениях изменение порогового значения температуры составляет по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 25%, по меньшей мере около 28%, по меньшей мере около 30%, по меньшей мере около 40% и иногда по меньшей мере около 50% по сравнению с необработанным (контрольным) участком тела или пациентом. 12.4. Введение агонистов TRPV1 со сниженным дискомфортом. Известно, что введение капсаицина вызывает интенсивную жгучую боль. Применение даже относительно низких концентраций капсаицина приводит к появлению боли, которая является непереносимой для многих пациентов. По этой причине капсаицин можно вводить сразу же после или вместе с приемом анестетика. Неожиданно было обнаружено, что быстрое введение агонистов TRPV1 с применением способов и композиций настоящего изобретения приводит к меньшим болевым ощущениям или дискомфорту по сравнению с введением традиционных капсаициновых композиций, включающих намного более низкие концентрации капсаицина. Пример 4 показывает, что неожиданно жидкая композиция 10%-ного (мас./об.) капсаицина вызывает статистически значимое (р≤0,1) уменьшение ответа на боль по сравнению с кремом Zostrix® при нанесении на вульву крысы (крем Zostrix® - доступный в продаже состав с 0,075%-ным капсаицином). Похожим образом пример 5 показывает, что местное нанесение жидкого состава 10%-ного капсаицина в моноэтиловом эфире диэтиленгликоля вызывает снижение ноцифензивных поведенческих реакций в течение 90 мин наблюдения по сравнению с местным нанесением отпускаемого без рецепта капсаицинового крема с низкими концентрациями (0,1%). Предполагают, что применяя способы настоящего изобретения, пациенту можно вводить среднюю (>1%), высокую (>3%) и даже очень высокую дозу капсаицина без необходимости в предварительной обработке или совместном введении анестетика. Кроме того, если предварительно применяется анесте- 22 - 012599 зия, во время или после контакта с агонистом TRPV1 потребуется меньшее количество анестетика или более кратковременный период контакта с анестетиком, чтобы достичь того же самого эффекта в отношении дискомфорта. Таким образом, при использовании композиции настоящего изобретения в одном из аспектов изобретение обеспечивает способы введения агониста TRPV1, например капсаицина, в концентрации больше чем 1% (мас./об.), больше чем 2%, больше чем 3%, больше чем 4%, больше чем 5% или больше чем 6% без необходимости применения анестетика. 13. Терапевтические применения композиций, включающих агонисты TRPV1. Этот раздел описывает применение композиций изобретения. Однако понятно, что примеры, приведенные в этом разделе, представлены для иллюстрации и не ограничивают объем изобретения. Как было указано выше, применение капсаицина дает много терапевтических преимуществ, каждое из которых может эффективно применяться при лечении, используя способы изобретения. Состояния, для которых может быть показано лечение агонистом TRPV1, включают невропатическую боль (включающую боль, ассоциированную с диабетической невропатией, постгерпесную невралгию, HIV/AIDS, травматическое повреждение, сложный региональный болевой синдром, тригеминальную невралгию, эритромелалгию и фантомную боль), боль, вызываемую смешанной ноцицептивной и/или невропатической смешанной этиологиями (например, раком), остеоартрит, фибромиалгию, поясничную боль, воспалительную гипералгезию, вульварный вестибулит или вульводинию, пазушный полипозный интерстициальный цистит, нейрогенный или гиперактивный мочевой пузырь, гиперплазию простаты, ринит, хирургическую травму, гиперчувствительность прямой кишки, синдром обожженного рта, оральный мукозит, герпес (или другие вирусные инфекции), гипертрофию простаты, дерматит, прурит, зуд кожи, шум в ушах, псориаз, бородавки, рак (в особенности рак кожи), головные боли или морщины. Обычно композиции, включающие агонист TRPV1, можно применять для лечения любого состояния, для которого местное введение агониста TRPV1 (например, капсаицина) приносит пользу. 13.1. Невропатическая боль. Доказано, что невропатическая боль, например ассоциированная с диабетической невропатией или постгерпесной невралгией, особенно устойчива к лечению. Однако было продемонстрировано, что капсаицин эффективен при лечении невропатической боли. Например, инактивация кожных ноцицепторов в эпидермисе и дерме, вызванная применением кожного пластыря с 8%-ным (мас./мас.) капсаицином, продемонстрировала клиническую эффективность против постгерпесной невралгии, состояния с прототипичной невропатической болью (см. Backonja et al., "A Single One Hour Application of High-Concentration Capsaicin Patches Leads to Four Weeks of Pain Relief in Postherpetic Neuralgia Patients" American Academy of Neurology, 2003 (meeting abstract). Композиции настоящего изобретения эффективны для лечения такой невропатической боли. Эффективность специфических композиций по отношению к способности приводить кожные рецепторы в стойкое нефункциональное состояние можно определить с помощью иммуногистохимической оценки в коже плотности маркеров кожных ноцицепторов, таких как белковый продукт гена 9.5 (PGP 9.5). Для количественной оценки изменений в плотности окрашивания PGP 9.5 можно использовать стандартные методы (см. Nolano et al., 1999, J Neuroscience 81:135-45). Можно провести анализ перфорационной биопсии, взятой через 3-7 дней после обработки с помощью состава. Ожидается, что композиции настоящего изобретения, вызывающие снижение окрашивания PGP 9.5, сравнимое или превосходящее снижение окрашивания после действия капсаицинового дермального пластыря (см. Backonja et al., 2003), будут вызывать сходные или превосходящие анальгетические эффекты. Однократное введение композиции изобретения, включающей агонисты TRPV1 (например, включающей капсаицин), можно применять для обеспечения значительного и долго длящегося ослабления хронических болевых состояний, в особенности невропатической боли и воспалительной боли. Употребляемый в этом контексте термин «значительное ослабление боли» означает снижение по меньшей мере на 15% и иногда по меньшей мере на 50% по отношению к боли, о которой исходно сообщил пациент. Боль можно измерить, используя общепринятые методы, такие как применение шкалы боли по Ликерту (см. Guyatt et al., 1987, "A comparison of Likert and visual analogue scales for measuring change in function" J Chronic Dis. 40:1129-33). Употребляемый в этом контексте термин «долго длящееся ослабление боли» означает освобождение по меньшей мере на две недели, обычно по меньшей мере на 1 месяц и очень часто это ослабление на 3-6 месяцев после введения композиции. Ожидается, что применение композиции, включающей 1-10% (мас./об.) капсаицин, в течение от 2 до 60 мин обеспечит значительное ослабление боли. Обычно применение средства в течение 30 мин или меньше, например 15 мин или меньше или даже 10 мин или меньше, обеспечит значительное ослабление боли. 13.2. Воспалительная или ноцицептивная боль. Агонист TRPV1 полезен для уменьшения воспалительной или ноцицептивной боли, в особенности тех, которые происходят в результате таких состояний, как остеоартрит, ревматоидный артрит, суставная боль, хирургия, травма, ушибы, ссадины, поясничная боль, острый герпесный опоясывающий лишай или раковые опухоли. 13.3. Раковые опухоли. - 23 - 012599 Композиции агонистов TRPV1 изобретения представляют особенную ценность при лечении различных типов раковых опухолей, например раковых опухолей кожи. Было показано, что капсаицин предупреждает рост раковой клетки и/или вызывает апоптоз раковой клетки в анализе in vitro при применении различных линий раковых клеток (для обзора, см. Y.-J. Surh, 2002, "More Than Spice: Capsaicin in Hot Chili Peppers Makes Tumor Cells Commit Suicide", J Nat Cancer Inst, 94:1263-65). В соответствии с изобретением композиции с капсаицином или агонистом TRPV1 доставляются прямо в раковые ткани или клетки или в предшественники раковых клеток (например, в клетки, ответственные за гиперплазию простаты или патологии уретры). Для лечения раковых опухолей кожи, например, композицию можно наносить с помощью местного применения или, альтернативно, с помощью инъекции или закапывания. Так как капсаицин усиливает чрескожное поглощение других веществ, ожидается, что доставка капсаицина в комбинации с противораковыми средствами (например, 5-фторурацилом) будет эффективной. 13.4. Оральный мукозит. Композицию агониста TRPV1 изобретения также применяют для лечения орального мукозита. Оральный мукозит является существенной проблемой у пациентов, получающих химиотерапию или радиационную терапию. Оценки случаев орального мукозита в терапии рака находятся в диапазоне от 40% для пациентов, получавших стандартную химиотерапию, до 76% для пациентов с трансплантацией костного мозга. Описана эффективность капсаицина для лечения орального мукозита (Berger et al., 1995, J Pain Symptom Manage 10:243-8). Однако ослабление боли, обеспечиваемое известными ранее композициями, у большинства пациентов было неполным и имело ограниченную продолжительность во времени. Это могло происходить из-за природы известных ранее композиций, как из-за их способности индуцировать боль, так и из-за неспособности направленно доставлять высокие концентрации капсаицина в участок, пораженный оральным мукозитом. Введение композиций настоящего изобретения в участки повреждений слизистой оболочки рта обеспечило бы быструю и удобную доставку капсаицина или других агонистов TRPV1. Применение композиций можно осуществить с помощью тампона, аэрозоля, валика, шприца или другого устройства. 13.5. Болезни мочевого пузыря. Закапывание растворов, содержащих капсаицин, в мочевой пузырь применялось для лечения множества нарушений мочевого пузыря, включающих нейрогенный мочевой пузырь, интерстициальный цистит, детрузивную гиперрефлексию и гиперактивный мочевой пузырь (для обзора, см. Fowler et al., 2002, "Voiding and the Sacral Reflex Arc: Lessons from Capsaicin Instillation," Scand J Urol Nephrol Supple 210:46-50). Несмотря на обычную эффективность, эти процедуры требуют по меньшей мере 20 мин контакта с раствором лекарственного средства и вызывают значительную боль и дискомфорт для пациентов. См. Chacellor et al., 1999, J Urol 162:3-11. Композиции настоящего изобретения можно применять для лечения таких нарушений мочевого пузыря. В одном из воплощений композицию вводят в форме микроэмульсии, такой как описана ниже в разделе 13, которую закапывали в мочевой пузырь. В другом воплощении описанная в тексте композиция, включающая агонист, является смешиваемой с водой из-за сорастворимости усилителя проницаемости. Амфифильная растворяющая система, такая как капсаицин, растворенный в моноэтиловом эфире диэтиленгликоля, может придавать капсаицину достаточную растворимость в воде, позволяющую осуществлять прямое закапывание образующейся однофазной смеси. 13.6. Гиперплазия простаты. Гиперплазия простаты - болезнь, поражающая миллионы мужчин во всем мире. Примечательно, что клетки гиперпролиферативной простаты имеют много общего с раковыми клетками (которые, как описано выше, уходят в апоптоз в ответ на капсаицин). См. Tayeb et al., 2003, Br J Cancer 88:928-32. Это состояние можно лечить с помощью введения композиций настоящего изобретения. В одном из воплощений композицию вводят в форме микроэмульсии так, как это описано ниже в разделе 13, закапывая в уретру, что имеет потенциальную ценность для лечения (и возможно обращения) гиперплазии простаты. Кроме лечения гиперплазии закапывание композиции изобретения должно также снизить дискомфорт симптома мочеиспускания, характерного для гиперплазии простаты. Инъецирование капсаицина непосредственно в простату могло бы затронуть водитель ритма и гиперпластические клетки, экспрессирующие TRPV1. См. Exintaris et al., 2002, J Urol. 168:315-22. 13.7. Псориаз, дерматит, прурит и зуд кожи. Эффективность капсаицина против псориаза, дерматита, прурита и зуда кожи была подтверждена в хорошо контролируемых клинических испытаниях (например, см. Bernstein et al., 1986, "Effects of Topically Applied Capsaicin on Moderate and Severe Psoriasis Vulgaris," J Am Acad Dermatol 15:504-507; Ellis et al., 1993, "A Double-Blind Evaluation of Topical Capsaicin in Pruritic Psoriasis," J Am Acad Dermatol 29:43842). Такое лечение требует нанесения кремов с низкой концентрацией по несколько раз в день в течение многих недель. В соответствии с настоящим изобретением композиции, описанные здесь, наносят локально на участки, пораженные псориазом, дерматитом, пруритом или зудом кожи. Ожидается, что это лечение обеспечит превосходное и долго длящееся облегчение по сравнению со способами, доступными в настоящее время. 13.8. Бородавки. Обычная бородавка, или Verruca vulgaris, встречается у 5-10% детей и в меньшем количестве у - 24 - 012599 взрослых. Обычное лечение представляет собой замораживание с помощью капель жидкого азота или криотерапию. Эта процедура может быть эффективной, но может потребовать месяцы повторных болезненных процедур, которые вызывают страх у многих детей и могут иногда приводить к появлению волдырей и инфекциям. Также сообщалось о том, что криотерапия имеет ограниченную эффективность. Обнаружено, что композиции настоящего изобретения, включающие капсаицин, полезны при лечении обычных бородавок. Ожидается, что это лечение обеспечит наивысшее и долго длящееся облегчение по сравнению со способами, доступными в настоящее время. 13.9. Мигрень и головная боль. Мигрень (включающая мигрень вместе с аурой) и головная боль (например, сильная приступообразная головная боль с периодическими рецидивами) характеризуются выводящей из строя болью и гиперактивацией тригеминальной нервной системы. Существуют доказательства того, что локальное применение агонистов TRPV1 на слизистой носа может предупредить или ликвидировать головную боль. См., например, Saper et al., 2002, Arch Neurol 59:990-4 и Vass et al., 2001, Neuroscience 103:189-201, так как тройничная нервная система иннервирует кожу лица и головы, а также слизистую полости носа. В соответствии с изобретением локальное применение композиций изобретения на тройничной нервной системе (например, нанесение на лоб или другие части лица или головы или в носовые ходы) используется для предупреждения или уменьшения симптомов головной боли. 13.10. Морщины. Многие морщины вызываются тонической активацией мышц, лежащих под кожей. Вероятно, в этот процесс вовлечена рефлекторная дуга, включающая в себя гиперактивность сенсорной нервной системы. Применение композиций настоящего изобретения используется для уменьшения глубины или протяженности морщин или для предупреждения образования морщин. 13.11. Шум в ушах. Существует много общего между симптомами и признаками тяжелой формы шума в ушах и хронической болью, например некоторые индивидуумы с тяжелой формой шума в ушах воспринимают звуки как неприятные или болезненные, и для лечения обоих состояний применяют до некоторой степени те же самые лекарства (Moller, 2000, "Similarities between severe tinnitus and chronic pain" J Am Acad Audiol. 11:115-24). Немного известно об анатомической локализации изменений, которые вызывают шум в ушах, но это может быть нижний бугорок, а также другие структуры. TRPV1 обнаружены в волосковых клетках и поддерживающих клетках кортиевого органа и клетках спиральных ганглиев улитки. Исследования на животных показывают, что основное действие капсаицина направлено на наружные волосковые клетки, и наводят на мысль, что TRPV1 в улитке играют роль в гомеостазе улитки (Zheng et al., 2003, "Vanilloid receptors in hearing: altered cochlear sensitivity by vanilloids and expression of EK3M1 in the organ of corti" J Neurophysiol. 90:444-55). Кроме того, активация TRPV1 эндогенными лигандами может вносить вклад в гиперчувствительность восьмого нерва по отношению к входным сигналам волосковых клеток при множестве патологических состояний, таких как шум в ушах, болезнь Меньера или мигрень (Balaban et al., 2003, "Type 1 vanilloid receptor expression by mammalian inner ear ganglion cells" Hear Res. 175:16570). Ожидается, что композиции настоящего изобретения могут быть эффективными при шуме в ушах. 14. Способы скрининга. В одном из аспектов изобретение обеспечивает способ идентификации композиции, полезной для терапевтической доставки агониста TRPV1 субъекту, путем определения эффекта накопления для раствора, состоящего из композиции и агониста TRPV1 или другого агониста TRPV1; те случаи, когда эффект накопления менее чем 0,25, указывают на то, что композиция полезна для терапевтической доставки агониста TRPV1. В альтернативных воплощениях эффект накопления, меньший чем 0,2, 0,1, 0,05, 0,01, 0,005 или 0,001, указывает на то, что композиция полезна для терапевтической доставки агониста TRPV1. В одном из воплощений изобретения существует дополнительная стадия определения количества агониста, доставленного в кожный эпидермис и дерму после определенного времени, когда композиция наносится на поверхность кожи. В родственном аспекте изобретение предоставляет способ ранжирования двух или более композиций в соответствии с их полезностью для терапевтической доставки агониста TRPV1 субъекту; сравнительную оценку осуществляют с помощью определения эффекта накопления для раствора, состоящего из композиции и агониста TRPV1 или другого агониста TRPV1, затем сравнивают значения, полученные для эффекта накопления каждой композиции, ранжируют эти композиции в соответствии с полученными значениями; композицию с более низким значением оценивают как более подходящую для терапевтической доставки агониста TRPV1. В одном из воплощений для каждой композиции существует дополнительная стадия определения количества агониста, доставленного в кожный эпидермис и дерму после определенного времени, когда композицию наносят на поверхность кожи, причем композицию с более высоким значением оценивают как более подходящую для терапевтической доставки агониста TRPV1. В различных воплощениях этих способов: (1) композиция включает один или несколько усилителей проницаемости; (2) композиция является композицией настоящего изобретения; (3) агонист TRPV1 является капсаицином; (4) эффект накопления определяют in vitro; (5) эффект накопления определяют, используя кожу мыши; или (6) эффект накопления определяют, используя способ анализа абсорбции кожей - 25 - 012599 мыши, предложенный в настоящем изобретении. 15. Приготовление и введение микроэмульсии. Композиции изобретения можно вводить в форме микроэмульсии. Способы изготовления микроэмульсий, как правило, известны в этой области техники. См., например, Prince, 1970 "Microemulsions" J. Soc. Cosmet. Chem. 21:193-204; Prince L.M. in Microemulsions-Theory and Practice, Academic, New York 1977; Belloq A.M. et al.; Adv Colloid Interfase Sci 20:167, 1984 и Bourell M., Schechter R.S. in Microemulsions and Related Systems, Dekker, New York, 1988. В одном из вариантов готовят микроэмульсию, включающую три компонента. Три компонента представляют собой дисперсную фазу, непрерывную фазу и один или более эмульгаторов. Дисперсная фаза. Содержание дисперсной фазы зависит от природы композиции, включающей агонист TRPV1, применяемой для изготовления микроэмульсии. Если композиция не смешивается с водой, композиция служит дисперсной фазой (хотя она может быть при необходимости соединена с маслом, с которым композиция смешивается). Если композиция (например, композиция, включающая агонист TRPV1 и растворяющую систему, например 5% (мас./об.) капсаицина в моноэтиловом эфире диэтиленгликоля) или амфифильна, или гидрофильна, композицию соединяют с маслом, с которым она смешивается. Примеры таких масел включают для иллюстрации, но не для ограничения объема изобретения, минеральное масло, норковое масло, льняное масло, тунговое масло, скипидар и растительное масло. Дисперсная фаза диспергируется в виде микрокапель (например, имеющих диаметр от приблизительно 10 до приблизительно 200 нм, обычно от приблизительно 10 до 60 нм). Непрерывная фаза. Непрерывная фаза - водный раствор, такой как вода, солевой раствор, буфер и т.п. Непрерывная фаза представляет собой среду, в которой диспергируются микрокапли. Эмульгатор (эмульгаторы). Примеры подходящих эмульгаторов (для иллюстрации, но не для ограничения объема изобретения) включают минеральное масло, Pluronic (BASF), полиэтоксилированные жирные кислоты, сложный диэфир жирных кислот и PEG, смесь сложных моно- и диэфиров жирных кислот и PEG, полиглицериновые эфиры жирных кислот, моно- и диглицериды, стерины и производные стерина, сложные эфиры сахаров, блок-сополимеры полиоксиэтилена и полиоксипропилена, сорбитановые сложные эфиры жирной кислоты, эфиры низкомолекулярного спирта и жирной кислоты, ионные поверхностно-активные вещества и неионные поверхностно-активные вещества и их смеси. Дополнительные компоненты. Кроме того, микроэмульсия может включать другие компоненты, такие как компоненты, повышающие стабильность (например, антибактериальные вещества, антиоксиданты и т.п.), вещества, регулирующие рН, стабилизаторы и т.п. Однако обычно эти компоненты присутствуют в небольших количествах (например, менее чем приблизительно 5% (мас./об.), наиболее часто менее чем примерно 1%). Приготовление микроэмульсии. Микроэмульсию можно приготовить добавлением по меньшей мере одного эмульгатора (например, полиглицерил-6-диолеата) в дисперсную фазу (например, в 5%-ный раствор капсаицина в моноэтиловом эфире диэтиленгликоля, смешанный с маслом). Смесь затем добавляют к непрерывной фазе (например, к воде). Полученную смесь энергично перемешивают, подвергают обработке ультразвуком или взбалтывают другим способом с нагреванием или без нагревания до тех пор, пока не сформируются стабильные микрокапельки и не будет достигнуто гомогенное распределение. Для повышения стабильности и/или физиологической устойчивости микроэмульсии можно довести рН среды. Можно приготовить концентрированные составы агониста TRPV1, включающие сорастворители, поверхностно-активные вещества, эмульгаторы и загустители в концентрациях, превышающих ожидаемые конечные концентрации вводимой композиции. (см. пример 6). Эти составы являются «предконцентратами», не предназначены для непосредственного введения и требуют дополнительного разведения в подходящем для этой цели растворителе для получения желаемой концентрации для введения. Применение микроэмульсии. Микроэмульсию приводят в контакт с тканью, которая предназначена для доставки агониста TRPV1. Без намерения быть связанным с конкретным механизмом полагают, что микрокапли будут быстро сливаться с тканью-мишенью (т.е. тканью, с которой контактирует микроэмульсия) и будут доставлять агонист TRPV1 и любые другие терапевтически активные агенты в ткань. Примеры лечения, для которых полезно введение микроэмульсии, включают, но не лимитируются только ими, (1) лечение периферической невропатии, артрита, псориаза и обморожения (введение с помощью ванны); (2) лечение нейрогенного мочевого пузыря, интерстициального цистита или похожих состояний (закапывание в мочевой пузырь); (3) лечение рака простаты или гиперплазии простаты (закапывание в уретру) и (4) закапывание в хирургические раны для лечения или предупреждения боли. Способ контактирования ткани с микроэмульсией будет разниться в зависимости от природы ткани и состояния, на которое воздействует лечение. Один пример способа введения средства представляет собой прием средства с помощью устройства типа водной ванны (например, контейнер с микроэмульси- 26 - 012599 ей, в который можно погрузить ткань-мишень, например кисть или стопу). Например, настоящее изобретение обеспечивает способы и устройства для введения композиции, включающей агонист TRPV1 (или микроэмульсии, или другой композиции, включающей агонист TRPV1, такой как были описаны выше) с применением устройства ванного типа. В одном из вариантов ванное устройство включает резервуар, предназначенный для помещения в него микроэмульсии агониста TRPV1 и погружения пораженной поверхности ткани. Например, кисть, стопу, локоть или любую другую пораженную поверхность можно погрузить в ванну для лечения. Этот тип устройства обладает несомненными преимуществами. Во-первых, устройство ванного типа обеспечивает удобный способ обеспечения того, что пораженная поверхность целиком подвергается лечению, поскольку целые части тела могут быть легко погружены в ванну для лечения. Терапевтическая ванна особенно удобна для пациентов, страдающих от некоторых типов невропатии, таких как диабетическая периферическая невропатия, которая обычно поражает и вызывает боль в нижних конечностях, в первую очередь в стопах. Терапевтическая ванна также может применяться для лечения скелетно-мышечной боли. Пациенты, страдающие диабетической периферической невропатией, могут погружать свои стопы в ванну, описанную здесь, для лечения с использованием способов, описанных здесь. Подобным же образом невропатическая боль в верхних конечностях обычно начинается с кончиков пальцев, перед тем как распространиться на кисти и руки. Поэтому терапевтическая ванна также особенно полезна для лечения пальцев и кистей. Во-вторых, использование ванны полезно для контроля и усиления доставки лекарственного средства. Это происходит потому, что окружающие условия, влияющие на доставку лекарственного средства, можно тщательно регулировать и модифицировать. Например, показано, что температура, гидратация, содержание солей и концентрация лекарственного средства влияют на поглощение лекарственного средства через кожу. Поэтому регулирование этих свойств может помочь контролировать или усиливать доставку лекарственного средства. В простейшей форме ванное устройство предоставляет контейнер, предназначенный для того, чтобы помещать в него терапевтическую жидкость. Контейнер имеет размер, достаточный для того, чтобы в него можно было бы погрузить пораженную поверхность. Устройство может, например, принимать форму ванны для стоп. Однако должно быть ясно, что ванна может иметь любую другую форму и размеры, вследствие этого быть пригодной для погружения любых других обрабатываемых частей тела. В одном из воплощений ванна включает резервуар, в который помещают микроэмульсию агониста TRPV1 и части тела. Резервуар имеет поверхность дна и конструкцию стенок, простирающуюся кверху от нее. Если ванна является устройством для стоп, резервуар имеет длину и ширину, достаточную для помещения в него стоп взрослого пользователя среднего размера. Подобным образом размер резервуара может быть выбран таким образом, чтобы обеспечить достаточное пространство для того, чтобы позволить пользователю легко опускать и вынимать из него стопы. Кроме того, ванна может иметь определенные анатомически подогнанные рельефы поверхности. Например, ванна может включать в себя отдельные опоры для стоп, дополнительные опоры для свода стоп или другие рельефы, разработанные для стоп. Ванна может быть сделана из любого подходящего материала. В некоторых воплощениях ванна включает нагревательные и охлаждающие элементы, предназначенные для регулирования температуры резервуара или микроэмульсии, содержащейся в нем. Повышенные температуры могут помочь облегчить проникновение агониста TRPV1 через кожу. Противоположным образом пониженные температуры могут помочь усилить переносимость любых проявлений дискомфорта, появляющегося в результате контакта с некоторыми агонистами TRPV1. Нагревающий и охлаждающий элемент может контролироваться с помощью электричества или работать от батареек. В некоторых воплощениях нагревательный элемент обеспечивает возможность фокусировать тепло на определенном участке стопы пользователя, например, при использовании инфракрасных лучей. Однако можно использовать любой тип подходящего нагревательного элемента. Ванна также может включать ультразвуковой элемент для пропускания волн через микроэмульсию агониста TRPV1. Без намерения быть связанным какой бы то ни было определенной теорией предполагается, что применение таких волн помогает облегчить проникновение агониста TRPV1 через кожу. Ванна также может иметь крышку или изоляцию, чтобы улавливать испарение и предупреждать случайный пролив. Крышка может полностью сниматься или нет. Например, крышка может быть сконфигурирована так, чтобы защелкиваться над поверхностью ванны, или может быть присоединена к ванне с помощью любого другого подходящего соединения (например, петель). В некоторых воплощениях крышка сконструирована так, чтобы покрывать поверхность резервуара целиком и создавать изолирующий слой вокруг пораженной поверхности, пока пораженная поверхность подвергается лечению. Чтобы контролировать элементы нагревания, охлаждения и ультразвуковой обработки можно использовать контрольную панель. Контрольная панель может питаться с помощью любого подходящего источника питания, например силового провода, который подключается к выходу на 110 В переменного тока, или даже с помощью батареи. Применение ванны, питающейся от батареи, помогает облегчить портативность устройства. Кроме того, контрольная панель может иметь таймер, чтобы отслеживать время лечения и чтобы показывать пользователю, когда заканчивается время обработки. По желанию на - 27 - 012599 контрольную панель можно добавить любое число дополнительных модификаций или контролей. Как было указано выше, один аспект изобретения предоставляет способ введения микроэмульсии агониста TRPV1 с использованием устройства в виде ванны. В процессе работы эмульсию, включающую агонист TRPV1, добавляют в резервуар устройства. Затем обрабатываемую часть тела погружают в микроэмульсию на определенный заранее период лечения. Времена лечения будут сильно разниться в зависимости от выбранного агониста. В одном из воплощений капсаицин является антагонистом рецептора VR1. В одном из воплощений капсаицин добавляют в ванну в виде микроэмульсии (например, как это описано выше), или микроэмульсию капсаицина можно образовать в самой ванне (например, доставляя капсаицин в подходящей растворяющей системе, добавляя эмульгирующее средство и затем смешивая с водой). В другом аспекте изобретение обеспечивает способы и устройства для введения агониста TRPV1 через предмет белья или одежды. Предметами одежды могут быть, например, перчатки, носки или напальчники для рук и ног, сконструированные для того, чтобы их носить на конечностях субъектов, пораженных невропатией. Желательно, чтобы предметы одежды были сделаны из плотно облегающего и растягивающегося материала, который допускает покрытие микроэмульсией или импрегнирование ею. Материал может быть сделан из любого числа натуральных или синтетических волокон. Толщина и эластичность предметов одежды отличаются в зависимости от типа применяемой микроэмульсии и желаемого вида одежды. Одежда может быть любой длины, а так же может быть одноразовой или многократного использования. В некоторых воплощениях предметы одежды могут быть многослойными. Слои могут включать наружный слой, который не пропускает влагу и испарения. 16. Примеры. Пример 1. Определение содержания агониста TRPV1 с использованием способа анализа абсорбции кожей мыши и демонстрации быстрой и эффективной доставки агониста TRPV1 в кожу млекопитающих. Этот пример показывает доставку агониста TRPV1 с использованием различных композиций и описывает «способ анализа абсорбции кожей мыши». Анализ абсорбции кожей мыши является анализом in vitro, направленным на измерение доставки и удерживания агониста TRPV1. Анализ обычно проводят, как описано в работе Kemppainen и Reifeinrath, 1990, in Methods For Skin Absorption, CRC Publication (в дальнейшем просто Kemppainen), со следующими модификациями: ткань, которую не использовали в день забоя животного и до дня эксперимента хранили при температуре ниже -70°С, а не при температуре ниже -60°С; также использовали 3Н2О со специфической активностью ~0,5 мкКи/мл (а не ~0,3 мкКи/мл), и раствор рецептора собирали и анализировали через 30 мин, а не через 20 мин, как описано у Kemppainen. Подготовка кожи. В этом исследовании использовалась кожа с туловища мыши (Nu/Nu) без очевидных признаков кожных заболеваний, полученная не позднее 2 ч после смерти. После получения кожу очищали от подкожных тканей, запечатывали в водонепроницаемый пластиковый пакет и, если не использовали в день поступления, то хранили при температуре ниже -70°С до дня эксперимента. Перед использованием ее размораживали, помещая пакет в воду с температурой ~37°С, затем промывали водопроводной водой, чтобы удалить приставшую кровь или любой другой материал с поверхности. Кожу от одного донора сначала очищали вручную от всех подкожных тканей и почти от 50% дермы с помощью скальпеля, а затем разрезали на более мелкие части достаточной величины, чтобы поместить их на диффузионные ячейки Франца размером 0,8 см2 (Crown Glass Co., Somerville, NJ). Камеру для дермы (рецепторная сторона) полностью заполняли рецепторным изотопическим солевым раствором, забуференным фосфатом (PBS), рН 7,4±0,1, а эпидермальную камеру (донорная сторона) оставляли открытой для окружающей среды лаборатории. Затем ячейки помещали в диффузионный аппарат, в котором дермальный рецепторный раствор перемешивали с помощью магнитной мешалки при ~600 об/мин и который установлен таким образом, чтобы достичь температуры кожи 33,0±1,0°С. Измеряли и записывали значения температуры кожи в репрезентативных камерах. Чтобы убедиться в целостности каждого среза кожи, перед введением тестируемого продукта определяли проницаемость кожи для воды, меченной тритием (Frantz et al., 1990, «The use of water permeability as a means validation for skin integrity in vitro percutaneous absorption studies» Abst. J. Invest. Dermatol., 94:525). После краткого (от 0,5 до 1 ч) периода уравновешивания на поверхность кожи с помощью пипетки наносили 3Н2О (NEN, Boston, MA, удельн.акт. ~0,5 мкКи/мл) таким образом, чтобы была покрыта вся поверхность (приблизительно 100-150 мкл). Спустя 5 мин водный слой 3Н2О удаляли. Через 30 мин рецепторный раствор собирали и анализировали на содержание радиоактивности при помощи жидкостного сцинтилляционного счетчика, и целостность кожи подтверждали с помощью способа, основанного на количественном определении проникновения. Типичные образцы кожи, в которых абсорбция 3Н2О не превышала 1,75 мкл эквивалентов, считали приемлемыми. Прежде чем наносить применяемые местно тестируемые составы на срезы кожи перед дозированием рецепторный раствор заменяли на свежий 1:10 PBS-раствор. Перед внесением препарата полуячейку дозировочной камеры удаляли, чтобы обеспечить свободный доступ к поверхности кожи. Затем все со- 28 - 012599 ставы наносили на поверхность кожных срезов, используя калиброванные пипетки с дожимом, в намеченном объеме дозы 10 мкл/0,8 см2. Составы размазывали по поверхности кожи, используя тефлоновый наконечник пипетки. Спустя одну-пять минут после нанесения составов донорную полуячейку камеры Франца возвращали на место, чтобы запечатать и закрепить кожу в камере. Спустя заранее выбранное время после внесения средства (15 мин) рецепторный раствор полностью удаляли, и 4 мл объема лиофилизировали (Savant Speed Vac) и хранили для последующего анализа. Поверхность каждого среза кожи дважды промывали 0,5 мл метанола для того, чтобы удалить возможные остатки агониста TRPV1. Срезы кожи удаляли с зажатого в камере рифленого по окружности края О-образного кольцевого желобка при помощи скальпеля, и эпидермис аккуратно отделяли от дермы пинцетом с заостренными концами. Затем срезы кожи разделяли на эпидермис и дерму. Каждый из разделенных слоев, эпидермис и дерму смешивали с 1 мл метанола и оставляли экстрагироваться на 24 ч при комнатной температуре на горизонтальном шейкере. Измерение количества капсаицина проводили при помощи метода жидкостной хроматографии высокого разрешения и масс-спектроскопии (ВЭЖК-МС). Вкратце, ВЭЖК-МС проводили на системе Hewlett-Packard 1100 Series HPLC с 1100 Series API-ES LC/MSD в режиме положительного иона. Систему растворителей, включающую 70%-ный ацетонитрил + 0,1% TEA, 30% воды + 0,1% муравьиной кислоты, пропускали через колонку С18 Luna (4,6×100 мм, 3 мкм, Phenominex Inc.) со скоростью 0,5 мл/мин (продолжительность прогона составляла 6,5 мин). Вводили двадцать микролитров образца. Площади пиков оценивали количественно в расчете на концентрацию, используя внешнюю стандартную кривую, полученную при использовании чистого синтетического стандарта капсаицина, и количественно оценивали с помощью методов внешнего стандарта. Результаты приведены в табл. 4 и 5. Пример 2. Снижение функциональности нервных волокон в коже «голых» мышей. Этот пример демонстрирует снижение функциональности нервных волокон (NFF), показанное с помощью иммуноокрашивания PGP 9.5, проведенного после нанесения капсаицина на кожу мыши. Эксперименты проводили на 8-12 недельных мышах, лишенных волосяного покрова (Nu/Nu) (Charles River). Мышей акклиматизировали и произвольно разделили или на 2 группы (для эксперимента 1) по 12 мышей в каждой группе (6 мышей мужского пола и 6 мышей женского пола), или на 4 группы (для эксперимента 2) по 20 мышей в каждой группе (10 мышей мужского пола и 6 мышей женского пола). В нулевой день эксперимента 1 на площадь в 1 см × 1 см спины анестезированных мышей из одной группы наносили 15 мкл 10% (мас./об.) капсаицина в 100%-ном моноэтиловом эфире диэтиленгликоля (DGME) и 0,1% (мас./об.) этилцеллюлозе (т.е. композицию № 23, включающую 0,1%-ную этилцеллюлозу), в то время как контрольная группа получала DGME, диспергированный в адгезивном матриксе. В нулевой день эксперимента 2 на площадь в 1 см × 1 см спины анестезированных мышей из трех групп наносили 15 мкл или 15% (мас./об.) капсаицина в 15%-ной олеиновой кислоте, 10%-ном изопропилмиристате, 10%-ном цетиловом спирте, 55%-ном DGME, и 10%-ном метаноле, и 0,1%-ной этилцеллюлозе (т.е. композицию № 42, включающую 0,1%-ную этилцеллюлозу); или 15% (мас./об.) капсаицина в 20%-ном олеиловом спирте и 80%-ном пропиленгликоле, также включающем 0,1%-ную этилцеллюлозу (т.е. композицию № 28, включающую 0,1%-ную этилцеллюлозу); или 15% (мас./об.) капсаицина в 90%-ном 1ментоне и 10%-ном метаноле плюс 0,1%-ная этилцеллюлоза (т.е. композицию № 27, включающую 0,1%ную этилцеллюлозу), в то время как контрольная группа не подвергалась никакой обработке. В обоих экспериментах мыши находились под общей анестезией в течение 30-минутного периода обработки до тех пор, пока тестируемые вещества не были удалены. После удаления тестируемых веществ кожу очищали с помощью очищающего геля (89,08% ПЭГ 300, 1,0% Carbopol 1382™, 0,02% бутилированного гидроксианизола, 0,01% динатриевой соли ЭДТА, рН 6,5). На 7-й день мышей забивали и снимали ткани, на которые было нанесено вещество, а затем разделяли их на два эквивалентных среза. Один срез кожи помещали на кусок картона, фиксировали в 10%-ном нейтральном забуференном формалине и обрабатывали для получения окрашенного гематоксилин-эозином препарата для оценки наличия воспаления и других патологий. Другой срез кожи приготовляли в виде замороженного блока для последующего иммуногистохимического анализа с применением антитела к PGP 9.5. Эту ткань окрашивали антителом к PGP 9.5, которое распознает находящиеся в коже нервные волокна. Обработанные ткани оценивались дипломированным ветеринаром-патологом на предмет (1) любых повреждений, особое внимание было уделено воспалению и любым изменениям в капиллярах, и (2) присутствию, отсутствию и любым отклонениям от нормы в строении сенсорных нервных волокон кожи. Для каждого образца определяли плотность нервных волокон путем подсчета количества нормально выглядящих нервных волокон, наблюдаемых по меньшей мере в четырех микроскопических полях (каждое круглое микроскопическое поле имело радиус 90 мкм), затем полученные значения усредняли. Если морфология нервных волокон в поле была изменена, т.е. там наблюдали опухание, волдыри или варикоз, а большая часть нервных волокон имела морфологические изменения, в этом случае считали, что в поле зрения не было нормальных нервных волокон. Полученные данные представляют собой уменьшение среднего количества нервных волокон, рассчитанного на микроскопическое поле, на животное, по сравнению с соответствующими контро- 29 - 012599 лями. Чтобы определить, повлияло ли каким-либо образом лечение на плотность нервных волокон, сравнивали значения плотности нервных волокон, усредненные между группами. Результаты исследований в этом примере показывают, что в эксперименте 1 10% (мас./об.) капсаицин в 100%-ном DGME и 0,1% (мас./об.) этилцеллюлозе (композиция № 23) вызывали уменьшение плотности нервных волокон примерно на 49% по сравнению с DGME, диспергированным в адгезивном матриксе. Такое уменьшение было статистически значимым (р≤0,01). В эксперименте 2 15% (мас./об.) капсаицин в 15%-ной олеиновой кислоте, 10%-ном изопропилмиристате, 10%-ном цетиловом спирте, 55%-ном DGME, и 10%-ном метаноле, и 0,1%-ной этилцеллюлозе (композиция № 42) вызывали уменьшение плотности нервных волокон примерно на 39%; 15% (мас./об.) капсаицин в 20%-ном олеиловом спирте, 80%-ном пропиленгликоле и 0,1%-ной этилцеллюлозе (композиция № 28) вызывали уменьшение плотности нервных волокон примерно на 70%; тогда как 15% (мас./об.) капсаицин в 90%-ном 1-ментоне, 10%-ном метаноле и 0,1%-ной этилцеллюлозе (композиция № 27) вызывали уменьшение плотности нервных волокон примерно на 75% по сравнению с контрольной необработанной группой. Все уменьшения плотности нервных волокон, наблюдавшиеся в этом эксперименте, были статистически значимыми (р≤0,01). Пример 3. Снижение функциональности нервных волокон в вульве крысы. Этот пример показывает эффект местного нанесения композиции агониста TRPV1 на вульву крысы. Шестьдесят крыс женского пола линии Sprague-Dawley были разделены на 6 групп. В нулевой день крыс анестезировали с помощью изофлуранового анестезирующего газа, и затем анестезирующий крем LMX5® наносили на всю вульварную поверхность каждой крысы по меньшей мере на 30 мин. Тестируемые композиции наносили при помощи микропипетки, дозирующей по 33 мкл каждой композиции. Были нанесены следующие композиции: только моноэтиловый эфир диэтиленгликоля (DGME); 0,01% (мас./об.) капсаицин в DGME; 0,1% (мас./об.) капсаицин в DGME; 1% (мас./об.) резинифератоксин в DGME; 3% (мас./об.) капсаицин в 90% (об./об.) DGME и 10% (об./об.) DMSO, 10% (мас./об.) капсаицин в DGME. Композиции оставляли на 20 мин, за исключением 10% (мас./об.) капсаицина в DGME, который оставляли на 5 мин. Остатки композиции удаляли с помощью очищающего геля (89,08% ПЭГ 300, 1,0% Carbopol 1382™, 0,02% бутилированного гидроксианизола, 0,01% динатриевой соли ЭДТА, рН 6,5). Гель оставляли приблизительно на 3-5 мин, а затем удаляли с помощью салфеток Kim wipes и генитальных тампонов. На седьмой день крыс забивали и брали перфорационную биопсию вульвы размером в 1 мм, которую затем помещали в ледяной физиологический солевой раствор, забуференный фосфатом, для подготовки замороженного блока для иммуногистохимического анализа. Замороженные срезы, сделанные из этих тканей, окрашивали антителами к PGP 9.5, которые окрашивают терминальные сенсорные нервные волокна. Ткани оценивались дипломированным ветеринаром-патологом на предмет (1) любых повреждений, особое внимание было уделено воспалению и изменениям в капиллярах; и (2) присутствия, отсутствия и любых отклонений от нормы в строении терминальных сенсорных нервных волокнах. Для каждого образца определяли плотность нервных волокон путем подсчета количества нервных волокон, наблюдаемых по меньшей мере в четырех микроскопических полях (каждое круглое микроскопическое поле имело радиус 90 мкм), затем полученные значения усредняли. Если морфология нервных волокон в поле была изменена, т.е. там наблюдали опухание, волдыри или варикозы, а большая часть нервных волокон имела морфологические изменения, в этом случае считали, что в поле зрения не было нормальных нервных волокон. Полученные данные представляют собой среднее количество нервных волокон, рассчитанное на микроскопическое поле и на животное. Чтобы определить, повлияло ли каким-либо образом лечение на плотность нервных волокон, сравнивали значения, полученные в группах. Результаты данного исследования приведены на рис. 2. Эти результаты показывают, что три композиции, включающие капсаицин в концентрации, превышающей 0,01% (мас./об.) и выше, вызывали статистически значимое (р<0,1) уменьшение плотности нервных волокон, как было показано с помощью иммуноокрашивания PGP 9.5, проведенного через 5 и 20 мин после нанесения. В этом эксперименте 1%ная (мас./об.) жидкая композиция другого агониста TRPV1 - резинифератоксина (RTX) при нанесении на 20 мин уменьшала плотность нервных волокон на 28%; тем не менее требуются дополнительные эксперименты, чтобы убедиться в статистической значимости наблюдаемого снижения. Пример 4. Болевые реакции после обработки вульвы. Этот пример показывает количество ноцифензивных поведенческих реакций, вызванных нанесением на вульву крыс линии Sprague-Dawley 10%-ного (мас./об.) капсаицина в моноэтиловом эфире диэтиленгликоля, 3% (мас./об.) капсаицина в моноэтиловом эфире диэтиленгликоля, просто моноэтилового эфира диэтиленгликоля и имеющегося в продаже крема Zostrix®, в состав которого входит 0,075% (мас./об.) капсаицин. - 30 - 012599 Группы обработки За крысами наблюдали в течение 5 мин, изучая базовые болевые реакции. Затем наносили тестируемое вещество. Спустя указанное время нанесения, оставшийся капсаицин удаляли с вульвы с помощью очищающего геля (89,08% ПЭГ 300, 1,0% Carbopol 1382™, 0,02% бутилированного гидроксианизола, 0,01% динатриевой соли ЭДТА, рН 6,5). После нанесения тестируемого вещества в течение 60 мин наблюдали болевые реакции. Следующее поведение было принято, как проявление болевых ощущений: вылизывание или чистка поверхности вульвы, рассматривание вульвы, обнюхивание вульвы, лижущие или жевательные движения ртом, вставание на задние лапы и поднимание хвоста, бегание по клетке, ползание по дну клетки, привставание и указывание носом на брюшко, чрезмерная и яростная чистка тела, вытягивание задних лап, поднимание хвоста, копание на дне клетки и принятие напряженной позы. На рис. 3 представлены результаты эксперимента. Жидкие композиции, включающие капсаицин (3 и 10% мас./об.) и продаваемый без рецепта крем (Zostrix®), содержащий капсаицин (0,075%), вызывали более сильную болевую реакцию по сравнению с нанесением только одного моноэтилового эфира диэтиленгликоля на вульву крысы на 5 или 20 мин. Тем не менее не наблюдалось статистически значимой разницы в болевых ответах после нанесения жидкой композиции, включавшей 3 мас./об.% капсаицин, и крема Zostrix®. Удивительно, но жидкая композиция, включающая 10 мас./об.% капсаицин давала статистически значимое (р≤0,1) уменьшение болевых реакций по сравнению с использованием крема Zostrix®, содержащего 0,075% капсаицина. Пример 5. Болевые реакции после обработки кожи. Этот пример показывает количество ноцифензивных поведенческих реакций у крыс, вызванных единственным местным нанесением капсаицина (10 мас./об.%) в моноэтиловом эфире диэтиленгликоля (Transcutol™) по сравнению с нанесением коммерческого концентрированного капсаицинового крема (0,1 мас./мас.%; капсаициновый крем Capzasin-HP®) или просто моноэтилового эфира диэтиленгликоля. Материалы и методы. Взрослых крыс мужского пола (250-300 г, N=19) линии Sprague-Dawley помещали в камеру и анестезировали 2-3%-ным галотаном в воздухе. После того как каждая из крыс демонстрировала достаточно глубокую анестезию, что можно было понять по отсутствию реакции на щипание хвоста, крысу вынимали из камеры и на морду крысы одевали маску, снабжающую ее 1-2%-ным галотаном. Крысу помещали на левый бок на подогреваемое одеяло таким образом, чтобы обе задние конечности были вытянуты. Дорсальная часть каждой задней лапы была очищена от мусора и протерта смоченной в изопропиловом спирте абразивной салфеткой. На дорсальную часть каждой лапы было нанесено химическое вещество для удаления волос. Спустя десять минут эпилирующий агент удалили марлей, а затем верхнюю часть каждой задней лапы протирали смоченной в изопропиловом спирте салфеткой. Дорсальную часть обеих задних лап осматривали, чтобы убедиться в отсутствии видимых волос. Подачу галотана прекращали и крысам давали возможность прийти в себя в своих клетках. Как только крысы начинали нормально передвигаться, их помещали на приподнятую пластиковую сетку и закрывали пластиковым контейнером. Крысам давали привыкнуть к сетке по меньшей мере в течение 30 мин. Затем записывали, сколько раз за 5-минутный период крыса дергала правой задней лапой. Дергание лапой фиксировали только в том случае, если крыса отчетливо поднимала правую заднюю лапу и трясла ей в момент, когда не происходило никакого передвижения. После оценки базовой линии каждую крысу извлекали из сетки и осторожно обертывали тканевым полотенцем. Дорсальную часть правой задней лапы протерли смоченной в изопропиловом спирте салфеткой. Сразу после того как спирт испарился, на дорсальную часть правой задней лапы нанесли одну из следующих композиций: i) Capzasin-НР® 0,1%-ный капсаициновый крем (~0,15 г); ii) 50 мкл DGME, содержавшего 10% (мас./об.) капсаицин; iii) 50 мкл DGME. Для нанесения капсаицинового крема использовался аппликатор с ватным концом, крем втирали в дорсальную часть задней лапы в течение 10 с. На дорсальную часть задней лапы при помощи пипетки наносили жидкую композицию, включающую капсаицин, и DGME, после чего крысу удерживали неподвижной в течение 10 с. После каждой обработки крыс снова помещали на сетку и закрывали пластиковым контейнером. В течение 90 мин записывали, сколько раз каждая крыса дергала правой задней лапой за следующие друг за другом 5-минутные промежутки времени. Статистический анализ. Число раз, когда крысы дергали правой задней лапой, представлены в виде среднего значения (± стандартная ошибка среднего) для каждой обработанной группы. Чтобы определить, есть ли значимая - 31 - 012599 разница между обработанными группами в количестве дерганий задней лапой в течение 5-минутного периода и за весь период в 90 мин был использован односторонний критерий Стьюдента. Для каждого анализа вероятность (величина Р), которая меньше или равна 0,05, была признана значимой. Результаты. В течение исходного 5-минутного периода (базовая линия) крысы не дергали правой задней лапой. Как показано на рис. 1, нанесение капсаицинового (0,1%) крема привело к 59,4±23,7 подергиваниям за весь 90-минутный период наблюдения. Нанесение жидкой композиции с капсаицином (10% (мас./об.) капсаицин в DGME) привело к значительно меньшему количеству подергиваний задней лапой (10,2±2,4 подергиваний, Р≤0,05). В отличие от этого, нанесение одного лишь DGME практически не вызывало появление ноцифензивных поведенческих реакций (0,7±0,7 подергиваний) за 90-минутный период, которые представляли собой значительно реже происходящие подергивания задними лапами по сравнению с тем, что происходит при нанесении 10%-ного капсаицина в DGME (Р≤0,01). Обсуждение результатов. Результаты, приведенные в этом примере, предполагают, что местное нанесение жидкой композиции, включающей 10%-ный капсаицин, приводит к меньшим ноцифензивным поведенческим реакциям (т.е. дерганиям лапой) за 90-минутный период, чем в случае местного нанесения имеющегося в продаже, отпускаемого без рецепта крема с низкой концентрацией капсаицина (0,1%). Нанесение жидкой композиции с капсаицином привело к большему числу подергиваний задней лапой по сравнению с нанесением только моноэтилового эфира диэтиленгликоля. Пример 6. Приготовление микроэмульсии, включающей 0,1% (мас./об.) капсаицин. Для приготовления микроэмульсии сначала готовят первую композицию, включающую капсаицин и моноэтиловый эфир диэтиленгликоля. Первую композицию готовят с помощью растворения 10 г капсаицина в 100 мл моноэтилового эфира диэтиленгликоля (DGME), чтобы сформировать дисперсную фазу. Микроэмульсию готовят, добавляя первую композицию к 1 л (один литр) минерального масла, затем добавляют 10-30% (мас./мас.) глицеридов каприлокапроилмакрогола-8 (эмульгатор) и перемешивают до полного растворения глицеридов каприлокапроилмакрогола-8, в результате получают вторую композицию («масляную фазу»). Перед использованием или введением 100 мл масляной фазы добавляют к 1 л воды или физиологического солевого раствора (непрерывная фаза), после чего тщательно перемешивают до тех пор, пока не будет получена устойчивая микроэмульсия. Полученная микроэмульсия содержит 0,1% (мас./об.) капсаицин. Пример 7. Получение микроэмульсии масло-в-воде. Следующий пример показывает состав микроэмульсии масло-в-воде. Все наполнители взвешивали в сосуде и нагревали на водяной бане при температуре 60°С до получения однородного раствора. Затем раствор охлаждали до комнатной температуры. Была получена мутная дисперсия эмульсии масло-в-воде. Чтобы добавить в композицию лекарственное средство, взвешивали капсаицин вместе с остальными компонентами, нагревали на водяной бане и оставляли охлаждаться с образованием эмульсии масло-в-воде. Пример 8. Получение липосомной микроэмульсии. Этот пример показывает состав липосомной микроэмульсии. Все ингредиенты взвешивали прямо во флаконе и нагревали на водяной бане при температуре 70°С до растворения липидов. Чтобы включить в смесь капсаицин, лекарственное средство взвешивали вместе с основными составляющими композиции и нагревали на водяной бане до получения однородного однофазного раствора. Затем раствор гомонегизировали до тех пор, пока он не остывал до комнатной температуры естественным образом. Был получен однородный белый крем. Образование липосом было проверено под микроскопом. Разведение липосомной композиции 1:10 и 1:100 в деионизированной воде не изменило физических характеристик липосом, как было обнаружено с помощью микроскопа. Пример 9. Получение композиции с сорастворителем. - 32 - 012599 Этот пример показывает состав композиции с сорастворителем. Предконцентрат сорастворителя в основном состоит из поверхностно-активного вещества (Poloxamer), растворенного в спирте. Данный пример растворяющих систем был разработан таким образом, чтобы концентрация капсаицина составляла 10%. Разбавление композиции в водной среде приводило к получению прозрачного раствора. Чтобы включить лекарственное средство в композицию, необходимое количество капсаицина взвешивали во флаконе, а затем добавляли этанол, чтобы растворить лекарственное средство. Затем добавляли Poloxamer 407, который растворяли, и прямо во флаконе взвешивали остальные ингредиенты. Композицию перемешивали на вортексе до образования прозрачной жидкости. Предконцентрат сорастворителя Несмотря на то что настоящее изобретение было детально описано с помощью иллюстраций и примеров, чтобы сделать материал более ясным и понятным, специалистам в этой области техники будет очевидно, что некоторые изменения и модификации могут быть осуществлены без отступления от духа и объема изобретения. Все публикации, патенты и патентные заявки, процитированные здесь, включены в заявку путем отсылки во всей полноте для всех целей, как если бы для каждой такой публикации, патента или патентной заявки было конкретно и в индивидуальном порядке указано, что они включены в описание путем отсылки. Таблица 1 - 33 - 012599 Таблица 2 Таблица 3 Таблица 4 - 34 - 012599 Таблица 5 - 35 - 012599 Таблица 6 Примеры растворяющих систем (v/v) - 36 - 012599 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ доставки агониста TRPV1 в эпидермис и дерму млекопитающего, включающий контактирование поверхности кожи или слизистой оболочки с композицией, включающей агонист TRPV1 и по меньшей мере первый и второй усилитель проницаемости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт. 2. Способ по п.1, в котором агонист TRPV1 представляет собой капсаицин. 3. Способ по п.1, в котором контактируемая поверхность является кожей. 4. Способ по п.3, в котором млекопитающее является человеком. 5. Способ по п.4, в котором человек страдает от капсаицин-чувствительного состояния. 6. Способ по п.1, в котором плотность функциональных ноцицептивных нервных волокон в эпидермисе и дерме уменьшается по меньшей мере приблизительно на 20% при измерении после 2-7 дней после указанной стадии контактирования. 7. Способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном участке тела субъекта, включающий контактирование участка с композицией с немедленным высвобождением, которая включает агонист TRPV1 и по меньшей мере первый и второй усилитель проницаемости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт. 8. Способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном участке тела субъекта, включающий контактирование участка с композицией, которая включает агонист TRPV1 и растворяющую систему, включающую по меньшей мере первый и второй усилитель проницае- 37 - 012599 мости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт. 9. Способ по п.7, в котором выбранный участок представляет собой поверхность кожи или слизистой оболочки. 10. Способ по п.7, в котором эффект накопления в результате указанного контактирования составляет менее чем приблизительно 0,25 при измерении с помощью способа анализа абсорбции кожей мыши. 11. Способ по п.10, в котором эффект накопления составляет менее чем приблизительно 0,1. 12. Способ по п.11, в котором эффект накопления составляет менее чем приблизительно 0,02. 13. Способ по п.12, в котором эффект накопления составляет менее чем приблизительно 0,001. 14. Способ по п.7, в котором эффект накопления находится в диапазоне приблизительно от 0,001 до 0,25. 15. Способ по п.7, в котором эффект распределения в результате указанного контактрования находится в диапазоне от 0,5 до 2 при измерении с помощью способа анализа абсорбции кожей мыши. 16. Способ по п.7, в котором композиция включает агонист TRPV1 и растворяющую систему, где усилитель (усилители) проницаемости составляют по меньшей мере 20% (об./об.) от растворяющей системы. 17. Способ по п.16, в котором усилитель (усилители) проницаемости составляют по меньшей мере 50% (об./об.) от растворяющей системы. 18. Способ по п.17, в котором усилитель (усилители) проницаемости составляют по меньшей мере 90% (об./об.) от растворяющей системы. 19. Способ по п.18, в котором усилитель (усилители) проницаемости составляют по меньшей мере 95% (об./об.) от растворяющей системы. 20. Способ по п.8, в котором растворяющая система дополнительно включает один или более усилителей проницаемости, выбранных из группы, состоящей из 1-ментона, диметилизосорбида, каприлового спирта, лаурилового спирта, олеилового спирта, этиленгликоля, диэтиленгликоля, триэтиленгликоля, бутиленгликоля, валериановой кислоты, пеларгоновой кислоты, капроновой кислоты, каприловой кислоты, лауриновой кислоты, олеиновой кислоты, изовалериановой кислоты, изопропилбутирата, изопропилгексаноата, бутилацетата, метилацетата, метилвалерата, этилолеата, полоксамера, d-пиперитона, метилноненовой кислоты, метилноненилового спирта и d-пулегона. 21. Способ по п.7, в котором указанная композиция включает указанный агонист TRPV1 в концентрации от 0,05% (мас./об.) до 60% (мас./об.). 22. Способ по п.21, в котором агонист TRPV1 является ваниллоидом. 23. Способ по п.22, в котором агонист TRPV1 является капсаицином. 24. Способ по п.21, в котором указанная композиция включает указанный агонист TRPV1 в концентрации от 1% (мас./об.) до 20% (мас./об.). 25. Способ по п.7, в котором субъект является человеком. 26. Способ по п.7, в котором указанное контактирование представляет собой местное нанесение или закапывание. 27. Способ по п.7, в котором 15-минутное нанесение композиции на кожу млекопитающего приводит к уменьшению плотности функциональных ноцицептивных нервных волокон по меньшей мере приблизительно на 50%, где млекопитающее выбирают из группы, состоящей из мыши или человека. 28. Способ по п.7, в котором субъект является человеком. 29. Способ по п.28, в котором субъект страдает от капсаицин-чувствительного состояния. 30. Способ по п.29, в котором капсаицин-чувствительное состояние представляет собой невропатическую боль, боль, вызываемую смешанными ноцицептивными и невропатическими этиологиями, воспалительную гиперальгезию, вульводинию, интерстициальный цистит, гиперактивный мочевой пузырь, гиперплазию простаты, ринит, гиперчувствительность прямой кишки, синдром обожженного рта, оральный мукозит, герпес, гипертрофию простаты, дерматит, прурит, зуд, шум в ушах, псориаз, бородавки, рак кожи, головные боли или морщины. 31. Способ лечения капсаицин-чувствительного состояния у субъекта, включающий неокклюзивное или неадгезивное введение композиции, которая включает агонист TRPV1 и по меньшей мере первый и второй усилитель проницаемости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт. 32. Способ по п.31, в котором композицию наносят на участок поверхности кожи, слизистой оболочки или эндотелия. 33. Способ по п.31, в котором эффект накопления в результате указанного контактирования составляет менее чем приблизительно 0,25 при измерении с помощью способа анализа абсорбции кожей мыши. 34. Способ по п.33, в котором эффект накопления составляет менее чем приблизительно 0,1. 35. Способ по п.34, в котором эффект накопления составляет менее чем приблизительно 0,02. 36. Способ по п.35, в котором эффект накопления составляет менее чем приблизительно 0,001. - 38 - 012599 37. Способ по п.33, в котором эффект накопления находится в диапазоне приблизительно от 0,001 до 0,25. 38. Способ по п.31, в котором эффект распределения в результате указанного контактирования находится в диапазоне от 0,5 до 2 при измерении с помощью способа анализа абсорбции кожей мыши. 39. Способ по п.31, в котором композиция включает агонист TRPV1 и растворяющую систему, где усилитель (усилители) проницаемости составляют по меньшей мере 20% (об./об.) от растворяющей системы. 40. Способ по п.39, в котором усилитель (усилители) проницаемости составляют по меньшей мере 50% (об./об.) от растворяющей системы. 41. Способ по п.40, в котором усилитель (усилители) проницаемости составляют по меньшей мере 90% (об./об.) от растворяющей системы. 42. Способ по п.41, в котором усилитель (усилители) проницаемости составляют по меньшей мере 95% (об./об.) от растворяющей системы. 43. Способ по п.31, в котором композиция дополнительно включает один или более усилителей проницаемости, выбранных из группы, состоящей из 1-ментона, диметилизосорбида, каприлового спирта, лаурилового спирта, олеилового спирта, этиленгликоля, диэтиленгликоля, триэтиленгликоля, бутиленгликоля, валериановой кислоты, пеларгоновой кислоты, капроновой кислоты, каприловой кислоты, лауриновой кислоты, олеиновой кислоты, изовалериановой кислоты, изопропилбутирата, изопропилгексаноата, бутилацетата, метилацетата, метилвалерата, этилолеата, полоксамера, d-пиперитона, метилноненовой кислоты, метилноненилового спирта и d-пулегона. 44. Способ по п.31, в котором указанная композиция включает указанный агонист TRPV1 в концентрации от 0,05% (мас./об.) до 60% (мас./об.). 45. Способ по п.44, в котором агонист TRPV1 является ваниллоидом. 46. Способ по п.45, в котором агонист TRPV1 является капсаицином. 47. Способ по п.46, в котором указанная композиция включает указанный агонист TRPV1 в концентрации от 1% (мас./об.) до 20% (мас./об.). 48. Способ по п.47, в котором 15-минутное нанесение композиции на кожу млекопитающего приводит к уменьшению плотности функциональных ноцицептивных нервных волокон по меньшей мере приблизительно на 20% при измерении после 2-7 дней после указанной стадии контактирования. 49. Способ по п.48, в котором 15-минутное нанесение композиции на кожу млекопитающего приводит к уменьшению плотности функциональных ноцицептивных нервных волокон по меньшей мере приблизительно на 50% при измерении через 7 дней после указанной стадии контактирования. 50. Способ по п.7, в котором плотность функциональных ноцицептивных нервных волокон в эпидермисе и дерме, расположенных под указанным участком, уменьшается по меньшей мере на около 20% при измерении через 7 дней после указанной стадии контактирования. 51. Способ по п.31, в котором композицию вводят местно. 52. Способ по п.51, в котором композицию вводят с помощью закапывания. 53. Способ по п.31, в котором композицию вводят с помощью инъекции. 54. Способ по п.31, в котором композицию вводят в форме микроэмульсии. 55. Способ по п.31, в котором капсаицин-чувствительное состояние представляет собой невропатическую боль, боль, вызываемую смешанными ноцицептивными и невропатическими этиологиями, воспалительную гиперальгезию, вульводинию, интерстициальный цистит, гиперактивный мочевой пузырь, гиперплазию простаты, ринит, гиперчувствительность прямой кишки, синдром обожженного рта, оральный мукозит, герпес, гипертрофию простаты, дерматит, прурит, зуд, шум в ушах, псориаз, бородавки, рак кожи, головные боли или морщины. 56. Способ по п.55, в котором невропатическая боль ассоциирована с диабетической невропатией, постгерпесной невралгией, ВИЧ/СПИД, травматическим повреждением, сложным региональным болевым синдромом, невралгией тройничного нерва, эритромелалгией и фантомной болью. 57. Способ по п.56, в котором одно или два применения композиции обеспечивают стойкое облегчение. 58. Способ по п.57, в котором одно применение композиции обеспечивает стойкое облегчение. 59. Фармацевтическая композиция, включающая терапевтически эффективные количества агониста TRPV1 и по меньшей мере первый и второй усилитель проницаемости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт, и, при необходимости, один или несколько дополнительных терапевтически активных агентов, где указанная фармацевтическая композиция представляет собой форму, подходящую для введения субъекту. 60. Фармацевтическая композиция, включающая терапевтически эффективные количества агониста TRPV1 и по меньшей мере первый и второй усилитель проницаемости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт, и, при необходимости, один или несколько дополнительных терапевтически активных агентов, при условии, что если агонист - 39 - 012599 TRPV1 представляет собой капсаицин, концентрация капсаицина выше чем 0,05% и ниже чем 20%. 61. Композиция по п.59, которая включает агонист TRPV1 и, при необходимости, один или несколько дополнительных терапевтически активных агентов в растворяющей системе, включающей по меньшей мере первый и второй усилитель проницаемости, где первым усилителем проницаемости является пропиленгликоль или моноэтиловый эфир диэтиленгликоля, а вторым усилителем проницаемости является этилолеат, олеиновая кислота или олеиловый спирт, и где указанные усилители проницаемости, взятые вместе, составляют по меньшей мере около 50% (об./об.) от растворяющей системы. 62. Композиция по п.61, в которой указанные усилители проницаемости, взятые вместе, составляют по меньшей мере около 75% (об./об.) от растворяющей системы. 63. Композиция по п.62, в которой указанные усилители проницаемости, взятые вместе, составляют по меньшей мере около 95% (об./об.) от растворяющей системы. 64. Композиция по п.59, которая при измерении с помощью способа анализа абсорбции кожей мыши доставляет в кожу по меньшей мере около 3 нмоль агониста. 65. Композиция по п.59 с эффектом накопления менее чем 0,25. 66. Композиция по п.59, в которой агонист TRPV1 является капсаицином. 67. Композиция по п.66, включающая от 1 до 15% капсаицина. 68. Композиция по п.59, которая включает локальный анестетик. 69. Способ лечения капсаицин-чувствительного состояния у субъекта, включающий введение композиции по п.59. 70. Композиция по п.59, которая содержится в микроэмульсии. 71. Система для лечения капсаицин-чувствительного состояния, включающая композицию по п.59 и неокклюзивное и/или неадгезивное аппликаторное устройство для нанесения состава на поверхность кожи или слизистой оболочки. 72. Система по п.71, в которой аппликаторное устройство предварительно заполнено композицией. 73. Система по п.71, в которой композиция содержится в контейнере, отделенном от устройства. 74. Система по п.71, дополнительно содержащая калибровочные метки на аппликаторном устройстве для помощи пользователю при определении количества композиции в аппликаторном устройстве. 75. Система по п.71, в которой аппликаторное устройство представляет собой дозирующий аэрозоль, дозировочный насос с запасенной энергией или ручной дозировочный насос. 76. Система по п.71, в которой аппликаторное устройство представляет собой губку, щетку или тампон. 77. Микроэмульсия агониста TRPV1, включающая композицию по п.71. 78. Способ лечения пациента, страдающего от капсаицин-чувствительного состояния, которое поражает часть тела пациента, который включает погружение части тела в микроэмульсию по п.77. 79. Способ по п.78, в котором пораженный участок ткани погружают в микроэмульсию на заранее определенный период времени. 80. Способ предоставления терапевтической ванны, включающий добавление в ванну микроэмульсии агониста TRPV1 по п.77. 81. Устройство для приема терапевтической ванны, включающее ванну, способную вместить внутри себя пораженный участок ткани, где ванна имеет поверхность дна и конструкцию стенок, простирающуюся вверх от нее, и где ванна содержит жидкость, включающую микроэмульсию агониста TRPV1 по п.77. 82. Способ уменьшения плотности функциональных ноцицептивных нервных волокон в выбранном участке тела субъекта, включающий контактирование участка с микроэмульсией агониста TRPV1 по п.77. 83. Способ по п.82, в котором выбранный участок является эндотелием мочевого пузыря. 84. Способ лечения капсаицин-чувствительного состояния у субъекта, включающий введение микроэмульсии агониста TRPV1 по п.77. 85. Способ по п.7, в котором капсаицин-чувствительное состояние представляет собой гиперактивный мочевой пузырь, и микроэмульсию агониста TRPV1 закапывают в мочевой пузырь. - 40 - 012599 Фиг. 1 Фиг. 2 Фиг. 3 - 41 - 012599 Фиг. 4 Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2 - 42 -