ÎÑÒÅÎÃÅÍÍÀß ÑÀÐÊÎÌÀ - îäíà èç îñíîâíûõ ôîðì ïåðâè÷íûõ
advertisement
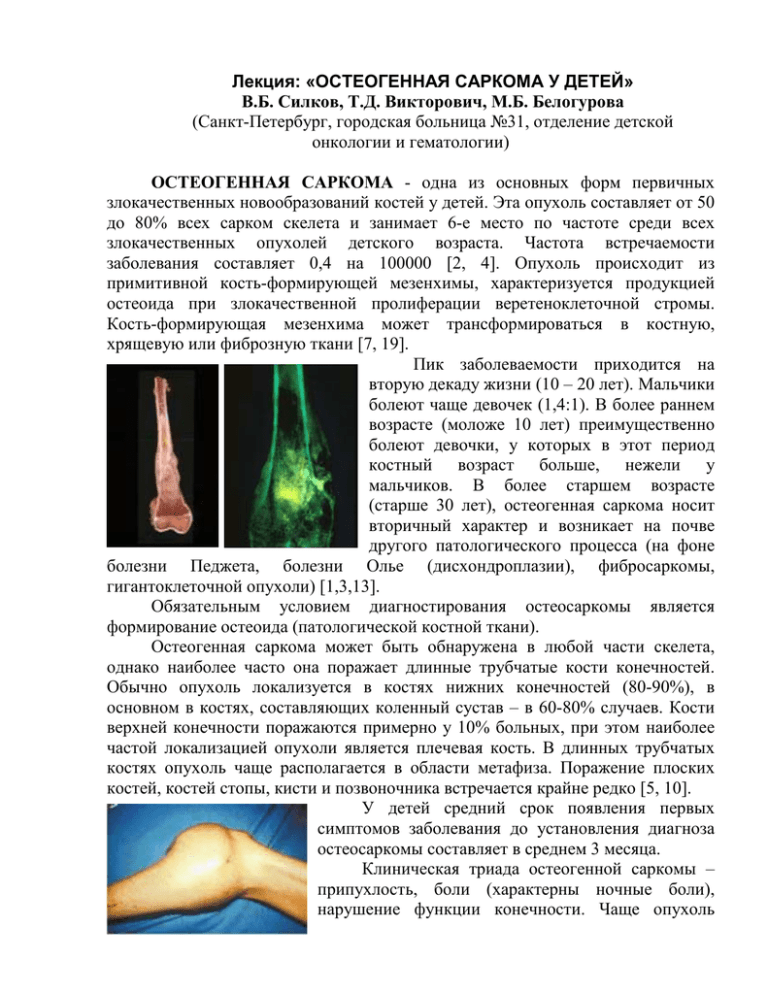
Лекция: «ОСТЕОГЕННАЯ САРКОМА У ДЕТЕЙ» В.Б. Силков, Т.Д. Викторович, М.Б. Белогурова (Санкт-Петербург, городская больница №31, отделение детской онкологии и гематологии) ОСТЕОГЕННАЯ САРКОМА - одна из основных форм первичных злокачественных новообразований костей у детей. Эта опухоль составляет от 50 до 80% всех сарком скелета и занимает 6-е место по частоте среди всех злокачественных опухолей детского возраста. Частота встречаемости заболевания составляет 0,4 на 100000 [2, 4]. Опухоль происходит из примитивной кость-формирующей мезенхимы, характеризуется продукцией остеоида при злокачественной пролиферации веретеноклеточной стромы. Кость-формирующая мезенхима может трансформироваться в костную, хрящевую или фиброзную ткани [7, 19]. Пик заболеваемости приходится на вторую декаду жизни (10 – 20 лет). Мальчики болеют чаще девочек (1,4:1). В более раннем возрасте (моложе 10 лет) преимущественно болеют девочки, у которых в этот период костный возраст больше, нежели у мальчиков. В более старшем возрасте (старше 30 лет), остеогенная саркома носит вторичный характер и возникает на почве другого патологического процесса (на фоне болезни Педжета, болезни Олье (дисхондроплазии), фибросаркомы, гигантоклеточной опухоли) [1,3,13]. Обязательным условием диагностирования остеосаркомы является формирование остеоида (патологической костной ткани). Остеогенная саркома может быть обнаружена в любой части скелета, однако наиболее часто она поражает длинные трубчатые кости конечностей. Обычно опухоль локализуется в костях нижних конечностей (80-90%), в основном в костях, составляющих коленный сустав – в 60-80% случаев. Кости верхней конечности поражаются примерно у 10% больных, при этом наиболее частой локализацией опухоли является плечевая кость. В длинных трубчатых костях опухоль чаще располагается в области метафиза. Поражение плоских костей, костей стопы, кисти и позвоночника встречается крайне редко [5, 10]. У детей средний срок появления первых симптомов заболевания до установления диагноза остеосаркомы составляет в среднем 3 месяца. Клиническая триада остеогенной саркомы – припухлость, боли (характерны ночные боли), нарушение функции конечности. Чаще опухоль проявляется увеличением объема конечности. При быстром росте опухоли возникает отечность мягких тканей и кожи, синюшность, что наиболее выражено в случаях поздней диагностики, когда опухоль сдавливает глубокие сосуды конечности. На 3-4 месяце от начала заболевания развивается болевая контрактура в ближайшем суставе; конечность из-за болей, как правило, не функциональна [6, 10]. Злокачественные опухоли костей, в отличие от злокачественных эпителиальных опухолей, метастазируют почти исключительно гематогенно, так как лимфатический дренаж костной ткани отсутствует. На ранних стадиях процесса гематогенное распространение опухоли проявляется метастатическим поражением легких, а затем вторичными метастазами в кости. Около 10-20% больных имеют клинически определяемые легочные метастазы в период установления диагноза. Опухоль может давать очаги сателлиты (skip-метастазы). Skip-MTS представляют собой опухолевые очаги, располагающиеся в пределах той же самой кости, но не имеющие непосредственной связи с первичной опухолью. Как правило, они выявляются в губчатом веществе кости проксимальнее основного очага, небольших размеров, с относительно четкими контурами. Частота обнаружения skip-MTS составляет менее 1% [9]. Остеогенная саркома может поражать прилегающий сустав. Прямое прорастание через суставную поверхность наблюдается редко. Распространение опухоли на прилегающий сустав чаще всего происходит вследствие прямого перикапсульного проникновения. Трансартикулярные «прыгающие» метастазы обнаруживаются в 1% случаев. Поражение лимфатических узлов встречается в 10% случаев и является плохим прогностическим признаком [21]. Повышение эффективности диагностики остеогенной саркомы относится к числу весьма сложных и актуальных задач современной клинической онкологии. Знание истинного распространения опухоли необходимо как для оценки эффективности проводимой химиотерапии, так и для выбора оптимального вида оперативного вмешательства в первичном очаге. Трудности диагностики предопределили внедрение в клиническую практику специальных визуализирующих методов диагностики (КТ, МРТ, ОСГ, ангиография). В диагностике остеогенной саркомы рентгенологический метод исследования позволяет обнаружить опухоль, выявить реакцию периоста, а также протяженность распространения не только в пределах кости, но и в мягких тканях. Проведение рентгенологического исследования в динамике позволяет судить об ответной реакции опухоли на проводимую предоперационную химиотерапию. Рентгенологические признаки опухоли обусловлены в основном вариантом остеогенной саркомы, локализацией и распространенностью процесса. Одним из наиболее патогномоничных рентгенологических признаков остеосаркомы принято считать наличие своеобразных остеофитов, возникающих на границе наружного дефекта компактного слоя кости и внекостного компонента опухоли, которые имеют вид характерного козырька, расположенного под углом к длинной оси кости («козырек» Кодмана). Другим симптомом, свидетельствующим о распространении опухолевого процесса за пределы кости, являются спикулы (очаги патологического костеобразования) – тонкие игольчатые участки обызвествления, располагающиеся перпендикулярно по отношению к оси кости. Распространение опухолевого процесса на окружающие мягкие ткани приводит к образованию внекостного компонента, в котором развиваются поля оссификации разных размеров и плотности. При оценке состояния внекостного компонента саркомы выявленные в нем участки опухолевого костеобразования являются практически патогномоничным симптомом остеогенной саркомы. Внекостный компонент остеосаркомы, по данным литературы, на рентгенограммах определяется в 80-90% случаев. Все злокачественные опухоли в той или иной степени вызывают воспалительную реакцию вокруг очага, поэтому изображение внекостного компонента на рентгенограммах превышает его реальные размеры. Выраженность мягкотканого компонента прямо пропорциональна длительности опухолевого процесса. Развитие компьютерной томографии (КТ) значительно расширило возможности определения границ распространения опухоли. Распространение мягкотканого компонента опухоли по данным КТ определяется более точно, чем на рентгенограммах за счет изменения коэффициента поглощения рентгеновских лучей опухолью. Возможности КТ ограничены лишь уточнением локализации, определением протяженности поражения кости и внекостного компонента опухоли. Магнитно-резонансная томография (МРТ) является более точным и специфичным исследованием, чем КТ. Информативность МРТ повышается благодаря отсутствию артефактов, которые имеют место при КТ-исследовании. МРТ дает хорошую дифференцировку мягких тканей, позволяя различать нормальную, гиперваскуляризированную и опухолевую ткани. Благодаря широкому спектру регистрируемых сигналов (в частности, разности сигналов от воспалительной ткани и ткани опухоли) МРТ позволяет с большей точностью установить истинный размер и границы опухоли максимально приближенные к реальным, оценить взаимоотношение опухоли с магистральным сосудисто-нервным пучком. Исследование с контрастированием гадалиниумсодержащим препаратом (омнискан – накапливается в опухоли и четко отграничивает ее границы) улучшает изображение краев опухоли и позволяет детально исследовать распространение опухоли в пределах костномозгового канала. Интрамедуллярное распространение опухоли обычно бывает более обширным, чем мягкотканное или кортикальное поражение. По данным МРТ можно оценить динамику опухолевого процесса после проведения предоперационной химиотерапии. В крупнейших онкологических центрах мира применяется усовершенствованный метод МРТ – DEMRI – динамический захват контрастного вещества в опухоли с определением процента его накопления, что позволяет оценить в динамике количество жизнеспособных опухолевых клеток [16]. По сравнению со всеми другими методами исследования данные МРТ подвержены наибольшим изменениям, связанным с предшествующей биопсией или манипуляцией в области опухоли. Радионуклидная диагностика – остеосцинтиграфия (ОСГ) – получила широкое применение в выявлении различных костных заболеваний, в том числе и злокачественных опухолей. Принцип диагностики поражения кости состоит в том, что в очаге специфического поражения повышается процент накопления радиофармпрепарата (РФП), выраженность которого зависит от степени реактивного костеобразования. В настоящее время широкое 99m применение находят фосфаты, меченные короткоживущим нуклидом Tc (Тепирофосфат). Повышенное накопление РФП совершенно очевидно отражает степень интенсивности обменных процессов в участках поражения и поэтому является важным признаком активности патологического процесса. Из этого следует, что опухолевое поражение проходит раннюю стадию интенсификации обменных процессов, предшествующую развитию грубых морфологических изменений, которые удается определить рентгенологически. Тип патологического накопления РФП в большинстве случаев отмечается в виде очагов гиперфиксации. Сцинтиграфическая активность опухоли – важный индикатор ее агрессивности. Наибольшая фиксация РФП отмечалась при остеобластическом варианте остеосаркомы и относительно невысокое содержание – при остеолитическим варианте. Но некоторые очаги могут быть негативными. Независимо от разновидности опухоли четкая визуализация контуров ее на сцинтиграммах соответствует границам интрамедуллярного и внекостного компонента новообразования. Значительная диагностическая ценность ОСГ заключается в выявлении отдаленных метастазов остеогенной саркомы в кости и skip-метастазов. Установлено, что рентгенологическая картина метастазов в кости, как правило, соответствует типу первичной опухоли с преимущественным преобладанием остеобластических очагов. По изменению процента накопления изотопа в динамике можно достаточно точно судить об эффективности химиотерапии. Значительное снижение процента накопления изотопа в очаге коррелирует с хорошим гистологическим ответом опухоли на химиотерапию. Ангиография – вспомогательный метод в диагностике остеогенной саркомы. Исследование используется для более четкого определения состояния магистральных сосудов в области опухоли, а также, выявление опухолевых тромбов. Некоторую помощь в диагностике остеогенной саркомы может оказывать определение активности щелочной фосфатазы (ЩФ). Повышение уровня ЩФ объясняют повышенной остеобластической активностью опухоли. Повышение уровня ЩФ – не абсолютный симптом. Прогноз при генерализованных формах остеогенной саркомы у детей зависит от срока появления легочных метастазов. С целью раннего выявления легочных метастазов в детской онкологии традиционно всем больным проводится рентгенографическое исследование грудной клетки. Однако разрешающие возможности обычной рентгенографии следует считать недостаточными для ранней диагностики метастазов в легких. Срок рентгенологического выявления метастазов в легких составляет в среднем от 3-х до 8 месяцев от начала заболевания. Для выявления легочных метастазов остеогенной саркомы методом рентгенографии необходимо, чтобы последний был представлен тенью более 10 мм в диаметре и был достаточно рентгеноконтрастен. С внедрением в клиническую практику КТ грудной клетки стало возможным определять метастатические очаги менее 5 мм в диаметре у 10-15% пациентов, у которых метастазы не определяются на рентгенограммах. Причем, при использовании спиральной программы, стало возможным выявлять очаги в диаметре до 1 мм [12]. Биопсия необходима для морфологического подтверждения диагноза. Хирургическая стратегия предусматривает осуществление минимального вмешательства, обеспечивающего получение адекватного по объему биопсийного материала для окончательной диагностики. Лучевые методы диагностики осуществляются до проведения биопсии, т.к. хирургическая манипуляция в зоне опухоли влияет на результаты всех радиологических исследований, что затрудняет их интерпретацию [10]. Для сведения к минимуму потенциальной диссеминации опухоли, многие авторы рекомендуют предпринять попытку выполнения трепанобиопсии иглой Jamshidi. Если трепанобиопсия оказывается не адекватной, осуществляется небольшая ножевая биопсия. Аспирационная биопсия при остеогенной саркоме – мало информативна. Выполнение биопсии несоответствующими методами приводит к осложнениям в ране (диссеминация опухолевых клеток, инфицирование) у 20% пациентов. B 10% случаев неправильно спланированная и выполненная биопсия приводит к невозможности выполнить органосохраняющую операцию в первичном очаге. Химиотерапия. До 1970 г. первичное лечение остеосаркомы конечностей без отдаленных метастазов состояло из удаления опухоли (ампутация) и/или облучения (в большой дозе) области основной опухоли. Ранние исследования роли химиотерапии при остеосаркомах были разочаровывающими; опухоль считалась химиорезистентной [11]. Сообщения об эффективных схемах химиотерапии при остеосаркоме появились в 80-х годах. В них описывалось успешное применение адриамицина, больших доз метотрексата под прикрытием лейковорина, препаратов платины и в последнее время ифосфамида. Было показано, что эти препараты способны устранить скрытые и микроскопические метастазы и улучшить выживаемость [14]. Предоперационная химиотерапия, предложенная играет основную роль в подавлении роста микрометастазов и способствует ограничению распространенности первичной опухоли. Реакция остеосаркомы на предоперационную химиотерапию может оцениваться на основании клинических, лабораторных, рентгенологических и патоморфологических характеристик. Клинически эффективность лечения проявляется уменьшением болей и отека. На лабораторном уровне о положительной реакции на лечение свидетельствует снижение ранее повышенного уровня щелочной фосфатазы. При проведении специальных методов исследования (МРТ, ОСГ) могут определяться уменьшение и/или полное исчезновение мягкотканого компонента опухоли, восстановление межмышечных промежутков, заживление патологических переломов и отложение кальция в неопластической костной ткани (кальцификация надкостницы). Ангиография представляет субъективный способ оценки выраженности реакции опухоли на химиотерапию. «Золотым стандартом» оценки и определения реакции на лечение стали гистологические изменения, выявленные в удаленной первичной опухоли после проведения предоперационной химиотерапии. Для определения выраженности этих изменений был разработан целый ряд систем оценки, каждая из которых основывается на определении количества «жизнеспособных» опухолевых клеток в удаленных тканях. Выраженность лекарственного патоморфоза в опухоли признана главным возможным прогностическим фактором [17]. До появления эффективных противоопухолевых химиопрепаратов ряд исследователей отстаивали необходимость использования лучевой терапии в лечении первичной опухоли для того, чтобы избежать выполнения калечащих операций у больных с первоначально не определяемыми отдаленными метастазами. Но отдаленные метастазы у этих больных выявлялись в ближайшие 5 – 6 месяцев после окончания лучевого лечения. Во всех крупнейших зарубежных клиниках этот вопрос решен не в пользу данного метода лечения. В настоящее время, на основании проведенных исследований, доказано, что остеосаркома является высокорадиорезистентной опухолью [8]. В настоящее время лучевая терапия используется с симптоматической (противоболевой) целью, в основном, после выполнения нерадикальной операции при определенных локализациях остеосаркомы, например, в костях позвоночника или таза. И если очаг в легком находится в нерезектабельном месте, иногда решается вопрос о проведении лучевой терапии, даже учитывая, что остеогенная саркома резистентна к лучевому воздействию. Лучевая терапия может контролировать размеры огромной опухоли какое-то время (только при солитарном поражении) [8]. Хирургический этап лечения (первичный очаг). Тщательное предоперационное планирование хирургического вмешательства и отбор больных – важнейшее условие успешного удаления первичной опухоли. Выбор метода оперативного вмешательства у больных с остеогенной саркомой зависит главным образом от анатомической локализации. В настоящее время большинство ведущих центров, занимающихся лечением костных сарком, доказали, что органосохраняющие операции у детей являются целесообразным и адекватным методом лечения у части больных, но только при условии их правильного отбора. Важнейшее хирургическое решение – определение границ резекции опухоли. Хотя выбор онкологической адекватности проксимальной границы резекции имеет решающее значение для предотвращения дальнейшего роста опухоли, не менее важно стремиться к «экономичности» хирургической операции, обеспечивающей максимальный потенциал для реабилитации больного. Исследования показывают, что физиологическая адаптация больных с ампутацией эквивалентна таковой у пациентов, подвергшихся органосохраняющей операции [18]. В определении уровня ампутации центральную роль играют два фактора. Первый фактор – протяженность мягкотканного компонента (полезную информацию дает КТ, МРТ) и связь с сосудисто-нервным пучком. Второй фактор – протяженность поражения кости, и, что еще важнее, степень интрамедуллярного распространения опухоли (ОСГ с 99mTc). Интрамедуллярное распространение опухоли обычно бывает более обширным, чем мягкотканный компонент. Традиционно уровень ампутации определяется примерно на 7 – 8 см выше проксимальной границы мягкотканного и интрамедуллярного компонентов опухоли. При хорошем ответе опухоли на предоперационную химиотерапию граница резекции может быть уменьшена до 3 – 5 см. Сохраняющая конечность операция рассматривается в настоящее время как предпочтительный метод лечения у тщательно отобранных больных с остеогенной саркомой. Необходимо подчеркнуть, что в настоящее время метастазы в легкие не являются противопоказанием к выполнению органосохраняющих операций [5]. Ампутация (калечащая операция) осуществляется в тех случаях, когда первичная опухоль оказывается нерезектабильной. Основным фактором, побуждающим к проведению ампутации, является вовлечение сосудисто-нервного пучка (особенно магистрального нерва). Вспомогательными факторами являются – значительное рассеивание опухолевых элементов вследствие плохо спланированной и проведенной биопсии или наличие патологического перелома [15]. Хирургическое лечение метастазов остеосаркомы в легкие. Последнее десятилетие характеризуется значительным прогрессом в лечении генерализованных форм остеогенной саркомы, прежде всего в тех случаях, когда имеются признаки метастатического поражения легких. Наметившиеся положительные тенденции в терапии этого контингента больных обусловлены появлением новых активных химиотерапевтических протоколов и возможностью определения гистологического ответа в метастатической опухоли на лечение. Применение химиотерапии и радикальное удаление солитарных и единичных метастазов позволили добиться 5-летней выживаемости у 30 – 35% больных с легочными метастазами [20]. ЛИТЕРАТУРА 1. Волков М.В. Болезни костей у детей. – М: Медицина, 1985. – С. 308–332. 2. Дурнов Л.А. Злокачественные новообразования у детей.– Душанбе, 1988. – С. 55–67. 3. Забродина А.В. Лучевая диагностика остеогенной саркомы. – Можайск: Можайск Терра, 1995. – С. 68-240. 4. Общая онкология / Под ред. Н.П. Напалкова. – Л: Медицина, 1989. – С. 570–573. 5. Bielack S, Kempf-Bielack B, Winkler K. Osteosarcoma: Relationship of response to preoperative chemotherapy and type of surgery to local recurrence // J Clin Oncol. – 1996. – №15. – р. 683. 6. Campanacci M. Bone and Soft Tissue Tumors // Sprainger-Verlag Wien-New-York, 1990. – p. 6–81. 7. Carter J.B., Abdul-Karim F.W. Pathology of childhood osteosarcoma // Perspect Pediatr Pathol. – 1987. – №2. – р. 190–196. 8. Daw NC, Mahmoud НН, Meyer WH, Jenkins JJ, Kaste SC, Poquette AS, Kun LE, Pratt С. Bone Sarcomas of the Head and Neck in Children. The St. Jude Children’s Research Hospital Experience // Cancer. – 2000. - №88. – р.2172–80. 9. Enneking W.F., Kagan A. Skip-metastases in osteosarcoma // Cancer. – 1975. – Vol. 36, №5. – p. 2192–2205. 10. Enneking W.F. Muscelosceletal Tumors Surgery. – New York: Churchill Livingstone, 1983. – Vol. 1. – p. 1–60. 11. Friedman MA, Carter SK. The therapy of osteogenic sarcoma: current status and thoughts for the future // J Surg Oncol. – 1972. – №4. –p. 482–510. 12. Kaste CS, Pratt CB, Cain MA, Jones-Wallace JD. Metastases Detected at the Time of Diagnosis of Primary Pediatric Extremity Osteosarcoma at Diagnosis // Cancer. – 1999. – N86. – p. 1602–8. 13. Huvos AG. Bone Tumors: Diagnosis, Treatment and Prognosis // Philadelphia, WB Saunders, 1979. 14. Pratt C, Howarth C, Ransom J, et al. High dose methotrexate used alone and in combination for measurable primaru and metastatic osteosarcoma // J Natl Cancer Inst. – 1988. – N80. – p. 626–656. 15. Picci P, Sangiorgi L, Bahamonde L, Aluigi P, Bibiloni J, Zavatta M, Mercuri M, Briccoli A, Campanacci M. Risk factors for local recurrences after limb-salvage surgery for hign-grade osteosarcoma of the extremities // Ann Oncol. – 1997. – N8(9). – p. 899–993. 16. Reddick WE, Wang S, Xiong X, Glass JO, Wu S, Kaste SC, Pratt CB, Meyer WH, Fletcher BD. Dynamic Magnetic Resonance Imaging of Regional Contrast Access as an Additional Prognostic Factor in Pediatric Osteosarcoma // Cancer. – 2001. – N9. – p. 2230–7. 17. Salzer-Kuntschik M, Brand G, Delling G. Bestimmung des morphologischen Regressionsgrades nach Chemotherapie bei malignen Knochentumoren // Pathologie. – 1983. – N4. – p. 135–141. 18. Sluga M, Windhager R, Lang S, Heinzl H, Bielack S, Kotz R. Local and systemic control after ablative and limb sparing surgery in patients with osteosarcoma // Clin Orthop. – 1990. – Jan; (358). - p. 120-7. 19. Spjut HJ, Ayala AG. Skeletal tumors in childhood and adolescent / In: Finegold M., ed. Pathology of neoplasia in children and adolescent. – Philadelphia: W.B. Saunders, 1986. – p. 265–281. 20. Ward WG, Mikaelian K, Dorey F, et al. Pulmonary metastases of stage IIB extremity osteosarcoma and subsequent pulmonary metastases // J Clin Oncol. – 1994. – N12. – p. 1849–1858. 21. Wuisman P., Enneking W.F. Prognosis for Patients Who Have Osteosarcoma with Skip Metastasis // J Bone and Joint Surgery. – 1990. – Vol. 72-A. – p. 60–68.
