кремний в природе - Тюменский государственный архитектурно
advertisement

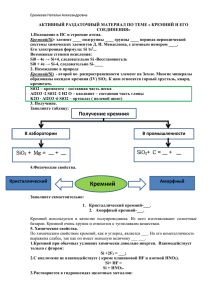
ГОУ ВПО Тюменский государственный архитектурно-строительный университет Кафедра Общей и специальной химии МЕТОДИЧЕСКИЕ УКАЗАНИЯ к лабораторной работе по теме «СВОЙСТВА КРЕМНИЯ И ЕГО СОЕДИНЕНИЙ» для студентов всех специальностей 1 курса Тюмень 2006 Свойства кремния и его соединений: ассистент Рудой С.Э., методическое указание к лабораторной работе для студентов всех специальностей 1курса , Тюмень: ТюмГСУ, 2006, 12 с. Рецензент: к.х.н., доцент Полещук И.Н. (степень, звание, Фамилия, Имя, Отчество) Учебно-методический материал утверждён на заседании кафедры: Протокол № 46__от « 9 » марта 2006г. Учебно-методический материал утверждён на УМС университета: Протокол №__от «___»________2006г. Тираж 100 экземпляров 2 ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ 1. 2. 3. 4. 5. 6. 7. 8. 9. Работая в химической лаборатории, студенты должны постоянно помнить и неукоснительно выполнять все требования инструкций по технике безопасности. Во время работы на лабораторном столе должны находиться только необходимые приборы, реактивы и лабораторный журнал. К опытам можно приступать только после ознакомления с их описанием в практикуме и выяснения всех непонятных вопросов у преподавателя. Для проведения опытов следует брать минимальное количество веществ, что обусловлено необходимостью не только экономии, но и опасности загрязнения излишними отходами окружающей среды. Все работы с вредными или пахучими веществами должны проводиться в вытяжном шкафу. В лаборатории категорически запрещается принимать пищу, курить. Категорически запрещается проводить незапланированные опыты без разрешения преподавателя. При работе с кислотами и щелочами необходимо постоянно помнить, что это едкие, агрессивные вещества. При работе с ними надо следить, чтобы вещества не попадали на кожу лица и рук, так как возможен химический ожёг. Каждый работающий должен знать, где находится в лаборатории средства противопожарной защиты и аптечка для оказания первой помощи. 3 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ КРЕМНИЙ В ПРИРОДЕ. Кремний – один из самых распространённых в земной коре элементов. Он составляет 27,6%(масс.) доступной нашему исследованию части земной коры, занимая по распространённости второе место после кислорода. В природе кремний встречается только в соединениях. В неорганическом мире они играют такую же важную роль, как углерод в органическом. Земная кора на 97% состоит из соединений кремния. Важнейшими из них являются кремнезём SiO2 (диоксид кремния, кремниевый ан гидрид) и силикатные минералы. К силикатным минералам относятся гранит, полевые шпаты, асбест, глины, слюда. Известно более 1000 различных силикатных минералов. Наиболее широко распространены в природе алюмосиликаты, в состав которых входит алюминий. К ним относятся полевые шпаты (К2О∙Al2O3·∙6SiO2), слюды (K2O·3Al2O3∙6SiO2·2O), каолин (Al2O3·2SiO2·2H2O). ФИЗИЧЕСКИЕ СВОЙСТВА Физические свойства кремния представлены в таблице №1 Таблица №1 Атомный номер Электронная конфигурация Ковалентный радиус, нм Плотность, г/см3 Температура плавления,0С Стандартная энтальпия испарения, кДж/моль Электроотрицательность Стандартная энтальпия связи, кДж/моль Э-Э Э-О Э=О Э-Н Структура 4 14 3s23p2 0,117 2,33 1423 440 1,75 176 374 640 338 макромолекула алмаза типа ПОЛУЧЕНИЕ. ПРИМЕНЕНИЕ. Получение технически чистого кремния основано на восстановлении двуокиси кремния углём или металлами. SiO2+2C=Si+2CO SiO2+2Mg=2MgO+Si (аморфный кремний) В технике также восстанавливают кремний из кремнезёма углём в присутствии железа и получают сплав кремния с различным содержанием железа, называемый ферросилицием, который используется в производстве чугуна, стали и для изготовления огнеупорных материалов. В связи с использованием кремния в качестве полупроводникового материала большое значение приобретают методы получения чистого и особо чистого кремния. В качестве исходных материалов используют чистейшие соединения кремния (чаще всего галиды): SiCl4+2Zn=Si+2ZnCl2 SiI4=Si+2I2 Дополнительной очистке подвергают при помощи зонной плавки. Кремний используется в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью. Кремний повышает коррозионную устойчивость сплавов, улучшает литейные свойства, повышает механическую прочность. Сплавы низкой и средней прочности системы Al-Mg-Si отличаются высокой коррозионной стойкостью, хорошо поддаются окраске и полировке. Они находят широкое применение в строительстве. ХИМИЧЕСКИЕ СВОЙСТВА Кремний является неметаллом. Поскольку у атома кремния на внешнем энергетическом уровне находится 4 электрона, то для него характерна 5 степень окисления как -4, так и +4. Кремний при обычных условиях довольно инертен, что объясняется прочностью его кристаллической решетки. При комнатной температуре он непосредственно соединяется только с фтором: Si+2F2=SiF4 При нагревании аморфный кремний легко соединяется с кислородом, галогенами и серой: Si+O2=SiO2 Si+2S=SiS2 Si+2Cl2=SiCl4 Кремний во всех своих формах легко реагирует с едкими щелочами: Si+2NaOH+H2O=Na2SiO3+2H2 СОЕДИНЕНИЯ КРЕМНИЯ. СВОЙСТВА СОЕДИНЕНИЙ. ПРИМЕНЕНИЕ. Наиболее устойчивым и распространенным соединением кремния с кислородом является его двуокись SiO2. Кремнезем в виде различных песков широко используется в силикатной промышленности и в строительстве. Землистые формы аморфного кремнезема-инфузорная земля, диатомит, трепел-имеют пористое строение, поэтому они обладают повышенной химической активностью, являются хорошими адсорбентами. Двуокись кремния - чрезвычайно устойчивое соединение. В воде при обычных условиях она практически нерастворима; из кислот на нее действует только плавиковая кислота HF: SiO2+4HF=2H2O+SiF4 Эта реакция используется при травлении стекла. 6 При сплавлении оксида кремния(IV) с твёрдыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты: SiO2+2NaOH=Na2SiO3+H2O SiO2+CaO=CaSiO2 SiO2+Na2CO3=Na2SiO3+CO2 Аморфный кремнезём может вступать в химическое взаимодействие со щелочами и гашёной известью(Ca(OH)2) уже на холоду. На этом основано использование этих материалов в качестве гидравлических добавок в цементах. Имеющаяся в цементе известь взаимодействует с аморфным кремнезёмом с образованием силикатов кальция: Ca(OH)2+SiO2=CaSiO3+H2O При накаливании в электрической печи смеси песка и кокса, взятых в определённом соотношении, получается соединение кремния с углеродомкарбид кремния SiC (карборунд): SiO2+3C=SiC+2CO Применение его разнообразно и связано с его высокой твёрдостью и огнеупорностью. На его основе производят плиты для сооружения полов, платформ и переходов в метро и на вокзалах. Из порошка карборунда изготовляют шлифовальные круги,бруски. При действии водной плавиковой кислоты на кремнезём образуется кремнефтористоводородная кислота (гексафторокремниевая): SiO2+6HF=H2SiF6+2H2O Соли кремнефтористоводородной кислоты – фторосиликаты (кремнефториды) разлагаются едкими и углекислыми щелочами. Фторосиликат натрия (Na2SiF6) применяется в производстве стекол, глазурей, эмалей. Он используется также как ускоритель твердения в производстве кислотоупорных замазок на основе растворимого стекла. 7 Водорастворимые фторосиликаты называют флюатами, их используют в строительстве для закрепления и предохранения от разрушения различных природных и искусственных камней, главным образом известняков и мрамора. Такой способ защиты называется флюатированием. В качестве флюатов чаще всего применяют фторосиликаты магния и алюминия: MgSiF6+2CaCO3+nH2O=SiO2nH2O+MgF2+2CaF2+2CO2 Образующиеся труднорастворимые фториды кальция и магния и гель кремниевой кислоты закупоривают поры защищаемого материала и создают на его поверхности плотный, высокопрочный слой, предохраняющий от влияния внешней среды. Диоксид кремния – кислотный оксид и ему соответствуют слабые малорастворимые в воде кремниевые кислоты. Их можно представить общей формулой nSiO2mH2O. Метакремниевая кислота (H2SiO3) легко образует пересыщенные растворы, в которых она постепенно полимеризуется и переходит в коллоидное состояние. В отсутствии стабилизаторов золь кремниевой кислоты переходит в гель. При его высушивании образуются пористые продукты (силикагель), применяемые в качестве осушителей и адсорбентов. Соли кремниевых кислот – силикаты – в большинстве своём нерастворимы в воде; растворимы только силикаты натрия и калия (Na2SiO3, K2SiO3). Все силикаты подвергаются гидролизу: Na2SiO3+HOH↔NaHSiO3+NaOH NaHSiO3+HOH↔H2SiO3 Благодаря внешнему сходству со стеклом и растворимости в воде они получили название растворимого стекла. Растворимое стекло в виде водных растворов, называемых жидким стеклом, применяется для изготовления кислотоупорного цемента и бетона, для керосинонепроницаемых шту- 8 катурок по бетону, для пропитывания тканей, для приготовления огнезащитных красок по дереву, для химического укрепления слабых грунтов. Оптические волокна изготовляют из кварцевого стекла, которое должно быть особо чистым, в нём число атомов железа и меди не должно превышать соотношения 1:1010. Такое стекло получают взаимодействием хлорида кремния с кислородом: SiCl4+O2=SiO2+2Cl2 Волокно, имеющее толщину человеческого волоса, окружается защитной оболочкой из кремния или органического полимера. Оптические волокна используются для телевизионных программ, телефонных разговоров, выходных данных компьютеров и других приборов. Большое значение в наши дни приобрели кремнийорганические соединения, прежде всего полимерные. Это теплостойкий и морозоустойчивый силиконовый каучук, кремнийорганические лаки. Кремний не обладает такой токсичностью, как мышьяк, ртуть или плутоний, что обусловливает применение кремнийорганических полимеров в косметике, медицине и протезировании. 9 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт 1. Получение кремниевой кислоты. (работать под тягой) а) В пробирку наливают 3 мл. концентрированной соляной кис- лоты (HCl) и 3 мл 10%-ного раствора силиката натрия (растворимого стекла Na2SiO3) и перемешивают стеклянной палочкой. Получается коллоидный раствор-золь кремниевой кислоты. Содержимое пробирки нагревают, при этом происходит коагуляция золя и выделяется студенистый осадок геля кремниевой кислоты. б) В две пробирки наливают по3 мл 10%-ного раствора силиката натрия и в одну пробирку добавляют раствор хлорида аммония (NH4Cl), а через раствор в другой пробирке пропускают очищенный от брызг соляной кислоты диоксид углерода (СО2) из аппарата Кипа. Образуется студенистый осадок. Задание. Запишите химические уравнения реакций, протекающих в данном опыте, сделайте вывод о свойствах кремниевой кислоты. Опыт 2. Выщелачивание стекла. В ступку вносят несколько небольших кусочков стекла, немного воды, тщательно растирают стекло в порошок и переносят его в пробирку. Приливают несколько капель раствора фенолфталеина. Наблюдают изменение окраски индикатора. Задание. Объясните изменение окраски индикатора, запишите химические уравнения гидролиза. 10 Опыт 3. Изучение свойств тетрахлорида кремния. (Работать под тягой) Открывают пробку склянки, в которой находится SiCl4. Что наблюдается? Стеклянную палочку опускают в концентрированный водный раствор аммиака и подносят её к отверстию склянки с SiCl4. Что наблюдается? Задание. Объясните наблюдаемые явления. Запишите уравнение химической реакции, наблюдаемой во второй части опыта. Опыт 4. Получение труднорастворимых солей кремниевой кислоты. Налить в пробирки по 5 мл растворов солей кальция, свинца, меди и добавить в каждую по 5 мл раствора силиката натрия. Задание. Запишите химические уравнения реакций, цвет образовавшихся труднорастворимых соединений. 11 КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ. 1. Назовите важнейшие природные силикаты. 2. Какие соли кремниевой кислоты растворимы в воде и как они называются? 3. Напишите уравнение гидролиза силиката калия в ионной форме. 4. Составьте уравнения следующих превращений: Si→SiO∙→K2SiO3→H2SiO3→SiO2 12 РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА 1. В.Н.Ушкалова Современная химия. Тюмень: ОАО «Тюменский дом печати», 2005.-496с. 2. Справочное руководство по химии/А.И.Артёменко, И.В. Тикунова, В.А. Малеванный-2-е издание, перераб. И доп. – М.: Высшая школа, 2002.-367с. 3. Э.Н. Рэмсден Начала современной химии: Справ. Изд.: Пер. с англ./Под ред.В.И. Барановского, А.А. Ефимова, А.А. Потехина-Л.: Химия, 1989.-784с. 4. Практикум по неорганической химии. - Под ред. А.Ф.Воробьёва и С.И.Дракина. – М.: Химия, 1984. – 248с. 13 СОДЕРЖАНИЕ Правила техники безопасности Теоретическая часть Экспериментальная часть Контрольные вопросы и упражнения Рекомендуемая литература 14 3 4 10 12 13