Сонографические и клинико-лабораторные аспекты диагностики тромботических осложнений в детской онкологической клинике
advertisement

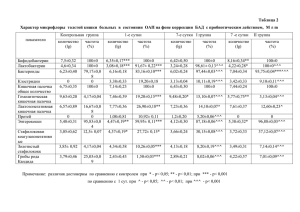
Гематол. и трансфузиол., 2012, т. 57, № 3 Сонографические и клинико-лабораторные аспекты диагностики тромботических осложнений в детской онкологической клинике И.В. Бегун ¹,², Р.А. Тарасевич ¹, Н.В. Липай¹, В.В. Дмитриев ¹, И.И. Папкевич ¹ ¹ГУ Республиканский научно-практический центр детской онкологии, гематологии и иммунологии ( РНПЦ ДОГИ);. ²Кафедра лучевой диагностики Медицинской академии последипломного образования (МАПО), Беларусь Введение. Цель исследования – изучение клинико-лабораторных, ультразвуковых и хронологических аспектов, а также анализ возможного риска развития тромботических осложнений у детей c онкологической/онкогематологической патологией на этапах лечения основного заболевания. Материалы и методы. Проводили ретроспективный анализ случаев венозных тромбозов (ВТ) у детей и подростков со злокачественными опухолями, лечившихся в ГУ РНПЦ ДОГ с 2002 по 2011 г. Расширенный анализ данных выполнен с использованием результатов сонографических и лабораторных исследований в группе из 55 детей и подростков обоего пола в возрасте от 6 до 16 лет (средний возраст 12 лет ) с впервые возникшим ВТ. Спектр основного заболевания в данной группе включал: лимфомы (n = 9), острый лейкоз (n = 32), солидные опухоли (n = 14). Больные имели клинические проявления впервые возникшего венозного тромбообразования на разных этапах лечения основного заболевания. Ультразвуковое сканирование выполняли впервые – при подозрении на тромбоз, и серийно, начиная с 4–14 сут (в среднем с 7-х сут) после диагностики и начала лечения данного осложнения. Синхронное определение плазменного уровня D-димеров проводили на автоматическом коагулометре с помощью иммунохимического метода. Результаты представлены в виде медианы с интерквартильным разбросом (25–75‰). Результаты и обсуждение. Частота ВТ на разных этапах лечения основного заболевания у пациентов составила 1,5– 4,1% (в среднем 2,6%) от числа впервые госпитализированных в течение 1 года. Временной интервал от начала лечения до первичной диагностики ВТ укладывался в 33–149 сут (в среднем 72 сут). Тромбомассы локализовались в камерах сердца (n = 1), во внутренней яремной вене (n = 1), подключичной (n = 8), нижней полой вене (n = 4), бедренных-подколенных (n = 9) и подвздошных венах (n = 4), глубоких венах голени (n = 4), в системе подкожных вен конечностей (n = 24) в виде гипоэхогенных или среднеэхогенных неоднородных струк- тур. Неокклюзивный тромбоз встречался лишь у ¼ больных, у остальных была констатирована тромботическая окклюзия вен. Флотацию проксимального участка тромба длиной 1,5– 4 см наблюдали у 4 больных. Тромбоэмболия ветвей легочной артерии (ТЭЛА) развилась у 2 пациентов. У ¾ больных ВТ глубоких вен был ассоциирован по времени с повышением плазменного уровня D-димеров до 0,5–3 мкг/мл (в среднем до 0,8 мкг/мл). У 66% пациентов к моменту диагностики ВТ была катетеризирована центральная вена (ЦВК). Доминировал подключичный венозный доступ. Топографическая связь ВТ с постановкой ЦВК установлена у 2/3 больных. Длительность нахождения катетера в центральной вене до констатации тромбообразования составила 19–35 сут ( в среднем 26 сут). По предварительным данным отмечена тенденция к снижению числа случаев ВТ, ассоциированных с ЦВК в группе пациентов, которым постановку катетера проводили под контролем или по результатам ультразвукового исследования с проекционной разметкой пунктируемых вен (χ² = 3,43; p = 0,06). Примерно в половине случаев ВТ имелась иммобилизация пациентов ввиду тяжелого состояния в течение 1,1–5,6 нед (в среднем 1,4 нед), из них ВТ вне катетерной ассоциации было также у половины. Заключение. ВТ у детей со злокачественными опухолями на стационарном этапе лечения встречаются с частотой 1,5–4,1% (25–75‰) в год и возникают в среднем через 1–5 мес (в среднем 2,5 мес) от начала лечения основного заболевания. Ультразвуковой диагноз тромбоза глубоких вен в большинстве случаев ассоциирован по времени с повышением плазменного уровня D-димеров. Значимыми факторами в развитии данного осложнения является катетеризация центральной вены и длительная иммобилизация пациента. Отмечена относительно низкая распространенность флотирующих тромбов и ТЭЛА. Ультразвуковое сопровождение постановки ЦВК рассматривается как фактор, снижающий риск дефекта пункции, и, возможно, тромботических осложнений. Мета-анализ: ассоциация генов фолатного цикла с риском развития неходжкинских злокачественных лимфом О.В. Березина, А.С. Вайнер, Т.И. Поспелова, М.Л. Филипенко ГБОУ ВПО Новосибирский государственный медицинский университет Минздравсоцразвития России; НИИ химической биологии и фундаментальной медицины СО РАН, Новосибирск Введение. Проведен мета-анализ результатов исследований по частоте аллелей полиморфных локусов генов фолатного цикла C677T и A1298C MTHFR, A2756G MTR, А66G MTRR, С1420Т SHMT1 для оценки ассоциации с риском развития неходжкинских злокачественных лимфом (НХЗЛ). Материалы и методы. В мета-анализ включены результаты исследования частоты полиморфных локусов генов ключевых ферментов фолатного цикла у 146 больных неходкинскими злокачественными лимфомами Городского гематологического центра Новосибирска. Поиск публикаций для мета-анализа осуществляли с помощью базы данных PubMed (www.pubmed.gov). При включении оригинальных исследований в мета-анализ учитывались следующие критерии: исследование ассоциации одного из изучаемых полиморфизмов и НХЗЛ; дизайн исследования типа "case-control"; численность контрольной группы и группы, не менее 150, больных НХЗЛ; распределение генотипов в контрольной группе соответствует равновесию Харди–Вайнберга. Для мета-анализа использовали значения отношения шансов (OR) и 95% доверительный интервал (C.I.) (редкий аллель против частого аллеля). Статистическую обработку материала проводили с помощью пакета прикладных программ Microsoft Excel 2007, статистических программ Statistica, версия 6.0; GenABEL; rmeta для языка R (версия 2.6.0). Результаты и обсуждение. Размеры объединенной выборки больных НХЗЛ колебались от 896 человек для поли- 96 морфного локуса A66G гена MTRR до 4176 пациентов для однонуклеотидной замены C677T в гене MTHFR. В большинстве исследований отмечена ассоциация мутантного 2756G-аллеля со сниженным риском развития НХЗЛ, и при расчете объединенного отношения шансов данная ассоциация оказалась статистически значимой (OR =0,902; C.I. [0,821–0,991]; р = 0,03), что подтвердило вклад данной замены в предрасположенность к НХЗЛ. Ассоциация 2756G-аллеля со сниженным количеством гиперметилированных CpG-островков в составе геновсупрессоров опухоли была показана в работе M.Paz, et al., 2002. Вероятно, мутантный аллель способствует активации геновсупрессоров опухоли, что обусловливает полученную ассоциацию, а также аналогичные результаты для других видов неоплазий, однако детальный механизм такого влияния данного аллеля в настоящее время остается неизученным. Для других полиморфных локусов не было выявлено ассоциации с НХЗЛ в объединенной выборке при выполнении мета-анализа. Для большинства полиморфных замен наблюдался большой разброс значений отношения шансов и 95% доверительного интервала между исследованиями, включенными в мета-анализ. Заключение. Мутантный 2756G-аллель полиморфного локуса A2756G гена MTR ассоциируется со снижением риска развития НХЗЛ, что подтверждено результатами мета-анализа. Гетерогенность результатов по изученным полиморфным локусам может быть связана с влиянием этнических особенностей выборок.